Фармацевтический состав
Формула / Реферат
1. Фармацевтический состав, содержащий соединение формулы (I)
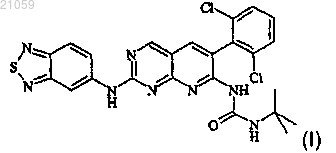
в форме основания или в форме соли фармацевтически приемлемой кислоты, растворенное в смеси
этанола и
поверхностно-активного вещества, содержащего смесь сложного полиэтоксилированного моно- и диэфира 12-гидроксистеариновой кислоты, имеющих соответственно формулы
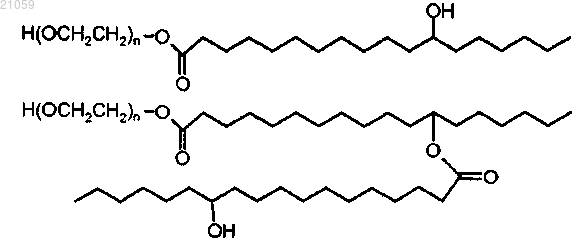
причем n является целым числом от 15 до 16,
в массовом отношении поверхностно-активное вещество/этанол от 25/75 до 80/20.
2. Фармацевтический состав по п.1, отличающийся тем, что поверхностно-активное вещество представляет собой макрогол 15 гидроксистеарат.
3. Фармацевтический состав по п.1 или 2, отличающийся тем, что массовое отношение поверхностно-активное вещество/этанол составляет от 73/27 до 77/23.
4. Состав по п.2, в котором поверхностно-активное вещество содержит по весу от 35 до 55% сложного моно- и диэфира и от 30 до 40% полиэтиленгликоля H(OCH2CH2)n-OH.
5. Состав по п.4, в котором поверхностно-активное вещество содержит по весу в качестве преобладающих компонентов от 35 до 55% сложного моно- и диэфира и от 30 до 40% полиэтиленгликоля H(OCH2CH2)n-OH.
6. Состав по п.1 или 2, в котором поверхностно-активное вещество содержит по весу от 10 до 20% сложного моноэфира, от 25 до 35% сложного диэфира и от 30 до 40% полиэтиленгликоля H(ОСН2СН2)n-ОН.
7. Фармацевтический состав по пп.1-6, в котором отношение поверхностно-активное вещество/этанол составляет от 73/27 до 77/23 и концентрация соединения формулы (I) составляет от 5 до 25 мг/мл.
8. Применение фармацевтического состава по любому из пп.1-7 для получения после разведения раствора для перфузии.
9. Способ получения фармацевтического состава по любому из пп.1-7, включающий следующие стадии:
поверхностно-активное вещество нагревают до перехода в жидкое состояние;
вводят этанол;
смесь поверхностно-активное вещество/этанол охлаждают до комнатной температуры;
соединение формулы (I) вводят в охлажденную смесь;
конечную смесь стерилизуют.
10. Способ по п.9, в котором смесь стерилизуют фильтрованием.
11. Раствор для перфузии, содержащий соединение формулы (I)
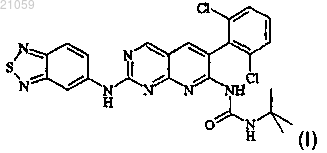
в форме основания или в форме соли фармацевтически приемлемой кислоты,
полученный разведением 1 объема фармацевтического состава по пп.1-7 в 20-500 объемах изотонического раствора.
12. Раствор для перфузии, содержащий соединение формулы (I)

в форме основания или в форме соли фармацевтически приемлемой кислоты, в концентрации от 0,01 до 1,2 мг/мл, поверхностно-активное вещество, такое как определено по любому из пп.1-7, в концентрации от 0,48 до 37 мг/мл и этанол в концентрации от 0,35 до 35 мг/мл, разведенные в изотоническом растворе.
13. Применение раствора для перфузии по п.11 или 12 для введения человеку.
14. Способ получения раствора для перфузии, заключающийся в разведении 1 объема фармацевтического состава по пп.1-7 в 20-500 объемах изотонического раствора.
15. Емкость, содержащая фармацевтический состав, такой как описан в любом из пп.1-7.
16. Карман для перфузии, содержащий раствор для перфузии по п.11 или 12.
Текст
Изобретение относится к фармацевтическому составу, содержащему в качестве действующего начала соединение формулы (I) или соль этого соединения с фармацевтически приемлемой кислотой. Настоящее изобретение относится к фармацевтическому составу, содержащему в качестве действующего начала соединение формулы (I) или соль этого соединения с фармацевтически приемлемой кислотой. Техническая задача Введение противоракового агента внутривенным путем является предпочтительным путем введения в онкологии, так как обеспечивает быструю диффузию агента в кровяном токе. В некоторых случаях используют одну лекарственную форму, если агент не обладает достаточной биодоступностью при введении другим путем, таким как пероральное введение. Соединение формулы (I) является слаборастворимым в разных средах (см. табл. I). Таблица I Таким образом, существует необходимость в стабильном фармацевтическом составе, которым можно манипулировать и который дает возможность вводить достаточное и эффективное количество соединения формулы (I) порядка нескольких сотен мг. Необходимо также, чтобы фармацевтический состав обладал химической и физической стабильностью, также как и раствор для перфузий, полученный после разведения в изотонической среде. Уровень техники В WO 2007/003765 описаны производные пиридо[2,3-d]пиримидина формулы (А) которые можно вводить в форме раствора. В WO 08102075 описано применение соединения формулы (I) в лечении лейкемий. Соединение можно вводить в форме раствора. Последний может являться одним из следующих:PEG 400 22%/SOLUTOL HS15 5%/G5 73% для лечения путем iv мыши, имеющей опухоли Kasumil, причем G5 является 5%-ным раствором глюкозы в воде;LABRASOL 21%/SOLUTOL HS15 5%/HCl 0,001 N 74% для лечения пероральным путем мыши,имеющей опухоли Kasumil или KG1;DMSO 5%/TWEEN 80 10%/Н 2 О 85% для лечения интраперитонеальным путем мыши, имеющей опухоли EOL-1. Описанные составы, таким образом, вводят как таковые мышам и не предназначены для разведения для получения раствора для перфузий. Краткое описание изобретения Изобретение относится к фармацевтическому составу, содержащему соединение формулы (I) в форме основания или в форме соли фармацевтически приемлемой кислоты, растворенной в смеси этанола и поверхностно-активного вещества макрогол 15 гидроксистеарат в массовом отношении поверхностно-активное вещество/этанол от 25/75 до 80/20, предпочтительно от 73/27 до 77/23. Оно растворяется в смеси этанола и поверхностно-активного вещества, содержащей сложный полиэтоксилированный моно- и диэфир 12-гидроксистеариновой кислоты, описанные ниже. Поверхностно-активное вещество содержит от 35 до 55 мас.% сложного моно- и диэфира и от 30 до 40% полиэтиленгликоля H(OCH2CH2)n-OH. Оно содержит в качестве преобладающих компонентов от 35 до 55 мас.% сложного моно- и диэфира и от 30 до 40 мас.% полиэтиленгликоля Н(ОСН 2 СН 2)n-ОН, а также другие соединения, дополняющие до 100%. Оно содержит от 10 до 20 мас.% сложного моноэфира, от 25 до 35 мас.% сложного диэфира и от 30 до 40 мас.% полиэтиленгликоля Н(ОСН 2 СН 2)n-ОН, а также другие соединения, дополняющие до 100%. Отношение поверхностно-активное вещество/этанол составляет от 73/27 до 77/23 и концентрация соединения формулы (I) составляет от 5 до 25 мг/мл. Фармацевтический состав предназначен для разведения для получения раствора для перфузий. Изобретение также относится к способу получения фармацевтического состава, включающему следующие стадии: поверхностно-активное вещество нагревают до перехода в жидкую форму; вводят этанол; смесь поверхностно-активное вещество/этанол охлаждают до комнатной температуры; соединение формулы (I) вводят в охлажденную смесь; конечную смесь стерилизуют предпочтительно фильтрованием. Изобретение также относится к раствору для перфузий, содержащему соединение формулы (I) в форме основания или в форме соли фармацевтически приемлемой кислоты, полученному путем разведения 1 объема фармацевтического раствора в 20-500 объемах изотонического раствора. Соединение формулы (I) в концентрации от 0,01 до 1,2 мг/мл, поверхностно-активное вещество в концентрации от 0,48 до 37 мг/мл и этанол в концентрации от 0,35 до 35 мг/мл разводят в изотоническом растворе. Раствор для перфузий предназначен для введения человеку. Изобретение также относится к способу получения раствора для перфузий, заключающемуся в разведении 1 объема фармацевтического раствора в 20-500 объемах изотонического раствора. Изобретение также относится к емкости, содержащей фармацевтический раствор, и к карману для перфузий, содержащему раствор для перфузий. Изобретение также относится к применению поверхностно-активного вещества такого, как определено выше, для получения фармацевтического состава, содержащего соединение формулы (I) в форме основания или в форме соли фармацевтически приемлемой кислоты, причем этот состав предназначен для разведения для получения раствора для перфузий. Подробное описание Изобретение относится к фармацевтическому составу, содержащему соединение формулы (I) в форме основания или в форме соли фармацевтически приемлемой кислоты, растворенной в смеси этанола и поверхностно-активного вещества, макрогол 15 гидроксистеарата, в массовом отношении поверхностно-активное вещество/этанол от 25/75 до 80/20, предпочтительно от 73/27 до 77/23. Фармацевтический состав содержит соединение формулы (I), растворенное в смеси этанола и поверхностно-активного вещества, содержащего смесь сложного полиэтоксилированного моно- и диэфира 12-гидроксистеариновой кислоты, имеющих соответственно формулы причем n является целым числом от 15 до 16,в массовом отношении поверхностно-активное вещество/этанол от 25/75 до 80/20, предпочтительно от 73/27 до 77/23. Соединение формулы (I) является противораковым агентом, пригодным для лечения лейкемий, описанным в ЕР 1902054 В 1. Оно может быть в форме основания (см. формулу (I или в форме соли фармацевтически приемлемой кислоты; по этому поводу см. "Remington's pharmaceutical sciences", 17 ed., Mack Publishing Company,Easton, PA, 1985 и Berge et al., "Pharmaceutical salts", J. Pharm. Sci. 1977, 66, 1-19. Используемое неионное гидрофильное поверхностно-активное вещество получают путем взаимодействия при 110-165 С 12-гидроксистеариновой кислоты и этиленоксида в присутствии щелочного катализатора, такого как K2CO3, в соответствии с "Synthetic Detergents from Animal Fats. VIII. The Ethenoxylation ef Fatty Acid and Alcohols", A.N. Wrigley, J. Am. Oil. Chem. Soc. 1957, 34, 39-43 или J.V. Karabinos J.Am. Oil. Chem. Soc. 1954, 31, 20-23. 12-Гидроксистеариновую кислоту получают гидрированием касторового масла ("castor oil"). См. также ЕР 0017059. Поверхностно-активное вещество содержит главным образом сложный моноэфир формулы или сложный диэфир формулы К тому же поверхностно-активное вещество может также содержать свободный полиэтиленгликоль(С 3; Н(ОСН 2 СН 2)15-16-OH). Поверхностно-активное вещество может также содержать от 30 до 40 мас.% полиэтиленгликоля и от 60 до 70 мас.% сложного моно- и диэфира. Поверхностно-активное вещество может также содержать другие соединения, полученные реакцией этоксилирования, в частности соединения формул: В качестве примеров композиции двух пригодных поверхностно-активных веществ приведены в табл. II. Таким образом, поверхностно-активное вещество содержит по весу в качестве преобладающих компонентов от 35 до 55% сложного моно- и диэфира 12-гидроксистеариновой кислоты и от 30 до 40% полиэтиленгликоля Н(ОСН 2 СН 2)n-ОН, а также другие соединения, дополняющие до 100%. Таблица II Для совокупности соединении С 4-С 6 + другие соединения. Примером пригодного поверхностно-активного вещества является SOLUTOL HS15, выпускаемый фирмой BASF, описанный в J. Pharm. Sci. 1998, 87(2), 200-208, Pharm. Res. 2004, 21(2), 201-230 (с. 222),Int. J. Cancer 1995, 62, 436-442, а также Cancer Res. 1991, 51, 897-902. В европейской фармакопее (PhEur 6.0) его описывают как макрогол 15 гидроксистеарат; его описывают как смесь сложного моноэфира и диэфира 12-гидроксистеариновой кислоты и макрогола, полученного этоксилированием 12 гидроксистеариновой кислоты. Число моль этиленоксида, прореагировавшего с кислотой, составляет 15(номинальная величина). Он содержит примерно 30 мас.% свободного макрогола. Он представлен в форме беловатой пасты при комнатной температуре, которая становится жидкой при 30 С. Гидрофиль-3 021059 но-липофильный баланс составляет примерно 14-16. Критическая мицеллярная концентрация (CMC) составляет от 0,005 до 0,12%. Другие данные: температура плавления 25-30 С; величина омыления: 5663; содержание гидроксила: 90-110; йодный индекс: 2; вязкость при 30 мас.% в воде при 25 С: примерно 12 mPas. В соответствии с вариантом изобретения фармацевтический состав может содержать по меньшей мере одну другую добавку, традиционно используемую в жидких лекарственных формах. Можно, например, использовать антиоксидант, консервант, буфер и т.д. В соответствии с другим вариантом изобретения фармацевтический состав содержит только поверхностно-активное вещество, этанол и соединение формулы (I). Фармацевтический состав можно готовить следующим образом: поверхностно-активное вещество нагревают до превращения в жидкость; температура, при которой поверхностно-активное вещество становится жидким, изменяется в зависимости от поверхностно-активного вещества и содержания сложного моно- и диэфира и в случае необходимости от свободного полиэтиленгликоля. Температура главным образом составляет от 35 до 50 С(включая предельные значения); вводят этанол; введенное количество является таким, что отношение поверхностно-активное вещество/этанол является таким, как указано выше; смесь поверхностно-активное вещество/этанол охлаждают до комнатной температуры; в охлажденную смесь вводят соединение формулы (I); конечную смесь стерилизуют. Преимущественно можно использовать стерилизацию фильтрованием: по этому поводу см. "Pharmaceutical process validation", R.A. Nash, 3 издание, Marcel Dekker Inc, isbn=0824708385, с. 119, или "Validation of pharmaceutical processes", J.P. Agalloco, 3 изд., 2007, isbn=9780849370557, с. 151-152. Стерилизация фильтрованием не разрушает соединение формулы (I), которое чувствительно к нагреванию в противоположность стерилизации нагреванием. Например, в случае лекарственной формы с отношением 75/25 можно использовать фильтрование через фильтр 0,22 мкм. Описанный выше фармацевтический состав является концентратом, предназначенным для разведения для получения раствора для перфузий. Он может находиться в стеклянной емкости. Раствор для перфузий получают непосредственно перед употреблением, разбавляя концентрат в изотоническом растворе, пригодном для перфузии (например, содержащим глюкозу или соль). Больничный персонал готовит раствор для перфузий главным образом в виде кармана для перфузий за некоторое время до введения. Раствор для перфузий является мицеллярным раствором с избыточным содержанием соединения формулы (I), полученным путем разведения 1 объема концентрата в 20-500 объемах изотонического раствора. Его используют для лечения рака человека. Функция поверхностно-активного вещества заключается в растворении соединения формулы (I) в составе и стабилизации раствора для перфузий (мицеллизация). Растворимость соединения формулы (I) повышается, таким образом, с увеличением отношения поверхностно-активное вещество/этанол. Тем не менее, при отношении, превышающем 80/20, вязкость состава увеличивается настолько, что забор при помощи шприца становится более трудным, даже невозможным. Этанол служит сорастворителем и его функция заключается в уменьшении вязкости поверхностноактивного вещества, что упрощает обращение с ним. Если значение отношения поверхностно-активное вещество/этанол ниже 25/75, вводимое количество этанола становится значительным и растворимость соединения формулы (I) становится слишком слабой. Этанол нельзя заменить PEG 300 или 400, так как поверхностно-активное вещество и PEG 300/400 не смешиваются при отношениях поверхностноактивное вещество/PEG от 25/75 до 50/50, или смесь поверхностно-активное вещество/PEG 300/400 является твердой при комнатной температуре в отношениях от 60/40 до 75/25. Также разведение соединения формулы (I) в одном только PEG не позволяет превышать растворимость больше 7 мг/мл и физическая стабильность раствора для перфузий не является удовлетворительной (24 ч). Наконец, исследования химической стабильности позволили показать, что соединение формулы (I) распадается менее быстро,особенно в ускоряющих условиях при 25C/60% HR (относительная влажность) и 30C/60% HR в составах по изобретению, чем в составах на основе PS80 или PS80/этанол. Таким образом, состав по изобретению имеет следующие преимущества: он представляет собой однородный раствор; он позволяет достичь достаточной растворимости соединения формулы (I) с тем, чтобы его можно было вводить пациенту в количестве порядка нескольких сотен мг; им можно манипулировать и, в частности, его можно брать шприцем; соединение формулы (I) не разлагается так, как с другими поверхностно-активными веществами(см. табл. IV); раствор для перфузий, полученный из состава, обладает физической стабильностью в течение по меньшей мере 24 ч при комнатной температуре, т.е. он не имеет видимого осадка; состав может стерилизоваться через фильтр. Концентрация соединения формулы (I) в фармацевтическом составе может варьировать от 5 до 25 мг/мл. В действительности растворимость зависит от отношения поверхностно-активное вещество/этанол. Примеры фармацевтических составов по изобретению являются следующими:(C) отношение поверхностно-активное вещество/этанол 25/75; соединение формулы (I): 5 мг/мл. Раствор для перфузий содержит соединение формулы (I) в концентрации от 0,01 до 1,2 мг/мл, поверхностно-активное вещество в концентрации от 0,48 до 37 мг/мл и этанол в концентрации от 0,35 до 35 мг/мл, разведенные в изотоническом растворе. Предпочтительно он содержит соединение формулы (I) в концентрации от 0,01 до 1,2 мг/мл, поверхностно-активное вещество в концентрации от 1,4 до 35 мг/мл и этанол в концентрации от 0,4 до 13 мг/мл, разведенные в изотоническом растворе. Фигуры Фиг. 1: кривая изменения во времени концентрации примесей в лекарственной форме SOLUTOLHS15/этанол. Фиг. 2: кривая изменения во времени концентрации примесей в лекарственной форме PS80/этанол. Фиг. 3: кривая изменения во времени концентрации примесей в лекарственной форме PS80. Примеры Получение состава по изобретению. В стеклянном реакторе расплавляют SOLUTOL HS15 при 40 С в течение примерно 3 ч, затем нагревание прекращают и емкость инертируют. Температуру емкости понижают до 20 С и не дожидаясь возврата к 20 С в SOLUTOL HS15 вводят этанол. Затем гомогенизируют в течение 30 мин. Вводят соединение формулы (I) (базовая форма), растворяют его в смеси SOLUTOL HS15/этанол и перемешивают в течение 3 ч при комнатной температуре. Затем фильтруют через фильтр PVDF 0,22 мкм и хранят раствор в течение 24 ч. Затем раствор подвергают стерилизующему фильтрованию через фильтр PVDF 0,22 мкм. Другие составы. Несколько составов соединения формулы (I) сравнивают для определения той, которая позволяет получить целевую растворимость 20 мг/г (табл. III). Таблица III Исследование химической стабильности путем измерения содержания примесей высокоэффективной жидкостной хроматографией (ВЭЖХ) проводили в отношении лекарственных форм, позволяющих достичь целевой растворимости. Для этого проводили количественное определение во времени примесей, присутствующих в трех следующих составах: Было отмечено, что состав, сочетающий SOLUTOL HS15 и этанол, является наиболее стабильным из трех. Физическая и химическая устойчивость раствора в кармане для перфузий. Концентрат SOLUTOL HS15/этанол 75/25 (мас./мас.) разводили непосредственно перед использованием в кармане для перфузии. Исследовали физическую и химическую стабильность раствора в кармане для перфузии. Оценивали разные параметры: разведение 0,04 мг/мл и 1 мг/мл; среда разведения (NaCl 0,9% или глюкоза 5%); температура хранения (5 и 30 С); продолжительность хранения. Независимо от тестируемых условий было показано, что карманы являются химически и физически стабильными по меньшей мере в течение 72 ч. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтический состав, содержащий соединение формулы (I) в форме основания или в форме соли фармацевтически приемлемой кислоты, растворенное в смеси этанола и поверхностно-активного вещества, содержащего смесь сложного полиэтоксилированного моно- и диэфира 12-гидроксистеариновой кислоты, имеющих соответственно формулы причем n является целым числом от 15 до 16,в массовом отношении поверхностно-активное вещество/этанол от 25/75 до 80/20. 2. Фармацевтический состав по п.1, отличающийся тем, что поверхностно-активное вещество представляет собой макрогол 15 гидроксистеарат. 3. Фармацевтический состав по п.1 или 2, отличающийся тем, что массовое отношение поверхностно-активное вещество/этанол составляет от 73/27 до 77/23. 4. Состав по п.2, в котором поверхностно-активное вещество содержит по весу от 35 до 55% сложного моно- и диэфира и от 30 до 40% полиэтиленгликоля H(OCH2CH2)n-OH. 5. Состав по п.4, в котором поверхностно-активное вещество содержит по весу в качестве преобладающих компонентов от 35 до 55% сложного моно- и диэфира и от 30 до 40% полиэтиленгликоляH(OCH2CH2)n-OH. 6. Состав по п.1 или 2, в котором поверхностно-активное вещество содержит по весу от 10 до 20% сложного моноэфира, от 25 до 35% сложного диэфира и от 30 до 40% полиэтиленгликоля H(ОСН 2 СН 2)nОН. 7. Фармацевтический состав по пп.1-6, в котором отношение поверхностно-активное вещество/этанол составляет от 73/27 до 77/23 и концентрация соединения формулы (I) составляет от 5 до 25 мг/мл. 8. Применение фармацевтического состава по любому из пп.1-7 для получения после разведения раствора для перфузии. 9. Способ получения фармацевтического состава по любому из пп.1-7, включающий следующие стадии: поверхностно-активное вещество нагревают до перехода в жидкое состояние; вводят этанол; смесь поверхностно-активное вещество/этанол охлаждают до комнатной температуры; соединение формулы (I) вводят в охлажденную смесь; конечную смесь стерилизуют. 10. Способ по п.9, в котором смесь стерилизуют фильтрованием. 11. Раствор для перфузии, содержащий соединение формулы (I) в форме основания или в форме соли фармацевтически приемлемой кислоты,полученный разведением 1 объема фармацевтического состава по пп.1-7 в 20-500 объемах изотонического раствора. 12. Раствор для перфузии, содержащий соединение формулы (I) в форме основания или в форме соли фармацевтически приемлемой кислоты, в концентрации от 0,01 до 1,2 мг/мл, поверхностно-активное вещество, такое как определено по любому из пп.1-7, в концентрации от 0,48 до 37 мг/мл и этанол в концентрации от 0,35 до 35 мг/мл, разведенные в изотоническом растворе. 13. Применение раствора для перфузии по п.11 или 12 для введения человеку. 14. Способ получения раствора для перфузии, заключающийся в разведении 1 объема фармацевтического состава по пп.1-7 в 20-500 объемах изотонического раствора. 15. Емкость, содержащая фармацевтический состав, такой как описан в любом из пп.1-7. 16. Карман для перфузии, содержащий раствор для перфузии по п.11 или 12.
МПК / Метки
МПК: A61K 9/00, A61K 47/14, A61K 31/519
Метки: фармацевтический, состав
Код ссылки
<a href="https://eas.patents.su/9-21059-farmacevticheskijj-sostav.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтический состав</a>
Предыдущий патент: Гетероциклы с фунгицидными свойствами
Следующий патент: Вытяжной колпак, сборочный комплект для вытяжного колпака и способ сборки вытяжного колпака
Случайный патент: Композиции для личной и домашней гигиены на основе дигидроцитрата серебра












