Жидкий фармацевтический состав, содержащий парацетамол
Номер патента: 18401
Опубликовано: 30.07.2013
Авторы: Скарпетти Паоло, Раньи Лорелла, Валенти Мауро, Мариотти Франческа
Формула / Реферат
1. Не содержащий сахара жидкий фармацевтический состав, включающий водный раствор парацетамола, солюбилизирующий агент, содержащий полиэтиленгликоль, загуститель, содержащий ксантановую камедь, и подслащивающую систему, содержащую сукралозу и смесь полиолов, содержащую глицерин, сорбитол и ксилитол, в суммарном количестве приблизительно от 15 до 35% мас./об. относительно суммарного объема указанного фармацевтического состава.
2. Фармацевтический состав по п.1, отличающийся тем, что солюбилизирующий агент представляет собой полиэтиленгликоль с молекулярной массой более чем 1000, присутствующий в количестве более чем 10% мас./об. относительно суммарного объема указанного фармацевтического состава.
3. Фармацевтический состав по п.2, отличающийся тем, что солюбилизирующий агент представляет собой полиэтиленгликоль с молекулярной массой от 3000 до 8000, присутствующий в количестве от 15 до 20% мас./об. относительно суммарного объема упомянутого фармацевтического состава.
4. Фармацевтический состав по любому из предшествующих пунктов, отличающийся тем, что загуститель представляет собой ксантановую камедь, присутствующую в количестве от 0,1 до 2,0% мас./об. относительно суммарного объема указанного фармацевтического состава.
5. Фармацевтический состав по п.4, отличающийся тем, что загуститель представляет собой XANTURAL® 75.
6. Фармацевтический состав по любому из предшествующих пунктов, отличающийся тем, что подслащивающая система содержит количество сукралозы от 0,05 до 0,5% мас./об. относительно суммарного объема указанного фармацевтического состава.
7. Фармацевтический состав по любому из предшествующих пунктов, отличающийся тем, что подслащивающая система содержит смесь полиолов в количестве от 20 до 30% мас./об. относительно суммарного объема указанного фармацевтического состава.
8. Фармацевтический состав по п.7, отличающийся тем, что подслащивающая система содержит смесь полиолов в количестве от 22 до 28% мас./об. относительно суммарного объема указанного фармацевтического состава.
9. Фармацевтический состав по любому из предшествующих пунктов, отличающийся тем, что подслащивающая система содержит от 7 до 14% мас./об. глицерина, от 7 до 14% мас./об. сорбитола и от 3 до 7% мас./об. ксилитола относительно суммарного объема указанного фармацевтического состава.
10. Фармацевтический состав по любому из предшествующих пунктов, отличающийся тем, что фармацевтический состав содержит по меньшей мере одну дополнительную фармацевтически приемлемую добавку, выбранную из группы, включающей консерванты, антиоксиданты, буферирующие агенты, стабилизаторы, красители и ароматизаторы.
11. Фармацевтический состав по п.10, отличающийся тем, что фармацевтически приемлемая добавка присутствует в количестве от 0,01 до 2,0% мас./об. относительно суммарного объема указанного фармацевтического состава.
12. Фармацевтический состав по любому из предшествующих пунктов, отличающийся тем, что фармацевтический состав включает ингредиенты, перечисленные в нижеследующей таблице, в количествах от минимального значения до максимального значения, выраженных в % мас./об. относительно суммарного объема указанного фармацевтического состава.
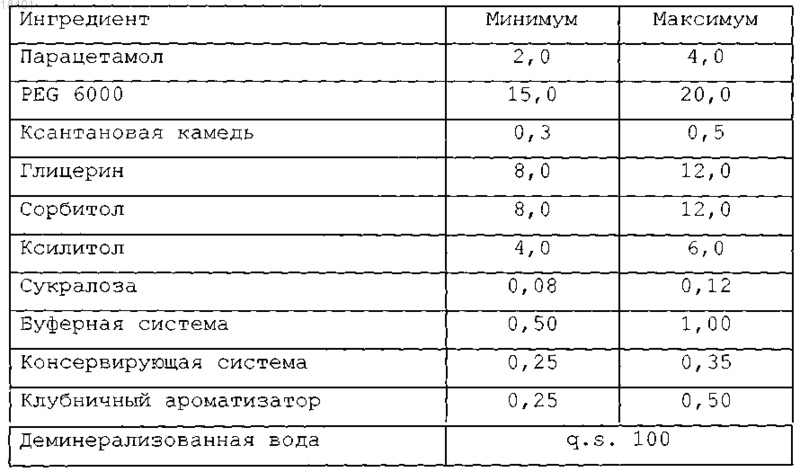
13. Фармацевтически приемлемое не содержащее сахара жидкое вспомогательное вещество для введения активных начал с неприятным вкусом, содержащее водную среду, солюбилизирующий агент, содержащий полиэтиленгликоль, загуститель, содержащий ксантановую камедь, и подслащивающую систему, содержащую сукралозу и смесь полиолов, включающую глицерин, сорбитол и ксилитол, в суммарном количестве приблизительно от 15 до 35% мас./об. относительно суммарного объема указанного фармацевтического состава.
14. Жидкое вспомогательное вещество по п.13, отличающееся тем, что солюбилизирующий агент имеет характеристики, представленные в пп.2 и 3.
15. Жидкое вспомогательное вещество по любому из пп.13 и 14, отличающееся тем, что загуститель имеет характеристики, представленные в пп.4 и 5.
16. Жидкое вспомогательное вещество по любому из пп.13-15, отличающееся тем, что подслащивающая система имеет характеристики, представленные в любом из пп.6-9.
17. Жидкое вспомогательное вещество по любому из пп.13-16, отличающееся тем, что жидкое вспомогательное вещество содержит по меньшей мере одну дополнительную фармацевтически приемлемую добавку, выбранную из группы, состоящей из консервантов, антиоксидантов, буферов, стабилизаторов, красителей и ароматизаторов.
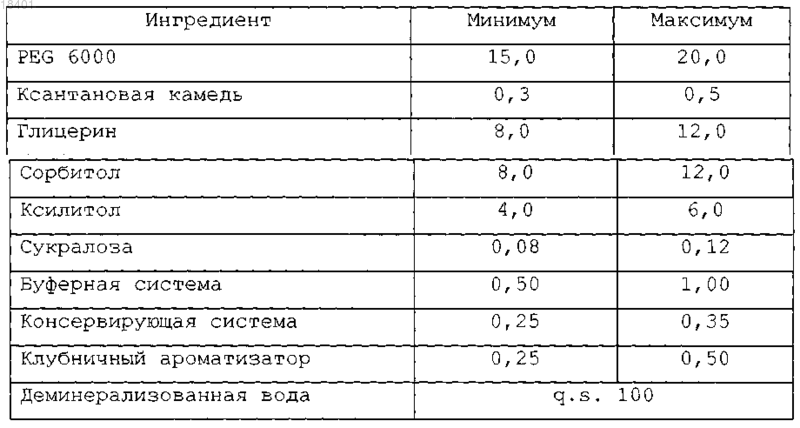
18. Жидкое вспомогательное вещество по любому из пп.13-17, отличающееся тем, что жидкое вспомогательное вещество содержит ингредиенты, перечисленные в нижеследующей таблице, в количествах от минимального значения до максимального значения, выраженных в виде % мас./об. относительно суммарного объема упомянутого жидкого вспомогательного вещества.
Текст
Изобретение относится к не содержащему сахара жидкому фармацевтическому составу,включающему в себя водный раствор парацетамола, солюбилизирующий агент, содержащий полиэтиленгликоль, загуститель, содержащий ксантановую камедь, и подслащивающую систему,содержащую сукралозу, и смесь полиолов, содержащую глицерин, сорбитол и ксилитол, в суммарном количестве приблизительно от 15 до 35% мас./об. относительно суммарного объема упомянутых фармацевтических составов.(71)(73) Заявитель и патентовладелец: АЦЬЕНДЕ КИМИКЕ РЬЮНИТЕ АНДЖЕЛИНИ ФРАНЧЕСКО Область техники, к которой относится изобретение Настоящее изобретение относится к жидкому фармацевтическому составу, содержащему парацетамол. Более конкретно, настоящее изобретение относится к жидкому фармацевтическому составу, не содержащему сахар и содержащему водный раствор парацетамола, солюбилизирующий агент, содержащий полиэтиленгликоль, загуститель, содержащий ксантановую камедь, и подслащивающую систему, содержащую сукралозу и смесь полиолов. Предшествующий уровень техники Из предшествующего уровня техники известно, что с физико-химической точки зрения парацетамол представляет собой белый порошок, не имеющий запаха, с особенно горьким вкусом, с умеренной растворимостью в воде (1,4 г/100 мл при 20 С), с показателем pH полученного в результате раствора,соответствующим умеренному значению кислотности и равным от 5,0 до 6,5. С химической точки зрения парацетамол представляет собой производное п-аминофенола, которое соответствует следующей формуле: С фармакологической точки зрения парацетамол широко применяют в качестве болеутоляющего средства с ярко выраженной жаропонижающей активностью. Благодаря данной специфической активности его применяют в различных фармацевтических формах в широком диапазоне доз. Парацетамол обладает механизмом действия, который связан с его способностью ингибировать синтез простагландинов, в частности ингибировать активность циклооксигеназы. Введение пероральным путем представляет собой предпочтительный способ введения парацетамола, подобно любому другому действующему началу, в жидкой или твердой форме, поскольку это оказывается быстрее и более практично для конечных пользователей. Применяемые фармацевтические формы могут быть твердыми и жидкими. В общем, особенно горький вкус многих активных начал не составляет большую проблему для введения твердых фармацевтических форм. В этих случаях можно маскировать горький вкус активных начал нанесением покрытия на фармацевтические формы, в форме таблетки или в форме капсулы, из синтетических полимеров или в виде сахарной оболочки. Однако твердая фармацевтическая форма является особенно неблагоприятной, когда конечным потребителем является ребенок или пожилой человек с проблемами глотания или когда доза активного начала связана, в частности, с весом пациента, как в случае антибиотиков, противовоспалительных средств и жаропонижающих средств, доза которых полностью связана с весом и возрастом пациента. В этих случаях особенно удобно и практично вводить активное начало в жидкой фармацевтической форме, например в форме сиропа или капель. Жидкие составы представлены суспензиями и растворами,в зависимости от того, суспендируют или растворяют активное начало в среде. В случае активных начал с особенно неприятным вкусом и/или очень низкой растворимостью часто применяют фармацевтические формы, в которых суспендируют, а не растворяют, активное начало. Патент США 5409907 описывает пример фармацевтической формы, в которой активное начало не растворяют, а суспендируют. Суспензия, описанная в указанном патенте, содержит на 100 мл от 0,5 до 1,0 г микрокристаллической целлюлозы, от 0,1 до 0,2 г ксантановой камеди, вплоть до 90 г подслащивающих сахаров, от 10 до 30 г воды и вплоть до 40 г активного начала. Однако общеизвестно, что фармацевтические формы, в которых активное начало находится в суспензии, имеют ряд недостатков, связанных главным образом с осаждением дисперсной фазы с течением времени и с нестабильностью упомянутой дисперсии. Осаждение вызывает изменения в концентрации активного начала в суспензии. Нестабильность суспензии ведет к разделению и расслоению компонентов суспензии. Это приводит к трудностям и погрешностям при введении точной дозы активного начала,особенно принимая во внимание, что конечные пользователи, в частности в случае пожилых людей, бывают неосторожными или неспособными хорошо встряхивать сосуд перед применением для восстановления гомогенного распределения активного начала в суспензии. Следовательно, ясно, что предпочтительно вводить жидкие фармацевтические формы, в которых полностью растворено активное начало, но для достижения этого в случае активных начал с особенно неприятным вкусом и/или очень низкой растворимостью необходимо иметь составы, содержащие специальные солюбилизирующие и подслащивающие агенты. Патент США 5154926 описывает сироп, содержащий на 100 мл от 0,5 до 5 г парацетамола или фенобарбитала, от 5 до 30 г полиола (глицерин, пропиленгликоль) или его полимера (полиэтиленгликоли или полипропиленгликоли с молекулярной массой между 300 и 400), от 0,5 до 5 г водорастворимой макромолекулы (поливинилпирролидоны), от 10 до 60 г сахарных подсластителей и достаточное количество воды для достижения 100 мл (по необходимости).WO 03/047502 описывает жидкий состав, в котором активное начало растворяют или диспергируют в водной среде, содержащей поливинилпирролидон и/или кополивидон (сополимер винилпирролидона и винилацетата) и высокомолекулярный полиэтиленгликоль. Составы, содержащие ацетаминофен (синоним парацетамола), всегда описывают как суспензии, и они содержат количество сахарных подсластителей от 20 до 95 мас.%. Растворы и суспензии, содержащие поливинилпирролидон, подвергаются значительному потемнению с течением времени, в большей степени и более быстро с большей температурой хранения, вызывая образование красящих веществ в результате окисления пирролидоновой группы. Кроме того, большое содержание сахарных подсластителей делает их непригодными для введения данных растворов и суспензий субъектам, которые не желают поглощать высокоэнергетические вещества или которые, по разным причинам, придерживаются специальных диет с низким содержанием сахара,например диабетики. Сущность настоящего изобретения Авторы изобретения неожиданно обнаружили, что не содержащий сахара жидкий фармацевтический состав, который включает в себя водный раствор парацетамола, солюбилизирующий агент, содержащий полиэтиленгликоль, загуститель, содержащий ксантановую камедь, и подслащивающую систему,содержащую сукралозу и смесь полиолов, включая глицерин, сорбитол и ксилитол, позволяет преодолеть вышеуказанные проблемы. В частности, авторы обнаружили, что фармацевтический состав настоящего изобретения позволяет сохранять в растворе количество парацетамола вплоть до 5% мас./об. относительно суммарного объема упомянутого фармацевтического состава. Авторы обнаружили, что фармацевтический состав настоящего изобретения является стабильным с течением времени без проявления феномена потемнения, что является характерным для составов, содержащих поливинилпирролидон, и без проявления феномена осаждения активного начала. Кроме того, авторы неожиданно обнаружили, что несмотря на содержание парацетамола в растворе и полное отсутствие сахарных подсластителей, фармацевтические составы настоящего изобретения тем не менее обладают превосходными и особенно приятными вкусовыми качествами, по сравнению со вкусовыми качествами общепринятых сиропов, содержащих парацетамол. Следовательно, в первом аспекте настоящее изобретение относится к не содержащему сахар жидкому фармацевтическому составу, содержащему водный раствор парацетамола, солюбилизирующий агент, содержащий полиэтиленгликоль, загуститель, содержащий ксантановую камедь, и подслащивающую систему, содержащую сукралозу и смесь полиолов, включая глицерин, сорбитол и ксилитол, в количестве от приблизительно 15 до 35% мас./об. относительно суммарного объема упомянутого фармацевтического состава. Во втором аспекте настоящее изобретение относится к фармацевтически приемлемому не содержащему сахара жидкому вспомогательному веществу для введения активных начал с неприятным вкусом, содержащему водную среду, солюбилизирующий агент, содержащий полиэтиленгликоль, загуститель, содержащий ксантановую камедь, и подслащивающую систему, содержащую сукралозу и смесь полиолов, включая глицерин, сорбитол и ксилитол, в количестве приблизительно от 15 до 35% мас./об. относительно суммарного объема упомянутого фармацевтического состава. В контексте данного изобретения выражение "не содержащее сахара" относится к вспомогательному веществу/составу, не содержащему определяемое количество сахаров, тогда как термин "сахара" включает все природные моносахариды и дисахариды, обычно определяемые как сахариды или восстанавливающие сахара, такие как глюкоза, фруктоза и сахароза (хотя последняя не обладает восстанавливающей способностью). В контексте данного изобретения выражение "% мас.част./об. относительно суммарного объема" относится к числу массовых частей относительно 100 об.част., обычно выражаемых в граммах на 100 мл, но эквивалентно 1 кг на 100 л. Подробное описание настоящего изобретения Настоящее изобретение по меньшей мере в одном из вышеупомянутых аспектов может обладать одной или более из предпочтительных характеристик, описанных ниже. Не содержащий сахара жидкий фармацевтический состав настоящего изобретения содержит водный раствор парацетамола, солюбилизирующий агент, содержащий полиэтиленгликоль, загуститель,содержащий ксантановую камедь, и подслащивающую систему, содержащую сукралозу и смесь полиолов, включая глицерин, сорбитол и ксилитол, в количестве приблизительно от 15 до 35% мас./об. относительно суммарного объема упомянутых фармацевтических составов. Предпочтительно жидкий фармацевтический состав настоящего изобретения содержит количество парацетамола вплоть до 5% мас./об., более предпочтительно вплоть до 4% мас./об. и даже более предпочтительно вплоть до 3% мас./об. относительно суммарного объема упомянутых фармацевтических составов. Обычно оптимальное количество парацетамола, содержащегося в жидких фармацевтических составах настоящего изобретения, составляет от 2 до 3% мас./об. относительно суммарного объема упомянутых фармацевтических составов. Авторы обнаружили, что ниже вышеупомянутого максимального предела количество парацетамола в жидких фармацевтических составах настоящего изобретения остается стабильным в растворе без придания фармацевтическим составам неприятного вкуса и обеспечивая общепринятую оптимальную дозу активного начала. Предпочтительно солюбилизирующим агентом, применяемым в жидких фармацевтических составах настоящего изобретения, является полиэтиленгликоль с высокой молекулярной массой, предпочтительно большей чем 1000, более предпочтительно от 2000 до 10000 и даже более предпочтительно от 3000 до 8000. Обычно полиэтиленгликоль, применяемый в жидких фармацевтических составах настоящего изобретения, представляет собой PEG 4000 или PEG 6000, оказалось, что последний является полиэтиленгликолем с наибольшей солюбилизирующей способностью. Полиэтиленгликоли, которые можно применять в настоящем изобретении, являются имеющимися в продаже продуктами, распространяемыми, например, Alfa Aesar GmbH, Karlsruhe, Germany и CarboMer, Inc., San Diego, California, USA. Предпочтительно жидкий фармацевтический состав настоящего изобретения содержит количество полиэтиленгликоля более чем 10% мас./об. и более предпочтительно более чем 15% мас./об. относительно суммарного объема упомянутых фармацевтических составов. Обычно оптимальное количество полиэтиленгликоля, содержащегося в жидких фармацевтических составах настоящего изобретения, составляет от 15 до 20% мас./об. относительно суммарного объема упомянутых фармацевтических составов. Удобно, чтобы загуститель, применяемый в жидких фармацевтических составах настоящего изобретения, представлял собой ксантановую камедь, имеющийся в продаже полисахарид, полученный ферментацией глюкозы и/или сахарозы, проводимой в присутствии Xanthomonas campestris, и продаваемый на рынке в течение первого времени в районе 60-х годов CP Kelco Company, USA. В настоящее время ксантановая камедь продается CP Kelco Company, USA под торговыми названиями KELTROL,KELZAN и XANTURAL. Предпочтительно ксантановая камедь, применяемая в жидких фармацевтических составах настоящего изобретения, представляет собой продукт XANTURAL 75. Предпочтительно жидкий фармацевтический состав настоящего изобретения содержит количество ксантановой камеди от 0,1 до 2,0% мас./об., более предпочтительно от 0,2 до 1,0% мас./об. относительно суммарного объема упомянутых фармацевтических составов. Подслащивающая система, применяемая в жидком фармацевтическом составе настоящего изобретения, содержит сукралозу и смесь полиолов, содержащих глицерин, сорбитол и ксилитол. Предпочтительно жидкий фармацевтический состав настоящего изобретения содержит количество сукралозы от 0,05 до 0,5% мас./об., более предпочтительно от 0,075 до 0,25% мас./об. относительно суммарного объема упомянутых фармацевтических составов. Предпочтительно жидкий фармацевтический состав настоящего изобретения содержит количество смеси полиолов от 20 до 30% мас./об., более предпочтительно от 22 до 28% мас./об. относительно суммарного объема упомянутых фармацевтических составов. Согласно предпочтительному варианту осуществления настоящего изобретения подслащивающая система содержит смесь глицерина, ксилитола и сорбитола в суммарном количестве от 23 до 27% мас./об. относительно суммарного объема упомянутых фармацевтических составов. Предпочтительно фармацевтический состав настоящего изобретения содержит подслащивающую систему, представленную от 7 до 14% мас./об. глицерина, от 7 до 14% мас./об. сорбитола и от 3 до 7% мас./об. ксилитола относительно суммарного объема упомянутого фармацевтического состава. Авторы обнаружили, что комбинация ксантановой камеди, сукралозы и полиолов настоящего изобретения, неожиданно, позволила скрыть неприятный вкус парацетамола, придавая жидким фармацевтическим составам настоящего изобретения приятный вкус и консистентность, сравнимые со вкусом и консистентностью сиропа на основе сахарозы. В частности, авторы обнаружили, что комбинация ксантановой камеди, сукралозы и полиолов настоящего изобретения, неожиданно, изолирует контакт парацетамола с вкусовыми сосочками, придавая приятный вкус, особенно совместимый с группой детского возраста, и консистентность, сравнимую с консистентностью полноценного сиропа на основе сахарозы. Жидкий фармацевтический состав настоящего изобретения может дополнительно содержать другие фармацевтически приемлемые добавки, традиционно известные специалистам в данной области техники,например консерванты, антиоксиданты, буферы, стабилизаторы, красители и ароматизаторы. Пригодными примерами консервантов и антиоксидантов являются сорбиновая кислота, сорбат натрия и сорбат калия, метил-п-гидроксибензоат (метилпарабен), этил-п-гидроксибензоат (этилпарабен) и пропил-п-гидроксибензоат (пропилпарабен), аскорбиновая кислота, аскорбат натрия или аскорбат калия,галловая кислота и галлаты натрия или калия или их смеси. Смесь сорбата калия и метилпарабена является особенно предпочтительной. Пригодными примерами буферирующих агентов являются органические и неорганические кислотно-основные буферные системы, например лимонная кислота и цитраты натрия или калия, фосфорная кислота и фосфаты натрия и калия. Комбинация лимонной кислоты и цитрата натрия является особенно предпочтительной. Пригодные примеры стабилизаторов включают альгиновую кислоту и альгинаты натрия и калия,агар-агар, каррагенин и трагакантовую камедь. Пригодные примеры ароматизаторов включают натуральные или синтетические ароматические добавки, например клубничный ароматизатор, мандариновый ароматизатор, персиковый ароматизатор,лимонный ароматизатор, малиновый ароматизатор и их смеси. Количество каждой из вышеупомянутых добавок обычно составляет от 0,01 до 2,0% мас./об., более предпочтительно от 0,05 до 1,0% мас./об. относительно суммарного объема упомянутых фармацевтических составов. Согласно особенно предпочтительному варианту осуществления жидкие фармацевтические составы настоящего изобретения содержат ингредиенты следующей табл. А в количествах от минимальной величины и до максимальной величины, показанных в упомянутой табл. А. Все количества выражаются в граммах (г), за исключением количества деминерализованной воды, которая выражается в миллилитрах В следующем аспекте настоящее изобретение относится к фармацевтически приемлемому не содержащему сахара жидкому вспомогательному веществу для введения активных начал с неприятным вкусом, содержащему водную среду, солюбилизирующий агент, содержащий полиэтиленгликоль, загуститель, содержащий ксантановую камедь, и подслащивающую систему, содержащую сукралозу и смесь полиолов, которая включает глицерин, сорбитол и ксилитол в количестве приблизительно от 15 до 35% мас./об. относительно суммарного объема упомянутых фармацевтических составов. Активные начала с неприятным вкусом, которые можно вводить предпочтительно в растворенной форме в фармацевтически приемлемое жидкое вспомогательное вещество настоящего изобретения, являются активными началами, содержащими гидрофильные группы, способные образовывать водородные связи, например гидроксильную группу, карбоксильную группу и аминогруппу. В частности, упомянутые активные начала могут представлять собой в качестве неограничивающих примеров ибупрофен,гидрохлорид фенилпропаноламина, гидрохлорид псевдоэфедрина, гидрохлорид фенилэприна, гидрохлорид дифенгидрамина, гвайфенезин, гидробромид декстрометорфана, малеат хлорфенирамина, малеат бромфенирамина, терфенадин, лоратадин, гидрохлорид бромексина, гидрохлорид амброксола, сульфат сальбутамола, амоксициллин, ампициллин, клоксациллин, флуклоксациллин, цефалексин и их комбинации. Фармацевтически приемлемое не содержащее сахара жидкое вспомогательное вещество настоящего изобретения по меньшей мере в одном его аспекте может проявлять одно или более из его предпочтительных характеристик, описанных ранее для фармацевтических составов настоящего изобретения. Предполагается, что следующие примеры иллюстрируют предпочтительные аспекты настоящего изобретения, не преследуя цели ограничить его. Специалисты в данной области техники смогут сделать различные изменения, которые включены в сущность настоящего изобретения и в объем формулы изобретения. Пример 1. Составы 1 и 2 получали смешением количеств компонентов, указанных в табл.1, согласно следующей методике.PEG6000 и метил п-гидроксибензоат растворяли в деминерализованной воде, нагретой до 80C. Температуру полученного в результате раствора понижали до 60C, затем добавляли и растворяли сорбат калия. Температуру полученного в результате раствора понижали до 40C, затем добавляли и растворяли парацетамол. Температуру полученного в результате раствора понижали до 25C, затем добавляли и растворяли лимонную кислоту, цитрат натрия и подслащивающую систему (сахарин натрия и сахароза для состава 1, сукралоза, ксилитол, сорбитол и глицерин для состава 2). Затем к прозрачному раствору до-4 018401 бавляли и растворяли ароматизаторы и ксантановую камедь и, наконец, раствор доводили вплоть до объема 100 мл деминерализованной водой при 25 С. Все количества компонентов в табл. 1 выражены в граммах (г), за исключением количества деминерализованной воды, которое выражено в миллилитрах (мл). Таблица 1Xantural 75 является торговым названием ксантановой камеди, полученной CP Kelco Company,USA (http://www.cpkelco.com/). Пример 2. Составы 1 и 2, полученные согласно примеру 1, подвергали анализу на определение вкусовых качеств для того, чтобы проверить их приемлемость конечными пользователями. Было отобрано 30 субъектов в возрасте от 20 до 50 лет. Испытание проводили инструктированием отобранных субъектов для восприятия и оценивания, с баллами от 0 до 3, относительного воздействия горькости, пощипывания, закупоривания и вязкости в момент введения (T0), в процессе глотания (T1),сразу после глотания (T2) и через 5 мин после глотания (T3). Следующие суммарные баллы рассчитывали для каждого субъекта: суммарный балл отдельных стимулов, являющийся суммой баллов, полученных в T0, T1, T2 и T3; суммарный балл, полученный суммированием суммарных баллов отдельных стимулов. В табл. 2 сведены полученные средние результаты, которые анализировали статистическим способом с применением рангового критерия Уилкоксона. Таблица 2 Статистический анализ показал статистически значимое различие (p0,05) между двумя сиропами относительно ощущения вязкости из-за большей маслянистости продукта (среднее 2=4,33 против среднего 1=2,47) и различие в пределах значимости (p=0,07) между двумя сиропами относительно ощущения закупоривания из-за лучшей консистентности продукта (среднее 2=3,87 против среднего 1=2,73). Показатели, относящиеся к ощущению вязкости и консистентности, несмотря на наличие загустителя, такого как ксантановая камедь, для регулирования вязкости и консистентности продукта, были только очень незначительно менее приятны в составе 2 и, тем не менее, рассматривались приемлемыми. Что касается других анализируемых стимулов (горькость и пощипывание) и общей суммы стимулов, статистически значимых различий между двумя сиропами обнаружено не было. Отобранных субъектов опрашивали и просили сделать суммарную оценку продукта (неприемлемый, приемлемый, хороший, превосходный), а также спрашивали о необходимости выпить воду после введения (да, нет). Следующие табл. 3 и 4 суммируют полученные результаты, которые анализировали тестом МакНемара. Все величины выражены в процентах. Рассматривая необходимость пить воду и суммарную оценку, выраженную субъектами для двух сиропов, статистически значимых различий обнаружено не было. Пример 3. Состав 2 настоящего изобретения подвергали оценке на стабильность в различных условиях температуры и относительной влажности. Результаты сведены в табл. 5. Таблица 5 Данные в табл. 5 показывают стабильность состава 2 настоящего изобретения даже в наиболее критических условиях хранения. Пример 4 С целью определения лучшей подслащивающей системы получали и тестировали следующие составы, изменяя число и количества компонентов системы. Составы 3-10 получали смешением количеств компонентов, показанных в табл. 6, аналогичной методикой, как в примере 1. Количества всех компонентов в табл. 6 выражены в граммах (г), за исключением количества деминерализованной воды, которая выражена в миллилитрах (мл). Таблица 6 Сразу же было обнаружено, что состав 8 не является подходящим, так как хранение при 4 С привело к образованию кристаллов, вследствие избыточного количества компонентов подслащивающей системы. Составы 3-7 и 9, 10 подвергали аналогичному тесту на определение вкусовых качеств, описанному в примере 2, ограниченному испытанием на горькость (изменение компонентов подслащивающей системы не оказывало влияния на испытание пощипывания, закупоривания и вязкости). Величины, полученные для составов 1 и 2, также показаны для сравнения. Полученные средние значения представлены табл. 7. Таблица 7 Оказалось, что все составы 3-6 дают очень отрицательные результаты в тесте на горькость из-за отсутствия одного из четырех компонентов подслащивающей системы (сукралозы, глицерина, сорбитола или ксилитола). Обнаружено, что состав 7 является едва приемлемым из-за минимального содержания всех компонентов подслащивающей системы. Обнаружено, что композиции 9 и 10 являются сравнимыми со значениями, полученными для составов 1 и 2. Данные в табл. 6 и 7 подтвердили, что только не содержащие сахара фармацевтические составы настоящего изобретения, в которых одновременно присутствуют четыре компонента подслащивающей системы в подходящих количествах, имеют приятный вкус, сравнимый с составами на основе сахарозы. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Не содержащий сахара жидкий фармацевтический состав, включающий водный раствор парацетамола, солюбилизирующий агент, содержащий полиэтиленгликоль, загуститель, содержащий ксантановую камедь, и подслащивающую систему, содержащую сукралозу и смесь полиолов, содержащую глицерин, сорбитол и ксилитол, в суммарном количестве приблизительно от 15 до 35% мас./об. относительно суммарного объема указанного фармацевтического состава. 2. Фармацевтический состав по п.1, отличающийся тем, что солюбилизирующий агент представляет собой полиэтиленгликоль с молекулярной массой более чем 1000, присутствующий в количестве более чем 10% мас./об. относительно суммарного объема указанного фармацевтического состава. 3. Фармацевтический состав по п.2, отличающийся тем, что солюбилизирующий агент представляет собой полиэтиленгликоль с молекулярной массой от 3000 до 8000, присутствующий в количестве от 15 до 20% мас./об. относительно суммарного объема упомянутого фармацевтического состава. 4. Фармацевтический состав по любому из предшествующих пунктов, отличающийся тем, что загуститель представляет собой ксантановую камедь,присутствующую в количестве от 0,1 до 2,0% мас./об. относительно суммарного объема указанного фармацевтического состава. 5. Фармацевтический состав по п.4, отличающийся тем, что загуститель представляет собой XANTURAL 75. 6. Фармацевтический состав по любому из предшествующих пунктов, отличающийся тем, что подслащивающая система содержит количество сукралозы от 0,05 до 0,5% мас./об. относительно суммарного объема указанного фармацевтического состава. 7. Фармацевтический состав по любому из предшествующих пунктов, отличающийся тем, что подслащивающая система содержит смесь полиолов в количестве от 20 до 30% мас./об. относительно суммарного объема указанного фармацевтического состава. 8. Фармацевтический состав по п.7, отличающийся тем, что подслащивающая система содержит смесь полиолов в количестве от 22 до 28% мас./об. относительно суммарного объема указанного фармацевтического состава. 9. Фармацевтический состав по любому из предшествующих пунктов, отличающийся тем, что подслащивающая система содержит от 7 до 14% мас./об. глицерина, от 7 до 14% мас./об. сорбитола и от 3 до 7% мас./об. ксилитола относительно суммарного объема указанного фармацевтического состава. 10. Фармацевтический состав по любому из предшествующих пунктов, отличающийся тем, что фармацевтический состав содержит по меньшей мере одну дополнительную фармацевтически приемлемую добавку, выбранную из группы, включающей консерванты, антиоксиданты, буферирующие агенты,стабилизаторы, красители и ароматизаторы. 11. Фармацевтический состав по п.10, отличающийся тем, что фармацевтически приемлемая добавка присутствует в количестве от 0,01 до 2,0% мас./об. относительно суммарного объема указанного фармацевтического состава. 12. Фармацевтический состав по любому из предшествующих пунктов, отличающийся тем, что фармацевтический состав включает ингредиенты, перечисленные в нижеследующей таблице, в количествах от минимального значения до максимального значения, выраженных в % мас./об. относительно суммарного объема указанного фармацевтического состава. 13. Фармацевтически приемлемое не содержащее сахара жидкое вспомогательное вещество для введения активных начал с неприятным вкусом, содержащее водную среду, солюбилизирующий агент,содержащий полиэтиленгликоль, загуститель, содержащий ксантановую камедь, и подслащивающую систему, содержащую сукралозу и смесь полиолов, включающую глицерин, сорбитол и ксилитол, в суммарном количестве приблизительно от 15 до 35% мас./об. относительно суммарного объема указанного фармацевтического состава. 14. Жидкое вспомогательное вещество по п.13, отличающееся тем, что солюбилизирующий агент имеет характеристики, представленные в пп.2 и 3. 15. Жидкое вспомогательное вещество по любому из пп.13 и 14, отличающееся тем, что загуститель имеет характеристики, представленные в пп.4 и 5. 16. Жидкое вспомогательное вещество по любому из пп.13-15, отличающееся тем, что подслащивающая система имеет характеристики, представленные в любом из пп.6-9. 17. Жидкое вспомогательное вещество по любому из пп.13-16, отличающееся тем, что жидкое вспомогательное вещество содержит по меньшей мере одну дополнительную фармацевтически приемлемую добавку, выбранную из группы, состоящей из консервантов, антиоксидантов, буферов, стабилизаторов, красителей и ароматизаторов. 18. Жидкое вспомогательное вещество по любому из пп.13-17, отличающееся тем, что жидкое вспомогательное вещество содержит ингредиенты, перечисленные в нижеследующей таблице, в количествах от минимального значения до максимального значения, выраженных в виде % мас./об. относительно суммарного объема упомянутого жидкого вспомогательного вещества.
МПК / Метки
МПК: A61K 9/00, A61K 31/167
Метки: жидкий, состав, содержащий, парацетамол, фармацевтический
Код ссылки
<a href="https://eas.patents.su/10-18401-zhidkijj-farmacevticheskijj-sostav-soderzhashhijj-paracetamol.html" rel="bookmark" title="База патентов Евразийского Союза">Жидкий фармацевтический состав, содержащий парацетамол</a>
Предыдущий патент: Устройство для вторичного вскрытия продуктивного пласта механической обработкой
Следующий патент: Легковесная соединительная втулка для элементов радиатора
Случайный патент: Жидкая лекарственная форма конъюгата












