Антимикробные соединения, их синтез и применение для лечения инфекций у млекопитающих
Формула / Реферат
1. Соединение формулы (I)

или его соль,
в которой R1 и R2 независимо друг от друга представляют собой NO2 или трифторметил;
R3 и R4 представляют собой Н;
R5 представляет собой Н, насыщенный линейный алифатический радикал, содержащий от 1 до 3 звеньев в цепи;
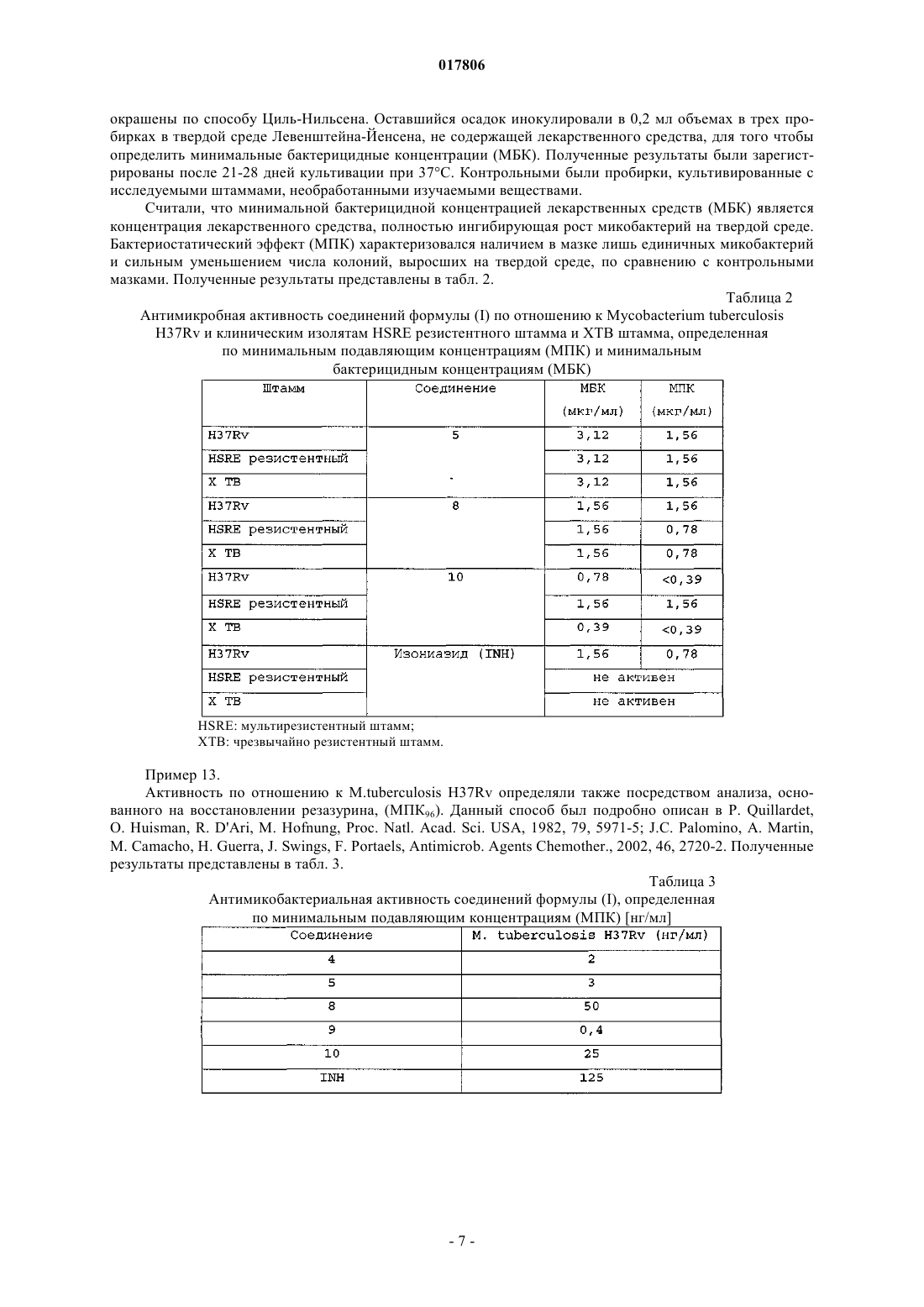
R6 представляет собой радикал
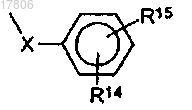
в котором X представляет собой насыщенный линейный алифатический радикал, содержащий от 1 до 2 звеньев в цепи; или
R5 и R6 вместе представляют собой бивалентные радикалы, в которых n составляет 1-4:
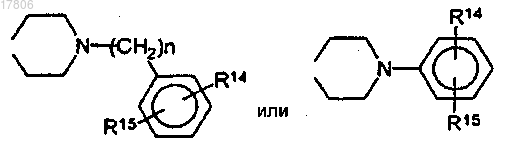
R14 и R15 независимо друг от друга представляют собой Н, линейный или разветвленный алифатический радикал, содержащий 1-5 звеньев в цепи, F, Cl, CF3.
2. Соединение формулы (I) по п.1, выбранное из группы, состоящей из
2-{метил[(1R)-1-фенилэтил]амино}-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,
2-[4-(4-хлорфенил)пиперазин-1-ил]-6,8-динитро-4H-1,3-бензотиазин-4-она,
2-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,
8-нитро-6-(трифторметил)-2-{4-[3-(трифторметил)фенил]пиперазин-1-ил}-4H-1,3-бензотиазин-4-она,
2-[бензил(этил)амино]-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,
2-[бензил(метил)амино]-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,
2-[4-(2-фторфенил)пиперазин-1-ил]-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,
2-(4-бензилпиперазин-1-ил)-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,
2-(бензиламино)-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,
2-[бензил(метил)амино]-6-хлоро-8-нитро-4H-1,3-бензотиазин-4-она,
или его соль.
3. Применение соединения формулы (I) или его соли по п.1 или 2 для получения фармацевтической композиции для лечения туберкулезной или гансениозной инфекции.
4. Применение соединения формулы (I) или его соли по п.1 или 2 для получения лекарственного средства для терапевтического или профилактического лечения микробной инфекции у млекопитающих.
5. Применение по п.4, где микробной инфекцией млекопитающих является туберкулезная или гансениозная инфекция.
6. Фармацевтическая композиция для лечения туберкулезной или гансениозной инфекции, содержащая соединение по п.1 или 2.
7. Применение соединения по п.1 или 2 или его соли в способе терапевтического или профилактического лечения микробной инфекции у млекопитающих.
8. Применение соединения по п.1 или 2 или его соли в способе терапевтического или профилактического лечения туберкулезной или гансениозной инфекции у млекопитающих.
9. Способ получения 2-NR5R6-4H-1,3-бензотиазин-4-онов в соответствии с формулой (I) по п.1, включающий реакцию 2-хлорбензкарбоксамидов с 1,1-2,0-кратным избытком солей металлов алкилксантогенатов при температуре 20-100°С в растворителе и последующую обработку полученного 2-алкокси-4H-1,3-бензотиазин-4-она амином HNR5R6 в растворителе при температуре 20-100°С.
Текст
АНТИМИКРОБНЫЕ СОЕДИНЕНИЯ, ИХ СИНТЕЗ И ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИЙ У МЛЕКОПИТАЮЩИХ Изобретение относится к соединениям общей формулы (I) с активностью по отношению к микобактериям в качестве потенциальных новых лекарственных средств для лечения туберкулеза, для того чтобы преодолеть проблемы, касающиеся резистентности и непереносимости лекарства где R1 и R2 независимо друг от друга представляют собой NO2 или трифторметил; R3 и R4 представляют собой Н; R5 представляет собой Н, насыщенный линейный алифатический радикал, содержащий 1-3 звеньев в цепи; R6 представляет собой радикал, в котором X представляет собой насыщенный линейный алифатический радикал, содержащий от 1 до 2 звеньев в цепи, или R5 и R6 вместе представляют собой бивалентные радикалы, в которых n=1-4: где R14 и R15 независимо друг от друга представляют собой Н, линейный или разветвленный алифатический радикал, содержащий 1-5 звеньев в цепи, F, Cl, CF3, или их солям. Изобретение также относится к фармацевтической композиции, содержащей соединение формулы (I), и к применению указанного соединения для получения лекарственного средства для терапевтического или профилактического лечения микробной инфекции у млекопитающих и в способе терапевтического или профилактического лечения микробной инфекции или туберкулезной или гансениозной инфекции, а также к способу получения 2-NR5R6-4H-1,3 бензотиазин-4-онов формулы (I). 017806 Настоящее изобретение относится к новым бензотиазиновым производным и их применению в качестве антибактериальных агентов в лечении инфекционных заболеваний у млекопитающих (людей и животных), вызванных бактериями, особенно заболеваний, подобных туберкулезу (ТБ) и гансениозу,вызванных микобактериями. Тиазинон, его производные и его применение в качестве антибактериальных агентов, особенно против микобактерий (ТБ), раскрыты для общего пользования, например, в AR 242567 A1, AU 3704400 А 1,СА 1322551 С 1 или ЕР 0245901 В 1. Как известно, существует угрожающее всемирное увеличение туберкулезных инфекций, связанных с микобактериями, которые выработали резистентность к доступным на данный момент терапиям(В.R. Bloom, J.L. Murray, Tuberculosis: commentary on a reemergent killer. Science. 1992, 257, 1055-1064). Чрезвычайно опасным является развитие мультирезистентных (МР) микобактерий. Существуют микобактерии, резистентные по крайней мере к двум из самых активных лекарственных средств для лечения туберкулеза, изониазиду и рифампицину, а также к стрептомицину, пиразинамиду и этамбутолу. Доля МР-ТБ в некоторых странах уже более 20%. Ситуация стала еще более угрожающей с тех пор как в прошлом году в Южной Африке были диагностированы первые случаи ТБ с широкой лекарственной резистентностью (чрезвычайно резистентного ТБ). В настоящее время ТБ с широкой лекарственной резистентностью уже распространился по всем континентам. Микобактерии, вызывающие ТБ с широкой лекарственной резистентностью, являются резистентными к первой линии лекарственных средств для лечения ТБ, рифампицину, изониазиду, пиразинамиду, этамбутолу и, кроме того, к хинолонам и аминогликозидам второй линии (Nature Med. 2007, 13, 295-298). Наряду с увеличением количества заболеваний ТБ повсеместно, это вызывает около 2000000 смертей ежегодно по всему миру. Для лечения таких заболеваний, как (ТБ) или гансениоз, существует острая необходимость в новых лекарственных средствах с новыми механизмами действия, особенно с целью преодоления резистентности к лекарственному средству и преодоления известных драматических побочных эффектов существующих лекарственных средств. Объекты данного изобретения Целью настоящего изобретения является получение новых соединений, обладающих активностью по отношению к микобактериям, в качестве потенциальных новых лекарственных средств для лечения туберкулеза, для того чтобы преодолеть проблемы, касающиеся резистентности и непереносимости лекарства. Решение технической задачи Данная цель достигается обеспечением соединений формулы (I) или их солейи,в которой R1 и R2 независимо друг от друга представляют собой NO2 или трифторметил;R5 представляет собой Н, насыщенный линейный алифатический радикал, содержащий от 1 до 3 звеньев в цепи;R5 и R6 вместе представляют собой бивалентные радикалы, в которых n составляет 1-4:R14 и R15 независимо друг от друга представляют собой Н, линейный или разветвленный алифатический радикал, содержащий 1-5 звеньев в цепи, F, Cl, CF3.-1 017806 В предпочтительном варианте осуществления данное изобретение касается соединений формулы(I), выбранных из группы, состоящей из 2-метил[(1R)-1-фенилэтил]амино-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,2-[4-(4-хлорфенил)пиперазин-1-ил]-6,8-динитро-4H-1,3-бензотиазин-4-она,2-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,8-нитро-6-(трифторметил)-2-4-[3-(трифторметил)фенил]пиперазин-1-ил-4H-1,3-бензотиазин-4 она,2-[бензил(этил)амино]-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,2-[бензил(метил)амино]-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,2-[4-(2-фторфенил)пиперазин-1-ил]-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,2-(4-бензилпиперазин-1-ил)-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,2-(бензиламино)-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,2-[бензил(метил)амино]-6-хлоро-8-нитро-4H-1,3-бензотиазин-4-она. Авторы изобретения применяли 4 различных способа синтеза вновь открытых и новых производных 1,3-бензотиазин-4-она. Способы А, В и С предполагают применение в качестве исходного вещества хорошо известных полизамещенных 2-хлор(бром)бензкарбоксамидов, многие из которых описаны в литературе или их можно легко получить при помощи аналогичных способов (Isaew S.G., Farm. Zh. (Kiev),2000, 52; Makosza M., Nizamov S. Org. Prep. and Proced. Int., 1997, 29, 707; Nerin C., Tomes A.R., Domento Способ А. Исходные 2-хлорбензкарбоксамиды обрабатывали 1,0-1,2 эквимолярным количеством солей металлов дитиокарбаматов в спиртах, ацетоне или в их смеси при 0-50 С в течение периода времени от около 15 мин до около 24 ч. Предпочтительно данную реакцию проводят в спирте при комнатной температуре. Данную реакционную смесь разбавляли водой и отфильтровывали твердый 2-дитиокарбамоилбензкарбоксамид. На следующей стадии можно применять неочищенный продукт или можно перекристаллизовывать его из подходящего органического растворителя. 2-Дитиокарбамоилбензкарбоксамид обрабатывали слабым основанием (например, Na2HPO4, NaHCO3, Na2CO3 и т.д.) в воде, спиртах или в смеси вода/спирт при температуре 50-100 С в течение 2-36 ч. Предпочтительно данную реакцию проводят в смеси вода/спирт при 50-75 С в течение около 24 ч. После завершения реакции 2-замещенный-4 Н 1,3-бензотиазин-4-он получают при помощи общепринятых процедур получения, например тритурации с этилацетатом или разбавления водой, фильтрации и перекристаллизации из подходящего органического растворителя. Способ В. Данный способ предполагает применять избыток дитиокарбамата металла в качестве слабого основания в бензотиазиноновой циклизации и не выделять 2-дитиокарбамоилбензкарбоксамид. Таким образом, исходные 2-хлорбензкарбоксамиды можно обрабатывать 1,2-2,5 эквимолярным количеством солей металлов дитиокарбаматов в спиртах, ацетоне или в их смеси при 20-80 С в течение периода около 3-36 ч. Предпочтительно данную реакцию проводят в спирте или в смеси вода/спирт при 50-75 С в течение около 24 ч. Целевой 2-замещенный-4 Н-1,3-бензотиазин-4-он получают при помощи общепринятых процедур получения из способа А. Способ С. Данный способ применяет в качестве исходного вещества 2-хлорбензолкарбоксамиды. Данные соединения обрабатывали 1,1-2,0-кратным избытком солей металлов алкилксантогената, например коммерчески доступным этилксантогенатом калия, при температуре 20-100 С в различных спиртах, ацетоне,ацетонитриле или других подходящих органических растворителях, в течение периода времени от около 0,5 до около 24 ч. Предпочтительно данную реакцию проводят в спирте при комнатной температуре в течение около 24 ч. Выделенный 2-алкокси-4H-1,3-бензотиазин-4-он обрабатывали соответствующим амином HNR5R6 в уксусной кислоте, спиртах, этилацетате, ДМФА, ацетоне или ацетонитриле в течение периода времени вплоть до 48 ч для полной замены алкоксильной группы на соответствующий амин. После завершения этого процесса полученную реакционную смесь можно выпаривать и разбавлять водой или ее можно сразу разбавлять водой. Целевой 2-NR5R6-4H-1,3-бензотиазин-4-он получали посредством стандартных процедур выделения, например фильтрации и перекристаллизации из подходящего органического растворителя. Способ D. Также применим классический способ синтеза 1,3-бензотиазин-4-она посредством применения реакции тиоционатных солей с 2-хлорарилхлорангидридом и последующей обработки реакционной массы соответствующим амином. Данный способ хорошо описан в научной литературе, например: J. Imrich,P. Kristian, Coll. Czech. Chem. Commun., 1982, 47, 3268-3282; D. Koscik, P. Kristian, J. Gonda, E.Chem. Commun., 1983, 48, 3427-3432; T.H. Cronin, H.-J.E. Hess, патент US 3522247. Как ни удивительно, соединения данного изобретения проявляют сильную антибактериальную активность, особенно по отношению к микобактериям с минимальными подавляющими концентрациями(МПК) в диапазоне 0,000012-0,78 мкг/мл для быстрорастущих микобактерий, 0,39-3,12 мкг/мл для М.tuberculosis, в том числе мультирезистентных штаммов, определенными посредством классического способа, и 2,0-50,0 нг/мл для М.tuberculosis H37Rv, определенными посредством способа с применением красителя Alamar Blue. Как ни удивительно, соединения данного изобретения демонстрируют высокий уровень селективности по отношению к микобактериям, что лишь драматически уменьшает возможность неблагоприятных побочных эффектов. Соединения данного изобретения являются немутагенными при 5 мг/мл в SOS-хромотестеM. Bombardier, N. Bermingham, R. Legault, A. Fouquet, Chemosphere, 2001, 42, 931-44; D.A. Widdick,D.I. Edwards, Mutat. Res., 1991, 259, 89-93). Таким образом, соединения данного изобретения применяются для лечения туберкулезных инфекций и других микобактериальных инфекций у людей и у животных. Соответственно, данное изобретение касается фармацевтических композиций, содержащих соединение формулы (I). Кроме того, данное изобретение относится к соединению формулы (I) для применения в способе лечения бактериальной инфекции у млекопитающих. Предпочтительными соединениями формулы (I) для применения в подобном способе являются соединения, специально перечисленные выше. Соединения данного изобретения формулируют для применения посредством получения разбавленного раствора или суспензии в фармацевтически приемлемой водной, органической или водноорганической среде для местного или парентерального введения посредством внутривенной, подкожной или внутримышечной инъекции,или для интраназального применения либо получают в форме таблетки,капсулы или водной суспензии с общепринятыми вспомогательными веществами для перорального введения или в виде суппозитория. Данные соединения можно применять в дозах от 0,001-1000 мг/кг массы тела. Примеры, которые следуют ниже в последующей экспериментальной части, служат для иллюстрации данного изобретения, но не должны быть истолкованы в качестве его ограничения. Структуры соединений данного изобретения были установлены способами синтеза и элементным анализом и при помощи спектров ядерного магнитного резонанса и масс-спектров. Варианты осуществления Исходные вещества. Химические вещества и растворители были приобретены в компании Alfa-Aesar (GB) или AldrichCo. (Sigma-Aldrich, St-Louis, US) и применялись в синтезе без дополнительной очистки. Температуры плавления определяли в соответствии с процедурой Британского фармацевтического кодекса (ВР) и не корректировались (Electrothermal 9001, GB). Если анализы выражаются только символами элементов, то результаты анализа попадают в пределы 0,3% теоретических значений (Carlo-Erba 5500, Italy). ЯМР спектры регистрировали при помощи установки Varian Unity Plus 400 (США). Сдвиги в 1 Н ЯМР представляют в ppm в сторону слабого поля относительно тетраметилсилана (ТМС) . Масс-спектры получали при помощи установки Finnigan SSQ-700 (США) с прямой инжекцией. Реакции и чистоту соединений контролировали посредством ТСХ, применяя алюминиевые пластины с силикагелем 60 F254 (MerckCo, Germany). Пример 1. 2-[4-(4-Хлорфенил)пиперазин-1-ил]-6,8-динитро-4H-1,3-бензотиазин-4-он (соединение 1). 0,5 г 2-хлор-3,5-динитробензкарбоксамида растворяли в 25 мл этанола. Полученную реакционную смесь обрабатывали 0,39 г дигидратом натриевой соли 4-(4-хлорфенил)пиперазиндитиокарбамата и оставляли на 6 ч при комнатной температуре. Полученную реакционную смесь приливали к 50 мл охлажденной воды и получившийся желтый осадок отфильтровывали. Чистый конечный продукт получали после перекристаллизации из этанола. 2-Аминокарбонил-4,6-динитрофенил-4-(4-хлорфенил)пиперазин 1-карбодитиоат представляет собой светло-желтое кристаллическое твердое вещество. Выход 68%. Температура плавления 178-180 С. МС m/z 481 (М+). Аналитически рассчитано для C18H16ClN5O5S2: С, 44,86; Н, 3,35; N, 14,53; S, 13,31. Получено: С, 44,71; Н, 3,36; N, 14,62; S, 13,35. 0,5 г 2-аминокарбонил-4,6-динитрофенил-4-(4-хлорфенил)пиперазин-1-карбодитиоата растворяли в 25 мл этанола. Полученную реакционную смесь обрабатывали 0,2 г Na2HPO412 Н 2 О и кипятили с обратным холодильником в течение 6 ч. Реакционную смесь охлаждали в холодильнике и получившийся светло-желтый осадок отфильтровывали и промывали 50 мл воды и 30 мл метанола. Чистый конечный продукт получали после перекристаллизации дважды из этанола. 2-(1,4-2-[4-(4-Хлорфенил)пиперазин-1-ил]6,8-динитро- 4H-1,3-бензотиазин-4-он представляет собой светло-желтое кристаллическое твердое вещество. Выход 38%. Температура плавления 279-281 С (EtOH). МС m/z 447 (М+). 1H ЯМР (ДМСО-d6/CDCl3)9,08 и 8,95 (два 1 Н, два с, 2 СН), 6,88 и 6,71 (два 2 Н, д, C6H4Cl), 3,68 и 3,30 (два 4 Н, м, N(CH2CH2)2N) ч./млн. Аналитически рассчитано для C18H14ClN5O5S: С, 48,27; Н, 3,15; N, 15,04; S, 7,16. Получено: С, 48,34; Н, 3,22; N, 14,97; S, 7,23. Пример 2. 2-[4-(5-Хлор-2-метилфенил)пиперазин-1-ил]-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-он(соединение 2). Следуя процедуре примера 1, применяя 2-хлор-3-нитро-5-трифторметилбензкарбоксамид в качестве исходного вещества. Светло-желтое кристаллическое твердое вещество. Выход 44%. Температура плавления 158-161 С (ДМФА/вода). МС m/z 484 (М+). 1H ЯМР (ДМСО-d6/CDCl3)8,80 и 8,77 (два 1 Н, два с, 2 СН), 7,32 (1 Н, с, СН), 9,95 и 6,73 (два 1 Н, д,два СН), 3,65 и 3,29 (два 4 Н, м, N(CH2CH2)2N), 2,29 (3 Н, с, СН 3) ч./млн. Аналитически рассчитано для C20H16ClF3N4O3S: С, 49,54; Н, 3,33; N, 11,55; S, 6,61. Получено: С, 49,45; Н, 3,40; N, 11,47; S, 6,83. Пример 3. 8-Нитро-6-(трифторметил)-2-4-[3-(трифторметил)фенил]пиперазин-1-ил-4H-1,3-бензотиазин-4-он(соединение 3). Следуя процедуре примера 1, применяя 2-хлор-3-нитро-5-трифторметилбензкарбоксамид в качестве исходного вещества. Светло-желтое кристаллическое твердое вещество. Выход 33%. Температура плавления 201-203 С (EtOH). МС m/z 504 (М+). 1H ЯМР (ДМСО-d6/CDCl3)8,80 и 8,77 (два 1 Н, два с, 2 СН), 7,61 (1 Н, с, СН), 7,39 и 7,03 (два 1 Н, д,два СН), 3,66 и 3,31 (два 4 Н, м, N(CH2CH2)2N) ч./млн. Аналитически рассчитано для C20H14F6N4O3S: С, 47,62; Н, 2,80; N, 11,11; S, 6,36. Получено: С, 47,74; H, 2,91; N, 11,29; S, 6,53. Пример 4. 2-[Бензил(этил)амино]-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-он (соединение 4).-4 017806 Суспензию 1,2 г 2-хлор-3-амино-5-трифторметилбензкарбоксамида в 45 мл этанола обрабатывали 2,0 г дигидрата натриевой соли бензил(этил)дитиокарбамата и кипятили с обратным холодильником в течение 14 ч. Темно-красную реакционную смесь разбавляли 70 мл воды, охлаждали в холодильнике в течение 6 ч, получившийся светло-желтый осадок отфильтровывали и промывали 50 мл эфира. Чистый конечный продукт получали после колоночной хроматографии(гексан/ацетон 3:1). 2-[Бензил(этил)амино]-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-он представляет собой светложелтое кристаллическое твердое вещество. Выход 40%. Температура плавления 94-97 С. МС m/z 409 (M+). 1 Н ЯМР (ДМСО-d6/CDCl3)8,80 и 8,77 (два 1 Н, два с, 2 СН), 7,41-7,25 (5 Н, м, С 6 Н 5), 4,62 (2 Н, с,СН 2), 3,43 (2 Н, кв., СН 2), 1,01 (3 Н, т, СН 3) ч./млн. Аналитически рассчитано для C18H14F3N3O3S: С, 52,81; Н, 3,45; N, 10,26; S, 7,83. Получено: С, 52,73; Н, 3,38; N, 10,44; S, 7,89. Пример 5. 2-[Бензил(метил)амино]-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-он (соединение 5). Следуя процедуре примера 4. Светло-желтое кристаллическое твердое вещество. Выход 47%. Температура плавления 120-124 С (EtOH/вода). МС m/z 395 (М+). 1H ЯМР (ДМСО-d6/CDCl3)8,81 и 8,77 (два 1 Н, два с, 2 СН), 7,40-7,25 (5 Н, м, С 6 Н 5), 4,64 (2 Н, с,СН 2), 2,87 (3 Н, с, СН 3) ч./млн. Аналитически рассчитано для C17H12F3N3O3S: С, 51,64; Н, 3,06; N, 10,63; S, 8,11. Получено: С, 51,76; H, 3,13; N, 10,41; S, 8,34. Пример 6. 2-[4-(2-Фторфенил)пиперазин-1-ил]-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-он (соединение 6). Следуя процедуре примера 1. Светло-желтое кристаллическое твердое вещество. Выход 37%. Температура плавления 164-168 С (i-PrOH). МС m/z 454 (М+). 1H ЯМР (ДМСО-d6/CDCl3)8,81 и 8,77 (два 1 Н, два с, 2 СН), 6,76 (3 Н, м, 3 СН), 6,11 (1 Н, м, СН),3,68 и 3,30 (два 4 Н, м, N(CH2CH2)2N) ч./млн. Аналитически рассчитано для C19H14F4N4O3S: С, 50,22; Н, 3,11; N, 12,33; S, 7,06. Получено: С, 50,08; Н, 3,21; N, 12,46; S, 7,09. Пример 7. 2-(4-Бензилпиперазин-1-ил)-8-нитро-6-трифторметил)-4H-1,3-бензотиазин-4-он (соединение 7). Следуя процедуре примера 4. Светло-желтое кристаллическое твердое вещество. Выход 51%. Температура плавления 161-163 С (EtOH/ДМФА). МС m/z 450 (М+). 1 Н ЯМР (ДМСО-d6/CDCl3)8,80 и 8,76 (два 1 Н, два с, 2 СН), 7,19-7,28 (5 Н, м, Ph), 3,48 (2 Н, с, СН 2),3,38 и 3,09 (два 4 Н, м, N(CH2CH2)2N) ч./млн. Аналитически рассчитано для C17H18N4O7S: С, 53,33; Н, 3,80; N, 12,44; S, 7,12. Получено: С, 53,29; Н, 4,01; N, 12,48; S, 7,06. Пример 8. 2-(Бензиламино)-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-он (соединение 8). Суспензию 2,5 г 2-хлор-3-нитро-5-трифторметилбензкарбоксамида в 25 мл этанола обрабатывали 1,75 г этилксантогената натрия и оставляли на 24 ч при комнатной температуре. Полученную реакционную смесь приливали к 50 мл охлажденной воды и получившийся желтый осадок отфильтровывали. Чистый 2-этокси-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-он получали после перекристаллизации из смеси этанол/вода в виде белого кристаллического твердого вещества. Выход 58%. Температура плавления 146-148 С. МС m/z 320 (М+). Аналитически рассчитано для C11H7F3N2O4S: С, 41,26; Н, 2,20; N, 8,75; S, 10,01. Получено: С, 41,34; Н, 2,22; N, 8,87; S, 10,27. Раствор 0,7 г 2-этокси-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она в 15 мл уксусной кислоты обрабатывали 0,4 мл бензиламина и кипятили с обратным холодильником в течение 14 ч. Полученную реакционную смесь выпаривали и остаток обрабатывали 10 мл воды, желтый осадок отфильтровывали и промывали 50 мл воды. Чистый конечный продукт получали после перекристаллизации дважды из смеси этанол/ДМФА. 2-(Бензиламино)-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-он представляет собой светло-желтое кристаллическое твердое вещество. Выход 73%. Температура плавления 192-194 С. МС m/z 381 (М+). 1-5 017806 Аналитически рассчитано для C16H10F3N3O3S: С, 50,39; Н, 2,64; N, 11,02; S, 8,41. Получено: С, 50,42; Н, 2,61; N, 10,89; S, 8,64. Пример 9. 2-(Метил[(1R)-1-фенилэтил]амино-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-он (соединение 9). Следуя процедуре примера 1. Светло-желтое кристаллическое твердое вещество. Выход 54%. Температура плавления 110-113 С (очистка посредством колоночной хроматографии ацетон/гексан 5:1). МС m/z 409 (М+). 1H ЯМР (ДМСО-d6/CDCl3)8,82 и 8,76 (два 1 Н, два с, 2 СН), 7,84, 7,43, 7,15 (5 Н, 3 м, Ph), 4,84 (Н, м,СН), 3,07 (3 Н, с, NCH3), 1,39 (3 Н, д, СН 3) ч./млн. Аналитически рассчитано для C18H14F3N3O3S: С, 52,81; Н, 3,45; N, 10,26; S, 7,83. Получено: С, 52,73; Н, 3,46; N, 10,19; S, 7,92. Пример 10. 2-[Бензил(метил)амино]-6-хлор-8-нитро-4H-1,3-бензотиазин-4-он (соединение 10). Следуя процедуре примера 8. Светло-желтое кристаллическое твердое вещество. Выход 64%. Температура плавления 138-141 С (очистка посредством колоночной хроматографии ацетон/гексан 4:1). МС m/z 361 (М+). 1H ЯМР (ДМСО-d6/CDCl3)8,37 и 8,23 (два 1 Н, два с, 2 СН), 7,45-7,35 (5 Н, м, Ph), 4,62 (2 Н, 2, СН 2),2,87 (3 Н, с, СН 3) ч./млн. Аналитически рассчитано для C16H12ClN3O3S: С, 53,11; Н, 3,34; N, 11,61; S, 8,86. Получено: С, 53,19; Н, 3,30; N, 11,52; S, 8,89. Пример 11. Определение in vitro ингибирующей активности соединений данного изобретения по отношению к микобактериям. Антибактериальные активности данных соединений по отношению к Mycobacterium smegmatis SG 987, М.aurum SB66, М.vaccae IMET 10670 и М.fortuitum В исследовали посредством определения минимальных подавляющих концентраций (МПК) при помощи способа бульонного микроразбавления в среде Мюллера-Хинтона (Difco) в соответствии с рекомендациями НККЛС (Национальный комитет по клиническим лабораторным стандартам) [National Committee for Clinical Laboratory Standards: Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically; 5th Ed.; Villanova, Ed.; Approved standard Document M7-A5. NCCLS, (2000)]. Полученные результаты представлены в табл. 1. Таблица 1 Антимикробная активность соединений формулы (I), определенная по минимальным подавляющим концентрациям МПК [мкг/мл] Пример 12. Активность по отношению к М.tuberculosis H37Rv исследовали посредством нижеописанного способа для определения минимальных подавляющих концентраций (МПК) и минимальных бактерицидных концентраций (МБК). Штаммы инокулировали на твердой среде Левенштейна-Йенсена. Через 21 день выросшие культуры применяли для получения суспензии инокулята, соответствующей 5108 микробных клеток/мл. В 0,2 мл пробирках полученную суспензию инокулировали в 2 мл жидкой среды Школьниковой, содержащей соответствующие концентрации исследуемых соединений - от 100,0 до 0,195 мкг/мл. После 14 дней инкубации при 37 С эти пробирки с жидкой средой центрифугировали в течение 15 мин при 3000 об/мин. После удаления супернатанта полученный осадок ресуспендировали в 0,8 мл стерильного раствора 0,9% NaCl. 0,1 мл суспензии применяли для приготовления мазков, которые впоследствии были-6 017806 окрашены по способу Циль-Нильсена. Оставшийся осадок инокулировали в 0,2 мл объемах в трех пробирках в твердой среде Левенштейна-Йенсена, не содержащей лекарственного средства, для того чтобы определить минимальные бактерицидные концентрации (МБК). Полученные результаты были зарегистрированы после 21-28 дней культивации при 37 С. Контрольными были пробирки, культивированные с исследуемыми штаммами, необработанными изучаемыми веществами. Считали, что минимальной бактерицидной концентрацией лекарственных средств (МБК) является концентрация лекарственного средства, полностью ингибирующая рост микобактерий на твердой среде. Бактериостатический эффект (МПК) характеризовался наличием в мазке лишь единичных микобактерий и сильным уменьшением числа колоний, выросших на твердой среде, по сравнению с контрольными мазками. Полученные результаты представлены в табл. 2. Таблица 2 Антимикробная активность соединений формулы (I) по отношению к Mycobacterium tuberculosisH37Rv и клиническим изолятам HSRE резистентного штамма и ХТВ штамма, определенная по минимальным подавляющим концентрациям (МПК) и минимальным бактерицидным концентрациям (МБК) Пример 13. Активность по отношению к М.tuberculosis H37Rv определяли также посредством анализа, основанного на восстановлении резазурина, (МПК 96). Данный способ был подробно описан в Р. Quillardet,О. Huisman, R. D'Ari, M. Hofnung, Proc. Natl. Acad. Sci. USA, 1982, 79, 5971-5; J.C. Palomino, A. Martin,M. Camacho, H. Guerra, J. Swings, F. Portaels, Antimicrob. Agents Chemother., 2002, 46, 2720-2. Полученные результаты представлены в табл. 3. Таблица 3 Антимикобактериальная активность соединений формулы (I), определенная по минимальным подавляющим концентрациям (МПК) [нг/мл] или его соль,в которой R1 и R2 независимо друг от друга представляют собой NO2 или трифторметил;R5 представляет собой Н, насыщенный линейный алифатический радикал, содержащий от 1 до 3 звеньев в цепи; в котором X представляет собой насыщенный линейный алифатический радикал, содержащий от 1 до 2 звеньев в цепи; илиR5 и R6 вместе представляют собой бивалентные радикалы, в которых n составляет 1-4:R14 и R15 независимо друг от друга представляют собой Н, линейный или разветвленный алифатический радикал, содержащий 1-5 звеньев в цепи, F, Cl, CF3. 2. Соединение формулы (I) по п.1, выбранное из группы, состоящей из 2-метил[(1R)-1-фенилэтил]амино-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,2-[4-(4-хлорфенил)пиперазин-1-ил]-6,8-динитро-4H-1,3-бензотиазин-4-она,2-[4-(5-хлор-2-метилфенил)пиперазин-1-ил]-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,8-нитро-6-(трифторметил)-2-4-[3-(трифторметил)фенил]пиперазин-1-ил-4H-1,3-бензотиазин-4 она,2-[бензил(этил)амино]-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,2-[бензил(метил)амино]-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,2-[4-(2-фторфенил)пиперазин-1-ил]-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,2-(4-бензилпиперазин-1-ил)-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,2-(бензиламино)-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,2-[бензил(метил)амино]-6-хлоро-8-нитро-4H-1,3-бензотиазин-4-она,или его соль. 3. Применение соединения формулы (I) или его соли по п.1 или 2 для получения фармацевтической композиции для лечения туберкулезной или гансениозной инфекции. 4. Применение соединения формулы (I) или его соли по п.1 или 2 для получения лекарственного средства для терапевтического или профилактического лечения микробной инфекции у млекопитающих. 5. Применение по п.4, где микробной инфекцией млекопитающих является туберкулезная или гансениозная инфекция. 6. Фармацевтическая композиция для лечения туберкулезной или гансениозной инфекции, содержащая соединение по п.1 или 2. 7. Применение соединения по п.1 или 2 или его соли в способе терапевтического или профилактического лечения микробной инфекции у млекопитающих. 8. Применение соединения по п.1 или 2 или его соли в способе терапевтического или профилактического лечения туберкулезной или гансениозной инфекции у млекопитающих. 9. Способ получения 2-NR5R6-4H-1,3-бензотиазин-4-онов в соответствии с формулой (I) по п.1,включающий реакцию 2-хлорбензкарбоксамидов с 1,1-2,0-кратным избытком солей металлов алкилксантогенатов при температуре 20-100 С в растворителе и последующую обработку полученного 2-алкокси 4H-1,3-бензотиазин-4-она амином HNR5R6 в растворителе при температуре 20-100 С. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2
МПК / Метки
МПК: C07D 279/08, A61P 31/08, A61K 31/5415, A61P 31/06
Метки: синтез, антимикробные, применение, соединения, млекопитающих, лечения, инфекций
Код ссылки
<a href="https://eas.patents.su/9-17806-antimikrobnye-soedineniya-ih-sintez-i-primenenie-dlya-lecheniya-infekcijj-u-mlekopitayushhih.html" rel="bookmark" title="База патентов Евразийского Союза">Антимикробные соединения, их синтез и применение для лечения инфекций у млекопитающих</a>
Предыдущий патент: 2-алкиламино-3-арилсульфонилциклоалкано[e или d]пиразоло[1,5-a]пиримидины-антагонисты серотониновых 5-нт6 рецепторов, способы их получения и применения
Следующий патент: Производное оксопиразина и гербицид
Случайный патент: Фармацевтические композиции, содержащие производные азетидина, новые производные азетидина и их получение