Способ получения высокочистого полиморфа (i) донепезила гидрохлорида
Номер патента: 12911
Опубликовано: 26.02.2010
Авторы: Греинер Иштван, Гараднаи Шандор, Чабаи Янош, Неу Йожеф
Формула / Реферат
1. Способ получения высокочистого Полиморфа (I) донепезила гидрохлорида, соединения, имеющего формулу I
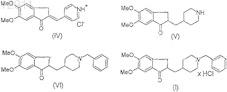
путем гидрогенизации соли 5,6-диметокси-2-(пиридин-4-ил-метилен)индан-1-она, промежуточного соединения, имеющего формулу IV,
и последующего бензилирования полученного 4-[(5,6-диметокси-1-инданон)-2-ил]метилпиперидина, промежуточного соединения, имеющего формулу V,
и последующих стадий образования соли путем введения в реакцию основания донепезила, соединения, имеющего формулу VI, и последующей перекристаллизации полученного донепезила гидрохлорида, соединения, имеющего формулу I, из раствора, содержащего спирт с короткой углеродной цепью,
включающий:
a) проведение указанной гидрогенизации гидрохлорида 5,6-диметокси-2-(пиридин-4-ил-метилен)индан-1-она, соединения, имеющего формулу IV, в присутствии катализатора в виде Pd на древесном угле, и
b) проведение указанных стадий образования соли путем введения в реакцию основания донепезила, соединения, имеющего формулу VI, с уксусной кислотой, затем экстрагирования соли уксусной кислоты в водную фазу, затем снова превращения ее в основание донепезила в присутствии основания, затем превращения последнего в донепезила гидрохлорид, соединение, имеющее формулу I, в присутствии хлористого водорода, и
c) проведение указанной перекристаллизации осаждением продукта, Полиморфа (I) донепезила гидрохлорида, из водного спиртового раствора, содержащего 2-18% воды.
2. Способ по п.1, в котором указанная гидрогенизация включает применение древесного угля, содержащего 5-15% палладия, в качестве катализатора.
3. Способ по п.2, в котором указанная гидрогенизация дополнительно включает применение избыточного давления 4-6 атм и температуры, равной 60-80°С.
4. Способ по п.1, в котором указанные стадии образования соли включают введение в реакцию основания донепезила с уксусной кислотой в растворе этилацетата и перевод донепезила ацетата в водную фазу.
5. Способ по п.1, в котором указанная перекристаллизация включает растворение донепезила гидрохлорида в водном метаноле, содержащем 3-5% (об./об.) воды.
6. Способ по п.1, в котором указанная перекристаллизация включает добавление раствора донепезила гидрохлорида в водном метаноле к метил-трет-бутиловому эфиру, осадителю, содержащему кристаллы-затравки Полиморфа (I).
Текст
012911 Область техники, к которой относится изобретение Это изобретение имеет отношение к новому способу получения высокочистого донепезила гидрохлорида, т.е. гидрохлорида 1-бензил-4-[(5,6-диметокси-1-инданон)-2-ил]метилпиперидина, соединения,имеющего формулу I, в морфологической кристаллической форме Полиморф (I). Уровень техники Донепезила гидрохлорид, соединение, имеющее формулу I,известно своей исключительной антиацетилхолинэстеразной активностью и представляет собой эффективный активный ингредиент в фармацевтических лекарственных средствах для лечения и предупреждения таких заболеваний, как болезнь Альцгеймера и старческое слабоумие. Известно несколько способов получения донепезила гидрохлорида. Большинство из них включают каталитическую гидрогенизацию этиленовой двойной связи ("илидная" связь) в боковой цепи или/и пиридинового кольца. В одной группе этих способов применяли гидрогенизирование после бензилирования. Согласно примеру 4, приведенному в патенте EP296560, донепезила гидрохлорид получали путем восстановления гидрохлорида 1-бензил-4-[(5,6-диметокси-1-инданон)-2-илиденил]метилпиперидина,как показано на следующей схеме. Согласно примеру 3 этого патента 5,6-диметокси-1-инданон реагировал с полученным сложным и дорогостоящим способом N-бензилпиперидин-4-карбальдегидом с образованием гидрохлорида 1-бензил-4-[(5,6-диметокси-1-инданон)-2-илиденил]метилпиперидина в громоздкой, с точки зрения производства, реакции при -70 С в присутствии бутиллития. Согласно другому способу, раскрытому в этом патенте, 5,6-диметокси-1-инданон реагировал с Nбензоилшшеридин-4-карбальдегидом и после насыщения образовавшегося "илидного" соединения бензоильную группу удаляли и конечный продукт получали с помощью N-бензилирования. Обычными недостатками этих технологий являются дорогостоящие исходные материалы, экстремальные условия проведения реакции (-70 С) и низкий выход. Обычно применяемая форма активного ингредиента, соль гидрохлорид донепезила, была также раскрыта в патенте EP296560. Реакционную смесь очищали с помощью колоночной хроматографии, затем основание растворяли в дихлорметане, затем его обрабатывали солянокислым этилацетатом с последующим выпариванием досуха при пониженном давлении. Кристаллический материал перекристаллизовывали из диизопропилового эфира. В публикациях РСТWO 97146526 и WO 97146527 кристаллическая форма донепезила гидрохлорида, полученная согласно предыдущему патенту EP296560, была названа Полиморф (I) и охарактеризована следующими IR-полосами, полученными в KBr таблетках: 463, 502, 563, 589, 604, 701, 750, 759,799, 860, 922, 947, 972, 1012, 1012, 1038, 1104, 1120, 1128, 1175, 1192, 1218, 1250, 1267, 1316, 1368, 1410,1433, 1440, 1455, 1472, 1502, 1591, 1606, 1644, 1684, 2412, 2530, 2559, 2595, 2620, 2717, 2840, 2858, 2924,3004, 3074, 3259, 3373, 3547, 3589 см-1. Следующий сложный 9-стадийный синтез был описан в публикации РСТWO 97/22584, при проведении этого синтеза также столкнулись с дополнительными трудностями В части методов синтеза промежуточный продукт, включающий насыщенную боковую цепь и пиперидиновое кольцо, превращали в конечный продукт. В публикации РСТWO 00/09483 был также описан сложный 7-стадийный синтез, в котором после бензилирования путем циклизации насыщенного интермедиата было получено индольное кольцо. Согласно документу EP Application1386607 основание донепезила получали с помощью дезэтоксикарбоксилирования 1-бензил-4-[(5,6-диметокси-2-этоксикарбонилиндан-1-он)-2-илметил]пиперидина В похожей методике, описанной в публикации РСТWO 05/03092, лишнюю группу (Y) удаляли также на последней стадии: Методики, приведенные выше, не могут быть рассмотрены в качестве промышленных способов изза их низкого выхода. Типичные недостатки следующих методик - это применение высокосортного дорогостоящего катализатора Адамса (PtO2). В EP Application1047674 сначала из 5,6-диметокси-1-инданона получали 5,6-диметокси-2 этоксикарбонил-2-[(4-пиридил)метил]-1-инданон, затем проводили дезэтоксикарбонилирование и затем его превращали в четвертичную соль бензилгалогенида. Конечный продукт получали путем гидрогенизации из четвертичной соли Согласно способу, описанному в документе EP Application711756, 4-[(5,6-диметокси-1 инданон)-2-илиденил]метилпиридин получали в реакции конденсации из 5,6-диметокси-1-инданон-4 альдегида, который был переведен в четвертичную форму с помощью бензилгалогенида. Эта четвертичная соль была подвергнута каталитической гидрогенизации Главным недостатком приведенных выше методик было широкомасштабное применение дорогостоящего катализатора. Опыт наших исследований подтверждает, что в этих условиях появлялись значительные количества нежелательных дебензилированных и сверхгидрогенизированных производных (например, циклогексил один). В этих методиках не сообщалось о чистоте продуктов и не были приведены способы получения гидрохлоридной соли. 4-[(5,6-Диметокси-1-инданон)-2-илиденил]метилпиридин применяли также в патенте US6649765. В этом документе исходное соединение восстанавливали в присутствии 10%-ного(моль/моль) катализатора Адамса, затем образующееся производное пиридина бензилировали. Похожая методика была раскрыта в документе РСТWO 04/082685 А 1. В этой методике илидную связь гидрогенизировали с помощью палладиевого катализатора и затем для гидрогенизации пиридинового кольца применяли катализатор Адамса Методика насыщения илидной двойной связи в присутствии палладиевого катализатора была опубликована в работах BioorganicMedicinal Chemistry Letters 2 (2002), 2565-2568 и Journal of Pharmaceutical and Biomedicinal Analysis 35 (2004), 1047-1058. В последней статье было описано, что в щелочной среде 4-[(5,6-диметокси-1-инданон)-2-илиденил]метилпиридин восстанавливается с образованием четырех различных продуктов, из которых могут быть выделены примеси донепезила. В этих двух заявках восстанавливали 4-[(5,6-диметокси-1-инданон)-2-илиденил]метилпиридин в виде основания. В документе РСТWO 04/082685 было указано, но не детализировано, что возможно восстановление не только подходящего основания, но также и его соли. Однако в этой заявке не сообщалось об очевидных различиях в чистоте в отношении выделенных продуктов. В воспроизводимых экспериментах мы также подтвердили то, что было установлено в этой статье вJournal of Pharmaceutical and Biomedicinal Analysis. В ходе восстановления основания, к сожалению, были насыщены не только илидная двойная связь и пиридиновое кольцо, но также, по меньшей мере, частично кетогруппа 5,6-диметокси-1-инданона. Согласно документу РСТWO 05/076749 донепезил получали согласно следующей схеме реакций: В способе, раскрытом в документе US Patent Application04/143121, 4-[(5,6-диметокси-1 инданон)-2-илиденил]метилпиридин гидрогенизировали с получением 4-[(5,6-диметокси-1-инданон)-2 ил]метилпиперидина, с последующим бензилированием, приводившем к образованию донепезила. Согласно нашему опыту таким путем, с помощью гидрогенизации основания, нельзя получить достаточно чистый донепезил в промышленных масштабах. В документе РСТWO 05/044805 донепезил получали согласно следующей схеме реакций: Известно, что на чистоту конечного продукта в основном влияет стадия гидрогенизации. Несмотря на то, что, в принципе, это описание устанавливает широкое разнообразие катализаторов, согласно примерам 2 и 6, касавшимся гидрогенизации, на практике оно ограничено только очевидным применением катализатора PtO2. Применение этого катализатора не только делает эту процедуру слишком дорогой, но также включает риск того, что гидрогенизирование не будет контролироваться в полной мере, и возникновения недостаточно гидрогенизированных и сверхгидрогенизированных продуктов нельзя избежать. К недостаткам также можно отнести применение солей п-толуолсульфокислоты, это становится очевидным при сравнении результатов, сведенных в таблицах в примерах 1 и 2 этого документа. Раскрытие изобретения Настоящее изобретение обеспечивает новый, реализуемый в промышленном масштабе и экономически предпочтительный способ получения высокочистого гидрохлорида 1-бензил-4-[(5,6-диметокси-1 инданон)-2-ил]метилпиперидина, т.е. донепезила гидрохлорида, приведенный на следующей схеме реакций, в морфологической кристаллической форме Полиморф (I). На одной из ключевых стадий способа, в ходе гидрогенизации насыщали гидрохлорид 5,6 диметокси-2-(пиридин-4-ил-метилен)индан-1-она, применяя Pd-углерод, и получали 4-[(5,6-диметокси-1 инданон)-2-ил]метилпиперидин с более чем 97%-ной чистотой, определенной с помощью ВЭЖХ. На стадии кристаллизации донепезила гидрохлорид кристаллизовали из водного спиртового растворителя и получали Полиморф (I) по меньшей мере с 99,95%-ной чистотой, определенной с помощью ВЭЖХ. Осуществление изобретения В ходе нашей экспериментальной работы мы неожиданно обнаружили, что, если восстанавливали существенно реакционно-активную соль гидрохлорида 4-[(5,6-диметокси-1-инданон)-2-илиденил]метилпиридина (V) в присутствии менее дорогостоящего и менее применяемого в промышленности и менее активного палладий-углеродного катализатора при низкой температуре, то затем желаемый неочищенный 4-[(5,6-диметокси-1-инданон)-2-ил]метилпиперидин (V) может быть получен в одну стадию, с соответствующей чистотой и с хорошим выходом. Поскольку бензиловую группу вводили на последней стадии, то можно было избежать образования сверхгидрогенизированных примесей метилциклогексила. В этом способе гидрогенизации была достигнута более чем 99,0%-ная чистота, определенная с помощью ВЭЖХ. Высокая чистота более ранних промежуточных продуктов обеспечивала высокую чистоту более поздних промежуточных продуктов, высокочистую соль донепезила гидрохлорида, из которой, наконец,получали в высшей степени чистый донепезила гидрохлорид в желаемой кристаллической форме Полиморф (I), конечный продукт которого был практически свободен от всевозможных остатков растворителя. В результате, может быть обеспечена высокая чистота продукта согласно приведенной выше схеме реакций, в которой 5,6-диметокси-1-инданон (II) и пиридин-4-альдегид (III) реагируют в реакции конденсации с получением основания 4-[(5,6-диметокси-1-инданон)-2-илиденил]метилпиридина, затем солянокислую соль последнего (IV) гидрогенизировали в уксусной кислоте при температуре 50-70 С и давлении 5 бар с получением 4-[(5,6-диметокси-1-инданон)-2-ил]метилпиперидина (V). Из этих промежуточных продуктов с помощью известного способа, бензилирования, с последующим образованием соли, включающим обмен фазами для дальнейшей очистки, получали донепезила гидрохлорид. Из этого-4 012911 материала после растворения в водном спирте и осаждения получали сверхчистый Полиморф (I) донепезила гидрохлорида, практически свободный от остатков растворителя. Мы установили, что такой высокочистый конечный продукт может быть получен только, если все следующие друг за другом стадии проведены соответствующим образом и, в особенности, две ключевые стадии, гидрогенизация и кристаллизация, неожиданно были применены более хорошие способы, чем те, что применялись раньше. Первое описание Полиморфа (I) гидрохлоридной соли донепезила может быть найдено в патентеEP296,560, согласно которому его можно получить путем очистки реакционной смеси с помощью колоночной хроматографии, растворением основания в дихлорметане и затем обработкой растворенного основания донепезила с помощью солянокислого этилацетата с последующим выпариванием при пониженном давлении. Кристаллическое вещество перекристаллизовывали, применяя метанол и изопропиловый эфир. Позднее, в документах РСТWO 97/46526 и WO 97/46527 (European Patent1019374 и 1,211,243) эту модификацию, охарактеризованную с помощью полос поглощения инфракрасного спектра этого вещества, полученных из таблетки с KBr, назвали Полиморф (I). Характеристики новых форм II,III, IV и V также были описаны в этих документах. Полиморф (III) был описан в патенте US6140321. Документ РСТWO 04/87660 обеспечивает способ получения аморфных модификаций. Согласно сведениям, приведенным в документе РСТWO 97/46527 (и документах EP1019374 и 1211243) донепезила гидрохлорид может быть получен в виде Полиморфа (I) в лабораторных условиях. В одном из предпочтительных способов ( 1-7), основание донепезила растворяли в низшем спирте, соль получали с помощью соляной кислоты или хлористого водорода, затем желаемый Полиморф (I) осаждали с помощью t-бутилметилового эфира (пример 29) или с помощью диизопропилового эфира(пример 30) или с помощью этилацетата (пример 31). Из не поддающейся обработке суспензии Полиморф (I) фильтруется плохо. В промышленном масштабе способ не может быть применен. В другом предпочтительном способе ( 1-9) Полиморф (I) донепезила гидрохлорида получали с помощью перекристаллизации. Донепезила гидрохлорид растворяли в низшем спирту (выгодно в метаноле), затем его растворимость снижали с помощью различных осаждающих агентов, таких как t-бутилметиловый эфир(пример 39), или этилацетат (пример 40), или н-гексан (пример 41), и кристаллическое вещество фильтровали и высушивали. Во всех этих описаниях осадитель добавляли к раствору донепезила или донепезила гидрохлорида. В этом описании не были приведены данные об остатках растворителя в донепезила гидрохлориде (I). Примечательно то, что в этих примерах, с одной стороны, применяемые растворители не подходят для крупномасштабного производства (точка воспламенения диэтилового эфира равна 40 С), и, с другой стороны, их применение разрешено только в крайне оправданных случаях (как в случае диизопропилового эфира) в фармацевтической промышленности. Из литературы (РСТWO 1997/46527) также известно, что метил-трет-бутиловый эфир также подходит для получения Полиморфа (I) донепезила гидрохлорида. В этом описании не сообщалось об обратном добавлении, и оно не было связано с остатком растворителя. Согласно нашим исследованиям, проведенным с привлечением огромного числа экспериментальных данных, мы заключили, что независимо от порядка добавок (диэтиловый эфир добавляли к раствору донепезила гидрохлорида в метаноле или наоборот) вместо желаемого Полиморфа (I) можно было получить кристаллы Полиморфа (III). Экономичные промышленные технологии не могут быть основаны на столь ненадежной методике. В известных методиках Полиморф (I), содержавший почти 1 моль связанной воды, закристаллизовывали из свободных от воды растворителей. В ходе экспериментов было установлено, что при 60-80 С донепезила гидрохлорид может потерять эту воду, но при комнатной температуре и относительной влажности, равной 40-60%, он быстро набирал воду обратно из воздуха. Мы заключили, что согласно известным методикам сначала получается нестабильная безводная переходная модификация Полиморфа (I), а в ходе обработки эта переходная форма превращается в стабильную содержащую воду кристаллическую модификацию Полиморфа (I). В широкомасштабном технологическом процессе нельзя допускать такое неконтролируемое получение, поскольку при получении фармацевтической продукции основным требованием является хорошая воспроизводимость. Неожиданно было обнаружено, что концентрация остатка растворителя продукта сильно зависит от порядка добавления компонентов. Так, если безводный раствор донепезила гидрохлорида в метаноле добавляли по каплям в раствор метил-трет-бутилового эфира, содержавшего кристаллы-затравки Полиморфа (I), то остаток метил-трет-бутилового эфира продукта был равен примерно 2500 м.д. Напротив,если метил-трет-бутиловый эфир добавляли по каплям к раствору донепезила гидрохлорида в безводном метаноле, содержавшем кристаллы-затравки, то остаток метил-трет-бутилового эфира был равен примерно 6500 м.д. Согласно нашим исследованиям содержание воды в применяемом спирте можно дополнительно увеличивать до определенного предела без проблем для формирования Полиморфа (IV), что можно было ожидать согласно документу ЕР 1211243. Полиморф (I) с требуемым содержанием воды, равным 1 моль,может быть выделен при условии, что количество воды в растворе было в 2-20 раз больше, чем теорети-5 012911 ческий 1 моль. Мы были удивлены, что данные по остатку растворителя сильно зависели от количества воды в используемом спирте. Мы утверждаем, что если донепезила гидрохлорид растворяли в метаноле,содержавшем 2-18%, благоприятно содержавшем 4% воды, то загрязняющий остаток растворителя будет на порядок ниже; только 200-300 м.д. Кристаллизация полиморфа (I) преимущественно гарантированно происходила с кристаллами-затравками Полиморф (I), суспендированными в растворе осаждающего средства, который плохо растворяет донепезила гидрохлорид. Наши дальнейшие исследования раскрыли, что образование Полиморфа (I) требует соответствующего контроля температуры. Независимо от порядка добавления компонентов при температуре выше 20 С кристаллизовался Полиморф (III), снижение температуры способствовало образованию Полиморфа(I). Однако при слишком низких температурах количество остатка растворителя увеличивалось. Примеры Пример 1. Воспроизводимый эксперимент для получения соли 2-(4-пиперидинилметил)-5,6 диметокси-1-инденон паратолуолсульфоновой кислоты согласно примеру 2 в документе РСТWO 2005/044805 A1. 4,02 г соли паратолуолсульфоновой кислоты 2-(4-пиридилметилен)-5,6-диметокси-1-инденона растворяли в 300 мл безводного метанола с последующим добавлением 330 мг PtO2 катализатора, смесь гидрогенизировали при перемешивании при комнатной температуре при атмосферном давлении в течение 10,5 ч. Осадок отфильтровывали, промывали в 50 мл безводного метанола. Жидкую фазу выпаривали досуха, остаток растворяли в 150 мл безводного изопропанола при нагревании, затем раствор охлаждали для кристаллизации и получали 2,02 г соединения, указанного в подзаголовке. Маточный раствор выпаривали до объема 15 мл и получали более чем 0,46 г вещества. После объединения двух порций получали 2,86 г соединения, указанного в подзаголовке. Результаты ВЭЖХ-анализа, касающиеся количества продукта, приведены в следующей таблице, в которой также показаны результаты экспериментов с более продолжительными временами реакции Пример 2. Воспроизводимый эксперимент для получения HCl соли 2-(4-пиперидинилметил)-5,6 диметокси-1-инденона согласно примеру 2, приведенному в документе РСТWO 2005/044805 Al. 3,17 г солянокислой соли 2-(4-пиридилметилен)-5,6-диметокси-1-инденона растворяли в 300 мл безводного метанола, затем добавляли 330 мг PtO2 катализатора, смесь гидрогенизировали при перемешивании при комнатной температуре, при атмосферном давлении в течение 10,5 ч. Осадок отфильтровывали, промывали 50 мл безводного метанола. Жидкую фазу выпаривали досуха, остаток растворяли в 150 мл безводного изопропанола при нагревании, затем раствор охлаждали до температуры 0 С для кристаллизации и получали 2,02 г соединения, указанного в подзаголовке. Маточный раствор выпаривали до объема, равного 15 мл, и получали более чем 1,11 г вещества. После объединения двух порций получали 3,13 г соединения, указанного в подзаголовке. В следующей таблице приведены результаты ВЭЖХ-анализа, касающиеся содержания продукта. Также показаны результаты экспериментов с более продолжительными временами реакции. Пример 3. 200 л уксусной кислоты, 2,2 кг древесного угля, содержавшего 10% палладия, суспендированного в 22 л уксусной кислоты, и 22,24 кг 4-[(5,6-диметокси-1-инданон)-2-илиденил]метилпиридина гидрохлорида (IV) отмеряли в сделанный из инертного материала автоклав для гидрогенизации объемом 500 л и смесь гидрогенизировали при 68-72 С под избыточным давлением, равном 5 атм, при интенсивном перемешивании до тех пор, пока не заканчивалось снижение давления. Автоклав охлаждали до 2025 С, катализатор отфильтровывали. Фильтрат концентрировали при пониженном давлении до объема,равного 66 л, затем к нему добавляли по каплям при перемешивании 72 л метилизобутилкетона. Кристаллическое вещество отфильтровывали и промывали метилизобутилкетоном. Влажное вещество растворяли в 210 л кипящего метанола и затем это охлаждали до 0-5 С. Кристаллическое вещество отфильтровывали, промывали и после высушивания получали 15,12 кг 4-[(5,6-диметокси-1-инданон)-2-ил] метилпиперидина (V).(V), 27,60 кг карбоната калия, 6,5 л воды и 2,2 кг древесного угля, содержавшего палладий и суспендированного в 22 л уксусной кислоты, отмеряли в автоклав объемом 1000 л, затем туда по каплям добавляли 12,5 л раствора бензилбромида в 40 л этилацетата. Реакционную смесь интенсивно перемешивали при 25-30 С в течение 4 ч. Удостоверившись в том, что реакция завершилась, осадок отфильтровывали. 300 л воды и 12 л уксусной кислоты добавляли к фильтрату и после перемешивания фазы разделяли. Органический слой промывали 50 л воды, фазы снова разделяли. Продукт находился в объединенной водной фазе, к которой добавляли 200 л этилацетата, и к этому по каплям добавляли 100 л водного раствора 10,0 кг NaOH. После перемешивания фазы разделяли, водную фазу промывали новой порцией 100 л этилацетата и органическую фазу промывали водой. Отделенную органическую фазу высушивали над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали до 50 л при пониженном давлении,добавляли 50 л метанола, гомогенизировали и выпаривали, затем добавляли новую порцию 50 л метанола и выпаривали снова. При перемешивании остаток растворяли в 140 л метанола и охлаждали до 5-10 С. В это добавляли по каплям 38 л солянокислого метанола (смесь 10,46 кг конц. соляной кислоты и 23,75 кг метанола). Кристаллизацию завершали, добавляя по каплям 280 л метил-трет-бутилового эфира, содержавшего кристаллы-затравки Полиморфа (I). Продукт отфильтровывали, дважды промывали 35 л метил-третбутилового эфира, высушивали при 35-40 С на воздухе и получали 30,7 кг активного ингредиента донепезила гидрохлорида в виде Полиморфа (I). Данные по его анализу приведены в следующей таблице: Пример 5. 34,5 л метанола, 1,5 л деминерализованной воды, 9,00 кг донепезила гидрохлорида (в принципе подходит любая модификация Полиморфа) отмеряли в автоклав объемом 150 л, оборудованный мешалкой и дефлегматором. Когда температура суспензии поднималась до 50-55 С, то осадок растворялся снова. Раствор охлаждали до 25-30 С и фильтровали до состояния, свободного от волокон. 90 л метил-трет-бутилового эфира и 90 г Полиморфа (I) донепезила гидрохлорида отмеряли в 150 л автоклав,температуру суспензии снижали до 5-10 С и при постоянном интенсивном перемешивании постоянно в течение 30 мин добавляли раствор донепезила гидрохлорида. После нового 30-минутного перемешивания кристаллический осадок отфильтровывали и промывали 9 л метил-трет-бутилового эфира. Кристаллическое вещество высушивали при 35-40, получали 8,7 кг Полиморфа (I) донепезила гидрохлорида,содержавшего незначительный остаток растворителя. Типичная концентрация остатка метил-третбутилового эфира была равна 150-750 м.д., тогда как другие примесные компоненты остатка растворителя были ниже чувствительности метода. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения высокочистого Полиморфа (I) донепезила гидрохлорида, соединения, имеющего формулу I путем гидрогенизации соли 5,6-диметокси-2-(пиридин-4-ил-метилен)индан-1-она, промежуточного соединения, имеющего формулу IV,и последующего бензилирования полученного 4-[(5,6-диметокси-1-инданон)-2-ил]метилпиперидина, промежуточного соединения, имеющего формулу V,и последующих стадий образования соли путем введения в реакцию основания донепезила, соединения, имеющего формулу VI, и последующей перекристаллизации полученного донепезила гидрохлорида, соединения, имеющего формулу I, из раствора, содержащего спирт с короткой углеродной цепью,включающий:a) проведение указанной гидрогенизации гидрохлорида 5,6-диметокси-2-(пиридин-4-илметилен)индан-1-она, соединения, имеющего формулу IV, в присутствии катализатора в виде Pd на древесном угле, иb) проведение указанных стадий образования соли путем введения в реакцию основания донепезила, соединения, имеющего формулу VI, с уксусной кислотой, затем экстрагирования соли уксусной кислоты в водную фазу, затем снова превращения ее в основание донепезила в присутствии основания, затем превращения последнего в донепезила гидрохлорид, соединение, имеющее формулу I, в присутствии хлористого водорода, иc) проведение указанной перекристаллизации осаждением продукта, Полиморфа (I) донепезила гидрохлорида, из водного спиртового раствора, содержащего 2-18% воды. 2. Способ по п.1, в котором указанная гидрогенизация включает применение древесного угля, содержащего 5-15% палладия, в качестве катализатора. 3. Способ по п.2, в котором указанная гидрогенизация дополнительно включает применение избыточного давления 4-6 атм и температуры, равной 60-80 С. 4. Способ по п.1, в котором указанные стадии образования соли включают введение в реакцию основания донепезила с уксусной кислотой в растворе этилацетата и перевод донепезила ацетата в водную фазу. 5. Способ по п.1, в котором указанная перекристаллизация включает растворение донепезила гидрохлорида в водном метаноле, содержащем 3-5% (об./об.) воды. 6. Способ по п.1, в котором указанная перекристаллизация включает добавление раствора донепезила гидрохлорида в водном метаноле к метил-трет-бутиловому эфиру, осадителю, содержащему кристаллы-затравки Полиморфа (I).
МПК / Метки
МПК: C07D 211/02, C07D 211/32
Метки: донепезила, получения, гидрохлорида, полиморфа, высокочистого, способ
Код ссылки
<a href="https://eas.patents.su/9-12911-sposob-polucheniya-vysokochistogo-polimorfa-i-donepezila-gidrohlorida.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения высокочистого полиморфа (i) донепезила гидрохлорида</a>
Предыдущий патент: Способ получения анилинов
Следующий патент: Управление исполнением задач
Случайный патент: Электроизоляционная пленка