Фармацевтическая композиция, включающая производные таксанов, и способ ее получения
Номер патента: 12561
Опубликовано: 30.10.2009
Авторы: Кузнецов Олег Олегович, Чибиляев Тимур Хайдарович, Морозов Павел Игоревич, Забудкин Александр Фридрихович
Формула / Реферат
- формула изобретения, действующая на территории Договаривающихся государств, для которых ниже не указана особая редакция формулы1. Фармацевтическая композиция, включающая активное вещество, выбранное из группы таксанов, поверхностно-активное вещество и этиловый спирт, отличающаяся тем, что она содержит подкисляющий агент, обеспечивающий рН среды в пределах от 3,0 до 4,5.
2. Композиция по п.1, отличающаяся тем, что подкисляющим агентом является лимонная кислота.
3. Композиция по п.1, отличающаяся тем, что количество этилового спирта составляет от 5 до 55 об.%.
4. Композиция по любому из пп.1-3, отличающаяся тем, что активное вещество выбирают из группы, включающей доцетаксел и паклитаксел.
5. Композиция по любому из пп.1-3, отличающаяся тем, что этиловый спирт представляет собой безводный этиловый спирт.
6. Композиция по любому из пп.1-3, отличающаяся тем, что она находится в форме инфузионного раствора.
7. Композиция по любому из пп.1-3, отличающаяся тем, что в качестве поверхностно-активного вещества используется полиоксиэтилена сорбитанмоноолеат.
8. Способ получения фармацевтической композиции, включающий растворение субстанции активного вещества, выбранного из группы таксанов, в этиловом спирте и добавление к полученной смеси поверхностно-активного вещества, отличающийся тем, что после добавления поверхностно-активного вещества рН полученной смеси доводят до значения от 3,0 до 4,5 и полученную смесь фильтруют.
9. Способ по п.8, отличающийся тем, что этиловый спирт представляет собой безводный этиловый спирт.
10. Способ по п.8, отличающийся тем, что рН регулируют за счет добавления лимонной кислоты.
11. Способ по п.8, отличающийся тем, что рН регулируют за счет добавления 10%-ного раствора безводной лимонной кислоты в безводном этиловом спирте.
12. Способ по любому из пп.8-11, отличающийся тем, что активное вещество выбирают из группы, включающей доцетаксел и паклитаксел.
Текст
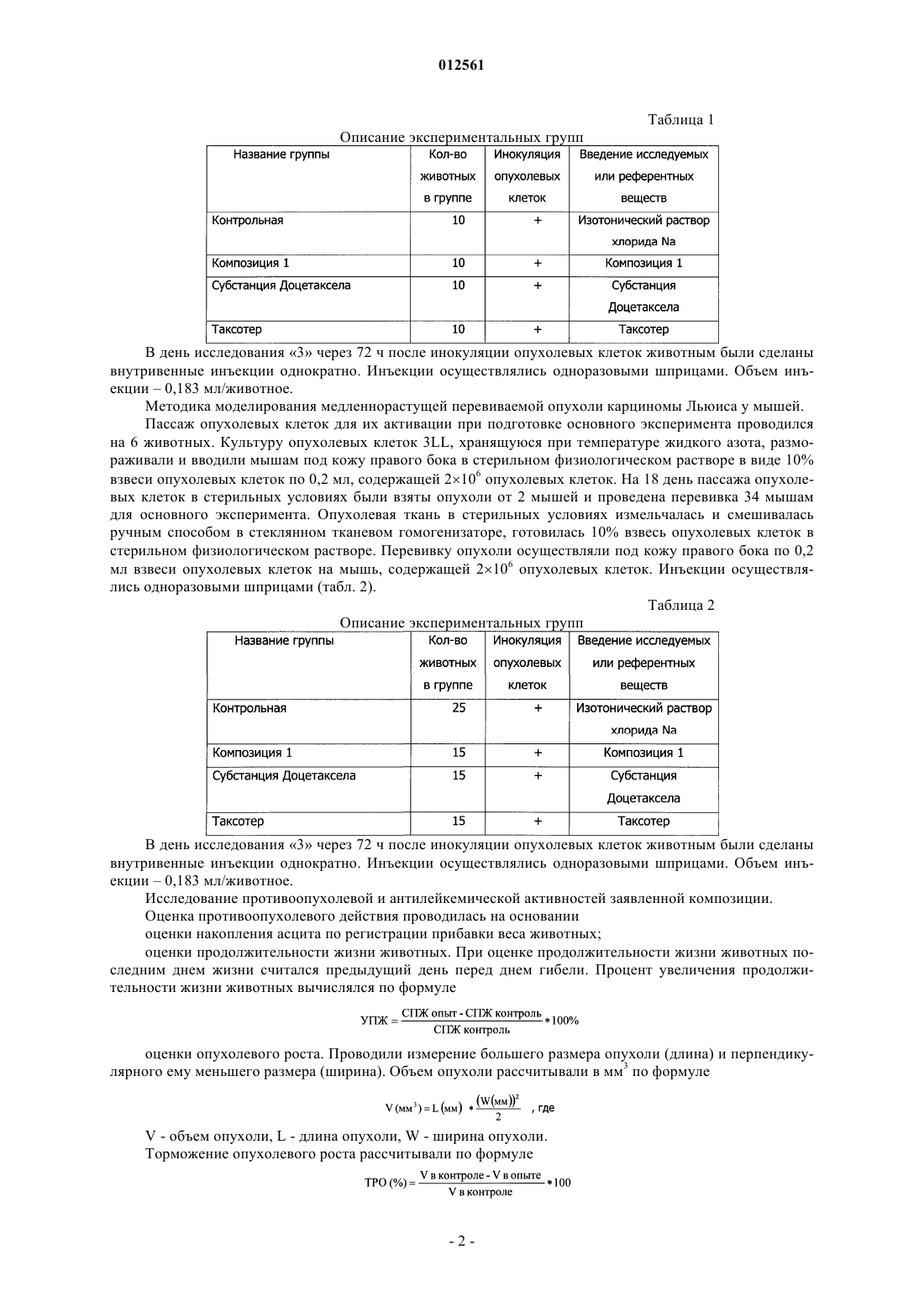
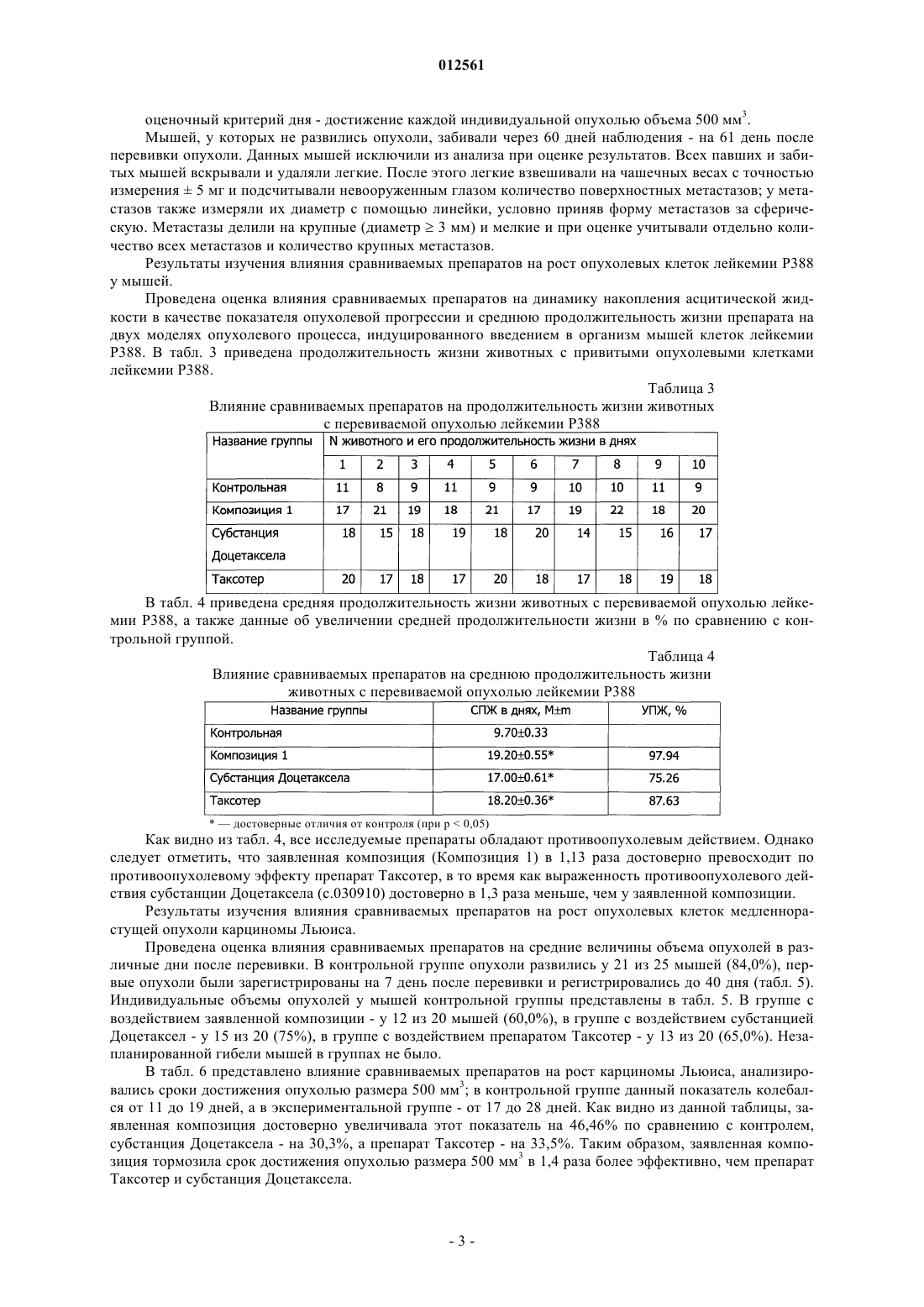
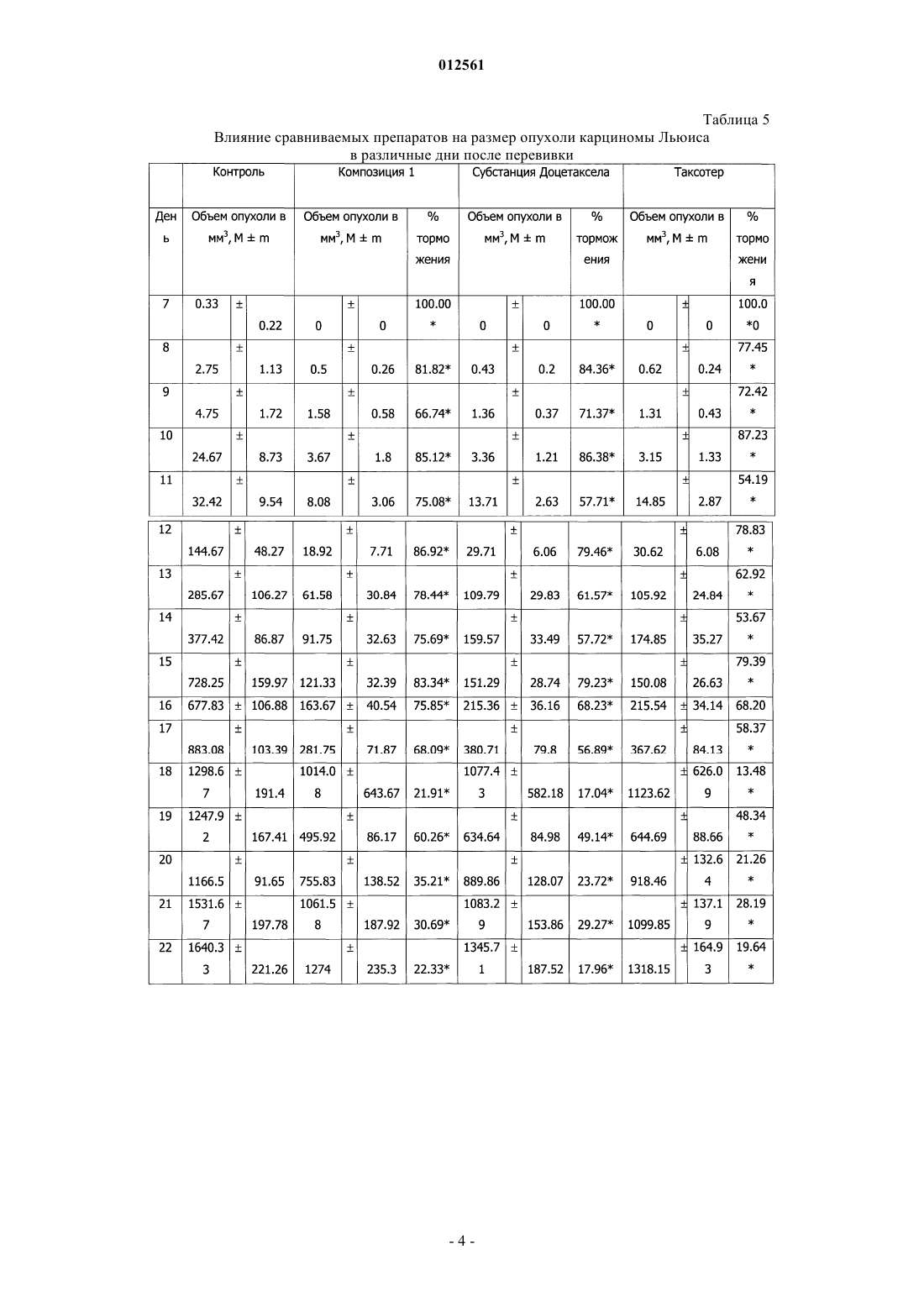
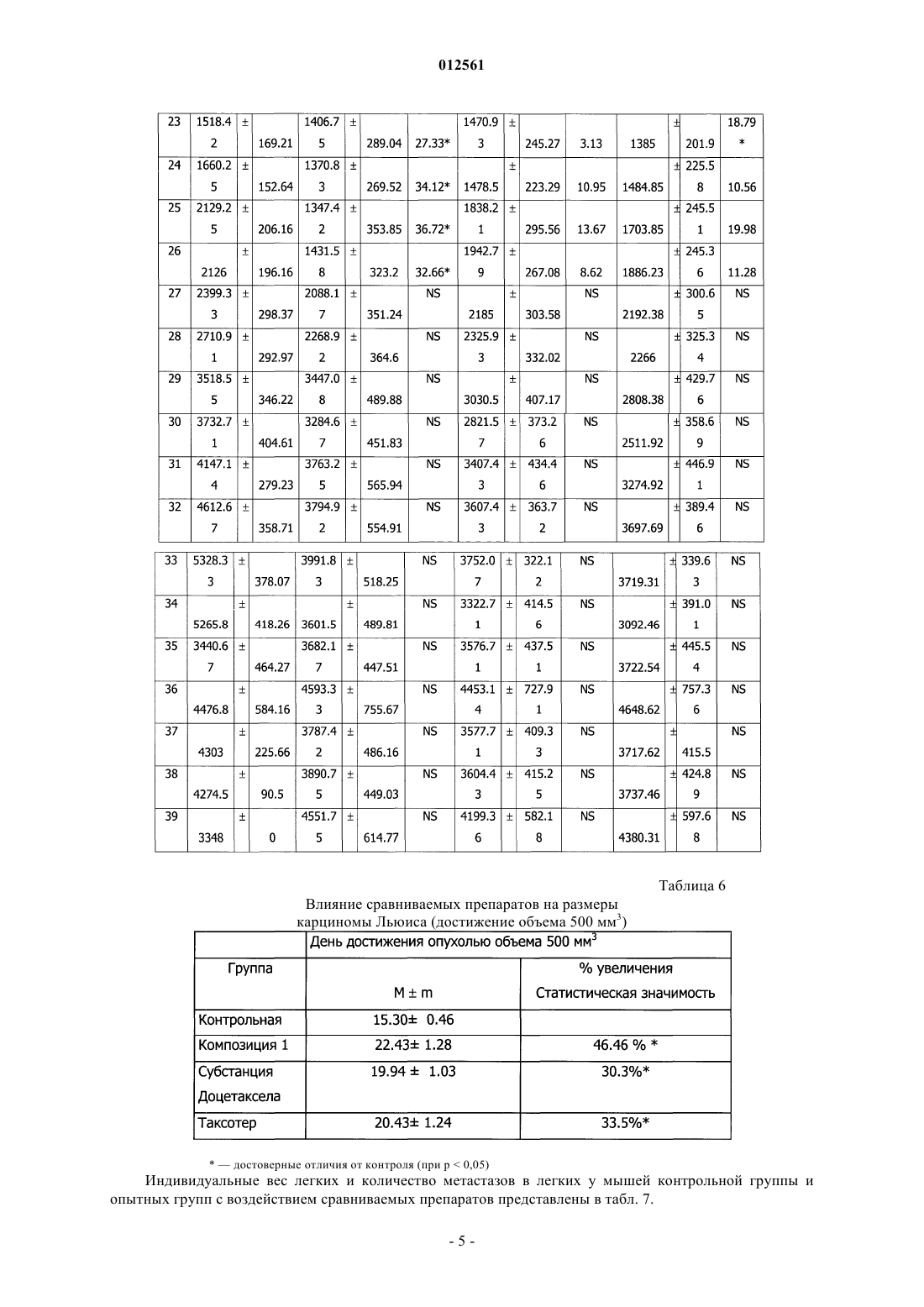
012561 Изобретение относится к области медицины, а именно к новой фармацевтической композиции, содержащей производные таксанов и обладающей противоопухолевой и антилейкемической активностями,а также к способу ее получения. Противоопухолевый эффект соединений класса таксанов опосредован преимущественно их действием на микротрубочки. Данные соединения повреждают микротубулярную сеть в клетках на стадии митоза и в интерфазе, связываются со свободным тубулином, стимулируют сбор тубулина в стабильные микротрубочки и препятствуют их распаду. В результате образуются связки микротрубочек, которые стабилизируются, теряют способность к нормальному функционированию, что приводит к нарушению фазы митоза и межфазных взаимодействий в клетках. Из уровня техники известен препарат Таксотер, содержащий в качестве активного вещества доцетаксел и поставляемый на рынок в виде концентрата для приготовления инфузионного раствора. Доцетаксел в химическом отношении представляет собой (2R,3S)-N-карбокси-3-фенилизосерин-N-трет-бутил 13-5 бета,20-эпокси-1,2 альфа,4,7 бета,10 бета,13 альфа-гексагидрокситакс-11-ен-9-он-4-ацетат-2-бензоат и относится группе противоопухолевых средств. Помимо доцетаксела препарат Таксотер включает поверхностно-активное вещество, выбранное из полисорбатов, сложных эфиров полиэтиленгликоля и сложных эфиров полиэтоксилированного касторового масла, и этиловый спирт, при этом содержание этилового спирта не превышает 5%. Данный препарат получают путем растворения активного вещества в этиловом спирте, введения поверхностно-активного вещества и испарения этилового спирта либо медленного введения активного вещества в раствор поверхностно-активного вещества в этиловом спирте,содержащемся в количестве 1-2%. Состав препарата Таксотер и способ его получения раскрыты в патенте РФ 2134123 (А 61 К 47/10, дата публикации 10.08.1999). Задачей настоящего изобретения явилось создание новой стабильной фармацевтической композиции, готовой к применению, т.е. не требующей дополнительного растворения, (далее Композиция 1) и обладающей повышенной противоопухолевой и антилейкемической активностями. Таким образом, техническим результатом изобретения является повышение стабильности и эффективности композиции, а также повышение удобства в применении (не требует дополнительного растворения). Данная композиция включает активное вещество, выбранное из группы таксанов, поверхностно-активное вещество и этиловый спирт, при этом рН среды находится в пределах от 3,0 до 4,5. В качестве активных веществ могут использоваться такие производные таксанов как паклитаксел и доцетаксел. В качестве активного вещества предпочтительно использование доцетаксела, а в качестве поверхностно-активного вещества - полиоксиэтилена сорбитанмоноолеата. В качестве подкисляющего агента может быть использована любая фармацевтически приемлемая кислота, предпочтительно лимонная кислота. Количество этилового спирта предпочтительно находится в пределах от 5 до 55 об.%. Предпочтительно использование безводного этилового спирта с концентрацией не менее 99,5%. Способ получения заявленной композиции включает растворение субстанции активного вещества в этиловом спирте, добавление к полученной смеси поверхностно-активного вещества, доведение рН полученной смеси до значения от 3,0 до 4,5 и стерилизующую фильтрацию полученной смеси. Экспериментальные исследования Методика моделирования быстрорастущей перевиваемой опухоли лейкемии Р 388 у мышей. Культуру опухолевых клеток лейкемии P388, хранящуюся при температуре жидкого азота, размораживали и разводили в стерильном растворе Хенкса до концентрации 5106 клеток /мл. 0,2 мл полученной суспензии, содержащей 106 клеток, инокулировали внутрибрюшинно 6 мышам линии DBA/2. Ha 8 день пассажа опухолевых клеток проводили выборочную оценку количества образовавшейся в организме асцитной жидкости. Случайным образом выбирали животное, умерщвляли его и из брюшной полости извлекали с помощью шприца 3,6 мл асцитной жидкости. День получения асцитной жидкости считался днем исследования 0, то есть днем начала проведения основного эксперимента. Асцитную жидкость, полученную от животного после пассажа опухолевых клеток, развели стерильным раствором Хенкса до концентрации 5106 клеток/мл. В день исследования 0 животным контрольной и экспериментальных групп провели внутрибрюшинную инъекцию суспензии опухолевых клеток лейкемии Р 388. Доза инокулюма - 106 клеток на мышь; объем инъекции 0,2 мл на мышь. Внутрибрюшинные инъекции осуществлялись одноразовыми шприцами (табл. 1). В день исследования 3 через 72 ч после инокуляции опухолевых клеток животным были сделаны внутривенные инъекции однократно. Инъекции осуществлялись одноразовыми шприцами. Объем инъекции 0,183 мл/животное. Методика моделирования медленнорастущей перевиваемой опухоли карциномы Льюиса у мышей. Пассаж опухолевых клеток для их активации при подготовке основного эксперимента проводился на 6 животных. Культуру опухолевых клеток 3LL, хранящуюся при температуре жидкого азота, размораживали и вводили мышам под кожу правого бока в стерильном физиологическом растворе в виде 10% взвеси опухолевых клеток по 0,2 мл, содержащей 2106 опухолевых клеток. На 18 день пассажа опухолевых клеток в стерильных условиях были взяты опухоли от 2 мышей и проведена перевивка 34 мышам для основного эксперимента. Опухолевая ткань в стерильных условиях измельчалась и смешивалась ручным способом в стеклянном тканевом гомогенизаторе, готовилась 10% взвесь опухолевых клеток в стерильном физиологическом растворе. Перевивку опухоли осуществляли под кожу правого бока по 0,2 мл взвеси опухолевых клеток на мышь, содержащей 2106 опухолевых клеток. Инъекции осуществлялись одноразовыми шприцами (табл. 2). Таблица 2 Описание экспериментальных групп В день исследования 3 через 72 ч после инокуляции опухолевых клеток животным были сделаны внутривенные инъекции однократно. Инъекции осуществлялись одноразовыми шприцами. Объем инъекции 0,183 мл/животное. Исследование противоопухолевой и антилейкемической активностей заявленной композиции. Оценка противоопухолевого действия проводилась на основании оценки накопления асцита по регистрации прибавки веса животных; оценки продолжительности жизни животных. При оценке продолжительности жизни животных последним днем жизни считался предыдущий день перед днем гибели. Процент увеличения продолжительности жизни животных вычислялся по формуле оценки опухолевого роста. Проводили измерение большего размера опухоли (длина) и перпендикулярного ему меньшего размера (ширина). Объем опухоли рассчитывали в мм 3 по формулеV - объем опухоли, L - длина опухоли, W - ширина опухоли. Торможение опухолевого роста рассчитывали по формуле-2 012561 оценочный критерий дня - достижение каждой индивидуальной опухолью объема 500 мм 3. Мышей, у которых не развились опухоли, забивали через 60 дней наблюдения - на 61 день после перевивки опухоли. Данных мышей исключили из анализа при оценке результатов. Всех павших и забитых мышей вскрывали и удаляли легкие. После этого легкие взвешивали на чашечных весах с точностью измерения 5 мг и подсчитывали невооруженным глазом количество поверхностных метастазов; у метастазов также измеряли их диаметр с помощью линейки, условно приняв форму метастазов за сферическую. Метастазы делили на крупные (диаметр 3 мм) и мелкие и при оценке учитывали отдельно количество всех метастазов и количество крупных метастазов. Результаты изучения влияния сравниваемых препаратов на рост опухолевых клеток лейкемии P388 у мышей. Проведена оценка влияния сравниваемых препаратов на динамику накопления асцитической жидкости в качестве показателя опухолевой прогрессии и среднюю продолжительность жизни препарата на двух моделях опухолевого процесса, индуцированного введением в организм мышей клеток лейкемии Р 388. В табл. 3 приведена продолжительность жизни животных с привитыми опухолевыми клетками лейкемии P388. Таблица 3 Влияние сравниваемых препаратов на продолжительность жизни животных с перевиваемой опухолью лейкемии Р 388 В табл. 4 приведена средняя продолжительность жизни животных с перевиваемой опухолью лейкемии Р 388, а также данные об увеличении средней продолжительности жизни в % по сравнению с контрольной группой. Таблица 4 Влияние сравниваемых препаратов на среднюю продолжительность жизни животных с перевиваемой опухолью лейкемии Р 388 достоверные отличия от контроля (при р 0,05) Как видно из табл. 4, все исследуемые препараты обладают противоопухолевым действием. Однако следует отметить, что заявленная композиция (Композиция 1) в 1,13 раза достоверно превосходит по противоопухолевому эффекту препарат Таксотер, в то время как выраженность противоопухолевого действия субстанции Доцетаксела (с.030910) достоверно в 1,3 раза меньше, чем у заявленной композиции. Результаты изучения влияния сравниваемых препаратов на рост опухолевых клеток медленнорастущей опухоли карциномы Льюиса. Проведена оценка влияния сравниваемых препаратов на средние величины объема опухолей в различные дни после перевивки. В контрольной группе опухоли развились у 21 из 25 мышей (84,0%), первые опухоли были зарегистрированы на 7 день после перевивки и регистрировались до 40 дня (табл. 5). Индивидуальные объемы опухолей у мышей контрольной группы представлены в табл. 5. В группе с воздействием заявленной композиции - у 12 из 20 мышей (60,0%), в группе с воздействием субстанцией Доцетаксел - у 15 из 20 (75%), в группе с воздействием препаратом Таксотер - у 13 из 20 (65,0%). Незапланированной гибели мышей в группах не было. В табл. 6 представлено влияние сравниваемых препаратов на рост карциномы Льюиса, анализировались сроки достижения опухолью размера 500 мм 3; в контрольной группе данный показатель колебался от 11 до 19 дней, а в экспериментальной группе - от 17 до 28 дней. Как видно из данной таблицы, заявленная композиция достоверно увеличивала этот показатель на 46,46% по сравнению с контролем,субстанция Доцетаксела - на 30,3%, а препарат Таксотер - на 33,5%. Таким образом, заявленная композиция тормозила срок достижения опухолью размера 500 мм 3 в 1,4 раза более эффективно, чем препарат Таксотер и субстанция Доцетаксела.-3 012561 Таблица 5 Влияние сравниваемых препаратов на размер опухоли карциномы Льюиса в различные дни после перевивки Таблица 6 Влияние сравниваемых препаратов на размеры карциномы Льюиса (достижение объема 500 мм 3) достоверные отличия от контроля (при р 0,05) Индивидуальные вес легких и количество метастазов в легких у мышей контрольной группы и опытных групп с воздействием сравниваемых препаратов представлены в табл. 7.-5 012561 Таблица 7 Влияние сравниваемых препаратов на метастазирование карциномы Льюиса у мышей достоверные отличия от контроля (при р 0,05) Как видно из табл. 7, в сравнении с Таксотером и субстанцией доцетаксела заявленная композиция(Композиция 1) наиболее эффективно препятствовала развитию метастазов в легких мышей. Исследование стабильности заявленной композиции. Стабильность выбранного состава изучена в процессе ускоренного хранения эквивалентного 1,5 года. Исследования показали, что факторами нестабильности препарата являются: присутствие воды,рН среды, выходящее за рамки рекомендованного значения 3,0-4,5,наличие примесей. Установлено, что присутствие спирта абсолютно не вызывает этерификации доцетаксела. Максимальное содержание единичной примеси увеличилось с 0,19 (рН 4,26) до 1,21% (рН 5,75), суммы примесей с 0,55 до 2,86 %. На основании проведенных исследований принято решение о необходимости доведения рН среды до 3,0-4,5, минимизации содержания воды, необходимости использования спирта на уровне 50%. Способ получения заявленной композиции. Для получения заявленной композиции использовались следующие ингредиенты: субстанция доцетаксела, полиооксиэтилен сорбитанмоноолеат, при необходимости осушенный до содержания воды не более 2,0%, спирт этиловый безводный (содержание спирта безводного не менее 99,5%), кислота лимонная безводная (содержание воды не более 1%). При помощи указанных компонентов был, в частности,разработан следующий состав: Доцетаксела безводного - 2,0 г Полиоксиэтилена сорбитанмоноолеата - 50 мл Лимонной кислоты (10%-ный раствор в спирте этиловом безводном) - до рН 3,0-4,5 Спирта этилового безводного - до 100 мл. Заявленная композиция может быть получена следующим образом. В первую герметичную емкость отмеривается необходимое количество спирта этилового безводного. Во вторую герметичную емкость отмеривается необходимое количество полиоксиэтилена сорбитанмоноолеата, при необходимости предварительно осушенного до содержания воды не более 2,0%. В третью емкость, установленную на весах и снабженную перемешивающим и барбатирующим устройством,вносится навеска субстанции доцетаксела. Растворение субстанции доцетаксела осуществляется подачей безводного этилового спирта при постоянном перемешивании и барбатированием газообразным азотом,предварительно очищенным на фильтрах с размером пор 0,2 мкм. Раствор субстанции доцетаксела переносится в четвертую герметичную емкость, снабженную перемешивающим устройством. При постоянном перемешивании в четвертую емкость переносится содержимое второй емкости (полиоксиэтилен сорбитанмоноолеат). Остаточное количество полиоксиэтилена сорбитанмоноолеата смывается безводным этиловым спиртом и количественно переносится в четвертую емкость. Перемешивание в четвертой емкости осуществляется до полного растворения всех компонентов. Из четвертой емкости отбирается контрольная проба для определения рН. В пятой герметичной емкости готовится 10% раствор лимонной кислоты в спирте этиловом безводном. Далее в четвертую емкость с раствором доцетаксела в смеси спирт-полиоксиэтилен сорбитанмоноолеат вносится из пятой емкости необходимое количество раствора лимонной кислоты с доведением рН до 3,0-4,5. Объем раствора в четвертой емкости доводится до расчетного безводным этиловым спиртом. Определяется рН полученного раствора. При получении удовлетворительного результата раствор доцетаксела передается на стерилизующую фильтрацию. Далее - розлив во флаконы, укупорка, упаковка. Стерилизующая фильтрация, розлив, укупорка осуществляются в атмосфере сухого азота. Был также получен и исследован следующий состав, включающий паклитаксел в качестве активно-6 012561 го компонента: При этом рН поддерживается в интервале 3,0-4,5. При необходимости для корректировки рН может использоваться лимонная кислота. Изучение активности препарата дало следующие результаты: Острая цитотоксичность препаратов таксанового ряда в отношении перевивной клеточной линии рака молочной железы человека МСР-7 (4 ч инкубации). Таблица 8- здесь и в табл. 9-11 - фракция выживших клеток (в процентах) Цитостатическая эффективность препаратов таксанового ряда в отношении перевивной клеточной линии рака молочной железы человека МСЕ-7 (24 ч инкубации). Таблица 9 Цитостатическая эффективность препаратов таксанового ряда в отношении перевивной клеточной линии рака молочной железы человека МСЕ-7 (48 ч инкубации). Таблица 10 Цитостатическая эффективность препаратов таксанового ряда в отношении перевивной клеточной линии рака молочной железы человека МСЕ-7 (72 ч инкубации). Таблица 11 Исследования показали, что факторами нестабильности препарата являются: присутствие воды,рН среды, выходящее за рамки рекомендованного значения 3,0-4,5,наличие примесей. Максимальное содержание единичной примеси увеличилось с 0,06% (рН 4,4) до 1,05% (рН 4,63),суммы примесей с 0,31 до 1,19%. На основании проведенных исследований принято решение о необходимости доведения рН среды до 3,0-4,5, минимизации содержания воды и необходимости использования спирта на уровне 50%. Указанный состав может быть получен аналогичным способом. Представленные примеры иллюстрируют технический результат заявленного изобретения, однако специалисту в данной области техники должно быть очевидно, что они не ограничивают область использования заявленного изобретения.-7 012561 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция, включающая активное вещество, выбранное из группы таксанов,поверхностно-активное вещество и этиловый спирт, отличающаяся тем, что она содержит подкисляющий агент, обеспечивающий рН среды в пределах от 3,0 до 4,5. 2. Композиция по п.1, отличающаяся тем, что подкисляющим агентом является лимонная кислота. 3. Композиция по п.1, отличающаяся тем, что количество этилового спирта составляет от 5 до 55 об.%. 4. Композиция по любому из пп.1-3, отличающаяся тем, что активное вещество выбирают из группы, включающей доцетаксел и паклитаксел. 5. Композиция по любому из пп.1-3, отличающаяся тем, что этиловый спирт представляет собой безводный этиловый спирт. 6. Композиция по любому из пп.1-3, отличающаяся тем, что она находится в форме инфузионного раствора. 7. Композиция по любому из пп.1-3, отличающаяся тем, что в качестве поверхностно-активного вещества используется полиоксиэтилена сорбитанмоноолеат. 8. Способ получения фармацевтической композиции, включающий растворение субстанции активного вещества, выбранного из группы таксанов, в этиловом спирте и добавление к полученной смеси поверхностно-активного вещества, отличающийся тем, что после добавления поверхностно-активного вещества рН полученной смеси доводят до значения от 3,0 до 4,5 и полученную смесь фильтруют. 9. Способ по п.8, отличающийся тем, что этиловый спирт представляет собой безводный этиловый спирт. 10. Способ по п.8, отличающийся тем, что рН регулируют за счет добавления лимонной кислоты. 11. Способ по п.8, отличающийся тем, что рН регулируют за счет добавления 10%-ного раствора безводной лимонной кислоты в безводном этиловом спирте. 12. Способ по любому из пп.8-11, отличающийся тем, что активное вещество выбирают из группы,включающей доцетаксел и паклитаксел.
МПК / Метки
МПК: A61K 47/34, A61K 47/10, A61J 3/00, A61K 31/337
Метки: таксанов, производные, фармацевтическая, включающая, композиция, способ, получения
Код ссылки
<a href="https://eas.patents.su/9-12561-farmacevticheskaya-kompoziciya-vklyuchayushhaya-proizvodnye-taksanov-i-sposob-ee-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтическая композиция, включающая производные таксанов, и способ ее получения</a>
Предыдущий патент: Двухосное прижимное устройство для формирования изображения среды по данным метода сопротивлений
Следующий патент: Способ оценки неопределенности и риска
Случайный патент: Теплообменник и способ и устройство для его изготовления