Фармацевтические композиции и способы лечения инсулином
Формула / Реферат
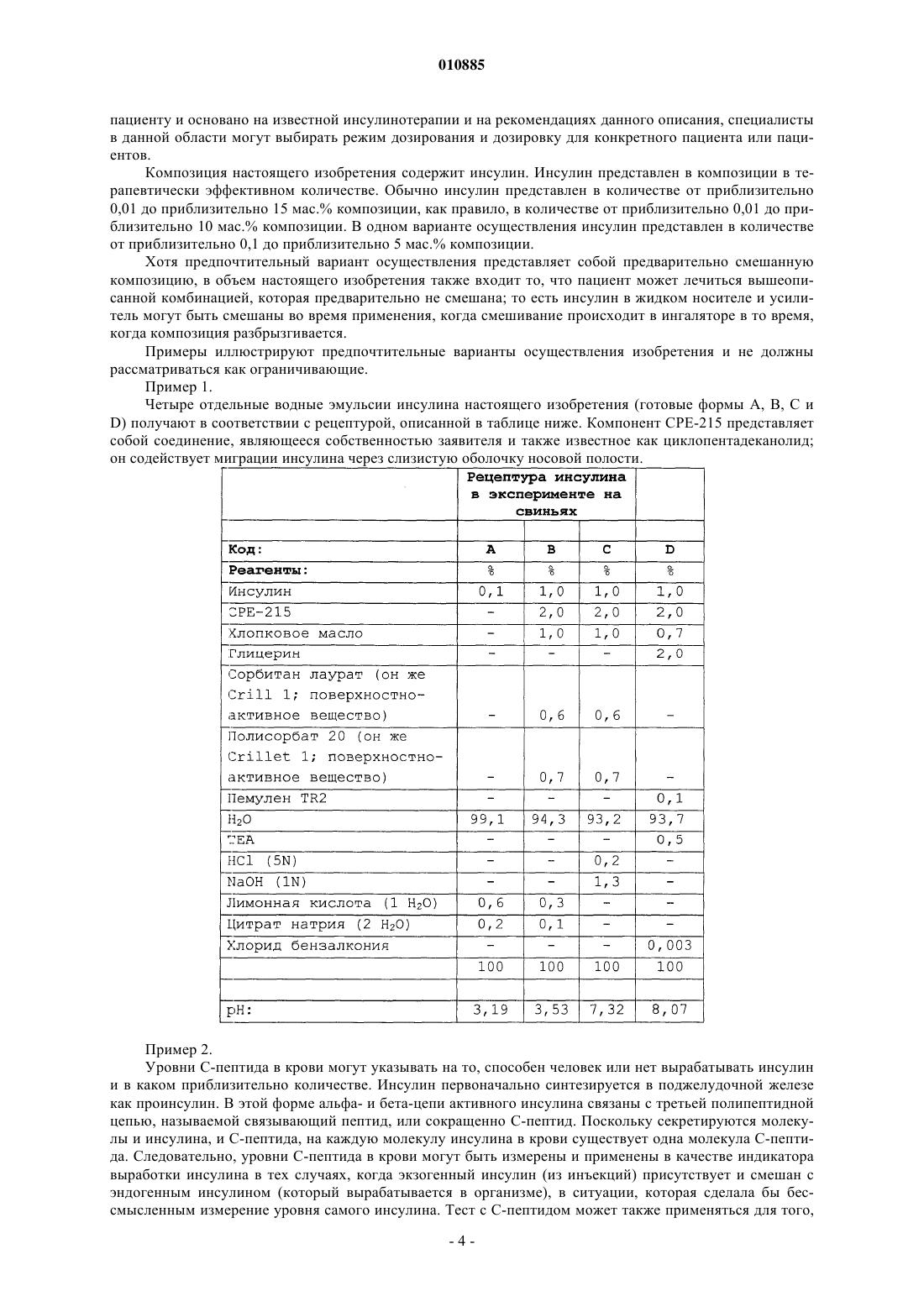
1. Фармацевтическая композиция в форме, пригодной для назальной доставки пациенту, содержащая терапевтически эффективное количество инсулина, усилитель проницаемости и жидкий носитель, причем указанная композиция имеет кислое значение рН, но не более чем рН 4,5, и указанный усилитель проницаемости является усилителем Hsieh, имеющим следующую структуру:
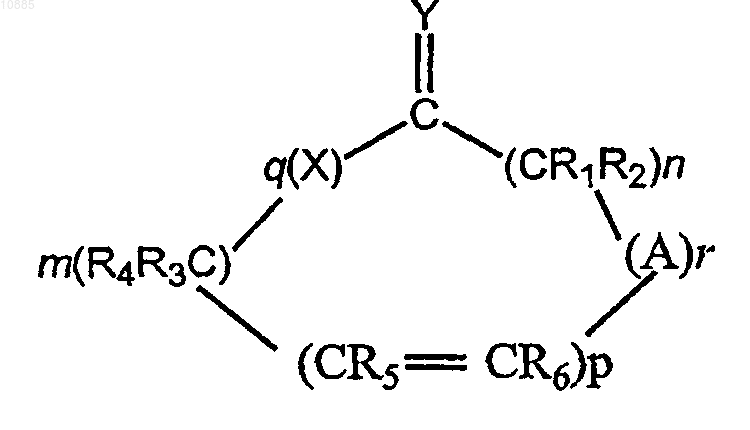
где X и Y представляют собой кислород, серу или иминогруппу структуры
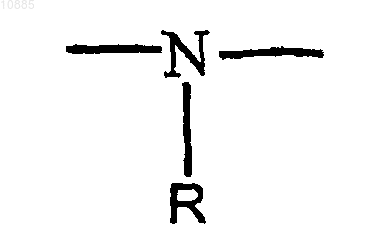
или =N-R, при условии, что когда Y представляет собой иминогруппу, то X является иминогруппой, а когда Y представляет собой серу, то X представляет собой серу или иминогруппу, А представляет собой группу, имеющую структуру
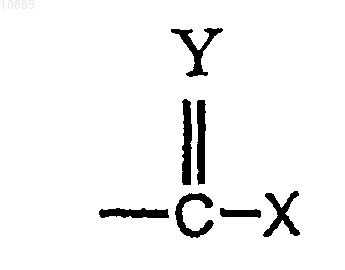
где X и Y определены выше; m и n представляют собой целые числа, имеющие значения от 1 до 20, и сумма m+n не превышает 25; р представляет собой целое число, имеющее значение 0 или 1; q является целым числом, имеющим значение 0 или 1; r представляет собой целое число, имеющее значение 0 или 1, и каждая из групп R, R1, R2, R3, R4, R5 или R6 независимо является водородом или алкильной группой, имеющей от 1 до 6 атомов углерода, которая может представлять собой прямую или разветвленную цепь в том случае, если только одна из R1-R6 может являться алкильной группой, при условии, что, когда р, q и r имеют значение 0 и Y является кислородом, m+n составляет по меньшей мере 11, и при дополнительном условии, что когда X является иминогруппой, q равен 1, Y является кислородом и р и r имеют значение 0, то m+n составляет по меньшей мере 11.
2. Фармацевтическая композиция по п.1, в которой указанное кислое значение рН составляет от приблизительно 2 до приблизительно 4.
3. Фармацевтическая композиция по любому из предшествующих пунктов, дополнительно содержащая ингибитор кристаллизации.
4. Фармацевтическая композиция по любому из предшествующих пунктов, которая представлена в форме эмульсии, в которой усилитель Hsieh эмульгирован в водной фазе, которая включает инсулин.
5. Фармацевтическая композиция по любому из предшествующих пунктов, в которой указанный усилитель Hsieh представляет собой макроциклический усилитель проницаемости.
6. Фармацевтическая композиция по любому из предшествующих пунктов, в которой указанный усилитель Hsieh представляет собой циклопентадекалактон или циклогексадеканон.
7. Фармацевтическая композиция по любому из предшествующих пунктов, в которой указанный усилитель проницаемости эмульгирован в указанной водной фазе поверхностно-активным веществом, имеющим гидрофильно-липофильный баланс (HLB) от приблизительно 7 до приблизительно 14.
8. Фармацевтическая композиция по любому из предшествующих пунктов, дополнительно включающая ингибитор кристаллизации, способный снижать температуру кристаллизации указанного усилителя проницаемости до температуры ниже приблизительно 25шC.
9. Фармацевтическая композиция по п.8, в которой указанный ингибитор кристаллизации способен снижать температуру кристаллизации указанного усилителя проницаемости до температуры ниже приблизительно 5шC.
10. Фармацевтическая композиция по п.9, в которой указанный ингибитор кристаллизации выбран из группы, состоящей из натуральных масел, маслянистых веществ, восков, сложных эфиров и углеводородов.
11.Фармацевтическая композиция по любому из пп.1-10 для использования в способе лечения пациента инсулином.
12. Продукт, включающий аппликатор назального спрея, интраназальное дозирующее спрей устройство или аэрозольный ингалятор, включающий фармацевтическую композицию по любому из пп.1-11.
Текст
010885 По данной заявке испрашивается приоритет в соответствии с предварительной патентной заявкой США, серийный 60/527728, поданной 8 декабря 2003 г., которая включена полностью в качестве ссылки. Это изобретение относится к композициям и способам доставки инсулина, в частности к доставке инсулина, отличной от инъекции через кожу, оболочки различных полостей тела, таких как глазная, носовая, ротовая, буккальная, анальная, ректальная, вагинальная, а также гематоэнцефалический барьер и подобные оболочки. Инсулин обычно используется для лечения пациентов, страдающих диабетом. Как правило, инсулин доставляется пациенту посредством инъекции. Патент США 5023252 описывает композицию для доставки инсулина путем, отличным от инъекции. Более конкретно, этот патент описывает применение композиций, которые включают усилители проницаемости для доставки инсулина через кожу и оболочки полостей тела, не требующие инъекции. Настоящее изобретение направлено на усовершенствование таких композиций и их применение. В соответствии с изобретением предоставляется фармацевтическая композиция, содержащая: (А) инсулин; (В) усилитель проницаемости и (С) жидкий носитель, в котором композиция имеет кислое значение рН. Было обнаружено, что при использовании композиции, которая содержит комбинацию инсулина и усилителя проницаемости, улучшенные результаты получают, если композиция имеет кислое значение рН. Дополнительно изобретение относится к лечению пациента, нуждающегося в инсулине, комбинацией инсулина, усилителя проницаемости и жидкого носителя; при этом комбинация имеет кислый рН,не выше 4,5. Предпочтительно, чтобы рН композиции был не выше 4 и не ниже 2. рН предпочтительно равняется по меньшей мере 2. Как правило, рН композиции равен по меньшей мере 2 и не превышает 4,5. В предпочтительном варианте осуществления рН не превышает 4. Предпочтительные интервалы значений рН - от 2,5 до 3,8. В одном предпочтительном варианте осуществления pH примерно равен 3. рН композиции может поддерживаться использованием подходящего буфера. Считается, что выбор буфера для поддержания требуемого рН находится в пределах квалификации специалистов в данной области на основе идей, изложенных здесь. В качестве представительных примеров подходящих буферов могут быть упомянуты буфер на основе лимонной кислоты, фосфатный буфер и им подобные как широко используемые, а также пригодные для медицинских препаратов. Как правило, применяемым усилителем проницаемости является такое вещество, которое увеличивает проникновение инсулина через оболочку полости тела. Как правило, усилителем проницаемости является такое вещество, которое увеличивает проникновение инсулина через оболочку полости тела, и особенно через слизистую носа. В композиции, содержащей эффективное количество инсулина, предпочтительным усилителем проницаемости является соединение такой структуры: где X и Y представляют собой кислород, серу или иминогруппу структуры или =N-R, при условии, что когда Y представляет собой иминогруппу, то X является иминогруппой, а когда Y представляет собой серу, то X представляет собой серу или иминогруппу, A представляет собой группу, имеющую структуру где X и Y определены выше, m и n представляют собой целые числа, имеющие значения от 1 до 20, и сумма m+n не превышает 25, р представляет собой целое число, имеющее значение 0 или 1, q является целым числом, имеющим значение 0 или 1, r представляет собой целое число, имеющее значение 0 или 1, и каждая из групп R, R1, R2, R3, R4, R5 или R6 независимо является водородом или алкильной группой,имеющей от 1 до 6 атомов углерода, которая может представлять собой прямую или разветвленную цепь,в том случае, если только одна из R1-R6 может являться алкильной группой, при условии, что, когда р, q и r имеют значение 0 и Y является кислородом, m+n составляет по меньшей мере 11, и при дополнитель-1 010885 ном условии, что, когда X является иминогруппой, q равняется 1, Y представляет собой кислород, а р и r равны 0, тогда m+n равно по меньшей мере 11, и упомянутое соединение будет увеличивать скорость прохождения лекарства через оболочки тела. В дальнейшем в этом документе такие соединения упоминаются как усилители. Когда R, R1, R2, R3, R4, R5 или R6 являются алкилом, он может представлять собой метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, амил, гексил и т.п. Такие усилители проницаемости описаны в патентах США 5023252 и 5731303. Предпочтительно соединения данного изобретения являются циклическими лактонами (соединениями, в которых и X, и Y являются кислородом (q равно 1, и r равно 0, циклическими сложными диэфирами (соединениями, в которых и X, и Y являются кислородом, a q и r равны 1) и циклическими кетонами (соединениями, в которых и q, и r равны 0 и Y представляет собой кислород). В циклических сложных диэфирах m+n предпочтительно равно по меньшей мере 3. В циклических кетонах m+n варьирует предпочтительно в пределах 11-15, а р предпочтительно равно 0. Усилители описанной выше структурной формулы упоминаются как "усилители Hsieh" и описываются, например, в упомянутых выше патентах США 5023252 и 5731303 (далее в этом тексте - "ПатентыHsieh"). Такие усилители являются липофильными и "совместимыми с мембранами" в том смысле, что они не вызывают повреждения мембран, к которым применяется композиция настоящего изобретения(далее в этом тексте - "мембрана-мишень). Такие усилители также незначительно раздражают или совсем не раздражают мембрану-мишень и, фактически, служат в качестве смягчающего средства. Предпочтительные усилители для применения в настоящем изобретении представляют собой макроциклические усилители. Термин "макроциклический" употребляется по отношению к циклическим соединениям, имеющим в кольце по меньшей мере 12 атомов углерода. Примеры предпочтительных макроциклических усилителей для применения в настоящем изобретении включают: (А) макроциклические кетоны, например 3-метилциклопентадеканон (мускон), 9-циклогептадецен-1-он (циветон), циклогексадеканон и циклопентадеканон (нормускон) и (В) макроциклические сложные эфиры, например пентадекалактоны, такие как оксациклогексадекан-2-он (циклопентадеканолид, -пентадекалактон). Оксациклогексадекан-2-он и циклопентадеканон являются особенно предпочтительными. Несмотря на то, что вышеописанные соединения представляют собой предпочтительные усилители проницаемости, любой специалист в данной области техники признал бы, что настоящие идеи были бы также применимы к другим усилителям проницаемости. Неограничивающие примеры других усилителей проницаемости, пригодных в настоящем изобретении, представляют собой длинноцепочечные сложные эфиры, которые признаны, в целом, безвредными (GRAS) в различных фармакопейных справочниках. Эти эфиры могут включать в себя простые алифатические, ненасыщенные или насыщенные (но предпочтительно полностью насыщенные) сложные эфиры, которые содержат цепи до средней длины. Неограничивающие примеры таких сложных эфиров включают изопропилмиристат, изопропилпальмитат, миристилмиристат, октилпальмитат и т.п. Усилители относятся к типу, который пригоден для применения в фармацевтической композиции. Рядовой специалист в данной области также примет во внимание, что тех веществ, которые являются несовместимыми со слизистыми оболочками или раздражающими слизистые оболочки, следует избегать. Усилитель представлен в композиции в концентрации, эффективной для усиления проникновения инсулина для доставки через мембрану. При определении количества усилителя для применения следует учитывать различные соображения. Такие соображения включают, например, достигаемую величину потока (скорость прохождения через мембрану) и стабильность и совместимость компонентов композиции. Усилитель обычно применяется в количестве от приблизительно 0,01 до приблизительно 25 мас.% композиции, как правило, в количестве от приблизительно 0,1 до приблизительно 15 мас.% композиции и в предпочтительных вариантах осуществления в количестве от приблизительно 0,5 до приблизительно 15 мас.% композиции. Жидкий носитель представлен в композиции в концентрации, эффективной для того, чтобы служить в качестве пригодного транспортного средства для композиции настоящего изобретения. В целом,носитель применяется в количестве от приблизительно 40 до приблизительно 98 мас.% композиции и в предпочтительных вариантах осуществления в количестве от приблизительно 50 до приблизительно 98 мас.% композиции. Инсулиновые композиции настоящего изобретения предпочтительно доставляются как назальный спрей. В таком варианте осуществления предпочтительным жидким носителем является вода с инсулином, диспергированным или растворенным в воде в терапевтически эффективном количестве. В одном предпочтительном варианте осуществления усилитель проницаемости эмульгирован в водной фазе, которая содержит инсулин. На эмульгирование может воздействовать применение одного или более пригодных поверхностно-активных веществ. Считается, что выбор пригодных поверхностноактивных веществ находится в пределах знаний специалистов в данной области техники на основании рекомендаций настоящего описания. По существу, любое пригодное поверхностно-активное вещество или смесь поверхностно-активных веществ может применяться в практике настоящего изобретения,включая, например, анионогенные, катионогенные и неионогенные поверхностно-активные вещества. Предпочтительные поверхностно-активные вещества представляют собой неионогенные поверхностно-2 010885 активные вещества, причем особенно предпочтительными являются вещества, имеющие гидрофильнолипофильный баланс (HLB) от приблизительно 7 до приблизительно 14. Примерами таких неионогенных поверхностно-активных веществ являются PEG-60 кукурузные глицериды, PEG-20 моностеарат сорбитана, феноксиполи(этиленокси)этанол, моноолеат сорбитана и т.п. Особенно предпочтительными являются взятые из справочной литературы поверхностно-активные вещества, такие как поверхностно-активные вещества, описанные в справочнике, таком как Фармакопея пищевых химических веществ, Национальный справочник, Фармакопея США и свод федеральных правил. Предпочтительно, чтобы средний диаметр капелек эмульсии составлял от приблизительно 500 нм до приблизительно 20 мкм и более предпочтительно от приблизительно 1 до приблизительно 10 мкм. Обычно поверхностно-активное вещество представлено в количестве, не большем чем приблизительно 2 мас.% композиции и, как правило, не большем чем приблизительно 0,5 мас.% композиции. В одном предпочтительном варианте осуществления эмульгированная или неоднородная фаза, которая содержит усилитель проницаемости, находится в виде капелек. Как правило, более мелкие капельки придают большую стабильность. Более крупные капельки могут являться причиной нестабильности и уменьшения срока хранения. В предпочтительных вариантах осуществления размер капель составляет от 0,1 до 20 мкм и предпочтительно от 0,1 до 5 мкм. В целом, композиции, которые содержат инсулин, хранятся в холодильнике, и такое охлаждение может приводить к кристаллизации усилителя проницаемости. Для того, чтобы ослабить или предотвратить такую кристаллизацию, в предпочтительном варианте осуществления композиция включает в себя один или более ингибиторов кристаллизации для того, чтобы уменьшить кристаллизацию усилителя проницаемости. Кристаллизация, когда допускается ее развитие, приводит эмульсию в состояние нестабильности и отрицательно действует на срок хранения. Предпочтительные ингибиторы кристаллизации действуют путем снижения температуры, при которой кристаллизуются рассматриваемые соединения. Примеры таких ингибиторов кристаллизации включают натуральные масла, маслянистые вещества, воски, эфиры и углеводороды. Примеры натуральных масел или маслянистых веществ включают ацетат витамина E, октилпальмитат, кунжутное масло, соевое масло, сафлоровое масло, масло авокадо, пальмовое масло и хлопковое масло. Полагают, что выбор пригодного ингибитора кристаллизации в пределах данной области техники основывается на рекомендациях данного описания. Предпочтительные ингибиторы действуют путем снижения температуры, при которой кристаллизуется усилитель проницаемости. Ингибиторы, которые способны к снижению температуры кристаллизации рассматриваемых соединений ниже приблизительно 25 С, являются особенно предпочтительными, причем способные к снижению кристаллизации рассматриваемых соединений ниже приблизительно 5 С исключительно предпочтительны. Примеры особенно предпочтительных ингибиторов кристаллизации для применения в ингибировании кристаллизации оксациклогексадекан-2-она включают гексадекан, изопропилмиристат, октилпальмитат, хлопковое масло, сафлоровое масло и ацетат витамина E, каждый из которых может применяться в фармацевтических препаратах. Ингибитор кристаллизации присутствует в композиции в концентрации, эффективной для подавления кристаллизации усилителя проницаемости. В основном, ингибитор кристаллизации присутствует в количестве от приблизительно 0,001 до приблизительно 5 мас.% композиции, как правило, в количестве от приблизительно 0,01 до приблизительно 2 мас.% композиции. В одном варианте осуществления ингибитор кристаллизации присутствует в количестве от приблизительно 0,1 до приблизительно 1 мас.% композиции. Ингибитор кристаллизации предпочтительно использовать, когда усилитель имеет температуру кристаллизации выше приблизительно 0C. В частности, например, ингибитор кристаллизации предпочтительно используют, когда усилитель представляет собой пентадекалактон и/или циклогексадеканон, в связи с тем, что эти усилители кристаллизуются при температуре выше комнатной. Композиция настоящего изобретения обычно доставляется через устройство для доставки назального спрея. Если желательно интраназальное применение, композиция может быть помещена в дозирующее спрей-устройство для интраназальной доставки или ингалятор и применяться путем впрыскивания ее в ноздри пациента для доставки на слизистую оболочку ноздрей. Необходимое количество применяется для достижения требуемого системного или локализованного содержания медикамента. Обычно применяют более 200 мкл интраназального спрея, причем предпочтительно применение от приблизительно 50 до приблизительно 150 мкл. В одну или более ноздрей может вводиться лекарство, и применение может производиться так часто, как желательно, или так часто, как необходимо. В предпочтительных вариантах осуществления устройство для доставки назального спрея выбирается так, чтобы обеспечить средний размер капелек композиции от приблизительно 10 до приблизительно 200 мкм. В более широких пределах размер капелек составляет от приблизительно 30 до приблизительно 100 мкм. Композиция инсулинового спрея изобретения обычно употребляется в дозирующем режиме, который зависит от подвергающегося лечению пациента. Таким образом, частота применения и количество дозы могут изменяться от пациента к пациенту. Как правило, дозирование осуществляется в количестве(количество, усваиваемое после абсорбции со слизистой оболочки) от приблизительно 3 до приблизительно 15 ME и частота приема составляет от 3 до 4 раз в день. Как известно специалистам в данной области, лечение заболевания, такого как диабет, при помощи инсулинотерапии изменяется от пациента к-3 010885 пациенту и основано на известной инсулинотерапии и на рекомендациях данного описания, специалисты в данной области могут выбирать режим дозирования и дозировку для конкретного пациента или пациентов. Композиция настоящего изобретения содержит инсулин. Инсулин представлен в композиции в терапевтически эффективном количестве. Обычно инсулин представлен в количестве от приблизительно 0,01 до приблизительно 15 мас.% композиции, как правило, в количестве от приблизительно 0,01 до приблизительно 10 мас.% композиции. В одном варианте осуществления инсулин представлен в количестве от приблизительно 0,1 до приблизительно 5 мас.% композиции. Хотя предпочтительный вариант осуществления представляет собой предварительно смешанную композицию, в объем настоящего изобретения также входит то, что пациент может лечиться вышеописанной комбинацией, которая предварительно не смешана; то есть инсулин в жидком носителе и усилитель могут быть смешаны во время применения, когда смешивание происходит в ингаляторе в то время,когда композиция разбрызгивается. Примеры иллюстрируют предпочтительные варианты осуществления изобретения и не должны рассматриваться как ограничивающие. Пример 1. Четыре отдельные водные эмульсии инсулина настоящего изобретения (готовые формы А, В, С иD) получают в соответствии с рецептурой, описанной в таблице ниже. Компонент СРЕ-215 представляет собой соединение, являющееся собственностью заявителя и также известное как циклопентадеканолид; он содействует миграции инсулина через слизистую оболочку носовой полости. Пример 2. Уровни С-пептида в крови могут указывать на то, способен человек или нет вырабатывать инсулин и в каком приблизительно количестве. Инсулин первоначально синтезируется в поджелудочной железе как проинсулин. В этой форме альфа- и бета-цепи активного инсулина связаны с третьей полипептидной цепью, называемой связывающий пептид, или сокращенно С-пептид. Поскольку секретируются молекулы и инсулина, и С-пептида, на каждую молекулу инсулина в крови существует одна молекула С-пептида. Следовательно, уровни С-пептида в крови могут быть измерены и применены в качестве индикатора выработки инсулина в тех случаях, когда экзогенный инсулин (из инъекций) присутствует и смешан с эндогенным инсулином (который вырабатывается в организме), в ситуации, которая сделала бы бессмысленным измерение уровня самого инсулина. Тест с С-пептидом может также применяться для того,-4 010885 чтобы определить, вызван ли высокий уровень глюкозы крови сниженной выработкой инсулина или сниженным захватом глюкозы клетками. При диабете 1 типа у людей С-пептида мало или нет, а при диабете 2 типа уровень С-пептида может быть снижен или нормальный. Концентрация С-пептида у людей,не являющихся диабетиками, составляет 0,5-3,0 нг/мл. Оценка композиций этого изобретения проводилась in vivo, как описано ниже. Фармакокинетика и фармакодинамика интраназального CPE-215/инсулиновых препаратов у юкатанских мини-свиней. Это исследование проводилось в соответствии с NIH "Руководством по уходу и использованию лабораторных животных" и Федеральным законом о защите животных и следует протоколу, утвержденному Институциональным комитетом защиты и использования животных Университета Нью-Хемпшира. Целью этого исследования было оценить и охарактеризовать фармакокинетическую и фармакодинамическую эффективность препаратов инсулина после интраназальной доставки у юкатанских мини-свиней. Ранее было определено у биглей (Hseih, 1993), что циклопентадеканолид облегчает миграцию инсулина через слизистую оболочку полости носа. Для того, чтобы проверить это у мини-свиней, в виде стадии перед проведением исследований на людях-добровольцах, готовые формы были оценены на предмет уровня инсулина в крови и глюкодинамики. Материалы, способы и готовые формы Тестируемые готовые формы представляли собой водные эмульсии инсулина, содержащие человеческий рекомбинантный инсулин фармацевтической категории, полученный от Diosynth, Inc., отделениеAkzo Nobel, Inc. Эти препараты в композиции слегка варьировали по составу; однако, каждый содержит инсулин в количестве 1 мас.% и СРЕ-215 2 мас.%. Эти препараты распылялись посредством интраназального ингалятора, разработанного для людей Valois of America. Два вдувания по 100 мкл каждое были распределены свиньям, которые предварительно были катетеризированы постоянным яремным катетером. Каждые 100 мкл спрея распыляют 1 мг или приблизительно 25 ME инсулина. Применяли насадку для устройства, предоставленную также Valois of America, необходимость в которой (для доставки препарата к адсорбирующей поверхности преддверия лабиринта и участка носовой раковины) была определена в предварительном пробном исследовании. Такое же устройство, распределяющее 100 мкл, применялось с прикрепленной насадкой. Эти интраназально доставленные дозы сравнивались с 3 единицами инсулина, вводимого подкожно (ПК), в качестве положительного контроля. Описание животных 4 самки юкатанских миниатюрных свиней были приобретены на UNH ферме по исследованию миниатюрных свиней. В течение исследования свиньи содержались в экспериментальной комнате для животных с контролируемой окружающей средой (температура 252 С и 12-часовой цикл "свет-темнота"),кормились серийным экспериментальным кормом для свиней и имели свободный доступ к воде в любое время. Свиньи были юкатанскими самками в возрасте 21 недели: Свинья 1, маркер 121-5; масса к началу исследования: 16,8 кг; дата рождения 26.11.02. Свинья 2, маркер 121-4; масса к началу исследования: 22,3 кг; дата рождения 26.11.02 (замечание: 1 и 2 являются животными одного помета). Свинья 3, маркер 122-7; масса к началу исследования: 18,3 кг; дата рождения 1.12.02. Свинья 4, маркер 122-9; масса к началу исследования: 15,5 кг; дата рождения 1.12.02 (замечание: 3 и 4 являются животными одного помета). Методика катетеризации Животные были подготовлены к исследованию путем хирургической имплантации яремного катетера за 4-6 дней до начала исследования. После успокоения внутримышечным введением ксилазина и кетамина, на животных были надеты маски и достигнут эффект глубокого хирургического наркоза путем ингаляции изофлюранового анестетика и кислорода. В положении животных лежа на спине был выполнен разрез кожи в правой яремной складке с последующим отслаиванием подкожной и периваскулярной соединительной ткани для выделения правой яремной вены краниально от верхнего отверстия грудной клетки. Отрезок трубки внутривенного катетера диаметром 0,050 дюймов был вставлен через небольшой разрез в пережатую вену и расположен каудально (caudally) в передней полой вене (приблизительно от 12 до 15 см от яремного разреза). Катетер был фиксирован к вене и глубоким подкожным тканям шовным материалом. Яремная вена краниально от катетера была лигирована полипропиленовым шовным материалом. Свободный конец катетера был извлечен путем отслаивания через подкожный слой на спину между лопаток, протянут через маленький кожный разрез и фиксирован к коже полипропиленовым шовным материалом. Катетер был закрыт устройством для присоединения шприца и заполнен антитромботическим препаратом. Антитромботик состоит из 60% (в отношении массы к объему) поливинилпирролидона (10000 мВ, PVP-10) и смеси физиологический раствор/натриевая соль гепарина (50000 единиц гепарина на 100 мл). Подкожный и кожный разрез в яремной складке были закрыты, соответственно,синтетическим рассасывающимся и полипропиленовым шовным материалом. Животные были удобно забинтованы для защиты катетера и кожного разреза и укрыты попоной, сделанной для работы с катетером у собак. Буторфанол внутримышечно вводился в качестве анальгетика сразу же и через 12 ч после хирургического вмешательства.-5 010885 Схема эксперимента Во время введения дозы подвижность свиней ограничивалась тканевым ремнем. После этого свиньям разрешалось свободно двигаться по их соответствующим индивидуальным загонам и только во время забора крови их подвижность временно ограничивали в закрытом помещении спереди загона с движущейся деревянной дверью. Каждой свинье дважды вводилась доза каждой из четырех различных готовых форм в течение 2 недель с перерывами между воздействиями по меньшей мере 18 ч. Интраназальное введение (готовые формы В, С, D) вызывает распределение 100 мкл 1%-ной эмульсии инсулина через аэрозольный дозатор (человеческий тип интраназального устройства), по одному разу в каждый носовой ход (общая доза 50 ME), или подкожное введение дозы (готовая форма А), 1200 мкл 0,1%-ного буферного стерильного раствора, с применением стерильного шприца на 1 куб.см (3 ME), оборудованного иглой 22 калибра. Интервалы введения дозы у свиней были рассчитаны по времени и составляли приблизительно 5 мин. Исходные пробы венозной крови брались сразу перед интраназальным или ПК введением инсулина, и впоследствии кровь бралась в 0 (сразу перед воздействием), 15, 30, 45, 60, 90, 120 и 180 мин после введения. Между заборами крови у отдельных свиней было приблизительно 5 мин, этот интервал был выбран в соответствии со временем введения дозы с точностью до 1 мин. Каждая свинья наблюдалась при помощи переносного серийного глюкометра при каждом заборе крови для обеспечения хорошего состояния животных. Кровь собирали в стеклянные пробирки, содержавшие натриевую соль гепарина. Плазма отделялась и сохранялась при -20C до определения содержания инсулина, С-пептида и глюкозы. В течение 8 дней производилось воздействие с ежедневной обработкой каждой из 4 свиней. Свиней меняют перекрестным образом (два последовательных одинаковых латинских квадрата), причем на каждую свинью каждый день воздействовали по-разному, в соответствии со следующим расписанием: Расписание воздействия Забор проб и способы анализа Гепаринизированная плазма была исследована на предмет концентрации инсулина с применением серийного RIA анализа на инсулин (Lincj research, Inc.; Human Insulin Specific RIS Kit, Ca HI-14K). Инсулин представлен в микро Международных Единицах)/миллилитр плазмы (мкЕ/мл). С-пептид исследовался серийным набором, специализированным для свиного С-пептида (Linco research, Inc.; Porcine CPeptide RIA Kit, CatPCP-22K), и представлен в единицах нг/мл. Глюкоза измерялась во время забора крови с применением глюкометра (Lifescan (JJ) One TouchFast TakeTM) и в лаборатории с применением серийного ферментативного анализа (Sigma Diagnostics,Procedure 315) и измерялась в мг/дл. Отклонение от протокола Отклонений от протокола не было. Результаты по глюкозе Результаты показали хорошее снижение уровней глюкозы крови, что было измерено гексокиназным ферментативным способом в крови, и исторически сопоставимы с положительным контролем - ПК инсулином; ПК введением дозы достигался минимальный уровень глюкозы, в среднем, через 30 мин после-6 010885 введения препарата. Для интраназальной готовой формы В было показано превосходное глюкодинамическое снижение с более быстрым началом, с минимумом 15 мин или ранее, но с более короткой продолжительностью действия (90-120 мин), чем при ПК (180 мин). Готовая форма С обладала таким же быстрым началом действия, как В, но менее выраженным эффектом. Готовая форма D была лишена значимой глюкодинамической активности. Воспроизводимость была хорошей как впределах изменения доз,так и изо дня в день (без значительно различающихся расхождений для любого воздействия, Р 0,05) (см. фиг. 1). Ферментативный анализ на глюкозу хорошо коррелировал с соответствующими показаниями глюкометра, полученными во время забора крови (r=0,9575; р 0,0001). Результаты по инсулину Результаты показали хорошие уровни инсулина в крови для готовой формы А, при ПК положительном контроле, со средним уровнем достижения максимума на 15 мин со средним Смax 59,85 мкЕ/мл (см. фиг. 2). Готовая форма В показала более высокие уровни в крови, чем другие готовые формы, с достижением максимума через 15 мин со средним Смax 182,4 мкЕ/мл (см. фиг. 2). Готовая форма С показала более низкие уровни, чем А или В, указывая на сниженную доставку инсулина при физиологическом рН по сравнению с кислой формой, обладая Смax 64,59 мкЕ/мл (см. фиг. 2). Готовая форма D показала небольшое изменение по сравнению с ускоренными исходными уровнями. Смах не наблюдалось (см. фиг. 2). Результаты по С-пептиду С-Пептид для взятых непосредственно, необработанных животных (время ноль), в среднем, составляет 0,35 нг/мл (n=36). Начало действия четырех воздействий было таким же, как у соответствующих кривых, полученных для глюкодинамики. Обработка В обладала более быстрым началом снижения концентрации С-пептида, за ним следует А, затем С, затем D. Обработка А вызывала самое длительное снижение концентрации С-пептида, приблизительно на 3 ч, тогда как другие обработки имели через это время нормальные уровни, отражая восстановление продукции эндогенного инсулина. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция в форме, пригодной для назальной доставки пациенту, содержащая терапевтически эффективное количество инсулина, усилитель проницаемости и жидкий носитель,причем указанная композиция имеет кислое значение рН, но не более чем рН 4,5, и указанный усилитель проницаемости является усилителем Hsieh, имеющим следующую структуру: где X и Y представляют собой кислород, серу или иминогруппу структуры или =N-R, при условии, что когда Y представляет собой иминогруппу, то X является иминогруппой, а когда Y представляет собой серу, то X представляет собой серу или иминогруппу, А представляет собой группу, имеющую структуру где X и Y определены выше; m и n представляют собой целые числа, имеющие значения от 1 до 20,и сумма m+n не превышает 25; р представляет собой целое число, имеющее значение 0 или 1; q является целым числом, имеющим значение 0 или 1; r представляет собой целое число, имеющее значение 0 или 1, и каждая из групп R, R1, R2, R3, R4, R5 или R6 независимо является водородом или алкильной группой,имеющей от 1 до 6 атомов углерода, которая может представлять собой прямую или разветвленную цепь в том случае, если только одна из R1-R6 может являться алкильной группой, при условии, что, когда р, q и r имеют значение 0 и Y является кислородом, m+n составляет по меньшей мере 11, и при дополнительном условии, что когда X является иминогруппой, q равен 1, Y является кислородом и р и r имеют значение 0, то m+n составляет по меньшей мере 11. 2. Фармацевтическая композиция по п.1, в которой указанное кислое значение рН составляет от приблизительно 2 до приблизительно 4.-7 010885 3. Фармацевтическая композиция по любому из предшествующих пунктов, дополнительно содержащая ингибитор кристаллизации. 4. Фармацевтическая композиция по любому из предшествующих пунктов, которая представлена в форме эмульсии, в которой усилитель Hsieh эмульгирован в водной фазе, которая включает инсулин. 5. Фармацевтическая композиция по любому из предшествующих пунктов, в которой указанный усилитель Hsieh представляет собой макроциклический усилитель проницаемости. 6. Фармацевтическая композиция по любому из предшествующих пунктов, в которой указанный усилитель Hsieh представляет собой циклопентадекалактон или циклогексадеканон. 7. Фармацевтическая композиция по любому из предшествующих пунктов, в которой указанный усилитель проницаемости эмульгирован в указанной водной фазе поверхностно-активным веществом,имеющим гидрофильно-липофильный баланс (HLB) от приблизительно 7 до приблизительно 14. 8. Фармацевтическая композиция по любому из предшествующих пунктов, дополнительно включающая ингибитор кристаллизации, способный снижать температуру кристаллизации указанного усилителя проницаемости до температуры ниже приблизительно 25C. 9. Фармацевтическая композиция по п.8, в которой указанный ингибитор кристаллизации способен снижать температуру кристаллизации указанного усилителя проницаемости до температуры ниже приблизительно 5C. 10. Фармацевтическая композиция по п.9, в которой указанный ингибитор кристаллизации выбран из группы, состоящей из натуральных масел, маслянистых веществ, восков, сложных эфиров и углеводородов. 11.Фармацевтическая композиция по любому из пп.1-10 для использования в способе лечения пациента инсулином. 12. Продукт, включающий аппликатор назального спрея, интраназальное дозирующее спрей устройство или аэрозольный ингалятор, включающий фармацевтическую композицию по любому из пп.1-11.
МПК / Метки
МПК: A61K 38/00
Метки: композиции, инсулином, фармацевтические, способы, лечения
Код ссылки
<a href="https://eas.patents.su/9-10885-farmacevticheskie-kompozicii-i-sposoby-lecheniya-insulinom.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтические композиции и способы лечения инсулином</a>
Предыдущий патент: Дифторметилбензанилиды и их применение для борьбы с микроорганизмами, промежуточные соединения и их получение
Следующий патент: Фармацевтическая композиция, способ ее получения и ее применение для лечения респираторных заболеваний, фармацевтический продукт и его применение, набор
Случайный патент: Пакеты рулонов и способ их изготовления