Мостиковые инденопирролокарбазолы, фармацевтические композиции и способы лечения
Номер патента: 4066
Опубликовано: 25.12.2003
Авторы: Хадкинз Роберт Л., Сингх Джасбир, Малламо Джон П., Андерайнер Теодор Л., Трипатхи Рабиндранатх
Формула / Реферат
1. Инденопирролокарбазолы формулы II
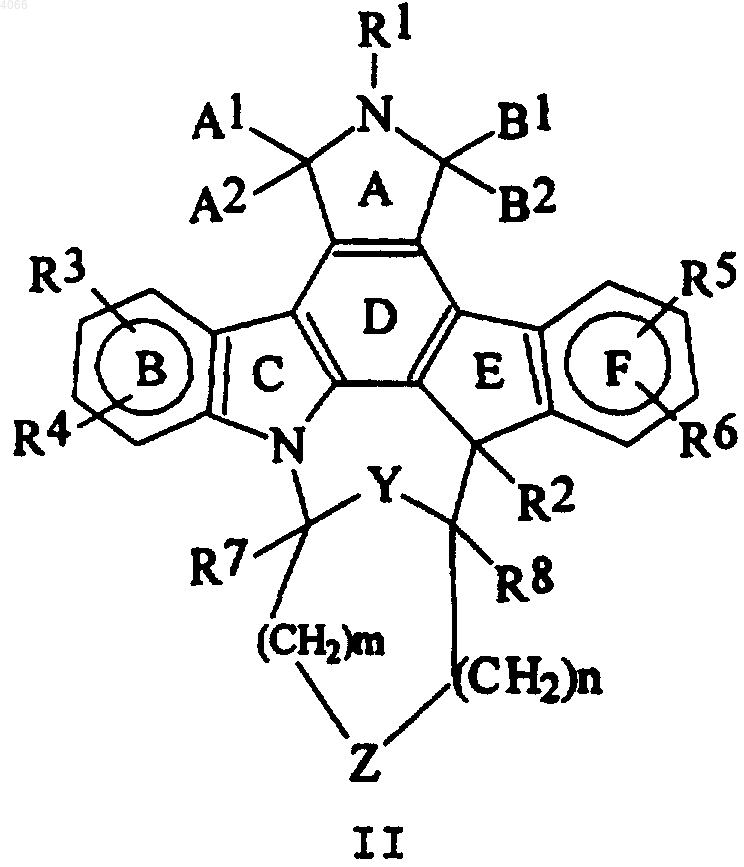
где R1, R4, R6, R7 представляют собой водород;
Y представляют собой O;
n представляет собой 1;
m представляет собой 1 или 2;
R2 представляет собой водород, OH или алкил, имеющий от 1 до 4 атомов углерода;
R3 представляет собой водород, галоген, C1-C4алкокси, 3-(3'-NH2-Ph);
R5 представляет собой водород, C1-C4алкокси;
R8 представляет собой водород, C1-C4алкил, CO2Et, CH2OH;
Z представляет собой связь или O.
A1 и A2, B1 и B2 выбраны из групп, состоящих из H и H или вместе образуют фрагмент =O;
2. Соединение по п.1, представленное диастереомерами формул
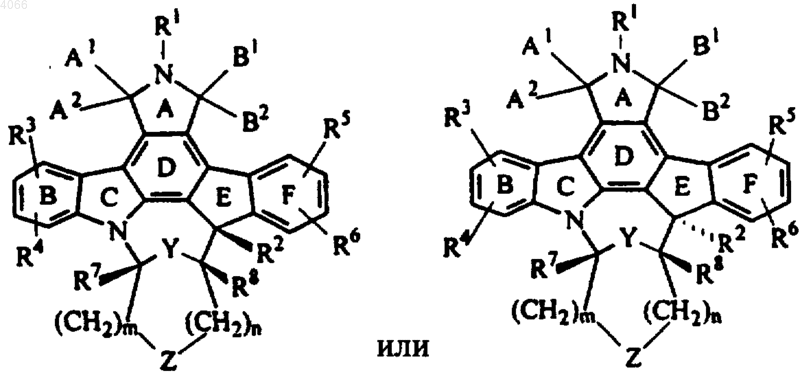
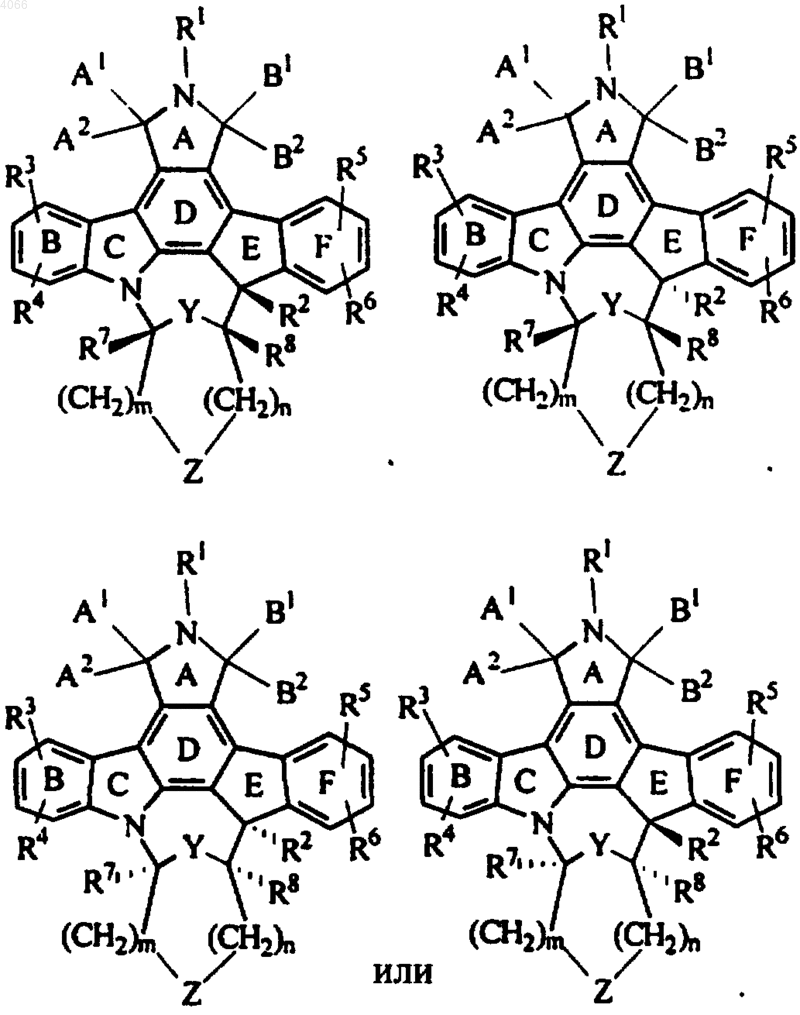
3. Соединение по п.2, представленное энантиомерами формул
4. Соединение по п.1, где R1 представляет собой H.
5. Соединение по п.1, где R2 представляет собой гидроксил или C1-C4алкил.
6. Соединение по п.1, имеющее формулу
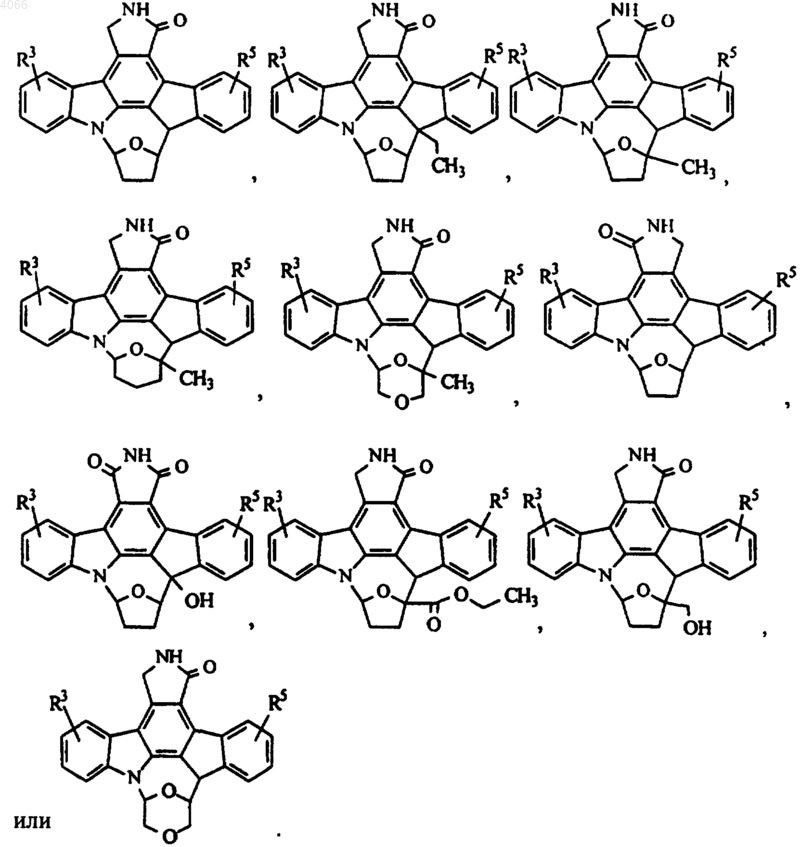
7. Соединение по п.1, имеющее формулу

8. Соединение по п.7, представленное энантиомерами формулы
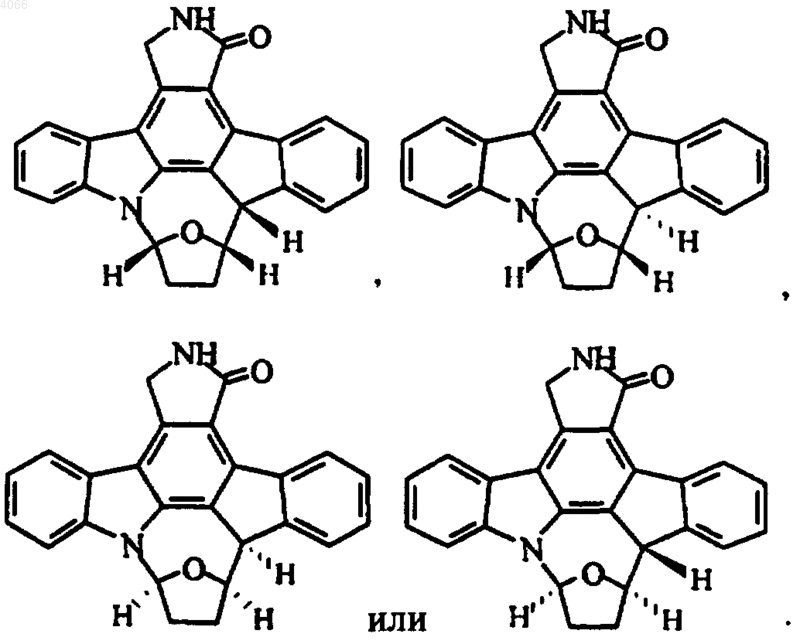
9. Соединение по п.8, представленное диастереомерами формулы

10. Фармацевтическая композиция, обладающая свойством ингибирования киназной trk активности, содержащая активное соединение по п.1 и фармацевтически приемлемый носитель.
11. Фармацевтическая композиция по п.10, содержащая соединение по п. 7 и фармацевтически приемлемый носитель.
12. Фармацевтическая композиция для лечения или предупреждения заболеваний простаты, содержащая соединение по п.1 и фармацевтически приемлемый носитель.
13. Фармацевтическая композиция по п.12, где заболеванием простаты является рак простаты или доброкачественная гиперплазия простаты.
14. Фармацевтическая композиция для лечения или профилактики ангиогенных заболеваний, содержащая соединение по п.1 и фармацевтически приемлемый носитель.
15. Фармацевтическая композиция по п.14, где ангиогенным заболеванием являются раковые твердые опухоли, эндометриоз, диабетическая ретинопатия, псориаз, гемангиобластома, заболевания глаз или дегенерация желтого пятна (макулярная дегенерация).
16. Фармацевтическая композиция для лечения или профилактики неоплазии, ревматоидного артрита, фиброза легкого, миелофиброза, патологического заживления ран, атеросклероза или рестеноза, содержащая соединение по п.1 и фармацевтически приемлемый носитель.
17. Фармацевтическая композиция для лечения или профилактики болезни Альцгеймера, амиотрофического латерального склероза, болезни Паркинсона, инсульта, ишемии, болезни Хантингтона, деменции при ВИЧ, эпилепсии, множественного (рассеянного) склероза, периферической невропатии или поражений мозга или спинного мозга, содержащая соединение по п.1 и фармацевтически приемлемый носитель.
18. Способ ингибирования киназной активности trk, включающий доставку соединения по п.1 в количестве, достаточном для получения результата в виде эффективного ингибирования.
19. Способ по п.18, где киназа trk представляет собой trk A.
20. Способ по п.18, где соединение по п.1 вводят для лечения воспаления.
21. Способ лечения или профилактики заболеваний простаты, включающий назначение нуждающемуся в данном лечении или профилактике больному терапевтически эффективного количества соединения по п.1.
22. Способ по п.21, где заболеванием простаты является рак простаты или доброкачественная гиперплазия простаты.
23. Способ лечения или профилактики ангиогенных заболеваний, включающий назначение нуждающемуся в данном лечении или профилактике больному терапевтически эффективного количества соединения по п.1.
24. Способ по п.23, где ангиогенным заболеванием являются раковые твердые опухоли, эндометриоз, диабетическая ретинопатия, псориаз, гемангиобластома, заболевания глаз или дегенерация желтого пятна.
25. Способ лечения или профилактики заболеваний, при котором активность PDGFR способствует патологическому состоянию, включающий доставку соединения по п.1 в количестве, достаточном для того, чтобы обеспечить контакт рецептора фактора роста из тромбоцитов (PDGFR) с ингибирующим эффективным количеством соединения.
26. Способ лечения или профилактики неоплазии, ревматоидного артрита, фиброза легкого, миелофиброза, патологического заживления ран, атеросклероза или рестеноза, включающий назначение больному, нуждающемуся в подобном лечении или профилактике, терапевтически эффективного количества соединения по п.1.
27. Способ лечения или профилактики заболеваний, характеризующихся аберрантой активностью клеток, реагирующих на трофический фактор, включающий доставку соединения по п.1 в количестве, достаточном для обеспечения контакта рецептора трофического фактора клеток с эффективным индуцирующим активность количеством соединения.
28. Способ лечения или профилактики болезни Альцгеймера, амиотрофического латерального склероза, болезни Паркинсона, инсульта, ишемии, болезни Хантингтона, деменции при ВИЧ, эпилепсии, множественного (рассеянного) склероза, периферической невропатии или поражений мозга или спинного мозга, включающий назначение больному, нуждающемуся в подобном лечении или профилактике, терапевтически эффективного количества соединения по п.1.
Текст
1 Область изобретения Настоящее изобретение относится к новым конденсированным арильным и гетероарильным мостиковым инденопирролокарбазолам, которые здесь называются "мостиковые инденопирролокарбазолы". Данное изобретение также относится к способам получения и использования мостиковых инденопирролокарбазолов. Обоснование изобретения Вещество, являющееся микробным производным и называемое "K-252 а", представляет собой уникальное соединение, которому за последние несколько лет уделялось большое внимание из-за большого количества различных видов функциональных активностей, которыми оно обладает. K-252 а представляет собой индолокарбазольный алкалоид, который первоначально выделили из культуры Nocardiosis sp.(Kase, H. et al., 39 J. Antibiotics 1059, 1986). K252 а является ингибитором нескольких ферментов, включающих протеинкиназу С (РКС), которая играет центральную роль в регулировании клеточных функций, и trk тирозинкиназу. Представленные в литературе виды функциональной активности K-252 а и его производных многочисленны и разнообразны: подавление опухолей(смотри патент США 4735939); лечение воспалений (смотри патент США 4816450); лечение заболеваний, связанных с нейрональными клетками (смотри патент США 5461146,5621100, 5621101; и WIPO публикацию WO 94/02488, опубликованную 3 февраля 1994 года на имя Cephalon, Inc. and Kyowa Hakko Kogyo(смотри патент США 5516771 и 5654427). Также имеются сообщения, что K-252 а подавляет продукцию IL-2 (смотри Grove, D.S. et al.,Experimental Cell Research 193: 175-182, 1991). Для описанных индолокарбазолов характерны несколько общих черт. В частности, каждый из них содержит три пятичленных кольца, и все включают азотный фрагмент; кроме того, и стауроспорин (производное Streptomyces sp.), иK-252 а содержат фрагмент сахара, связанный двумя N-гликозидными связями. Как K-252 а,так и стауроспорин широко изучались с точки зрения их применения в качестве терапевтических агентов. Индолокарбазолы обычно являются липофильными, что способствует сравнительной легкости их перехода через биологические мембраны и, в отличие от белковых веществ, они обладают более длительным периодом полужизни in vivo. Хотя K-252 а обычно выделяют из культуральной среды посредством ферментативного процесса, осуществлен общий синтез природных (+) изомеров и неприродных (-) изомеров, в которых три хиральных атома углерода сахара имеют противоположные конфигурации (смот 004066 2 ри Wood et al., J. Am. Chem. Soc. 117: 10413,1995 и WIPO публикация WO 97/07081). Однако эти способы синтеза неудобны для практического применения при коммерческом использовании. Кроме индолокарбазольных алкалоидов,представленных K-252 а и стауроспорином, получены синтетические небольшие органические молекулы, которые являются биологически активными и известны как конденсированные пирролокарбазолы (смотри патент США 5475110, 5591855, 5594009, 5705511 и 5616724). Также известны конденсированные изоиндолоны, которые представляют собой молекулы, не содержащие индол, и которые могут быть химически синтезированы de novo (смотриWIPO публикацию WO 97/21677). Также имеются сообщения об определенных макроциклических производных бисиндолилмалеимидов (смотри, например патент США 5710145, 5672618, 5552396 и 5545636). Также сообщается о индолопирролокарбазолах производных сахаров (смотри WIPO публикацию WO 98/07433). При этом остается потребность в новых пирролокарбазольных производных, обладающих полезными свойствами. На этот и на другие важные аспекты и направлено настоящее изобретение. Описание сущности изобретения Настоящее изобретение направлено на новые конденсированные арильные и гетероарильные мостиковые инденопирролокарбазолы,которые здесь называются "мостиковые инденопирролокарбазолы". Представительные соединения данного изобретения имеют общую формулу I Составляющие ее члены и предпочтительные варианты осуществления далее раскрыты подробно. Эти соединения, наряду с прочим,пригодны для усиления активности, индуцированной трофическим фактором в клетках, реагирующих на трофический фактор, как, например, в холинергических нейронах, и могут также функционировать как агенты, способствующие выживанию других видов нейрональных клеток, например, допаминергических и глютаматергических, и вследствие этого являются полезными фармакологическими и терапевтическими агентами. Настоящие соединения также 3 пригодны в лечении заболеваний, связанных со снижением ChAT активности или гибелью или поражением мотонейронов спинного мозга, и также полезны при болезнях, связанных с апоптотической гибелью клеток периферической и центральной нервных систем, иммунной системы и при воспалительных заболеваниях. Определенные описанные здесь мостиковые инденопирролокарбазольные соединения также могут найти применение в лечении болезненных состояний, включающих злокачественную пролиферацию клеток, таких как рак. Также раскрываются композиции, содержащие данные соединение, и способы использования представленных соединений. Также раскрываются методики получения настоящих мостиковых инденопирролокарбазолов. Другие удобные способы получения станут очевидны для специалистов в данной области техники после ознакомления с настоящим описанием. Эти и другие особенности соединений настоящего изобретения ниже представлены более подробно. Краткое описание рисунков Фиг. 1 представляет собой схематичное изображение, показывающее общий способ получения мостиковых инденопирролокарбазолов. Фиг. 2 представляет собой схематичное изображение, показывающее общий способ получения мостиковых инденопирролокарбазолов. Фиг. 3 представляет собой схематичное изображение, показывающее общий способ получения связанных со смолой инденопирролокарбазолов. Фиг. 4 представляет собой схематичное изображение, показывающее получение защищенных, растворимых инденопирролокарбазолов. Фиг. 5 представляет собой схематичное изображение, показывающее получение промежуточного вещества V. Фиг. 6 представляет собой схематичное изображение, показывающее получение мостиковых инденопирролокарбазолов с использованием способа А. Фиг. 7 представляет собой схематичное изображение, показывающее получение мостиковых инденопирролокарбазолов с использованием способа В. Фиг. 8 представляет собой схематичное изображение, показывающее получение замещенных по кольцу В мостиковых инденопирролокарбазолов . Фиг. 9 представляет собой схематичное изображение, показывающее получение производных Е кольца мостиковых инденопирролокарбазолов . Подробное описание Раскрытые здесь соединения представляют собой мостиковые инденопирролокарбазолы,представленные формулой I где кольцо В и кольцо F, независимо друг от друга и каждое вместе с атомами углерода, с которыми оно связано, выбрано из группы, состоящей из а) ненасыщенного 6-членного карбоциклического ароматического кольца, в котором от 1 до 3 атомов углерода могут быть заменены атомами азота;b) ненасыщенного 5-членого карбоциклического ароматического кольца иc) ненасыщенного 5-членного карбоциклического ароматического кольца, в котором либо 1) один атом углерода заменен атомом кислорода, азота или серы; 2) два атома углерода заменены атомом серы и азота, атомом кислорода и азота или двумя атомами азота, либо 3) три атома углерода заменены тремя атомами азота;R1 выбран из группы, состоящей из а) Н, замещенного или незамещенного алкила, имеющего от 1 до 4 атомов углерода, замещенного или незамещенного арила, замещенного или незамещенного арилалкила, замещенного или незамещенного гетероарила или замещенного или незамещенного гетероарилалкила;d) -C(=О)NH2, NR11R12, -(CH2)pNR11R12,-(CH2)pOR10, -O(CH2)pOR10 и -O(CH2)pNR11R12,где р принимает значения от 1 до 4 и где либо 1) R11 и R12 каждый независимо друг от друга выбран из группы, состоящей из Н, алкила, имеющего от 1 до 4 атомов углерода, либо 2) R11 и R12 вместе образуют связывающую группу формулы -(СН 2)2-Х 1-(СН 2)2-, где X1 выбран из группы, состоящей из -О-, -S- и -СН 2-;R2 выбран из группы, состоящей из Н, алкила, имеющего от 1 до 4 атомов углерода, -ОН,алкокси, имеющего от 1 до 4 атомов углерода,-OC(=)R9, -OC(=O)NR11R12, -O(CH2)pNR11R12,-О(СН 2)рОR10, замещенного или незамещенного арилалкила, имеющего от 6 до 10 атомов углерода, замещенного или незамещенного гетероарилалкила;R3, R4, R5 и R6 каждый независимо выбран из группы, состоящей изa) Н, арила, гетероарила, F, Cl, Br, I, -CN, CF3,-NO2, -ОН, -OR9, -O(CH2)pNR11R12, -OC(=O)R9,-ОС(=O)NR2R7, -OC(=O)NR11R12, -O(CH2)pOR10,-CH2OR10, -NR11R12, -NR10S(=O)2R9, -NR10C(=O)R9,b) -CH2OR14, где R14 представляет собой остаток аминокислоты после удаления гидроксильной группы карбоксильной группы;e) алкил, имеющий от 1 до 8 атомов углерода, алкенил, имеющий от 2 до 8 атомов углерода, и алкинил, имеющий от 2 до 8 атомов углерода, где 1) каждая алкильная, алкенильная или алкинильная группа является незамещенной или 2) каждая алкильная, алкенильная или алкинильная группа является замещенной 1-3 группами, выбранными из группы, состоящей из арила, имеющего от 6 до 10 атомов углерода, гетероарила, арилалкокси, гетероциклоалкокси, гидроксиалкокси, алкилокси-алкокси,гидроксиалкилтио, алкоксиалкилтио, F, Cl, Br, I,-CN, -NO2, ОН, -OR9, -X2(CH2)pNR11R12,-X2(CH2)pC(=O)NR11R12, -X2(CH2)pOC(=O)NR11R12,-X2(CH2)pCO2R9,-X2(СН 2)pS(O)yR9,2 10 11 12-P(=O)(OR )2, -OR и моносахарида, имеющего от 5 до 7 атомов углерода, где каждая гидроксильная группа моносахарида независимо друг от друга или является незамещенной, или заменена на Н, алкил, имеющий от 1 до 4 атомов углерода, алкилкарбонилокси, имеющий от 2 до 5 атомов углерода, или алкокси, имеющий от 1 до 4 атомов углерода;R7 и R8 независимо друг от друга выбирают из группы, состоящей из Н, алкила, имеющего от 1 до 4 атомов углерода, алкокси, имеющего от 1 до 4 атомов углерода, замещенного или незамещенного арилалкила, имеющего от 6 до 10 атомов углерода, замещенного или незамещенного гетероарилалкила,-(CH2)pOR10,11 12 11 12-(CH2)pOC(=O)NR R и -(CH2)pNR R ; или R7 и R8 вместе образуют связывающую группу формулы -CH2-X3-CH2-, где X3 представляет собой X2 или связь;m и n независимо друг от друга представляют собой 0, 1 или 2;R15 и R16 независимо друг от друга выбраны из группы, состоящей из Н, -ОН, -C(=O)R10,-O(C=O)R9, гидроксиалкила и -CO2R10;R17 выбран из группы, состоящей из Н, алкила, арила и гетероарила; А 1 и А 2 выбраны из групп, состоящих из Н и Н; Н и OR2; Н и -SR2; Н и -N(R2)2; и группы,где А 1 и А 2 вместе образуют фрагмент, выбранный из группы, состоящей из =O, =S и =NR2; В 1 и В 2 выбраны из групп, состоящих из Н и Н; Н и -OR2; Н и -SR2; H, -N(R2)2; и группы,где В 1 и В 2 вместе образуют фрагмент, выбранный из группы, состоящей из =O, =S и =NR2; при условии, что по крайней мере одна из пар А 1 и А 2 или В 1 и В 2 образуют =O. Соединения данного изобретения включают все диастереомеры и энантиомеры относительно атома углерода, к которому присоединяются заместители R2, R7 и R8. Предпочтительные мостиковые инденопирролокарбазолы представлены следующей формулой: В некоторых предпочтительных воплощениях соединений формулы II, соединения представлены диастереомерами формулы В других предпочтительных воплощениях соединений формулы II эти соединения представлены энантиомерами формул или В некоторых предпочтительных воплощениях соединений формул I и II R1 представляет собой Н. В других предпочтительных воплощениях R2 представляет собой Н, гидроксил или замещенный или незамещенный алкил. В других предпочтительных воплощенияхR3, R4, R5 и R6 независимо друг от друга представляют собой Н, замещенный или незамещенный алкил, галоген, замещенный или незамещенный алкокси, замещенный или незамещенный амино или замещенный или незамещенный арил. В других предпочтительных воплощенияхR7 и R8 независимо друг от друга представляют собой Н или замещенный или незамещенный алкил. В некоторых предпочтительных воплощениях Y представляет собой О. В других предпочтительных воплощениях Z представляет собой связь, О, S или замещенный или незамещенный N. Еще в одних предпочтительных воплощениях тип независимо друг от друга представляют собой 1 или 2. В некоторых особенно предпочтительных воплощениях Y представляет собой О, Z представляет собой связь или О, и m и n независимо друг от друга равны 1 или 2. В других предпочтительных воплощениях А 1A2 и В 1B2 независимо друг от друга представляют =O или Н и Н. В некоторых особенно предпочтительных воплощениях каждый R1, R4, R6 и R7 представляет собой Н, Y представляет собой =O, n равно 1, А 1 А 2 и В 1 В 2 представляют собой =O или Н и Н, R2 представляет собой Н, ОН или низший алкил, R3 представляет собой Н или замещенный алкил, каждый R5 и R6 представляет собой алкокси, причем предпочтительным является метокси, Z представляет собой связь или О, и m равно 1 или 2. В других предпочтительных воплощениях соединения формулы II имеют формулыR3 и R5 каждый независимо друг от друга выбран из групп, состоящих из а) Н, гетероарила, F, Br, -CN, CF3, -NO2,-ОН, -OR9, -O(CH2)pNR11R12, -OC(=O)R9,-OC(=O)NR2R7, -ОС(=O)NR11R12, -O(CH2)pOR10,-CH2OR10,-NR11R12,-NR10S(=O)2R9,10 9e) алкила, имеющего от 1 до 8 атомов углерода, алкенила, имеющего от 2 до 8 атомов углерода, и алкинила, имеющего от 2 до 8 атомов углерода, где 1) каждая алкильная, алкенильная или алкинильная группа является незамещенной или 2) каждая алкильная, алкенильная или алкинильная группа является замещенной 1-3 группами, выбранными из арила, имеющего от 6 до 10 атомов углерода, гетероарила, аралалкокси, гетероциклоалкокси, гидроксиалкокси, алкилоксиалкокси, гидроксиалкилтио, алкоксиалкилтио, F, Cl, Br, I, -CN, -NO2, -ОН, -OR9,-X2(CH2)pNR11R12,-X2(CH2)pC(=O)NR11R12,2 11 12-X (CH2)pS(O)yR , -X (CH2)pNR10C(=O)NR11R12,-OC(=O)R9, -OCONHR2, -O-тетрагидропиранила, -NR11R12, -NR10C(=O)R9, -NR10CO2R9,-NR10C(=O)NR11R12,-NHC(=NH)NH2,NR10S(O)2R9, -S(O)yR9, -CO2R2, -C(=O)NR11R12,-C(=O)R2, -CH2OR10, -CH=NR9, -S(=O)2NR2R2A,-OR14, и моносахарида, имеющего от 5 до 7 атомов углерода, где каждая гидроксильная группа моносахарида независимо друг от друга или является ненасыщенной, или заменена на Н,алкил, имеющий от 1 до 4 атомов углерода, ал 9 килкарбонилокси, имеющий от 2 до 5 атомов углерода, или алкокси, имеющий от 1 до 4 атомов углерода. В еще более предпочтительном воплощении R5 независимо выбран из группы, состоящей из Н, -OR9, -О(CH2)pNR11R12, -OC(=O)R9,-OC(=O)NR2R7, -OC(=O)NR11R12, -O(CH2)pOR10,-CH2OR10,-NR11R12,-NR10S(=O)2R9,10 9 11 12-NR C(=O)R , -C(=O)NR R , -(CH2)pNR11R12,-S(O)yR2, -(CH2)pS(O)yR9 и -СН 2S(O)уR14, где Y равен 0, 1 или 2. Некоторые особенно предпочтительные воплощения соединений формулы II представляют собой II-1, II-1b, II-2, II-3, II-4a, II-4b, II-5,II-6, II-7a, II-7b, II-8, II-9, II-10, II-11, II-12, II-13,II-14a, II-14b, II-15, II-16a и II-16b, структуры которых проведены ниже в табл. 8. Некоторые предпочтительные хирально специфические воплощения соединений из группы соединений формулы II приведены в табл. 9. В других вариантах осуществления настоящее изобретение предлагает фармацевтические композиции, включающие соединения формулы I или формулы II и фармацевтически приемлемый носитель. В случае определенных предпочтительных фармацевтических композиций композиция предназначена для ингибирования одного или большего количества видов активности trk киназы, активности VEGFR киназы или активности PDGFR, причем композиция включает соединение формулы I и фармацевтически приемлемый носитель. В других фармацевтически приемлемых композициях, композиция предназначена для усиления активности трофического фактора или активности ChAT спинного мозга,причем композиция включает соединение формулы I и фармацевтически приемлемый носитель. В другом варианте предпочтительной фармацевтической композиции эта композиция предназначена для лечения или предупреждения заболеваний простаты, таких как рак простаты или доброкачественная гиперплазия простаты. В других предпочтительных фармацевтических композициях, композиция предназначена для лечения или предупреждения ангиогенных заболеваний, таких как раковые твердые опухоли,эндометриоз, диабетическая ретинопатия, псориаз, гемангиобластома, заболевания глаз или макулярная дегенерация (дегенерация желтого пятна). В случае других предпочтительных фармацевтических композициях, эта композиция предназначена для лечения или предупреждения неоплазии, ревматоидного артрита, фиброза легкого, миелофиброза, аномального заживления ран, атеросклероза или рестеноза. В других предпочтительных фармацевтических композициях эта композиция предназначена для лечения или предупреждения болезни Альцгеймера, амиотрофического латерального склероза,болезни Паркинсона, инсульта, ишемической 10 болезни, болезни Хантингтона, деменции при ВИЧ, эпилепсии, множественного склероза, периферической невропатии или поражении мозга или спинного мозга. В других воплощениях настоящее изобретение предлагает способ ингибирования активности trk киназы, включающий доставку (введение) соединения формулы I в количестве, достаточном для получения результата в виде эффективного ингибирования. В предпочтительном воплощении соединение формулы I предназначено для лечения воспалительных заболеваний. В другом предпочтительном воплощении рецептор trk киназы представляет собой trk А. В других воплощениях настоящее изобретение предлагает способ лечения или предупреждения заболеваний простаты, который включает введение больному, нуждающемуся в подобном лечении или профилактике, терапевтически эффективного количества соединения формулы I. В предпочтительном воплощении заболевание простаты представляет собой рак простаты или доброкачественную гиперплазию простаты. В других воплощениях настоящее изобретение предлагает способ лечения или предупреждения ангиогенных заболеваний, при которых активность VEGFR киназы способствует развитию патологических состояний, включающий применение соединения формулы I в количестве, достаточном для получения результата в виде контакта рецептора фактора роста сосудистого эндотелия с соединением в количестве, эффективном для его ингибирования. В другом воплощении настоящее изобретение предлагает способ лечения или предупреждения ангиогенных заболеваний, который включает применение больным, нуждающимся в подобном лечении или предупреждении, терапевтически эффективного количества соединения формулы I. В предпочтительном воплощении ангиогенное заболевание представляет собой раковую твердую опухоль, макулярную дегенерацию, эндометриоз, диабетическую ретинопатию, псориаз или гемангиобластому. В других воплощениях настоящее изобретение предлагает способ лечения или предупреждения заболеваний, при которых активностьPDGFR способствует развитию патологического состояния, включающий применение соединения формулы I в количестве, достаточном для получения результата в виде контакта рецептора фактора роста тромбоцита с соединением в количестве, эффективном для его ингибирования. В другом воплощении настоящее изобретение предлагает способ лечения или предотвращения различных патологических состояний, который включает введение больным, нуждающимся в подобном лечении или профилактике, терапевтически эффективного количества соединения формулы I. В предпочтительном воплощении заболевание представляет собой неоплазию, 11 ревматоидный артрит, фиброз легкого, миелофиброз, патологическое заживление ран, атеросклероз и рестеноз. В других воплощениях настоящее изобретение предлагает способ лечения заболеваний,характеризующихся аберрантной активностью клеток, ответственных за трофический фактор,включающий применение соединения формулыI в количестве, достаточном для получения контакта рецептора трофического фактора клеток с соединением в количестве, эффективном для его ингибирования. В предпочтительных воплощениях активность клеток, реагирующих на трофический фактор, представляет собой активность ChAT. В другом воплощении настоящее изобретение предлагает способ лечения или предупреждения болезни Альцгеймера, амиотрофического латерального склероза, болезни Паркинсона, инсульта, ишемической болезни,болезни Хантингтона, деменции при ВИЧ, эпилепсии, мышечного склероза, периферической невропатии или поражении мозга или спинного мозга, который включает применение больным,нуждающимся в подобном лечении или профилактике, терапевтически эффективного количества соединения формулы I. Соединения настоящего изобретения включают все диастереомеры и энантиомеры. Соединения формулы (I) также называются здесь, как соединение (I), что относится и к соединениям формул с другими номерами. При использовании здесь термин "карбоциклический" относится к циклическим группам, в которых кольцевую часть образуют только атомы углерода. Термин "гетероцикло" и"гетероциклический" относится к циклическим группам, в которых кольцевая часть включает по крайней мере один гетероатом, такой как О,N или S. При использовании здесь термин "алкил" означает алкильную группу с прямой цепью,циклическую или с разветвленной цепью,имеющую от 1 до 8 атомов углерода, таких как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изоамил,неопентил, 1-этилпропил, гексил, октил, циклопропил и циклопентил. Алкильный фрагмент алкил-содержащей группы, такой как алкокси,алкоксикарбонильная и алкиламинокарбонильная группы, может быть таким же, как определено выше для алкила. Низшие алкильные группы, являющиеся предпочтительными, представляют собой такие алкильные группы, которые определены выше, и которые содержат от 1 до 4 атомов углерода. Следует понимать, что термин "алкенил" включает прямые или разветвленные углеводородные цепи, имеющие по крайней мере одну углерод-углеродную двойную связь. Примеры алкенильных групп включают этенильные и пропенильные группы. Следует понимать, что при использовании здесь термин "алкинил" включает прямые или раз 004066 12 ветвленные углеводородные цепи, имеющие по крайней мере одну углерод-углеродную тройную связь. Примеры алкинильных групп включают этинильную или пропенильную группы. Ацильный фрагмент ацил-содержащих групп, таких как ацилокси группы, включает алканоильную группу с прямой или разветвленной цепью, имеющую от 1 до 6 атомов углерода, такую как формил, ацетил, пропаноил, бутирил, валерил, пивалоил или гексаноил. При использовании здесь термин "арил" означает группу, имеющую от 6 до 12 атомов углерода, таких как фенил, бифенил и нафтил. Предпочтительные арильные группы включают незамещенные или замещенные фенильные и нафтильные группы. При использовании здесь термин "гетероарил" обозначает арильную группу, в которой один или большее количество кольцевых атомов углерода заменены на гетеро(то есть не углеродные) атомы, такие как О, N или S. Предпочтительные гетероарильные группы включают пиридильную, пиримидильную,пирролильную, фурильную, тиенильную, имидазолильную, триазолильную, тетразолильную,хинолильную, изохинолильную, бензоимидазолильную, тиазолильную, пиразолильную и бензотиазолильную группы. Следует понимать, что термин "аралкил"(или "арилалкил") обозначает группу, имеющую от 7 до 15 атомов углерода, состоящую из алкильной группы, которая несет арильную группу. Примеры аралкильных групп включают бензильную, фенетильную, бензгидрильную и нафтилметильную группы. Алкильные группы и алкильные фрагменты, содержащиеся в ряду групп-заместителей, таких как аралкильная,алкокси, арилалкокси, гидроксиалкокси, алкоксиалкокси, гидроксиалкилтио, алкоксиалкилтио,алкилкарбонилокси, гидроксиалкильная и ацилокси группы, могут быть замещенными или незамещенными. Замещенная алкильная группа имеет от 1 до 3 независимо выбранных заместителей, предпочтительно гидрокси, низший алкокси, низший алкоксиалкокси, замещенный или незамещенный арилалкоксинизший алкокси, замещенный или незамещенный гетероарилалкоксинизший алкокси, замещенный или незамещенный арилалкокси, замещенный или незамещенный гетероциклоалкокси, галоген, карбоксил, низший алкоксикарбонил, нитро, амино,моно- или ди-низший алкиламино, диоксолан,диоксан, дитиолан, дитион, фуран, лактон или лактам. Замещенная арильная, замещенная гетероарильная и замещенная аралкильная группы имеют каждая от 1 до 3 независимо выбранных заместителей, которые предпочтительно представляют собой низший алкил, гидрокси, низший алкокси, карбокси, низший алкоксикарбонил, нитро, амино, моно- или ди-низший алкиламино и галоген."Гидроксиалкильные" группы представляют собой алкильные группы, которые имеют приведенную здесь гидроксильную группу. Галогены включают фтор, хлор, бром и йод. При использовании здесь термин "гетероарилалкил" обозначает арилалкильную группу,которая содержит гетероатом. Термин "окси" указывает на присутствие атома кислорода. Так"алкокси" группы представляют собой алкильные группы, которые присоединены через атом кислорода, и "карбонилокси" группы представляют собой карбонильные группы, которые присоединены через атом кислорода . Термин "гетероциклоалкокси" обозначает алкокси группу, которая имеет гетероциклогруппу, присоединенную к алкильному фрагменту, и термин "арилалкокси" обозначает алкокси группу, которая имеет арильную группу,присоединенную к алкильному фрагменту. Термин "алкилкарбонилокси" обозначает группу формулы -О-С(=О)-алкил. При использовании здесь термин "алкилокси-алкокси" обозначает алкокси группу, которая содержит алкилокси заместитель, присоединенный к ее алкильному фрагменту. Термин(то есть группу формулы -S-алкил), которая содержит алкокси заместитель, присоединенный к ее алкильному фрагменту. Термин "гидроксиалкилтио" обозначает группу алкилтио (то есть группу формулы -S-алкил), которая содержит гидрокси заместитель, присоединенный к ее алкильному фрагменту. При использовании здесь термин "моносахарид" имеет свое общепринятое значение, а именно - простой сахар. При использовании здесь термин "аминокислота" обозначает молекулу, содержащую как аминогруппу, так и карбоксильную группу. Воплощения аминокислот включают -аминокислоты; то есть, карбоновые кислоты общей формулы HOOC-CH(NH2)-(боковая цепь). Боковые цепи аминокислот включают фрагменты природного и неприродного происхождения. Боковые цепи аминокислот неприродного происхождения (то есть не естественного) представляют собой такие фрагменты,которые используются вместо природных боковых цепей аминокислот, например, в аналогах аминокислот. Смотри, например, Lehninger, 004066Biochemistry, Second Edition, Worth Publishers,Inc, 1975, pages 73-75, включенный здесь в качестве ссылки. Предпочтительные -аминокислоты включают глицин, аланин, пролин, глютаминовую кислоту и лизин, имеющий D-конфигурацию, Lконфигурацию или в виде рацемата. Боковые цепи представленных далее характерных -аминокислот показаны ниже в табл. 1. Таблица 1 В некоторых предпочтительных воплощениях группы-заместители для соединений формул I и II включают остаток аминокислоты после удаления гидроксильного фрагмента ее карбоксильной группы; то есть группы формулы-С(=O-СН(NH2 - (боковая цепь). Функциональные группы, присутствующие на соединении формулы I, могут содержать защитные группы. Например, аминокислотные заместители боковой цепи соединения формулыI могут быть замещены защитной группой, такой как бензилоксикарбонильная или третбутоксикарбонильная группы. Защитные группы известны per se, как химические функциональные группы, которые могут быть избирательно присоединены или удалены с функционально активных групп, таких как гидроксильные группы и карбоксильные группы. Эти группы присутствуют в химических соединениях,чтобы обеспечить функциональную инертность к условиям химической реакции, которым подвергается данное соединение. В настоящем изобретении может быть использована любая из разнообразных защитных групп. Одной такой защитной группой является бензилоксикарбонилиная (Cbz; Z) группа. В соответствии с настоящим изобретением другие предпочтительные защитные группы можно найти у Green,T.W. and Wuts, P.G.M., "Protective Groups in Organic Synthesis" 2d. Ed., WileySons, 1991. Мостиковые инденопирролокарбазольные соединения обладают очевидными важными 15 видами функциональной фармакологической активности, которая находит применение в различных областях, включая как исследовательскую, так и лечебную области. Эти производные пригодны в качестве терапевтических агентов. Активность данных соединений демонстрирует положительное влияние на функцию и/или выживание клеток, реагирующих на трофический фактор. Влияние на функционирование и/или выживание клеток, реагирующих на трофический фактор, например, клеток нейронного происхождения, продемонстрировано с использованием следующих анализов: (1) тест с холинацетилтрансферазой культуры спинного мозга("ChAT"); или тест активности нейронного СhАТ культуры базального переднего мозга. При использовании здесь термин "эффект", когда он используется для определения термина "функция" и "выживание" означает положительное или отрицательное изменение или перемену. Эффект, который является положительным, может здесь относиться к "повышению" или "усилению", и эффект, который является отрицательным, может относится к"подавлению" или "снижению". При использовании здесь термин "усиливать" или "усиление", когда используется для определения термина "функция" или "выживание" означает, что присутствие мостикового инденопирролокарбазольного соединения имеет положительный эффект на функцию и/или выживание клеток, реагирующих на трофический фактор, по сравнению с клетками в отсутствии соединения. Для примера, не ограничиваясь этом, если рассматривать выживание, например,холинергических нейронов, соединение будет явно повышать выживание популяции холинергических нейронов при риске их гибели (вследствие, например, ранения, болезненного состояния, дегенеративных условий или естественных процессов) по сравнению с популяцией холинергических нейронов при отсутствии подобного соединения, если обработанная популяция имеет относительно более длительный период функционирования, чем необработанная популяция. При использовании здесь термин "подавлять" и "подавление" означает, что специфический ответ указанного объекта (например, ферментативная активность) относительно снижается в присутствии мостикового инденопирролокарбазольного соединения. При использовании здесь термин "trk" относится к семейству нейротрофических рецепторов с высокой афинностью, включающему trk А, trk В и trk С, и другие связанные с мембраной белки, с которыми может связываться нейротрофин. При использовании здесь подавлениеVEGFR означает возможность применения, например, в заболеваниях, в которых ангиогенез играет важную роль, таких как раковые твердые 16 опухоли, эндометриоз, диабетическая ретинопатия, псориаз, гемангиобластома, а также глазные заболевания и рак. Подавление trk означает возможность применения при, например, заболеваниях простаты, таких как рак простаты и доброкачественная гиперплазия простаты, и при лечении воспалительных болей. Подавление рецептора фактора роста из тромбоцитов (PDGFR) означает возможность применения при, например, различных формах неоплазии, ревматоидном артрите, фиброзе легкого, миелофиброзе, патологическом заживлении ран, кардиоваскулярных нарушениях, таких как атеросклероз, рестеноз, постангиопластический рестеноз и т.д. При использовании здесь термин "рак" и"раковый" относится к любой злокачественно пролиферации клеток у млекопитающих. Примеры включают рак простаты, доброкачественную гиперплазию простаты, рак яичника, молочной железы, мозга, легкого, поджелудочной железы, тонкого кишечника и прямой кишки,желудка, твердые опухоли, рак области головы и шеи, нейробластому, почечную клеточную карциному, лимфому, лейкемию, другие известные злокачественные разрастания гемопоэтической системы, и другие известные раковые заболевания. При использовании здесь термины "нейрон", "клетки нейронного (нейронального) происхождения" и "нейронные клетки" включают,не ограничиваясь ими, гетерогенную популяцию различных видов нейронов, имеющих один или множество трансмиттеров и/или одну или множество функций; предпочтительно, они являются холинергическими и сенсорными нейронами. При использовании здесь фраза "холинергический нейрон" означает нейроны центральной нервной системы (CNS) и периферической нервной системы (PNS), нейротрансмиттерами которых является ацетилхолин; а в качестве примера можно привести базальный передний мозг, полосатое тело, и нейроны спинного мозга. При использовании здесь словосочетание"сенсорный нейрон" включает нейроны, реагирующие на внешнее воздействие (например,температуру, движение) со стороны, например,кожи, мышц и суставов; примером является нейрон дорсального корневого ганглия. Словосочетание "клетка, реагирующая на трофический фактор", при использовании здесь означает клетку, которая имеет рецептор, с которым трофический фактор может специфически связываться; сюда входят, например, нейроны (например, холинергические и сенсорные нейроны) и ненейронные клетки (например, моноциты и неопластические клетки). Описанные здесь мостиковые инденопирролокарбазольные соединения находят применение как в исследовательской, так и в медицинской области, например, в подавлении фер 17 ментативной активности. Например, в исследовательской деятельности, соединение может быть использовано при разработке тестов и моделей для дальнейшего изучения роли, которую играет подавление серин/треонин или тирозин протеинкиназы (например, РКС, trk тирозинкиназы) в механизме развития связанных с ним нарушений функций и заболеваний. В терапевтической области соединения, которые подавляют подобные виды ферментативной активности, могут быть использованы для подавления разрушительных последствий деятельности этих ферментов в отношении, например, таких заболеваний, как рак. Как демонстрируют приведенные ниже примеры, подавление ферментативной активности с использованием мостиковых инденопирролокарбазольных соединений может быть определено с помощью, например, следующих тестов: 1. Тест на подавление активности тирозинкиназы trk А; 2. Подавление NGF-стимулированного фосфорилирования trk в препарате цельных клеток; 3. Тест на подавление киназы рецептора фактора роста сосудистого эндотелия (VEGFR). 4. Тест на активности подавления РКС и 5. Тест на подавления PDGFR. Описываемые здесь мостиковые инденопирролокарбазольные соединения могут быть использованы для усиления функций и/или выживания клеток нейронного происхождения у млекопитающих, например, человека. В этом смысле соединения могут быть использованы сами по себе или с другими сконденсированными пирролокарбазолами и/или индолокарбазолами, или в сочетании с другими полезными молекулами, которые также проявляют явную активность по воздействию на функцию и/или выживание определенных клеток. Разнообразие неврологических заболеваний варьирует в зависимости от нейронных клеток, которые гибнут, повреждаются, функционально подвергаются риску, аксонной дегенерации, при риске смерти и т.д. Эти нарушения включают, не ограничиваясь ими: болезнь Альцгеймера, поражения моторных нейронов(например,амиотрофический латеральный склероз); болезнь Паркинсона; цереброваскулярные нарушения (например, инсульт, ишемия); болезнь Хантингтона, деменция при ВИЧ; эпилепсия; множественный (рассеянный) склероз; периферические нейропатии (например,такие, которые затрагивают DRG нейроны при связанной с химиотерапией периферической нейропатологией), включая диабетическую нейропатию; заболевания, вызванные возбуждающими аминокислотами; и заболевания, связанные с сотрясением или проникающим поражением мозга или спинного мозга.ChAT катализирует синтез нейротрансмиттера ацетилхолина и он считается ферментативным маркером для функционального холинергического нейрона. Функциональный нейрон также способен к выживанию. Выживание нейрона оценивается по величине специфического поглощения и ферментативной конверсии красителя (например, кальцеина AМ) живыми нейронами. Из-за разнообразия в их полезных свойствах, мостиковые инденопирролокарбазольные соединения, раскрытые здесь, находят применение в различных областях. Эти соединения могут использоваться в разработке in vitro моделей выживания нейронных клеток, функционирования, идентификации или для скрининга других синтетических соединений, которые имеют активность, подобную активности инденопирролокарбазольных соединений. Соединения могут применяться в научной области для исследования, характеристики и определения молекулярных мишеней, связанных с функциональными ответами. Например, путем радиомаркирования мостикового инденопирролокарбазольного соединения, связанного с характерной клеточной функцией (например, митогенезом), может быть определено, выделено, и очищено для определения их характеристик область-мишень, с которой связывается производное. Соединения могут быть пригодны, interalia, не только для повышения активности индуцированной трофическим фактором, клеток,реагирующих на трофический фактор, например, холинергических нейронов, но они также могут функционировать в качестве агентов,способствующих выживанию других типов нейронных клеток, например, допаминергических или глютаматергических. Фактор роста может регулировать выживание нейронов путем запуска каскадного потока небольших GTP связывающих белков чаs, час и cdc42 ( Denhardt, D.T.,Biochem. J., 1996, 318, 729). Характерно, что активация газ приводит к фосфорилированию и активированию внутриклеточной рецепторактивирующей киназы (ERK), которая связана с биологическим ростом и процессами дифференциации. Стимуляция rac/cdc42 приводит к росту активации JNK и р 38, ответам, которые связаны со стрессом, апоптозом и воспалением. Хотя ответы фактора первоначально осуществляются через ERK путь, влияние на эти последние процессы может приводить к альтернативным механизмам выживания нейронов, которые могут быть подобны свойствам выживания при усилении фактора роста (Xia et al., Science, 1995, 270,1326). Соединения также могут действовать как агенты, способствующие выживанию нейронных и ненейронных клеток с помощью механизма, относящегося к, но также отличного от механизма выживания, медиированого фактором роста, например, путь подавления JNK и р 38 МАРК, что может привести к выживанию 19 путем ингибирования процесса апоптотической гибели клеток. Настоящие соединения пригодны в лечении заболеваний, связанных со снижением активности СhАТ или гибелью, повреждением мотонейронов спинного мозга, и также находят применение, например, при заболеваниях, связанных с апоптотической гибелью клеток центральной или периферической нервной системы, иммунной системы, и при воспалительных заболеваниях. Описанные здесь мостиковые инденопирролокарбазольные соединения также могут найти применение в лечении болезненных состояний, включающих пролиферацию злокачественных клеток, таких как многие виды рака. Фармацевтически приемлемые соли соединений (I) включают фармацевтически приемлемые соли присоединения кислоты, соли металлов, аммониевые соли, соли присоединения органических аминов и соли присоединения аминокислот. Примерами солей присоединения кислот являются соли присоединения неорганических кислот, таких как хлористоводородная,серная и фосфорная, и органических кислот,таких как ацетат, малеат, фумарат, тартрат, цитрат и лактат; примерами солей металлов являются соли щелочных металлов, таких как литиевая соль, натриевая соль и калиевая соль,соли щелочно-земельных металлов, такие как соль магния и соль натрия, соль кальция и соль цинка; примерами аммониевых солей являются соль аммония и соль тетраметиламмония; примерами солей присоединения органического амина являются соли с морфолином и пиперидином; и примерами солей присоединения аминокислот являются соли с глицином, фенилаланином, глютаминовой кислотой и лизином. Предложенные здесь соединения могут быть составлены в виде фармацевтических композиций, путем смешивания с фармацевтически приемлемыми нетоксичными эксципиентами и носителями. Такие композиции могут быть приготовлены для парентерального использования,в частности в форме жидких растворов или суспензий; или для орального применения, в частности в форме таблеток или капсул; или для интраназального применения в частности в форме порошков, капель для носа или аэрозолей; или для дермального применения, через,например, накожный пластырь. Композиции удобно применять в дозированной форме, причем они могут быть приготовлены любыми способами, хорошо известными в фармацевтической области, например, как описано у Rimington's Pharmaceutical Sciences(Mack Pub. Co., Easton, PA, 1980). Готовые препаративные формы для парентерального применения могут содержать в качестве обычных эксципиентов стерильную воду или физиологический раствор, полиалкиленгликоли, такие как полиэтиленгликоль, масла, в частности расти 004066 20 тельного происхождения, гидрированные нафталины и им подобные. В частности, биосовместимые, биодеградируемые лактидные полимеры, лактид/гликолидные сополимеры или полиоксиэтилен-полиоксипропиленовые сополимеры, могут служить пригодными эксципиентами для контроля высвобождения активных соединений. Другие потенциально пригодные системы для парентерального ведения этих активных соединений включают частицы этиленвинилацетатного сополимера, осмотические насосы,инфузионные имплантационные системы и липосомы. Готовые препаративные формы для ингаляционного применения содержат в качестве эксципиентов, например, лактозу, или могут быть в виде водных растворов, содержащих,например, полиоксиэтилен-9-лауриловый эфир,гликохолят или деоксихолят, или масляные растворы для использования в виде капель для носа, или в виде геля, применяемого интраназально. Готовые препаративные формы для парентерального применения также могут включать гликохолят для буккального применения, салицилат для ректального применения или лимонную кислоту для вагинального применения. Готовые препаративные формы для трансдермального введения в виде пластыря предпочтительно представляют собой липофильные эмульсии. Соединения настоящего изобретения могут использоваться как единственный активный агент в фармацевтической композиции. Но альтернативно, они могут использоваться и в сочетании с другими активными ингредиентами,например, другими факторами роста, которые способствуют выживанию нейронов или аксональной регенерации при различных заболеваниях. Соединения формулы I и их фармацевтически приемлемые соли могут применяться орально или не орально, например, в виде мазей или инъекции. Концентрация соединений данного изобретения в терапевтической композиции может быть различной. Концентрация зависит от таких факторов, как общая доза назначаемого лекарственного средства, химические характеристики (например, гидрофобность) применяемого соединения, путь введения, возраст, вес тела и симптоматика больного и т.д. Обычно соединения настоящего изобретения предлагаются в виде растворов в физиологическом буферном растворе, содержащем от около 0,1 до 10% объем/вес соединения для парентерального применения. Обычная доза колеблется от около 1 мкг/кг до около 1 г/кг веса тела в день; предпочтительная доза колеблется от около 0,01 до 100 мг/кг веса тела в день, и предпочтительно около 0,1-20 мг/кг от 1 до 4 раз в день. Предпочтительная доза лекарственного средства, предназначенного для применения, обычно зависит от таких факторов, как вид и степень прогрессирования заболевания, общее состояния здоровья конкретного больного, относи 21 тельная биологическая эффективность выбранного соединения, вид препарата соединения,эксципиент и путь введения. Соединения формулы I и их фармацевтически приемлемые соли могут назначаться сами по себе или в форме различных фармацевтических композиций, в соответствии с фармакологической активностыо и целью применения. Фармацевтические композиции в соответствии с настоящим изобретением могут быть получены смешиванием до однородного состояния эффективного количества соединения формулы I или его фармацевтически приемлемой соли в качестве активного ингредиента с фармацевтически приемлемым носителем. Носитель имеет широкий спектр форм в соответствии с пригодными для применения формами композиции. Желательно, чтобы такие фармацевтические композиции готовились в виде единичной дозированной формы для орального и не орального применения. Формы для не орального применения включают мази и инъекционные формы. Таблетки могут быть получены общепринятым способом с использованием таких эксципиентов, как лактоза, глюкоза, сахароза, маннит и метил целлюлоза, дезинтегрирующие агенты, такие как крахмал, альгинат натрия, карбоксиметилцеллюлоза кальция и кристаллическая целлюлоза,смазывающие вещества, такие как стеарат магния и тальк, связывающие агенты, такие как желатин,поливиниловый спирт, поливинилпирролидон,гидроксипропилцеллюлоза и метилцеллюлоза,сурфактанты, такие как сложный эфир жирных кислот и сахарозы и сложный эфир жирных кислот и сорбита, и им подобные. Предпочтительно,чтобы каждая таблетка содержала 15-300 мг активного ингредиента. Гранулы могут быть получены общепринятым способом с использованием таких эксципиентов, как лактоза и сахароза, дезинтегрирующих агентов, таких как крахмал, связывающие вещества, таких как желатин; и им подобные. Порошки могу быть получены общепринятым способом с использованием таких эксципиентов, как лактоза и маннит и им подобных. Капсулы могут быть получены общепринятым способом с использованием желатина, воды, сахарозы, гуммиарабика,сорбита, глицерина, кристаллической целлюлозы,стеарата магния, талька и им подобным. Предпочтительно, чтобы капсула содержала 15-300 мг активного ингредиента. Препараты в виде сиропа можно получить обычным способом с использованием таких cахаров, как сахароза, вода, этанол и им подобные. Мази можно получить общепринятым способом с использованием таких мазевых основ,как вазелин, жидкий парафин, ланолин и макроголь, эмульгаторов, таких как лауриллактат натрия, безалькония хлорид, моно-сложный эфир жирных кислот и сорбита, карбоксиметилцеллюлозы натрия и гуммиарабика и им подобных. 22 Препараты для инъекций можно получить общепринятым способом, используя растворители, такие как вода, физиологический раствор, растительные масла (например, оливковое масло и арахисовое масло), этилолеат и пропиленгликоль,солюбилизирующие агенты, такие как бензоат натрия, салицилат натрия и уретан, изотонические агенты, такие как хлорид натрия и глюкоза, консерванты, такие как фенол, крезол, парагидроксибензойный сложный эфир и хлорбутанол, антиоксиданты, такие как аскорбиновая кислота и пиросульфит натрия, и им подобные. Далее изобретение иллюстрируется с помощью следующих примеров, которые предназначены для разъяснения изобретения. Эти примеры никоим образом не ограничивают объем раскрытия данного изобретения. Примеры Пример 1. Подавление активности trkA тирозинкиназы. Выбранные мостиковые инденопирролокарбазольные соединения тестируют на их способность ингибировать киназную активность цитоплазматического домена человеческогоtrkA экспрессирующего бакуловирус, используя ранее описанный тест на основе ELISA (Angeleset al., Anal. Biochem. 236: 49-55, 1996). Вкратце,96-луночную микротитровальный планшет покрывают раствором белка слияния человеческой рекомбинантной фосфорилаза C-1/глютатионS-трансферазы (Rotin et al., EMBO J., 11:559567, 1992). Стадии ингибирования проводятся в 100 мкл тестовых смесях, содержащих 50 мМ Нереs, рН 7,4, 40 мкМ АТР, 10 мМ MnCl2, 0,1% БСА, 2% ДМСО и ингибитор в различных концентрациях. Реакцию инициируют добавлением киназы trkA и оставляют для протекания в течение 15 мин при 37 С. К фосфотирозину (UBI) добавляют антитела, с последующим добавлением вторичного фермент-конъюгированого антитела, щелочного фосфотаза-меченного антимышиного IgG козы (Bio-Rad). Активность связанного фермента измеряется с помощью системы с усиленным детектированием (GibcoBRL). Данные ингибирования анализируют с использованием сигмоидального уравнения зависимости доза-ответ (переменный угловой коэффициент) в системе обсчета GraphPad Prism. Концентрация, при которой достигается 50% ингибирование активности киназы, принимают за "IC50". Результаты суммированы в табл. 2. Таблица 2 Ингибирующее действие мостиковых инденопирролокарбазольных соединений на активность trkA киназыNGFстимулированного trkA фосфорилирования в препарате цельных клеток. Подавление NGF-стимулированного фосфорилирования trk выбранными мостиковыми инденопирролокарбазольными соединениями осуществляют с использованием модифицированной методики, как описано ниже, из ранее описанной в патенте США 5516771. NIH3T3 клетки, помещенные с trkA, выращивают в 100 мм чашках. Субконфлюентные клетки помещают в условия сывороточного голодания путем замены среды на свободную от сыворотки 0,05% BSA-DMEM, содержащую соединение(100 нМ и 1 мкМ) или ДМСО (добавляют к контролю) на 1 ч при 37 С. Затем к клеткам добавляют NGF (Harlan/Bioproducts for Science) в концентрации 10 нг/мл на 5 мин. Клетки лизируют в буфере, содержащем детергент и ингибиторы протеазы. Осветленные клеточные лизаты доводят до нормы белка, используя ВСА способ, и затем лизаты иммунопреципитируют с анти-trk антителами. Были получены поликлональные анти-trk антитела против пептида, соответствующего 14 аминокислотам на карбокси конце trk (Martin-Zanca et al., Mol. Cell. Biol. 9: 24-33, 1989). Иммунные комплексы собирают на гранулы Сефарозы с протеином A (Sigma Chem.Co., St. Lois, МО), разделенные с помощью SDS электрофореза на полиакриламидном геле (SDSPAGE), и переносят на поливинилидендифторидную мембрану (PVDF). Мембрану подвергают иммуноблоттингу с антифосфотирозиновыми антителами (UBI) c последующей инкубацией с пероксидазой хрена, соединенной с антимышиным IgG (Bio-Rad Laboratories, Hercules,CA). Фосфорилированные протеины визиализируют, используя ECL (Amersham Lite Science,Inc., Arlington Heights, IL). Площадь полосы поглощения trk протеина измеряют и сравнивают сNGF стимулированным контролем. Используют систему обсчета ингибирования, беря за основу процентное понижение в полосе белка trk, оценивая следующим образом: 0=нет снижения; 1=1-25%; 2=26-49%; 3=50-75%; 4=76-100%. Результаты представлены ниже в табл. 3. 24 Таблица 3 Влияние мостиковых инденопирролокарбазольных соединений на NGF-стимулированное фосфорилирование trk в NIH3T3 клетках Обсчет ингибирования Соединениепри 100 нМ при 1000 нМII-7b 3 4 Пример 3. Подавление киназной активности рецептора фактора роста сосудистого эндотелия. Мостиковые инденопирролокарбазольные соединения исследовались на их подавляющее воздействие на киназную активность домен киназы рецептора VEGF, экспрессирующего бакуловирус (flk-1 человека, KDR, VEGFR2), используя описанную выше методику ELISA для киназы trkA. Киназная реакционная смесь, содержащая 50 мМ Нереs, рН 7,4, 40 мкМ АТР, 10 мМ MnCl2, 0,1% БСА, 2% ДМСО и различные концентрации ингибитора, переносят на планшеты, покрытые PLC-/GST. Добавляют киназуVEGFR, и реакцию оставляют протекать в течение 15 мин при 37 С. Детектирование продукта фосфорилирования осуществляется добавлением анти-фосфотирозиновых антител (UBI). Вторичные фермент-конъюгированные антитела доставляют для захвата комплекса фосфорилированный PLC-/GST. Активность связанного фермента измеряют с помощью системы с усиленным детектированием (Gibco-BRL). Данные ингибирования анализируют с использованием сигмоидального уравнения зависимости дозаответ (переменный угловой коэффициент) в системе обсчета GraphPad Prism. Результаты суммированы в табл. 4. Таблица 4 Ингибирующее действие мостиковых инденопирролокарбазольных соединений на активность киназы VEGF рецептора Пример 4. Игибирование активности протеинкиназы С. Активность протеинкиназы С тестировали с использованием Millipore Multiscreen TCA анализа "в планшете", как описано в Ritt, A.M.(Millipore). Каждая 40 миллилитровая смесь содержала 20 мМ Нереs,рН 7,4, 10 мМ MgCl2, 2,5 мМ EGTA, 2,5 мМ[-32P]ATP, 1,5 нг протеинкиназы С (UBI; смешанные изозимы а, b, g), 0,1% БСА, 2% ДМСО и тестовое мостиковое конденсированное пирролокарбазольное соединение. Реакции позволяют протекать в течение 10 мин при 37 С, затем гасят добавлением охлажденной льдом 50% трихлоруксусной кислоты (ТХУК). Планшетам дают уравновеситься в течение 30 мин при 4 С,затем промывают ледяной 25% ТХУК. В планшеты добавляют сцинцилляционый коктейль, и определяют радиоактивность, используя WallacMicroBeta 1450 PLUS сцинцилляционный счетчик. Значение IC50 рассчитывают путем обработки данных с помощью сигмоидального уравнения зависимости доза-ответ (переменный угловой коэффициент) в системе обсчета GraphPad Prism. Результаты суммированы в табл. 5. Таблица 5 Ингибирующее действие мостиковых инденопирролокарбазольных соединений на активность протеинкиназы С ПКС (% инг.1 мкМ) Соединение Пример 5. Ингибирование активности киназы рецептора фактора роста из тромбоцитов. Мостиковые инденопирролокарбазольные соединения теститовали на их ингибирующее воздействие на киназную активность домена киназы рецептора PDGF, экспрессирующего бакуловирус, используя метод ELISA с trkA киназой, описанный выше. Анализ проводят в 96 луночных микротитровальных планшетах, покрытых субстратом (PLC-/GST). Каждые из 100-мкл реакционной смеси содержат 50 мМ Нереs, рН 7,4, 20 мкМ АТР, 10 мМ MgCl2, 0,1% БСА, 2% ДМСО и различные концентрации ингибитора. Реакцию инициируют добавлением фосфорилированного рекомбинантного ферманта человека (10 нг/мл PDGFR) и дают протекать в течение 15 мин при 37 С. Фосфорилированный фермент готовят перед использованием путем инкубации киназы в буфере, содержащем 20 мкМ АТР и 10 мМ MnCl2 в течение 1 ч при 4 С. Детектирование фосфорилированного продукта производят добавляя пероксидазу хрена(НRР)-конъюгированное антифосфотирозиновое антитело (UBI). Раствор HRP субстрата, содержащий 3,3'-5,5'-тетраметилбензидин и перекись водорода, добавляют позже, и планшеты инкубируют в течение 10 мин при комнатной температуре. Реакцию гасят кислотой, и полученный в результате абсорбат считывают при 450 нм, используя Microplate Bio-kinetics Reader(Bio-Tek Instrument EL 312e). Данные, полученные после инкубации, анализируют с использованием сигмоидального уравнения зависимости доза-ответ (переменный угловой коэффициент) в системе обсчета GraphPad, Prism. Результаты суммированы в табл. 6. Таблица 6 Ингибирующее действие на PDGFR мостиковых инденопирролокарбазольных соединений Пример 6. Усиление активности ChAT спинного мозга. Как обсуждалось выше, ChAT представляет собой специфический биохимический маркер для функциональных холинергических нейронов. Холинергические нейроны составляют главный холинергический вклад в образование гиппокампа, обонятельные ядра, кору, миндалины и отделы таламуса. В спином мозге двигательные нейроны являются холинергическими нейронами, содержащими ChAT (Phelps et al., J. Соmр. Neurol. 273:459-472 (1988. АктивностьChAT использована для изучения влияния нейротрофинов (например, NGF или NT-3) на выживание и/или функционирование холинергических нейронов. Анализ ChAT также служит показателем регулирования уровня ChAT внутри холинергических нейронов. Мостиковые инденопирролокарбазольные соединения повышают активность ChAT в тесте на измельченной культуре эмбрионального спинного мозга крысы (табл. 7). Например, в этих исследованиях соединения непосредственно добавляют к измельченной культуре спинного мозга. Соединения, которые дают повышение активности ChAT по крайней мере до 120% от активности контроля, считаются активными. Результаты суммированы в табл. 7. Таблица 7 Повышение активности ChAT спинного мозга мостиковыми инденопирролокарбазольными соединениямиChAT спинного мозга, % от контроля Соединение Активность МаксимальнаяII-1 114 139300 нМ Метод: Фетальные клетки спинного мозга крысы диссоциируют и эксперименты проводят,как описано (Smith et al., J. Cell Biology 101:1608-1621 (1985); Glicksman et al., J. Neurochem. 61:210-221 (1993. Диссоциированные клетки получают из спинного мозга, иссеченного у крысы (эмбрионы 14-15 дня) с помощью стандартной методики трипсиновой диссоциации (Smith et al., supra.). Клетки помещают при 6 х 105 клеток/см 2 в лунки с тканевой культурой,покрытой поли-1-орнитином в свободной от сыворотки N2 среде с 0,05% бычьего сывороточного альбумина (БСА). (Bottenstein et al.,PNAS USA 76:514-517 (1979. Культуры инкубируют при 37 С во влажной атмосфере 5%CO2/95% в течение 48 ч. Активность ChAT измеряют через 2 дня in vitro, используя модифицированную методику Fonnum (Fonnum, J. Neurochem. 24:407-409 (1975 в соответствии сZ связь связь связь связь связь связь связь Общее описание процесса синтеза и примеры Общий путь синтеза, используемый для получения мостиковых инденопирролокарбазольных соединений данного изобретения, показан на фиг. 1 и 2. Общий способ синтеза инденопирролокарбазолов (III)/(VIII) может быть осуществлен, как описано в патенте США 5705511, раскрытие которого в полном объеме включено здесь в качестве ссылки. Когда R1 представляет собой Н, лактам азота инденопирролокарбазолов (III)/(VIII) защищен соответствующей защитной группой, приводя к (IV)/(IX). Защищенные соединения обрабатывают соответствующим основанием в безводном органическом растворителе(ях), что приводит к образованию темно-красного раствора, который считают карбанионом. Реакция карбаниона с бифункциональным реагентом (V) дает в результате электрофильное присоединение (V) к С=Y связи, приводя к исходным промежуточным 29 веществам (VI)/(X). Обработка промежуточного вещества(ществ) (VI)/(X) и/или (VII)/(XI) сульфоновой кислотой или кислотой Льюиса, например, этератом трифторида бора, дает мостиковые инденопирролокарбазолы (I)/(II). Стратегия защиты лактама азота (показанная на фиг. 3 и 4) может быть проведена с помощью процесса, катализируемого или кислотой или основанием. Реакция, катализируемая кислотой, может проводиться со связанным со смолой реагентом, допуская иммобилизацию инденопирролокарбазола (III)/(VIII) на полимерной подложке, такой как полистиролосновная смола Rink acid (XII) (фиг. 3), давая(XIII). Альтернативно, реакция, катализируемая кислотой, может быть проведена с растворимым реагентом, давая соединение (XIV) (фиг. 4). Силил-защищенное соединение (XV) получают с щелочным катализатором (фиг. 4). Фиг. 5 показывает несколько способов получения промежуточных продуктов (V). Способ(а) описывает превращения различных ацеталей(XVI) в (XVII, Z=связь). Например, сложный эфир-ацеталь/кеталь (XVI, D=COOR) полностью восстанавливается до соответствующего спирта и последовательно окисляется (например, окисление по Swern или Dess-Martin) до альдегид-ацеталь/кеталя (XVII, R8=Н). Альтернативно, сложный эфир-ацеталь/кеталь (XVI,D=COOR) частично восстанавливается с помощью DIBAL, давая непосредственно альдегид(XVII, R8=Н). Подобно этому, восстановление нитрил-ацеталя (XVI, D=CN) DIBAL дает альдегид (XVII, R8=Н). Кето-ацетали/кеталь получают добавлением реагента Гриньяра к амидацеталь/кеталю Вейнреба (XVI, D=CON(ОМе)Me). Промежуточное вещество (XVII, Z=связь) может быть также получено с помощью двухступенчатого процесса, показанного в способе (b). Добавление органо-металлического реактива(XIX) к ацеталь/кеталю (XVIII), дает алкен (XX),который при озонолизе с последующим восстановлением дает кетоацеталь/кеталь (XVII). Получение промежуточного продукта (XVII, Z=гетероатом) в двухступенчатом процессе показано в способе (С). Связывание ацеталя (XXII) с алкеном(XXI) с последующим озонолизом (с восстановлением) полученного в результате алкена дает кетоацеталь/кеталь (XVII). Альтернативно промежуточное вещество (XVII, Z=гетероатом) получают в двухступенчатом процессе, показанном в способе (d). Взаимодействие соединения (XXIV) с ацеталь/кеталем (XVIII) дает (XXV), который превращается в кетоацеталь/кеталь (XVII) способом,описанным в способе (а). Конденсация кетоацеталь/кеталя (XVII) с гидроксиламинами, гидразинами, N-алкил-N-алкоксиаминами и аминами дает промежуточное вещество (XXVI), несущее электрофильную С=N функциональность. Связанные со смолой инденопирролокарбазолы (XIII) (фиг. 6, способ А) обрабатывают из 004066 30 бытком реактива Гриньяра в качестве основания, в результате чего получают темно-красный раствор карбаниона. Последующее взаимодействие с (V) приводит к продуктам, полученным путем электрофильного присоединения к С=Y группе. Обработка водой и отщепление продукта(ов) разбавленной кислотой (1% ТФУК в метиленхлориде) от смолы приводит к выделению соединения(ий)(XXVII) и/или (XXVIII). Обработка промежуточного вещества(ств) (XXVII) и/или (XXVIII) или сульфоновой кислотой, или реактивом Льюиса,например, этератом трифторида бора, дает мостиковые инденопирролокарбазолы. Подобная стратегия применяется для взаимодействия растворимого промежуточного вещества защищенного лактамом, например(XV) (фиг. 7, способ В). Однако в этом случае промежуточное вещество (XV) вместо реактива Гриньяра обрабатывают Тритоном В в пиридине. Промежуточное вещество(ва) (XXIX) и/или(XXX) могут быть выделены с интактной защитной группой лактама, которая неспособна к очистке хроматографией. Как в способе А (фиг. 6), обработка реактивом Льюиса (таким как этерат трифторида бора) дает мостиковые инденопирролокарбазолы (II), где R1=Н. Введение групп R3, R4, R5 и R6 можно осуществить, как описано в патенте США 5705511 и 4923986, которые приведены здесь в качестве ссылки в полном объеме. R3 заместитель может быть введен иным способом после образования мостиковых инденопирролокарбазолов, как показано на фиг. 8. 3 положение В кольца бромируют с помощью NBS, получая соединение (XXXI). Затем вводят углеродный фрагмент, используя катализируемые палладием реакции Stille, Suzuki, Heck, Kumada или CastroStephens, получая соединения типа (XXXII),(XXXIII) и т.д. Кроме того, соединение (XXXI) может давать избыток соединений, когда группа брома заменяется на гетероатом, например,амин-основная группа с использованием аминирования, катализируемого палладием по Бушвальду (Buchwald). Процессами окисления связанная с кислородом группа может быть введена в инденовый углерод Е кольца, как показано на фиг. 9, соединение (XXXIV). Этот синтез также приводит к окислению метиленовой группы лактама (А кольцо), давая, как показано, имидное производное. Пример 7. Получение промежуточных продуктов, связанных со смолой Ринка; (XIIIA), (XIII-B) и (XIII-C) (фиг. 3). Пример 7-А. Трехгорловую круглодонную колбу, снабженную верхней механической мешалкой и насадкой Дина Старка, последовательно заполняют смолой кислоты Ринка (XII) (10,00 г, 0,64 ммоль/г), 1-метил-2-пиролидиноном (80 мл),бензолом (350 мл), VIII-A [А 1, А 2=Н 2, В 1, В 2=О,R3=R4=R5=R6=H] (3,00 г) и паратолуол 31 сульфоновой кислотой (1,00 г). Реакционную смесь нагревают при кипячении с обратным холодильником в течение 20 ч, и затем фильтруют. Смолу промывают ТГФ (5 х 175 мл) и фильтрат отставляют. Смолу затем последовательно промывают ДМСО (4 х 100 мл), 2% водным NаНСО 3 (4 х 100 мл), водой (4 х 100 мл),ДМСО (2 х 200 мл), ТГФ (4 х 100 мл) и этилацетатом (4 х 100 мл). Смолу сушат в вакууме (24 ч),получая 11,70 (0,47 ммоль/г) связанного со смолой VIII-A (XIII-A). Первую смывную жидкость с ТГФ выпаривают, и остаток разбавляют водой (750 мл) и полученный в результате осадок фильтруют и последовательно промывают водой, 2% воднымB =H2, R3=R4=R5=R6=H] (0,5 г) связывают со смолой кислоты Ринка XII (1,52 г), получая 1,58 г связанного со смолой VIII-B (XIII-B). Пример 7-С. Таким же образом, VIII-C [А 1, А 2=Н 2, В,2 В =О, R3=R4=R5=H, R6=10-OMe] (1,02 г) связывают со смолой кислоты Ринка XII (3,12 г), получая 3,70 г (0,46 ммоль/г) связанного со смолой(II-4 а), соединения (II-4b), соединения (II-6) и соединения (II-8) [Cпособ А, фиг. 6]. Пример 8-А. К суспензии (XIII-A) , (1,25 г) в ТГФ (24 мл) добавляют 1,0 М раствор EtMgBr (6,25 мл в ТГФ), и реакционную смесь перемешивают в течение 1 ч перед добавлением НМРА (5,0 мл). После перемешивания в течение 10 мин добавляют диэтоксибутиральдегид (3,0 г) [который получают в соответствии с описанной в литературе методикой Paquette, L.A., Backhaus, D.,Braum, R., Underiner, T.L., and Fuchs, K.J. Am.Chem. Soc. 1997, 119, 9662-71], и реакционную смесь перемешивают в течение 20 ч. Реакцию гасят 10% водным NH4Cl (5 мл) и фильтруют. Смолу последовательно промывают 10% водным NH4Cl (3 х 10 мл), водой (3x10 мл), ТГФ(15 мл) и обрабатывают трифторуксусной кислотой (0,15 мл). После перемешивания в течение 1 ч, реакционную смесь фильтруют, и фильтрат выпаривают. Полученный в результате остаток переносят в метиленхлорид (20 мл) и обрабатывают тозилатом пиридиния (50 мг), и полученный в результате раствор перемешивают в течение 4 ч. В этот момент реакционную смесь промывают насыщенным воднымNаНСО 3 и солевым раствором и сушат над сульфатом магния. После фильтрации и выпа 004066 32 ривания растворителя остаток очищают с помощью препаративной ВЭЖХ (Zorbax RX-8,4 х 25 см, элюируя 60% (объем) MeCN/водой(вес)/0,1% трифторуксусная кислота). Соответствующие фракции нейтрализуют NаНСО 3 и экстрагируют метиленхлоридом (3 х 50 мл) и сушат над сульфатом магния. После фильтрации и выпаривания растворителя получают 70,2 мг соединения II-1 в виде белого порошка, которое имеет следующие характеристики: 13 С ЯМР(м, 1H); 1,96-1,92 (м, 1H); 0,96-0,88 (м, 1H); 0,600,57 (м, 1H); MC m/z (M+H) рассчитано 379,найдено 379. Также с помощью препаративной ВЭЖХ данной реакционной смеси продуктов выделено соединение II-2 (0,5 мг), которое имеет следующие характеристики: 1H ЯМР (ДMCO-d6)9,17 (д, J=8,1, 1H); 8,62 (с, 1H); 7,98 (д, J=7,0,1H); 7,85 (д, J=6,8, 1H); 7,57 (д, J=6,8; 1H); 7,49(дд, J=7,9; 7,4; 1H); 7,44-7,26 (м, 3 Н); 6,81 (д,J=6,0; 1H); 5,43-5,38 (м, 1 Н); 4,43 (с, 2 Н); 2,232,14 (м, 1 Н); 1,96-1,92 (м, 1 Н); 1,45-1,55 (м, 2 Н); 0,96-0,88 (м, 1H); 0,60-0,57 (м, 1 Н); 0,29 (т,J=7,0; 3 Н); MC m/z (M+H) рассчитано 407, найдено 407. Пример 8-В. Таким же образом, как описано выше для соединения II-1, смолу (XIII-A) (70,3 мг) обрабатывают 1,1-диэтокси-2-пентаноном (0,75 мл)[который получают в соответствии с описанной в литературе методикой Sworin, М. And Neuman, W.L. J. Org. Chem. 1988, 53, 4894-6], получая соединение II-3 (3,5 мг), которое выделяют с помощью препаративной ТСХ (силикагель,элюация 50% EtOAc/толуол), и имеет следующие свойства: 1H ЯМР (ДМСО-d6)9,42 (д,J=8,2, 1H); 8,58 (с, 1H); 7,95 (д, J=7,4, 1H); 7,79(M+H) рассчитано 393, найдено 393. Пример 8-С. Таким же образом (XIII-A) (74,3 мг) обрабатывают 1,1-диэтокси-2-гексаноном [который получают в соответствии с описанной в литературе методикой Brenner J.E. J. Org. Chem. 1961,26, 22-7] (0,75 мл), получая соединение II-4a(2,10 мг) и соединение II-4b (1,06 мл), которые выделяют по отдельности с помощью препаративной ВЭЖХ (Zorbax RX-8, 4 х 25 см, 65%(м, 3 Н); 6,31 (дд, J=5,9; 5,5; 1H); 5,02 (с, 1H); 4,88 (с, 2 Н); 0,88 (с, 3 Н) другие алифатические сигналы экранируются пиками растворителя; МС m/z (M+H) рассчитано 407, найдено 407. Соединение II-4b имеет следующие свойства: 1 Н ЯМР (ДМСО-d6)9,43 (д, J=8,1; 1H); 8,59 (с,1H); 7,99 (д, J=7,3; 1H); 7,75-7,65 (м, 2 Н); 7,49(с, 1 Н); 1,95 (с, 3 Н) другие алифатические сигналы экранируются пиками растворителя; МСm/z (M+H) рассчитано 407, найдено 407. Пример 8-D. Таким же образом (XIII-C) (1,00 г) обрабатывают диэтоксибутиральдегидом (3,65 г), получая соединение II-6 (87,8 мг), которое выделяют с помощью препаративной ВЭЖХ (ZorbaxRX-8, 2,5 х 25 см, 65% MeCN/вода (вес)/0,1% трифторуксусная кислота) и которое имеет следующие свойства: 1H ЯМР (ДМСО-d6)9,09 (д,J=8,6; 1H); 8,60 (с, 1H); 7,95 (д, J=7,4; 1H); 7,84(д, J=8,3; 1H); 7,47 (дд, J=7,2; 7,0; 1H); 7,35 (с,1 Н); 7,29 (дд, J=7,0; 7,0; 1H); 6,98 (дд, J=8,6; 1,9; 1H); 6,83 (д, J=6,0; 1H); 5,65-5,55 (м, 1 Н); 4,88 (с,2 Н); 4,48 (д, J=3,9; 1H); 3,82 (с, 3 Н); 2,25-2,10 (м,1H); 2,08-1,85 (м, 1H); 0,96-0,75 (м, 1H); 0,650,50 (м, 1H); МС m/z (M+Na) рассчитано 431,найдено 431. Пример 8-Е. Таким же образом смолу (XIII-B) (153,2 мг) обрабатывают диэтоксибутиральдегидом(вес)/0,1% трифторуксусная кислота) и которое имеет следующие свойства: 1H ЯМР (ДМСО-d6)9,09 (д, J=7,9; 1 Н); 8,81 (с, 1 Н); 7,81-7,73 (м,3 Н); 7,48-7,35 (м, 3 Н); 7,24 (дд, J=7,6; 7,5; 1 Н); 6,85 (д, J=6,2; 1 Н); 5,63-5,59 (м, 1 Н); 4,86 (с, 2 Н); 4,61 (д, J=3,6; 1 Н); 3,82 (с, 3 Н); 2,21-2,13 (м, 1 Н); 1,96-1,90 (м, 1H); 0,87-0,79 (м, 1 Н); 0,61-0,56 (м,1 Н); MC m/z (M+H) рассчитано 379, найдено 379. Пример 9. Получение соединения II-7a и соединения II-7b (способ А, фиг. 6). Пример 9-А. Получение (1,1-диэтоксиэтокси)ацетона. К холодной суспензии (0 С) NaH (2,68 г,60%) в ТГФ (150 мл) добавляют раствор 1,1 диэтоксиэтанола [который получают в соответствии с описанной в литературе методикойZirkle, C.L. et al., J. Org. Chem. 1061, 26, 395407] (9,00 г) в ТГФ (20 мл), и реакционную смесь перемешивают при комнатной температуре в течение 1 ч перед добавлением металлилхлорида (8,0 мл). Реакционную смесь нагревают при кипячении с обратным холодильником в 34 течение ночи, охлаждают и фильтруют через слой целита. Растворитель удаляют в роторном испарителе, и остаток очищают с помощью колоночной хроматографии (диоксид кремния,20% эфир/гексан), получая эфир 1,1-диэтоксиэтилметалила (11,5, 90%). Озонолиз охлажденного раствора (-30 С) этого эфира (6,00 г) вEtOAc (80 мл) проводят до тех пор, пока исходные вещества не перестанут определяться по ТСХ (1 ч). В это время реакционную смесь продувают кислородом, обрабатывают Pd(OH)2 (150 мг) и перемешивают в атмосфере водорода в течение ночи. Катализатор отфильтровывают, и фильтрат концентрируют на роторном испарителе. Полученный в результате остаток очищают с помощью колоночной хроматографии (диоксид кремния, 20% EtOAc/гексан, получая названое в заголовке соединение (4,53 г, 82%). Пример 9-В. В соответствии со способом А (фиг. 6) смолу (XIII-A) (230,2 мг) обрабатывают EtMgBr(пример 8-А) (1,2 мл). После обработки и отщепления от смолы, часть сырого продукта реакционной смеси (10,5 мг) переносят в метиленхлорид (20 мл) и обрабатывают этератом BF3(20 мкл). После перемешивания в течение 2,5 ч раствор промывают насыщенным воднымNаНСО 3 и солевым раствором до сушки над сульфатом магния. После фильтрации растворитель удаляют, полученный остаток очищают с помощью препаративной ВЭЖХ (Zorbax RX-8,4 х 25 см, 65% MeCN/вода (вес)/0,1% трифторуксусная кислота), получая соединение II-7 а (2,34 мг) и соединение II-7b (1,34 мг). Соединение (II7 а) имеет следующие свойства: 1H ЯМР (CDCl3)9,35-9,20 (м, 1 Н); 7,87 (д, J=7,6; 1 Н); 7,62 (д,J=7,0; 1 Н); 7,60-7,45 (м, 1 Н); 7,49 (дд, J=7,7; 7,5; 1 Н); 7,40 (д, J=8,1; 1H); 7,37-7,26 (м, 3 Н); 6,22 (с,1H); 5,20-4,85 (м, 1H); 4,47 (с, 1H); 3,67 (д,J=12,7; 1H); 3,52 (д, J=11,8; 1H); 3,40 (д, J=12,7; 1H); 3,38 (д, J=11,8; 1H); 1,91 (с, 3 Н); MC m/z(2 мл) добавляют NBS (4,6 мг), и реакционную смесь перемешивают в течение ночи. Добавляют дополнительное количество NBS (4,5 мг) и реакционную смесь перемешивают в течение 2,5 ч. Нерастворимые вещества отфильтровывают, и фильтрат концентрируют на роторном испарителе. Полученный в результате остаток 35 очищают с помощью колоночной хроматографии (С-18, 65% MeCN/воды (вес)/0,1% трифторуксусная кислота). Соответствующие фракции нейтрализуют NаНСО 3 и экстрагируют в метиленхлорид (3 х 20 мл) и сушат над сульфатом магния. После фильтрации растворитель выпаривают, соединение II-5 (5,1 мг) получают в виде белого порошка, который имеет следующие характеристики: 1H ЯМР (ДМСО-d6)9,22(1:1). Пример 11. Получение промежуточного соединения XV (фиг. 4). Триэтиламин (0,75 мл) и хлорид третбутилдиметилсилила (TBS-Cl) (0,65 г) добавляют к раствору VIII-A [А 1, А 2=Н 2, В 1, В 2=О,R3=R4=R5=R6=H] (1,05 г) в ДМФ (25 мл). После перемешивания в течение 3 ч, реакцию гасят насыщенной водной NаНСО 3 и экстрагируютEtOAc. Органический слой промывают водой и насыщенным солевым раствором и сушат над МgSO4. После фильтрования раствор упаривают, полученный остаток растирают с эфиром,получая соединение XV (848 мг). Промывки выпаривают с получением остатка, который очищают колоночной хроматографией (диоксид кремния, 1% EtOAc/CH2Cl2) и получают продукт (502 мг, общий выход 94%), имеющий следующие спектральные свойства: 1H ЯМР(ДМСО-d6)11,94 (с, 1H), 9,32 (д, J=7,6, 1H),8,03 (д, J=7,7, 1H), 7,64 (д, J=7,2, 1H), 7,58 (д,J=8,1, 1H), 7,44 (дд, J=7,7, 7,6, 1H), 7,39 (дд,J=7,7, 7,6, 1H), 7,32 (д, J=7,3, 1H), 7,25 (дд,J=7,6, 7,3, 1H), 5,00 (с, 2 Н), 4,14 (с, 2 Н), 0,99 (с,9 Н), 0,46 (с, 6 Н); MC m/z (M+H) вычислено 425,найдено 425. Пример 12. Получение соединения II-1 методом В (фиг. 7). Раствор Тритона В в пиридине (0,45 М) получают растворением 40% раствора Тритона В в метаноле (10 мл) и в пиридине (10 мл). Растворитель удаляют при пониженном давлении(20 мм рт.ст.) до конечного объема 8 мл. Остаток разбавляют пиридином до 50 мл, фильтруют и хранят в азоте. Раствор XV (20,3 мг) в пиридине (2,0 мл) промывают струeй аргона и обрабатывают 300 мкл Тритона В (0,45 М в пиридине) и диэтоксибутиральдегидом (50 мкл). После перемешивания в течение 2 ч реакционную смесь экстрагируют в EtOAc, промывают 1 н. водной НСl, солевым раствором и сушат над сульфатом магния. После фильтрации растворитель выпаривают, аддукт переносят в CH2Cl2 (10 мл) и обрабатывают этератом ВF3 (10 мкл). После перемешивания в течение 2,0 ч раствор 36 промывают насыщенным водным NaHCO3 и солевым раствором перед сушкой над сульфатом магния. Удаление растворителя на роторном испарителе дает остаток, который очищают с помощью колоночной препаративной ВЭЖХ(вес)/0,1% трифторуксусная кислота). Соответствующие фракции нейтрализуют NaHCO3 и экстрагируют в метиленхлорид (3 х 20 мл) и сушат над сульфатом магния. После фильтрации и выпаривания растворителя получают II-1 (11,8 мг, выход 65%), 1 ЯМP и МС спектр и ВЭЖХ которого и время удерживания идентичны веществу, полученному и выделенному по способу А, описанному в примере 8-А. Пример 13. Получение соединения II-9(фиг. 8). К суспензии соединения брома II-5 (6,2 мг) в 1-пропаноле (4,0 мл) добавляют 3 аминофенилборную кислоту (3,8 мг). После перемешивания в течение 0,25 ч последовательно добавляют Pd(OAc)2 (2,0 мг), Рh3 Р (4,8 мг),Na2CO3 (2,8 мг) и воду (2,0 мл). Смесь нагревают при кипячении с обратным холодильником в течение 0,75 ч, охлаждают, экстрагируют вCH2Cl2 и промывают водой и солевым раствором. Органический слой сушат над сульфатом магния, и растворитель удаляют на роторном испарителе, получая остаток, который очищают с помощь препаративной ВЭЖХ (Zorbax RX-8,2,5 х 25 см, 50% MeCN/вода (вес)/0,1% трифторуксусная кислота). Соответствующие фракции нейтрализуют NaHCO3 и экстрагируют в метиленхлорид (3 х 20 мл) и сушат над сульфатом магния. После фильтрации и выпаривания испарителя получают соединение II-9 (3,1 мг, выход 49%), имеющее следующие спектральные свойства: 1H ЯМР (ДМСО-d6)9,22 (д, J=7,5; 1 Н); 8,66 (с, 1 Н); 8,00-7,25 (м, 8 Н); 7,12 (дд, J=7,1; 7,0; 1 Н); 6,95-6,80 (м, 3 Н); 6,53 (д, J=6,0; 1 Н); 5,63-5,58 (м, 1 Н); 4,99 (с, 2 Н); 4,55 (с, 1 Н); 2,252,10 (м, 1 Н); 1,95-1,90 (м, 1H); 0,98-0,88 (м, 1 Н); 0,65-0,57 (м, 1 Н); MC m/z (M+H) рассчитано 470, найдено 470. Пример 14. Получение соединения II-10(фиг. 9). К раствору соединения II-1 (5,0 мг) в ДМСО (1 мл) добавляют NaCN (4,3 мг), и смесь нагревают до 145 С в течение 1 ч. Смесь охлаждают, экстрагируют в EtOAc и промывают водой (3x20 мл) и солевым раствором. Органический слой сушат над сульфатом магния, фильтруют и выпаривают, получая остаток, который очищают с помощью препаративной ВЭЖХ(вес)/0,1% трифторуксусная кислота). Соответствующие фракции нейтрализуют NаНСО 3 и экстрагируют в метиленхлорид (3 х 20 мл) и сушат над сульфатом магния. После фильтрации и выпаривания растворителя получают соединение II-10 (2,7 мг, выход 50%), имеющее следующие спектральные свойства: 1H ЯМР(метод А, фиг. 6). В соответствии со способом А смола[Schmidt, U., Reidl, В. Synthesis, 1993, 809] (1,5 мл). После обработки и отщепления от смолы,смесь сырого реакционного продукта переносят в метиленхлорид (20 мл) и обрабатывают этератом ВF3 (20 мкл). После перемешивания в течение 2,5 ч раствор промывают насыщенным водным NаНСО 3 и солевым раствором перед сушкой над сульфатом магния. После фильтрации и удаления испарителя полученный остаток очищают с помощью препаративной ВЭЖХ (Zorbax(м, 2 Н). Пример 16. Получение соединения II-12. Раствор соединения II-11 (3,4 мг) в ТГФ (2 мл) обрабатывают 2 М раствором LiBH4 (1,0 мл в ТГФ) и перемешивают в течение 1,5 ч. Реакцию гасят путем добавления 1 н. водной НСl (4 мл). После перемешивания в течение 20 мин добавляют 10% водный NaOH (15 мл) и смесь экстрагируют в метиленхлорид (3 х 10 мл). После высушивания над сульфатом магния смесь фильтруют и растворитель упаривают, получая соединение II-12 (0,32 мг), имеющее следующие свойства: 1H ЯМР (ДМСО-d6)9,35 (д, J=7,7,1H), 8,62 (с, 1H), 7,98 (д, J=7,7, 1H), 7,83 (д,J=8,2, 1H), 7,75 (д, J=8,2, 1H), 7,50-7,25 (м, 4 Н),6,84 (д, J=7,7, 1H), 6,11 (с, 1H), 4,91 (с, 2 Н), 4,71(с, 1H), 4,50-4,40 (м, 1H), 4,30-4,20 (м, 1H), 2,421,91 (м, 2 Н), 1,25-0,63 (м, 2 Н); МС m/z (M+H) вычислено 409, найдено 409. Пример 17. Получение соединения II-13. Следуя способу из примера 11, раствор около 95-5 смесей VIII-C [А 1, А 2=H2, В 1, В 2=О,R3=R4=R5=H, R6=OMe] и VIII-D [А 1, А 2=H2, В 1,В 2=О, R3=R4=R6=H, R5=OMe] (1,25 г) растворяют в ДМФ (45 мл) и триэтиламине (0,85 мл) и трет-бутилдиметилсилилхлориде (0,65 г), получая VIII-TDBMS (1,41 г), имеющий следующие спектральные свойства: 1H ЯМР (ДМСО-d6)11,91 (с, 1H); 9,18 (д, J=8,6, 1H); 7,99 (д, J=7,8,1H); 7,56 (д, J=8,0; 1H); 7,42 (дд, J=7,7, 7,6, 1H); 7,30-7,20 (м, 2 Н); 6,95 (дд, J=7,6, 2,5, 1H); 4,97(с, 2 Н); 4,09 (с, 2 Н); 3,81 (с, 3 Н); 0,99 (с, 9 Н); 0,45 (с, 6 Н). Также с помощью колоночной хроматографии выделяют VIII-TBDMS (65 мг),имеющий следующие спектральные свойства: 1(с, 2 Н); 4,06 (с, 2 Н); 3,78 (с, 3 Н); 0,99 (с, 9 Н); 0,46 (с, 6 Н). Синтез в фазе растворителя соединения II-13. Следуя способу из примера 12, растворPaquette, L. A., Backhaus, D., Braum, R., Underiner, T.L., and Fuchs, K. J. Am. Chem. Soc. 1997,119, 9662-71, раскрытие которого включено здесь в качестве ссылки в полном объеме). После перемешивания в течение 2 ч реакционную смесь экстрагируют в EtOAc, промывают 10% водным CuSO4 (3 х 50 мл), солевым раствором и сушат над сульфатом магния. После фильтрации и выпаривания растворителя остаток элюируют через силикагель (30% EtOAc/гексан), и УФ активные фракции концентрируют, переносят вCH2Cl2 (4 мл) и обрабатывают этератом Вr3 (10 мкл). После перемешивания в течение 2,0 ч раствор промывают насыщенным водным NaHCO3 и солевым раствором до сушки над сульфатом магния. Удаление растворителя на роторном испарителе дает остаток, который растирают с эфиром, получая чистое соединение II-13 (4,6 мг), имеющее следующие спектральные свойства: 1H ЯМР (ДМСО-d6)8,92 (д, J=2,3, 1 Н); 8,59MC m/z (M+H) рассчитано 409, найдено 409. Пример 18. Синтез соединения II-14a и соединения II-14b. Синтез VIIIA-TBDPS. К раствору VIII-А (6,2 г) в ДМФ (150 мл) добавляют триэтиламин (9,7 мл), трет-бутилхлордифенилсилан (tBDPS-Cl, 10,5 мл) и каталитическое количество диметиламинопиридин. Смесь нагревают при 50 С в течение 15 ч. Добавляют дополнительное количество триэтиламина (5,0 мл) и tBDPS-Cl (5,0 мл), и реакционную смесь выдерживают при 50 С в течение 20 ч. Реакцию гасят NаНСО 3 и экстрагируютEtOAc. Органический слой промывают водой(2 х 100 мл) и солевым раствором перед сушкой над сульфатом магния. После фильтрации и выпаривания растворителя полученный в результате остаток растирают с 1:1 эфиром:гексаном, 39 получая продукт (9,1 г, 83%) VIII-TBDPS,имеющий следующие спектральные свойства: 1 Н ЯМР (ДМСО-d6)11,95 (с, 1 Н); 9,21 (д,J=1,8, 1 Н); 7,80-7,20 (м, 16 Н); 7,13 (дд, J=8,1,2,7, 1 Н); 4,83 (с, 2 Н); 4,13 (с, 2 Н); 1,25 (с, 9 Н); МС m/z (M+H) рассчитано 549, найдено 549. Синтез II-17 в фазе растворителя. Раствор VIIIA-TBDPS (102,5 мг) в пиридине (4,0 мл) промывают струй аргона и обрабатывают 1,0 мл Тритона В (0,45 М в пиридине) и диэтоксибутиральдегид (140 мкл) [полученный в соответствии с описанным в литературе способом Paquette, L.A., Backhaus, D., Braum, R.,Underiner, T.L., and Fuchs, K.J. Am. Chem. Soc. 1997, 119, 9662-71]. После перемешивания в течение 2 ч реакционную смесь экстрагируют вEtOAc, промывают 10% водным CuSO4 (3 х 50 мл), солевым раствором и сушат над сульфатом магния. После фильтрации и выпаривания растворителя остаток элюируют через силикагель(30% EtOAc/гексан), и УФ активные фракции концентрируют, переносят в CH2Cl2 (10 мл) и обрабатывают этератом ВF3 (10 мкл). После перемешивания в течение 0,5 ч растворитель промывают насыщенным водным NaHCO3 и солевым раствором до сушки над сульфатом магния. Удаление растворителя на роторном испарителе дает остаток, который очищают с помощью колоночной хроматографии (силикагель, 25% EtOAc/гексан), получая продукт (75,5 мг), имеющий следующие спектральные свойства: 1H ЯМР (ДМСО-d6)9,08 (д, J=7,2, 1 Н); 7,86 (д, J=8,2, 1H); 7,73 (д, J = 6,9, 1H); 7,70-7,24TBDPSзащищенного II-1a с помощью ВЭЖХ на хиральной фазе (оптически активной) и получение соединений II-14 а и II-14b.TBDPS-защищенное II-1a растворяют в минимальном количестве (1:4, о/о) СНСl3:ЕtOН,и 500 мкл порции наносят на CHIRACEL OD колонку (1 см IDx25 см), и в качестве элюента используют 100% этанол (1,5 мл/мин). Фракции из каждого прогона, соответствующие энантиомеру А (24,0-27,0 мин) и энантиомеру В (36,039,0 мин) собирают и концентрируют раздельно. Отдельные энантиомерыTBDPSзащищенного II-1a переносят в ТГФ (12 мл) и добавляют к 0,1 М водному раствору KF (4,6 мл), забуференного HF (0,125 мл 0,1 М водного раствора). Каждый раствор перемешивают в течение 40 ч. Раствор переносят в DCM и промывают водным NаНСО 3. Водный слой экстрагируют DCM (3 х 100 мл), и объединенные органические слои сразу пропускают через слой МgSO4 и выпаривают до получения остатка,который растирают с 1:1 эфиром:гексаном и очищают с помощью препаративной ВЭЖХ, как 40 описано в примере 8-А. Время удерживания ВЭЖХ и данные МС спектрального анализа каждого энантиомера соответствуют аутентичному II-1a. Соединение II-14 а (2,84 мг) получают в 97% ее, и соединение II-14b (3,52 мг) получают в 90% ее, что определено с помощью ВЭЖХ на хиральной фазе. Хиральную чистоту отдельных энантиомеров определяют с помощью колонки CHIRACEL OD (0,46 см IDx5 см),используя в качестве элюента 1:1 метанол/этанол (0,25 мл/мин). Rt=для II-14 а: 14,0 мин и Rt=для II-14b: 20,5 мин. Пример 19. Синтез соединения II-15. К суспензии VIII-A (1 г, 3,2 ммоль) в ТГФ(40 мл) добавляют NBS (632 мг, 3,5 ммоль), и реакционную смесь перемешивают в течение 18 ч. Растворитель удаляют в вакууме, и полученное в результате желто-оранжевое твердое вещество суспендируют в метаноле (50 мл). Взвесь фильтруют, и твердое вещество промывают метанолом. После сушки соединение брома (R3=Br) (1,09 г, 2,8 ммоль, выход 88%) извлекают в виде бледно-желтого твердого вещества: (МС: m/z (M+H) 389, 391). К раствору вышеприведенного бромида(1,09 г, 2,8 ммоль) в бензоле (60 мл) и Nметилпирролидиноне (6 мл) добавляют 4,4'диметоксибензгидрол (818 мг, 3,4 ммоль) и паратолуолсульфоновую кислоту (532 мг, 2,8 ммоль), и смесь нагревают при кипячении с обратным холодильником. Через 24 ч реакционную смесь охлаждают до комнатной температуры и разбавляют этилацетатом (200 мл). Органический слой промывают NaHCO3 (2 х), водой(2 х) и солевым раствором (2 х). Органический слой сушат над безводным сульфатом магния, и растворитель удаляют в вакууме. Сырой материал очищают посредством колоночной хроматографии (10% EtOAc-гексан), получая требуемый DMB-защищенное 3-броминдольное производное (1,5 г, 2,4 ммоль, выход 87%) в виде оранжевого твердого вещества: (МС: m/z (M+H) 615, 617). 250 мл герметично закрывающиеся пробирки заполняют DMB-защищенным 3-бром соединением (1,5 г, 2,4 ммоль), бис(трифенилфосфинил)палладия дихлоридом (100 мг, 0,14 ммоль),безводным ацетатом натрия (3,9 г, 4,8 ммоль) и метоксиэтанолом (50 мл). Пробирку попеременно то опустошают, то наполняют СО, оставляя ее в атмосфере СО. Затем ее опускают в масляную баню при 150 С. Через 4 ч пробирку охлаждают до комнатной температуры и снова заполняют СО. Это повторяют еще раз при протекании реакции в целом в течение 10 ч. Реакционную смесь разбавляют этилацетатом (250 мл), промывают водой,сушат над безводным сульфатом магния, фильтруют и сушат в вакууме. Остаток растирают с метанолом, получая 3-карбокси соединение (1,29 г,2,02 ммоль, выход 84%) в виде желтого твердого вещества: МС: m/z (M+H) 639. 41 К раствору вышеприведенного сложного эфира (1,2 г, 1,9 ммоль) в метиленхлориде (20 мл) добавляют тиоанизол (1 мл) и затем ТФУА(4 мл). После перемешивания в течение 1 ч при комнатной температуре реакционную смесь выпаривают до сухого состояния, и остаток суспендируют в диэтиловом эфире. Суспензию фильтруют и твердое вещество промывают диэтиловым эфиром до обесцвечивания фильтрата. Твердое вещество сушат в вакууме, получая сложный эфир (636 мг, 1,54 ммоль) в виде почти белого твердого вещества: МС: m/z (M+H) 423. Вышеприведенный сложный эфир (500 мг,1,2 ммоль) суспендируют в метиленхлориде (15 мл), и добавляют раствор диизобутилалюмогидрида в метиленхлориде (5,5 мл, 5,5 ммоль, 1,0 М). Через 2 ч при комнатной температуре реакцию гасят метанолом. Растворитель удаляют на роторном испарителе, и к остатку добавляют воду. Взвесь фильтруют, и твердое вещество сушат в вакууме. Требуемый продукт [A1, A2=O, B1B2=H,R3=3-СН 2 ОН, R4=R5=R6=H, Q=NH] (367 мг, 1,08 ммоль) получают в виде бледно-желтого твердого вещества: МС: m/z (M+H) 341 m/e. Вышеприведенный спирт (360 мг, 0,9 ммоль) [A1, A2=O, B1B2=H2, R3=3-CH2OH,R4=R5=R6=H, Q=NH] помещают в герметично закрывающуюся пробирку с этанолом (15 мл). К этой суспензии добавляют трифторуксусный ангидрид (254 мл, 1,8 ммоль). Реакционную смесь нагревают при 70 С в течение 15 ч. Пробирку охлаждают, и растворитель удаляют в вакууме. Полученное в результате твердое вещество растирают с метанолом, фильтруют и сушат, получая требуемый эфир (239 мг, 0,65 ммоль, выход 72%) в виде оранжевого твердого вещества: МС: m/z (M+H) 369. Следуя способу примера 11, вышеприведенный эфир (100 мг, 0,27 ммоль) силилируют в ДМФ (5 мл) с триэтиламином (0,75 мл, 0,54 момль) и трет-бутилдиметилсилилхлоридом(81,0 мг, 0,54 ммоль). После обработки водой и выпаривания растворителя твердое вещество растирают с эфиром:гексаном (1:1), получая продукт (114,6 мг, 0,24 ммоль, выход 88%) в виде оранжевого твердого вещества: МС: m/z(M+H) 483. Следуя способу из примера 12, раствор вышеприведенного эфира (23,0 мг, 0,048 ммоль) в пиридине (4,0 мл) продувают струй аргона и обрабатывают с 200 мкл Тритона В (0,45 М в пиридине) и 5,5-диметил-1,3-диоксан-2 пропиональдегидом (50 мкл). Khanna, I.K.,Weier, R.M., Yu. Y.; Collins, P.W.; Miyashiro,J.M; et al., J. Med. Chem. 1997, 40, 1619-33,включенный здесь в качестве ссылки в полном объеме. Через 0,5 ч добавляют дополнительное количество Тритона В (200 мкл, 0,45 М в пиридине). Это повторяют еще 2 раза. Наконец, реакционную смесь экстрагируют в EtOAc, промывают 10% водным CuSO4 (3 х 50 мл), солевым раствором и сушат над сульфатом магния. По 004066 42 сле фильтрации и выпаривания растворителя остаток элюируют через силикагель (30%EtOAc/гексан), и УФ активные фракции концентрируют, переносят в CH2Cl2 (4 мл) и обрабатывают каталитическим количеством пиридиния тозилата (1 мг). Смесь нагревают при кипячении с обратным холодильником в течение 48 ч и затем растворитель удаляют в вакууме. Полученный в результате остаток переносят в ТГФKF (2,9 мл), забуференного HF (0,09 мл 0,1 М водного раствора). После перемешивания в течение 20 ч раствор экстрагируют в DCM и промывают водным NaHCO3. Водный слой экстрагируют DCM (3 х 100 мл), и объединенные органические слои сразу пропускают через слой сульфата магния и выпаривают до получения остатка, который растирают с 1:1 эфиром:гесаном и очищают с помощью препаративной ВЭЖХ, как описано в примере 8-А. Это дает требуемый продукт II-15 (1,26 мг, 6,0%),который имеет следующие спектральные свойства: 1H ЯМР (ДМСО-d6)9,41 (д, J=2,3, 1 Н); 8,53 (с, 1H); 7,90 (с, 1 Н); 7,80-7,25 (м, 5 Н); 6,33(М+Н) рассчитано 437, найдено 437. Пример 20. Синтез соединения II-1b. Получение XIV (DMB-VIIIA). Трехгорловую круглодонную колбу, снабженную верхней механической мешалкой и насадкой ДинаСтарка последовательно заполняют DMB-OH(1,90 г, 10 ммоль). Реакционную смесь нагревают до кипения с обратным холодильником. Через 2 ч реакционная смесь становится гомогенной, и нагревание продолжают еще 2 ч. Реакционную смесь охлаждают до комнатной температуры, разбавляют EtOAc (200 мл), промывают насыщенным водным раствором NаНСО 3 (4 х 100 мл), и водой (4x100 мл) и органический слой сушат над безводным MgSO4, фильтруют и концентрируют в вакууме. Остаток растирают сEtOAc/гексаном, и полученное в результате твердое вещество фильтруют и сушат в глубоком вакууме, получая XIV (фиг. 4) [A1, A2=H2,B1B2=O, R3=R4=R5=R6=H, Q=NH, R'=R=H], (5,2 г, 98%), имеющее следующие спектральные свойства: 1 Н ЯМР (CDCl3)9,54 (д, J=7,82, 1H); 8,55 (с, 1H); 7,68 (д, J=7,8, 1H); 7,60-6,70 (м,15 Н); 4,71 (с, 2 Н); 4,03 (с, 2 Н); 3,78 (с, 6 Н); MCNH4Cl и экстрагируют EtOAc. Органический слой промывают насыщенным водным NаНСО 3 и солевым раствором до сушки над сульфатом магния. Удаление растворителя на роторном испарителе дает остаток, который очищают с помощью колоночной хроматографии (силикагель, 40% EtOAc/гексан), получая две фракции,соответствующие двум диастреоизомерным аддуктам: MC m/z (M+H) 709. Более полярную фракцию (25 мг) переносят в дихлорметан (10 мл) и обрабатывают этератом ВF3 (10 мкл). После перемешивания в течение 1,5 ч раствор промывают насыщенным водным раствором NaHCO3 и солевым раствором и органический слой сушат над безводным сульфатом магния, фильтруют и концентрируют в вакууме. Полученный в результате остаток очищают с помощью препаративной ВЭЖХ, как описано в примере 8-А, получая продукт (1,75 мг), который имеет следующие спектральные свойства: 1(214 мг) в пиридине (4,0 мл) промывают потоком аргона и обрабатывают 750 мкл Тритона ВGonzalez F.S.; Carbohydr, Res. 1983, 297-302,раскрытие которого включено здесь в качестве ссылки в полном объеме] в пиридине (2 мл). Добавляют дополнительное количество Тритона В (250 мкл) в течение 2 ч. После перемешивания в течение еще 0,5 ч реакционную смесь экстрагируют EtOAc, промывают 10% водным CuSO4(3 х 50 мл), солевым раствором и сушат над сульфатом магния. После фильтрации и выпаривания растворителя остаток, элюируют через силикагель (35% EtOAc/гексан), и УФ активные фракции концентрируют, переносят в CH2Cl2(10 мл) и обрабатывают этератом ВF3 (10 мкл). После перемешивания в течение 0,5 ч раствор промывают насыщенным водным NаНСО 3 и солевым раствором до сушки над сульфатом магния. Удаление растворителя на роторном испарителе дает остаток, который очищают с помощью колоночной хроматографии (силикагель, 35% EtOAc/гексан), получая две фракции,соответствующие двум диастереомерным аддуктам: МС m/z (М+Н) 725. Каждый аддукт пе 004066 44 реносят в CH2Cl2 (10 мл) и обрабатывают этератом ВF3 (10 мкл). После перемешивания в течение 0,5 ч растворитель выпаривают на роторном испарителе, и каждый остаток переносят в ТГФ(5,8 мл), забуференный HF (0,20 мл 0,1 М водного раствора). Каждый раствор перемешивают в течение 20 ч, экстрагируют DCM и промывают водным NаНСО 3. Водный слой экстpагируютDCM (3 х 100 мл) и объединенные органические слои сразу пропускают через слой сульфата магния и выпаривают. Полученные в результате два остатка переносят в CH2Cl2 (10 мл) и обрабатывают этератом ВF3 (10 мкл) и перемешивают в течение 48 ч. Каждую реакционную смесь экстрагируютNаНСО 3 и солевым раствором и до сушки над сульфатом магния. Удаление растворителя на роторном испарителе дает остаток, который очищают с помощью препаративной ВЭЖХ, как описано в примере 8-А. Один диастереоизомер,соединение II-16 а (2,38 мг выделено) имеет следующие спектральные свойства: 13 С ЯМР(м, 1 Н); 4,90 (с, 2 Н); 4,70 (м, 1H); 3,80-3,60 (м,2 Н); 3,30-3,00 (м, 2 Н); МС m/z (M+Na) рассчитано 395, найдено 395. Другой диастереомер, соединение II-16b,(выделено 1,00 мг) имеет следующие спектральные свойства: 1H ЯМР (ДМСО-d6)9,21(с, 2 Н); 4,63 (м, 1H); 4,55-4,30 (м, 2 Н); другие сигналы экранируются пиком растворителя; МСm/z (M+Na) рассчитано 395, найдено 395. Композиции формулы II можно также узнать по ссылке к табл. 9, которая представляет определенные предпочтительные воплощения,названные, как формула III, где точно определены хиральные центры . R1, R4, R6 и R7 представляют Н; Y представляет собой О; n равно 1.Z связь связь связь связь связь связь связь связь связь связь связь связь связь связь связь связь связь связь связь связь связь связь связь связьO связь связь связь связь связь связь связь связь связь связь связь связь связь связь связь связь связь связь связь связь связь связь связь связь связь связь связь связь Подразумевается, что каждый из патентов,заявок и напечатанных публикаций, упомянутых в данном патенте, включен здесь в качестве ссылки в полном объеме. Для специалистов в области техники очевидно, что в предпочтительных воплощениях может быть произведен ряд модификаций и изменений, не выходя из области изобретения. Подразумевается, что все подобные изменения входят в область изобретения. связь связь связь связь 4. Соединение по п.1, где R1 представляет собой Н. 5. Соединение по п.1, где R2 представляет собой гидроксил или С 1-С 4 алкил. 6. Соединение по п.1, имеющее формулу где R1, R4, R6 ,R7 представляют собой водород;Z представляет собой связь или О; А 1 и А 2 , В 1 и В 2 выбраны из групп, состоящих из Н и Н или вместе образуют фрагмент =O. 2. Соединение по п.1, представленное диастереомерами формул 10. Фармацевтическая композиция, обладающая свойством ингибирования киназной trk активности, содержащая активное соединение по п.1 и фармацевтически приемлемый носитель. 11. Фармацевтическая композиция по п.10,содержащая соединение по п. 7 и фармацевтически приемлемый носитель. 12. Фармацевтическая композиция для лечения или предупреждения заболеваний простаты, содержащая соединение по п.1 и фармацевтически приемлемый носитель. 13. Фармацевтическая композиция по п.12,где заболеванием простаты является рак простаты или доброкачественная гиперплазия простаты. 50 14. Фармацевтическая композиция для лечения или профилактики ангиогенных заболеваний, содержащая соединение по п.1 и фармацевтически приемлемый носитель. 15. Фармацевтическая композиция по п.14,где ангиогенным заболеванием являются раковые твердые опухоли, эндометриоз, диабетическая ретинопатия, псориаз, гемангиобластома,заболевания глаз или дегенерация желтого пятна (макулярная дегенерация). 16. Фармацевтическая композиция для лечения или профилактики неоплазии, ревматоидного артрита, фиброза легкого, миелофиброза,патологического заживления ран, атеросклероза или рестеноза, содержащая соединение по п.1 и фармацевтически приемлемый носитель. 17. Фармацевтическая композиция для лечения или профилактики болезни Aльцгеймера,амиотрофического латерального склероза, болезни Паркинсона, инсульта, ишемии, болезни Хантингтона, деменции при ВИЧ, эпилепсии,множественного (рассеянного) склероза, периферической невропатии или поражений мозга или спинного мозга, содержащая соединение по п.1 и фармацевтически приемлемый носитель. 18. Способ ингибирования киназной активности trk, включающий доставку соединения по п.1 в количестве, достаточном для получения результата в виде эффективного ингибирования. 19. Способ по п.18, где киназа trk представляет собой trk А. 20. Способ по п.18 , где соединение по п.1 вводят для лечения воспаления. 21. Способ лечения или профилактики заболеваний простаты, включающий назначение нуждающемуся в данном лечении или профилактике больному терапевтически эффективного количества соединения по п.1. 22. Способ по п.21, где заболеванием простаты является рак простаты или доброкачественная гиперплазия простаты. 23. Способ лечения или профилактики ангиогенных заболеваний, включающий назначение нуждающемуся в данном лечении или профилактике больному терапевтически эффективного количества соединения по п.1. 24. Способ по п.23, где ангиогенным заболеванием являются раковые твердые опухоли,эндометриоз, диабетическая ретинопатия, псориаз, гемангиобластома, заболевания глаз или дегенерация желтого пятна. 25. Способ лечения или профилактики заболеваний, при котором активность PDGFR способствует патологическому состоянию,включающий доставку соединения по п.1 в количестве, достаточном для того, чтобы обеспечить контакт рецептора фактора роста из тромбоцитов (PDGFR) с ингибирующим эффективным количеством соединения. 26. Способ лечения или профилактики неоплазии, ревматоидного артрита, фиброза легкого, миелофиброза, патологического заживле 51 ния ран, атеросклероза или рестеноза, включающий назначение больному, нуждающемуся в подобном лечении или профилактике, терапевтически эффективного количества соединения по п.1. 27. Способ лечения или профилактики заболеваний, характеризующихся аберрантой активностью клеток, реагирующих на трофический фактор, включающий доставку соединения по п.1 в количестве, достаточном для обеспечения контакта рецептора трофического фактора клеток с эффективным индуцирующим активность количеством соединения. 52 28. Способ лечения или профилактики болезни Альцгеймера, амиотрофического латерального склероза, болезни Паркинсона, инсульта, ишемии, болезни Хантингтона, деменции при ВИЧ, эпилепсии, множественного (рассеянного) склероза, периферической невропатии или поражений мозга или спинного мозга,включающий назначение больному, нуждающемуся в подобном лечении или профилактике,терапевтически эффективного количества соединения по п.1.
МПК / Метки
МПК: A61K 31/553, C07D 498/22, A61P 35/00
Метки: инденопирролокарбазолы, композиции, мостиковые, лечения, фармацевтические, способы
Код ссылки
<a href="https://eas.patents.su/28-4066-mostikovye-indenopirrolokarbazoly-farmacevticheskie-kompozicii-i-sposoby-lecheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Мостиковые инденопирролокарбазолы, фармацевтические композиции и способы лечения</a>
Предыдущий патент: Кобальтовый катализатор для синтеза углеводородов, способ получения углеводородов
Случайный патент: Консерванты для древесины












