Способ получения производных 2-оксо-1-пирролидина
Формула / Реферат
1. Способ получения производных 2-оксо-1-пирролидина общей формулы (I)
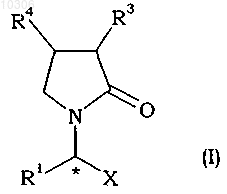
и его солей, где
R1 представляет собой Ra или Rb;
R3 и R4 являются одинаковыми или различными и, каждый независимо, представляют собой водород, гидроксигруппу, тиол, галоген, циано-, карбоксигруппу, группу сульфоновой кислоты, Ra, Rb, С1-С20алкилсульфонил, С6-С10арилсульфонил, C1-С20алкилсульфинил, С6-С10арилсульфинил, C1-С20алкилтио-, С6-С10арилтио-, С1-С20алкокси-, С6-С10арилоксигруппу, сульфонамидную группу, ацил, сложноэфирную группу, амидо, ацилоксигруппу, оксизамещенную сложноэфирную группу или амидооксигруппу;
X представляет собой -CONR5R6, -COOR7 или -CN;
R5, R6, R7 являются одинаковыми или различными и, каждый независимо, представляют собой водород, Ra или Rb;
Ra представляет собой (С1-С20)алкил или (С1-С20)алкил, замещенный одной или несколькими группами гидрокси, тиолом, галогеном, группой циано, группой карбокси, группой сульфоновой кислоты, группой Rb, C1-С20алкилсульфонилом, С6-С10арилсульфонилом, С1-С20алкилсульфинилом, С6-С10арилсульфинилом, группой C1-С20алкилтио, группой С6-С10арилтио, C1-С20алкоксигруппой, группой С6-С10арилокси, сульфонамидной группой, ацилом, сложноэфирной группой, группой амидо, группой ацилокси, оксизамещенной сложноэфирной группой и/или амидооксигруппой;
Rb представляет собой С6-С10арил, гетероарил, содержащий по меньшей мере один атом О, S и/или N, прерывающий карбоциклическую кольцевую структуру, гетероциклоалкил, содержащий по меньшей мере один атом О, S и/или N, прерывающий карбоциклическую кольцевую структуру, или указанный радикал, замещенный одной или несколькими группами Ra, группой гидрокси, тиолом, галогеном, группой циано, группой карбокси, группой сульфоновой кислоты, С6-С10арилом, С1-С20алкилсульфонилом, С6-С10арилсульфонилом, C1-С20алкилсульфинилом, С6-С10арилсульфинилом, группой С1-С20алкилтио, группой С6-С10арилтио, группой C1-С20алкокси, группой С6-С10арилокси, сульфонамидной группой, гетероциклоалкилом, содержащим по меньшей мере один атом О, S и/или N, прерывающий карбоциклическую кольцевую структуру, гетероарилом, содержащим по меньшей мере один атом О, S и/или N, прерывающий карбоциклическую кольцевую структуру, ацилом, сложноэфирной группой, группой амидо, группой ацилокси, оксизамещенной сложноэфирной группой и/или амидооксигруппой;
включающий взаимодействие производного фурана формулы (II) или (III)

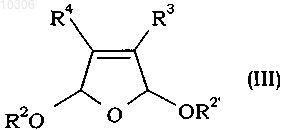
где R2 и R2' являются одинаковыми или различными и каждый представляет собой (С1-С10)алкил или указанный C1-С10алкил, замещенный С6-С10арилом,
с соединением формулы (IV)

и с использованием H2 в присутствии катализатора.
2. Способ по п.1, в котором используют производное фурана формулы (II).
3. Способ по п.1 или 2, где R3 представляет собой водород.
4. Способ по любому из пп.2, 3, где R4 представляет собой Ra или водород.
5. Способ по п.4, где R4 представляет собой (С1-С6)алкил или (C1-С6)алкил, замещенный одним или несколькими галогенами.
6. Способ по п.5, где R4 обозначает н-пропил.
7. Способ по любому из предшествующих пунктов, где X представляет собой -CONR5R6.
8. Способ по п.7, где X обозначает -CONH2.
9. Способ по любому из пп.1-8, где R1 обозначает (С1-С6)алкил.
10. Способ по п.9, где R1 представляет собой этил.
11. Способ по любому из пп.2-10, в котором соединение формулы (II) получают взаимодействием альдегидов формулы (V) с кетокислотой формулы (VI)
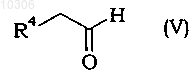
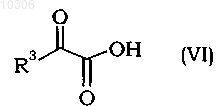
где R3 и R4 являются такими, как определено в п.1, в присутствии основания.
12. Способ по любому из предшествующих пунктов, где соединение формулы (IV) получают посредством нейтрализации соответствующей соли - гидрохлорида.
13. Способ по любому из предшествующих пунктов, где в качестве катализатора используют катализатор на основе Pd, Pt или Ni.
14. Способ по п.13, где катализатор представляет собой катализатор на основе Pd.
15. Способ по любому из предшествующих пунктов, где соединения формулы (I) получают в (S)-форме или в (R)-форме.
16. Способ по п.15, где соединения формулы (I) получают в (S)-форме.
17. Способ по любому из предшествующих пунктов, согласно которому в том случае, когда R3 и/или R4 являются иными, чем водород, полученные диастереоизомеры дополнительно разделяют.
18. Способ по любому из предшествующих пунктов, который используют для получения (2S)-2-((4R)-2-оксо-4-н-пропил-1-пирролидинил)бутанамида.
Текст
010306 Настоящее изобретение относится к способу получения производных 2-оксо-1-пирролидина. В европейском патенте 0162036 описан (S)-(-)этил-2-оксо-1-пирролидинацетамид, для которого также используют непатентованное название леветирацетам, как защитное средство для лечения и профилактики агрессий гипоксического и ишемического типа в отношении центральной нервной системы. Это соединение также эффективно при лечении эпилепсии. Получение леветирацетама описано в европейском патенте 0162036 и в патенте Великобритании 2225322. Другие производные 2-оксо-1-пирролидина и их синтез описаны в опубликованной международной заявке WO 01/62726. В этой заявке, в частности, раскрыт синтез (2S)-2-(2-оксо-4-н-пропил-1 пирролидинил)бутанамида с использованием двухстадийной реакции, где на первой стадии 4-н-пропилгидроксифуранон подвергают взаимодействию с S-2-аминобутирамидом в присутствии NaBH4 для того,чтобы получить и выделить соответствующий ненасыщенный пирролидон, с последующим проведением второй стадии реакции, на которой ненасыщенный пирролидон подвергают гидрированию с использованием NH4COOH в присутствии катализатора Pd/C. Настоящее изобретение относится к простому и экономичному способу получения производных 2 оксо-1-пирролидина. В соответствии с настоящим изобретением предлагается способ получения производных 2-оксо-1 пирролидина общей формулы (I) и их солейR3 и R4 являются одинаковыми или различными и, каждый независимо, представляют собой водород, гидрокси, тиол, галоген, циано, карбокси, группу сульфоновой кислоты, Ra, Rb, алкилсульфонил,арилсульфонил, алкилсульфинил, арилсульфинил, алкилтио, арилтио, алкокси, арилокси, сульфонамидную группу, ацил, сложноэфирную группу, амидо, ацилокси, оксизамещенную сложноэфирную группу или амидооксигруппу;R5, R6, R7 являются одинаковыми или различными и, каждый независимо, представляют собой водород, Ra или Rb;Ra представляет собой (С 1-С 20)алкил или (С 1-С 20)алкил, замещенный одной или несколькими группами гидрокси, тиолом, галогеном, циано, карбокси, группой сульфоновой кислоты, Rb, алкилсульфонилом, арилсульфонилом, алкилсульфинилом, арилсульфинилом, алкилтио, арилтио, алкокси, арилокси,группой сульфонамида, ацилом, сложноэфирной группой, амидо, ацилокси, оксизамещенной сложноэфирной группой и/или амидооксигруппой;Rb представляет собой арил, гетероарил, гетероциклоалкил или указанный радикал, замещенный одной или несколькими группами Ra, гидрокси, тиолом, галогеном, циано, карбокси, группой сульфоновой кислоты, арилом, алкилсульфонилом, арилсульфонилом, алкилсульфинилом, арилсульфинилом, алкилтио, арилтио, алкокси, арилокси, остатком сульфонамида, гетероциклоалкилом, гетероарилом, ацилом, сложноэфирной группой, группой амидо, ацилокси, оксизамещенной сложноэфирной группой и/или амидооксигруппой; включающий взаимодействие производного фурана формулы (II) или (III) где радикалы R2 и R2' являются одинаковыми или различными и каждый представляет собой (С 1 С 10)алкил или указанный алкил, замещенный арилом,с соединением формулы (IV) и с Н 2 в присутствии катализатора. Термин "алкил" при использовании в тексте настоящего изобретения включает насыщенные моновалентные углеводородные радикалы, содержащие линейные, разветвленные или циклические фрагменты или их комбинации и содержащие 1-20 атомов углерода, предпочтительно 1-6 атомов углерода в случае нециклического алкила и 3-8 атомов углерода в случае циклоалкила. Термин "арил" при использовании в тексте настоящего изобретения включает органический радикал, полученный из ароматического углеводорода в результате удаления одного атома водорода, например, такой как фенил, нафтил. Термин "гетероциклоалкил" при использовании в тексте настоящего изобретения означает циклический алкил (циклоалкил), содержащий по меньшей мере один атом О, S и/или N, прерывающий карбоциклическую кольцевую структуру, например, такой как группа тетрагидрофуранил, тетрагидропиранил,пиперидинил, пиперазинил, морфолино и пирролидинил. Термин "гетероарил" при использовании в тексте настоящего изобретения представляет собой"арил", как определено выше, содержащий по меньшей мере один атом О, S и/или N, прерывающий карбоциклическую кольцевую структуру, например, такой как пиридил, фурил, пирролил, тиенил, изотиазолил, имидазолил, бензимидазолил, тетразолил, пиразинил, пиримидил, хинолил, изохинолил, изобензофурил, бензотиенил, пиразолил, индолил, изоиндолил, пуринил, карбазолил, изоксазолил, тиазолил, оксазолил, бензтиазолил или бензоксазолил. Термин "галоген" при использовании в тексте настоящего изобретения включает атом Cl, Br, F, I. Термин "гидрокси" при использовании в тексте настоящего изобретения представляет группу формулы -OH. Термин "тиол" при использовании в тексте настоящего изобретения представляет группу формулы-SH. Термин "циано" при использовании в тексте настоящего изобретения представляет группу формулы-CN. Термин "карбокси" при использовании в тексте настоящего изобретения представляет группу формулы -COOH. Термин "группа сульфоновой кислоты" при использовании в тексте настоящего изобретения представляет группу формулы -SO3H. Термин "сульфонамидная группа" при использовании в тексте настоящего изобретения представляет группу формулы -SO2NH2, в которой один или два атома водорода могут быть необязательно замещены группой "алкил", "арил", "гетероарил" и/или "гетероциклоалкил" или этой же группой, замещенной таким образом, как указано выше. Термин "ацил" при использовании в тексте настоящего изобретения означает группу формулыRCO-, в которой R представляет фрагмент "алкил", "арил", "гетероциклоалкил" или "гетероарил", или указанный фрагмент, замещенный таким образом, как указано выше. Термин "сложноэфирная группа" при использовании в тексте настоящего изобретения представляет группу формулы -COOR, в которой R означает фрагмент "алкил", "арил", "гетероциклоалкил" или "гетероарил", или указанный фрагмент, замещенный таким образом, как указано выше. Термин "алкокси" при использовании в тексте настоящего изобретения включает группы -OR, в которых R означает фрагмент "алкил" или "гетероциклоалкил", или указанный фрагмент, замещенный таким образом, как указано выше. Термин "арилокси" при использовании в тексте настоящего изобретения включает группы -OR, в которых R означает фрагмент "арил" или "гетероарил", или означает указанный фрагмент, замещенный таким образом, как указано выше. Термин "алкилтио" при использовании в тексте настоящего изобретения включает группы -SR, гдеR означает фрагмент "алкил" или "гетероциклоалкил", или указанный фрагмент, замещенный таким образом, как указано выше. Термин "арилтио" при использовании в тексте настоящего изобретения включает группы -SR, где R означает фрагмент "арил" или "гетероарил", или указанный фрагмент, замещенный таким образом, как-2 010306 указано выше. Термин "ацилокси" при использовании в тексте настоящего изобретения представляет группу формулы RCOO-, в которой R означает фрагмент "алкил", "арил", "гетероарил" или "гетероциклоалкил", или указанный фрагмент, замещенный таким образом, как указано выше. Термин "алкилсульфонил" при использовании в тексте настоящего изобретения представляет группу формулы -SO2R, в которой R означает фрагмент "алкил" или "гетероциклоалкил", или указанный фрагмент, замещенный таким образом, как указано выше. Термин "арилсульфонил" при использовании в тексте настоящего изобретения представляет группу формулы -SO2R, в которой R означает фрагмент "арил" или "гетероарил", или указанный фрагмент, замещенный таким образом, как указано выше. Термин "алкилсульфинил" при использовании в тексте настоящего изобретения представляет группу формулы -SO-R, в которой R представляет собой фрагмент "алкил" или "гетероциклоалкил", или указанный фрагмент, замещенный таким образом, как указано выше. Термин "арилсульфинил" при использовании в тексте настоящего изобретения представляет группу формулы -SO-R, в которой R представляет собой фрагмент "арил" или "гетероарил", или указанный фрагмент замещенный таким образом, как указано выше. Термин "оксизамещенная сложноэфирная группа" при использовании в тексте настоящего изобретения означает группу формулы -OCOOR, в которой R представляет собой фрагмент "алкил", "арил","гетероарил" или "гетероциклоалкил", или указанный фрагмент, замещенный таким образом, как указано выше. Термин "амидо" при использовании в тексте настоящего изобретения представляет группу формулы -CONH2, в которой один или несколько атомов водорода может быть необязательно замещенным группой "алкил", "арил", "гетероарил" и/или "гетероциклоалкил", или указанный фрагмент, замещенный таким образом, как указано выше. Термин "амидоокси" при использовании в тексте настоящего изобретения представляет группу формулы -OCONH2, в которой один или оба атома водорода могут быть необязательно замещенными группой "алкил", "арил", "гетероарил" и/или "гетероциклоалкил", или указанную группу, замещенную таким образом, как указано выше. В соответствии со способом согласно настоящему изобретениюRa представляет собой предпочтительно (С 1-С 20)алкил или (С 1-С 20)алкил, замещенный одной или несколькими группами гидрокси, тиолом, галогеном, группой циано, группой карбокси, группой сульфоновой кислоты, арилом, алкилсульфонилом, арилсульфонилом, алкилсульфинилом, арилсульфинилом,группой алкилтио, группой арилтио, группой алкокси, группой арилокси, сульфонамидной группой, гетероциклоалкилом, гетероарилом, ацилом, сложноэфирной группой, группой амидо, группой ацилокси,оксизамещенной сложноэфирной группой и/или амидооксигруппой; иRb предпочтительно представляет собой арил, гетероарил, гетероциклоалкил или указанный радикал, замещенный одной или несколькими группами алкил, группой гидрокси, тиолом, галогеном, группой циано, группой карбокси, группой сульфоновой кислоты, арилом, алкилсульфонилом, арилсульфонилом, алкилсульфинилом, арилсульфинилом, группой алкилтио, группой арилтио, группой алкокси,группой арилокси, сульфонамидной группой, гетероциклоалкилом, гетероарилом, ацилом, сложноэфирной группой, группой амидо, группой ацилокси, оксизамещенной сложноэфирной группой и/или амидооксигруппой. В соединениях формулы (I) и (IV)X предпочтительно представляет собой -CONR5R6, более предпочтительно группу -CONH2.R1 предпочтительно представляет собой (С 1-С 6)алкил, более предпочтительно метил, этил, нпропил, изопропил, н-бутил или изобутил; наиболее предпочтительно метил, этил или н-пропил, в особенности этил. При осуществлении способа согласно настоящему изобретению предпочтительно используют производное фурана формулы (II). В соединениях формулы (I), (II) и (III) R3 предпочтительно представляет собой водород, галоген или (С 1-С 4)алкил. Более предпочтительно R3 представляет собой водород. В том случае, когда используют производное фурана формулы (II), R4 предпочтительно представляет собой Ra или водород, более предпочтительно (С 1-С 6)алкил или (С 1-С 6)алкил, замещенный одной или несколькими группами галогена. Наиболее предпочтительно R4 представляет собой н-пропил. В том случае, когда используют производное фурана формулы (III), R3 и R4 предпочтительно являются одинаковыми. В этом случае R3 и R4 более предпочтительно выбирают из водорода, галогена или(С 1-С 4)алкила. Наиболее предпочтительно R3 и R4 представляют собой водород. В производных фурана формулы (III) R2 и R2' предпочтительно представляют собой (С 1-С 4)алкил или бензил, наиболее предпочтительно метил. Соединения формул (II) и (III), которые используют при осуществлении способа согласно настоящему изобретению, могут быть получены любым подходящим способом. Соединения формулы (II) предпочтительно получают посредством взаимодействия альдегида фор-3 010306 мулы (V) с кетокислотой формулы (VI) в присутствии основания, например, такого как циклический вторичный амин, предпочтительно морфолин, с последующим гидролизом в кислой среде. Взаимодействие, как правило, проводят при температуре, находящейся между 25 и 100 С, предпочтительно между 30 и 60 С. Более предпочтительно, продукт реакции очищают посредством экстракции, в частности, посредством экстракции простым эфиром, в особенности, простым диизопропиловым эфиром. Настоящее изобретение также относится к получению соединения формулы (II) способом, описанным выше в тексте настоящего изобретения. Соединение формулы (IV), которое используют при осуществлении способа согласно настоящему изобретению, может быть получено любым подходящим способом. Предпочтительно его получают посредством нейтрализации соответствующих солей, более предпочтительно из соответствующего гидрохлорида или соли винной кислоты, наиболее предпочтительно из соответствующей соли - гидрохлорида. Способ согласно настоящему изобретению, как правило, осуществляют в присутствии растворителя. Предпочтительные растворители выбирают из спиртов, воды, сложных эфиров, например, таких как этилацетат и ароматические растворители, например, такие как толуол или их смеси. Более предпочтительными растворителями являются спирты. Наиболее предпочтительным является изопропанол. Предпочтительными катализаторами согласно настоящему изобретению являются катализаторы на основе металлов, например, такие как катализаторы на основе Pd, Pt и Ni. Более предпочтительными являются катализаторы на основе Pd, наиболее предпочтительно используют Pd на углероде, например,такой катализатор, как 5% Pd на углероде. Взаимодействие, как правило, проводят при температуре от 25 до 100 С, предпочтительно 30 до 60 С, наиболее предпочтительно при температуре 40 С. Способ согласно настоящему изобретению осуществляют в присутствии водорода. Способ согласно настоящему изобретению, как правило, осуществляют при давлении водорода в интервале от 0,1 до 10 бар, предпочтительно при давлении от 0,2 до 5 бар и наиболее предпочтительно при давлении от 0,2 до 0,5 бар, в закрытом реакторе. Способ согласно настоящему изобретению также подходит для получения фармацевтически приемлемых солей соединения (I). Термин "фармацевтически приемлемые соли" согласно настоящему изобретению включает терапевтически активные, нетоксичные аддитивные соли с основаниями и нетоксичные аддитивные соли с кислотами, которые могут образовывать соединения формулы (I). Способ согласно настоящему изобретению относится к получению всех стереоизомерных форм, таких как геометрические и оптические энантиомерные и диастереоизомерные формы соединения формулы (I) и их смеси (включая рацематы). Соединения формулы (I) и (IV) имеют в своей структуре по меньшей мере один стереогенный центр, атом углерода, который присоединяется к атому азота пирролидинового кольца. Этот стереогенный центр обозначается звездочкойв соединениях формулы (I) и (IV). Этот стереогенный центр может находиться в R- или S-конфигурации, указанное R- и S- обозначение используется в соответствии с правилами, описанными в Pure. Appl. Chem., т. 45 (1976), c. 11-30. Способ согласно настоящему изобретению предпочтительно используют для получения соединения формулы (I) в (S)- или в (R)-форме. Термин "(S)-форма" при использовании в тексте настоящего изобретения означает, что рассматриваемое соединение состоит более чем на 50%, предпочтительно более чем на 90% из энантиомера,имеющего стереогенный атом углерода, обозначенный звездочкой, в S-конфигурации. Термин "(R)-форма" при использовании в тексте настоящего изобретения означает, что рассматриваемое соединение состоит более чем на 50%, предпочтительно более чем на 90% из энантиомера,имеющего стереогенный атом углерода, обозначенный звездочкой, в R-конфигурации. Способ согласно настоящему изобретению, в частности, подходит для получения соединений общей формулы (I) в (S)-форме. В этом случае, способ согласно настоящему изобретению предпочтительно осуществляют с использованием соединения формулы (IV) в (S)-форме или в (R)-форме. Неожиданно было обнаружено, что при осуществлении способа согласно настоящему изобретению не происходит рацемизация. В том случае, когда R3 и/или R4 являются иными, чем водород, соединения формулы (I) содержат в своей структуре по меньшей мере один дополнительный стереогенный центр, т.е. атом углерода, к которому присоединяются такие заместители R3 и R4.-4 010306 В этом случае, способ может включать дополнительную стадию, на которой разделяют полученные диастереоизомеры. Такое разделение может быть осуществлено с использованием любых подходящих средств. Предпочтительно использовать хроматографию, в особенности, с использованием хиральной стационарной фазы. Способ согласно настоящему изобретению, в частности, используют для получения соединения формулы (I) в (2S,4S) и (2S,4R)-форме. Термин (2S,4S)-[соответственно, (2S,4R)-] при использовании в тексте настоящего изобретения означает, что рассматриваемое соединение состоит более чем на 50%,предпочтительно более чем на 90% из диастереоизомера, у которого стереогенный атом углерода, обозначенный звездочкой, находится в S-конфигурации, а атом углерода, к которому присоединяется радикал R4, находится в S-конфигурации [соответственно, R-конфигурации]. Приведенные ниже примеры служат только для иллюстрации настоящего изобретения и их не следует рассматривать и толковать каким-либо образом как ограничение объема изобретения. Специалисту в данной области техники будет понятно, что в соответствии с установившейся практикой в пределах объема настоящего изобретения могут быть выполнены различные модификации и вариации. Пример 1. Синтез (2S)-2-4R)-2-оксо-4-н-пропил-1-пирролидинил)бутанамида. 1.1. Синтез (2S)-2-аминобутирамида - свободного основания. В реактор емкостью 5 л вводят 1800 мл изопропанола. Добавляют при перемешивании при комнатной температуре 1800 г тартрата (2S)-2-аминобутирамида. Медленно добавляют 700 мл 25%-ного водного раствора гидроксида аммония, при этом температуру поддерживают ниже 25 С. Полученную смесь перемешивают дополнительно в течение 3 ч и затем оставляют реакционную смесь при 18 С на 1 ч для завершения реакции. Тартрат аммония отфильтровывают. Выход: 86%. 1.2. Синтез 5-гидрокси-4-н-пропил-фуран-2-она. Гептан (394 мл) и морфолин (127,5 мл) вводят в реактор. Полученную смесь охлаждают до 0 С и добавляют глиоксиловую кислоту (195 г, 150 мл, 50 мас.% в воде). Полученную смесь нагревают при 20 С в течение 1 ч и затем добавляют валериановый альдегид (148,8 мл). Реакционную смесь нагревают при 43 С в течение 20 ч. После охлаждения до 20 С к полученной смеси медленно добавляют 37%-ный водный раствор HCl (196,9 мл), после чего перемешивают в течение 2 ч. После удаления гептановой фазы водную фазу промывают три раза гептаном. Добавляют к водной фазе простой диизопропиловый эфир. Органическую фазу удаляют и затем водную фазу дополнительно экстрагируют простым диизопропиловым эфиром (2 х). Фазы простого диизопропилового эфира объединяют, промывают насыщенным раствором соли и затем высушивают посредством азеотропной перегонки. После фильтрации и упаривания растворителя получают 170 г 5-гидрокси-4-н-пропилфуран-2-она в виде коричневого маслянистого вещества. Выход: 90,8%. 1.3. Синтез (2S)-2-4R)-2-оксо-4-н-пропил-1-пирролидинил)бутанамида и (2S)-2-4S)-2-оксо-4-нпропил-1-пирролидинил)бутанамида. Раствор (2S)-2-аминобутирамида в изопропаноле, содержащий 250 г соединения, полученного таким образом, как описано выше в тексте настоящего изобретения, высушивают посредством азеотропной перегонки в вакууме. К высушенному раствору (2S)-2-аминобутирамида добавляют 5-гидрокси-4-нпропилфуран-2-он (290 г) при температуре от 15 до 25 С; полученную смесь нагревают до 30 С и выдерживают по меньшей мере 2 ч при этой температуре. Добавляют уксусную кислоту (1,18 экв.), катализатор Pd/C (5 мас./мас.%; 5% Pd на углероде - тип 87L, Johnson Matthey) и под давлением вводят в систему водород. Температуру поддерживают равной максимально 40 С, а давление Н 2 - от 0,2 до 0,5 бар, с последующим перемешиванием в течение по меньшей мере 20 ч после начальной реакции. После этого раствор охлаждают до температуры от 15 до 25 С и затем фильтруют для того, чтобы удалить катализатор. Раствор продукта в изопропанольном растворителе заменяют на раствор продукта в изопропилацетате посредством азеотропной перегонки с изопропилацетатом. Органический раствор промывают водным раствором бикарбоната натрия с последующей промывкой насыщенным раствором соли и фильтрацией. После перекристаллизации получают 349 г (2S)-2-4R)-2-оксо-4-н-пропил-1-пирролидинил)бутанамида и (2S)-2-4S)-2-оксо-4-н-пропил-1-пирролидинил)бутанамида (выход: 82,5%).-5 010306 1.4. Получение (2S)-2-4R)-2-оксо-4-н-пропил-1-пирролидинил)бутанамида. Хроматографическое разделение двух диастереоизомеров, полученных в примере 1.3, осуществляют с использованием хиральной стационарной фазы (CHIRALPAK AD 20 мкм) и смеси в соотношении 45/55 (объем/объем) н-гептана и этанола в качестве элюента при температуре, составляющей 252 С. Неочищенный (2S)-2-4R)-2-оксо-4-н-пропил-1-пирролидинил)бутанамид, полученный таким образом, перекристаллизовывают из изопропилацетата, получая при этом чистый (2S)-2-4R)-2-оксо-4-нпропил-1-пирролидинил)бутанамид (суммарный выход: 80%). Пример 2. Синтез (2S)-2-4R)-2-оксо-4-н-пропил-1-пирролидинил)бутанамида. Пример 1 повторяют, с тем исключением, что на стадии 1.1 используют раствор (2S)-2 аминобутирамидаHCl в изопропаноле (27,72 г, 1,2 экв.), который нейтрализуют, используя растворNH3/изопропанол (3,4-3,7 моль/л). Полученный хлорид аммония удаляют из этого раствора посредством фильтрации и затем раствор непосредственно используют для проведения взаимодействия с 5-гидрокси 4-н-пропил-фуран-2-оном (23,62 г, 1,0 экв.) без промежуточной сушки раствора (2S)-2-аминобутирамида. Выход после разделения двух диастереоизомеров и перекристаллизации: приблизительно 84%. Пример 3. Синтез (S)-(-)этил-2-оксо-1-пирролидинацетамида.(2S)-2-Аминобутирамид - свободное основание (2 г) растворяют в воде (80 мл) и добавляют 2,5 диметокси-2,5-дигидрофуран (2,4 мл, 1 экв.). Добавляют водный раствор HCl (2,4 мл, 1,5 экв.) при комнатной температуре и затем полученную реакционную смесь перемешивают в течение 1,5 ч. После этого добавляют карбонат натрия до тех пор, пока значение pH полученной смеси не достигнет величины 8-9. Затем добавляют Pd/C (5%) катализатор в смеси с водой и этанолом (20 мл) и в атмосфере H2 выдерживают в течение 35 мин. Полученный раствор охлаждают до 15-25 С и затем фильтруют для того, чтобы удалить катализатор. Этанол удаляют в вакууме и после этого целевое соединение экстрагируют этилацетатом; органический раствор затем промывают насыщенным раствором соли, высушивают над сульфатом магния и упаривают, получая при этом (S)-(-)этил-2-оксо-1-пирролидинацетамид (выход: 13%). Пример 4. Синтез метилового эфира 1-[(1S)-1-(аминокарбонил)пропил]-5-оксо-3-пирролидинкарбоновой кислоты.(40 мл) добавляют к раствору (2S)-2-аминобутирамида (2,0 г) в метаноле (30 мл) в реакторе для проведения гидрирования и затем полученную смесь выдерживают по меньшей мере 2 ч при комнатной температуре. Затем добавляют катализатор Pd/C (10 мас./мас.%; 5% Pd на углероде - тип 87L, фирма JohnsonMatthey) и вводят в систему водород под давлением. Значение температуры поддерживают максимум 40 С, а давление водорода - от 4 до 5 бар, с последующим перемешиванием в течение по меньшей мере 20 ч после начальной реакции. Затем раствор охлаждают до температуры 15-25 С и фильтруют для того,чтобы удалить катализатор. Растворитель упаривают в вакууме, и затем полученный желтый продукт очищают посредством препаративной жидкостной хроматографии (элюент:дихлорметан/метанол (95:5-6 010306 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения производных 2-оксо-1-пирролидина общей формулы (I)R3 и R4 являются одинаковыми или различными и, каждый независимо, представляют собой водород, гидроксигруппу, тиол, галоген, циано-, карбоксигруппу, группу сульфоновой кислоты, Ra, Rb, С 1 С 20 алкилсульфонил,С 6-С 10 арилсульфонил,C1-С 20 алкилсульфинил,С 6-С 10 арилсульфинил,C1 С 20 алкилтио-, С 6-С 10 арилтио-, С 1-С 20 алкокси-, С 6-С 10 арилоксигруппу, сульфонамидную группу, ацил,сложноэфирную группу, амидо, ацилоксигруппу, оксизамещенную сложноэфирную группу или амидооксигруппу;R5, R6, R7 являются одинаковыми или различными и, каждый независимо, представляют собой водород, Ra или Rb;Ra представляет собой (С 1-С 20)алкил или (С 1-С 20)алкил, замещенный одной или несколькими группами гидрокси, тиолом, галогеном, группой циано, группой карбокси, группой сульфоновой кислоты,группой Rb, C1-С 20 алкилсульфонилом, С 6-С 10 арилсульфонилом, С 1-С 20 алкилсульфинилом, С 6 С 10 арилсульфинилом, группой C1-С 20 алкилтио, группой С 6-С 10 арилтио, C1-С 20 алкоксигруппой, группой С 6-С 10 арилокси, сульфонамидной группой, ацилом, сложноэфирной группой, группой амидо, группой ацилокси, оксизамещенной сложноэфирной группой и/или амидооксигруппой;Rb представляет собой С 6-С 10 арил, гетероарил, содержащий по меньшей мере один атом О, S и/илиN, прерывающий карбоциклическую кольцевую структуру, гетероциклоалкил, содержащий по меньшей мере один атом О, S и/или N, прерывающий карбоциклическую кольцевую структуру, или указанный радикал, замещенный одной или несколькими группами Ra, группой гидрокси, тиолом, галогеном, группой циано, группой карбокси, группой сульфоновой кислоты, С 6-С 10 арилом, С 1-С 20 алкилсульфонилом,С 6-С 10 арилсульфонилом, C1-С 20 алкилсульфинилом, С 6-С 10 арилсульфинилом, группой С 1-С 20 алкилтио,группой С 6-С 10 арилтио, группой C1-С 20 алкокси, группой С 6-С 10 арилокси, сульфонамидной группой, гетероциклоалкилом, содержащим по меньшей мере один атом О, S и/или N, прерывающий карбоциклическую кольцевую структуру, гетероарилом, содержащим по меньшей мере один атом О, S и/или N, прерывающий карбоциклическую кольцевую структуру, ацилом, сложноэфирной группой, группой амидо,группой ацилокси, оксизамещенной сложноэфирной группой и/или амидооксигруппой; включающий взаимодействие производного фурана формулы (II) или (III) где R2 и R2' являются одинаковыми или различными и каждый представляет собой (С 1-С 10)алкил или указанный C1-С 10 алкил, замещенный С 6-С 10 арилом,с соединением формулы (IV) и с использованием H2 в присутствии катализатора. 2. Способ по п.1, в котором используют производное фурана формулы (II). 3. Способ по п.1 или 2, где R3 представляет собой водород. 4. Способ по любому из пп.2, 3, где R4 представляет собой Ra или водород. 5. Способ по п.4, где R4 представляет собой (С 1-С 6)алкил или (C1-С 6)алкил, замещенный одним или несколькими галогенами. 6. Способ по п.5, где R4 обозначает н-пропил. 7. Способ по любому из предшествующих пунктов, где X представляет собой -CONR5R6.-7 010306 8. Способ по п.7, где X обозначает -CONH2. 9. Способ по любому из пп.1-8, где R1 обозначает (С 1-С 6)алкил. 10. Способ по п.9, где R1 представляет собой этил. 11. Способ по любому из пп.2-10, в котором соединение формулы (II) получают взаимодействием альдегидов формулы (V) с кетокислотой формулы (VI) где R3 и R4 являются такими, как определено в п.1, в присутствии основания. 12. Способ по любому из предшествующих пунктов, где соединение формулы (IV) получают посредством нейтрализации соответствующей соли - гидрохлорида. 13. Способ по любому из предшествующих пунктов, где в качестве катализатора используют катализатор на основе Pd, Pt или Ni. 14. Способ по п.13, где катализатор представляет собой катализатор на основе Pd. 15. Способ по любому из предшествующих пунктов, где соединения формулы (I) получают в (S)форме или в (R)-форме. 16. Способ по п.15, где соединения формулы (I) получают в (S)-форме. 17. Способ по любому из предшествующих пунктов, согласно которому в том случае, когда R3 и/или R4 являются иными, чем водород, полученные диастереоизомеры дополнительно разделяют. 18. Способ по любому из предшествующих пунктов, который используют для получения (2S)-24R)-2-оксо-4-н-пропил-1-пирролидинил)бутанамида.
МПК / Метки
МПК: C07D 207/26
Метки: получения, 2-оксо-1-пирролидина, производных, способ
Код ссылки
<a href="https://eas.patents.su/9-10306-sposob-polucheniya-proizvodnyh-2-okso-1-pirrolidina.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения производных 2-оксо-1-пирролидина</a>
Предыдущий патент: Стереоселективное биопревращение алифатических динитрилов в цианокарбоновые кислоты
Следующий патент: Фармацевтическое соединение
Случайный патент: Водосчетчик













