Способ получения (r)-(-)-5(2-аминопропил)-2-метоксибензолсульфонамида
Формула / Реферат
1. Способ получения (R)-(-)-5(2-аминопропил)-2-метоксибензолсульфонамида формулы I
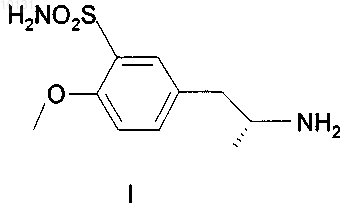
характеризующийся тем, что
а) вводят защитную группу в N-[(1R)-2-(4-метоксифенил)-1-метилэтил]-N-[(1R)-1-фенилэтил)]амин формулы VIII
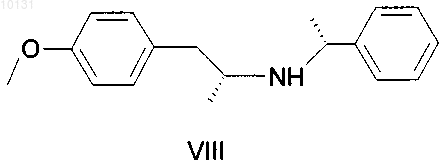
с получением амида, имеющего формулу IX
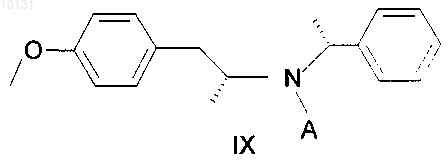
где А представляет собой ацильную группу с 2-8 атомами углерода,
б) после чего амид формулы IX подвергают хлорсульфированию, а образовавшийся сульфохлорид превращают в сульфонамид, имеющий формулу X
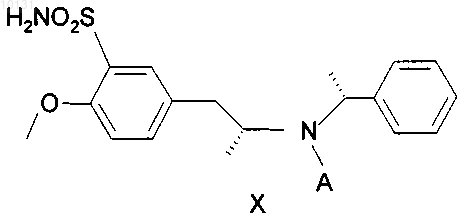
где А - такое, как определено выше,
в) сульфонамид формулы X подвергается гидрированию и деацилированию с получением соединения формулы I.
2. Способ по п.1, характеризующийся тем, что защитная группа А представляет собой ацетил.
3. Способ по п.2, характеризующийся тем, что в качестве ацетилирующего агента используют ацетангидрид при температуре 50-100шС.
4. Способ по п.1, характеризующийся тем, что сульфохлорид, образующийся после хлоросульфирования, не выделяют, а превращают непосредственно в сульфонамид с помощью аммиака.
5. Способ по п.4, характеризующийся тем, что хлорсульфирование проводят в метиленхлориде при температуре от -30 до +30шС.
6. Способ по п.1, характеризующийся тем, что гидрирование выполняют в присутствии палладия в качестве катализатора.
7. Способ по п.6, характеризующийся тем, что катализатором является 3%-ный Pd/C с 50%-ным содержанием воды и гидрирование проводят при давлении 2 МПа и температуре 80-85шС.
8. Сульфонамид формулы X
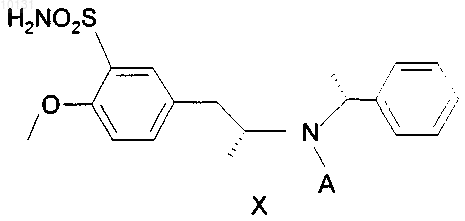
где А - такое, как определено в п.1.
9. Сульфонамид по п.8, где А является ацетилом
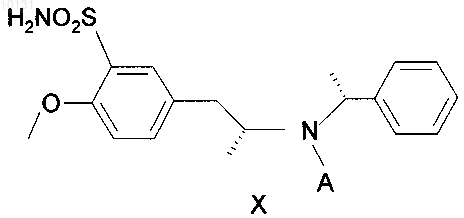
где А - такое, как определено в п.1.
10. Сульфонамид по п.9, где А является ацетилом.
Текст
010131 Область техники Изобретение относится к усовершенствованному способу получения (R)-(-)-5(2-аминопропил)-2 метоксибензолсульфонамида, имеющего формулу I который является важным промежуточным продуктом для получения медицинского продукта(R)-(-)-5-[2-[2-(2-этоксифенокси)этиламино]пропил]-2-метоксибензолсульфонамида, известного под непатентованным международным названием тамсулозин формулы II: Предшествующий уровень техники Вещество II известно в качестве селективного блокатора 1C рецепторов, что позволяет использовать его для лечения заболеваний, связанных с задержкой мочи по причине гиперпластичности простаты,без воздействия на кровяное давление. Этим свойством данное вещество выделяется из многих других блокаторов 1C рецепторов, не действующих селективно и поэтому дающих побочные эффекты в виде гипотонии, обуславливающей различные неприятные состояния у пациента (например, ЕР 710 486). Смесь (R) и (S) энантиомеров 5-[2-[2-(2-этоксифенокси)этиламино]пропил]-2-метоксибензолсульфонамида (далее в документе - рацемический тамсулозин) была описана в патенте ЕР 34 432. Способ получения группы сульфамоилфенилэтиламиновых производных, заявленных в патенте, заключается в восстановительном аминировании (или аминировании с последующим восстановлением) кетонов типа Группа веществ, описанная в патенте ЕР 34 432, характеризовалась свойством блокироватьадренергические рецепторы, что делает эти вещества подходящими агентами для лечения многих заболеваний, особенно гипертонии, застойной сердечной недостаточности или проблем, связанных с мочевыводящими путями. Позднее оказалось, что вышеупомянутое вещество II, особенно (R)-энантиомер, проявляет селективность при лечении проблем, связанных с гиперпластичностью простаты, не оказывая влияния на кровяное давление или деятельность сердца (Honda K. And Nakagawa С: Alpha-1-adrenoreceptor antagonisteffect of optical isomers YM-12617 in rabbit lower urinary tract and prostate- J. Pharm Exp. Ther.239, 512,(1986. Это привело к поиску эффективной схемы синтеза оптически активного вещества II. В патенте Австрии AT 397960 синтез (R)-тамсулозина (II) осуществляют реакцией оптически активного амина, имеющего формулу I, с бромированым эфиром, имеющим формулу IV Данный способ синтеза считается очень эффективным, при условии, что исходный амин I получен согласно способу, описанному в патенте ЕР 257787, или в патенте ЕР 380 144, выданному по выделенной заявке.-1 010131 В патентах описан путь синтеза, показанный на следующей схеме: Реакция кетона III с (R)метилбезиламином в восстановительной среде при катализе PtO2 дает в результате оптически активный (R,R)-диастереоизомер V с высокой оптической чистотой (около 92%). Этот промежуточный продукт далее перекристаллизовывают с получением высокой оптической чистоты и превращают гидрогенолизом в оптически активный (R)-гидрохлорид VI. Последний превращают в сам(R)-амин формулы I, действуя на него основанием. Однако воспроизведение этой процедуры показало, что выход (R)-амина I составляет от 10 до 15%,а выход конечного продукта тамсулозина II составляет лишь примерно 4-5% от теоретического выхода. Выход на последней стадии синтеза, т.е. получение вещества II из вещества I, был увеличен согласно патенту CZ 291802. Тем не менее, еще остается проблема очень низкого выхода важного промежуточного продукта I. Однако неожиданно был найден способ получения соединения I, дающий вдвое больший выход. Описание изобретения Исходным веществом для получения амина формулы I служит метилбензилкетон (VII), из которого получают N-[(1R)-2-(4-метоксифенил)-1-метилэтил]-N-[(1R-фенилэтил)]амингидрохлорид формулы VIII посредством восстановительного аминирования Гидрирование осуществляют при нормальном давлении в течение примерно 12 ч с добавлением катализатора в количестве 0,6 г/1 моль метилбензилкетона, что составляет около 60% от расхода, указанного в патенте ЕР 257 787. Учитывая то, что стоимость катализатора составляет значительную часть от стоимости сырья, это является существенной экономией. Указанный способ также позволяет избежать многократной очистки в ацетоне и в водно-ацетоновой смеси; в большинстве случаев, достаточно повторить очистку в ацетоне лишь 1-3 раза. Снижение требований к оптической чистоте от предельной 0,2% до приемлемого содержания в количестве 0,4% R,S-энантиомера никак не влияет на высокую оптическую чистоту конечного продукта формулы II. Выход реакции составляет около 50%. Введение защитной группы А, где А может являться ацильной группой с 2-8 атомами углерода в своем составе, такой как, например, ацетил, пропионил, гексаноил или бензоил, реакцией с безводной кислотой, галогенидом или ангидридом соответствующей кислоты, приводит к получению амида формулы IX После N-ацетилирования ацетангидридом получают, таким образом, N-[(1R)-2-(4-метоксифенил)-1 метилэтил]-N-[(1R)-1-фенилэтил]ацетамид. Реакция идет 4-6 ч при температуре от 60 до 70 С с высоким выходом, составляющим около 100%. Амид, имеющий формулу IX, затем подвергают хлорсульфированию и полученный сульфохлорид превращают в сульфонамид. Реакцию с хлорсульфоновой кислотой ведут предпочтительно в дихлорметане с охлаждением до температуры от -30 до +30 С. Также эффективно разложение реакционной смеси добалением смеси льда и 25%-ного водного раствора аммония. Данная процедура приводит к получению непосредственно Такой способ позволяет избежать процедуры выделения промежуточного продукта, а также использования другого растворителя (тетрагидрофурана) в синтезе. Выход реакции неожиданно высок и составляет до 96%. Гидрирование на палладии в уксусной кислоте с добавлением разбавленной соляной кислоты при температуре от 80 до 85 С и давлении 2 МПа приводит к отщеплению этилбензола с образованием N(1R)-2-[3-(аминосульфонил)-4-метоксифенил]-1-метилэтилацетамида (XI). При гидрировании использовали существенно более дешевый и безопасный катализатор - 3% Pd/C с 50%-ным содержанием воды в количестве 1/10 от веса вводимого вещества формулы X. Выход реакции близок к 100%. Дефлегмация в 5%-ом водном растворе соляной кислоты приводит к деацетилированию промежуточного вещества (XI), а добавлением карбоната осаждают (R)-(-)-5-(2-аминопропил)-2-метоксибензолсульфонамид, имеющий формулу I, который перекристаллизовывают из воды. Выход реакции после кристаллизации составил около 80%. Примеры В экспериментальной части все спектры 1 Н-ЯМР измеряли с использованием прибора фирмыBruker 250-DPX (250,13 и 62,9 МГц),в м.д., J в Гц). Пример 1. Получение N-[(1R)-2-(4-метоксифенил)-1-метилэтил]-N-[(1R)-1-фенилэтил]амина гидрохлорида VIII. 4-метоксибензилметилкетон (VII, 43,2 г), R(+)-метилбензиламин (32,0 г) и катализатор PtO2 (0,16 г) поместили в 2-литровую колбу и добавили метанол (1000 мл). Гидрирование проводили до окончания реакции, с воздушным охлаждением в течение 12 ч при 60 С. После завершения реакции катализатор отфильтровали. Фильтрат упаривали, затем к желтому маслу (69,47 г) добавили 300 мл этанола; образовался желтый раствор. При охлаждении на водяной бане добавляли по каплям 50 мл HCl/EtOH в течение 30 мин; раствор постепенно становился красным. Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Кристаллический осадок отфильтровали с помощью вакуумного насоса и промывали 50 мл этанола. Этот осадок, обнаруженный в двух фракциях, нагревали с обратным холодильником в 500 мл ацетона в течение 1 ч. После охлаждения суспензию перемешивали в течение 2 ч, охлаждая водой, выпавшие кристаллы отфильтровали вакуумным насосом и промывали 50 мл ацетона. Выход составил 48,18 г (59,9%). Далее требовалось провести анализ газовой хроматографией на химическую и оптическую чистоту. Содержание R,S-диастереомера должно быть ниже 0,4%. При более высоком содержании очистку ацетоном повторяют. 1 Н ЯМР:1,41 (d, J=6.5, 3H, СН 2 СН(CH3; 1,95 (d=6.8, 3H, PhCH(CH3; 2,81 (dd, J=10.0, J=12.9, 1 Н,CH2); 3,00 (bm, 1H, CH2CH(CH3; 3,37 (dd, J=4.3, J=13.0, 1H, CH2); 3,76 (s, 3H, CH3O); 4,37 (bm, 1H,PhCH(CH3; 6,78 (m, 2H, CHarom); 6,93 (m, 2H, CHarom); 7,45 (m, 3H, CHarom); 7,69 (m, 2H, CHarom); 9,80 (b,NH, HCl); 10,26 (b, NH, HCl). (CD3OD, 30C) Пример 2. Получение N-[(1R)-2-(4-метоксифенил)-1-метилэтил]-N-[(1R)-1-фенилэтил]ацетамидаIX. Промежуточное вещество VIII (48 г) поместили в 1-литровую колбу, добавили этилацетат (450 мл) и к полученной суспензии по каплям добавили 10%-ного (по весу) водного раствора NaOH (120 мл) с перемешиванием и умеренным охлаждением водой до комнатной температуры. Нерастворившиеся кристаллы медленно переходили в желтый раствор, затем реакционную смесь перемешивали при комнатной температуре в течение 0,5 ч. Органическую фазу отделяли, водную фазу однократно встряхивали со 100 мл этилацетата и объединенные органические фракции упаривали. Ацетангидрид (200 мл) добавляли к остатку после упаривания, содержащему основание, и продол-3 010131 жали кипячение с дефлегматором и хлоркальциевой трубкой с перемешиванием при температуре 6070 С в течение 4-6 ч. Присутствие исходного соединения проверяли методом тонкослойной хроматографии (ТСХ) и после окончания реакции реакционную смесь упаривали. К остатку после упаривания добавили по каплям насыщенный раствор гидрокарбоната натрия (100 мл) при перемешивании и охлаждении водой. Реакционную смесь экстрагировали этилацетатом (200 мл), органическую фазу отделяли и водный слой экстрагировали один раз 100 мл этилацетата. Объединенные органические фракции экстрагировали один раз 50 мл солевым раствором и упаривали. Выход составил 53,1 г (100%). 1 Н ЯМР:1,27 (d, J=6.2, 3H, СН 2 СН(СН 3; 1.59 (d, J=7.0, 3H, PhCH(CH3; 1.82 (b, 1 Н, CH2), 2.28 (s,3H, COCH3), 2.31 (bm, 1H, CH2), 3.13 (bm, 1H, СН 2 СН(СН 3; 3.72 (s, 3H, CH3O); 5.08 (m, 1 Н, PhCH(CH3; 6.42 (m, 2H, CHarom), 6.63 (m, 2 Н, CHarom); 7.38 (m, 5 Н, CHarom). (CDCl3, 30C). Пример 3. Получение N-(1R)-2-[3-(аминосульфонил)-4-метоксифенил]-1-метилэтил-N-[(1R)-1 фенилэтил]ацетамида X. Дихлорметан (50 мл) добавляли к остатку промежуточного вещества IX после упаривания (25,39 г),перемешали и охладили до температуры -5 - -10 С. По каплям при охлаждении медленно добавляли хлорсульфоновую кислоту (55 мл), так, что температура реакционной смеси возрастала максимум до + 5 С. Добавление хлорсульфоновой кислоты проводили в течение 45 мин и затем реакционную смесь перемешивали при температуре 0 - 10 С в течение 1 ч. Реакционную смесь осторожно приливали, перемешивая и охлаждая, к охлажденной смеси 25%-ного водного раствора аммония (210 мл) и льда (210 г). После того, как разложение закончилось, добавили этилацетат (420 мл), реакционную смесь перемешивали в течение 5 мин до растворения выпавших кристаллов, а затем оставили стоять при комнатной температуре в течение, максимум, 8 ч. После завершения реакции органическую фракцию отделяли, водный слой однократно встряхивали с 210 мл этилацетата. Объединенные органические фракции упаривали. Выход составил 28,82 г (90,6%). 1 Н ЯМР:1,26 (d, J=6.5, 3H, СН 2 СН(СН 3; 1,58 (d, J=6.9, 3H, PhCH(CH3: 1-80 (b, 1 Н, CH2); 2,30 (s,3H, СОСН 3); 2,32 (bm, 1H, СН 2); 3,13 (bm, 1H, СН 2 СН(СН 3; 3,93 (s, 3H, CH3O); 5,11 (bm, 1H,PhCH(CH3; 6,77 (m, 2H, CHarom); 7,02 (bs, 1H, CHarom), 7,37 (m, 5H, CHarom). (CDCl3, 30C). Пример 4. Получение N-(1R)-2-[3-(аминосульфонил)-4-метоксифенил]-1-метилэтилацетамида XI. Промежуточное вещество X (3 г) растворили в уксусной кислоте (160 мл), разбавили HCl 1:1 (10 мл), и добавили 3%-ный Pd/C с 50%-ным содержанием воды (0,3 г). Гидрирование проходило при 80 85 С и давлении 2 МПа в течение 10-12 ч. После окончания гидрирования раствор отфильтровали и упарили. Выход составил 2,55 г (-100%). 1 Н ЯМР:1,10 (d, J=6.6, 3H, СН(CH3; 1,87 (s, 3H, СОСН 3); 2,71 (d, J=6.9, 2H, СН 2); 3,30 (b, NH2); 3,95 (s, 3H, CH3O); 4,05 (m, 1H, СН(СН 3; 7,11 (d, J=8.5, CHarom); 7,40 (dd, J=8.6, J=2.4, 1H, CHarom); 7,68(d, J=2.2, 1H, CHarom); 7,96 (bd, NH). (CD3OD, 30C). Пример 5. Получение (R)-(-)-5(2-аминопропил)-2-метоксибензолсульфонамида I. Промежуточный продукт VII (10,5 г) кипятили в 5% HCl (250 мл) с дефлегматором в течение 16-18 ч. Ход реакции контролировали методом ТСХ, определяя исходное вещество. После окончания реакции реакционную смесь сконцентрировали примерно до 1/3 от начального объема, а затем медленно добавили по каплям насыщенный раствор карбоната натрия (50 мл), постоянно перемешивая. После добавления контролировали уровень рН 10, и реакционную смесь перемешивали в течение 0,5 ч, затем оставив кристаллизоваться при 0 С. Выпавшие кристаллы отфильтровали под вакуумом, а фильтрат сконцентрировали доот начального объема и оставили кристаллизоваться при 0 С. Обе фракции (4 г + 8 г) кристаллов (от белых до коричневатых) объединили и перекристаллизовали из воды. Выход составил 7,52 гJ=2.2; 1H, CHarom); 7,59 (d, J=2.2, 1H, CHarom). (CD3SOCD3, 30C). Пример 6 - сравнительный. Способ получение тамсулозина (II) согласно известному уровню техники по сравнению со способом, включающим стадии по изобретению 1. Способ из известного уровня техники. 1.1. Хлорсульфирование в две стадии согласно US 4,731,478 (1988) 1.2. Гидрирование на платине согласно ЕР 0257787 (1987) Использовали катализатор в количестве 1 г/1 моль кетона, гидрирование проводили в метаноле при нормальном давлении в течение 20 ч. Для очистки до желаемой оптической чистоты (ниже 0,2%), вещество очищали 4 раза ацетоном и 3 раза смесью воды и ацетона. 1.3. Гидрирование на палладии согласно ЕР 0257787 Гидрирование проводили в метаноле при нормальном давлении, в качестве катализатора использовали 10%-ный палладий на углероде в количестве 10% от веса исходного вещества, время реакции не определяли. 1.4. Превращение в основание Кипятили с дефлегматором в течение 16 ч, использовали избыток амина (двойное количество),очищали с помощью хроматографии, выход приведен для неочищенного основания, выход гидрохлорида не указан. 2. Новый синтез согласно изобретению. 2.1. Гидрирование на платине В автоклав загружали: 23,1 г (0,141 моль) 4-метоксибензилметилкетона VII, 17,2 г R(+)-метилбензиламина (0,142 ммоль), 0,05 г катализатора PtO2 и добавили метанол (450 мл). Гидрирование проводили при нормальном давлении и 60-62 С в течение 12 ч. После этого реакционную смесь обработали раствором HCl в этаноле, в результате чего получили промежуточный продукт VIII, который очищали кипячением в ацетоне. Выход составил 24,62 г (57%). Гидрирование проводили при нормальном давлении в течение примерно 12 ч, катализатор использовали в количестве 0,6 г/1 моль кетона. Очистку в ацетоне повторяли от одного до трех раз для получения желаемой оптической чистоты, предел которой, как было установлено, составляет максимум 0,4% нежелательного диастереоизомера. 2.2. Получение ацетильного производного 6377 г промежуточного вещества VII (20,85 моль) превращали в основание 10%-ным водным раствором NaOH (15,9 л), экстрагировали этилацетатом, растворитель выпаривали и остаток после выпаривания нагревали в ацетангидриде (26,57 л) при 65-70 С в течение 6 ч. В результате выпаривания получили 6693 г ( 100%) промежуточного вещества IX. 6690 г остатка после упаривания (IX) из предыдущей стадии ( 20,85 моль) перемешивали в дихлорметане (13,7 л), а затем по каплям добавили хлорсульфоновую кислоту при температуре -5 - +2 С. Через 1 ч в реакционной смеси осуществляли разложение смесью льда (65,5 кг) и 25%-ного водного раствора аммония (65,5 л). Продукт X экстрагировали этилацетатом и выход промежуточного продукта X после упаривания составил 8068 г (96,2%). Сульфохлорид, образующийся после хлорсульфирования, предпочтительно не выделять, а непосредственно превращать в сульфонамид X, проводя разложение в реакционной смеси водным раствором аммония. Проведение реакции таким способом позволяет избежать использования тетрагидрофурана в качестве другого растворителя. Выход оказался необыкновенно высок для такого типа реакций. 2.4. Гидрирование на палладииPd/C с 50%-ым содержанием воды (2,5 г) в уксусной кислоте (160 мл) с добавлением разбавленной соляной кислоты (1:1; 19 мл) при 80-85 С и давлении 2 МПа в течение 12 ч. После обработки реакционной смеси выход промежуточного вещества XI составил 22,13 г ( 100%). Гидрирование проводили при 80-85 С и давлении 2 МПа в течение 15 ч в уксусной кислоте с добавлением разбавленной соляной кислоты. Катализатор, который использовали в количестве 1/10 от веса исходного вещества X, т.е. 3%-ный Pd/C с 50%-ым содержанием воды, существенно дешевле и безопаснее легко воспламеняющегося 10%-ного Pd/C. Выход в ходе реакции составляет практически 100%. 2.5. Деацетилирование (по US 4 731 478, 1998) Промежуточное вещество XI (28,2 г; 0,063 моль) кипятили с обратным холодильником в 5%-ном водном растворе HCl (660 мл) в течение 18 ч, после концентрирования продукт I осадили добавлением насыщенного раствора карбоната калия (140 мл) двумя порциями (10,4 г + 37,3 г). После перекристаллизации из воды выход составил 17,1 г (80%). 2.6. Тамсулозин 220 г (0,88 моль) промежуточного вещества IV, 84 г (0,79 моль) карбоната натрия и 1500 мл N,Nдиметилформамида добавили к 208 г (0,85 моль) промежуточного вещества I. Реакционную смесь перемешивали при 70 С в течение 5 ч. К реакционной смеси добавили воду и продукт II экстрагировали этилацетатом. Остаток после упаривания перемешали в этаноле, после чего отфильтровали. Выход неочищенного основания II составил 173,9 г (50%). Способ, описанный в CZ 291802. Для сравнения выход также считали для неочищенного основания. Реакция проходила при 60-70 С в течение 5 ч и продукт не очищали необходимой для этого колоночной хроматографией. 1. Вывод. Сравнение суммарных выходов проведено, начиная с 4-метоксифенилацетона VII, хотя в ЕР 257787 получение описано, начиная только с промежуточного вещества III. А. Выход (R)-(-)-5(2-аминопропил)-2-метоксибензолсульфонамида I без конечной конденсации до-6 010131 тамсулозина II, т.е. в реакциях 1.1-1.4, составил 12,38%; а в способе по изобретению (реакции 2.1-2.5) 38,40%, т.е. в три раза выше. В. Если мы также сравним последнюю стадию получения неочищенного основания, суммарный выход синтеза тамсулозина по патенту ЕР 257787 составляет 4,63%, а в способе, предложенном авторами изобретения, 19,20%, т.е. в четыре раза выше. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения (R)-(-)-5(2-аминопропил)-2-метоксибензолсульфонамида формулы I характеризующийся тем, что а) вводят защитную группу в N-[(1R)-2-(4-метоксифенил)-1-метилэтил]-N-[(1R)-1-фенилэтил)]амин формулы VIII где А представляет собой ацильную группу с 2-8 атомами углерода,б) после чего амид формулы IX подвергают хлорсульфированию, а образовавшийся сульфохлорид превращают в сульфонамид, имеющий формулу X где А - такое, как определено выше,в) сульфонамид формулы X подвергается гидрированию и деацилированию с получением соединения формулы I. 2. Способ по п.1, характеризующийся тем, что защитная группа А представляет собой ацетил. 3. Способ по п.2, характеризующийся тем, что в качестве ацетилирующего агента используют ацетангидрид при температуре 50-100 С. 4. Способ по п.1, характеризующийся тем, что сульфохлорид, образующийся после хлоросульфирования, не выделяют, а превращают непосредственно в сульфонамид с помощью аммиака. 5. Способ по п.4, характеризующийся тем, что хлорсульфирование проводят в метиленхлориде при температуре от -30 до +30 С. 6. Способ по п.1, характеризующийся тем, что гидрирование выполняют в присутствии палладия в качестве катализатора. 7. Способ по п.6, характеризующийся тем, что катализатором является 3%-ный Pd/C с 50%-ным содержанием воды и гидрирование проводят при давлении 2 МПа и температуре 80-85 С. 8. Сульфонамид формулы X
МПК / Метки
МПК: C07C 303/40, C07C 311/37
Метки: r)-(-)-5(2-аминопропил)-2-метоксибензолсульфонамида, получения, способ
Код ссылки
<a href="https://eas.patents.su/9-10131-sposob-polucheniya-r-52-aminopropil-2-metoksibenzolsulfonamida.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения (r)-(-)-5(2-аминопропил)-2-метоксибензолсульфонамида</a>
Следующий патент: Производные триазола в качестве антагонистов вазопрессина
Случайный патент: Способ и установка для сушки и измельчения влажного минерального сырья













