Способ получения (s)- или (r)-4-галоген-3-гидроксибутиратов
Формула / Реферат
1. Способ получения энантиомерно чистых (S)- или (R)-4-галоген-3-гидроксобутиратов формулы
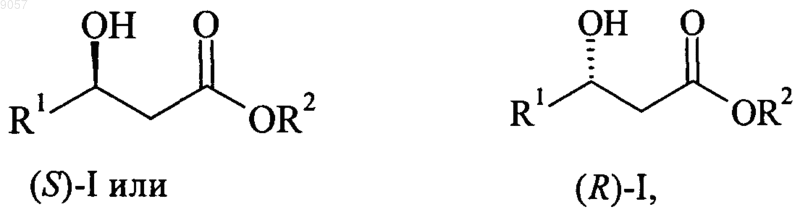
в которой R1 обозначает CH2X, CHX2 или CX3;
X независимо обозначает Сl и/или Br; и
R2 обозначает C1-С6алкил, С3-С6циклоалкил, арил или арилалкил, каждый арил или арилалкил необязательно дополнительно замещен одной или более С1-С4алкильными группами и/или атомами галогена,
включающий асимметрическое гидрирование 4-галоген-3-оксибутиратов формулы
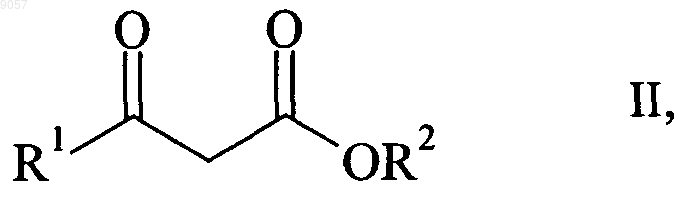
в которой R1, R2 и X являются такими, как определено выше,
в присутствии катализатора, представляющего собой комплекс рутения, включающий хиральный лиганд формулы
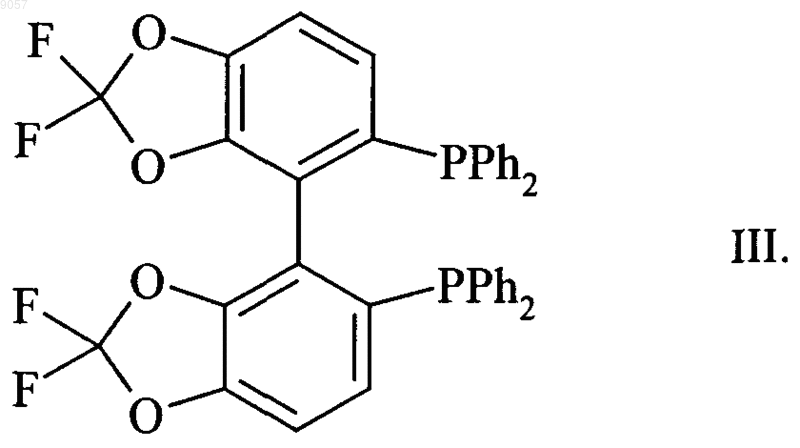
2. Способ по п.1, в котором рутениевый комплекс, содержащий лиганд формулы III, включает в качестве стабилизирующего лиганда по меньшей мере одну молекулу диена, алкена, или арена, или полярного растворителя.
3. Способ по п.1 или 2, в котором рутениевый комплекс, содержащий лиганд формулы III, включает в качестве стабилизирующего лиганда по меньшей мере одну молекулу 1,5-циклооктадиена или п-кумола.
4. Способ по любому из пп.1-3, в котором гидрирование проводят в растворе, содержащем полярный растворитель, выбранный из группы, включающей С1-С4спирты, диметилсульфоксид, диметилформамид, ацетонитрил и их смеси, в котором растворитель необязательно содержит добавки других растворителей.
5. Способ по любому из пп.1-4, в котором противоион рутениевого комплекса выбран из группы, включающей Cl-, Br-, I-, BF4-, AsF6-, SbF6-, PF6-, ClO4- и ОТf -.
6. Способ по любому из пп.1-5, в котором рутениевый комплекс получают путем смешивания комплекса формулы [Ru2Cl4(cym)2] с лигандом Флуоксфосом в полярном растворителе.
7. Способ по любому из пп.1-6, в котором давление водорода во время проведения реакции находится в диапазоне от 1 до 60 бар и предпочтительно в диапазоне от 2 до 35 бар.
Текст
009057 Настоящее изобретение относится к способу получения энантиомерно чистых (S)- или (R)-4 галоген-3-гидроксобутиратов формулыR2 обозначает C1-С 6 алкил, С 3-С 8 циклоалкил, арил или арилалкил,с помощью асимметрического гидрирования 4-галоген-3-оксобутиратов формулы в которой R1, R2 и X являются такими, как определено выше. Здесь и ниже в настоящем изобретении термин "энантиомерно чистое соединение" включает оптически активные соединения, содержащиеся при энантиомерном избытке (ЭИ), составляющем не менее 90%. Здесь и ниже в настоящем изобретении термин "С 1-С 6 алкил" обозначает линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, например метил, этил, пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил и гексил, которые дополнительно могут быть замещены одним или большим количеством атомов галогенов. Здесь и ниже в настоящем изобретении термин "С 1-С 4 алкоксигруппа" обозначает линейную или разветвленную алкоксигруппу, содержащую от 1 до 4 атомов углерода, например метокси-, этокси-, пропилокси-, изопропилокси-, н-бутилокси-, изобутилокси-, втор-бутилокси-, трет-бутилоксигруппу, которые дополнительно могут быть замещены одним или большим количеством атомов галогенов. Здесь и ниже в настоящем изобретении термин "С 3-С 8 циклоалкил" обозначает циклоалифатическую группу, содержащую от 3 до 8 атомов углерода, т.е. циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Здесь и ниже в настоящем изобретении термин "арил" обозначает ароматическую группу, предпочтительно фенил или нафтил, которая необязательно замещена одним или большим количеством атомов галогенов, С 1-С 4 алкилом и/или С 1-С 4 алкоксигруппой, где алкильные и алкоксильные заместители необязательно замещены одним или большим количеством атомов галогенов. Здесь и ниже в настоящем изобретении термин "арилалкил" обозначает линейный фрагмент С 1 С 4 алкил, необязательно дополнительно замещенный атомами галогенов, который связан с дополнительно необязательно замещенным арильным фрагментом, являющимся таким, как определено выше. Обычно 3-гидроксобутираты и их производные являются ключевыми промежуточными продуктами промышленной синтетической химии. Среди этих производных этил-(S)-4-хлор-3-гидроксибутират является особенно важным фрагментом для получения ингибиторов HMG-CoA редуктазы, таких как росувастатин или аторвастатин. Для получения указанных гидроксобутиратов в фармацевтически приемлемых количествах и исключения дорогостоящего разделения энантиомеров способ асимметрического гидрирования должен приводить к большому ЭИ, предпочтительно находящемуся в диапазоне от 90 до 100%. Асимметрическое гидрирование обычно проводят с помощью хиральных комплексов переходный металл-лиганд, в которых переходным металлом является рутений или родий и в которых лигандами являются часто замещенные хиральные бидентатные дифосфины. В WO-A-02/40492 описано асимметрическое гидрирование этил-4-хлор-3-оксобутирата с использованием катализатора, содержащего (S)-6-метокси-5,6'-бензо-2,2'-бис(дифенилфосфино)бифенилового лиганда. (S)-Продукт получают с ЭИ, равным 83%. Новый класс метилендиоксо- и этилендиоксозамещенных дифосфиновых лигандов и их применение для асимметрического гидрирования метил-2-бензамидометил-3-оксобутирата описан в ЕР-А 0850945. В публикации Pai, C.-С. et al., Tetrahedron Lett. 2002, 43, 2789-2792 описано применение указанных лигандов для асимметрического гидрирования этил-4-хлор-3-оксобутирата. В ЕР-А-0955303 описано асимметрическое гидрирование 4-метилен-2-оксетанона (дикетена) в 4 метил-2-оксетанон, -лактон 3-гидроксимасляной кислоты, с использованием рутениййодпроизводных лигандов, описанных в ЕР-А-0850945. Техническая задача, которую должно решить настоящее изобретение, представляет собой альтернативный общий способ асимметрического гидрирования 4-галоген-3-оксобутиратов с получением энантиомерно чистых (S)- или (R)-4-галоген-3-гидроксобутиратов. Эту задачу можно решить способом по п.1 формулы изобретения.-1 009057 Настоящее изобретение относится к способу получения энантиомерно чистых сложных эфиров (S)или (R)-4-галоген-3-гидроксимасляной кислоты формулыR2 обозначает C1-С 6 алкил, С 3-С 8 циклоалкил, арил или арилалкил, каждый арил или арилалкил необязательно дополнительно замещен одной или более С 1-С 4 алкильными группами и/или атомами галогена,с помощью асимметрического гидрирования сложных эфиров 4-галоген-3-оксомасляной кислоты формулы в которой R1, R2 и X являются такими, как определено выше,в присутствии катализатора, представляющего собой комплекс рутения, включающий хиральный лиганд формулы В предпочтительном варианте осуществления R1 обозначает CH2X и X обозначает Cl или Br, более предпочтительно, если R1 обозначает CH2X и X обозначает Cl. В WO 03/029259 описан способ асимметрического гидрирования алкил- и арилпроизводных сложных эфиров 3-оксокислоты с использованием рутениевого комплекса лиганда формулы III. Приведено несколько примеров асимметрического гидрирования сложных эфиров фторированных 3-оксокислот, но гидрирование соединений формулы II не описано. Все описанные сложные эфиры фторированных алифатических 3-гидроксикислот, такие как этил-4,4,4-трифтор-3-гидроксибутират, получают только при умеренных ЭИ, находящихся в диапазоне от 70 до 80%. В отношении ЕР-А-0850945 с учетом экспериментальных результатов, полученных в WO 03/029259, представляется весьма маловероятным, чтобы комплексы переходных металлов с 5,5'бис(дифенилфосфанил)-2,2,2',2'-тетрафтор-4,4'-би[бензо-1,3-диоксолил]ьными лигандами формулы III(Флуоксфос) являлись пригодными для асимметрического гидрирования соединений формулы II. Согласно изобретению неожиданно обнаружено, что асимметрическое гидрирование 4-хлор-3 оксобутиратов и 4,4,4-трихлор-3-оксобутиратов с использованием рутениевых комплексов, содержащих лиганд формулы III -)-Флуоксфос и (+)-Флуоксфос), приводит к очень высоким значениям ЭИ. В предпочтительном варианте осуществления R2 выбран из группы, включающей метил, этил, пропил, изопропил, н-бутил и трет-бутил. Более предпочтительно, если R2 обозначает метил, этил или изопропил. Особенно предпочтительно, если R2 обозначает метил или этил. В другом предпочтительном варианте осуществления R2 обозначает необязательно замещенный фенил или нафтил. Гидрирование проводят с использованием раствора катализатора в полярном растворителе, таком как C1-C4 спирты, диметилсульфоксид (ДМСО), диметилформамид (ДМФ), ацетонитрил (MeCN) или их смеси. Предпочтительными полярными растворителями являются метанол, этанол и изопропиловый спирт и их смеси. Раствор может содержать добавки других растворителей, таких как дихлорметан. Раствор катализатора можно приготовить in situ путем растворения соли рутения Run+Y-n, в которойn равно 2 или 3 и в которой Y- обозначает Cl-, Br-, I-, BF4-, AsF6-, SbF6-, PF6-, СlO4- или OTf - (трифторметансульфонат или трифлат) или другой подходящий противоион, в полярном растворителе, и смешивания с подходящим количеством лиганда формулы III, необязательно с дополнительным смешиванием по меньшей мере с одним стабилизирующим лигандом. Альтернативно, раствор катализатора можно приготовить путем смешивания комплексапредшественника катализатора, т.е. предварительно полученного комплекса рутения, который уже содержит по меньшей мере один стабилизирующий лиганд, в полярном растворителе, с подходящим количеством других лигандов. Комплекс-предшественник катализатора включает по меньшей мере один стабилизирующий лиганд, такой как диен, алкен или арен. В предпочтительном варианте осуществления стабилизирующий лиганд представляет собой 1,5-циклоктадиен (cod), норборнадиен (nbd) или п-кумол(cym). Особенно предпочтительным стабилизирующим лигандом является п-кумол.-2 009057 В другом предпочтительном варианте осуществления комплекс-предшественник катализатора включает по меньшей мере один хиральный лиганд формулы III (Флуоксфос). В другом особенно предпочтительном варианте осуществления комплекс-предшественник катализатора включает в качестве стабилизирующего лиганда по меньшей мере одну молекулу полярного растворителя, такого как диметилсульфоксид (ДМСО), диметилформамид (ДМФ) или ацетонитрил (MeCN). Примерами комплексов-предшественников катализатора, содержащих такие стабилизирующие лиганды, являются [Ru2Cl4(cym)2], [Ru2Br4(cym)2], [RuСl(Флуоксфос)(бензол)]Сl, [RuСl2(Флуоксфос)ДМФ],[RuСl2(Флуоксфос)ДМСО] и [Ru2Cl4(cod)2MeCN]. Кроме того, раствор катализатора можно приготовить путем растворения предварительно полученного хирального комплекса рутения, который уже содержит все необходимые лиганды. Несколько примеров общих применимых методик получения катализаторов и растворов катализаторов приведено в публикации Ashworth, Т.V. et al. S. Afr. J. Chem. 1987, 40, 183-188, WO 00/29370 иMashima, K. J. Org. Chem. 1994, 59, 3064-3076. В предпочтительном варианте осуществления комплекс-предшественник катализатора получают путем смешивания бис[(1-изопропил-4-метилбензол)дихлоррутения] формулы [Ru2Cl4(cym)2] с лигандом(-)-Флуоксфос или (+)-Флуоксфос в полярном растворителе. Предпочтительно, если соль металла Run+Y-n или комплекс рутения смешивают с хиральным бидентатным фосфином в отношении от 1:5 до 5:1. Более предпочтительно, если отношение Ru/фосфин находится в диапазоне от 1:2 до 2:1. Наиболее предпочтительно, если отношение Ru/фосфин составляет 1:1. В конкретном варианте осуществления противоион соли переходного металла, комплексапредшественника катализатора и рутениевого комплекса с лигандом формулы III представляет собой Cl-,Br-, I-, BF4-, AsF6-, SbF6-, PF6-, ClO4- или ОТf -, более предпочтительно Cl-, I- или BF4-. В предпочтительном варианте осуществления давление водорода во время реакции находится в диапазоне от 1 до 60 бар и более предпочтительно в диапазоне от 2 до 35 бар. Гидрирование можно проводить при температуре, находящейся в диапазоне от 20 до 150 С. Предпочтительно, если температура находится в диапазоне от 70 до 130 С. Особенно предпочтительно, если температура находится в диапазоне от 80 до 120 С. Настоящее изобретение иллюстрируется приведенными ниже не ограничивающими примерами. Примеры Пример 1. Этил-(S)-4-хлор-3-гидроксибутират (формула (S)-I, R1=CH2Cl, R2=этил) В автоклаве объемом 150 мл в атмосфере аргона RuCl3 (10,2 мг, 0,049 ммоль), (-)-5,5'бис(дифенилфосфанил)-2,2,2',2'-тетрафтор-4,4'-би[бензо-1,3-диоксолил] (т.е. (-)-Флуоксфос) (34,2 мг,0,050 ммоль) и этил-4-хлор-3-оксобутират (0,81 г, 4,9 ммоль, примерно 98,5%) растворяют в дегазированном этаноле (30 мл). После продувания автоклава аргоном гидрирование проводят в течение 2 ч при 80 С и при давлении водорода, равном 4 бар. После охлаждения до комнатной температуры реакционную смесь непосредственно анализируют с помощью ГХ (газовая хроматография) для определения степени конверсии (колонка: HP-101 25 м/0,2 мм) и энантиомерного избытка (ЭИ) (колонка: Lipodex-E 25 м/0,25 мм). Конверсия составляет 100% при ЭИ, равном 97,6%. Пример 2. Этил-(S)-4-хлор-3-гидроксибутират (формула (S)-I, R1=CH2Cl, R2=этил) В автоклаве объемом 250 мл в атмосфере аргона бис[(1-изопропил-4-метилбензол)дихлоррутений](т.е. [Ru2Cl4(cym)2]) (6,7 мг, 0,011 ммоль), (-)-Флуоксфос (16,0 мг, 0,023 ммоль) и этил-4-хлор-3 оксобутират (9,11 г, 54,5 ммоль, примерно 98,5%) растворяют в дегазированном этаноле (30 мл). После продувания автоклава аргоном гидрирование проводят в течение 2,3 ч при 90 С и при давлении водорода, равном 30 бар. После охлаждения до комнатной температуры реакционную смесь непосредственно анализируют с помощью ГХ для определения степени конверсии (колонка: HP-101 25 м/0,2 мм) и ЭИ(колонка: Lipodex-E 25 м/0,25 мм). Конверсия составляет 100% при ЭИ, равном 95,8%. Пример 3. Этил-(R)-4-хлор-3-гидроксибутират (формула (R)-I, R1=CH2Cl, R2=этил) В автоклаве объемом 1 л в атмосфере аргона RuCl3 (10,0 мг, 0,048 ммоль), (+)-Флуоксфос (36,1 мг,0,053 ммоль) и этил-4-хлор-3-оксобутират (8,0 г, 48 ммоль, примерно 98,5%) растворяют в дегазированном этаноле (170 мл) и дихлорметане (40 мл). После продувания автоклава аргоном гидрирование проводят в течение 90 мин при 82 С и при давлении водорода, равном 35 бар. После охлаждения до комнатной температуры реакционную смесь непосредственно анализируют с помощью ГХ для определения степени конверсии (колонка: HP-101 25 м/0,2 мм) и ЭИ (колонка: Lipodex-E 25 м/0,25 мм). Конверсия составляет 100% при ЭИ, равном 97,8%. Пример 4. Этил-(R)-4-хлор-3-гидроксибутират (формула (R)-I, R1=CH2Cl, R2=этил) В автоклаве объемом 1 л в атмосфере аргона [Ru2Cl4(cod)2MeCN] (15,8 мг, 0,026 ммоль), получен из RuCl3 и 1,5-циклооктадиена в соответствии с описанием в публикации Ashworth, Т.V. et al. S. Afr. J.Chem. 1987, 40, 183-188, (+)-Флуоксфос (36,1 мг, 0,053 ммоль) и этил-4-хлор-3-оксобутират (8,0 г, 48 ммоль, примерно 98,5%) растворяют в дегазированном этаноле (170 мл) и дихлорметане (40 мл). После продувания автоклава аргоном гидрирование проводят в течение 80 мин при 82 С и при давлении водорода, равном 35 бар. После охлаждения до комнатной температуры реакционную смесь непосредственно-3 009057 анализируют с помощью ГХ для определения степени конверсии (колонка: HP-101 25 м/0,2 мм) и ЭИ(12,1 мг, 0,018 ммоль) и этил-4-хлор-3-оксобутират (27,0 г, 162 ммоль, примерно 98,5%) растворяют в дегазированном этаноле (340 мл) и дихлорметане (80 мл). После продувания автоклава аргоном гидрирование проводят в течение 70 мин при 110 С и при давлении водорода, равном 22 бар. После охлаждения до комнатной температуры реакционную смесь непосредственно анализируют с помощью ГХ для определения степени конверсии (колонка: HP-101 25 м/0,2 мм) и ЭИ (колонка: Lipodex-E 25 м/0,25 мм). Конверсия составляет 100% при ЭИ, равном 98,1%. Пример 6. Этил-(S)-4-хлор-3-гидроксибутират (формула (S)-I, R1=CH2Cl, R2=этил) В автоклаве объемом 1 л в атмосфере аргона [RuI-)-Флуоксфос)(cym)]I (35 мг, 0,030 ммоль), получен из (-)-Флуоксфос и [Ru2I4(cym)2] в соответствии с описанием в WO 00/29370, и этил-4-хлор-3 оксобутират (33,4 г, 200 ммоль, примерно 98,5%) растворяют в дегазированном этаноле (340 мл) и дихлорметане (80 мл). После продувания автоклава аргоном гидрирование проводят в течение 170 мин при 100 С и при давлении водорода, равном 22 бар. После охлаждения до комнатной температуры реакционную смесь непосредственно анализируют с помощью ГХ для определения степени конверсии (колонка:HP-101 25 м/0,2 мм) и ЭИ (колонка: Lipodex-E 25 м/0,25 мм). Конверсия составляет 100% при ЭИ, равном 97,4%. Пример 7. Этил-(S)-4-хлор-3-гидроксибутират (формула (S)-I, R1=CH2Cl, R2=этил) В автоклаве объемом 1 л в атмосфере аргона [RuСl-)-Флуоксфос)(cym)]ВF4 (23 мг, 0,022 ммоль),получен из (-)-Флуоксфос и [Ru2Cl4(cym)2] и AgBF4 в соответствии с описанием в публикации Mashima,K., J. Org. Chem. 1994, 59, 3064-3076, и этил-4-хлор-3-оксобутират (33,4 г, 200 ммоль, примерно 98,5%) растворяют в дегазированном этаноле (340 мл) и дихлорметане (80 мл). После продувания автоклава аргоном гидрирование проводят в течение 180 мин при 100 С и при давлении водорода, равном 22 бар. После охлаждения до комнатной температуры реакционную смесь непосредственно анализируют с помощью ГХ для определения степени конверсии (колонка: НР-101 25 м/0,2 мм) и ЭИ (колонка: Lipodex-E 25 м/0,25 мм). Конверсия составляет 100% при ЭИ, равном 98,0%. Пример 8. трет-Бутил-4-хлор-3-гидроксибутират (формула I, R1=CH2Cl, R2=трет-бутил) В автоклаве объемом 150 мл в атмосфере аргона [Ru2Cl4(cym)2] (7,7 мг, 0,013 ммоль), (+)Флуоксфос (17,9 мг, 0,026 ммоль) и трет-бутил 4-хлор-3-оксобутират (96,9%, по данным анализа с помощью ГХ, 1,0 г, 5,2 ммоль) растворяют в дегазированном этаноле (30 мл). После продувания автоклава аргоном гидрирование проводят в течение 4 ч при 80 С и при давлении водорода, равном 4 бар. После охлаждения до комнатной температуры реакционную смесь непосредственно анализируют с помощью ГХ для определения степени конверсии (колонка: НР-101 25 м/0,2 мм). Определение энантиомерного избытка проводят с помощью 1 Н-ЯМР с использованием трис[3-(трифторметилгидроксиметилен)-(+)камфората] европия(III) в качестве сдвигающего реагента и CDCl3 в качестве растворителя. Конверсия составляет 99%. Выход составляет примерно 67% при ЭИ одного энантиомера, равном 93,2%. Пример 9. Этил-4,4,4-трихлор-3-гидроксибутират (формула I, R1=CCl3, R2=этил) В автоклаве объемом 150 мл в атмосфере аргона [Ru2Cl4(cym)2] (7,6 мг, 0,012 ммоль), (+)Флуоксфос (17,8 мг, 0,026 ммоль) и этил-4,4,4-трихлор-3-оксобутират (97%, по данным анализа, 1,21 г,5,2 ммоль) растворяют в дегазированном этаноле (30 мл). После продувания автоклава аргоном гидрирование проводят в течение 7,5 ч при 80 С и при давлении водорода, равном 4 бар. После охлаждения до комнатной температуры реакционную смесь непосредственно анализируют с помощью ГХ для определения степени конверсии (колонка: НР-101 25 м/0,2 мм). Конверсия составляет 99% при ЭИ, одного энантиомера, равном 95,3%. Определение энантиомерного избытка проводят с помощью 1 Н-ЯМР с использованием трис[3-(трифторметилгидроксиметилен)-(+)-камфората] европия(III) в качестве сдвигающего реагента и CDCl3 в качестве растворителя. Сравнительный пример 1. Этил-(S)-4-хлор-3-гидроксибутират (формула (S)-I, R1=CH2Cl, R2=этил) В автоклаве объемом 250 мл в атмосфере аргона [Ru2Cl4(cym)2] (6,7 мг, 0,011 ммоль), (-)-5,5'бис(дифенилфосфанил)-4,4'-би[бензо-1,3-диоксолил] (14,3 мг, 0,023 ммоль) и этил-4-хлор-3-оксобутират(9,10 г, 54,5 ммоль, примерно 98,5%) растворяют в дегазированном этаноле (30 мл). После продувания автоклава аргоном гидрирование проводят в течение 2,3 ч при 90 С и при давлении водорода, равном 30 бар. После охлаждения до комнатной температуры реакционную смесь непосредственно анализируют с помощью ГХ для определения степени конверсии (колонка: НР-101 25 м/0,2 мм) и ЭИ (колонка: LipodexE 25 м/0,25 мм). Конверсия составляет 100% при ЭИ, равном 89,5%.-4 009057 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения энантиомерно чистых (S)- или (R)-4-галоген-3-гидроксобутиратов формулыR2 обозначает C1-С 6 алкил, С 3-С 6 циклоалкил, арил или арилалкил, каждый арил или арилалкил необязательно дополнительно замещен одной или более С 1-С 4 алкильными группами и/или атомами галогена,включающий асимметрическое гидрирование 4-галоген-3-оксибутиратов формулы в которой R1, R2 и X являются такими, как определено выше,в присутствии катализатора, представляющего собой комплекс рутения, включающий хиральный лиганд формулы 2. Способ по п.1, в котором рутениевый комплекс, содержащий лиганд формулы III, включает в качестве стабилизирующего лиганда по меньшей мере одну молекулу диена, алкена, или арена, или полярного растворителя. 3. Способ по п.1 или 2, в котором рутениевый комплекс, содержащий лиганд формулы III, включает в качестве стабилизирующего лиганда по меньшей мере одну молекулу 1,5-циклооктадиена или пкумола. 4. Способ по любому из пп.1-3, в котором гидрирование проводят в растворе, содержащем полярный растворитель, выбранный из группы, включающей С 1-С 4 спирты, диметилсульфоксид, диметилформамид, ацетонитрил и их смеси, в котором растворитель необязательно содержит добавки других растворителей. 5. Способ по любому из пп.1-4, в котором противоион рутениевого комплекса выбран из группы,включающей Cl-, Br-, I-, BF4-, AsF6-, SbF6-, PF6-, ClO4- и ОТf -. 6. Способ по любому из пп.1-5, в котором рутениевый комплекс получают путем смешивания комплекса формулы [Ru2Cl4(cym)2] с лигандом Флуоксфосом в полярном растворителе. 7. Способ по любому из пп.1-6, в котором давление водорода во время проведения реакции находится в диапазоне от 1 до 60 бар и предпочтительно в диапазоне от 2 до 35 бар.
МПК / Метки
МПК: C07C 69/675, C07C 67/31
Метки: способ, r)-4-галоген-3-гидроксибутиратов, получения
Код ссылки
<a href="https://eas.patents.su/6-9057-sposob-polucheniya-s-ili-r-4-galogen-3-gidroksibutiratov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения (s)- или (r)-4-галоген-3-гидроксибутиратов</a>
Предыдущий патент: Связывающие агенты, ингибирующие миостатин
Следующий патент: Уменьшение частоты спонтанных мутаций в клетках
Случайный патент: Применение ингибиторов il-18 для лечения и/или предотвращения атеросклероза










