Способ ферментативного синтеза (7s)-1-(3,4-диметоксибицикло[4.2.0]окта-1,3,5-триен-7-ил) n-метилметанамина и применение в синтезе ивабрадина и его солей
Номер патента: 24637
Опубликовано: 31.10.2016
Авторы: Гонсалес-Сабин Хавьер, Педрагоза-Моро Сандрина, Лефулон Франсуа, Морис-Варас Франсиско
Формула / Реферат
1. Способ получения соединения формулы (IX)

где R1 представляет собой линейную или разветвленную C1-C6-алкильную, аллильную или бензильную группу,
энантиоселективным ферментативным ацилированием рацемического амина формулы (IV)
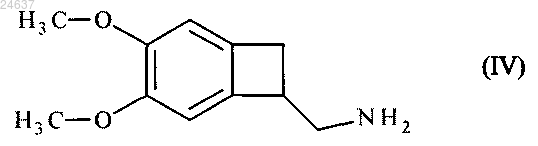
при помощи липазы (ЕС 3.1.1.3 в международной классификации ферментов) карбонатом формулы R1O-(CO)-OR1, где R1 является таким, как определен выше, в количестве от 1 до 15 мол.экв. по отношению к амину формулы (IV), в водном или органическом растворителе, смеси органических растворителей или смеси органических и водных растворителей, при концентрации от 5 до 500 г/л соединения формулы (IV) на 1 л растворителя или смеси растворителей, при соотношении E/S от 10/1 до 1/100, при температуре от 25 до 40°C.
2. Способ получения по п.1, в котором липазу выбирают из липаз Pseudomonas fluorescens, Pseudomonas cepacia, поджелудочной железы свиньи и липаз PS "Amano" SD (Burkholderia cepacia) и IM (иммобилизованная на диатомите).
3. Способ получения по п.2, в котором липаза представляет собой липазу Pseudomonas cepacia или липазу PS "Amano" IM.
4. Способ получения по одному из пп.1-3, в котором соотношение E/S представляет собой от 1/1 до 1/10.
5. Способ получения по одному из пп.1-4, в котором растворитель выбирают из ТВМЕ, ТГФ, 2-Ме ТГФ и 1,4-диоксана как таковых или в смеси с буферным раствором при pH 7.
6. Способ получения по одному из пп.1-5, в котором R1 представляет собой этильную, аллильную или бензильную группу.
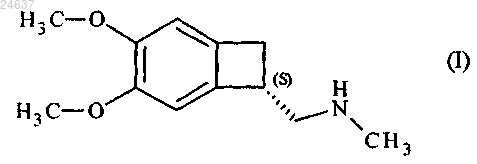
7. Способ получения соединения формулы (I)
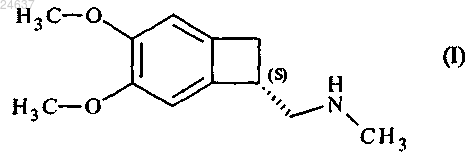
ферментативным ацилированием рацемического амина формулы (IV) по одному из пп.1-6 с получением карбамата формулы (IX)
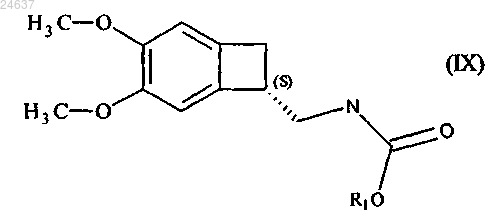
где R1 представляет собой линейную или разветвленную C1-C6-алкильную, аллильную или бензильную группу,
который затем восстанавливают агентом восстановления, выбранным из LiAlH4 и RedAl, с получением соединения формулы (I).
8. Способ получения ивабрадина, в котором соединение формулы (I)
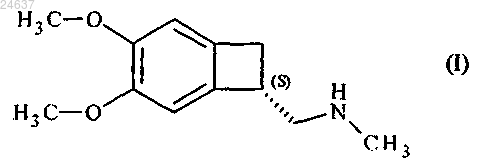
соединяют с соединением формулы (X)
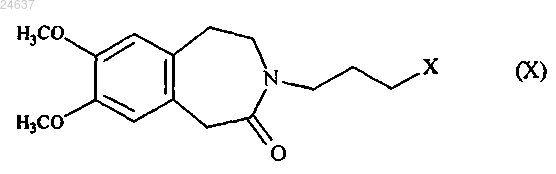
где X представляет собой атом галогена,
с получением ивабрадина, который затем преобразуют в фармацевтически приемлемую кислотно-аддитивную соль в виде ангидрида или гидрата.
9. Способ получения ивабрадина, в котором соединение формулы (I)
подвергают реакции восстановительного аминирования с соединением формулы (XI) в присутствии агента восстановления
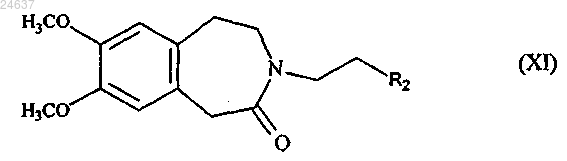
где R2 представляет собой группу, выбранную из CHO и CHR3R4, где R3 и R4, каждый, представляют собой линейную или разветвленную (C1-C6)алкоксигруппу или же вместе с атомом углерода, который их несет, образуют 1,3-диоксановое, 1,3-диоксолановое или 1,3-диоксепановое кольцо с получением ивабрадина, который затем преобразуют в фармацевтически приемлемую кислотно-аддитивную соль в виде ангидрида или гидрата.
10. Способ получения по п.8, в котором X представляет собой атом йода.
11. Способ получения по п.9, в котором соединение формулы (I) вводят в реакцию восстановительного аминирования в виде его гидрохлорида с получением ивабрадина в виде гидрохлорида.
12. Способ получения по одному из пп.9 или 11, в котором реакцию восстановительного аминирования с соединением формулы (XI) осуществляют в присутствии водорода, катализированного палладием на угле.
Текст
СПОСОБ ФЕРМЕНТАТИВНОГО СИНТЕЗА (7S)-1-(3,4 ДИМЕТОКСИБИЦИКЛО[4.2.0]ОКТА-1,3,5-ТРИЕН-7-ИЛ) N-МЕТИЛМЕТАНАМИНА И ПРИМЕНЕНИЕ В СИНТЕЗЕ ИВАБРАДИНА И ЕГО СОЛЕЙ Способ ферментативного синтеза соединения формулы диметоксибицикло[4.2.0]окта-1,3,5-триен-7-ил) N-метилметанамина(71)(73) Заявитель и патентовладелец: ЛЕ ЛАБОРАТУАР СЕРВЬЕ (FR) Применение в синтезе ивабрадина и его фармацевтически приемлемых кислотно-аддитивных солей. Настоящее изобретение относится к способу ферментативного синтеза соединения формулы (I),(7S)-1-(3,4-диметоксибицикло[4.2.0]окта-1,3,5-триен-7-ил) N-метилметанамина а также к его применению в синтезе ивабрадина формулы (II) или 3-3-(7S)-3,4-диметоксибицикло[4.2.0]окта-1,3,5-триен-7-ил]метил(метил)амино]пропил 7,8-диметокси-1,3,4,5-тетрагидро-2H-3-бензазепин-2-она, его фармацевтически приемлемых кислотноаддитивных солей и их гидратов. Ивабрадин, а также его фармацевтически приемлемые кислотно-аддитивные соли, в особенности его гидрохлорид, обладают ценными фармакологическими и терапевтическими свойствами, а именно брадикардическими свойствами, делающими эти соединения полезными для лечения или профилактики различных клинических состояний ишемии миокарда, таких как стенокардия, инфаркт миокарда и ассоциированные нарушения ритма, а также различных патологий, связанных с нарушениями ритма, в частности суправентрикулярных нарушений ритма, и для лечения сердечной недостаточности. Получение и терапевтическое применение ивабрадина и его фармацевтически приемлемых кислотно-аддитивных солей, в особенности его гидрохлорида, описаны в европейском патенте EP 0534859. Этот патент описывает синтез гидрохлорида ивабрадина исходя из соединения формулы (I). Соединение формулы (I) является ключевым промежуточным продуктом в синтезе ивабрадина и его фармацевтически приемлемых солей. В уровне техники раскрыто несколько способов получения соединения формулы (I). Патент EP 0534859 описывает синтез соединения формулы (I) восстановлением рацемического нитрила формулы (III) посредством BH3 в тетрагидрофуране,за которым следует присоединение соляной кислоты, чтобы получить гидрохлорид рацемического амина формулы (IV) который вступает в реакцию с этилхлорформиатом, чтобы получить карбамат формулы (V) восстановление которого посредством LiAlH4 дает рацемический метилированный амин формулы разделение которого с помощью камфарсульфокислоты дает соединение формулы (I). Недостатком этого способа является то, что получают соединение формулы (I) с очень низким выходом от 2 до 3% исходя из рацемического нитрила формулы (III). Этот очень низкий выход связан с низким выходом (от 4 до 5%) стадии разделения вторичного амина формулы (VI). Патент EP 1598333 описывает получение соединения формулы (I) посредством образования соли рацемического первичного амина формулы (IV) с использованием N-ацетил-L-глутаминовой кислоты, с последующей рекристаллизацией затем возвратом к основанию, чтобы получить оптически активный первичный амин формулы (VII) который затем метилируют с использованием той же самой реакционной последовательности, что и ранее (превращение в карбамат, затем восстановление). Этим способом получают метанамин формулы(I) в 4 стадии с выходом приблизительно 30%, исходя из рацемического первичного амина формулы (IV). Задача настоящего изобретения заключалась в том, чтобы получить соединение формулы (I) уменьшив количество стадий, исходя из рацемического первичного амина формулы (IV), сохраняя общий хороший выход. В особенности настоящее изобретение относится к способу синтеза карбамата формулы (IX) где R1 представляет собой группу линейного или разветвленного C1-C6-алкила, аллила или бензила,путем энантиоселективного ферментативного ацилирования рацемического амина формулы (IV) при помощи липазы (ЕС 3.1.1.3 в международной классификации ферментов) карбонатом формулы R1O(CO)-OR1, где R1 является таким, как определен выше, в количестве от 1 до 15 мол.экв. относительно амина формулы (IV), в водном органическом растворителе, смеси органических растворителей или смеси органических и водных растворителей, при концентрации от 5 до 500 г/л соединения формулы (IV) на 1 л растворителя или смеси растворителей, при соотношении E/S от 10/1 до 1/100, предпочтительно от 1/1 до 1/10, при температуре от 25 до 40C. Карбамат формулы (IX), полученный способом согласно настоящему изобретению, предпочтительно обладает энантиомерной чистотой более чем 85%, то есть энантиомерный избыток более чем 70%. Среди липаз, используемых в способе ферментативной этерификации согласно настоящему изобретению, можно перечислить, не ограничиваясь только ими, липазы Pseudomonas fluorescens, Pseudomonascepacia, Pancreas porcine и липазы PS "Amano" SD (Burkholderia cepacia) и IM (иммобилизованная на диатомите). Предпочтительные липазы в соответствии с изобретением представляют собой липазы Pseudomonascepacia и PS "Amano" IM. Предпочтительными карбонатами R1O-(CO)-OR1 являются таковые, в которых R1 представляет собой аллильную, этильную или бензильную группу. Среди органических растворителей, применяемых для реакции ферментативного ацилирования согласно настоящему изобретению, можно назвать, не ограничивая только ими, этилацетат, ТВМЕ, ТГФ, 2 Ме ТГФ, толуол, 1,4-диоксан, трет-амиловый спирт, СРМЕ и ацетонитрил. Предпочтительными растворителями являются ТВМЕ, ТГФ, 2-Ме ТГФ и 1,4-диоксан как таковые или в смеси с буферным раствором при pH 7. Схема ферментативного ацилирования согласно изобретению является следующей: Затем карбамат формулы (IX) выделяют из реакционной среды, после этого восстанавливают с помощью гидрида алюминия, такого как гидрид лития алюминия LiAlH4 или гидрид бис-(2 метоксиэтокси)натрий алюминий (RedAl), чтобы получить метилированный амин формулы (I). Последний затем соединяют или с соединением формулы (X) где X представляет собой атом галогена, предпочтительно атом йода,или подвергают реакции восстановительного аминирования с соединением формулы (XI) в присутствии агента восстановления где R2 представляет собой группу, выбранную из CHO и CHR3R4; где R3 и R4, каждый, представляют собой линейную или разветвленную (C1-C6)алкоксигруппу или же вместе с атомом углерода, который их несет, образуют 1,3-диоксановое, 1,3-диоксолановое или 1,3 диоксепановое кольцо, чтобы получить ивабрадин, который затем преобразуют в фармацевтически приемлемую кислотно-аддитивную соль. Соединение формулы (I) равным образом может быть введено в реакцию восстановительного аминирования в виде его фармацевтически приемлемой кислотно-аддитивной соли, предпочтительно его гидрохлорида. В этом случае ивабрадин получают непосредственно в виде гидрохлорида. Определения. Под рацемическим соединением следует понимать соединение в виде смеси двух энантиомеров в соотношении от 55:45 до 45:55. Под энантиоселективным ацилированием амина в виде смеси двух энантиомеров следует понимать преимущественное ацилирование одного из энантиомеров смеси. Среди фармацевтически приемлемых кислот можно привести, не ограничиваясь только ими, соляную кислоту, бромисто-водородную, серную, фосфорную, уксусную, трифторуксусную, молочную, пировиноградную, малоновую, янтарную, глутаровую, фумаровую, винную, малеиновую, лимонную, аскорбиновую, щавелевую, метансульфоновую, бензолсульфоновую и камфорную кислоты. В числе агентов восстановления для реакции восстановительного аминирования между соединением формулы (I) и соединением формулы (XI) можно привести, не ограничиваясь только ими, соединения-доноры гидрида, такие как триацетоксиборгидрид натрия или цианоборгидрид натрия, и водород в присутствии катализатора, такого как палладий, платина, никель, рутений, родий или их производных, в особенности на носителе или в виде оксидов. Предпочтительным агентом восстановления для реакции восстановительного аминирования между соединением формулы (I) и соединением формулы (XI) является водород в присутствии катализатора - палладия на угле. Приведенные ниже примеры поясняют изобретение. Сокращения. СРМЕ - циклопентил метиловый эфир,DEA - диэтиламин,Е - коэффициент энантиоселективности,E/S - соотношение фермент/подложка, выраженное в г/г,ее - энантиомерный избыток,экв. - молярный эквивалент,ВЭЖХ - высокоэффективная жидкостная хроматография,RedAl - натрий бис-(2-метокси-этокси)алюминий гидрид,ЯМР - (спектроскопия) ядерный магнитный резонанс,ТВМЕ - трет-бутилметиловый эфир,ТГФ - тетрагидрофуран,2-Me - ТГФ 2-метил тетрагидрофуран,об/мин - оборотов/минуту. Пример 1. Этил [(7S)-3,4-диметоксибицикло[4.2.0]окта-1,3,5-триен-7-ил]метилкарбамат. 5 мг 1-(3,4-диметоксибицикло[4.2.0]окта-1,3,5-триен-7-ил)метанамин и 12.6 мг (10 экв.) диэтилкарбоната растворяют в 2-Ме ТГФ. Затем 5 мг липазы II Pseudomonas cepacia (PS-CII Amano) добавляют в среду (соотношение E/S 1/1). Реакционную среду поддерживают при 30C при ротационном перемешивании 250 об/мин в течение от 24 до 96 ч. Реакцию контролируют с помощью ВЭЖХ на хиральной фазе при условиях, позволяющих сразу определить энантиомерные избытки карбамата и амина. Пример 2. Этил [(7S)-3,4-диметоксибицикло[4.2.0]окта-1,3,5-триен-7-ил]метилкарбамат. 0.5 г 1-(3,4-диметоксибицикло[4.2.0] окта-1,3,5-триен 7-ил)метанамина растворяют в 50 мл 2 МеТГФ и затем добавляют диэтилкарбонат (1.5 мл, 12 экв.). 0.5 г (соотношение E/S 1/1) липазы II Pseudomonas cepacia (PS-CII Amano) добавляют в среду, которую поддерживают при 30C в течение 48 ч при перемешивании 220 об/мин. Через 48 ч реакционную среду отфильтровывают, чтобы удалить фермент, и затем выпаривают. Карбамат конфигурации S получают после разделения на колонке SiO2, элюирован-3 024637 ной циклогексан/этилацетат 95/5, затем 80/20 и в конце 50/50, чтобы выделить более полярный амин. В таком случае получают этилкарбамат конфигурации S (224 мг) с выходом в 32.5% по отношению к исходному амину (65% относительно ожидаемого количества карбамата) и с энантиомерной чистотой в 90%. Реакцию контролируют с помощью ВЭЖХ на хиральной фазе в условиях, позволяющих сразу определить энантиомерные избытки карбамата и амина. Пример 3. Аллил [(7S)-3,4-диметоксибицикло[4.2.0]окта-1,3,5-триен-7-ил]метилкарбамат. 0,87 г 1-(3,4-диметоксибицикло[4.2.0]окта-1,3,5-триен-7-ил)метанамин растворяют в 100 мл 2 МеТГФ, затем добавляют диаллилкарбонат (1.5 мл, 2 экв.). 0,5 г (соотношение E/S 1/1) липазы II Pseudomonas cepacia (PS-CII Amano) добавляют в среду, которую поддерживают при 30 в течение 42 ч при перемешивании при 220 об/мин. Затем реакционную среду отфильтровывают, чтобы удалить фермент, и после этого выпаривают. Аллилкарбамат получают после разделения на колонке SiO2, элюированной с циклогексан/этилацетат 95/5, затем 80/20 и затем 50/50, чтобы выделить более полярный амин. Таким образом получают аллилкарбамат конфигурации S (440 мг) с выходом в 35% относительно исходного амина (70% относительно ожидаемого количества карбамата) и с энантиомерной чистотой в 88%. Реакционную среду анализируют с помощью обращено-фазовой ВЭЖХ и энантиоселективность(ее) карбамата и амина контролируют посредством ВЭЖХ на хиральной фазе в соответствии с описанными ниже способами: Пример 4. Бензил [(7S)-3,4-диметоксибицикло[4.2.0]окта-13,5-триен-7-ил]метилкарбамат. 0.5 г 1-(3,4-диметоксибицикло[4.2.0] окта-1,3,5-триен 7-ил)метанамина растворяют в 50 мл 2 MeТГФ, затем добавляют дибензилкарбонат (4.5 г, 7 экв.). 0.5 г (соотношение E/S 1/1) липазы II Pseudomonas cepacia (PS-CII Amano) добавляют в среду, которую поддерживают при 30 при перемешивании при 220 об/мин. Через 24 ч реакционную среду отфильтровывают, чтобы удалить фермент, и после этого выпаривают. Карбамат конфигурации S получают после разделения на колонке SiO2, элюированной циклогексан/этилацетатом 95/5, затем 80/20 и в конце 50/50, чтобы выделить более полярный амин. Таким образом получают карбамат бензила конфигурации S (0.26 г) с выходом в 30% относительно исходного амина (60% относительно ожидаемого количества карбамата) и с энантиомерной чистотой в 95%. Реакционную среду анализируют с помощью обращено-фазовой ВЭЖХ и энантиоселективность(ее) карбамата и амина контролируют с помощью ВЭЖХ на хиральной фазе в соответствии с описанными ниже способами. Пример 5. (7S)-3,4-Диметоксибицикло[4.2.0]окта-1,3,5-триен-7-ил]-N-метилметанамин. В реактор загружают под азотом гидрид лития и алюминия (1,41 кг) и тетрагидрофуран (32,5 л), затем при 20C вливают раствор этил [(7S)-3,4-диметоксибицикло[4.2.0]окта-1,3,5-триен-7 ил]метилкарбамата (5 кг) в тетрагидрофуране (50 л). Нагревают в колбе с обратным холодильником в течение 1 ч, затем охлаждают до температуры ниже 15C, чтобы гидролизовать реакционную смесь водой (1 л), водным раствором 5 N гидроксида натрия (1 л), затем водой (1 л). Полученное твердое вещество отфильтровывают. Органическую фазу высушивают. Продукт, указанный в заголовке, выделяют в виде масла с выходом в 93%. 1H ЯМР (ДМСО-d6, част./млн/TMS) 2.60 (m; 3H); 2.85 (m; 1H); 3.15 (m; 1H); 3.25 (dd; 1H); 3.30 (m; 1H); 3.62 (m; 1H); 3.70 (s; 6H); 6.82 (s; 1H); 6.89 (s; 1H); 8.48 (sl; 1H). Пример 6. (7S)-3,4-Диметоксибицикло[4.2.0]окта-1,3,5-триен-7-ил]-N-метилметанамин, гидрохлорид. В реактор загружают (7S)-3,4-диметоксибицикло[4.2.0]окта-1,3,5-триен-7-ил]-N-метилметанамин (5 кг), этилацетат (40 л) и этанол (10 л). Перемешивают при 20C в течение 30 мин, затем через донный клапан реактора или через погружную трубку добавляют газообразную соляную кислоту (1,012 кг). Полученную суспензию перемешивают при 15-20C в течение 1 ч, затем отфильтровывают или высушивают. Осадок промывают смесью этилацетат/этанол 4/1 (25 л), затем сушат, чтобы получить продукт, указанный в заголовке, с выходом в 92%. Пример 7. Гидрохлорид ивабрадина. В автоклав загружают 5.5 кг 3-[2-(1,3-диоксолан-2-ил)этил]-7,8-диметокси-1,3-дигидро-2H-3 бензазепин-2-она, 27.5 л этанола и 550 г палладия на угле. Продувают азотом затем водородом, нагревают до 55C, затем гидрируют при этой температуре под давлением в 5 бар до поглощения теоретического количества водорода. Затем возвращают к температуре окружающей среды, после этого в автоклаве снижают давление. Затем добавляют 4 кг гидрохлорида (7S)-3,4-диметоксибицикло[4.2.0]окта-1,3,5-триен-7-ил]-Nметилметанамина, 111 этанола, 5.5 л воды и 1 кг палладия на угле. Продувают азотом, затем водородом, нагревают до 85C, затем гидрируют при этой температуре под давлением в 30 бар до поглощения теоретического количества водорода. Затем возвращают к температуре окружающей среды, автоклав продувают, затем реакционную смесь фильтруют, растворители дистиллируют, затем гидрохлорид ивабрадина выделяют кристаллизацией в смеси толуол/л-метил-2-пирролидинол. Таким образом получают гидрохлорид ивабрадина с выходом в 85% и химической чистотой более чем 99%. Пример 8. Скрининг липаз для ферментативного ацилирования 1-(3,4-диметоксибицикло[4.2.0]окта-13,5-триен-7-ил)метанамина. Рацемический 1-(3,4-диметоксибицикло[4.2.0]окта-1,3,5-триен-7-ил)метанамин (5 мг; c=10 г/л) и карбонат формулы R1O-(CO)-OR1 (10 экв.) растворяют в 0.5 мл ТВМЕ. В таком случае добавляют 5 мг (c=10 г/л) исследуемой липазы в среду (соотношение E/S=1/1). Реакционную среду поддерживают при 30C при ротационном перемешивании 250 об/мин в течение 24 ч. Реакционные среды анализировали с помощью ВЭЖХ на хиральной фазе, чтобы контролировать энантиоселективность согласно способу: Энантиомерный избыток ее (в %) = % энантио Е 2 - % энантио Е 1/% энантио Е 2+% энантио Е 1 (энантио Е 2, будучи доминирующим энантиомером); ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы (IX) где R1 представляет собой линейную или разветвленную C1-C6-алкильную, аллильную или бензильную группу,энантиоселективным ферментативным ацилированием рацемического амина формулы (IV) при помощи липазы (ЕС 3.1.1.3 в международной классификации ферментов) карбонатом формулыR1O-(CO)-OR1, где R1 является таким, как определен выше, в количестве от 1 до 15 мол.экв. по отношению к амину формулы (IV), в водном или органическом растворителе, смеси органических растворителей или смеси органических и водных растворителей, при концентрации от 5 до 500 г/л соединения формулы (IV) на 1 л растворителя или смеси растворителей, при соотношении E/S от 10/1 до 1/100, при температуре от 25 до 40C. 2. Способ получения по п.1, в котором липазу выбирают из липаз Pseudomonas fluorescens, Pseudomonas cepacia, поджелудочной железы свиньи и липаз PS "Amano" SD (Burkholderia cepacia) и IM (иммобилизованная на диатомите). 3. Способ получения по п.2, в котором липаза представляет собой липазу Pseudomonas cepacia или липазу PS "Amano" IM. 4. Способ получения по одному из пп.1-3, в котором соотношение E/S представляет собой от 1/1 до 1/10. 5. Способ получения по одному из пп.1-4, в котором растворитель выбирают из ТВМЕ, ТГФ, 2-Ме ТГФ и 1,4-диоксана как таковых или в смеси с буферным раствором при pH 7. 6. Способ получения по одному из пп.1-5, в котором R1 представляет собой этильную, аллильную или бензильную группу. 7. Способ получения соединения формулы (I) ферментативным ацилированием рацемического амина формулы (IV) по одному из пп.1-6 с полу-6 024637 чением карбамата формулы (IX) где R1 представляет собой линейную или разветвленную C1-C6-алкильную, аллильную или бензильную группу,который затем восстанавливают агентом восстановления, выбранным из LiAlH4 и RedAl, с получением соединения формулы (I). 8. Способ получения ивабрадина, в котором соединение формулы (I) где X представляет собой атом галогена,с получением ивабрадина, который затем преобразуют в фармацевтически приемлемую кислотноаддитивную соль в виде ангидрида или гидрата. 9. Способ получения ивабрадина, в котором соединение формулы (I) подвергают реакции восстановительного аминирования с соединением формулы (XI) в присутствии агента восстановления где R2 представляет собой группу, выбранную из CHO и CHR3R4, где R3 и R4, каждый, представляют собой линейную или разветвленную (C1-C6)алкоксигруппу или же вместе с атомом углерода, который их несет, образуют 1,3-диоксановое, 1,3-диоксолановое или 1,3-диоксепановое кольцо с получением ивабрадина, который затем преобразуют в фармацевтически приемлемую кислотно-аддитивную соль в виде ангидрида или гидрата. 10. Способ получения по п.8, в котором X представляет собой атом йода. 11. Способ получения по п.9, в котором соединение формулы (I) вводят в реакцию восстановительного аминирования в виде его гидрохлорида с получением ивабрадина в виде гидрохлорида. 12. Способ получения по одному из пп.9 или 11, в котором реакцию восстановительного аминирования с соединением формулы (XI) осуществляют в присутствии водорода, катализированного палладием на угле.
МПК / Метки
МПК: C12P 13/00, C12N 9/78, C07C 217/58, C07D 223/16
Метки: способ, солей, синтезе, ивабрадина, n-метилметанамина, ферментативного, применение, синтеза, 7s)-1-(3,4-диметоксибицикло[4.2.0]окта-1,3,5-триен-7-ил
Код ссылки
<a href="https://eas.patents.su/8-24637-sposob-fermentativnogo-sinteza-7s-1-34-dimetoksibiciklo420okta-135-trien-7-il-n-metilmetanamina-i-primenenie-v-sinteze-ivabradina-i-ego-solejj.html" rel="bookmark" title="База патентов Евразийского Союза">Способ ферментативного синтеза (7s)-1-(3,4-диметоксибицикло[4.2.0]окта-1,3,5-триен-7-ил) n-метилметанамина и применение в синтезе ивабрадина и его солей</a>
Предыдущий патент: Прямоточные и противоточные процессы ионного обмена в выщелачивателе в способах выщелачивания золота
Следующий патент: Способ дезинтеграции эластомера и дезинтегратор
Случайный патент: Новые гетероциклические соединения в качестве положительных аллостерических модуляторов метаботропных глутаматных рецепторов












