Кристаллы производных гидроксинорэфедрина
Номер патента: 6022
Опубликовано: 25.08.2005
Авторы: Касаи Кийоси, Сонехара Дзунити, Хотеи Юкихико, Харада Хирому, Акахане Сатоси, Исава Хидетоси
Формула / Реферат
1. Гидрохлорид этил (-)-2-[4-[2-[[(1S,2R)-2-гидрокси-2-(4-гидроксифенил)-1-метилэтил]амино]этил]-2,5-диметилфенокси]ацетата формулы (I)
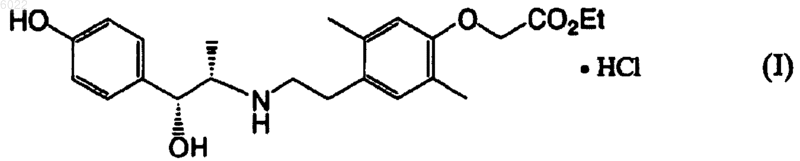
2. Кристаллическая форма соединения формулы I по п.1.
3. Кристаллическая форма A соединения формулы I по п.2, которая демонстрирует картину рентгеновской дифракции порошка с характеристическими пиками при угле дифракции (2q + 0,1° ) 8,9; 10,2; 12,9; 14,2; 15,6; 18,4 и 20,6° .
4. Кристаллическая форма B соединения формулы I по п.2, которая демонстрирует картину рентгеновской дифракции порошка с характеристическими пиками при угле дифракции (2q + 0,1° ) 7,3; 10,1; 12,2; 14,6; 15,9; 16,0; 18,7 и 21,8° .
5. Фармацевтическая композиция, которая включает в качестве активного ингредиента соединение по любому из пп.1-4.
6. Фармацевтическая композиция по п.5 для лечения поллакиурии или недержания мочи.
7. Лекарственное средство для лечения поллакиурии или недержания мочи, которое содержит в качестве активного ингредиента соединение по любому из пп.1-4.
8. Применение соединения по любому из пп.1-4 для получения лекарственного средства для лечения поллакиурии или недержания мочи.
9. Способ лечения поллакиурии или недержания мочи, который включает введение терапевтически эффективного количества соединения по любому из пп.1-4.
Текст
006022 Область изобретения Настоящее изобретение касается гидрохлорида этил (-)-2-[4-[2-(1S,2R)-2-гидрокси-2-(4 гидроксифенил)-1-метилэтил]амино]этил]-2,5-диметилфенокси]ацетата и в частности его кристаллических форм, которые обладают стимулирующим эффектом на 3-адреноцепторы и полезны в качестве лекарственного средства для лечения поллакиурии или недержания мочи. Предпосылки Этил (-)-2-[4-[2-(1S,2R)-2-гидрокси-2-(4-гидроксифенил)-1-метилэтил]амино]этил]-2,5-диметилфенокси]ацетат, представленный формулой (II) раскрыт заявителем настоящего изобретения в WO 00/02846 и сам по себе является известным соединением. Известно, что данное соединение обладает превосходным эффектом стимуляции 3 адреноцепторов и полезно в качестве лекарственного средства для лечения поллакиурии или недержания мочи. Соединение (II) демонстрирует превосходную терапевтическую активность для лечения поллакиурии или недержания мочи, однако его можно получить только в аморфном виде способом, описанным вWO 00/02846. Для получения аморфного соединения (II) по существу в чистом виде необходимы сложные стадии очистки. Соединение (II) трудно изготовить в составе твердых препаратов из-за его физического свойства вязкости. Кроме того, соединение (II) имеет неудовлетворительную стабильность, и при хранении в обычных условиях в течение длительного периода возникают значительные проблемы изменения цвета и снижения содержания активного ингредиента. Таким образом, существует необходимость в новой форме соединения (II), которая обладает удовлетворительной стабильностью при хранении и применима в качестве лекарственного вещества. Описание изобретения Заявители настоящего изобретения интенсивно исследовали разнообразные соли присоединения кислот соединения (II) и неожиданно обнаружили, что гидрохлорид соединения (II), который представляет собой гидрохлорид этил (-)-2-[4-[2-(1S,2R)-2-гидрокси-2-(4-гидроксифенил)-1-метилэтил]амино]этил]-2,5-диметилфенокси]ацетата, представленный формулой (I) можно получить в виде высоко кристалличного твердого вещества. Кроме того, заявители настоящего изобретения исследовали кристаллы соединения (I) и обнаружили, что кристаллы по изобретению неожиданно обладают превосходной стабильностью при хранении и полезны в качестве лекарственного вещества. На основании данных открытий создано настоящее изобретение. Таким образом, настоящее изобретение относится к(2) кристаллу соединения по указанному выше пункту (1);(3) кристаллу по указанному выше пункту (2), который демонстрирует картину рентгеновской дифракции порошка с характеристическими пиками при угле дифракции (2 + 0,1) 8,9; 10,2; 12,9; 14,2; 15,6; 18,4 и 20,6 (здесь далее обозначен как кристаллическая форма А);(4) кристаллу по указанному выше пункту (2), который демонстрирует картину рентгеновской дифракции порошка с характеристическими пиками при угле дифракции (2 + 0,1) 7,3; 10,1; 12,2; 14,6; 15,9; 16,0; 18,7 и 21,8 (здесь далее обозначен как кристаллическая форма В);(5) фармацевтической композиции, которая включает в качестве активного ингредиента соединение по любому из указанных выше пунктов с (1) по (4);(6) фармацевтической композиции по указанному выше пункту (5) для лечения поллакиурии или недержания мочи;(7) лекарственному средству для лечения поллакиурии или недержания мочи, которое включает в качестве активного ингредиента соединение по любому из указанных выше пунктов с (1) по (4);(8) применению соединения по любому из указанных выше пунктов с (1) по (4) для получения лекарственного средства для лечения поллакиурии или недержания мочи и(9) способу лечения поллакиурии или недержания мочи, который включает введение терапевтически эффективного количества соединения по любому из указанных выше пунктов с (1) по (4).-1 006022 Краткое описание чертежей На фиг. 1 представлена картина рентгеновской дифракции порошка кристаллической формы А соединения (I), полученной в примере 2, где ордината показывает интенсивность рентгеновского излучения в имп./с, а абсцисса показывает угол дифракции в 2. На фиг. 2 представлена картина рентгеновской дифракции порошка кристаллической формы В соединения (I), полученной в примере 3, где ордината показывает интенсивность рентгеновского излучения в имп./с, а абсцисса показывает угол дифракции в 2. Наилучший вариант осуществления данного изобретения Соединение настоящего изобретения, представленное формулой (I), и его индивидуальные кристаллические формы А и В можно получить следующим образом. Соединение (II), которое применяют в качестве исходного вещества настоящего изобретения, можно получить в виде аморфных форм по известной методике, которая описана в WO OO/02846. Соединение (I) можно получить в виде кристаллических форм путем взаимодействия раствора соединения (II) в подходящем органическом растворителе с соляной кислотой или хлористым водородом. Примеры органических растворителей, используемых при указанном выше взаимодействии, включают этанол, эфиры карбоновых кислот, такие как этилацетат и подобные, углеводороды, такие как толуол и подобные, ацетонитрил и подобные. Органические растворители можно применять сами по себе или в виде смеси двух или более растворителей. Можно применять источник НСl в виде соляной кислоты или раствора указанного выше органического растворителя, через который продувают газообразный хлористый водород. Взаимодействие соединения (II) с соляной кислотой или хлористым водородом происходит мгновенно. Время, необходимое для кристаллизации, меняется в зависимости от условий кристаллизации,таких как используемые количества органических растворителей и НСl, а также температура кристаллизации и подобное, и обычно составляет примерно от 1 до 24 ч. Предпочтительно проводить кристаллизацию при перемешивании реакционной смеси при температуре примерно от 0 до 30 С в течение 1-6 ч,получая соединение (I). Перекристаллизация полученного таким образом соединения (I) из подходящего растворителя дает кристаллические формы А и В, которые являются индивидуальными кристаллическими формами соединения (I) настоящего изобретения. Например, кристаллическую форму А можно получить следующим образом. Соединение (I) растворяют в этаноле при нагревании и к полученному раствору добавляют, если необходимо, третбутилметиловый эфир, изопропанол или воду при температуре примерно от 40 до 50 С при перемешивании, затем данную смесь перемешивают при температуре примерно от 40 до 50 С в течение 1-6 ч. После этого смесь перемешивают при температуре примерно от 0 до 30 С еще в течение 1-6 ч, получая кристаллическую форму А. Кристаллическую форму В можно получить следующим образом. Соединение (I) растворяют в этаноле и тетрагидрофуране при нагревании и к полученной смеси добавляют при перемешивании дополнительное количество тетрагидрофурана примерно при 40 С. Смесь перемешивают при температуре примерно от 0 до 10 С в течение 1-12 ч, получая кристаллическую форму В. Полученные таким образом кристаллические формы А и В соединения (I) можно идентифицировать по их характеристическим диффракционным пикам, которые показаны на диаграммах рентгеновской дифракции порошков, фиг. 1 и 2:(1) кристаллическая форма А имеет характеристические пики при углах дифракции (2 + 0,1) 8,9; 10,2; 12,9; 14,2; 15,6; 18,4 и 20,6, как показано на фиг. 1; и(2) кристаллическая форма В имеет характеристические пики при углах дифракции (2 + 0,1) 7,3; 10,1; 12,2; 14,6; 15,9; 16,0; 18,7 и 21,8, как показано на фиг. 2. Кристаллические формы А и В соединения (I) могут храниться при обычных условиях хранения,таких как 25 С, 60% относительная влажность и подобные, в течение длительного периода без изменения кристаллических форм и также являются химически стабильными. Кристаллические формы А и В имеют превосходную текучесть и хорошие характеристики для манипуляций и подходят для получения препаратов. Соединение настоящего изобретения, представленное формулой (I), обладает превосходным стимулирующим 3-адреноцепторы эффектом и расслабляет сокращающую мышцу мочевого пузыря, а также увеличивает объем мочевого пузыря. Таким образом, соединение (I) настоящего изобретения можно применять для лечения дизурии, такой как поллакиурия, недержания мочи в случае нервной поллакиурии, нейрогенной дисфункции мочевого пузыря, никтурии, нестабильного мочевого пузыря, цистоспазма, хронического или острого цистита, хронического или острого простатита, гипертрофии предстательной железы и подобного, идиопатической поллакиурии, идиопатического недержания мочи и подобного. Соединение настоящего изобретения, представленное формулой (I), можно применять, если требуется, в комбинации с другим лекарственным средством для лечения дизурии. Примеры таких лекарственных средств включают антихолинергические агенты, такие как оксибутинингидрохлорид, пропиве-2 006022 рингидрохлорид, толтеродин, дарифенацин, фезотеродин, троспиумхлорид, KRP-197, YM-905 и подобные; релаксанты гладких мышц, такие как флавоксатгидрохлорид и подобные; агонисты 2 адреноцепторов, такие как кленбутеролгидрохлорид, формотеролфумарат и подобные; агонисты 1 адреноцепторов, такие как мидодрингидрохлорид, R-450, GW-515524, АВТ-866 и подобные; препараты эстрогена, такие как конъюгированный эстроген, эстриол, эстрадиол и подобные; агенты для центральной нервной системы, такие как антиэпилептические агенты, антидепрессанты и подобные, такие как имипрамин, резерпин, диазепам, карбамазепин и подобные; антагонисты рецепторов нейрокинина, такие как ТАК-637, SB-223956, AZD-5106 и подобные; агенты для открывания калиевых каналов, такие какKW-7158, AZD-0947, NS-8, АВТ-598, WAX-151616 и подобные; агонисты ваниллоидных рецепторов,такие как капсаицин, резинифератоксин и подобные; агонисты рецепторов вазопрессина 2, такие как десмопрессин, ОРС-51803, WAY-141608 и подобные; антагонисты 1-адреноцепторов, такие как тамсулозин, урапидил, нафтопидил, силодзин, теразозин, празозин, алфузозин, фидуксозин, AIO-8507L и подобные; антагонисты рецепторов GABA, такие как баклофен и подобные; антагонисты рецепторов серотонина, такие как REC-15-3079 и подобные; агонисты рецепторов допамина, такие как L-допа и подобные, или антагонисты рецепторов допамина; противоаллергические агенты, такие как антагонисты рецепторов гистамина, например, сульплатасттозилат, норастемизол и подобные; ингибиторы NO-синтазы,такие как нитрофлурбипрофен и подобные. В случае применения фармацевтической композиции, включающей соединение, представленное формулой (I), или его кристаллические формы, для лечения можно использовать разнообразные дозированные формы в зависимости от их употреблений. Типичные дозированные формы включают порошки,гранулы, мелкие гранулы, сухие сиропы, таблетки, капсулы, препараты для инъекций, жидкости, мази,суппозитории, припарки и подобные формы, которые вводят перорально или парентерально. Фармацевтические композиции можно приготовить путем смешивания, разбавления или растворения при помощи подходящих фармацевтических добавок, таких как наполнители, разрыхлители, связующие, лубриканты (смазывающие агенты), разбавители, буферы, изотонические агенты, консерванты,смачивающие агенты, эмульгаторы, диспергирующие агенты, стабилизаторы, агенты, способствующие растворению и подобные, в соответствии с обычной методикой получения препаратов в зависимости от их дозированных форм. В случае применения фармацевтической композиции настоящего изобретения для лечения, дозы соединения, представленного формулой (I), или его кристаллических форм определяют подходящим образом в зависимости от возраста, пола или массы тела конкретного пациента, тяжести заболевания, состояния, подлежащего лечению, и подобного. Типичная доза для перорального приема составляет примерно от 0,01 до 100 мг в день на взрослого человека. Типичная доза для парентерального введения составляет примерно от 0,0003 до 30 мг в день на взрослого человека. Дозированный препарат можно вводить в виде одной дозы или раздельных доз от одного до нескольких раз в день. Если соединение, представленное формулой (I), или его кристаллические формы применяют в комбинации с другим лекарственным средством для лечения дизурии, то фармацевтические композиции можно приготовить путем смешивания отдельно каждого из активных ингредиентов или одновременного смешивания обоих активных ингредиентов с фармацевтически приемлемыми добавками, такими как наполнитель, разрыхлитель, связующее, лубрикант, разбавитель, буфер, изотонический агент, консервант, смачивающий агент, эмульгатор, диспергирующий агент, стабилизатор, агент, способствующий растворению, и подобные, и вводить отдельно или одновременно в виде дозированной формы для перорального или парентерального применения. Если применяют отдельно приготовленные фармацевтические композиции, то данные композиции можно смешивать вместе с подходящим разбавителем и вводить одновременно. Альтернативно, если применяют отдельно приготовленные композиции, то данные композиции можно вводить отдельно, одновременно или с различными интервалами. Примеры Приведенные далее примеры, сравнительные примеры и примеры испытаний дополнительно иллюстрируют данное изобретение. Однако следует понимать, что они никоим образом не ограничивают область данного изобретения. Картины рентгеновской дифракции порошков кристаллических форм по изобретению получали с применением рентгеновского дифракционного анализатора RINT1400 (Rigaku), который работает при 30 кВ/100 мА, и СuК-пучка лучей. Температуры плавления определяли, используя микроустройство для определения температуры плавления MP-J3 (Yanagimoto). Исходное вещество, соединение (II), получали в соответствии с методикой, которая описана в примере 2 в WO 00/02846. Ссылочный пример 1. Этил (-)-2-[4-[2-(1S,2R)-2-гидрокси-2-(4-гидроксифенил)-1-метилэтил]амино]этил]-2,5-диметилфенокси]ацетат (соединение (II К смеси этил 2-[4-(2-бромэтил)-2,5-диметилфенокси]ацетата (18,1 г), (1R,2S)-пара-гидроксинорэфедрина (8,0 г) и N,N-диметилформамида (45 г) добавляют диизопропиламин (7,26 г) и полученную смесь перемешивают при 100 С в течение 1,5 ч в атмосфере азота. После охлаждения до комнатной тем-3 006022 пературы к реакционной смеси добавляют этилацетат (140 г) и воду (60 г) и отделяют органический слой. Водный слой экстрагируют дополнительным количеством этилацетата (72 г). Объединенные органические слои промывают последовательно водой и насыщенным раствором соли, сушат над сульфатом натрия и фильтруют. Растворитель удаляют при пониженном давлении, получая сырой продукт (27,8 г). Порцию сырого продукта в 15 г очищают колоночной хроматографией, используя 400 г аминопропилсиликагеля (элюент: дихлорметан/этанол = 20/1), получая этил (-)-2-[4-[2-(1S,2R)-2-гидрокси-2-(4 гидроксифенил)-1-метилэтил]амино]этил]-2,5-диметилфенокси]ацетат (4,48 г) в виде бесцветного аморфного вещества. 1(1 Н, с), 7,05 (2 Н, д, J=8,6 Гц). Пример 1. Гидрохлорид этил (-)-2-[4-[2-(1S,2R)-2-гидрокси-2-(4-гидроксифенил)-1-метилэтил]амино]этил]2,5-диметилфенокси]ацетата (соединение (I Смесь этил 2-[4-(2-бромэтил)-2,5-диметилфенокси]ацетата (23 г), (1R,2S)-пара-гидроксинорэфедрина (10 г), диизопропиламина (9,1 г) и N,N-диметилформамида (56 г) нагревают при 100 С в течение 2 ч в атмосфере азота. После охлаждения до комнатной температуры к реакционной смеси добавляют этилацетат (180 г) и воду (75 г). Отделяют органический слой и экстрагируют водный слой дополнительным количеством этилацетата (90 г). Объединенные органические слои промывают водой и насыщенным раствором соли, сушат над сульфатом натрия и фильтруют. Удаляют растворитель при пониженном давлении и остаток растворяют в толуоле (38,5 г). К полученному раствору добавляют по каплям 30 мас.% раствор хлористого водорода в этаноле (6,1 г) при охлаждении льдом и полученную смесь перемешивают при комнатной температуре в течение 2 ч для кристаллизации. Осадившиеся кристаллы собирают фильтрованием, сушат при 60 С в течение 6 ч в вакууме, получая 15 г соединения (I). 1 Н-ЯМР (ДМСО-d6)м.д.: 0,98 (3H, д, J=6,1 Гц), 1,33 (3H, т, J=7,0 Гц), 2,18 (3H, с), 2,21 (3H, с), 2,63,0 (5 Н, м), 4,30 (2 Н, кв, J=7,0 Гц), 4,50 (1 Н, д, J=5,5 Гц), 4,61 (2 Н, с), 6,42 (1 Н, с), 6,69 (2 Н, д, J=8,5 Гц),6,78 (1 Н, с), 7,05 (2 Н, д, J=8,6 Гц). Пример 2. Кристаллическая форма А гидрохлорида этил (-)-2-[4-[2-(1S,2R)-2-гидрокси-2-(4-гидроксифенил)1-метилэтил]амино]этил]-2,5-диметилфенокси]ацетата Смесь 17,0 г соединения (I), полученного в примере 1, и этанола (130 г) нагревают при 70 С с перемешиванием до тех пор, пока она не станет прозрачным раствором. Отфильтровывают нерастворенные вещества и затем охлаждают фильтрат до 40 С и добавляют затравочные кристаллы. Смесь перемешивают при 40 С в течение 1,5 ч для кристаллизации и добавляют трет-бутилметиловый эфир (68 г). После перемешивания полученной смеси еще в течение 1 ч суспензию охлаждают до 20 С и добавляют третбутилметиловый эфир (58 г). Суспензию оставляют стоять в течение ночи при комнатной температуре и затем перемешивают 3 ч при охлаждении льдом. Осадившиеся кристаллы собирают фильтрованием, сушат при 60 С в течение ночи в вакууме, получая 13,0 г кристаллов. Температура плавления 194-196 С. Кристаллы идентифицируют как кристаллическую форму А посредством рентгеновского дифракционного анализа порошка. Картина рентгеновской дифракции порошка показана на фиг. 1. Пример 3. Кристаллическая форма В гидрохлорида этил (-)-2-[4-[2-(1S,2R)-2-гидрокси-2-(4-гидроксифенил)1-метилэтил]амино]этил]-2,5-диметилфенокси]ацетата Смесь 100 мг соединения (I) , полученного в примере 1, этанола (245 мкл) и тетрагидрофурана (450 мкл) нагревают при 75 С с перемешиванием до тех пор, пока она не станет прозрачным раствором. Данный раствор охлаждают до 40 С и добавляют тетрагидрофуран (1,6 мл). Полученную смесь сразу охлаждают на бане со льдом и продолжают перемешивание в течение 7 ч. Смесь оставляют стоять в течение ночи при комнатной температуре и затем перемешивают 2 ч при охлаждении льдом. Осадившиеся кристаллы собирают фильтрованием и сушат при 60 С в течение ночи в вакууме, получая 60,5 мг кристаллов. Температура плавления 177-179 С. Кристаллы идентифицируют как кристаллическую форму В посредством рентгеновского дифракционного анализа порошка. Картина рентгеновской дифракции порошка показана на фиг. 2. Исследование стабильности Исследование стабильности проводят в условиях хранения при 60 С для кристаллической формы А, полученной в примере 2, кристаллической формы В, полученной в примере 3, и аморфной формы соединения (II), полученной в ссылочном примере 1. Остаточный процент исследуемых веществ определяют методом ВЭЖХ и наблюдают изменения внешнего вида. Результаты представлены выше в таблице. Кристаллические формы А и В настоящего изобретения показывают отсутствие изменений во внешнем виде и имеют превосходную стабильность при хранении по сравнению с аморфным соединением (II). Промышленная применимость Соединение настоящего изобретения, представленное формулой (I), обладает превосходным стимулирующим 3-адреноцепторы эффектом и терапевтическим действием на поллакиурию или недержание мочи и полезно в качестве лекарственного средства. Соединение настоящего изобретения, представленное формулой (I), имеет свойство высокой кристалличности и может быть получено с высокой степенью чистоты по обычной методике очистки и, следовательно, подходит для коммерческого производства. Кроме того, индивидуальные кристаллические формы А и В настоящего изобретения имеют превосходную стабильность при хранении, текучесть, характеристики манипулирования и подходят для получения препаратов. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Гидрохлорид этил (-)-2-[4-[2-(1S,2R)-2-гидрокси-2-(4-гидроксифенил)-1-метилэтил]амино]этил]-2,5-диметилфенокси]ацетата формулы (I) 2. Кристаллическая форма соединения формулы I по п.1. 3. Кристаллическая форма А соединения формулы I по п.2, которая демонстрирует картину рентгеновской дифракции порошка с характеристическими пиками при угле дифракции (2 + 0,1) 8,9; 10,2; 12,9; 14,2; 15,6; 18,4 и 20,6. 4. Кристаллическая форма В соединения формулы I по п.2, которая демонстрирует картину рентгеновской дифракции порошка с характеристическими пиками при угле дифракции (2 + 0,1) 7,3; 10,1; 12,2; 14,6; 15,9; 16,0; 18,7 и 21,8. 5. Фармацевтическая композиция, которая включает в качестве активного ингредиента соединение по любому из пп.1-4. 6. Фармацевтическая композиция по п.5 для лечения поллакиурии или недержания мочи. 7. Лекарственное средство для лечения поллакиурии или недержания мочи, которое содержит в качестве активного ингредиента соединение по любому из пп.1-4. 8. Применение соединения по любому из пп.1-4 для получения лекарственного средства для лечения поллакиурии или недержания мочи. 9. Способ лечения поллакиурии или недержания мочи, который включает введение терапевтически эффективного количества соединения по любому из пп.1-4.
МПК / Метки
МПК: A61P 13/10, A61K 31/216, C07C 217/60
Метки: кристаллы, гидроксинорэфедрина, производных
Код ссылки
<a href="https://eas.patents.su/7-6022-kristally-proizvodnyh-gidroksinorefedrina.html" rel="bookmark" title="База патентов Евразийского Союза">Кристаллы производных гидроксинорэфедрина</a>
Предыдущий патент: Применение липосом для транспорта лекарственных средств или веществ с косметической активностью на основе сложных эфиров l-карнитина и композиции, включающие липосомы
Следующий патент: Пиридазиноновые ингибиторы альдозоредуктазы
Случайный патент: Способ получения обезвоженного порошка плодов абрикоса и содержащая такой порошок биологически активная пищевая добавка











