Способ получения циталопрама
Формула / Реферат
1. Способ получения циталопрама, включающий взаимодействие соединения формулы (II)
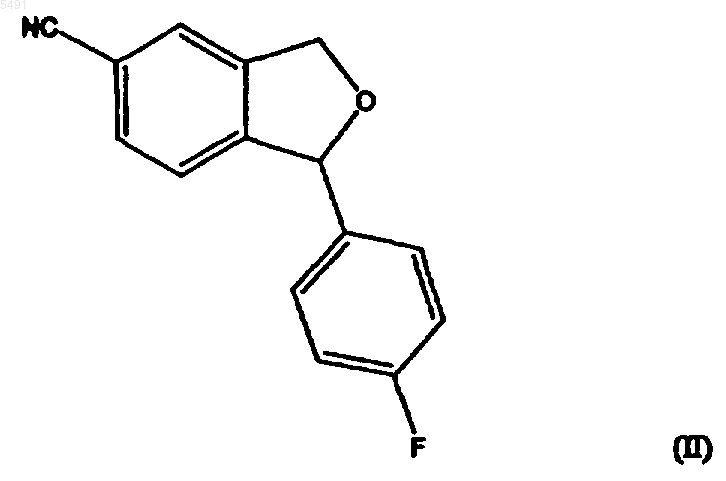
с соединением, имеющим формулу
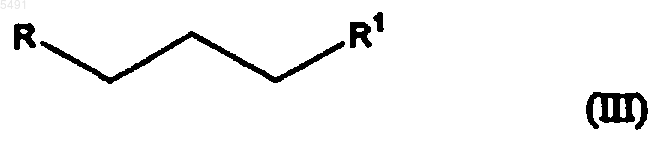
где R представляет собой галоген или -O-SO2-X, где X выбран из группы, включающей метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-2-пропил, 2,2-диметил-1-этил, 2-метил-1-пропил, этенил, пропенил, бутенил, этинил, пропинил, бутинил, фенил, нафтил, бензил и фенилэтил,
и R1 представляет собой диметиламино, галоген или -O-SO2-X, где X такой, как определен выше, при условии, что R не является галогеном, когда R1 представляет собой диметиламино;
и, если R1 представляет собой диметиламино, с последующим выделением основания циталопрама или его фармацевтически приемлемой соли добавления кислот,
и, если R1 представляет собой галоген или -O-SO2-X, где X такой, как определен выше, с последующим преобразованием полученного соединения формулы
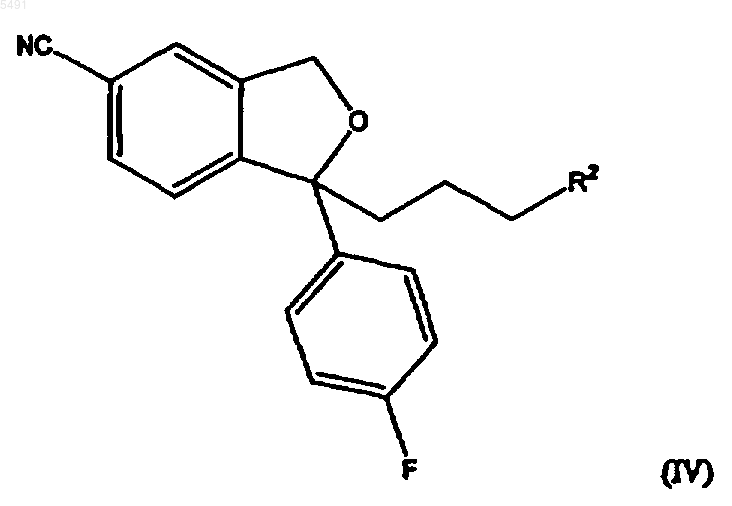
где R2 представляет собой галоген или группу формулы -O-SO2-X, где X такой, как определен выше, в циталопрам, с последующим выделением основания циталопрама или его фармацевтически приемлемой соли добавления кислот.
2. Способ получения циталопрама по п.1, включающий взаимодействие соединения формулы (II) с сульфониловым эфиром, имеющим формулу
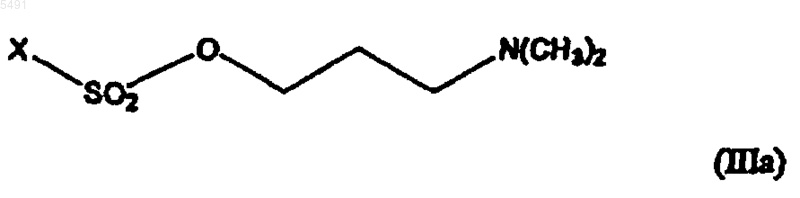
где X такой, как определен в п.1, с последующим выделением основания циталопрама или его фармацевтически приемлемой соли добавления кислот.
3. Способ получения циталопрама по п.1, включающий взаимодействие соединения формулы (II) с соединением, имеющим формулу
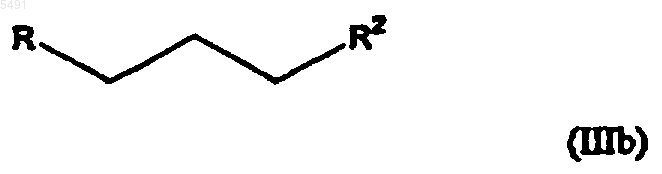
где R и R2 такие, как определены в п.1, с последующим взаимодействием полученного соединения формулы (IV)
a) с диметиламином или его солью с металлом,
b) с метиламином и последующим восстановительным аминированием или
c) с азидом и последующим восстановлением с образованием соответствующего аминосоединения и далее метилированием или восстановительным аминированием,
с образованием циталопрама.
4. Способ по любому из пп.1-3, где взаимодействие соединения формулы (II) с соединением формулы (III) проводят в присутствии основания, выбранного из LDA (диизопропиламин лития), LiHMDS (гексаметилдисилазан лития), NaH, NaHMDS (гексаметилдисиласан натрия) и металалкоксидов, таких как NaOMe, KOMe, LiOMe, NaOтретBu, KOтретBu и LiOтретBu.
5. Соединение общей формулы (IV)
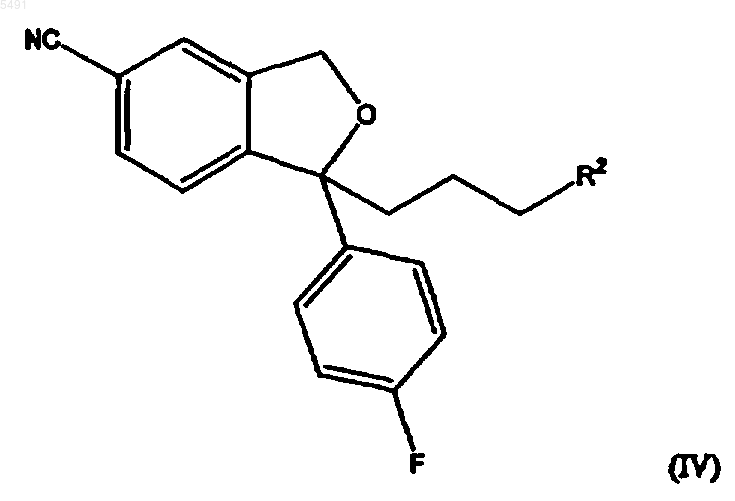
где R2 представляет собой галоген или группу формулы -O-SO2-X, где X такой, как определен в п.1.
Текст
005491 Настоящее изобретение относится к способу получения широко известного антидепрессантного лекарственного препарата циталопрама, 1-[3-(диметиламино)пропил]-1-(4-фторфенил)-1,3-дигидро-5 изобензофуранкарбонитрила. Предпосылки изобретения Циталопрам является хорошо известным антидепрессантным лекарственным препаратом, который уже несколько лет находится на рынке и имеет следующую структуру: Он является селективным ингибитором обратного захвата серотонина (5-гидрокситриптамин; 5-НТ) с центральным действием и, таким образом, имеет антидепрессантную активность. Об антидепрессантной активности соединения сообщалось в нескольких публикациях, например в J. Hyttel Prog. NeuroPsychopharmacol.Biol. Psychiat. 1982, 6, 277-295, и A. Gravem Acta Psychiatr. Scand. 1987, 75, 478-486. Также было описано, что соединение оказывает эффект при лечении деменции и цереброваскулярных расстройств, ЕР-А-474580. Циталопрам впервые был описан в DE 2657013, соответствующей US 4136193. В этой патентной публикации описано получение циталопрама с помощью одного способа и в общих чертах обрисован дополнительный способ, который может использоваться для получения циталопрама. В соответствии с описанным способом, соответствующий 1-(4-фторфенил)-1,3-дигидро-5 изобензофуранкарбонитрил взаимодействует с 3-(N,N-диметиламино)пропилхлоридом в присутствии метилсульфинилметида в качестве конденсирующего агента. Исходный продукт получали из соответствующего 5-бромпроизводного взаимодействием с цианидом меди. В международной патентной публикацииWO 98/019511 описан способ получения циталопрама,где соединение 4-(циано, алкилоксикарбонил или алкиламинокарбонил)-2-гидроксиметилфенил-(4 фторфенил)метанол подвергается замыканию кольца. Полученный 5-(алкилоксикарбонил или алкиламинокарбонил)-1-(4-фторфенил)-1,3-дигидроизобензофуран преобразуют в соответствующее 5 цианопроизводное, и 5-цианопроизводное затем алкилируют (3-диметиламино)пропилгалогенидом с получением циталопрама. В настоящее время, неожиданно, было обнаружено, что циталопрам может быть получен новым удобным способом. Процесс алкилирования в соответствии с изобретением является особенно выгодным, так как избегается образование побочных продуктов путем полимеризации алкилирующих агентов, посредством чего становится возможным восстановление количества используемого алкилирующего агента. Способ по изобретению обеспечивает высокий выход. Краткое описание изобретения Таким образом, настоящее изобретение относится к способу получения циталопрама, который включает взаимодействие соединения формулы где R представляет собой галоген или -O-SO2-X, где X выбран из группы, включающей метил, этил, 1 пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-2-пропил, 2,2-диметил-1-этил, 2-метил-1-пропил, этенил,пропенил, бутенил, этинил, пропинил, бутинил, фенил, нафтил, бензил и фенилэтил,и R1 представляет собой диметиламино, галоген или -O-SO2-X, где X такой, как определен выше,при условии, что R не является галогеном, когда R1 представляет собой диметиламино; и, если R1 представляет собой диметиламино, с последующим выделением основания циталопрама или его фармацевтически приемлемой соли добавления кислот,и, если R1 представляет собой галоген или -О-SО 2-Х, где X такой, как определен выше, с последующим преобразованием полученного соединения формулы где R2 представляет собой галоген или группу формулы -O-SO2-X, где X такой, как определен выше, в циталопрам, с последующим выделением основания циталопрама или его фармацевтически приемлемой соли добавления кислот. Таким образом, в одном воплощении настоящее изобретение относится к способу, где соединение формулы (II) взаимодействует с сульфониловым эфиром, имеющим формулу где X такой, как определен выше, что приводит к непосредственному образованию циталопрама. Во втором воплощении настоящее изобретение относится к способу, где соединение формулы (II) взаимодействует с соединением, имеющим формулу где R и R2 такие, как определены выше, с последующим взаимодействием полученного соединения формулы (IV)a) с диметиламином или его солью с металлом,b) с метиламином и последующим восстановительным аминированием, илиc) с азидом и последующим восстановлением с образованием соответствующего аминосоединения и далее метилированием или восстановительным аминированием, с образованием циталопрама. В другом аспекте изобретение относится к промежуточным продуктам общей формулы (IV). В еще другом аспекте настоящее изобретение относится к антидепрессантной фармацевтической композиции, включающей циталопрам, полученный способом по изобретению. Стадию алкилирования, где соединение формулы (II) взаимодействует с соединением формулы(III), обычно проводят обработкой соединения формулы (II) основанием, таким как, например, LDA(диизопропиламин лития), LiHMDS (гексаметилдисиласан лития), NaH, NaHMDS (гексаметилдисиласан натрия) и металалкоксиды, такие как NaOMe, KOMe, LiOMe, NaОтретВu, КОтретВu и LiОтретВu в апротонном органическом растворителе, таком как ТГФ (тетрагидрофуран), ДМФ (диметилформамид), NMP(N-метилпирролидон), простые эфиры, такие как диэтиловый эфир или диоксалан, толуол, бензол или алканы, и их смесях. Образующийся анион затем взаимодействует с соединением формулы (III), посредством чего группа формулы -CH2-CH2-CH2-R2 или -CH2-CH2-CH2-N(CH3)2 вводится в положение 1 изобензофуранильной кольцевой системы. Соединение формулы (VI) затем взаимодействует с диметиламином или его солью с металлом, такой как М+, N(СН 3)2, где М+ представляет собой Li+ или Na+. Взаимодействие удобно проводить в апротонном органическом растворителе, таком как ТГФ (тетрагидрофуран), ДМФ (диметилформамид), NMP(N-метилпирролидон), простые эфиры, такие как диэтиловый эфир или диоксалан, толуол, бензол или алканы, и их смесях. Соединение формулы (IV) может также быть преобразовано в циталопрам взаимодействием с хлоридом диметиламмония. Реакционные условия, растворители и тому подобное, используемые для описанных выше взаимодействий, являются обычными условиями для таких взаимодействий и могут быть легко определены специалистом в данной области. Альтернативно, соединение формулы (IV) взаимодействует с азидом, таким как азид натрия, с последующим восстановлением, c использованием в качестве катализатора, например, Pd/C, с образованием соответствующего амина формулы и после этого метилированием или восстановительным аминированием с образованием цитолопрама.-2 005491 Соединение формулы (IV) может быть также преобразовано в циталопрам взаимодействием с метиламином с образованием соединения формулы с последующим метилированием или восстановительным аминированием с образованием циталопрама. Аминогруппы в соединениях формулы (V) и (VI) могут быть метилированы метилирующими агентами, такими как MeI и Me2SO4, где Me представляет собой метил. Метилирование проводят обычными способами, проводимыми для таких взаимодействий. Метильные группы также могут быть введены в соединения формулы (V) и (VI) восстановительным аминированием. В соответствии с этим способом, соединение формулы (V) или (VI) взаимодействует с соединениями, такими как формальдегид, параформальдегид или триоксан в присутствии восстановительного агента, такого как NaBH4 или NaBH3CN. Восстановительное аминирование проводят, используя обычные способы, проводимые для таких взаимодействий. Исходные продукты формулы (II) могут быть получены, как описано в патенте США номер 4136193 или как описано в WO 98/019511. Соединения формулы (III) являются известными или могут быть получены из известных соединений, используя обычные способы. Циталопрам как антидепрессантный препарат представлен на рынке в виде рацемата. Однако в ближайшем будущем активный S-энантиомер циталопрама также будет представлен на рынке.S-циталопрам может быть получен разделением оптически активных изомеров хроматографией. В описании и формуле изобретения термин алкил относится к разветвленной или неразветвленной алкильной группе, имеющей от одного до шести включительно атомов углерода, такой как метил, этил,1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-2-пропил, 2,2-диметил-1-этил и 2-метил-1-пропил. Подобным образом, алкенил и алкинил, соответственно, обозначают такие группы, которые имеют от двух до шести углеродных атомов, включая одну двойную связь и тройную связь соответственно, такие как этенил, пропенил, бутенил, этинил, пропинил и бутинил. Термин арил относится к моно- или бициклической углеводородной ароматической группе, такой как фенил и нафтил, в особенности фенил. Термин аралкил относится к арил-алкилу, где арил или алкил такие, как определены выше. Необязательно, алкил-замещенный арил или аралкил обозначает группы арил или аралкил, которые могут быть необязательно замещены одной или несколькими алкильными группами. Галоген обозначает хлор, бром или йод. Соединение общей формулы I может использоваться в виде свободного основания, в частности, как циталопрамовое основание в кристаллической форме, или в виде его фармацевтически приемлемой соли добавления кислоты. В виде солей добавления кислот могут использоваться такие соли, которые образованы с органическими или неорганическими кислотами. Примерами таких органических солей являются соли с малеиновой, фумаровой, бензойной, аскорбиновой, янтарной, щавелевой, бисметиленсалициловой, метансульфоновой, этандисульфоновой, уксусной, пропионовой, винной, салициловой, лимонной,глюконовой, молочной, яблочной, миндальной, коричной, цитраконовой, аспарагиновой, стеариновой,пальмитиновой, итаконовой, гликолевой, п-аминобензойной, глутамовой, бензолсульфоновой и теофиллинуксусной кислотами, а также 8-галотеофиллинами, например, 8-бромтеофиллином. Примерами таких неорганических солей являются соли с хлористо-водородной, бромисто-водородной, серной, сульфаминовой, фосфорной и азотной кислотами. Аддитивные соли кислот могут быть получены способами, известными в данной области. Основание взаимодействует либо с рассчитанным количеством кислоты в смешивающемся с водой растворителе, таком как ацетон или этанол, с последующим выделением соли путем концентрирования и охлаждения, или с избытком кислоты в несмешивающемся с водой растворителе, таком как этиловый эфир, этилацетат или дихлорметан, с самопроизвольным осаждением соли. Фармацевтические композиции по изобретению могут вводиться любым удобным путем и в любой удобной форме, например, перорально в виде таблеток, капсул, порошков или сиропов, или парентерально в виде обычных стерильных растворов для инъекций. Фармацевтические композиции по изобретению могут быть получены обычными способами, известными в данной области. Например, таблетки могут быть получены путем смешивания активного ингредиента с обычными адъювантами и/или разбавителями и последующего прессования смеси в обычной таблетировочной машине. Примеры адъювантов или разбавителей включают в себя кукурузный крахмал,картофельный крахмал, тальк, стеарат магния, желатин, лактозу, камедь и тому подобное. Любые другие-3 005491 адъюванты или добавки, красящее вещество, ароматизаторы, консерванты и тому подобное могут использоваться при условии, что они являются совместимыми с активными ингредиентами. Растворы для инъекций могут быть получены растворением активного ингредиента и возможных добавок в части растворителя для инъекций, предпочтительно в стерильной воде, доведением раствора до желаемого объема, стерилизацией раствора и помещением его в подходящие ампулы или пузырьки. Могут быть добавлены любые подходящие добавки, обычно используемые в данной области, такие как изотонические агенты, консерванты, антиоксиданты и тому подобное. Изобретение далее иллюстрируется следующими примерами. Пример 1. Раствор 1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрила (4,8 г, 0,02 моль) в ТГФ (50 мл) добавляли по каплям в раствор LDA (бутиллитий 1,6 М (15 мл), диизопропиламин 2,6 г) при -30 С в атмосфере азота. После перемешивания при -30 С в течение 10 мин по каплям добавляли раствор алкилгалогенида/сульфоната (0,02 моль) в ТГФ (25 мл) и оставляли нагреваться до комнатной температуры и перемешивали еще 60 мин. Реакцию затем гасили льдом, экстрагировали толуолом (3 х 50 мл), промывали водой (50 мл) и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента смеси н-гептана/EtAc. Полученный анион взаимодействовал с соединением формулы (III). Пример 2. Получение 1-[3-(N,N-диметиламино)пропил]-1-(4-фторфенил)-1,3-дигидро-5 изобензофуранкарбонитрила (оксалат циталопрама). В раствор 1-(4-фторфенил)-1-[(3-п-толуолсульфонилокси)-пропил]-1,3-дигидро-5-изобензофуранкарбонитрила (0,20 г, 0,4 ммоль) в ДМФ (10 мл) добавляли триэтиламин (1,4 мл, 7,0 ммоль) и хлорид диметиламмония (0,41 г, 5,0 ммоль). Реакционную смесь перемешивали при 70 С в течение ночи,затем охлаждали до комнатной температуры, выливали на лед/Н 2 О и экстрагировали Et2O (3 х 30 мл). Органические экстракты промывали Н 2 О и насыщенным солевым раствором и упаривали. Остаток очищали путем хроматографии с силикагелем (гептан, EtOAc, триэтиламин 1:3:4%) и кристаллизовали из ацетона в виде оксалатной соли (0,12 г, 70%). ДСК (открытая камера), Тначала = 158,96, Тпика = 162,14. 1 Н ЯМР (DMSO-d6)1,42 (1 Н, м); 1,51 (1 Н, м); 2,22 (2 Н, т, J=8,0 Гц); 2,62 (6 Н, с); 2,95 (2 Н, т, J= 8,0 Гц); 5,15 (1 Н, д, J= 4,0 Гц); 5,23 (1 Н, д, J=14,0 Гц); 7,18 (2 Н, т, J=9,0 Гц); 7,59 (2 Н, дд, J=5,0 и 8,0 Гц); 7,74 (1 Н,д, J=7,5 Гц); 7,79 (1 Н, д, J=7,0 Гц); 7,80 (1 Н, уш. с), 13 С ЯМР (DMSO-d6)19,3; 37,0; 42,3; 56,7; 71,2; 90,3; 110,7; 115,2; 115,3; 118,8; 123,2; 125,8; 127,0; 132,1; 139,9; 140,0; 148,161,4; 164,3. Для C20H21N2O, С 2 Н 2 О 4: Вычислено: С 63,76; Н 5,59; N 6,76. Найдено: С 63,50; Н 5,78; N 6,63. Пример 3. Получение 1-[3-(N,N-диметиламино)пропил]-1-(4-фторфенил)-1,3-дигидро-5 изобензофуранкарбонитрила (оксалат циталопрама). Диметиламин (18 мл, 100 ммоль, 33% в этаноле) добавляли в раствор 1-(4-фторфенил)-1-[(3 метинсульфонилокси)пропил]-1,3-дигидро-5-изобензофуранкарбонила (1,0 г, 2,7 ммоль) в этаноле (10 мл) и ТГФ (20 мл). Полученную смесь перемешивали при комнатной температуре в течение 1 ч и при 60 С в течение 3 ч. После охлаждения реакционную смесь упаривали. К остатку добавляли 1 М NaOH (70 мл) и экстрагировали Et2O (100 мл). Органический экстракт промывали насыщенным солевым раствором, сушили и упаривали. Остаток фильтровали через силикагель (EtOAc, гептан, триэтиламин 75:25:1) и кристаллизовали из ацетона в виде оксалатной соли (0,72 г, 65%). ДСК (открытая камера), Тначала = 158,56, Тпика = 161,59. ЯМР-спектр был аналогичен спектру оксалата циталопрама, полученного в примере 2. Для C20H21N2O, С 2 Н 2 О 4: Вычислено: С 63,76; Н 5,59; N 6,76. Найдено: С 63,57; Н 5,51; N 6,77. Пример 4. Получение 1-(3-азидопропил)-1-(4-фторфенил)-1,3-дигидро-5-изобензофуранкарбонитрила. Азид натрия (5,5 г, 80,5 ммоль) добавляли в раствор 1-(4-фторфенил)-1-[(3 метансульфонилокси)пропил]-1,3-дигидро-5-изобензофуранкарбонила (4,0 г, 10,6 ммоль) в ДМФ (100 мл). Полученную смесь перемешивали при 40 С в течение 3 ч и затем кипятили с обратным холодильником в течение 2 ч. После охлаждения реакционную смесь выливали в Н 2 О и экстрагировали Et2O (4 х 200 мл). Органические экстракты промывали Н 2 О и насыщенным солевым раствором, сушили и упаривали с получением сырого продукта в виде коричневого масла (1,3 г, 45%). 1H ЯМР (DMSO-d6)1,40 (2 Н, м) ; 2,22 (2 Н, м) ; 3,30 (2 Н, т, J=6,6 Гц); 5,10 (1 Н, д, J=13,7 Гц); 5,21 (1 Н, д, J=13,7 Гц); 7,18 (2 Н, т, J=8,5 Гц); 7,59 (2 Н, дд, J=5,2 и 8,5 Гц); 7,78 (3 Н, с + д, J=8,1 Гц). Получение 1-(3-аминопропил)-1-(4-фторфенил)-1,3-дигидро-5-изобензофуранкарбонитрила Смесь 1-(3-азидопропил)-1-(4-фторфенил)-1,3-дигидро-5-изобензофуранкарбонитрила (1,3 г, 4,4 ммоль) и палладия на угле (0,6 г, 5%) в этаноле (50 мл) гидрировали в течение 2 ч. Смесь фильтровали через целит и упаривали с получением сырого продукта в виде коричневого масла (0,8 г, 66%). 1 Н ЯМР(оксалат циталопрама) Цианоборгидрид натрия (0,34 г, 5,4 ммоль) добавляли в смесь 1-(3-аминопропил)-1-(4-фторфенил)1,3-дигидро-5-изобензофуранкарбонитрила (0,80 г, 2,7 ммоль) и формальдегида (0,44 мл, 5,4 ммоль, 37% в Н 2 О) в метаноле (10 мл). Полученную смесь перемешивали при комнатной температуре в течение 3 ч,затем добавляли еще цианоборгидрид натрия (0,17 г, 2,7 ммоль) и формальдегида (0,22 мл, 2,7 ммоль). После перемешивания при комнатной температуре в течение 1 ч смесь гасили Н 2 О и экстрагировалиEt2O. Органические экстракты сушили и упаривали. Хроматография остатка на силикагеле (EtOAc, гептан, триэтиламин 75:25:1) дала сырой продукт,который выделяли в виде оксалатной соли из ацетона (0,31 г, 0,8 ммоль, 30%). ЯМР-спектр был аналогичен спектру оксалата циталопрама, полученному в примере 2. Для C20H21N2O, С 2 Н 2 О 4, Н 2 О: Вычислено: С 63,06; Н 5,67; N 6,69. Найдено: С 63,28; Н 5,64; N 6,67. Пример 5. Получение оксалатной соли 1-(4-фторфенил)-1-[3-(N-метиламино)пропил]-1,3-дигидро 5-изобензофуранкарбонитрила. Соединение получали из метиламина (60 мл, 120 ммоль, 2 М раствора в ТГФ), используя способ,описанный в примере 3. Выход: 760 мг, 36%. 1 Н ЯМР (DMSO-d6)1,40 (1 Н, м); 1,41 (1 Н, м); 2,25 (2 Н, т); 2,47 (3 Н, с); 2,83 (2 Н, т, J= 8,0 Гц); 5,15 (1 Н, д, J=13,2 Гц); 5,21 (1 Н, д, J=13,2 Гц); 7,18 (2 Н, т, J=9,0 Гц); 7,59 (2 Н, дд, J= 5,6 и 7,5 Гц); 7,73 (1 Н, д, J=8,1 Гц); 7,81 (3 Н, д + с, J=8,l Гц). Получение 1-[3-(N,N-диметиламино)пропил]-1-(4-фторфенил)-1,3-дигидро-5 изобензофуранкарбонитрила (оксалат циталопрама) Раствор 1-[3-(N-метиламмоний)пропил]-1-(4-фторфенил)-1,3-дигидро-5-изобензофуранкарбонила(0,70 г, 2,24 ммоль) и формальдегида (0,5 мл, 6,7 ммоль, 37% водный раствор) в 98% муравьиной кислоты (5 мл) кипятили с обратным холодильником в течение 4 ч. После охлаждения добавляли 4 М НСl (2 мл) и полученную смесь упаривали. К остатку добавляли 1 М NaOH (50 мл) и экстрагировали в Et2O (3 х 100 мл). Органический экстракт промывали насыщенным солевым раствором, сушили и упаривали. Оксалатную соль выделяли из ацетона (0,22 г, 30%). ДСК (открытая камера), Тначала = 157,73, Тпика = 160,80. ЯМР-спектр был аналогичен спектру оксалата циталопрама, полученному в примере 2. ДляC20H21N20O, C2H2O4, Н 2 О: Вычислено: С 63,06; Н 5,67; N 6,69. Найдено: С 63,24; Н 5,65; N 6,62. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения циталопрама, включающий взаимодействие соединения формулы (II) с соединением, имеющим формулу где R представляет собой галоген или -O-SO2-X, где X выбран из группы, включающей метил, этил, 1 пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-2-пропил, 2,2-диметил-1-этил, 2-метил-1-пропил, этенил,пропенил, бутенил, этинил, пропинил, бутинил, фенил, нафтил, бензил и фенилэтил,и R1 представляет собой диметиламино, галоген или -O-SO2-X, где X такой, как определен выше,при условии, что R не является галогеном, когда R1 представляет собой диметиламино; и, если R1 представляет собой диметиламино, с последующим выделением основания циталопрама или его фармацевтически приемлемой соли добавления кислот,и, если R1 представляет собой галоген или -O-SO2-X, где X такой, как определен выше, с последующим преобразованием полученного соединения формулы где R2 представляет собой галоген или группу формулы -О-SO2-X, где X такой, как определен выше, в циталопрам, с последующим выделением основания циталопрама или его фармацевтически приемлемой соли добавления кислот. 2. Способ получения циталопрама по п.1, включающий взаимодействие соединения формулы (II) с сульфониловым эфиром, имеющим формулу где X такой, как определен в п.1, с последующим выделением основания циталопрама или его фармацевтически приемлемой соли добавления кислот. 3. Способ получения циталопрама по п.1, включающий взаимодействие соединения формулы (II) с соединением, имеющим формулу где R и R2 такие, как определены в п.1, с последующим взаимодействием полученного соединения формулы (IV)a) с диметиламином или его солью с металлом,b) с метиламином и последующим восстановительным аминированием илиc) с азидом и последующим восстановлением с образованием соответствующего аминосоединения и далее метилированием или восстановительным аминированием,с образованием циталопрама. 4. Способ по любому из пп.1-3, где взаимодействие соединения формулы (II) с соединением формулы (III) проводят в присутствии основания, выбранного из LDA (диизопропиламин лития), LiHMDS (гексаметилдисилазан лития), NaH, NaHMDS (гексаметилдисиласан натрия) и металалкоксидов, таких какNaOMe, KOMe, LiOMe, NаОтретВu, KОтретВu и LiOтретВu. 5. Соединение общей формулы (IV) где R2 представляет собой галоген или группу формулы -O-SO2-X, где X такой, как определен в п.1.
МПК / Метки
МПК: C07D 307/87
Метки: способ, циталопрама, получения
Код ссылки
<a href="https://eas.patents.su/7-5491-sposob-polucheniya-citaloprama.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения циталопрама</a>
Предыдущий патент: Новый способ синтеза соединений (2s, 3аs, 7аs)-1-[(s)-аланил]-октагидро -1h-индол-2-карбоновой кислоты и применение в синтезе периндоприла
Следующий патент: Способ отделения гемицеллюлозы от биомассы, содержащей гемицеллюлозу, а также биомасса и гемицеллюлоза, полученные этим способом
Случайный патент: Чувствительный элемент датчика











