Способ получения циталопрама
Номер патента: 5315
Опубликовано: 30.12.2004
Авторы: Рок Майкл Хэролд, Ахмадиан Халех, Петерсен Ханс
Формула / Реферат
1. Способ получения циталопрама, включающий взаимодействие соединения формулы (I)
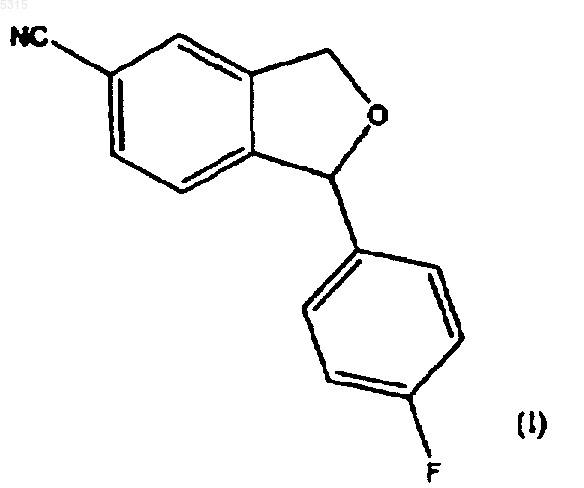
с соединением формулы
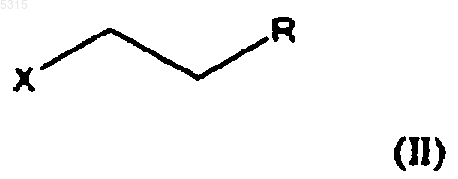
в которой X представляет подходящую уходящую группу и R представляет -CH2-O-Pg, -CH2-NPg1Pg2, -CH2-NMePg2, -CO-N(CH3)2, -CH(OR1)(OR2), -C(OR4)(OR5)(OR6), -COOR3, -CH2-CO-NH2, -CH=CHR7 или -CO-NHR8, где Pg представляет защитную группу для спиртовой группы, Pg1 и Pg2 представляют защитные группы для аминогруппы, R1 и R2 независимо выбирают из C1-6алкила, C1-6алкенила, C1-6алкинила и, необязательно, C1-6алкилзамещенного фенила, C1-6алкилзамещенного нафтила, фенил-C1-6алкила или нафтил-C1-6алкила или R1 и R2 вместе образуют цепь из 2-4 углеродных атомов, каждый из R3, R4, R5, R6 и R7 независимо выбирают из C1-6алкила, C1-6алкенила, C1-6алкинила и, необязательно, C1-6алкилзамещенного фенила, C1-6алкилзамещенного нафтила, фенил-C1-6алкила или нафтил-C1-6алкила, и R8 представляет водород или метил,
для образования соединения формулы
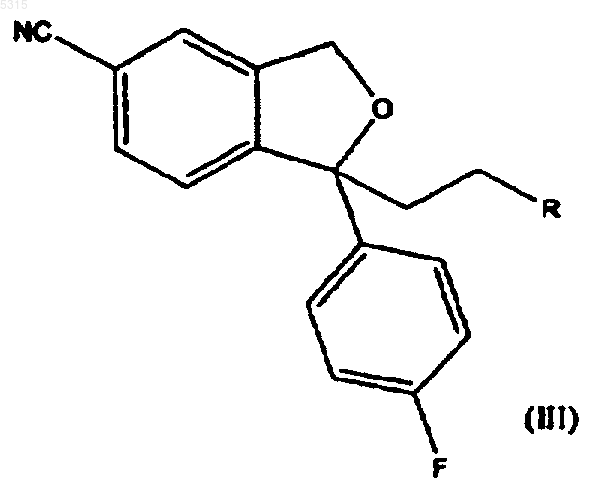
в которой R имеет определенные выше значения, последующее превращение группы R в диметиламинометильную группу и выделение циталопрама в виде основания или его фармацевтически приемлемой соли.
2. Способ по п.1, в котором соединение формулы (I) подвергают взаимодействию с соединением формулы (II), где R представляет -CH2-O-Pg, с последующим удалением защитной группы для образования соответствующего спирта формулы
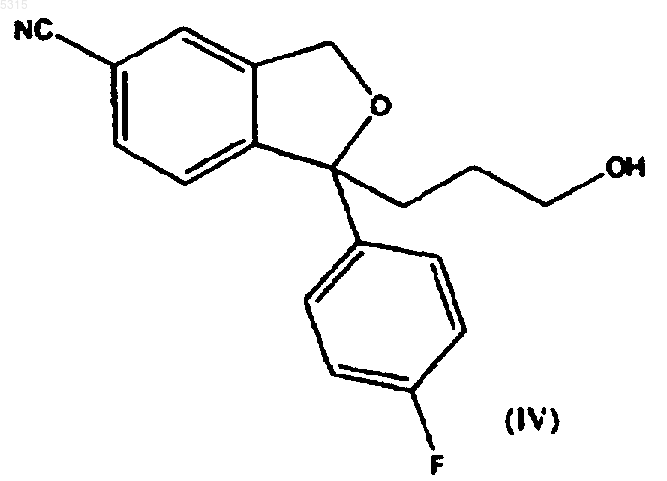
и с последующим превращением спиртовой группы в возможную уходящую группу и реакцией полученного соединения
a) с диметиламином или его металлической солью для получения циталопрама;
b) с метиламином с последующим восстановительным аминированием для получения циталопрама или
c) с азидом с последующим восстановлением для образования соответствующего аминосоединения и последующим метилированием или восстановительным аминированием для получения циталопрама.
3. Способ по п.1, в котором соединение формулы (I) подвергают взаимодействию с соединением формулы (II), где R представляет -CO-N(CH3)2, с последующим восстановлением полученного соединения формулы
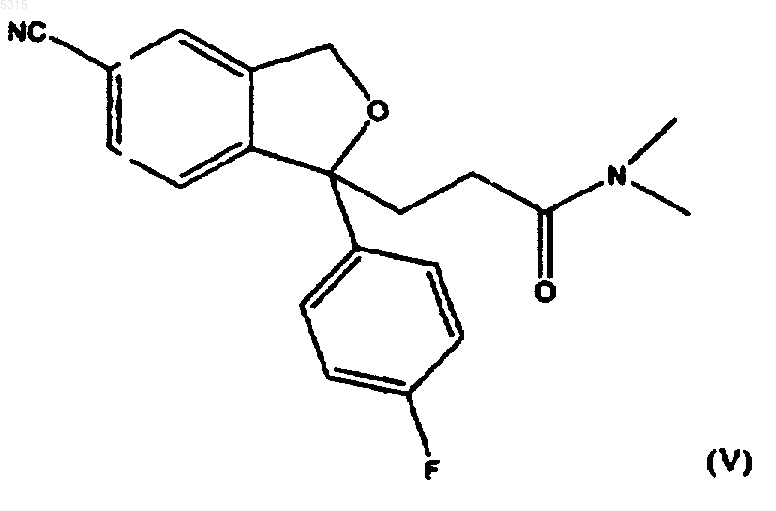
для образования циталопрама.
4. Способ по п.1, где соединение формулы (I) подвергают взаимодействию с соединением формулы (II), в котором R представляет -CH2-N(Pg1)(Pg2) с последующим удалением защитных групп для образования соединения формулы
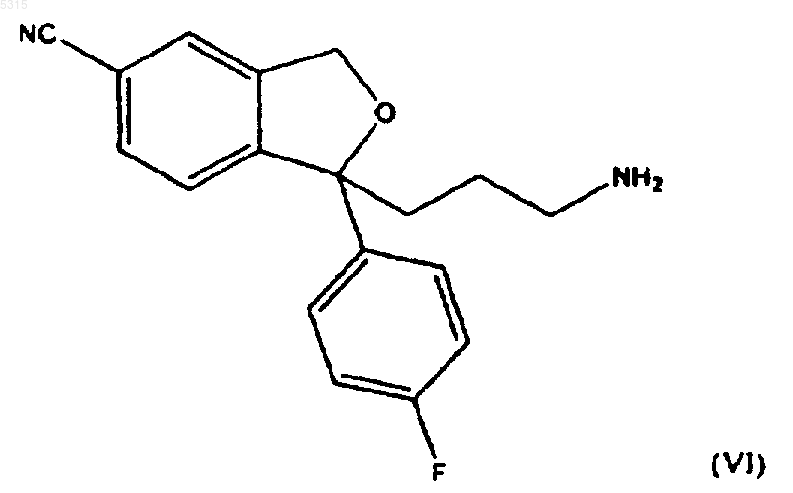
с последующим восстановительным аминированием или метилированием свободной аминогруппы для образования циталопрама.
5. Способ по п.1, где соединение формулы (I) подвергают взаимодействию с соединением формулы (II), где R представляет -CH(OR1)(OR2) или -C(OR4)(OR5)(OR6), для образования соединения формулы (VIIa) или (VIIb)

в которой R1, R2, R4, R5 и R6 имеют определенные выше значения, с последующим снятием защиты соединения формулы (VIIa) или (VIIb) и последующим восстановительным аминированием полученного альдегида для образования циталопрама.
6. Способ по п.1, где соединение формулы (I) подвергают взаимодействию с соединением формулы (II), в котором R представляет -COOR3, для образования соединения формулы
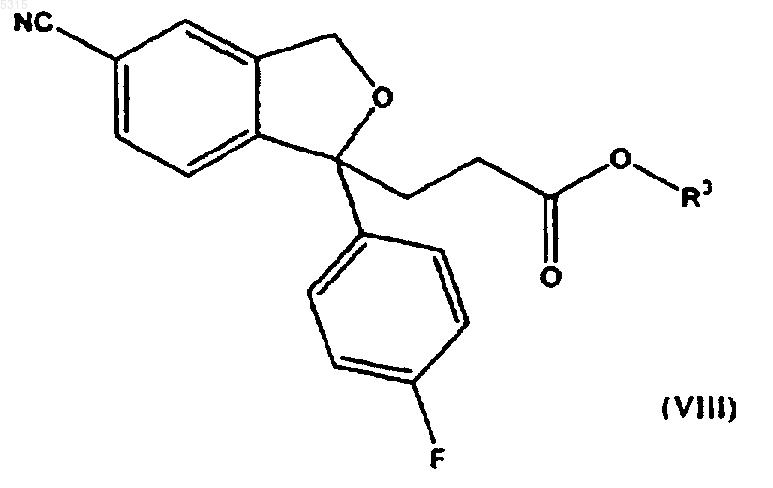
которое превращают в амид формулы (V) с последующим восстановлением для образования циталопрама, или соединение формулы (VIII) восстанавливают для образования соответствующего спирта формулы (IV) с последующим превращением спиртовой группы в возможную уходящую группу и последующими реакциями
a) с диметиламином или его металлической солью для получения циталопрама;
b) с метиламином с последующим восстановительным аминированием для получения циталопрама или
c) с азидом с последующим восстановлением для образования соответствующего аминосоединения и последующим метилированием или восстановительным аминированием для получения циталопрама.
7. Способ по п.1, в котором соединение формулы (I) подвергают взаимодействию с соединением формулы (II), где R представляет -CH2-CONH2, для образования соединения формулы
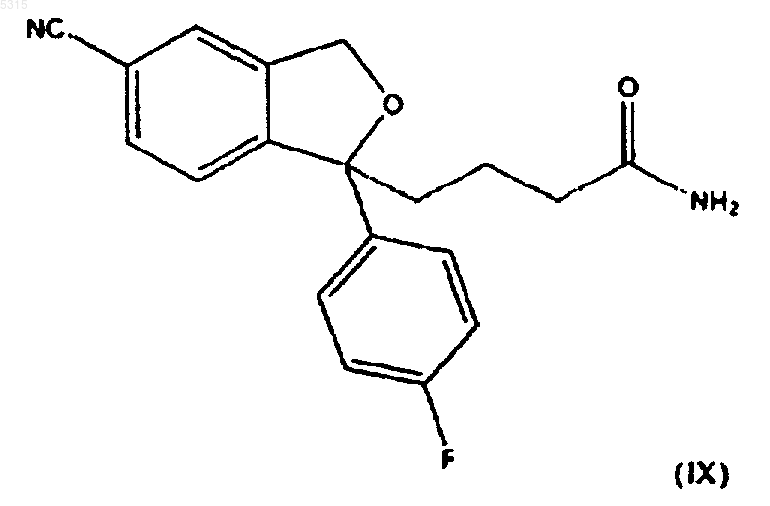
которое обрабатывают гипогалогенидом для образования соединения формулы

с последующим метилированием свободной аминогруппы или восстановительным аминированием для образования циталопрама.
8. Способ по п.1, в котором соединение формулы (I) подвергают взаимодействию с соединением формулы (II), где R представляет -CH=CHR7, для образования соединения формулы
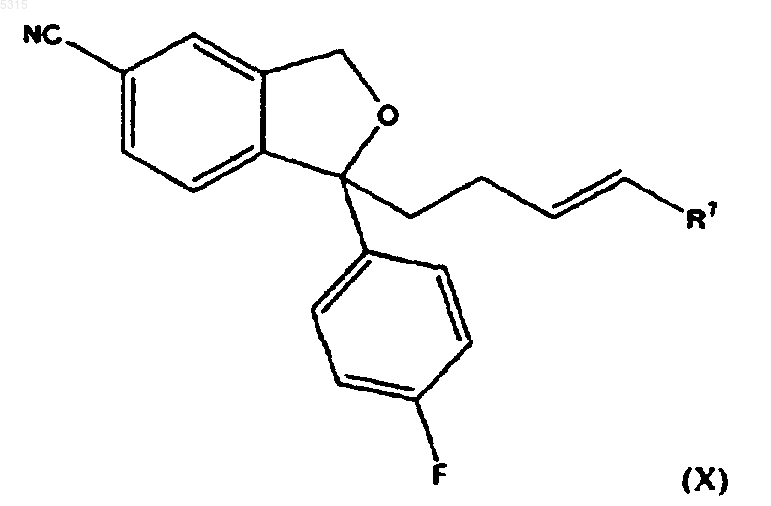
где R7 имеет определенное выше значение, которое окисляют для образования соединения формулы
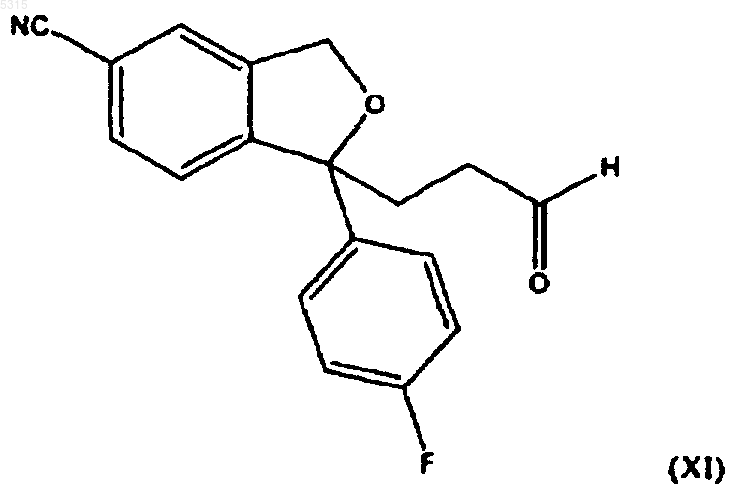
с последующим восстановительным аминированием для образования циталопрама.
9. Способ по п.1, в котором соединение формулы (I) подвергают взаимодействию с соединением формулы (II), где R представляет -CH2-Me(Pg1), с последующим удалением защитной группы для образования соединения формулы
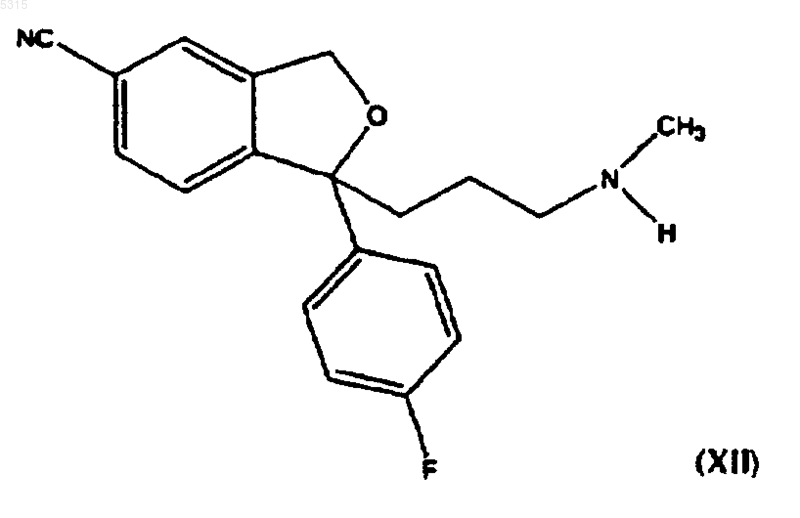
и последующим метилированием аминогруппы или восстановительным аминированием для образования циталопрама.
10. Способ по п.1, в котором соединение формулы (I) подвергают взаимодействию с соединением формулы (II), где R представляет -CO-NHR8, где R8 представляет водород или метил, с последующим восстановлением полученного соединения формулы
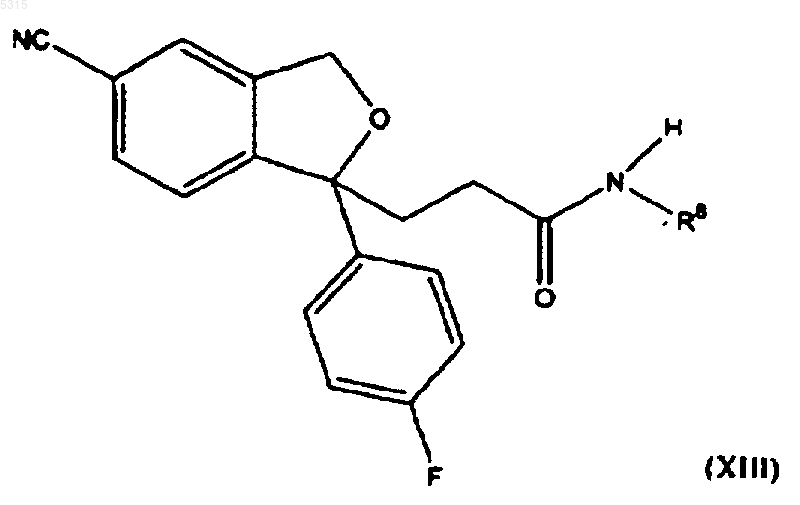
в которой R8 имеет определенные выше значения для образования соединения формулы
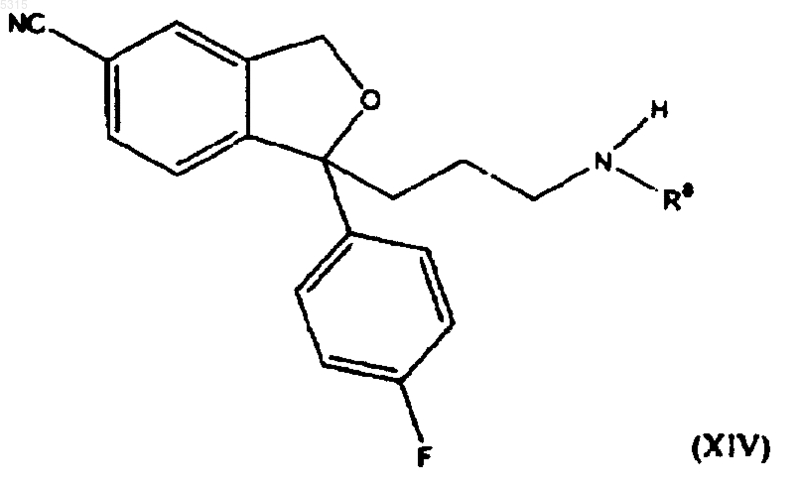
где R8 имеет определенные выше значения с последующим метилированием или восстановительным аминированием для образования циталопрама.
11. Способ по п.1, в котором реакцию соединения формулы (I) с соединением формулы (II) проводят в присутствии основания, выбранного из LDA (литийдиизопропиламин), LiHMDS (гексаметилдисилазан лития), NaH, NaHMDS (гексаметилдисилазан натрия) и алкоксидов металлов, таких как NaOMe, KOMe, LiOMe, NaOтретBu, KOтретBu и LiOтретBu.
12. Промежуточное соединение общей формулы
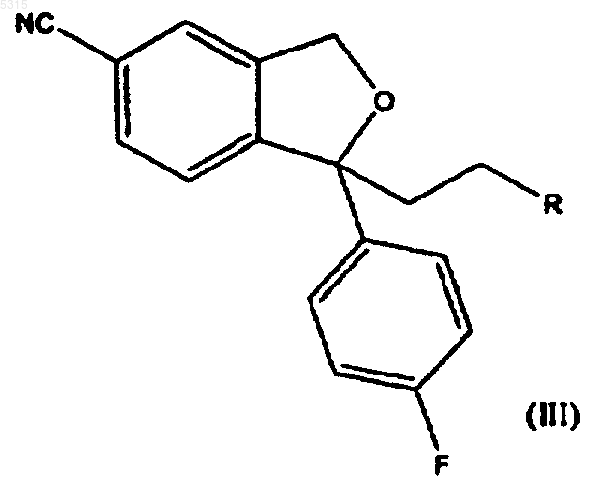
где R представляет -CH2-O-Pg, -CH2-NPg1Pg2, -CH2-NMePg1, -CO-N(CH3)2, -CH(OR1)(OR2), -C(OR4)(OR5)(OR6), -COOR3, -CH2-CO-NH2, -CH=CHR7 или -CO-NHR8, где Pg представляет защитную группу фыя спиртовой группы, Pg1 и Pg2 представляют защитные группы для аминогруппы, R1 и R2 независимо выбирают из C1-6алкила, C1-6алкенила, C1-6алкинила и, необязательно, C1-6алкилзамещенного фенила, C1-6алкилзамещенного нафтила, фенил-C1-6алкила или нафтил-C1-6алкила или R1 и R2 вместе образуют цепь из 2-4 углеродных атомов, каждый из R3, R4, R5, R6 и R7 независимо выбирают из C1-6алкила, C1-6алкенила, C1-6алкинила и, необязательно, C1-6алкилзамещенного фенила, C1-6алкилзамещенного нафтила, фенил-C1-6алкила или нафтил-C1-6алкила, и R8 представляет водород или метил, и его кислотно-аддитивные соли.
13. Промежуточное соединение формулы
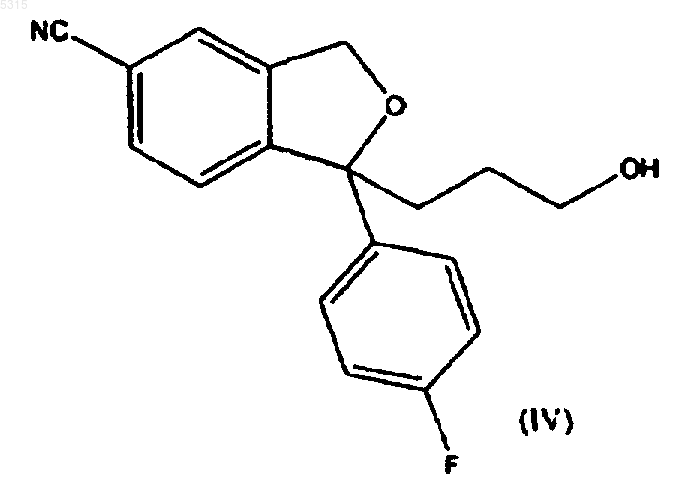
и его кислотно-аддитивные соли.
14. Промежуточное соединение формулы
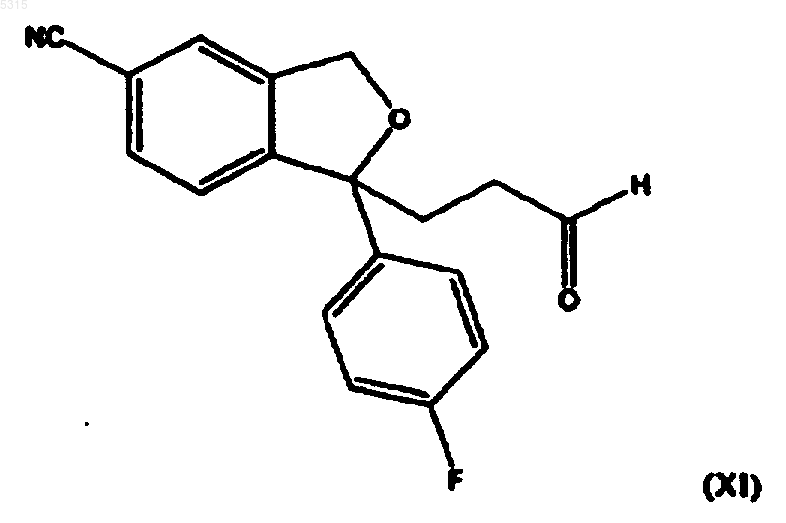
и его кислотно-аддитивные соли.
Текст
Настоящее изобретение относится к способу получения хорошо известного антидепрессивного лекарства - циталопрама, 1-[3-(диметиламино)пропил]-1-(4-фторфенил)-1,3-дигидро-5-изобензофуранкарбонитрила. Циталопрам является хорошо известным антидепрессивным лекарственным средством,которое имеется в продаже уже в течение ряда лет и имеет следующую структуру: чается образование побочных продуктов при полимеризации алкилирующего агента, благодаря чему уменьшается количество используемого алкилирующего реагента. Кроме того, способ согласно изобретению обеспечивает высокий выход. Настоящее изобретение относится к способу получения циталопрама, включающему реакцию соединения формулы (I) Он является селективным ингибитором повторного поглощения серотонина центрального действия (5-гидрокситриптамина; 5-НТ),имея, соответственно, антидепрессивную активность. Об антидепрессивной активности соединения сообщалось в нескольких публикациях,например в J. Hyttel Progr. Neuro Psychopharmacol.Biol. Psychiat. 1982, 6, 277-295 и A.Gravem Acta Psychiatr. Scand. 1987, 75, 478-486. В ЕР-А-474580 было указано, что соединение дополнительно проявляет эффект при лечении деменции и цереброваскулярных расстройств. Циталопрам был впервые раскрыт в DE 2.657.013, соответствующем US 4.136.193. Эта патентная публикация описывает получение циталопрама одним способом и намечает дополнительный способ, который может быть применен для получения циталопрама. Согласно описанному способу, соответствующий 1-(4-фторфенил)-1,3-дигидро-5-изобензофуранкарбонитрил подвергают взаимодействию с 3-(N,N-диметиламино)пропилхлоридом в присутствии метилсульфинилметида в качестве конденсирующего агента. Исходное вещество получают реакцией соответствующего 5-бромпроизводного с цианидом меди. Международная патентная заявка WO 98/019511 раскрывает способ получения циталопрама, где 4-(циано, алкилоксикарбонил или алкиламинокарбонил)-2-гидроксиметилфенил(4-фторфенил)метанольное соединение подвергают циклизации. Полученный 5-(алкилоксикарбонил или алкиламинокарбонил)-1-(4-фторфенил)-1,3-дигидроизобензофуран превращают в соответствующее 5-цианопроизводное, и затем 5-цианопроизводное алкилируют (3 диметиламино)пропилгалогенидом для получения циталопрама. В настоящее время неожиданно обнаружено, что циталопрам может быть получен новым предпочтительным способом, где 5-циано-1-(4 фторфенил)-1,3-дигидроизобензофуран алкилируют соединением, которое может быть превращено в диметиламинопропильную группу. Способ алкилирования согласно изобретению особенно выгоден, поскольку в нем исклю с соединением формулы в которой Х представляет подходящую уходящую группу, и R представляет -СН 2-О-Рg, -CH2NPg1Pg2,-CH2-NMePg1,-СО-N(СН 3)2,-CH(OR1)(OR2), -С(OR4)(OR5)(OR6), -COOR3,-CH2-CO-NH2, -CH=CHR7 или -CO-NHR8, где Рg представляет защитную группу для спиртовой группы, Pg1 и Рg2 представляют защитные группы для аминогруппы, R1 и R2 независимо выбирают из алкильной, алкенильной, алкинильной и, необязательно, алкилзамещенной арильной или аралкильной групп, или R1 и R2 вместе образуют цепь из 2-4 углеродных атомов, R3, R4,R5, R6 и R7 независимо выбирают из алкила, алкенила, алкинила и, необязательно, алкилзамещенного арила или аралкила, и R8 представляет водород или метил; для образования соединения формулыR в диметиламинометильную группу и выделением циталопрама в виде основания или его фармацевтически приемлемой соли. Согласно первому аспекту осуществления изобретения соединение формулы (I) реагирует с соединением формулы (II), где R представляет-СН 2-O-Рg, где Рg является защитной группой для спиртовой группы, с последующим удалением защитной группы для образования соответствующего спирта формулы Далее спиртовую группу превращают в возможную уходящую группу, такую как галоген или -O-SO2-R0, где R0 представляет алкил 3 или необязательно замещенный алкилом арил или аралкил, и полученное в результате соединение затемa) подвергают взаимодействию с диметиламином или его металлической солью для получения циталопрама;b) подвергают взаимодействию с метиламином для получения соединения формулы(XII), указанной ниже, с последующим восстановительным аминированием для получения циталопрама; илиc) подвергают взаимодействию с азидом с последующим восстановлением для образования соответствующего аминосоединения формулы (VI), указанной ниже, с последующим метилированием или восстановительным аминированием для получения циталопрама. Согласно второму аспекту осуществления изобретения соединение формулы (I) взаимодействует с соединением формулы (II), где R представляет -СО-N(СН 3)2, с последующим восстановлением полученного соединения формулы для образования циталопрама. Согласно третьему аспекту осуществления изобретения соединение формулы (I) взаимодействует с соединением формулы (II), где R представляет -CH2-N(Pg1)(Pg2), где Pg1 или Рg2 являются защитными группами для аминогруппы, затем удаляют защитные группы для образования соединения формулы с последующим метилированием свободной аминогруппы или восстановительным аминированием для образования циталопрама. Согласно четвертому аспекту осуществления циталопрам может быть получен взаимодействием соединения формулы (I) с соединением формулы (II), где R представляет-CH(OR1)(OR2) или -C(OR4)(OR5)(OR6), где R1,R2, R4, R5 и R6 имеют значения, как определено выше, для образования соединения формулы в которой R1, R2, R4, R5 и R6 имеют значения,как определено выше, с последующим снятием защиты соединения формулы (VIIa) или (VIIb) и 4 последующим восстановительным аминированием полученного альдегида диметиламином для образования циталопрама. Согласно пятому аспекту осуществления циталопрам может быть получен взаимодействием соединения формулы (I) с соединением формулы (II), в котором R представляет -COOR3 и R3 имеют значения, как определено выше, для образования соединения формулы где R3 имеет значение, как определено выше,которое затем превращают в амид формулы (V) или спирт формулы (IV), который превращают в циталопрам, как описано выше. Согласно шестому аспекту осуществления изобретение относится к способу получения циталопрама, где соединение формулы (I) взаимодействует с соединением формулы (II), где R представляет -CH2-CONH2, для образования соединения формулы которое обрабатывают гипогалидом для образования соединения формулы с последующим метилированием свободной аминогруппы или восстановительным аминированием для образования циталопрама. Согласно седьмому аспекту осуществления изобретение относится к способу получения циталопрама, в котором соединение формулы(II), где R представляет -CH=CHR7, для образования соединения формулы где R7 имеет значение, как определено выше,которое окисляют для образования соединения формулы 5 с последующим восстановительным аминированием диметиламином для образования циталопрама. Согласно восьмому аспекту осуществления изобретение относится к способу получения циталопрама, где соединение формулы (I) взаимодействует с соединением формулы (II),где R представляет -СН 2-Ме(Pg1), с последующим удалением защитной группы для образования соединения формулы и последующим метилированием аминогруппы или восстановительным аминированием для образования циталопрама. Согласно последнему аспекту осуществления изобретение относится к способу получения циталопрама, в котором соединение формулы(II), где R представляет -CO-NHR8, где R8 представляет водород или метил, с последующим восстановлением полученного соединения формулы в которой R8 имеет значение, как определено выше, для образования соединения формулы в которой R8 имеет значение, как определено выше, с последующим метилированием или восстановительным аминированием для образования циталопрама. В другом аспекте настоящее изобретение раскрывает новые промежуточные соединения общей формулы (III), (IV), (VI), (XI) и (XII). В еще одном аспекте настоящее изобретение относится к антидепрессивной фармацевтической композиции, включающей циталопрам,полученный способом согласно изобретению. Стадию алкилирования, где соединение формулы (I) реагирует с соединением формулы(II), проводят путем обработки соединения формулы (I) основанием, таким как, например,LDA (литийдиизопропиламин), LiHMDS (гексаметилдисилазан лития), NaH, NaHMDS (гексаметилдисилазан натрия) и алкоксиды металлов, такие как NaOMe, KOMe, LiOMe,NaOtertBu, KOtertBu LiOtertBu, в апротонном органическом растворителе, таком как ТГФN-МП (N-метилпирролидон), простые эфиры,такие как диэтиловый эфир или диоксолан, толуол, бензол, или алканы, и их смеси. Образовавшийся анион подвергают взаимодействию с соединением формулы (II), благодаря чему группа формулы -CH2-CH2-R вводится в положение 1 изобензофуранильной кольцевой системы. Уходящие группы Х могут представлять галогенид или сульфонат формулы -O-SO2-R0,где R0 представляет алкил или необязательно замещенный алкилом арил или аралкил. Предпочтительно, R0 представляет метил или пметилфенил. Заместители R1 и R2 предпочтительно представляют алкил или аралкил, или R1 и R2 вместе образуют цепь из 2-4 углеродных атомов. Предпочтительно, чтобы R1 и R2 были одинаковыми. Заместители R3, R4, R5 и R6 предпочтительно представляют алкил или аралкил. Предпочтительно, R4, R5 и R6 являются одинаковыми.R7 предпочтительно представляет алкил или аралкил. Защитной группой спирта Рg может быть триалкилсилильная группа, бензильная группа или тетрагидропиранильная группа (ТГП). Соединение формулы (IV) получают путем удаления защитной группы спирта, используя обычные способы удаления рассматриваемой защитной группы. Таким образом, защитная группа, представляющая собой триалкилсилил, может быть удалена путем обработки основанием, органической или минеральной кислотой или фторидом, таким как KF или триалкиламинофторид. Если Рg представляет собой бензил, защитная группа может быть удалена восстановлением с использованием в качестве катализатора Pd/C или Pt/C. Если Рg представляет собой тетрагидропиранильную группу (ТГП), то защитная группа может быть удалена путем обработки органической или минеральной кислотой или смолой,несущей Н+ группы, такой как Dowex H+ или(IV) превращают в возможную уходящую группу, такую как галоген или сульфонат формулы-O-SO2-R0, где R0 имеет значение, как определено выше, путем реакции с такими реагентами как тионилхлорид, мезилхлорид, тозилхлорид и т.д. Полученное соединение подвергают взаимодействию с диметиламином или его металлической солью, например M+,-N(CH3)2, где М+ представляет Li+ или Na+. Реакцию обычно проводят в апротонном органическом растворителе,таком как ТГФ (тетрагидрофуран), ДМФ (диметилформамид), N-МП (N-метилпирролидон),простые эфиры, такие как диэтиловый эфир или 7 диоксалан, толуол, бензол, или алканы, и их смеси. Соединение формулы (IV), несущее подходящую уходящую группу, может быть также превращено в циталопрам реакцией с хлоридом диметиламмония в присутствии основания. Альтернативно, соединение формулы (IV), несущее подходящую уходящую группу, такую как сульфонат формулы -O-SO2-R0, где R0 имеет значение, как определено выше, может взаимодействовать с азидом, таким как азид натрия, с последующим восстановлением с использованием в качестве катализатора Pd/C для образования соединения формулы (VI) и последующего метилирования или восстановительного аминирования для получения циталопрама. Соединение формулы (IV), несущее подходящую уходящую группу, может также быть превращено в циталопрам реакцией с метиламином для образования соединения формулы(XII), указанной выше, с последующим метилированием или восстановительным аминированием для образования циталопрама. Восстановление амида формулы (V) обычно проводят в толуоле, используя Red-Al в качестве восстановителя. Подходящие группы Pg1 и Рg2 представляют аралкильные группы или группы -O-SO2R0, в которых R0 принимает значение, как определено выше, обычно бензил или тозил, или Pg1 и Рg2 вместе с атомом N, к которому они присоединены, образуют необязательно замещенную фталимидную группу. Защитные группы Pg1 и Рg2 могут быть удалены обычными методами удаления таких защитных групп. Так, фталимидные группы могут быть превращены в аминогруппу обработкой гидразином или метиламином и этанолом. Если защитная группа представляет собой аралкильную группу, такую как бензил, она может быть удалена восстановлением, обычно в присутствии Pd/C или Pt/C в качестве катализатора. Сульфонатные группы формулы -O-SO2-R0 могут быть удалены обработкой Red-Al. Свободная аминогруппа в соединении формулы (VI) может быть метилирована метилирующими агентами, такими как МеI и Ме 2SO4, где Me представляет метил. Метилирование проводят, используя обычные методики проведения таких реакций. Альтернативно, циталопрам образуется при восстановительном аминировании. Согласно этой методике, соединение формулы (VI) реагирует с такими соединениями как формальдегид, параформальдегид или триоксан, в присутствии восстановителя, такого как NaBH4 илиNaBH3CN. Восстановительное аминирование проводят, используя обычные методики проведения таких реакций. Соединение формулы (VIIa) или (VIIb) может быть предпочтительно превращено в соответствующий альдегид обработкой органиче 005315 8 ской или минеральной кислотой или смолой,несущей группы Н+, такой как Dowex H+ илиAmberlyst. Полученный альдегид может быть превращен в циталопрам восстановительным аминированием, т.е. реакцией с диметиламином в присутствии восстановителя, такого как NaBH4 или NaBH3CN. Диметиламин может быть введен в реакцию в форме соли диметиламмонийхлорида. Сложноэфирное производное формулы(VIII) может быть превращено в циталопрам через соответствующий спирт формулы (IV) восстановлением эфира с использованием RedAl в качестве восстановителя, или через соответствующий амид формулы (V) путем реакции эфира с NH(Me)2 или его металлические соли. Предпочтительно, агентом, используемым для превращения соединения формулы (IX) в соединение формулы (VI) является NaOH/Br2. Окисление соединения формулы (X) может быть осуществлено путем обработки соединения озоном в полярном растворителе, таком как спирт, вода, уксусная кислота или ее сложные эфиры. Альтернативно, соединение формулы(X) может быть обработано окислителями, такими как NaIO4, OsO4/NaIO4 или KMnO4. Предпочтительно, восстановительное аминирование соединения формулы (XI) может быть проведено реакцией с диметиламином в присутствии восстановителя, такого как NaBH4 или NaBH3CN. Диметиламин может быть введен в реакцию в виде соли диметиламмонийхлорида. Аминогруппа в соединении формулы (XII) и (XIV) может быть метилирована метилирующими агентами, такими как МеI и Ме 2SO4, гдеMe представляет метил. Метилирование осуществляют с использованием обычных методик проведения таких реакций. Альтернативно, аминогруппа в соединениях формулы (XII) и (XIV) может быть метилирована путем восстановительного аминирования. Согласно этой методике, соединение формулы (XII) или (XIV) взаимодействует с такими соединениями как формальдегид,параформальдегид или триоксан, в присутствии восстановителя, такого как NaBH4 илиNаВН 3 СN. Восстановительное аминирование проводят с использованием обычных методик проведения таких реакций. Условия реакции, растворители и т.п.,применяемые для описанных выше реакций,представляют собой обычные для таких реакций условия и могут быть легко определены квалифицированным специалистом. Исходное соединение формулы (I) может быть получено так, как описано в патенте США 4.136.193 или в WO 98/019511. Соединения формулы (II) являются доступными коммерческими соединениями или могут быть получены из доступных исходных 9 материалов при использовании обычных методик. Циталопрам имеется в продаже как антидепрессивное лекарственное средство в виде рацемической смеси. Однако, в ближайшем будущем собираются выпустить в продажу также активный S-энантиомер циталопрама.S-циталопрам может быть получен разделением оптически активных изомеров с помощью хроматографии. В описании и формуле изобретения термин"алкил" относится к разветвленной или неразветвленной алкильной группе, имеющей от одного до шести атомов углерода включительно,такой как метил, этил, 1-пропил, 2-пропил, 1 бутил, 2-бутил, 2-метил-2-пропил, 2,2-диметил 1-этил и 2-метил-1-пропил. Подобным же образом, алкенил и алкинил означают, соответственно, такие группы,имеющие от двух до шести атомов углерода,включающие одну двойную связь или тройную связь, соответственно, такие как этенил, пропенил, бутенил, этинил пропинил и бутинил. Термин "арил" относится к моно- или бициклическим карбоциклическим ароматическим группам, таким как фенил и нафтил, в особенности как фенил. Термин "аралкил" относится к арилалкилу,в котором алкил и арил являются такими, как определено выше."Необязательно замещенные алкилом арил и аралкил" относятся к арильным и аралкильным группам, которые могут быть необязательно замещены одной или несколькими алкильными группами."Галоген" означает хлор, бром или йод. Циталопрам может быть использован в виде свободного основания, в частности, свободного основания в кристаллической форме, или в виде его фармацевтически приемлемой кислотно-аддитивной соли. В качестве кислотноаддитивных солей могут быть использованы соли, образованные органическими или неорганическими кислотами. Примерами таких солей с органическими кислотами являются соли с малеиновой, фумаровой, бензойной, аскорбиновой, янтарной, щавелевой, бисметиленсалициловой, метансульфоновой, этандисульфоновой,уксусной, пропионовой, винной, салициловой,лимонной, глюконовой, молочной, яблочной,миндальной, коричной, цитраконовой, аспарагиновой, стеариновой, пальмитиновой, итаконовой, гликолевой, п-аминобензойной, глютаминовой, бензолсульфоновой и теофиллинуксусной кислотами, а также с 8-галогентеофиллинами, например с 8-бромтеофиллином. Примерами таких солей с неорганическими кислотами являются соли с хлористоводородной,бромистоводородной, серной, сульфаминовой,фосфорной и азотной кислотами. Кислотно-аддитивные соли соединений могут быть получены известными способами. 10 Основание подвергают взаимодействию или с рассчитанным количеством кислоты в смешивающемся с водой растворителе, таком как ацетон или этанол, с последующим выделением соли путем концентрирования и охлаждения,или с избытком кислоты в не смешивающемся с водой растворителе, таком как простой этиловый эфир, этилацетат или дихлорметан, со спонтанным выделением соли. Фармацевтические композиции по изобретению могут вводиться любым подходящим способом и в любой подходящей форме, например, перорально в форме таблеток, капсул, порошков или сиропов, или парентерально в форме обычных стерильных растворов для инъекций. Фармацевтические формы по изобретению могут быть приготовлены обычными способами, известными в практике. Например, таблетки могут быть приготовлены смешением активных ингредиентов с обычными носителями и/или разбавителями и последующим прессованием смеси в обычной таблетирующей машине. Примеры наполнителей или разбавителей включают кукурузный крахмал, картофельный крахмал,тальк, стеарат магния, желатин, лактозу, смолы и т.п. Любые другие наполнители или вспомогательные вещества, красители, ароматизаторы,консерванты могут использоваться при условии их совместимости с активными ингредиентами. Растворы для инъекций могут быть приготовлены растворением активного ингредиента и возможных добавок в части растворителя для инъекций, предпочтительно, стерильной воды,доведения раствора до нужного объема, стерилизацией раствора и заполнением им подходящих ампул или сосудов. Могут быть добавлены любые подходящие добавки, обычно используемые в практике, такие как тонические агенты, консерванты, антиоксиданты и т.п. Изобретение дополнительно поясняется следующими примерами. Пример 1. Раствор 1-(4-фторфенил)-1,3 дигидроизобензофуран-5-карбонитрила (4,8 г,0,02 моль) в ТГФ (50 мл) добавляли по каплям к раствору LDA (бутиллитий 1,6 М (15 мл), диизопропиламин 2,6 г) при -30 С в атмосфере азота. После перемешивания при -30 С в течение 10 мин по каплям добавляли раствор алкилгалогенида (0,02 моль) в ТГФ (25 мл), давали смеси нагреться до комнатной температуры и перемешивали в течение еще 60 мин. Затем реакцию гасили льдом, реакционную смесь экстрагировали толуолом (3 х 50 мл), промывали водой (50 мл) и концентрировали под пониженным давлением. Остаток очищали хроматографией на силикагеле с использованием смеси нгептан/EtOAc в качестве элюента. Полученный анион затем вводили в реакцию с соединением формулы (II). 11 Пример 2. Синтез 1-[(3-бензилгидрокси) пропил]-1-(4-фторфенил)-1,3-дигидро-5-изобензофуранкарбонитрила. Раствор 1-(4-фторфенил)-1,3-дигидро-5 изобензофуранкарбонитрила (2,2 г, 9,2 ммоль) в ТГФ (40 мл) добавляли к раствору LDA (12 ммоль) в ТГФ (70 мл) при -78 С в атмосфере азота. После перемешивания при -78 С в течение 30 мин добавляли раствор бензил-3 бромпропилового эфира (2 мл, 12 ммоль) в ТГФ(10 мл), полученной смеси давали нагреться до комнатной температуры и перемешивали ее в течение 2 ч. Затем смесь выливали на лед/Н 2O(100 мл) и экстрагировали Et2O (3 х 100 мл). Органические экстракты промывали Н 2 О (100 мл) и рассолом (150 мл), сушили и выпаривали. Хроматография остатка на силикагеле (гептан,EtOAc 5:1) давала продукт в виде масла (2,0 г,60%). 1(3 Н, J=7,27 Гц); 7,32 (2 Н, м); 7,58 (2 Н, дд, J=5,6 и 8,8 Гц); 7,75 (3 Н, м). Синтез 1-(4-фторфенил)-1-[3-(тетрагидропиранилокси)пропил]-1,3-дигидро-5-изобензофуранкарбонитрила. Использовали ту же методику для получения указанного в заголовке соединения в виде масла (2,0 г, 60%). 1(i) Раствор 1-(4-фторфенил)-1,3-дигидро-5 изобензофуранкарбонитрила (13,4 г, 60 ммоль) в ТГФ (450 мл) добавляли к раствору LDA (76 ммоль) в ТГФ (30 мл) при -78 С в атмосфере азота. После перемешивания при -78 С в течение 30 мин добавляли раствор (3-бромпропокси)-трет-бутилдиметилсилана (16,8 мл,72 ммоль) в ТГФ (30 мл), полученной смеси давали нагреться до комнатной температуры и перемешивали ее в течение 2 ч. Затем смесь выливали на лд/Н 2 О (400 мл) и экстрагировалиEt2O (3 х 500 мл). Органические экстракты промывали Н 2 О (500 мл) и рассолом (500 мл), сушили и выпаривали. Остаток растворяли в метаноле (400 мл) и добавляли 1 М НСl (200 мл). Полученный раствор перемешивали при комнатной температуре в течение 1 ч и выпаривали. С помощью хроматографии остаток очищали на силикагеле (гептан, EtOAc 5:1), получая продукт в виде масла (14,4 г, 81%).(ii) К раствору 1-[(3-бензилокси)пропил]-1(4-фторфенил)-1,3-дигидро-5-изобензофуранкарбонитрила (1,2 г, 3,1 ммоль) и 1,4-циклогексадиена (5,5 мл, 58,1 ммоль) в этаноле (50 мл) добавляли Pd/C (4 г, 5%). Реакционную смесь кипятили с обратным холодильником в атмосфере азота в течение 2 суток, затем охлаждали до комнатной температуры и фильтровали через целит. Фильтрат выпаривали и остаток очищали хроматографией на силикагеле, получая указанный в заголовке продукт в виде масла(iii) К раствору 1-(4-фторфенил)-1-[3(тетрагидропиранилокси)пропил]-1,3-дигидро 5-изобензофуранкарбонитрила (1,5 г, 4,1 ммоль) в метаноле добавляли каталитическое количество моногидрата п-толуолсульфоновой кислоты(60 мг) и полученную смесь перемешивали при комнатной температуре в течение 1 ч и затем выпаривали. С помощью хроматографии на силикагеле (гептан, EtOAc 5:1) получали указанный в заголовке продукт (1,0 г, 91%). Спектр 1 Н ЯМР (CDCl3) был идентичен спектру продукта,полученного из 1-[(3-бензилокси)пропил]-1-(4 фторфенил)-1,3-дигидро-5-изобензофуранкарбонитрила. Пример 4. Синтез 1-(4-фторфенил)-1-[(3-птолуолсульфонилокси)пропил]-1,3-дигидро-5 изобензофуранкарбонитрила. К раствору 1-(4-фторфенил)-1-(3-гидроксипропил)-1,3-дигидро-5-изобензофуранкарбонитрила (2,5 г, 8,4 ммоль) в толуоле (50 мл) при температуре 0-5 С добавляли триэтиламин (2,5 мл, 18 ммоль) и раствор п-толуолсульфонилхлорида (2,6 г, 13,6 ммоль) в толуоле (10 мл). Полученную смесь перемешивали при комнатной температуре в течение 3 суток, затем промывали H2O и насыщенным водным растворомNaHCO3. Выпаривание органического экстракта с последующей хроматографией остатка на силикагеле (гептан, EtOAc 4:1) давало указанный в заголовке продукт в виде масла (1,6 г, 42%). 1(30 мл, 41,8 ммоль) и раствор метансульфонилхлорида (11,6 г, 150 ммоль) в ТГФ (20 мл). Полученную смесь перемешивали при комнатной температуре в течение ночи, затем добавляли толуол (200 мл) и промывали H2O и насыщенным водным раствором NaHCO3. Выпаривание органической фазы с последующей хроматографией остатка на силикагеле (гептан, EtOAc 3:1) давало указанный в заголовке продукт в виде масла (12,0 г, 64%). 1H ЯМР (CDCl3)1,70 (2 Н, м); 2,25 (2 Н,м); 2,90 (3H, с); 4,22 (2 Н, т, J=7,0 Гц); 5,14 (1 Н,д, J=13,2 Гц); 5,14 (1 Н, д, J=13,2 Гц); 7,01 (2 Н, т,J=9,0 Гц); 7,41 (2 Н, д; J=9,0 Гц); 7,45 (1 Н, д,J=8,0 Гц); 7,52 (1 Н, с); 7,61 (1 Н, шир. д, J=8,0 Гц). Пример 6. Синтез 1-[3-(N,N-диметиламино)пропил]-1-(4-фторфенил)-1,3-дигидро-5 изобензофуранкарбонитрила (циталопрам, оксалат). К раствору 1-(4-фторфенил)-1-[(3-птолуолсульфонилокси)пропил]-1,3-дигидро-5 изобензофуранкарбонитрила (0,20 г, 0,4 ммоль) в ДМФ (10 мл) добавляли триэтиламин (1,4 мл,7,0 ммоль) и диметиламмонийхлорид (0,41 г, 5,0 ммоль). Реакционную смесь перемешивали при 70 С в течение ночи, затем охлаждали до комнатной температуры, выливали на лд/Н 2O и экстрагировали Et2O (3 х 30 мл). Органические экстракты промывали Н 2O и рассолом и выпаривали. Остаток очищали хроматографией на силикагеле (гептан, EtOAc, триэтиламин 1:3:4%) и кристаллизовали из ацетона в виде оксалатной соли (0,12 г, 70%). ДСК (открытая камера): Тначала = 158,96,Тпика = 162,14. 1 14 Диметиламин (18 мл, 100 ммоль, 33% в этаноле) добавляли к раствору 1-(4-фторфенил)1-[(3-метансульфонилокси)пропил]-1,3-дигидро-5-изобензофуранкарбонитрила (1,0 г, 2,7 ммоль) в этаноле (10 мл) и ТГФ (20 мл). Полученную смесь перемешивали при комнатной температуре в течение 1 ч и при 60 С в течение 3 ч. После охлаждения реакционную смесь выпаривали. К остатку добавляли 1 М NaOH (70 мл) и экстрагировали Et2O (100 мл). Органический экстракт промывали рассолом, сушили и выпаривали. Остаток фильтровали через силикагель (гептан, EtOAc, триэтиламин 75:25:1) и кристаллизовали из ацетона в виде оксалатной соли (0,72 г, 65%). ДСК (открытая камера): Тначала = 158,56,Тпика = 161,59. ЯМР-спектры были идентичны спектрам для циталопрама оксалата, полученного в примере 6. Анализ (C20H21N2O, С 2 Н 2O4). Рассчитано: С 63,76; Н 5,59; N 6,76. Найдено: С 63,57; Н 5,51;N 6,77. Пример 8. Синтез 1-(4-фторфенил)-1-[3(фталимидопропил)]-1,3-дигидро-5-изобензофуранкарбонитрила. Раствор 1-(4-фторфенил)-1,3-дигидро-5 изобензофуранкарбонитрила (4,4 г, 20 ммоль) в ТГФ (40 мл) добавляли к раствору LDA (24 ммоль) в ТГФ (70 мл) при -78 С в атмосфере азота. После перемешивания при -78 С в течение 30 мин добавляли раствор 2-(3-бромпропил) фталимида (6,4 г, 24 ммоль) в ТГФ (20 мл), полученной смеси давали нагреться до комнатной температуры и перемешивали ее в течение 5 ч. Затем смесь выливали на лд/Н 2 О (200 мл) и экстрагировали Et2O (3 х 250 мл). Органические экстракты промывали H2O (100 мл) и рассолом(100 мл), сушили и выпаривали. С помощью хроматографии на силикагеле (гептан, EtOAc 5:1) остатка получали продукт в виде желтого порошка (3,0 г, 36%). Образец перекристаллизовывали из этанола. 1 15 Азид натрия (5,5 г, 80,5 ммоль) добавляли к раствору 1-(4-фторфенил)-1-[(3-метансульфонилокси)пропил]-1,3-дигидро-5-изобензофуранкарбонитрила (4,0 г, 10,6 ммоль) в ДМФ (100 мл). Полученную смесь перемешивали при 40 С в течение 3 ч и затем кипятили с обратным холодильником в течение 2 ч. После охлаждения реакционную смесь выливали в Н 2 О и экстрагировали Et2O (4 х 200 мл). Органические экстракты промывали Н 2 О и рассолом, сушили и выпаривали, получая сырой продукт в виде коричневого масла (1,3 г, 45%). 1(2 Н, м); 3,30 (2 Н, т, J=6,6 Гц); 5,10 (1H, д, J=13,7 Гц); 5,21 (1H, д, J=13,7 Гц); 7,18 (2 Н, т, J= 8,5 Гц); 7,59 (2 Н, дд, J=5,2 и 8,5 Гц); 7,78 (3H, с + д,J=8,1 Гц). Синтез 1-(3-аминопропил)-1-(4-фторфенил)1,3-дигидро-5-изобензофуранкарбонитрила. Смесь 1-(3-азидопропил)-1-(4-фторфенил)1,3-дигидро-5-изобензофуранкарбонитрила (1,3 г, 4,4 ммоль) и палладия на угле (0,6 г, 5%) в этаноле (50 мл) гидрировали в течение 2 ч. Смесь фильтровали через целит и выпаривали,получая сырой продукт в виде коричневого масла (0,8 г, 66%). 1(10 мл). Полученную смесь перемешивали при комнатной температуре в течение 3 ч, затем добавляли еще цианоборогидрид натрия (0,17 г,2,7 ммоль) и формальдегид (0,22 мл, 2,7 ммоль). После перемешивания при комнатной температуре в течение 1 ч смесь гасили Н 2O и экстрагировали Et2O. Органические экстракты сушили и выпаривали. С помощью хроматографии остатка на силикагеле (EtOAc, гептан, триэтиламин 75:25:1) получали сырой продукт, который выделяли из ацетона в виде оксалатной соли (0,31 г, 0/8 ммоль, 30%). ЯМР-спектры были идентичны спектрам для циталопрама оксалата, полученного в примере 6. Анализ (C20H21N2O, С 2 Н 2O4, 1/4 Н 2 О). Рассчитано С 63,06; Н 5,67; N 6,69. Найдено: С 63,28; Н 5,64; N 6,67. Пример 10. Синтез 1-(4-фторфенил)-1-[3(N-метиламино)пропил]-1,3-дигидро-5-изобензофуранкарбонитрила, оксалатная соль. 16 Соединение получали из метиламина (60 мл, 120 ммоль, 2 М раствор в ТГФ), используя способ, описанный в примере 7. Выход: 760 мг,36%. 1+ с, J=8,1 Гц). Синтез 1-[3-(N,N-диметиламино)пропил]1-(4-фторфенил)-1,3-дигидро-5-изобензофуранкарбонитрила (циталопрам, оксалат). Раствор 1-[3-(N-метиламмоний)пропил]-1(4-фторфенил)-1,3-дигидро-5-изобензофуранкарбонитрила (0,70 г, 2,24 ммоль) и формальдегида (0,5 мл, 6,7 ммоль, 37% водный раствор) в 98% муравьиной кислоте (5 мл) кипятили с обратным холодильником в течение 4 ч. После охлаждения добавляли 4 М НСl (2 мл) и полученную смесь упаривали. К остатку добавляли 1 М NaOH (50 мл) и экстрагировали Et2O (3 х 100 мл). Органический экстракт промывали рассолом, сушили и выпаривали. Оксалатную соль выделяли из ацетона (0,22 г, 30%). ДСК (открытая камера): Тначала = 157,73,Тпика = 160,80. ЯМР-спектры были идентичны спектрам для циталопрама оксалата, полученного в примере 6. Анализ (C20H21N2O, C2H2O4, 1/4H2O). Рассчитано: С 63,06; Н 5,67; N 6,69. Найдено: С 63,24; Н 5,65; N 6,62. Пример 11. Синтез 1-[3-([1,3]-диоксалан-2 ил)этил]-1-(4-фторфенил)-1,3-дигидро-5-изобензофуранкарбонитрила. Раствор 1-(4-фторфенил)-1,3-дигидро-5 изобензофуранкарбонитрила (4,46 г, 18,7 ммоль) в ТГФ (40 мл) добавляли к раствору-78 С в течение 30 мин добавляли раствор 2-2(2 бромэтил)-[1,3]-диоксолана (2,8 мл, 24 ммоль) в ТГФ (20 мл), полученной смеси давали нагреться до комнатной температуры и перемешивали ее в течение 2 ч. Затем смесь выливали на лд/Н 2O (100 мл) и экстрагировали Et2O (3 х 300 мл). Органические экстракты промывали Н 2 О(100 мл) и рассолом (100 мл), сушили и выпаривали. С помощью хроматографии остатка на силикагеле (гептан, EtOAc 5:1) получали продукт в виде масла (5,5 г, 86%). 1 17 Синтез 1-(4-фторфенил)-1-(3-формилэтил)1,3-дигидро-5-изобензофуранкарбонитрила. Раствор 1-[3-([1,3]-диоксолан-2-ил)этил]-1(4-фторфенил)-1,3-дигидро-5-изобензофуранкарбонитрила (5,30 г, 16 ммоль) в 30% уксусной кислоте (200 мл) кипятили с обратным холодильником в течение 2 ч. Реакционную смесь охлаждали и экстрагировали CH2Cl2 (3 х 400 мл). Органические экстракты сушили и выпаривали,получая сырой продукт (5,0 г, с содержанием около 8 ммоль продукта, по данным ЯМР и ВЭЖХ 50%), который использовали на следующей стадии без дополнительной очистки. 1H ЯМР (CDCl3)1,49 (1H, м); 1,61 (1H,м); 2,38 (1H, м); 2,51 (1H, м); 5,15 (2 Н, шир. с); 7,01 (2 Н, т, J=8,0 Гц); 7,41 (3H, дд + с, J=5,6 и 8,0 Гц); 7,51 (2 Н, д, J=8,0 Гц); 7,61 (2 Н, д, J=8,0 Гц). Синтез 1-[3-(N,N-диметиламино)пропил]1-(4-фторфенил)-1,3-дигидро-5-изобензофуранкарбонитрила (циталопрам, оксалат). Цианоборогидрид натрия (0,76 г, 14,4 ммоль) добавляли при 0-5 С к смеси сырого 1(3-формилэтил)-1-(4-фторфенил)-1,3-дигидро-5 изобензофуранкарбонитрила (5,0 г, с содержанием около 8 ммоль соединения по данным ЯМР и ВЭЖХ) и хлорида диметиламмония (1,17 г, 14,4 ммоль) в метаноле (50 мл). Полученную смесь перемешивали при комнатной температуре в течение ночи, затем добавляли толуол (100 мл) и EtOAc (100 мл) и промывали Н 2O (100 мл). Водную фазу экстрагировали Et2O (2 х 100 мл). Объединенные органические экстракты сушили и выпаривали. Хроматография остатка на силикагеле (гептан, EtOAc, триэтиламин 25:25:1) дала указанное в заголовке соединение,которое выделяли из ацетона в виде оксалатной соли (2,7 г, 82%). ДСК (открытая камера): Тначала = 159,55,Тпика = 163,54. ЯМР-спектры были идентичны спектрам для циталопрама оксалата, полученного в примере 6. Анализ (C20H21N2O, C2H2O4). Рассчитано: С 63,76; Н 5,59; N 6,76. Найдено: С 63,65; Н 5,69;N 6,80. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения циталопрама, включающий взаимодействие соединения формулы 18 в которой Х представляет подходящую уходящую группу и R представляет -СН 2-O-Рg, -CH2NPg1Pg2,-CH2-NMePg2,-СО-N(СН 3)2,-CH(OR1)(OR2), -С(OR4)(OR5)(OR6), -COOR3,-CH2-CO-NH2, -CH=CHR7 или -CO-NHR8, где Pg представляет защитную группу для спиртовой группы, Pg1 и Рg2 представляют защитные группы для аминогруппы, R1 и R2 независимо выбирают из C1-6 алкила, C1-6 алкенила, C1-6 алкинила и, необязательно, С 1-6 алкилзамещенного фенила, C1-6 алкилзамещенного нафтила, фенил-С 1-6 алкила или нафтил-С 1-6 алкила или R1 и R2 вместе образуют цепь из 2-4 углеродных атомов,каждый из R3, R4, R5, R6 и R7 независимо выбирают из C1-6 алкила, C1-6 алкенила, C1-6 алкинила и, необязательно, C1-6 алкилзамещенного фенила, C1-6 алкилзамещенного нафтила, фенил-С 1-6 алкила или нафтил-С 1-6 алкила, и R8 представляет водород или метил,для образования соединения формулы в которой R имеет определенные выше значения, последующее превращение группы R в диметиламинометильную группу и выделение циталопрама в виде основания или его фармацевтически приемлемой соли. 2. Способ по п.1, в котором соединение формулы (I) подвергают взаимодействию с соединением формулы (II), где R представляет-CH2-O-Pg, с последующим удалением защитной группы для образования соответствующего спирта формулы и с последующим превращением спиртовой группы в возможную уходящую группу и реакцией полученного соединенияa) с диметиламином или его металлической солью для получения циталопрама;b) с метиламином с последующим восстановительным аминированием для получения циталопрама илиc) с азидом с последующим восстановлением для образования соответствующего аминосоединения и последующим метилированием или восстановительным аминированием для получения циталопрама. 3. Способ по п.1, в котором соединение формулы (I) подвергают взаимодействию с соединением формулы (II), где R представляет-СО-N(СН 3)2, с последующим восстановлением полученного соединения формулы(I) подвергают взаимодействию с соединением формулы (II), в котором R представляет -CH2N(Pg1)(Pg2) с последующим удалением защитных групп для образования соединения формулыc) с азидом с последующим восстановлением для образования соответствующего аминосоединения и последующим метилированием или восстановительным аминированием для получения циталопрама. 7. Способ по п.1, в котором соединение формулы (I) подвергают взаимодействию с соединением формулы (II), где R представляет-CH2-CONH2, для образования соединения формулы которое обрабатывают гипогалогенидом для образования соединения формулы с последующим восстановительным аминированием или метилированием свободной аминогруппы для образования циталопрама. 5. Способ по п.1, где соединение формулы-CH(OR1)(OR2) или -С(OR4)(OR5)(OR6), для образования соединения формулы (VIIa) или в которой R1, R2, R4, R5 и R6 имеют определенные выше значения, с последующим снятием защиты соединения формулы (VIIa) или (VIIb) и последующим восстановительным аминированием полученного альдегида для образования циталопрама. 6. Способ по п.1, где соединение формулы-COOR3, для образования соединения формулы которое превращают в амид формулы (V) с последующим восстановлением для образования циталопрама, или соединение формулы (VIII) восстанавливают для образования соответствующего спирта формулы (IV) с последующим превращением спиртовой группы в возможную уходящую группу и последующими реакциямиa) с диметиламином или его металлической солью для получения циталопрама;b) с метиламином с последующим восстановительным аминированием для получения циталопрама или с последующим метилированием свободной аминогруппы или восстановительным аминированием для образования циталопрама. 8. Способ по п.1, в котором соединение формулы (I) подвергают взаимодействию с соединением формулы (II), где R представляет-CH=CHR7, для образования соединения формулы где R7 имеет определенное выше значение, которое окисляют для образования соединения формулы с последующим восстановительным аминированием для образования циталопрама. 9. Способ по п.1, в котором соединение формулы (I) подвергают взаимодействию с соединением формулы (II), где R представляет-CH2-Me(Pg1), с последующим удалением защитной группы для образования соединения формулы и последующим метилированием аминогруппы или восстановительным аминированием для образования циталопрама. 10. Способ по п.1, в котором соединение формулы (I) подвергают взаимодействию с соединением формулы (II), где R представляет-CO-NHR8, где R8 представляет водород или метил, с последующим восстановлением полученного соединения формулы в которой R8 имеет определенные выше значения для образования соединения формулы где R8 имеет определенные выше значения с последующим метилированием или восстановительным аминированием для образования циталопрама. 11. Способ по п.1, в котором реакцию соединения формулы (I) с соединением формулы(гексаметилдисилазан натрия) и алкоксидов металлов, таких как NaOMe, КОМе, LiOMe, NaOтретBu, КОтретВu и LiOтретBu. 12. Промежуточное соединение общей формулы где R представляет -СН 2-О-Рg, -CH2NPg1Pg2,-CH2-NMePg1,-СО-N(СН 3)2,-CH(OR1)(OR2), -С(OR4)(OR5)(OR6), -COOR3,-CH2-CO-NH2, -CH=CHR7 или -CO-NHR8, где Pg представляет защитную группу для спиртовой группы, Pg1 и Pg2 представляют защитные группы для аминогруппы, R1 и R2 независимо выбирают из C1-6 алкила, C1-6 алкенила, C1-6 алкинила и, необязательно, C1-6 алкилзамещенного фенила, C1-6 алкилзамещенного нафтила, фенил-С 1-6 алкила или нафтил-С 1-6 алкила или R1 и R2 вместе образуют цепь из 2-4 углеродных атомов,каждый из R3, R4, R5, R6 и R7 независимо выбирают из C1-6 алкила, C1-6 алкенила, C1-6 алкинила и, необязательно, C1-6 алкилзамещенного фенила, C1-6 алкилзамещенного нафтила, фенил-С 1-6 алкила или нафтил-С 1-6 алкила, и R8 представляет водород или метил, и его кислотноаддитивные соли. 13. Промежуточное соединение формулы
МПК / Метки
МПК: C07D 307/87
Метки: циталопрама, способ, получения
Код ссылки
<a href="https://eas.patents.su/12-5315-sposob-polucheniya-citaloprama.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения циталопрама</a>
Предыдущий патент: Фармацевтическая композиция дронедарона для парентерального введения
Следующий патент: Арил-конденсированные азаполициклические соединения
Случайный патент: Кумулятивный заряд












