Способ получения циталопрама
Номер патента: 3132
Опубликовано: 27.02.2003
Авторы: Бегесе Клаус Петер, Бек Соммер Михаэль, Петерсен Ханс
Формула / Реферат
1. Способ получения циталопрама, включающий стадии
а) восстановления соединения формулы IV

в которой R1 представляет CN, C1-6 алкилоксикарбонил или C1-6 алкиламинокарбонил;
b) осуществления замыкания кольца полученного соединения формулы V
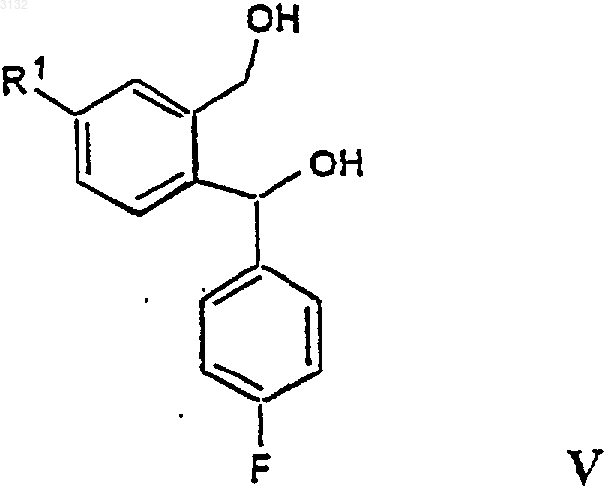
в которой R1 имеет значения, определенные выше, с получением соединения формулы VI
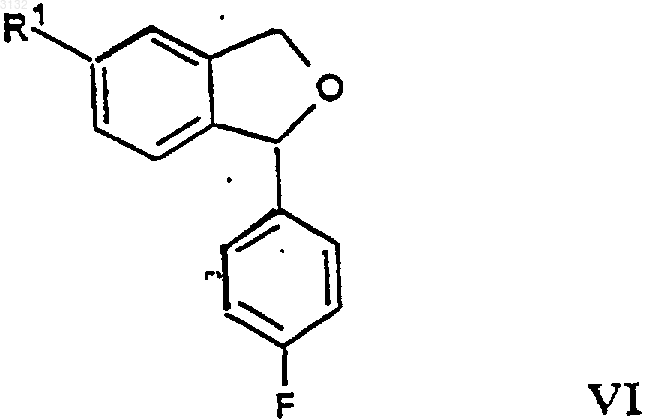
в которой R1 имеет значения, определенные выше;
c) затем, если R1 представляет циано, использования соединения формулы VI непосредственно на следующей стадии, и, если R1 представляет C1-6 алкилоксикарбонил или C1-6 алкиламинокарбонил, превращения соединения формулы VI в соответствующее соединение, в котором R1 является циано; и
d) алкилирования полученного 5-циано соединения формулы VI (R1 = CN) 3-диметиламинопропилгалогенидом в щелочных условиях с получением циталопрама
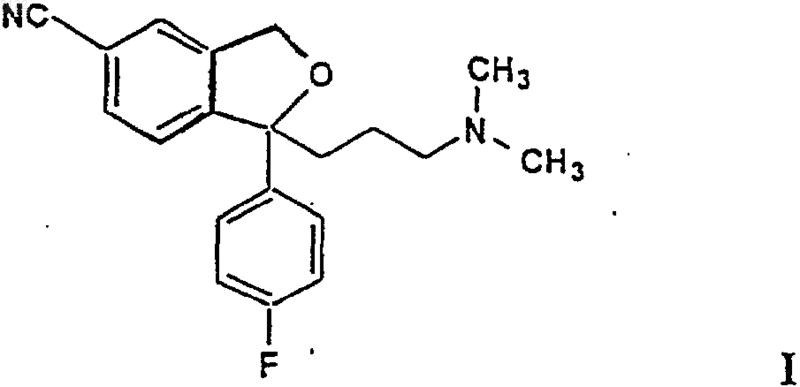
который выделяют в виде основания или его фармацевтически приемлемой соли.
2. Способ по п.1, в котором R1 представляет CN.
3. Способ по п.1, в котором R1 представляет C1-6 алкилоксикарбонил.
4. Способ по п.1, в котором R1 представляет C1-6 алкиламинокарбонил.
5. Способ по п.3 или 4, в котором C1-6 алкил представляет этил-, пропил- или бутил, предпочтительно этил, 2-пропил или трет-бутил, наиболее предпочтительно трет-бутил.
6. Способ по любому из пп.1-5, в котором восстановление соединения формулы IV осуществляют с использованием NaBH4 в спирте, таком как этанол или метанол, в щелочных условиях.
7. Способ по любому из пп.1-6, в котором замыкание кольца соединения формулы V осуществляют с помощью кислотной циклизации в неорганической кислоте, такой как серная или фосфорная кислота, или в органической кислоте, такой как метилсульфоновая, п-толуолсульфоновая или трифторуксусная кислота.
8. Способ по любому из пп.1-6, в котором циклизацию соединения формулы V осуществляют путем основной циклизации через лабильный сложный эфир, предпочтительно с одновременной сложной этерификацией и добавлением основания.
9. Способ по п.8, в котором лабильный сложный эфир представляет метансульфониловый, п-толуолсульфониловый, 10-камфорсульфониловый, трифторацетиловый или трифторметансульфониловый сложный эфир и основание представляет триэтиламин, диметиланилин или пиридин.
10. Способ по п.3, в котором превращение C1-6 алкилоксикарбонила в циано осуществляют через соответствующую амидную группу.
11. Способ по п.10, в котором реакцию C1-6 алкилоксикарбонила в амид осуществляют гидролизом кислотой или основанием, последующим превращением в хлорангидрид кислоты и амидированием по реакции с аммиаком или алкиламином, предпочтительно трет-бутиламином.
12. Способ по п.11, в котором гидролиз осуществляют с использованием подходящей кислоты, такой как HBr, HCl, HBr/уксусная кислота.
13. Способ по п.11, в котором гидролиз осуществляют с использованием подходящего основания, предпочтительно K2CO3, NaOH или KOH.
14. Способ по п.10, в котором реакцию C1-6 алкоксикарбонила в амид осуществляют взаимодействием сложного эфира с аммиаком или алкиламином под давлением и при нагревании.
15. Способ по любому из пп.4 и 10-14, в котором амид превращают в цианогруппу по реакции с дегидратирующим агентом, предпочтительно тионилхлоридом или пентахлоридом фосфора.
16. Способ по любому из пп.1-15, в котором используемый в качестве алкилирующего агента на стадии d) 3-диметиламинопропилгалогенид является хлоридом, бромидом или йодидом, предпочтительно хлоридом.
17. Способ по любому из пп.1-16, в котором алкилирование на стадии d) осуществляют в простом эфире, предпочтительно 1,2-диметоксиэтане, ТГФ, диглиме или диэтиловом эфире.
18. Способ по любому из пп.1-17, в котором алкилирование на стадии d) осуществляют в присутствии основания, предпочтительно литийдиизопропиламина.
19. Способ по любому из пп.1-18, в котором исходное вещество формулы IV получают из соответствующего фталидного соединения взаимодействием с реактивом Гриньяра, производным 4-галогенфторфенила, предпочтительно 4-фторфенилмагнийгалогенидом, наиболее предпочтительно магнийбромидом.
20. Способ по п.1, в котором R1 представляет циано, исходное вещество формулы IV получают из соответствующего фталидного соединения взаимодействием с 4-фторфенилмагнийгалогенидом, восстановление на стадии а) осуществляют с помощью NaBH4 в спирте, циклизацию на стадии b) осуществляют с неорганической кислотой и алкилирование на стадии d) осуществляют с использованием диметиламинопропилхлорида в простом эфире в присутствии литийдиизопропиламина.
21. Соединение формулы V
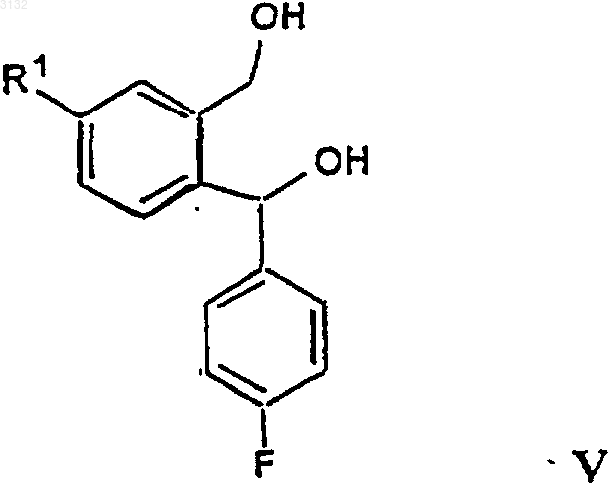
в которой R1 представляет CN, C1-6 алкилоксикарбонил или C1-6 алкиламинокарбонил.
22. Соединение формулы VI
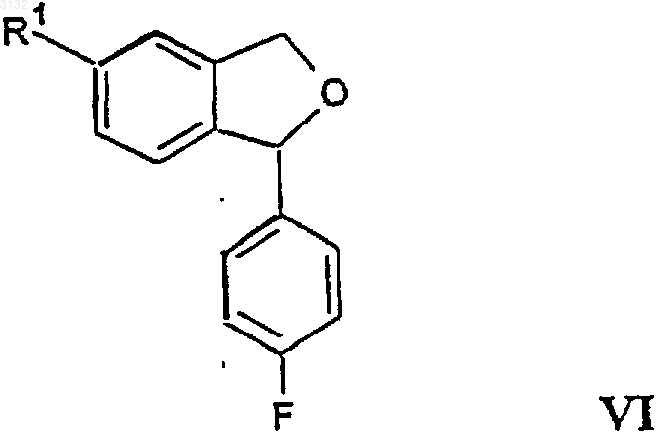
в которой R1 представляет C1-6 алкилоксикарбонил или C1-6 алкиламинокарбонил.
23. Способ получения циталопрама, включающий алкилирование соединения формулы VI
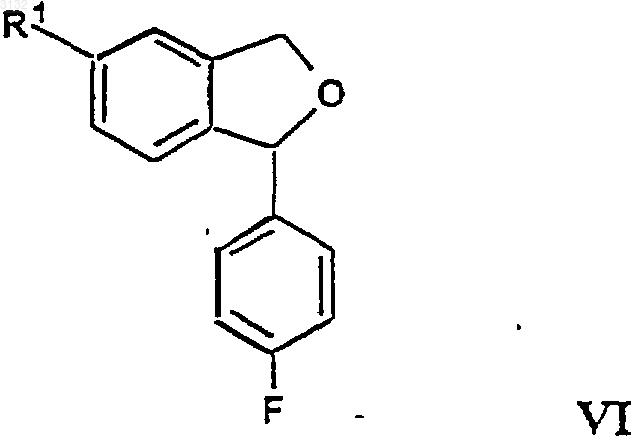
в котором R1 представляет CN, 3-диметиламинопропилгалогенидом в щелочных условиях, причем реакцию осуществляют в простом эфире, предпочтительно 1,2-диметоксиэтане, ТГФ, диглиме или диэтиловом эфире в присутствии литийдиизопропиламина.
Текст
1 Настоящее изобретение относится к способу получения хорошо известного антидепрессивного лекарственного средства циталопрама,1-[3-(диметиламино)пропил]-1-(4-фторфенил)1,3-дигидро-5-изобензофуранкарбонитрила. Предпосылки изобретения Циталопрам является хорошо известным антидепрессивным лекарственным средством,которое уже в течение нескольких лет имеется на рынке, и имеет следующую формулу: Он является селективным, действующим на центральную нервную систему ингибитором повторного захвата серотонина (5-гидрокситриптамина; 5-НТ), соответственно, обладающим антидепрессивной активностью. Об антидепрессивной активности этого соединения сообщалось в нескольких публикациях, например, J.Psychiatr. Scand., 1987, 75, 478-486. Данное соединение, кроме того как было раскрыто, оказывает действие при лечении деменции и энцефало-сосудистых расстройств, ЕР-А 474580. Циталопрам был впервые описан в патенте Германии DE 2657271, соответствующем патенту США US 4136193. В данной патентной публикации описывается один способ получения циталопрама и представлена общая схема другого способа, который можно использовать для получения циталопрама. В соответствии с описанным способом, соответствующий 1-(4-фторфенил)-1,3-дигидро-5 изобензофуранкарбонитрил подвергают взаимодействию с 3-(N,N-диметиламино)пропилхлоридом в присутствии метилсульфинилметида в качестве агента конденсации. Исходное вещество получают из соответствующего 5 бромпроизводного путем взаимодействия с цианидом меди. В соответствии со способом, который лишь схематично представлен в общих чертах,циталопрам может быть получен с помощью замыкания кольца соединения в присутствии агента дегидратации и последующей замены группы 5-бром цианидом меди. Исходное вещество формулы II получают из 5 бромфталида с помощью двух последовательных реакций Гриньяра, т.е. с 4-фторфенил 003132 2 магнийхлоридом и N,N-диметиламинопропилмагнийхлоридом соответственно. Новый и неожиданный способ, а также промежуточное соединение для получения циталопрама были описаны в патенте США 4650884, в соответствии с которым промежуточное соединение формулы подвергают реакции замыкания кольца дегидратацией сильной серной кислотой с целью получения циталопрама. Промежуточное соединение формулы III получали из 5-цианофталида с помощью двух последовательных реакций Гриньяра, т.е. с 4-фторфенилмагнийгалогенидом иN,N-диметиламинопропилмагнийгалогенидом,соответственно. Наконец, способы получения отдельных энантиомеров циталопрама описаны в патенте США 4943590, из которого также следует,что замыкание кольца промежуточного соединения формулы III можно осуществлять через лабильный сложный эфир при помощи основания. В настоящее время неожиданно найдено,что циталопрам можно получать новым благоприятным и безопасным способом с использованием удобных исходных материалов. Сущность изобретения Настоящее изобретение, соответственно,относится к новому способу получения циталопрама, который включает стадии: а) восстановления соединения формулы IV в которой R1 представляет CN, C1-6 алкилоксикарбонил или C1-6 алкиламинокарбонил,b) проведения циклизации полученного соединения формулы V в которой R1 имеет значения, определенные выше, с получением таким образом соединения формулы VIc) затем, если R1 представляет циано, использования соединения формулы VI непосредственно на следующей стадии, и, если R1 представляет C1-6 алкилоксикарбонил или C1-6 алкиламинокарбонил, превращения соединения формулы VI в соответствующее соединение, в котором R1 является циано; и который выделяют в виде основания или его фармацевтически приемлемой соли. Согласно еще одному аспекту данное изобретение представляет новые промежуточные соединения формулы V. Согласно следующему аспекту изобретение относится к новым промежуточным соединениям для получения циталопрама формулыVI, в которой R1 представляет C1-6 алкилоксикарбонил или C1-6 алкиламинокарбонил. Согласно еще одному аспекту настоящее изобретение относится к антидепрессивной фармацевтической композиции, включающей циталопрам, полученный по способу настоящего изобретения. Во всем описании и в формуле изобретения "C1-6 алкил" относится к алкильной группе с прямой или разветвленной цепью, содержащей от одного до шести атомов углерода включительно, такой как метил, этил, 1-пропил, 2 пропил, 1-бутил, 2-бутил, 2-метил-2-пропил,2,2-диметил-1-этил и 2-метил-1-пропил. Используемым 3-диметиламинопропилгалогенидом может быть хлорид, бромид или йодид, предпочтительно хлорид. Восстановление соединения формулы IV можно осуществлять с использованием удобного восстанавливающего агента, предпочтительно NaBH4 в спирте, таком как этанол или метанол, в щелочных условиях или с использованием цинка в водной уксусной кислоте. Замыкание кольца или циклизацию соединения формулы V можно осуществлять при помощи кислоты или через лабильный сложный эфир с помощью основания. Кислотную циклизацию осуществляют с использованием неорганической кислоты, такой как серная или фос 003132 4 форная кислота, или органической кислоты,такой как метилсульфоновая, п-толуолсульфоновая или трифторуксусная кислота. Основную циклизацию можно осуществлять через лабильный сложный эфир, такой как метансульфониловый, п-толуолсульфониловый, 10-камфорсульфониловый, трифторацетиловый или трифторметансульфониловый сложный эфир, с добавлением основания, такого как триэтиламин,диметиланилин, пиридин и т.д. Реакцию проводят в инертном растворителе, предпочтительно при охлаждении, в частности около 0 С, предпочтительно ее осуществляют способом в одном резервуаре, т.е. осуществляют сложную этерификацию с одновременным добавлением основания. Когда R1 является алкиламинокарбонильной группой, превращение в циано может проводиться с помощью обычного нитрильного синтеза. Так, амид формулы V, в которой R1 является алкиламинокарбонильной группой,предпочтительно превращают в цианосоединение, т.е. циталопрам, по реакции с дегидратирующим агентом, наиболее предпочтительно,тионилхлоридом или пентахлоридом фосфора. Когда R1 является алкилоксикарбонильной группой, превращение в циано предпочтительно осуществляют через соответствующую амидную группу, которую затем превращают в циано группу таким же образом, как и соединения формулы VI, в которой R1 представляет алкиламинокарбонильную группу. Реакцию алкилоксикарбонила в амид осуществляют с помощью гидролиза кислотой или основанием с последующим превращением в хлорангидрид кислоты и амидированием по реакции с аммиаком или алкиламином, предпочтительно, трет-бутиламином. Кислотный гидролиз может осуществляться с использованием любой подходящей кислоты, такой как HBr,HCl, НВr/уксусная кислота. Щелочной гидролиз осуществляют с любым подходящим основанием, таким как, К 2 СО 3, NaOH, КОН, и т.д. Превращение в амид также может достигаться по реакции сложного эфира (R1 представляет алкилоксикарбонильную группу) с аммиаком или алкиламином под давлением и при нагревании. Полученный амид превращают в цианогруппу,как описано выше. Альтернативно, сложный эфир, т.е. соединение формулы VI, в которой R1 является алкилоксикарбонильной группой, может гидролизоваться и затем подвергаться реакции с хлорсульфонилизоцианатом с целью образования нитрила.Aлкилирование на стадии d) осуществляют путем добавления 3-диметиламинопропилгалогенида к соединению формулы VI (R1=CN) в подходящем растворителе, таком как простой эфир,предпочтительно 1,2-диметоксиэтан(DME), ТГФ, диглим или диэтиловый эфир, в 5 присутствии основания, предпочтительно, литийдиизопропиламина (LDA). Способ по изобретению может осуществляться с или без выделения промежуточных соединений. Другие реакционные условия, растворители и т.д. являются условиями, которые обычно используют для таких реакций, и могут быть легко определены специалистом в данной области. Исходные вещества формулы IV можно получить из соответствующего фталидного соединения по реакции с реактивом Гриньяра,производным 4-галогенфторфенила, например, с магнийгалогенидом, как показано на следующей схеме реакции: где R1 имеет значения, определенные выше. Когда R1 представляет цианогруппу, исходные вещества формулы VII можно получить,как описано Tirouflet, J.; Bull. Soc. Sci. Bretagne 26, 1959, 35. Другие исходные вещества формулы IV могут получаться из 5-карбоксифталида по реакции с тионилхлоридом и затем с C1-6 алканолом или C1-6 алкиламином. 5-карбоксифталид является промышленно доступным и может быть получен с помощью известных приемов(Tirouflet,J.; Bull.Soc.Sci.Bretagne, 1959, 35). В предпочтительном варианте воплощения изобретения R1 представляет циано. В другом варианте воплощения изобретения R1 является C1-6 алкилоксикарбонилом, причем C1-6 алкильная группа предпочтительно является этилом, пропилом или бутилом, предпочтительно этилом, 2-пропилом или третбутилом. Еще в одном варианте воплощения изобретения R1 является C1-6 алкиламинокарбонилом,причем С 1-6 алкильной группой предпочтительно является этил, пропил или бутил, предпочтительно, этил, 2-пропил или трет-бутил, наиболее предпочтительно трет-бутил. Соединение общей формулы I может использоваться в виде свободного основания или в виде его фармацевтически приемлемой соли присоединения кислоты. В качестве кислотноаддитивных солей можно использовать соли,образованные с органическими или неорганическими кислотами. Примерами таких органических солей являются соли с малеиновой, фумаровой, бензойной, аскорбиновой, янтарной, щавелевой, бисметиленсалициловой, метансульфоновой, этандисульфоновой, уксусной, пропионовой, винной, салициловой, лимонной,глюконовой, молочной, яблочной, миндальной,коричной, цитраконовой, аспарагиновой, стеа 003132 6 риновой, пальмитиновой, итаконовой, гликолевой, п-аминобензойной, глутаминовой, бензолсульфоновой и теофиллинуксусной кислотами,а также с 8-галогентеофиллинами, например, 8 бромтеофиллином. Примерами таких неорганических солей являются соли с соляной, бромисто-водородной, серной, сульфаминовой, фосфорной и азотной кислотами. Кислотно-аддитивные соли соединений могут получаться известными в технике способами. Основание подвергают взаимодействию либо с рассчитанным количеством кислоты в смешиваемом с водой растворителе, таком как ацетон или этанол, с последующим выделением соли путем концентрирования и охлаждения,или с избытком кислоты в не смешиваемом с водой растворителе, таком как простой этиловый эфир, этилацетат или дихлорметан, с самопроизвольным отделением соли. Фармацевтические композиции по изобретению могут вводиться любым подходящим путем и в любой подходящей форме, например пероральным путем в форме таблеток, капсул,порошков или сиропов, или парентеральным путем в форме обычных стерильных растворов для инъекций. Фармацевтические готовые формы композиций по изобретению могут получаться обычными известными в технике способами. Например, таблетки можно получать смешиванием активного ингредиента с обычными вспомогательными веществами и/или разбавителями с последующим прессованием полученной смеси в обычной машине для таблетирования. Примеры вспомогательных веществ или разбавителей включают: кукурузный крахмал, картофельный крахмал, тальк, стеарат магния, желатин, лактозу, камеди и т.д. Можно использовать любое вспомогательное вещество или окрашивающие,ароматизирующие добавки, консерванты и т.д.,при условии, что они являются совместимыми с активными ингредиентами. Растворы для инъекций можно получать путем растворения активного ингредиента и возможных добавок в части растворителя для инъекций, предпочтительно, стерильной воде,доведения раствора до желаемого объема, стерилизации раствора и заполнения им подходящих для этого ампул или пробирок. Можно добавлять любые обычно используемые в технике добавки, такие как агенты тоничности, консерванты, антиоксиданты и т.д. Примеры Изобретение далее иллюстрируется следующими примерами. Пример 1. (4-Циано-2-гидроксиметилфенил)(4-фторфенил)метанол. К суспензии 5-цианофталида (500 г, 3,14 моль) в сухом-ТГФ (3000 мл) по каплям добавляют раствор 4-фторфенилмагнийбромида, полученного из 4-фторбромбензола (605 г, 3,45 моль) и магниевых стружек (107 г, 4,4 моль) в 7 сухом ТГФ (1200 мл). Температуру поддерживают ниже 5 С. По завершении добавления реакционную смесь перемешивают в течение ночи при комнатной температуре. К реакционной смеси добавляют этанол(4500 мл) и добавляют NaBH4 порциями по 50 г и перемешивают в течение ночи при комнатной температуре. Около 2/3 растворителей удаляют в вакууме и к реакционной смеси добавляют воду (4000 мл). Полученный раствор экстрагируют EtOAc(2 х 500 мл). После выпаривания растворителей остается указанное в заголовке соединение (780 г) в виде масла, которое считается достаточно чистым для использования в дальнейшей реакции. Чистый образец получают после колоночной хроматографии на силикагеле с использованием в качестве элюента смеси EtOAc/н-гептан(1/1). После выпаривания элюента получают указанное в заголовке соединение в виде кристаллов. ДСК, нач.: 116,5 С. 1(1 Н, д J=8,5 Гц), 7,77 (1 Н, д J=8,5 Гц), 7,83 (1 н,с). Анал. Для C15H12N1F1O2; Вычислено: С 70,02; Н 4,71; N 5,45 Найдено: С 70,01; Н 4,71, N 5,51. 1-(4-Фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил. Неочищенный (4-циано-2-гидроксиметилфенил)(4-фторфенил)метанол (700 г) растворяют в Н 3 РО 4 (60%, 3000 мл) и раствор нагревают в течение 3 ч до 80 С. Добавляют толуол (1000 мл) и фазы разделяют. Водную фазу затем экстрагируют толуолом (1000 мл). Толуольные фазы соединяют и растворители удаляют в вакууме. Оставшиеся кристаллы перекристаллизовывают из EtOH (99%). Выход 219 г (29%). ДСК. Нач.: 97 С. 1(2 Н, м), 7,71 (1 Н, д J=8,5 Гц), 7,90 (1 Н, с). Анал. Для C15H10N1F1O1; Вычислено: С 75,30; Н 4,22; N 5,86 Найдено: С 75,01; Н 4,22; N 5,83. 1-(3-Диметиламинопролил)-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил. К растворенному в DME (150 мл) диизопропиламину (55 г, 0,5 моль) при -50 С в атмосфере азота добавляют н-BuLi (1,6 н. в гексане,320 мл). 1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил (62 г, 0,26 моль) растворяют в DME (500 мл) и добавляют по каплям,поддерживая при этом температуру ниже -40 С. После добавления (45 мин) темно-красный раствор перемешивают в течение дополнительного 8 времени 20 мин. Добавляют одной порцией 3 диметилпропилхлорид (100 г, 0,82 моль) при-50 С и охлаждение убирают. Через 60 мин. раствор подогревают до 50 С в течение 120 мин. Реакционную смесь выливают в ледяную воду(1 л) и экстрагируют толуолом (2 х 500 мл). Органическую фазу экстрагируют НСl (4 н., 500 мл). Кислый раствор доводят до щелочного(рН=10) при помощи NaOH (10 н.) и экстрагируют толуолом (500 мл), который промывают водой (3 х 200 мл). Толуольную фазу сушат над безводным Na2SO4 (50 г), обрабатывают активированным углем, и растворители удаляют в вакууме. Указанное в заголовке соединение (64-71 г, 76-84%) получают в виде масла. 1(2 Н, т, J=8,5 Гц), 7,58 (2 Н, дт, J=1,2 Гц J=8,5 Гц),7,70-7,78 (3 Н, м). Соль щавелевой кислоты кристаллизуют из ацетона. ДСК, нач.: 156 С. Анал. Для C22H23N2F1O5; Вычислено: С 63,75; Н 5,60; N 6,76 Найдено: С 61,60; Н 5,62; N 6,63. Пример 2. (4-Этоксикарбонил-2-гидроксиметилфенил)(4-фторфенил)метанол. К суспензии 5-этоксикарбонилфталида(20,6 г, 0,1 моль) в сухом ТГФ (150 мл) добавляют по каплям раствор 4-фторфенилмагнийбромида, полученного из 4-фторбромбензола(21 г, 0,12 моль) и магниевых стружек (3,4 г,0,14 моль), в сухом ТГФ (150 мл). Температуру поддерживают ниже 5 С. По завершении добавления реакционную смесь перемешивают в течение ночи при комнатной температуре. К реакционной смеси добавляют этанол(300 мл) и порциями примерно по 1 г добавляютNaBH4 (7,6 г, 0,2 моль) и перемешивают при комнатной температуре в течение 4 ч. Растворители удаляют в вакууме и к оставшемуся маслу добавляют хлорид аммония (нас. водн., 300 мл). рН полученного раствора доводят до 7,2 при помощи 4 н. водной НСl и экстрагируют EtOAc(2 х 100 мл). После выпаривания растворителей остается неочищенное указанное в заголовке соединение в виде масла (30 г), которое считают достаточно чистым для использования в следующей реакции. 1H ЯМР (ДМСО-d6, 500 МГц): 1,3 (3 Н, т,J=7 Гц), 4,3 (2 Н, д, J=7 Гц), 4,35-4,5 (2 Н, м),4,55-4,65 (2 Н, м), 5,35 (1 Н, т, J=3 Гц), 5,95 (1 Н,д, J=3 Гц), 6,05 (1 Н, д, J=3 Гц), 7,13 (2 Н, т, J=10 Гц), 7,33 (2 Н, м), 7,64 (1 Н, д, J=8,5 Гц), 7,90 (1 Н,д, J=8,5 Гц), 8,10 (1 Н, с). Этил-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбоксилат. Неочищенный (4-этоксикарбонил-2-гидроксиметилфенил)(4-фторфенил) метанол (30 г) растворяют в Н 3 РO4 (60%, 250 мл) и раствор нагревают до 80 С в течение 1,5 ч. Добавляют воду (300 мл) и EtOAc (100 мл) и фазы разделя 9 ют. Водную фазу затем экстрагируют EtOAc(100 мл). Органические фазы объединяют и растворители удаляют в вакууме. Выход оставшегося несколько нечистого масла составляет 30 г. 1NaOH (150 мл). Полученный раствор кипятят с обратным холодильником в течение 1 ч. Половину объема удаляют в вакууме. Водную фазу экстрагируют EtOAc (2 х 100 мл). Водную фазу подкисляют (рН=1, конц. НСl) и после охлаждения до 5 С отфильтровывают белые кристаллы. Выход 16 г. Общий выход составляет 66%,исходя из 5-этоксикарбонилфталида. Т.пл. 187190 С. 1 Н ЯМР (ДМСО-d6, 500 МГц): 5,15 (1 Н, д,J=13 Гц), 5,33 (1 Н, д, J=13 Гц), 6,23 (1 Н, с), 7,18(1 Н, д, J=8,5 Гц), 7,94 (1 Н, с), 12,95 (1 Н,ушир.с). Полученное соединение затем превращают в соответствующее цианосоединение, которое снова алкилируют, как описано в примере 1. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения циталопрама, включающий стадии а) восстановления соединения формулы IVb) осуществления замыкания кольца полученного соединения формулы V в которой R1 имеет значения, определенные выше, с получением соединения формулы VIc) затем, если R1 представляет циано, использования соединения формулы VI непосредственно на следующей стадии и, если R1 представляет C1-6 алкилоксикарбонил или C1-6 алкиламинокарбонил, превращения соединения формулы VI в соответствующее соединение, в котором R1 является циано; и который выделяют в виде основания или его фармацевтически приемлемой соли. 2. Способ по п.1, в котором R1 представляет CN. 3. Способ по п.1, в котором R1 представляет C1-6 алкилоксикарбонил. 4. Способ по п.1, в котором R1 представляет C1-6 алкиламинокарбонил. 5. Способ по п.3 или 4, в котором C1-6 алкил представляет этил-, пропил- или бутил,предпочтительно этил, 2-пропил или третбутил, наиболее предпочтительно трет-бутил. 6. Способ по любому из пп.1-5, в котором восстановление соединения формулы IV осуществляют с использованием NaBH4 в спирте, таком как этанол или метанол, в щелочных условиях. 7. Способ по любому из пп.1-6, в котором замыкание кольца соединения формулы V осуществляют с помощью кислотной циклизации в неорганической кислоте, такой как серная или фосфорная кислота, или в органической кислоте, такой как метилсульфоновая, п-толуолсульфоновая или трифторуксусная кислота. 8. Способ по любому из пп.1-6, в котором циклизацию соединения формулы V осуществляют путем основной циклизации через лабильный сложный эфир, предпочтительно с одновременной сложной этерификацией и добавлением основания. 9. Способ по п.8, в котором лабильный сложный эфир представляет метансульфониловый, п-толуолсульфониловый, 10-камфорсульфониловый, трифторацетиловый или трифторметансульфониловый сложный эфир и основание представляет триэтиламин, диметиланилин или пиридин. 10. Способ по п.3, в котором превращениеC1-6 алкилоксикарбонила в циано осуществляют через соответствующую амидную группу. 11. Способ по п.10, в котором реакцию C1-6 алкилоксикарбонила в амид осуществляют гидролизом кислотой или основанием, последующим превращением в хлорангидрид кислоты и амидированием по реакции с аммиаком или ал 11 киламином, предпочтительно трет-бутиламином. 12. Способ по п.11, в котором гидролиз осуществляют с использованием подходящей кислоты, такой как HBr, HCl, НВr/уксусная кислота. 13. Способ по п.11, в котором гидролиз осуществляют с использованием подходящего основания, предпочтительно К 2 СО 3, NaOH или КОН. 14. Способ по п.10, в котором реакцию C1-6 алкоксикарбонила в амид осуществляют взаимодействием сложного эфира с аммиаком или алкиламином под давлением и при нагревании. 15. Способ по любому из пп.4 и 10-14, в котором амид превращают в цианогруппу по реакции с дегидратирующим агентом, предпочтительно тионилхлоридом или пентахлоридом фосфора. 16. Способ по любому из пп.1-15, в котором используемый в качестве алкилирующего агента на стадии d) 3-диметиламинопропилгалогенид является хлоридом, бромидом или йодидом, предпочтительно хлоридом. 17. Способ по любому из пп.1-16, в котором алкилирование на стадии d) осуществляют в простом эфире, предпочтительно 1,2 диметоксиэтане, ТГФ, диглиме или диэтиловом эфире. 18. Способ по любому из пп.1-17, в котором алкилирование на стадии d) осуществляют в присутствии основания, предпочтительно литийдиизопропиламина. 19. Способ по любому из пп.1-18, в котором исходное вещество формулы IV получают из соответствующего фталидного соединения взаимодействием с реактивом Гриньяра, производным 4-галогенфторфенила, предпочтительно 4-фторфенилмагнийгалогенидом,наиболее предпочтительно магнийбромидом. 20. Способ по п.1, в котором R1 представляет циано, исходное вещество формулы IV получают из соответствующего фталидного со 12 единения взаимодействием с 4-фторфенилмагнийгалогенидом, восстановление на стадии а) осуществляют с помощью NaBH4 в спирте,циклизацию на стадии b) осуществляют с неорганической кислотой и алкилирование на стадии в которой R1 представляет C1-6 алкилоксикарбонил или C1-6 алкиламинокарбонил. 23. Способ получения циталопрама, включающий алкилирование соединения формулы в котором R1 представляет CN, 3-диметиламинопропилгалогенидом в щелочных условиях, причем реакцию осуществляют в простом эфире, предпочтительно 1,2-диметоксиэтане,ТГФ, диглиме или диэтиловом эфире в присутствии литийдиизопропиламина.
МПК / Метки
МПК: C07D 307/87
Метки: циталопрама, получения, способ
Код ссылки
<a href="https://eas.patents.su/7-3132-sposob-polucheniya-citaloprama.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения циталопрама</a>











