Способ получения циталопрама
Формула / Реферат
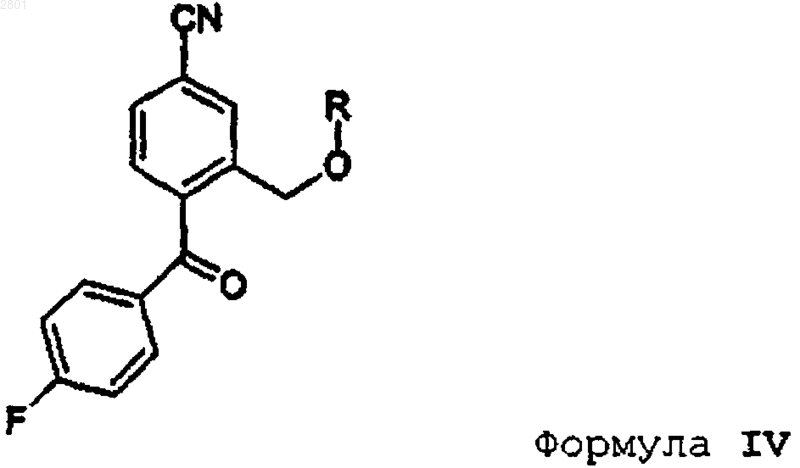
1. Способ получения циталопрама, включающий взаимодействие соединения формулы IV
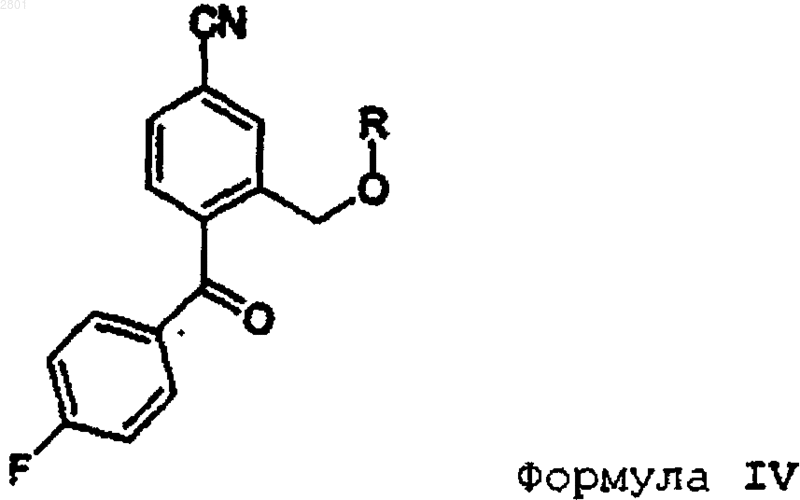
в которой R представляет собой С1-С6алкил, ацил, C1-C6 алкилсульфонил или арилсульфонил, с 3-(N,N-диметиламино)пропилмагнийгалогенидом, предпочтительно 3-(N,N-диметиламино)пропилмагнийхлоридом, с получением циталопрама
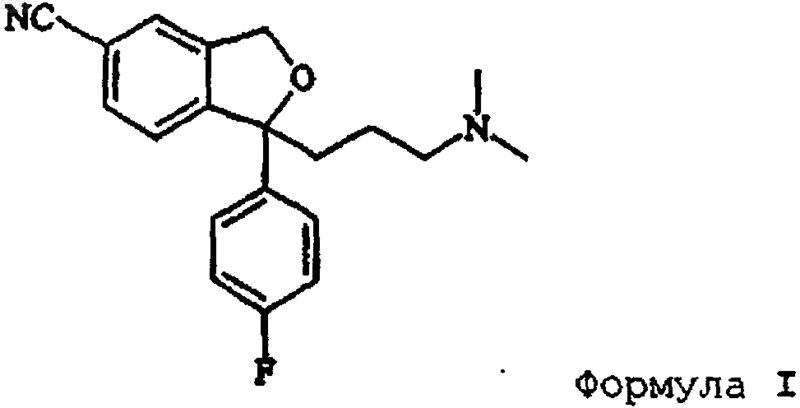
который выделяют в виде основания или его фармацевтически приемлемой соли.
2. Способ получения промежуточного соединения формулы IV, включающий окисление соответствующего соединения формулы V
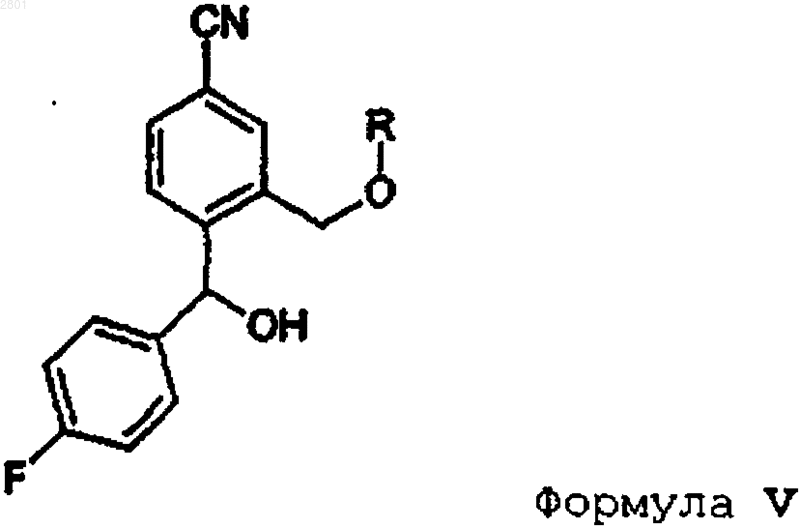
в которой R имеет значения, указанные в п.1.
3. Способ получения соединения формулы V, включающий защиту гидроксиметилспиртовой группы (4-циано-2-гидроксиметилфенил)(4-фторфенил)метанола формулы VI
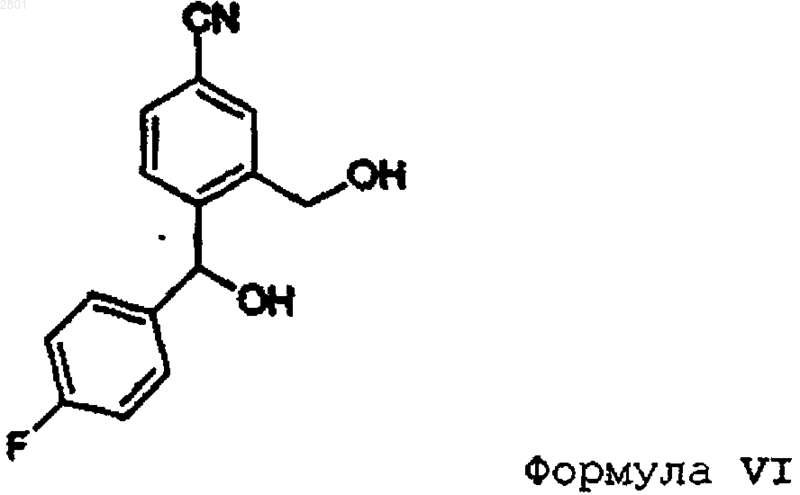
4. Способ получения промежуточного соединения формулы IV, включающий окислительное расщепление соответствующего соединения формулы VII
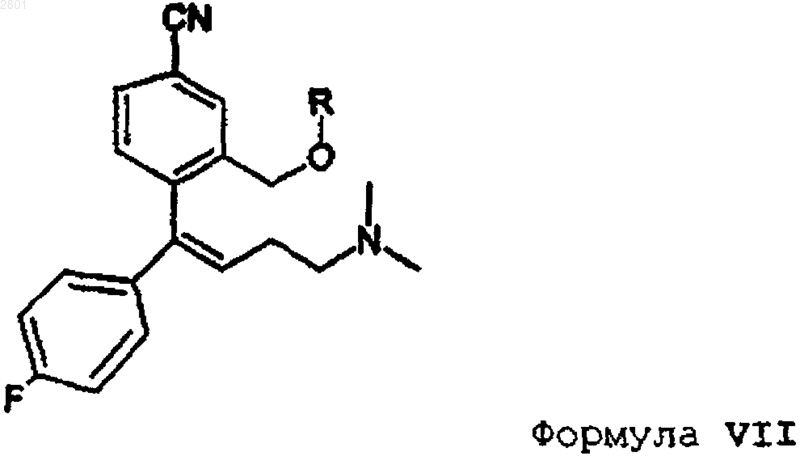
в которой R имеет значения, указанные в п.1.
5. Способ по п.4, отличающийся тем, что окислительное расщепление соединения формулы VII осуществляют окислением предпочтительно с помощью МnO-4 (перманганатов), озона, RuСl3 или OsO4.
6. Способ получения промежуточного алкена формулы VII, включающий защиту и дегидратацию соответствующего соединения формулы III
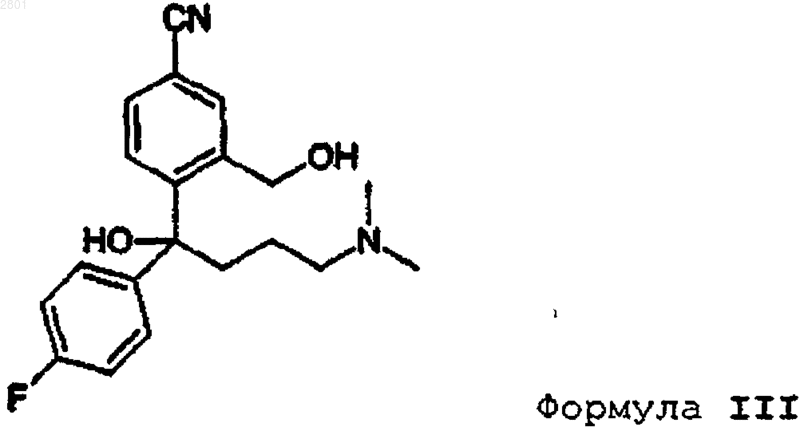
в которой соединение формулы III представляет собой R-энантиомер.
7. Способ получения промежуточного соединения формулы IV, включающий реакцию 5-цианофталида с 4-фторфенилмагнийгалогенидом, предпочтительно 4-фторфенилмагнийбромидом, с последующей реакцией с соединением R-X с получением кетона формулы IV, в которой R имеет значения, указанные в п.1, а Х представляет собой уходящую группу, причем предпочтительно, чтобы соединение R-X представляло собой пивалоилхлорид, 3,5-диметоксибензоилхлорид, метилиодид, этилбромид, тозилхлорид, Ме2SO4 или MeSO2Cl.
8. Способ получения рацемического соединения формулы III, включающий стадии:
а) снятия защитной группы у соединения формулы IV
в которой R имеет значения, указанные в п.1,
b) взаимодействия полученного соединения формулы VIII
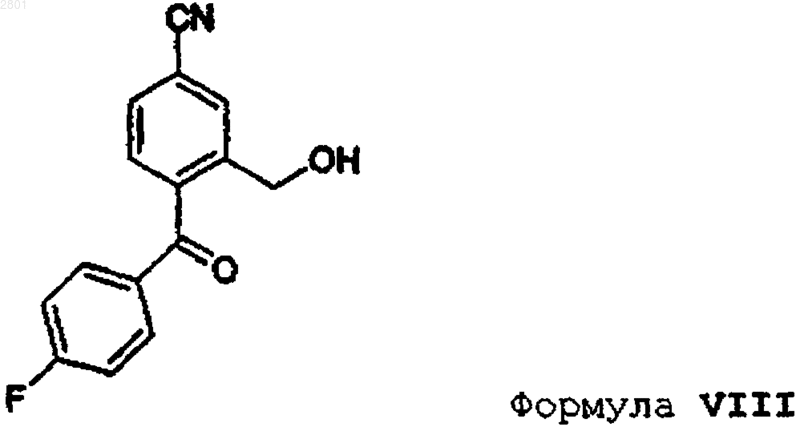
с 3-(N,N-диметиламино)пропилмагнийгалогенидом, предпочтительно 3-(N,N-диметиламино)пропилмагнийхлоридом, с получением рацемического соединения формулы III

9. Способ по любому из пп.1-8, в котором R представляет собой ацил, предпочтительно пивалоил, ацетил или необязательно замещенный бензоил.
10. Соединение формулы IV
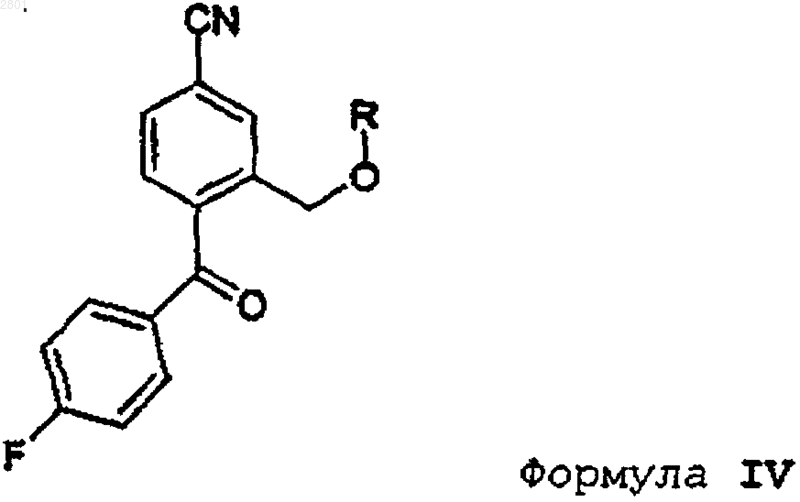
в которой R представляет собой C1-С6алкил, ацил, C1-C6алкилсульфонил или арилсульфонил, предпочтительно пивалоил, ацетил или необязательно замещенный бензоил.
11. Применение промежуточного соединения по п.10 для получения циталопрама или S-циталопрама.
Текст
1 Настоящее изобретение относится к способу получения хорошо известного антидепрессантного лекарства циталопрама,1-[3(диметиламино)пропил]-1-(4-фторфенил)-1,3 дигидро-5-изобензофуранкарбонитрила. Область техники, к которой относится изобретение Циталопрам представляет собой хорошо известный антидепрессант следующей ниже структуры, который уже в течение ряда лет поступает на рынок Этот препарат представляет собой селективный ингибитор повторного усвоения действующего на центральную нервную систему серотонина (5-гидрокситриптамин; 5-НТ), соответственно обладающий антидепрессантной активностью. В литературе имеется несколько публикаций, описывающих антидепрессантную активность рассматриваемого соединения, например, J.Hyttel, Prog. Neuro-Psychopharmacol.Psychiatr. Scand., 1987, 75, 478-486. Кроме этого,дополнительно обнаружено, что это соединение обладает эффективностью при лечении слабоумия и сердечно-сосудистых заболеваний, ЕРА-474580. Впервые циталопрам был описан в DE 2657271, соответствующем патенту США 4136193. В указанном опубликованном патенте описан один из способов получения циталопрама и приводится схема другого способа, который может использоваться для получения циталопрама. Согласно описанному способу, соответствующий 1-(4-фторфенил)-1,3-дигидро-5-изобензофуранкарбонитрил реагирует с 3-(N,N-диметиламино)пропилхлоридом в присутствии метилсульфинилметида в качестве конденсирующего агента. Исходный материал получают из соответствующего 5-бром производного реакцией с цианидом одновалентной меди. В соответствии со способом, который представлен лишь схематически, циталопрам может быть получен реакцией циклизации цикла соединения в присутствии дегидратирующего агента с последующим замещением 5-бром группы реакцией с цианидом меди. Исходное вещество формулы II получают из 5-бромфталида путем осуществления двух последовательных реакций Гриньяра, например, с 4-фторфенилмагнийхло 002801 2 ридом и N,N-диметиламинопропилмагнийхлоридом, соответственно. Новый неожиданный способ, а также промежуточное соединение для получения циталопрама описаны в патенте США 4650884,согласно которому промежуточное соединение формулы подвергают реакции циклизации в результате дегидратации в присутствии концентрированной серной кислоты с получением циталопрама. Промежуточное соединение формулы III получают из 5-цианофталида двумя последовательными реакциями Гриньяра, например, с 4 фторфенилмагнийгалогенидом и N,N-диметиламинопропилмагнийгалогенидом, соответственно. Другие способы раскрыты в Международных патентных заявкахWO 98019511, WO 98019512 и WO 98019513. Заявки WO 98019512 и WO 98019513 относятся к способам, в которых 5-амино-, 5-карбокси- или 5-(втораминокарбонил)фталид подвергают двум последовательным реакциям Гриньяра, реакции замыкания цикла и полученное производное 1,3 дигидроизобензофурана превращают в соответствующее 5-циано производное, т.е. циталопрам. В Международной патентной заявкеWO 98019511 раскрыт способ получения цитало-прама, в котором производное (4-замещенный-2 гидроксиметилфенил-(4-фторфенил)-метанола подвергают реакции замыкания цикла и полученный 5-замещенный 1-(4-фторфенил)-1,3 дигидроизобензофуран превращают в соответствующее 5-циано производное, которое алкилируют (3-диметиламино)пропилгалогенидом с получением циталопрама. Наконец, способы получения индивидуальных энантиомеров циталопрама раскрыты в патенте США 4943590, из которого также следует, что реакцию замыкания кольца промежуточного соединения формулы III можно осуществлять через образование лабильного сложного эфира с помощью основания. Неожиданно было обнаружено, что циталопрам может быть получен новым, удобным и безопасным способом с использованием традиционных исходных веществ. Краткое описание сущности изобретения Настоящее изобретение относится к новому способу получения циталопрама, включающему взаимодействие соединения формулы IV который выделяют в виде основания или его фармацевтически приемлемой соли. В соответствии с другим аспектом настоящего изобретения, предложены новые промежуточные соединения формулы IV. Согласно еще одному аспекту, настоящее изобретение относится к способам получения промежуточных соединений формулы IV. Согласно другому аспекту настоящего изобретения соединения формулы IV используются для получения рацемического соединения формулы III В соответствии с другим аспектом, настоящее изобретение относится к антидепрессантной фармацевтической композиции, содержащей циталопрам, полученной по способу изобретения. В соответствии со способом настоящего изобретения циталопрам получают в одну стадию реакцией Гриньяра из соединений формулы Неожиданно было установлено, что в продукте, полученном реакцией Гриньяра, происходит спонтанно и непосредственно замыкание кольца с образованием циталопрама и, соответственно, одностадийное взаимодействие соединения формулы IV с реагентом Гриньяра приводит к образованию циталопрама. Кроме этого, в соответствии с настоящим изобретением, соединения формулы IV могут быть получены тремя различными способами. Один из таких способов включает защиту гидроксиметиловой группы (4-циано-2-гидроксиметилфенил)(4-фторфенил) метанола формулы VI с последующим окислением, приводящим к получению соединений формулы IV, в которой R 4 представляет собой C1-6 алкил, ацил, C1-6алкилсульфонил или арилсульфонил. Окисление соединений формулы V может осуществляться с помощью любого подходящего окислителя, предпочтительно, с помощьюNa2WO4. Исходный материал для получения соединения формулы VI может быть получен по способу, описанному в Международной патентной заявкеPCT/DK97/00511. Другой способ получения соединений формулы IV включает реакцию 5-цианофталида с 4-фторфенилмагнийгалогенидом, предпочтительно с 4-фторфенилмагнийбромидом с последующей реакцией с R-X, где R имеет указанные выше значения, а Х представляет собой уходящую группу, предпочтительно R-X представляет собой пивалоилхлорид, 3,5-диметоксибензоилхлорид, метилиодид, этилбромид, тозилхлорид, Ме 2SO4 или MeO2Cl. Реакция может быть проиллюстрирована следующей схемой: Исходный материал, 5-цианофталид, может быть получен по способу, описанному Tirouflet, J. ; Bull. Soc. Sci. Bretagne 26, 1959, 35. Согласно третьему способу получения соединения формулы IV, один из энантиомеров соединения формулы III, например Rэнантиомер, подвергают защите и дегидратации с получением соединения формулы VII, которое окисляют с образованием кетона формулы IV.III может использоваться для получения рацемического циталопрама. Окислительное расщепление соединения формулы VII осуществляют окислением, предпочтительно, МnO4-(перманганатами), либо озоном, RuCl3, OsO4. Циталопрам поступает на рынок в качестве антидепрессантного лекарственного средства в форме рацемата. Однако в ближайшем будущем на рынок поступит также активный Sэнантиомер циталопрама. Активный S-энантиомер циталопрама может быть получен из соединения формулы III путем разделения S-энантиомера и Rэнантиомера с последующим замыканием кольца S-энантиомера по способу патента США 4 943 590. Ранее, после разделения, R-энантиомер соединения формулы III не использовали. Кроме этого, согласно еще одному аспекту настоящего изобретения, после превращения Rэнантиомера формулы III в оптически неактивное соединение формулы IV, рацемическое со 5 единение формулы III может быть получено в соответствии со следующей схемой: Рацемическое соединение формулы III может быть разделено на оптически активные энантиомеры по способу, описанному в патенте США 4943590, в результате чего получают Sэнантиомер соединения формулы III, который используют для получения S-циталопрама. Rэнантиомер соединения формулы III можно еще раз рециркулировать в описанный выше технологический цикл. Таким образом, R-энантиомер формулы III может быть превращен в S-энантиомер циталопрама. Прочие условия проведения реакции, растворители и т.п. для каждой из описанных выше реакций являются традиционными для таких реакций и могут быть легко установлены специалистом в данной области. В тексте описания и формулы изобретения термин C1-6 алкил относится к алкильной группе с прямой или разветвленной цепью, содержащей от одного до шести углеродных атомов включительно, такой как метил, этил, 1 пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-2 пропил, 2,2-диметил-1-этил и 2-метил-1-пропил. Термин арил относится к моно- или бициклической, карбоциклической ароматической группе, такой как фенил и нафтил, особенно фенил или замещенный по кольцу фенил. Термин гетероарил относится к моноили бициклической гетероциклической ароматической группе, такой как индолил, тиенил,пиримидил, оксазолил, изоксазолил, тиазолил,изотиазолил, имидазолил, бензофуранил, бензотиенил, пиридил и фуранил, в особенности, пиримидил, индолил и тиенил. Термин ацил обозначает C1-6 алкил- или арил- или гетероарилкарбонил, в котором C1-6 алкил и арил, а также гетероарил имеют указанные выше значения. Термин галоген обозначает хлор, бром или иод. Предпочтительно,термин уходящая группа обозначает галогенид или сульфонат. Согласно предпочтительному варианту изобретения R представляет собой ацил, предпочтительно пивалоил, ацетил или необязательно замещенный бензоил. Соединение общей формулы I может применяться в виде свободного основания или его фармацевтически приемлемой аддитивной соли кислоты. В качестве аддитивных солей кислоты могут применяться соли органических или неорганических кислот. Примерами таких соединений могут служить соли таких органических кислот, как малеиновая, фумаровая, бензойная, аскорбиновая, 002801 6 янтарная, щавелевая, бисметиленсалициловая,метансульфокислота,этандисульфоксилота,уксусная, пропионовая, винная, салициловая,лимонная, глюконовая, молочная, яблочная,миндальная, коричная, цитраконовая, аспарагиновая, стеариновая, пальмитиновая, итаконовая,гликолевая, п-аминобензойная, глутаминовая,бензолсульфокислота и теофиллинуксусная кислота, а также 8-галотеофиллины, например 8 бромтеофиллин. Примерами неорганических солей могут служить соли хлористоводородной, бромисто-водородной, серной,сульфаминовой, фосфорной и азотной кислот. Кислотно-аддитивные соли рассматриваемых соединений могут быть получены способами, известными из уровня техники. Основание взаимодействует с рассчитанным количеством кислоты в смешивающемся с водой растворителе, таком как ацетон или этанол, с последующим выделением полученной соли концентрированием и охлаждением, или с избытком кислоты в не смешивающемся с водой растворителе, таком как диэтиловый эфир, этилацетат или дихлорметан, с последующим самопроизвольным отделением соли. Фармацевтические композиции настоящего изобретения могут быть введены любым подходящим способом и в любой подходящей форме, например перорально в виде таблеток,капсул, порошков или сиропов, либо парентерально в виде традиционных стерильных растворов для инъекций. Фармацевтические препаративные формы настоящего изобретения могут быть получены традиционными способами. Так например, таблетки могут быть изготовлены смешиванием активного ингредиента с традиционными адъювантами и/или разбавителями с последующим прессованием смеси в традиционной машине для таблетирования. Примеры адьювантов или разбавителей включают кукурузный крахмал,картофельный крахмал, тальк, стеарат магния,желатин, лактозу, смолы и т.п. Могут использоваться любые другие адьюванты или окрашивающие агенты, ароматизаторы, консерванты и т.п. при условии их совместимости с активными ингредиентами. Растворы для инъекций могут быть получены растворением активного ингредиента и возможных добавок в части раствора для инъекций, предпочтительно в стерильной воде, доведением раствора до желаемого объема, стерилизацией раствора и заполнения им подходящих ампул или пузырьков. В препарат могут вводиться любые подходящие добавки, традиционно используемые в данной области техники,например изотонические агенты, консерванты,антиоксиданты и т.п. Примеры Далее настоящее изобретение иллюстрируется следующими примерами. 7 Пример 1. 5-Циано-2-[1-(4-фторфенил)-1 гидроксиметил]бензиловый эфир 2,2-диметилпропионовой кислоты. В перемешиваемый раствор (4-циано-2 гидроксиметилфенил)(4-фторфенил)метанола (9,2 г, 0,037 моль) и триэтиламина (4,0 г, 0,04 моль) добавляли пивалоилхлорид (4,2 г, 0,39 моль). После перемешивания в течение 60 мин реакционную смесь выливали на лед, экстрагировали диэтиловым эфиром (2 х 75 мл), сушили (МgSO4) и концентрировали при пониженном давлении с получением бесцветного масла (12,0 г). Полученное соединение очищали хроматографией(элюент гексан/этилацетат в соотношении 1:9) с получением названного в заголовке соединения (8,2 г, 70%). Спектр 1H ЯМР (ДМСО-D6) : 1,1 (с, 9 Н),5,15 (м, 2 Н), 6 (широкий с, 1 Н), 6,25 (д, J=6 Гц,1H), 7,1-7,2 (м, 2 Н), 7,3-7,4 (м, 2 Н), 7,7-7,9 (м,3 Н). Пример 2. 5-Циано-2-[1-(4-фторфенил)метаноил]бензиловый эфир 2,2-диметилпропионовой кислоты. В перемешиваемый раствор 5-циано-2-[1(4-фторфенил)-1-гидроксиметил]бензилового эфира 2,2-диметилпропионовой кислоты (8,0 г,0,025 моль) в этилацетате (20 мл) добавляли раствор пероксида водорода с концентрацией 30 мас.% (10 г, 0,079 моль), Na2WO42H2O (0,15 г,0,0005 моль) и (н-октил) 3NСН 3. HSO4 (0,23 г,0,0005 моль). Полученную смесь кипятили с обратным холодильником в течение 4 ч, давали охлаждаться до комнатной температуры и переливали в разбавленную НСl, экстрагировали диэтиловым эфиром (2 х 50 мл), сушили (MgSO4) и концентрировали при пониженном давлении с получением названного в заголовке кетонного производного (7,8 г, 97,5%). Пример 3. 5-Циано-2-[4-диметиламино-1(4-фторфенил)бут-1-енил]бензиловый эфир уксусной кислоты и ее оксалатная соль. Способ 3 А. Уксусный ангидрид (103 г, 1 моль) прикапывали в перемешиваемый раствор 4-[4-диметиламино-1-(4-фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила (72 г,0,21 моль) в ацетонитриле (438 г) при 20 С. После завершения добавления прикапывали хлористый триметилсилил (5,5 г, 0,05 моль) (в результате протекания экзотермической реакции температура повышалась от 20 до 28 С) и полученную смесь перемешивали в течение ночи. Затем в реакционную смесь добавляли концентрированную Н 2SO4 (14,5 г, 0,14 моль) после чего смесь нагревали в течение 30 мин при 50 С(методом ЖХВР регистрировали завершение реакции). После охлаждения реакционную смесь концентрировали при пониженном давлении и нейтрализовали водным раствором аммиака (23%) с последующей экстракцией толуолом (2 раза). Органическую фазу сушили(МgSO4) и концентрировали при пониженном давлении с получением названного в заголовке(69,5 г, 85%). Физико-химические характеристики получены для оксалатной соли. Теплый раствор щавелевой кислоты (1,0 г, 0,0177 моль) в метаноле(50 мл) добавляли в перемешиваемый раствор названного в заголовке алкенового производного (6,63 г, 0,0173 моль) в метаноле (50 мл). После охлаждения образовавшиеся кристаллы выделяли фильтрацией (7,4 г) и промывали холодным метанолом (10 мл). Т.пл. 168 С. Спектр 1H ЯМР (ДМСО-D6) : 1,9 (с, 3 Н),2,2 (м, 2 Н), 2,62 (с, 6 Н), 3,1 (т, J=6,2 Гц, 2 Н), 4,8(д, J=7 Гц, 1H), 7,9-8 (м, 2 Н). Спектр 13 С ЯМР (ДМСО-D6) : 20,35, 24,98,42,16, 55,54, 62,51, 111,17, 115,25, 115,59, 118,51,124,85, 128,0, 128,18, 131,32, 132,43, 132,73, 135,65,135,99, 138,68, 142,9, 164,72, 169,96. Элементный анализ: Вычислено для C24H25N2O6F С, 63,14; Н,5,53; N, 6,14. Найдено: С, 63,1; Н, 5,58; N, 6,12 5-Циано-2-[4-диметиламино-1-(4-фторфенил)бут-1-енил]бензиловый эфир уксусной кислоты Способ 3 В. Уксусный ангидрид (1112 г,10,8 моль)прикапывали к перемешиваемому раствору 4-[4-диметиламино-1-(4-фторфенил)-1 гидроксибутил]-3-гидроксиметилбензонитрила(1000 г, 2,9 моль) в ацетонитриле (1000 г) при 20 С (в результате протекания экзотермичной реакции температура повышалась от 20 до 50 С) и полученную смесь перемешивали в течение 2 ч. В реакционную смесь добавляли концентрированную H2SO4 (300 г, 3 моль) и затем смесь нагревали в течение 3 ч при 50 С (о завершении реакции судили по данным ЖХВР). После охлаждения реакционную смесь нейтрализовали водным раствором аммиака (25%) и экстрагировали толуолом (дважды). Органическую фазу сушили (МgSO4) и концентрировали при пониженном давлении с получением названного в заголовке соединения в виде бледно-оранжевого масла (1023 г, 92%). Пример 4. 5-Циано-2-[4-диметиламино-1(4-фторфенил)бут-1-енил]-бензиловый эфир 2,2 диметилпропионовой кислоты и ее оксалат. Способ 4 А. В перемешиваемый раствор 4[4-диметиламино-1-(4-фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила (72 г, 0,21 моль) и триэтиламина (25,0 г, 0,247 моль) в ацетонитриле (438 г), при 20 С добавляли раствор пивалоил хлорида (26,0 г, 0,215 моль). Через 60 мин прикапывали концентрированную Н 2SO4(40 мл) и реакционную смесь нагревали в течение 180 мин при 70 С. Реакционной смеси давали охлаждаться до комнатной температуры,нейтрализовали водным раствором аммиака(25%) и экстрагировали диэтиловым эфиром. Органическую фазу сушили (МgSO4) и концентрировали при пониженном давлении с получе 9 нием названного в заголовке соединения в виде желтого масла (82 г, 96%). Физико-химические характеристики получены для оксалатной соли. (ацетон) Т.пл. 188 С. Спектр 1H ЯМР (ДМСО-D6) : 1,07 (с, 9 Н),2,2 (м, 2 Н), 2,6 (с, 6 Н), 3,05 (т, J=6,2 Гц, 2H),4,725 (д, J=12 Гц, 1H), 4,85 (д, J=12 Гц, 1H), 6,3(85,5 г, 0,21 моль) в ацетонитриле (290 мл) при 0 С. Реакционную смесь перемешивали еще в течение 60 мин перед добавлением концентрированной H2SO4 (32,5 г, 0,33 моль). Сразу после завершения добавления реакционную смесь нагревали в течение 180 мин при 70 С. Реакционной смеси давали охлаждаться до комнатной температуры и ацетонитрил(220 мл) удаляли при пониженном давлении,после чего проводили нейтрализацию водным раствором аммиака (23%) и экстракцию диэтиловым эфиром. Органическую фазу сушили (MgSO4) и концентрировали при пониженном давлении с образованием названного в заголовке продукта в виде розового масла (102,1 г). Раствор полученного алкенового производного II (50,0 г, 0,11 моль) в метаноле добавляли к перемешиваемому раствору безводной НСl в метаноле (200 мл). После перемешивания при комнатной температуре в течение 30 мин растворитель удаляли при пониженном давлении, добавляли диэтиловый эфир и полученное в результате твердое вещество отфильтровывали и промывали диэтиловым эфиром с образованием гидрохлорида (48,1 г). Т.пл. = 165 С. Бисульфат 5-циано-2-[4-диметиламино-1(4-фторфенил)-бут-1-енил]бензилового эфира 2,2-диметилпропионовой кислоты. Способ 4 С. Раствор пивалоилхлорида (29 г, 0,24 моль) добавляли к перемешиваемому раствору 4-[4-диметиламино-1-(4-фторфенил)-1 гидроксибутил]-гидроксиметилбензонитрила(85,5 г, 0,21 моль) в ацетонитриле (290 мл) при 0 С. Реакционную смесь перемешивали еще в течение 60 мин перед добавлением концентрированной H2SO4 (32,5 г, 0,33 моль). После завершения добавления, реакционную смесь нагревали при 70 С в течение 180 мин. Смеси давали охлаждаться до комнатной температуры и ацетонитрил удаляли при пониженном давле 002801 10 нии, добавляли толуол (200 мл) и затем его удаляли при пониженном давлении с получением названного в заголовке соединения в виде бледно-розового масла (112,4 г). Гидрохлорид 5-циано-2-[4-диметиламино 1-(4-фторфенил)бут-1-енил]бензилового эфира 2,2-диметилпропионовой кислоты. Способ 4D. Пивалоилхлорид (7,6 г, 0,63 моль) прикапывали к перемешиваемому раствору 4-[4-диметиламино-1-(4-фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила (21,35 г, 0,052 моль) в ацетонитриле (21,35 г) при комнатной температуре. После завершения этой операции добавляли раствор хлористого метансульфонила (6,1 г, 0,053 моль) в CH2Cl2 (50 мл) после чего добавляли триэтиламин (10,6 г, 0,105 моль). Реакционную смесь перемешивали еще в течение 30 мин, переливали в воду, экстрагировали CH2Cl2, органическую фазу сушили(MgSO4) и концентрировали при пониженном давлении. Затем полученное в результате масло растворяли в смеси безводный этанол/HCl, концентрировали при пониженном давлении, обрабатывали диэтиловым эфиром и фильтровали с получением гидрохлорида алкена (22,6 г, 98%). Пример 5. 5-Циано-2-[1-(4-фторфенил)метаноил]бензиловый эфир 2,2-диметилпропионовой кислоты. Способ 5 А. К перемешиваемому раствору гидрохлорида алкенового производного 5 циано-2-[4-диметиламино-1-(4-фторфенил)бут 1-енил]бензилового эфира 2,2-диметилпропионовой кислоты (165 г, 0,337 моль) в Н 2 О(40% об/об) (3,7 моль) с такой скоростью, что температура реакционной смеси поддерживалась в интервале 45-50 С. После завершения добавления реакционной смеси давали охлаждаться до комнатной температуры и смесь фильтровали. Твердый фильтрат промывали холодной водой (3 х 150 мл) и твердый остаток перемешивали в ацетоне (2000 мл) и фильтровали, в результате выпаривания получали сырой кетон,который очищали фильтрацией через слой силикагеля (элюент гексан:этилацетат в соотношении 8:2) с получением названного в заголовке кетона в виде чистого соединения (82 г, 75%). Т.пл.=81 С. Спектр 1H ЯМР (ДМСО-D6) : 0,9 (с, 9 Н),5,1 (с, 2 Н), 7,35-7,5 (м, 3 Н), 7,65 (д, J=7 Гц, 1 Н),7,8-7,9 (м, 2 Н), 8,0 (м, 1 Н), 8,1 (с, 1 Н). Спектр 13 С ЯМР (ДМСО-D6) : 26,5, 63,01,113,183, 116,0, 116,36, 118,02, 129,35, 132,19,132,58, 133,03, 133,18, 133,34, 135,98, 141,7,163,62, 167,65, 176,87, 193,94. Элементный анализ: Вычислено для С 20 Н 18NO3F: С, 70,79; Н,5,35; N, 4,13. Найдено: С, 70,49; Н, 5,30; N, 4,07. 5-Циано-2-[1-(4-фторфенил)метаноил]бензиловый эфир 2,2-диметилпропионовой кислоты. Способ 5 В. Озон в O2 барботировали через перемешиваемый раствор алкенового производ 11 ного 5-циано-2-[4-диметиламино-1-(4-фторфенил)бут-1-енил) бензилового эфира 2,2 диметилпропионовой кислоты (38,0 г, 0,093 моль) в Н 2O (1300 мл) и концентрированной НСl (70 мл), причем за ходом реакции следили с помощью ЖХВР. В ходе реакции образовывался белый осадок, и после окончания реакции белое твердое вещество отфильтровывали, промывали водой и сушили при пониженном давлении с получением в чистом виде названного в заголовке защищенного кетона (22,5 г, 72%). 5-Циано-2-[1-(4-фторфенил)метаноил]бензиловый эфир 2,2-диметилпропионовой кислоты. Метод 5 С. К суспензии 5-циано-2-[4 диметиламино-1-(4-фторфенил)бут-1-енил]бензилового эфира 2,2-диметилпропионовой кислоты, H2SO4 (11,0 г, 0,022 моль) в воде (250 мл) и этилацетате (100 мл) добавляли NaIO4 (30 г, 0,14 моль) и гидрат RuСl3 (0,35 г). Полученную суспензию интенсивно перемешивали в течение 16 ч при температуре окружающей среды. Суспензию фильтровали через слой диоксида кремния. Органическую фазу отделяли и промывали водой (50 мл). В результате выпаривания растворителя в вакууме получали названное в заголовке соединение в виде масла, которое кристаллизовалось при выстаивании. Выход: 7,4 г (99%). Пример 6. 5-Циано-2-[1-(4-фторфенил)метаноил]бензиловый эфир 2,2-диметилпропионовой кислоты. Раствор 4-фторфенилмагнийбромида, полученного из 4-фторбромбензола (19,2 г, 0,11 моль) и магниевой стружки (3,2 г, 0,13 моль) в сухом ТГФ (100 мл), прикапывали в суспензию 5-цианофталида (15,9 г, 0,1 моль) в сухом ТГФ(150 мл). Температуру поддерживали на уровне ниже 5 С. После завершения добавления реакционную смесь перемешивали в течение ночи при комнатной температуре. В реакционную смесь добавляли пивалоилхлорид (13,3 г, 0,11 моль) и температуру поддерживали в течение 2 ч на уровне 60 С. Полученный в результате раствор добавляли в насыщенный раствор NH4Cl (100 мл) и льда (50 г). В результате добавления диэтилового эфира (100 мл) происходило разделение фаз. Органическую фазу промывали 0,1N NaOH (2 х 100 мл) и водой(100 мл) и сушили над MgSO4 (20 г). В результате выпаривания растворителей получали названное в заголовке неочищенное вещество(29,8 г, 88%) в виде масла, которое считали достаточно чистым для дальнейшей реакции. Чистый образец получали кристаллизацией из смеси EtOAc/н-гептан (1:9). Названное в заголовке соединение получали в виде беловатых кристаллов. Пример 7. 1-(3-Диметиламинопропил)-1(4-фторфенил)-1,3-дигидроизобензофуран-5 карбонитрил и его оксалат. К раствору 5-циано-2-[1-(4-фторфенил)метаноил]бензилового эфира 2,2-диметилпропио 002801 12 новой кислоты (28,5 г, 0,084 моль) в безводном ТГФ (150 мл) при 0 С добавляли раствор 3(N,N-диметиламино)пропилмагнийхлорида (2,2 эквивалента) и за ходом реакции следили с помощью ЖХВР. Через 1 ч при 0 С добавляли насыщенный хлористый аммоний и полученную смесь экстрагировали этилацетатом, сушили(Na2SO4) и концентрировали при пониженном давлении с получением названного в заголовке соединения в виде масла (28,0 г (чистота согласно ЖХВР 87%. Оксалат получали перекристаллизацией полученного вещества из ацетона. Пример 8. 4-[1-(4-Фторфенил)метаноил]-3 гидроксиметилбензонитрил. Кетонное производное 5-циано-2-[1-(4 фторфенил)метаноил]бензилового эфира 2,2 диметилпропионовой кислоты (20 г, 0,061 моль) добавляли к свежеприготовленному метилатуNa (0,25 г натрия в 100 мл метанола) и перемешивали при комнатной температуре (снятие защиты определяли с помощью ЖХВР). Затем метанол удаляли при пониженном давлении,остаток растворяли в МТБЭ, промывали насыщенным хлористым аммонием, сушили (MgSO4) и концентрировали при пониженном давлении с получением освобожденного от защитной группы кетонного производного соединения названного в заголовке (14,6 г). Пример 9. 4-[4-Диметиламино-1-(4-фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрил. К раствору кетонного производного 4-[1(4-фторфенил)метаноил]-3-гидроксиметилбензонитрила (15,0 г, 0,046 моль) в безводном ТГФ при 0 С добавляли раствор 3-(N,Nдиметиламино)пропилмагнийхлорида (2,2 эквивалента), причем за ходом реакции следили с помощью ЖХВР. Через 1 ч при 0 С добавляли насыщенный раствор хлористого аммония и полученную смесь экстрагировали МТБЭ, сушили (MgSO4) и концентрировали при пониженном давлении с получением названного в заголовке соединения в виде масла (16,7 г (чистота 85%. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения циталопрама, включающий взаимодействие соединения формулы который выделяют в виде основания или его фармацевтически приемлемой соли. 2. Способ получения промежуточного соединения формулы IV, включающий окисление соответствующего соединения формулы V в которой R имеет значения, указанные в п.1. 3. Способ получения соединения формулыV, включающий защиту гидроксиметилспиртовой группы (4-циано-2-гидроксиметилфенил)(4 фторфенил)метанола формулы VI 4. Способ получения промежуточного соединения формулы IV, включающий окислительное расщепление соответствующего соединения формулы VII в которой R имеет значения, указанные в п.1. 5. Способ по п.4, отличающийся тем, что окислительное расщепление соединения формулы VII осуществляют окислением предпочтительно с помощью МnO-4 (перманганатов), озона, RuСl3 или OsO4. 6. Способ получения промежуточного алкена формулы VII, включающий защиту и дегидратацию соответствующего соединения формулы III в которой соединение формулы III представляет собой R-энантиомер. 7. Способ получения промежуточного соединения формулы IV, включающий реакцию 5 цианофталида с 4-фторфенилмагнийгалоге 14 нидом, предпочтительно 4-фторфенилмагнийбромидом, с последующей реакцией с соединением R-X с получением кетона формулы IV, в которой R имеет значения, указанные в п.1, а Х представляет собой уходящую группу, причем предпочтительно, чтобы соединение R-X представляло собой пивалоилхлорид,3,5 диметоксибензоилхлорид, метилиодид, этилбромид, тозилхлорид, Ме 2SO4 или MeSO2Cl. 8. Способ получения рацемического соединения формулы III, включающий стадии а) снятия защитной группы у соединения формулы IV в которой R имеет значения, указанные в п.1,b) взаимодействия полученного соединения формулы VIII с 3-(N,N-диметиламино)пропилмагнийгалогенидом, предпочтительно 3-(N,N-диметиламино)пропилмагнийхлоридом, с получением рацемического соединения формулы III 9. Способ по любому из пп.1-8, в которомR представляет собой ацил, предпочтительно пивалоил, ацетил или необязательно замещенный бензоил. 10. Соединение формулы IV в которой R представляет собой C1-С 6 алкил,ацил, C1-C6 алкилсульфонил или арилсульфонил,предпочтительно пивалоил, ацетил или необязательно замещенный бензоил. 11. Применение промежуточного соединения по п.10 для получения циталопрама или Sциталопрама.
МПК / Метки
МПК: C07C 255/56, A61P 25/24, A61K 31/343, C07D 307/87
Метки: получения, циталопрама, способ
Код ссылки
<a href="https://eas.patents.su/8-2801-sposob-polucheniya-citaloprama.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения циталопрама</a>
Предыдущий патент: Внутриматочное противозачаточное устройство с уменьшенным побочным действием
Следующий патент: Способ полного осаждения ценных металлов из кислотного выщелачивающего раствора
Случайный патент: Соединения, ингибирующие металлоферменты












