Способ получения циталопрама
Формула / Реферат
1. Способ получения циталопрама, включающий стадии взаимодействия соединения формулы IV
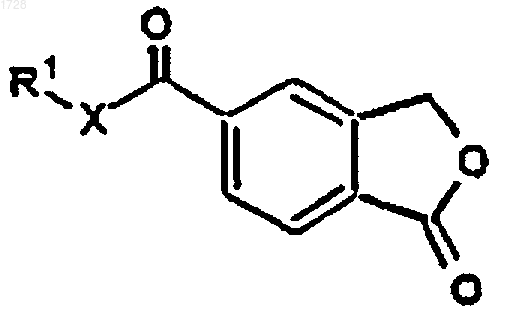
где R1 представляет C1-6алкил и Х представляет О или NH, последовательно с реактивом Гриньяра, полученным из 4-галогенфторфенила, с получением соединения формулы IVa
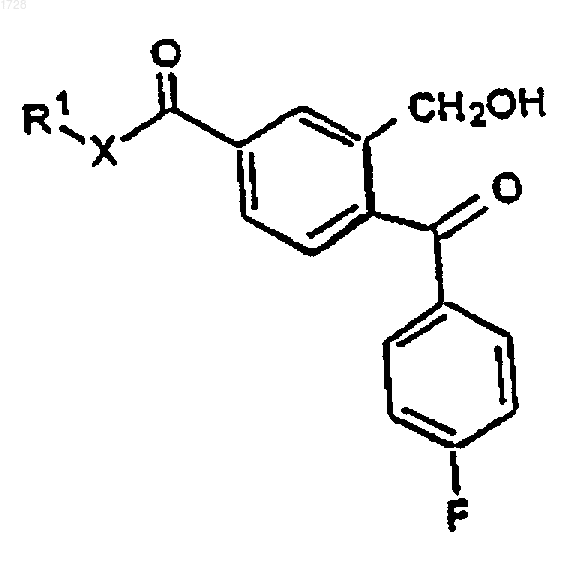
где R1 и Х являются такими, как определено выше, и реактивом Гриньяра, полученным из 3-галоген-N,N-диметилпропиламина, циклизации полученного соединения формулы V
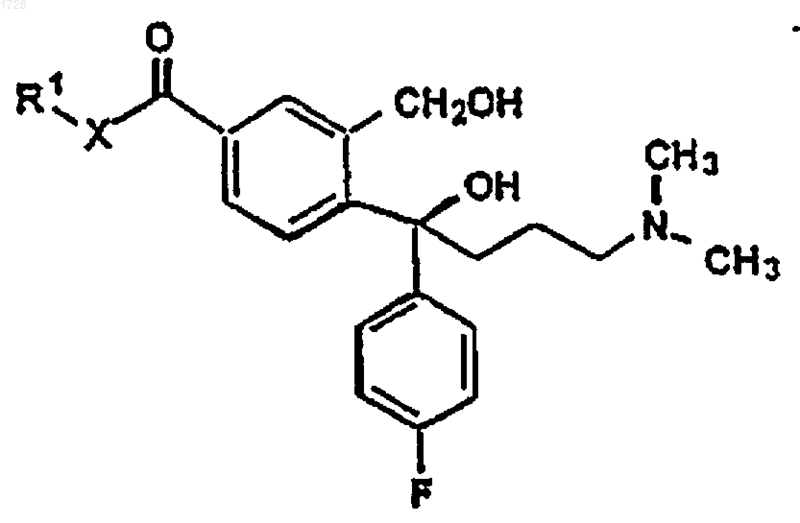
где R1 и Х являются такими, как определено выше, и превращения полученного соединения формулы VI
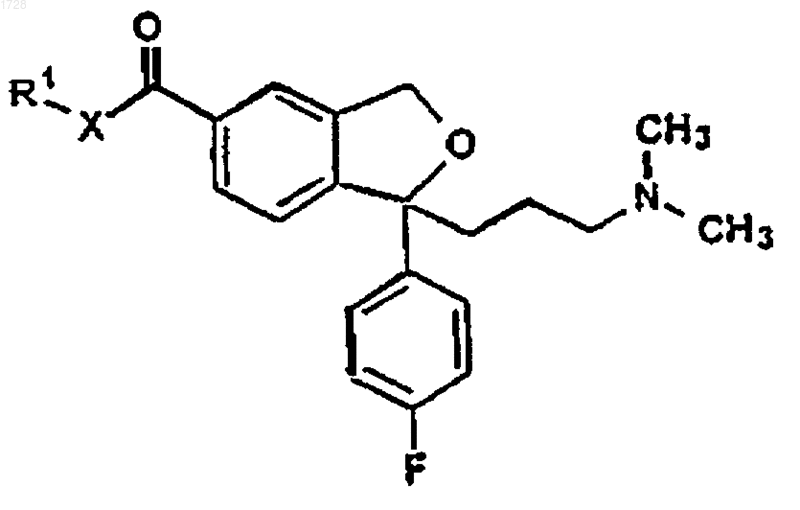
где R1 и Х являются такими, как определено выше, в циталопрам, который выделяют в виде основания или его фармацевтически приемлемой соли.
2. Способ по п.1, в котором Х представляет О.
3. Способ по п.1, в котором Х представляет NH.
4. Способ по п.2 или 3, в котором R1 представляет этил, пропил или бутил, предпочтительно этил, 2-пропил или трет-бутил, наиболее предпочтительно трет-бутил.
5. Способ по пп.1-4, в котором используемый реактив Гриньяра представляет галогенид магния, предпочтительно хлорид, бромид или иодид.
6. Способ по п.5, в котором используемый на первой стадии реактив Гриньяра представляет соль бромида магния.
7. Способ по п.5, в котором используемый на второй стадии реактив Гриньяра представляет хлорид магния.
8. Способ по любому из пп.1-7, в котором циклизацию соединения формулы V осуществляют путем кислотного замыкания кольца действием неорганической кислоты, такой как серная или фосфорная кислота, или органической кислоты, такой как метилсульфоновая, п-толуолсульфоновая или трифторуксусная кислота.
9. Способ по любому из пп.1-6, в котором циклизацию соединения формулы V осуществляют путем основного замыкания кольца через лабильный сложный эфир предпочтительно с одновременной этерификацией и добавлением основания.
10. Способ по п.9, в котором лабильный сложный эфир представляет метансульфоновый, п-толуолсульфоновый, 10-камфорсульфоновый, трифторуксусный или трифторметансульфоновый сложный эфир и основание представляет триэтиламин, диметиланилин или пиридин.
11. Способ по п.2, в котором Х представляет О и превращение группы R1-X-CO- в циано осуществляют через соответствующую амидную группу.
12. Способ по п.11, в котором реакцию превращения R1-X-CO- в амид осуществляют гидролизом кислотой или основанием, последующим превращением в хлорангидрид кислоты и амидированием путем взаимодействия с аммиаком или алкиламином, предпочтительно трет-бутиламином.
13. Способ по п.12, в котором гидролиз осуществляют, используя подходящую кислоту, такую как HBr, HCl, НВr/уксусная кислота.
14. Способ по п.12, в котором гидролиз осуществляют, используя подходящее основание, предпочтительно K2CO3, NaOH или KOH.
15. Способ по п.9, в котором реакцию превращения R1-Х-СО- в амид осуществляют путем взаимодействия сложного эфира с аммиаком или алкиламином под давлением и при нагревании.
16. Способ по любому из пп.11-14, в котором амид превращают в цианогруппу взаимодействием с дегидратирующим агентом, предпочтительно тионилхлоридом или пентахлоридом фосфора.
17. Способ по любому из пп.1-16, отличающийся тем, что соединение формулы V перед его использованием в реакции циклизации разделяют на оптически активные энантиомеры, получая таким образом (S)-энантиомер.
18. Промежуточное соединение для получения циталопрама, имеющее формулу IVa
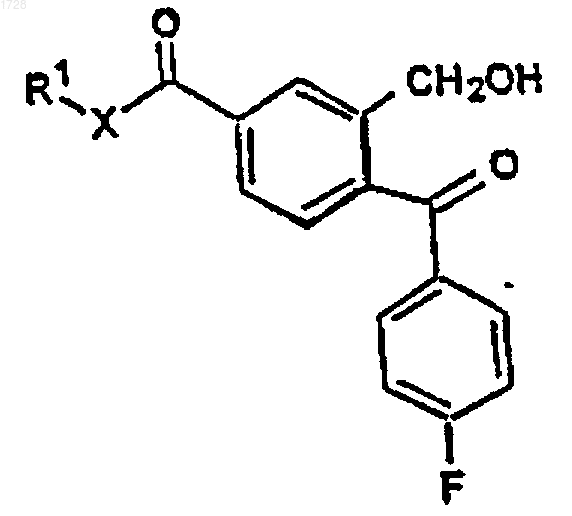
где R1 представляет C1-6алкил и Х представляет О или NH.
19. Промежуточное соединение для получения циталопрама, имеющее формулу V
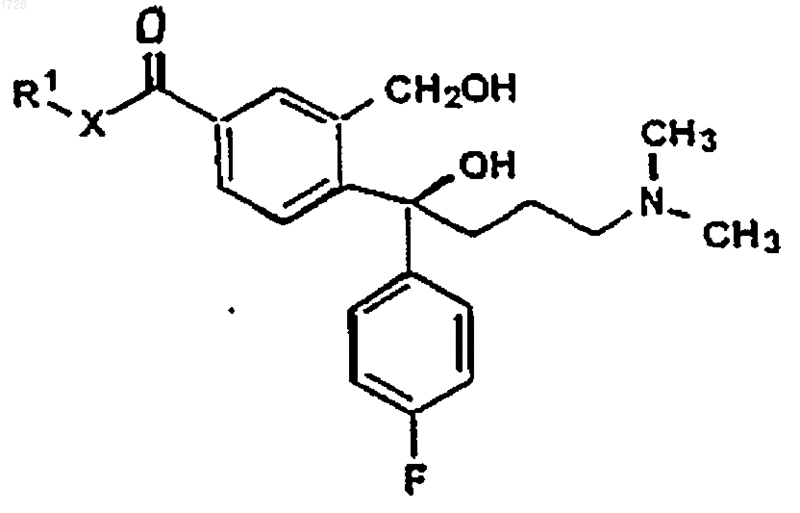
где R1 представляет C1-6алкил и Х представляет О или NH.
20. Промежуточное соединение для получения циталопрама, имеющее формулу VI
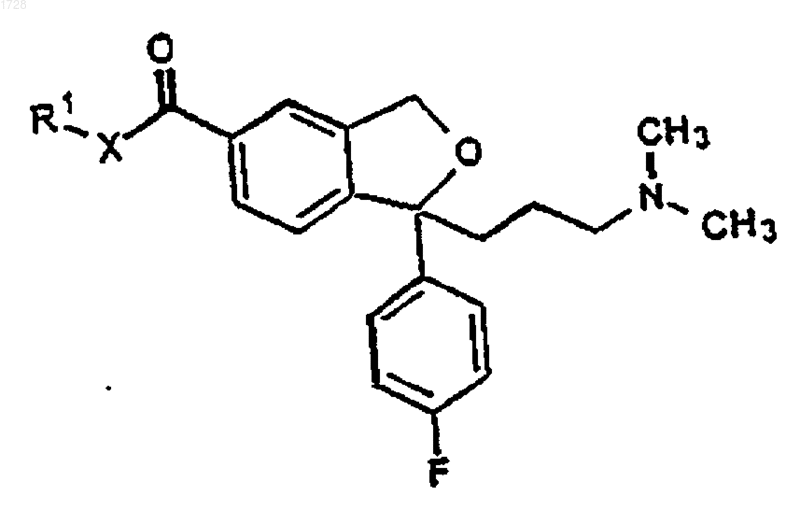
где R1 представляет C1-6алкил и Х представляет О или NH.
Текст
Настоящее изобретение относится к способу получения хорошо известного антидепрессанта лекарственного препарата циталопрама, 1[3-(диметиламино)пропил]-1-(4-фторфенил)-1,3 дигидро-5-изобензофуранкарбонитрила, и промежуточных продуктов, используемых в данном способе. Предпосылки создания изобретения Циталопрам представляет собой хорошо известное антидепрессионное лекарственное средство, которое представлено на рынке в течение нескольких лет и имеет следующую структуру: в присутствии дегидрирующего агента и последующей замены 5-бромгруппы с использованием цианида одновалентной меди. Исходное вещество формулы II получают из 5-бромфталида с использованием двух последовательных реакций Гриньяра, т.е. с 4-фторфенилмагнийхлоридом и N,N-диметиламинопропилмагнийхлоридом, соответственно. Новый и неожиданный способ и промежуточное соединение для получения циталопрама описан в патенте США 4650884, согласно которому промежуточное соединение формулы подвергают реакции замыкания кольца путем дегидратации концентрированной серной кислотой с получением циталопрама. Промежуточное соединение формулы III получали из 5-цианофталида, используя две последовательные реакции Гриньяра. т.е. с 4 фторфенилмагний галогенидом и N,N-диметиламинопропилмагний галогенидом, соответственно. Наконец, способы получения индивидуальных энантиомеров циталопрама раскрыты в патенте США 4943590, из которого также следует, что замыкание кольца в промежуточном соединении формулы III может быть осуществлено в основных условиях. В настоящий момент неожиданно было установлено, что циталопрам может быть получен удобным и безопасным способом с использованием обычных исходных веществ. Краткое изложение сущности изобретения Таким образом, настоящее изобретение относится к новому способу получения циталопрама, включающему стадии взаимодействия соединения формулы IV Он представляет собой спастически активный ингибитор обратного захвата серотонина(5-гидрокситриптамин; 5-НТ), обладающий вследствие этого антидепрессионной активностью. Антидепрессионная активность соединения была описана в нескольких публикациях,например, J. Hyttel, Prog. Neuro-Psychopharmacol.Biol. Psychiat, 1982, 6, 277-295 и A.Gravem, Acta Psychiatr. Scand., 1987, 75, 478-486. В дальнейшем было описано, что соединение показывает результаты при лечении старческого слабоумия и церебрально-сосудистых заболеваний, ЕР-А-474580. Циталопрам впервые был описан в патенте Германии DE 2657271, соответствующем патенту США 4136193. В данной патентной публикации описано получение циталопрама и в общих чертах представлен дальнейший способ, который может использоваться для получения циталопрама. Согласно описанному способу соответствующий 1-(4-фторфенил)-1,3-дигидро-5-изобензофуранкарбонитрил взаимодействует с 3-(N,Nдиметиламино)пропилхлоридом в присутствии метилсульфинилметида в качестве конденсирующего агента. Исходное вещество получали из соответствующего 5-бромпроизводного путем взаимодействия с цианидом одновалентной меди. В соответствии со способом, который был очерчен только в общих чертах, циталопрам может быть получен замыканием кольца в соединении 3 где R1 и Х являются такими, как определено выше, и реактивом Гриньяра 3-галоген-N,Nдиметилпропиламина, осуществления замыкания кольца в полученном соединении формулы где R1 и Х являются такими, как определено выше, и превращения полученного соединения формулы VI где R1 и Х являются такими, как определено выше, в соответствующее 5-цианопроизводное,т.е. циталопрам, который выделяют в виде основания или его фармацевтически приемлемой соли. В другом варианте настоящее изобретение относится к новым промежуточным соединениям формул IVa и V, соответственно. В еще одном варианте настоящее изобретение относится к новым промежуточным соединениям формулы VI. В описании и формуле изобретенияC1-6 алкил относится к разветвленной или неразветвленной алкильной группе, имеющей от одного до шести атомов углерода включительно,такой как метил, этил, 1-пропил, 2-пропил, 1 бутил, 2-бутил, 2-метил-2-пропил, 2,2-диметил 1-этил и 2-метил-1-пропил. Реактивы Гриньяра 4-галогенфторфенила,которые могут использоваться на первой стадии, представляют галогениды магния, такие как хлорид, бромид или иодид. Предпочтительно используют бромид магния. Реактивы Гриньяра 3-галоген-N,N-диметилпропиламина, которые могут использоваться, представляют собой галогениды магния, такие как хлорид, бромид или иодид, предпочтительно бромид магния. Промежуточное соединение формулы IVa может быть выделено или его можно не выделять. Предпочтительно две реакции осуществляют последовательно без выделения промежуточного продукта. Замыкание кольца в соединении формулыV осуществляют действием кислоты или через лабильный сложный эфир действием основания. Кислотное замыкание кольца осуществляют действием неорганической кислоты, такой как 4 серная или фосфорная кислота, или органической кислоты, такой как метилсульфоновая, птолуолсульфоновая или трифторуксусная кислота. Основное замыкание кольца осуществляют через лабильный сложный эфир, такой как метансульфоновый, п-толуолсульфоновый, 10 камфорсульфоновый, трифторуксусный или трифторметансульфоновый сложный эфир с добавлением основания, такого как триэтиламин, диметиланилин, пиридин и т.д. Взаимодействие проводят в инертном растворителе, предпочтительно при охлаждении, в частности, примерно при 0 С, и предпочтительно осуществляют как процесс в одном реакторе, т.е. этерификация и одновременное добавление основания. Когда Х представляет О, превращение группы R1-X-CO- в цианогруппу осуществляют через соответствующую амидную группу, которую затем превращают в цианогруппу таким же образом, что и в случае соединений формулыVI, где Х представляет NH. Реакцию превращения R1-X-CO- (X=O) в амид осуществляют гидролизом кислотой или основанием и последующим превращением в хлорангидрид кислоты и амидированием путем взаимодействия с аммиаком или алкиламином,предпочтительно трет-бутиламином. Кислотный гидролиз может быть осуществлен с использованием любой подходящей кислоты, такой какHBr, HCl, НВr/уксусная кислота. Основной гидролиз может быть осуществлен с помощью любого подходящего основания, такого как К 2 СО 3,NaOH, КОН и т.д. Превращение в амид также может быть проведено путем взаимодействия сложного эфира (Х=O) с аммиаком или алкиламином под давлением и при нагревании. Амид превращают в цианогруппу обычным нитрильным синтезом. Таким образом, полученный амид или амид формулы V, где Х представляет NH, предпочтительно превращают в цианосоединение, т.е. циталопрам, взаимодействием с дегидратирующим агентом, наиболее предпочтительно тионилхлоридом, пентахлоридом фосфора и т.д. Альтернативно, сложный эфир, т.е. соединение формулы VI, где Х представляет О, может быть гидролизовано и затем приведено во взаимодействие с хлорсульфонилизоцианатом для получения нитрила. Способ по изобретению можно проводить с выделением или без выделения промежуточных соединений. Способ по изобретению также может использоваться для получения (S)-энантиомера циталопрама. В таком случае соединение формулы V разделяют на оптически активные энантиомеры с использованием методики, аналогичной описанной в патенте США 4943590, получая таким образом (S)-энантиомер соединения формулы V, который используют в реакции замыкания кольца на стадии с). Соответственно,индивидуальные энантиомеры промежуточных 5 соединений формул V и VI, соответственно,охватываются общими структурными формулами. Другие условия реакций, растворители и т.д. представляют собой обычные условия для таких реакций и легко могут быть определены специалистом в данной области. Исходные вещества формулы IV являются коммерчески доступными или могут быть получены из 5-карбоксифталида взаимодействием с тионилхлоридом и затем с C1-6 алканолом илиC1-6 алкиламином. 5-Карбоксифталид коммерчески доступен и может быть получен хорошо известными способами (Tirouflet J., Bull. Soc.Sci. Bretagne 26, 1959, 35). В одном из вариантов изобретения Х представляет О, и R1 представляет этил, пропил или бутил, предпочтительно этил, 2-пропил или трет-бутил. В другом варианте изобретения Х представляет NH, и R1 представляет этил, пропил или бутил, предпочтительно этил, 2-пропил или трет-бутил, наиболее предпочтительно третбутил. Соединение общей формулы I можно использовать в виде свободного основания или в виде его фармацевтически приемлемой кислотно-аддитивной соли. В качестве кислотноаддитивных солей могут использоваться соли,образованные органическими или неорганическими кислотами. Примерами таких органических солей являются соли с малеиновой, фумаровой, бензойной, аскорбиновой, янтарной, щавелевой, бисметиленсалициловой, метансульфоновой, этандисульфоновой, уксусной, пропионовой, винной, салициловой, лимонной,глюконовой, молочной, яблочной, миндальной,коричной, цитраконовой, аспаргиновой, стеариновой, пальмитиновой, итаконовой, гликолевой,п-аминобензойной, глютамовой, бензолсульфоновой и теофиллинуксусной кислотами, а также 8-галогентеофиллинами, например, 8-бромтеофиллином. Примерами таких неорганических солей являются соли с хлор-водородной, бромводородной, серной, сульфамовой, фосфорной и азотной кислотами. Кислотно-аддитивные соли соединений могут быть получены известными в данной области способами. Основание взаимодействует или с расчетным количеством кислоты в растворителе, смешивающемся с водой, таком как ацетон или этанол, с последующим выделением соли путем концентрирования и охлаждения,или с избытком кислоты в несмешивающемся с водой растворителе, таком как этиловый простой эфир, этилацетат или дихлорметан, с самопроизвольным выделением соли. Фармацевтические композиции на основе циталопрама могут вводиться любым подходящим способом и в любой подходящей форме,например, перорально в виде таблеток, капсул,порошков или сиропов или парентерально в 6 виде обычных стерильных растворов для инъекций. Фармацевтические препаративные формы композиций на основе циталопрама могут быть получены обычными способами, известными в данной области. Например, таблетки могут быть получены смешиванием активного ингредиента с обычными адъювантами и/или разбавителями и последующим прессованием смеси с использованием обычной таблетировочной машины. Примеры адъювантов или разбавителей включают: кукурузный крахмал, картофельный крахмал, тальк, стеарат магния, желатин, лактозу, камеди и подобное. Могут использоваться любой другой адъювант или дополнительные красители, ароматизаторы, консерванты и т.д. при условии, что они совместимы с активными ингредиентами. Растворы для инъекций могут быть получены растворением активного ингредиента и возможных добавок в части раствора для инъекции, предпочтительно стерильной воде, доведения раствора до требуемого объема, стерилизации раствора и заполнения подходящих ампул или пузырьков. Могут быть добавлены любые подходящие добавки, обычно используемые в технике, такие как тонизирующие агенты, консерванты, антиоксиданты и т.д. Примеры Пример 1. 5-трет-Бутоксикарбонилфталид. 5-Карбоксифталид (100 г, 0,56 моль) суспендируют в пиридине (1200 мл). Добавляют птолуолсульфонилхлорид (211 г, 1,12 моль) и смесь перемешивают в течение 30 мин при комнатной температуре. Добавляют трет-бутанол(54 г, 0,73 моль) и реакционную смесь оставляют при комнатной температуре и активном перемешивании на 3 дня. Прозрачный раствор выливают в ледяную воду и выпавшие в осадок кристаллы отфильтровывают. Продукт перекристаллизовывают из 2-пропанола (500 мл). Выход: 123 г, 94%. ДСК начало: 151,5 С. Пример 2. 5-(2-Пропилоксикарбонил)фталид. Способ А). 5-Карбоксифталид (36 г, 0,2 моль) суспендируют в тионилхлориде (100 мл). Добавляют ДМФ (1,5 мл) и смесь кипятят с обратным холодильником в течение 1 ч. Добавляют толуол (200 мл) и растворители упаривают в вакууме. Добавляют 2-пропанол (200 мл) и смесь кипятят с обратным холодильником в течение 30 мин. После охлаждения до 0 С кристаллы отфильтровывают и промывают холодным 2-пропанолом (50 мл). Выход: 38 г, 87%. ДСК начало: 144 С. Способ В). 5-Этоксикарбонилфталид (52 г,0,25 моль) суспендируют в 2-пропаноле (1000 мл). Добавляют Ti(iPrO)4 (38 г, 0,14 моль) и смесь кипятят с обратным холодильником в течение 3 ч. Реакционную смесь охлаждают до 0 С, кристаллы отфильтровывают и промывают(200 мл) и растворители упаривают в вакууме. Остаток растворяют в ТГФ (200 мл) и добавляют к раствору трет-бутиламина (31 г, 0,42 моль) в ТГФ (200 мл) при 5 С. Смесь оставляют нагреваться до комнатной температуры и перемешивают в течение ночи, затем реакционную смесь выливают в ледяную воду и выпавшие в осадок кристаллы отфильтровывают. Кристаллы промывают водой (100 мл). Выход 41 г, 87%. ДСК начало: 189,5 С. Пример 4. Оксалат трет-бутил 1-(3 диметиламинопропил)-1-(4-фторфенил)-1,3 дигидроизобензофуран-5-карбоксилата. Раствор 4-фторфенилмагний бромида, полученного из 4-фторбромбензола (31,5 г, 0,18 моль) и магниевой стружки (5,1 г, 0,21 моль) в сухом ТГФ (150 мл), добавляют по каплям к суспензии 5-трет-бутоксикарбонилфталида (35,1 г, 0,15 моль) в сухом ТГФ (150 мл). Температуру поддерживают ниже 5 С. После завершения прибавления реакционную смесь перемешивают в течение 3 ч при комнатной температуре. Раствор второго реактива Гриньяра, полученного из 3-диметиламинопропилхлорида(21,9 г, 0,18 моль) и магниевой стружки (5,1 г,0,21 моль) в сухом ТГФ (150 мл), добавляют к реакционной смеси. Во время прибавления температуру поддерживают ниже 10 С. Реакционную смесь оставляют на ночь при комнатной температуре при перемешивании. Реакционную смесь выливают в ледяную воду (300 мл) и насыщенный раствор хлорида аммония (100 мл). ТГФ упаривают в вакууме. Добавляют этилацетат (300 мл), органическую фазу отделяют и промывают водой (2100 мл) и насыщенным солевым раствором. Органическую фазу экстрагируют 2 М НСl (2100 мл) . К водной фазе добавляют 4 М NaOH (100 мл) для получения конечного значения рН 9 или выше. Водный слой экстрагируют этилацетатом (400 мл) и органическую фазу промывают водой (100 мл), насыщенным солевым раствором (50 мл) и сушат над MgSO4 (20 г). К органической фазе добавляют триэтиламин (45,5 г, 0,45 моль) и раствор охлаждают до 5 С. Добавляют по каплям метансульфонилхлорид (19,5 г, 0,17 моль) в этилацетате (100 мл) и после прибавления реакционную смесь оставляют для перемешивания на один час. Реакционную смесь промывают 0,1 М NaOH (2100 мл), органическую фазу сушат (MgSO4, 10 г) и растворитель упаривают в вакууме. Полученное таким образом вещество (15 г указанного в заголовке соединения в виде свободного основа 001728 8 ния) растворяют в ацетоне (120 мл) и обрабатывают безводной щавелевой кислотой (13,5 г,0,15 моль), растворенной в ацетоне (120 мл). Смесь оставляют на ночь при комнатной температуре и выпавший в осадок оксалат отфильтровывают. Выход: 34 г, 43%. ДСК начало: 172 С. 1C26H32N1F1O7; С, 63,78; Н, 6,60; N, 2,86. Найдено С, 63,95; Н, 6,51; N, 3,14. Аналогичным образом получали следующие соединения из 5-(2-пропилоксикарбонил) фталида и 5-(этоксикарбонил)фталида, соответственно. Оксалат 2-пропил 1-(3-диметиламинопропил)-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбоксилата. Выход: 20 г (42%) из ацетона. ДСК начало: 79 С. 1(2 Н, т, J=10 Гц), 2,64 (6 Н, с), 3,00 (2 Н, т, J=10 Гц), 4,39 (2 Н, к, J=7,5 Гц), 5,15 (1 Н, д, J=12,5 Гц), 5,23 (1 Н, д, J=12,5 Гц), 7,15 (2 Н, т, J=8,5 Гц), 7,58 (2 Н, дт, J=1,2 Гц, J=8,5 Гц), 7,65 (1 Н, д,J=8,5 Гц), 7,89 (1 Н, с), 8,92 (1 Н, д, J=8,5 Гц). Элементный анализ. Вычислено для С 26H32NF1O7, 1,5 H2O; С, 59,00; Н, 6,40; N, 2,86. Найдено С, 58,99; Н, 5,93; N, 2,92. Пример 5. Оксалат (5-трет-бутилкарбамил)-1-(3-диметиламинопропил)-1-(4-фторфенил)-1,3-дигидроизобензофурана. Раствор 4-фторфенилмагний бромида, полученного из 4-фторбромбензола (42 г, 0,24 моль) и магниевой стружки (7 г, 0,29 моль) в сухом ТГФ (120 мл), добавляют по каплям к суспензии 5-трет-бутилкарбамилфталида (23,3 г,0,1 моль) в сухом ТГФ (120 мл). Температуру поддерживают ниже 5 С. После завершения прибавления реакционную смесь перемешивают в течение 3 ч при комнатной температуре. Раствор второго реактива Гриньяра, полученного из 3-диметиламинопропилхлорида (14,6 9 г, 0,12 моль) и магниевой стружки (3,4 г, 0,14 моль) в сухом ТГФ (100 мл), добавляют к реакционной смеси. Во время прибавления температуру поддерживают ниже 10 С. Реакцию оставляют на ночь при комнатной температуре при перемешивании. Реакционную смесь выливают в ледяную воду (250 мл) и насыщенный раствор хлорида аммония (100 мл). ТГФ упаривают в вакууме. Добавляют этилацетат, органическую фазу отделяют и промывают водой (2100 мл) и насыщенным солевым раствором (50 мл). Органическую фазу экстрагируют 2 М НСl (2100 мл). К водной фазе добавляют 4 М NaOH (100 мл) для достижения конечного значения рН 9 или выше. Водный слой экстрагируют этилацетатом(400 мл) и органическую фазу промывают водой(100 мл), насыщенным солевым раствором (50 мл) и сушат над МgSO4 (20 г). К органической фазе добавляют триэтиламин (45,5 г, 0,45 моль) и раствор охлаждают до 5 С. Добавляют по каплям метансульфонилхлорид (19,5 г, 0,17 моль) в этилацетате (100 мл) и после прибавления реакционную смесь оставляют на один час при перемешивании. Реакционную смесь промывают 0,1 М NaOH (2100 мл) и органическую фазу сушат (MgSO4, 10 г) и растворитель упаривают в вакууме. Полученное таким образом вещество (15 г указанного в заголовке соединения в виде свободного основания) растворяют в ацетоне (100 мл) и обрабатывают безводной щавелевой кислотой (10 г, 0,11 моль), растворенной в ацетоне (100 мл). Смесь оставляют при комнатной температуре при перемешивании в течение 3 дней и выпавший в осадок оксалат отфильтровывают. Выход: 7 г, 14%. ДСК начало: 167 С. 1C26H32N1F1O7; С, 63,91; Н, 6,82; N, 5,73. Найдено С, 63,53; Н, 6,82; N, 5,81. Пример 6. Оксалат 1-(3-диметиламинопропил)-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрила. Способ А). Оксалат трет-бутил 1-(3 диметиламинопропил)-1-(4-фторфенил)-1,3 дигидроизобензофуран-5-карбоксилата (20 г,0,048 моль) растворяют в уксусной кислоте (100 мл). Добавляют НВr (20 мл, 33% в АсОН) и оставляют при перемешивании на 10 мин. Растворители удаляют в вакууме и остаток упаривают совместно с толуолом (100 мл). Остаток растворяют в толуоле (80 мл), добавляют тионилхлорид (80 мл), ДМФ (1 мл) и смесь кипятят с обратным холодильником в течение 1 ч. Растворители удаляют в вакууме и остаток растворяют в 10 этилацетате (100 мл). Смешивают NH4OH (100 мл, 25% в воде) и лед (100 г), добавляют в этилацетатный раствор и оставляют при интенсивном перемешивании на 30 мин. Органическую фазу промывают водой (50 мл) и насыщенным солевым раствором (20 мл) и сушат над МgSO4(10 г). Растворители упаривают в вакууме и остаток растворяют в тионилхлориде (40 мл) и кипятят с обратным холодильником в течение 2 ч. Добавляют толуол (100 мл) и растворители упаривают в вакууме. Добавляют толуол и органическую фазу промывают 2 М NaOH (100 мл) и водой (50 мл). Растворители удаляют в вакууме. Полученный таким образом продукт очищают флэш-хроматографией, получая в виде масла указанное в заголовке соединение в виде свободного основания. Соль щавелевой кислоты кристаллизуют из ацетона. Выход: 9,0 г (43%). ДСК начало: 156 С. 1C22H23N2F1O5; С, 63,75; Н, 5,60; N, 6,76. Найдено С, 63,12; Н, 6,59; N, 6,66. Способ В). Оксалат 5-(трет-бутилкарбамил)-1-(3-диметиламинопропил)-1-(4-фторфенил)-1,3-дигидроизобензофурана (1 г, 0,002 моль) растворяют в тионилхлориде (10 мл) и смесь кипятят с обратным холодильником в течение 2 ч. Добавляют толуол (10 мл) и растворители удаляют в вакууме. Остаток растворяют в этилацетате (15 мл). Смешивают NH4OH (5 мл, 25% в воде) и лед (5 г), добавляют в этилацетатный раствор и разделяют фазы. Органическую фазу промывают водой (10 мл) и сушат над МgSO4. После удаления растворителя в вакууме указанное в заголовке соединение кристаллизуют из ацетона. Выход 0,66 г, 78%. ДСК начало: 156 С. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения циталопрама, включающий стадии взаимодействия соединения формулы IV где R1 представляет C1-6 алкил и Х представляет О или NH, последовательно с реактивом Гриньяра, полученным из 4-галогенфторфенила, с получением соединения формулы IVa где R1 и Х являются такими, как определено выше, и реактивом Гриньяра, полученным из 3 галоген-N,N-диметилпропиламина, циклизации полученного соединения формулы V где R1 и Х являются такими, как определено выше, и превращения полученного соединения формулы VI где R1 и Х являются такими, как определено выше, в циталопрам, который выделяют в виде основания или его фармацевтически приемлемой соли. 2. Способ по п.1, в котором Х представляет О. 3. Способ по п.1, в котором Х представляетNH. 4. Способ по п.2 или 3, в котором R1 представляет этил, пропил или бутил, предпочтительно этил, 2-пропил или трет-бутил, наиболее предпочтительно трет-бутил. 5. Способ по пп.1-4, в котором используемый реактив Гриньяра представляет галогенид магния, предпочтительно хлорид, бромид или иодид. 6. Способ по п.5, в котором используемый на первой стадии реактив Гриньяра представляет соль бромида магния. 7. Способ по п.5, в котором используемый на второй стадии реактив Гриньяра представляет хлорид магния. 8. Способ по любому из пп.1-7, в котором циклизацию соединения формулы V осуществляют путем кислотного замыкания кольца действием неорганической кислоты, такой как серная или фосфорная кислота, или органической кислоты, такой как метилсульфоновая, птолуолсульфоновая или трифторуксусная кислота. 9. Способ по любому из пп.1-6, в котором циклизацию соединения формулы V осуществ 001728 12 ляют путем основного замыкания кольца через лабильный сложный эфир предпочтительно с одновременной этерификацией и добавлением основания. 10. Способ по п.9, в котором лабильный сложный эфир представляет метансульфоновый,п-толуолсульфоновый, 10-камфорсульфоновый,трифторуксусный или трифторметансульфоновый сложный эфир и основание представляет триэтиламин, диметиланилин или пиридин. 11. Способ по п.2, в котором Х представляет О и превращение группы R1-X-CO- в циано осуществляют через соответствующую амидную группу. 12. Способ по п.11, в котором реакцию превращения R1-X-CO- в амид осуществляют гидролизом кислотой или основанием, последующим превращением в хлорангидрид кислоты и амидированием путем взаимодействия с аммиаком или алкиламином, предпочтительно трет-бутиламином. 13. Способ по п.12, в котором гидролиз осуществляют, используя подходящую кислоту,такую как HBr, HCl, НВr/уксусная кислота. 14. Способ по п.12, в котором гидролиз осуществляют, используя подходящее основание, предпочтительно K2CO3, NaOH или KOH. 15. Способ по п.9, в котором реакцию превращения R1-Х-СО- в амид осуществляют путем взаимодействия сложного эфира с аммиаком или алкиламином под давлением и при нагревании. 16. Способ по любому из пп.11-14, в котором амид превращают в цианогруппу взаимодействием с дегидратирующим агентом, предпочтительно тионилхлоридом или пентахлоридом фосфора. 17. Способ по любому из пп.1-16, отличающийся тем, что соединение формулы V перед его использованием в реакции циклизации разделяют на оптически активные энантиомеры,получая таким образом (S)-энантиомер. 18. Промежуточное соединение для получения циталопрама, имеющее формулу IVa где R1 представляет C1-6 алкил и Х представляет О или NH. 19. Промежуточное соединение для получения циталопрама, имеющее формулу V где R1 представляет C1-6 алкил и Х представляет О или NH. 20. Промежуточное соединение для получения циталопрама, имеющее формулу VI
МПК / Метки
МПК: A61K 31/343, C07D 307/87
Метки: циталопрама, способ, получения
Код ссылки
<a href="https://eas.patents.su/8-1728-sposob-polucheniya-citaloprama.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения циталопрама</a>
Предыдущий патент: Кабель с покрытием, стойким к ударным нагрузкам
Следующий патент: Резьбовое соединение металлических труб для коррозионной текучей среды
Случайный патент: Способ расчета электронных транзакций и способ выполнения электронных транзакций с использованием телефона












