Новые композиции на основе таксоидов
Формула / Реферат
1. Композиция для инъекций, отличающаяся тем, что она находится в форме эмульсии, содержащей производные класса таксанов, состоящая из эмульсии на основе фармацевтически приемлемого масла в воде и лецитиновой композиции, в которой растворен таксан, отвечающий следующей общей формуле (I) или (II):
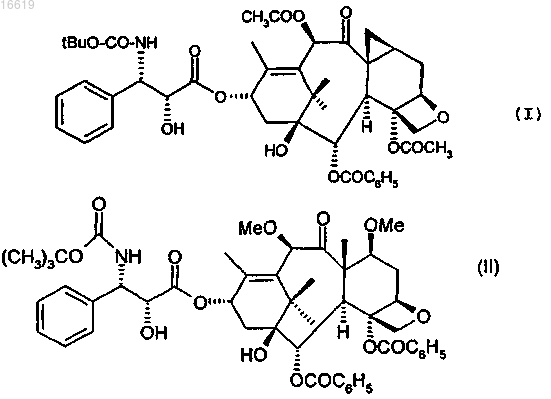
причем композиция дополнительно содержит анионное поверхностно-активное вещество.
2. Композиция по п.1, отличающаяся тем, что фармацевтически приемлемые масла выбраны из смесей соевого масла и триглицеридов с цепями средней длины.
3. Композиция по п.1, отличающаяся тем, что лецитин представляет собой природный лецитин, выбираемый из яичного или соевого лицитина, или полусинтетический лецитин, выбираемый из фосфатидилхолинов.
4. Композиция по п.1, отличающаяся тем, что анионным поверхностно-активным веществом является фосфатидилглицерин или фосфатидиновая кислота.
5. Композиция по п.4, отличающаяся тем, что фосфатидилглицерин выбран из дилауроилфосфатидилглицерина (DLPG), димиристоилфосфатидилглицерина (DMPG) или дипальмитоилфосфатидилглицерина (DPPG).
6. Композиция по п.4, отличающаяся тем, что фосфатидиновая кислота выбрана из натриевых солей дилауроилглицерофосфатидиновой кислоты (DLPA), димиристоилглицерофосфатидиновой кислоты (DMPA) или дипальмитоилглицерофосфатидиновой кислоты (DPPA).
7. Композиция по п.1, отличающаяся тем, что массовое соотношение между фосфатидилхолином или лецитином и фосфатидилглицерином или фосфатидиновой кислотой составляет преимущественно величину от 500 до 3.
8. Композиция по п.7, отличающаяся тем, что массовое соотношение предпочтительно составляет величину от 100 до 10.
9. Композиция по п.1, отличающаяся тем, что рН состава доводят до величины 3-7 путем добавления кислоты.
10. Композиция по п.9, отличающаяся тем, что кислота выбрана из соляной, лимонной или аскорбиновой кислот.
11. Композиция по п.1, отличающаяся тем, что добавляют гистидиновый буфер.
12. Композиция по п.1, отличающаяся тем, что изотоничность раствора достигается путем добавления глицерина.
13. Композиция по п.1, отличающаяся тем, что массовый состав композиции находится в следующих пределах:

14. Композиция по одному из пп.1-13, отличающаяся тем, что ее вводят путем внутривенной инъекции в виде болюса.
15. Композиция по одному из пп.1-14, отличающаяся тем, что частицы имеют размер от 100 нм до 1 мкм.
16. Способ получения композиции по одному из пп.1-15, отличающийся тем, что эмульсию получают с помощью аппарата микрофлюидизации или гомогенизатора высокого давления.
Текст
НОВЫЕ КОМПОЗИЦИИ НА ОСНОВЕ ТАКСОИДОВ Настоящее изобретение относится к новым композициям на основе таксоидов, представляющим собой инъецируемые составы этих производных в форме эмульсии. Эти составы предназначены для непосредственного внутривенного вливания. 016619 Настоящее изобретение относится к новой фармацевтической форме на основе терапевтического агента, обладающего противоопухолевой и противолейкемической активностью. Более конкретно, оно относится к новой форме для инъекций, содержащей производное следующей общей формулы (I): или производное следующей формулы (II): Соединение формулы (I) более известно под общим международным наименованием ларотаксел, в настоящее время оно проходит клинические испытания и известно под аббревиатурой XRP9881. Соединение общей формулы (II) также в настоящее время проходит клинические испытания и известно под наименованием XRP6258. Эти продукты проявляют высокую активность in vivo по отношению к злокачественным опухолям,что позволяет их исследовать при заболеваниях, резистентных к другим противораковым методам лечения. К сожалению, этот вид продукта, в частности доцетаксел или паклитаксел, имеет настолько низкую растворимость в воде, что состав для инъекций приходится готовить на основе поверхностно-активного вещества и этанола. Этанол является наилучшим растворителем для молекул, отвечающих как формуле(I), так и формуле (II). Такие составы описаны, например, в патенте ЕР 0593656 или в публикации, о которой говорится ниже. Например, согласно публикации Rowinsky, Lorraine, Cazenave et Donehower, напечатанной в National Cancer Institute, vol. 82, No 15, cc. 1247-1259 1 августа 1990 г. и относящейся к таксолу, имеющему сходную растворимость с соединениями формулы (I) или (II), готовят первый раствор, называемый маточный раствор, содержащий около 6 мг/мл таксола в растворяющей смеси, состоящей из 50 об.% этанола и 50 об.% полиоксиэтилированного касторового масла (например, Cremophor EL). Согласно этой же публикации для достижения заданных концентраций (между 0,3 и 1 мг/мл) необходимо инъецировать растворы, содержащие наряду с активным началом определенные концентрации каждого из соединений, таких как этанол и особенно Cremophor, в количестве около 8 г на 100 перфузионного раствора. Поскольку лечение часто требует введения высоких доз активного начала, а концентрация активного начала в растворе невелика, то в процессе лечения высокообъемные вливания приводят помимо анафилактических проявлений к явлениям этилизма. Согласно европейскому патенту ЕР 0593601 выяснилось, что использование различных фармацевтических форм позволяет либо значительно снизить концентрации этанола, либо полностью исключитьCremophor и этанол из перфузионных растворов. Для этого готовили маточный раствор, содержащий активное начало в смеси растворителей, состоящей из этанола, который считается наилучшим биосовместимым растворителем активных начал класса таксанов, и поверхностно-активного вещества, выбранного из полисорбатов, выпускаемых, в частности, под наименованиями Tween и Montanox, или сложных/простых эфиров этиленоксида и глицеридов жирных кислот (гидрированное или не гидрированное касторовое масло), выпускаемых, например,под наименованием Cremophor или Emulphor. Маточный раствор с низким содержанием этанола содержит предпочтительно менее 5% этанола,более предпочтительно менее 2% этанола. Этот раствор является стабильным и поэтому может содержать до 200 мг/мл, предпочтительно до 80 мг/мл активного начала в поверхностно-активном веществе. Согласно этому изобретению маточный раствор паклитаксела имеет концентрацию 6-20 мг/мл активного начала в поверхностно-активном веществе. Маточный раствор доцетаксела имеет концентрацию 20-80 мг/мл активного начала в поверхностно-активном веществе. Эти растворы в поверхностно-активном веществе, необязательно содержащие небольшие количества этанола, могут быть растворены в перфузионном растворе, но при условии очень сильного перемешивания, например, с помощью аппарата типа Vortex. Изобретение, описанное в патенте ЕР 0671912, позволяет решить задачи, не решенные в указанном выше патенте, и заключается оно в приготовлении раствора, являющегося промежуточным между рас-1 016619 твором производных класса таксанов в поверхностно-активном веществе и водным раствором, содержащим добавку, способствующую в дальнейшем растворению указанного промежуточного раствора в перфузионном растворе. Эти добавки выбирают из числа тех, которые способны раздробить или устранить образование гелеобразной фазы, которая образуется между эмульгатором, содержащим производное класса таксанов, и водой. Среди добавок, способных раздробить или устранять образование этой гелеобразной фазы, примерами были подтверждены этанол,глюкоза,глицерин,пропиленгликоль,глицин,сорбит,маннит,бензиловый спирт,полиэтиленгликоли. Перфузионные растворы доцетаксела или паклитаксела вводили людям со скоростью, которую предварительно определяли в зависимости от количества активного начала, необходимого для инъекционного введения. При использовании всех составов известного уровня техники наблюдались явления анафилактического шока, выраженные более или менее умеренно, но эти явления всегда предупреждались введением перед перфузией антигистаминного агента и/или кортикоидов. Среди растворов, разработанных в последнее время, способных устранять эти анафилактические проявления, появились составы, в которых таксоид заключен в капсулу на основе альбумина. Этот раствор устраняет появление анафилактических шоков и, следовательно, устраняет необходимость предварительного введения антигистаминных агентов и/или кортикоидов и позволяет вводить более высокие дозы активного вещества при снижении побочных эффектов по сравнению с растворами известного уровня техники. Такой состав описан, например, в патенте US 6537579. Заявка на патент US 2003/0099674 относится к лиофилизованным композициям, состоящим из таксоида, солюбилизированного в капле масла, инкапсулированной поверхностно-активным веществом. Этот лиофилизованный состав не коллапсирует и не разрушается во время хранения. Указанное масло содержит триглицериды с цепями средней длины (Miglyol 812N или МСТ) и соевое масло в числе многих других масел. На стр. 7 [0072] написано, что эти лиофилизаты менее подвержены потерям в отношении устойчивости и разрушения, чем жидкие эмульсии. Также отмечается [0089], что эмульсию в процессе ее получения необходимо подвергать лиофилизации на протяжении некоторых часов или минут, и на восстановление лиофилизата также требуется затратить часы или минуты. Среди примеров в табл. 2 описаны растворы паклитаксела в масле с лецитином, эти растворы показали хорошую устойчивость при ТА (комнатной температуре) в течение одного месяца при использовании масла Miglyol и соевого масла. Описан также раствор, содержащий воду с кунжутным маслом. Из растворов, полученных растворением лиофилизата, описаны только те, которые проявили стабильность при -20 С в течение 1 месяца. Эти условия стабильности не дают никаких преимуществ перед растворами, описанными в первых названных патентах с точки зрения их стабильности, поскольку целью настоящего изобретения является получение составов, готовых к употреблению и стабильных в течение по крайней мере одного года при комнатной температуре. На сегодняшний день продолжаются поиски составов, позволяющих вводить удовлетворительные дозы агентов класса таксоидов и одновременно исключить использование поверхностно-активных веществ типа полиоксиэтилированного касторового масла или полисорбатов, но в которых таксоиды были бы стабильными при комнатной температуре и находились в жидкой форме, позволяющей их смешивание с перфузионным раствором без проявления физического явления, ведущего к разделению фаз, т.е. либо к осаждению, либо к отделению жидкой фазы. Кроме того, нужны составы, которые вводились бы в виде болюса, не прибегая к перфузиям. Кроме того, разрабатываемые составы должны обеспечить стабильность продукта при комнатной температуре в течение времени и не должны допускать разрушение таксоида, например, под действием гидролиза. Настоящее изобретение позволяет достичь указанных целей и относится к таксоидсодержащей эмульсии на основе фармацевтически приемлемого масла в воде, включающей лецитин или полусинтетический фосфолипид. Среди фармацевтически приемлемых масел можно назвать соевое масло, используемое индивидуально, или триглицериды с цепью средней длины (С 8-С 10), такие как Miglyol или МСТ, используемые индивидуально, или же предпочтительно можно использовать смесь соевого масла и МСТ. В частности, массовое соотношение соевого масла и триглицерида составляет 1:1.-2 016619 Эмульсию создают введением соевого или яичного лецитина, предпочтительно яичного лецитина,такого как лецитин, выпускаемый в продажу под наименованием Lipoid E80, или предпочтительным введением фосфатидилхолина, который представляет собой цвиттерионный поверхностно-активный агент. Эмульсия обладает прекрасной физической стабильностью, если лецитин или фосфатидилхолин ассоциирован с анионным фосфолипидом, выбранным, в частности, из фосфатидилглицеринов или фосфатидиновых кислот. Среди фосфатидилглицеринов можно назвать дилауроилфосфатидилглицерин (DLPG), димиристоилфосфатидилглицерин (DMPG) или же дипальмитоилфосфатидилглицерин (DPPG). Среди фосфатидиновых кислот можно назвать натриевые соли дилауроилглицерофосфатидиновой кислоты (DLPA), димиристоилглицерофосфатидиновой кислоты (DMPA) или дипальмитоилглицерофосфатидиновой кислоты(DPPA). Массовое соотношение между, соответственно, лицитином или фосфатидилхолином и фосфатидилглицерином или фосфатидиновой кислотой составляет предпочтительно величину от 500 до 3, более предпочтительно от 100 до 10. Из всех анионных фосфолипидов предпочитают дилауроилфосфатидилглицерин. Величина рН состава может находиться в диапазоне от 3 до 7 и регулируется добавлением кислоты. Предпочтительно используют буфер для поддержания рН в указанном диапазоне, в который введена или не введена кислота. Буфером предпочтительно является гистидиновый буфер. Предпочитают использовать от 5 до 50 мМ гистидина в растворе. Кислоту выбирают предпочтительно из соляной, лимонной или аскорбиновой кислоты. Изотоничность раствора может достигаться добавлением глицерина. Для облегчения применения препарата можно использовать 0-2% этанола. Предпочтительно массовый состав композиции может находиться в следующих пределах: масляная фаза - 10-30%,лецитин или фосфатидилхолин - 0,6-5%,фосфатидилглицерин - 0,01-0,2%,глицерин - 0-2,5%,этанол - 0-2%,вода - до 100%. Получение эмульсии осуществляют предпочтительно с помощью аппарата для микрофлюидизации или гомогенизатора высокого давления для того, чтобы получить капельки размером от 100 нм до 1 мкм,предпочтительно от 100 до 500 нм. Более конкретно предпочитают составы, в которых средний размер капелек составляет 150-350 нм. Создают инертную среду в конечном составе предпочтительно с помощью азота или инертного газа, не содержащего кислород. Концентрации активного начала формулы (I) или формулы (II) составляют менее 10 мг/мл, в частности используются концентрации от 0,5 до 6 мг/мл, предпочтительно около 4 мг/мл. Более подробно изобретение будет описано с помощью примеров, которые не ограничивают изобретение. Пример 1. 1 г DPPC и 0,03 г DLPG солюбилизируют при 60 С в смеси МСТ (10 г), соевого масла (10 г) и этанола (0,4 г). 0,4 г соединения формулы (I) растворяют в полученном выше прозрачном растворе. 2,5 г глицерина добавляют при перемешивании к 75,7 г 10 мМ гистидинового водного буфера до получения гомогенной смеси. К масляной фазе добавляют водную фазу и смесь гомогенизируют в измельчителе (Ultraturrax), а затем в микрофлюидизаторе (11 циклов при 11000 пси). Полученный размер капелек составляет около 250 нм. Пример 2. 1 г DPPC и 0,03 г DLPG солюбилизируют при 60 С в смеси МСТ (10 г), соевого масла (10 г) и этанола (2 г). 0,4 г соединения формулы (I) растворяют в полученном выше прозрачном растворе. 2,5 г глицерина добавляют при перемешивании к 75,7 г 10 мМ гистидинового водного буфера с рН,доведенным до 6 (HCl), до получения гомогенной смеси. К масляной фазе добавляют водную фазу и смесь гомогенизируют в измельчителе (Ultraturrax), а затем в микрофлюидизаторе (11 циклов при 11000 пси). Полученный размер капелек составляет около 280 нм. Пример 3. 1,2 г Lipod E80 и 0,03 г DLPG солюбилизируют при 60 С в смеси МСТ (10 г) и соевого масла (10 г). 0,4 г соединения формулы (I XRP9881) растворяют в полученном выше прозрачном растворе. 2,5 г глицерина добавляют при перемешивании к 75,7 г 10 мМ гистидинового водного буфера до получения гомогенной смеси.-3 016619 К масляной фазе добавляют водную фазу и смесь гомогенизируют в измельчителе (Ultraturrax), а затем в микрофлюидизаторе (11 циклов при 11000 пси). Полученный размер капелек составляет около 140 нм (Dv [диаметр визикул] 50). Физическая стабильность раствора 1 месяц при 60 С: размер частиц не изменился (Dv 50 и Dv 90). Пример 4. 1,2 г Lipod E80 и 0,03 г DLPG солюбилизируют при 60 С в смеси МСТ (10 г) и соевого масла (10 г). 0,4 г соединения формулы (I XRP9881) растворяют в полученном выше прозрачном растворе. 2,5 г глицерина добавляют при перемешивании к 75,7 г 10 мМ гистидинового водного буфера с рН,доведенным до 6 (HCl), до получения гомогенной смеси. К масляной фазе добавляют водную фазу и смесь гомогенизируют в измельчителе (Ultraturrax), а затем в микрофлюидизаторе (11 циклов при 11000 пси). Полученный размер капелек составляет около 140 нм (Dv 50). Физическая стабильность раствора 1 месяц при 60 С: размер частиц не изменился (Dv 50 и Dv 90). Пример 5. 1 г DPPC и 0,03 г DLPG солюбилизируют при 60 С в смеси МСТ (10 г), соевого масла (10 г) и этанола (0,4 г). 0,4 г соединения формулы (I XRP9881) растворяют в полученном выше прозрачном растворе. 2,5 г глицерина добавляют при перемешивании к 75,7 г 10 мМ гистидинового водного буфера с рН,доведенным до 6 (HCl), до получения гомогенной смеси. К масляной фазе добавляют водную фазу и смесь гомогенизируют в измельчителе (Ultraturrax), а затем в микрофлюидизаторе (11 циклов при 11000 пси). Полученный размер капелек составляет около 280 нм (Dv 50). Физическая стабильность раствора 1 месяц при 60 С: размер частиц не изменился (Dv 50 и Dv 90). Пример 6. 1,2 г Lipod E80 и 0,03 г DLPG солюбилизируют при 60 С в смеси МСТ (10 г) и соевого масла (10 г). 0,4 г соединения формулы (I XRP9881) растворяют в полученном выше прозрачном растворе. 2,5 г глицерина добавляют при перемешивании к 75,7 г воды PPI до получения гомогенной смеси. К масляной фазе добавляют водную фазу и смесь гомогенизируют в измельчителе (Ultraturrax), а затем в микрофлюидизаторе (11 циклов при 11000 пси). Средний размер полученных капелек составляет около 140 нм (Dv 50). Физическая стабильность раствора 1 месяц при 60 С: размер частиц не изменился (Dv 50 и Dv 90). Пример 7. 1,2 г Lipod E80 и 0,03 г DPPA солюбилизируют при 60 С в смеси МСТ (10 г) и соевого масла (10 г). 0,4 г соединения формулы (I XRP9881) растворяют в полученном выше прозрачном растворе. 2,5 г глицерина добавляют при перемешивании к 75,7 г воды PPI до получения гомогенной смеси. К масляной фазе добавляют водную фазу и смесь гомогенизируют в измельчителе (Ultraturrax), а затем в микрофлюидизаторе (11 циклов при 11000 пси). Средний размер полученных капелек составляет около 140 нм (Dv 50). Физическая стабильность раствора 1 месяц при 60 С: размер частиц не изменился (Dv 50 и Dv 90). Пример 8. 1 г DPPC и 0,03 г DLPG солюбилизируют при 60 С в смеси МСТ (10 г), соевого масла (10 г) и этанола (0,4 г). 0,4 г соединения формулы (II XRP6258) растворяют в полученном выше прозрачном растворе. 2,5 г глицерина добавляют при перемешивании к 75,7 г 10 мМ гистидинового водного буфера с рН,доведенным до 6 (HCl), до получения гомогенной смеси. К масляной фазе добавляют водную фазу и смесь гомогенизируют в измельчителе (Ultraturrax), а затем в микрофлюидизаторе (11 циклов при 11000 пси). Полученный размер капелек составляет около 260 нм. Сравнительный пример. Следующий пример был осуществлен для сравнения с заявкой US 2003/0099674 с целью доказать,что лиофилизация является приемом, который не может быть применен к составам согласно изобретению, поскольку он приводит к увеличению размера липидных частиц согласно изобретению. 1. Материал и методы. 1.1. Материал. чистый продукт без растворителя 1.3. Способ получения эмульсий. 1) Солюбилизация активного начала в масле. 2) Предварительное диспергирование в Ultra-turrax масляной фазы в воде + лецитин. 3) Гомогенизация в микрофлюидизаторе при 11000 пси (11 циклов). 4) Разделение эмульсии на 2 фракции - добавление 15% мальтозы или сахарозы. 5) Распределение по высоте слоя QS 1 мм и 6 мм. 6) Лиофилизация: использовались условия, описанные ниже; замораживание: температура на полке-45 С, температура продукта -39 С. Сублимация: температура на полке -25 С, давление 50 микробар. Вторичное высушивание при 30 С. 2. Результат. 2.1. Перед лиофилизацией. Перед добавлением криопротекторов размер частиц составлял 250 нм (Coulter N4+, метод измерения: псевдоэластичное рассеяние света). Не произошло изменения размера частиц после добавления криопротекторов (перед лиофилизацией). 2.2. После лиофилизации. 2.2.1. Внешний вид и восстановление. Внешний вид лиофилизата: не наблюдается ни коллапса, ни уменьшения размеравнешний вид корректный. Восстановление водой PPI: восстановление мгновенное, полученная эмульсия имеет вид гомогенного продукта. 2.2.2. Размер частиц после восстановления. Наличие везикул с размером между 300 нм и 10 мкм (метастабильная система). Отсутствие видимых или измеряемых отличий ни между мальтозой и сахарозой, ни между высотой слоя лиофилизата 1 и 6 мм. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Композиция для инъекций, отличающаяся тем, что она находится в форме эмульсии, содержащей производные класса таксанов, состоящая из эмульсии на основе фармацевтически приемлемого масла в воде и лецитиновой композиции, в которой растворен таксан, отвечающий следующей общей формуле причем композиция дополнительно содержит анионное поверхностно-активное вещество.-5 016619 2. Композиция по п.1, отличающаяся тем, что фармацевтически приемлемые масла выбраны из смесей соевого масла и триглицеридов с цепями средней длины. 3. Композиция по п.1, отличающаяся тем, что лецитин представляет собой природный лецитин, выбираемый из яичного или соевого лицитина, или полусинтетический лецитин, выбираемый из фосфатидилхолинов. 4. Композиция по п.1, отличающаяся тем, что анионным поверхностно-активным веществом является фосфатидилглицерин или фосфатидиновая кислота. 5. Композиция по п.4, отличающаяся тем, что фосфатидилглицерин выбран из дилауроилфосфатидилглицерина (DLPG), димиристоилфосфатидилглицерина (DMPG) или дипальмитоилфосфатидилглицерина (DPPG). 6. Композиция по п.4, отличающаяся тем, что фосфатидиновая кислота выбрана из натриевых солей дилауроилглицерофосфатидиновой кислоты (DLPA), димиристоилглицерофосфатидиновой кислоты(DMPA) или дипальмитоилглицерофосфатидиновой кислоты (DPPA). 7. Композиция по п.1, отличающаяся тем, что массовое соотношение между фосфатидилхолином или лецитином и фосфатидилглицерином или фосфатидиновой кислотой составляет преимущественно величину от 500 до 3. 8. Композиция по п.7, отличающаяся тем, что массовое соотношение предпочтительно составляет величину от 100 до 10. 9. Композиция по п.1, отличающаяся тем, что рН состава доводят до величины 3-7 путем добавления кислоты. 10. Композиция по п.9, отличающаяся тем, что кислота выбрана из соляной, лимонной или аскорбиновой кислот. 11. Композиция по п.1, отличающаяся тем, что добавляют гистидиновый буфер. 12. Композиция по п.1, отличающаяся тем, что изотоничность раствора достигается путем добавления глицерина. 13. Композиция по п.1, отличающаяся тем, что массовый состав композиции находится в следующих пределах: 14. Композиция по одному из пп.1-13, отличающаяся тем, что ее вводят путем внутривенной инъекции в виде болюса. 15. Композиция по одному из пп.1-14, отличающаяся тем, что частицы имеют размер от 100 нм до 1 мкм. 16. Способ получения композиции по одному из пп.1-15, отличающийся тем, что эмульсию получают с помощью аппарата микрофлюидизации или гомогенизатора высокого давления.
МПК / Метки
МПК: A61K 47/44, A61K 9/107, A61K 47/24, A61K 9/00
Метки: композиции, таксоидов, новые, основе
Код ссылки
<a href="https://eas.patents.su/7-16619-novye-kompozicii-na-osnove-taksoidov.html" rel="bookmark" title="База патентов Евразийского Союза">Новые композиции на основе таксоидов</a>
Предыдущий патент: Метод измерения положения рельсового пути
Следующий патент: Защитное устройство на основе фотонного кристалла и способ формирования такого устройства
Случайный патент: Замещенные производные бензоксазола, бензимидазола, оксазолопиридина и имидазопиридина в качестве модуляторов гамма-секретазы











