Способ получения амлодипина бензолсульфоната
Номер патента: 4208
Опубликовано: 26.02.2004
Авторы: Добаи Ласло, Сёке Каталин, Фишер Янош, Левай Шандор
Формула / Реферат
1. Способ получения амлодипина бензолсульфоната формулы (I)

включающий реакцию между бензолсульфоновой кислотой и производными полуамида фталевой кислоты общей формулы (II)
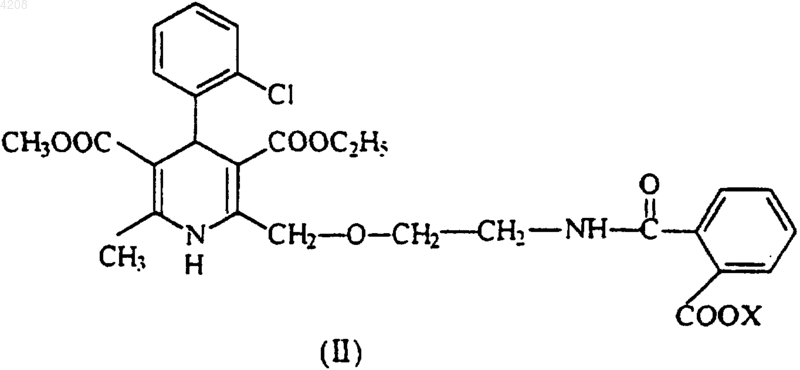
где X означает водород, щелочной или щелочно-земельный металл либо четвертичный аммоний.
2. Способ по п.1, отличающийся тем, что производное полуамида фталевой кислоты общей формулы II, где X определен в п.1, реагирует со стехиометрическим количеством или небольшим избытком бензолсульфоновой кислоты.
3. Способ по п.1 или 2, отличающийся тем, что реакция проводится в инертном растворителе при повышенной температуре.
4. Производное полуамида фталевой кислоты общей формулы (II)
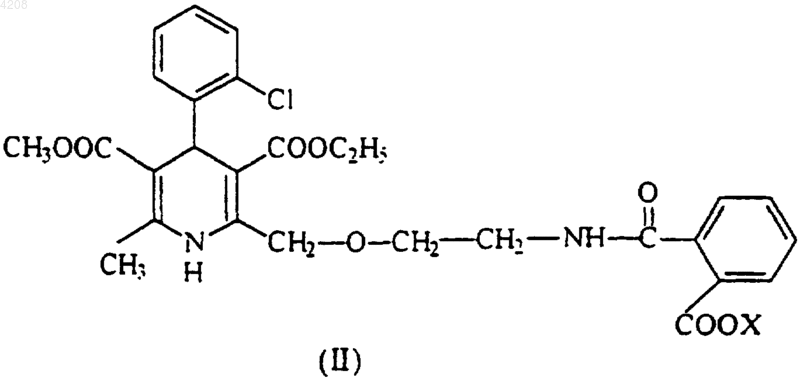
где X означает водород, щелочной или щелочно-земельный металл либо четвертичный аммоний.
5. 2-[/2-N-(2-Карбоксибензоил)аминоэтокси/метил]-4-(2-хлорофенил)-3-этоксикарбонил-5-метоксикарбонил-6-метил-1,4-дигидропиридин.
6. Способ получения производных полуамида фталевой кислоты общей формулы II, где X означает водород, щелочной или щелочно-земельный металл либо четвертичный аммоний, включающий реакцию между 4-(2-хлорофенил)-3-этоксикарбонил-5-метоксикарбонил-6-метил-2-(2-фталимидоэтокси)метил-1,4-дигидропиридином и сильным основанием, а при необходимости и реакцию с выделением или без выделения полученного соединения общей формулы II, где X означает щелочной или щелочно-земельный металл либо четвертичный аммоний, с кислотой.
7. Способ по п.6, отличающийся тем, что сильное основание представляет собой гидроокись щелочного металла, окись или гидроокись щелочно-земельного металла либо четвертичное аммониевое основание.
8. Способ по п.6 или 7, отличающийся тем, что сильное основание применяется в стехиометрическом количестве или с небольшим избытком и, при необходимости, подвергается нейтрализации стехиометрическим количеством кислоты.
9. Способ по любому из пп.6-8, отличающийся тем, что реакция с сильным основанием проводится при комнатной температуре, а реакция с кислотой проводится с охлаждением во льду.
10. Способ по п.1, отличающийся тем, что производное полуамида фталевой кислоты формулы (II) получают способом по любому из пп.6-9.
Текст
1 Область техники, к которой относится изобретение Изобретение относится к области органической химии и, в частности, к способу получения амлодипина бензолсульфоната (безилата) формулы (I) и содержащих его фармацевтических препаратов. Согласно способу, раскрытому в изобретении, амлодипин бензолсульфонат получают с помощью реакции между бензолсульфоновой кислотой и 2-[/2-N-(2-карбоксибензоил)аминоэтокси/метил]-4-(2-хлорофенил)-3-этоксикарбонил-5-метоксикарбонил-6-метил-1,4-дигидропиридиновыми производными полуамида фталевой кислоты общей формулы (II) где Х означает водород, щелочной или щелочно-земельный металл либо четвертичный аммоний. Изобретение также относится к производным полуамида фталевой кислоты общей формулы II, где Х означает водород, щелочной или щелочно-земельный металл либо четвертичный аммоний, - самих производных и способа их получения. Эти соединения являются новыми ключевыми промежуточными соединениями(предшественниками) в синтезе амлодипина бензолсульфоната. Уровень техники Амлодипин, представляющий собой 2[(2-аминоэтокси)]-метил-4-(2-хлорофенил)-3 этоксикарбонил-5-метоксикарбонил-6-метил 1,4-дигидропиридинбензолсульфонат, является блокатором кальциевых каналов длительного действия, применяется при лечении ишемической болезни сердца и гипертонии. Об амлодипине и его солях впервые сообщалось в европейском патенте 89167 в числе запатентованных новых 1,4-дигидропиридинов и их фармацевтически приeмлемых солей. Из различных солей малеат был заявлен как наиболее предпочтительный. В способе согласно ЕР 89167 1,4-дигидропиридины, включая амлодипин и его соли,получают из предшественников, которыми являются соответствующие производные азида,превращаемого в аминогруппу при восстановлении с помощью, например, трифенилфосфина или цинка и соляной кислоты, или при гидрогенизации над палладиевым катализатором. Недостатком этого способа является сравнительно 2 малый выход соответствующего азидного предшественника, кроме того, работа с азидами достаточно опасна из-за взрывоопасности таких соединений. Другим предшественником может быть 1,4-дигидропиридин с блокированной аминогруппой. В этом случае амино-1,4-дигидропиридин, включая амлодипин, можно получить путем удаления защитной группы, при этом образуется основание 1,4-дигидропиридина (к примеру, амлодипина), которое выделяют в виде масла, а затем обрабатывают кислотой. В том случае, когда защитной группой является бензил, его удаляют путем каталитической гидрогенизации над палладиевым катализатором в растворителе типа метанола, при комнатной температуре. Если защитная группа представляет собой 2,2,2-трихлороэтоксикарбонил, то ее удаляют путем восстановления цинком в муравьиной или уксусной кислоте. Если защитной группой является фталоил,его удаляют путем реакции с первичным амином, например, метиламином. Фталоильную группу также можно удалить с помощью гидразина гидрата при кипячении, например, в этаноле. Фталоильную группу также можно удалить двумя эквивалентами гидроокиси щелочного металла, например КОН, при комнатной температуре с последующим кипячением смеси в избытке соляной или серной кислоты в водном растворе тетрагидрофурана. Недостатками вышеназванных способов является их относительно малый выход целевого продукта из предшественников 1,4-дигидропиридина, которые получают синтезом асимметричных эфиров 1,4-дигидропиридина по Хантшу (Hantzsch). Кроме того, каждому из этих способов присущи технические проблемы и проблемы безопасности окружающей среды. Например, в случае удаления фталоильной группы из фталоиламлодипина с помощью метиламина выход конечной соли малеата достаточно низок (49%) и, кроме того, приходится применять ядовитый метиламин. Это вещество раздражает глаза и дыхательные органы (см.Merck-Index p.5944, 11. Ed., Merck and Co.,Rahway, USA, 1989). В случае применения гидразина гидрата конечный выход малеата амлодипина достигает 81%, однако гидразин однозначно является канцерогеном (см. D. Beabei,Sicherheit, Handbuch fr das Labor, p. 136, GITVerlag, Darmstadt, 1991). При применении гидроксидов щелочных металлов и соляной кислоты было указано, что выход конечной соли малеата амлодипина достигал 81%. Однако при попытке воспроизвести метод С (пример 22) авторам изобретения не удалось получить указанный выход целевого продукта. В ЕР 244944 был запатентован сам амлодипин безилат как новое химическое соединение, а также содержащие его фармацевтические 3 композиции. Было описано и запатентовано получение амлодипина безилата путем реакции основания амлодипина с бензолсульфоновой кислотой и получение фармацевтических композиций, его содержащих, путем смешивания безилата амлодипина с фармацевтически приемлемым разбавителем или носителем, поскольку было обнаружено, что амлодипин безилат обладает преимуществом перед ранее описанными солями - малеатом и другими, поскольку оказалось, что ранее описанные соли не подходят для приготовления фармацевтических композиций. В ЕР 244944 были описаны два других способа получения амлодипина безилата. В первом варианте основание амлодипина подвергали реакции со стехиометрическим, по меньшей мере, количеством бензолсульфоновой кислоты в метаноловой суспензии и получали амлодипин безилат с выходом 83,8%. Во втором варианте основание амлодипина подвергали реакции с бензолсульфонатом аммония в метаноле и после кратковременного кипячения с дефлегматором выделяли амлодипин безилат с выходом 70%. В этом патенте получение исходного основания амлодипина не было описано. В ЕР 599220 описан способ получения амлодипина бензолсульфоната путем реакции нового, блокированного тритилом, основания амлодипина с бензолсульфоновой кислотой в метаноловой или водно-метаноловой среде при температурах от 20 С до температуры закипания с последующим выделением и очисткой амлодипина бензолсульфоната. Сущность изобретения Несмотря на то, что цель указанного выше изобретения заключалась в поиске простого и легко осуществимого способа получения амлодипина бензолсульфоната высокой чистоты и с высоким выходом без дополнительного получения и выделения амлодипина в виде основания,как это описано в двух предыдущих европейских патентах, однако раскрытый в этом патенте способ имеет некоторые недостатки. Действительно, исходный N-тритилэтаноламин получают достаточно сложным способом, который очень трудно применить в промышленном масштабе. Кроме того, тритилалкилирование может произойти как по амино-, так и по гидроксильной группе исходного этаноламина, вследствие чего одновременно могут образоваться Nтритил, О-тритил и N,О-дитритилэтаноламинComm. Pays-Bas. 98(4), 243 (1979)]. Вследствие лабильности тритиловой группы реакция Хантша не может проходить как следует. Продолжительность реакции между тритил-защищенным основанием амлодипина и бензолсульфоновой кислотой достаточно велика -реакционную смесь нужно перемешивать в течение 13 ч. Продукт получается в виде смолы, что чрезвычайно 4 усложняет дальнейшую обработку, включая продолжительные экстракции. Неожиданно было обнаружено, что соль амлодипин бензолсульфоната может быть получена прямо, без получения основания амлодипина, в отличие от способов, описанных в ЕР 89167 и 244944, путем реакции легко получаемого, стабильного и кристаллического производного полуамида фталевой кислоты общей формулы II, где Х означает водород, щелочной или щелочно-земельный металл либо четвертичный аммоний, с бензолсульфоновой кислотой в одностадийном синтезе. Бензолсульфоновая кислота применяется в стехиометрическом количестве или с небольшим избытком. Продолжительность реакции от 3 до 4 ч. Новые производные полуамида фталевой кислоты общей формулы II, где Х означает водород, щелочной или щелочно-земельный металл либо четвертичный аммоний, могут быть избирательно получены путем реакции 4-(2 хлорофенил)-3-этоксикарбонил-5-метоксикарбонил-6-метил-2-(2-фталимидоэтокси)метил 1,4-дигидропиридина с сильным основанием. Полученное таким образом соединение общей формулы II, где Х означает водород, щелочной или щелочно-земельный металл либо четвертичный аммоний, может быть подвергнуто, с выделением или без выделения, реакции с кислотой для получения производного полуамида фталевой кислоты общей формулы II, где Х означает водород. Исходный материал для этого процесса обычно получают реакцией Хантша. В качестве сильного основания могут применяться гидроокиси щелочных металлов - гидроокись калия, гидроокись натрия, гидроокись лития и т.д., окислы или гидроокиси щелочноземельных металлов - окись кальция и т.п., четвертичные аммонийные основания - гидроокись тетраметиламмония и другие. Количество сильного основания не имеет решающего значения, однако на практике требуется стехиометрическое количество или небольшой избыток сильного основания. На стадии нейтрализации требуется стехиометрическое количество кислоты соответственно внесенному основанию. Реакцию с сильным основанием проводят при комнатной температуре, а стадия нейтрализации кислотой осуществляется на льду. Более подробно изобретение описано ниже. В способе по изобретению полуамид фталевой кислоты или ее основная соль общей формулы II, где Х означает водород, щелочной или щелочно-земельный металл либо четвертичный аммоний, подвергается реакции со стехиометрическим, по меньшей мере, количеством водного раствора бензолсульфоновой кислоты в атмосфере инертного газа, предпочтительно азота или аргона, в смеси органического 5 растворителя и воды, предпочтительнее всего в смеси воды с ацетонитрилом в соотношении 2:1,при нагревании. Температура реакции составляет 70-80 С, а продолжительность реакции - от 3 до 4 ч. Амлодипинбензолсульфонат формулы I может быть получен с хорошим выходом (8090%) и высокой степенью чистоты (99,5% методом HPLC). Преимущества способа по настоящему изобретению можно суммировать следующим образом: 1. Избирательное получение в кристаллическом виде производных полуамида фталевой кислоты, являющихся ключевыми интермедиатами в синтезе амлодипина бензолсульфоната. Вследствие этого амлодипинбензолсульфонат также получают с высокой степенью чистоты. 2. Общий выход амлодипина бензолсульфоната из производных полуамида фталевой кислоты гораздо выше, чем в предшествующем уровне техники в этой области, так как отсутствует стадия выделения основания амлодипина. 3. Способ настоящего изобретения существенно короче и проще, чем в предшествующем уровне техники. 4. Способ настоящего изобретения легко применим в промышленном масштабе. 5. Тот факт, что конечные интермедиаты процесса по изобретению получают избирательно и выделяют в кристаллическом виде,облегчает промышленное получение фармацевтически активного ингредиента. 6. Можно избежать применения таких реагентов, как гидразин или метиламин, которые опасны для здоровья и окружающей среды, поскольку становится ненужным деблокирование аминогруппы. Нижеследующие примеры иллюстрируют способ по изобретению, ничем его не ограничивая. Сведения, подтверждающие возможность осуществления изобретения Пример 1. Амлодипин бензолсульфонат. 2-[/2-N-(2-карбоксибензоил)аминоэтокси/метил]-4-(2-хлорофенил)-3-этоксикарбонил 5-метоксикарбонил-6-метил-1,4-дигидропиридин (3,9 г) суспендировали в смеси воды (100 мл) с ацетонитрилом (60 мл) в атмосфере аргона при комнатной температуре и к суспензии добавляли бензолсульфоновую кислоту (1,2 г) в водном растворе (20 мл). Реакционную смесь перемешивали при 80 С от 3 до 4 ч. Затем растворитель выпаривали, а продукт кристаллизировали охлаждением, после чего фильтровали и промывали водой. Указанный в заголовке продукт (3,5 г, 87%) перекристаллизовывали из смеси этилацетата и метанола. Температура плавления: 200-204 С. ТСХ (Kieselgel, Merck 5719): Rf=0,31 (пиридин/уксусная кислота/вода/этилацетат=16/5/9/70). 6 Пример 2. Амлодипинбензолсульфонат. Натриевую соль 2-[/2-N(2-карбоксибензоил)аминоэтокси/метил]-4-(2-хлорофенил)-3 этоксикарбонил-5-метоксикарбонил-6-метил 1,4-дигидропиридина (5,8 г) суспендировали в смеси дистиллированной воды (120 мл) с ацетонитрилом (70 мл) в атмосфере аргона, затем добавляли бензолсульфоновую кислоту (3,5 г),растворенную в дистиллированной воде (20 мл). Реакционную смесь перемешивали от 3 до 4 ч при 70-80 С. После выпаривания растворителя указанное соединение (5,5 г) кристаллизировали охлаждением. Указанное в заголовке соединение перекристаллизовывали из этанола и получали 4,5 г (80%) очищенного продукта. Пример 3. 2-[/2-N-(2-Карбоксибензоил)аминоэтокси/метил]-4-(2-хлорофенил)-3-этоксикарбонил-5-метоксикарбонил-6-метил-1,4-дигидропиридин (формула II, где Х означает водород). а) Получение с помощью гидроокиси калия. 4-(2-Хлорофенил)-3-этоксикарбонил-5 метоксикарбонил-6-метил-2-[(2-фталимидоэтокси)метил]-1,4-дигидропиридин (10,8 г) суспенидровали в изопропаноле (80 мл), затем добавляли раствор КОН (1,6 г) в воде (40 мл) с перемешиванием при комнатной температуре в атмосфере азота от 3 до 4 ч. Раствор помещали на лед и добавляли 1N раствор НСl (28 мл), выпавший осадок продукта отфильтровывали и промывали водой. Получали указанное в заголовке соединение (10,9 г, 98%) с температурой плавления 167-169 С. ТСХ (Kieselgel): Rf=0,29 (бензол/метанол=14/3). Характеристики 1 Н-ЯМР: прибор: Varian UNITYINOVA 500 (500 МГц для 1 Н), растворитель: [D6]-DMSO, внутренний стандарт: TMS (30 С).(1H) [СООН]. б) Получение с помощью гидроокиси натрия. 4-(2-Хлорофенил)-3-этоксикарбонил-5 метоксикарбонил-6-метил-2-[(2-фталимидоэтокси)метил]-1,4-дигидропиридин (6,5 г) суспендировали в изопропаноле (20 мл) при комнатной температуре в атмосфере аргона, затем добавляли 1N раствор NaOH. Реакционную смесь перемешивали при комнатной температуре от 3 до 4 ч. Остаток после выпаривания изопропанола остаток охлаждали во льду и добавляли 1N раствор НСl. Получали указанное в заголовке соединение (6,4 г, 96%) с температурой плавления 165,5-166 С. 7 в) Получение с помощью гидроокиси лития. 4-(2-Хлорофенил)-3-этоксикарбонил-5 метоксикарбонил-6-метил-2-[(2-фталимидоэтокси)метил]-1,4-дигидропиридин (2,7 г) суспендировали в изопропаноле (20 мл) при комнатной температуре в атмосфере аргона, затем добавляли раствор LiOH (0,4 г) в воде (20 мл). Реакционную смесь перемешивали при комнатной температуре от 2 до 3 ч. Остаток выпаривания изопропанола охлаждали во льду и добавляли 1N раствор НСl. Получали указанное в заголовке соединение (2,6 г, 93%) с температурой плавления 165,5-166 С. г) Получение с помощью окиси кальция. 4-(2-Хлорофенил)-3-этоксикарбонил-5 метоксикарбонил-6-метил-2-[(2-фталимидоэтокси)метил]-1,4-дигидропиридин (6,5 г) растворяли в смеси тетрагидрофурана (30 мл) с водой(20 мл) и добавляли при перемешивании окись кальция (0,31 г). Реакционную смесь перемешивали 1 ч при комнатной температуре, затем охлаждали во льду и добавляли 1N раствор НСl. Кристаллический продукт после выпаривания тетрагидрофурана отфильтровывали и промывали водой. Получали указанное в заголовке соединение (3,0 г, 97%) с температурой плавления 165,5-166 С. д) Получение с помощью гидроокиси тетраметиламмония. 4-(2-Хлорофенил)-3-этоксикарбонил-5 метоксикарбонил-6-метил-2-[(2-фталимидоэтокси)метил]-1,4-дигидропиридин (3,0 г) растворяли в тетрагидрофуране (30 мл) и в реакционную смесь добавляли 25% раствор гидроокиси тетраметиламмония (4,0 мл) в воде, перемешивая в течение 1 ч при комнатной температуре. Затем реакционную смесь подкисляли 2N раствором НСl (6 мл). После выпаривания тетрагидрофурана под вакуумом остаток кристаллизировали диэтиловым эфиром, получая указанное в заголовке соединение (3,0 г, 97%) с температурой плавления 165-166 С. Пример 4. Натриевая соль 2-[/2-N-(2 карбоксибензоил)аминоэтокси/метил]-4-(2-хлорофенил)-3-этоксикарбонил-5-метоксикарбонил-6-метил-1,4-дигидропиридина. 4-(2-Хлорофенил)-3-этоксикарбонил-5 метоксикарбонил-6-метил-2-[(2-фталимидоэтокси)метил]-1,4-дигидропиридин (6,5 г) суспендировали в изопропаноле (20 мл) при комнатной температуре в атмосфере аргона, добавляли 1N раствор NaOH (20 мл). Реакционную смесь перемешивали от 3 до 4 ч при комнатной температуре. Образовывался чистый раствор. Растворитель выпаривали, а маслянистый остаток кристаллизировали из воды, фильтровали и промывали водой, получая указанное в заголовке соединение (6,9 г) с температурой плавления 140-146 С. ТСХ (Kieselgel): Rf=0,72 (пиридин/уксусная кислота/вода/этилацетат=16/5/9/70). 8 Пример 5. Изготовление таблеток, содержащих амлодипинбензолсульфонат. Безводный кислый фосфат кальция (315 г) смешивали с микрокристаллической целлюлозой (525 г, 90 мкм) и переносили в барабан. Затем смешивали амлодипинбензолсульфонат (70 г) с микрокристаллической целлюлозой (187,5 г,50 мкм), пропускали через сито и подавали в барабан, содержащий указанную выше порошковую смесь. Через сито, использованное на предыдущей стадии, пропускали микрокристаллическую целлюлозу (525 г, 90 мкм). В эту смесь добавляли безводный кислый фосфат кальция (315 г) и всю смесь перемешивали в течение 10 мин. Затем добавляли крахмальный гликолат натрия (40 г) и перемешивали в течение 6 мин. Наконец, добавляли стеарат магния(20 г) и смесь перемешивали в течение 3 мин. После этого порошковую смесь таблетировали общепринятым способом. Этим способом изготавливали таблетки,содержащие различные концентрации амлодипина бензолсульфоната. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения амлодипина бензолсульфоната формулы (I) включающий реакцию между бензолсульфоновой кислотой и производными полуамида фталевой кислоты общей формулы (II) где Х означает водород, щелочной или щелочно-земельный металл либо четвертичный аммоний. 2. Способ по п.1, отличающийся тем, что производное полуамида фталевой кислоты общей формулы II, где Х определен в п.1, реагирует со стехиометрическим количеством или небольшим избытком бензолсульфоновой кислоты. 3. Способ по п.1 или 2, отличающийся тем,что реакция проводится в инертном растворителе при повышенной температуре. 4. Производное полуамида фталевой кислоты общей формулы (II) где X означает водород, щелочной или щелочно-земельный металл либо четвертичный аммоний. 5. 2-[/2-N-(2-Карбоксибензоил)аминоэтокси/метил]-4-(2-хлорофенил)-3-этоксикарбонил 5-метоксикарбонил-6-метил-1,4-дигидропиридин. 6. Способ получения производных полуамида фталевой кислоты общей формулы II, где Х означает водород, щелочной или щелочноземельный металл либо четвертичный аммоний,включающий реакцию между 4-(2-хлорофенил)3-этоксикарбонил-5-метоксикарбонил-6-метил 2-(2-фталимидоэтокси)метил-1,4-дигидропиридином и сильным основанием, а при необходимости и реакцию с выделением или без выделения полученного соединения общей формулы II,где Х означает щелочной или щелочноземельный металл либо четвертичный аммоний,с кислотой. 10 7. Способ по п.6, отличающийся тем, что сильное основание представляет собой гидроокись щелочного металла, окись или гидроокись щелочно-земельного металла либо четвертичное аммониевое основание. 8. Способ по п.6 или 7, отличающийся тем,что сильное основание применяется в стехиометрическом количестве или с небольшим избытком и, при необходимости, подвергается нейтрализации стехиометрическим количеством кислоты. 9. Способ по любому из пп.6-8, отличающийся тем, что реакция с сильным основанием проводится при комнатной температуре, а реакция с кислотой проводится с охлаждением во льду. 10. Способ по п.1, отличающийся тем, что производное полуамида фталевой кислоты формулы (II) получают способом по любому из пп.6-9.
МПК / Метки
МПК: A61K 31/4422, C07D 211/90
Метки: бензолсульфоната, получения, амлодипина, способ
Код ссылки
<a href="https://eas.patents.su/6-4208-sposob-polucheniya-amlodipina-benzolsulfonata.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения амлодипина бензолсульфоната</a>
Предыдущий патент: Производные пиридина, ингибирующие фосфодиэстеразу iv
Следующий патент: Способ получения 2-(n-фениламино) бензойных кислот
Случайный патент: Производные тиазола и их применение










