Способ синтеза основания бензилиден-росиглитазона
Номер патента: 14560
Опубликовано: 30.12.2010
Авторы: Иберхардт Тамашне, Шебёк Ференц, Веркне Папп Эва, Цибула Ласло, Добаи Ласло, Надьне Багди Юдит, Дёйчне Юхас Ида
Формула / Реферат
1. Способ синтеза 5-{4-[N-метил-N-(2-пиридил)аминоэтокси]бензилиден}тиазолидин-2,4-диона (МНН: бензилиден-росиглитазона) формулы (I)
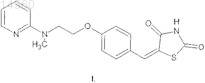
который состоит из следующих стадий:
a) реакция 2-хлорпиридина с 2-(N-метиламино)этанолом,
b) реакция полученного соединения формулы (III) с 4-фторбензальдегидом,
с) реакция полученного соединения формулы (IV) с тиазолидин-2,4-дионом,
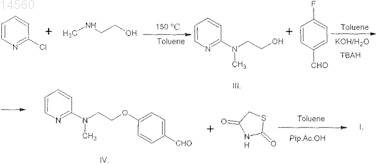
где Toluene - толуол,
TBAN - гидросульфат тетрабутиламмония,
Pip.Ac.OH - пиперидин×АсОН,
отличающийся тем, что
4-{2-[N-метил-N-(2-пиридил)амино]этанол} формулы (III), полученный на стадии а), растворяют в толуоле и используют на стадии b) без выделения;
толуольный раствор соединения формулы (III) подвергают взаимодействию с 4-фторбензальдегидом на стадии b) в присутствии водного раствора гидроксида щелочного металла и катализатора межфазного переноса при 25-50°С;
толуольный раствор производного бензальдегида формулы (IV), полученный на стадии b), подвергают взаимодействию с тиазолидин-2,4-дионом на стадии с) и выделяют целевой продукт.
2. Способ по п.1, отличающийся тем, что в качестве гидроксида щелочного металла на стадии b) используют гидроксид калия.
3. Способ по п.1, отличающийся тем, что в качестве катализатора межфазного переноса на стадии b) используют гидросульфат тетрабутиламмония (ТВАН).
4. Способ по п.1, отличающийся тем, что реакцию на стадии b) проводят при 30-45°С.
Текст
(МНН: бензилиден-росиглитазона) формулы (I), который состоит из следующих стадий: (I) стадии а) реакции 2-хлорпиридина с 2-(N-метиламино)этанолом; стадии b) реакции полученного соединения формулы (III) с 4-фторбензальдегидом; стадии с) реакции полученного соединения формулы (IV) с тиазолидин-2,4-дионом; отличающийся тем, что 4-2-[N-метил-N-(2 пиридил)амино]этанол формулы (III), полученный на стадии а), растворяют в толуоле и используют на стадии b) без выделения; толуольный раствор соединения формулы (III) подвергают взаимодействию с 4-фторбензальдегидом на стадии b) в присутствии водного раствора гидроксида щелочного металла и катализатора межфазного переноса при 25-50 С; толуольный раствор производного бензальдегида формулы (IV), полученный на стадии b),подвергают взаимодействию с тиазолидин-2,4-дионом на стадии с) и выделяют целевой продукт. 014560 Область техники, к которой относится изобретение Изобретение относится к новому способу синтеза 5-4-[N-метил-N-(2-пиридил)аминоэтокси]бензилидентиазолидин-2,4-диона (МНН (международное непатентованное название): бензилиденросиглитазон) формулы (I) Уровень техники Соединение формулы (I) - бензилиден-росиглитазон - является ключевым промежуточным соединением в синтезе 5-4-[N-метил-N-(2-пиридил)аминоэтокси]бензилтиазолидин-2,4-диона (МНН: росиглитазон), который представляет собой активный ингредиент лекарственного средства для лечения инсулинонезависимого диабета. Росиглитазон формулы (II) был впервые описан в ЕР 306228 (фирмы Beecham). Бензилиденросиглитазон формулы (I) и его синтез описан также в настоящем патенте. Первая стадия синтеза представляет собой реакцию 2-хлорпиридина с 2-(метиламино)этанолом при 150 С. Затем полученный 4-2[N-метил-N-(2-пиридил)амино]этанол формулы(III) подвергают взаимодействию с 4 фторбензальдегидом и NaH в диметилформамиде (ДМФА) и получают 2-[N-метил-N-(2 пиридил)амино]этоксибензальдегид формулы (IV). Последний подвергают взаимодействию с тиазолидин-2,4-дионом в присутствии ацетата пиперидиния в толуоле и получают промежуточный бензилиденросиглитазон формулы (I).Pip.Ac.OH - пиперидинАсОН. В ЕР 306228 (фирмы Beecham) синтез соединения формулы (IV) не описан, образование эфирной связи представлено только на аналогичном примере. Согласно этому аналогичному примеру реакцию с реагентом NaH осуществляют в ДМФА при высокой температуре (80 С) и время реакции составляет 16 ч. При обработке используют диэтиловый эфир, который является чрезвычайно взрывчатым и огнеопасным, а полученный маслообразный сырой продукт очищают хроматографией. В публикации заявки WO 0144240 А 1 Рихтера также описан синтез промежуточного бензилиденросиглитазона формулы (I). Соединение формулы (III), которое выделяют после обработки дихлорметаном, подвергают взаимодействию с 4-фторбензальдегидом в присутствии трет-бутоксида калия (вместоNaH) в ДМФА в безводных условиях, но использованная методика с трудом выполнима в лабораторных масштабах. Соединение формулы (III) растворяют в ДМФА вместе с трет-бутоксидом калия (KTB) и полученный раствор по каплям прибавляют в инертной атмосфере к раствору 4-фторбензальдегида в ДМФА при 75 С. Известно, что растворимость KTB в ДМФА низка, поэтому реакцию образования эфирной связи следует проводить в разбавленном растворе при высокой температуре. Продукт тоже плохо растворяется в ДМФА, и в связи с этим реакционная смесь содержит смолообразное вещество, что затрудняет ее обработку. Дополнительными недостатками использования ДМФА являются высокая температура кипения(его трудно отгонять) и склонность разлагаться при повышенной температуре. Следующий недостаток указанного способа состоит в том, что продукт выделяют после осторожной отгонки ДМФА, для осуществления которой в промышленности требуется специальное оборудование, а образующееся промежуточное соединение формулы (IV) можно использовать на следующей стадии только после выделения и очистки. Согласно WO 0251823 А 1 соединение формулы (III) подвергают взаимодействию с 4 фторбензальдегидом в присутствии гидрида или гидроксида щелочного металла в полярном апротонном растворителе (например, ДМФА, ДМСО). Образующийся альдегид формулы (IV) выделяют и затем подвергают взаимодействию с тиазолидин-2,4-дионом. Растворитель ДМФА, используемый для синтеза альдегида формулы (IV), оказывает вредное физиологическое действие, а при применении DMSO возникают проблемы техники безопасности. Обработка реакционной смеси затруднительна с точки зрения технологии. Раскрытие изобретения Задача настоящего изобретения состояла в том, чтобы разработать рациональный способ, соответствующий требованиям безопасности, приемлемый с экологической точки зрения и позволяющий получать продукт хорошего качества с высоким выходом. В основе настоящего изобретения лежит предположение, что недостатки предшествующих методик можно устранить, если соединение формулы (III) не выделять, а экстрагировать его толуолом и толуольный раствор подвергать взаимодействию с 4-фторбензальдегидом в инертной атмосфере в водной основной среде в присутствии катализатора межфазного переноса. Это предположение является неожиданным, так как считалось, что данная реакция не будет происходить в водной основной среде. Согласно вышеупомянутым фактам изобретение относится к способу синтеза 5-4-[N-метил-N-(2 пиридил)аминоэтокси]бензилидентиазолидин-2,4-диона (МНН: бензилиден-росиглитазон) формулы (I),который состоит из следующих стадий:a) реакция 2-хлорпиридина с 2-(N-метиламино)этанолом,b) реакция полученного соединения формулы (III) с 4-фторбензальдегидом,c) реакция полученного соединения формулы (IV) с тиазолидин-2,4-диономPip.Ac.OH - пиперидинАсОН,и отличается тем, что 4-2-[N-метил-N-(2-пиридил)амино]этанол формулы (III), полученный на стадии а), растворяют в толуоле и используют на стадии b) без выделения; толуольный раствор соединения формулы (III) на стадии b) подвергают взаимодействию с 4 фторбензальдегидом в присутствии водного раствора гидроксида щелочного металла и катализатора межфазного переноса при 20-25 С; толуольный раствор производного бензальдегида формулы (IV), полученный на стадии b), подвергают взаимодействию с тиазолидин-2,4-дионом на стадии с) и выделяют целевой продукт. Настоящий способ дает альдегид формулы (IV) с высоким выходом - выше 80% - с хорошей воспроизводимостью. Соединение формулы (IV) получают в толуольном растворе, который можно сразу же использовать на следующей химической стадии конденсации (без выделения продукта), т.е. для синтеза бензилиден-росиглитазона формулы (I). Настоящее изобретение имеет следующие преимущества: используют только один органический растворитель - толуол; исключается применение ДМФА, который является карциногеном и загрязняет окружающую среду; промежуточные соединения получают в толуольном растворе и используют без выделения на следующих стадиях;-2 014560 в способе по настоящему изобретению не применяют чрезвычайно огнеопасных и взрывчатых реагентов (NaH, KTB) и используют водную среду; высокочистый бензилиден-росиглитазон формулы (I) получают с высоким выходом и хорошей воспроизводимостью за короткий промежуток времени 3-4 ч. Технологическое преимущество способа синтеза соединения формулы (II) по настоящему изобретению выявляется при восстановлении основания бензилиден-росиглитазона формулы (I), а именно восстановление с образованием росиглитазона формулы (II) можно осуществлять с помощью существенно меньшего количества катализатора Pd на угле по сравнению с ранее известными методиками (см. ссылочный пример). Гидрирование соединения формулы (I), полученного способом авторов настоящего изобретения, с образованием соединения (II) можно проводить, используя 20-30% Pd/C - в расчете на массу соединения формулы (I) - с очень хорошим выходом. В ЕР 306228 Бичема (Beecham) описано гидрирование соединения формулы (I) с образованием продукта формулы (II) только на аналогичном примере, где используют 150% катализатора в расчете на массу соединения формулы (I). Это свидетельствует о неожиданном дополнительном эффекте способа авторов настоящего изобретения. Способ по настоящему изобретению иллюстрируется следующими примерами. Пример 1. Стадия а). Синтез 2-N-метил-N-(2-пиридил)аминоэтанола (III). В атмосфере азота 2-хлорпиридин (67 г, 55,8 мл, 0,59 моль) и 2-метиламиноэтанол (177,1 г,188,9 мл, 2,36 моль) помещают колбу объемом 500 мл, снабженную мешалкой, холодильником и термометром, и смесь перемешивают при 140-150 С в течение 15 ч. После завершения реакции отгоняют в вакууме избыток 2-метиламиноэтанола при температуре ниже 110 С. Остаток растворяют в толуоле(300 мл, 260,4 г) и промывают 20% раствором хлорида натрия (350 мл, 356,5 г). Объединенные водные фазы экстрагируют толуолом (370 мл, 360,8 г). Объединенные органические фазы промывают 20% раствором хлорида натрия (50 мл, 56,5 г). Полученный толуольный раствор используют сразу же в реакции образования простого эфира. Раствор содержит 84 г (93,5%) соединения формулы (III). Стадия b). Синтез 4-2-[N-метил-N-(2-пиридил)]аминоэтоксибензальдегида (IV). Толуольный раствор соединения формулы (III), полученный на стадии а), разбавляют толуолом(400 мл, 347,2 г), затем прибавляют 4-фторбензальдегид (59,3 мл, 68,5 г, 0,55 моль), гидросульфат тетрабутиламмония (18,71 г, 0,055 моль) и раствор гидроксида калия (93,5 г, 1,65 моль) в воде (93 мл). Реакционную смесь энергично перемешивают в атмосфере азота при 39-41 С в течение 3 ч. После завершения реакции смесь разбавляют водой (300 мл) и перемешивают при 20-25 С в течение 30 мин. Органическую фазу отделяют и водную фазу экстрагируют толуолом (100 мл, 86,8 г). Объединенные органические слои промывают водой (5250 мл, 5250 г). Полученный толуольный раствор сразу же используют на следующей стадии - в реакции конденсации. Раствор содержит 119 г (84%) соединения формулы (IV). Стадия с). Синтез 5-4-[N-метил-N-(2-пиридил)аминоэтокси]бензилидентиазолидина-2,4-диона (I). Тиазолидин-2,4-дион (64,83 г, 0,55 моль), пиперидин (5,1 мл, 4,41 г, 0,052 моль) и уксусную кислоту(2,96 мл, 3,12 г, 0,052 моль) прибавляют к толуольному раствору соединения формулы (IV), полученному на стадии b), затем реакционную смесь кипятят с обратным холодильником при 130-140 С в атмосфере азота. Осаждение продукта начинается через 1 ч. После завершения реакции смесь охлаждают до 5-10 С,перемешивают при этой температуре в течение 3 ч, затем фильтруют и промывают холодным толуолом(150 мл, 130,2 г). Отфильтрованный продукт (не высушивая) суспендируют в метаноле (400 мл, 316,4 г) и суспензию кипятят с обратным холодильником при 70-75 С в течение 30 мин. Затем суспензию перемешивают при 20-25 в течение 2 ч и при 5-10 С в течение еще 2 ч. Продукт отфильтровывают, промывают холодным метанолом (100 мл, 79,1 г) и сушат при температуре ниже 50 С. Масса полученного влажного продукта составляет 212,5 г, после высушивания - 142,9 г (87%). Т.пл. 194-196 С. Пример 2. Стадия а). Синтез 2-N-метил-N-(2-пиридил)аминоэтанола (III). В атмосфере азота 2-хлорпиридин (4,9 кг, 4,1 л) и 2-метиламиноэтанол (13,0 кг, 13,9 л) помещают в реактор Ламперта с рубашкой объемом 50 л и смесь перемешивают при 140-150 С в течение 15 ч. После завершения реакции избыток 2-метиламиноэтанола отгоняют в вакууме (6-7 л дистиллата) при температуре ниже 110 С. Остаток охлаждают до 30 С, растворяют в толуоле (22 л, 19,1 кг) и промывают 20% раствором хлорида натрия (43,7 л, 44,2 кг). Объединенные водные фазы экстрагируют толуолом (25,2 л, 24,5 кг). Объединенные органические фазы промывают 20% раствором хлорида натрия (3,7 л, 4,2 кг). Полученный толуольный раствор сразу же используют в реакции образования простого эфира.-3 014560 Стадия b). Синтез 4-2-[N-метил-N-(2-пиридил)]аминоэтоксибензальдегида (IV). Толуольный раствор соединения формулы (III), полученный на стадии а), помещают в реактор Ламперта с рубашкой объемом 250 л и разбавляют толуолом (30 л, 26,1 кг). Затем к раствору прибавляют 4 фторбензальдегид (4,6 л, 5,3 кг), гидросульфат тетрабутиламмония (1,4 кг) и раствор гидроксида калия(6,9 кг) в воде (6,9 л). Реакционную смесь энергично перемешивают в атмосфере азота при 39-41 С в течение 3 ч. После завершения реакции смесь разбавляют водой (22 л) и перемешивают при 20-25 С в течение 30 мин. Органическую фазу отделяют и водную фазу экстрагируют толуолом (7,4 л, 6,4 кг). Объединенные органические слои промывают водой (518,5 л). Полученный толуольный раствор сразу же используют в реакции конденсации. Стадия с). Синтез 5-4-[N-метил-N-(2-пиридил)аминоэтокси]бензилидентиазолидин-2,4-диона (I). К толуольному раствору соединения формулы (IV), полученному на стадии b), прибавляют тиазолидин-2,4-дион (4,77 кг), пиперидин (0,37 л, 0,34 кг) и уксусную кислоту (0,22 л, 0,23 кг), затем реакционную смесь кипятят с обратным холодильником при 130-140 С в атмосфере азота. Осаждение продукта начинается через 1 ч. После завершения реакции смесь охлаждают до 5-10 С, перемешивают при этой температуре в течение 3 ч, затем продукт выделяют центрифугированием и промывают холодным толуолом (11 л, 9,6 кг). Отфильтрованный продукт, не высушивая, суспендируют в метаноле (29,5 л, 24 кг) и суспензию кипятят с обратным холодильником в течение 30 мин. Затем суспензию перемешивают при 20-25 в течение 2 ч и при 5-10 С в течение еще 2 ч. Продукт выделяют центрифугированием, промывают холодным метанолом (7,4 л, 5,9 кг) и сушат при температуре ниже 50 С. Масса полученного влажного продукта составляет 12,1 кг, после сушки - 10,6 кг (выход 69% в расчете на исходный 2-хлорпиридин). Т.пл. 194-196 С. Ссылочный пример. Синтез 5-4-[N-метил-N-(2-пиридил)аминоэтокси]бензилтиазолидин-2,4-диона (II). Основание бензилиден-росиглитазона формулы (I) (18,84 г, 0,053 моль) растворяют в смеси уксусной кислоты (375 мл, 393,8 г) и трифторуксусной кислоты (4,25 мл, 6,14 г, 0,053 моль) при 45-50 С в автоклаве объемом 2 л, затем прибавляют суспензию 10% Pd на угле (5 г) в воде, очищенной ионообменной смолой (25 мл). После пропускания азота через смесь реакционную смесь гидрируют при 69-71 С при давлении 5-6 атм в течение 12-15 ч. Затем смесь охлаждают до 23-25 С, воздух в автоклаве заменяют азотом, катализатор отфильтровывают и промывают уксусной кислотой (40 мл, 42 г). Фильтрат концентрируют в вакууме при температуре ниже 60 С. Маслообразный остаток растворяют в смеси метанола(100 мл, 79,5 г) и воды, очищенной ионообменной смолой (50 мл, 50 г), и по каплям прибавляют 7,7 N раствор KOH (7,25 мл, 9,58 г, 0,053 моль KOH). После прибавления основного раствора продукт начинает осаждаться. Затем суспензию нагревают до температуры кипения и перемешивают при этой температуре с обратным холодильником в течение 30 мин. Затем суспензию охлаждают до 0-2 С со скоростью 1 С/мин и перемешивают еще 3 ч. Продукт отфильтровывают, промывают водой, очищенной ионообменной смолой, с температурой 0-2 С (60 мл), метанолом с температурой (-10)-(-8)С (60 мл, 47,7 г), сушат при температуре ниже 50 С и получают 16,1 г (84,6%) соединения, указанного в заголовке. (Масса полученного влажного продукта составляет 22,3 г). Т.пл. 153-155 С. Чистота: минимум 95% (по данным ВЭЖХ). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ синтеза 5-4-[N-метил-N-(2-пиридил)аминоэтокси]бензилидентиазолидин-2,4-диона который состоит из следующих стадий:a) реакция 2-хлорпиридина с 2-(N-метиламино)этанолом,b) реакция полученного соединения формулы (III) с 4-фторбензальдегидом,с) реакция полученного соединения формулы (IV) с тиазолидин-2,4-дионом,где Toluene - толуол,TBAN - гидросульфат тетрабутиламмония,Pip.Ac.OH - пиперидинАсОН,отличающийся тем, что 4-2-[N-метил-N-(2-пиридил)амино]этанол формулы (III), полученный на стадии а), растворяют в толуоле и используют на стадии b) без выделения; толуольный раствор соединения формулы (III) подвергают взаимодействию с 4 фторбензальдегидом на стадии b) в присутствии водного раствора гидроксида щелочного металла и катализатора межфазного переноса при 25-50 С; толуольный раствор производного бензальдегида формулы (IV), полученный на стадии b), подвергают взаимодействию с тиазолидин-2,4-дионом на стадии с) и выделяют целевой продукт. 2. Способ по п.1, отличающийся тем, что в качестве гидроксида щелочного металла на стадии b) используют гидроксид калия. 3. Способ по п.1, отличающийся тем, что в качестве катализатора межфазного переноса на стадии b) используют гидросульфат тетрабутиламмония (ТВАН). 4. Способ по п.1, отличающийся тем, что реакцию на стадии b) проводят при 30-45 С.
МПК / Метки
МПК: C07D 417/12
Метки: способ, синтеза, бензилиден-росиглитазона, основания
Код ссылки
<a href="https://eas.patents.su/6-14560-sposob-sinteza-osnovaniya-benziliden-rosiglitazona.html" rel="bookmark" title="База патентов Евразийского Союза">Способ синтеза основания бензилиден-росиглитазона</a>
Предыдущий патент: Способ получения (s)-n-метил-3-(1-нафтилокси)-3-(2-тиенил)пропиламина гидрохлорида (дулоксетина)
Следующий патент: Способ открытия скрытой игровой информации, содержащейся в лотерейном билете моментальной лотереи
Случайный патент: Способ и устройство для изготовления сигарет с фильтром










