Способ получения производных 5-(1, 3-оксазол-2-ил)бензойной кислоты
Формула / Реферат
1. Способ получения соединения формулы
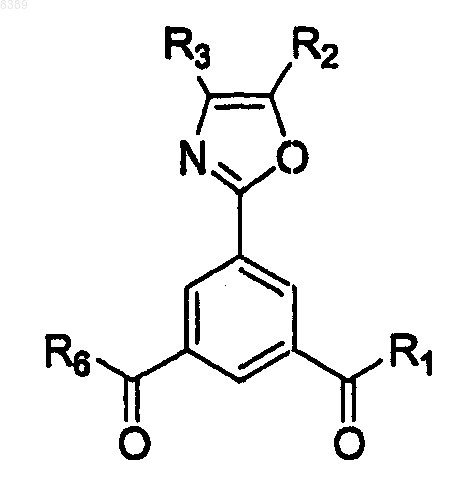
где R1 представляет собой C1-C6алкокси или ОН;
R2 и R3 независимо представляют собой Н, фенил или C1-C4алкил; или
R2 и R3 и атомы углерода, к которым они присоединены, образуют бензольное кольцо, которое может быть замещено C1-C4алкилом, C1-C4алкокси или диалкиламиногруппой; и
R6 представляет собой C1-C6алкокси или NR4R5, где
R4 и R5 независимо представляют собой C1-C6алкил,
включающий взаимодействие соединения формулы I
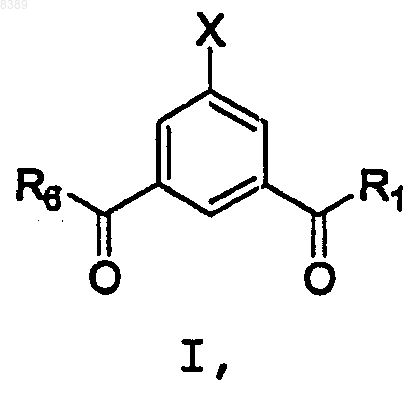
где X представляет собой Br, -OSO2CF3 или -OSO2CH3,
с соединением формулы II
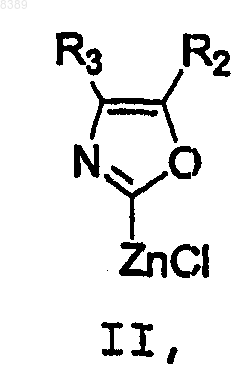
в присутствии катализатора и по меньшей мере одного растворителя.
2. Способ по п.1, где катализатор представляет собой катализатор на основе переходного металла.
3. Способ по п.2, где катализатор представляет собой Pd(PPh3)4, PdCl2(PPh3)2, PdCl2, PdCl2 и PPh3 или Pd(OCOCH3)2.
4. Способ по п.3, где катализатор представляет собой Pd(PPh3)4.
5. Способ по п.1, где взаимодействие осуществляют в присутствии одного дополнительного полярного апротонного растворителя.
6. Способ по п.5, где полярный апротонный растворитель представляет собой тетрагидрофуран, тетраметилтетрагидрофуран, диметоксиэтан, метил-трет-бутиловый эфир или их смесь.
7. Способ по п.6, где полярный апротонный растворитель представляет собой тетрагидрофуран.
8. Способ по п.1, где реакцию осуществляют при температуре примерно от 25шС до температуры кипения растворителя.
9. Способ по п.8, где температура находится в интервале примерно от 30 до 75шС.
10. Способ по п.9, где температура находится в интервале примерно от 40 до 60шС.
11. Способ по п.10, где реакционную смесь формируют путем объединения соединения формулы I, соединения формулы II и катализатора и любых возможных дополнительных агентов сразу или в течение короткого периода времени.
12. Способ по п.10, где реакционную смесь формируют в течение периода времени примерно от 0,5 до 4 ч.
13. Способ по п.12, где время составляет примерно от 1 до 3 ч.
14. Способ по п.13, где время составляет примерно от 1,5 до 2,5 ч.
15. Способ по п.1, где катализатор на основе переходного металла присутствует в количестве от 0,01 до 20 мол.% от количества соединения формулы I.
16. Способ по п.15, где катализатор на основе переходного металла присутствует в количестве от 0,1 до 10 мол.% от количества соединения формулы I.
17. Способ по п.16, где катализатор на основе переходного металла присутствует в количестве от 1 до 7 мол.% от количества соединения формулы I.
18. Способ по п.17, где реакционную смесь нагревают в течение примерно 24 ч.
19. Способ по п.18, где реакционную смесь нагревают в течение примерно от 0,5 до 8 ч.
20. Способ по п.19, где реакционную смесь нагревают в течение примерно от 0,5 до 4 ч.
21. Способ по п.20, где реакционную смесь нагревают в течение примерно от 0,5 до 2,25 ч.
22. Способ по п.1, где соединение формулы II используют в избытке от 1,001 до 10 эквивалентов на основе соединения формулы I.
23. Способ по п.22, где соединение формулы II используют в избытке от 1,01 до 5 эквивалентов от количества соединения формулы I.
24. Способ по п.23, где соединение формулы II используют в избытке 3 эквивалента от количества соединения формулы I.
25. Способ по п.1, где X представляет собой Br;
R2 и R3 независимо представляют собой Н, метил или этил;
R6 представляет собой NR4R5; где
R4 и R5 оба представляют собой C3алкил и
R1 представляет собой C1-C4алкил.
26. Соединение формулы
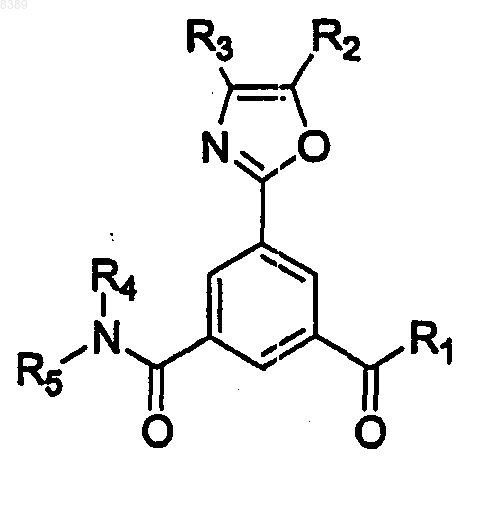
где R1 представляет собой ОН, галоген, C1-C4алкокси, -ОС(O)СH3 или -OC(O)CF3,
R2 и R3 независимо представляют собой Н или C1-C4алкил, и
R4 и R5 независимо представляют собой C1-C6алкил.
27. Соединение по п.26, где R2 и R3 независимо представляют собой Н или метил.
28. Соединение по п.27, где R4 и R5 оба представляют собой C3алкил.
29. Соединение по п.28, где R1 представляет собой ОН.
30. Соединение по п.29, которое представляет собой 3-(дипропилкарбамоил)-5-(оксазол-2-ил)бензойную кислоту.
31. Соединение по п.28, где R1 представляет собой C1-C4алкокси.
32. Соединение по п.31, которое представляет собой метил-3-(дипропилкарбамоил)-5-(оксазол-2-ил)бензоат.
33. Соединение по п.28, где R1 представляет собой хлор.
34. Способ получения соединений формулы
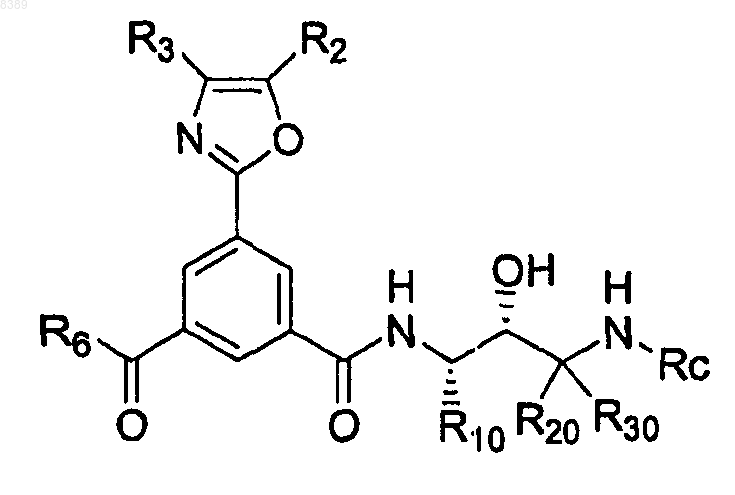
где R10 представляет собой 3,5-дифторбензил,
R20 и R30 представляют собой Н, и
Rc представляет собой 3-этилбензил или 1-(3-этинилбензил)циклопропил,
включающий взаимодействие соединения формулы III
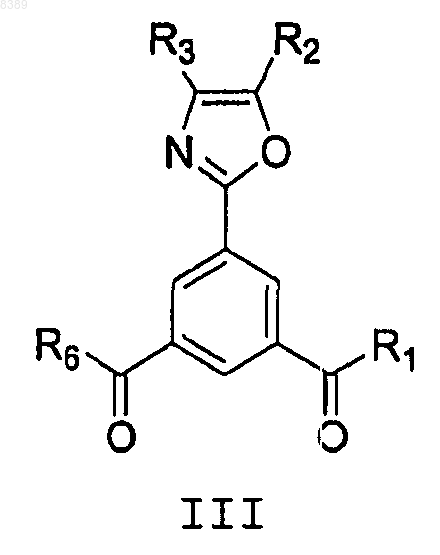
где R1 представляет собой ОН или галоген,
R2 и R3 независимо представляют собой Н, фенил или C1-C4 алкил, и
R6 представляет собой (C2Н5)N или (C3Н7)2N,
и соединения формулы VIII
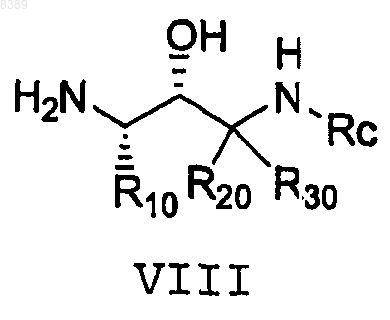
в растворителе.
35. Способ по п.34, где растворитель выбран из тетрагидрофурана, диметилформамида, CH2Cl2 и CHCl3.
36. Способ по п.34, где взаимодействие проводят в присутствии основания, которое представляет собой пиридин, коллидин, ди-трет-бутилпиридин, триэтиламин, диизопропилэтиламин, диметиламинопиридин или лутидин.
37. Способ по п.36, где реакционная смесь дополнительно включает агент, который представляет собой одно, два или три из следующих соединений:
1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид, 1-гидроксибензотриазола гидрат, бензотриазол, 1-гидрокси-7-азабензотриазол, О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат или 1,3-дициклогексилкарбодиимид.
Текст
008389 Предпосылки изобретения Эта заявка испрашивает приоритет предварительной заявки США 60/390285, поданной 20 июня 2002 г., и предварительной заявки США 60/450478, поданной 27 февраля 2003 г. Область изобретения Изобретение относится к способам получения сложных эфиров оксазолила, которые полезны в получении фармацевтически активных соединений. Изобретение также включает способы получения фармацевтически активных соединений. Изобретение также включает соединения, полезные в получении соединений и фармацевтических композиций для лечения болезни Альцгеймера и аналогичных состояний. Описание предшествующего уровня техникиSynthesis 583 (1996) раскрывает реакцию соединения арилгалогенидов или арилтрифлатов (арилтрифторметансульфонатов) с аддуктом оксазол-2-ила с хлоридом цинка с получением соответствующего арилоксазолила. В изобретении предложен способ осуществления реакции соединения, который неожиданно дает улучшенные выходы и во многих случаях уменьшает время реакции. Способы, описанные здесь, также подходят для получения конечных продуктов и/или промежуточных соединений, раскрытых в WO 02/02512. Краткое описание изобретения В первом аспекте изобретения предложен способ получения соединений формулы IIIR2 и R3 независимо представляют собой Н; фенил, возможно замещенный C1-C4 алкилом, C1C4 алкокси или диалкиламино; или C1-C4 алкил; илиR2 и R3 и атомы углерода, к которым они присоединены, образуют бензольное кольцо, которое может быть замещено C1-C4 алкилом, C1-C4 алкокси или диалкиламино; иR6 представляет собой C1-C6 алкокси, C1-C6 алкоксифенил или NR4R5; где R4 и R5 независимо представляют собой C1-C6 алкил или -C1-C6 алкилфенил; включающий взаимодействие соединения формулы I в присутствии катализатора, необязательного дополнительного агента и по меньшей мере одного растворителя. Во втором аспекте изобретения предложены соединения формулы III-аR2 и R3 независимо представляют собой Н; фенил, возможно замещенный C1-C4 алкилом, C1C4 алкокси или диалкиламино; или C1-C4 алкил; илиR2 и R3 и атомы углерода, к которым они присоединены, образуют бензольное кольцо, которое может быть замещено C1-C4 алкилом, C1-C4 алкокси или диалкиламино; иR6 представляет собой C1-C6 алкокси, C1-C6 алкоксифенил или NR4R5, где R4 и R5 независимо представляют собой C1-C6 алкил или -C1-C6 алкилфенил. Соединения формулы III-а полезны в получении фармацевтически активных соединений. Например, соединения формулы III-а полезны в получении различных фармацевтически активных соединений,раскрытых в опубликованной международной заявке WO 02/02512. В третьем аспекте изобретения предложен способ получения соединений формулы XX где R10 представляет собой -(CH2)1-2-S(O)0-2-(C1-C6 алкил), или C1-C10 алкил, возможно замещенный 1, 2 или 3 группами, независимо выбранными из галогена, -ОН, =O, -SH, -CN, -CF3, -C1-C3 алкокси, амино,моно- или диалкиламино, -N(R)C(O)R'-, -ОС(=O)-амино и -ОС(=O)-моно- или диалкиламино, или C2C6 алкенил или C2-C6 алкинил, каждый из которых может быть замещен 1, 2 или 3 группами, независимо выбранными из галогена, -ОН, -SH, -CN, -CF3, C1-C3 алкокси, амино и моно- или диалкиламино, или арил, гетероарил, гетероциклил, -C1-C6 алкиларил, -C1-C6 алкилгетероарил или -C1-C6 алкилгетероциклил,где циклические части каждого могут быть замещены 1, 2, 3 или 4 группами, независимо выбранными из группы, включающей галоген, -ОН, -SH, -СN, -NR105R'105, -CO2R, -N(R)COR' или-N(R)SO2R', -С(=O)-(C1-C4)алкил, SO2-амино, -SO2-моно- или диалкиламино, -С(=O)-амино, -С(=O)моно- или диалкиламино, -SO2-(C1-C4)алкил, или C1-C6 алкокси, возможно замещенный 1, 2 или 3 группами, которые независимо выбраны из галогена, или С 3-C7 циклоалкил, возможно замещенный 1, 2 или 3 группами, независимо выбранными из галогена, ОН, -SH, -С, -CF3, C1-C3 алкокси, амино, -C1-C6 алкила и моно- или диалкиламино, или C1-C10 алкил, возможно замещенный 1, 2 или 3 группами, независимо выбранными из галогена, -ОН, -SH, -CN, -CF3, -C1-C3 алкокси, амино, моно- или диалкиламино и -C1C3 алкила, или C2-C10 алкенил или C2-C10 алкинил, каждый из которых может быть замещен 1, 2 или 3 группами, независимо выбранными из галогена, -ОН, -SH, -CN, -CF3, C1-C3 алкокси, амино, C1-C6 алкила и моно- или диалкиламино; и гетероциклильная группа может быть дополнительно замещена оксогруппой; R и R' независимо представляют собой водород, C1-C10 алкил, C1-C10 алкиларил или C1C10 алкилгетероарил;R20 выбран из группы, включающей Н; C1-C6 алкил, возможно замещенный 1, 2 или 3 заместителями, которые независимо выбраны из группы, включающей C1-C3 алкил, галоген, -ОН, -SH, -CN, -CF3, C1C3 алкокси и -NR1-aR1-b; -(CH2)0-4-арил; -(CH2)0-4-гетероарил; C2-C6 алкенил; -C2-C6 алкинил; -CONRN-2RN-3;R1-a и R1-b независимо представляют собой -Н или C1-C6 алкил;R30 выбран из группы, включающей Н; C1-C6 алкил, возможно замещенный 1, 2 или 3 заместителями, независимо выбранными из группы, включающей C1-C3 алкил, галоген, -ОН, -SH, -CN, -CF3, C1C3 алкокси и -NR1-aR1-b; -(CH2)0-4-арил; -(CH2)0-4-гетероарил; C2-C6 алкенил; С 2-C6 алкинил; -CO-NRN-2RN-3;R20, R30 и атом углерода, к которому они присоединены, образуют карбоцикл из трех-семи атомов углерода, где один атом углерода может быть замещен группой, выбранной из -О-, -S-, -SO2- или -NRN-2-;RN-2 и RN-3 независимо выбраны из группы, включающей -C1-C8 алкил, возможно замещеннный 1, 2 или 3 группами, независимо выбранными из группы, включающей -ОН, -NH2, фенил и галоген; -C3C8 циклоалкил; -(C1-C2 алкил)-(C3-C8 циклоалкил); -(C1-C6 алкил)-O-(C1-C3 алкил); -C2-C6 алкенил; -C2C6 алкинил; -C1-C6 алкильную цепь с одной двойной связью и одной тройной связью; арил; гетероарил;-2 008389 гетероциклоалкил; или RN-2, RN-3 и атом азота, к которому они присоединены, образуют 5-, 6- или 7 членную гетероциклоалкильную или гетероарильную группу, где указанная гетероциклоалкильная или гетероарильная группа может быть сконденсирована с бензольным, пиридиновым или пиримидиновым кольцом, и указанные группы не замещены или замещены 1, 2, 3, 4 или 5 группами, которые независимо представляют собой C1-C6 алкил, C1-C6 алкокси, галоген, галоген-C1-C6 алкил, галоген-C1-C6 алкокси, -CN,-NO2, -NH2, NH(C1-C6 алкил), N(C1-C6 алкил)(C1-C6 алкил), -ОН, -C(O)NH2, -C(O)NH(C1-C6 алкил),-C(O)N(C1-C6 алкил)(C1-C6 алкил), C1-C6 алкокси-C1-C6 алкил, C1-C6 тиоалкокси и C1-C6 тиоалкокси-C1C6 алкил;C1-C10 алкил, возможно замещенный 1, 2 или 3 группами, независимо выбранными из группы, включающей R205, -OC=ONR235R240, -S(=O)0-2(C1-C6 алкил), -SH, -NR235C=ONR235R240, -C=ONR235R240, и-S(=O)2NR235R240, или -(CH2)0-3-(C3-C8)циклоалкил, где циклоалкил может быть замещен 1, 2 или 3 группами, независимо выбранными из группы, включающей R205, -CO2 Н и -CO2-(C1-C4 алкил), или циклопентильное, циклогексильное или циклогептильное кольцо, сконденсированное с арилом, гетероарилом или гетероциклилом, где один, два или три атома углерода циклопентила, циклогексила или циклогептила могут быть замещены гетероатомом или группой, независимо выбранными из NH, NR215, О или S(=O)0-2,и где циклопентильная, циклогексильная или циклогептильная группа может быть замещена одной или двумя группами, которые независимо представляют собой R205, =O, -CO-NR235R240 или -SO2-(C1-C4 алкил),или С 2-C10 алкенил или С 2-C10 алкинил, каждый из которых может быть замещен 1, 2 или 3 группами R205,где каждый арил и гетероарил может быть замещен 1, 2 или 3 R200, и где каждый гетероциклил может быть замещен 1, 2, 3 или 4 R210;R200 независимо выбран из группы, включающей -ОН, -NO2, галоген, -CO2H, CN, -(CH2)0-4-CONR220R225, -(CH2)0-4-СО-(C1-C12 алкил), -(CH2)0-4-СО-(С 2-C12 алкенил), -(CH2)0-4-СО-(С 2-С 12 алкинил),-(CH2)0-4-СО-(C3-C7 циклоалкил), -(CH2)0-4-СО-арил, (CH2)0-4-СО-гетероарил, -(CH2)0-4-СО-гетероциклил,-(CH2)0-4-CO-O-R215, -(CH2)0-4-SO2-NR220R225, -(CH2)0-4-SO-(C1-C8 алкил), -(CH2)0-4-SO2-(C1-C12 алкил),-(CH2)0-4-SO2-(C3-C7 циклоалкил), (CH2)0-4-N(H или R215)-CO-O-R215, -(CH2)0-4-N(H или R215)-CO-N(R215)2,-(CH2)0-4-N-CS-N(R215)2, -(CH)0-4-N(-H или R215)-CO-R220, -(CH2)0-4-NR220R225, -(CH2)0-4-О-СО-(C1-C6 алкил),-(CH2)0-4-O-P(O)-(OR240)2, -(CH2)0-4-O-CO-N(R2I5)2, -(CH2)0-4-O-CS-N(R215)2, -(CH2)0-4-O-(R215), -(CH2)0-4-O(R215)-COOH, -(CH2)0-4-S-(R215), -(CH2)0-4-O-(C1-C6 алкил, возможно замещенный 1, 2, 3 или 5 -F), C3C7 циклоалкил, -(CH2)0-4-N(H или R215)-SO2-R220, -(CH2)0-4-С 3-C7 циклоалкил, или C1-C10 алкил, возможно замещенный 1, 2 или 3 группами R205, или С 2-C10 алкенил или С 2-C10 алкинил, каждый из которых может быть замещен 1 или 2 группами R205, где арильные и гетероарильные группы могут быть замещены 1, 2 или 3 группами, которые независимо представляют собой R205, R210, или C1-C6 алкил, замещенный 1, 2 или 3 группами, которые независимо представляют собой R205 или R210, и где гетероциклильная группа может быть замещена 1, 2 или 3 группами, которые независимо представляют собой R210;R205 независимо выбран из группы, включающей C1-C6 алкил, галоген, -ОН, -О-фенил, -SH,-CN, -CF3, C1-C6 алкокси, NH2, NH(C1-C6 алкил) или N-(C1-C6 алкил)(C1-C6 алкил);R210 независимо выбран из группы, включающей галоген, C1-C6 алкокси, C1-C6 галогеналкокси,-NR220R225, ОН, CN, -СО-(C1-C4 алкил), -SO2-NR235R240, -СО-NR235R240, -SO2-(C1-C4 алкил), =O, или C1C6 алкил, С 2-C6 алкенил, С 2-C6 алкинил или C3-C7 циклоалкил, каждый из которых может быть замещен 1, 2 или 3 группами R205;R215 независимо выбран из группы, включающей C1-C6 алкил, -(CH2)0-2-(арил), С 2-C6 алкенил, С 2C6 алкинил, C3-C7 циклоалк:ил и -(CH2)0-2-(гетероарил), -(CH2)0-2-(гетероциклил), где арильная группа может быть замещена 1, 2 или 3 группами, которые независимо представляют собой R205 или R210, и где гетероциклильные и гетероарильные группы могут быть замещены 1, 2 или 3 R210;R220 и R225 независимо выбраны из группы, включающей -Н, -C3-C7 циклоалкил, -(C1-С 2 алкил)-(C3C7 циклоалкил), (C1-C6 алкил)-O-(C1-C3 алкил), -С 2-C6 алкенил, -С 2-C6 алкинил, -C1-C6 алкильную цепь с одной двойной связью и одной тройной связью, -арил, -гетероарил и -гетероциклил, или -C1-C10 алкил, возможно замещенный -ОН, -NH2 или галогеном, где арильные, гетероциклильные и гетероарильные группы могут быть замещены 1, 2 или 3 группами R270,R235 и R240 независимо представляют собой Н или C1-C6 алкил;R245 и R250 независимо выбраны из группы, включающей -Н, C1-C4 алкил, C1-C4 алкиларил, C1C4 алкилгетероарил, C1-C4 гидроксиалкил, C1-C4 алкокси, C1-C4 галогеналкокси, -(CH2)0-4-C3-C7 циклоалкил,-3 008389R245 и R250 вместе с атомом углерода, к которому они соединены, образуют карбоцикл из 3, 4, 5, 6 или 7 атомов углерода, где один атом углерода может быть замещен гетероатом, выбранным из -О-, -S-,-SO2- и -NR220-;R255 и R260 независимо выбраны из группы, включающей -Н, -(CH2)1-2-S(O)0-2-(C1-C6 алкил), -(C1C4 алкил)арил, -(C1-C4 алкил)гетероарил, -(C1-C4 алкил)гетероциклил, -арил, -гетероарил, -гетероциклил,-(CH2)1-4-R265-(CH2)0-4-арил, -(CH2)1-4-R265-(CH2)0-4-гетероарил, -(CH2)1-4-R265-(CH2)0-4-гетероциклил, илиC1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил или -(CH2)0-4-C3-C7 циклоалкил, каждый из которых может быть замещен 1, 2 или 3 группами R205, где каждый арил или фенил может быть замещен 1, 2 или 3 группами,которые независимо представляют собой R205, R210 или C1-C6 алкил, замещенный 1, 2 или 3 группами,которые независимо представляют собой R205 или R210, и где каждый гетероциклил может быть замещен 1, 2, 3 или 4 R210;R265 независимо представляет собой -О-, -S- или -N(C1-C6 алкил)-;R270 независимо представляет собой R205, галоген-C1-C6 алкокси, C1-C6 галогеналкокси, NR235R240,-ОН, -CN, -СО-(C1-C4 алкил), -SO2-NR235R240, -CO-NR235R240, -SO2-(C1-C4 алкил), =О, или C1-C6 алкил, C2C6 алкенил, C2-C6 алкинил или -(CH2)0-4-C3-C7 циклоалкил, каждый из которых может быть замещен 1, 2 или 3 группами R205; включающий взаимодействие соединения формулы III-аR2 и R3 независимо представляют собой Н, фенил или C1-C4 алкил; илиR2 и R3 и атомы углерода, к которым они присоединены, образуют бензольное кольцо, которое может быть замещено C1-C4 алкилом, C1-C4 алкокси или диалкиламино; иR6 представляет собой C1-C6 алкокси или NR4R5; где R4 и R5 независимо представляют собой C1C6 алкил; с соединением формулы VIII в растворителе, возможно в присутствии основания и дополнительного агента, представляющего собой, например, амидный связывающий агент, используемого в приготовлении соединений формулы I. Соединения формулы VIII могут быть получены, например, согласно способам, описанным в опубликованной международной заявке WO 02/02512. В еще одном аспекте изобретения предложен способ превращения соединений формулы III в соединения формулы III-а. В еще одном аспекте изобретения предложено соединение формулы III-аR2 и R3 независимо представляют собой Н, фенил или C1-C4 алкил; илиR2 и R3 и атомы углерода, к которым они присоединены, образуют бензольное кольцо, которое может быть замещено C1-C4 алкилом, C1-C4 алкокси или диалкиламино; иR6 представляет собой C1-C6 алкокси или NR4R5; где R4 и R5 независимо представляют собой C1C6 алкил. Соединения формулы III-а полезны в получении фармацевтически активных соединений, раскрытых в WO 02/02512. В другом аспекте изобретения предложен способ получения аддукта хлорида цинка с оксазолом формулы II. Подробное описание изобретения Как указано выше, в одном аспекте изобретения предложены способы получения соединений формулы III с использованием соединений формулы II. В предпочтительном способе получения соединений формулы III с использованием соединений формулы II катализатор представляет собой катализатор на основе переходного металла. Более предпочтительно, он представляет собой платиновый или палладиевый катализатор. Еще более предпочтительно,он представляет собой Pd(0) катализатор. Еще более предпочтительно, этот катализатор представляет собой Pd(PPh3)4, PdCl2(PPh3)2, PdCl2, PdCl2 и PPh3 или Pd(OCOCH3)2. Наиболее предпочтительно, этот катализатор представляет собой Pd(PPh3)4. В предпочтительном способе реакцию выполняют в растворителе. Более предпочтительно, способ осуществляют по меньшей мере в одном полярном, апротонном растворителе. Еще более предпочтительно, растворитель представляет собой тетрагидрофуран, тетраметилтетрагидрофуран, диметоксиэтан(glyme), метил-трет-бутиловый эфир или их смеси. Еще более предпочтительно, растворитель представляет собой тетрагидрофуран. В предпочтительном способе реакцию выполняют при температуре примерно от 25 С до температуры кипения используемого растворителя. Более предпочтительно, температура находится в интервале примерно от 30 до 75 С. Еще более предпочтительно, температура находится в интервале примерно от 40 до 60 С. Еще более предпочтительно, температура находится в интервале от 45 до 55 С. Предпочтительно все реагенты могут быть объединены сразу, т.е. почти в одно и то же время, или в пределах короткого периода времени. В альтернативном способе реакционную смесь формируют путем объединения соединения формулы I, соединения формулы II, катализатора и любого дополнительного компонента (при необходимости) в течение периода времени примерно от 0,5 до 4 ч, называемым временем добавления. Более предпочтительно, чтобы время добавления составляло примерно от 1 до 3 ч. Еще более предпочтительно, чтобы время добавления составляло примерно от 1,5 до 2,5 ч. Наиболее предпочтительно, чтобы оно составляло 2 ч. Следует заметить, что соединение формулы I может быть добавлено к смеси, содержащей соединение формулы II, или наоборот. Например, соединение формулы II может быть добавлено к реакционной смеси, например, раствору, содержащему соединение формулы I и катализатор. Или соединение формулы I и катализатор могут быть добавлены к реакционной смеси, например, раствору, содержащему соединение формулы II. В предпочтительном способе катализатор на основе переходного металла присутствует в количестве от 0,01 до 20 мол.% от количества соединения формулы I. Более предпочтительно, катализатор присутствует в количестве от 0,1 до 10 мол.% от количества соединения формулы I. Еще более предпочтительно, катализатор присутствует в количестве от 1 до 7 мол.% от количества соединения формулы I. В предпочтительном способе после того, как все соединения и реагенты были объединены с образованием реакционной смеси, эту реакционную смесь нагревают при указанных выше температурах в течение примерно от 0,5 до 24 ч. Более предпочтительно, реакционную смесь нагревают в течение примерно от 0,5 до 4 ч. Еще более предпочтительно, реакционную смесь нагревают в течение примерно от 0,5 до 2,25 ч. В предпочтительном способе соединение формулы II используют в избытке от 1,001 до 10 эквивалентов от количества соединения формулы I. Предпочтительно, соединение формулы II используют в избытке от 1,01 до 5 эквивалентов от количества соединения формулы I. Еще более предпочтительно,соединение формулы II используют в избытке от 1,05 до 4 эквивалентов от количества соединения формулы I. Еще более предпочтительно, второе соединение используют в избытке от 1,1 до 1,7 эквивалента-5 008389 от количества соединения формулы I. В наиболее предпочтительном воплощении используют примерно 3 эквивалента. В предпочтительном способе получения соединений формулы III, X представляет собой Br; R2 и R3 независимо представляют собой Н, метил или этил; R6 представляет собой NR4R5, где R4 и R5 оба представляют собой C3 алкил; и R1 представляет собой C1-C4 алкил. В этом аспекте R1 более предпочтительно представляет собой метил или этил. В другом аспекте изобретения предложен улучшенный способ получения аддукта хлорида цинка с оксазолом формулы II. В предпочтительном аспекте соединение формулы II получают, используя твердый ZnCl2. Предпочтительно, для получения соединения формулы II используют примерно от 1,1 до 10 эквивалентов ZnCl2 от количества конкретного используемого оксазола. Более предпочтительно, используют примерно от 1,1 до 5 эквивалентов ZnCl2. Еще более предпочтительно, используют примерно от 2,5 до 3,5 эквивалентовZnCl2. Предпочтительные соединения формулы III и формулы III-а включают соединения, где R2 и R3 независимо представляют собой Н, метил или фенил; или R2, R3 и атомы углерода, к которым они присоединены, образуют бензольное кольцо. Более предпочтительно, R2 и R3 независимо представляют собой Н или метил. Еще более предпочтительно, R2 и R3 оба представляют собой Н. Более предпочтительные соединения формулы III и формулы III-а включают соединения, где R6 представляет собой NR4R5, где R4 и R5 оба представляют собой C3 алкил, или R4 и R5 независимо представляют собой C1-C4 алкил или бензил. Предпочтительно, R4 и R5 оба представляют собой C3 алкил. Альтернативно, R4 и R5 независимо представляют собой C1-C4 алкил или бензил. Еще более предпочтительные соединения формулы III-а включают соединения, где R6 представляет собой NR4R5, где R4 и R5 оба представляют собой C3 алкил, или R4 и R5 независимо представляют собойC1-C4 алкил или бензил. Предпочтительно, R4 и R5 оба представляют собой C3 алкил. Альтернативно, R4 иR5 независимо представляют собой C1-C4 алкил или бензил; и R1 представляет собой ОН. Еще более предпочтительные соединения формулы III включают соединения, где R6 представляет собой NR4R5, где R4 и R5 оба представляют собой C3 алкил, или R4 и R5 независимо представляют собойC1-C4 алкил или бензил. Предпочтительно, R4 и R5 оба представляют собой C3 алкил. Альтернативно, R4 иR5 независимо представляют собой C1-C4 алкил или бензил; и R1 представляет собой C1-C4 алкокси, более предпочтительно, R1 представляет собой метил или этил. Еще более предпочтительно, R1 представляет собой метил. Еще более предпочтительные соединения формулы III-а включают соединения, где R6 представляет собой NR4R5, где R4 и R5 оба представляют собой C3 алкил, или R4 и R5 независимо представляют собойC1-C4 алкил или бензил. Предпочтительно, R4 и R5 оба представляют собой C3 алкил. Альтернативно, R4 иR5 независимо представляют собой C1-C4 алкил или бензил; и R1 представляет собой галоген, более предпочтительно, R1 представляет собой хлор. Еще более предпочтительные соединения формулы III-а включают соединения, где R6 представляет собой NR4R5; где R4 и R5 оба представляют собой C3 алкил, или R4 и R5 независимо представляют собойC1-C4 алкил или бензил. Предпочтительно, R4 и R5 оба представляют собой С 3 алкил. Альтернативно, R4 и R5 независимо представляют собой C1-C4 алкил или бензил; и R1 представляет собойOС(O)СН 3 или -OC(O)CF3. В другом аспекте предпочтительные соединения формулы III и формулы III-а представляют собой такие соединения, где R6 представляет собой C1-C6 алкокси или C1-C6 алкоксифенил, более предпочтительно R6 представляет собой C1-C4 алкокси или бензилокси. Еще более предпочтительно, R6 представляет собой метокси или этокси. Еще более предпочтительно, R6 представляет собой метокси. Другие предпочтительные соединения формулы III-а включают соединения, где R2 и R3 независимо представляют собой Н, фенил или C1-C4 алкил; или R2 и R3 и атомы углерода, к которым они соединены,образуют бензольное кольцо, которое может быть замещено C1-C4 алкилом, C1-C4 алкокси или диалкиламино; и R6 представляет собой C1-C6 алкокси или NR4R5, где R4 и R5 независимо представляют собой C1C6 алкил. Еще одни предпочтительные соединения формулы III-а включают соединения, где R2 и R3 независимо представляют собой Н, фенил или C1-C4 алкил. Другие предпочтительные соединения формулы III-а представляют собой соединения, где R6 пред-6 008389 ставляет собой NR4R5, где R4 и R5 представляют собой C1-C6 алкил. Еще одни предпочтительные соединения формулы III-а представляют собой соединения, где R2 и R3 независимо представляют собой Н, фенил или C1-C4 алкил; и R6 представляет собой NR4R5, где R4 и R5 представляют собой C1-C6 алкил. Еще одни предпочтительные соединения формулы III-а представляют собой соединения, где R1 представляет собой ОН. Еще одни предпочтительные соединения формулы III-а представляют собой соединения, где R1 представляет собой ОН; и R2 и R3 независимо представляют собой Н, фенил или C1-C4 алкил. Более предпочтительно, когда R1 представляет собой ОН, то R2 и R3 независимо представляют собой Н, метил или этил. Также предпочтительными, когда R1 представляет собой ОН, являются соединения, где R2 и R3 независимо представляют собой Н или фенил. Еще одни предпочтительные соединения формулы III-а представляют собой соединения, где R1 представляет собой ОН; и R2 и R3 независимо представляют собой Н, фенил или C1-C4 алкил. Более предпочтительно, R2 и R3 независимо представляют собой Н, метил или этил. Также предпочтительными являются соединения, где R2 и R3 независимо представляют собой Н или фенил; и R6 представляет собойNR4R5, где R4 и R5 представляют собой C1-C6 алкил. Более предпочтительно, R4 и R5 оба представляют собой C3 алкил. Также предпочтительно, когда R4 и R5 оба представляют собой C2 алкил. Также предпочтительно, когда R4 и R5 оба представляют собой C4 алкил. Как указано выше, в изобретении предложен способ получения соединения формулы XX. В одном аспекте способ получения соединений формулы XX осуществляют в растворителе. Предпочтительно, растворитель представляет собой ТГФ, ДМФА, CH2Cl2, CHCl3 или их смесь. Полезные сорастворители включают гексан, гептан, н-метилпирролидин, трифторэтан, тетраметилтетрагидрофуран и циклогексан. Возможное основание представляет собой обычно амин, предпочтительно третичный амин. Примеры подходящих аминооснований выбраны из пиридина, коллидина, ди-трет-бутилпиридина, триэтиламина, диизопропилэтиламина, диметиламинопиридина, лутидина и их смесей. Возможный дополнительный агент представляет собой обычно амидный связывающий агент. Примеры подходящих амидных связывающих агентов представляют собой 1, 2 или 3 из следующих соединений: 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (также известный как EDC и/илиEDCI), 1-гидроксибензотриазола гидрат (НОВТ), бензотриазол, 1-гидрокси-7-азабензотриазол (НОAT),O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HATU), O-бензотриазол-1 ил-N,N,N',N'-тетраметилурония гексафторфосфат (HBTU), PYBop, Вор, BopCl или 1,3 дициклогексилкарбодиимид (DCC). Реакцию предпочтительно осуществляют в течение примерно от 0,5 до 24 ч. Более предпочтительное время реакции составляет примерно от 2 до 16 ч. Предпочтительно реакцию осуществляют при температуре примерно от -5 до 70 С. Более предпочтительно, при температуре примерно от 0 до 50 С. Еще более предпочтительно, при температуре примерно от 15 до 40 С. Еще более предпочтительно, при температуре примерно от 20 до 40 С. В другом аспекте соединение формулы III-а используют в избытке по отношению к количеству соединения формулы VIII. Предпочтительно используют примерно от 1,01 до 5 эквивалентов соединения формулы III-а. Более предпочтительно используют примерно от 1,1 до 3 эквивалентов соединения формулы III-а. В другом аспекте, когда реакцию проводят в присутствии основания, его используют 1) в каталитическом количестве, 2) в соотношении один к одному по отношению к количеству соединения формулыIII-а, или 3) в избытке. При использовании в каталитическом количестве можно применять примерно от 0,01 до 0,99 эквивалента от количества соединения формулы III-а. При использовании в избытке можно применять от 1,0001 до примерно 30 эквивалентов основания. Более предпочтительно, используют от 1,001 до примерно 20 эквивалентов основания. Еще более предпочтительно, используют от 1,01 до примерно 10 эквивалентов основания. Более предпочтительно, используют от 1,1 до примерно 5 эквивалентов основания. Однако специалисту в данной области будет понятно, что точное количество основания(или даже заменяющего другого основания) может варьировать без отклонения от рамок изобретения. При использовании любых дополнительных агентов, специалист в данной области подберет соответствующее количество дополнительного агента, которое следует добавить. Применение таких агентов известно в области органического синтеза и медицинской химии. Это известно также в области пептидного синтеза и амидосочетаний. Определения Под "алкилом" и "C1-C6 алкилом" в настоящем изобретении подразумевают алкильные группы с прямой или разветвленной цепью, имеющие 1-6 атомов углерода, такие как метил, этил, пропил, изопропил, н-бутил, втор-бутил, трет-бутил, пентил, 2-пентил, изопентил, неопентил, гексил, 2-гексил, 3-гексил и 3-метилпентил. Предполагают, что в тех случаях, когда алкильная цепь заместителя (например, алкила, алкокси или алкенильной группы) короче или длиннее 6 атомов углерода, это будет указано во втором "С", как на-7 008389 пример, "C1-C10" указывает максимальное количество атомов углерода, равное 10. Под "алкокси" и "C1-C6 алкокси" в настоящем изобретении подразумевают алкильные группы с прямой или разветвленной цепью, имеющие 1-6 атомов углерода, присоединенные по меньшей мере через один двухвалентный атом кислорода, такие как, например, метокси, этокси, пропокси, изопропокси,н-бутокси, втор-бутокси, трет-бутокси, пентокси, изопентокси, неопентокси, гексокси и 3 метилпентокси. Под термином "галоген" в настоящем изобретении подразумевают фтор, бром, хлор и йод. Под термином "OTf" подразумевают -OSO2CF3. Под термином "OMs" подразумевают -ОSO2CH3."Алкенил" и "C2-C6 алкенил" означает прямые и разветвленные углеводородные радикалы, имеющие от 2 до 6 атомов углерода и от одной до трех двойных связей, и включает, например, этенил, пропенил, 1-бут-3-енил, 1-пент-3-енил, 1-гекс-5-енил и т.п."Алкинил" и "C2-C6 алкинил" означает прямые и разветвленные углеводородные радикалы, имеющие от 2 до 6 атомов углерода и одну или две тройные связи, и включает этинил, пропинил, бутинил,пентин-2-ил и т.п. Используемый здесь термин "циклоалкил" относится к насыщенным карбоциклическим радикалам,имеющим от трех до двенадцати атомов углерода. Циклоалкил может представлять собой моноциклическую или полициклическую конденсированную систему. Примеры таких радикалов включают циклопропил, циклобутил, циклопентил и циклогексил. Предпочтительные циклоалкильные группы представляют собой циклопентил, циклогексил и циклогептил. Циклоалкильные группы при этом являются незамещенными или, как указано, замещенными в одном или более чем одном замещаемом положении разными группами. Например, такие циклоалкильные группы могут быть, возможно, замещены, например,C1-C6 алкилом, C1-C6 алкокси, галогеном, гидрокси, циано, нитро, амино, моно(C1-C6)алкиламино, ди(C1C6)алкиламино, C2-C6 алкенилом, C2-C6 алкинилом, C1-C6 галогеналкилом, C1-C6 галогеналкокси, амино(C1C6)алкилом, моно(C1-C6)алкиламино(C1-C6)алкилом или ди(С 1-C6)алкиламино(C1-C6)алкилом. Под "арилом" подразумевают ароматическую карбоциклическую группу, имеющую один цикл (например, фенил), множество циклов (например, дифенил), или поликонденсированные циклы, в которых по меньшей мере один является ароматическим (например, 1,2,3,4-тетрагидронафтил, нафтил), который является возможно моно-, ди- или тризамещенным. Предпочтительные арильные группы по настоящему изобретению представляют собой фенил, 1-нафтил, 2-нафтил, инданил, инденил, дигидронафтил, тетралинил или 6,7,8,9-тетрагидро-5H-бензо[а]циклогептенил. Арильные группы при этом являются незамещенными или, как указано, замещенными в одном или более чем одном замещаемом положении разными группами. Например, такие арильные группы могут быть, возможно, замещены, например, C1C6 алкилом, C1-C6 алкокси, галогеном, гидрокси, циано, нитро, амино, моно(C1-C6)алкиламино, ди(C1C6)алкиламино, C2-C6 алкенилом, C2-C6 алкинилом, C1-C6 галогеналкилом, C1-C6 галогеналкокси, амино(C1C6)алкилом, моно(C1-C6)алкиламино(C1-C6)алкилом или ди(C1-C6)алкиламино(C1-C6)алкилом. Под "гетероарилом" подразумевают одну или более ароматических циклических систем из 5-, 6 или 7-членных циклов, которые включают конденсированные циклические системы из 9-11 атомов, содержащие по меньшей мере от одного до четырех гетероатомов, выбранных из азота, кислорода или серы. Предпочтительные гетероарильные группы по настоящему изобретению включают пиридинил, пиримидинил, хинолил, бензотиенил, индолил, индолинил, пиридазинил, пиразинил, изоиндолил, изохинолил, хиназолинил, хиноксалинил, фталазинил, имидазолил, изоксазолил, пиразолил, оксазолил, тиазолил,индолизинил, индазолил, бензотиазолил, бензимидазолил, бензофуранил, фуранил, тиенил, пирролил,оксадиазолил, тиадиазолил, триазолил, тетразолил, оксазолопиридинил, имидазопиридинил, изотиазолил, нафтиридинил, циннолинил, карбазолил, бета-карболинил, изохроманил, хроманил, тетрагидроизохинолил, изоиндолинил, изобензотетрагидрофуранил, изобензотетрагидротиенил, изобензотиенил, бензоксазолил, пиридопиридинил, бензотетрагидрофуранил, бензотетрагидротиенил, пуринил, бензодиоксолил, триазинил, феноксазинил, фенотиазинил, птеридинил, бензотиазолил, имидазопиридинил, имидазотиазолил, дигидробензизоксазинил, бензизоксазинил, бензоксазинил, дигидробензизотиазинил, бензопиранил, бензотиопиранил, кумаринил, изокумаринил, хромонил, хроманонил, пиридинил-N-оксид, тетрагидрохинолил, дигидрохинолил, дигидрохинолинонил, дигидроизохинолинонил, дигидрокумаринил,дигидроизокумаринил, изоиндолинонил, бензодиоксанил, бензоксазолинонил, пирролил-N-оксид, пиримидинил-N-оксид, пиридазинил-N-оксид, пиразинил-N-оксид, хинолил-N-оксид, индолил-N-оксид, индолинил-Nоксид, изохинолил-N-оксид, хиназолинил-N-оксид, хиноксалинил-N-оксид, фталазинил-Nоксид, имидазолил-N-оксид, изоксазолил-N-оксид, оксазолил-N-оксид, тиазолил-N-оксид, индолизинилN-оксид, индазолил-N-оксид, бензотиазолил-N-оксид, бензимидазолил-N-оксид, пирролил-N-оксид, оксадиазолил-N-оксид, тиадиазолил-N-оксид, триазолил-N-оксид, тетразолил-N-оксид, бензотиопиранилN-оксид, бензотиопиранил-S,S-диоксид. Гетероарильные группы при этом являются незамещенными или, как указано, замещенными в одном или более чем одном замещаемом положении разными группами. Например, такие гетероарильные группы могут быть, возможно, замещены, например, C1-C6 алкилом,C1-C6 алкокси, галогеном, гидрокси, циано, нитро, амино, моно(C1-C6)алкиламино, ди(C1-C6)алкиламино,C2-C6 алкенилом, C2-C6 алкинилом, С 1-C6 галогеналкилом, C1-C6 галогеналкокси, амино(C1-C6)алкилом,-8 008389 моно(C1-C6)алкиламино(C1-C6)алкилом или ди(C1-C6)алкиламино(C1-C6)алкилом. Под "гетероциклом", "гетероциклоалкилом" или "гетероциклилом" подразумевают одну или более карбоциклических кольцевых систем из 4-, 5-, 6- или 7-членных циклов, которые включают конденсированные кольцевые системы из 9-11 атомов, содержащие по меньшей мере от одного до четырех гетероатомов, выбранных из азота, кислорода или серы. Предпочтительные гетероциклы по настоящему изобретению включают морфолинил, тиоморфолинил, тиоморфолинил-S-оксид, тиоморфолинил-S,S-диоксид,пиперазинил, гомопиперазинил, пирролидинил, пирролинил, тетрагидропиранил, пиперидинил, тетрагидрофуранил, тетрагидротиенил, гомопиперидинил, гомоморфолинил, гомотиоморфолинил, гомотиоморфолинил-S,S-диоксид, оксазолидинонил, дигидропиразолил, дигидропирролил, дигидропиразинил,дигидропиридинил, дигидропиримидинил, дигидрофурил, дигидропиранил, тетрагидротиенил-S-оксид,тетрагидротиенил-S,S-диоксид и гомотиоморфолинил-S-оксид. Гетероциклические группы при этом являются незамещенными или, как указано, замещенными в одном или более чем одном замещаемом положении разными группами. Например, такие гетероциклические группы могут быть, возможно, замещены, например, C1-C6 алкилом, C1-C6 алкокси, галогеном, гидрокси, циано, нитро, амино, моно(C1C6)алкиламино, ди(C1-C6)алкиламино, C2-C6 алкенилом, C2-C6 алкинилом, C1-C6 галогеналкилом, C1C6 галогеналкокси, амино(C1-C6)алкилом, моно(C1-C6)алкиламино(C1-C6)алкилом, ди(C1-C6)алкиламино(C1-C6)алкилом или =O. В изобретении предложены способы превращения соединений формулы III в соединения формулыIII-а. Такие способы приведены на схемах В и С (где X1 такой, как определено ниже) и обсуждаются более подробно ниже. Способы превращения сложного эфира в амид хорошо известны в данной области. Такие способы включают, например, щелочной гидролиз с использованием LiOH, NaOH или KOH в качестве основания, или кислотный гидролиз с использованием HCl, H2SO4, H3PO4, трифторметансульфоновой кислоты, пара-толуолсульфоновой кислоты или HNO3. В изобретении также предполагается применение комбинации двух или более кислот или комбинации двух или более оснований для осуществления гидролиза. Другие способы будут очевидны для специалиста в данной области. Превращение кислоты в хлорангидрид предпочтительно достигается при использовании SOCl2,SO2Cl2 или оксалилхлорида. Другие реагенты, известные в данной области, также могут быть использованы для осуществления этого превращения. Превращение кислоты в имидазолильное соединение предпочтительно выполняют с использованием карбонилдиимидазола (КДИ). Превращение кислоты в кислотный ангидрид достигается путем обработки этой кислоты другим кислотным ангидридом, таким как уксусный ангидрид (при этом образуется смешанный ангидрид), или это превращение может быть осуществлено путем дегидратации двух молекул кислоты при нагревании или с использованием другого дегидратирующего агента. Обработка кислотным ангидридом более предпочтительна. В промышленном масштабе одним из предпочтительных способов получения ангидрида является нагревание. Способы по изобретению приведены на следующих схемах. Схема A Сложный эфир III оксазолила может быть использован in situ (в реакционной смеси) или выделен. Специалисты в данной области, пытаясь удалить соли цинка, часто добавляют кислоту для осаждения солей цинка. Здесь, при добавлении кислоты, целевой сложный эфир III оксазолила будет протонироваться и также осаждаться. Поэтому предпочтительней обрабатывать реакционную смесь, добавляя насыщенный раствор хлорида аммония к сырой реакционной смеси и экстрагируя подходящим органическим растворителем, таким как этилацетат. В этом способе сложный эфир III оксазолила переходит в органическую фазу, а соли цинка остаются в водной фазе.- 11008389 Схема А иллюстрирует получение аддукта ZnCl2 с оксазолом. В способе, представленном на схеме,применяют твердый ZnCl2. Могут быть использованы и растворы ZnCl2, но твердый ZnCl2 является предпочтительным. Используемым алкиллитиевым основанием может быть н-бутиллитий, третбутиллитий, втор-бутиллитий или метиллитий, причем н-бутиллитий является предпочтительным. Обработка оксазолов литием описана у Hodges с соавт. (J. Org. Chem. 1991, 56, 449) и Whitney S.Е. с соавт. (J.Org. Chem. 1991, 56, 3058), и в ссылках, приведенных здесь. Схема В иллюстрирует реакцию между соединением формулы I (где R6 представляет собой ди-нпропиламин, X представляет собой Br, и R1 представляет собой алкокси) и аддуктом хлорида цинка с оксазолом формулы II с образованием соединения формулы III. Сложный эфир затем гидролизуют или иным путем расщепляют с образованием карбоновой кислоты. Схема С иллюстрирует превращение карбоновой кислоты формулы IV в галогенид кислоты или имидазолид (соединение формулы V, где X1 представляет собой Cl или имидазолил соответственно) или кислотный ангидрид (соединение формулы VI). Схема С далее иллюстрирует реакцию соединения кислоты (IV), хлористого (или бромистого) ангидрида (V), кислотного ангидрида (VI) или имидазолида (V) с амином формулы VIII с образованием соединения формулы X. Амино- и/или спиртовая группы в соединениях формулы VIII могут быть защищены перед осуществлением реакции соединения. Специалист в данной области может определить необходимость применения защитных групп. См., например, Wuts иGreen "Protective Groups in Organic Synthesis", третье издание. Эти реакции соединения также известны специалистам в данной области. Соединения формулы X, являющиеся продуктами присоединения, раскрыты в общих чертах в международной публикации WO 02/02512 на основе PCT/US01/21012. Кроме того, международная публикация WO02/02512 раскрывает, что замещенные амины формулыX получают путем взаимодействия RN кислоты, галогенида кислоты, ангидрида или карбонилимидазольного соединения с соответствующим амином формулы VIII. Схемы D и Е раскрывают способ получения одного возможного амина формулы VIII. Схема F иллюстрирует реакцию соединения формулы I с амином формулы VIII с образованием амида формулы XI. Следует отметить, что согласно этой схеме соединение формулы I не подвергалось реакции соединения с аддуктом хлорида цинка с оксазолом перед соединением с амином формулы VIII. Соединение XI затем может быть подвергнуто взаимодействию с аддуктом хлорида цинка с оксазолом с образованием соединения XII. Защитная группа затем может быть удалена с образованием соединения формулы X. Все температуры представлены в градусах Цельсия. КДИ обозначает 1,1'-карбонилдиимидазол. МТБЭ обозначает метил-трет-бутиловый эфир. ТСХ обозначает тонкослойную хроматографию. ВЭЖХ обозначает высокоэффективную жидкостную хроматографию. Хроматография (колоночная и флэш-хроматография) означает очистку/разделение соединений и характеризуется используемым сорбентом и элюентом. Подразумевается, что соответствующие фракции собирают и концентрируют с получением целевого соединения (соединений). ЯМР обозначает ядерную (протонную) магнитно-резонансную спектроскопию, химические сдвиги указаны в млн-1(d) относительно ТМС (тетраметилсилана). СМР обозначает 13 С магнитно-резонансную спектроскопию, химические сдвиги указаны в млн-1 относительно ТМС. МС обозначает масс-спектрометрию, выраженную в единицах m/e, m/z или масса/заряд. [М+Н]+ обозначает положительный ион исходной молекулы плюс атом водорода. ЭУ обозначает электронный удар. ХИ обозначает химическую ионизацию. ББА обозначает бомбардировку быстрыми атомами. ЭРМС обозначает масс-спектрометрию с ионизацией электрораспылением. ТГФ обозначает тетрагидрофуран. Эфир обозначает диэтиловый эфир. Рассол обозначает водный насыщенный раствор хлорида натрия. Тетракис(трифенилфосфин)палладий обозначает Pd(PPh3)4. Фармацевтически приемлемый относится к таким свойствам и/или веществам, которые являются приемлемыми для изготовления фармацевтического препарата с физической/химической точки зрения,что касается композиции, приготовления и стабильности. Когда используют пары растворителей, то соотношения используемых растворителей выражают как объем/объем (об./об.). Для раствора твердого вещества в растворителе соотношение твердого вещества к растворителю выражают как вес/объем (вес./об.). Дихлорбис(трифенилфосфин)палладий (II) обозначается как (PdCl2(PPh3)2). Трифенилфосфина оксид обозначается как Ph3PO.Prot обозначает защитную группу или водород. Защитные группы хорошо известны специалистам в данной области. Дополнительная информация о защитных группах может быть найдена у Wuts и Green в- 12008389 Палладиевые(0) катализаторы представляют собой катализаторы, содержащие палладий со степенью окисления ноль. Палладиевые(0) катализаторы включают, но не ограничиваются, Pd(PPh3)4,PdCl2(PPh3)2, PdCl2, PdCl2 и PPh3, Pd(OCOCH3)2 и о-Tol)3P)2PdCl2. Специалист в данной области обнаружит, что некоторые из вышеупомянутых палладиевых(0) катализаторов содержат палладий в окисленном состоянии, например, Pd(II)Cl2. Специалист в данной области легко обнаружит, что варианты палладиевых(0) катализаторов могут быть получены в реакционной смеси с применением бутиллития, DIBALH или других реагентов, известных в области органического синтеза. См., например, Negishi с соавт. (J.Pd(PPh3)4. Примеры Исходные вещества, в основном, легко доступны из коммерческих источников, таких как SigmaAldrich Corp. (St. Louis, МО), или могут быть получены, как описано здесь. Способы, показанные выше на схемах и представленные ниже в примерах, не рассматриваются в качестве ограничивающих рамки или сущность изобретения конкретными реагентами и условиями, представленными в них. Специалистам в данной области ясно, что исходные вещества, реагенты и условия могут быть изменены, и могут быть использованы дополнительные стадии в способах по изобретению и для получения соединений,охватываемых данным изобретением. В некоторых случаях может понадобиться защита активных функциональных групп для достижения желаемых превращений. В основном такая потребность в защитных группах, а также условия, необходимые для присоединения и удаления таких групп, будут очевидны специалистам в области органического синтеза. Если не указано иначе в представленных ниже схемах, то переменные величины такие, как определено выше. Все ссылки, упомянутые в этой заявке, включены во всей их полноте посредством ссылки. Все реагенты имеют техническую частоту, если не указано иначе. Все реакции перемешивают или иным способом подвергают смешиванию. Если не указано иначе, растворители не дегазировали. Синтез 1. трет-Бутил-(1S,2R)-1-(3,5-дифторбензил)-3-[1-(3-этинилфенил)циклопропил]амино-2 гидроксипропилкарбамат. Стадия (А). Получение бромфенилциклопропилнитрила (2). Смесь 1-бром-2-хлорэтана (120 мл), 3-бромбензилцианида (1,25 г) и бензилтриэтиламмония хлорида (1,1 г) перемешивают при 40, в это время добавляют по каплям водный раствор гидроксида натрия(50%, 120 г) в течение примерно 20 мин. Во время добавления водного основания температура реакции повышается до примерно 80. Реакционную смесь очень энергично перемешивают, пока температура медленно падает до 50 (в течение примерно 3 ч). Через 3 ч реакционную смесь охлаждают до 20-25,добавляют воду (100 мл), и смесь перемешивают в течение 5 мин. Органическую фазу отделяют и водную фазу экстрагируют дихлорметаном (3 раза). Объединенные органические фазы промывают водой и разбавляют соляной кислотой. Органическую фазу затем сушат над сульфатом магния, фильтруют и концентрируют. Концентрат очищают высоковакуумным фракционированием, используя установку короткими насадками и одним приемником. Фракции с т.пл.=108-115/0,1-0,05 мм рт.ст. собирают; после охлаждения до 20-25 эта жидкость затвердевает. Стадия (В). Получение бромамида (3). Бромфенилциклопропилнитрил 2), стадия (А), 5,9 г; 26,6 ммоль) растворяют в метаноле (150 мл). Добавляют гидроксид калия (25% водный раствор, 0,68 мл) и перекись водорода (30%, 35 мл), и реакционную смесь нагревают при 55 в течение 5 ч. Смесь концентрируют с получением сырого бромамида. Стадия (С). Получение бромзамещенной кислоты (4). Сырой бромамид 3), стадия (В суспендируют в метаноле (10 мл) и добавляют гидроксид натрия(10% водный, 150 мл). Реакционную смесь кипятят с обратным холодильником в течение 4,5 ч. Реакционную смесь затем охлаждают до 20-25, подкисляют соляной кислотой (15%) до рН=2 и концентрируют. Полученный осадок (6,8 г) собирают фильтрацией. Стадия (D). Получение хлорангидрида (5). Тионилхлорид (2,73 мл) и бензотриазол (4,47 г) растворяют в сухом дихлорметане (25 мл). 22,2 мл(1,25 эквивалента) затем добавляют порциями в течение нескольких минут к сырой бромзамещенной кислоте 4), стадия (С), 6,8 г) в дихлорметане (120 мл). Перед тем как закончится добавление, гидрохлорид бензотриазола начинает выпадать в виде белого твердого вещества. Реакционную смесь перемешивают еще 15 мин, и осадки затем отфильтровывают. Фильтрат перемешивают с безводным сульфатом магния (2 г) для разложения избыточного реагента. Осадки отфильтровывают, и фильтрат концентрируют при пониженном давлении и сушат под высоким вакуумом в течение примерно 1 ч с получением целевого продукта (6,6 г). Стадия (Е). Получение бромамина (6). Сырой хлорангидрид 5), стадия (D растворяют в сухом ацетоне (40 мл), охлаждают до -10 и обрабатывают азидом натрия (4 г в 15 мл воды). После перемешивания в течение 1 ч при -10 смесь оставляют нагреваться до 0 и вливают в холодную воду (300 мл). Азид экстрагируют в минимально возможном количестве толуола (примерно 40 мл). Толуольную фазу отделяют и промывают водой и сушат надNa2SO4. Осадки отфильтровывают, и фильтрат осторожно нагревают при 100 в течение 1 ч. Концентри- 13008389 рованную соляную кислоту (примерно 25 мл) добавляют через конденсатор, и смесь нагревают с обратным холодильником в течение 15 мин. При охлаждении формируется осадок, который отфильтровывают. Фильтрат слегка концентрируют, охлаждают и собирают дополнительную порцию осадка. Объединенные осадки сушат с получением целевого продукта (4,1 г) в виде гидрохлоридной соли. Стадия (F). Получение 3,5-дифторбензил-бромзамещенного соединения (7). Сырой бромамин 6), стадия (Е), 2 г; 8 ммоль) растворяют в насыщенном карбонате натрия (20 мл) и экстрагируют дихлорметаном (510 мл). Объединенные экстракты сушат и концентрируют. Экстракт,содержащий бромамин (1,68 г, 7,92 ммоль), растворяют в изопропаноле (20 мл) и добавляют ВОСзащищенный-3,5-дифторбензилэпоксид (ii, Международная публикация WO02/02512, пример 3, 2,36 г,7,92 ммоль). Смесь нагревают до 80 в запаянной трубке в течение 16 ч. Реакционную смесь концентрируют с получением сырого 3,5-дифторбензил-бромзамещенного соединения (3,9 г). Стадия (G). Получение силилзамещенного соединения (8). Сырое 3,5-дифторбензил-бромзамещенное соединение 7), стадия (F), 3,9 г; 7,0 ммоль; 1 эквивалент) растворяют в триэтиламине (20 мл). Затем добавляют дихлорбис(трифенил-фосфин)палладий(II)(0,196 г, 0,28 ммоль; 0,04 эквивалента) и CuI (0,068 г; 0,36 ммоль; 0,05 эквивалента). Реакционную смесь нагревают до кипения и одной порцией добавляют триметилсилилацетилен (0,82 г, 1,2 мл, 8,2 ммоль, 1,2 эквивалента). Реакционную смесь кипятят с обратным холодильником в течение 3 ч в токе азота, затем охлаждают до 20-25 перед распределением между водным насыщенным карбонатом натрия и этилацетатом. Органическую фазу отделяют и водную фазу экстрагируют этилацетатом (325 мл). Объединенные органические экстракты промывают рассолом, сушат над Na2SO4, фильтруют и концентрируют с получением целевого силилзамещенного соединения. Стадия (Н). Получение ВОС-защищенного-ацетиленового соединения (8 а). Тетрабутиламмония фторид (1M в ТГФ, 8 мл) добавляют к раствору сырого силилзамещенного соединения 8), стадия (G в ТГФ (5 мл). Реакционную смесь перемешивают в течение 1 ч при 20-25 и затем концентрируют. Концентрат растворяют в эфире (30 мл), промывают рассолом, сушат над Na2SO4,фильтруют и концентрируют. Сырой продукт очищают флэш-хроматографией (силикагель; этилацетат/гексан, смесь 2/3) с получением указанного в заголовке соединения. Пример 1. Метил-1-[3-[(Дипропиламино)карбонил]-5-(1,3-оксазол-2-ил)]бензоат. Соединение 13 может быть получено следующим образом. н-Бутиллитий (1,4 эквивалента) добавляют по каплям в течение 30 мин к перемешиваемой, охлажденной до -78 смеси 1,3-оксазола (1,3 эквивалента) в ТГФ, поддерживая смесь при температуре ниже примерно -55 С. Смесь перемешивают в течение 30 мин и затем добавляют твердый хлорид цинка (3 эквивалента) в 3-10 приемов в течение примерно 10-15 мин. Охлаждающую баню затем удаляют, реакционную смесь оставляют нагреваться до 2025, и реакцию затем перемешивают в течение еще 10 мин. Затем в течение 2 ч к смеси метил-3-бром-5[(дипропиламино)карбонил]бензоата (10, WO 02/02512, PREPARATION 3) и тетракис(трифенилфосфин)палладия (5 мол.%) в ТГФ при 50 добавляют аддукт (12) хлорида цинка с оксазолом. Реакционную смесь перемешивают при 50 до тех пор, пока метил-3-бром-5-[(дипропиламино)карбонил]бензоат 10 не будет больше обнаруживаться с помощью ВЭЖХ (примерно 1 ч). Время удерживания в ВЭЖХ=3,9 мин (колонка: luna длиной 15 см с фенилгексилом; ацетонитрил/вода, 0,2 М формиат аммония; 65/35, =210 нм; 1,0 мл/мин). Реакционную смесь охлаждают до 20-25 и добавляют метил-трет-бутиловый эфир и соляную кислоту (1 н). Фазы разделяют и водную фазу трижды экстрагируют метил-трет-бутиловым эфиром. Объединенные органические фазы концентрируют при пониженном давлении с получением твердого вещества. Продукт очищают, используя хроматографию на силикагеле (этилацетат/октан (25/75) - этилацетат/октан (50/50 с получением указанного в заголовке соединения с 84% выходом; ЯМР (d6-ДМСО) 8,50, 8,28, 8,10, 7,94, 7,44, 3,90, 3,38-3,14, 1,62-1,49 и 0,99-0,67 ; СМР (d6-ДМСО) 168,56, 164,99, 159,29,140,98, 138,77, 130,95, 128,41, 127,69, 126,53, 54,91, 52,67, 50,14, 45,93, 21,46, 20,27, 11,30 и 10,80 . Пример 2. Метил-1-[3-[(дипропиламино)карбонил]-5-(1,3-оксазол-2-ил)]бензоат. В предпочтительном аспекте соединение 13 может быть получено следующим образом. н-Бутиллитий (405 мл, 1,0 моль, 1,4 эквивалента) добавляют по каплям в течение примерно 30 мин к оксазолу (50,32 г, 0,73 моль, 1,3 эквивалента) в охлажденном до -78 ТГФ, поддерживая смесь при температуре ниже примерно -55 С. Твердый хлорид цинка (300 г, 2,2 моль, 3 эквивалента) добавляют в 3-10 приемов в течение примерно 10-15 мин, и реакционную смесь нагревают до 20-25 путем удаления охлаждающей бани. После достижения 20-25, реакцию перемешивают в течение еще 10 мин и затем добавляют метил 3-бром-5-[(дипропиламино)карбонил]бензоат (10,155 г, 0,45 моль, 1 эквивалент) и тетракис(трифенилфосфин)палладий (5 мол.%). Реакционную смесь затем нагревают до температуры образования флегмы и перемешивают до тех пор, пока исходное вещество не будет израсходовано. После того как завершение реакции будет подтверждено ВЭЖХ, реакционную смесь охлаждают до 20-25, и сырую реакционную смесь концентрируют досуха. К полученному твердому веществу добавляют NH4Cl и EtOAc. Фазы разделяют и водную фазу экстрагируют этилацетатом. Органические слои объединяют и промывают насыщенным водным хлоридом аммония. Растворитель удаляют при пониженном давлении с получением указанного в заголовке соединения. Время удерживания в ВЭЖХ=3,5 мин (колонка: luna длиной 15 см с фенилгексилом; ацетонитрил/вода, 60/40; =210 нм; 1,0 мл/мин). Это вещество может быть очищено с помощью хроматографии на силикагеле (этилацетат/октан(25/75) - этилацетат/октан (50/50 или использовано без очистки на следующей стадии. Альтернативную обработку реакционной смеси осуществляют следующим образом. После того как реакция завершится, реакционную смесь охлаждают до 20-25 С и концентрируют с получением твердого остатка. К остатку добавляют EtOAc (1 л) и насыщенный NH4Cl (1 л). Слои разделяют и водный слой экстрагируют EtOAc (2100 мл). Объединенные органические слои затем промывают насыщенным NH4Cl (2100 мл) и концентрируют с получением целевого продукта. Пример 3. 1-[3-[(Дипропиламино)карбонил]-5-(1,3-оксазол-2-ил)]бензойная кислота (14). Водный гидроксид натрия (2 н, 120 мл, 4 эквивалента) добавляют порциями к смеси метил-1-[3[(дипропиламино)карбонил]-5-(1,3-оксазол-2-ил)]бензоата (13, пример 2) в метаноле (300 мл) при 20-25. Полученную суспензию перемешивают при 20-25 в течение 1 ч, завершение реакции подтверждают ВЭЖХ. Затем добавляют воду (3 объема относительно метанола), слои разделяют, и водный слой экстрагируют МТБЭ до тех пор, пока трифенилфосфина оксид не будет больше определяться в водном слое с помощью ВЭЖХ. рН водного слоя доводят концентрированной соляной кислотой до значения менее единицы, и продукт экстрагируют в этилацетате (200 мл). Этилацетатную фазу отделяют и затем перегоняют при пониженном давлении при добавлении октана, который вызывает осаждение кислоты. Полученные осадки собирают фильтрацией и сушат при пониженном давлении с получением указанного в заголовке соединения. Время удерживания в ВЭЖХ=1,1 мин (колонка: luna длиной 15 см с фенилгексилом; ацетонитрил/вода; 60/40; =210 нм; 1,0 мл/мин). Пример 4. (2R,3S)-3-амино-4-(3,5-дифторфенил)-1-[1-(3-этинилфенил)циклопропил]аминобутан 2-ол (17). Ацетилхлорид (84 мл, 1,18 моль, 15 эквивалентов в пересчете на защищенное 3,5 дифторбензилзамещенное соединение) медленно добавляют к перемешиваемому метанолу (250 мл). (В альтернативном варианте могут быть использованы HCl или ТФУ). Смесь перемешивают в течение по меньшей мере 15 мин, в это время медленно добавляют трет-бутил-(1S,2R)-1-(3,5-дифторбензил)-3-[1(3-этинилфенил)циклопропил]амино-2-гидроксипропилкарбамат (WO 02/02512, PREPARATION 1, 37,8 г, 0,08 моль, 1 эквивалент), растворенный в метаноле (100 мл). Затем смесь перемешивают при 20-25 до тех пор, пока завершение реакции не подтвердится ВЭЖХ. После того как реакция завершится, удаляют метанол при пониженном давлении, и полученный остаток растворяют в воде (500 мл). Эту смесь промывают МТБЭ (2200 мл), и объединенные органические фазы промывают соляной кислотой (1 н, 100 мл). рН объединенных водных фаз доводят с помощью основания до значения более 10 и затем экстрагируют МТБЭ (2200 мл). Объединенные органические фазы затем концентрируют досуха при пониженном давлении с получением указанного в заголовке соединения. Время удерживания в ВЭЖХ=3,9 мин (колонка: luna длиной 15 см с фенилгексилом; ацетонитрил/вода, 0,2 М формиат аммония; 65/35, =210 нм; 1,0 мл/мин). Этот продукт затем может быть растворен в ТГФ и использован без очистки в реакции присоединения. Пример 5. N1-(1S,2R)-1-(3,5-дифторбензил)-3-[(3-этилбензил)амино]-2-гидроксипропил-5-(1,3 оксазол-2-ил)-N3,N3-дипропилизофталамид (19). Твердую 1-[3-[(дипропиламино)карбонил]-5-(1,3-оксазол-2-ил)] бензойную кислоту (14, пример 3,1,0 эквивалент) медленно добавляют к КДИ (1,3 эквивалента) в ТГФ комнатной температуры. Полученную смесь перемешивают в течение по меньшей мере 1 ч, в это время ее медленно добавляют в течение 1 ч к охлажденной до -35 смеси (2R,3S)-3-амино-4-(3,5-дифторфенил)-1-[(3-этилбензил)амино]бутан-2 ола (18, Международная публикация WO 02/02512, 1,0 эквивалент) в ТГФ. После этого добавления реакционную смесь нагревают до 0 и перемешивают до тех пор, пока завершение реакции не подтвердится ВЭЖХ. После завершения реакции, содержимое вливают в соляную кислоту (1 н), и водную фазу отделяют и экстрагируют этилацетатом. Объединенные органические фазы промывают насыщенным бикарбонатом натрия и растворитель удаляют при пониженном давлении. Сырой продукт очищают, используя хроматографию на силикагеле, с получением указанного в заголовке соединения. Пример 6. N1-1S,2R)-1-(3,5-дифторбензил)-3-[1-(3-этинилфенил)циклопропил]амино-2-гидроксипропил)-5-(1,3-оксазол-2-ил)-N3,N3-дипропилизофталамид (20). Твердую 1-[3-[(дипропиламино)карбонил]-5-(1,3-оксазол-2-ил)]бензойную кислоту (14, пример 3,23 г, 0,08 моль, 1,0 эквивалент) медленно добавляют к смеси КДИ (14,6 г, 0,09 моль, 1,3 эквивалента) в ТГФ (150 мл). Полученную смесь перемешивают при 20-25 в течение по меньшей мере 1 ч, в это время ее медленно добавляют в течение 1 ч к охлажденной до -35 смеси (2R,3S)-3-амино-4-(3,5-дифторфенил)1-[1-(3-этинилфенил)циклопропил]аминобутан-2-ола (17, пример 4, 28 г, 0,08 моль, 1,0 эквивалент) в ТГФ (300 мл). После завершения этого добавления, реакцию оставляют нагреваться до 0. После того как реакция завершится, реакционную смесь вливают в соляную кислоту (1 н, 500 мл). Водную фазу затем отделяют и экстрагируют этилацетатом (2500 мл). Объединенные органические экстракты промывают насыщенным бикарбонатом натрия (250 мл) и затем концентрируют. Сырой продукт очищают, используя хроматографию на силикагеле, с получением указанного в заголовке соединения. Время удерживания в ВЭЖХ=4,7 мин (колонка: luna длиной 15 см с фенилгексилом, ацетонитрил/вода, 0,2 М формиат аммония, 65/35, =210 нм, 1,0 мл/мин). Изобретение и способ его осуществления и применения описаны теперь настолько полно, ясно и точно, что позволят любому специалисту в области, к которой это имеет отношение, осуществить и применить это изобретение. Следует отметить, что выше описаны предпочтительные воплощения настоящего изобретения и что могут быть осуществлены модификации без отклонения от сущности или рамок настоящего изобретения, как оно представлено в формуле изобретения. Для ясного изложения притязаний объект изобретения определен в формуле изобретения, которая завершает это описание.- 18008389 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулыR2 и R3 независимо представляют собой Н, фенил или C1-C4 алкил; илиR2 и R3 и атомы углерода, к которым они присоединены, образуют бензольное кольцо, которое может быть замещено C1-C4 алкилом, C1-C4 алкокси или диалкиламиногруппой; иR4 и R5 независимо представляют собой C1-C6 алкил,включающий взаимодействие соединения формулы I в присутствии катализатора и по меньшей мере одного растворителя. 2. Способ по п.1, где катализатор представляет собой катализатор на основе переходного металла. 3. Способ по п.2, где катализатор представляет собой Pd(PPh3)4, PdCl2(PPh3)2, PdCl2, PdCl2 и PPh3 или Pd(OCOCH3)2. 4. Способ по п.3, где катализатор представляет собой Pd(PPh3)4. 5. Способ по п.1, где взаимодействие осуществляют в присутствии одного дополнительного полярного апротонного растворителя. 6. Способ по п.5, где полярный апротонный растворитель представляет собой тетрагидрофуран,тетраметилтетрагидрофуран, диметоксиэтан, метил-трет-бутиловый эфир или их смесь. 7. Способ по п.6, где полярный апротонный растворитель представляет собой тетрагидрофуран. 8. Способ по п.1, где реакцию осуществляют при температуре примерно от 25 С до температуры кипения растворителя. 9. Способ по п.8, где температура находится в интервале примерно от 30 до 75 С. 10. Способ по п.9, где температура находится в интервале примерно от 40 до 60 С. 11. Способ по п.10, где реакционную смесь формируют путем объединения соединения формулы I,соединения формулы II и катализатора и любых возможных дополнительных агентов сразу или в течение короткого периода времени. 12. Способ по п.10, где реакционную смесь формируют в течение периода времени примерно от 0,5 до 4 ч. 13. Способ по п.12, где время составляет примерно от 1 до 3 ч. 14. Способ по п.13, где время составляет примерно от 1,5 до 2,5 ч. 15. Способ по п.1, где катализатор на основе переходного металла присутствует в количестве от 0,01 до 20 мол.% от количества соединения формулы I. 16. Способ по п.15, где катализатор на основе переходного металла присутствует в количестве от 0,1 до 10 мол.% от количества соединения формулы I. 17. Способ по п.16, где катализатор на основе переходного металла присутствует в количестве от 1 до 7 мол.% от количества соединения формулы I. 18. Способ по п.17, где реакционную смесь нагревают в течение примерно 24 ч. 19. Способ по п.18, где реакционную смесь нагревают в течение примерно от 0,5 до 8 ч. 20. Способ по п.19, где реакционную смесь нагревают в течение примерно от 0,5 до 4 ч.- 19008389 21. Способ по п.20, где реакционную смесь нагревают в течение примерно от 0,5 до 2,25 ч. 22. Способ по п.1, где соединение формулы II используют в избытке от 1,001 до 10 эквивалентов на основе соединения формулы I. 23. Способ по п.22, где соединение формулы II используют в избытке от 1,01 до 5 эквивалентов от количества соединения формулы I. 24. Способ по п.23, где соединение формулы II используют в избытке 3 эквивалента от количества соединения формулы I. 25. Способ по п.1, где X представляет собой Br;R2 и R3 независимо представляют собой Н, метил или этил;R4 и R5 оба представляют собой C3 алкил и где R1 представляет собой ОН, галоген, C1-C4 алкокси, -ОС(O)СH3 или -OC(O)CF3,R2 и R3 независимо представляют собой Н или C1-C4 алкил, иR4 и R5 независимо представляют собой C1-C6 алкил. 27. Соединение по п.26, где R2 и R3 независимо представляют собой Н или метил. 28. Соединение по п.27, где R4 и R5 оба представляют собой C3 алкил. 29. Соединение по п.28, где R1 представляет собой ОН. 30. Соединение по п.29, которое представляет собой 3-(дипропилкарбамоил)-5-(оксазол-2-ил) бензойную кислоту. 31. Соединение по п.28, где R1 представляет собой C1-C4 алкокси. 32. Соединение по п.31, которое представляет собой метил-3-(дипропилкарбамоил)-5-(оксазол-2 ил)бензоат. 33. Соединение по п.28, где R1 представляет собой хлор. 34. Способ получения соединений формулыRc представляет собой 3-этилбензил или 1-(3-этинилбензил)циклопропил,включающий взаимодействие соединения формулы III где R1 представляет собой ОН или галоген,R2 и R3 независимо представляют собой Н, фенил или C1-C4 алкил, и в растворителе. 35. Способ по п.34, где растворитель выбран из тетрагидрофурана, диметилформамида, CH2Cl2 иCHCl3. 36. Способ по п.34, где взаимодействие проводят в присутствии основания, которое представляет собой пиридин, коллидин, ди-трет-бутилпиридин, триэтиламин, диизопропилэтиламин, диметиламинопиридин или лутидин. 37. Способ по п.36, где реакционная смесь дополнительно включает агент, который представляет собой одно, два или три из следующих соединений: 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид, 1-гидроксибензотриазола гидрат,бензотриазол, 1-гидрокси-7-азабензотриазол, О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат или 1,3-дициклогексилкарбодиимид.
МПК / Метки
МПК: C07D 263/32
Метки: 5-(1, производных, 3-оксазол-2-ил)бензойной, получения, кислоты, способ
Код ссылки
<a href="https://eas.patents.su/22-8389-sposob-polucheniya-proizvodnyh-5-1-3-oksazol-2-ilbenzojjnojj-kisloty.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения производных 5-(1, 3-оксазол-2-ил)бензойной кислоты</a>
Предыдущий патент: Способ обнаружения и определения типа папилломавируса человека с использованием амплификации-гибридизации
Следующий патент: Система изолирования пространства ствола скважины
Случайный патент: Тренажер авиационный












