Новый способ синтеза периндоприла и его фармацевтически приемлемых солей
Формула / Реферат
1. Способ синтеза соединения формулы (I)
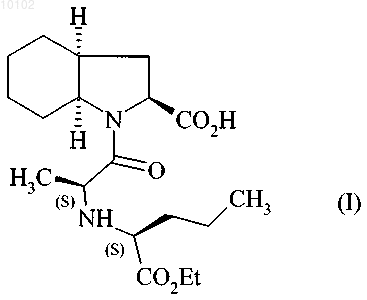
и его фармацевтически приемлемых солей,
отличающийся тем, что соединение формулы (II) с конфигурацией (S)
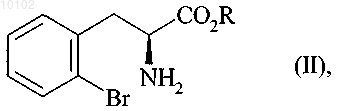
в которой R представляет собой атом водорода или защитную группу для карбоксильной группы, такую как бензильная, или линейная, или разветвленная (С1-С6)алкильная группа,
реагирует с соединением формулы (III) с конфигурацией (R)
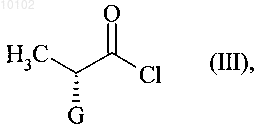
в которой G представляет собой атом хлора или брома или гидрокси, п-толуолсульфонилокси, метансульфонилокси или трифторметансульфонилоксигруппу,
в присутствии основания с получением соединения формулы (IV)
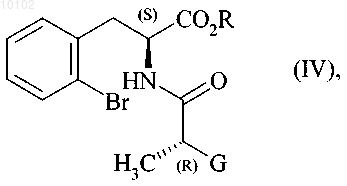
в которой R и G являются такими, как определено выше,
которое подвергают реакции внутримолекулярной конденсации с образованием соединения формулы (V)
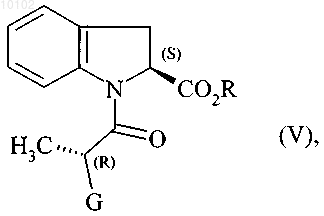
в которой R и G являются такими, как определено выше,
которое реагирует с образованием соединения формулы (VI)
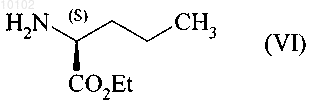
с образованием соединения формулы (VII)
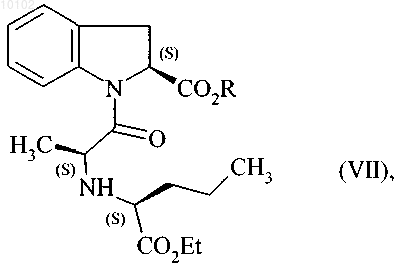
в которой R является таким, как определено выше,
которое подвергают реакции каталитического гидрирования с образованием после снятия защиты, если необходимо, соединения формулы (I).
2. Способ синтеза по п.1, отличающийся тем, что реакцию внутримолекулярного конденсирования проводят или в присутствии основания и катализатора на основе палладия или используя гидрид натрия и йодид меди(I) или бромид меди(I).
3. Способ синтеза по п.2, отличающийся тем, что реакцию внутримолекулярного конденсирования проводят в присутствии основания и катализатора на основе палладия и арилфосфина или бисфосфина.
4. Способ синтеза по п.3, отличающийся тем, что основание, используемое в реакции внутримолекулярного конденсирования, выбирают из Cs2CO3, NaOtBu, Na2CO3, NaOAc и KOAc.
5. Способ синтеза по п.3 или 4, отличающийся тем, что катализатор на основе палладия и арилфосфина или бисфосфина выбирают из Pd(0)/PPh3, Pd(0)/P(о-толил)3, Pd(0)/Р(1-нафтил)3, Pd(0)/Р(о-метоксифенил)3, Pd2(dba)3/PPh3, Pd2(dba)3/Р(о-толил)3, Pd2(dba)3/P(1-нафтил)3, Pd2(dba)3/P(o-метоксифенил)3, Pd2(dba)3/P(2-фурил)3, Pd2(dba)3/dppp, Pd2(dba)3/(+)-BINAP и (DPPF)PdCl2ЧCH2Cl2/DPPF,
под BINAP здесь понимают 2,2'-бис(дифенилфосфино)-1,1'-бинафтил,
под dba здесь понимают дибензилиденацетон,
под DPPF здесь понимают 1,1'-бис(дифенилфосфино)ферроцен
и под dppp здесь понимают 1,3-бис(дифенилфосфино)пропан.
6. Способ синтеза по п.1, отличающийся тем, что G представляет собой атом хлора, или брома, или п-толуолсульфонилокси, метансульфонилокси или трифторметансульфонилоксигруппу.
7. Способ синтеза по п.6, отличающийся тем, что реакцию между соединениями формул (V) и (VI) проводят в присутствии органического амина, который выбирают из триэтиламина, пиридина и диизопропилэтиламина или минерального основания, которое выбирают из Na2CO3, K2CO3, NaHCO3 и KHCO3.
8. Способ синтеза по п.1, отличающийся тем, что G представляет собой гидроксигруппу.
9. Способ синтеза по п.8, отличающийся тем, что реакцию между соединениями формул (V) и (VI) проводят в присутствии йодида N-метил-N-фениламинотрифенилфосфония или, когда R является другим, нежели атом водорода, с помощью реакции Мицунобу.
10. Соединение формулы (IV)
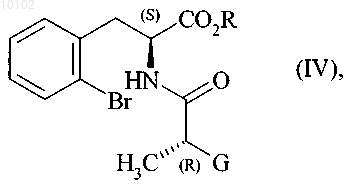
в которой R и G являются такими, как определено в п.1.
11. Способ по любому из пп.1-9 для синтеза периндоприла в форме его трет-бутиламиновой соли.
Текст
010102 Данное изобретение касается способа синтеза периндоприла формулы (I) и его фармацевтически приемлемых солей. Периндоприл и его фармацевтически приемлемые соли, и в особенности его трет-бутиламиновая соль, имеют ценные фармакологические свойства. Основным свойством периндоприла является ингибирование ангиотензин I конвертирующего фермента (или киназы II), что приводит, с одной стороны, к предотвращению превращения декапептида ангиотензина I в октапептид ангиотензин II (вазоконстриктор) и, с другой стороны, к предотвращению деградации брадикинана (вазодилатор) в неактивный пептид. Эти два действия обуславливают целебное действие периндоприла на кардиоваскулярные заболевания, более предпочтительно на артериальную гипертензию и сердечную недостаточность. Периндоприл, его получение и его применение в терапевтических целях описаны в описании европейского патента ЕР 0049658. Ввиду фармацевтической ценности этого соединения, важным является доступность его получения с помощью эффективного способа синтеза, легкость транспортировки в промышленных масштабах, что дает периндоприл с хорошим выходом и с превосходной чистотой, исходя из исходных материалов,имеющих умеренную цену. Патент ЕР 0308341 описывает промышленный синтез периндоприла путем конденсирования сложного этилового эфира (2S,3aS,7aS)-октагидроиндол-2-карбоновой кислоты со сложным этиловым эфиромN-[(S)-1-карбоксибутил]-(S)-аланина с последующим снятием защиты с карбоксильной группы гетероцикла при использовании каталитического гидрирования. Заявитель разработал новый способ синтеза периндоприла, который использует легкодоступные исходные материалы. Еще более представленное изобретение касается способа синтеза периндоприла и его фармацевтически приемлемых солей, где способ отличается тем, что соединение формулы (II) с конфигурацией (S) в которой R представляет собой атом водорода или защитную группу для карбоксильной группы,реагирует с соединением формулы (III) с конфигурацией (R) в которой G представляет собой атом хлора или брома или гидрокси, п-толуолсульфонилокси, метансульфонилокси или трифторметансульфонилоксигруппу,в присутствии основания с получением соединения формулы (IV) в которой R и G являются такими, как тут определено выше,которое подвергают реакции внутримолекулярной конденсации с образованием соединения формулы (V) в которой R и G являются такими, как тут определено выше,-1 010102 которое реагирует с соединением формулы (VI) с образованием соединения формулы (VII) в которой R является таким, как тут определено выше,которое подвергают реакции каталитического гидрирования с образованием после снятия защиты,если необходимо, соединения формулы (I). Среди защитных групп для карбоксильной группы можно упомянуть, без намека на какое-либо ограничение, бензильную и линейную или разветвленную (C1-С 6)алкильные группы. Среди оснований, которые могут быть использованы при реакции между соединениями формулы(II) и (III), можно упомянуть, без намека на какое-либо ограничение, органические амины, такие как триэтиламин, пиридин или диизопропилэтиламин, и минеральные основания, такие как NaOH, KOH,Na2CO3, K2CO3, NaHCO3 или KHCO3. Реакцию внутримолекулярного конденсирования предпочтительно проводят или в присутствии основания и катализатора на основе палладия, или используя гидрид натрия и йодид меди(I) или бромид меди(I). Катализаторами на основе палладия, которые предпочтительно используют в реакции конденсирования,являются катализаторы на основе палладия и арилфосфина или бисфосфина. Среди этих катализаторов можно упомянуть, без намека на какое-либо ограничение, Pd(0)/PPh3, Pd(0)/P(o-толил)3, Pd(0)/P(1-нафтил)3,Pd(0)/P(o-метоксифенил)3, Pd2(dba)3/PPh3, Pd2dba)3/Р(о-толил)3, Pd2(dba)3/Р(1-нафтил)3, Pd2(dba)3/Р(о-метоксифенил)3, Pd2dba)3/Р(2-фурил)3, Pd2(dba)3/dppp, Pd2(dba)3/-BINAP и (DPPF)PdCl2CH2Cl2/DPPF,под BINAP здесь понимают 2,2'-бис(дифенилфосфино)-1,1'-бинафтил, под dba здесь понимают дибензилиденацетон, под DPPF здесь понимают 1,1'-бис(дифенилфосфино)ферроцен и под dppp здесь понимают 1,3-бис(дифенилфосфино)пропан. Среди оснований, которые могут быть использованы для реакции конденсирования в присутствии катализатора на основе палладия, можно упомянуть, без намека на какое-либо ограничение, Cs2CO3,NaOtBu, Na2CO3, NaOAc и KOAc. Когда G представляет собой атом хлора или брома или п-толуолсульфонилокси, метансульфонилокси или трифторметансульфонилоксигруппу, реакцию между соединениями формул (V) и (VI) предпочтительно проводят в присутствии основания, предпочтительно органического амина, такого как триэтиламин, пиридин или диизопропилэтиламин, или минерального основания, такого как Na2CO3, K2CO3, NaHCO3 или KHCO3. Когда G представляет собой гидроксигруппу, реакцию между соединениями формул (V) и (VI) предпочтительно проводят в присутствии активирующего реагента, такого как йодид N-метил-N-фениламинотрифенилфосфония, или, когда R является другим, нежели атом водорода, с помощью реакции Мицунобу. Соединения формулы (IV) являются новыми продуктами, которые являются полезными как синтетические промежуточные продукты в химической и фармацевтической промышленности, особенно в синтезе периндоприла, и как таковые составляют неотъемлемую часть представленного изобретения. Соединения формулы (II) можно получить в соответствии с методикой, описанной в публикации J.Am. Chem. Soc. 1994, 116, 10847-10848. Пример 1. трет-Бутиламиновая соль (2S,3aS,aS)-1-(2S)-2-[(1S)-1-(этоксикарбонил)бутиламино]пропионилоктагидро-1H-индол-2-карбоновой кислоты. Стадия А. Бензил (2S)-3-(2-бромфенил)-2-[(2R)-2-бромпропаноил]аминопропаноат. В реактор вводят 25,7 г бензил (5)-2-бромфенилаланината и 1:50 мл дихлорметана, потом доводят температуру реакционной смеси до 0 С и прибавляют 20 мл диизопропилэтиламина после введения 13,2 г(2R)-2-бромпропионилхлорида. Потом температуру реакционной смеси доводят до комнатной температуры. После перемешивания на протяжении 1 ч при этой температуре промывают реакционную смесь водой и потом раствором разведенной уксусной кислоты и отгоняют растворители, получая указанное в заголовке соединение. Стадия Б. Бензил (2S)-1-[(2R)-2-бромпропаноил]-2-индолинкарбоксилат. В реактор вводят 15,5 г соединения, полученного на стадии выше, растворяют в толуоле и прибавляют 1,57 г Pd2(dba)3, 1,83 г Р(о-толил)3 и 21,5 г Cs2CO3. Потом температуру реакционной смеси доводят до 100 С. После перемешивания на протяжении 15 ч при этой температуре смесь оставляют охлаждаться до комнатной температуры и очищают с помощью хроматографии на силикагеле, получая указанное в-2 010102 заголовке соединение. Стадия В. Бензил (2S)-1-2S)-2-[(1S)-1-(этоксикарбонил)бутил]аминопропаноил)-2-индолинкарбоксилат. В реактор вводят 12,3 г этил (2S)-2-аминопентаноата, 16 мл триэтиламина и 16 мл ацетонитрила; потом температуру смеси доводят до 60 С, медленно прибавляют раствор 19,4 г соединения, полученного на стадии выше, растворенного в дихлорметане, и кипятят с обратным холодильником на протяжении 4 ч. После остывания до комнатной температуры промывают реакционную смесь водой и раствором разведенной уксусной кислоты и отгоняют растворители, получая указанное в заголовке соединение. Стадия Г. (2S,3aS,7aS)-1-(2S)-2-[(1S)-1-(Этоксикарбонил)бутиламино]пропионилоктагидро-1 Н-индол 2-карбоновая кислота. В аппарат для гидрирования вводят 20 г соединения, полученного на стадии выше, растворяют в уксусной кислоте и потом вводят 0,5 г 10% Pd/C. Гидрируют при давлении 0,5 бар в интервале от 15 до 30 С до абсорбции теоретического количества водорода. Удаляют катализатор фильтрованием и потом охлаждают до 0-5 С и собирают твердое вещество фильтрованием. Промывают остаток на фильтре и сушат его до постоянной массы, получая указанное в заголовке соединение, с энантиомерной чистотой 99%. Стадия Д. трет-Бутиламиновая соль (2S,3aS,7aS)-1-(2S)-2-[(1S)-1-(этоксикарбонил)бутиламино] пропионилоктагидро-1H-индол-2-карбоновой кислоты. Осадок, полученный на стадии выше (20 г), растворяют в 280 мл этилацетата и потом к нему прибавляют 4 г трет-бутиламина и 40 мл этилацетата. Полученную суспензию кипятят с обратным холодильником до полного растворения твердого вещества; полученный раствор фильтруют горячим и охлаждают до температуры 15-20 С при перемешивании. Полученный осадок отфильтровывают, снова получают из него пасту, используя этилацетат, сушат и потом размалывают, получая ожидаемый продукт с выходом 95%. Пример 2. трет-Бутиламиновая соль (2S,3aS,7aS)-1-(2S)-2-[(1S)-1-(этоксикарбонил)бутиламино] пропионилоктагидро-1H-индол-2-карбоновой кислоты. Стадия А. (2S)-3-(2-Бромфенил)-2-[(2R)-2-бромпропаноил]аминопропановая кислота. В реактор вводят 28,8 г (S)-2-бромфенилаланина, 7,5 мл воды и 15 мл толуола; потом температуру реакционной смеси доводят до 0-5 С и прибавляют 25 мл 5 М раствора гидроксида натрия и раствор 20,2 г(2R)-2-бромпропионилхлорида в толуоле, поддерживая в это время температуру ниже 10 С и рН смеси на 10 путем прибавления 5 М раствора гидроксида натрия. После перемешивания на протяжении еще 1 ч при 10 С прибавляют концентрированную хлороводородную кислоту до достижения рН смеси 6. Отделяют толуольную фазу и потом прибавляют концентрированную хлороводородную кислоту к водной фазе до достижения рН смеси отметки 2. Образовавшийся осадок отфильтровывают и сушат, получая указанное в заголовке соединение. Стадия Б. Идентично стадии Б примера 1. Стадия В. (2S)-1-2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропаноил)-2-индолинкарбоновая кислота. В реактор вводят 10,5 г этил (2S)-2-аминопентаноата, 13,5 мл триэтиламина и 13,5 мл ацетонитрила; потом температуру реакционной смеси доводят до 60 С и медленно прибавляют раствор 19,3 г соединения, полученного на стадии выше, в 130 мл дихлорметана и потом кипятят с обратным холодильником на протяжении 4 ч. После охлаждения до комнатной температуры промывают смесь водой и раствором разведенной уксусной кислоты; отгоняют растворители, получая указанное в заголовке соединение. Стадии Г и Д. Идентично стадиям Г и Д примера 1. Пример 3. трет-Бутиламиновая соль (2S,3aS,7aS)-1-(2S)-2-[(1S)-1-(этоксикарбонил)бутиламино] пропионилоктагидро-1 Н-индол-2-карбоновой кислоты. Стадия А. Бензил (2S)-3-(2-бромфенил)-2-[(2R)-2-(п-толуолсульфонилокси)пропаноил]аминопропаноат. В реактор вводят 25,7 г бензил (R)-2-бромфенилаланината и 150 мл дихлорметана; потом доводят температуру реакционной смеси до 0 С и прибавляют 20 мл диизопропилэтиламина и 20,2 г (1R)-2-хлор 1-метил-2-оксоэтил-п-толуолсульфонатхлорида. Потом смесь оставляют нагреваться до комнатной температуры. После перемешивания на протяжении 1 ч при комнатной температуре промывают смесь водой. Растворители отгоняют, получая указанное в заголовке соединение. Стадии Б-Д. Идентично стадиям Б-Д примера 1. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ синтеза соединения формулы (I)-3 010102 и его фармацевтически приемлемых солей,отличающийся тем, что соединение формулы (II) с конфигурацией (S) в которой R представляет собой атом водорода или защитную группу для карбоксильной группы, такую как бензильная, или линейная, или разветвленная (С 1-С 6)алкильная группа,реагирует с соединением формулы (III) с конфигурацией (R) в которой G представляет собой атом хлора или брома или гидрокси, п-толуолсульфонилокси, метансульфонилокси или трифторметансульфонилоксигруппу,в присутствии основания с получением соединения формулы (IV) в которой R и G являются такими, как определено выше,которое подвергают реакции внутримолекулярной конденсации с образованием соединения формулы (V) в которой R и G являются такими, как определено выше,которое реагирует с образованием соединения формулы (VI) с образованием соединения формулы (VII) в которой R является таким, как определено выше,которое подвергают реакции каталитического гидрирования с образованием после снятия защиты,если необходимо, соединения формулы (I). 2. Способ синтеза по п.1, отличающийся тем, что реакцию внутримолекулярного конденсирования проводят или в присутствии основания и катализатора на основе палладия или используя гидрид натрия и йодид меди(I) или бромид меди(I). 3. Способ синтеза по п.2, отличающийся тем, что реакцию внутримолекулярного конденсирования проводят в присутствии основания и катализатора на основе палладия и арилфосфина или бисфосфина. 4. Способ синтеза по п.3, отличающийся тем, что основание, используемое в реакции внутримолекулярного конденсирования, выбирают из Cs2CO3, NaOtBu, Na2CO3, NaOAc и KOAc. 5. Способ синтеза по п.3 или 4, отличающийся тем, что катализатор на основе палладия и арилфосфина или бисфосфина выбирают из Pd(0)/PPh3, Pd(0)/P(о-толил)3, Pd(0)/Р(1-нафтил)3, Pd(0)/Р(ометоксифенил)3,Pd2(dba)3/PPh3,Pd2(dba)3/Р(о-толил)3,Pd2(dba)3/P(1-нафтил)3,Pd2(dba)3/P(oметоксифенил)3, Pd2(dba)3/P(2-фурил)3, Pd2(dba)3/dppp, Pd2(dba)3/-BINAP и (DPPF)PdCl2CH2Cl2/DPPF,под BINAP здесь понимают 2,2'-бис(дифенилфосфино)-1,1'-бинафтил,-4 010102 под dba здесь понимают дибензилиденацетон,под DPPF здесь понимают 1,1'-бис(дифенилфосфино)ферроцен и под dppp здесь понимают 1,3-бис(дифенилфосфино)пропан. 6. Способ синтеза по п.1, отличающийся тем, что G представляет собой атом хлора, или брома, или п-толуолсульфонилокси, метансульфонилокси или трифторметансульфонилоксигруппу. 7. Способ синтеза по п.6, отличающийся тем, что реакцию между соединениями формул (V) и (VI) проводят в присутствии органического амина, который выбирают из триэтиламина, пиридина и диизопропилэтиламина или минерального основания, которое выбирают из Na2CO3, K2CO3, NaHCO3 и KHCO3. 8. Способ синтеза по п.1, отличающийся тем, что G представляет собой гидроксигруппу. 9. Способ синтеза по п.8, отличающийся тем, что реакцию между соединениями формул (V) и (VI) проводят в присутствии йодида N-метил-N-фениламинотрифенилфосфония или, когда R является другим, нежели атом водорода, с помощью реакции Мицунобу. 10. Соединение формулы (IV) в которой R и G являются такими, как определено в п.1. 11. Способ по любому из пп.1-9 для синтеза периндоприла в форме его трет-бутиламиновой соли.
МПК / Метки
МПК: C07C 309/73, C07C 229/36, C07K 5/06
Метки: приемлемых, солей, периндоприла, способ, фармацевтически, новый, синтеза
Код ссылки
<a href="https://eas.patents.su/6-10102-novyjj-sposob-sinteza-perindoprila-i-ego-farmacevticheski-priemlemyh-solejj.html" rel="bookmark" title="База патентов Евразийского Союза">Новый способ синтеза периндоприла и его фармацевтически приемлемых солей</a>
Предыдущий патент: Биокомплекс для производства парфюмерно-косметических средств
Следующий патент: Способ изготовления одноразовой посуды
Случайный патент: Гидравлико-инерционный преобразователь крутящего момента и способ преобразования крутящего момента при помощи данного устройства










