Производные сложных эфиров о-диметилтрамадола, способ их получения и применение для получения лекарственного препарата
Номер патента: 3742
Опубликовано: 28.08.2003
Авторы: Дель Кастильо Нието Хуан Карлос, Де Рамон Амат Элизабет, Чалаукс Фрейкса Мария, Угуэт Клотет Хоан, Моурелье Мансини Марисабель
Формула / Реферат
1. Производные сложных эфиров O-диметилтрамадола общей формулы (I)
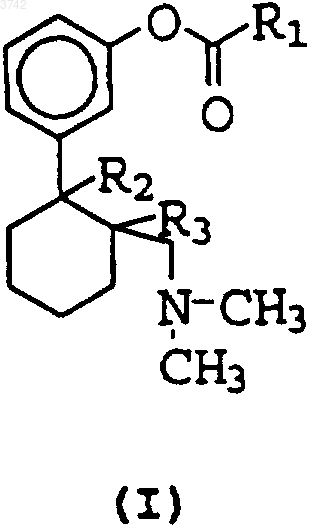
где R1
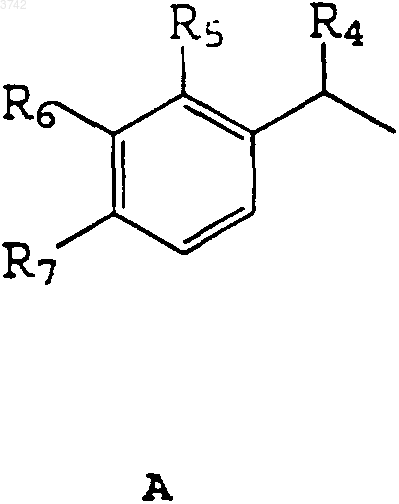
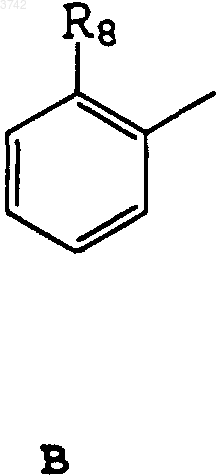
или

R2 - OH-группа;
R3 - атом водорода;
или R2 и R3 вместе образуют двойную связь;
R4 - атом водорода или C1-C3алкилгруппа;
R5 - атом водорода, NH2, NH-R11 или O-R11-группа;
R6 - атом водорода, CO-R11, O-R11-группы или атом галогена;
R7 - атом водорода, C1-C5-алкил-, C2-C5-O-алкенил-, фенилгруппы;
или R6 и R7 - CH=CR12-CR13=CH-группа, образующая возможно замещенное конденсированное ароматическое кольцо;
R8 - OH-, -O-CO-H(CH3)2 или NH-R11-группа;
R9 и R10 - атомы водорода или C1-C4алкилгруппы - одинаковые или разные или они образуют -CH2-CH2-группу,
R11 - фенилгруппа или фенилгруппа, замещенная одним или несколькими следующими заместителями: атомом галогена (хлор, бром, йод), NO2, C1-C6алкил-, C2-C6алкенил-, OH- или NH2-группой,
R12 и R13 - атомы водорода или C1-C3-O-алкилгруппы - одинаковые или разные, их соли и оптические изомеры.
2. Соединение по п.1, отличающееся тем, что R1 представляет собой A и R4 - метилгруппу или атом водорода, R5 - NH2-группу, 2,5-дихлорфениламиногруппу или атом водорода, R6 - замещенную CO-фенилгруппу или атом водорода, R7 - изобутилгруппу или атом водорода или R6 и R7 образуют замещенное конденсированное ароматическое кольцо.
3. Соединение по п.1, отличающееся тем, что R1 представляет собой B и R8 - OH- или -O-CO-N(CH3)2-группу.
4. Соединение по п.1, отличающееся тем, что R1 представляет собой C и R9 - метилгруппу или атом водорода или образует -CH2-CH2-группу с R10 и R11 - фенил- или толилгруппу.
5. Соединение по п.2, отличающееся тем, что его выбирают из следующих соединений:
-3-(2-диметиламинометил-1-гидроксициклогексил)фенил-2-(4-изобутилфенил)пропионата,
-3-(2-диметиламинометил-1-гидроксициклогексил)фенил-2-(6-метоксинафтален-2-ил)пропионата,
-3-(2-диметиламинометилциклогекс-1-енил)фенил-2-(4-изобутилфенил)пропионата,
-3-(2-диметаламинометилциклогекс-1-енил)фенил-2-(6-метоксинафтален-2-ил)пропионата.
6. Соединение по п.3, отличающееся тем, что его выбирают из следующих соединений:
-3-(2-диметиламинометил-1-гидроксициклогексил)фенил-2-гидроксибензоата,
-3-(2-диметиламинометилциклогекс-1-енил)фенил-2-гидроксибензоата,
-3-(2-диметиламинометил-1-гидроксициклогексил)фенил-2-диметилкарбамоилоксибензоата,
-3-(2-диметиламинометилциклогекс-1-енил)фенил-2-диметилкарбамоилоксибензоата.
7. Соединение по п.4, отличающееся тем, что представляет собой следующее соединение:
-3-(2-диметиламинометил-1-гидроксициклогексил)фенил-5-бензоил-2,3-дигидро-1H-пирролизин-1-карбоксилат.
8. Способ получения соединения по п.1, отличающийся тем, что соединение формулы (II) реагирует с соединением формулы (III)
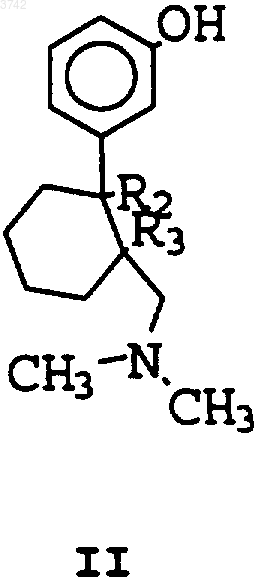

где R2 - OH-группа,
R3 - атом водорода,
или R2 и R3 вместе образуют двойную связь,
X - OH-группа, атом галогена,  -группа, OR14-группа,
-группа, OR14-группа,
R14 - C1-C6алкил-, фенилгруппа или замещенная фенилгруппа и
R1 представляет собой
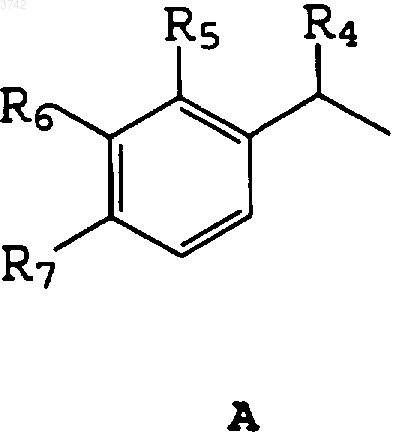
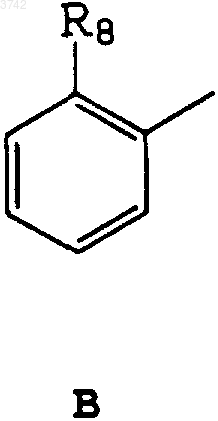
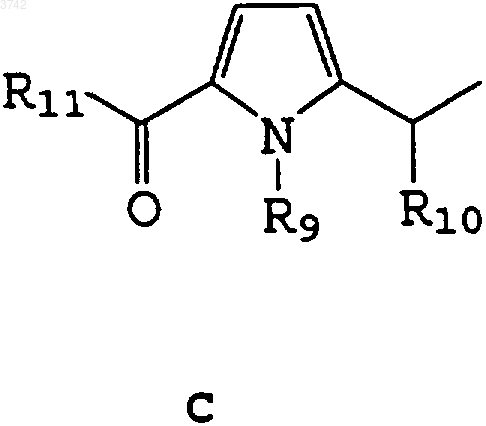
R4 - атом водорода или C1-C3алкилгруппа,
R5 - атом водорода, NH2, NH-R11 или O-R11-группа,
R6 - атом водорода, CO-R11, O-R11-группа или атом галогена,
R7 - атом водорода, C1-C5-алкил-, C2-C5-O-алкенил-, фенилгруппа или
R6 и R7 - -CH=CR12-CR13=CH-группа, образующая возможно замещенное конденсированное ароматическое кольцо,
R8- OH-, -O-CO-N(CH3)2 или NH-R11-группа,
R9 и R10 - атомы водорода или C1-C4-алкилгруппы - одинаковые или разные или они образуют -CH2-CH2-группу,
R11 - фенилгруппа, фенилгруппа возможно замещенная одним или несколькими следующими заместителями: атомом галогена (Cl, Br, I), NO2, C1-C6-алкил-, C2-C6алкенил-, OH- или NH2-группой,
R12 и R13 - атомы водорода или C1-C3-O-алкилгруппы - одинаковые или разные,
в инертном растворителе в температурном интервале от -20 до 120шC в присутствии или отсутствии промотирующего конденсацию агента.
9. Способ по п.8, отличающийся тем, что инертным растворителем является дихлорметан или тетрагидрофуран.
10. Способ по п.8, отличающийся тем, что промотирующим конденсацию агентом является карбонилдиимидазол или дициклогексилкарбодиимид.
11. Способ по п.8, отличающийся тем, что температурный интервал составляет от 0 до 35шC.
12. Применение соединения общей формулы (I) по любому из пп.1-7 для получения лекарственного препарата для лечения боли.
Текст
1 Область изобретения Данное изобретение относится к новым сложным эфирам, полученным из замещенных фенилциклогексилпроизводных, которые, в свою очередь, получают из Трамадола. Полученные соединения обладают большей анальгезирующей активностью, более низкой токсичностью и более продолжительным периодом действия, чем у Трамадола. Предпосылки изобретения Лечение боли имеет большое значение в медицине. Фармакологические агенты, используемые в настоящее время для лечения боли,можно прежде всего подразделить на две большие группы: опиоидные вещества и нестероидные противовоспалительные средства (nonsteroidal anti-inflammatories, NSAIs). NSAIs пригодны только в случае легкой или умеренной боли; сильную или резкую боль традиционно лечат опиоидными соединениями. Однако, эти опиоидные соединения обладают несколькими нежелательными побочными эффектами, как например, запор, угнетение дыхания, толерантность и возможность привыкания. В патенте США 3652589 описан тип анальгезирующих соединений со структурой замещенных циклоалканолфенильных эфиров,имеющих основную аминогруппу в циклоалкильном кольце. Среди них соединение (1R, 2R или 1S,2S)-2-[(диметиламино)метил]-1-(3-метоксифенил)циклогексанол, обычно известное как Трамадол, особенно отмечено и, в частности,заявлено в формуле изобретения данного патента. В Нидерландском патенте 6610022 описан ряд продуктов, полученных из приведенного соединения, в котором дегидрирование в циклоалканоловом кольце происходит вместе с деметилированием метоксигруппы в положении 3 фенильного кольца с получением структуры В данном патенте также описаны продукты, полученные из соединений, приведенных в патенте США, в которых метоксигруппа в положении 3 фенильного кольца деметилирована,т.е. продукты структурыO-деметилтрамадол включен среди других продуктов, описанных в патенте NL6610022; данный продукт описан как один из продуктов метаболизма Трамадола (Von W. Lintz et al. Arzneim-Forsch (Drug Res) 31(II); 1932-43 (1981. Анальгезирующую активность Трамадола при 003742Clin. Pharmacol. Ther (St. Louis) 1996, 60(6) 636644). Однако, в патенте отсутствуют данные относительно клинического применения метаболита O-деметилтрамадола. Позднее в патенте ЕР 753506 были описаны новые производные Трамадола, которые являются O-деметилзамещенными, галогенированными в положении 1- и/или 3-циклогексилзамещенными. Трамадол обладает эффектом опиоидного агониста. Однако, клинический опыт работы с Трамадолом показывает, что несмотря на это, он не имеет некоторых побочных эффектов, типичных для опиоидных агонистов, как например, угнетение дыхания (W. Vogel et al. Arzneim. Forsch (Drug Res) 28(1), 183 (1978, запор (I. Arend et al. Arzneim. Forsch (Drug Res) 28(I), 199 (1978, толерантность (L. Flohe et al.Arzneim. Forsch (Drug Res) 28(1), 158 (1978. Были найдены некоторые побочные эффекты,специфичные для Трамадола, которые проявляются, когда их вводят внутривенно (i.v.) и быстро, как например, приливы и потоотделение. Другие недостатки, связанные с Трамадолом, заключаются в коротком периоде его действия (Т. Matthiesen, T.Wohrmann, T.P.Coogan,H. Uragg, The experimental toxicology of tramadol: an overview, Toxicology Letters 95, 63-71,(1998. В патенте США А-5733936 описаны некоторые сложные эфиры 6-диметиламинометил-1 фенилциклогексана в общей формуле раздела описания, обладающие анальгезирующей активностью и низкой токсичностью. Целью изобретения по патенту США А 5733936 является получение сложных эфиров,фосфонатов, простых эфиров, фенолов, карбонатов, карбаматов и т.д. производных 6 диметиламинометил-1-фенилциклогексана, данные производные могут быть замещены в положении 5 циклогексилгруппы (в соответствии со значениями R2 и R3 в формуле изобретения), а также их дегидроксилированным, хлорированным, фторированным аналогам соединений. Кроме того, хотя в патенте США А 5733936 описаны некоторые сложные эфиры 6 диметиламинометил-1-фенилциклогексана, ни один пример в патенте US-A-5733936 не относится к сложному эфиру O-деметилтрамадола. Данные примеры не включают соединения, которые имеют характеристики третичной ОНгруппы O-деметилтрамадола. В частности, пример 13, который является самым близким к описанному в заявке сложному эфиру - аналогу Oдеметилтрамадола с ацетилсалициловой кислотой, а не сложный эфир O-деметилтрамадола. Поэтому в патенте US-A-5733936 не описан сложный эфир O-деметилтрамадола с характерной гидроксигруппой в положении 1. В патенте 3 США А-5733936 описаны не действующие примеры сложных эфиров O-деметилтрамадола. В трех других приведенных сложных эфирах(примеры 14, 15, 16) также отсутствует третичная гидроксильная группа. Поэтому данные по стабильности, активности и побочным эффектам нельзя предвидеть или предположить. Согласно данной заявке неожиданный эффект достигается для соединений формулы I. Основываясь на вышеуказанной предпосылке изобретения, соединения с анальгезирующей активностью, подобные или с более высокой активностью, чем у Трамадола и с меньшей токсичностью и с более высоким периодом эффективности все еще представляют интерес. Описание изобретения Данное изобретение относится к новым сложным эфирам O-деметилтрамадола или его 1,2-дегидрированному производному. Было найдено, что анальгезирующая активность данных соединений выше, чем Трамадола, они характеризуются меньшей токсичностью и более продолжительным периодом действия при оральном введении (см. фиг. 1) В частности, в данном изобретении описаны и заявлены данные продукты общей формулы (I), их соли и оптические изомеры, а также способ их получения. Продукты, описанные в данном изобретении, представлены следующей общей формулой указаны асимметрические атомы углерода,где R1R3 - атом водорода; или R2 и R3 вместе образуют двойную связь;R4 - атом водорода или C1-С 3 алкилгруппа;R6 - атом водорода, CO-R11, О-R11- группа или атом галогена;R7 - атом водорода, С 1-С 5-алкил-, С 2-С 5-Oалкенил-, фенилгруппы,или R6 и R7 - CH=CR12-CR13=CH-группа,образующая возможно замещенное конденсированное ароматическое кольцо;R9 и R10 - атомы водорода или С 1-С 4 алкилгруппы - одинаковые или разные или они образуют -СН 2-СН 2-группу;R11 - фенилгруппа, фенилгруппа, возможно замещенная одним или несколькими следующими заместителями: атомом галогена (Cl, Br,I), NO2, C1-С 6-алкил-, С 2-С 6 алкенил-, ОН- илиR12 и R13 - атомы водорода или C1-С 3-Оалкилгруппы - одинаковые или разные. Если R1 представляет A, R4 - предпочтительно метилгруппа или атом водорода, R5-NH2rpyппa, 2,5-дихлорфениламиногруппа или атом водорода, R6 представляет собой замещенную СО-фенилгруппу или атом водорода, R7 - изобутилгруппа или атом водорода или R6 и R7 образуют замещенное конденсированное ароматическое кольцо. Более предпочтительно, когда R1 является А, продукт представляет собой:-3-(2-диметиламинометилциклогекс-1 енил)-фенил-2-(6-метоксинафтален-2-ил)пропионат. Если R1 представляет собой В, то R8 предпочтительно ОН- или -O-СО-N(СН 3)2-группа. Когда R1=B, более предпочтительными продуктами являются:-3-(2-диметиламинометилциклогекс-1 енил)-фенил-2-диметилкарбамоилоксибензоат. Если R1 представляет С, R9 предпочтительно метилгруппа или атом водорода или образует -СН 2-СН 2-группу с R10. Когда R1 представляет С, более предпочтительным продуктом является: Описание способов Соединения общей формулы (I) данного изобретения можно получить общим способом,который характеризуется взаимодействием соединения общей формулы (II) с соответствующей кислотой или производным кислоты общей формулы III Через 30 мин после введения проверяемого продукта проверку повторяли и снова регистрировали максимальное время, необходимое для выпрыгивания животных. Тех животных, которые не выпрыгивали после 60 с, удаляли с пластинки, чтобы избежать каких-либо травм, и регистрировали в качестве 100% защиты. Результаты выражают в виде % увеличения времени прыжка, вычисленного следующим образом: Для того, чтобы определить продолжительность анальгезирующего эффекта при оральном введении продуктов, анальгезирующую активность оценивали на горячей пластинке в течение 1, 3, 6, 8 и 24 ч после введения продукта, а также контрольную группу, которая получала обработку только наполнителем. Базисные ответные реакции оценивали за 30 и 5 мин до введения продуктов. б) Определение DL50 продуктовIII Feb. 87, Single dose toxicity). Для определения острой токсичности продуктов применяли мужские особи швейцарских мышей той же серии весом 20-25 г. До введения продуктов животных заставляли голодать в течение 12 ч без потребления пищи, но с открытым доступом к воде. Несколько подгрупп из 10 животных произвольно отбирали и орально давали увеличивающиеся дозы продуктов при одном введении, после чего их наблюдали в течение 14 дней, при открытом доступе к воде и пище. Наконец, количественно определяли число умерших животных в каждой подгруппе и вычисляли величину DL50 (1-2). Описание чертежа Чертеж показывает анальгезирующий эффект при тесте на горячей пластинке для мышей в зависимости от времени; эффект выражен в виде процента увеличения времени ответной реакции относительно времени (в часах), прошедшего после введения продукта. Это представлено серым (бледным) цветом для Трамадола, заштрихованным для соединения (I) примера 6 и черным для примера 1. Экспериментальная часть 1.1. Примеры синтеза Пример 1. Синтез -3-(2-диметиламинометил-1-гидроксициклогексил)фенил 2-(4-изобутилфенил)пропионатаR1, R2, R3 имеют приведенные выше значения, иL предпочтительно является ОН-группой или атомом галогена. Реакцию проводят в инертном растворителе,предпочтительно дихлорметане, тетрагидрофуране и т.д. в температурном интервале от -20 до 120 С, предпочтительно в интервале от 0 до 35 С и, предпочтительно, в присутствии промотирующего конденсацию агента, как например, карбонилдиимидазола или дициклогексилкарбодиимида и т.д. Соединения формулы (II) получают согласно способам, описанным в литературе (NL 6610022 или Flick el al., Arzneim. Forsch/DrugRes. (1978), 28 (I), 107-113). Описание фармакологических способов проверки анальгезирующей активности Фармакологическую активность продуктов, описанных в данном изобретении, проверяли in vivo в разных экспериментальных моделях, которые известны для оценки боли у животных. а) Метод горячей пластинки Применяемый метод описан в работе EddyN.B., Leimbach D. (J. Pharm. Exp. Ther. 107: 385393, 1953). Анальгезирующий эффект продуктов оценивали, анализируя поведение животных на горячей поверхности при температуре (551)С. Использовали мужские особи швейцарских мышей весом 20-25 г. Проверяемые соединения вводили орально или внутрибрюшинно за один час или 30 мин до начала проверки, соответственно. Способ состоял в помещении животных на пластинку и выдерживании их в цилиндре из органического стекла высотой 25 и 21 см. Определяли время, в течение которого животные выпрыгивали с горячей поверхности. Животных отбирали перед началом проверки так, чтобы те,которые выпрыгивали больше, чем через 10 с,не включались бы в группу, которая получала обработку продуктом. 7 комнатной температуре в течение 2 ч, после чего прибавляли 60% раствор 0,59 г (2,4 ммоля)(RR,SS)-3-(2-диметиламинометил-1-гидроксициклогексил)фенола, предварительно обработанного 0,1 г (2,5 ммоля) гидрида натрия в минеральном масле. Реакцию оставляли при комнатной температуре в течение 16 ч. Затем концентрировали досуха и остаток обрабатывали 100 мл дихлорметана и промывали 2 х 50 мл 1 N NaOH и далее 100 мл Н 2 О. Органическую фазу (слой) сушили и концентрировали и остаток хроматографировали на силикагеле. Элюированием с помощью СH2 Сl2/ ЕtOН 98/2 до 96/4, получали 0,65 г (62%) чистого продукта в виде бесцветного масла. 1 Н-ЯМР (CDCl3): 0,90 (д, 6 Н); 1,20-2,20 [м,21 Н, включая 1,6 (д, 3 Н) и 2,05 (с, 6 Н)]; 2,322,44 (дд, 1 Н); 2,47 (д, 2 Н); 3,92 (с, 1 Н); 6,78-6,86 Следуя способу, описанному в примере 1,и заменяя -ибупрофен на (+)-кеторолак(5 бензоил-1,2-дигидро-1 Н-пирролизин-1-карбоновую кислоту), названный продукт получают в виде масла. 1 Н-ЯМР (CDCl3): 1,20-2,20 (м, 17 Н); 2,40 Следуя способу, описанному в примере 1,и заменяя (RR,SS)-3-(2-диметиламинометил-1 гидроксициклогексил)фенол на 3-(2-диметиламинометил-1-циклогекс-1-енил)фенол, названный продукт получают в виде масла. 1 Н-ЯМР (CDCl3): 0,90 (д, 6 Н); 1,60 (д, 3 Н); 1,62-1,98 (м, 4 Н); 2,02 (с, 6 Н); 2,10-2,25 (м, 4 Н); 2,45 (д, 2 Н); 2,70 (с. уш., 2 Н); 3,92 (к, 1 Н); 6,70 Следуя способу, описанному в примере 1,и заменяя -ибупрофен на (+)-6-метокси-метил-2-нафталенуксусную кислоту (Naproxen) и (RR,SS)-3-(2-диметиламинометил-1-гидроксициклогексил)фенол на 3-(2-диметиламинометилциклогекс-1-енил)фенол, названный продукт получают в виде масла. 1 Н-ЯМР (CDCl3): 1,60-1,76 (м, 4 Н); 1,68 (д,3 Н); 2,02 (с, 6 Н); 2,10-2,24 (м, 4 Н); 2,66 (с, 2 Н); 3,92 (с, 3 Н); 4,09 (к, 1 Н); 6,70 (д, 1 Н); 2,82-2,92CH2Cl2 прибавляли по каплям 5,8 г (29,3 ммолей) раствора хлорангидрида ацетилсалициловой кислоты в 50 мл СН 2 Сl2 при 0 С. Смесь выдерживали при 0 С в течение 10 ч, прибавляли 100 мл метанола и 100 мл 1 N НСl и смесь выдерживали при 25 С в течение 4 дней. После упаривания метанола и подщелачивания до рН 8,5 с помощью Na2CO3 смесь экстрагировали ЕtOАс (3 х 50 мл). Объединенные органические экстракты сушили (MgSO4) и упаривали; остаток очищали хроматографией на силикагеле,элюируя CH2Cl2/MeOH/NH4OH = 1000:30:3 с получением 1,7 г (16%) названного соединения в виде желтого масла. 1 Н-ЯМР (CDCl3): 1,20-2,25 (м, 16 Н), включая 2,11 (с, 6 Н); 2,45 (дд, 1 Н); 6,90-7,15 (м, 3 Н); Начиная с 3-(2-диметиламинометилциклогекс-1-енил)фенола и следуя способу, описанному в примере 6, названное соединение получали в виде желтого масла. 1 Н-ЯМР (СDСl3): 1,60-1,80 (м, 4 Н); 2,10 (с,6 Н); 2,15-2,35 (м, 4 Н); 2,75 (с, 2 Н); 6,90-7,10 (м,5 Н); 7,40 (т, 1 Н); 7,55 (т, 1 Н); 8,10 (д, 1 Н); 10,50 Раствор 1,82 г (8,0 нмоля) 2-диметилкарбамоилоксибензоилхлорида в 25 мл СН 2 Сl2 прибавляли по каплям при 0 С к раствору 1,9 г (7,7 нмолей) (RR-SS)-3-(2-диметиламинометил-1-гидроксициклогексил)фенола и 0,73 г (9,2 нмолей) пиридина в 50 мл СН 2 Сl2. Смесь выдерживали при 0 С в течение 10 ч и выливали на охлажденную воду, разделяли слои и водный слой экстрагировали 100 мл СН 2 Сl2. Органический слой сушили (MgSO4) и упаривали. Остаток хроматографировали на силикагеле,элюируя СН 2 Сl2/ацетон 80:20. 570 мг (48%) названного соединения получали в виде оранжевого масла. 1 Н-ЯМР (СDСl3): 1,30-1,90 (м, 9 Н); 2,05 (м,1 Н); 2,10 (с, 6 Н); 2,45 (дд, 1 Н); 2,95 (с, 3 Н); 3,05 10 Примеры фармакологических результатов Ниже в табл. 1 приведены результаты фармакологической активности нескольких примеров продуктов, описанных в изобретении,а также Трамадола. Результаты представляли в виде процента увеличенного времени ответной реакции на тесте горячей пластины. В табл. 2 показаны значения острой токсичности Трамадола и примеров продуктов,описанных в изобретении, где можно наблюдать меньшую токсичность последних. Таблица 1. Анальгезирующая активность продуктов для мышей на горячей пластине Продукт (15 мг/кг, введениеDL50 (мг/кг) оральлей/кг, оральное времени ответной ное введение введение) реакции на горячей пластине (n=20-40) Трамадол 8723 350 Пример 6 24872 550 Пример 1 21088 900 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производные сложных эфиров диметилтрамадола общей формулы (I)R3 - атом водорода; или R2 и R3 вместе образуют двойную связь;R4 - атом водорода или C1-С 3 алкилгруппа;R7 - атом водорода, С 1-С 5-алкил-, С 2-С 5-Оалкенил-, фенилгруппы; или R6 и R7 - CH=CR12-CR13=CH-группа,образующая возможно замещенное конденсированное ароматическое кольцо;R9 и R10 - атомы водорода или С 1 С 4 алкилгруппы - одинаковые или разные или они образуют -СН 2-СН 2-группу,R11 - фенилгруппа или фенилгруппа, замещенная одним или несколькими следующими заместителями: атомом галогена (хлор, бром,йод), NO2, C1-С 6 алкил-, С 2-С 6 алкенил-, ОН- илиNH2-группой,R12 и R13 - атомы водорода или C1-С 3-Оалкилгруппы - одинаковые или разные, их соли и оптические изомеры. 2. Соединение по п.1, отличающееся тем,что R1 представляет собой А и R4 - метилгруппу или атом водорода, R5 - NH2-группу, 2,5 дихлорфениламиногруппу или атом водорода,R6 - замещенную СО-фенилгруппу или атом водорода, R7 - изобутилгруппу или атом водорода или R6 и R7 образуют замещенное конденсированное ароматическое кольцо. 3. Соединение по п.1, отличающееся тем,что R1 представляет собой В и R8 - ОН- или -OСО-N(СН 3)2-группу. 4. Соединение по п.1, отличающееся тем,что R1 представляет собой С и R9 - метилгруппу или атом водорода или образует -СН 2-СН 2 группу с R10 и R11 - фенил- или толилгруппу. 5. Соединение по п.2, отличающееся тем,что его выбирают из следующих соединений:-3-(2-диметиламинометил-1-гидроксициклогексил)фенил-2-(4-изобутилфенил)пропионата,-3-(2-диметиламинометил-1-гидроксициклогексил)фенил-2-(6-метоксинафтален-2 ил)пропионата,-3-(2-диметиламинометилциклогекс-1 енил)фенил-2-(4-изобутилфенил)пропионата,-3-(2-диметаламинометилциклогекс-1 енил)фенил-2-(6-метоксинафтален-2-ил)пропионата. 6. Соединение по п.3, отличающееся тем,что его выбирают из следующих соединений:-3-(2-диметиламинометил-1-гидроксициклогексил)фенил-2-диметилкарбамоилоксибензоата,-3-(2-диметиламинометилциклогекс-1 енил)фенил-2-диметилкарбамоилоксибензоата. 7. Соединение по п.4, отличающееся тем,что представляет собой следующее соединение:-3-(2-диметиламинометил-1-гидроксициклогексил)фенил-5-бензоил-2,3-дигидро-1 Нпирролизин-1-карбоксилат. 8. Способ получения соединения по п.1,отличающийся тем, что соединение формулыR2 - OH-группа,R3 - атом водорода,или R2 и R3 вместе образуют двойную связь,Х - ОН-группа, атом галогена OR14 группа,R14-C1-С 6 алкил-, фенилгруппа или замещенная фенилгруппа иR4 - атом водорода или C1-С 3 алкилгруппа,R5 - атом водорода, NH2, NH-R11 или O-R11 группа,R6 - атом водорода, СО-R11, O-R11-группа или атом галогена,R7 - атом водорода, С 1-С 5-алкил-, С 2-С 5-Oалкенил-, фенилгруппа илиR6 и R7 - -CH=CR12-CR13=CH-группа, образующая возможно замещенное конденсированное ароматическое кольцо,R8 - ОН-, -O-CO-N(CH3)2 или NH-R11 группа, 13R9 и R10 - атомы водорода или С 1-С 4 алкилгруппы - одинаковые или разные или они образуют -СН 2-СН 2-группу,R11 - фенилгруппа, фенилгруппа, возможно замещенная одним или несколькими следующими заместителями: атомом галогена (Cl, Br,I), NO2, C1-С 6-алкил-, С 2-С 6 алкенил-, ОН- илиNH2-группой,R12 и R13 - атомы водорода или C1-С 3-Оалкилгруппы - одинаковые или разные, в инертном растворителе в температурном интервале от-20 до 120 С в присутствии или отсутствии промотирующего конденсацию агента. 14 9. Способ по п.8, отличающийся тем, что инертным растворителем является дихлорметан или тетрагидрофуран. 10. Способ по п.8, отличающийся тем, что промотирующим конденсацию агентом является карбонилдиимидазол или дициклогексилкарбодиимид. 11. Способ по п.8, отличающийся тем, что температурный интервал составляет от 0 до 35 С. 12. Применение соединения общей формулы (I) по любому из пп.1-7 для получения лекарственного препарата для лечения боли.
МПК / Метки
МПК: A61P 25/04, C07D 207/337, C07C 219/26, A61K 31/24
Метки: способ, о-диметилтрамадола, сложных, лекарственного, получения, препарата, эфиров, производные, применение
Код ссылки
<a href="https://eas.patents.su/8-3742-proizvodnye-slozhnyh-efirov-o-dimetiltramadola-sposob-ih-polucheniya-i-primenenie-dlya-polucheniya-lekarstvennogo-preparata.html" rel="bookmark" title="База патентов Евразийского Союза">Производные сложных эфиров о-диметилтрамадола, способ их получения и применение для получения лекарственного препарата</a>
Предыдущий патент: Местное трансдермальное лечение
Следующий патент: Способ для идентификации, поиска и обработки технических чертежей
Случайный патент: Способ синтеза тропенола для его получения в промышленном масштабе












