Способ получения r-энантиомера n-карбамоилметил-4-фенил-2-пирролидона
Номер патента: 15420
Опубликовано: 31.08.2011
Авторы: Лебедевс Антонс, Калвиньш Иварс, Ворона Максим, Вейнберг Григорий, Чернобровыйс Александрс
Формула / Реферат
1. Способ получения R-энантиомера N-карбамоилметил-4-фенил-2-пирролидинона
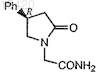
включающий следующие этапы:
(1) замещение водорода в амидной группе 4(R)-фенил-2-пирролидинона ионом металла или триалкилсилильной группой в подходящем органическом растворителе;
(2) N-алкилирование N-металлированного или N-силилированного 4(R)-фенил-2-пирролидинона эфирами галоуксусной кислоты в подходящем органическом растворителе;
(3) карбамоилирование N-алкоксикарбонилметил-4(R)-фенил-2-пирролидинона аммиаком в подходящем органическом растворителе.
2. Способ по п.1, отличающийся тем, что на стадии (1) триметилсилильная группа вводится с помощью хлортриметилсилана в подходящем органическом растворителе.
3. Способ по п.1, отличающийся тем, что на стадии (1) триметилсилильная группа вводится с помощью гексаметилдисилазана в подходящем органическом растворителе.
4. Способ по п.1, отличающийся тем, что на стадии (2) эфир галоуксусной кислоты представлен эфиром бромуксусной кислоты.
5. Способ по п.1, отличающийся тем, что на стадии (2) эфир галоуксусной кислоты представлен эфиром хлоруксусной кислоты.
6. Способ по п.1, отличающийся тем, что на стадии (2) эфир галоуксусной кислоты представлен метиловым эфиром.
7. Способ по п.1, отличающийся тем, что на стадии (2) эфир галоуксусной кислоты представлен этиловым эфиром.
8. Способ по п.1, отличающийся тем, что на стадии (2) N-алкилирование N-триметилсилила, замещенного 4(R)-фенил-2-пирролидинона эфирами галоуксусной кислоты, катализируется бромтриметилсиланом.
9. Способ по п.1, отличающийся тем, что на стадии (2) N-алкилирование N-триметилсилила, замещенного 4(R)-фенил-2-пирролидинона эфирами галоуксусной кислоты, катализируется триметилсилиловым эфиром трифторметансульфокислоты.
10. Способ по п.1, отличающийся тем, что на стадиях (1) и (2) использованные для реакции органические растворители выбирают из группы, включающей гексан, бензол, толуол, хлороформ, дихлорметан, дихлорэтан, этилацетат, метилацетат, диэтиловый эфир, 1,4-диоксан, диметилсульфоксид или их смеси.
11. Способ по п.1, отличающийся тем, что на стадии (3) карбамоилирование N-алкоксикарбонилметил-4(R)-фенил-2-пирролидинона осуществляется в водном растворе аммиака или его смеси с подходящим органическим растворителем.
12. Способ по п.1, отличающийся тем, что на стадии (3) карбамоилирование N-алкоксикарбонилметил-4(R)-фенил-2-пирролидинона осуществляется газообразным раствором аммиака в подходящем органическом растворителе.
13. Способ по п.1, отличающийся тем, что на стадии (3) используемый для реакций органический растворитель выбирают из группы, включающей метанол, этанол, пропанол, хлороформ, дихлорметан, этилацетат и 1,4-диоксан.
Текст
ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ Дата публикации и выдачи патента Способ получения R-энантиомера N-карбамоилметил-4-фенил-2-пирролидинона путем Nалкилирования 4(R)-фенил-2-пирролидинона эфирами галоуксусной кислоты и последующего преобразования промежуточного N-алкоксикарбонилметил-4(R)-фенил-2-пирролидинона в целевой продукт путем обработки аммиаком. 015420 Предпосылки создания изобретения Изобретение относится к методу получения нового производного N-карбамоилметил-4-фенил-2 пирролидинона. В частности, изобретение относится к получению R-энантиомера N-карбамоилметил-4 фенил-2-пирролидинона (Карфедона, МНН), который в соответствии с нашим специальным исследованием, раскрытым в другой патентной заявке, представляет собой биологически активную часть молекулы рацемического карфедона, значительно превосходя в фармакологических свойствах сам карфедон и в особенности его S-энантиомерный эквивалент. Следовательно, разработка способа получения данного вещества создает предпосылки для внедрения в медицину нового эффективного фармацевтического агента. Описание известного уровня техники В литературе описано несколько способов получения рацемического N-карбамоилметил-4-фенил-2 пирролидинона. Они основаны на алкилировании рацемического 4-фенил-2-пирролидинона эфирами хлор- или бромуксусной кислоты и на последующем аммонолизе промежуточного N-алкоксикарбонилметил-4-фенил-2-пирролидинона аммиаком в газообразной или водорастворимой форме [1-4]. Краткое изложение сущности изобретения Целью настоящего изобретения является разработка процесса, обеспечивающего получение оптически чистого R-энантиомера N-карбамоилметил-4-фенил-2-пирролидинона, с коммерческими выгодами в простой и доступной форме. Нами обнаружено, что R-карфедон 5 можно получать из легкодоступного оптически активного 4(R)-фенил-2-пирролидинона (1) в качестве исходного вещества, который может быть получен разнообразными химическими и энзиматическими способами [5-12] в соответствии со схемой. Замещение амидного протона в 4(R)-фенил-2-пирролидиноне (1) на ион металла или триметилсилильную группу способствует N-алкилированию промежуточного пирролидинона 2 эфирами галоуксусной кислоты 3. Полученный N-алкоксикарбонилметил-4(R)-фенил-2-пирролидинон (4) превращают в конечный N-карбамоилметил-4(R)-фенил-2-пирролидинон (5) с помощью обработки аммиаком. Подробное описание изобретения В соответствии с изобретением процесс получения оптически чистого N-карбамоилметил-4(R)фенил-2-пирролидинона (5) обеспечивается следующим образом. 1. Замещение водорода в амидной группе энантиомерного 4(R)-фенил-2-пирролидинона (1) ионом металла или триалкилсилильной группой в подходящем органическом растворителе; при этом предпочтительные условия для этой реакции включают: а) использование в качестве иона металла атомов натрия или калия; б) использование в качестве триалкилсилильной группы триметилсилильной группы; в) введение иона металла в R-пирролидинон путем проведения реакции последнего с такими основаниями, как гидрид натрия или гидроокись калия в диапазоне температур от 20 до 130 С в подходящем органическом растворителе; г) N-триметилсилилирование 4(R)-фенил-2-пирролидинона хлортриметилсиланом или гексаметилдисилазаном в диапазоне температур от 20 до 150 С в подходящем органическом растворителе; д) проведение реакции в органических растворителях, представленных углеводородами, как гексан,бензол, толуол; галогенированными углеводородами, как хлороформ, дихлорметан; сложными эфирами,как этилацетат; простыми эфирами, как 1,4-диоксан. 2. N-алкилирование N-металлированных или N-силилированных промежуточных продуктов 2 эфиром галоуксусной кислоты 3, где Hal обозначает хлор или бром и R - метил или этил в подходящем органическом растворителе; при этом предпочтительные условия для этой реакции включают: а) N-алкилирование N-металлированного пирролидинона 2 эфиром галоуксусной кислоты 3 в диа-1 015420 пазоне температур от 120 до 180 С в подходящем органическом растворителе; б) N-алкилирование N-силилированного пирролидинона 2 эфиром галоуксусной кислоты 3 в диапазоне температур от 120 до 180 С в присутствии каталитических количеств бромтриметилсилана или триметилсилилового эфира трифторметансульфокислоты; в) проведение реакции в органических растворителях, представленных углеводородами, как толуол; простыми эфирами, как 1,4-диоксан. 3. Карбамоилирование N-алкоксикарбонилметил-4(R)-фенил-2-пирролидинона (4) аммиаком в подходящем растворителе; при этом предпочтительные условия для этой реакции включают: а) использование водного раствора аммиака; б) использование газообразного аммиака в подходящем органическом растворителе; в) проведение реакции в органических растворителях, представленных спиртами, как метанол, этанол, пропанол; галогенированными углеводородами, как хлороформ, дихлорметан; сложными эфирами,как этилацетат. Следующие примеры иллюстрируют, но не ограничивают данное изобретение. Пример 1. Раствор 4(R)-фенил-2-пирролидинона (345 мг, 2,14 мМ) в 1,4-диоксане (30 мл) добавляли к суспензии гидрида натрия (56 мг, 2,35 мМ) в 1,4-диоксане (30 мл). Смесь нагревали при температуре 80-90 С в течение 30 мин и затем охлаждали до комнатной температуры. Этиловый эфир бромуксусной кислоты(393 мг, 2,37 мМ) добавляли к реакционной смеси, которую нагревали при температуре 110-120 С в течение 6 ч и затем выпаривали при пониженном давлении. Остаток фракционировали с помощью колоночной хроматографии, используя 1:1 смесь этилацетат-гексан на основе силикагеля, с получением(CDCl3), : 1,28 (3 Н, т, СН 2 СН 3); 2,59 (1 Н, д, д, 3-СН 2); 2,87 (1 Н, д, д, 3-СН 2); 3,54 (1 Н, т, 5-СН 2); 3,64 (1 Н,квинтет, 4-СН); 3,83 (1 Н, т, 5-СН 2); 4,11 (2 Н, с, NCH2CO); 4,20 (2 Н, к, СН 2 СН 3); 7,20-7,39 (5 Н, м, С 6 Н 5). Пример 2. Раствор N-этоксикарбонилметил-4(R)-фенил-2-пирролидинона (250 мг, 1,01 мМ) в метаноле (30 мл) насыщали газообразным раствором аммиака в течение 5 ч. Реакционную смесь выпаривали при пониженном давлении и остаток фракционировали с помощью колоночной хроматографии, используя 1:1 смесь этилацетат-гексан на основе силикагеля, с получением N-карбамоилметил-4(R)-фенил-2 пирролидинона (187 мг, 85%). Т.пл. 107,5-108 С. []D20= +8,5 (с=3, МеОН). 1 Н ЯМР (CDCl3), : 2,61 (1 Н,д, д, 3-СН 2); 2,87 (1 Н, д, д, 3-СН 2); 3,54 (1 Н, т, 5-СН 2); 3,66 (1 Н, квинтет, 4-СН); 3,89 (1 Н, т, 5-СН 2); 4,00(2 Н, с, NCH2CO); 5,68 и 6,21 (1H и 1 Н, ущ.с и ущ.с, NH2); 7,20-7,40 (5 Н, м, С 6 Н 5). Пример 3. Заменяя этиловый эфир бромуксусной кислоты в примере 1 на метиловый эфир бромуксусной кислоты, получали N-метоксикарбонилметил-4(R)-(4-фенил)-2-пирролидинон. 1 Н ЯМР (CDCl3), : 2,58 (1 Н,д, д, 3-СН 2); 2,88 (1 Н, д, д, 3-СН 2); 3,53 (1 Н, т, 5-СН 2); 3,64 (1 Н, квинтет, 4-СН); 3,65 (3 Н, с, СН 3); 3,83(1 Н, т, 5-СН 2); 4,10 (2 Н, с, NCH2CO); 7,20-7,41 (5 Н, м, С 6 Н 5). Пример 4. Заменяя этиловый эфир бромуксусной кислоты в примере 1 на этиловый эфир хлоруксусной кислоты, получали N-этоксикарбонилметил-4(R)-(4-фенил)-2-пирролидинон. Пример 5. Раствор 4(R)-фенил-2-пирролидинона (345 мг, 2,14 мМ) и хлортриметилсилана (0,28 мг, 2,20 мМ) в дихлорметане (30 мл) нагревали при обратном потоке в течение 3 ч. Реакционную смесь выпаривали при пониженном давлении и к остатку добавляли толуол (30 мл) и этиловый эфир бромуксусной кислоты(393 мг, 2,37 мМ). Полученный раствор нагревали при температуре 100-110 С в течение 6 ч и затем выпаривали при пониженном давлении. Остаток фракционировали с помощью колоночной хроматографии,используя 1:1 смесь этилацетат-гексан на основе силикагеля, с получением N-этоксикарбонилметил 4(R)-фенил-2-пирролидинона. Пример 6. Раствор 4(R)-фенил-2-пирролидинона (345 мг, 2,14 мМ) и гексаметилдисилазана (0,47 мл, 2,20 мМ) в толуоле (30 мл) в присутствии каталитического количества концентрированной серной кислоты (10 мг) нагревали при обратном потоке в течение 3 ч. Реакционную смесь выпаривали при пониженном давлении и к остатку добавляли метиловый эфир бромуксусной кислоты (363 мг, 2,37 мМ) и бромтриметилсилан (30 мг). Полученный раствор нагревали при температуре 100-110 С в течение 6 ч и затем выпаривали при пониженном давлении. Остаток фракционировали с помощью колоночной хроматографии, используя 1:1 смесь этилацетат-гексан на основе силикагеля, с получением N-метоксикарбонилметил-4(R)-(4 фенил)-2-пирролидинона.-2 015420 Пример 7. Заменяя концентрированную серную кислоту (в качестве катализатора N-алкилирования) в примере 7 на триметилсилиловый эфир трифторметансульфокислоты, получали N-метоксикарбонилметил-4(R)(4-фенил)-2-пирролидинон. Пример 8. Заменяя метанол, насыщенный газообразным раствором аммиака в примере 2, 30 мл 25%-ным, на водный раствор аммиака, получали N-карбамоилметил-4(R)-(4-фенил)-2-пирролидинон. Литература. 1. J. L'Iatalien, USP 4144246 (1979). 2. М. Glozman et al., Khim.-Pharm. J., 1980, 14, Nr. 11, 43-48. 3. E. Kramarova et al., SU 1265191 (1986). 4. E. Kramarova et al., SU 1265192 (1986). 5. R.D. Allan et al., Tetrahedron, 1990, 46, No 7, 2511-2524. 6. N. Langlois et. al. Tetrahedron, 1996, 52, No 48, 15117-151260. 7. R.E. Zelle, Synthesis, 1991, 1023. 8. M. Soborcinska et al., Pol. J. Chem., 1979, 53, 435-446. 9. A.F. Wildervanck, et al., US 6051734, 2000. 10. R. Chenevret, M. Desjardins, Can. J. Chem., 1994, 72, 2312-2317, vol. 74, 2312. 11. R.V. Muralidhar, R.R. Chirumamilla et al., Med. Fac. Landbouww. Univ. Gent, 2001, 66, Nr. 3a, 227232. 12. Levadoux et al., D.W. US 5483765 (1998). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения R-энантиомера N-карбамоилметил-4-фенил-2-пирролидинона(1) замещение водорода в амидной группе 4(R)-фенил-2-пирролидинона ионом металла или триалкилсилильной группой в подходящем органическом растворителе;(2) N-алкилирование N-металлированного или N-силилированного 4(R)-фенил-2-пирролидинона эфирами галоуксусной кислоты в подходящем органическом растворителе;(3) карбамоилирование N-алкоксикарбонилметил-4(R)-фенил-2-пирролидинона аммиаком в подходящем органическом растворителе. 2. Способ по п.1, отличающийся тем, что на стадии (1) триметилсилильная группа вводится с помощью хлортриметилсилана в подходящем органическом растворителе. 3. Способ по п.1, отличающийся тем, что на стадии (1) триметилсилильная группа вводится с помощью гексаметилдисилазана в подходящем органическом растворителе. 4. Способ по п.1, отличающийся тем, что на стадии (2) эфир галоуксусной кислоты представлен эфиром бромуксусной кислоты. 5. Способ по п.1, отличающийся тем, что на стадии (2) эфир галоуксусной кислоты представлен эфиром хлоруксусной кислоты. 6. Способ по п.1, отличающийся тем, что на стадии (2) эфир галоуксусной кислоты представлен метиловым эфиром. 7. Способ по п.1, отличающийся тем, что на стадии (2) эфир галоуксусной кислоты представлен этиловым эфиром. 8. Способ по п.1, отличающийся тем, что на стадии (2) N-алкилирование N-триметилсилила, замещенного 4(R)-фенил-2-пирролидинона эфирами галоуксусной кислоты, катализируется бромтриметилсиланом. 9. Способ по п.1, отличающийся тем, что на стадии (2) N-алкилирование N-триметилсилила, замещенного 4(R)-фенил-2-пирролидинона эфирами галоуксусной кислоты, катализируется триметилсилиловым эфиром трифторметансульфокислоты. 10. Способ по п.1, отличающийся тем, что на стадиях (1) и (2) использованные для реакции органические растворители выбирают из группы, включающей гексан, бензол, толуол, хлороформ, дихлорметан, дихлорэтан, этилацетат, метилацетат, диэтиловый эфир, 1,4-диоксан, диметилсульфоксид или их смеси. 11. Способ по п.1, отличающийся тем, что на стадии (3) карбамоилирование N-алкоксикарбонилметил-4(R)-фенил-2-пирролидинона осуществляется в водном растворе аммиака или его смеси с подходящим органическим растворителем.-3 015420 12. Способ по п.1, отличающийся тем, что на стадии (3) карбамоилирование N-алкоксикарбонилметил-4(R)-фенил-2-пирролидинона осуществляется газообразным раствором аммиака в подходящем органическом растворителе. 13. Способ по п.1, отличающийся тем, что на стадии (3) используемый для реакций органический растворитель выбирают из группы, включающей метанол, этанол, пропанол, хлороформ, дихлорметан,этилацетат и 1,4-диоксан.
МПК / Метки
МПК: C07D 207/26
Метки: n-карбамоилметил-4-фенил-2-пирролидона, способ, получения, r-энантиомера
Код ссылки
<a href="https://eas.patents.su/5-15420-sposob-polucheniya-r-enantiomera-n-karbamoilmetil-4-fenil-2-pirrolidona.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения r-энантиомера n-карбамоилметил-4-фенил-2-пирролидона</a>
Предыдущий патент: Новые производные фенантридина в качестве антагонистов брадикинина
Следующий патент: Способ получения синтетического нефтяного сульфоната
Случайный патент: Устройство и способ для обеспечения тары индивидуальным оформлением









