Способ получения 6-(4-хлорфенил)-2,2-диметил-7-фенил-2,3-дигидро-1н-пирролизин-5-илуксусной кислоты
Номер патента: 4938
Опубликовано: 28.10.2004
Авторы: Меркле Филипп, Каммермайер Томас, Лауфер Штефан, Штригель Ханс-Гюнтер
Формула / Реферат
1. Способ получения соединения формулы I
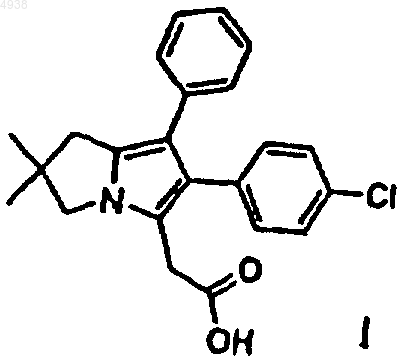
заключающийся в том, что соединение формулы III
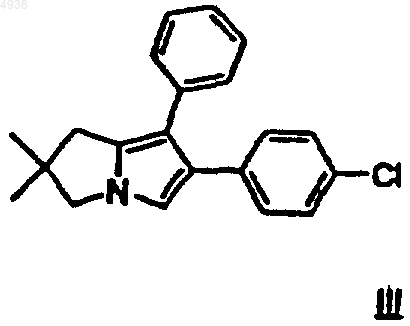
подвергают взаимодействию с оксалилхлоридом и полученный продукт (соединение II) обрабатывают гидразином и гидроксидом щелочного металла в водной фазе при температуре в диапазоне от 120 до 180шC в присутствии алифатического одно- или двухатомного спирта с температурой кипения по меньшей мере 140шC, после завершения обработки путем добавления эфира образуют трехфазную систему и подкислением средней фазы получают соединение формулы I.
2. Способ по п.1, заключающийся в том, что в качестве простого эфира используют диэтиловый эфир, метил-трет-бутиловый эфир или тетрагидрофуран.
3. Способ по п.1 или 2, заключающийся в том, что обработку гидразином и гидроксидом щелочного металла проводят в присутствии этиленгликоля, монометилового эфира этиленгликоля или диэтиленгликоля.
4. Способ по п.3, заключающийся в том, что обработку гидразином и гидроксидом щелочного металла проводят в присутствии диэтиленгликоля.
5. Способ по любому из пп.1-4, заключающийся в том, что получаемый взаимодействием с оксалилхлоридом продукт вначале обрабатывают гидразином, а затем гидроксидом щелочного металла.
6. Способ по п.5, заключающийся в том, что обработку гидроксидом щелочного металла проводят при температуре в диапазоне от 120 до 180шC.
7. Способ по п.6, заключающийся в том, что при обработке компоненты, являющиеся летучими при температуре обработки, удаляют, по крайней мере, частично.
8. Способ по любому из пп.1-7, заключающийся в том, что среднюю фазу перед подкислением смешивают со смесью из воды и не смешивающимся с водой простым эфиром.
9. Способ по п.8, заключающийся в том, что целевой продукт получают из эфирной фазы путем добавления к эфирной фазе алифатического или циклоалифатического углеводорода с температурой кипения выше температуры кипения простого эфира.
10. Способ по п.8 или 9, заключающийся в том, что для получения требуемого продукта простой эфир отгоняют, по крайней мере, частично.
11. Способ по любому из пп.1-10, заключающийся в том, что в нем используют соединение формулы III, полученное в результате взаимодействия 2-бензил-4,4-диметил-1-пирролина с w -галоген-4-хлорацетофеноном в полярном органическом растворителе в присутствии гидрокарбоната щелочного металла и/или карбоната щелочного металла в твердом виде.
12. Способ по п.11, заключающийся в том, что в качестве полярного органического растворителя используют метанол.
13. Способ по п.11 или 12, заключающийся в том, что реакцию проводят в присутствии твердого гидрокарбоната натрия.
14. Соединение формулы II

15. Соединение формулы I

в кристаллическом виде с единственной эндотермой на ДСК-диаграмме, находящейся в диапазоне температур от 155 до 170шC.
16. Соединение по п.15 со следующими значимыми пиками в ИК-спектре (волновое число, см-1): 1706; 1600; 1536; 1487; 1463; 1450; 1441; 1413; 1395; 1383; 1369; 1293; 1219; 1177; 1099; 1013; 836; 765; 698.
17. Соединение по п.15 или 16 с представленным, в основном, на фиг. 2 ИК-спектром.
18. Соединение по любому из пп.15-17 со следующими характерными значениями параметра d (расстояние между плоскостями в кристаллической решетке) на рентгенограмме: 11,9; 4,2; 4,0.
19. Соединение по п.18 со следующими значениями параметра d: 11,9; 8,2; 7,9; 6,4; 5,9; 5,8; 5,6; 5,3; 5,0; 4,9; 4,7; 4,5; 4,4; 4,3; 4,2; 4,05; 4,0; 3,9; 3,7; 3,6; 3,55; 3,5; 3,4; 3,3; 3,25; 3,2; 3,1; 2,95; 2,9; 2,85; 2,8; 2,75; 2,7; 2,65; 2,6.
20. Фармацевтическое средство, содержащее соединение по любому из пп.15-19, необязательно вместе с обычными вспомогательными веществами.
21. Применение соединений по любому из пп.15-19 для получения фармацевтического средства, предназначенного для лечения заболеваний ревматического характера.
Текст
1 Настоящее изобретение относится к способу получения 6-(4-хлорфенил)-2,2-диметил-7 фенил-2,3-дигидро-1 Н-пирролизин-5-илуксусной кислоты (ML 3000), а также к новой полиморфной модификации соединения ML 3000, обозначаемой далее как полиморфная модификация А.ML 3000 представляет собой перспективный ингибитор циклооксигеназы и 5-липоксигеназы и тем самым пригоден для лечения заболеваний ревматического характера и для предупреждения заболеваний, индуцированных аллергическими реакциями, как это описано, например, в Drugs of the Future, 20 (10), cc. 10071009 (1095). В этой публикации также рассматривается возможность получения данного соединения. Другие возможности получения вышеназванного соединения описываются также в ЕР-А-397175,WO95/32970,WO95/32971,WO95/32972, Archiv der Pharmazie 312, с. 896907 (1979) и 321, cc. 159-162 (1988), J. Med.Med. Chem. 330, cc. 307-312 (1997). При осуществлении всех этих синтезов пирролизиновый скелет структурируют по методу, проиллюстрированному на следующей схеме: Реакцию проводят в метиленхлориде, этаноле или диэтиловом эфире. Образующийся в ходе реакции бромистый водород улавливают путем добавления водного раствора бикарбоната натрия. Введение остатка уксусной кислоты в положение 5 осуществляют затем за счет реакции с диазоуксусным эфиром или хлоридом эфира щавелевой кислоты и последующего омыления или омыления и восстановления кетогруппы гидразином. В Arch. Pharm. 312, cc. 896-907 (1979) рассмотрена следующая реакция: Эту реакцию проводят в бензоле, используемом в качестве растворителя. ОднакоCOCOCl-группировку в данном случае переводят не в группу уксусной кислоты, а подвергают взаимодействию с диэтиламином. В заявках WO 95/32970, WO 95/32971 иWO 95/32972 описывается введение остатка уксусной кислоты в соединения, родственные по их структуре соединению ML 3000, осуществляемое взаимодействием этих пирролизиновых соединений с оксалилхлоридом или этилоксалилхлоридом и последующим восстановлением гидразином и гидроксидом калия (вариант Хуанга-Минлона восстановления по Вольфу-Киж 004938 2 неру). Более подробные данные о проведении экспериментов содержатся только в примере 5 С в заявке WO95/32971. В соответствии с этой методикой пирролизиновое соединение подвергают взаимодействию с оксалилхлоридом в тетрагидрофуране. К продукту реакции добавляют воду и гидрат гидразина, отгоняют тетрагидрофуран, к остатку примешивают диэтиленгликоль и гидроксид калия и нагревают до 140 С при одновременном удалении воды. После этого реакционную смесь смешивают с водой, подкисляют и растворяют выделенную карбоновую кислоту в диэтиловом эфире. Продукт очищают путем перемешивания эфирного раствора в течение некоторого промежутка времени над сушильным агентом, таким как безводный сульфат натрия или сульфат магния, оставляют стоять, после чего насыщенный водой сульфат отфильтровывают и в завершение подводом тепла выпаривают эфир. Кристаллизующееся из маточного раствора при его концентрировании вещество собирают и сушат. Для получения соединения ML 3000 в промышленном масштабе предпочтительным является введение остатка уксусной кислоты с использованием оксалилхлорида. При этом, однако, было установлено, что при работе в соответствии с вышеописанной методикой выделения и очистки сырого продукта, используемой в существующих в настоящее время способах,выход продукта значительно снижается, а на стадии очистки и даже в процессе сушки снова образуется целый ряд продуктов разложения, в силу чего возникает необходимость проведения дополнительной дорогостоящей очистки соединения ML 3000, например, путем перекристаллизации с целью обеспечить его качество, требуемое для фармацевтических продуктов. В вышеуказанных способах получения соединений, аналогичных по структуре соединению ML 3000, их очистку и кристаллизацию осуществляют нижеописанными методами. Согласно J. Med. Chem., 37, с. 1894-1897(1994), полученный в результате омыления этилового эфира этанольно-щелочной раствор натриевой соли ML 3000 подкисляют фосфорной кислотой и экстрагируют смесью из 3 частей диэтилового эфира и 1 части метиленхлорида. Образующееся после сушки над сульфатом натрия и после удаления смеси растворителей твердое вещество вторично суспендируют в диизопропиловом эфире, отфильтровывают и сушат. Что касается получения соединения ML 3000, то можно сослаться на Arch. Pharm. 321,сс. 159-162 (1988) (более подробно рассматривается ниже). Согласно Arch. Pharm. Med. Chem. 330, сс. 307-312 (1997) гетероциклические структурные аналоги соединения ML 3000, образующиеся по методу Хуанга-Минлона из предшественников,представляющих собой эфиры 2-оксоуксусной кислоты, получают путем концентрирования 3 элюатов, полученных на заполненной силикагелем небольшой колонке с использованием диэтилового эфира. Согласно Arch. Pharm. 321, сс. 159-162(1988) этиловые эфиры некоторых кислот, родственных по их структуре соединению ML 3000,подвергают омылению в этанольном раствореKОН, после омыления кислоты выделяют из водно-этанольного маточного раствора солей калия с помощью 6%-ной фосфорной кислоты и растворяют в диэтиловом эфире. После уменьшения объема кислоты адсорбируют нейтральным оксидом алюминия. После элюирования эфиром нейтральных сопутствующих веществ карбоновые кислоты десорбируют из минерального носителя под действием водного раствора дигидрофосфата натрия и повторно растворяют в диэтиловом эфире. Этот вторичный экстракт диэтилового эфира концентрируют до образования кристаллов, кристаллы отделяют и после добавления пентана с целью осаждения второй кристаллической фракции снова уменьшают объем эфирного маточного раствора. Согласно диссертации Кифера (Kiefer,Франкфурт, 1992) для получения аналогичной пирролизин-5-илуксусной кислоты соответствующую 2-оксоуксусную кислоту подвергают превращению в соответствии с восстановительным методом Хуанга-Минлона. Перед выделением в свободном виде пирролизин-5-илуксусной кислоты, присутствующей в реакционной смеси в виде соли калия, удаляют сопутствующие вещества (от нейтрального до щелочного характера) и примеси посредством предварительной экстракции содержащей продукт воднощелочной фазы с помощью этилацетата. Только после этого с помощью 6 н. НСl выделяют карбоновую кислоту, которую растворяют в диэтиловом эфире. Диэтилэфирные экстракты промывают водой, сушат и полностью удаляют растворитель до момента образования кристаллического твердого вещества, которое затем промывают холодным диэтиловым эфиром. Полученные по известным в настоящее время методам кристаллические порошковые образцы соединения ML 3000 анализировали рентгенографическим методом в рефрактометрах для порошков и рефрактограммы, спектры порошков, сравнивали между собой. Далее порошковые образцы исследовали методом дифференциальной сканирующей калориметрии(ДСК) или методом термогравиметрии (ТГМ). Данные рефрактометрического анализа порошков и ДСК свидетельствуют о том, что после кристаллизации из диэтилового эфира вещество получают сначала в виде эфирного сольвата в форме игольчатых кристаллов. При кристаллизации из этилацетата аналогичным путем получают сольват с этилацетатом в виде ромбических кристаллов. При этом было установлено,что такие сольваты являются нестабильными. Они разлагаются в вакууме и/или при повы 004938 4 шенных температурах с неполной отдачей связанного растворителя до, по существу, аморфных веществ, которые все еще содержат остатки растворителя и в которых после сушки можно обнаружить повышенное содержание продуктов разложения. С помощью ДСК-метода у сольватов выявляют характерные для десольватации температурные переходы. Сырое соединение ML 3000, которое по гидразиновому способу получают в виде соли калия и которое затем выделяют из подкисленной минеральной солью реакционной смеси,помимо труднорастворимых в воде солей калия содержит также гидразин, побочные продукты и продукты разложения (продукт декарбоксилирования, а также димер) в виде загрязняющих примесей. В связи с этим возникает необходимость проведения дополнительных операций по очистке получаемого продукта. Так, например,для удаления примесей гидразина сырые кристаллические кислоты необходимо многократно промывать разбавленными минеральными кислотами или экстрагировать их раствор с целью минимизировать содержание гидразина в чистом целевом продукте. Ни один из опубликованных к настоящему времени способов не позволяет получать материал, который обладал бы не ограниченной какими-либо факторами пригодностью для использования на человеке. С учетом вышеизложенного в основу настоящего изобретения была положена задача разработать способ получения соединения ML 3000, который позволял бы получать это соединение с высоким выходом и в виде чистых,имеющих определенную форму кристаллов. Неожиданно было установлено, что указанная задача решается благодаря тому, что соответствующее пирролизиновое соединение подвергают взаимодействию с оксалилхлоридом и гидразином, а реакционную смесь подвергают специальной переработке. Кроме того, было установлено, что при такой переработке образуется новая полиморфная модификация соединения ML 3000 (полиморфная модификация А). Настоящее изобретение в соответствии с этим относится к способу получения соединения формулы I (ML 3000) заключающемуся в том, что соединение формулы III 5 подвергают взаимодействию с оксалилхлоридом и полученный продукт обрабатывают гидразином и гидроксидом щелочного металла в водной фазе при повышенной температуре, по завершении обработки путем добавления несмешивающегося или частично смешивающегося с водой эфира образуют трехфазную систему и подкислением средней фазы получают соединение формулы I. Краткое описание чертежей На прилагаемых к описанию чертежах показано на фиг. 1 - ДСК-диаграмма кристаллической полиморфной модификации соединенияML 3000 (полиморфная модификация А),на фиг. 2 - ИК-спектр полиморфной модификации А,на фиг. 3 - рентгенограмма полиморфной модификации А,на фиг. 4 - ДСК-диаграмма этилацетатного сольвата соединения ML 3000 (полиморфная модификация С),на фиг. 5 - ИК-спектр полиморфной модификации С,на фиг. 6 - рентгенограмма полиморфной модификации С,на фиг. 7 - ДСК-диаграмма диэтилового эфирата соединения ML 3000 (полиморфная модификация Е),на фиг. 8 - ИК-спектр полиморфной модификации Е, и на фиг. 9 - рентгенограмма полиморфной модификации Е. Процесс получения 6-(4-хлорфенил)-2,2 диметил-7-фенил-2,3-дигидро-1 Н-пирролизин 5-илуксусной кислоты (ML 3000), исходя из соединения формулы IV, согласно предлагаемому в изобретении способу можно проиллюстрировать на примере следующей реакционной схемы:Arch. Pharm. 321, cc. 159-162 (1988). Это соединение может быть получено взаимодействием бензилмагнийхлорида с 3,3-диметил-4-хлорбутиронитрилом, как это описано в J. Med. Chem. 37, cc. 1894-1987 (1994). Реакцию проводят в инертном растворителе, таком как простой эфир или углеводород, например в толуоле. В этом случае соединение формулы IV подвергаютV. Соединение -бром-4-хлорацетофенон и его получение известны и описаны, например, вBull. Soc. Chim. Fr. 21, cc. 69 (1989). Как правило, реакцию проводят в полярном органическом растворителе. Пригодными для этой цели полярными органическими растворителями являются, прежде всего, С 1-С 4cпирты, такие как метанол, этанол, изопропанол, или простые эфиры, такие как диэтиловый эфир, ТГФ или диоксан. Компоненты реакции можно применять в эквимолярных количествах. Однако, как правило, -бром-4-хлорацетофенон применяют в избытке, например в количестве вплоть до 40 мол.%. Для улавливания выделяющегося в ходе реакции бромистого водорода работают в присутствии основания. Предпочтительно применяют неорганическое основание, прежде всего гидрокарбонат щелочного металла или карбонат щелочного металла, при этом особенно предпочтительны соответствующие соединения натрия и калия. Неорганическое основание можно применять в виде водного раствора. Однако особенно предпочтительным оказалось применение неорганического основания в твердом виде. Последнее облегчает отделение неорганических продуктов реакции и уменьшает спектр образующихся побочных продуктов. Неорганическое основание, как правило, применяют в эквимолярном количестве по отношению к количеству выделяющегося бромистого водорода. Целесообразно, однако, использовать неорганическое основание в избытке, например вплоть до 1,8 экв. Кроме того, оказалось целесообразным проводить реакцию, исключая доступ света. Температуру реакции можно варьировать в широком диапазоне. Предпочтительно, однако,работать в интервале от 0 до 50 С. Соединение формулы III можно получать обычным образом, удаляя образующиеся соли и растворитель. Таким путем получают соединение формулы III с выходом по меньшей мере 40% и с чистотой по меньшей мере 97%. Так, в частности, содержание изомера с 4-хлорфенильной группой в положении 5 составляет не более порядка 1,5%, обычно приблизительно 1%. Далее соединение формулы III подвергают реакции с оксалилхлоридом. При этом обычно применяют инертный растворитель, такой как простой эфир, в частности диэтиловый эфир,метил-трет-бутиловый эфир, тетрагидрофуран или диоксан, углеводород, такой как толуол,или хлорированный углеводород, такой как метиленхлорид. Предпочтительно использовать тетрагидрофуран. Как правило, температура реакции находится в диапазоне от -20 до +30 С. Для поддержания этого температурного режима экзотермическую реакцию контролируют скоростью добавления оксалилхлорида и/или за счет охлаж 7 дения реакционной смеси. Таким путем получают соединение формулы II. Далее реакционную смесь подвергают взаимодействию с водой для гидролиза избытка оксалилхлорида. При этом неожиданно было установлено, что гидролиз соединения формулыII до соответствующей карбоновой кислоты не происходит. Затем реакционную смесь обрабатывают реагентом, пригодным для восстановления кетокарбонильной группы в положении 5 с образованием группы уксусной кислоты. Для этой цели предпочтительно применение гидразина(восстановление по Вольфу-Кижнеру). Наиболее целесообразным оказался вариант ХуангаМинтона, в соответствии с которым реакцию с гидразином проводят в высококипящем спирте в присутствии гидроксида щелочного металла. При этом целесообразно до или после добавления высококипящего спирта по крайней мере частично удалять используемый в реакции растворитель. После этого добавляют гидразин,прежде всего гидрат гидразина, и повышают температуру реакции примерно до 70-80 С с целью отгонки при необходимости остатков растворителя. Затем температуру реакции повышают до 120-180 С, предпочтительно до 130160 С. Гидроксид щелочного металла добавляют в твердом виде или в виде концентрированной водной щелочи, предпочтительно, однако, в твердом виде. Момент добавления гидроксида не играет решающей роли, и его целесообразно добавлять после удаления остатков растворителя, используемого для реакции с оксалилхлоридом. Предпочтительно использовать гидроксид калия. В качестве высококипящего спирта применяют прежде всего одно- или двухатомный спирт с температурой кипения по меньшей мере 140 С. Пригодными для этой цели спиртами являются этиленгликоль, монометиловый эфир этиленгликоля и т.д. и, в первую очередь, диэтиленгликоль. Продолжительность реакции, как правило,составляет от 30 до 300 мин. Компоненты реакционной смеси, которые являются летучими при температуре реакции и к которым, в основном, относятся вода, гидразин и присутствующие еще при определенных условиях остатки используемого в реакции с оксалилхлоридом растворителя, целесообразно удалять, например, путем дистилляции. По завершении реакции реакционную смесь смешивают с эфиром (эфирный растворитель) и с водой либо с водой, содержащей электролит (например, содержащей NaCl). Предпочтительно применяют эфир, смешивающийся с водой в ограниченной степени. Пригодными для этой цели эфирами являются, например, метилтрет-бутиловый эфир, тетрагидрофуран и, прежде всего, диэтиловый эфир. 8 В результате добавления эфира происходит образование трехфазной системы. Верхняя фаза представляет собой эфирную фазу, содержащую присутствующие в системе органические примеси. Нижняя фаза представляет собой сильно щелочную водную фазу, содержащую неорганические компоненты. Средняя фаза представляет собой масляную фазу, состоящую,в основном, из соли ML 3000 с используемым в реакции гидроксидом щелочного металла, который является труднорастворимым в содержащей диэтиленгликоль щелочной водной фазе. Неожиданно было установлено, что средняя фаза содержит соль ML 3000 с высокой степенью чистоты. Фазы разделяют и среднюю фазу смешивают со смесью воды с лишь ограниченно смешивающимся с водой простым эфиром, например диэтиловым эфиром или метил-третбутиловым эфиром, и подкисляют до рН примерно 1-2 неорганической или органической кислотой, такой как соляная кислота, серная кислота, фосфорная кислота, уксусная кислота,щавелевая кислота или лимонная кислота. В этом случае соединение ML 3000 способно растворяться в эфирной фазе. При необходимости эту эфирную фазу можно подвергать обычной очистке на последующих стадиях экстракции с использованием соответствующей кислоты или воды. При необходимости можно также проводить последующую очистку путем обработки получаемого продукта активированным углем или другими адсорбентами (например, бентонитом и т.д.). Количество простого эфира и воды, добавляемых для образования трехфазной системы,не играет решающей роли. Как правило, добавляют такое количество простого эфира и воды,чтобы обеспечить образование и легкое разделение фаз. Как правило, используют от 5 до 10 мас. частей воды и от 3 до 20 мас. частей простого эфира в пересчете на 1 мас. часть исходного соединения. Соединение ML 3000 можно выделять из эфирной фазы различными методами. Так, например, простой эфир можно выпаривать и получать соединение ML 3000 путем кристаллизации из этилацетата или изопропанола. При выпаривании эфира происходит кристаллизация сольвата простого эфира, в котором при использовании диэтилового эфира на 1 молекулу растворителя приходится 2 молекулы ML 3000. При работе с этилацетатом получают соответствующий сольват, содержащий 1 молекулу этилацетата и 2 молекулы ML 3000. Однако более предпочтительно добавлять к эфирной фазе, по крайней мере, углеводород с более высокой по сравнению с простым эфиром температурой кипения, при необходимости по крайней мере частично отгонять простой эфир,осажденное в твердом кристаллическом виде соединение ML 3000 отделять от маточного 9 раствора обычным образом, например путем фильтрации или центрифугирования, и получать путем сушки под невысоким вакуумом при несколько повышенной температуре. Предпочтительно используют углеводород с температурой кипения, которая по крайней мере на 30 С,прежде всего на 40 С, выше температуры кипения простого эфира. Углеводород применяют при необходимости после отгонки простого эфира в 2-15-кратном избытке (по объему). Используемый углеводород может представлять собой алифатический углеводород с разветвленной или неразветвленной цепью и предпочтительно с 6-12 атомами углерода. Примерами таковых являются н-гексан, нгептан, н-октан, изооктан, н-декан, циклогексан и циклогептан. Предпочтительны н-гептан или смесь изомеров гептана, а также циклогексан. Неожиданно было установлено далее, что при обработке эфирного раствора соединенияML 3000, например вышеназванной эфирной фазы, углеводородом получают новую, в основном, не содержащую растворитель кристаллическую модификацию соединения ML 3000, а именно полиморфную модификацию А. Данная полиморфная модификация А характеризуется наличием одной-единственной эндотермы на ДСК-диаграмме (от 50 до 200 С), которая находится в диапазоне температур от 155 до 170 С. ДСК-диаграмма представлена на фиг. 1. Полиморфную модификацию А можно получить из аморфной формы соединения ML 3000 или из его других полиморфных модификаций (полиморфных модификаций С и Е, см. примеры 4 и 5) путем их обработки углеводородом при повышенной температуре, например при температуре в диапазоне от 40 до 110 С. Целесообразно проводить обработку углеводородом путем размешивания (дигерирования). Для полиморфной модификации А характерно, кроме того, наличие следующих значимых пиков в ИК-спектре (растирание с KВr в соотношении 1:3, ИК-спектрометр преобразованием Фурье типа Spektrum 2000 фирмы PerkinElmer; управление прибором осуществляют с помощью программы Spektrum 2.00; измерения проводят в диффузном отраженном свете): волновое число (см-1): 1706; 1601; 1536; 1487; 1463; 1450; 1441; 1413; 1395; 1383; 1369; 1293; 1219; 1177; 1099; 1013; 836; 765; 698. ИК-спектр представлен на фиг. 2. Рентгенограмма (рефрактограмма порошка) полиморфной модификации А представлена на фиг. 3. Полиморфная модификация А имеет следующие характерные значения параметра d: 11,9; 4,2; 4,0, (2: 7,5; 21,2; 22,4). Полиморфная модификация А характеризуется узким диапазоном распределения частиц по размерам, при этом средние размеры частиц 10 кальное расстояние 50 мм) составляют от 30 до 50 мкм. Для сольватов же характерен широкий диапазон распределения частиц по размерам с высокой долей мелкозернистой фракции с крупностью частиц приблизительно 10 мкм и высокой долей крупнозернистой фракции с крупностью частиц приблизительно 1 мм. Средний размер частиц составляет от 100 до 150 мкм. По сравнению с известными сольватами и аморфной формой соединения ML 3000 полиморфная модификация А обладает существенными преимуществами. Благодаря кристаллической структуре полиморфная модификация А отличается стабильностью при сушке и хранении. У нее не наблюдаются фазовые превращения и вторичное агрегирование, которые имеют место у аморфной формы. Кроме того, чистота полиморфной модификации А выше, поскольку при ее получении загрязняющие примеси в кристаллическую структуру не проникают. Для полиморфной модификация А характерно плотное сцепление кристаллов с относительно небольшой поверхностью. В отличие от аморфной формы соединения ML 3000, поверхностные явления, такие как электростатический заряд, адгезия, адсорбция и т.п., проявляются у полиморфной модификации А лишь в незначительной степени. Кроме того, кристаллическая структура обеспечивает высокую химическую стабильность, тогда как аморфная форма соединения ML 3000 имеет большую поверхность и вследствие этого подвержена более сильному окислительному разложению. Сольваты не обладают стабильностью при хранении, поскольку они способны выделять растворитель даже при комнатной температуре. Происходящее при этом фазовое превращение в аморфную форму, не содержащую растворитель, протекает неоднозначно. При старении сольватов каверны в кристаллической структуре остаются. Вследствие этого вещества в значительной степени подвержены окислительной деструкции. Кроме того, при старении сольватов образуется продукт с широким диапазоном распределения частиц по размерам, что оказывает отрицательное влияние на его реологические свойства и его дальнейшую обрабатываемость. С помощью предлагаемого в изобретении способа исходя из соединения формулы III получают соединение ML 3000 с высоким выходом, составляющим по меньшей мере 70%, что существенно выше в сравнении с уровнем техники. Так, в частности, согласно примеру 5 С,приведенному в WO 95/32971, аналогичное соединению ML 3000 соединение получают только с выходом 29%. Неожиданным образом соединение ML 3000 удается получать в виде не содержащих растворитель кристаллов с высокой чистотой. Так, например, содержание самого целевого продукта, определенное путем титрования с использованием тетрабутиламмонийхлорида, составляет почти 100%. Содержание 11 тяжелых металлов составляет меньше 10 част./ млн, а количество золы составляет 0%. Суммарное количество изомеров и производных соединения ML 3000 составляет менее 0,2% (согласно данным ЖХВР), содержание остатков растворителя также меньше 0,2% (согласно данным газовой хроматографии в паровой фазе). Предлагаемое в изобретении соединение(полиморфная модификация) является эффективным ингибитором циклооксигеназы и/или липоксигеназы. Это соединение отличается выраженным обезболивающим действием и равномерным ингибирующим действием на ферменты циклооксигеназу (ЦО) и липоксигеназу(ЛО) (IC50LO/IC50CO 1). Благодаря этому такое соединение может применяться при лечении заболеваний, сопровождающихся изменениями метаболизма арахидоновой кислоты. При этом,прежде всего, следует назвать болезни ревматического характера и профилактику заболеваний,индуцируемых аллергическими реакциями. Тем самым предлагаемое в изобретении соединение представляет собой эффективное противовоспалительное средство, обезболивающее средство,жаропонижающее средство, средство, препятствующее сужению бронхов, и, кроме того, пригодно для профилактики тромбозов и предупреждения анафилактического и септического шока, а также для лечения дерматологических заболеваний, таких как псориаз, крапивница,острые и хронические эксантемы аллергического и неаллергического генеза. Кроме того, это соединение пригодно для лечения гиперхолестеринемии. Предлагаемое в изобретении соединение можно назначать либо как таковое в виде терапевтического активного вещества, либо в смеси с другими терапевтическими активными веществами. Однако, как правило, его назначают в виде фармацевтического средства, т.е. в виде смеси активного вещества с фармацевтически приемлемыми вспомогательными веществами,прежде всего с носителями или разбавителями и/или с добавками. Соединение или средство можно применять энтерально, например орально или ректально, либо парентерально, например как средство для подкожного, внутривенного или внутримышечного введения, при этом предпочтительна, однако, оральная лекарственная форма. Тип фармацевтического средства и фармацевтического носителя или разбавителя зависит от предусматриваемой методики введения. Средства для перорального применения могут быть представлены, например, в виде таблеток или капсул и могут содержать обычные эксципиенты, такие как связующие (например, сироп,гуммиарабик, желатин, сорбит, трагакант или поливинилпирролидон), наполнители (например, лактозу, сахар, кукурузный крахмал, фосфат кальция, сорбит или глицин), скользящие вещества (например, стеарат магния, тальк, по 004938 12 лиэтиленгликоль или диоксид кремния), разрыхлители (например, крахмал) либо смачиватели (например, лаурилсульфат натрия). Жидкие препараты для перорального применения могут быть представлены в виде водных или масляных суспензий, растворов, эмульсий, сиропов, эликсиров или спреев и т.п. либо в виде сухих порошков для восстановления водой или каким-либо иным пригодным для этой цели носителем. Жидкие препараты такого типа могут содержать обычные добавки, например суспендирующие средства, вкусовые добавки, разбавители или эмульгаторы. При парентеральном назначении можно применять растворы или суспензии с обычными фармацевтическими носителями. Лечение предлагаемым в изобретении соединением проводят путем введения пациенту,предпочтительно грудному младенцу, прежде всего человеку, эффективного количества соединения, определяемого, как правило, согласно фармацевтической практике. Показано ли такое лечение пациенту и в какой форме его следует проводить, зависит от каждого конкретного случая и требует соответствующей медицинской оценки (постановка диагноза), учитывающей наличие признаков, симптомов и/или функциональных нарушений, равно как и риска развития определенных признаков, симптомов и/или функциональных нарушений, а также с учетом других факторов. Лечение, как правило, проводят путем назначения соединения по изобретению из расчета на однократный или многократный прием в день, при необходимости совместно либо поочередно с другими активными веществами или препаратами, содержащими активные вещества,и поэтому суточная доза для пациента составляет от приблизительно 0,1 до приблизительно 1000 мг, особенно предпочтительно от 0,5 до приблизительно 100 мг/кг веса тела. Ниже изобретение более подробно поясняется на примерах, которые не ограничивают его объем. Приведенные в настоящем изобретении ДСК-диаграммы и рентгенограммы (рефрактограммы порошков) получали следующим образом. ДСК-анализ проводили с использованием системы ТА 4000 фирмы Mettler (измерительная ячейка типа DSC-20; процессор Т 11; обработку результатов измерений осуществляли с помощью программы ТА-72). Скорость нагрева составляла 5 С/мин, а в диапазоне температур плавления равнялась 2 С/мин. Рефрактограммы порошков получали с помощью рефрактометра для порошков типа 13 В реактор объемом 250 л после трехкратного вакуумирования и продувки азотом последовательно загружают 4,64 кг (190,9 моль) магния и 18,8 кг диэтилового эфира. Эфир нагревают с обратным холодильником. При выключенной мешалке добавляют 0,03 кг йода и 0,5 кг(4 моль) бензилхлорида, при этом сразу же начинается реакция между магнием и галогенидом(обесцвечивание и помутнение). При включенной мешалке в реактор в течение 2 ч из питающего резервуара подают раствор 23,5 кг (185,6 моль) бензилхлорида в 37,8 кг диэтилового эфира, при этом наблюдается бурное кипение образовавшейся черно-серой смеси. По окончании добавления раствор Гриньяра еще в течение 2 ч кипятят с обратным холодильником. Затем при этой температуре из питающего резервуара в течение 1,5 ч подают раствор 17,7 кг (134,6 моль) дистиллированного 4-хлор-3,3-диметилбутиронитрила в 48,5 кг диэтилового эфира. Далее реакционную смесь в течение еще 2 ч нагревают с обратным холодильником. После этого из суспензии светло-серого цвета при нормальном давлении отгоняют диэтиловый эфир. Затем отбирают 54-59 кг дистиллята (необходимое время составляет 2 ч). При этом реакционная смесь сохраняет способность к перемешиванию. К остатку добавляют 106,3 кг толуола. Температура внутри реактора составляет 43 С. Затем вплоть до достижения внутренней температуры 85-90 С отгоняют смесь эфир/толуол(приблизительно 36-40 кг). Остаток превращается в густую, но еще сохраняющую способность к перемешиванию суспензию без корки. Эту суспензию переносят в реактор, в который предварительно загружают 76,7 кг льда и 38,5 кг 32%-ной соляной кислоты. При внесении суспензии в этот реактор температура фаз повышается с 0 до 23 С. Значение рН при этом должно находиться в интервале от 0,5 до 1,5 (рН=1,0). После нагревания реактора до температуры внутри него 40-45 С фазы в течение 1,75-2 ч интенсивно перемешивают между собой. Затем для разделения фаз при этой же температуре и при выключенной мешалке выдерживают в течение 10-15 мин. Далее содержащую продукт водную фазу отделяют (147 кг). Водную фазу охлаждают в экстракционном аппарате до температуры в диапазоне от -8 до 0 С и затем подщелачивают 33,2 кг 24%-ного аммиака, при этом скорость подачи аммиака регулируют таким образом, чтобы температура внутри аппарата не превышала максимум 5 С. Значение рН составляет 10,5-11. Подвергнутую подщелачиванию водную фазу в течение 30-40 мин при 10-25 С тщательно перемешивают с 106,3 кг диэтилового эфира и затем оставляют стоять в течение 25-30 мин для разделения фаз. Прозрачную водную фазу желтоватого цвета (170 кг) отделяют и отбрасывают. Прозрачную эфирную фазу желтовато 004938 14 зеленого цвета полностью концентрируют под вакуумом (0,7-0,8 мбара) и в результате получают 95 кг эфирного дистиллята (1,40 ч). В качестве остатка от перегонки получают 20,6 кг светло-зеленого масла, которое содержит 86,7% 2-бензил-4,4-диметил-1-пирролина. 20,6 кг этого остатка (86,7%-ного), соответственно 17,9 кг(95,5 моль) 2-бензил-4,4-диметил-1-пирролина,29,7 кг (127,2 моль, 1,33 экв.) -бром-4 хлорацетофенона и 226,6 кг метанола предварительно загружают в реактор объемом 500 л. После добавления 12,7 кг (151,2 моль, 1,58 экв.) гидрокарбоната натрия реакционную смесь перемешивают, исключая доступ света, при температуре от 17 до 24 С с образованием суспензии бежевого цвета. Реакцию продолжают до остаточного содержания пирролинового соединения в смеси менее 5%. Через 17 ч отбирают пробу, которую анализируют газовой хроматографией на содержание пирролинового соединения. В результате проведенного анализа получают значение 2%. После этого суспензию подвергают центрифугированию при внутренней температуре от 18 до 22 С и полученное в результате центрифугирования твердое вещество промывают двумя порциями метанола общим количеством 14,4 кг. Масса еще влажного продукта желтоватого цвета составляет 25,8 кг. Все еще влажный сырой продукт (25,8 кг) суспендируют в 150 кг воды, затем в течение 15 мин нагревают до температуры в диапазоне от 50 до 60 С и в течение 40 мин перемешивают при этой температуре. Охлажденную до 40 С суспензию (40 мин) центрифугируют и полученное в результате центрифугирования твердое кристаллическое вещество светло-желтого цвета промывают двумя порциями воды общим количеством 27 кг. Затем в течение 12-24 ч продукт сушат под вакуумом при 50-60 С. Таким путем получают 18,6 кг 6-(4-хлорфенил)-2,2-диметил 7-фенил-2,3-дигидро-1 Н-пирролизина с содержанием золы 0,33% и содержанием изомера (5(4-хлорфенил)-2,2-диметил-7-фенил-2,3-дигидро-1H-пирролизина) 1,0%. Пример 2. 6-(4-Xлорфенил)-2,2-диметил-7 фенил-2,3-дигидро-1 Н-пирролизин-5-илуксусная кислота (соединение ML 3000). В реактор объемом 250 л после трехкратного вакуумирования и продувки азотом предварительно загружают 11,5 кг (35,7 ммоль) 6-(4 хлорфенил)-2,2-диметил-7-фенил-2,3-дигидро 1 Н-пирролизина в 60 кг тетрагидрофурана(ТГФ). При подаче азота под давлением 0,5 бара раствор желтого цвета охлаждают до 10-15 С. Затем в атмосфере азота из питающего резервуара в течение 35 мин порциями подают 6,8 кг(54,7 моль) оксалилхлорида таким образом, чтобы внутренняя температура не превышала 20 С. По завершении подачи оксалилхлорида образовавшуюся темно-зеленую жидкую суспензию в течение 20-30 мин перемешивают при температуре от 18 до 25 С. 15 В реактор объемом 500 л послойно загружают 18 кг льда. Затем в течение 5 мин в реактор порциями подают суспензию с температурой 25 С таким образом, чтобы температура в объеме смеси не превышала 20 С. Реакционную смесь еще в течение 10-20 мин перемешивают при температуре от 25 до 35 С. Все еще сохраняющий зеленый цвет раствор при температуре от 25 до 35 С разбавляют 62,2 кг диэтиленгликоля. Затем из питающего резервуара при охлаждении в течение 10-15 мин подают 14,9 кг (298 моль) гидрата гидразина. Внутренняя температура при этом повышается максимум до 40-45 С. Путем ступенчатого повышения температуры в течение 1,5 ч суспезию,принявшую бежевую окраску, нагревают до температуры 70-75 С, отгоняя при этом ТГФ. Количество отогнанного ТГФ, собираемого вплоть до достижения температуры 75 С, составляет 45,4 кг. Реакционную смесь охлаждают до 50-55 С и в течение 45 мин послойно смешивают с 8-10 порциями гидроксида калия (KОН), общее количество которого составляет 26,4 кг , при этом внутренняя температура уже при промывании первыми 5 кг KОН повышается до 65-70 С, а первоначально густая суспензия окрашивается в желтый цвет, становится более жидкой, и в течение короткого промежутка времени наблюдается слабое кипение с дефлегмацией. Далее эту суспензию нагревают до 90 С со скоростью 15 С/ч, при этом начиная с температуры 85 С наблюдается легкое вспенивание, и суспензия загустевает. Затем при скорости нагрева 2 С/ч температуру повышают до 102 С и одновременно через реакционную смесь при более высокой скорости вращения мешалки через погружную трубку барботируют азот. В результате интенсивного вспенивания и дополнительного газообразования объем реакционной смеси увеличивается вдвое. При необходимости температуру реакционной смеси снижают путем ее охлаждения. При температуре 100-105 С пена начинает опадать, что сопровождается образованием красно-коричневой жидкой суспензии,температуру которой далее увеличивают до 140145 С нагреванием со скоростью 15 С/ч. При слишком бурном вспенивании температуру реакционной смеси кратковременно понижают за счет ее охлаждения. Одновременно собирают водные дистилляты, общее количество которых составляет 44 кг. Далее смесь в течение 2-2,5 ч выдерживают при температуре 120-145 С. После этого температуру в реакторе понижают до 30-40 С и добавляют 74,7 кг воды и 56,7 кг диэтилового эфира. В течение 10-15 мин реакционную смесь тщательно перемешивают при внутренней температуре 30-33 С, а затем дают фазам отстояться. Образовавшуюся трехфазную систему разделяют. Нижняя водная сильно щелочная фаза массой 154,9 кг является бесцветной и лишь 16 слегка мутной. Ее удаляют как сточную воду. Мутная средняя фаза желтого цвета масляной консистенции имеет массу 29,6 кг и содержит основное количество продукта в виде соли калия. Верхнюю прозрачную эфирную фазу желтой окраски в течение 10 мин интенсивно перемешивают в экстракционном аппарате с 10 кг воды при внутренней температуре 30 С. Через 10 мин после прекращения перемешивания водную фазу отделяют. Среднюю фазу (29,6 кг) и водный экстракт эфирной фазы (10,9 кг) смешивают в экстракционном аппарате с 126,2 кг диэтилового эфира и 59,7 кг воды и смесь охлаждают до температуры 0-5 С. Из питающего резервуара в течение 15 мин подают смесь из 6,0 кг 32,5%-ной соляной кислоты и 6,0 кг воды такими порциями, чтобы максимальная температура в объеме не превышала 10 С, а значение рН достигло 1-2. Если это значение рН не достигнуто, то добавляют еще 0,2 кг 32,5%-ной соляной кислоты в смеси с 0,2 кг воды. По достижении указанного значения рН фазы еще в течение 5-10 мин тщательно перемешивают, а затем при выключенной мешалке выдерживают в течение 10-20 мин для их разделения. Далее подкисленную соляной кислотой водную фазу спускают. Эфирную фазу еще раз смешивают с подаваемой из питающего резервуара смесью из 9,5 кг соляной кислоты и 19 кг воды и, не превышая температуры 10 С, тщательно перемешивают в течение 5-10 мин. Фазы разделяют и при необходимости обработку НСl повторяют до 3 раз. После этого эфирную фазу смешивают с 30 кг деминерализованной воды, тщательно перемешивают в течение 10-20 мин и нагревают до 15-20 С. Затем фазы разделяют и повторно экстрагируют. Отмытую от следов кислоты эфирную фазу смешивают с 6,5 кг безводного сульфата магния и 0,4 кг активированного угля (Acticarbon 2S), суспендированными в 1 кг диэтилового эфира, и в течение 30-45 мин перемешиваютпри 18 С. Суспензию осветляют на прессфильтре с покрытием из фильтровального вспомогательного вещества (Cell Flock) и подают в дистилляционный аппарат. Фильтр и аппарат промывают затем 8 кг диэтилового эфира. К эфирной фазе добавляют 95,6 кг нгептана и под вакуумом при температуре 1520 С отгоняют эфир. Образовавшуюся после отгонки эфира кристаллическую суспензию охлаждают до температуры 13-18 С и перемешивают при этой температуре в течение 0,5-1,5 ч,после чего кристаллы отделяют путем центрифугирования. Полученный влажный продукт промывают двумя порциями н-гептана общим количеством 23,0 кг. Влажный продукт в течение ночи сушат в вакуумном сушильном шкафу при температуре 50-60 С и при необходимости размалывают. Таким путем получают 10,5 кг(77,2%) соединения ML 3000. Описание продукта. Цвет продукта от желтоватого до цвета слоновой кости. Раствор в тетрагидрофуране является бесцветным (Y7) и прозрачным. Температура плавления согласно данным ДСКанализа (при других условиях, отличных от приведенных выше) составляет около 157 С. Вторичное определение температуры плавления при вышеприведенных условиях проводили с использованием представленной на фиг. 1 ДСКдиаграммы. ИК-спектр и рефрактограмма порошка представлены на фиг. 2 и 3. Расстояния между плоскостями в кристаллической решетке (значения параметра d) приведены ниже (с учетом всех пиков вплоть до 2=34). 2 7,5 10,8 11,2 13,8 14,9 15,4 15,9 16,8 18,1 18,15 19,0 19,9 20,1 20,8 21,2 22,0 22,4 22,8 23,7 24,4 25,0 25,7 26,4 26,9 27,2 27,7 28,4 30,4 30,7 31,2 31,5 32,3 32,5 33,7 33,9 Содержание целевого продукта, определенное путем титрования с использованием тетрабутиламмонийхлорида, составляет около 100,9%. Содержание тяжелых металлов 10 ч./млн Содержание золы 0% Содержание остатков растворителей(согласно данным ГХ) 0,11% диэтилового эфира и 0,04% гептана Содержание гидразина 0,3 ч./млн 18 Пример 3. Получение полиморфной модификации А 6-(4-хлорфенил)-2,2-диметил-7-фенил-2,3-дигидро-1 Н-пирролизин-5-илуксусной кислоты путем кристаллизации из смеси диэтиловый эфир/циклогексан. Влажную сырую 6-(4-хлорфенил)-2,2-диметил-7-фенил-2,3-дигидро-1 Н-пирролизин-5 илуксусную кислоту (500 г) при повышенной температуре (40-50 С) и при перемешивании полностью растворяют в диэтиловом эфире (13 л),фильтруют через оксид алюминия Аl2 О 3 и удаляют из фильтрата растворитель. Полученную в виде остатка сырую кристаллическую фракцию суспендируют в циклогексане (3,6 л) и дигерируют при нагревании. После охлаждения до комнатной температуры кристаллы отфильтровывают, промывают сначала холодным циклогексаном, а затем холодным метанолом и после этого в течение нескольких часов сушат при 5060 С. Таким путем получают 470 г (73% в пересчете на использованный предшественник) полиморфной модификации А 6-(4-хлорфенил)2,2-диметил-7-фенил-2,3-дигидро-1 Н-пирролизин-5-илуксусной кислоты с чистотой 99,69%. Пример 4. Получение 6-(4-хлорфенил)-2,2 диметил-7-фенил-2,3-дигидро-1 Н-пирролизин 5-илуксусной кислоты 1/2 этилацетата (полиморфная модификация C). Суспендированную в этилацетате (115 л) при повышенной температуре (40-50 С) сырую 6-(4-хлорфенил)-2,2-диметил-7-фенил-2,3-дигидро-1 Н-пирролизин-5-илуксусную кислоту (33 кг) переводят в растворенную форму при кипячении с обратным холодильником. Образовавшийся светлый раствор фильтруют через обогреваемую фильтровальную воронку и затем в течение 2-2,5 ч при перемешивании медленно охлаждают до 15-20 С со скоростью 0,5 С/мин. После прекращения перемешивания в течение 20 мин при этой же температуре кристаллам дают осесть, отделяют их центрифугированием и промывают холодным этилацетатом (33 л). Содержание этилацетата определяли, анализируя с помощью 1 Н-ЯМР (CDCl3) свежеполученные после отжатия и сушки на воздухе кристаллические фракции. Было установлено,что определенное опытным путем значение практически достигает рассчитанного теоретического значения 10,38 мас.% для сольвата 2:1(гемисольват). Отношение площади интегральной поверхности под резонансной кривой, соответствующей ацетилметильной группе этилацетата (d=2,04, 3H), к площади интегральной поверхности под резонансной кривой, соответствующей метиленовой группе соединения ML 3000 при d (ч./млн)=2,85 (2 Н), дает ожидаемое для гемисольвата численное значение, равное 3:4. ДСК-диаграмма, ИК-спектр и полученная для порошка рефрактограмма представлены на фиг. 4, 5 и 6.(2 г) полностью растворяют в диэтиловом эфире при кипячении с обратным холодильником. Затем в течение 7 ч, исключая доступ света, медленно охлаждают до комнатной температуры. При дальнейшем понижении температуры до 0 С, начиная с 15 С, происходит образование кристаллов. Для роста кристаллов смесь в течение 2 дней выдерживают при 0 С, после чего путем декантирования отделяют маточный раствор от кристаллов. Содержание диэтилового эфира определяли, анализируя с помощью 1 Н-ЯМР (СDСl3) свежеполученные после декантирования и сушки на воздухе кристаллы. Было установлено, что определенное экспериментальным путем значение практически достигает ожидаемого теоретического значения 8,87 мас.% для сольвата 2:1(гемисольват). Отношение площади интегральной поверхности под триплетом, соответствующим этилметильным группам диэтилового эфира (=1,21, 6 Н), к площади интегральной поверхности под резонансной кривой, соответствующей геминальной диметильной группе соединения ML 3000 (=1,29, 6 Н), дает ожидаемое для гемисольвата численное значение, равное 1:2. ДСК-диаграмма, ИК-спектр и рефрактограмма порошка представлены на фиг. 7, 8 и 9. Пример 6. Получение монокристаллов полиморфной модификации Е. 6-(4-Xлофенил)-2,2-диметил-7-фенил-2,3 дигидро-1 Н-пирролизин-5-илуксусную кислоту(250 мг) растворяют в диэтиловом эфире (5 мл),добавляя 1,4-дихлорбензол (0,5 мл). Исключая доступ света, в течение 1 ч смесь охлаждают сначала до 4 С, а затем до -25 С. В течение 1 дня вещество кристаллизуется в виде крупных хорошо сформированных бесцветных иголок. Пример 7. Получение полиморфной модификации А 6-(4-хлорфенил)-2,2-диметил-7-фенил-2,3-дигидро-1 Н-пирролизин-5-илуксусой кислоты путем кристаллизации из смеси метилтрет-бутиловый эфир (МТБЭ)/н-гептан. В двугорлой колбе объемом 100 мл, снабженной обратным холодильником и магнитной мешалкой с рабочим органом в виде стержня и обернутой для защиты от попадания света алюминиевой фольгой, суспендируют ML 3000 (1 г) в метил-трет-бутиловом эфире (14 мл) и полностью растворяют путем нагревания в атмосфере аргона (1,2 атм) вплоть до температуры кипения. После перемешивания в течение 15 мин(200 об./мин) при нагревании с обратным холодильником к прозрачному раствору добавляют н-гептан вплоть до начала помутнения (30 мл), а 20 затем медленно при нагревании добавляют еще н-гептан (40 мл) вплоть до образования суспензии (65 С), которой затем при перемешивании дают остыть до комнатной температуры. Через 3 ч суспензию помещают в холодильный шкаф и выдерживают в нем в течение 15 ч при 4 С. Кристаллы отделяют от маточного раствора с помощью вакуум-фильтра из спеченного стекла типа G4. Кристаллический осадок многократно(5 раз) повторно суспендируют в н-гептане (10 мл) и досуха отфильтровывают с помощью вакуумфильтра (1 мин), а затем без дальнейшей сушки хранят в закрытом стакане. Выход кристаллов составляет 81%, при этом они имеют чистую белую окраску. Рефрактограмма кристаллического порошка соответствует рефрактограмме порошка чистой полиморфной модификации А. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы I заключающийся в том, что соединение формулы IIIII) обрабатывают гидразином и гидроксидом щелочного металла в водной фазе при температуре в диапазоне от 120 до 180 С в присутствии алифатического одно- или двухатомного спирта с температурой кипения по меньшей мере 140 С, после завершения обработки путем добавления эфира образуют трехфазную систему и подкислением средней фазы получают соединение формулы I. 2. Способ по п.1, заключающийся в том,что в качестве простого эфира используют диэтиловый эфир, метил-трет-бутиловый эфир или тетрагидрофуран. 3. Способ по п.1 или 2, заключающийся в том, что обработку гидразином и гидроксидом щелочного металла проводят в присутствии этиленгликоля, монометилового эфира этиленгликоля или диэтиленгликоля. 4. Способ по п.3, заключающийся в том,что обработку гидразином и гидроксидом щелочного металла проводят в присутствии диэтиленгликоля. 5. Способ по любому из пп.1-4, заключающийся в том, что получаемый взаимодействием с оксалилхлоридом продукт вначале обрабатывают гидразином, а затем гидроксидом щелочного металла. 21 6. Способ по п.5, заключающийся в том,что обработку гидроксидом щелочного металла проводят при температуре в диапазоне от 120 до 180 С. 7. Способ по п.6, заключающийся в том,что при обработке компоненты, являющиеся летучими при температуре обработки, удаляют,по крайней мере, частично. 8. Способ по любому из пп.1-7, заключающийся в том, что среднюю фазу перед подкислением смешивают со смесью из воды и не смешивающимся с водой простым эфиром. 9. Способ по п.8, заключающийся в том,что целевой продукт получают из эфирной фазы путем добавления к эфирной фазе алифатического или циклоалифатического углеводорода с температурой кипения выше температуры кипения простого эфира. 10. Способ по п.8 или 9, заключающийся в том, что для получения требуемого продукта простой эфир отгоняют, по крайней мере, частично. 11. Способ по любому из пп.1-10, заключающийся в том, что в нем используют соединение формулы III, полученное в результате взаимодействия 2-бензил-4,4-диметил-1 пирролина с -галоген-4-хлорацетофеноном в полярном органическом растворителе в присутствии гидрокарбоната щелочного металла и/или карбоната щелочного металла в твердом виде. 12. Способ по п.11, заключающийся в том,что в качестве полярного органического растворителя используют метанол. 13. Способ по п.11 или 12, заключающийся в том, что реакцию проводят в присутствии твердого гидрокарбоната натрия. 14. Соединение формулы II в кристаллическом виде с единственной эндотермой на ДСК-диаграмме, находящейся в диапазоне температур от 155 до 170 С. 16. Соединение по п.15 со следующими значимыми пиками в ИК-спектре (волновое число, см-1): 1706; 1600; 1536; 1487; 1463; 1450; 1441; 1413; 1395; 1383; 1369; 1293; 1219; 1177; 1099; 1013; 836; 765; 698. 17. Соединение по п.15 или 16 с представленным, в основном, на фиг. 2 ИК-спектром. 18. Соединение по любому из пп.15-17 со следующими характерными значениями параметра d (расстояние между плоскостями в кристаллической решетке) на рентгенограмме: 11,9; 4,2; 4,0. 19. Соединение по п.18 со следующими значениями параметра d: 11,9; 8,2; 7,9; 6,4; 5,9; 5,8; 5,6; 5,3; 5,0; 4,9; 4,7; 4,5; 4,4; 4,3; 4,2; 4,05; 4,0; 3,9; 3,7; 3,6; 3,55; 3,5; 3,4; 3,3; 3,25; 3,2; 3,1; 2,95; 2,9; 2,85; 2,8; 2,75; 2,7; 2,65; 2,6. 20. Фармацевтическое средство, содержащее соединение по любому из пп.15-19, необязательно вместе с обычными вспомогательными веществами. 21. Применение соединений по любому из пп.15-19 для получения фармацевтического средства, предназначенного для лечения заболеваний ревматического характера.
МПК / Метки
МПК: A61P 21/00, A61K 31/40, C07D 487/04
Метки: получения, 6-(4-хлорфенил)-2,2-диметил-7-фенил-2,3-дигидро-1н-пирролизин-5-илуксусной, способ, кислоты
Код ссылки
<a href="https://eas.patents.su/13-4938-sposob-polucheniya-6-4-hlorfenil-22-dimetil-7-fenil-23-digidro-1n-pirrolizin-5-iluksusnojj-kisloty.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения 6-(4-хлорфенил)-2,2-диметил-7-фенил-2,3-дигидро-1н-пирролизин-5-илуксусной кислоты</a>
Предыдущий патент: Кристаллы ингибитора натрий-водородного обмена 1 типа
Следующий патент: Ингибиторы репликации респираторно-синцитиального вируса
Случайный патент: Расширяющийся баллонный имплантат












