Антивирусные олигонуклеотиды, не связанные с комплементарностью последовательностей
Формула / Реферат
1. Антивирусная олигонуклеотидная композиция, содержащая по меньшей мере один антивирусный олигонуклеотид, отличающаяся тем, что антивирусная активность указанного олигонуклеотида осуществляется в принципе по механизму действия, не связанному с комплементарностью последовательностей.
2. Композиция антивирусного олигонуклеотида по п.1, содержащая смесь по меньшей мере двух разных антивирусных олигонуклеотидов.
3. Композиция антивирусного олигонуклеотидного рандомера, содержащая по меньшей мере один антивирусный олигонуклеотидный рандомер, отличающаяся тем, что антивирусная активность указанного рандомера осуществляется в принципе по механизму действия, не связанному с комплементарностью последовательностей.
4. Композиция антивирусного олигонуклеотидного рандомера по п.3, содержащая смесь по меньшей мере двух антивирусных рандомеров разной длины.
5. Олигонуклеотидная композиция, обладающая антивирусной активностью против целевого вируса, содержащая по меньшей мере один антивирусный олигонуклеотид, где указанный олигонуклеотид составляет по меньшей мере 29 нуклеотидов в длину и где последовательность указанного олигонуклеотида не комплементарна любой из частей геномной последовательности указанного целевого вируса.
6. Олигонуклеотидная композиция, обладающая антивирусной активностью против целевого вируса, содержащая по меньшей мере один антивирусный олигонуклеотид, где указанный олигонуклеотид составляет по меньшей мере 6 нуклеотидов в длину и где последовательность указанного олигонуклеотида не комплементарна любой из частей геномной последовательности указанного целевого вируса и не состоит, по существу, из полиА, полиС, полиG, полиТ, G-квартета или G-обогащенной последовательности.
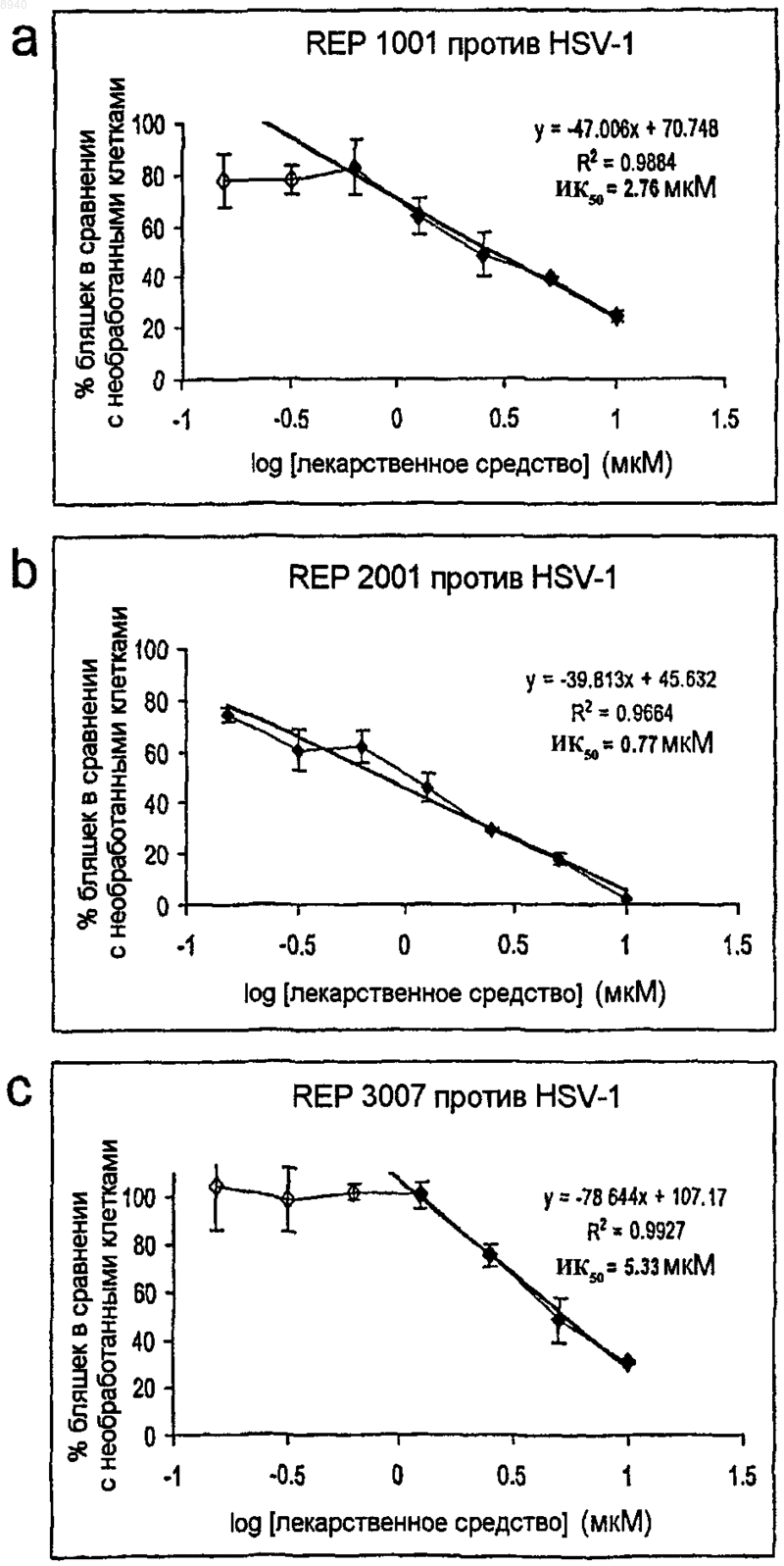
7. Олигонуклеотидная композиция по любому из пп.1-6, отличающаяся тем, что указанная композиция имеет значение ИК50 для целевого вируса, составляющее 0,10 мкМ или менее.
8. Олигонуклеотидная композиция по любому из пп.1-6, отличающаяся тем, что указанная композиция имеет значение ИК50 для целевого вируса, составляющее 0,05 мкМ или менее.
9. Олигонуклеотидная композиция по любому из пп.1-6, отличающаяся тем, что указанная композиция имеет значение ИК50 для целевого вируса, составляющее 0,025 мкМ или менее.
10. Олигонуклеотидная композиция по любому из пп.1-6, отличающаяся тем, что указанная композиция имеет значение ИК50 для целевого вируса, составляющее 0,015 мкМ или менее.
11. Олигонуклеотидная композиция по любому из пп.1-10, отличающаяся тем, что мишенью для указанного олигонуклеотида является ДНК-содержащий вирус.
12. Олигонуклеотидная композиция по любому из пп.1-10, отличающаяся тем, что мишенью для указанного олигонуклеотида является РНК-содержащий вирус.
13. Олигонуклеотидная композиция по любому из пп.1-10, отличающаяся тем, что мишенью для указанного олигонуклеотида является представитель семейства Herpesviridae, HSV-1, HSV-2, CMV, представитель семейства Hepadnaviridae, HBV, представитель семейства Parvoviridae, представитель семейства Poxviridae, представитель семейства Papillomaviridae, представитель семейства Adenoviridae, представитель семейства Retroviridae, ВИЧ-1, ВИЧ-2, представитель семейства Paramyxoviridae, RSV, вирус парагриппа, представитель семейства Bunyaviridae, хантавирус, представитель семейства Picornaviridae, вирус Коксаки, риновирус, представитель семейства Flaviviridae, вирус желтой лихорадки, вирус денге, вирус лихорадки Западного Нила, вирус гепатита С, представитель семейства Filoviridae, вирус Эбола, вирус Марбург, представитель семейства Orthomyxoviridae, вирус гриппа, представитель семейства Togaviridae, представитель семейства Coronaviridae, представитель семейства Reoviridae, представитель семейства Rhabdoviridae, представитель семейства Arenaviridae, представитель семейства Calciviridae.
14. Олигонуклеотидная композиция по любому из пп.1-4 и 6-13, отличающаяся тем, что указанный олигонуклеотид содержит по меньшей мере 6 нуклеотидов в длину.
15. Олигонуклеотидная композиция по любому из пп.1-4 и 6-13, отличающаяся тем, что указанный олигонуклеотид содержит по меньшей мере 10 нуклеотидов в длину.
16. Олигонуклеотидная композиция по любому из пп.1-4 и 6-13, отличающаяся тем, что указанный олигонуклеотид содержит по меньшей мере 20 нуклеотидов в длину.
17. Олигонуклеотидная композиция по любому из пп.1-13, отличающаяся тем, что указанный олигонуклеотид содержит по меньшей мере 29 нуклеотидов в длину.
18. Олигонуклеотидная композиция по любому из пп.1-13, отличающаяся тем, что указанный олигонуклеотид содержит по меньшей мере 32 нуклеотидав длину.
19. Олигонуклеотидная композиция по любому из пп.1-13, отличающаяся тем, что указанный олигонуклеотид содержит по меньшей мере 34 нуклеотида в длину.
20. Олигонуклеотидная композиция по любому из пп.1-13, отличающаяся тем, что указанный олигонуклеотид содержит по меньшей мере 36 нуклеотидов в длину.
21. Олигонуклеотидная композиция по любому из пп.1-13, отличающаяся тем, что указанный олигонуклеотид содержит по меньшей мере 38 нуклеотидов в длину.
22. Олигонуклеотидная композиция по любому из пп.1-13, отличающаяся тем, что указанный олигонуклеотид содержит по меньшей мере 40 нуклеотидов в длину.
23. Олигонуклеотидная композиция по любому из пп.1-13, отличающаяся тем, что указанный олигонуклеотид содержит по меньшей мере 46 нуклеотидов в длину.
24. Олигонуклеотидная композиция по любому из пп.1-13, отличающаяся тем, что указанный олигонуклеотид содержит по меньшей мере 50 нуклеотидов в длину.
25. Олигонуклеотидная композиция по любому из пп.1-13, отличающаяся тем, что указанный олигонуклеотид содержит по меньшей мере 80 нуклеотидов в длину.
26. Олигонуклеотидная композиция по любому из пп.1-13, отличающаяся тем, что указанный олигонуклеотид содержит по меньшей мере 120 нуклеотидов в длину.
27. Олигонуклеотидная композиция по любому из пп.1-26, отличающаяся тем, что указанный олигонуклеотид содержит по меньшей мере одну фосфодиэфирную связь.
28. Олигонуклеотидная композиция по любому из пп.1-26, отличающаяся тем, что указанный олигонуклеотид содержит по меньшей мере одну модификацию в своей химической структуре.
29. Олигонуклеотидная композиция по пп.1-26, отличающаяся тем, что каждый указанный олигонуклеотид содержит по меньшей мере одну фосфоротиоатную связь и необязательно систему доставки, которая необязательно является липосомной системой доставки, по меньшей мере одну 2'-О-метильную модификацию в рибозном фрагменте, по меньшей мере одну 2'-модификацию в рибозном фрагменте, по меньшей мере одну метилфосфонатную связь или по меньшей мере одну фосфородитиоатную связь и необязательно систему доставки, которая необязательно является липосомной системой доставки.
30. Олигонуклеотидная композиция по любому из пп.1-26, отличающаяся тем, что указанный олигонуклеотид представляет собой конкатемер, состоящий из двух или более олигонуклеотидных последовательностей, соединенных линкером.
31. Олигонуклеотидная композиция по любому из пп.1-26, отличающаяся тем, что указанный олигонуклеотид связывают или конъюгируют по одному или более нуклеотидным остаткам с молекулой, модифицирующей свойства олигонуклеотида, с достижением одного или более свойств, выбранных из группы, состоящей из повышенной стабильности, сниженного уровня взаимодействия с сывороткой, усиленного поглощения клетками, повышенного уровня взаимодействия с вирусным белком, улучшенной способности включения в состав композиции для доставки, наличия обнаруживаемого сигнала, более высокой антивирусной активности, улучшенных фармакокинетических свойств, специфического тканевого распределения, сниженной токсичности.
32. Олигонуклеотидная композиция по любому из пп.1-26, отличающаяся тем, что указанный олигонуклеотид является двухцепочечным.
33. Олигонуклеотидная композиция по любому из пп.1-26, отличающаяся тем, что указанный олигонуклеотид является двухцепочечным или одноцепочечным и содержит по меньшей мере одно основание, которое способно гибридизоваться в хюфх взаимодействий, не соответствующих модели Уотсона-Крика.
34. Олигонуклеотидная композиция по любому из пп.1-33, отличающаяся тем, что указанный олигонуклеотид содержит по меньшей мере одну часть с G-квартетным мотивом или CpG-мотивом.
35. Олигонуклеотидная композиция по любому из пп.1-4 и 7-33, отличающаяся тем, что указанный олигонуклеотид содержит часть, комплементарную вирусной мРНК.
36. Олигонуклеотидная композиция по любому из пп.1-33, отличающаяся тем, что указанный олигонуклеотид связывается с одним или более вирусными компонентами.
37. Олигонуклеотидная композиция по любому из пп.1-33, отличающаяся тем, что указанный олигонуклеотид взаимодействует с одним или более компонентами хозяйской клетки, где указанное взаимодействие приводит к ингибированию вирусной активности или продукции.
38. Олигонуклеотидная композиция по любому из пп.1-4 и 7-33, отличающаяся тем, что по меньшей мере часть последовательности указанного олигонуклеотида получают из вирусного генома.
39. Олигонуклеотидная композиция по любому из пп.1-4 и 7-33, отличающаяся тем, что по меньшей мере часть последовательности указанного олигонуклеотида получают из вирусного генома, и она обладает антивирусной активностью, которая преимущественно осуществляется по механизму действия, не связанному с комплементарностью последовательностей.
40. Олигонуклеотидная композиция по любому из пп.1-4 и 7-33, отличающаяся тем, что по меньшей мере часть последовательности указанного олигонуклеотида получают из последовательности вирусной упаковки или другой вирусной последовательности, участвующей в аптамерном взаимодействии.
41. Олигонуклеотидная композиция по любому из пп.1-33, отличающаяся тем, что по меньшей мере часть последовательности указанного олигонуклеотида участвует в аптамерном взаимодействии с вирусным компонентом, или с компонентом хозяйской клетки, или с ними обоими.
42. Олигонуклеотидная композиция по любому из пп.1-33, отличающаяся тем, что по меньшей мере часть последовательности указанного олигонуклеотида содержит полиА, полиС, полиG, полиТ, полиАС, полиАG, полиАТ, полиСG, полиСТ или полиGТ.
43. Олигонуклеотидная композиция по любому из пп.1-33, отличающаяся тем, что по меньшей мере часть последовательности указанного олигонуклеотида содержит две или более повторяющихся последовательностей.
44. Олигонуклеотидная композиция по любому из пп.1 и 5-43, содержащая смесь по меньшей мере двух разных антивирусных олигонуклеотидов.
45. Олигонуклеотидная композиция по п.44, содержащая смесь по меньшей мере 10 разных антивирусных олигонуклеотидов.
46. Олигонуклеотидная композиция по п.44, содержащая смесь по меньшей мере 100 разных антивирусных олигонуклеотидов.
47. Олигонуклеотидная композиция по п.44, содержащая смесь по меньшей мере 1000 разных антивирусных олигонуклеотидов.
48. Олигонуклеотидная композиция по п.44, содержащая смесь по меньшей мере 106 разных антивирусных олигонуклеотидов.
49. Олигонуклеотидная композиция по п.44, отличающаяся тем, что множество указанных разных олигонуклеотидов содержит по меньшей мере 6 нуклеотидов в длину.
50. Олигонуклеотидная композиция по п.44, отличающаяся тем, что множество указанных разных олигонуклеотидов содержит по меньшей мере 10 нуклеотидов в длину.
51. Олигонуклеотидная композиция по п.44, отличающаяся тем, что множество указанных разных олигонуклеотидов содержит по меньшей мере 20 нуклеотидов в длину.
52. Олигонуклеотидная композиция по п.44, отличающаяся тем, что множество указанных разных олигонуклеотидов содержит по меньшей мере 29 нуклеотидов в длину.
53. Олигонуклеотидная композиция по п.44, отличающаяся тем, что множество указанных разных олигонуклеотидов содержит по меньшей мере 32 нуклеотида в длину.
54. Олигонуклеотидная композиция по п.44, отличающаяся тем, что множество указанных разных олигонуклеотидов содержит по меньшей мере 34 нуклеотида в длину.
55. Олигонуклеотидная композиция по п.44, отличающаяся тем, что множество указанных разных олигонуклеотидов содержит по меньшей мере 36 нуклеотидов в длину.
56. Олигонуклеотидная композиция по п.44, отличающаяся тем, что множество указанных разных олигонуклеотидов содержит по меньшей мере 38 нуклеотидов в длину.
57. Олигонуклеотидная композиция по п.44, отличающаяся тем, что множество указанных разных олигонуклеотидов содержит по меньшей мере 40 нуклеотидов в длину.
58. Олигонуклеотидная композиция по п.47, отличающаяся тем, что множество указанных разных олигонуклеотидов содержит по меньшей мере 50 нуклеотидов в длину.
59. Олигонуклеотидная композиция по п.47, отличающаяся тем, что множество указанных разных олигонуклеотидов содержит по меньшей мере 80 нуклеотидов в длину.
60. Олигонуклеотидная композиция по п.47, отличающаяся тем, что множество указанных разных олигонуклеотидов содержит по меньшей мере 120 нуклеотидов в длину.
61. Антивирусная фармацевтическая композиция, содержащая терапевтически эффективное количество по меньшей мере одного фармакологически приемлемого антивирусного олигонуклеотида по любому из пп.1-60, где антивирусная активность указанного олигонуклеотида осуществляется принципиально по механизму действия, не связанному с комплементарностью последовательностей, и фармацевтически приемлемый носитель.
62. Антивирусная фармацевтическая композиция по п.61, адаптированная для лечения, контроля или профилактики заболевания вирусной этиологии.
63. Антивирусная фармацевтическая композиция по п.61, адаптированная для лечения, контроля или профилактики болезни приона.
64. Антивирусная фармацевтическая композиция по п.61, адаптированная для доставки способом, выбранным из группы, состоящей из внутриглазного введения, перорального введения, энтерального введения, ингаляции, внутрикожной инъекции, подкожной инъекции, внутримышечной инъекции, внутрибрюшинной инъекции, внутриоболочечной инъекции, внутритрахеальной инъекции и внутривенной инъекции.
65. Антивирусная фармацевтическая композиция по п.61, отличающаяся тем, что указанная композиция дополнительно содержит систему доставки.
66. Антивирусная фармацевтическая композиция по п.61, отличающаяся тем, что указанная композиция дополнительно содержит липосомный препарат.
67. Антивирусная фармацевтическая композиция по п.65 или 66, отличающаяся тем, что указанная система доставки или липосомный препарат нацелены на специфические клетки или специфические ткани.
68. Антивирусная фармацевтическая композиция по п.61, отличающаяся тем, что указанная композиция дополнительно сочетает в себе по меньшей мере одно другое антивирусное лекарственное средство.
69. Антивирусная фармацевтическая композиция по п.61, отличающаяся тем, что указанная композиция дополнительно сочетает в себе ненуклеотидный антивирусный полимер.
70. Набор, содержащий по меньшей мере один антивирусный олигонуклеотид или антивирусное олигонуклеотидное средство по любому из пп.1-61 в снабженной этикеткой упаковке, где антивирусная активность указанного олигонуклеотида осуществляется принципиально по механизму действия, не связанному с комплементарностью последовательностей, и на этикетке на указанной упаковке указано, что данный антивирусный олигонуклеотид может быть использован по меньшей мере против одного вируса.
71. Набор по п.70, отличающийся тем, что указанный набор содержит смесь по меньшей мере двух разных антивирусных олигонуклеотидов.
72. Набор по п.70, отличающийся тем, что указанный набор разрешен регламентирующим агентством для применения на человеке.
73. Набор по п.70, отличающийся тем, что указанный набор разрешен регламентирующим агентством для применения по меньшей мере на одном животном, отличном от человека.
74. Способ профилактики или лечения вирусной инфекции у субъекта, подразумевающий введение субъекту, при необходимости такого лечения, терапевтически эффективного количества по меньшей мере одного фармакологически приемлемого олигонуклеотида по любому из пп.1-62.
75. Способ по п.74, отличающийся тем, что указанный субъхът является человеком, животным или растением.
76. Способ профилактического лечения рака, вызванного онковирусами, у человека или животного, отличного от человека, подразумевающий введение человеку или животному, отличному от человека, при необходимости такого лечения, фармакологически приемлемого терапевтически эффективного количества по меньшей мере одного олигонуклеотида по любому из пп.1-61.
77. Способ по п.76, отличающийся тем, что указанный олигонуклеотид вводят человеку.
Текст
008940 Область техники, к которой относится изобретение Настоящее изобретение относится к олигонуклеотидам, обладающим антивирусной активностью, и к их применению в качестве терапевтических средств при вирусных инфекциях, вызванных вирусами человека и животных, и в случаях рака, вызванного онкогенными вирусами, и также при других заболеваниях, этиология которых связана с вирусами. Предпосылки создания изобретения Приведенное ниже обсуждение дано исключительно в целях лучшего понимания читателем, и как само описание, так и содержащиеся в нем ссылки не должны рассматриваться как исчерпывающая информация о достигнутом уровне в той области, к которой относится данное изобретение. Многие значимые инфекционные заболевания, поражающие человечество, вызываются вирусами. Многие из указанных заболеваний, включая бешенство, оспу, полиомиелит, гепатит, желтую лихорадку,иммунодефицит и различные энцефалиты, являются зачастую смертельными. Другие важны в том смысле, что они являются чрезвычайно контагиозными и создают острый дискомфорт, такие как грипп, корь,эпидемический паротит и ветряная оспа, а также респираторные или желудочно-кишечные расстройства. Другие возбудители, вызывающие краснуху, а также цитомегаловирус, могут вызвать наследственные аномалии. И наконец, есть вирусы, такие как онковирусы, которые могут вызывать рак у человека и животного. Среди вирусов особый интерес вызывает семейство Herpesviridae. Herpesviridae представляет собой широко распространенный класс двадцатигранных вирусов с двухцепочечной ДНК. Из 100 охарактеризованных представителей Herpesviridae (HHV) только восемь инфицируют людей. Самыми известными среди них являются вирус простого герпеса типа 1 (Herpes simplex (HSV-1, вирус простого герпеса типа 2 (Herpes simplex (HSV-2, Varicella zoster (вирус, вызывающий ветрянку или опоясывающий лишай),цитомегаловирус (CMV) и вирус Эпштейна-Барр (EBV). Встречаемость Herpesviridae у человека высока,им поражена по меньшей мере одна треть населения земного шара, а в США 70-80% населения имеют некоторые виды инфекции герпеса. Несмотря на то, что патология герпес-инфекции обычно не вызывает опасений, как в случае HSV-1, который обычно вызывает лишь недлительные поражения вокруг рта и на других частях лица, известны также такие герпес-вирусы, которые вызывают более опасные симптомы,включающие в себя поражения, начиная от изъязвления половых органов до инфицирования плода, что может приводить к развитию энцефалита (15% смертность) или диссеминированной инфекции (40% смертность). Вирусы герпеса широко распространены в природе и характеризуются высокой патогенностью для человека. Например, вирус Эпштейна-Барр (EBV), который, как известно, вызывает инфекционный мононуклеоз у детей или подростков или у молодых взрослых людей. Признаками острого инфекционного мононуклеоза являются фарингит, лихорадка, головная боль, лимфаденопатия, увеличение миндалин и атипичные делящиеся лимфоциты в периферической крови. Другие часто встречающиеся проявления включают в себя слабый гепатит, спленомегалию и энцефалит. EBV также ассоциируется с двумя формами рака: лимфома Бэркитта (ЛБ, (BL и рак носоглотки (назофарингеальная карцинома, НФК (NPC. В эндемичных районах экваториальной Африки ЛБ представляет собой наиболее распространенную форму злокачественных заболеваний у детей, которая насчитывает примерно 80% случаев рака у детей. Будучи умеренно распространенной у белых представителей Северной Америки, НФК представляет собой наиболее часто встречающийся вид рака в Южном Китае, поражающий чаще всего людей в возрасте от 25 до 55 лет. EBV, как и цитомегаловирус, также часто ассоциируется с посттрансплантационным лимфопролиферативным заболеванием, которое является потенциально смертельным осложнением хронической иммуносупрессии, возникающей после трансплантации твердого органа или костного мозга. С HSV ассоциированы также другие заболевания, включая инфекции кожи и глаз, например, хориоретинит или кератоконъюнктивит. Ежегодно в США диагностируется примерно 300000 случаев HSV инфекций глаза. СПИД (синдром приобретенного иммунодефицита) вызывается вирусом иммунодефицита человека(ВИЧ). Уничтожая или повреждая клетки иммунной системы организма, ВИЧ в прогрессирующей степени нарушает способность человека бороться с инфекциями и некоторыми видами рака. В настоящее время во всем мире примерно 42 млн людей живут с поражением ВИЧ/СПИД. В 2002 г. по причинам, связанным с ВИЧ/СПИДом, умерло в общей сложности 3,1 млн человек. Главной целью анти-ВИЧ лекарственной терапии является предотвращение репродукции вируса и связанного с этим поражения иммунной системы. Несмотря на то что за последние пятнадцать лет был достигнут существенный прогресс в борьбе против ВИЧ, проблема излечивания все еще не решена медицинской наукой. В настоящее время врачи имеют более десятков антиретровирусных средств, относящихся к трем разным классам лекарственных препаратов для лечения данного заболевания. В типичном случае в рамках терапии, известной как ВААРТ (HAART) (высокоактивная антиретровирусная терапия), назначают прием в различных комбинациях лекарственных средств из двух или трех классов. Под ВААРТ в типичном случае подразумевается применение двух нуклеозидных ингибиторов обратной транскриптазы в сочетании с третьим лекарственным средством, либо ингибитором протеазы, либо ненуклеозидным ингибитором обратной транскриптазы. Клинические исследования показали, что ВААРТ является наиболее эффективным средством-1 008940 снижения уровня вирусов и минимизации вероятности возникновения лекарственной резистентности. Несмотря на то что, как было показано, ВААРТ снижает количество ВИЧ в организме, известное как вирусная нагрузка, десятки из сотен пациентов имеют существенные проблемы при проведении такого лечения. Некоторые возникающие побочные эффекты, включая аномалии в метаболизме жиров,камни в почках и заболевания сердца, весьма серьезны. Другие побочные эффекты, такие как тошнота,рвота и бессонница, менее серьезны, хотя также создают проблемы для ВИЧ-пациентов, которые нуждаются в хронической лекарственной терапии в течение всей жизни. Разрешенные в настоящее время анти-ВИЧ-средства действуют путем поступления в ВИЧинфицированные CD4+ Т-клетки и блокирования при этом функции вирусного фермента, либо обратной транскриптазы, либо протеазы. Для репродукции ВИЧ нужны оба указанных фермента. Однако ВИЧ часто мутирует и становится резистентным, делая неэффективными такие лекарственные средства, основанные на ингибиторах обратной транскриптазы или протеазы. При возникновении резистентности вирусная нагрузка повышается, что диктует необходимость заменить неэффективное средство другим антиретровирусным средством. Однако, к сожалению, когда вирус становится резистентным к одному лекарственному средству данного класса, то другие средства того же класса также могут стать менее эффективными. Указанное явление, известное как перекрестная резистентность, существует в связи с тем,что многие анти-ВИЧ-средства работают аналогичным образом. Встречаемость перекрестной лекарственной резистентности - очень нежелательное явление, поскольку уменьшается количество доступных вариантов для лечения пациентов. В этой связи, имеется огромная потребность в разработке других антивирусных средств, эффективных против ВИЧ, которые бы работали посредством других механизмов действия, против которых вирус не развил резистентности. Такой подход становится особенно важным в свете последних данных, показывающих что один из десяти пациентов в Европе, заново диагностированных как ВИЧ-пациент, инфицируется штаммом ВИЧ, который уже является резистентным по меньшей мере к одному из разрешенных лекарственных средств, имеющихся на фармацевтическом рынке. Респираторно-синцитиальный вирус (RSV) вызывает инфекции верхних и нижних дыхательных путей. Он представляет собой оболочечный РНК-содержащий вирус с (-)-цепью, который отличается очень высокой вирулентностью. Обычно указанный вирус поражает маленьких детей и является самой частой причиной поражений нижних дыхательных путей у младенцев. Инфекции, вызванные RSV, обычно сопровождаются симптомами, подобными простуде, которые выражены в степени от умеренной до сильной. Однако тяжелое заболевание нижних дыхательных путей может встречаться в любом возрасте, особенно у пожилых людей или у пациентов с ослабленным иммунитетом. Для детей с тяжелыми инфекциями может потребоваться кислородная терапия и в ряде случаев механическая вентиляция. Согласно данным Американской Медицинской Ассоциации растет число детей, госпитализируемых с бронхиолитом, который часто вызывается RSV-инфекцией. RSV-инфекции также насчитывают примерно одну треть контактных респираторных вирусных инфекций у пациентов в центрах трансплантации костного мозга. У пожилой части населения RSV-инфекция, как было показано в последнее время, очень похожа по тяжести на инфекцию вирусом гриппа. Грипп (INF), также известный как простуда, представляет собой контагиозное заболевание, которое вызывается вирусом гриппа. Он поражает дыхательные пути человека (нос, горло и легкие). В США в среднем примерно 36000 человек ежегодно умирает от гриппа и 114000 человек нуждаются ежегодно в госпитализации в связи с гриппом. В случае всех инфекционных заболеваний эффективность проводимой терапии зачастую зависит от иммунного ответа хозяйского организма. Указанное замечание особенно справедливо в случае герпесвирусов, где способность всех вирусов герпеса устанавливать латентные инфекции сказывается на чрезвычайно высокой частоте рецидивирующих инфекций у пациентов со слабым иммунитетом. У реципиентов с трансплантацией почки наблюдается от 40 до 70% случаев реактивации латентных HSVинфекций и от 80 до 100% реактивации CMV-инфекций. Такие случаи вирусной реактивации также отмечаются у пациентов со СПИДом. Вирус гепатита В (HBV) является ДНК-содержащим вирусом, который принадлежит семейству вирусов Hepadnaviridae. HBV вызывает гепатит В у человека. В настоящее время во всем мире насчитывается примерно 2 миллиарда людей, инфицированных указанным вирусом (1 из 3 человек). Примерно 350 млн людей остаются хроническими носителями инфекции и, по оценкам, 1 млн людей умирают каждый год от гепатита В и его осложнений. HBV может вызвать длительную инфекцию, цирроз печени, рак печени, печеночную недостаточность и смерть. Вирус переносится через кровь и жидкости организма. Указанный процесс может иметь место при непосредственном контакте через кровь, в случае незащищенных половых контактов, при использовании нестерильных игл и при передаче от инфицированной женщины новорожденному в процессе родов. Большинство здоровых взрослых (90%) из числа инфицированных выздоравливает, при этом у них образуются защитные антитела против дальнейших инфекций вирусом гепатитом В. Небольшое число (510%) неспособно избавиться от вируса и становится носителем хронических инфекций, тогда как у 90% младенцев и до 50% маленьких детей развиваются хронические инфекции после инфицирования данным-2 008940 вирусом. В качестве наиболее распространенного вида лечения используют альфа-интерферон. Значительные побочные эффекты, связанные с таким лечением, включают в себя симптомы типа простуды,депрессию, сыпь и другие реакции, а также аномалии в составе крови. Другой вид лечения связан с препаратом 3 ТС, при использовании которого также отмечаются многочисленные побочные эффекты. За последние несколько лет отмечалось растущее число отчетов, указывающих на появление у пациентов,проходивших лечение с использованием 3 ТС, резистентных штаммов HBV. Указанная тенденция вырастает в особенно серьезную проблему для той категории пациентов, которые имеют совместную инфекцию HBV и HIV. В этой связи, имеется насущная потребность в разработке новых антивирусных средств для борьбы с данным вирусом. Инфекция вирусом гепатита С (HCV) представляет собой самую распространенную в Соединенных Штатах хроническую трансфузионную инфекцию, где число инфицированных пациентов превышает 4 млн. Обычно вирусная инфекция является ведущей причиной цирроза и рака печени, и в настоящее время рассматривается как основная причина трансплантации печени у пациентов Соединенных Штатов. Выздоровление от инфекции - редкое явление, и примерно 85% инфицированных пациентов становятся хроническими носителями вируса и у 10-20% развивается цирроз. Установлено, что в настоящее время во всем мире насчитывается 170 млн людей, которые являются хроническими носителями. Согласно данным Центра контроля и профилактики заболеваний, хронический гепатит С вызывает от 8000 до 10000 смертельных случаев и является причиной примерно 1000 случаев трансплантации печени в Соединенных Штатах каждый год. В настоящее время отсутствует доступная вакцина для гепатита С. Длительная терапия с использованием интерферона-альфа или сочетания интерферона с рибовирином эффективна лишь примерно у 40% пациентов и вызывает серьезные побочные эффекты. В настоящее время ситуацию с лечением вирусных инфекций нельзя назвать удовлетворительной. В основном эффективность лечения вирусных инфекций находится на среднем уровне, что связано с развитием выраженных побочных эффектов, которые либо не позволяют осуществлять введение эффективных доз, либо препятствуют проведению длительного лечения. Три клинических ситуации, которые являются показательными для данной проблемы, связаны с инфекциями вирусами из семейства Herpesviridae, ВИЧ и RSV. В случае вирусов из семейства Herpesviridae имеется пять основных видов лечения, разрешенных в настоящее время для применения в клинических условиях: лечение с использованием идоксуридина,видарабина, ацикловира, фоскарнета и ганцикловира. Указанные виды лечения, имея ограниченную эффективность, также зачастую сопровождаются развитием выраженных побочных эффектов. Аллергические реакции отмечаются у 35% пациентов, принимающих для лечения идоксуридин, видарабин может привести к нарушениям со стороны желудочно-кишечного тракта у 15% пациентов, тогда как ацикловир,фоскарнет и ганцикловир, будучи нуклеозидными аналогами, поражают репликацию ДНК в хозяйских клетках. В случае ганцикловира отмечается развитие нейтропении и тромбоцитопении у 40% больных СПИДом, принимающих для лечения данное лекарственное средство. Несмотря на то что в настоящее время разрешено множество различных лекарственных средств для лечения ВИЧ-инфекции, все они сопровождаются развитием побочных эффектов, которые являются достаточно сильными и вызывают необходимость обширной вспомогательной терапии для того, чтобы обеспечить пациентам приемлемое качество жизни. Дополнительная проблема, связанная с резистентностью ВИЧ к лекарственным препаратам (проблема, существующая также в случае инфекции герпесвирусами), обычно требует периодического изменения набора лекарственных средств, применяемых для лечения, что в ряде случаев чрезвычайно осложняет лечение такой инфекции. Лечение RSV-инфекций у маленьких детей является другим примером, подтверждающим актуальность разработки нового лекарственного средства. В данном случае обычным направлением лечения является доставка рибавирина ингаляцией с использованием аэрозоля в виде мелких частиц, вдыхаемого под отдельным тентом. Однако рибавирин не только характеризуется слабой эффективностью, но его использование сопровождается также значительными побочными эффектами. Кроме того, возможность выделения лекарственного средства вызывает большую озабоченность у персонала больниц в связи с известными тератогенными свойствами рибавирина. Совершенно очевидно, что для вновь разрабатываемых антивирусных средств чрезвычайно желательно наличие трех основных свойств: 1 - улучшенная эффективность; 2 - сниженный риск побочных эффектов и 3 - механизм действия, который было бы трудно преодолеть за счет вирусной мутации. Были предприняты некоторые попытки ингибирования конкретных вирусов по методике, связанной с использованием антисмысловых молекул. Замецник с соавт. (Zamecnik et al.) использовали ОН, которые специфически достигают сайт праймера обратной транскриптазы и оказывают сплайсинг сайтов донора/акцептора (Zamecnik et al., (1986),Proc. Natl. Acad. Sci. USA, 83: 4143), (GoodchildZamecnik (1989), патент США 4806463). Крук с соавторами (Crooke et al., (1992), Antimicrob. Agents Chemother., 36: 527-532) описали антисмысловое соединение против HSV-1. Дрэпер с соавт. (Draper et al., (1993 (патент США 5248670) описали антисмысловые олигонуклеотиды с анти-HSV-активностью, содержащие последовательность Cat и гибридизующиеся с HSV-1 генамиUL13, UL39 и UL40. Кин с соавт. (Kean et al., Biochemistry (1995), 34: 14617-14620) протестировали антисмысловые метилфосфонатные олигомеры в качестве aнти-HSV-средств. Пейман с соавт. (Peyman et al., Biol. Chem. Hoppe Seyler (1995) Mar; 376: 195-198) опубликовали результаты исследования на наличие антивирусных свойств специфических антисмысловых олигонуклеотидов, направленных против мРНК IE110 и UL30 HSV-1. Олигонуклеотиды или олигонуклеотидные аналоги, воздействующие в качестве мишени на мРНКCMV, кодирующие IE1, IE2 или ДНК-полимеразу, были описаны Андерсоном с соавт. (Anderson et al.,(1997), патент США 5591720). Хэнекак с соавт. (Hanecak et al., (1999) (патент США 5952490 описали модифицированные олигонуклеотиды, содержащие консервативную G-квартетную последовательность и достаточное количество фланкирующих последовательностей нуклеотидов, которые позволяют в значительной мере ингибировать активность вируса, такого как HSV-1. Джайрет с соавт. (Jairath et al., Antiviral. Res. (1997), 33: 201-213) сообщили об антисмысловых олигонуклеотидах, активных против RSV. Торренс с соавт. (Torrence et al., (1999) (патент США 5998602 сообщили о соединениях, включающих антисмысловой компонент, комплементарный одноцепочечной части антигеномной цепи RSV(цепь мРНК), линкер и олигонуклеотидный активатор РНКазы L. Ки с соавт. (Qi et al., Zhonghua Shi Yan He Lin Chuang Bing Du Xue Za Zhi (2000), 14: 253-256) опубликовали результаты тестирования антисмысловых PS-ОДН в вирусе Коксаки В 3. В международной публикации WO 9203051 (Roizman and Maxwell) описываются метилфосфонатные антисмысловые олигомеры, которые комплементарны жизненно важным участкам вирусного геномаHSV или транскриптам мРНК, которые демонстрируют антивирусную активность. Было показано, что фосфоротиоатные гуанозин/тимидиновые или обогащенные гуанозином олигодезоксинуклеотиды (ГТ-PS-ОДН) обладают антивирусной активностью. В статье отмечается, что несколько разных PS-содержащих ГТ-обогащенных ОДН (В 106-140, 1100-12 и G106-57), составляющие 26 или 27 нт в длину, были так же эффективны по снижению титра ВИЧ-2, как и ГТ-обогащенные ОДН,состоящие из 36 (В 106-96, В 106-97) или 45 нт (табл. 4) (Fennewald et al., Antiviral. Res. (1995), 26: 37-54). В патенте США 6184369 описаны анти-ВИЧ, анти-HSV и анти-CMV олигонуклеотиды, содержащие высокий процент гуанозиновых оснований. В предпочтительных вариантах олигонуклеотид имеет трехмерную структуру и данная структура стабилизируется гуанозиновыми тетрадами. В другом варианте олигонуклеотидные композиции, описанные в данном изобретении, включают два или более тяжа двух соприкасающихся дезоксигуанозинов. В указанном патенте заявляется G-обогащенный ОДН, который включает в себя по меньшей мере два G-остатка, локализованных по меньшей мере в двух положениях. Коэн с соавт. (Cohen et al., патенты США 5264423 и 5276019) описывают ингибирование репликации ВИЧ и, более конкретно, аналогами PS-ОДН, которые могут использоваться для предотвращения репликации чужеродных нуклеиновых кислот в присутствии нормальных живых клеток. Коэн с соавт. описывают антивирусную активность антисмысловых PS-ОДН, специфичных к вирусной последовательности. Они также привели способ тестирования полиА, полиТ и полиС в PS-ОДН последовательностях, состоящих из 14, 18, 21 и 28 нуклеотидов и указали на наличие антивирусного эффекта у используемых PS-ОДН. Мацукура с соавт. (Matsukura et al., (1987), Proc. Natl. Acad. Sci. USA, 84: 7706-7710) позже опубликовали данные, соответствующие результатам, описанным в указанных выше патентах СШАHSV-2 под действием PS-ОДН при проведении тестирования полиА, полиТ и полиС последовательностей PS-ОДН с размерами, включающими 7, 15, 21 и 28 нуклеотидов. Аршамбо, Стайн и Коэн (Archambault et al., (1994), Arch. Virol., 139: 97109) показали, что полиС PSОДН из 28 нуклеотидов не эффективен против HSV-1. Стайн с соавт. (Stein et al., (1989), AIDS Res. Hum. Retrovir., 5: 639-646) опубликовали результаты,содержащие дополнительные данные об анти-ВИЧ активности ОДН, составляющих 21-28 нуклеотидов в длину. Маршалл с соавт. (Marshall et al., (1992), Proc. Natl. Acad. Sci. USA, 89: 6265-6269) описали антиВИЧ-1-эффект фосфоротиоатных и фосфоротиоатных полиС олигонуклеотидов, составляющих 4-28 нуклеотидов в длину. Стайн и Ченг (SteinCheng) (Stein et al., (1993), Science 261: 1004-1012) в обзорной статье описали антивирусную активность неспецифичных ОДН из 28 нуклеотидов, отмечая, что "анти-ВИЧ-свойства PS олигонуклеотидов в значительной мере испытывают воздействие эффектов, неспецифичных к последовательности, что представляет собой ингибирующий эффект, который не зависит от последовательности оснований". Лебедева и Стайн (LebedevaStein) (Lebedeva et al., (2001), Annul. Rev. Pharmacol., 41: 403-419) в обзорной статье опубликовали результаты исследования множества PS-ОДН с неспецифической связы-4 008940 вающей активностью в отношении белка, включая вирусные белки. Они заявляют, что "указанные молекулы являются биологически высокоактивными и часто относительно легко перепутать артифакт с антисмысловым соединением". Райн с соавт. (Rein et al., патент США 6316190) описали GT-обогащенный имитирующий ОН, присоединенный к компоненту слияния и связанный с нуклеокапсидом ВИЧ, который может использоваться в качестве антивирусного соединения. Аналогично, Кэмпбелл с соавт. (Campbell et al., (1999), J. Virol.,73: 2270-2279) описали РО-ОДН с мотивом TGTGT, который связывается специфично с нуклеокапсидом ВИЧ, но при этом они не упомянули об антивирусной активности. Фенг с соавт. (Feng et al., (2002), J. Virol., 76: 11757-11762) описали A(n) и TG(n) РО-ОДН, связывающиеся с рекомбинантным нуклеокапсидом ВИЧ, однако они также не привели данных или соответствующих ссылок относительно анти-ВИЧ-активности. Антисмысловые ОДН, разрабатываемые в качестве противораковых средств, антивирусных средств или для лечения других заболеваний, в типичном случае составляют примерно 20 нуклеотидов в длину. В обзорной статье Стайна (Stein, CA, (2001), J. Clin. Invest., 108: 641-644) подтверждается, что "длина антисмыслового олигонуклеотида должна быть оптимизирована: если антисмысловой олигонуклеотид слишком длинный или слишком короткий, то элемент специфичности теряется. В настоящее время считается, что оптимальной длиной для антисмыслового олигонуклеотида является примерно длина в 16-20 нуклеотидов". Аналогично, в другой обзорной статье (Crooke, ST (2000), Methods Enzymol., 313: 3-45) указывается, что "в сравнении с РНК и образованием дуплекса РНК фосфоротиоатные олигодезоксинуклеотиды имеют значение Тm примерно на -2,2 ниже в расчете на единицу. Это означает, что для эффективности in vitro фосфоротиоатные олигодезоксинуклеотиды должны составлять в типичном случае от 17 до 20 остатков в длину". Карутерс с соавт. (Caruthers) (Marshall et al., (1992), Proc. Natl. Acad. Sci. USA, 89 6265-6269) описали анти-ВИЧ-активность фосфородитиоатных ОДН (PS2-ОДН) для полицитидин-PS2-ОДН из 12 остатков и для PS2-ОДН из 14 остатков. Никакие другие размеры не тестировались на наличие анти-ВИЧактивности. Указанные авторы также сообщили об ингибировании обратной транскриптазы (ОТ) ВИЧ в случае использования полицитидин-РS2-ОДН из 12, 14, 20 и 28 остатков. Позже, Маршал с соавт. (Marshal et al., (1993), Science, 259: 1564-1570) опубликовали результаты, показывающие специфичное относительно последовательности ингибирование ОТ ВИЧ. Та же группа авторов опубликовала данные по исследованию PS2-ОДН у нескольких пациентов. В патентах США 5218103 и 5684148 описаны структура и синтез PS2-ОДН. В патенте США 5452496, 5278302 и 5695979 описано ингибирование ОТ ВИЧ для РS2-ОДН, который не крупнее, чем 15 оснований в длину. В патентах США 5750666 и 5602244 описана антисмысловая активность PS2-ОДН. Краткое описание сущности изобретения Настоящее изобретение относится к открытию того факта, что олигонуклеотиды (ОН), например олигодезоксинуклеотиды (ОДН), могут иметь антивирусную активность широкого спектра, не определяемую комплементарностью последовательностей. Таким образом, нет необходимости в том, чтобы олигонуклеотид был комплементарным к любой вирусной последовательности или характеризовался бы конкретным распределением нуклеотидов для того, чтобы проявлять антивирусную активность. Такой олигонуклеотид может быть даже получен в виде рандомера, так что будет представлено наименьшее количество копий каждой конкретной последовательности в препарате, например, в 15 микромолярном рандомерном препарате из 32 или более нуклеотидов в длину. Кроме того, авторы настоящего изобретения обнаружили, что олигонуклеотиды разной длины обладают разным антивирусным эффектом и, более того, длина антивирусного олигонуклеотида, в случае выявления максимального антивирусного эффекта, составляет от 40 до 120 нуклеотидов. В свете указанных данных относительно антивирусных свойств олигонуклеотидов настоящее изобретение относится к антивирусным средствам олигонуклеотидной природы, которые могут обладать активностью против множества разных вирусов и которые могут быть даже выбраны для применения в качестве антивирусных средств широкого спектра действия. Такие антивирусные средства в особенности полезны ввиду ограниченных вариантов возможного и доступного в настоящее время антивирусного лечения. В этой связи ОН, например ОДН, согласно изобретению могут использоваться в терапии и профилактике вирусных инфекций или при лечении или профилактике опухолей или рака, индуцированных вирусами, такими как онковирусы (например, ретровирусы, папилломовирусы, герпес-вирусы), а также при лечении или профилактике других заболеваний, этиология которых связана с вирусами. Такие виды лечения применимы ко многим типам пациентов и курсов лечения, включая в себя, например, профилактику или лечение вирусных инфекций у человека и животных с ослабленным иммунитетом. В первом аспекте настоящее изобретение относится к антивирусному олигонуклеотидному средству, которое включает в себя по меньшей мере один антивирусный олигонуклеотид, например, длиной по меньшей мере 6 нуклеотидов, адаптированный для применения в качестве антивирусного средства, где антивирусная активность олигонуклеотида осуществляется принципиально по механизму действия, не зависящему от комплементарности последовательностей. Такое средство может включать в себя смесь различных олигонуклеотидов, например, по меньшей мере 2, 3, 5, 10, 50, 100 или более.-5 008940 Термин "антивирусный" в контексте настоящего описания, применительно к олигонуклеотидам или другим материалам, относится к эффекту, определяемому наличием олигонуклеотидов или другого материала, ингибирования продукции вирусных частиц, т.е. снижения числа образованных инфекционных вирусных частиц в системе, пригодной для образования инфекционных вирусных частиц. Термин "антивирусное олигонуклеотидное средство" в контексте настоящего описания относится к препарату, который включает в себя по меньшей мере один антивирусный нуклеотид, адаптированный для применения в качестве антивирусного средства. Указанный препарат включает в себя один или несколько олигонуклеотидов и может содержать другие материалы, которые не мешают использованию антивирусного средства in vivo. Такие другие материалы могут включать в себя, без ограничения, разбавители, наполнители, материалы носителя и/или другие антивирусные материалы. Термин "фармацевтическая композиция" в контексте настоящего описания относится к антивирусному олигонуклеотидному средству, которое включает в себя физиологически или фармацевтически приемлемый носитель или наполнитель. Такие композиции могут также включать в себя другие компоненты, которые не придают композиции свойства, непригодные для введения субъекту, например человеку. В контексте настоящего описания, если особо не указаны определенные ограничения, термин "олигонуклеотид (ОН)" означает олигодезоксинуклеотид (ОДН) или олигодезоксирибонуклеотид или олигорибонуклеотид. Таким образом, термин "олигонуклеотид" относится к олигомеру или полимеру рибонуклеиновой кислоты (РНК) или дезоксирибонуклеиновой кислоты (ДНК) или к их миметикам. Указанный термин включает в себя олигонуклеотиды, состоящие из природных нуклеотидных оснований, сахаров и ковалентных внутринуклеозидных (скелетных) связей, а также олигонуклеотиды, включающие в себя неприродные части, которые функционируют аналогичным образом. Такие модифицированные или замещенные олигонуклеотиды являются зачастую более предпочтительными, чем нативные формы, поскольку обладают желательными свойствами, такими, например, как улучшенное поглощение клетками,повышенная аффинность к мишени нуклеиновой кислоте и повышенная стабильность в присутствии нуклеазы. Примеры модификаций, которые могут быть использованы, описаны ниже. Олигонуклеотиды,которые включают в себя внутрискелетные и/или другие модификации, могут также называться олигонуклеозидами. Фраза "адаптирован(а) для применения в качестве антивирусного средства" в контексте настоящего описания применительно к антивирусному препарату, фармацевтической композиции или другому материалу означает, что данный материал проявляет антивирусный эффект и не содержит какого-либо компонента или материала, который делает его непригодным для использования с целью ингибирования вирусной продукции в системе in vivo, например, для введения субъекту, такому как человек. Фраза "механизм действия, не связанный с комплементарностью последовательностей" в контексте настоящего описания применительно к антивирусному действию материала указывает, что механизм,посредством которого данный материал демонстрирует антивирусный эффект, не определяется гибридизацией комплементарных последовательностей нуклеиновой кислоты, например, за счет антисмыслового эффекта. И наоборот, фраза "механизм действия, определяемый комплементарностью последовательностей" означает, что антивирусный эффект материала включает гибридизацию комплементарных последовательностей нуклеиновой кислоты. Таким образом, указание на то, что антивирусная активность материала "не определяется в первую очередь механизмом действия, основанным на комплементарности последовательностей" означает, что активность олигонуклеотида удовлетворяет по меньшей мере одному из 4 тестов, приведенных в данном описании (см. пример 10), для определения, является ли данный механизм действия таким, который "преимущественно не связан с комплементарностью последовательностей". В конкретных вариантах осуществления настоящего изобретения рассматриваемый олигонуклеотид соответствует критерию теста 1, теста 2, теста 3 или теста 4; рассматриваемый олигонуклеотид соответствует критериям двух тестов, например тестов 1 и 2, тестов 1 и 3, тестов 1 и 4, тестов 2 и 3, тестов 2 и 4 или тестов 3 и 4; рассматриваемый олигонуклеотид соответствует критериям трех тестов, например тестов 1, 2 и 3, тестов 1, 2 и 4, тестов 1, 3 и 4 или тестов 2, 3 и 4; и рассматриваемый олигонуклеотид соответствует критериям всех тестов: 1, 2, 3 и 4. Термин "субъект" в контексте настоящего описания применительно к введению антивирусного материала относится к живому высшему организму, включая в себя, например, животных, таких как млекопитающие, например человек, приматы, отличные от человека, быки, свиньи, овцы, лошади, собаки и кошки; птицы; и растения, например фруктовые деревья. Родственный аспект относится к антивирусному препарату олигонуклеотидного рандомера, где антивирусная активность рандомера реализуется принципиально по механизму действия, не связанному с комплементарностью последовательностей. Такой препарат рандомера может, например, включать в себя смесь рандомеров разной длины, например, по меньшей мере 2, 3, 5, 10 или более вариантов разной длины. Термин "случайный" в контексте настоящего описания применительно к олигонуклеотидным последовательностям используется для характеристики последовательности или ОН, которые не комплементарны вирусной мРНК и которые выбирают таким образом, чтобы не образовались "шпильки" и что-6 008940 бы в них не содержалось палиндромных последовательностей. При использовании термина "случайный" в контексте антивирусной активности олигонуклеотида относительно конкретного вируса, данный термин означает отсутствие комплементарности к вирусной мРНК такого рассматриваемого вируса. Отсутствие комплементарности может пониматься шире, например, применительно к множеству вирусов, к вирусам из определенного семейства вирусов или к вирусам, вирулентным для человека. В рамках настоящего изобретения термин "рандомер" означает одноцепочечную ДНК, включающую в себя нуклеотид по принципу нестрогого соответствия (или по принципу "качелей") (N) в каждом положении, такую как NNNNNNNNNN. Каждое основание синтезируют в соответствии с указанным принципом "качелей", так что данный ОН существует фактически в виде популяции различных случайным образом созданных последовательностей одного и того же размера. В другом аспекте настоящее изобретение относится к олигонуклеотиду, обладающему антивирусной активностью против вируса-мишени, где указанный олигонуклеотид включает в себя по меньшей мере 29 нуклеотидов в длину (или в конкретных вариантах осуществления изобретения по меньшей мере 30, 32, 34, 36, 38, 40, 46, 50, 60, 70, 80, 90, 100, 110 или 120 нуклеотидов в длину) и последовательность олигонуклеотида не комплементарна никакой из частей геномной последовательности вируса-мишени. В другом аспекте настоящее изобретение относится к олигонуклеотидному средству, содержащему по меньшей мере один олигонуклеотид, обладающий антивирусной активностью против вируса-мишени,где указанный олигонуклеотид составляет по меньшей мере 6 нуклеотидов в длину (в конкретных вариантах осуществления изобретения по меньшей мере 29, 30, 32, 34, 36, 38, 40, 46, 50, 60, 70, 80, 90, 100,110 или 120 нуклеотидов в длину), и последовательность олигонуклеотида менее чем на 70% комплементарна любой из частей последовательности геномной нуклеиновой кислоты вируса-мишени и не состоит по существу из полиА, полиС, полиG, полиТ, G-квартета или TG-обогащенной последовательности. В конкретных вариантах осуществления изобретения олигонуклеотид характеризуется менее чем на 65, 60,55, 50, 80, 90, 95 или 100% комплементарностью к любой из частей последовательности геномной нуклеиновой кислоты вируса-мишени. Термин "TG-обогащенный" в контексте настоящего описания применительно к описываемым олигонуклеотидам указывает, что последовательность антивирусного олигонуклеотида состоит по меньшей мере на 70% из нуклеотидов Т и G или, в конкретных вариантах, содержит по меньшей мере 80, 90 или 95% Т и G или даже 100%. Родственный аспект относится к выбранным очищенным или обогащенным антивирусным нуклеотидам, приведенным в настоящем описании, например, таким, которые были описаны применительно к антивирусным олигонуклеотидным препаратам, а также относится к другим олигонуклеотидным препаратам, например препаратам, пригодным для использования in vitro. Антивирусные олигонуклеотиды, используемые в настоящем изобретении, могут быть разной длины, например, могут иметь 6, 10, 14, 15, 20, 25, 28, 29, 30, 35, 38, 40, 46, 50, 60, 70, 80, 90, 100, 110, 120,140, 160 или более нуклеотидов в длину. Аналогично, олигонуклеотид может характеризоваться некоторым диапазоном, например, диапазоном, определяемым двумя ранее указанными величинами как конечными точками диапазона, например 10-20, 20-40, 30-50, 40-60, 40-80, 60-120 и 80-120 нуклеотидов. В конкретных вариантах осуществления настоящего изобретения минимальная длина или длина диапазона сочетается с любыми другими характеристиками олигонуклеотидов, приведенными в настоящем описании для рассматриваемых антивирусных олигонуклеотидов. Антивирусный нуклеотид может включать в себя различные модификации, например, стабилизирующие модификации, и может, таким образом, включать в себя по меньшей мере одну модификацию фосфодиэфирной связи и/или на сахарном фрагменте, и/или на основании. Например, олигонуклеотид может включать в себя одну или более фосфоротиоатных связей, фосфородитиоатных связей и/или метилфосфонатных связей; модификаций в 2'-положении сахара, таких как 2'-О-метильные модификации,2'-аминомодификации, 2'-галогеновые модификации, такие как 2'-фтор; ациклические нуклеотидные аналоги и может также включать в себя по меньшей мере одну фосфодиэфирную связь. Другие модификации также известны в данной области и могут использоваться. В случае олигонуклеотидов, которые содержат 2'-О-метильные модификации, указанные олигонуклеотиды необязательно включают 2'-Ометильные модификации по всей длине, поскольку, в соответствии с имеющимися результатами, такие олигонуклеотиды не обладают подходящей активностью. В конкретных вариантах осуществления настоящего изобретения олигонуклеотид имеет модифицированные связи по всей длине, например фосфоротиоат; имеет 3'- и/или 5'-кэппирование; включает в себя терминальную 3'-5'-связь; а также олигонуклеотид представляет собой или включает в себя конкатемер, состоящий из двух или более олигонуклеотидных последовательностей, соединенных линкером(ами). В конкретных вариантах осуществления изобретения олигонуклеотид связывается с одним или более вирусными белками; последовательность олигонуклеотида (или его часть, например, по меньшей мере 1/2) получают из вирусного генома; активность олигонуклеотида вместе с последовательностью,полученной из вирусного генома, не превосходит по данной способности рандомерный олигонуклеотид или случайный олигонуклеотид той же длины; олигонуклеотид включает в себя часть, комплементарную вирусной последовательности, и часть, не комплементарную вирусной последовательности; последова-7 008940 тельность олигонуклеотида получают из последовательности вирусной упаковки или другой вирусной последовательности, участвующей в аптамерном взаимодействии; если особо не оговорено иное, последовательность олигонуклеотида включает в себя А(х), С(х), G(x), T(x), AC(x), AG(x), AT(х), CG(x), СТ(х) или GT(x), где х равен 2, 3, 4, 5, 6, 60120 (в конкретных вариантах осуществления изобретения олигонуклеотид включает в себя по меньшей мере 29, 30, 32, 34, 36, 38, 40, 46, 50, 60, 70, 80, 90, 100, 110 или 120 нуклеотидов в длину, или длина указанной повторной последовательности является по меньшей мере такой указанной длиной); олигонуклеотид является одноцепочечным (РНК или ДНК); олигонуклеотид является двухцепочечным (РНК или ДНК); олигонуклеотид включает в себя по меньшей мере один Gквартет или CpG-часть; олигонуклеотид включает в себя часть, комплементарную вирусной мРНК, и составляет по меньшей мере 29, 37 или 38 нуклеотидов в длину (или имеет другую длину, указанную выше); олигонуклеотид включает в себя по меньшей мере один олигонуклеотид, не соответствующий модели Уотсона-Крика, и/или по меньшей мере один нуклеотид, который участвует в связывании с другим нуклеотидом, не соответствующим модели Уотсона-Крика; олигонуклеотид является случайным олигонуклеотидом, олигонуклеотид является рандомером или включает в себя рандомерную часть, т.е. рандомерную часть, которая имеет длину, указанную выше в контексте длины олигонуклеотида; олигонуклеотид соединяют или конъюгируют по одному или более нуклеотидных остатков с молекулой, которая модифицирует свойства олигонуклеотида, например, для обеспечения лучшей стабильности (такой как стабильность в сыворотке или стабильность в конкретном растворе), для снижения уровня взаимодействия с сывороткой, для увеличения поглощения клетками, для усиления взаимодействия с вирусным белком, для улучшения свойств, способствующих созданию композиции для доставки, для получения обнаруживаемого сигнала, для улучшения фармакокинетических свойств, для достижения специфического распределения по тканям и/или для снижения токсичности. Олигонуклеотиды также могут использоваться в сочетании, например, в виде смеси. Такие сочетания или смеси могут включать в себя, например, по меньшей мере 2, 4, 10, 100, 1000, 10000, 100000,1000000 или более различных олигонуклеотидов. Такие сочетания или смеси могут включать в себя, например, разные последовательности, и/или последовательности разной длины, и/или разные модификации, и/или разные соединенные или конъюгированные молекулы. В конкретных вариантах таких сочетаний или смесей множество олигонуклеотидов имеет минимальную длину или характеризуется диапазоном длины, указанным выше для олигонуклеотидов. В конкретных вариантах таких сочетаний или смесей по меньшей мере один, множество или каждый из олигонуклеотидов могут обладать любым другим свойством из числа указанных в данном описании для индивидуальных антивирусных олигонуклеотидов (которые могут также находиться в любом согласованном сочетании). Фраза "получен(а) из вирусного генома" указывает на то, что конкретная последовательность имеет последовательность нуклеотидных оснований, которая по меньшей мере на 70% идентична нуклеотидной последовательности вирусного генома или его комплемента (например, является такой же или комплементарной данной геномной последовательностью вируса) или является последовательностью соответствующей РНК. В конкретных вариантах осуществления настоящего изобретения данный термин указывает на то, что последовательность по меньшей мере на 70% идентична вирусной геномной последовательности конкретного вируса, против которого направлено действие данного олигонуклеотида, или его комплементарной последовательности. В конкретных вариантах идентичность составляет по меньшей мере 80, 90, 95, 98, 99 или 100%. Настоящее изобретение также относится к антивирусной фармацевтической композиции, которая включает в себя терапевтически эффективное количество фармакологически приемлемого антивирусного олигонуклеотида, имеющего длину по меньшей мере 6 нуклеотидов (или другую длину, указанную выше), где антивирусная активность олигонуклеотида осуществляется принципиально по механизму действия, не связанному с комплементарностью последовательностей, и фармацевтически приемлемый носитель. В конкретных вариантах олигонуклеотид или сочетание или смесь олигонуклеотидов соответствуют тому, что было указано выше относительно индивидуальных олигонуклеотидов или сочетаний или смесей олигонуклеотидов. В конкретных вариантах фармацевтические композиции разрешены для введения человеку или животному, отличному от человека, такому как примат, отличный от человека. В конкретных вариантах осуществления настоящего изобретения фармацевтические композиции адаптированы для лечения, контроля или профилактики заболевания вирусной этиологии; адаптированы для лечения, контроля или профилактики заболевания приона; адаптированы для доставки путем внутриглазного введения, перорального приема, энтерального введения, ингаляции, кожной, подкожной, внутримышечной, внутрибрюшинной, внутриоболочечной, интратрахеальной или внутривенной инъекции или для местного введения. В конкретных вариантах композиция включает в себя систему доставки, например, направляется в специфические клетки или ткани; липосомную композицию, другое антивирусное средство, например, ненуклеотидный антивирусный полимер, антисмысловую молекулу, siPHK или малую молекулу лекарственного средства. В конкретных вариантах осуществления настоящего изобретения антивирусный олигонуклеотид,олигонуклеотидный препарат, олигонуклеотидное средство и антивирусная фармацевтическая компози-8 008940 ция имеют значение ИК 50 для вируса-мишени (например, любого конкретного вируса или вирусов из указанных в описании групп вирусов), составляющие 0,50, 0,20, 0,10, 0,09, 0,08, 0,07, 0,75, 0,06, 0,05,0,045, 0,04, 0,035, 0,03, 0,025, 0,02, 0,015 или 0,01 мкМ или менее. В конкретных вариантах, относящихся к средствам, фармацевтическим композициям, а также к способам профилактики и лечения, указанные композиция или средство адаптированы для лечения, контроля или профилактики заболевания вирусной этиологии; адаптированы для лечения, контроля или профилактики заболевания приона; адаптированы для доставки способом, выбранным из группы, состоящей из внутриглазного введения, перорального приема, энтерального введения, ингаляции или доставки путем кожной, подкожной, внутримышечной или внутривенной инъекции; а также содержат систему доставки, которая может содержать или может быть ассоциирована с молекулой, повышающей аффинность к специфическим клеткам; а также сочетают в себе по меньшей мере одно другое антивирусное средство; и/или дополнительно сочетают в себе антивирусный полимер. В контексте настоящего описания применительно к антивирусным олигонуклеотидам и композициям и аналогичным материалам в том, что касается конкретного вируса или группы вирусов, термин "мишень" указывает, что данный олигонуклеотид отбирается для ингибирования такого вируса или группы вирусов. В контексте конкретного типа ткани или клетки данный термин указывает, что олигонуклеотид,композиция или система доставки выбирается таким образом, что олигонуклеотид преимущественно присутствует и/или преимущественно демонстрирует антивирусный эффект вблизи от конкретной ткани или клеток определенного типа. В контексте настоящего описания термин "система доставки" относится к компоненту или компонентам, которые, в сочетании с описанным в данном изобретении олигонуклеотидом, повышают количество олигонуклеотида, который контактирует с целевым сайтом in vivo, и/или увеличивают длительность его присутствия в мишени, т.е., например, по меньшей мере на 20, 50 или 100% или даже более в сравнении с количеством и/или длительностью в отсутствие такой системы доставки, и/или препятствуют или снижают взаимодействия, которые вызывают побочные эффекты. В контексте настоящего описания применительно к антивирусным средствам и другим средствам или исследуемым соединениям термин "малая молекула" означает, что молекулярная масса молекулы составляет 1500 Да или менее. В некоторых случаях молекулярная масса составляет 1000, 800, 600, 500 или 400 Да или менее. В другом аспекте настоящее изобретение относится к набору, который содержит по меньшей мере один антивирусный олигонуклеотид или олигонуклеотидное средство в составе снабженной этикеткой упаковки, где антивирусная активность олигонуклеотида осуществляется по механизму действия, который принципиально не связан с комплементарностью последовательностей, и этикетка на упаковке указывает на то, что антивирусный олигонуклеотид может использоваться по меньшей мере против одного вируса. В конкретных вариантах набор содержит фармацевтическую композицию, которая включает в себя по меньшей мере один приведенный в описании антивирусный олигонуклеотид; антивирусный олигонуклеотид адаптирован для введения in vivo животному и/или этикетка указывает, что олигонуклеотид или композиция приемлемы и/или разрешены для введения животному; указанное животное является млекопитающим, таким как человек, или является млекопитающим, отличным от человека, таким как бык, свинья, представитель грызунов, овца или лошадь; указанное животное представляет собой животное, отличное от человека; набор разрешен официальным Агентством, таким как Управление США по контролю за пищевыми продуктами, лекарственными средствами и косметическими препаратами (Foodand Drug Administration), или аналогичным регламентирующим органом для введения животному, например, человеку. В другом аспекте настоящее изобретение относится к способу выбора антивирусного олигонуклеотида, например, антивирусного олигонуклеотида, действие которого не связано с комплементарностью последовательностей, для использования в качестве антивирусного средства. Данный способ подразумевает синтез множества различных случайных олигонуклеотидов, тестирование олигонуклеотидов на активность по ингибированию способности вируса продуцировать инфекционные вирионы и отбор олигонуклеотида, обладающего фармацевтически приемлемым уровнем активности, для использования его в качестве антивирусного средства. В конкретных вариантах осуществления настоящего изобретения различные случайные олигонуклеотиды включают в себя рандомеры разной длины; случайные олигонуклеотиды могут иметь разные последовательности или могут иметь общую для всех последовательность, такую как последовательность самых коротких олигонуклеотидов в множестве; и/или различные случайные олигонуклеотиды включают в себя множество олигонуклеотидов, содержащих рандомерный сегмент длиной по меньшей мере в 5 нуклеотидов, или различные случайные олигонуклеотиды содержат множество рандомеров разной длины. Другие олигонуклеотиды, например из числа приведенных в настоящем описании в качестве антивирусных олигонуклеотидов, могут тестироваться в определенной системе. В еще одном аспекте настоящее изобретение относится к способу профилактики или лечения вирусной инфекции у субъекта путем введения субъекту, при необходимости такого лечения, терапевтиче-9 008940 ски эффективного количества по меньшей мере одного фармацевтически приемлемого олигонуклеотида,приведенного в настоящем описании, например, олигонуклеотида, действующего независимо от комплементарности последовательностей, который содержит по меньшей мере 6 нуклеотидов в длину, или антивирусной фармацевтической композиции или средства, содержащих такой олигонуклеотид. В конкретных вариантах вирус может представлять собой любой из числа перечисленных в настоящем описании в качестве подходящего для ингибирования согласно настоящему изобретению; инфекция относится к заболеванию или состоянию, которое указано в данном описании как связанное с вирусной инфекцией; рассматриваемый субъект является субъектом того типа, который указан в настоящем описании, например, это может быть человек, животное, отличное от человека, млекопитающее, отличное от человека,растение и т.п.; лечение рассматривается применительно к вирусному заболеванию или заболеванию вирусной этиологии, например, представляет собой заболевание, приведенное в разделе, относящемся к предпосылкам создания изобретения. В конкретных вариантах настоящего изобретения вводят описанный антивирусный олигонуклеотид(или олигонуклеотидное средство или фармацевтическую композицию); введение представляет собой метод, приведенный в настоящем описании; используют систему доставки или способ, приведенный в настоящем описании; вирусная инфекция представляет собой инфекцию ДНК-содержащим вирусом или РНК-содержащим вирусом; вирус представляет собой вирус, относящийся к Parvoviridae, Papovaviridae,Adenoviridae, Herpesviridae, Poxviridae, Hepadnaviridae или Papillomaviridae; вирус, относящийся кArenaviridae, Bunyaviridae, Calciviridae, Coronaviridae, Filoviridae, Flaviridae, Orthomyxoviridae, Paramyxoviridae, Picornaviridae, Reoviridae, Rhabdoviridae, Retroviridae или Togaviridae; вирус из Herpesviridae представляет собой EBV, HSV-1, HSV-2, CMV, VZV, HHV-6, HHV-7 или HHV-8; указанный вирус представляет собой ВИЧ-1 или ВИЧ-2; указанный вирус представляет собой RSV; указанный вирус представляет собой вирус гриппа, например, вирус гриппа А; указанный вирус представляет собой HBV; указанный вирус представляет собой вирус ветряной оспы или вирус осповакцины; указанный вирус представляет собой коронавирус; указанный вирус представляет собой вирус, вызывающий SARS; указанный вирус представляет собой вирус лихорадки западного Нила; указанный вирус представляет собой хантавирус; указанный вирус представляет собой вирус парагриппа; указанный вирус представляет собой вирус Коксаки; указанный вирус представляет собой риновирус; указанный вирус представляет собой вирус желтой лихорадки; указанный вирус представляет собой вирус денге; указанный вирус представляет собой вирус гепатита С; указанный вирус представляет собой вирус Эбола; указанный вирус представляет собой вирус Марбург. Аналогично, в родственном аспекте настоящее изобретение относится к способу профилактического лечения рака, вызываемого онковирусами, у животного и человека путем введения указанному человеку или животному, при необходимости такого лечения, фармакологически приемлемого терапевтически эффективного количества по меньшей мере одного случайного олигонуклеотида, составляющего в длину по меньшей мере 6 нуклеотидов (или олигонуклеотида другой длины, указанной в настоящем описании), или средства, или фармацевтической композиции, содержащих такой олигонуклеотид. В конкретных вариантах осуществления настоящего изобретения приведенный(ые) в описании настоящего изобретения олигонуклеотид(ы), например, имеет(ют) длину, приведенную в описании; при этом используется способ введения, указанный в настоящем описании; а также используется система доставки, указанная в настоящем описании. Термин "терапевтически эффективное количество" относится к количеству, которого достаточно для того, чтобы вызвать терапевтически или профилактически значимое снижение продукции инфекционных вирусных частиц при введении типичному субъекту соответствующего типа. В аспектах, включающих введение антивирусного олигонуклеотида субъекту, в типичном случае олигонуклеотид, средство или композиция должны вводиться в терапевтически эффективном количестве. В другом аспекте факт обнаружения того, что взаимодействия, не основанные на комплементарности последовательностей, создают эффективную антивирусную активность, указывает на способ скрининга для идентификации соединения, которое меняет связывание олигонуклеотида с вирусным компонентом, таким как один или более вирусных белков (например, экстрагированных или очищенных из вирусной культуры или инфицированных хозяйских организмов, или получаемых рекомбинантными методами). Например, такой способ может включать в себя выявление того, снижает ли исследуемое соединение связывание олигонуклеотида с одним или более вирусными компонентами. В контексте настоящего описания термин "скрининг" относится к тестированию множества соединений с целью определения того, обладают ли они желательным свойством. Такое множество соединений может представлять собой, например, по меньшей мере 10, 100, 1000, 10000 или более исследуемых соединений. В конкретных вариантах осуществления настоящего изобретения может использоваться любое множество аналитических форматов и способов обнаружения для идентификации такого изменения в процессе связывания, например, путем контакта олигонуклеотида с вирусным(ыми) компонентом(ами) в присутствии или в отсутствие соединения(ий), подвергаемого(ых) скринингу (например, в ходе отдельных реакций), с последующим определением того, отличается ли связывание олигонуклеотида с вирус- 10008940 ным(ми) компонентом(ами) в присутствии соединения по сравнению с ситуацией, когда исследуемое соединение отсутствует. Наличие такой разницы является показателем того, что данное соединение изменяет характеристики связывания случайного олигонуклеотида с вирусным компонентом. Альтернативно, может быть использовано конкурентное замещение, при котором олигонуклеотид связывают с вирусным компонентом и определяют замещение добавленным исследуемым соединением,или, наоборот, исследуемое соединение связывают и определяют наличие замещения за счет добавленного олигонуклеотида. В конкретных вариантах осуществления настоящего изобретения олигонуклеотид относится к числу приведенных в настоящем описании вирусных олигонуклеотидов; где указанный олигонуклеотид содержит по меньшей мере 6, 8, 10, 15, 20, 25, 29, 30, 32, 34, 36, 38, 40, 46, 50, 60, 70, 80, 90, 100, 110 или 120 нуклеотидов в длину или имеет по меньшей мере другую длину, приведенную в настоящем описании применительно к антивирусным олигонуклеотидам, или описывается диапазоном, определяемым при указании двух предшествующих значений как конечных точек диапазона; исследуемое(ые) соединение(ия) представляет(ют) собой малую(ые) молекулу(ы); исследуемое соединение имеет молекулярную массу менее чем 400, 500, 600, 800, 1000, 1500, 2000, 2500 или 3000 Да, или данная величина укладывается в диапазон, определяемый путем указания двух предшествующих значений как конечных точек диапазона; вирусный экстракт или компонент получают из вируса, указанного в настоящем описании; скринингу подвергают по меньшей мере 100, 1000, 10000, 20000, 50000 или 100000 соединений; олигонуклеотид характеризуется значением ИК 50, которое равно или менее чем 0,500, 0,200, 0,100, 0,075, 0,05, 0,045,0,04, 0,035, 0,03, 0,025, 0,02, 0,015 или 0,01 мкМ. В контексте настоящего описания термин "вирусный компонент" относится к продукту, кодируемому вирусом или продуцируемому инфицированными хозяйскими клетками в результате вирусной инфекции. Такие компоненты могут включать в себя белки, а также другие биомолекулы. Такие вирусные компоненты могут быть, например, получены из вирусных культур, инфицированных хозяйских организмов, например из животных и растений, или могут быть получены из вирусных последовательностей в рекомбинантных системах (прокариотических или эукариотических), а также из синтетических белков,имеющих аминокислотные последовательности, соответствующие белкам, кодируемым вирусом. Термин"экстракт вирусной культуры" относится к экстракту клеток, инфицированных вирусом, который включает в себя вирус-специфические продукты. Аналогично, термин "вирусный белок" относится к вирусспецифическому белку, который обычно кодируется вирусом, но может также кодироваться, по меньшей мере частично, последовательностями хозяйского организма, возникающими вследствие вирусной инфекции. В родственном аспекте настоящее изобретение относится к антивирусному соединению, идентифицируемому указанным выше способом, например, к новому антивирусному соединению. В другом аспекте настоящее изобретение относится к способу очистки олигонуклеотидов, связанных по меньшей мере с одним вирусным компонентом из пула олигонуклеотидов, посредством приведения в контакт пула по меньшей мере с одним вирусным компонентом, например, при связывании со средой стационарной фазы с последующим отбором олигонуклеотидов, которые связались с вирусным(ыми) компонентом(ами). В основном метод сбора включает в себя замещение олигонуклеотида из вирусного(ых) компонента(ов). Метод может также включать в себя секвенирование и/или тестирование антивирусной активности собранных олигонуклеотидов (например, олигонуклеотидов, которые связались с вирусным белком). В конкретных вариантах осуществления настоящего изобретения связанные олигонуклеотиды пула замещают из среды стационарной фазы соответствующим способом, например, с использованием ионного заместителя, и замещенные олигонуклеотиды собирают. В том, что касается различных способов замещения, в типичном случае указанное замещение может осуществляться с использованием методики,основанной на повышении жесткости условий (например, при увеличении концентрации замещающего средства, такой как солевая концентрация, так что в данном случае имеет место ступенчатый или непрерывный градиент), таким образом, что нуклеотиды замещаются в основном в порядке повышения их аффинности связывания. Во многих случаях может применяться методика, основанная на снижении жесткости условий для удаления слабо связанных нуклеотидов, и может быть собрана одна или более фракций, содержащих замещенные более прочно связанные олигонуклеотиды. В некоторых случаях бывает желательно выбрать фракции, которые содержат очень прочно связанные олигонуклеотиды (например,олигонуклеотиды во фракциях, полученных при замещении в условиях более высокой жесткости замещения), для дальнейшего использования. Аналогично, настоящее изобретение относится к способу обогащения олигонуклеотидов из пула олигонуклеотидов, связанных по меньшей мере с одним вирусным компонентом, путем приведения в контакт пула с одним или более вирусными белками и амплификации олигонуклеотидов, связанных с вирусными белками, с получением пула обогащенных олигонуклеотидов. Контакт и амплификация могут быть проведены при многократном повторении, например, по меньшей мере 1, 2, 3, 4, 5, 10 или более дополнительных раз с использованием обогащенного олигонуклеотидного пула из предшествующего цикла в качестве пула олигонуклеотидов для следующего цикла. Указанный способ может также вклю- 11008940 чать в себя секвенирование и тестирование антивирусной активности олигонуклеотидов в пуле обогащенных олигонуклеотидов после проведения одного или более циклов контакта и амплификации. Данный способ может включать в себя замещение олигонуклеотидов из вирусного компонента (например, вирусного белка, связанного с твердофазной средой) с использованием любой методики из множества имеющихся, таких как описанные выше методики, например, с использованием замещающего агента. Как указывалось выше, для дальнейшего использования, например, в других циклах связывания и амплификации может быть удобно выбрать более прочно связанные олигонуклеотиды. Данный способ может также включать в себя отбор одного или более обогащенных олигонуклеотидов, например олигонуклеотидов с высокой аффинностью, для дальнейшего использования. В конкретных вариантах осуществления настоящего изобретения отбор может включать в себя удаление олигонуклеотидов, которые имеют последовательности, комплементарные последовательностям хозяйского генома (например, человека) в данном представляющем интерес вирусе. Такое удаление может включать в себя сравнение данной(ых) олигонуклеотидной(ых) последовательности(ей) с последовательностями из конкретного организма-хозяина в базе(ах) данных последовательностей, например, с использованием программы сравнения последовательностей (например, программы поиска BLAST), и удаление тех олигонуклеотидов, которые имеют последовательности, идентичные хозяйской последовательности или имеющие определенную степень идентичности с нею. Удаление таких последовательностей, комплементарных хозяйской последовательности, и/или отбор одного или более олигонуклеотидов, которые не являются комплементарным хозяйским последовательностям, может быть осуществлено в соответствии с другими аспектами настоящего изобретения. В указанных выше способах идентификации, очистки или обогащения олигонуклеотидов данные олигонуклеотиды могут относиться к любому указанному выше типу. Приведенные выше методы удобны для идентификации, очистки или обогащения высокоаффинных олигонуклеотидов, например, из препарата олигонуклеотидного рандомера. В родственном аспекте настоящее изобретение относится к антивирусному олигонуклеотидному препарату, который включает в себя один или более олигонуклеотидов, идентифицированных с использованием способа по любому из указанных выше способов идентификации, получения или очистки антивирусных олигонуклеотидов из исходного пула олигонуклеотида, где указанные олигонуклеотиды в олигонуклеотидном препарате проявляют повышенный средний уровень аффинности связывания с одним или более вирусных белков по сравнению со средним значением аффинности связывания олигонуклеотидов в исходном пуле олигонуклеотидов. В конкретных вариантах осуществления настоящего изобретения среднее значение аффинности связывания олигонуклеотидов представляет собой величину,которая по меньшей мере в 2 раза, в 3 раза, в 5 раз, в 10 раз, в 20 раз, в 50 раз или в 100 раз выше, чем среднее значение аффинности связывания олигонуклеотидов в исходном пуле олигонуклеотидов, или даже более; медианное значение аффинности связывания по меньшей мере в 2 раза, в 3 раза, в 5 раз, в 10 раз, в 20 раз, в 50 раз или в 100 раз выше медианного значения аффинности связывания олигонуклеотидов из исходного пула, где термин "медианное значение" относится к промежуточному срединному значению. В еще одном аспекте настоящее изобретение относится к антивирусной полимерной смеси, которая включает в себя по меньшей мере один антивирусный олигонуклеотид и по меньшей мере один антивирусный полимер ненуклеотидной природы. В конкретных вариантах осуществления настоящего изобретения понятие "олигонуклеотид" соответствует описанию, приведенному в настоящем изобретении для антивирусных олигонуклеотидов, и/или понятие "антивирусный полимер" соответствует приведенному в данном изобретении описанию или принятым в данной области понятиям или будет далее определен. В еще одном аспекте настоящее изобретение относится к олигонуклеотидному рандомеру, где указанный рандомер составляет в длину по меньшей мере 6 нуклеотидов. В конкретных вариантах рандомер имеет длину, указанную выше для антивирусных олигонуклеотидов; при этом рандомер содержит по меньшей мере одну фосфоротиоатную связь, рандомер содержит по меньшей мере одну фосфородитиоатную связь или другую модификацию из числа приведенных в настоящем описании; рандомерные олигонуклеотиды содержат по меньшей мере один нерандомерный сегмент (такой как сегмент, комплементарный к последовательности нуклеиновой кислоты выбранного вируса), который имеет длину, указанную выше для олигонуклеотидов; рандомер входит в состав препарата или пула препаратов, содержащих по меньшей мере 5, 10, 15, 20, 50, 100, 200, 500 или 700 мкмоль, 1, 5, 7, 10, 20, 50, 100, 200, 500 или 700 мкмоль, или 1 моль рандомера, или описывается диапазоном, определяемым указанием любых двух разных значений из указанных выше в качестве конечных точек интервала, или его синтезируют в соответствии с одним из перечисленных выше показателей или интервала показателей. Аналогично, настоящее изобретение относится к способу получения антивирусных рандомеров путем синтеза по меньшей мере одного рандомера, например рандомера, указанного выше. Как указывалось выше, для любого аспекта, относящегося к вирусной инфекции или риску развития вирусной инфекции или нацеливанию на конкретный вирус, рассматриваемый в конкретных вариантах осуществления настоящего изобретения, вирус соответствует описанному выше вирусу. Выражение "вирусы человека и животного" в контексте настоящего описания включает в себя, безArenaviridae, Bunyaviridae, Calciviridae, Coronaviridae, Filoviridae, Flaviridae, Orthomyxoviridae, Paramyxoviridae, Picornaviridae, Reoviridae, Rhabdoviridae, Retroviridae или Togaviridae. В том, что касается модифицированных характеристик олигонуклеотидов, введенных путем связывания или конъюгирования с другими молекулами или фрагментами, то такие модификации параметров подвергают оценке в сравнении с тем же олигонуклеотидом, но без присоединения или конъюгирования молекулы или фрагмента. Дополнительные варианты могут быть очевидны из приведенного ниже подробного описания и из прилагаемой формулы изобретения. Краткое описание чертежей Фиг. 1. Тест на снижение бляшкообразования проводят в клетках VERO с использованием HSV-1(штамм KOS). Инфицированные клетки обрабатывают возрастающими концентрациями REP 1001 (а),REP 2001 (b) или REP 3007 (с). Для каждого графика приведены значения ИК 50 (IC50), вычисленные на основании уравнения линейной регрессии. Фиг. 2. Связь между размером PS-ОДН и значением ИК 50 против HSV-1. Значения ИК 50, полученные из фиг. 1, наносят на график против конкретного размера каждого исследуемого PS-ОДН, приведенного на фиг. 1. Фиг. 3. Тест на снижение бляшкообразования проводят в клетках VERO с использованием HSV-1(штамм KOS). Инфицированные клетки обрабатывают возрастающими концентрациями REP 2001 (а),REP 2002 (b) или REP 3003 (с), REP 2004 (d), REP 2005 (е), REP 2006 (f) и ацикловира (g). Для каждого графика приведены значения ИК 50, вычисленные на основании уравнения линейной регрессии. Фиг. 4. Связь между размером PS-ОДН и значением ИК 50 против HSV-1. Значения ИК 50, взятые из фиг. 3, наносят на график против конкретного размера каждого исследуемого PS-ОДН из фиг. 3, который проявляет анти-НSV-1-активность. Показано значение ИК 50 для ацикловира в качестве клинического варианта сравнения. Фиг. 5. Тест на снижение бляшкообразования проводят в клетках VERO с использованием HSV-1(штамм KOS). Исследуют широкий спектр размеров рандомеров PS-ОДН в возрастающих концентрациях; REP 2003 (a), REP 2009 (b), REP 2010 (с), REP 2011 (d), REP 2012 (е), REP 2004 (f), REP 2006 (g), REP 2007 (h) и REP 2008 (i). Для каждого графика приведены значения ИК 50, вычисленные на основании уравнения линейной регрессии. Фиг. 6. Снимок в УФ рандомеров PS-ОДН, исследованных и показанных на фиг. 5, после разделения электрофорезом в акриламидном геле. Фиг. 7. Связь между размером рандомера PS-ОДН и значением ИК 50 против HSV-1. Значения ИК 50,полученные из фиг. 9, наносят на график против конкретного размера каждого исследуемого PS-ОДН из фиг. 5, который проявляет aнти-HSV-1-активность. Фиг. 8. Тест на снижение бляшкообразования проводят в клетках VERO с использованием HSV-1(штамм KOS). Исследуют в возрастающих концентрациях немодифицированные ОДН, PS-ОДН со случайной последовательностью и PS-ОДН, нацеленные на стартовый кодон HSV-1 IE 110. REP 2013 (a),REP 2014 (b), REP 2015 (с), REP 2016 (d), REP 2017 (e), REP 2018 (f), REP 2019 (g), REP 2020 (h) и REP 2021 (i). Для каждого графика приведены значения ИК 50, вычисленные на основании уравнения линейной регрессии. Фиг. 9. Снимок в УФ рандомеров PS-ОДН, исследованных и приведенных на фиг. 8, после разделения электрофорезом в акриламидном геле. Фиг. 10. Связь между рандомером PS-ОДН, PS-ОДН со случайной последовательностью, PS-ОДНпоследовательностью из HSV-1 IE 110 и значением ИК 50 против HSV-1. Значения ИК 50, взятые из фиг. 8,наносят на график против конкретного размера каждого исследуемого PS-ОДН из фиг. 8, который проявляет анти-HSV-1-активность. Дополнительные значения ИК 50 из фиг. 5 включены для целей сравнения с рандомерами PS-ОДН. Фиг. 11. Тест на снижение бляшкообразования проводят в клетках VERO с использованием HSV-1(штамм KOS). Исследуют в возрастающих концентрациях PS-ОДН, имеющий 2-О-метильные модификации в 4 рибозах на каждом конце олигонуклеотида (REP 2024, [а]); ОДН, содержащий метилфосфонатные модификации по 4 сложноэфирным связям на каждом конце олигонуклеотида (REP 2026 [b]); и PSОДН РНК из 20 оснований (REP 2059 [с]) и 30 оснований (REP 2060 [d]) в длину. Для каждого графика приведены значения ИК 50, вычисленные на основании уравнения линейной регрессии. Фиг. 12. Тест на снижение бляшкообразования проводят в клетках фибробластов человека с использованием HSV-2 (штамм MS2). Инфицированные клетки обрабатывают возрастающими концентрациями REP 1001 (a), REP 2001 (b) и REP 3007 (с). Для каждого графика приводят значения ИК 50, вычисленные на основании уравнения линейной регрессии. Фиг. 13. Связь между размером PS-ОДН и значением ИК 50 против HSV-2. Значение ИК 50, взятое из фиг. 12, наносят на график против конкретного размера каждого исследованного PS-ОДН, приведенного- 13008940 на фиг. 12. Фиг. 14. Тест на снижение бляшкообразования проводят в клетках VERO с использованием HSV-2(штамм MS2). Инфицированные клетки обрабатывают возрастающими концентрациями REP 2001 (а),REP 2002 (b), REP 2003 (с), REP 2004 (d), REP 2005 (е), REP 2006 (f) и ацикловиром (g). Для каждого графика приводят значение ИК 50, вычисленное на основании уравнения линейной регрессии. Фиг. 15. Связь между размером PS-ОДН и значением ИК 50 против HSV-2. Значение ИК 50 из фиг. 14 наносят на график против конкретного размера каждого исследованного PS-ОДН, приведенного на фиг. 14, который проявляет aнти-HSV-2-активность. Для сравнения приводят значение ИК 50 ацикловира, взятого в качестве клинически значимого стандарта. Фиг. 16. Тест на снижение бляшкообразования проводят в клетках VERO с использованием CMV(штамм AD169). Инфицированные клетки обрабатывают возрастающими концентрациями REP 2004 (а) или REP 2006 (b). Для каждого графика приводят значение ИК 50, вычисленное на основании уравнения линейной регрессии. Связь между размером PS-ОДН и значением ИК 50 против CMV наносят на график(с). Значение ИК 50 из фиг. (а) и (b) наносят на график против конкретного размера каждого исследуемогоPS-ОДН. Фиг. 17. Тест на снижение бляшкообразования проводят в клетках VERO с использованием CMV(штамм AD169). Исследуют препараты, используемые в трех стратегиях лечения CMV: ганцикловир (а),фоскарнет (b) и цидофовир (с). Исследуют также широкий диапазон размеров рандомеров PS-ОДН в возрастающих концентрациях: REP 2003 (d), REP 2004 (е), REP 2006 (f) и REP 2007 (g). И наконец, REP 2036 (витравен) (Vitravene) тестируют в варианте собственного синтеза (h) и в коммерчески доступном варианте (i). Для каждого графика приводят значения ИК 50, вычисленные на основании уравнения линейной регрессии. Фиг. 18. Связь между размером PS-ОДН и значением ИК 50 против CMV. Значение ИК 50 из фиг. 17 наносят на график против конкретного размера каждого исследованного PS-ОДН, приведенного на фиг. 17, который проявляет анти-СМV-активность. Фиг. 19. Тест на ЦПЭ (СРЕ) проводят в клетках МТ 4 с использованием ВИЧ-1 (штамм NL4-3). Инфицированные клетки обрабатывают возрастающими концентрациями REP 2004 (а) или REP 2006 (b). Для каждого графика приводят значения ИК 50, вычисленные на основании уравнения линейной регрессии. Профили цитотоксичности в неинфицированных клетках МТ 4 представлены для REP 2004 (с) и REP 2006 (d). Фиг. 20. Связь между размером PS-ОДН и значением ИК 50 против ВИЧ-1. Значения ИК 50 из фиг. 1 наносят на график против конкретного размера каждого исследованного PS-ОДН, приведенного на фиг. 1. Фиг. 21. Тест на репликацию, проведенный в клетках 293 А с использованием рекомбинантного варианта дикого типа ВИЧ-1 NL4-3 (штамм CNDO). Инфицированные клетки обрабатывают возрастающими концентрациями ампренавира (а), индинавира (b), лопинавира (с), саквинавира (d), REP 2003 (е),REP 2004 (f), REP 2006 (g) и REP 2007 (h). Обе кривые (проведенные черной и пунктирной линией) отражают реакцию штамма CNDO на дозу препарата. Фиг. 22. (а) Значения ИК 50, взятые из фиг. 21, и (b) связь между размером PS-ОДН и значением ИК 50 против рекомбинантного ВИЧ-1. Значения ИК 50 из (а) наносят на график против конкретного размера каждого исследованного PS-ОДН, взятого из фиг. 21. Фиг. 23. Тест на репликацию, проведенный в клетках 293 А с использованием рекомбинантного штамма ВИЧ-1 с множественной резистентностью к лекарственному препарату (штамм MDRC4). Инфицированные клетки обрабатывают возрастающими концентрациями ампренавира (а), индинавира (b),лопинавира (с), саквинавира (d), REP 2003 (е), REP 2004 (f), REP 2006 (g) и REP 2007 (h). Кривые, отражающие реакцию варианта CNDO (дикого типа) на дозу, показаны пунктирными линиями, а для MDRC4(с лекарственной резистентностью) показаны жирными линиями. Фиг. 24. (а) Значения ИК 50 из фиг. 21 и 23, демонстрирующие кратность возрастания значений ИК 50 между штаммом дикого типа (CNDO) и штаммом с лекарственной резистентностью (MDRC4) рекомбинантного ВИЧ-1, и (b) график, демонстрирующий кратное увеличение значений, вычисленных на основе (а). Фиг. 25. Тест на ЦПЭ проводят в клетках Нер 2 с использованием RSV (штамм А 2). Инфицированные клетки обрабатывают возрастающими концентрациями REP 2004 (а), REP 2006 (b), REP 2007 (с) или рибавирина (d). Для каждого графика приводят значения ИК 50, вычисленные на основании уравнения линейной регрессии. Профили цитотоксичности в неинфицированных клетках Нер 2 показаны для REP 2004 (е), REP 2006 (f), REP 2007 (g) или рибавирина (h). Фиг. 26. Связь между размером PS-ОДН и значением ИК 50 против RSV. Значения ИК 50 из фиг. 25 наносят на график против конкретного размера каждого исследованного PS-ОДН, приведенного на фиг. 25, который проявляет анти-RSV-активность. Фиг. 27. Тест на ЦПЭ проводят в клетках LLC-MK2 с использованием вируса Коксаки В 2 (штаммOhio-1). Инфицированные клетки обрабатывают возрастающими концентрациями REP 2006 (а). Показан профиль цитотоксичности для REP 2006 в (b).PS-ОДН (REP 2003, 2004, 2006 и 2007) конкурировать за взаимодействие с затравочным рандомером PSОДН в 20 оснований из ФСТ. Показано, что более крупные рандомеры конкурируют более эффективно. В) и С) Защита в сыворотке и улучшенная доставка REP 2006 в клетки 293 А в присутствии DOTAP и цитофектина. D) и Е) Защита в сыворотке REP 2006, инкапсулированного с использованием DOTAP или цитофектина при измерении по методу ФП. Фиг. 29. Определение способности вирусного лизата связываться с затравками различного размера по методу флуоресцентной поляризации. REP 2032-FL, REP 2003-FL и REP 2004-FL используют для исследования способности лизата к связыванию с использованием лизатов, полученных из HSV-1 (а), ВИЧ 1 (b) или RSV (с). Фиг. 30. Определение сродства рандомеров PS-ОДН к вирусным лизатам по методу флуоресцентной поляризации. С использованием REP 2004-FL в качестве затравки провоцируют образование комплекса с лизатом HSV-1 (а), с лизатом ВИЧ-1 (b) или с лизатом RSV (с) повышающимися концентрациями REP 2003, REP 2004, REP 2006 или REP 2007. Фиг. 31. REP 2004-FL может связываться с ВИЧ-1 p24gag и ВИЧ-1 gp41. Способность REP 2004-FL взаимодействовать с повышающимися количествами указанных двух очищенных белков исследуют по методу флуоресцентной поляризации. Фиг. 32. Влияние размера затравки на связывание с р 24 и gp41. Затравки возрастающего размера исследуют на их способность связываться с p24gag и gp41 по методу флуоресцентной поляризации. Фиг. 33. Способность двухцепочечных PS-ОДН связываться с вирусными лизатами исследуют методом флуоресцентной поляризации. Получают как одноцепочечный (ss) или двухцепочечный (ds) фосфоротиоатированный REP 2017 (меченный флуоресцентной меткой), так и его нетиоатированный аналог(2017U). Указанные затравки тестируют на их способность связываться с вирусными лизатами HSV-1 и ВИЧ-1. Фиг. 34. Доставку PS-ОДН с флуоресцентным хвостом в клетки измеряют путем инкубации клеток 293 А в присутствии 250 нМ REP 2004-FL в течение 4 ч. После инкубации клетки лизируют и с помощью флуорометрии определяют относительную флуоресценцию, высвобождаемую из клеток в результате лизиса. Фиг. 35. Способность PS-ОДН с последовательностью из 20 остатков разного состава связываться с вирусными лизатами измеряют методом флуоресцентной поляризации. PS-ОДН метят на 3'-конце с использованием FITC и инкубируют в присутствии 1 мкг лизатов HSV-1 (а), ВИЧ-1 (b) или RSV (с). Профили связывания указанных PS-ОДН аналогичны для всех трех вирусных лизатов (см. фиг. 35). Фиг. 36. Опосредованное определение вирусной нагрузки в инфицированных супернатантах из культуры клеток VERO, инфицированных вирусом осповакцины, путем измерения ЦПЭ, индуцированного указанными супернатантами в клетках, не подвергавшихся ранее обработке. REP 2004, 2006 и 2007 тестируют в концентрации 10 мкМ, тогда как цидофовир тестируют в концентрации 50 мкМ. Фиг. 37. (А) Значения ИК 50, полученные в тесте на снижение бляшкообразования, проведенном на клетках VERO с использованием HSV-1 (штамм KOS). Инфицированные клетки обрабатывают возрастающими концентрациями REP 2006 (N40), REP 2028 (G40), REP 2029 (А 40), REP 2030 (Т 40) и REP 2031(С 40) для вычисления значений ИК 50 (В). В тесте на снижение уровня бляшкообразования с использованием HSV-1 получены следующие значения ИК 50: N40 (REP 2006), АС 20 (REP 2055), ТС 20 (REP 2056) или AG20 (REP 2057). Выбранные сокращения ОН (ON): олигонуклеотид ОДН (ODN): олигодезоксинуклеотид ФС (PS): фосфоротиоат ТСБ (PRA): тест на снижение бляшкообразования БОЕ (PFU): бляшкообразующая единицаINF А: вирус гриппа А ВИЧ (HIV): вирус иммунодефицита человека (включает ВИЧ-1 и ВИЧ-2, если особо не оговорено иное)HSV: вирус простого герпеса Herpes simplex (включает HSV-2 и HSV-3, если особо не оговорено иное)DHBV: утиный вирус гепатита В Подробное описание предпочтительного варианта осуществления изобретения Настоящее изобретение относится к идентификации и использованию антивирусных олигонуклеотидов, которые действуют по механизму, не связанному с комплементарностью последовательностей, и связано с открытием того факта, что в случае многих вирусов антивирусная активность выше у более крупных олигонуклеотидов и в типичном случае является оптимальной у олигонуклеотидов, содержащих 40 нуклеотидов или более в длину.- 15008940 Как указано в предпосылках создания изобретения, было проведено тестирование множества антисмысловых олигонуклеотидов (ОН) на их антивирусную активность. Однако такие антисмысловые ОН обладают специфичностью, связанной с последовательностью, и в типичном случае содержат примерно 16-20 нуклеотидов в длину. Как показано в результатах примеров 1 и 2, антивирусный эффект случайных PS-ОДН не имеет специфичности, связанной с последовательностью. Что касается объемов и концентраций использованных в данных тестах PS-ОДН, то теоретически почти невозможно, чтобы конкретная случайная последовательность присутствовала в количестве более одной копии в смеси. Данный факт означает, что не может быть антисмыслового эффекта в таких PS-ОДН рандомерах. В последнем примере, если считать, что антивирусный эффект вызывается PS-ОДН по механизму, имеющему специфичность, связанную с последовательностью, то такой эффект должен вызываться только одной молекулой - результат, который нельзя рассматривать как реальный. Например, в случае рандомера ОН с длиной 40 оснований любая конкретная последовательность в популяции будет теоретически представлять только 40 или 8,2710-25 часть от общей фракции. Исходя из того, что 1 моль=6,0221023 молекул и имея в виду тот факт, что самый крупный масштаб синтеза был осуществлен авторами в размере 15 мкмолей, все возможные последовательности также не будут присутствовать, и, кроме того, каждая последовательность присутствует,скорее всего, в виде только одной копии. Разумеется, любой специалист в данной области, применяя описание настоящего изобретения, может также использовать последовательность специфичных ОН, но на основе активности, механизм которой не связан с комплементарностью последовательностей, который раскрыт в настоящем изобретении. Соответственно, настоящее изобретение не ограничивается ОН,действующими независимо от комплементарности последовательностей, но отрицает устоявшиеся в данной области представления относительно применения антисмысловых ОН, имеющих специфичность,связанную с последовательностью, для лечения вирусных инфекций. Для практически применимых вирусов (включая, например, те, для которых в описании представлены данные) по мере повышения размера рандомера повышается их антивирусный эффект. Следует отметить, что в связи с ограничениями, которые свойственны фосфорамидитному методу синтеза ДНК,применяемому в настоящее время, более крупные PS-ОДН (например, из 80 и 120 нуклеотидов) имеют значительные примеси фрагментов с длиной, меньшей желательного размера. Более слабый эффект (в расчете на основание), отмечаемый в случае более крупных олигонуклеотидов (80 и 120 пн.) может отражать меньшую концентрацию рандомеров полной длины в указанных популяциях, а также может отражать их сниженное поступление в клетки. Можно достичь более выраженного повышения антивирусной активности, если более крупные рандомеры (40 оснований) реально достижимой чистоты (75% полной длины) синтезировать или очищать и/или если облегчать поступление в клетки любого из указанных ОДН с помощью соответствующей системы доставки. В настоящем изобретении рандомеры (или другие олигонуклеотиды) могут блокировать вирусную репликацию по нескольким механизмам, которые включают в себя, без ограничения, следующие: 1 предотвращение адсорбции или взаимодействия с рецептором вирионов, препятствуя таким образом инфекции; 2 - подавление вирусной сборки или упаковки вирусных геномов в капсиды (конкуренция с вирусной ДНК или РНК в процессе упаковки), что приводит к получению дефектных вирионов; 3 - разрушение и предотвращение образования капсидов в ходе упаковки или взаимодействия капсидных белков с другими структурными белками, что приводит к высвобождению вирусов или вызывает высвобождение дефектных вирионов; 4 - связывание с ключевыми вирусными компонентами и предотвращение или снижение их активности; 5 - связывание с ключевыми компонентами хозяйской клетки, необходимыми для вирусной пролиферации. Не ограничиваясь механизмом, посредством которого достигается ингибирование вируса согласно изобретению, описанное выше, следует указать на несколько возможных механизмов, которые позволяют объяснить и/или прогнозировать ингибирующие способности ОН в отношении вирусной репликации. Первая из них заключается в том, что общий аптамерный эффект ОН, приводящий к присоединению,либо к белку на поверхности клетки, либо к вирусным белкам, препятствует адсорбции вируса и последующему слиянию. Пороговое значение размера для данного эффекта может быть результатом определенного кумулятивного заряда, необходимого для взаимодействия. Второй возможный механизм заключается в том, что ОН могут функционировать внутри клетки за счет создания препятствий в процессе упаковки и/или сборки вируса. ОН свыше определенного порога размера могут конкурировать или препятствовать нормальному взаимодействию капсид/нуклеиновая кислота, препятствуя упаковке функционального вирусного генома внутри новых вирусов. Альтернативно, ОН могут препятствовать образованию нормального капсида, что, в свою очередь, будет препятствовать нормальному бадингу вирусов, менять вирусную стабильность или препятствовать соответствующей разупаковке вириона при интернализации. Несмотря на то что механизм действия еще полностью не ясен, результаты тестирования показывают, что ОН согласно изобретению могут демонстрировать более высокую эффективность по ингибированию вируса в сравнении с такими клиническими коррелятами, как ацикловир, ганцикловир, рибави- 16008940 рин и ингибиторы протеазы. Таким образом, ОН в соответствии с настоящим изобретением могут использоваться для лечения или профилактики вирусной инфекции. Вирусные инфекции, подвергаемые такому лечению, могут включать в себя инфекции, вызванные вирусами человека, животного или растения. Широкий спектр антивирусной активности В соответствии с обсуждавшимися выше выводами и приведенными в описании материалами следует полагать, что случайные ОН и рандомеры ОН могут обладать широким спектром антивирусной активности в отношении тех вирусов, у которых процесс сборки, и/или упаковки, и/или инкапсидации вирусного генома является необходимой стадией в репликации. В этой связи, для проверки данной гипотезы были исследованы несколько рандомеров PS-ОДН разного размера после их отбора с использованием клеточных моделей различных вирусных инфекций. Множество таких тестов приведено в настоящем описании в разделе примеров, включая в себя тесты с использованием CMV, ВИЧ-1, RSV, вируса Коксаки В 2, DHBV, хантавируса, вируса парагриппа и вируса осповакцины, а также тесты на HSV-1 и HSV-2,описанные в примерах 1 и 2. Несмотря на высокий уровень активности, продемонстрированный для некоторых из перечисленных олигонуклеотидов, система доставки олигонуклеотидов, такая как DOTAP,липофектамин или олигофектамин, может приводить к достижению значительно более высокой эффективности, особенно в случае более крупных (40 оснований) рандомеров. Выводы относительно широкого спектра антивирусной активности Изучение эффективности в отношении различных вирусов показало, что случайные ОН и рандомеры проявляют ингибирующие свойства в отношении множества различных вирусов. Кроме того, данные исследования подтверждают вывод, согласно которому более крупные рандомеры проявляют повышенную эффективность по подавлению вирусов, чем более мелкие рандомеры. Указанный факт позволяет предположить наличие общего механизма активности, зависимого от размера и/или заряда, как для случайных ОН, так и рандомеров ОН, в случае всех инкапсидированных вирусов. В то время как и HSV, и CMV являются вирусами семейства Herpesviridae с двухцепочечной ДНК,ВИЧ представляет собой РНК-содержащий вирус из Retroviridae, a RSV является РНК-содержащим вирусом из Paramyxoviridae. В свете того факта, что рандомеры ОН могут ингибировать вирусную функцию у большого числа различных вирусов, то, не ограничиваясь каким-либо конкретным механизмом,следует отметить реальность следующих обсуждавшихся ранее механизмов действия: А) ОН/ОН рандомеры ингибируют вирусную инфекцию через аптамерный эффект, препятствуя вирусному слиянию с плазменной мембраной; и/или В) ОН/ОН-рандомеры препятствуют или подавляют сборку вирионов или упаковку вирусных ДНК в капсиды, что приводит к появлению дефектных вирионов; и/или С) ОН/ОН рандомеры создают препятствия для белков или других компонентов хозяйского организма, которые необходимы для сборки, и/или упаковки, и/или экспрессии гена вируса. Потребности для достижения антивирусной активности Поскольку рандомизированная последовательность ДНК, по всей видимости, является достаточной для вирусного ингибирования, было интересно посмотреть, может ли антивирусная активность поддерживаться без фосфоротиоатной модификации, а также, повышается ли эффективность при соответствующем выборе случайной последовательности или специфической последовательности, имеющейся в вирусном геноме. Соответственно, были исследованы модификации ДНК и РНК с точки зрения их воздействия на антивирусную эффективность рандомеров. Поскольку рандомеры действуют через механизм, не связанный с комплементарностью последовательностей, указанные эксперименты были разработаны для выявления эффекта на антивирусную эффективность небольших изменений в конформации нуклеиновой кислоты и в распределении заряда. Для определения того, могут ли ОДН с различными нуклеотидными/нуклеозидными модификациями ингибировать HSV-1, были исследованы REP 2024, 2026, 2059 и 2060 в рамках модели снижения бляшкообразования для HSV-1, как описано в примерах. REP 2024 (PS-ОДН с 2-О-метильной модификацией связи 4 оснований с рибозой на обоих концах ОДН), REP 2026 (РО-ОДН с метилфосфонатными модификациями связей между 4 основаниями на обоих концах ОДН), REP 2059 (PS-ОДН рандомер РНК из 20 оснований в длину) и REP 2060 (PS-ОДН рандомер РНК из 30 оснований в длину) продемонстрировали анти-НSV-1-активность (см. фиг. 11). Относительно последнего примера следует отметить, что если бы антивирусный эффект могли вызывать только ОН, состоящие из фосфоротиоатного скелета ДНК, то такой эффект должен вызываться всего лишь одной молекулой. Но другие скелетные структуры и модификации также демонстрируют положительную антивирусную активность. Разумеется, любой специалист в данной области при использовании описания настоящего изобретения может также использовать ОН различной химической природы. Модификация ОН, такая как, без ограничения, фосфоротиоатная модификация, является, по всей видимости, благоприятной для антивирусной активности. Это, скорее всего, связано с требуемым зарядом ОН и/или потребностью в стабилизации ДНК, как в средах, так и внутри клеток, и может быть также связано с хиральными свойствами PS-ОДН. Соединение REP 2026 демонстрирует антивирусную активность, имея центральную часть, вклю- 17008940 чающую в себя немодифицированные РО-нуклеотиды и 4 метилфосфонатных связи на обоих концах,защищенных от деградации. Данный факт указывает на то, что РО-ОДН могут использоваться в качестве антивирусных средств, при их защите от деградации. Указанная защита может быть достигнута путем модификации нуклеотидов на концах и/или путем использования соответствующей системы доставки,описанной далее. В основном состав последовательности используемой ДНК оказывает небольшое воздействие на общую эффективность, независимо от того, что используют рандомер, случайную последовательность или специфическую последовательность HSV-1. Однако при использовании промежуточной длиныHSV-1-последовательность была почти в 3 раза более мощной, чем случайная последовательность (см. фиг. 10). Такого рода данные позволяют полагать, что в то время как специфическая антисмысловая функция присутствует в специфических последовательностях HSV, механизм, не связанный с антисмысловым эффектом (механизм, не связанный с комплементарностью последовательностей), описанный в настоящем изобретении, может представлять собой подавляющую часть данной активности. В действительности, как только ОН достигает длины в 40 оснований, по существу, вся антивирусная активность может определяться эффектом, не связанным с антисмысловыми последовательностями. Сниженная токсичность рандомера Одной из целей использования ОН рандомера является снижение токсичности. Известно, что разные последовательности могут запускать разные ответные реакции у животных, такие как общая токсичность, взаимодействие с сывороточными белками и взаимодействие с иммунной системой (Monteith etal., (1998), Toxicol. Sci., 46: 365-375). Смесь ОН может, таким образом, снижать токсические эффекты,поскольку уровень любой конкретной последовательности будет очень низким, так что маловероятно существенное взаимодействие, определяемое последовательностью и/или нуклеотидным составом. Фармацевтические композиции ОН согласно изобретению могут быть представлены в виде терапевтической композиции или средства, используемых для лечения (или профилактики) вирусных заболеваний, которые разрешены регламентирующим агентством для применения на человеке или животных, отличных от человека, и/или против конкретного вируса или группы вирусов. Указанные ОН могут использоваться как часть фармацевтической композиции при объединении с физиологически и/или фармацевтически приемлемым носителем. Характеристики носителей могут определяться способом введения. Фармацевтическая композиция согласно изобретению может также содержать другие активные факторы и/или средства, которые повышают активность. Введение ОН согласно изобретению, используемых в фармацевтической композиции или средстве,или в практике осуществления способа лечения животного, может проводиться с использованием множества традиционных режимов, таких как внутриглазное введение, пероральное употребление, энтеральное введение, ингаляция или кожная, подкожная, внутримышечная, внутрибрюшинная, внутриоболочечная, интратрахеальная или внутривенная инъекция. Фармацевтическая композиция или олигонуклеотидное средство согласно изобретению может также содержать другие химиотерапевтические средства, применяемые для лечения вирусных заболеваний,такие как, без ограничения, рифампин, рибавирин, плеконарил, цидофовир, ацикловир, пенцикловир,ганцикловир, валацикловир, фамцикловир, фоскарнет, видарабин, амантадин, занамивир, оселтамивир,ресквимод, антипротеазы, ингибиторы встраивания ВИЧ путем слияния, нуклеотидные ингибиторы ОТ ВИЧ (например, AZT, ламивудин, абакавир), ненуклеотидные ингибиторы ОТ ВИЧ, доконозол, интерфероны, бутилированный гидрокситолуол (БГТ) и гиперицин. Такие дополнительные факторы и/или средства могут включаться в фармацевтическую композицию, например, для достижения синергического эффекта с ОН согласно изобретению. Фармацевтическая композиция или олигонуклеотидное средство согласно изобретению может также включать в себя полимер, такой как, без ограничения, полианионные средства, сульфатированные полисахариды, гепарин, сульфат декстрана, пентозанполисульфат, сульфат поливинилового спирта, ацеманнан, полигидроксикарбоксилаты, сульфат целлюлозы, полимеры, содержащие сульфонированный бензол или нафталиновые кольца и нафталинсульфонатный полимер, ацетилфталоилцеллюлоза, поли-Lлизин, капрат натрия, катионные амфифилы, холевая кислота. Известно, что полимеры в ряде случаев воздействуют на поступление вирионов в клетки путем связывания вирионов или адсорбции на них. Указанные свойства антивирусных полимеров могут быть полезны при конкурировании с ОН за связывание или адсорбцию на вирион, результатом чего является повышение внутриклеточной активности ОН в сравнении с их внеклеточной активностью. Примеры системы доставки Авторы настоящего изобретения отслеживали поступление рандомеров PS-ОДН при добавлении к культивируемым клеткам меченных флуоресцентной меткой рандомеров и затем, после двух циклов промывки, смотрели интенсивность флуоресценции в лизированных клетках. Клеточное поглощение в клетках, подвергшихся воздействию 250 нМ REP 2004-FL, оценивают в варианте без системы доставки и после инкапсулирования в одну из приведенных ниже липидных систем доставки: липофектамин (Li- 18008940pofectamine (Invitrogen, полифект (Polyfect (Qiagen и олигофектамин (Oligofectamine (Invitrogen. Через 4 ч клетки промывают два раза PBS и лизируют с использованием лизирующего реагентаMPER (PROMEGA). На фиг. 34 показана относительная флуоресценция с использованием эквивалентного количества экспонированных клеток при наличии и в отсутствие системы доставки. Авторы обнаружили, что в присутствии трех исследованных систем доставки отмечается значительное увеличение внутриклеточной концентрации PS-ОДН в сравнении с вариантом отсутствия системы доставки. В свете результатов указанного тестирования следует отметить, что использование системы доставки может существенно повысить антивирусную эффективность ОН рандомеров. Дополнительно, они могут служить для защиты указанных соединений от сывороточных взаимодействий, для снижения уровня побочных эффектов и максимизации распределения по тканям и клеткам. Несмотря на то что PS-ОДН отличаются большей резистентностью к эндогенным нуклеазам, чем природные фосфодиэфиры, они не полностью стабильны и медленно разрушаются в крови и тканях. Ограничением для клинического применения олигонуклеотидных препаратов на основе PS является их тенденция активировать комплемент при в/в введении. В основном липосомы и другие системы доставки повышают терапевтический индекс лекарственных средств, включая ОН, за счет снижения токсичности лекарственного средства, увеличения времени пребывания в плазме и доставки более активного лекарственного средства к пораженной ткани за счет экстравазации носителей через гиперпроницаемую сосудистую сеть. Более того, в случае PS-ОДН инкапсулирование в липиды препятствует взаимодействию с потенциальными сайтами связывания белка при нахождении в кровотоке (Klimuk et al., (2000), J. Pharmacol. Exp. Ther., 292: 480-488). В соответствии с приведенными в данном описании результатами, авторами была разработана стратегия на основе использования системы доставки, такой как, без ограничения, липофильные молекулы,полярные липиды, липосомы, монослои, бислои, везикулы, программируемые фузогенные везикулы,мицеллы, циклодекстрины, ПЭГ, лекарственный электрофорез, порошковая инъекция и наночастицы(такие как PIBCA, PIHCA, РНСА, желатин, PEG-PLA) для доставки ОН по настоящему описанию. Целью использования таких систем доставки является, в числе других, снижение токсичности активного соединения для животных и человека, повышение уровня доставки в клетки, снижение значения ИК 50, увеличение длительности действия с момента доставки лекарственного средства и защита олигонуклеотидов от неспецифического связывания с сывороточными белками. Авторы показали, что антивирусная активность PS-ОДН рандомеров повышается с увеличением их размера. Кроме того, данная активность коррелирует с повышенным сродством к вирусным белкам (в вирусном лизате). Поскольку в данной области известно, что фосфоротиоатная модификация повышает аффинность при взаимодействии белка-ДНК, авторы исследовали способность PS-ОДН рандомеров прогрессивно возрастающих размеров связываться с фетальной сывороткой теленка (ФСТ (FBS (фиг. 28 а) с использованием теста на основе ФП, применяемого для оценки уровня взаимодействия с вирусным лизатом. В данном тесте 250 мкг инактивированного по способу, отличному от нагревания, ФСТ подвергают реакции комплексообразования с меченым флуоресцентной меткой PS-ОДН рандомером из 20 оснований, в условиях, при которых связывание (значение mP) достигает насыщения. Немеченые рандомеры PS-ОДН возрастающего размера (REP 2003, REP 2004, REP 2006 и REP 2007) используют для создания конкуренции при взаимодействии ФСТ с меченой затравкой. Результаты указанного теста четко показывают, что по мере повышения размера PS-ОДН рандомера повышается аффинность к ФСТ. Полученный результат позволяет полагать, что наиболее активными антивирусными PS-ОДН будут те варианты, которые связываются с наивысшей аффинностью с белками. В данной области известно, что одной из терапевтических проблем при лечении фосфоротиоатными антисмысловыми олигонуклеотидами является развитие побочных эффектов, которые определяются,прежде всего, повышенным уровнем взаимодействия с белками (конкретно с белками сыворотки), как было описано Кандималла с соавт. (Kandimalla et al., (1998), Bioorg. Med. Chem. Lett., 8: 2103-2108). Полученные авторами данные указывают на возможность достижения существенной пользы в случае применения подходящей системы доставки, способной доставлять антивирусные ОН в клетку и препятствующей взаимодействию с белками сыворотки. Для демонстрации полезного эффекта данной системы доставки авторы протестировали две различных методики доставки на основе липосом: цитофектина и DOTAP. Авторы измеряли уровень доставки PS-ОДН рандомера REP 2006 (инкапсулированного с использованием цитофектина или DOTAP) в клетки 293 А в присутствии высоких концентраций сыворотки (50%) при измерении внутриклеточной концентрации меченого REP 2006 флуорометрией (фиг. 28b, с). Полученные данные показывают, что система доставки повышает внутриклеточную концентрацию REP 2006 и также, в случае примененияDOTAP, уровни внутриклеточного REP 2006 через 24 ч заметно повышаются. Наконец, авторы измеряли уровень защиты REP 2006 от взаимодействий с сывороточными белками посредством DOTAP (28d) и цитофектина (28 е) в тесте на взаимодействие in vitro с использованием методики ФП. Неинкапсулированный REP 2006 был способен конкурировать за связывание с флуоресцентным олигонуклеотидом из сыворотки, но когда REP 2006 подвергали инкапсулированию с использованием DOTAP или цитофектина, он более не был способен конкурировать за связывание с сывороткой. Приведенные данные позволя- 19008940 ют полагать, что инкапсулирование предотвращает взаимодействие олигонуклеотидов с сывороткой и приводит к достижению более эффективного терапевтического воздействия при снижении побочных эффектов. Другим потенциальным преимуществом использования системы доставки является защита ОН от взаимодействий, таких как адсорбция, с инфекционными вирионами с целью предотвращения амплификации вирусной инфекции через другие механизмы, такие как повышенное проникновение вирионов в клетки. Другим подходом является осуществление доставки, специфичной для определенных клеток, путем ассоциации системы доставки с молекулой(ами), которая(ые) будет(ут) повышать аффинность к конкретным клеткам, и такие молекулы включают в себя, без ограничения, антитела, лиганды рецепторов,витамины, гормоны и пептиды. Другие варианты систем доставки приведены ниже. Связанные ОДН В некоторых вариантах осуществления настоящего изобретения данные ОН модифицируют с использованием множества способов, не затрагивая их способность ингибировать вирусную репликацию. Например, ОН подвергают связыванию или конъюгированию, по одному или более их нуклеотидных остатков, с другим фрагментом. Таким образом, модификация олигонуклеотидов согласно изобретению может включать в себя химическое связывание с олигонуклеотидом одного или более фрагментов или конъюгатов, которые повышают активность, распределение по клеткам или поглощение клеткой, повышают специфический или неспецифический транспорт через клеточные мембраны, защищают от деградации или выделения или обеспечивают достижение других благоприятных характеристик. Такие благоприятные характеристики могут включать в себя, например, сниженный уровень взаимодействия с сывороткой, повышенный уровень взаимодействия с вирусным белком, способность подвергаться обработке в процессе введения в композицию для доставки, обнаруживаемый сигнал, улучшенные фармакокинетические свойства и сниженную токсичность. Такие конъюгированные группы могут ковалентно связываться с функциональными группами, такими как первичные или вторичные гидроксильные группы. Например, конъюгированные фрагменты могут включать в себя стероидную молекулу, неароматическую липофильную молекулу, пептид, холестерин, бис-холестерин, антитело, ПЭГ, белок, водорастворимый витамин, жирорастворимый витамин, другой ОН или любую другую молекулу, повышающую активность и/или биодоступность ОН. Более детально, репрезентативные конъюгированные группы согласно изобретению могут включать в себя интеркалирующие средства, репортерные молекулы, полиамины, полиамиды, полиэтиленгликоли, полиэфиры, SATE, т-бутил-SATE, группы, которые усиливают фармакодинамические свойства олигомеров, и группы, которые усиливают фармакокинетические свойства олигомеров. Типичные конъюгированные группы включают в себя холестерины, липиды, фосфолипиды, биотин, феназин, фолят,фенантридин, антрахинон, акридин, флуоресцеины, родамины, кумарины, флуоресцентные нуклеотидные основания и красители. Группы, которые усиливают фармакодинамические свойства, в контексте настоящего изобретения включают в себя группы, которые улучшают клеточное поглощение олигомера и/или усиливают устойчивость олигомера к разрушению и/или защищают от взаимодействия с сывороткой. Группы, которые усиливают фармакокинетические свойства, в контексте настоящего изобретения включают группы, которые улучшают поглощение, распределение, метаболизм или выделение олигомера. Примеры конъюгатных групп описаны в заявке на Международный патент PCT/US92/09196, зарегистрированной 23 октября 1992 года, которая включена в настоящее описание полностью в качестве ссылки. Конъюгатные фрагменты могут включать в себя, без ограничения, липидные фрагменты, такие как холестериновый фрагмент (Letsinger et al., Proc. Natl. Acad. Sci. USA, 1989, 86, 6553-6556), холевую кислоту (Manoharan et al., Bioorg. Med. Chem. Let., 1994, 4, 1053-1060), тиоэфир, например, гексил-Sтритилтиол (Manoharan et al., Ann. N.Y. Acad. Sci., 1992, 660, 306-309; Manoharan et al., Bioorg. Med.Chem. Let., 1993, 3, 2765-2770), тиохолестерин (Oberhauser et al., Nucl. Acids Res., 1992, 20, 533-538),алифатическую цепь, например, додекандиоловые или ундецильные остатки (Saison-Behmoaras et al.,EMBO J., 1991, 10, 1111-1118; Kabanov et al., FEBS Lett., 1990, 259, 327-330; Svinarchuk et al., Biochimie,1993, 75, 49-54), фосфолипид, например, ди-гексадецил-рац-глицерин или 1,2-ди-О-гексадецил-рацглицеро-3-Н-фосфонат триэтиламмония (Manoharan et al., Tetrahedron Lett., 1995, 36, 3651-3654; Shea etal., Nucl. Acids Res., 1990, 18, 3777-3783), полиаминную или полиэтиленгликолевую цепь (Manoharan etal., NucleosidesNucleotides, 1995, 14, 969-973) или адамантануксусную кислоту (Manoharan et al., Tetrahedron Lett., 1995, 36, 3651-3654); пальмитиловый фрагмент (Mishra et al., Biochim. Biophys., Acta, 1995,1264, 229-237) или октадециламиновый или гексиламинокарбонил-оксихолестериновый фрагмент(Crooke et al., J. Pharmacol. Exp. Ther., 1996, 277, 923-937). Олигонуклеотиды согласно изобретению могут быть также конъюгированы с активными лекарственными веществами, например, без ограничения, с аспирином, варфарином, фенилбутазоном, ибупрофеном, супрофеном, фенбуфеном, кетопрофеном, (S)-(+)-пранопрофеном, карпрофеном, дансилсаркозином, 2,3,5-трийодбензойной кислотой, флуфенамовой кислотой, фолиновой кислотой, бензотиадиазидом,- 20008940 хлортиазидом, диазепином, индометацином, барбитуратом, цефалоспорином, сульфанильными препаратами, антидиабетическими, антибактериальными или антибиотическими средствами. Примеры патентов США, в которых описано получение репрезентативных олигонуклеотидных конъюгатов, включают в себя, например, патенты США 4828979; 4948882; 5218105; 5525465; 5541313; 5545730; 5552538; 5578717; 5580731; 5580731; 5591584; 5109124; 5113802; 5138045; 5414077; 5486603; 5512439; 5573718; 5608046; 4587044; 4605735; 4667025; 4762779; 4789737; 4824941; 4835263; 4876335; 4904582; 4958013; 5082830; 5112963; 5214136; 5082830; 5112963; 5214136; 5245022; 5254469; 5258506; 5262536; 5272250; 5292873; 5317098; 5371241; 5391723; 5416203; 5451463; 5510475;5512667; 5514785; 5565552; 5567810; 5574142; 5585481; 5587371; 5595726; 5597696; 5599923; 5599928 и 5688941, каждый из которых полностью включен в настоящее описание в качестве ссылки. Другой подход включает в себя получение антивирусных ОН в виде липофильных проолигонуклеотидов за счет введения модификации, включающей энзиматически расщепляемые заряженные нейтрализующие аддукты, такие как S-ацетилтиоэтил или S-пивалоилтиоэтил (Vives et al., 1999, Nucl. Acids Res.,27: 4071-4076). Такие модификации, как было показано, повышают поглощение ОН в клетки. Разработка неспецифических ОН В рамках другого подхода получают антивирусные ОН, демонстрирующие низкую, предпочтительно минимально возможную, гомологию с геномом человека (или другого выбранного организма). Целью данного подхода является получение ОН, которые будут иметь наименьшую токсичность, которая определяется взаимодействием с одной или более последовательностями генома человека или животного и соответствующими мРНК. Первой стадией является получение последовательности ОН желательной длины, например, путем выстраивания нуклеотидов А, С, G, Т в случайном порядке вручную или, чаще всего, с использованием компьютерной программы. Второй стадией является сравнение последовательности данного ОН с соответствующей информацией из библиотеки последовательностей человека, такой как ГенБанк (GenBank) и/или база данных по сборке человеческого генома (Ensemble Human GenomeDatabase). Восстановление и сравнение последовательностей, при желательности, может проводиться многократно для идентификации последовательности или последовательностей, имеющих заданный низкий уровень гомологии с целевым геномом. В желательном варианте последовательность ОН имеет наименьший возможный уровень гомологии с полным геномом, при этом предпочтительно минимизируется процесс аутовзаимодействия. Неспецифические ОН с активностью, определяемой антисмысловой последовательностью В рамках другого подхода часть(и) антивирусной неспецифической последовательности связывают с частью(ями) антисмысловой последовательности для повышения активности конечного ОН. Неспецифическая часть ОН описывается в настоящем изобретении. Антисмысловая часть является комплементарной к вирусной мРНК. Неспецифические ОН с активностью G-обогащенного мотива В рамках другого подхода часть(и) антивирусной неспецифической последовательности связывают с частью(ями) мотива для повышения активности конечного ОН. Неспецифическая часть ОН описана в настоящем изобретении. Часть мотива может, в качестве не ограничивающего примера, включать CpG,G-квартет и/или CG, которые описаны в литературе как стимуляторы иммунной системы (Agrawal et al.,(2001), Curr. Cancer Drug Targets, 3: 197-209). ОН, не соответствующие модели Уотсона-Крика Другой подход включает использование ОН, состоящих из одного типа или более типов не канонических нуклеотидов/нуклеозидов, то есть не соответствующих модели Уотсона-Крика. Такие ОН могут имитировать PS-ОДН, демонстрируя некоторые общие характеристики, близкие к PS-ОДН: а) суммарный заряд; b) наличие пространства между единицами; с) длина, цепи; d) образование результирующего диполя с накоплением отрицательного заряда на одной стороне; е) способность связываться с белками; f) способность связываться с вирусными белками; g) способность проникать в клетки; h) приемлемый терапевтический индекс; i) антивирусная активность. Данные ОН имеют предпочтительный фосфоротиоатный скелет, но не ограничиваются указанными рамками. Примеры нуклеотидов/нуклеозидов, не соответствующих модели Уотсона-Крика, описаны в работах Кула и Такешита с соавт. (Kool, 2002, Асc.Chem. Res., 35: 936-943; и Takeshita et al., (1987), J. Biol. Chem., 262: 10171-10179), где описаны ОДН,содержащие синтетические неосновные сайты. Антивирусный полимер Другой подход включает в себя использование полимера, имитирующего активность фосфоротиоатных ОДН. Как описано в литературе, несколько анионных полимеров обладают антивирусной ингибирующей активностью. Указанные полимеры принадлежат к нескольким классам:(1) сложные сульфатные эфиры полисахаридов (сульфаты декстрина и декстрана; сульфат целлюлозы);(2) полимеры, содержащие сульфонированные бензольные или нафталиновые кольца или полимеры нафталинсульфоната;(4) неосновные олигонуклеотиды (Takeshita et al., (1987), J. Biol. Chem., 262: 10171-10179). Другие примеры ненуклеотидных антивирусных полимеров описаны в литературе. Приведенные в настоящем описании полимеры включают в себя имитирующие PS-ОДН, которые имеют следующие свойства, близкие к PS-ОДН: а) длина цепи; b) образование результирующего диполя с накоплением отрицательного заряда на одной стороне; с) способность связываться с белками; d) способность связываться с вирусными белками; е) приемлемый терапевтический индекс; f) антивирусная активность. Для целей имитации эффекта PS-ОДН антивирусный полимер может предпочтительно представлять собой полианион, имеющий аналогичное пространство между своими единицами, как и в случае PS-ОДН. Он также может обладать способностью проникать в клетки, один или в сочетании с системой доставки. Антивирусная активность двухцепочечных PS-ОДН Случайную последовательность (REP 2017) и комплементарную ей последовательность (PSмодифицированную или немодифицированную) подвергают флуоресцентному мечению, как описано в литературе, и исследуют на ее способность связываться с очищенными белками HSV-1 и ВИЧ-1 по методу флуоресцентной поляризации, описанному в настоящем изобретении. Наличие гибридизации подтверждают электрофорезом в акриламидном геле. Немодифицированный REP 2017 (2017U), либо одноцепочечный (ss), либо двухцепочечный (ds), не обладает связывающей активностью ни с HSV-1, ни с ВИЧ-1 лизатами. Однако PS-модифицированный REP 2017 либо одноцепочечный, либо двухцепочечный, способен к взаимодействию с HSV-1 и ВИЧ-1 (см. фиг. 33). В соответствии с приведенными в настоящем описании результатами, выбранный авторами подход основан на использовании двухцепочечных ОН в качестве эффективных антивирусных средств. Преимущественно такие ОН имеют фосфоротиоатный скелет, но могут также иметь другие и/или дополнительные модификации, которые повышают их доставку, и/или антивирусную активность, и/или стабильность, как описано здесь в отношении одноцепочечных ОН. Тест in vitro на обнаружение лекарственного средства Разработан тест in vitro на основе флуоресцентной поляризации, который используется для измерения способности PS-ОДН связываться с вирусными компонентами, например, с вирусными белками. В том случае, когда белок (или другой взаимодействующий агент) связывается с флуоресцентно меченой затравкой, трехмерный процессинг затравки в растворе задерживается. Указанную задержку измеряют по усилению поляризации возбужденного света от меченой затравки. Таким образом, увеличенная поляризация (обозначаемая в виде безразмерного параметра [mP]) коррелирует с повышением уровня связывания. Одна методика включает в себя использование в качестве затравки PS-ОДН рандомера, меченого по 3'-концу с помощью FITC при использовании негибкого линкера (3'-(6-флуоресцеин) CPG). УказанныйPS-ОДН рандомер разбавляют до 2 нМ буфером для тестирования (10 мМ Трис, рН 7,2, 80 мМ NaCl, 10 мМ ЭДТА, 100 мМ b-меркаптоэтанол и 1% Твин 20). Затем указанный олигонуклеотид смешивают с соответствующим взаимодействующим агентом. В данном случае авторы используют очищенные в градиенте сахарозы лизаты HSV-1 (штамм Maclntyre), ВИЧ-1 (штамм Мn) или RSV (штамм А 2), суспендированные в 0,5 М KСl и 0,5% Тритон-Х-100 (HSV-1 и ВИЧ-1) или 10 мМ Трис, рН 7,5, 150 мМ NaCl, 1 мМ ЭДТА, 0,1% Тритон-Х-100 (RSV). После взаимодействия с затравкой проводят провокацию комплексов различными немечеными PS-ОДН для оценки их способности замещать затравку в комплексе. На фиг. 29 авторами показаны результаты предварительного теста, проведенного с тремя затравками разного размера: 6 (REP 2032-FL), 10 (REP 2003-FL) и 20 оснований (REP 2004-FL). Указанные варианты затравки исследуют на их способность взаимодействовать с лизатами HSV-1 (фиг. 29 а), ВИЧ-1(фиг. 29b) и RSV (фиг. 29 с). В присутствии любого из вирусных лизатов степень связывания зависит от размера использованной затравки, при этом вариант 2004-FL демонстрировал наибольший сдвиг в единицах mP (указывающий на связывание) в присутствии вирусного лизата. Авторы отмечают, что указанный результат соответствует антивирусной эффективности рандомеров PS-ОДН, реализуемой по механизму, зависимому от их размера. Указанную затравку далее используют для оценки способности PSОДН разных размеров создавать конкуренцию в процессе взаимодействия затравки с лизатом. На фиг. 30 показан результат провокации в ходе взаимодействия REP 2004-FL с лизатами HSV-1(фиг. 30 а), ВИЧ-1 (фиг. 30b) и RSV (фиг. 30 с) с использованием PS-ОДН повышающихся размеров. В случае каждого исследуемого вирусного лизата авторы отмечали, что REP 2003 был не способен конкурировать с затравкой в лизате. Взаимодействие с затравкой было очень сильным, на что указывает относительно слабая конкуренция, проявляемая в присутствии конкурентного препарата REP 2004 (немеченая затравка). Однако было показано, что при повышении размера конкурентного PS-ОДН свыше 20 оснований, его способность к замещению затравки становится более сильной. Данные результаты указывают на повышение аффинности к белковым компонентам в вирусном лизате по мере повышения размера PS-ОДН рандомера. Указанное явление отражает повышенную антивирусную активность более крупных рандомеров PS-ОДН против HSV-1, HSV-2, CMV, ВИЧ-1 и RSV. Сходство между эффективностью по конкурированию с затравкой и антивирусной активностью PSОДН рандомеров указывает на то, что механизм, лежащий в основе данного теста, является хорошим прогностическим фактором для антивирусной активности. Данный тест является жестким, легко выпол- 22008940 няемым и очень стабильным, что делает его хорошим возможным вариантом для использования в крупномасштабных скринингах, осуществляемых с целью идентификации новых антивирусных молекул, основанных не на идентификации их специфической мишени, но на их способности взаимодействовать с одним или более компонентами, например, с вирусными белками. Приведенную в настоящем описании методику используют для скрининга новых соединений, полученных из желательного источника, например из библиотеки, синтезированной методами комбинаторной химии, или выделенных путем очистки из природных веществ. Указанный способ может использоваться для а) определения соответствующего размера, наличия модификаций и структуры скелетов новых ОН; b) тестирования новых молекул, включающих новые полимеры; с) прогнозирования чувствительности конкретного вируса к новым ОН или другим новым соединениям; или d) определения соответствующего варианта соединений, подходящего для максимального ингибирования конкретного вируса. Факт повышения аффинности лизата при увеличении размеров PS-ОДН рандомеров позволяет полагать, что механизм антивирусного действия PS-ОДН рандомеров основан на взаимодействии с одним или более вирусными белковыми компонентами, которые препятствуют либо инфекции, либо корректной репликации вирионов. Указанный эффект также позволяет предположить, что данное взаимодействие зависит от заряда (размера) и не зависит от последовательности. Поскольку указанные PS-ОДН рандомеры обладают активностью, зависимой от размера, и данный механизм охватывает множество вирусов в разных семействах, авторы полагают, что PS-ОДН рандомеры препятствуют осуществлению обычных, зависимых от заряда взаимодействий по типу белок-белок, взаимодействий по типу белокДНК/РНК и/или других взаимодействий по типу молекула-молекула. Указанные взаимодействия могут включать в себя (но не ограничиваются приведенным перечнем):a. Взаимодействие между отдельными субъединицами капсида в ходе образования капсида.b. Взаимодействие между белком капсида/нуклеокапсида и вирусным геномом.c. Взаимодействие между капсидом и гликопротеинами в ходе бадинга.d. Взаимодействие между гликопротеином и его рецептором в процессе инфекции.e. Взаимодействие между другими ключевыми компонентами вируса, участвующими в вирусной репликации. Указанные множественные, осуществляемые одновременно процессы ингибирования взаимодействий по типу белок-белок отражают новый механизм ингибирования вирусов. Влияние состава последовательности PS-ОДН на лизат Авторы отслеживают способность разных последовательностей PS-ОДН взаимодействовать с несколькими вирусными лизатами. В каждом случае PS-ОДН из 20 остатков подвергают мечению по 3'концу с помощью FITC, как было описано выше. Исследуемые PS-ОДН состоят из А 20, Т 20, G20, С 20,АС 10, AG10, ТС 10, TG10, REP 2004 и REP 2017. Каждую из указанных последовательностей разбавляют до 4 нМ в буфере для анализа и инкубируют в присутствии 1 мкг лизата HSV-1, ВИЧ-1 или RSV. Взаимодействие измеряют по методу флуоресцентной поляризации. Профиль взаимодействия с исследуемыми последовательностями аналогичен для всех вирусных лизатов, указывая на то, что природа связывающего взаимодействия очень схожа во всех вариантах. В случае каждого лизата PS-ОДН одинакового состава (А 20, G20, Т 20, С 20) оказывались самыми слабыми по взаимодействию вариантами с А 20, будучи наиболее слабыми по взаимодействию вариантами указанных компонентов с выраженной границей действия. Относительно остальных исследованных PS-ОДН было показано, что все они проявляют аналогичное сильное взаимодействие, за исключением TG10, который неизменно демонстрировал наивысший уровень взаимодействия с каждым из лизатов(см. фиг. 35). Идентификация мишеней для PS-ОДН рандомеров в ВИЧ-1 Способность PS-ОДН рандомеров связываться с очищенными белками ВИЧ-1 исследуют методом флуоресцентной поляризации, как описано в примере 9. Возрастающие количества очищенного ВИЧ-1 р 24 или очищенного ВИЧ-1 gp41 подвергают реакции с REP 2004-FL (см. фиг. 31). Относительно обоих белков авторы отмечают, что имеется зависимое от концентрации белка изменение уровня флуоресцентной поляризации, указывающее на наличие взаимодействия с обоими указанными белками. Способность PS-ОДН рандомеров с размерами в определенном диапазоне связываться с указанными белками была также исследована с использованием флуоресцентных вариантов REP 2032, REP 2003,REP 2004, REP 2006 и REP 2007 (см. фиг. 32). Авторы обнаружили, что в случае р 24 отсутствует зависимое от размера взаимодействие с р 24 (см. фиг. 32 а), однако, было обнаружено увеличение в связывании сgp41 в случае тех PS-ОДН рандомеров, размер которых превышал 20 оснований, в сравнении с теми,размер которых меньше 20 оснований (см. фиг. 32b). Указанный результат позволяет полагать, что при повышении размера PS-ОДН рандомера свыше 20 оснований, с индивидуальными рандомерами может связываться множество копий gp41, что усиливает их поляризацию. Указанный результат представляет собой весьма важное наблюдение, поскольку демонстрирует потенциал более крупных ОН по секвестрации структурных белков в ходе вирусного синтеза и, соответственно, по ограничению их доступности для формирования новых вирионов.- 23008940 Олигонуклеотиды с высокой аффинностью Другой подход представляет собой способ обогащения или очистки с получением антивирусного(ых) ОН, обладающего(их) большей аффинностью к вирусным компонентам, таким как вирусные белки, чем средняя аффинность ОН в исходном пуле ОН. Таким образом, данный способ позволяет получать один или более ОН, не зависящих от комплементарности последовательностей, которые будут проявлять повышенную аффинность к одному или более вирусным компонентам, т.е. будут обладать трехмерной формой, соответствующей такой повышенной аффинности связывания. Принципом такого подхода является понимание того, что поскольку ОН действуют как линейные молекулы в процессе связывания с вирусными компонентами, они могут также сворачиваться с образованием трехмерной формы, которая может усиливать взаимодействие с такими вирусными компонентами. При этом, без ограничения какойлибо конкретной методикой, следует отметить, что ОН с высокой аффинностью могут быть очищены или обогащены приведенными ниже способами. Одним из методов очистки высокоаффинного ОН или множества высокоаффинных ОН является метод, включающий в себя использование среды стационарной фазы со связанным(ыми) вирусным(ыми) белком(ами) в качестве аффинной матрицы, функционирующей по связыванию с ОН, которые могут быть далее подвергнуты элюции в условиях повышающейся жесткости, (например, при повышении концентрации соли или другого хаотропного агента и/или при повышении температуры и/или при изменении значения рН). Такая методика может быть, например, осуществлена путем:a) внесения пула ОН на ионообменную колонку, содержащую вирусный белок или несколько вирусных белков или вирусный лизат, в связанном со стационарной фазой состоянии;b) замещения (элюции) связанных ОН из колонки, например, при использовании замещающего раствора, такого как раствор с повышенной концентрацией соли;c) сбора фракций ОН, элюированных при разной концентрации соли;d) клонирования и секвенирования элюированных ОН из разных фракций, более предпочтительно из фракции(ий), элюированной(ых) при высокой концентрации соли, так что ОН, элюированные при высокой концентрации соли, будут обладать большей аффинностью по связыванию с вирусным(ыми) белком(ами); иe) тестирования активности секвенированного(ых) ОН, в рамках таких тестов, как тест на связывание и/или вирусное ингибирование, например, с помощью теста на поляризацию-связывание по флуоресцентному методу, приведенного в настоящем описании, и/или теста на ингибирование вируса в клетке, и/или теста на ингибирование вируса в организме животного. Во втором примере описан метод, основанный и далее модифицированный с использованием в качестве исходной методики SELEX (Morris et al., (1998), Biochemistry, 95: 2902-2907), применяемый для очистки высокоаффинного ОН. Один из вариантов осуществления такого метода может включать в себя:(а) получение исходного материала из пула ОН, например, сбор синтезированных случайных ОН,содержащих большое число последовательностей, например, от ста триллионов (1014) до десяти квадриллионов (1016) разных последовательностей. Каждая молекула ОН содержит сегмент случайной последовательности, фланкированный на каждом конце праймер-связанными последовательностями для облегчения осуществления полимеразно-цепьевой реакции (ПЦР). Поскольку нуклеотидные последовательности, по существу, всех молекул являются уникальными, в популяции представлено огромное число структур. Указанные структуры определяют биохимические свойства каждой молекулы, такие как способность связываться с данной вирусной молекулой-мишенью;(c) отбор ОН, которые связываются с вирусным(ыми) белком(ами) в рамках одной или более методик распределения, которые позволяют распределять связанные и несвязанные ОН, на основе таких показателей, как сдвиги в нативном геле и фильтрование через нитроцеллюлозу. Любой из указанных методов позволяет физически отделить связанные виды от несвязанных видов, что приводит к преимущественному восстановлению тех последовательностей, которые связаны наилучшим образом. Кроме того,для отбора ОН, которые связываются с небольшим белком, желательно присоединить мишень к твердой подложке и использовать такую подложку в качестве матрицы для аффинной очистки. Те молекулы, которые не связываются, вымываются, а связанные молекулы элюируются в случае использования свободных молекул-мишеней, что вновь позволяет физически отделить связанные и несвязанные виды;(d) амплификацию элюированных связанных ОН, например, с использованием ПЦР, включающей применение праймеров, гибридизирующихся с обеими фланкирующими последовательностями ОН;(e) стадии (b), (с) и (d) могут проводиться много раз (например, могут быть выполнены множественные циклы или раунды обогащения и амплификации) с целью преимущественного восстановления тех ОН, которые проявляют наивысшую аффинность связывания с вирусным(ыми) белком(ами). После нескольких циклов обогащения и амплификации в популяции преобладают последовательности, которые проявляют желательное биохимическое свойство;(f) клонирование и секвенирование одного или более ОН, выбранных из варианта, полученного в цикле обогащения (например, последнего такого цикла); и(g) тестирование наличия связывания и/или активности секвенированных ОН в тестах, например, в рамках теста на связывание по методу флуоресцентной поляризации, приведенному в настоящем описании, и/или теста на подавление вируса в клетках, и/или теста на подавление вируса в организме животного. Другой подход основан на внесении модификации в методику синтеза путем расщепления для создания библиотек, построенных на принципе один шарик - один - PS-ОДН и один шарик - один - РS2 ОДН, в соответствии с работой Янга с соавт. (Yang et al., (2002), Nucl. Acids Res., 30(e132): 1-8). При этом проводится связывание специфических шариков с вирусными белками с последующим отбором. Секвенирование и по основаниям нуклеиновой кислоты, и по положениям любой тиоатной/дитиоатной связи может быть осуществлено с использованием методики ПЦР для идентификации tag-метки в выбранных шариках. Данный подход позволяет провести быструю и удобную идентификацию PS-ОДН илиPS2-ОДН, которые связываются с вирусными белками и которые демонстрируют мощные антивирусные свойства. Как только определяются специфические последовательности, которые связываются с вирусными белками с высокой аффинностью (например, путем амплификации и секвенирования индивидуальных последовательностей), то одна или более таких высокоаффинных последовательностей могут быть отобраны и синтезированы (например, путем химического или ферментативного синтеза) для получения препарата высокоаффинных ОН, которые могут быть далее модифицированы с целью усиления их активности, включая улучшение их фармакокинетических свойств. Такие высокоаффинные ОН могут быть использованы в рамках настоящего изобретения. Заболевания приона Другой подход используют в альтернативном варианте осуществления изобретения для лечения,контроля прогрессирования или предупреждения заболевания приона. Указанное смертельное нейродегенеративное заболевание является инфекционным и может поражать и людей, и животных. Считается,что структурные изменения в клеточном белке прионе РrРС в его расщепленную изоформу PrPSC является обязательной стадией возникновения и распространения заболевания приона. Амилоидные полимеры ассоциированы с невропатологией указанного заболевания приона. Инкубация белкового фрагмента приона и двухцепочечной нуклеиновой кислоты приводит к образованию амилоидных волокон (Nandi et al., (2002), J. Mol. Biol., 322: 153-161). OH, обладающие аффинностью к белкам, таким как фосфоротиоаты, используют для конкуренции или ингибирования взаимодействия двухцепочечной нуклеиновой кислоты с РrРС и, следовательно, для остановки образования амилоидных полимеров. Такие ОН разных размеров и разного состава могут использоваться в соответствующей форме для доставки при лечении пациентов, страдающих от заболевания приона, или с целью профилактики в тех ситуациях, когда имеется высокий риск развития данного заболевания. Такие останавливающие ОН могут быть идентифицированы путем оценки изменений в свернутой структуре амилоидной полимеразы, как описано в работе Нанди с соавт. (Nandi et al., supra), в присутствии исследуемых ОН. Заболевания предположительно вирусной этиологии Другой подход используют в другом варианте осуществления настоящего изобретения для лечения или профилактики заболеваний или состояний, предположительно вирусной этиологии, как описано, в неограничивающем варианте, в приведенных ниже примерах. Вирусы являются вероятными причинными агентами многих заболеваний и состояний, которые не относятся к первичной вирусной инфекции. Так, например, артрит ассоциирован с HCV (Olivieri et al., (2003), Rheum. Dis. Clin. North. Am., 29: 111122), с парвовирусом В 19, ВИЧ, HSV, CMV, EBV и VZV (Stahl et al., (2000), Clin. Rheumatol., 19: 281286). Были идентифицированы также другие вирусы, которые играют определенную роль в различных заболеваниях. Так, например, вирус гриппа А играет определенную роль в болезни Паркинсона (Takahashi et al., (1999), Jpn. J. Infect. Dis., 52: 89-98), коронавирус, EBV и другие вирусы - в развитии рассеянного склероза (Talbot et al., (2001), Curr. Top. Microbiol. Immunol., 253: 247-71); EBV, CMV и HSV-6 - в развитии синдрома хронической усталости (Lerner et al., (2002), Drugs Today, 38: 549-561); парамиксовирусы- в развитии астмы (Walter et al., (2002), J. Clin. Invest., 110: 165-175) и болезни Педжета; а HBV, HSV и вирус гриппа - в развитии синдрома Гийена-Барре. В связи с указанной этиологией, подавление релевантного вируса, согласно настоящему изобретению, может задерживать, замедлять или препятствовать развитию соответствующего заболевания или состояния, или по меньшей мере некоторых симптомов такого заболевания. Модификации олигонуклеотидов и их синтез Как указывалось выше в разделе "Краткое описание сущности изобретения", в настоящем изобретении используются модифицированные олигонуклеотиды. Такие модифицированные олигонуклеотиды включают в себя, например, олигонуклеотиды, содержащие модифицированный скелет или неприродные внутринуклеозидные связи. Олигонуклеотиды, обладающие модифицированным скелетом, включают в себя такие олигонуклеотиды, которые содержат атом фосфора в своем скелете и те, которые в скелете не содержат атома фосфора. Такие модифицированные олигонуклеотидные скелеты включают в себя, например, фосфоротиоаты, хиральные фосфоротиоаты, фосфородитиоаты, фосфотриэфиры, аминоалкилфосфотриэфиры, ме- 25008940 тильные и другие алкильные фосфонаты, включая 3'-алкиленфосфонаты, 5'-алкиленфосфонаты и хиральные фосфонаты, фосфинаты, фосфорамидаты, включая 3'-аминофосфорамидат и аминоалкилфосфорамидаты, тионофосфорамидаты, тионоалкилфосфонаты, тионоалкилфосфотриэфиры, селенофосфаты, карборанилфосфат и боранофосфаты, содержащие нормальные 3'-5'-связи, их 2'-5'-связанные аналоги, и такие соединения, которые включают инвертированную полярность, где одна или более внутринуклеотидных связей представляют собой 3'-3', 5'-5', 2'-2'-связь. Олигонуклеотиды, содержащие инвертированную полярность, в типичном случае включают одну 3'-3'-связь на 3'-удаленной связке, т.е. один инвертированный нуклеозидный остаток, который может быть неосновным (нуклеотидное основание отсутствует или вместо него содержится гидроксильная группа). Включаются также различные соли, смешанные соли и свободные кислотные формы. Получение указанных выше олигонуклеотидов с фосфорсодержащими связями описано, например,в патентах США 3687808; 4469863; 4476301; 5023243; 5177196; 5188897; 5264423; 5276019; 5278302; 5286717; 5321131; 5399676; 5405939; 5453496; 5455233; 5466677; 5476925; 5519126; 5536821; 5541306; 5550111; 5563253; 5571799; 5587361; 5194599; 5565555; 5527899; 5721218; 5672697 и 5625050, каждый из которых включен в настоящее описание в качестве ссылки. Некоторые репрезентативные олигонуклеотиды с модифицированным скелетом, который не включает в себя атом фосфора, содержат скелет, образованный посредством короткоцепочечных алкильных или циклоалкильных внутринуклеозидных связей или смешанных гетероатомных и алкильных или циклоалкильных внутринуклеозидных связей или одной или более короткоцепочечных гетероатомных или гетероциклических внутринуклеозидных связей. Указанные скелеты включают в себя такие, которые содержат морфолино-связи (образованные частично за счет сахарной части нуклеозида); силоксановые скелеты; сульфидные, сульфоксидные и сульфоновые скелеты; формацетильные и тиоформацетильные скелеты; метиленформацетильные и тиоформацетильные скелеты; рибоацетильные скелеты; алкенсодержащие скелеты; сульфаматные скелеты; метиленимино и метиленгидразино скелеты; сульфонатные и сульфонамидные скелеты; амидные скелеты и другие, содержащие смешанные N, О, S и СН 2 компоненты в качестве их частей. Особенно полезными в данном контексте являются скелетные связи, которые включают в себя один или более заряженных фрагментов. Примеры патентов США, описывающих получение указанных выше олигонуклеотидов, включают в себя патенты США 5034506; 5166315; 5185444; 5214134; 5216141; 5235033; 5264562; 5264564; 5405938; 5434257; 5466677; 5470967; 5489677; 5541307; 5561225; 5596086; 5602240; 5610289; 5602240; 5608046; 5610289; 5618704; 5623070; 5663312; 5633360; 5677437; 5792608; 5646269 и 5677439, каждый из которых включен в настоящее описание в качестве ссылки. Модифицированные олигонуклеотиды могут также содержать один или более замещенных сахарных фрагментов. Например, такие олигонуклеотиды могут содержать одну или более из приведенных ниже 2'-модификаций: ОН; F; O-, S- или N-алкил; О-, S- или N-алкенил; О-, S- или N-алкинил; или Оалкил-O-алкил, где алкил, алкенил или алкинил могут представлять собой замещенные или незамещенные C1-С 10 алкил или С 2-С 10 алкенил и -алкинил или 2'-O-(O-карборан-1-ил)метил. Конкретные примеры включают в себя O[(CH2)nO]mCH3, O(СН 2)ОСН 3, O(CH2)nNH2, O(CH2)nCH3, O(CH2)nONH2 иO(СН 2)nON[СН 2)nСН 3)]2, где n и m равны от 1 до 10. Другие репрезентативные олигонуклеотиды содержат одну из приведенных ниже 2'-модификаций: C1-С 10 низший алкил, замещенный низший алкил,алкенил, алкинил, алкарил, аралкил, O-алкарил или O-аралкил, SH, SCH3, OCN, Cl, Br, CN, CF3, OCF3,SOCH3, SO2CH3, ONO2, NO2, N3, NH2, гетероциклоалкил, гетероциклоалкарил, аминоалкиламино, полиалкиламино, замещенный силил, репортерную группу, интеркалирующий агент, группу, используемую для улучшения фармакокинетических свойств олигонуклеотида, или группу, используемую для улучшения фармакодинамических свойств олигонуклеотида. Соответствующие примеры включают в себя 2'метоксиэтокси (2'-О-СН 2 СН 2 ОСН 3 также известную как 2'-O-(2-метоксиэтил) или 2'-МОЕ) (Martin et al.,Helv. Chim. Acta, 1995, 78, 486-504), например, алкоксиалкоксигруппу; 2'-диметиламинооксиэтокси, например, О(СН 2)2ON(CH3)2 группу, также известную как 2'-DMAOE, и 2'-диметиламиноэтоксиэтокси(также известную как 2'-О-диметиламиноэтоксиэтил или 2'-DMAEOE), например, 2'-O-CH2-O-CH2N(СН 2)2. Другие модификации включают в себя замкнутые нуклеиновые кислоты (LNA), в которых 2'гидроксильная группа присоединена к 3'- или 4'-атому углерода в сахарном кольце, образуя при этом бициклический сахарный фрагмент. Указанная связь может представлять собой метиленовую (-СН 2-)группу, соединяющую мостиковой связью 2'-атом кислорода и 4'-атом углерода, где n равно 1 или 2.LNA и способы их получения описаны в WO 93/39352 и WO 99/14226, которые включены в настоящее описание полностью в качестве ссылки. Другие модификации включают в себя модификации мостиковой связи сера-азот, такие как в закрытых нуклеиновых кислотах, описанные в работе Орума с соавт. (Orum et al., (2001), Curr. Opin. Mol.Ther., 3: 239-243). Другие модификации включают в себя 2'-метокси (2'-О-СН 3), 2'-метоксиэтил (2'-O-СН 2-СН 3), 2'аминопропокси (2'-OCH2CH2CH2NH2), 2'-аллил (2'-СН 2-СН=СН 2), 2'-О-аллил (2'-O-СН 2-СН=СН 2) и 2'фтор (2'-F). 2'-Модификация может быть в арабино (верхнем) положении или в рибо (нижнем) положе- 26008940 нии. Аналогичные модификации могут быть также введены в другие положения олигонуклеотида, в особенности в 3'-положение сахарного фрагмента на 3'-терминальном нуклеотиде или в 2'-5'-соединенных олигонуклеотидах и в 5'-положение 5'-терминального нуклеотида. Олигонуклеотиды могут также содержать сахарные миметики, такие как циклобутильные фрагменты, вместо пентофуранозильного сахара. Примеры патентов США, в которых описано получение таких модифицированных сахарных структур,включают в себя, например, патенты США 4981957; 5118800; 5319080; 5359044; 5393878; 5446137; 5466786; 5514785; 5519134; 5567811; 5576427; 5591722; 5597909; 5610300; 5627053; 5639873; 5646265; 5658873; 5670633; 5792747 и 5700920, каждый из которых включен в настоящее описание полностью в качестве ссылки. Еще другие модификации включают в себя ОН конкатемер, состоящий из множества олигонуклеотидных последовательностей, присоединенных с помощью линкера(ов). Линкер может, например, состоять из модифицированных нуклеотидных или ненуклеотидных единиц. В некоторых вариантах осуществления настоящего изобретения линкер обеспечивает гибкость ОН конкатемеру. Использование таких ОН конкатемеров может обеспечить простой способ синтеза конечной молекулы путем объединения более мелких строительных блоков из олигонуклеотидов с получением продукта желательной длины. Например, может использоваться 12-углеродный линкер (С 12 фосфорамидит) для объединения двух или более ОН конкатемеров и обеспечивать достижение определенной длины, стабильности и гибкости. В контексте настоящего описания термин "немодифицированные" или "природные" основания(нуклеотидные основания) включает в себя пуриновые основания: аденин (А) и гуанин (G), и пиримидиновые основания: тимин (Т), цитозин (С) и урацил (U). Олигонуклеотиды могут также включать в себя модификации или замещения в основании. Модифицированные основания включают другие синтетические и природные основания, такие как 5-метилцитозин (5-mе-С; 5-МЦ), 5-гидроксиметилцитозин, ксантин, гипоксантин, 2-аминоаденин, 6-метильные и другие алкильные производные аденина и гуанина, 2 пропильные и другие алкильные производные аденина и гуанина, 2-тиоурацил, 2-тиотимин и 2 тиоцитозин, 5-галогенурацил и -цитозин, 5-пропинил(-СС-СН 3)урацил и -цитозин и другие алкинильные производные пиримидиновых оснований, 6-азоурацил, -цитозин и -тимин, 5-урацил (псевдоурацил),4-тиоурацил, 8-галоген-, 8-амино-, 8-тиоловые, 8-тиоалкильные, 8-гидроксильные и другие 8 замещенные аденины и гуанины, 5-галоген-, в особенности 5-бром-, 5-трифторметильные и другие 5 замещенные урацилы и цитозины, 7-метилгуанин и 7-метиладенин, 2-F-аденин, 2-аминоаденин, 8 азагуанин и 8-азааденин, 7-деазагуанин и 7-деазааденин, 3-деазагуанин и 3-деазааденин. Дополнительные модифицированные основания включают в себя трициклические пиримидины, такие как феноксазинцитидин (1 Н-пиримидо[5,4-b][1,4]бензоксазин-2(3 Н)-он), фенотиазинцитидин (1 Н-пиримидо[5,4b][1,4]бензотиазин-2(3 Н)-он), G-замкнутые структуры, такие как замещенный феноксазинцитидин (например,9-(2-аминоэтокси)-Н-пиримидо[5,4-b][1,4]бензоксазин-2(3 Н)-он),карбазолцитидин(2 Нпиримидо[4,5-b]индол-2-он), пиридоиндолцитидин (Н-пиридо[3',2':4,5]пирроло[2,3-d]пиримидин-2-он). Модифицированные основания могут также включать в себя такие основания, в которых пуриновое или пиримидиновое основание замещено другими гетероциклами, например, 7-деазааденином, 7 деазагуанозином, 2-аминопиридином и 2-пиридоном. Другие нуклеотидные основания включают в себя основания, описанные в патенте США 3687808, а также в литературе (The Concise Encyclopedia OfPolymer Science And Engineering, pages 858-859, Kroschwitz, J.I., ed. John WileySons, 1990, а также в работе Englisch et al., Angewandte Chemie, International Edition, 1991, 30, 613, и основания, раскрытые в работе Sanghvi, Y.S., Chapter 15, Antisense Research and Applications, pages 289-302, Crooke, S.T. and Lebleu, В., ed., CRC Press, 1993). Другая модификация включает в себя фосфородитиоатные связи. Поскольку известно, что фосфородитиоатные ОДН (РS2-ОДН) и PS-ОДН имеют близкую аффинность связывания с белками (Tonkinsonet al., (1994), Antisense Res. Dev., 4: 269-278; Cheng et al., (1997), J. Mol. Recogn., 10: 101-107) и поскольку известно, что возможным механизмом действия ОДН является связывание с вирусными белками, может быть желательно включать в себя фосфородитиоатные связи в антивирусные ОДН, описанные в настоящем изобретении. Другой подход, используемый для модификации ОДН, связан с получением ОДН со структурой заданной или обогащенной соответствующей стереохимии, описанных, например, в публикации Yu et al.,(2000), Bioorg. Med. Сhеm., 8: 275-284 и в публикации Inagawa et al., (2002), FEBS Lett., 25: 48-52. ОДН,полученные традиционными методами, состоят из смеси диастереомеров, образуемых за счет асимметрии вокруг атома фосфора, входящего во внутринуклеотидную связь. Данный эффект может влиять на стабильность связывания между ОДН и вирусными компонентами, такими как вирусные белки. Полученные ранее данные показывают, что связывание с белком в существенной мере зависит от стереохимии (Yu et al.). Таким образом, с использованием ОДН со структурой заданной или обогащенной соответствующей стереохимии можно улучшить их способность к связыванию с белком и повысить антивирусную эффективность. Включение модификаций, таких как описанные выше, может быть использовано во многих вариантах разного рода включения и уровня. Иными словами, не обязательно, чтобы конкретная модификация включалась в каждый нуклеотид или каждую связь в олигонуклеотиде, тогда как в одном олигонуклео- 27008940 тиде или даже в одном единственном олигонуклеотиде могут использоваться в сочетании разные модификации. Синтез олигонуклеотидов Олигонуклеотиды согласно изобретению могут быть синтезированы с использованием известных в данной области методик. Например, незамещенные и замещенные олигонуклеотиды с фосфодиэфирной связью (Р=O) могут быть синтезированы с использованием автоматизированного синтезатора ДНК (например, Applied Biosystems, модель 380 В) стандартными методами фосфорамидитной химии при окислении йодом. Фосфоротиоаты (P=S) могут быть синтезированы по методике получения фосфодиэфирных олигонуклеотидов, за исключением того, что используемые для окисления стандартные флаконы заменяют 0,2 М раствором 1,1-диоксида 311-1,2-бензодитиол-3-она в ацетонитриле в рамках двухступенчатого процесса тиоатирования фосфитных связей. Стадия тиоатирования может быть продлена до 68 с,и далее за ней следует стадия кэппирования. После выщепления из колонки CPG и деблокирования с использованием концентрированного гидроксида аммония при 55 С (18 ч) олигонуклеотиды могут быть подвергнуты очистке путем двукратного осаждения 2,5 объемами этанола из 0,5 М раствора NaCl. Фосфинатные олигонуклеотиды могут быть получены в соответствии с описанием, приведенным в патенте США 5508270; алкилфосфонатные олигонуклеотиды могут быть получены в соответствии с описанием, приведенным в патенте США 4469863; 3'-дезокси-3'-метиленфосфонатные олигонуклеотиды могут быть получены в соответствии с описанием, приведенным в патентах США 5610289 и 5625050; фосфорамидитные олигонуклеотиды могут быть получены в соответствии с описанием, приведенным в патентах США 5256775 и 5366878; алкилфосфонотиоатные олигонуклеотиды могут быть получены в соответствии с описанием, приведенным в опубликованных РСТ заявках PCT/US94/00902 иPCT/US93/06976 (опубликованы как WO 94/17093 и WO 94/02499 соответственно); 3'-дезокси-3'аминофосфорамидатные олигонуклеотиды могут быть получены в соответствии с описанием, приведенным в патенте США 5476925; фосфотриэфирные олигонуклеотиды могут быть получены в соответствии с описанием, приведенным в патенте США 5023243; боранофосфатные олигонуклеотиды могут быть получены в соответствии с описанием, приведенным в патентах США 5130302 и 5177198; метиленметилиминосвязанные олигонуклеотиды, также обозначаемые как ММI-связанные олигонуклеотиды,метилендиметилгидразосвязанные олигонуклеотиды, также обозначаемые как MDII-связанные олигонуклеотиды, и метиленкарбониламиносвязанные олигонуклеотиды, также обозначаемые как амид-3 связанные олигонуклеотиды, и метиленаминокарбонилсвязанные олигонуклеотиды, также обозначаемые как амид-4-связанные олигонуклеозиды, а также соединения со смешанным скелетом, включающим, например, чередующиеся MMI и Р=O или P=S связи, могут быть получены в соответствии с описанием,приведенным в патентах США 5378825, 5386023, 5489677, 5602240 и 5610289; олигонуклеотиды с присоединенными формацетальными и тиоформацетальными фрагментами могут быть получены в соответствии с описанием, приведенным в патентах США 5264562 и 5264564; и олигонуклеотиды, связанные с этиленоксидом, могут быть получены в соответствии с описанием, приведенным в патенте США 5223618. Каждый из цитированных патентов и патентных заявок входит в настоящее описание полностью в качестве ссылки. Олигонуклеотидные средства и фармацевтические композиции Описанные в настоящем изобретении олигонуклеотиды могут быть получены в виде олигонуклеотидного средства или фармацевтической композиции. Так, олигонуклеотиды согласно изобретению могут быть также смешаны, инкапсулированы, конъюгированы или ассоциированы с другими молекулами,молекулярными структурами или смесями соединений, такими как, например, липосомы, рецепторные молекулы-мишени, пероральные, ректальные, местные или другие средства, способствующие поглощению, распределению и/или абсорбции. Репрезентативные патенты США, в которых описано получение таких средств, способствующих поглощению, распределению и/или абсорбции, включают, например,патенты США 5108921, 5354844, 5416016, 5459127, 5521291, 5543158, 5547932, 5583020, 5591721,4426330, 4534899, 5013556, 5108921, 5213804, 5227170, 5264221, 5356633, 5395619, 5416016, 5417978,5462854, 5469854, 5512295, 5527528, 5534259, 5543152, 5556948, 5580575 и 5595756, каждый из которых включен в настоящее описание в качестве ссылки. Олигонуклеотиды, средства и композиции согласно изобретению включают в себя любые фармацевтически приемлемые соли, сложные эфиры или соли таких сложных эфиров, или любое другое соединение, которое при введении животному, включая человека, способно обеспечить (непосредственно или опосредованно) наличие биологически активного метаболита или его остатка. Соответственно, например, настоящее описание также относится к пролекарствам и фармацевтически приемлемым солям соединений согласно изобретению, фармацевтически приемлемым солям таких пролекарств и других биологически эквивалентных соединений. Термин "пролекарство" относится к терапевтическому средству, которое получают в неактивной форме и которое превращается в активную форму (например, в лекарство) в организме или в его клетках под воздействием эндогенных ферментов или других химических веществ и/или условий. В конкретных вариантах осуществления настоящего изобретения описанные в нем пролекарственные формы олигонуклеотидов получают в виде SATE [(S-ацетил-2-тиоэтил)фосфат] производных по методам, описанным вWO 93/24510 (Gosselin et al.) и WO 94/26764 (Imbach et al.) и в патенте США 5770713, которые включены в настоящее описание полностью в качестве ссылки. Термин "фармацевтически приемлемые соли" относится к физиологически и фармацевтически приемлемым солям соединений согласно изобретению, т.е. к солям, которые сохраняют желательную биологическую активность исходного соединения и не оказывают нежелательного токсикологического эффекта. Многие такие фармацевтически приемлемые соли известны и могут использоваться в практике осуществления настоящего изобретения. В том, что касается олигонуклеотидов, полезные примеры фармацевтически приемлемых солей включают в себя, без ограничения, соли, образованные с катионами, такими как натрий, калий, аммоний,магний, кальций, с полиаминами, такими как спермин и спермидин; аддитивные соли кислоты, образованные с использованием неорганических кислот, например, хлористо-водородной кислоты, бромистоводородной кислоты, серной кислоты, фосфорной кислоты, азотной кислоты и т.п.; соли, образованные с использованием органических кислот, таких как, например, уксусная кислота, щавелевая кислота, винная кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, глюконовая кислота, лимонная кислота, яблочная кислота, аскорбиновая кислота, бензойная кислота, танниновая кислота, пальмитиновая кислота, альгиновая кислота, полиглютаминовая кислота, нафталинсульфоновая кислота, метансульфоновая кислота, п-толуолсульфоновая кислота, нафталиндисульфоновая кислота, полигалактуроновая кислота и т.п.; и соли, образованные на основе анионов элементов, таких как хлор, бром и йод. Настоящее изобретение также относится к фармацевтическим композициям и средствам, которые включают в себя антивирусные олигонуклеотиды согласно изобретению. Такие фармацевтические композиции могут вводиться с использованием множества способов, в зависимости от того, какое, местное или системное, лечение является желательным, и от той области, которая подлежит лечению. Так, например, введение может быть местным (включая глазное введение и введение в слизистые оболочки, в том числе вагинальный и ректальный способ доставки), внутрилегочным, например, путем ингаляции или инсуффляции с использованием порошков или аэрозолей, в том числе с помощью небулайзера; внутритрахеальным, интраназальным; эпидермальным и чрескожным; пероральным или парентеральным. Парентеральное введение включает в себя внутривенную, внутриартериальную, подкожную, внутрибрюшинную или внутримышечную инъекцию или инфузию; или внутричерепное, например, внутриоболочечное или внутрижелудочковое введение. Фармацевтические композиции и средства для местного введения могут включать в себя чрескожные пластыри, мази, лосьоны, кремы, гели, капли, суппозитории, спреи, жидкости и порошки. Традиционные фармакологические носители, водные, порошковые или масляные основы, загустители и т.п. могут быть также необходимы или желательны. Покрытые оболочкой презервативы, перчатки и т.п. также могут использоваться. Предпочтительные местные композиции включают в себя такие композиции, в которых олигонуклеотиды согласно изобретению находятся в смеси со средством для местной доставки,таким как липиды, липосомы, жирные кислоты, сложные эфиры жирной кислоты, стероиды, хелатирующие средства и поверхностно-активные вещества. Предпочтительные липиды и липосомы включают в себя нейтральные по заряду (например, диолеилфосфатидилэтаноламин ДОФЭ (DOPE), димиристоилфосфатидилхолин ДМФХ (DMPC), дистеароилфосфатидилхолин), отрицательно заряженные (димиристоилфосфатидилглицерин ДМФГ (DMPG и катионные (например, диолеилтетраметиламинопропил ДОТАП (DOTAP) и диолеилфосфатидилэтаноламин (DOTMA. Олигонуклеотиды могут быть инкапсулированы в липосомы или могут образовывать комплексы, в частности, с катионными липосомами. Альтернативно, олигонуклеотиды могут быть подвергнуты комплексообразованию с липидами, в частности,с катионными липидами. Предпочтительные жирные кислоты и сложные эфиры включают в себя, без ограничения, арахидоновую кислоту, олеиновую кислоту, эйкозановую кислоту, лауриновую кислоту,каприловую кислоту, каприновую кислоту, миристиновую кислоту, пальмитиновую кислоту, стеариновую кислоту, линолевую кислоту, линоленовую кислоту, дикапрат, трикапрат, моноолеин, дилаурин,глицерил-1-монокапрат, 1-додецилазациклогептан-2-он, ацилкарнитин, ацилхолин или C1-10 алкиловый сложный эфир (например, изопропилмиристат ИПМ (IPM, моноглицерид, диглицерид или их фармацевтически приемлемую соль. Композиции и средства для перорального введения включают в себя порошки или гранулы, микрочастицы, наночастицы, суспензии или растворы в водных или неводных средах, капсулы, гель-капсулы,пакетики, таблетки или мини-таблетки. При этом могут быть желательны загустители, вкусовые вещества, разбавители, эмульгаторы, средства, способствующие диспергированию, или связующие вещества. Предпочтительные пероральные композиции включают в себя такие композиции, в которых олигонуклеотиды согласно изобретению вводятся в сочетании с одним или более средствами, усиливающими проникновение, поверхностно-активными веществами или хелатирующими средствами. Примеры поверхностно-активных веществ включают в себя жирные кислоты и/или их сложные эфиры или соли, желчные кислоты и/или их соли. Примеры желчных кислот/солей включают в себя хенодезоксихолевую кислоту(ХДХК (CDCA и урсодезоксихендезоксихолевую кислоту (УДХК (UDCA, холевую кислоту, дегидрохолевую кислоту, дезоксихолевую кислоту, глюхолевую кислоту, глихолевую кислоту, гликодезоксихолевую кислоту, таурохолевую кислоту, тауродезоксихолевую кислоту, тауро-24,25-дигидрофузидат на- 29008940 трия, гликодигидрофузидат натрия. Примеры жирных кислот включают в себя арахидоновую кислоту,ундекановую кислоту, олеиновую кислоту, лауриновую кислоту, каприловую кислоту, каприновую кислоту, миристиновую кислоту, пальмитиновую кислоту, стеариновую кислоту, линолевую кислоту, линоленовую кислоту, дикапрат, трикапрат, моноолеин, дилаурин, глицерил-1-монокапрат, 1 додецилазациклогептан-2-он, ацилкарнитин, ацилхолин или моноглицерид, диглицерид или их фармацевтически приемлемую соль (например, натриевую). Также предпочтительными являются сочетания усилителей проникновения, например, жирные кислоты/соли в сочетании с желчными кислотами/солями. Особенно предпочтительные сочетания включают в себя натриевую соль лауриновой кислоты, каприновой кислоты и УДХК (UDCA). Другие примеры усилителей проникновения включают в себя полиоксиэтилен-9-лауриловый эфир, полиоксиэтилен-20-цетиловый эфир. Олигонуклеотиды согласно изобретению могут доставляться перорально в гранулярной форме, включая распыление высушенных частиц, или в виде комплексов, приводящих к образованию микро- или наночастиц. Средства, образующие комплексы с олигонуклеотидами, включают в себя полиаминокислоты, полиимины, полиакрилаты,полиалкилакрилаты, полиоксэтаны, полиалкилцианоакрилаты, желатины в катионной форме, альбумины, крахмалы, акрилаты, полиэтиленгликоли (ПЭГ) и крахмалы; полиалкилцианоакрилаты; ДЭАЭдериватизированные полиимины, поллуланы, целлюлозы и крахмалы. Особенно благоприятными комплексообразующими средствами являются хитозан, N-триметилхитозан, поли-L-лизин, полигистидин,полиорнитин, полиспермины, протамин, поливинилпиридин, политиодиэтиламинометилэтилен П(ТДАЭ)(ПЛГК) (PLGA), альгинат и полиэтиленгликоль (ПЭГ). Композиции и средства для парентерального, внутриоболочечного или внутрижелудочкового введения могут включать в себя стерильные водные растворы, которые могут также содержать буферы, разбавители и другие приемлемые добавки, такие как, без ограничения, усилители проникновения, соединения-носители и другие фармацевтически приемлемые носители или наполнители. Фармацевтические композиции согласно изобретению включают в себя, без ограничения, растворы,эмульсии или липосомные препараты. Указанные композиции могут быть получены на основе множества компонентов, которые включают в себя, без ограничения, предварительно обработанные жидкости,самоэмульгирующиеся твердые вещества и самоэмульгирующиеся полутвердые вещества. Фармацевтические средства согласно изобретению, которые могут быть представлены в удобной для применения стандартной дозированной форме, могут быть получены по традиционным методикам,известным в фармацевтической отрасли. Такие методики включают в себя стадию приведения в контакт активных ингредиентов с фармацевтическим(ими) носителем(ями) или наполнителем(ями). В основном указанные композиции получают посредством равномерного и тщательного приведения в контакт активных ингредиентов с жидкими носителями или тонкоизмельченными твердыми носителями, или обеими формами, с последующим, при необходимости, встряхиванием полученного продукта. Композиции согласно изобретению могут быть изготовлены с получением любой из многих возможных дозированных форм, таких как, без ограничения, таблетки, капсулы, гель-капсулы, жидкие сиропы,мягкие гели, суппозитории и клизмы. Композиции согласно изобретению могут быть также введены в состав таких форм, как суспензии в водных, неводных или смешанных средах. Водные суспензии могут также содержать вещества, которые повышают вязкость суспензии, включающие в себя, например, натрийкарбоксиметилцеллюлозу, сорбит и/или декстран. Суспензия может также содержать стабилизаторы. В одном варианте осуществления настоящего изобретения рассматриваемые в нем фармацевтические композиции могут быть изготовлены и далее применяться в виде пенных продуктов. Фармацевтические пенки включают в себя композиции, такие как, без ограничения, эмульсии, микроэмульсии, кремы,желе и липосомы. Будучи по природе в основном близкими, данные композиции отличаются по компонентам и по консистенции конечного продукта. Способы получения таких композиций и препаратов в основном известны специалистам в области фармацевтики и изготовлении препаратов и они могут применяться при получении композиций согласно изобретению. Эмульсии Средства и композиции согласно изобретению могут быть также приготовлены и сформированы в виде эмульсий. В типичном случае эмульсии представляют собой гетерогенные системы, в которых один жидкий компонент диспергирован в другом в виде капелек, обычно превышающих в диаметре 0,1 мкмYork, N.Y., vol. 1, p. 199; Rosoff, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.),1988, Marcel Dekker, Inc., New York, N.Y., vol. 1, p. 245; Block in Pharmaceutical Dosage Forms, Lieberman,Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., vol. 2, p. 335; Higuchi et al., in Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, Pa., 1985, p. 301). Эмульсии чаще всего представляют собой двухфазные системы, включающие две несмешивающихся жидких фазы, тщательно перемешанные и диспергированные друг в друге. В основном эмульсии могут представлять собой вариант
МПК / Метки
МПК: C12N 15/11
Метки: связанные, последовательностей, антивирусные, олигонуклеотиды, комплементарностью
Код ссылки
<a href="https://eas.patents.su/30-8940-antivirusnye-oligonukleotidy-ne-svyazannye-s-komplementarnostyu-posledovatelnostejj.html" rel="bookmark" title="База патентов Евразийского Союза">Антивирусные олигонуклеотиды, не связанные с комплементарностью последовательностей</a>
Предыдущий патент: Производные никотинамида, полезные в качестве ингибиторов pde4
Следующий патент: Способ получения тиоуксусной кислоты и её солей


































