Замещённые в положении 6 индолиноновые производные, их получение и их применение в качестве лекарственных средств
Номер патента: 8623
Опубликовано: 29.06.2007
Авторы: Хильберг Франк, Хеккель Армин, Клей Йорг, Тонч-Грунт Ульрике, Рот Геральд Юрген, Ван-Мэл Якобус, Леманн-Линтц Торстен
Формула / Реферат
1. Соединения общей формулы
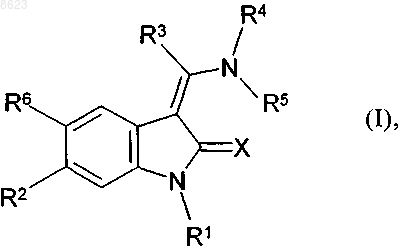
в которой
X обозначает атом кислорода,
R1 обозначает атом водорода,
R2 обозначает атом фтора, хлора либо брома или цианогруппу,
R3 обозначает фенильную группу, замещенную С1-С2алкилкарбониламиногруппой, карбокси-С1-С3алкилом, карбокси-С1-С4алкоксигруппой, С1-С4алкоксикарбонил-С1-С3алкилом, С1-С4алкоксикарбонил-С1-С3алкоксигруппой, аминокарбонил-С1-С3алкилом, (С1-С2алкиламино)карбонил-С1-С3алкилом, ди(С1-С2алкил)аминокарбонил-С1-С3алкилом, (С1-С2алкилкарбонил)амино-С1-С3алкилом, (С1-С4алкоксикарбонил)амино-С1-С3алкилом, (фенилкарбонил)амино-С1-С3алкилом, (С3-С6-циклоалкилкарбонил)амино-С1-С3алкилом, (С3-С6-циклоалкил-С1-С3алкилкарбонил)амино-С1-С3алкилом, (фенилкарбонил)амино-С1-С3алкилом, (тиофен-2-илкарбонил)амино-С1-С3алкилом, (фуран-2-илкарбонил)амино-С1-С3алкилом, (фенил-С1-С3алкилкарбонил)амино-С1-С3алкилом, (2-(С1-С4алкокси)бензоилкарбонил)амино-С1-С3алкилом, (пиридин-2-илкарбонил)амино-С1-С3алкилом, (пиридин-3-илкарбонил)амино-С1-С3алкилом, (пиридин-4-илкарбонил)амино-С1-С3алкилом, С1-С3алкилпиперазин-1-илкарбонил-С1-С3алкилом, аминокарбонил-С1-С3алкенилом, (С1-С3алкиламино)карбонил-С2-С3алкенилом, ди(С1-С3алкил)аминокарбонил-С2-С3алкенилом или С1-С4алкоксикарбонил-С2-С3алкенилом,
R4 обозначает фенильную группу или фенильную группу, монозамещенную замещенной в концевом положении аминогруппой, гуанидиногруппой, моно- либо ди(С1-С2алкил)аминогруппой, N-[w-ди(С1-С3алкил)амино-С2-С3алкил]-N-(С1-С3алкил)аминогруппой, N-метил-(С3-С4алкил)аминогруппой, N-(С1-С3алкил)-N-бензиламиногруппой, N-(С1-С4алкоксикарбонил)аминогруппой, N-(С1-С4алкоксикарбонил)-С1-С4алкиламиногруппой, 4-(С1-С3алкил)пиперазин-1-илом, имидазол-1-илом, пирролидин-1-илом, азетидин-1-илом, морфолин-4-илом, пиперазин-1-илом, тиоморфолин-4-илом С1-С3алкильной группой или монозамещенную ди(С1-С3алкил)амино-(С1-С3алкил)сульфонилом, 2-[ди(С1-С3алкил)амино]этоксигруппой, 4-(С1-С3алкил)пиперазин-1-илкарбонилом, {w-[ди(С1-С3алкил)амино]-(С2-С3алкил)}-N-(С1-С3алкил)аминокарбонилом, 1-(С1-С3алкил)имидазол-2-илом, (С1-С3алкил)сульфонилом или группой формулы
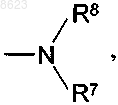
в которой
R7 представляет собой С1-С2алкил, С1-С2алкилкарбонил, ди(С1-С2алкил)аминокарбонил-С1-С3алкил или С1-С3алкилсульфонил и
R8 представляет собой С1-С3алкил, w-[ди(С1-С2алкил)амино]-С2-С3алкил, w-[моно(С1-С2алкил)амино]-С2-С3алкил либо замещенную в концевом положении ди(С1-С2алкил)аминогруппой, пиперазин-1-илом или 4-(С1-С3алкил)пиперазин-1-илом (С1-С3алкил)карбонильную, (С4-С6алкил)карбонильную или карбонил(С1-С3алкильную) группу, при этом все присутствующие в остатке R4 диалкиламиногруппы могут быть также представлены в кватернизованной форме, например в виде N-метил-(N,N-диалкил)аммониевой группы, где противоион предпочтительно выбран из иодида, хлорида, бромида, метилсульфоната, пара-толуолсульфоната и трифторацетата,
R5 обозначает атом водорода и
R6 обозначает атом водорода,
при этом под вышеуказанными алкильными группами подразумеваются линейные и разветвленные алкильные группы, в которых от одного до трех атомов водорода дополнительно могут быть заменены на атом(-ы) фтора, и помимо этого присутствующая карбокси-, амино- или иминогруппа может быть замещена отщепляемым in vivo остатком, соответственно может быть представлена в виде пролекарственного остатка, например в виде переводимой in vivo в карбоксигруппу группы или в виде переводимой in vivo в имино- или аминогруппу группы,
их таутомеры, энантиомеры, диастереомеры, их смеси и их соли.
2. Соединения общей формулы I по п.1, в которых
X, R1, R2, R4, R5 и R6 имеют указанные в п.1 значения, a R3 обозначает фенильную группу, замещенную карбокси-С1-С3алкилом или С1 -С4алкоксикарбонил-С1-С3алкилом.
3. Соединения общей формулы I по одному из пп.1, 2, в которых X, R1, R3, R4, R5 и R6 имеют указанные в пп.1, 2 значения, a R2 обозначает атом фтора или хлора.
4. Соединения общей формулы I по п.1, выбранные из группы, включающей
(а) 3-Z-[1-(4-диметиламинометиланилино)-1-(3-(2-карбоксиэтил)фенил)метилен]-6-хлор-2-индолинон,
(б) 3-Z-[l-(4-диметиламинометиланилино)-1-(4-(2-карбоксиэтил)фенил)метилен]-6-фтор-2-индолинон,
(в) 3-Z-[1-(4-диметиламинометиланилино)-1-(3-(2-карбоксиэтил)фенил)метилен]-6-фтор-2-индолинон,
(г) 3-Z-[1-(4-(N-(4-метилпиперазин-1-илметилкарбонил)-N-метиламино)анилино)-1-(4-(2-карбоксиэтил)фенил)метилен]-6-фтор-2-индолинон,
(д) 3-Z-[1-(4-(N-(2-димeтилaминoэтил)-N-мeтилcyльфoнилaминo)aнилинo)-1-(4-(2-карбоксиэтил)фенил)метилен]-6-фтор-2-индолинон,
(е) 3-Z-[1-(4-(N-(3-диметиламинопропил)-N-ацетиламино)анилино)-1-(4-(2-карбоксиэтил)фенил)метилен]-6-фтор-2-индолинон,
(ж) 3-Z-[1-(4-(1-метилимидазол-2-ил)анилино)-1-(4-(2-карбоксиэтил)фенил)метилен]-6-фтор-2-индолинон,
(з) 3-Z-[1-(4-(N-(диметиламинометилкарбонил)-N-метиламино)анилино)-1-(4-(2-карбоксиэтил)фенил)метилен]-6-фтор-2-индолинон,
(и) 3-Z-[1-(4-(N-(2-диметиламиноэтилкарбонил)-N-метиламино)анилино)-1-(4-(2-карбоксиэтил)фенил)метилен]-6-фтор-2-индолинон,
(к) 3-Z-[1-(4-(пирролидин-1-илметил)анилино)-1-(4-(2-карбоксиэтил)фенил)метилен]-6-фтор-2-индолинон,
(л) 3-Z-[1-(4-(диэтиламинометил)анилино)-1-(4-(2-карбоксиэтил)фенил)метилен]-6-фтор-2-индолинон,
(м) 3-Z-[1-(4-(2-диметиламиноэтил)анилино)-1-(4-(2-карбоксиэтил)фенил)метилен]-6-хлор-2-индолинон,
(н) 3-Z-[1-(4-димeтилaминoмeтилaнилинo)-l-(4-(2-карбоксиэтил)фенил)метилен]-6-хлор-2-индолинон,
(о) 3-Z-[1-(4-(пирролидин-1-илметил)анилино)-1-(4-(2-карбоксиэтил)фенил)метилен]-6-хлор-2-индолинон,
(п) 3-Z-[1-(4-(пирролидин-1-илметил)анилино)-1-(4-(2-карбоксиэтил)фенил)метилен]-6-бром-2-индолинон,
(р) 3-Z-[1-(4-(диметиламинометил)анилино)-1-(4-(2-карбоксиэтил)фенил)метилен]-6-бром-2-индолинон,
(с) 3-Z-[1-(4-(диэтиламинометил)анилино)-1-(4-(2-карбоксиэтил)метилен)]-6-бром-2-индолинон,
(т) 3-Z-[1-(4-диметиламинометиланилино)-1-(4-(2-этоксикарбонилэтил)фенил)метилен]-6-фтор-2-индолинон, а также их соли.
5. 3-Z-[1-(4-Диметиламинометиланилино)-1-(4-(2-карбоксиэтил)фенил)метилен]-6-фтор-2-индолинон и его соли.
6. Физиологически совместимые соли соединений по любому из пп.1-5.
7. Лекарственное средство, содержащее соединение общей формулы I по любому из пп.1-5 или физиологически совместимую соль по п.6 и необязательно один или несколько инертных носителей и/или разбавителей.
8. Применение соединения общей формулы I по любому из пп.1-5 или физиологически совместимой соли по п.6 для получения лекарственного средства, пригодного для лечения избыточной или аномальной пролиферации клеток.
9. Способ получения лекарственного средства по п.7, отличающийся тем, что соединение общей формулы I по любому из пп.1-5 или физиологически совместимую соль по п.6 не химическим путем объединяют с одним или несколькими инертными носителями и/или разбавителями.
10. Способ получения соединений по любому из пп.1-5, отличающийся тем, что
а) соединение общей формулы

в которой остатки Z1 и R3 необязательно могут меняться положениями, X, R2, R3 и R6 имеют указанные в п.1 значения, R1' имеет указанные выше для R1 значения или обозначает защитную группу для атома азота лактамовой группы, при этом R1 может также представлять собой необязательно образованную спейсером связь с твердой фазой, и Z1 обозначает атом галогена, гидрокси-, алкокси- или арилалкоксигруппу, например атом хлора либо брома, метокси-, этокси- или бензилоксигруппу, подвергают взаимодействию с амином общей формулы
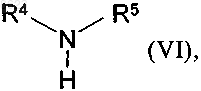
в которой R4 и R5 имеют вышеуказанные значения, и затем при необходимости отщепляют использовавшуюся защитную группу для атома азота лактамовой группы или полученное таким путем соединение от твердой фазы,
б) для получения соединения общей формулы I, в которой R3 обозначает замещенную карбокси-С2-С3алкенилом, аминокарбонил-С2-С3алкенилом, (С1-С3алкиламино)карбонил-С2-С3алкенилом, ди(С1-С3алкиламино)карбонил-С2-С3алкенилом или С1-С4алкоксикарбонил-С2-С3алкенилом фенильную или нафтильную группу, соединение общей формулы

в которой R2, R4, R5, R6 и X имеют указанные в п.1 значения, R1' имеет указанные выше для R1 значения или обозначает защитную группу для атома азота лактамовой группы, при этом R1' может также представлять собой необязательно образованную спейсером связь с твердой фазой, и Z3 обозначает уходящую группу, например атом галогена либо алкильную или арилсульфонилоксигруппу, в частности атом хлора, брома или иода либо метилсульфонилокси-, этилсульфонилокси-, n-толуолсульфонилокси- или трифторметансульфонилоксигруппу, подвергают взаимодействию с алкеном общей формулы
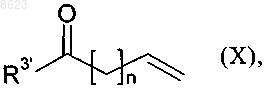
в которой R3' обозначает амино-, (С1-С3алкиламино)-, ди(С1-С3алкиламино)- или С1-С4алкоксигруппу, а n обозначает число 0 или 1,
в) для получения соединения общей формулы I, в которой R3 обозначает замещенную карбокси-С1-С3алкилом, С1-С4алкоксикарбонил-С1-С3алкилом, аминокарбонил-С1-С3алкилом, (С1-С3алкиламино)карбонил-С1-С3алкилом или ди(С1-С3алкил)аминокарбонил-С1-С3алкилом фенильную или нафтильную группу, соединение общей формулы
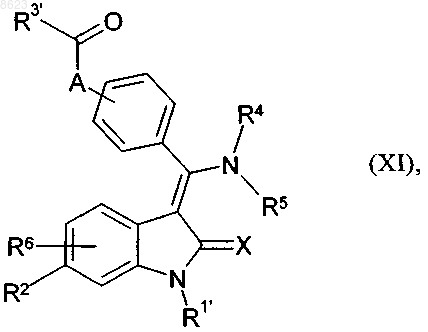
в которой R2 , R4 , R5 , R6 и X имеют указанные в п.1 значения, R1' имеет указанные выше для R1 значения или обозначает защитную группу для атома азота лактамовой группы, при этом R1' может также представлять собой необязательно образованную спейсером связь с твердой фазой, А обозначает С2-С3алкенил и R3' обозначает гидрокси-, С1-С4алкокси-, амино-, (С1-С3алкиламино)- или ди-(С1-С3алкил)аминогруппу, подвергают гидрированию и затем при необходимости аналогично варианту (а) отщепляют использовавшуюся защитную группу для атома азота лактамовой группы или полученное соединение от твердой фазы и после этого при необходимости алкоксикарбонильную группу переводят путем гидролиза в соответствующее карбоксисоединение, или амино- или алкиламиногруппу переводят путем гидроалкилирования в соответствующее алкиламино- или диалкиламиносоединение, или диалкиламиногруппу переводят путем алкилирования в соответствующее триалкиламмониевое соединение, или амино- или алкиламиногруппу переводят путем ацилирования или сульфирования в соответствующее ацильное либо сульфонильное соединение, или карбоксигруппу переводят путем этерификации или амидирования в соответствующий сложный эфир либо соответствующее аминокарбонильное соединение, или нитрогруппу переводят путем восстановления в соответствующее аминосоединение, или цианогруппу переводят путем восстановления в соответствующее аминометильное соединение, или арилалкилоксигруппу переводят путем обработки кислотой в соответствующее гидроксисоединение, или алкоксикарбонильную группу переводят путем омыления в соответствующее карбоксисоединение, или замещенную аминогруппой, алкиламиногруппой, аминоалкилом или N-алкиламиногруппой фенильную группу переводят взаимодействием с соответствующим передающим амидиногруппу соединением или взаимодействием с соответствующим нитрилом в соответствующее гуанидиносоединение общей формулы I.
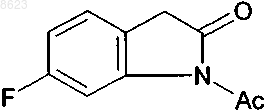
11. 1-Ацетил-6-фтор-2-индолинон формулы
Текст
008623 Настоящее изобретение относится к новым замещенным в положении 6 индолиноновым производным общей формулы их таутомерам, энантиомерам, диастереомерам, их смесям и их солям, прежде всего их физиологически совместимым солям, обладающим ценными фармакологическими свойствами, к содержащим эти соединения лекарственным средствам, к их применению и к способу их получения. Вышеуказанные соединения общей формулы I обладают ценными фармакологическими свойствами, прежде всего ингибирующим действием на различные киназы, главным образом рецепторные тирозинкиназы, такие как VEGFR1, VEGFR2, VEGFR3, PDGFR, PDGFR, FGFR1, FGFR3, EGFR, HER2, cKit, IGF1R, HGFR и Flt-3, а также на пролиферацию культивируемых клеток человека, прежде всего эндотелиальных клеток, например при ангиогенезе (развитии кровеносных сосудов), и на пролиферацию других клеток, прежде всего опухолевых клеток. В соответствии с этим объектом настоящего изобретения являются представленные выше соединения общей формулы I, обладающие ценными фармакологическими свойствами, а также содержащие эти фармакологически активные соединения лекарственные средства, применение этих соединений и способ их получения. Объектом настоящего изобретения являются, кроме того, физиологически совместимые соли предлагаемых в изобретении соединений, содержащие эти соединения лекарственные средства, которые дополнительно необязательно содержат один или несколько инертных носителей и/или разбавителей, а также применение подобных соединений для получения лекарственного средства, пригодного прежде всего для лечения избыточной или аномальной пролиферации клеток. Объектом настоящего изобретения являются далее способы получения лекарственных средств, отличающиеся прежде всего тем, что предлагаемые в изобретении соединения или их физиологически совместимые соли объединяют с одним или несколькими инертными носителями и/или разбавителями.I. В приведенной выше общей формуле IX обозначает атом кислорода,R1 обозначает атом водорода,R2 обозначает атом фтора, хлора либо брома или цианогруппу,R3 обозначает фенильную группу или однозамещенную атомом фтора, хлора, брома либо иода илиC1-С 3 алкоксигруппой фенильную группу, при этом указанные незамещенные, а также однозамещенные фенильные группы дополнительно могут быть замещены в положении 3 или 4 идентичными или различными заместителями, выбранными из группы, включающей атом фтора, атом хлора, атом брома, цианогруппу, C1-С 3 алкоксигруппу, С 1-С 2 алкилкарбониламиногруппу, циано-С 1-С 3 алкил, карбокси-С 1-С 3 алкил,карбокси-С 1-С 4 алкоксигруппу, карбокси-С 1-С 3 алкиламиногруппу, карбокси-С 1-С 3 алкил-N-(С 1-С 3 алкил)аминогруппу, С 1-С 4 алкоксикарбонил-С 1-С 3 алкил, С 1-С 4 алкоксикарбонил-С 1-С 3 алкоксигруппу, С 1 С 4 алкоксикарбонил-С 1-С 3 алкиламиногруппу,С 1-С 4 алкоксикарбонил-С 1-С 3 алкил-N-(С 1-С 3 алкил)аминогруппу, амино-C1-С 3 алкил, аминокарбонил-С 1-С 3 алкил, (С 1-С 2 алкиламино)карбонил-С 1-С 3 алкил,ди(С 1-С 2 алкил)аминокарбонил-С 1-С 3 алкил, (С 1-С 2 алкилкарбонил)амино-С 1-С 3 алкил, (С 1-С 4 алкоксикарбонил)амино-С 1-С 3 алкил,(С 3-С 6 алкилкарбонил)амино-С 1-С 3 алкил,(фенилкарбонил)амино-С 1 С 3 алкил, (С 3-С 6 циклоалкилкарбонил)амино-С 1-С 3 алкил, (С 3-С 6 циклоалкил-С 1-С 3 алкилкарбонил)аминоС 1-С 3 алкил, (фенилкарбонил)амино-С 1-С 3 алкил, (тиофен-2-илкарбонил)амино-С 1-С 3 алкил, (фуран-2 илкарбонил)амино-С 1-С 3 алкил,(фенил-С 1-С 3 алкилкарбонил)амино-С 1-С 3 алкил,(2-(С 1-С 4 алкокси)бензоилкарбонил)амино-С 1-С 3 алкил, (пиридин-2-илкарбонил)амино-С 1-С 3 алкил, (пиридин-3-илкарбонил)амино-С 1-С 3 алкил, (пиридин-4-илкарбонил)амино-С 1-С 3 алкил, С 1-С 3 алкилпиперазин-1-илкарбонил-С 1-С 3 алкил, карбокси-С 2-С 3 алкенил, аминокарбонил-С 2-С 3 алкенил, (С 1-С 3 алкиламино)карбонилС 2-С 3 алкенил, ди(С 1-С 3 алкил)аминокарбонил-С 2-С 3 алкенил и С 1-С 4 алкоксикарбонил-С 2-С 3 алкенил;R4 обозначает фенильную группу или фенильную группу, монозамещенную замещенной в концевом положении аминогруппой, гуанидиногруппой, моно- либо ди(С 1-С 2 алкил)аминогруппой, N-[ди(С 1-С 3 алкил)амино-С 2-С 3 алкил]-N-(С 1-С 3 алкил)аминогруппой, N-метил-(С 3-С 4 алкил)аминогруппой, N(С 1-С 3 алкил)-N-бензиламиногруппой,N-(С 1-С 4 алкоксикарбонил)аминогруппой,N-(С 1-С 4 алкоксикарбонил)-С 1-С 4 алкиламиногруппой, 4-(С 1-С 3 алкил)пиперазин-1-илом, имидазол-1-илом, пирролидин-1 илом, азетидин-1-илом, морфолин-4-илом, пиперазин-1-илом, тиоморфолин-4-илом С 1-С 3 алкильной группой или монозамещенную ди(С 1-С 3 алкил)амино-(С 1-С 3 алкил)сульфонилом,2-[ди(С 1 С 3 алкил)амино]этоксигруппой, 4-(С 1-С 3 алкил)пиперазин-1-илкарбонилом, -[ди(С 1-С 3 алкил)амино](С 2-С 3 алкил)-N-(С 1-С 3 алкил)аминокарбонилом, 1-(С 1-С 3 алкил)имидазол-2-илом, (С 1-С 3 алкил)суль-1 008623 фонилом или группой формулыR8 представляет собой С 1-С 3 алкил,-[ди(С 1-С 2 алкил)амино]-С 2-С 3 алкил,-[моно(С 1 С 2 алкил)амино]-С 2-С 3 алкил либо замещенную в концевом положении ди(С 1-С 2 алкил)аминогруппой, пиперазин-1-илом или 4-(С 1-С 3 алкил)пиперазин-1-илом (С 1-С 3 алкил)карбонильную, (С 4-С 6 алкил)карбонильную или карбонил(С 1-С 3 алкильную)группу,при этом все присутствующие в остатке R4 диалкиламиногруппы могут быть также представлены в кватернизованной форме, например в виде N-метил-(N,N-диалкил)аммониевой группы, где противоион предпочтительно выбран из иодида, хлорида, бромида, метилсульфоната, пара-толуолсульфоната и трифторацетата,R5 обозначает атом водорода иR6 обозначает атом водорода,при этом под вышеуказанными алкильными группами подразумеваются линейные и разветвленные алкильные группы, в которых от одного до трех атомов водорода дополнительно могут быть заменены на атом(-ы) фтора, и помимо этого присутствующая карбокси-, амино- или иминогруппа может быть замещена отщепляемым in vivo остатком, соответственно может быть представлена в виде пролекарственного остатка, например в виде переводимой in vivo в карбоксигруппу группы или в виде переводимой invivo в имино- или аминогруппу группы,при этом к соединениям формулы I относятся также их таутомеры, энантиомеры, диастереомеры,их смеси и их соли.II. К особенно предпочтительным соединениям приведенной выше общей формулы I относятся соединения, в которых X, R1 ,R5 и R6 имеют указанные выше в п.I значения и в которых далееII.i. R2 и R4 имеют указанные выше в п.I значения, аR3 обозначает фенильную группу или однозамещенную атомом фтора, хлора, брома либо иода или С 1-С 3 алкоксигруппой фенильную группу, при этом указанные незамещенные, а также однозамещенные фенильные группы дополнительно могут быть замещены в положении 3 или 4 идентичными или различными заместителями, выбранными из группы, включающей атом фтора, атом хлора, атом брома, цианогруппу, С 1-С 3 алкоксигруппу, С 1-С 2 алкилкарбониламиногруппу, циано-С 1-С 3 алкил, карбокси-С 1-С 3 алкил,карбокси-С 1-С 4 алкоксигруппу, карбокси-С 1-С 3 алкиламиногруппу, карбокси-С 1-С 3 алкил-N-(С 1-С 3 алкил)аминогруппу, С 1-С 4 алкоксикарбонил-С 1-С 3 алкил, С 1-С 4 алкоксикарбонил-С 1-С 3 алкоксигруппу, С 1 С 4 алкоксикарбонил-С 1-С 3 алкиламиногруппу, С 1-С 4 алкоксикарбонил-С 1-С 3 алкил-N-(С 1-С 3 алкил)аминогруппу, амино-С 1-С 3 алкил, аминокарбонил-С 1-С 3 алкил, (С 1-С 2 алкиламино)карбонил-С 1-С 3 алкил, ди-(С 1(С 1-С 2 алкилкарбонил)амино-С 1-С 3 алкил,(С 1-С 4 алкоксикарбоС 2 алкил)аминокарбонил-С 1-С 3 алкил,нил)амино-С 1-С 3 алкил, (С 1-С 6 алкилкарбонил)амино-С 1-С 3 алкил, (фенилкарбонил)амино-С 1-С 3 алкил, (С 3 С 6-циклоалкилкарбонил)амино-С 1-С 3 алкил,(С 3-С 6 циклоалкил-С 1-С 3 алкилкарбонил)амино-С 1-С 3 алкил,(фенилкарбонил)амино-С 1-С 3 алкил, (тиофен-2-илкарбонил)амино-С 1-С 3 алкил, (фуран-2-илкарбонил)амино-С 1-С 3 алкил,(фенил-С 1-С 3 алкилкарбонил)амино-С 1-С 3 алкил,(2-(С 1-С 4 алкокси)бензоилкарбонил)амино-С 1-С 3 алкил, (пиридин-2-илкарбонил)амино-С 1-С 3 алкил, (пиридин-3-илкарбонил)амино-С 1 С 3 алкил, (пиридин-4-илкарбонил)амино-С 1-С 3 алкил, С 1-С 3 алкилпиперазин-1-илкарбонил-С 1-С 3 алкил,карбокси-С 2-С 3 алкенил, аминокарбонил-С 2-С 3 алкенил, (С 1-С 3 алкиламино)карбонил-С 2-С 3 алкенил, ди(С 1-С 3 алкил)аминокарбонил-С 2-С 3 алкенил и С 1-С 4 алкоксикарбонил-С 2-С 3 алкенил,II.ii. R2 и R4 имеют указанные выше в п.I значения, аR3 обозначает фенильную группу, замещенную С 1-С 2 алкилкарбониламиногруппой, карбокси-С 1 С 3 алкилом,карбокси-С 1-С 4 алкоксигруппой,С 1-С 4 алкоксикарбонил-С 1-С 3 алкилом,С 1-С 4 алкоксикарбонил-С 1-С 3 алкоксигруппой,аминокарбонил-С 1-С 3 алкилом,(С 1-С 2 алкиламино)карбонил-С 1 С 3 алкилом, ди-(С 1-С 2 алкил)аминокарбонил-С 1-С 3 алкилом, (С 1-С 2 алкилкарбонил)амино-С 1-С 3 алкилом,(С 1-С 4 алкоксикарбонил)амино-С 1-С 3 алкилом,(фенилкарбонил)амино-С 1-С 3 алкилом,(С 3-С 6 циклоалкилкарбонил)амино-С 1-С 3 алкилом, (С 3-С 6 циклоалкил-С 1-С 3 алкилкарбонил)амино-С 1-С 3 алкилом, (фенилкарбонил)амино-С 1-С 3 алкилом,(тиофен-2-илкарбонил)амино-С 1-С 3 алкилом,(фуран-2-илкарбонил)амино-С 1-С 3 алкилом,(фенил-С 1-С 3 алкилкарбонил)амино-С 1-С 3 алкилом,(2-(С 1-С 4 алкокси)бензоилкарбонил)амино-С 1-С 3 алкилом, (пиридин-2-илкарбонил)амино-С 1-С 3 алкилом, (пиридин-3-илкарбонил)амино-С 1-С 3 алкилом,(пиридин-4-илкарбонил)амино-С 1-С 3 алкилом,С 1-С 3 алкилпиперазин-1 илкарбонил-С 1-С 3 алкилом,аминокарбонил-С 2-С 3 алкенилом,(С 1-С 3 алкиламино)карбонил-С 2-С 3 алкенилом, ди-(С 1-С 3 алкил)аминокарбонил-С 2-С 3 алкенилом или С 1-С 4 алкоксикарбонил-С 2-С 3 алкенилом,II.iii.R2 и R4 имеют указанные выше в п.I значения, аR3 обозначает замещенную карбокси-С 1-С 3 алкилом или С 1-С 4 алкоксикарбонил-С 1-С 3 алкилом фе-2 008623 нильную группу,II.iv. R3 и R4 имеют указанные выше в п.I значения, аR2 обозначает атом фтора или хлора,II.v. R2 и R3 имеют указанные выше в п.I значения, аR4 обозначает фенильную группу или фенильную группу, монозамещенную замещенной в концевом положении аминогруппой, гуанидиногруппой, моно- либо ди-(С 1-С 2 алкил)аминогруппой, N-[-ди(С 1-С 3 алкил)амино-С 2-С 3 алкил]-N-(С 1-С 3 алкил)аминогруппой, N-метил-(С 3-С 4 алкил)аминогруппой, N(С 1-С 3 алкил)-N-бензиламиногруппой,N-(С 1-С 4 алкоксикарбонил)аминогруппой,N-(С 1-С 4 алкоксикарбонил)-С 1-С 4 алкиламиногруппой, 4-(С 1-С 3 алкил)пиперазин-1-илом, имидазол-1-илом, пирролидин-1 илом, азетидин-1-илом, морфолин-4-илом, пиперазин-1-илом, тиоморфолин-4-илом С 1-С 3 алкильной группой или монозамещенную ди-(С 1-С 3 алкил)амино-(С 1-С 3 алкил)сульфонилом,2-[ди-(С 1 С 3 алкил)амино]этоксигруппой, 4-(С 1-С 3 алкил)пиперазин-1-илкарбонилом, -[ди-(С 1-С 3 алкил)амино](С 2-С 3 алкил)-N-(С 1-С 3 алкил)аминокарбонилом, 1-(С 1-С 3 алкил)имидазол-2-илом, (С 1-С 3 алкил)сульфонилом или группой формулыR8 представляет собой С 1-С 3 алкил, -[ди-(С 1-С 2 алкил)амино]-С 2-С 3 алкил, -[моно-(С 1 С 2 алкил)амино]-С 2-С 3 алкил либо замещенную в концевом положении ди-(С 1-С 2 алкил)аминогруппой,пиперазин-1-илом или 4-(С 1-С 3 алкил)пиперазин-1-илом(С 1-С 3 алкил)карбонильную,(С 4 С 6 алкил)карбонильную или карбонил-С 1-С 3 алкильную группу,при этом все присутствующие в остатке R4 диалкиламиногруппы могут быть также представлены в кватернизованной форме, например в виде N-метил-(N,N-диалкил)аммониевой группы, где противоион предпочтительно выбран из иодида, хлорида, бромида, метилсульфоната, пара-толуолсульфоната и трифторацетата.III. Среди особенно предпочтительных соединений приведенной выше общей формулы I особо следует выделить подгруппу соединений, в которых:III.i. X, R1, R2, R5 и R6 имеют указанные выше в п.I значения,R3 имеет указанные выше в п.II.i значения, aR4 имеет указанные выше в п.II.v значения,III.ii. X, R1 , R2 , R5 и R6 имеют указанные выше в п.I значения,R3 имеет указанные выше в п. II.ii значения, aR4 имеет указанные выше в п.II.v значения,III.iii. X, R1, R2, R5 и R6 имеют указанные выше в п.I значения,R3 имеет указанные выше в п.II.ii. значения, aR4 имеет указанные выше в п.II.v значения,III.iv. X, R1, R5 и R6 имеют указанные выше в п.I значения,R2 имеет указанные выше в п. II.iv значения,R3 имеет указанные выше в п. II.i, II.ii или II.iii значения, aR4 имеет указанные выше в п.II.v значения. Другую предпочтительную группу предпочтительных соединений приведенной выше общей формулы I образуют соединения, в которых X обозначает атом кислорода,R1 обозначает атом водорода,R2 обозначает атом фтора, хлора или брома либо цианогруппу,R3 обозначает фенильную группу или однозамещенную атомом фтора, хлора, брома либо иода или С 1-С 3 алкоксигруппой фенильную группу, при этом указанные незамещенные, а также однозамещенные фенильные группы дополнительно могут быть замещены в положении 3 или 4 идентичными или различными заместителями, выбранными из группы, включающей атом фтора, атом хлора, атом брома, С 1 С 3 алкоксигруппу, С 1-С 3 алкилкарбониламиногруппу, карбокси-С 1-С 3 алкил, аминокарбонил-С 1-С 3 алкил,(С 1-С 2 алкиламино)карбонил-С 1-С 3 алкил, ди-(С 1-С 2 алкил)аминокарбонил-С 1-С 3 алкил, (С 1-С 2 алкилкарбонил)амино-С 1-С 3 алкил и (фенилкарбонил)амино-С 1-С 3 алкил,R4 обозначает фенильную группу, замещенную замещенной в концевом положении ди-(С 1 С 2 алкил)аминогруппой С 1-С 3 алкильной группой либо группой формулыR8 представляет собой С 1-С 3 алкил или -[ди-(С 1-С 2 алкил)амино]-С 2-С 3 алкил либо замещенную в концевом положении ди-(С 1-С 2 алкил)аминогруппой, пиперазиногруппой или 4-(С 1-С 3 алкил)пиперазин-1 илом С 1-С 3 алкилкарбонильную группу,R5 обозначает атом водорода иR6 обозначает атом водорода,при этом под вышеуказанными алкильными группами подразумеваются линейные и разветвленные алкильные группы, в которых от одного до трех атомов водорода дополнительно могут быть заменены на атом(-ы) фтора, и помимо этого присутствующая карбокси-, амино- или иминогруппа может быть замещена отщепляемым in vivo остатком, их таутомеры, энантиомеры, диастереомеры, их смеси и их соли. Наиболее предпочтительны следующие соединения общей формулы I:(с) 3-Z-[1-(4-(диэтиламинометил)анилино)-1-(4-(2-карбоксиэтил)метилен)]-6-бром-2-индолинон,при этом, кроме того, присутствующая карбокси-, амино- или иминогруппа может быть замещена отщепляемым in vivo остатком, соответственно может быть представлена в виде пролекарственного остатка, например в виде переводимой in vivo в карбоксигруппу группы или в виде переводимой in vivo в имино- или аминогруппу группы, а также их соли. Под переводимой in vivo в карбоксигруппу группой подразумевается, например, гидроксиметильная группа либо этерифицированная спиртом карбоксигруппа, в которой спиртовой фрагмент предпочтительно представляет собой С 1-С 6 алканол, фенил-С 1-С 3 алканаол, С 3-С 9 циклоалканол, при этом С 5 С 8 циклоалканол дополнительно может быть замещен одной или двумя С 1-С 3 алкильными группами, С 5 С 8 циклоалканол, в котором метиленовая группа в положении 3 или 4 заменена на атом кислорода или на необязательно замещенную С 1-С 3 алкилом, фенил-С 1-С 3 алкилом, фенил-С 1-С 3 алкоксикарбонилом или С 1 С 6 алкилкарбонилом иминогруппу, а циклоалканольный фрагмент дополнительно может быть замещен одной или двумя С 1-С 3 алкильными группами, С 4-С 7 циклоалкенол, С 3-С 5 алкенол, фенил-С 3-С 5 алкенол,С 3-С 5 алкинол или фенил-С 3-С 5 алкинол при условии, что с атомом кислорода не связан атом углерода,несущий двойную или тройную связь, С 3-С 8 циклоалкил-С 1-С 3 алканол, бициклоалканол, который содержит в общей сложности от 8 до 10 атомов углерода и который в бициклоалкильном фрагменте дополнительно может быть замещен одной или двумя С 1-С 3 алкильными группами, 1,3-дигидро-3-оксо-1 изобензфуранол либо спирт формулыRa обозначает С 1-С 8 алкил, С 5-С 7 циклоалкил, фенил или фенил-С 1-С 3 алкил,Rb обозначает атом водорода, С 1-С 3 алкил, С 5-С 7 циклоалкил или фенил иRc обозначает атом водорода или С 1-С 3 алкил, а под отщепляемым in vivo от имино- или аминогруппы остатком подразумевается, например, гидроксигруппа, ацильная группа, такая как бензоил или пиридиноил, или С 1-16 алкилкарбонильная группа, такая как формил, ацетил, пропионил, бутаноил, пентаноил или гексаноил, аллилоксикарбонильная группа, С 1-16 алкоксикарбонильная группа, такая как метоксикарбонил,этоксикарбонил,пропоксикарбонил,изопропоксикарбонил,бутоксикарбонил,трет-4 008623 бутоксикарбонил, пентоксикарбонил, гексилоксикарбонил, октилоксикарбонил, нонилоксикарбонил,децилоксикарбонил, ундецилоксикарбонил, додецилоксикарбонил или гексадецилоксикарбонил, фенилС 1-6 алкоксикарбонильная группа, такая как бензилоксикарбонил, фенилэтоксикарбонил или фенилпропоксикарбонил, С 1-3 алкилсульфонил-С 2-4 алкоксикарбонильная группа, С 1-3 алкокси-С 2-4 алкокси-С 2-4 алкоксикарбонильная группа или группа RaCO-O-(RbCRc)-O-CO, в которойRa обозначает C1-С 8 алкил, С 5-С 7 циклоалкил, фенил или фенил-С 1-С 3 алкил,Rb обозначает атом водорода, С 1-С 3 алкил, С 5-С 7 циклоалкил или фенил иRc обозначает атом водорода, С 1-С 3 алкил или группу RaCO-O-(RbCRc)-O, в которой Ra-Rc имеют указанные выше значения, и в случае отщепляемого in vivo от аминогруппы остатка дополнительно имеется в виду также фталимидогруппа, при этом вышеуказанные сложноэфирные остатки также могут использоваться в качестве переводимой in vivo в карбоксигруппу группы. Предпочтительными пролекарственными остатками, в виде которых может быть представлена карбоксигруппа, являются С 1-С 6 алкоксикарбонильная группа, такая как метоксикарбонил, этоксикарбонил,н-пропилоксилкарбонил, изопропилоксикарбонил, н-бутилоксикарбонил, н-пентилоксикарбонил, нгексилоксикарбонил или циклогексилоксикарбонил, или фенил-С 1-С 3 алкоксикарбонильная группа, такая как бензилоксикарбонил, а пролекарственными остатками, в виде которых может быть представлена имино- или аминогруппа, являются С 1-С 9 алкоксикарбонильная группа, такая как метоксикарбонил, этоксикарбонил, н-пропилоксикарбонил, изопропилоксикарбонил, н-бутилоксикарбонил, н-пентилоксикарбонил, н-гексилоксикарбонил, циклогексилоксикарбонил, н-гептилоксикарбонил, н-октилоксикарбонил или н-нонилоксикарбонил, фенил-С 1-С 3 алкоксикарбонильная группа, такая как бензилоксикарбонил, необязательно замещенная С 1-С 3 алкильной группой фенилкарбонильная группа, такая как бензоил или 4-этилбензоил, пиридиноильная группа, такая как никотиноил, С 1-С 3 алкилсульфонил-n-С 2 С 3 алкоксикарбонильная группа или С 1-С 3 алкокси-С 2-С 3 алкокси-С 1-С 4 алкоксикарбонильная группа, такая как 2-метилсульфонилэтоксикарбонил или 2-(2-этокси)этоксикарбонил. Новые соединения получают согласно изобретению, например, следующими методами, которые в принципе известны из литературы. а) В этом варианте соединение общей формулы в которой остатки Z1 и R3 необязательно могут меняться положениями, X, R2, R3 и R6 имеют указанные выше значения, R1 имеет указанные выше для R1 значения или обозначает защитную группу для атома азота лактамовой группы, при этом R1 может также представлять собой необязательно образованную спейсером связь с твердой фазой, и Z1 обозначает атом галогена, гидрокси-, алкокси- или арилалкоксигруппу, например атом хлора либо брома, метокси-, этокси- или бензилоксигруппу, подвергают взаимодействию с амином общей формулы в которой R4 и R5 имеют вышеуказанные значения, и затем при необходимости отщепляют использовавшуюся защитную группу для атома азота лактамовой группы или полученное таким путем соединение от твердой фазы. В качестве примера защитной группы для атома азота лактамовой группы можно назвать ацетильную, бензоильную, этоксикарбонильную, трет-бутилоксикарбонильную или бензилоксикарбонильную группу, а в качестве примера твердой фазы можно назвать смолу, такую как 4-(2',4'диметоксифениламинометил)феноксисмола, связь с которой преимущественно образована аминогруппой, или представляющую собой n-бензилоксибензиловый спирт смолу, связь с которой преимущественно образована промежуточным членом, таким как 2,5-диметокси-4-гидроксибензильное производное. Описанное выше взаимодействие целесообразно проводить в растворителе, таком как диметилформамид, толуол, ацетонитрил, тетрагидрофуран, диметилсульфоксид, метиленхлорид или их смеси, необязательно в присутствии инертного основания, такого как триэтиламин, N-этилдиизопропиламин или гидрокарбонат натрия, при температуре от 20 до 175 С, при этом в результате переамидирования одновременно может происходить отщепление используемой защитной группы. Если в соединении общей формулы V Z1 обозначает атом галогена, то в этом случае взаимодействие предпочтительно проводить в присутствии инертного основания при температуре от 20 до 120 С. Если же в соединении общей формулы V Z1 обозначает гидрокси-, алкокси- или арилалкоксигруппу, то в этом случае взаимодействие предпочтительно проводить при температуре от 20 до 200 С. Необходимое при определенных условиях последующее отщепление используемой защитной груп-5 008623 пы целесообразно осуществлять либо гидролитическим путем в водном или спиртовом растворителе,например в метаноле/воде, этаноле/воде, изопропаноле/воде, тетрагидрофуране/воде, диоксане/воде, диметилформамиде/воде, метаноле или этаноле, в присутствии гидроксида щелочного металла, такого как гидроксид лития, гидроксид натрия или гидроксид калия, при температуре от 0 до 100 С, предпочтительно от 10 до 50 С, либо, что предпочтительно, путем переамидирования с помощью органического основания, такого как аммиак, бутиламин, диметиламин или пиперидин, в растворителе, таком как метанол, этанол, диметилформамид и их смеси, либо в избыточном количестве используемого амина при температуре от 0 до 100 С, предпочтительно от 10 до 50 С. Отщеплять полученное соединение от используемой твердой фазы предпочтительно с помощью трифторуксусной кислоты и воды при температуре от 0 до 35 С, предпочтительно при комнатной температуре. б) В этом варианте для получения соединения общей формулы I, в которой R3 обозначает замещенную карбокси-С 2-С 3 алкенилом, аминокарбонил-С 2-С 3 алкенилом, (С 1-С 3 алкиламино)карбонил-С 2 С 3 алкенилом, ди(С 1-С 3 алкиламино)карбонил-С 2-С 3 алкенилом или С 1-С 4 алкоксикарбонил-С 2-С 3 алкенилом фенильную или нафтильную группу, соединение общей формулы в которой R2, R4, R5, R6 и X имеют указанные выше значения, R1 имеет указанные выше для R1 значения или обозначает защитную группу для атома азота лактамовой группы, при этом R1' может также представлять собой необязательно образованную спейсером связь с твердой фазой, и Z3 обозначает уходящую группу, например атом галогена либо алкильную или арилсульфонилоксигруппу, в частности атом хлора, брома или иода либо метилсульфонилокси-, этилсульфонилокси-, n-толуолсульфонилокси- или трифторметансульфонилоксигруппу, подвергают взаимодействию с алкеном общей формулы в которой R3 обозначает амино-, (С 1-С 3 алкиламино)-, ди(С 1-С 3 алкиламино)- или С 1-С 4 алкоксигруппу, а n обозначает число 0 или 1. Подобное взаимодействие целесообразно проводить при катализе палладием с использованием, например, ацетата палладия(II), хлорида палладия(II), ацетата бис(трифенилфосфин)палладия(II), хлорида бис(трифенилфосфин)палладия(II), палладия на активированном угле, бис[1,2-бис(дифенилфосфино)этан]палладия(0), дихлор(1,2-бис(дифенилфосфино)этан)палладия(II), тетракистрифенилфосфинпалладия(0), трис(дибензилиденацетон)дипалладия(0), 1,1'-бис(дифенилфосфино)ферроцендихлорпалладия(II) или аддукта трис(дибензилиденацетон)дипалладия(0) и хлороформа, в присутствии основания, такого как триэтиламин, диизопропилэтиламин, карбонат лития, карбонат калия, карбонат натрия,карбонат цезия, и лиганда, такого как трифенилфосфин, три-орто-толилфосфин или три(третбутил)фосфин, в растворителях, таких как ацетонитрил, N-метилпирролидинон, диоксан или диметилформамид и их смеси. Процесс необходимого при определенных условиях последующего отщепления используемой защитной группы для атома азота лактамовой группы или полученного соединения от твердой фазы аналогичен описанному выше для варианта (а). в) В этом варианте для получения соединения общей формулы I, в которой R3 обозначает замещенную карбокси-С 1-С 3 алкилом, С 1-С 4 алкоксикарбонил-С 1-С 3 алкилом, аминокарбонил-С 1-С 3 алкилом, (С 1 С 3 алкиламино)карбонил-С 1-С 3 алкилом или ди(С 1-С 3 алкил)аминокарбонил-С 1-С 3 алкилом фенильную или нафтильную группу, соединение общей формулы в которой R2, R4, R5, R6 и X имеют указанные выше значения, R1' имеет указанные выше для R1 значения-6 008623 или обозначает защитную группу для атома азота лактамовой группы, при этом R1' может также представлять собой необязательно образованную спейсером связь с твердой фазой, А обозначает С 2 С 3 алкенил и R3' обозначает гидрокси-, С 1-С 4 алкокси-, амино-, (С 1-С 3 алкиламино)- или ди-(С 1 С 3 алкил)аминогруппу, подвергают гидрированию. Подобное гидрирование целесообразно проводить путем каталитического гидрирования водородом в присутствии катализатора, такого как палладий на угле или платина, в растворителе, таком как метанол, этанол, этилацетат, диметилформамид, диметилформамид/ацетон или ледяная уксусная кислота,необязательно с добавлением кислоты, такой как соляная кислота, при температуре от 0 до 50 С, предпочтительно, однако, при комнатной температуре, и при давлении водорода от 1 до 7 бар, предпочтительно, однако, от 3 до 5 бар. Процесс необходимого при определенных условиях последующего отщепления используемой защитной группы для атома азота лактамовой группы или полученного соединения от твердой фазы аналогичен описанному выше для варианта (а). Если согласно изобретению получают соединение общей формулы I, содержащее алкоксикарбонильную группу, то это соединение можно перевести путем гидролиза в соответствующее карбоксисоединение, или получают соединение общей формулы I, содержащее амино- или алкиламиногруппу, то такое соединение можно перевести путем гидроалкилирования в соответствующее алкиламино- или диалкиламиносоединение, или получают соединение общей формулы I, содержащее диалкиламиногруппу,то это соединение можно перевести путем алкилирования в соответствующее триалкиламмониевое соединение, или получают соединение общей формулы I, содержащее амино- или алкиламиногруппу, то это соединение можно перевести путем ацилирования или сульфонилирования в соответствующее ацильное или сульфонильное соединение, или получают соединение общей формулы I, содержащее карбоксигруппу, то такое соединение можно перевести путем этерификации или амидирования в соответствующий сложный эфир или соответствующее аминокарбонильное соединение, или получают соединение общей формулы I, содержащее нитрогруппу, то это соединение можно перевести путем восстановления в соответствующее аминосоединение, или получают соединение общей формулы I, содержащее цианогруппу, то это соединение можно перевести путем восстановления в соответствующее аминометильное соединение, или получают соединение общей формулы I, содержащее арилалкилоксигруппу, то такое соединение можно перевести путем обработки кислотой в соответствующее гидроксисоединение, или получают соединение общей формулы I, содержащее алкоксикарбонильную группу, то это соединение можно перевести путем омыления в соответствующее карбоксисоединение, или получают соединение общей формулы I, в котором R4 представляет собой замещенную аминогруппой, алкиламиногруппой,аминоалкилом или аминоалкильной группой фенильную группу, то это соединение можно перевести путем последующего взаимодействия с соответствующим цианатом, изоцианатом или карбамоилгалогенидом в соответствующее мочевинное соединение общей формулы I, или получают соединение общей формулы I, в котором R4 представляет собой замещенную аминогруппой, алкиламиногруппой, аминоалкилом или аминоалкильной группой фенильную группу, то это соединение можно перевести путем последующего взаимодействия с соответствующим передающим амидиногруппу соединением или взаимодействия с соответствующим нитрилом в соответствующее гуанидиносоединение общей формулы I. Последующий гидролиз предпочтительно проводить в водном растворителе, например в воде, метаноле/воде, этаноле/воде, изопропаноле/воде, тетрагидрофуране/воде или диоксане/воде, в присутствии кислоты, такой как трифторуксусная кислота, соляная кислота или серная кислота, либо в присутствии гидроксида щелочного металла, такого как гидроксид лития, гидроксид натрия или гидроксид калия, при температуре от 0 до 100 С, предпочтительно от 10 до 50 С. Последующее гидроалкилирование предпочтительно проводить в пригодном для этой цели растворителе, таком как метанол, метанол/вода, метанол/вода/аммиак, этанол, простой эфир, тетрагидрофуран,диоксан или диметилформамид, необязательно с добавлением кислоты, такой как соляная кислота, в присутствии каталитически активированного водорода, например водорода в присутствии никеля Ренея,платины или палладия на угле, или в присутствии гидрида металла, такого как боргидрид натрия, боргидрид лития, цианоборгидрид натрия или алюмогидрид лития, при температуре от 0 до 100 С, предпочтительно от 20 до 80 С. Последующее алкилирование предпочтительно проводить в пригодном для этой цели растворителе,таком как простой эфир, тетрагидрофуран, диоксан, дихлорметан, ацетон или ацетонитрил, в присутствии алкилирующих агентов, таких как алкилиодиды, алкилбромиды, алкилхлориды, эфиры алкилметансульфоновых кислот, эфиры алкил-пара-толуолсульфоновых кислот или алкилтрифторацетаты, при температуре от 0 до 100 С, предпочтительно от 20 до 60 С. Последующее ацилирование или сульфонилирование целесообразно проводить с использованием соответствующей свободной кислоты или соответствующего реакционноспособного соединения, такого как ее ангидрид, эфир, имидазолид или галогенангидрид, предпочтительно в растворителе, таком как метиленхлорид, диэтиловый эфир, тетрагидрофуран, толуол, диоксан, ацетонитрил, диметилсульфоксид или диметилформамид, необязательно в присутствии неорганического или третичного органического основания при температуре от -20 до 200 С, предпочтительно от 20 С до температуры кипения исполь-7 008623 зуемого растворителя. Взаимодействие со свободной кислотой при необходимости можно проводить в присутствии активатора кислоты или обезвоживающего агента, например в присутствии изобутилового эфира хлормуравьиной кислоты, тетраэтилового эфира ортоугольной кислоты, триметилового эфира ортоуксусной кислоты, 2,2-диметоксипропана, тетраметоксисилана, тионилхлорида, триметилхлорсилана,трихлорида фосфора,пентоксида фосфора,N,N'-дициклогексилкарбодиимида,N,N'дициклогексилкарбодиимида/N-гидроксисукцинимида, N,N'-дициклогексилкарбодиимида/1-гидроксибензотриазола, тетрафторбората 2-(1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония, тетрафторбората 2(1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония/1-гидроксибензотриазола, N,N'-карбонилдиимидазола или трифенилфосфина/четыреххлористого углерода, и при необходимости с добавлением основания,такого как пиридин, 4-диметиламинопиридин, N-метилморфолин или триэтиламин, преимущественно при температуре от 0 до 150 С, предпочтительно от 0 до 100 С. Взаимодействие с соответствующим реакционноспособным соединением можно при необходимости проводить в присутствии третичного органического основания, такого как триэтиламин, N-этилдиизопропиламин, N-метилморфолин или пиридин, или с использованием ангидрида в присутствии соответствующей кислоты при температуре от 0 до 150 С, предпочтительно от 50 до 100 С. Последующую этерификацию или последующее амидирование целесообразно проводить путем взаимодействия соответствующего реакционноспособного производного карбоновой кислоты с соответствующим спиртом или амином, как это описано выше. Этерификацию или амидирование предпочтительно проводить в растворителе, таком как метиленхлорид, диэтиловый эфир, тетрагидрофуран, толуол, диоксан, ацетонитрил, диметилсульфоксид или диметилформамид, необязательно в присутствии неорганического или третичного органического основания, предпочтительно при температуре от 20 С до температуры кипения используемого растворителя. При этом взаимодействие с соответствующей кислотой предпочтительно проводить в присутствии обезвоживающего агента, например в присутствии изобутилового эфира хлормуравьиной кислоты, тетраэтилового эфира ортоугольной кислоты, триметилового эфира ортоуксусной кислоты, 2,2 диметоксипропана, тетраметоксисилана, тионилхлорида, триметилхлорсилана, трихлорида фосфора,пентоксида фосфора,N,N'-дициклогексилкарбодиимида,N,N'-дициклогексилкарбодиимида/Nгидроксисукцинимида, N,N'-дициклогексилкарбодиимида/1-гидроксибензотриазола, тетрафторбората 2(1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония, тетрафторбората 2-(1 Н-бензотриазол-1-ил)-1,1,3,3 тетраметилурония/1-гидроксибензотриазола,N,N'-карбонилдиимидазола или трифенилфосфина/четыреххлористого углерода, и при необходимости с добавлением основания, такого как пиридин, 4 диметиламинопиридин, N-метилморфолин или триэтиламин, преимущественно при температуре от 0 до 150 С, предпочтительно от 0 до 100 С, а ацилирование предпочтительно проводить путем взаимодействия с соответствующим реакционноспособным соединением, таким как ангидрид, эфир, имидазолид или галогенангидрид указанной кислоты, необязательно в присутствии третичного органического основания,такого как триэтиламин, N-этилдиизопропиламин, N-метилморфолин или пиридин, при температуре от 0 до 150 С, предпочтительно от 50 до 100 С. Последующее восстановление нитрогруппы предпочтительно осуществлять путем гидрогенолиза,например, под действием водорода в присутствии катализатора, такого как палладий на угле или никель Ренея, в растворителе, таком как метанол, этанол, этилацетат, диметилформамид, диметилформамид/ацетон или ледяная уксусная кислота, необязательно с добавлением кислоты, такой как соляная кислота или ледяная уксусная кислота, при температуре от 0 до 50 С, предпочтительно, однако, при комнатной температуре, и при давлении водорода от 1 до 7 бар, предпочтительно, однако, от 3 до 5 бар. Последующее гидрирование цианогруппы предпочтительно осуществлять путем гидрогенолиза,например, под действием водорода в присутствии катализатора, такого как палладий на угле или никель Ренея, в растворителе, таком как метанол, этанол, этилацетат, метиленхлорид, диметилформамид, диметилформамид/ацетон или ледяная уксусная кислота, необязательно с добавлением кислоты, такой как соляная кислота или ледяная уксусная кислота, при температуре от 0 до 50 С, предпочтительно, однако,при комнатной температуре, и при давлении водорода от 1 до 7 бар, предпочтительно, однако, от 3 до 5 бар. Последующий процесс получения соответствующего гуанидиносоединения общей формулы I целесообразно осуществлять взаимодействием с передающим амидиногруппу соединением, таким как амидин 3,5-диметилпиразол-1-карбоновой кислоты, предпочтительно в растворителе, таком как диметилформамид, и необязательно в присутствии третичного органического основания, такого как триэтиламин,при температуре от 0 до 50 С, предпочтительно при комнатной температуре. При проведении описанных выше реакций присутствующие при определенных условиях реакционноспособные группы, такие как карбокси-, гидрокси-, амино-, алкиламино- или иминогруппы, можно защищать на время протекания реакции обычными защитными группами и вновь отщеплять их по завершении реакции. В качестве примера защитной группы для карбоксигруппы можно назвать триметилсилильную, метильную, этильную,трет-бутильную, бензильную или тетрагидропиранильную группу, в качестве примера защитной группы для гидрокси-, амино-, алкиламино- или иминогруппы можно назвать ацетильную,-8 008623 трифторацетильную, бензоильную, этоксикарбонильную, трет-бутоксикарбонильную, бензилоксикарбонильную, бензильную, метоксибензильную или 2,4-диметоксибензильную группу, а для аминогруппы дополнительно фталильную группу. При необходимости последующее отщепление используемой защитной группы можно осуществлять, например, гидролитическим путем в водном растворителе, например в воде, изопропаноле/воде,тетрагидрофуране/воде или диоксане/воде, в присутствии кислоты, такой как трифторуксусная кислота,соляная кислота или серная кислота, либо в присутствии гидроксида щелочного металла, такого как гидроксид лития, гидроксид натрия или гидроксид калия, при температуре от 0 до 100 С, предпочтительно от 10 до 50 С. Однако отщепление бензильной, метоксибензильной или бензилоксикарбонильной группы осуществляют, например, путем гидрогенолиза, в частности под действием водорода в присутствии катализатора, такого как палладий на угле, в растворителе, таком как метанол, этанол, этилацетат, диметилформамид, диметилформамид/ацетон или ледяная уксусная кислота, необязательно с добавлением кислоты,такой как соляная кислота или ледяная уксусная кислота, при температуре от 0 до 50 С, но предпочтительно при комнатной температуре, и при давлении водорода от 1 до 7 бар, более предпочтительно от 3 до 5 бар. Метоксибензильную группу можно отщеплять также в присутствии окислителя, такого как аммонийнитрат церия(IV), в растворителе, таком как метиленхлорид, ацетонитрил или ацетонитрил/вода, при температуре от 0 до 50 С, предпочтительно, однако, при комнатной температуре. 2,4-Диметоксибензильную группу предпочтительно, однако, отщеплять в трифторуксусной кислоте в присутствии анизола. трет-Бутильную или трет-бутилоксикарбонильную группу предпочтительно отщеплять обработкой кислотой, такой как трифторуксусная кислота или соляная кислота, необязательно с использованием растворителя, такого как метиленхлорид, диоксан, этилацетат или простой эфир. Фталильную группу предпочтительно отщеплять в присутствии гидразина или первичного амина,такого как метиламин, этиламин или н-бутиламин, в растворителе, таком как метанол, этанол, изопропанол, толуол/вода или диоксан, при температуре от 20 до 50 С. Кроме того, полученные хиральные соединения общей формулы I можно разделять на их энантиомеры и/или диастереомеры. Так, например, полученные соединения общей формулы I, которые образуются в виде рацематов,можно разделять по известным методам (см. Allinger N.L. и Eliel E.L., "Topics in Stereochemistry", т. 6,изд-во Wiley Interscience, 1971) на их оптические антиподы, а соединения общей формулы I по меньшей мере с 2 асимметрическими атомами углерода можно разделять на основе различий их физикохимических свойств по известным методам, например хроматографией и/или фракционированной кристаллизацией, на их диастереомеры, которые при их образовании в рацемической форме в последующем можно разделять, как это описано выше, на энантиомеры. Разделение на энантиомеры предпочтительно осуществлять путем колоночного разделения на хиральных фазах либо путем перекристаллизации из оптически активного растворителя или взаимодействием с образующим с рацемическим соединением соли или производные, такие как сложные эфиры или амиды, оптически активным веществом, прежде всего с кислотами и их активированными производными или спиртами, и разделением полученной в результате смеси диастереомерных солей или производных,например на основе различий в их растворимости, при этом из чистых диастереомерных солей или производных можно высвобождать свободные антиподы воздействием пригодного для этой цели средства. В качестве примера наиболее часто используемых в вышеуказанных целях оптически активных кислот можно назвать D- и L-формы винной кислоты, дибензоилвинной кислоты, ди-о-толилвинной кислоты,яблочной кислоты, миндальной кислоты, камфорсульфоновой кислоты, глутаминовой кислоты, Nацетилглутаминовой кислоты, аспарагиновой кислоты, N-ацетиласпарагиновой кислоты или хинной кислоты. Примером оптически активного спирта служит (+)- или (-)-ментол, а в качестве примера оптически активного ацильного фрагмента в амидах можно назвать (+)- или (-)-ментилоксикарбонильный остаток. Помимо этого полученные соединения формулы I можно переводить в их соли, прежде всего в их пригодные для фармацевтического применения физиологически совместимые соли с неорганическими или органическими кислотами. В качестве примера пригодных для этой цели кислот можно назвать соляную кислоту, бромисто-водородную кислоту, серную кислоту, фосфорную кислоту, фумаровую кислоту, янтарную кислоту, молочную кислоту, лимонную кислоту, винную кислоту, малеиновую кислоту,метансульфоновую кислоту, этансульфоновую кислоту, пара-толуолсульфоновую кислоту, фенилсульфоновую кислоту или L-(+)-миндальную кислоту. Кроме того, полученные таким путем новые соединения формулы I, если они содержат карбоксигруппу, в последующем при необходимости можно переводить в их соли с неорганическими или органическими основаниями, прежде всего в их пригодные для фармацевтического применения физиологически приемлемые соли. В качестве примера пригодных для этой цели оснований можно назвать гидроксид натрия, гидроксид калия, циклогексиламин, этаноламин, диэтаноламин и триэтаноламин.-9 008623 Соединения общей формулы I, которые содержат две или более кислотных или основных групп,могут быть также представлены в виде солей с двумя или более неорганическими или органическими основаниями или кислотами (в виде так называемых двойных солей и т.д.). Используемые в качестве исходных продуктов соединения общих формул V-XI частично известны из литературы, либо их получают по известным из литературы методам или их можно получать по методам, описанным выше и в последующих примерах. Так, например, соединения общей формулы IX описаны в заявке DE 19844003. Как уже указывалось выше, новые соединения общей формулы I обладают ценными фармакологическими свойствами, прежде всего ингибирующим действием на различные киназы, главным образом на рецепторные тирозинкиназы, такие как VEGFR1, VEGFR2, VEGFR3, PDGFR, PDGFR, FGFR1, FGFR3,EGFR, HER2, c-Kit, IGF1R, HGFR и Flt-3, а также на пролиферацию культивируемых клеток человека,прежде всего эндотелиальных клеток, например при ангиогенезе, и на пролиферацию других клеток,прежде всего опухолевых клеток. Биологические свойства новых соединений исследовали стандартным методом описанным ниже путем. Эндотелиальные клетки пуповины человека (HUVEC) культивировали в среде IMDM (фирма GibcoBRL), дополненной 10% фетальной телячьей сыворотки (ФТС) (фирма Sigma), 50 мкМ меркаптоэтанолом (фирма Fluka), стандартными антибиотиками, фактором роста эндотелиальных клеток в концентрации 15 мкг/мл (ECGS, фирма Collaborative Biomedical Products) и гепарином в концентрации 100 мкг/мл (фирма Sigma), в покрытых желатином культуральных чашках (0,2% желатина, фирма Sigma) при температуре 37 С и 5%-ном содержании СО 2 в насыщенной водяными парами атмосфере. Для исследования ингибирующей активности предлагаемых в изобретении соединений клетки в течение 16 ч выдерживали "на голодном пайке", т.е. в культуральной среде без факторов роста (ECGS + гепарин). Далее клетки отделяли от культуральных чашек с помощью трипсина/ЭДТК и однократно промывали в содержащей сыворотку среде. После этого клетки высевали на планшеты в количестве 2,5x103 клеток на лунку. Пролиферацию клеток стимулировали с помощью VEGF165 (васкулярный эндотелиальный фактор роста ("vascular endothelial growth factor"), H. Weich, GBF Braunschweig) в концентрации 5 нг/мл и гепарином в концентрации 10 мкг/мл. По 6 лунок каждого планшета использовали в качестве контроля, не стимулируя находящиеся в них клетки. Предлагаемые в изобретении соединения растворяли в 100%-ном диметилсульфоксиде и в различных разведениях в трех повторностях добавляли в культуры клеток, при этом максимальная концентрация диметилсульфоксида составляла 0,3%. Клетки инкубировали в течение 76 ч при 37 С, после чего для выявления синтеза ДНК в течение последующих 16 ч добавляли 3 Н-тимидин (0,1 мкКи/лунку, фирма Amersham). Затем радиоактивно меченные клетки иммобилизовали на фильтровальных холстах и с помощью счетчика -излучения определяли связанную (встроенную) радиоактивность. Для определения ингибирующей активности предлагаемых в изобретении соединений полученное для не стимулированных клеток среднее значение вычитали из среднего значения, полученного для стимулированных фактором клеток (в присутствии или в отсутствие предлагаемых в изобретении соединений). Относительную пролиферацию клеток рассчитывали в процентном отношении к контролю (HUVEC-клетки без ингибитора) и определяли концентрацию действующего вещества, при которой достигается 50%-ное ингибирование пролиферации клеток (IC50). Значение IC50 у предлагаемых в изобретении соединений общей формулы I составляет от 50 мкМ до 1 нМ. Соединения общей формулы I благодаря их ингибирующему действию на пролиферацию клеток,прежде всего эндотелиальных и опухолевых клеток, пригодны для лечения заболеваний, при которых определенную роль играет пролиферация клеток, прежде всего эндотелиальных клеток. Так, например, пролиферация эндотелиальных клеток и связанное с ней образование новых сосудов являются решающими факторами при прогрессировании опухолей (Folkman J. и др., Nature 339, 1989, cc. 58-61; Hanahan D. и Folkman J., Cell 86, 1996, cc. 353-365). Кроме того, пролиферация эндотелиальных клеток имеет особое значение и при гемангиомах, при метастазировании, при ревматическом артрите,псориазе и при образовании новых глазных сосудов (Folkman J., Nature Med. 1, 1995, cc. 27-31; CarmelietP. и Rakeh J., Nature 407, 2000, cc. 249-257). Терапевтическая эффективность ингибиторов пролиферации эндотелиальных клеток была подтверждена при моделировании на животных, например, O'Reilly и др., а также Parangi и др. (O'Reilly M.S. и др., Cell 88, 1997, cc. 277-285; Parangi S. и др., Proc. Natl. Acad. Sci.USA 93, 1996, cc. 2002-2007). В соответствии с этим соединения общей формулы I, их таутомеры, их стереоизомеры или их физиологически приемлемые соли пригодны, например, для лечения опухолей (в частности плоскоклеточного рака, астроцитомы, саркомы Капоши, глиобластомы, рака легкого, рака мочевого пузыря, рака затылочной и шейной областей, рака пищевода, меланомы, рака яичника, рака предстательной железы,- 10008623 рака молочной железы, мелкоклеточного рака легкого, глиомы, рака толстой кишки, рака поджелудочной железы, рака мочеполовой системы и рака желудочно-кишечного тракта, а также раковых заболеваний крови (таких как множественная миелома и острый миелоидный лейкоз), псориаза, артрита (например ревматоидного артрита), гемангиомы, ангиофибромы, глазных заболеваний (например диабетической ретинопатии), неоваскулярной глаукомы, заболеваний почек (например гломерулонефрита), диабетической нефропатии, злокачественного нефросклероза, синдрома тромботической микроангиопатии,отторжения трансплантата и гломерулопатии, фиброзных заболеваний (например цирроза печени), связанных с пролиферацией клеток мезангия заболеваний, артериосклероза, поражений нервной ткани и для подавления повторной окклюзии сосудов после лечения с использованием баллонного катетера, при протезировании сосудов или после применения, соответственно введения механических приспособлений для поддержания проходимости сосудов (например стентов) либо иных заболеваний, при которых определенную роль играют пролиферация клеток или ангиогенез. Предлагаемые в изобретении соединения благодаря их биологическим свойствам могут применяться индивидуально или в сочетании с другими фармакологически активными соединениями, например,для терапевтического лечения опухолей при монотерапии либо в сочетании с другими противоопухолевыми лечебными средствами, например в сочетании с ингибиторами топоизомеразы (например этопозидом), с антимитотическими средствами (например винбластином, таксолом), со взаимодействующими с нуклеиновыми кислотами соединениями (например цис-платином, циклофосфамидом, адриамицином), с антагонистами гормонов (например тамоксифеном), со стероидами и их аналогами (например дексаметазоном), с ингибиторами метаболических процессов (например 5-FU и т.д.), с цитокинами (например интерферонами), с ингибиторами киназ (например ингибиторами EGFR-киназы, такими как иресса,Gleevec), с обладающими аллостерическим действием ингибиторами рецепторной тирозинкиназы, с антителами (например герцептином), с ингибиторами СОХ-2, или же в сочетании с лучевой терапией и т.д. В подобных сочетаниях действующие вещества можно вводить либо одновременно, либо последовательно, соответственно использовать действующие вещества в сочетании с немедикаментозными типами терапии одновременно либо последовательно. Ниже изобретение проиллюстрировано на примерах. В последующих примерах используются следующие сокращения: ГОБТ 1-гидрокси-1 Н-бензотриазол ТБТУ тетрафторборат О-бензотриазол-1-ил-N,N,N',N'-тетраметилурония Получение исходных соединений Пример I. Диметиловый эфир 2-(4-фтор-2-нитрофенил)малоновой кислоты К раствору 188 мл диметилового эфира малоновой кислоты в 970 мл N-метилпирролидона при охлаждении льдом добавляют 185 г трет-бутилата калия и затем смесь перемешивают в течение 2 ч. К образовавшейся густой суспензии в течение 30 мин по каплям добавляют 150 мл 2,5-дифторнитробензола и затем перемешивают в течение 6 ч при 85 С. После этого смесь сливают в 4 л смеси воды со льдом и 250 мл концентрированной соляной кислоты и экстрагируют 2 л этилацетата. Органическую фазу сушат над сульфатом натрия и концентрируют. Маслянистый остаток дважды экстрагируют путем размешивания с водой и затем растворяют в 600 мл этилацетата. Полученный раствор сушат над сульфатом натрия и концентрируют досуха. Выкристаллизовавшийся сырой продукт перекристаллизовывают из 600 мл сме- 24008623 си этилацетат/гексан в соотношении 2:8 и сушат. Выход: 222 г (59% от теории). Значение Rf: 0,40 (силикагель, циклогексан/этилацетат в соотношении 5:1),C11H10FNO6. Масс-спектр: m/z = 270 [М-Н]-. Аналогично примеру 1 получают следующие соединения:(1.1) диэтиловый эфир 2-(4-бром-2-нитрофенил)малоновой кислоты: указанное соединение получают из 2,5-дибромнитробензола и диэтилового эфира малоновой кислоты,значение Rf: 0,40 (силикагель, петролейный эфир/этилацетат в соотношении 5:1),C13H14BrNO6,масс-спектр: m/z = 359/361 [М]+;(1.2) диметиловый эфир 2-(4-циано-2-нитрофенил)малоновой кислоты: указанное соединение получают из 4-хлор-3-нитробензонитрила и диметилового эфира малоновой кислоты,значение Rf: 0,50 (силикагель, метиленхлорид/метанол в соотношении 50:1),C12H10N2O6,масс-спектр: m/z = 277 [М-Н]-. Пример II. Метиловый эфир 4-циано-2-нитрофенилуксусной кислоты 14,2 г диметилового эфира 2-(4-циано-2-нитрофенил)малоновой кислоты (эдукт I.2) растворяют в 200 мл диметилсульфоксида и добавляют 4,5 г хлорида лития и 1,0 мл воды. Затем раствор перемешивают в течение 3,5 ч при 100 С, после чего смешивают с 300 мл смеси воды со льдом и оставляют стоять на 12 ч. Выпавший осадок отделяют вакуум-фильтрацией, растворяют в метиленхлориде и промывают водой. Органическую фазу сушат над сульфатом натрия, упаривают на роторном испарителе и сушат. Выход: 7,7 г (68% от теории). Значение Rf: 0,40 (силикагель, метиленхлорид/метанол в соотношении 50:1),C10H8N2O4. Масс-спектр: m/z = 219 [М-Н]-. Пример III. 4-фтор-2-нитрофенилуксусная кислота 50,0 г диметилового эфира 2-(4-фтор-2-нитрофенил)малоновой кислоты (эдукт I) в течение 20 ч перемешивают при 100 С в 400 мл 6-молярной соляной кислоты, после чего смешивают с 400 мл воды и охлаждают до 0 С. Выпавший осадок отделяют вакуум-фильтрацией, промывают водой и 100 мл петролейного эфира и сушат. Выход: 34,5 г (94% от теории). Значение Rf: 0,30 (силикагель, циклогексан/этилацетат в соотношении 5:2).C8H6FNO4. Масс-спектр: m/z= 154 [М-СОО-Н]-. Пример IV. 6-Фтор-2-индолинон 119 г 4-фтор-2-нитрофенил уксусной кислоты (эдукт III) гидрируют в 600 мл уксусной кислоты с добавлением 20 г палладия на активированном угле (10%-ного) при давлении водорода 50 фунтов/кв.дюйм. После этого катализатор отделяют вакуум-фильтрацией и отгоняют растворитель. Сырой продукт экстрагируют путем размешивания с 500 мл петролейного эфира, отделяют вакуумфильтрацией, промывают водой и сушат. Выход: 82,5 г (91% от теории). Значение Rf: 0,30 (силикагель, петролейный эфир/этилацетат в соотношении 1:1),C8H6FNO. Масс-спектр: m/z =150 [М-Н]-. Аналогично примеру 4 получают следующие соединения:(IV. 1) 6-бром-2-индолинон: указанное соединение получают из диэтилового эфира 2-(4-бром-2-нитрофенил)малоновой кислоты(эдукт I.1) в присутствии никеля Ренея в качестве катализатора гидрирования,значение Rf: 0,45 (силикагель, петролейный эфир/этилацетат в соотношении 1:1),C8H6BrNO,масс-спектр: m/z = 210/212 [М-Н]-;(IV.2) 6-циано-2-индолинон: указанное соединение получают из метилового эфира 4-циано-2-нитрофенилуксусной кислоты(эдукт II) в присутствии палладия на карбонате кальция в качестве катализатора гидрирования,значение Rf: 0,45 (силикагель, метиленхлорид/метанол в соотношении 9:1),C9H6N2O,масс-спектр: m/z =157 [М-Н]-. Пример V. 1-ацетил-6-фтор-2-индолинон 82,5 г 6-фтор-2-индолинона (эдукт IV) в течение 3 ч перемешивают при 130 С в 180 мл уксусного ангидрида. После охлаждения до комнатной температуры осадок отделяют вакуум-фильтрацией, промы- 25008623 вают 100 мл петролейного эфира и сушат. Выход: 64,8 г (61% от теории). Значение Rf: 0,75 (силикагель, петролейный эфир/этилацетат в соотношении 1:1).(V.1) 1-ацетил-6-хлор-2-индолинон: указанное соединение получают из 6-хлор-2-индолинона и уксусного ангидрида,значение Rf: 0,55 (силикагель, петролейный эфир/этилацетат в соотношении 2:3),С 11 Н 10 СlNO6,масс-спектр: m/z = 208/210 [М-Н]-;(V.2) 1-ацетил-6-бром-2-индолинон: указанное соединение получают из 6-бром-2-индолинона (эдукт IV.1) и уксусного ангидрида,значение Rf: 0,60 (силикагель, петролейный эфир/этилацетат в соотношении 2:1),C10H8BrNO2,масс-спектр: m/z = 253/255 [М]+;(V.3) 1-ацетил-6-циано-2-индолинон: указанное соединение получают из 6-циано-2-индолинона (эдукт IV.2) и уксусного ангидрида,значение Rf: 0,60 (силикагель, метиленхлорид/метанол в соотношении 50:1),C11H8N2O2,масс-спектр: m/z = 199 [М-Н]-. Пример VI. 1-ацетил-3-[1-гидрокси-1-(3-иодфенил)метилен]-6-хлор-2-индолинон 10,5 г 1-ацетил-6-хлор-2-индолинона (эдукт V.1), 13,6 г 3-иодбензойной кислоты и 17,7 г ТБТУ добавляют к 100 мл диметилформамида, после чего добавляют 35 мл триэтиламина и смесь перемешивают в течение 12 ч при комнатной температуре. По истечении этого промежутка времени отгоняют растворитель, остаток смешивают с водой, подвергают вакуум-фильтрации, промывают небольшим количеством воды, метанола и простого эфира и сушат в вакууме при 100 С. Выход: 12,9 г (59% от теории). Значение Rf: 0,80 (силикагель, метиленхлорид/метанол в соотношении 9:1).(VI.1) 1-ацетил-3-[1-гидрокси-1-(4-метоксикарбонилметилфенил)метилен]-6-фтор-2-индолинон: указанное соединение получают из 1-ацетил-6-фтор-2-индолинона (эдукт V) и метилового эфира (4 карбоксифенил)уксусной кислоты (метод получения которого описан в Tetrahedron, 53, 1997, cc. 73357340);(VI.2) 1-ацетил-3-[1-гидрокси-1-(4-хлорфенил)метилен]-6-хлор-2-индолинон: указанное соединение получают из 1-ацетил-6-хлор-2-индолинона (эдукт V.1) и 4-хлорбензойной кислоты;(VI.3) 1-ацетил-3-[1-гидрокси-1-(3,4-диметоксифенил)метилен]-6-хлор-2-индолинон: указанное соединение получают из 1-ацетил-6-хлор-2-индолинона (эдукт V.1) и 3,4 диметоксибензойной кислоты;(VI.4) 1-ацетил-3-[1-гидрокси-1-(3,4-диметоксифенил)метилен]-6-циано-2-индолинон: указанное соединение получают из 1-ацетил-6-циано-2-индолинона (эдукт V.3) и 3,4 диметоксибензойной кислоты;(VI.5) 1-ацетил-3-[ 1-гидрокси-1-(3-фторфенил)метилен]-6-фтор-2-индолинон: указанное соединение получают из 1-ацетил-6-фтор-2-индолинона (эдукт V) и 3-фторбензойной кислоты;(VI.6) 1-ацетил-3-[1-гидрокси-1-(4-(2-ацетиламиноэтил)фенил)метилен]-6-фтор-2-индолинон: указанное соединение получают из 1-ацетил-6-фтор-2-индолинона (эдукт V) и 4-(2 ацетиламиноэтил)бензойной кислоты (метод получения которой описан в J. Am. Chem. Soc., 65, 1943, с. 2377);(VI.7) 1-ацетил-3-[1-гидрокси-1-(3-метоксикарбонилметилфенил)метилен]-6-фтор-2-индолинон: указанное соединение получают из 1-ацетил-6-фтор-2-индолинона (эдукт V) и метилового эфира (3 карбоксифенил)уксусной кислоты (метод получения которого аналогичен описанному в Tetrahedron, 53,1997, сс. 7335-7340);(VI.8) 1-ацетил-3-[1-гидрокси-1-(3-(N-трет-бутоксикарбониламинометил)фенил)метилен]-6-фтор-2 индолинон: указанное соединение получают из 1-ацетил-6-фтор-2-индолинона (эдукт V) и 3-(N-третбутоксикарбониламинометил)бензойной кислоты (метод получения которой описан в Tetrahedron, 53,1997, cc. 7335-7340);- 26008623 указанное соединение получают из 1-ацетил-6-фтор-2-индолинона (эдукт V) и (3 карбоксифенил)ацетонитрила (метод получения которого описан в J. Prakt. Chem., 340, 1998, cc. 367374);(VI. 10) 1-ацетил-3 -[1-гидрокси-1-(4-(N-трет-бутоксикарбониламинометил)фенил)метилен]-6-фтор 2-индолинон: указанное соединение получают из 1-ацетил-6-фтор-2-индолинона (эдукт V) и 4-(N-третбутоксикарбониламинометил)бензойной кислоты (метод получения которой описан в Bioorg. Med. Chem.(VI.11) 1-ацетил-3-[1-гидрокси-1-(4-иодфенил)метилен]-6-фтор-2-индолинон: указанное соединение получают из 1-ацетил-6-фтор-2-индолинона (эдукт V) и 4-иодбензойной кислоты;(VI. 12) 1-ацетил-3-[1 -гидрокси-1-(4-иодфенил)метилен]-6-хлор-2-индолинон: указанное соединение получают из 1-ацетил-6-хлор-2-индолинона (эдукт V.1) и 4-иодбензойной кислоты;(VI.13) 1-ацетил-3-[1-гидрокси-1-(3-иодфенил)метилен]-6-фтор-2-индолинон: указанное соединение получают из 1-ацетил-6-фтор-2-индолинона (эдукт V) и 3-иодбензойной кислоты;(VI.14) 1-ацетил-3-[1-гидрокси-1-(4-(2-метоксикарбонилэтил)фенил)метилен]-6-фтор-2-индолинон: указанное соединение получают из 1-ацетил-6-фтор-2-индолинона (эдукт V) и 4-(2 метоксикарбонилэтил)бензойной кислоты (метод получения которой описан в Tetrahedron, 53, 1997, cc. 7335-7340);(VI.15) 1-ацетил-3-[1-гидрокси-1-(3-(2-метоксикарбонилэтил)фенил)метилен]-6-фтор-2-индолинон: указанное соединение получают из 1-ацетил-6-фтор-2-индолинона (эдукт V) и 3-(2 метоксикарбонилэтил)бензойной кислоты (метод получения которой аналогичен описанному в Tetrahedron, 53, 1997, cc. 7335-7340);(VI. 16)1-ацетил-3-[1-гидрокси-1-(3-(N-трет-бутоксикарбонил-2-аминоэтил)фенил)метилен]-6-фтор 2-индолинон: указанное соединение получают из 1-ацетил-6-фтор-2-индолинона (эдукт V) и 3-(N-третбутоксикарбонил-2-аминоэтил)бензойной кислоты (метод получения которой описан в Bioorg. Med.(VI.17) 1-ацетил-3-[1-гидрокси-1-(4-(N-трет-бутоксикарбонил-2-аминоэтил)фенил)метилен]-6-фтор 2-индолинон: указанное соединение получают из 1-ацетил-6-фтор-2-индолинона (эдукт V) и 4-(N-третбутоксикарбонил-2-аминоэтил)бензойной кислоты (метод получения которой аналогичен описанному в(VI.18) 1-ацетил-3-[1-гидрокси-1-(4-цианофенил)метилен]-6-хлор-2-индолинон: указанное соединение получают из 1-ацетил-6-хлор-2-индолинона (эдукт V.1) и 4-цианобензойной кислоты;(VI.19) 1-ацетил-3-[1-гидрокси-1-(3-ацетиламинометилфенил)метилен]-6-фтор-2-индолинон: указанное соединение получают из 1-ацетил-6-фтор-2-индолинона (эдукт V) и 3 ацетиламинометилбензойной кислоты (полученной согласно J. Med. Chem., 40, 1997, cc. 4030-4052);(VI.20) 1-ацетил-3-[1-гидрокси-1-(3-(2-этоксикарбонилэтил)фенил)метилен]-6-фтор-2-индолинон: указанное соединение получают из 1-ацетил-6-фтор-2-индолинона (эдукт V) и 3-(2 этоксикарбонилэтил)бензойной кислоты (метод получения которой аналогичен описанному в(VI.21) 1-ацетил-3-[1-гидрокси-1-(4-(2-метоксикарбонилэтил)фенил)метилен]-6-хлор-2-индолинон: указанное соединение получают из 1-ацетил-6-хлор-2-индолинона (эдукт V.1) и 4-(2 метоксикарбонилэтил)бензойной кислоты (метод получения которой аналогичен описанному в Tetrahedron, 53, 1997, cc. 7335-7340);(VI.22) 1-ацетил-3-[1-гидрокси-1-(4-(2-этоксикарбонилэтил)фенил)метилен]-6-фтор-2-индолинон: указанное соединение получают из 1-ацетил-6-фтор-2-индолинона (эдукт V) и 4-(2 этоксикарбонилэтил)бензойной кислоты (метод получения которой аналогичен описанному в(VI.23) 1-ацетил-3-[1-гидрокси-1-(3-метоксикарбонилметилоксифенил)метилен]-6-фтор-2-индолинон: указанное соединение получают из 1-ацетил-6-фтор-2-индолинона (эдукт V) и 3 метоксикарбонилметилоксибензойной кислоты (метод получения которой описан в Tetrahedron Letters,39, 1998, cc. 8563-8566);(VI.24) 1-ацетил-3-[1-гидрокси-1-(4-метоксикарбонилметилоксифенил)метилен]-6-фтор-2-индолинон: указанное соединение получают из 1-ацетил-6-фтор-2-индолинона (эдукт V) и 4 метоксикарбонилметилоксибензойной кислоты (метод получения которой аналогичен описанному в Tetrahedron Letters, 39, 1998, cc. 8563-8566);- 27008623 указанное соединение получают из 1-ацетил-6-фтор-2-индолинона (эдукт V) и 3-(2 этоксикарбонилэтилокси)бензойной кислоты (метод получения которой описан в WO 96/20173, с. 60);(VI.26) 1-ацетил-3-[1-гидрокси-1-(4-(2-этоксикарбонилэтилокси)фенил)метилен]-6-фтор-2-индолинон: указанное соединение получают из 1-ацетил-6-фтор-2-индолинона (эдукт V) и 4-(2 этоксикарбонилэтилокси)бензойной кислоты (метод получения которой описан в WO 96/20173, с. 58);(VI.27) 1-ацетил-3-[1-гидрокси-1-(4-(2-метоксикарбонилэтил)фенил)метилен]-6-бром-2-индолинон: указанное соединение получают из 1 -ацетил-6-бром-2-индолинона (эдукт V.2) и 4-(2 метоксикарбонилэтил)бензойной кислоты (метод получения которой аналогичен описанному в Tetrahedron, 53, 1997, cc 7335-7340). Пример VII. 1-Ацетил-3-[1-метокси-1-(3 -иодфенил)метилен]-6-хлор-2-индолинон Раствор 3,52 г 1-ацетил-3-[1-гидрокси-1-(3-иодфенил)метилен]-6-хлор-2-индолинона (эдукт VI) и 2,72 мл этилдиизопропиламина в 80 мл дихлорметана порциями смешивают с 2,36 г тетрафторбората триметилоксония и перемешивают в течение часа при комнатной температуре. После этого вновь добавляют 1,4 мл этилдиизопропиламина и 1,2 г тетрафторбората триметилоксония и перемешивают еще в течение последующих двух часов при комнатной температуре. Затем экстрагируют водой, органическую фазу сушат над сульфатом магния и концентрируют досуха. Остаток перекристаллизовывают из простого эфира и сушат в вакууме при 80 С. Выход: 2,40 г (66% от теории). Значение Rf: 0,60 (силикагель, петролейный эфир/дихлорметан/этилацетат в соотношении 5:4:1).(VII. 1)1-ацетил-3-[1-метокси-1-(4-метоксикарбонилметилфенил)метилен]-6-фтор-2-индолинон: указанное соединение получают из 1-ацетил-3-[1-гидрокси-1-(4-метоксикарбонилметилфенил)метилен]-6 фтор-2-индолинона (эдукт VI.1);(VII.2) 1-ацетил-3-[1-метокси-1-(4-хлорфенил)метилен]-6-хлор-2-индолинон: указанное соединение получают из 1-ацетил-3-[1-гидрокси-1-(4-хлорфенил)метилен]-6-хлор-2 индолинона (эдукт VI.2);(VII.3) 1-ацетил-3-[1-метокси-1-(3,4-диметоксифенил)метилен]-6-хлор-2-индолинон: указанное соединение получают из 1-ацетил-3-[1-гидрокси-1-(3,4-диметоксифенил)метилен]-6 хлор-2-индолинона (эдукт VI.3);(VII.4) 1-ацетил-3-[1-метокси-1-(3,4-диметоксифенил)метилен]-6-циано-2-индолинон: указанное соединение получают из 1-ацетил-3-[1-гидрокси-1-(3,4-диметоксифенил)метилен]-6 циано-2-индолинона (эдукт VI.4);(VII.5) 1-ацетил-3-[1-метокси-1-(3-фторфенил)метилен]-6-фтор-2-индолинон: указанное соединение получают из 1-ацетил-3-[1-гидрокси-1-(3-фторфенил)метилен]-6-фтор-2 индолинона (эдукт VI.5);(VII.6) 1-ацетил-3-[1-метокси-1-(4-(2-ацетиламиноэтил)фенил)метилен]-6-фтор-2-индолинон: указанное соединение получают из 1-ацетил-3-[1-гидрокси-1-(4-(2-ацетиламиноэтил)фенил)метилен]-6-фтор-2-индолинона (эдукт VI.6);(VII.7) 1-ацетил-3-[1-метокси-1-(3-метоксикарбонилметилфенил)метилен]-6-фтор-2-индолинон: указанное соединение получают из 1-ацетил-3-[1-гидрокси-1-(3-метоксикарбонилметилфенил)метилен]-6-фтор-2-индолинона (эдукт VI.7);(VII.8) 1-ацетил-3-[1-метокси-1-(3-(N-трет-бутоксикарбониламинометил)фенил)метилен]-6-фтор-2 индолинон: указанное соединение получают из 1-ацетил-3-[1-гидрокси-1-(3-(N-трет-бутоксикарбониламинометил)фенил)метилен]-6-фтор-2-индолинона (эдукт VI.8);(VII.9) 1-ацетил-3-[1-метокси-1-(3-цианометилфенил)метилен]-6-фтор-2-индолинон: указанное соединение получают из 1-ацетил-3-[1-гидрокси-1-(3-цианометилфенил)метилен]-6 фтор-2-индолинона (эдукт VI.9);(VII.10) 1-ацетил-3-[1-метокси-1-(4-(N-трет-бутоксикарбониламинометил)фенил)метилен]-6-фтор 2-индолинон: указанное соединение получают из 1-ацетил-3-[1-гидрокси-1-(4-(N-трет-бутоксикарбониламинометил)фенил)метилен]-6-фтор-2-индолинона (эдукт VI.10);(VII.11) 1-ацетил-3-[1-метокси-1-(4-иодфенил)метилен]-6-фтор-2-индолинон: указанное соединение получают из 1-ацетил-3-[1-гидрокси-1-(4-иодфенил)метилен]-6-фтор-2 индолинона (эдукт VI.11);(VII.12)1-ацетил-3-[1-метокси-1-(4-иодфенил)метилен]-6-хлор-2-индолинон: указанное соединение получают из 1-ацетил-3-[1-гидрокси-1-(4-иодфенил)метилен]-6-хлор-2 индолинона (эдукт VI.12);- 28008623 указанное соединение получают из 1-ацетил-3-[1-гидрокси-1-(3-иодфенил)метилен]-6-фтор-2 индолинона (эдукт VI.13);(VII.14) 1-ацетил-3-[1-метокси-1-(3-(2-метоксикарбонилэтил)фенил)метилен]-6-фтор-2-индолинон: указанное соединение получают из 1-ацетил-3-[1-гидрокси-1-(3-(2-метоксикарбонилэтил)фенил)метилен]-6-фтор-2-индолинона (эдукт VI.14);(VII.15)1-ацетил-3 -[1-метокси-1-(4-(2-метоксикарбонилэтил)фенил)метилен]-6-фтор-2-индолинон: указанное соединение получают из 1-ацетил-3-[1-гидрокси-1-(4-(2-метоксикарбонилэтил)фенил)метилен]-6-фтор-2-индолинона (эдукт VI.15);(VII.16)1-ацетил-3-[1-метокси-1-(4-(N-трет-бутоксикарбонил-2-аминоэтил)фенил)метилен]-6-фтор 2-индолинон: указанное соединение получают из 1-ацетил-3-[1-гидрокси-1-(4-(N-трет-бутоксикарбонил-2 аминоэтил)фенил)метилен]-6-фтор-2-индолинона (эдукт VI.17);(VII.17) 1-ацетил-3-[1-метокси-1-(3-(N-трет-бутоксикарбонил-2-аминоэтил)фенил)метилен]-6-фтор 2-индолинон: указанное соединение получают из 1-ацетил-3-[1-гидрокси-1-(3-(N-трет-бутоксикарбонил-2 аминоэтил)фенил)метилен]-6-фтор-2-индолинона (эдукт VI.16);(VII.18) 1-ацетил-3-[1-метокси-1-(3-ацетиламинометилфенил)метилен]-6-фтор-2-индолинон: указанное соединение получают из 1-ацетил-3-[1-гидрокси-1-(3-ацетиламинометилфенил)метилен]6-фтор-2-индолинона (эдукт VI.19);(VII.19) 1-ацетил-3-[1 -метокси-1-(3-(2-этоксикарбонилэтил)фенил)метилен]-6-фтор-2-индолинон: указанное соединение получают из 1-ацетил-3-[1-гидрокси-1-(3-(2-этоксикарбонилэтил)фенил)метилен]-6-фтор-2-индолинона (эдукт VI.20);(VII.20) 1-ацетил-3-[1-метокси-1-(4-(2-метоксикарбонилэтил)фенил)метилен]-6-хлор-2-индолинон: указанное соединение получают из 1-ацетил-3-[1-гидрокси-1-(4-(2-метоксикарбонилэтил)фенил)метилен]-6-хлор-2-индолинона (эдукт VI.21);(VII.21) 1-ацетил-3-[1-метокси-1-(4-(2-этоксикарбонилэтил)фенил)метилен]-6-фтор-2-индолинон: указанное соединение получают из 1-ацетил-3-[1-гидрокси-1-(4-(2-этоксикарбонилэтил)фенил)метилен]-6-фтор-2-индолинона (эдукт VI.22);(VII.22) 1-ацетил-3-[1-метокси-1-(4-метоксикарбонилметилоксифенил)метилен]-6-фтор-2-индолинон: указанное соединение получают из 1-ацетил-3-[1-гидрокси-1-(4-метоксикарбонилметилоксифенил)метилен]-6-фтор-2-индолинона (эдукт VI.23);(VII.23) 1-ацетил-3-[1-метокси-1-(3-метоксикарбонилметилоксифенил)метилен]-6-фтор-2-индолинон: указанное соединение получают из 1-ацетил-3-[1-гидрокси-1-(3-метоксикарбонилметилоксифенил)метилен]-6-фтор-2-индолинона (эдукт VI.24);(VII.24) 1-ацетил-3-[1-метокси-1-(3-(2-этоксикарбонилэтилокси)фенил)метилен]-6-фтор-2-индолинон: указанное соединение получают из 1-ацетил-3-[1-гидрокси-1-(3-(2-этоксикарбонилэтилокси)фенил)метилен]-6-фтор-2-индолинона (эдукт VI.25);(VII.25) 1-ацетил-3-[1-метокси-1-(4-(2-этоксикарбонилэтилокси)фенил)метилен]-6-фтор-2-индолинон: указанное соединение получают из 1-ацетил-3-[1-гидрокси-1-(4-(2-этоксикарбонилэтилокси)фенил)метилен]-6-фтор-2-индолинона (эдукт VI.26);(VII.26) 1-ацетил-3-[1-метокси-1-(4-(2-метоксикарбонилэтил)фенил)метилен]-6-бром-2-индолинон: указанное соединение получают из 1-ацетил-3-[1-гидрокси-1-(4-(2-метоксикарбонилэтил)фенил)метилен]-6-бром-2-индолинона (эдукт VI.27). Пример VIII. 1-Ацетил-3-[1-хлор-1-(4-цианофенил)метилен]-6-хлор-2-индолинон Суспензию 7,0 г 1-ацетил-3-[1-хлор-(1-(4-цианометил)фенил)метилен]-6-хлор-2-индолинона (эдуктVI.18) и 6,39 г пентахлорида фосфора в 150 мл диоксана в течение 6 ч перемешивают при 100 С. После дополнительного добавления 1,0 г пентахлорида фосфора перемешивают еще в течение последующих 4 ч при 110 С. В завершение отгоняют растворитель и остаток промывают этилацетатом. Выход: 4,5 г (61% от теории). Значение Rf: 0,70 (силикагель, метиленхлорид/метанол в соотношении 50:1).C18H10Cl2N2O2. Пример IX. Методы синтеза перечисленных ниже соединений уже описаны в WO 01/27081:(IX.28) 4-[N-(2-(N-бензил-N-метиламино)этил)-N-ацетиламино]анилин,(IX.29) 4-амино-N-(2-диметиламиноэтил)-N-метилбензамид,(IX.30) 4-(4-метилпиперазин-1-илкарбонил)анилин,(IX.31) 4-(2-диметиламиноэтокси)анилин,(IX.32) N-(4-диметиламинобутилкарбонил)-N-метил-n-фенилендиамин,(IX.33) N-[(3-диметиламинопропил)карбонил]-N-метил-n-фенилендиамин. Получение конечных соединений Пример 1.0 3-Z-[1-(4-(N-метил-N-метилсульфониламино)анилино)-1-(3-иодфенил)метилен]-6-хлор-2 индолинон 0,9 г 1-ацетил-3-(1-метокси-1-(3-иодфенил)метилен)-6-хлор-2-индолинона (эдукт VII) и 0,5 г Nметил-N-метилсульфонил-n-фенилендиамина (эдукт IX.9) растворяют в 10 мл диметилформамида и перемешивают в течение 3 ч при 120 С. После охлаждения к реакционной смеси добавляют 1,5 мл пиперидина и перемешивают еще в течение часа при комнатной температуре. Далее добавляют воду, выпавший осадок отделяют вакуум-фильтрацией, промывают его небольшим количеством воды, метанола и простого эфира и в завершение сушат в вакууме при 100 С. Выход: 0,9 г (74% от теории). Значение Rf: 0,6 (силикагель, метиленхлорид/метанол в соотношении 9:1).C23H19ClIN3O3S. Масс-спектр: m/z = 578/580 [М-Н]-. Аналогично примеру 1.0 получают следующие соединения общей формулы I-1:
МПК / Метки
МПК: C07D 401/12, C07D 409/12, C07D 209/34, C07D 405/12, A61P 35/00, A61K 31/4045, C07D 403/12, A61K 31/404
Метки: лекарственных, качестве, производные, замещённые, индолиноновые, средств, положении, применение, получение
Код ссылки
<a href="https://eas.patents.su/30-8623-zameshhyonnye-v-polozhenii-6-indolinonovye-proizvodnye-ih-poluchenie-i-ih-primenenie-v-kachestve-lekarstvennyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Замещённые в положении 6 индолиноновые производные, их получение и их применение в качестве лекарственных средств</a>
Предыдущий патент: Ингибиторы ассоциированной с иммунитетом протеинкиназы
Следующий патент: Обработка гидролизатов химических агентов
Случайный патент: Укупорочный элемент, препятствующий незаконному вскрытию тары


































