Агенты, специфически связывающиеся с человеческим ангиопоэтином-2
Формула / Реферат
1. Полипептид, способный связываться с Ang-2, содержащий аминокислотную последовательность
WDPWT
(SEQ ID NO: 65)
длиной в 5-50 аминокислот, и его физиологически приемлемые соли.
2. Полипептид, способный связываться с Ang-2, содержащий аминокислотную последовательность
WDPWTC
(SEQ ID NO: 66)
и его физиологически приемлемые соли.
3. Полипептид, способный связываться с Ang-2, содержащий аминокислотную последовательность
Cz2WDPWT
(SEQ ID NO: 67)
где z2 представляет собой кислый или нейтральный полярный аминокислотный остаток, и его физиологически приемлемые соли.
4. Полипептид по п.3, содержащий аминокислотную последовательность
Cz2WDPWTC
(SEQ ID NO: 68)
где z2 обозначает кислый или нейтральный полярный аминокислотный остаток, и его физиологически приемлемые соли.
5. Полипептид, способный связываться с Ang-2, содержащий аминокислотную последовательность формулы
a1a2a3Ca5WDPWTCa12a13a14
(SEQ ID NO: 69)
где а1, а2 и а3, каждый независимо, обозначают аминокислотные остатки;
а5 обозначает аминокислотный остаток;
а12 отсутствует или обозначает аминокислотный остаток;
а13 отсутствует или обозначает нейтральный гидрофобный, нейтральный полярный или основной аминокислотный остаток;
а14 обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток;
и его физиологически приемлемые соли.
6. Полипептид по п.5, отличающийся тем, что
а1 обозначает V, I, P, W, G, S, Q, N, Е, K, R или Н;
а2 обозначает V, Р, М, G, S, Q, D, Е, K, R или Н;
а3 обозначает А, V, Р, М, F, T, G, D, Е, K или Н;
а8 обозначает А, V, G, Q, N, D или Е;
а12 обозначает S, Q, N, D, Е, K или R;
а13 обозначает L, Т или Н;
а14 обозначает V, L, I, W или М;
и его физиологически приемлемые соли.
7. Полипептид по п.5, отличающийся тем, что
а1 обозначает Q;
а2 обозначает Е;
а3 обозначает Е;
а5 обозначает D или Е;
а12 обозначает D или Е;
а13 обозначает Н и
а14 обозначает М,
и его физиологически приемлемые соли.
8. Полипептид, способный связываться с Ang-2, содержащий аминокислотную последовательность формулы
b1b2b3b4b5b6Cb8WDPWTCb15b16b17b18b19b20
(SEQ ID NO: 70)
где b1 отсутствует или обозначает аминокислотный остаток;
b2 отсутствует или обозначает нейтральный гидрофобный, нейтральный полярный или основной аминокислотный остаток;
b3, b4, b5 и b6, каждый независимо, отсутствуют или обозначают аминокислотные остатки;
b8 обозначает аминокислотный остаток;
b15 отсутствует или обозначает аминокислотный остаток;
b16 отсутствует или обозначает нейтральный гидрофобный, нейтральный полярный или основной аминокислотный остаток;
b17 отсутствует или обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток;
b18, b19 и b20, каждый независимо, отсутствуют или обозначают аминокислотные остатки;
и его физиологически приемлемые соли.
9. Полипептид по п.8, отличающийся тем, что
b1 отсутствует или обозначает А, V, L, P, W, F, T, G, S, Q, N, K, R или Н;
b2 отсутствует или обозначает А, V, L, I, P, W, M, T, G, S, Y, N, K, R или Н;
b3 отсутствует или обозначает A, L, I, P, W, M, T, G, S, Q, N, E, R или Н;
b4 обозначает V, I, P, W, G, S, Q, N, Е, K, R или Н;
b5 обозначает V, Р, М, G, S, Q, D, Е, K, R или Н;
b6 обозначает А, V, Р, М, F, T, G, D, Е, K или Н;
b8 обозначает А, V, G, Q, N, D или Е;
b15 обозначает S, Q, N, D, Е, K или R;
b16 обозначает L, Т или Н;
b17 обозначает V, L, I, W или М;
b18 отсутствует или обозначает А, V, L, P, W, F, T, G, Y, Q, D, Е или R;
b19 отсутствует или обозначает V, L, I, P, T, G, S, Y, Q, N, D, Е или R и
b20 отсутствует или обозначает V, L, P, W, M, T, G, S, Y, Q, N, D, K или R;
и его физиологически приемлемые соли.
10. Полипептид по п.8, отличающийся тем, что
b1 отсутствует или обозначает Р или Т;
b2 отсутствует или обозначает I или N;
b3 отсутствует или обозначает R или I;
b4 обозначает Q;
b5 обозначает Е;
b6 обозначает Е;
b8 обозначает D или Е;
b15 обозначает D или Е;
b16 обозначает Н;
b17 обозначает М;
b18 отсутствует или обозначает W или Р;
b19 отсутствует или обозначает G или Е и
b20 отсутствует или обозначает V или K;
и его физиологически приемлемые соли.
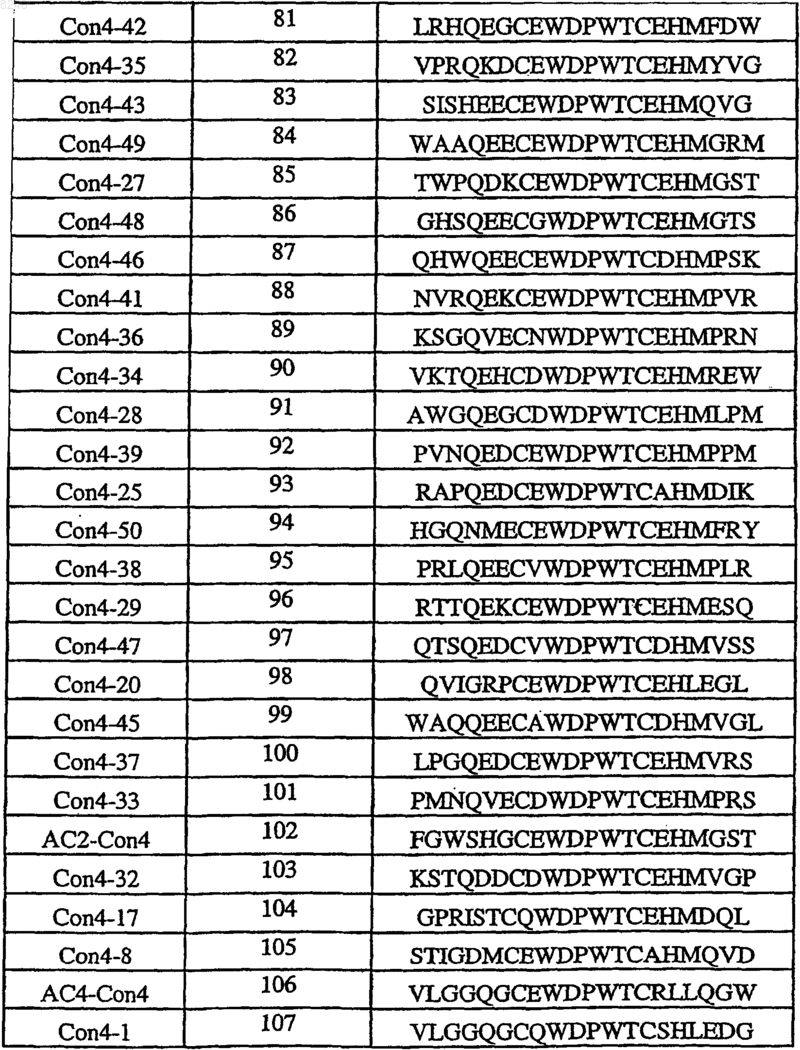
11. Полипептид, способныйсвязываться с Ang-2, содержащий по меньшей мере одну аминокислотную последовательность, выбираемую из группы, приведенной в табл. 1, состоящей из SEQ ID NO: 4 и с SEQ ID NO: 76 по SEQ ID NO: 118 включительно, и его физиологически приемлемые соли.
Таблица 1



12. Слитый полипептид, способный связываться с Ang-2, содержащий по меньшей мере один пептид по пп.1, 5, 8 или 11 и носитель, и его физиологически приемлемые соли.
13. Слитый полипептид по п.12, отличающийся тем, что указанный носитель представляет собой по меньшей мере один из группы: Fc область (домен), полиэтиленгликоль, липид, группа холестерина, углевод и олигосахарид.
14. Полипептид по пп.1, 5, 8 или 11, который является циклическим.
15. Димер или мультимер полипептидов по пп.1, 5, 8 или 11.
16. Состав полипептида, имеющий формулу
(X1)a-F1-(X2)b,
и его мультимеры,
где F1 обозначает носитель;
X1 и X2, каждый независимо, выбирают из
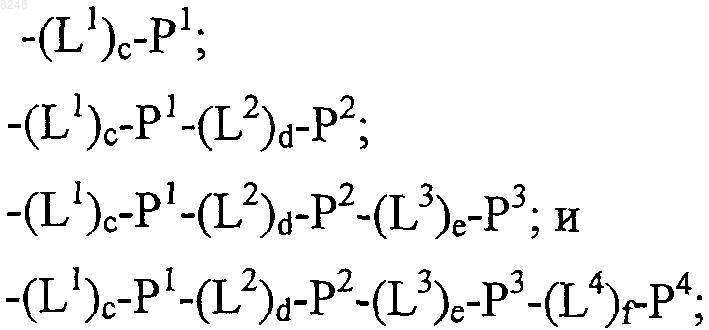
где один или более из Р1, Р2, Р3 и Р4, каждый независимо, представляют собой полипептид, выбираемый из группы, состоящей из:
(a) аминокислотной последовательности WDPWT (SEQ ID NO: 65), отличающейся тем, что указанный полипептид имеет протяжённость 5-50 аминокислот;
(b) аминокислотной последовательности WDPWTC (SEQ ID NO: 66),
(c) аминокислотной последовательности Cz2WDPWT (SEQ ID NO: 67) и
(d) аминокислотной последовательности Cz2WDPWTC (SEQ ID NO: 68),
где z2 обозначает кислый или нейтральный полярный аминокислотный остаток;
L1, L2, L3 и L4, каждый независимо, обозначает линкеры и
а, b, с, d, e и f, каждый независимо, обозначает 0 или 1, при условии, что по меньшей мере один из а и b обозначает 1;
и его физиологически приемлемые соли.
17. Состав полипептида по п.16, отличающийся тем, что z2 обозначает А, V, G, Q, N, D или Е.
18. Состав полипептида по п.16, отличающийся тем, что один или более из Р1, Р2, Р3 шыш Р4, каждый независимо, представляет собой полипептид, выбираемый из группы, состоящей из SEQ ID NO: 4 и с SEQ ID NO: 76 по SEQ ID NO: 118 включительно.
19. Состав полипептида по п.16, соответствующий формулам
X1-F1
или
F1-X2
и его физиологически приемлемые соли.
20. Состав полипептида по п.16 формулы
F1-(L1)c-P1
и его физиологически приемлемые соли.
21. Состав полипептида по п.16, соответствующий формуле
F1-(L1)c-P1-(L2)d-P2
и его физиологически приемлемые соли.
22. Состав полипептида по п.16, соответствующий формуле
P1-(L1)c-F1-(L2)d-P2
и его физиологически приемлемые соли.
23. Состав полипептида по п.16, отличающийся тем, что F1 обозначает домен Fc или его фрагмент.
24. Состав полипептида по п.16, отличающийся тем, что F1 содержит аминокислотную последовательность SEQ ID NO: 60.
25. Полинуклеотид, кодирующий состав полипептида по пп.1, 5, 8 или 11.
26. Вектор экспрессии, содержащий полинуклеотид по п.25.
27. Клетка-хозяин, содержащая вектор экспрессии по п.26.
28. Клетка-хозяин по п.27, отличающаяся тем, что является клеткой прокариот.
29. Клетка-хозяин по п.28, отличающаяся тем что является клеткой Е. coli.
30. Клетка-хозяин по п.27, отличающаяся тем, что является клеткой эукариот.
31. Полипептид, способный связываться с Ang-2, содержащий аминокислотную последовательность формулы
Pc2Dc4Lc6c7c8LY
(SEQ ID NO: 71)
где с2 обозначает нейтральный гидрофобный аминокислотный остаток;
с4 обозначает A, D или Е;
с6 обозначает кислый аминокислотный остаток;
с7 обозначает аминокислотный остаток и
с8 обозначает нейтральный гидрофобный, нейтральный полярный или основной аминокислотный остаток;
и его физиологически приемлемые соли.
32. Полипептид по п.31, отличающийся тем, что с2 обозначает L или М.
33. Полипептид по п.31, отличающийся тем, что с6 обозначает D или Е.
34. Полипептид, способный связываться с Ang-2, содержащий аминокислотную последовательность формулы
d1d2d3d4Pd6Dd8Ld10d11d12LYd15d16d17d18d19d20d21d22
(SEQ ID NO: 72)
где d1 отсутствует или обозначает аминокислотный остаток;
d2 отсутствует или обозначает нейтральный полярный, кислый или основной аминокислотный остаток;
d3 отсутствует или обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток;
d4 отсутствует или обозначает аминокислотный остаток;
d6 обозначает нейтральный гидрофобный аминокислотный остаток;
d8 обозначает A, D или Е;
d10 обозначает кислый аминокислотный остаток;
d11 обозначает аминокислотный остаток;
d12 обозначает нейтральный гидрофобный, нейтральный полярный или основной аминокислотный остаток;
d15 отсутствует или обозначает нейтральный полярный, кислый или основной аминокислотный остаток;
d16 отсутствует или обозначает нейтральный полярный, кислый или основной аминокислотный остаток;
d17 отсутствует или обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток;
d18 отсутствует или обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток;
d19 отсутствует или обозначает нейтральный гидрофобный, нейтральный полярный или основной аминокислотный остаток;
d20 отсутствует или обозначает аминокислотный остаток;
d21 отсутствует или обозначает нейтральный полярный, кислый или основной аминокислотный остаток;
d22 отсутствует или обозначает нейтральный гидрофобный, нейтральный полярный или основной аминокислотный остаток;
и его физиологически приемлемые соли.
35. Полипептид по п.34, отличающийся тем, что:
d1 обозначает Т, S, Q, R или Н;
d2 обозначает Т, Q, N или K;
d3 обозначает F;
d4 обозначает М, Q, Е или K;
d6 обозначает L или М;
d8 обозначает D или Е;
d10 обозначает Е;
d11 обозначает Q или Е;
d12 обозначает Т или R;
d15 обозначает Y, D, Е или K;
d16 обозначает Q;
d17 обозначает W или F;
d18 обозначает L, I, М или Т;
d19 обозначает L, F или Y;
d20 обозначает Q, D или Е;
d21 отсутствует или обозначает Q или Н;
d22 отсутствует или обозначает A, L, G, S или R;
и его физиологически приемлемые соли.
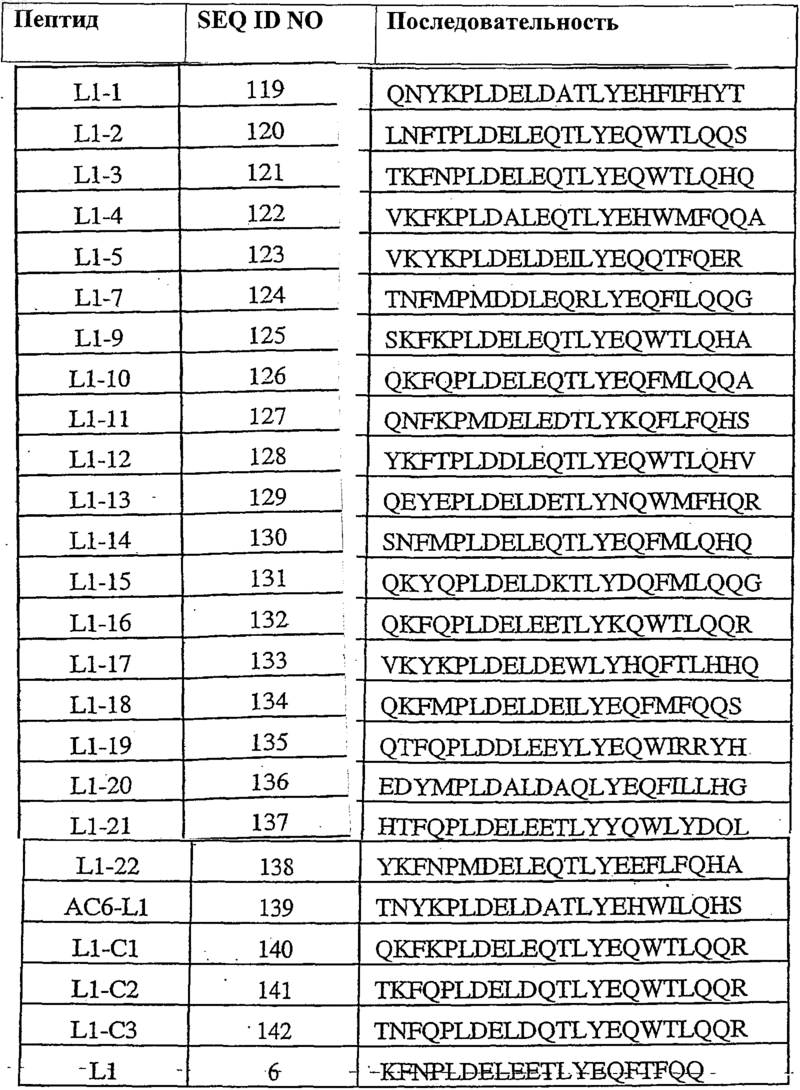
36. Полипептид, способный связываться с Ang-2, содержащий по меньшей мере одну аминокислотную последовательность, выбранную из группы, приведенной в табл. 2, состоящей из SEQ ID NO: 6 и с SEQ ID NO: 119 по SEQ ID NO: 142 включительно, и его физиологически приемлемые соли.
Таблица 2
37. Слитый полипептид, способный связываться с Ang-2, содержащий по меньшей мере один пептид по пп.31, 34 или 36 и носитель, и его физиологически приемлемые соли.
38. Слитый полипептид по п.37, отличающийся тем, что указанный носитель представляет собой по меньшей мере один из группы: Fc область (домен), полиэтиленгликоль, липид, группа холестерина, углевод и олигосахарид.
39. Полипептид по пп.31, 34 или 36, который является циклическим.
40. Димер или мультимер полипептидов по пп.31, 34 или 36.
41. Состав полипептида, имеющий формулу
(Х1)a-F1-(X2)b
и его мультимеры,
где F1 обозначает носитель;
X1 и X2, каждый независимо, выбирают из

где один или более из Р1, Р2, Р3 и Р4, каждый независимо, представляют собой полипептид по пп.31, 34 или 36;
L1, L2, L3 и L4, каждый независимо, обозначают линкеры и
а, b, с, d, e и f, каждый независимо, обозначают 0 или 1, при условии, что по меньшей мере один из а и b обозначает 1;
и его физиологически приемлемые соли.
42. Состав полипептида по п.41, отличающийся тем, что один или более из Р1, Р2, Р3 и Р4, каждый независимо, представляет собой полипептид, выбранный из группы, состоящей из SEQ ID NO: 6 и с SEQ ID NO: 119 по SEQ ID NO: 142 включительно.
43. Состав полипептида по п.41, соответствующий формулам
X1-F1
или
F1-X2
и его физиологически приемлемые соли.
44. Состав полипептида по п.41 формулы
F1-(L1)c-P1
и его физиологически приемлемые соли.
45. Состав полипептида по п.41, соответствующий формуле
F1-(L1)c-P1-(L2)d-P2
и его физиологически приемлемые соли.
46. Состав полипептида по п.41, соответствующий формуле
P1-(L1)c-F1-(L2)d-P2
и его физиологически приемлемые соли.
47. Состав полипептида по п.41, отличающийся тем, чтю F1 обозначает домен Fc или его фрагмент.
48. Состав полипептида по п.41, отличающийся тем, что F1 содержит аминокислотную последовательность SEQ ID NO: 60.
49. Полинуклеотид, кодирующий полипептид по любому из пп.31, 34 или 36.
50. Вектор экспрессии, содержащий полинуклеотид по п.49.
51. Клетка-хозяин, содержащая вектор экспрессии по п.50.
52. Клетка-хозяин по п.51, отличающаяся тем, что является клеткой прокариот.
53. Клетка-хозяин по п.52, отличающаяся тем что является клеткой Е. coli.
54. Клетка-хозяин по п.51, отличающаяся тем, что является клеткой эукариот.
55. Полипептид, способный связываться с Ang-2, содержащий аминокислотную последовательность формулы
RPe3e4e5e6e7G
(SEQ ID NO: 73)
где е3 обозначает нейтральный полярный аминокислотный остаток;
е4 обозначает кислый аминокислотный остаток;
е5 обозначает нейтральный полярный или кислый аминокислотный остаток;
е6 обозначает нейтральный гидрофобный аминокислотный остаток;
е7 обозначает нейтральный гидрофобный аминокислотный остаток;
и его физиологически приемлемые соли.
56. Полипептид по п.55, отличающийся тем, что е3 обозначает Y или С.
57. Полипептид по п.55, отличающийся тем, что е4 обозначает D или Е.
58. Полипептид по п.55, отличающийся тем, что е6 обозначает I или М.
59. Полипептид, способный связываться с Ang-2, содержащий аминокислотную последовательность формулы
f1f2f3f4RPf7f8f9f10f11Gf13f14f15f16f17f18f19f20
(SEQ ID NO: 74)
где f1 обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток;
f2 обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток;
f3 обозначает нейтральный полярный или кислый аминокислотный остаток;
f4 обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток;
f7 обозначает нейтральный полярный аминокислотный остаток;
f8 обозначает кислый аминокислотный остаток;
f9 обозначает нейтральный полярный или кислый аминокислотный остаток;
f10 обозначает нейтральный гидрофобный аминокислотный остаток;
f11 обозначает нейтральный гидрофобный аминокислотный остаток;
f13 обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток;
f14 обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток;
f15 обозначает нейтральный полярный аминокислотный остаток;
f16 обозначает нейтральный полярный аминокислотный остаток;
f17 обозначает нейтральный полярный или кислый аминокислотный остаток;
f18 обозначает нейтральный гидрофобный или основной аминокислотный остаток;
f19 обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток и
f20 обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток;
и его физиологически приемлемые соли.
60. Полипептид по п.59, отличающийся тем, что
f1 обозначает S, А или G;
f2 обозначает G, Q или Р;
f3 обозначает Q, G или D;
f4 обозначает L, М или Q;
f7 обозначает С или Y;
f8 обозначает Е или D;
f9 обозначает Е, G или D;
f10 обозначает I или М;
f11 обозначает F или L;
f13 обозначает С или W;
f14 обозначает G или Р;
f15 обозначает Т или N;
f16 обозначает Q, Y или K;
f17 обозначает N, D или Q;
f18 обозначает L, V, W или R;
f19 обозначает A, Q, Y или I и
f20 обозначает L, A, G или V;
и его физиологически приемлемые соли.
61. Полипептид, способный связываться с Ang-2, содержащий по меньшей мере одну аминокислотную последовательность, выбранную из группы, приведенной в табл. 3, состоящей из SEQ ID NO: 3 и с SEQ ID NO: 143 по SEQ ID NO: 148 включительно, и его физиологически приемлемые соли
Таблица 3

62. Слитый полипептид, способный связываться с Ang-2, содержащий по меньшей мере один полипептид по пп.55, 59 или 61 и носитель и его физиологически приемлемые соли.
63. Слитый полипептид по п.62, отличающийся тем, что указанный носитель представляет собой по меньшей мере один из группы: Fc область (домен), полиэтиленгликоль, липид, группа холестерина, углевод и олигосахарид.
64. Полипептид по пп.55, 59 или 61, который является циклическим.
65. Димер или мультимер полипептидов по пп.55, 59 или 61.
66. Состав полипептида, имеющий формулу
(X1)a-F1-(X2)b
и его мультимеры,
где F1 обозначает носитель;
X1 и X2, каждый независимо, выбирают из
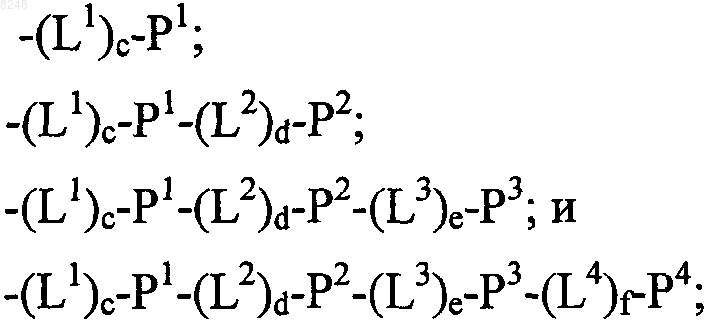
где один или более из Р1, Р2, Р3 и Р4, каждый независимо, представляют собой полипептид по пп.55, 59 или 61;
L1, L2, L3 и L4, каждый независимо, обозначают линкеры и
а, b, с, d, е и f, каждый независимо, обозначают 0 или 1, при условии, что по меньшей мере один из а и b обозначает 1;
и его физиологически приемлемые соли.
67. Состав полипептида по п.66, отличающийся тем, что один или более из Р1, Р2, Р3 и Р4, каждый независимо, представляет собой полипептид, выбранный из группы, состоящей из SEQ ID NO: 3 и с SEQ ID NO: 143 по SEQ ID NO: 148 включительно.
68. Состав полипептида по п.66, соответствующий формулам
X1-F1
или
F1-X2
и его физиологически приемлемые соли.
69. Состав полипептида по п.66 формулы
F1-(L1)c-P1
и его физиологически приемлемые соли.
70. Состав полипептида по п.66, соответствующий формуле
F1-(L1)c-P1-(L2)d-P2
и его физиологически приемлемые соли.
71. Состав полипептида по п.66, соответствующий формуле
P1-(L1)c-F1-(L2)d-P2
и его физиологически приемлемые соли.
72. Состав полипептида по п.66, отличающийся тем, что F1 обозначает домен Fc или его фрагмент.
73. Состав полипептида по п.66, отличающийся тем, что F1 содержит аминокислотную последовательность SEQ ID NO: 60.
74. Полинуклеотид, кодирующий полипептид по любому из пп.55, 59 или 61.
75. Вектор экспрессии, содержащий полинуклеотид по п.74.
76. Клетка-хозяин, содержащая вектор экспрессии по п.75.
77. Клетка-хозяин по п.76, отличающаяся тем, что является клеткой прокариот.
78. Клетка-хозяин по п.77, отличающаяся тем что является клеткой Е. coli.
79. Клетка-хозяин по п.76, отличающаяся тем, что является клеткой эукариот.
80. Полипептид, способный связываться с Ang-2, содержащий аминокислотную последовательность формулы
Cg2Gg4g5DPFTg10GCg13
(SEQ ID NO: 75)
где g2 обозначает кислый аминокислотный остаток;
g4 обозначает нейтральный гидрофобный аминокислотный остаток;
g5 обозначает Е, D или Q;
g10 обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток;
g13 обозначает кислый остаток;
и его физиологически приемлемые соли.
81. Полипептид по п.80, отличающийся тем, что g2 обозначает Е или D.
82. Полипептид по п.80, отличающийся тем, что g4 обозначает V или М.
83. Полипептид по п.80, отличающийся тем, что g10 обозначает F или Q.
84. Полипептид по п.80, отличающийся тем, что g13 обозначает D или Е.
85. Полипептид, способный связываться с Ang-2, содержащий аминокислотную последовательность формулы
h1h2h3h4Ch6Gh8h9DPFTh14GCh17h18h19h20
(SEQ ID NO:158)
где h1 отсутствует или обозначает нейтральный гидрофобный, нейтральный полярный или основной аминокислотный остаток;
h2 обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток;
h3 обозначает кислый аминокислотный остаток;
h4 обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток;
h6 обозначает кислый аминокислотный остаток;
h8 обозначает нейтральный гидрофобный аминокислотный остаток;
h9 обозначает Е, D или Q;
h14 обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток;
h17 обозначает кислый аминокислотный остаток;
h18 обозначает нейтральный гидрофобный, нейтральный полярный или основной аминокислотный остаток;
h19 обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток и
h20 отсутствует или обозначает аминокислотный остаток;
и его физиологически приемлемые соли.
86. Полипептид по п.85, отличающийся тем, что
h1 отсутствует или обозначает A, L, M, G, K или Н;
h2 обозначает L, F или Q;
h3 обозначает D или Е;
h4 обозначает W или Y;
h6 обозначает D или Е;
h8 обозначает V или М;
h14 обозначает F или Q;
h17 обозначает D или Е;
h18 обозначает М, Y, N или K;
h19 обозначает L или Q и
h20 отсутствует или обозначает М, Т, G, S, D, K или R;
и его физиологически приемлемые соли.
87. Полипептид, способный связываться с Ang-2, содержащий по меньшей мере одну аминокислотную последовательность, выбранную из группы, приведенной в табл. 4, состоящей из SEQ ID NO: 5 или с SEQ ID NO: 149 по SEQ ID NO: 157 включительно, и его физиологически приемлемые соли.
Таблица 4

88. Слитый полипептид, способный связываться с Ang-2, содержащий по меньшей мере один пептид по пп.80, 85 или 87 и носитель, его физиологически приемлемые соли.
89. Слитый полипептид по п.88, отличающийся тем, что носитель представляет собой по меньшей мере один из группы: Fc область (домен), полиэтиленгликоль, липид, группа холестерина, углевод и олигосахарид.
90. Полипептид по пп.80, 85 или 87, который является циклическим.
91. Димер или мультимер полипептидов по пп.80, 85 или 87.
92. Состав полипептида, имеющий формулу
(X1)a-F1-(X2)b
и его мультимеры,
где F1 обозначает носитель;
X1 и X2, каждый независимо, выбирают из
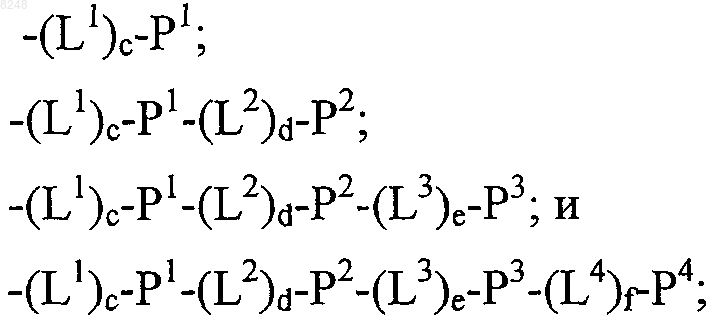
где один или более из Р1, Р2, Р3 и Р4, каждый независимо, представляют собой полипептид по пп.80, 85 или 87;
L1, L2, L3 и L4, каждый независимо, обозначает линкеры и
а, b, с, d, e и f, каждый независимо, обозначает 0 или 1, при условии, что по меньшей мере один из а и b обозначает 1;
и его физиологически приемлемые соли.
93. Состав полипептида по п.92, отличающийся тем, что один или более из Р1, Р2, Р3 и Р4, каждый независимо, представляет собой полипептид, выбранный из группы, состоящей из SEQ ID NO: 5 и с SEQ ID NO: 149 по SEQ ID NO: 157 включительно.
94. Состав полипептида по п.92, соответствующий формулам
X1-F1
или
F1-X2
и его физиологически приемлемые соли.
95. Состав полипептида по п.92 формулы
F1-(L1)c-P1
и его физиологически приемлемые соли.
96. Состав полипептида по п.92, соответствующий формуле
F1-(L1)c-P1-(L2)d-P2
и его физиологически приемлемые соли.
97. Состав полипептида по п.92, соответствующий формуле
P1-(L1)c-F1-(L2)d-P2
и его физиологически приемлемые соли.
98. Состав полипептида по п.92, отличающийся тем, что F1 обозначает домен Fc или его фрагмент.
99. Состав полипептида по п.92, отличающийся тем, что F1 содержит аминокислотную последовательность SEQ ID NO: 60.
100. Полинуклеотид, кодирующий полипептид по любому из пп.80, 85 или 87.
101. Вектор экспрессии, содержащий полинуклеотид по п.100.
102. Клетка-хозяин, содержащая вектор экспрессии по п.101.
103. Клетка-хозяин по п.102, отличающаяся тем, что является клеткой прокариот.
104. Клетка-хозяин по п.103, отличающаяся тем что является клеткой Е. coli.
105. Клетка-хозяин по п.102, отличающаяся тем, что является клеткой эукариот.
106. Полипептид в соответствии с любой из последовательностей SEQ ID NO: l, SEQ ID NO: 2, SEQ ID NO: 3 или SEQ ID NO: 4 или его вариант.
107. Полипептид в соответствии с любой из последовательностей SEQ ID NO: 5, SEQ ID NO: 6 или SEQ ID NO: 7 или его вариант.
108. Состав полипептида формулы
(X1)q-F1-(X2)r
и его мультимеры,
где F1 обозначает носитель;
X1 и X2, каждый независимо, выбирают из
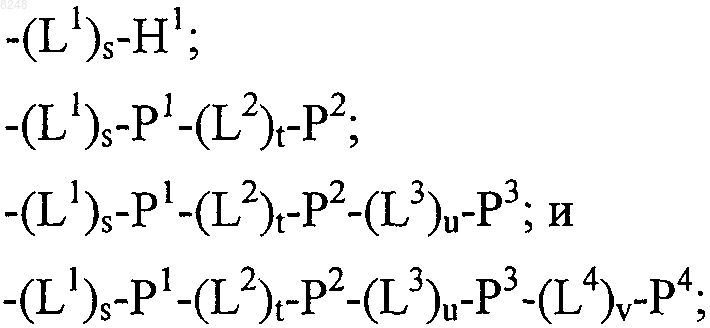
где один или более из Р1, Р2, Р3 и Р4, каждый независимо, представляют собой полипептид, выбранный из группы, состоящей из:
(a) аминокислотной последовательности WDPWT (SEQ ID NO: 65), причём указанный полипептид имеет в длину 5-50 аминокислот;
(b) аминокислотной последовательности WDPWTC (SEQ ID NO: 66);
(c) аминокислотной последовательности Cz2WDPWT (SEQ ID NO: 67), где z2 обозначает кислый или нейтральный полярный аминокислотный остаток;
(d) аминокислотной последовательности Cz2WDPWTC (SEQ ID NO: 68), где z2 обозначает кислый или нейтральный полярный аминокислотный остаток;
(e) аминокислотной последовательности Рс2Dc4Lc6с7с8LY (SEQ ID NO: 71), где с2 обозначает нейтральный гидрофобный аминокислотный остаток; с4 обозначает A, D или Е; с6 обозначает кислый аминокислотный остаток; с7 обозначает аминокислотный остаток и с8 обозначает нейтральный гидрофобный, нейтральный полярный или основной аминокислотный остаток;
(f) аминокислотной последовательности RPe3e4e5e6e7G (SEQ ID NO: 73), где е3 обозначает нейтральный полярный аминокислотный остаток; е4 обозначает кислый аминокислотный остаток; е5 обозначает нейтральный полярный или кисыыщ аминокислотный остаток; е6 обозначает нейтральный гидрофобный аминокислотный остаток и е7 обозначает нейтральный гидрофобный аминокислотный остаток;
(g) аминокислотной последовательности Cg2Cg4g5DPFTg10GCg13 (SEQ ID NO: 75), где g2 обозначает кислый аминокислотный остаток; g4 обозначает нейтральный гидрофобный аминокислотный остаток; g5 обозначает нейтральный полярный или кислый аминокислотный остаток; g10 обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток и g13 обозначает кислый остаток;
(h) полипептида SEQ ID NO: 1;
(i) полипептида SEQ ID NO: 2 и
(j) полипептида SEQ ID NO: 7;
L1, L2, L3 и L4, каждый независимо, обозначает линкеры и
q, r, s, t, u и v, каждый независимо, обозначает 0 или 1, при условии, что по меньшей мере один из q и r обозначает 1;
и его физиологически приемлемые соли.
109. Фармацевтическая композиция, содержащая эффективное количество состава полипептида по пп.1, 31, 55 или 80 в смеси с фармацевтически приемлемым носителем.
110. Способ ингибирования нежелательного ангиогенеза у млекопитающих, заключающийся во введении терапевтически эффективного количества состава полипептида по пп.12, 16, 37, 41, 62, 66, 88 или 92.
111. Способ лечения ангиогенеза у субъекта, заключающийся во введении эффективного количества состава полипептида по пп.12, 16, 37, 41, 62, 66, 88 или 92.
112. Способ модулирования ангиогенеза у млекопитающих, заключающийся во введении терапевтически эффективного количества состава полипептида по пп.12, 16, 37, 41, 62, 66, 88 или 92.
113. Способ подавления роста опухоли, характеризующейся нежелательным ангиогенезом, у млекопитающих, заключающийся во введении терапевтически эффективного количества состава полипептида по пп.12, 16, 37, 41, 62, 66, 88 или 92.
114. Способ лечения рака у млекопитающих, заключающийся во введении терапевтически эффективного количества состава полипептида по пп.12, 16, 37, 41, 62, 66, 88 или 92 и химиотерапевтического агента.
115. Способ по п.114, отличающийся тем, что химиотерапевтический агент является по меньшей мере одним из 5-FU, СРТ-11 и Таксотер.
116. Способ модулирования по меньшей мере одного нарушения у млекопитающего: сосудистой проницаемости или истечения плазмы, заключающийся во введении терапевтически эффективного количества состава полипептида по пп.12, 16, 37, 41, 62, 66, 88 или 92.
117. Способ лечения по меньшей мере одного из заболеваний: реваскулярного заболевания глаза, ожирения, ангиоретикулёмы, гемангиомы, артериосклероза, воспалительного заболевания, воспалительных нарушений, атеросклероза, эндометриоза, опухолевого заболевания, костного заболевания или псориаза, у млекопитающего, заключающийся во введении терапевтически эффективного количества состава полипептида по пп.12, 16, 37, 41, 62, 66, 88 или 92.
Текст
008248 Область, к которой относится изобретение Настоящее изобретение относится к агентам специфического связывания, которые распознают ангиопоэтин-2 (Ang-2) и связываются с ним. Более конкретно, изобретение относится к получению, диагностическому и терапевтическому применению специфически связывающихся агентов и их фрагментов,которые специфически связываются с Ang-2. Предпосылки создания изобретения Ангиогенез, образование новых кровеносных сосудов из уже имеющихся, является существенно важным для многих физиологических и патологических процессов. Обычно ангиогенез непосредственно регулируется про- и антиангиогенными факторами, но в случае таких болезней как рак, глазные реваскулярные заболевания, артрит и псориаз, процесс может идти "неправильно". Folkman, J. Nat. Med., 1:27-31 (1995). Известно, что многие заболевания ассоциируются с разрегулированным или нежелательным ангиогенезом. Такие заболевания включают, но без ограничения, глазную реваскуляризацию, такую как ретинопатии (включая диабетическую ретинопатию), пятнистую дегенерацию, связанную со старением, псориаз, ангиоретикулму, гемангиому, артериосклероз, воспалительное заболевание, такое как ревматоидное или ревматическое воспалительное заболевание, в особенности артрит (включая ревматоидный артрит), или другие хронические воспалительные заболевания, такие как хроническая астма, артериальный или пост-трансплантационный атеросклероз, эндометриоз и опухолевые заболевания, такие, например,как так называемые солидные опухоли и "жидкие" (или гемопоэтические) опухоли (такие как лейкемии и лимфомы). Другие заболевания, связанные с нежелательным ангиогенезом, очевидны для специалистов в данной области техники. Хотя в регуляции ангиогенеза участвуют многие системы сигнальной трансдукции, одна из лучше всего охарактеризованных и наиболее селективных в отношении эндотелиальных клеток систем включает Tie-2 рецепторную тирозинкиназу (называемую как "Tie-2" или "Tie-2R" (также называемую "ORK"; мышиную Tie-2, называемую также "tec") и е лиганды, ангиопоэтины (Gale, N.W. and Yancopoulos, О.D.,Genes Dev. 13:1055-1066 [1999]). Существуют 4 известных ангиопоэтина; от ангиопоэтина-1 ("Ang-1") до ангиопоэтина-4 ("Ang-4"). Эти ангиопоэтины можно также называть "Tie-2 лиганды" (Davis, S., et al.,Cell, 87:1161-1169 [1996]; Grosios, K., et al., Cytogenet. Cell Genet., 84:118-120 [1999]; Holash, J., et al., Investigative OphthalmologyVisual Science, 42(40):1617-1625 [1999]; Koblizek, T.I., et al., Current Biology,8:529-532 [1998]; Lin, P., et al., Proc. Natl. Acad. Sci. USA, 95:8829-8834 [1998]; Maisonpierre, P.C., et al.,Science, 277:55-60 [1997]; Papapetropoulos, A., et al., Lab. Invest., 79:213-223 [1999]; Sato, T.N., et al., Nature, 375:70-74 [1998]; Shyu, K.G., et al., Circulation, 98:2081-2087 [1998]; Suri, C., et al., Cell, 87:1171-1180[1998]). Наблюдали, что в то время как связывание Ang-1 с Tie-2 стимулирует рецепторное фосфорилирование в культивированных эндотелиальных клетках, Ang-2 является как агонистом, так и антагонистом Tie-2 рецепторного фосфорилирования (Davis, S., et al., [1996], см. выше; Maisonpierre, Р.С., et al.,[1997], см. выше; Kim, I., J.H. Kim, et al., Oncogene 19(39): 4549-4552 (2000); Teichert-Kuliszewska, K., Р.С.Maisonpierre, et al., Cardiovascular Research 49(3): 659-70 (2001. Фенотипы нокаутов мышей Tie-2 и Ang-1 сходны, и полагают, что стимулированное Ang-1 фосфорилирование Tie-2 опосредует реструктурирование и стабилизацию образующихся сосудов в матке за счт сохранения клеточной адгезии к эндотелиальным клеткам в качестве подложки (Dumont, D.J., et al.,GenesDevelopment, 8:1897-1909 [1994]; Sato, T.N., et al., Nature, 376:70-74 [1995]; Suri, C., et al., [1996],см. выше). Полагают, что роль Ang-1 в стабилизации сосудов сохраняется у взрослых, где он экспрессирует широко и конститутивно (Hanahan, О., Science, 277:48-50 [1997]; Zagzag, D., et al., Experimental Neurology, 159:391-400 [1999]). Напротив, экспрессия Ang-2, прежде всего, ограничена сайтами васкулярного (сосудистого) рестуктурирования, где, как полагают, блокируется функция Ang-1, тем самым вызывается состояние сосудистой пластичности, ведущее к ангиогенезу (Hanahan, D., [1997], см. выше; Holash,J., et al., Science, 284:1994-1998 [1999]; Maisonpierre, P.C., et al., [1997], см. выше). Многочисленные опубликованные исследования как будто демонстрируют экспрессию Ang-2 при болезненных состояниях, ассоциированных с ангиогенезом. (Bunone, G., et al., American Journal of Pathology,155:1967-1976 [1999]; Etoh, Т., et al., Cancer Research, 61:2145-2153 [2001]; Hangai, M., et al., InvestigativeTanaka, S., et al., J. Clin. Invest., 103:34-345 [1999]; Yoshida, Y., et al., International Journal of Oncology,15:1221-1225 [1999]; Yuan, K., et al., Journal of Periodontal Research, 35:165-171 [2000]; Zagzag, D., et al.,[1999] см. выше). Основная часть этих исследований сосредоточена на раке, при этом многие типы опухолей выявляют сосудистую экспрессию Ang-2. В отличие от его экспрессии при патологическом ангиогенезе экспрессия Ang-2 в нормальных тканях чрезвычайно ограничена (Maisonpierre, Р.С., et al., [1997],см. выше; Mezquita, J., et al., Biochemical and Biophysical Research Communications, 260:492-498 [1999]). У здорового взрослого человека существуют три основных сайта ангиогенеза, это яичник, плацента и матка; эти ткани являются первичными в нормальных (не злокачественных) тканях, где обнаружена мРНК Ang-2.-1 008248 В некоторых функциональных исследованиях высказывается предположение, что Ang-2 может принимать участие в ангиогенезе опухолей. Ahmad et al. (Cancer Res., 61:1255-1259 [2001]) описывает сверхэкспрессию Ang-2 и показывает на мышиной модели ксенотрансплантата, что она, по-видимому (якобы),ассоциирована с ускоренным (повышенным) ростом опухоли. См. также выше Etoh et al., и Tanaka et al.,данные в которых предполагают связь сверхэкспрессии Ang-2 с гиперваскулярностью опухолей. Напротив,данные, сообщаемые Yu et al. (Am. J. Path., 158:563-570 [2001]), показывают, что сверхэкспрессия Ang-2 в раковых клетках при раке лгкого Льюиса и в раковых клетках ТА 3 молочной железы, по-видимому,продлевает продолжительность жизни мышей, которым инъецированы соответствующие трансфектанты. В последние несколько лет в различных публикациях предлагаются Ang-1, Ang-2 и/или Tie-2 в качестве возможной мишени для противораковой терапии. Например, в каждом из патентов США 6166185,5650490 и 5814464 описываются представления об антителах против лиганда Tie-2 ligand и рецепторных"тельцах". Lin et al. (Proc. Natl. Acad. Sci. USA, 95:8829-8834 [1998]) инъецировали аденовирус, экспрессирующий растворимый Tie-2, мышам; растворимый Tie-2, по-видимому (якобы), уменьшал число и размер опухолей, образовавшихся у мышей. Lin et al. (J. Clin. Invest., 100:2072-2078 [1997]), инъецировали растворимую форму Tie-2 крысам; как пишут, это соединение уменьшало размер опухолей у крыс.Siemeister et al. (Cancer Res., 59:3185-3189 [1999]) генерировали клеточные линии человеческой меланомы, экспрессирующие внеклеточную область Tie-2, инъецировали эти клеточные линии "голым" мышам и сделали вывод, что Tie-2 (как полагают) вызывает "заметное ингибирование" роста опухоли и ангиогенеза опухоли. В свете этой информации и при условии, что Ang-1 и Ang-2 связываются с Tie-2, из этих исследований не ясно, являются ли Ang-1, Ang-2 или Tie-2 привлекательными в качестве мишени для противораковой терапии. Слияние некоторых пептидов с устойчивым плазменным белком, таким как константная область Ig,с целью увеличения периода полужизни этих молекул описано, например, в международной заявке РСТWO 00/24782, опубликованной 4 мая 2000 г. Слияние белка или его фрагмента с устойчивым белком плазмы, таким как константная область Ig,с целью увеличения периода полужизни этих молекул многократно описано (см., например, патент США 5480981; Zheng et al., J. Immunol., 154:5590-5600, (1995); Fisher et al., N. Engl. J. Med., 334:1697-1702, (1996);WO 97/23614, опубликованная 3 июля 1997 г.; заявка PCT/US 97/23183, поданная 11 декабря 1997 г.; Linsley,J. Exp. Med., 174:561-569, (1991); международная заявка WO 95/21258, опубликованная 10 августа 1995 г.). Эффективная aнти-Ang-2 может принести пользу многочисленной группе больных раком, так как для роста тврдых опухолей более 1-2 мм в диаметре требуется реваскуляризация. Такая терапия могла бы найти более широкое применение при других ассоциированных с ангиогенезом заболеваниях, таких как ретинопатии, артрит и псориаз. Существует настоятельная необходимость в идентификации новых агентов, которые специфически распознают Ang-2 и связываются с ним. Такие агенты были бы полезны для диагностического поиска и терапевтического вмешательства в болезненные состояния, ассоциированные с активностью Ang-2. Таким образом, целью настоящего изобретения является создание специфических агентов для связывания Ang-2, которые модулируют активность Ang-2. Такие агенты по данному изобретению имеют форму "пептител" (peptibodies), т.е. пептидов, слитых с другими молекулами, такими как Fc домен антитела, при этом пептидный фрагмент специфически связывается с Ang-2. Сущность изобретения Настоящее изобретение в одном свом варианте относится к пептидам (также называемым в данном описании "полипептиды"), которые связываются с Ang-2. Также данное изобретение охватывает варианты и производные таких пептидов. В другом варианте изобретения пептиды и их варианты и производные по данному изобретению связаны с носителями. В другом варианте изобретения пептиды могут быть слиты с Fc доменами, тем самым создавая"пептитела" (peptibodies). "Пептитела", необязательно, содержат по меньшей мере один пептид, например, из SEQ ID NO: 3-SEQ ID NO: 6 или SEQ ID NO: 76-SEQ ID NO: 157, а также их варианты и производные. Кроме того, пептиды могут содержать по меньшей мере один пептид, соответствующий формулам, представленным SEQ ID NO: 65-SEQ ID NO: 75 и SEQ ID NO: 158. Ещ в одном варианте изобретение охватывает молекулы нуклеиновых кислот, кодирующие специфически связывающиеся агенты и их варианты и производные. Ещ в одном варианте изобретение включает молекулы нуклеиновых кислот, кодирующих "пептитела", а также их варианты и производные. Необязательно, такие молекулы нуклеиновых кислот включают SEQ ID NO: 33-SEQ ID NO: 53. Ещ в одном варианте изобретение охватывает способ уменьшения опухоли путм введения эффективного количества специфически связывающихся агентов по настоящему изобретению нуждающемуся в этом субъекту. Изобретение также охватывает способ ингибирования ангиогенеза у субъекта, заключающийся во введении эффективного количества специфически связывающихся агентов по данному-2 008248 изобретению нуждающемуся в нм субъекту. Кроме того, изобретение включает способ лечения рака субъекту, заключающийся во введении эффективного количества специфически связывающихся агентов по данному изобретению субъекту, нуждающемуся в этом. Изобретение также относится к полипептиду, способному связывать Ang-2, причм этот полипептид содержит аминокислотную последовательность WDPWT (SEQ ID NO: 65) и длина этого полипептида 5-50 аминокислот, а также к его физиологически приемлемым солям. Изобретение может также включать полипептид с аминокислотной последовательностью(SEQ ID NO: 66) и его физиологически приемлемые соли. Кроме того, изобретение охватывает полипептид, который может содержать аминокислотную последовательность(SEQ ID NO: 67) где z2 представляет собой кислый или нейтральный полярный аминокислотный остаток, и его физиологически приемлемые соли. Кроме того, изобретение относится к полипептиду, который может содержать аминокислотную последовательность(SEQ ID NO: 68) где z2 обозначает кислый или нейтральный полярный аминокислотный остаток, и его физиологически приемлемым солям. В другом варианте изобретение относится к полипептиду, способному связываться с Ang-2, содержащим аминокислотную последовательность формулы(SEQ ID NO: 69) где а 1, а 2 и а 3, каждый независимо, обозначают аминокислотные остатки; а 5 обозначает аминокислотный остаток; а 12 отсутствует или обозначает аминокислотный остаток; а 13 отсутствует или обозначает нейтральный гидрофобный, нейтральный полярный или основной аминокислотный остаток; а 14 обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток; и его физиологически приемлемым солям. В предпочтительном варианте изобретения а 1 обозначает V, I, P, W, G, S, Q, N, Е, K, R или Н; а 2 обозначает V, Р, М, G, S, Q, D, Е, K, R или Н; а 3 обозначает А, V, Р, М, F, T, G, D, Е, K или Н; а 8 обозначает А, V, G, Q, N, D или Е; а 12 обозначает S, Q, N, D, Е, K или R; а 13 обозначает L, Т или Н и а 14 обозначает V, L, I, W или М. В более предпочтительном варианте изобретения а 1 обозначает Q; а 2 обозначает Е; а 3 обозначает Е; а 5 обозначает D или Е; а 12 обозначает D или Е; а 13 обозначает Н и а 14 обозначает М. Понятно, что строчные буквы (нижние литеры) с верхними индексами по данному описанию (например, а 1 и b1) определяют положения аминокислот, но не являются однобуквенными сокращениями для данной аминокислоты. Далее изобретение относится к полипептиду, способному связываться с Ang-2, содержащему аминокислотную последовательность формулы(SEQ ID NO: 70) где b1 отсутствует или обозначает аминокислотный остаток;b2 отсутствует или обозначает нейтральный гидрофобный, нейтральный полярный или основной аминокислотный остаток;b3, b4, b5 и b6, каждый независимо, отсутствуют или обозначают аминокислотные остатки;b15 отсутствует или обозначает аминокислотный остаток;b16 отсутствует или обозначает нейтральный гидрофобный, нейтральный полярный или основной аминокислотный остаток;b17 отсутствует или обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток;b18, b19 и b20, каждый независимо, отсутствуют или обозначают аминокислотные остатки; и их физиологически приемлемые соли. В предпочтительном вариантеb1 отсутствует или обозначает А, V, L, P, W, F, T, G, S, Q, N, K, R или Н;b2 отсутствует или обозначает А, V, L, I, P, W, M, T, G, S, Y, N, K, R или Н;b3 отсутствует или обозначает A, L, I, P, W, M, T, G, S, Q, N, E, R или Н;b18 отсутствует или обозначает А, V, L, P, W, F, T, G, Y, Q, D, Е или R;b19 отсутствует или обозначает V, L, I, P, T, G, S, Y, Q, N, D, Е или R иb20 отсутствует или обозначает V, L, P, W, M, T, G, S, Y, Q, N, D, K или R. В более предпочтительном варианте изобретения b1 отсутствует или обозначает Р или Т; b2 отсутствует или обозначает I или N; b3 отсутствует или обозначает R или I; b4 обозначает Q; b5 обозначает Е; b6 обозначает Е; b8 обозначает D или Е; b15 обозначает D или Е; b16 обозначает Н; b17 обозначает М; b18 отсутствует или обозначает W или Р; b19 отсутствует или обозначает G или Е; и b20 отсутствует или обозначает V или K. Также будет оценено, что изобретение предпочтительно относится к полипептиду, содержащему по меньшей мере одну аминокислотную последовательность, выбираемую из группы, состоящей из SEQ IDNO: 4 и SEQ ID NO: 76-SEQ ID NO: 118 включительно, причм полипептид способен связываться с Ang2, a также его физиологически приемлемые соли. Ниже представлены пептидные последовательности. Таблица 1 Следует понимать, что названия некоторых пептидов и/или "пептител" могут содержать префикс"TN", "TN8" или "TN12" и что этот префикс может присутствовать или может отсутствовать в названии(обозначении) данного "пептитела". Так например, в данном описании чередуются взаимозаменяемые термины "TN8-Con4" и "Соn4". В другом варианте предметом изобретения является состав полипептида, отвечающий формуле где один или более из Р 1, Р 2, Р 3 и Р 4, каждый независимо, представляет собой полипептид по данному описанию. Например, в предпочтительном варианте изобретения Р 1, Р 2, Р 3 и Р 4, каждый независимо,представляет собой полипептид SEQ ID NO: 3 - SEQ ID NO: 6 и/или SEQ ID NO: 76 - SEQ ID NO: 157. В другом варианте предметом изобретения является состав полипептида, отвечающий формуламF1-X2 1 1 и его физиологически приемлемые соли, где X , F и X2 имеют значение по данному описанию. В другом варианте предметом изобретения является состав полипептида, соответствующий формулеF1-(L1)c-P1 1 1 и его физиологически приемлемые соли, где L , F и Р 1 имеют значение по определению в данном описании. Ещ в одном варианте предметом изобретения является состав полипептида, соответствующий формулеF1-(L1)c-P1-(L2)d-P2 и его физиологически приемлемые соли, где L1, F1, Р 1, Р 2 и с и d имеют значение по определению в данном описании. Ещ в одном варианте предметом изобретения является состав полипептида, соответствующий формулеP1-(L1)c-F1-(L2)d-P2 и его физиологически приемлемые соли. В предпочтительном варианте изобретения F1 обозначает доменFc или его фрагмент. Кроме того, изобретение относится к полипептиду, способному связывать Ang-2, содержащему аминокислотную последовательность формулы(SEQ ID NO: 71) где с 2 обозначает нейтральный гидрофобный аминокислотный остаток; с 4 обозначает A, D или Е; с 6 обозначает кислый аминокислотный остаток; с 7 обозначает аминокислотный остаток и с 8 обозначает нейтральный гидрофобный, нейтральный полярный или основной аминокислотный остаток,и к его физиологически приемлемым солям. В предпочтительном варианте изобретения с 2 обозначает L или М. В другом предпочтительном варианте с 6 обозначает D или Е. Кроме того, изобретение относится к полипептиду, способному связываться с Ang-2, содержащему аминокислотную последовательность формулы(SEQ ID NO: 72) где d1 отсутствует или обозначает аминокислотный остаток;d2 отсутствует или обозначает нейтральный полярный, кислый или основной аминокислотный остаток;d3 отсутствует или обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток;d4 отсутствует или обозначает аминокислотный остаток;d6 обозначает нейтральный гидрофобный аминокислотный остаток;d10 обозначает кислый аминокислотный остаток;d12 обозначает нейтральный гидрофобный, нейтральный полярный или основной аминокислотный остаток;d15 отсутствует или обозначает нейтральный полярный, кислый или основной аминокислотный остаток;d16 отсутствует или обозначает нейтральный полярный, кислый или основной аминокислотный остаток;d17 отсутствует или обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток;d18 отсутствует или обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток;d19 отсутствует или обозначает нейтральный гидрофобный, нейтральный полярный или основной аминокислотный остаток;d20 отсутствует или обозначает аминокислотный остаток;d21 отсутствует или обозначает нейтральный полярный, кислый или основной аминокислотный остаток;d22 отсутствует или обозначает нейтральный гидрофобный, нейтральный полярный или основной аминокислотный остаток; и к его физиологически приемлемым солям. В предпочтительном варианте изобретенияd21 отсутствует или обозначает Q или Н;d22 отсутствует или обозначает A, L, G, S или R. В предпочтительном варианте изобретения полипептид содержит по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 6 и SEQ ID NO: 119 - SEQID NO: 142 включительно, причм полипептид способен связываться с Ang-2. SEQ ID NO: 6 и SEQ ID Изобретение также относится к полипептиду, способному связываться с Ang-2, содержащему аминокислотную последовательность формулы(SEQ ID NO: 73) где е 3 обозначает нейтральный полярный аминокислотный остаток; е 4 обозначает кислый аминокислотный остаток; е 5 обозначает нейтральный полярный или кислый аминокислотный остаток; е 6 обозначает нейтральный гидрофобный аминокислотный остаток; е 7 обозначает нейтральный гидрофобный аминокислотный остаток; и к его физиологически приемлемым солям. В предпочтительном варианте изобретения е 3 обозначает Y или С. В другом предпочтительном варианте изобретения е 4 обозначает D или Е. Ещ в одном предпочтительном варианте изобретения е 6 обозначает I или М. Далее изобретение относится к полипептиду, способному связываться с Ang-2, содержащему аминокислотную последовательность формулы(SEQ ID NO: 74) где f1 обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток;f2 обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток;f3 обозначает нейтральный полярный или кислый аминокислотный остаток;f4 обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток;f7 обозначает нейтральный полярный аминокислотный остаток;f8 обозначает кислый аминокислотный остаток;f9 обозначает нейтральный полярный или кислый аминокислотный остаток;f10 обозначает нейтральный гидрофобный аминокислотный остаток;f11 обозначает нейтральный гидрофобный аминокислотный остаток;f13 обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток;f14 обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток;f15 обозначает нейтральный полярный аминокислотный остаток;f16 обозначает нейтральный полярный аминокислотный остаток;f17 обозначает нейтральный полярный или кислый аминокислотный остаток;f18 обозначает нейтральный гидрофобный или основной аминокислотный остаток;f19 обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток иf20 обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток;-7 008248 и его физиологически приемлемым солям. В предпочтительном варианте изобретенияf20 обозначает L, A, G или V. В более предпочтительном варианте изобретение относится к полипептиду, содержащему по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 3 и SEQ ID NO: 143 - SEQ ID NO: 148 включительно, причм полипептид способен связываться с Ang-2, и к его физиологически приемлемым солям. SEQ ID NO: 3 и SEQ ID NO: 143 - SEQ ID NO: 148 суть следующие. Ещ в одном аспекте изобретение относится к полипептиду, способному связываться с Ang-2, содержащему аминокислотную последовательность формулы(SEQ ID NO:75) где g2 обозначает кислый аминокислотный остаток;g4 обозначает нейтральный гидрофобный аминокислотный остаток;g10 обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток;g13 обозначает кислый остаток; и к его физиологически приемлемым солям. В предпочтительном варианте изобретения g2 обозначает Е или D. В другом предпочтительном варианте изобретения g4 обозначает V или М. Ещ в одном варианте изобретения g10 обозначает F или Q. И еще в одном варианте изобретения g13 обозначает D или Е. Далее изобретение относится к полипептиду, способному связываться с Ang-2, содержащему аминокислотную последовательность формулы(SEQ ID NO: 158) где h1 отсутствует или обозначает нейтральный гидрофобный, нейтральный полярный или основной аминокислотный остаток;h2 обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток;h3 обозначает кислый аминокислотный остаток;h4 обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток;h6 обозначает кислый аминокислотный остаток;h8 обозначает нейтральный гидрофобный аминокислотный остаток;h14 обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток;h17 обозначает кислый аминокислотный остаток;h18 обозначает нейтральный гидрофобный, нейтральный полярный или основной аминокислотныйh19 обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток иh20 отсутствует или обозначает аминокислотный остаток; и к его физиологически приемлемым солям. В предпочтительном варианте изобретенияh1 отсутствует или обозначает A, L, M, G, K или Н;h20 отсутствует или обозначает М, Т, G, S, D, K или R. В более предпочтительном варианте изобретение относится к полипептиду, содержащему по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 5 или SEQ ID NO: 149 - SEQ ID NO: 157 включительно, причм указанный полипептид способен связываться с Ang-2, и к его физиологически приемлемым солям. SEQ ID NO: 5 и SEQ ID NO: 149 - SEQ ID В наиболее предпочтительном варианте изобретение относится к составу полипептида, имеющему формулу где один или более из Р 1, Р 2, Р 3 и Р 4, каждый независимо, представляют собой полипептид, выбранный из группы, состоящей из:(a) аминокислотной последовательности WDPWT (SEQ ID NO: 65), причм указанный пептид имеет в длину 5-50 аминокислот;(c) аминокислотной последовательности Cz2WDPWT (SEQ ID NO: 67), где z2 обозначает кислый или нейтральный полярный аминокислотный остаток;(d) аминокислотной последовательности Cz2WDPWTC (SEQ ID NO: 68), где z2 обозначает кислый или нейтральный полярный аминокислотный остаток;(e) аминокислотной последовательности Pc2Dc4Lc6c7c8LY (SEQ ID NO: 71), где с 2 обозначает нейтральный гидрофобный аминокислотный остаток; с 4 обозначает A, D или Е; с 6 обозначает кислый аминокислотный остаток; с 7 обозначает аминокислотный остаток и с 8 обозначает нейтральный гидрофобный, нейтральный полярный или основной аминокислотный остаток;(f) аминокислотной последовательности RPe3e4e5e6e7G (SEQ ID NO: 73), где е 3 обозначает нейтральный полярный аминокислотный остаток; е 4 обозначает кислый аминокислотный остаток; е 5 обозначает нейтральный полярный или кислый аминокислотный остаток; е 6 обозначает нейтральный гидрофобный аминокислотный остаток и е 7 обозначает нейтральный гидрофобный аминокислотный остаток;(g) аминокислотной последовательности Cg2Cg4g5DPFTg10GCg13 (SEQ ID NO: 75), где g2 обозначает кислый аминокислотный остаток; g4 обозначает нейтральный гидрофобный аминокислотный остаток; g5 обозначает нейтральный полярный или кислый аминокислотный остаток; g10 обозначает нейтральный гидрофобный или нейтральный полярный аминокислотный остаток и g13 обозначает кислый остаток;(j) полипептида SEQ ID NO: 7; где L1, L2, L3 и L4, каждый независимо, обозначают линкеры; и q, r, s, t, u и v, каждый независимо, обозначают 0 или 1, при условии, что по меньшей мере один из q и r обозначает 1; и к его физиологически приемлемым солям. Будет оценено, что изобретение, кроме того, относится к слитому полипептиду, содержащему по меньшей мере один пептид по данному описанию и носитель, причм слитый полипептид способен связываться с Ang-2, и к его физиологически приемлемым солям. В слитом полипептиде носителем является по меньшей мере один из ряда: Fc домен, полиэтиленгликоль, липид, группа холестерина, углевод, олигосахарид. Другие подходящие носители, такие как альбумин и т.п., будут оценены специалистами в данной области техники и входят в объм изобретения. Специалист в данной области техники понимает, что в структуру специфически связывающегося агента могут быть встроены различные молекулы. Так, данную молекулу можно ввести, например, между участками пептида и носителя специфически связывающихся агентов или внутри участка самого пептида, при сохранении заданной активности специфически связывающегося агента. Можно легко встроить, например, такие молекулы, как Fc домен или его фрагмент, полиэтиленгликоль или другие родственные молекулы, такие как декстран, жирная кислота, липид, группа холестерина, низкомолекулярный углевод, пептид, цитотоксический агент, химиотерапевтический агент, обнаруживаемый фрагмент, такой как представленный в данном описании (включая флуоресцентные агенты, радиоактивные метки, такие как радиоизотопы), олигосахарид, олигонуклеотид, полинуклеотид, "интерференционная" (или другая) РНК, ферменты, гормоны и т.п. Другие молекулы, пригодные для внедрения таким образом, будут понятны специалисту в данной области и входят в объм данного изобретения. Сюда входит, например,инсерция заданной молекулы между двумя последовательными аминокислотами, необязательно соединнными соответствующим линкером. В качестве примера приведена последовательность Соn4(С) "пептитела"Cпециалист в данной области техники может легко встроить заданную молекулу, например, между двумя остатками глутамина ("QQ") для получения заданной структуры и/или функции при сохранении способности пептида связывать Ang-2. Так, эту последовательность можно модифицировать следующим образом:M-Fc-GGGGGAQ-[мoлeкyлa]-QEECEWDPWTCEHMLE Если требуется, можно добавить линкерные молекулы. Кроме того, понятно, что молекулу можно встроить в различные местоположения в молекуле, включая подходящие боковые цепи, между носителем и пептидной последовательностью, как показано ниже М-Fс-[молекула]-GGGGGАQQЕЕСЕWDРWTCEHMLE или в любом другом месте по желанию специалиста в данной области техники. Другие подходящие варианты изобретения будут понятны специалистам в данной области техники. Ещ в одном варианте изобретение относится к полинуклеотиду, кодирующему специфические связывающие агенты (включая, но без ограничения, пептиды и/или "пептитела") по изобретению по данному описанию. Специалист в данной области техники понимает, что если известна аминокислотная последовательность, то с помощью известных методов можно легко определить соответствующую(ие) нуклеотидную(ые) последовательность(и). См., например, Suzuki, D., An Introduction to Genetic Analysis,W.H. Freeman Pub. Co. (1986). Примеры нуклеотидных последовательностей, кодирующих пептиды по изобретению, представлены ниже. Специалист в данной области техники знает, что данную аминокислоту могут кодировать более одного кодона, и, следовательно, изобретение относится к любым нуклеотидным последовательностям, которые кодируют пептиды и/или "пептитела" по изобретению. Ещ в одном варианте изобретение относится к экспрессирующим векторам, содержащим по меньшей мере один нуклеотид по изобретению. В другом варианте изобретение относится к клеткамхозяевам, содержащим вектор экспрессии. Следует понимать, что клетки-хозяева представляют собой- 16008248 предпочтительно прокариотные клетки (такие как клетки Е. coli) или эукариотные клетки. Изобретение также относится к фармацевтической композиции, содержащей эффективное количество состава полипептида по данному описанию в смеси с фармацевтически приемлемым носителем. Изобретение также относится к способу ингибирования нежелательного ангиогенеза у млекопитающих, заключающемуся во введении терапевтически эффективного количества полипептида или состава полипептида по данному описанию. Изобретение также относится к способу модулирования ангиогенеза у млекопитающих, заключающемуся во введении терапевтически эффективного количества полипептида или состава полипептида по данному описанию. Кроме того, изобретение относится к способу ингибирования роста опухоли, характеризующегося нежелательным ангиогенезом, у млекопитающих,заключающемуся во введении терапевтически эффективного количества полипептида или состава полипептида по данному описанию. Помимо этого, изобретение относится к способу лечения рака у млекопитающих, заключающемуся во введении терапевтически эффективного количества полипептида или состава полипептида по данному описанию и химиотерапевтического агента. В предпочтительном варианте изобретения химиотерапевтический агент представляет собой по меньшей мере один из 5-Fu, СРТ-11 и Taxotere (таксотер). Однако следует отдавать себе отчт, что можно применять другие химиотерапевтические агенты и другие методы терапии рака. Изобретение также относится к способу модулирования по меньшей мере одного из свойств: проницаемости сосудов или просачивания плазмы у млекопитающих, заключающемуся во введении эффективного количества полипептида или состава полипептида по данному описанию. Кроме того, изобретение относится к способу лечения по меньшей мере одного из следующих заболеваний (нарушений): глазного реваскулярного заболевания, ожирения, ангиоретикулмы, гемангиомы, артериосклероза, воспалительного заболевания, воспалительных нарушений, атеросклероза, эндометриоза, опухолей, костного заболевания или псориаза у млекопитающих, заключающемуся во введении терапевтически эффективного количества полипептида или состава полипептида по данному описанию. Понятно, что специфически связывающиеся агенты по изобретению можно применять для лечения ряда заболеваний, ассоциированных с нарушенным или нежелательным ангиогенезом. Такие заболевания включают, но без ограничения, глазную реваскуляризацию, такую как ретинопатии (включая диабетическую ретинопатию и пятнистую дегенерацию, связанную со старением), псориаз, ангиоретикулму,гемангиому, артериосклероз, воспалительное заболевание, такое как ревматоидное или ревматическое воспалительное заболевание, в особенности артрит (включая ревматоидный артрит), или другие хронические воспалительные заболевания, такие как хроническая астма, артериальный или посттрансплантационный атеросклероз, эндометриоз и опухолевые заболевания, такие, например, как так называемые солидные опухоли и "жидкие" (или гемопоэтические) опухоли (такие как лейкемии). Дополнительные заболевания, которые можно лечить введением специфически связывающихся агентов, будут очевидны для специалистов в данной области техники. Такие дополнительные заболевания включают, но без ограничения, ожирение, проницаемость сосудов, просачивание плазмы и костные нарушения, включая остеопороз. Таким образом, изобретение далее относится к способам лечения этих заболеваний, ассоциированных с нарушенным или нежелательным ангиогенезом. Другие варианты данного изобретения будут совершенно очевидны из прилагаемого описания. Краткое описание чертежей На фиг. 1 дан график изменения объма опухоли (ось у) во времени (ось х) у мышей с опухолью линии А-431, пролеченных либо "пептителом" TN8-Con4-C по данному изобретению, либо фосфатносолевым буферным раствором (PBS). Подробности описаны в примерах. На фиг. 2 изображн график зависимости концентрации "пептитела" (ось у) от времени после введения дозы (ось х) у мышей дикого типа, пролеченных дозой 50 мкг "пептитела" 2xCon4-C, L1-7-N илиL1-21-N. Подробности описаны в примерах. На фиг. 3 дан график изменения объма опухоли (ось у) во времени (ось х) у мышей с опухолью А 431, пролеченных либо "пептителом" TN8-Con4-C по данному изобретению, либо фосфатно-солевым буферным раствором (PBS), либо контрольным "пептителом". Подробности описаны в примерах. На фиг. 4 изображн график, представляющий in vitro рост культивированных клеток А-431, обработанных "пептителом" Соn4-С по настоящему изобретению, контрольным "пептителом" или необработанных. Подробности описаны в примерах. На фиг. 5 изображн график изменения объма опухоли (ось у) во времени (ось х) в опухолевых клетках Соlо 205 у мышей, пролеченных "пептителом" Соn4-С, "пептителом" L1-7-N, "пептителом" L121-N или "пептителом" 2 хСоn4-С по данному изобретению, либо фосфатно-солевым буферным раствором (PBS), антителом против Ang-2 (Ab536) или Fc. Подробности описаны в примерах. На фиг. 6 дан график зависимости объма опухоли (ось у) от времени (ось х) у мышей с Соlо 205 ксенотрансплантатом опухоли, пролеченных варьируемыми дозами "пептитела" 2 хСоn4-С по данному изобретению, или фосфатно-солевым буферным раствором (PBS), или Fc. Подробности описаны в примерах. На фиг. 7 дан график зависимости объма опухоли (ось у) от времени (ось х) у мышей с Соlо 205 ксенотрансплантатом опухоли, пролеченных "пептителом" 2 хСоn4-С по данному изобретению или контрольными "пептителами". На фиг. 7 также изображн график - область, окрашенная CD31/общая пло- 17008248 щадь опухоли для этих "пептител". Подробности описаны в примерах. На фиг. 8 изображн график зависимости объма опухоли (ось у) от времени (ось х) у мышей с Со 1 о 205 ксенотрансплантатом опухоли, пролеченных "пептителом" 2 хСоn4-С по данному изобретению или фосфатно-солевым буферным раствором (PBS) или контрольным "пептителом". Подробности описаны в примерах. Этот график показывает, что aнти-Ang-2 "пептитела" способны ингибировать рост опухоли Со 1 о 205 независимо от того, когда начинают вводить дозу лекарства. На фиг. 9 дана сводка скоростей полной реакции (CR) у самок "голых" мышей, полученных при использовании антитела Аb536 или "пептитела" 2 хСоn4-С как на модели ксенотрансплантата А 431, так и на модели ксенотрансплантата Colo-205. Подробности описаны в примерах. На фиг. 10 А дан график изменения объма опухоли (ось у) во времени (ось х) у мышей с ксенотрансплантатом Colo-205 опухоли, пролеченных либо "пептителом" 2 хСоn4-С по данному изобретению, либо комбинацией 2 хСоn4-С и таксотера, либо фосфатно-солевым буферным раствором (PBS), либо PBS плюс таксотер. Подробности описаны в примерах. На фиг. 10 В дан график изменения объма опухоли (ось у) во времени (ось х) у мышей с ксенотрансплантатом Colo-205 опухоли, пролеченных либо "пептителом" 2 хСоn4-С по данному изобретению, либо комбинацией 2 хСоn4-С и 5-FU, либо фосфатно-солевым буферным раствором (PBS), либоPBS плюс 5-FU. Подробности описаны в примерах. На фиг. 11 А дан график уровня опухания лапы (AUCSE) у индуцированной адъювантом модели артрита у крыс, пролеченных "пептителом" 2 хСоn4-С по данному изобретению, либо фосфатно-солевым буферным раствором (PBS), либо контрольным "пептителом", либо нормальным контролем или контролем на артрит. Подробности описаны в примерах. На фиг. 11 В дан график минеральной плотности костей лапы (BMD) у индуцированной адьювантом модели артрита у крыс, пролеченных "пептителом" 2 хСоn4-С по данному изобретению, либо фосфатносолевым буферным раствором (PBS), либо контрольным "пептителом", либо нормальным контролем или контролем на артрит. Подробности описаны в примерах. На фиг. 11 С дан график изменения веса тела у индуцированной адьювантом модели артрита у крыс,пролеченных "пептителом" 2 хСоn4-С по данному изобретению, либо фосфатно-солевым буферным раствором (PBS), либо контрольным "пептителом", либо нормальным контролем или контролем на артрит. Подробности описаны в примерах. На фиг. 12 даны 2 графика, изображающих ингибирование индуцированного VEGF корнеального ангиогенеза у крыс. На первом графике изображено число кровеносных сосудов у крыс, обработанных альбумином бычьей сыворотки (BSA), VEGF плюс фосфатно-солевой буферный раствор (PBS) илиVEGF плюс "пептитело" Соn4-С по изобретению. Второй график изображает площадь кровеносных сосудов (мм 2) у крыс, получавших BSA, VEGF плюс фосфатно-солевой раствор (PBS) или "пептитело" Соn4-С по изобретению. Подробности описаны в примерах. На фиг. 13 А, 13 В и 13 С изображены данные эпитопного картирования (O.D) для полноразмерногоTN8-Con4-C, L1-7-N и 12-9-3-С по изобретению, а также для контрольного "пептитела" Tie2-Fc, C2B8 или 5 В 12. Подробности описаны в примерах. На фиг. 14 изображает аффинность связывания (КD) "пептитела" по изобретению, определяемую методом Sapidane KinExA. Подробности описаны в примерах. Подробное описание изобретения Оглавления разделов даны лишь в целях упорядочения материала, но никоим образом не для ограничения описываемого предмета изобретения. Для получения молекул рекомбинантных ДНК, белков и антител, а также для получения тканевой культуры и трансформации клеток можно применять стандартные методы. Ферментативные реакции и очистку, как правило, осуществляют в соответствии с рекомендациями производителя или обычно принятыми в данной области техники методами, такими, как описанные в Sambrook et al. (Molecular Cloning:A Laboratory Manual. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY [1989], или методами по данному описанию. Если не указано иначе, применяемые в данном описании номенклатура, а также лабораторные методики и методы аналитической химии, синтетической органической химии и медицинской и фармацевтической химии, хорошо известны и применяются обычно в технике. Для химических синтезов, химических анализов, приготовления и доставки фармацевтических препаратов и лечения больных можно применять стандартные методы. Определения Ниже приводятся определения терминов, употребляемых по всему данному описанию (если не указано иначе в конкретных примерах). Термин "Ang-2" относится к полипептиду, представленному на фиг. 6 в патенте США 6166185("Tie-2 лиганд-2"), или к его фрагментам, а также к родственным полипептидам, которые включают аллельные варианты, "сплайсинговые" варианты, производные, варианты с заменами, делециями и/или инсерциями, слитые пептиды и полипептиды и межвидовые гомологи. Полипептид Ang-2 может включать или не включать дополнительные концевые остатки, например лидерные последовательности, целевые- 18008248 последовательности, метионин по аминоконцу, остатки метионина и лизина по аминоконцу и/или последовательности-метки или последовательности слитых белков, в зависимости от способа его получения. Термин "биологически активный" в применении к Ang-2 или к агенту, специфически связывающемуся с Ang-2, относится к полипептиду, имеющему по меньшей мере одну активность, характерную дляAng-2, может иметь агонистическую, антагонистическую или нейтрализующую или блокирующую активность в отношении по меньшей мере одной биологической активности Ang-2. Термин "специфически связывающийся агент" относится к молекуле, предпочтительно белковой молекуле, которая специфически связывается с Ang-2 и его вариантами и производными по данному описанию. Специфически связывающийся агент может представлять собой белок, пептид, нуклеиновую кислоту, углевод, липид или низкомолекулярное соединение, которое связывается преимущественно сAng-2. В предпочтительном варианте специфически связывающийся агент по данному изобретению представляет собой пептид или "пептитело", а также его фрагменты, варианты или производные, одни или в сочетании с другими аминокислотными последовательностями, получаемые известными методами. Такие методы включают, но без ограничения, ферментативное расщепление, химическое расщепление, пептидный синтез или методы рекомбинантной ДНК. Aнти-Ang-2 специфически связывающиеся агенты по данному изобретению способны связываться с участками Ang-2, которые модулируют, например ингибируют или промотируют, биологическую активность Ang-2 и/или другие типы ассоциированной с Ang-2 активности. Термин "варианты" по данному описанию включает такие пептиды и полипептиды, в которых аминокислотные остатки встроены в природную (или, по меньшей мере, в известную) аминокислотную последовательность, делетированы из не и/или заменены в ней на связывающийся агент. Варианты по изобретению включают слитые белки, описанные ниже."Производные" включают такие связывающиеся агенты, которые были химически модифицированы каким-либо способом, отличным от вариантов инсерции, делеции или замены."Специфически связывающийся с Ang-2" относится к способности специфически связывающегося агента (такого как "пептитело" или его пептидный участок) по данному изобретению распознавать и связывать зрелый, полноразмерный или неполноразмерный человеческий Ang-2 полипептид, или его ортолог, так что его аффинность (определяемая, например, методами анализа Affinity ELISA или Biacore) или его нейтрализующая способность (определяемая, например, методом анализа Neutralization ELISA по данному описанию или аналогичными методами анализа) по меньшей мере в 10 раз выше, но, необязательно, в 50 раз выше, в 100, 250 или в 500 раз выше или даже по меньшей мере в 1000 раз выше, чем аффинность или нейтрализующая способность того же агента в отношении любого другого ангиопоэтина или другого пептида или полипептида, в котором пептидный участок "пептитела" сначала слит с человеческим Fc фрагментом для оценки с помощью такого метода анализа. Термин "эпитоп" относится к участку любой молекулы, способному распознаваться и связываться специфически связывающимся агентом, например "пептителом", по одному или более антигенсвязывающих участков связывающегося агента. Эпитопы, как правило, состоят из химически активных поверхностных молекулярных группировок, таких, например, как боковые цепи аминокислот или углеводов, и имеют специфические признаки трхмерной структуры, так же как специфические характеристики заряда. Эпитопы по данному описанию могут быть смежными и несмежными. Термин "ингибирующий и/или нейтрализующий эпитоп" представляет собой эпитоп, который, будучи связан специфически связывающимся агентом, таким как "пептитело", приводит к утрате (или, по меньшей мере, к снижению) биологической активности молекулы, клетки или организма, содержащих такой эпитоп, in vivo, in vitro или in situ. В контексте настоящего изобретения нейтрализующий эпитоп локализуется на биологически активной области Ang-2 или ассоциируется с этой областью. Термин же"активирующий эпитоп" представляет собой эпитоп, который, будучи связан специфически связывающимся агентом по изобретению, таким как антитело, вызывает в результате активацию или, по меньшей мере, сохранение биологически активной конформации Ang-2. Термин "фрагмент "пептитела" относится к пептиду или полипептиду, который содержит область,меньшую, чем полное интактное "пептитело". Термин "природный" в применении к биологическим материалам, таким как нуклеиновые кислоты,полипептиды, клетки-хозяева и т.п., относятся к тем из них, которые обнаружены в природе, а не модифицированы человеком. Термин "изолированный, выделенный" в применении к Ang-2 или к агенту, специфически связывающемуся с Ang-2, относится к соединению, свободному по меньшей мере от одного загрязняющего полипептида или соединения, в смеси с которым он обнаруживается в природе, и предпочтительно практически не содержит любые другие загрязняющие полипептиды, обнаруживаемые в организме млекопитающих, которые могли бы помешать его (Ang-2 или агента, специфически связывающегося с Ang-2) применению в терапевтических или диагностических целях. Термин "зрелый" в применении к Ang-2 "пептителу", или его фрагменту, или к любому другому белковому агенту, специфически связывающемуся с Ang-2, относится к пептиду или полипептиду, у которого отсутствует лидерная или сигнальная последовательность. Если связывающийся агент по изобре- 19008248 тению экспрессирует, например, в прокариотной клетке-хозяине, "зрелый" пептид по изобретению может также включать дополнительные аминокислотные остатки (но по-прежнему не содержит лидерной последовательности), такие как концевой метионин или один или более остатков метионина и лизина. Пептид или полипептид, полученный таким образом, можно употреблять, удаляя или не удаляя эти дополнительные аминокислотные остатки. Термин "эффективное количество" и "терапевтически эффективное количество" в применении к агенту, специфически связывающемуся с Ang-2, относится к количеству специфически связывающегося агента, которое пригодно или необходимо для поддержания наблюдаемого изменения уровня одного или более типов биологической активности Ang-2. Изменение может представлять собой либо повышение,либо понижение уровня Ang-2 активности. Предпочтительно изменение представляет собой уменьшениеAng-2 активности. Термин "пептитело" относится к молекуле, содержащей Fc область (домен) антитела, связанный по меньшей мере с одним пептидом. Получение пептител в целом описано в международной заявке РСТWO 00/24782, опубликованной 4 мая 2000 г. Термин "варианты" по данному описанию включает молекулы таких соединений, как пептиды или комбинации пептид-носитель, такие как "пептитела" по данному изобретению, в которых аминокислотные остатки встроены в аминокислотные последовательности таких молекул, делетированы из них и/или заменены на них. Варианты, содержащие одну или более встроенных аминокислот, включают слитые белки, описанные далее."Производные" включают такие пептиды и/или комбинации пептид-носитель, такие как "пептитела", которые были химически модифицированы иным способом, нежели варианты с инсерцией, делецией или с заменой. Термин "фрагмент" относится к пептиду или к комбинации пептид-носитель, который содержит аминокислотную последовательность меньшей длины, нежели полноразмерная аминокислотная последовательность таких пептидов и/или таких комбинаций пептид-носитель. Такой фрагмент может получаться в результате усечения по аминоконцу, усечения по карбоксиконцу и/или внутренней делеции остатка(ов) аминокислотной последовательности пептида или комбинации пептид-носитель. Фрагменты могут получаться в результате альтернативного сплайсинга РНК или вследствие in vivo или in vitro протеазной активности. Такие фрагменты можно также получить методами химического пептидного синтеза или модификацией полинуклеотида, кодирующего пептид, комбинацию пептид-носитель или Fc фрагмент и/или пептидный фрагмент "пептитела". Термин "Fc" относится к одному типу носителя по данному изобретению и содержит последовательность неантигенсвязывающего фрагмента антитела, образующегося в результате протеолитического расщепления целого антитела, в мономерной или мультимерной форме. Источником Fc по данному изобретению является предпочтительно полностью человеческий Fc и может быть любой из иммуноглобулинов, хотя предпочтительными являются IgG1 и IgG2. Однако также по данному описанию охватываются молекулы Fc частично человеческие или получаемые из нечеловеческих видов. Fc составлены из мономерных полипептидов, которые могут быть связаны в димерные или мультимерные формы ковалентной связью (т.е. дисульфидными связями) и с помощью нековалентной ассоциации. Число межмолекулярных дисульфидных связей между мономерными субъединицами молекул нативного Fc составляет от 1 до 4 в зависимости от класса (например, IgG, IgA, IgE) или подкласса (например, IgG1, IgG2, IgG3,IgA1, IgA2). Одним примером нативного Fc является связанный дисульфидной связью димер, получающийся при расщеплении IgG под действием папаина [см. Ellison et al. (1982), Nucl. Acids Res. 10: 4071-9]. Термин "нативный Fc", применяемый в данном описании, является родовым по отношению к мономерным, димерным и мультимерным формам. Термин "Fc область (домен)" охватывает молекулы нативного Fc и Fc вариантов и последовательности по определению выше. Как в случае Fc вариантов и нативных Fc, термин "Fc область (домен) охватывает молекулы в мономерной и мультимерной форме, полученные либо при расщеплении целого антитела, либо другими способами. Термин "мультимер" в применении к Fc областям или молекулам, содержащим Fc области, относится к молекулам, имеющим две полипептидные цепи или более, ассоциированные за счт ковалентных взаимодействий, нековалентных взаимодействий, или как за счт ковалентных, так и за счт нековалентных взаимодействий. Молекулы IgG, как правило, образуют димеры; IgM-пентамеры; IgD-димеры; иIgA-мономеры, димеры, тримеры и тетрамеры. Мультимеры могут образовываться за счт использования последовательности и результирующей активности нативного Ig-источника Fc или за счт дериватизации(по определению см. ниже) такого нативного Fc. Термин "димер" в применении к Fc областям или молекулам, содержащим Fc области, относится к молекулам, имеющим две полипептидные цепи, ассоциированные за счт ковалентных или нековалентных связей. Термин "носитель" относится к молекуле, которая предотвращает расщепление и/или повышает период полужизни, снижает токсичность, уменьшает иммуногенности или повышает биологическую активность терапевтического белка. Примеры носителей включают Fc область, а также линейный полимер- 20008248 США 5229490, принадлежащий Tam, выданный 20 июля 1993 г.; международная заявка WO 93/21259 авторов Frechet et al., опубликованная 28 октября 1993 г.); липид, группа холестерина (например, стероид); углевод или олигосахарид; или любой природный или синтетический белок, полипептид или пептид,который связывается с рецептором-"утилизатором". Носители дополнительно описаны ниже. Термины "дериватизация" и "производное" или "дериватизированный" обозначают процессы и полученные в результате соединения соответственно, в которых (1) соединение содержит циклический фрагмент; например перекрстное связывание между цистеинильными остатками в соединении; (2) соединение перекрстно связано или содержит сайт перекрстного связывания; например, соединение содержит цистеинильный остаток и, следовательно, образует димер за счт перекрстного связывания в культуре in vivo; (3) одна или более пептидильных связей замещаются непептидильной связью; (4) Nконец заменяется на -NRR1, NRC(O)R1, -NRC(O)ORl, -NRS(O)2R1, -NHC(O)NHR, сукцинимидную группу, или замещнный или незамещнный бензоилоксикарбонил-NH-, где R и R1 и заместители в цикле определены ниже; (5) С-конец на -C(O)R2 или -NR3R4, где определение R2, R3 и R4 дано ниже; и (6) соединения, в которых индивидуальные аминокислотные фрагменты модифицированы обработкой агентами, способными реагировать с выбранными боковыми цепями или концевыми остатками. Производные дополнительно описаны ниже. Термин "пептид" относится к молекулам, содержащим, примерно, 3-75 аминокислот, при этом предпочтительны молекулы, содержащие около 5-50 аминокислот, более предпочтительны молекулы,содержащие около 8-40, и наиболее предпочтительны молекулы, содержащие 10-25 аминокислот. Пептиды могут иметь природные или искусственные (т.е. не встречающиеся в природе) аминокислотные последовательности. Примеры пептидов могут получаться любыми методами, представленными в данном описании, такими как использование пептидной библиотеки (например, метод фагового дисплея),химический синтез, расщепление пептидов или метод рекомбинантной ДНК. Термин "фармакологически активное" обозначает, что найдено, что описанное таким образом вещество обладает активностью, которая влияет на медицинские показатели (например, кровяное давление, число гемоцитов, уровень холестерина) или на болезненное состояние (например, рак, аутоиммунные расстройства и т.д.). Термины "пептид-антагонист, пептид антагонистического действия" или "ингибирующий пептид" относятся к пептиду, который блокирует биологическую активность, или каким-либо образом препятствует биологической активности ассоциированного представляющего интерес белка, или обладает биологической активностью, сравнимой с известным антагонистом или ингибитором ассоциированного представляющего интерес белка. Так, термин "пептид-антагонист Ang-2" охватывает пептиды, которые, как можно идентифицировать или установить, обладают антагонистическими в отношении Ang-2 признаками. Кроме того, в данное описание включены физиологически приемлемые соли соединений по изобретению. Под "физиологически приемлемыми солями" подразумеваются любые соли, известные или станут известными позже как фармацевтически приемлемые. Некоторые конкретные примеры: ацетат; трифторацетат; галогенводороды (галоидводороды), такие как хлоргидрат и бромгидрат; сульфат; цитрат; тартрат; гликолят; и оксалат, мезилат и фосфат."Пептитела" Один аспект настоящего изобретения связан с созданием Ang-2 "пептител". Взаимодействие белкалиганда со своим рецептором часто происходит на относительно большой поверхности раздела. Однако,как показано для соматотропина и его рецептора, только несколько ключевых (важных) остатков на поверхности раздела вносят вклад в энергию связывания. Clackson et al., Science 267; 383-6 (1995). Основной объм белка-лиганда просто выявляет связывающие эпитопы в правильной топологии или служит в качестве функций, не связанных со связыванием. Так, молекулы только на длине "пептида" (как правило,2-40 аминокислот) могут связываться с рецепторным белком данного большого белка-лиганда. Такие пептиды могут имитировать биоактивность большого белка-лиганда ("пептидные агонисты", "пептидыагонисты") или за счт конкурентного связывания ингибировать биоактивность большого белка-лиганда("пептидные антагонисты", "пептиды-антагонисты"). Фаговый дисплей является эффективным методом для идентификации таких пептидных агонистов и антагонистов. См, например, Scott et al., Science 249: 386 (1990); Devlin et al., Science 249: 404 (1990); патент США 5223409, выданный 29 июня 1993 г.; патент США 5733731, выданный 31 марта 1998 г.; патент США 5498530, выданный 12 марта 1996 г.; патент США 5432018, выданный 11 июля 1995 г.; патент США 5338665, выданный 16 августа 1994 г.; патент США 5922545, выданный 13 июля 1999 г.; международная заявка WO 96/40987, опубликованная 19 декабря 1996 г. и международная заявка WO 98/15833,опубликованная 16 апреля 1998 г. (каждый из этих источников вводится в данное описание в качестве ссылки). В пептидных библиотеках для выявления пептидов методом фагового дисплея случайные пептидные последовательности можно выявлять слиянием с оболочечными белками нитчатого фага. Если требуется, выявленные пептиды можно, используя метод аффинной хроматографии, элюировать против связанного с антителом внеклеточного домена рецептора. Удержанный фаг может быть обогащен за счт последовательных циклов аффинной очистки и повторного культивирования. См., например, Cwirla etal., Science 276: 1696-9 (1997), где были идентифицированы два различных семейства. Пептидные последовательности могут подсказать, какие остатки можно безопасно заменить на аланин ("alanine-scanning")- 21008248 или мутагенезом на уровне ДНК. Можно создать библиотеки, провести мутагенез, а затем скрининг для дополнительной оптимизации последовательностей лучших связывающихся агентов. Lowman, Ann. Rev.Biophys. Biomol. Struct. 26:401-24(1997). Для определения пептидов, которые имитируют связывающую активность больших белковлигандов можно также использовать структурный анализ белок-белкового взаимодействия. В таких анализах структура может подсказать идентичность и относительную ориентацию существенно важных(критических), остатков большого белка-лиганда, из которого можно построить (создать) пептид. См.,например, Takasaki et al., Nature Biotech 15: 1266-70 (1997). Эти аналитические методы можно также применять для изучения взаимодействия между рецепторным белком и пептидами, выбираемыми методом фагового дисплея, который может подсказать дальнейшую модификацию пептидов с целью повышения аффинности связывания. Другие методы конкурируют с методом фагового дисплея в исследовании пептидов. Пептидную библиотеку можно сливать (присоединять) по карбоксильному концу белка-репрессора lac и экспрессировать в Е. coli. Другой метод с использованием Е. coli делает возможным дисплей на внешней клеточной мембране за счт слияния с липопротеидом, ассоциированным с пептидогликаном (PAL). В дальнейшем эти и родственные методы в данном описании объединены общим названием "Е. coli дисплей". В другом методе перед выделением рибосом прекращают трансляцию произвольной РНК, в результате получают библиотеку полипептидов со вс ещ присоединнной ассоциированной с ними РНК. В дальнейшем в данном описании этот и родственные методы употребляются под общим названием "рибосомный дисплей". Другие методы используют химическое связывание пептидов с РНК. См., например, Roberts and Szostak, Proc. Natl. Acad. Sci. USA 94: 12297-303 (1997). В дальнейшем в данном описании этот и родственные методы в целом называются "РНК-пептидный скрининг". Создаются получаемые химическим синтезом пептидные библиотеки, в которых пептиды иммобилизуют на стабильных материалах небиологического происхождения, таких как полиэтиленовые стержни или полимеры, проницаемые для растворителя. В других образованных химическим способом пептидных библиотеках используют фотолитографию для сканирования пептидов, иммобилизованных на предметных стеклах. В дальнейшем в данном описании эти и родственные методы имеют общее название "химический пептидный скрининг"(скрининг пептидов, полученных химическим путм). "Химический пептидный скрининг" может иметь преимущества, так как позволяет применять D-аминокислоты и другие неприродные аналоги, а также непептидные элементы. Обзор как биологических, так и химических методов дан в Wells and Lowman, Curr.Opin. Biotechnol., 3: 355-62 (1992). Умозрительно понятно, что можно обнаружить пептиды-миметики любого белка, используя метод фагового дисплея и другие приведнные выше методы. Эти методы были использованы для эпитопного картирования, для идентификации важных (критических) для белок-белкового взаимодействия аминокислот, и в качестве ключевых методов для открытия новых терапевтических агентов. См., например,Cortese et al., Curr. Opin. Biotech. 7: 616-21 (1996). В настоящее время пептидные библиотеки очень часто используются в иммунологических исследованиях, таких как эпитопное картирование. См. Kreeger, TheScientist 10(13): 19-20 (1996). Пептиды, определнные скринингом библиотек методом фагового дисплея, скорее рассматриваются как "ключевые" в создании терапевтических агентов, нежели как сами терапевтические агенты. Аналогично другим белкам и пептидам, они, по-видимому, быстро удаляются in vivo либо почечной фильтрацией, либо по механизмам клеточного клиренса в ретикулоэндотелиальной системе, либо путм протеолитического распада [Francis, (см. выше)]. В результате в настоящее время в технике пептиды используют для подтверждения целевых препаратов (препаратов-мишеней), либо в качестве "скелета," основы для дизайна органических соединений, которые , которые невозможно так легко или так быстро обнаружить скринингом химических библиотек [Lowman, см. выше; Кау et al., (см. выше)]. Способ, позволяющий, используя такие пептиды, более просто получить терапевтические агенты против ангиогенеза, дал бы большие преимущества. Структура "пептител" В составах полипептида, получаемых в соответствии с данным изобретением, пептид может быть связан с носителем по N- или по С-концу пептида. Таким образом, молекулы носитель-пептид по данному изобретению можно описать в виде следующих пяти формул и в виде из мультимеров:-(Ll)с-P1-(L2)d-P2-(L3)e-P3-(L4)f-P4; Р 1, Р 2, Р 3 и Р 4, каждый независимо, обозначают последовательности или фармакологически активные пептиды по данному описанию;"а", b", "с", "d", "e" и "f", каждый независимо, обозначают 0 и 1, при условии, что по меньшей мере один из "а" и "b" обозначает 1. Пептиды В настоящем изобретении рассматриваются пептиды, которые селективно связываются с Ang-2. По данному изобретению может использоваться любое количество таких пептидов. Метод фагового дисплея, в частности, применим для получения пептидов, используемых по данному изобретению, так как было показано, что аффинная селекция из библиотек случайных пептидов может быть использована для идентификации пептидных лигандов для любого сайта любого генного продукта. Dedman et al., J. Biol.Chem. 268: 23025-30 (1993). Пептиды по данному изобретению могут быть получены любыми методами, описанными в уровне техники. Используются однобуквенные аббревиатуры аминокислот. Термин "X" в любой последовательности (и по всему описанию, если в конкретном случае не указано иначе) означает, что может присутствовать любой из 20 природных аминокислотных остатков или любая из синтетических (неприродных) аминокислот (описанных далее в разделе "Варианты"). Любые из этих пептидов могут быть связаны парами, тандемом (т.е. последовательно), с линкером или без него, и примеры пептидов, связанные тандемом, представлены в таблице. Линкеры обозначены "L" и могут представлять собой любые из линкеров по данному описанию. Показаны тандемные повторы и линкеры, разделнные для ясности тире. Любой пептид, содержащий цистеинильный остаток, может быть перекрстно связан с другим Cys-содержащим пептидом, каждый из которых или они оба могут быть связаны с носителем. Любой пептид, содержащий более одного Cys остатка, может также образовывать внутрипептидную дисульфидную связь. Любой из этих пептидов может быть дериватизирован по данному описанию. В производных, у которых карбоксильный конец может заканчиваться аминогруппой, эта завершающая аминогруппа представляет собойNH2. В производных, у которых аминокислотные остатки заменены фрагментами, отличными от аминокислотных остатков, замены обозначаются S, что обозначает любой фрагмент, описанный в Bhatnagar etal., J. Med. Chem. 39: 3814-9 (1996) и Cuthbertson et al., J. Med. Chem. 40: 2876-82 (1997), которые вводятся в данное описание в качестве ссылки. Если не указано иначе, все пептиды связаны пептидной связью. Носители В одном варианте настоящее изобретение включает по меньшей мере один пептид для присоединения по меньшей мере к одному носителю (F1, F2) по N-концу, С-концу или по боковым цепям одного из аминокислотных остатков пептида(ов). Можно также использовать разные носители; например, Fc на каждом конце или на одном конце Fc, а на другом конце или в боковой цепи - группу ПЭГ. Область (домен) Fc является одним предпочтительным носителем. Область Fc может быть слита сN- или С-концом пептидов или как с N-, так и с С-концом. Как отмечалось выше, Fc варианты являются подходящими носителями в объме данного изобретения. Нативный Fc может быть значительно модифицирован для образования Fc варианте по данному изобретению при условии, что связывание с рецептором-утилизатором сохраняется. См., например, международные заявки WO 97/34631 и WO 96/32478. В таких Fc вариантах можно удалять один или более сайтов нативного Fc, которые придают структурные особенности или функциональную активность, не требующиеся в слитых молекулах по данному изобретению. Можно удалить эти сайты, например, заменой или делецией остатков, инсерцией остатков в сайт или отсекая участки, содержащие сайт. Встроенные или замещнные остатки могут также быть изменнными аминокислотами, такими как пептидомиметики или D-аминокислоты. Fc варианты могут быть желательны по ряду причин, некоторые из этих причин описаны ниже. Примеры Fc вариантов включают молекулы и последовательности, в которых 1. Сайты, участвующие в образовании дисульфидной связи, удаляют. Такое удаление позволяет избежать реакции с другими цистеинсодержащими белками, находящимися в клетке-хозяине, используемой для продуцирования молекул по изобретению. Для этой цели цистеинсодержащий сегмент на Nконце можно отсечь или можно удалить цистеиновые остатки или заменить их на остатки других аминокислот (например, аланил, серил). Даже если цистеиновые остатки удалены, одноцепочечные Fc области вс ещ образуют димерный Fc домен, который удерживается вместе за счт нековалентных связей. 2. Нативный Fc домен модифицируют, чтобы сделать его более совместимым с выбранной клеткойхозяином. Например, можно удалить РА последовательность близ N-конца типичного нативного Fc домена (нативной Fc области), который может распознаваться расщепляющим ферментом в Е. coli, таким как пролиниминопептидаза. Также можно добавить N-концевой метионильный остаток, особенно, когда молекулу экспрессируют методом рекомбинантной ДНК в бактериальной клетке, такой как Е. coli. 3. Часть N-конца нативного Fc удаляют с целью предотвратить N-концевую гетерогенность при экспрессии в выбранной клетке-хозяине. Для этой цели можно удалить любые из первых 20 аминокислотных остатков на N-конце, в частности, в положениях 1, 2, 3, 4 и 5. 4. Один или более сайтов гликозилирования удаляют. Остатки, которые, как правило, гликозили- 23008248 руются (например, аспарагин), могут придать цитолитическую активность. Такие остатки можно удалить или заменить на негликозилированные остатки (например, аланин). 5. Сайты, участвующие во взаимодействии с комплементом, такие как Clq-связывающий сайт, удаляют. Например, можно удалить или заменить ЕКК последовательность человеческого IgG1. Восстановление комплемента может быть неблагоприятным для молекул по данному изобретению и поэтому его можно избежать с помощью такого Fc варианта. 6. Сайты, которые влияют на связывание с Fc рецепторами, иными, нежели рецептор-утилизатор,удаляют. Нативный Fc может содержать сайты для взаимодействия с некоторыми лейкоцитами, которые не требуются для слитых молекул по данному изобретению и поэтому их можно удалить. 7. Сайт ADCC удаляют. Сайты ADCC известны в технике. См., например, Molec. Immunol. 29 (5): 633-9 (1992) относительно сайтов ADCC в IgG1. Эти сайты также не требуются для слитых молекул по данному изобретению и поэтому их можно удалить. 8. Если нативный Fc получают из нечеловеческого антитела, нативный Fc может быть "гуманизирован". Как правило, для гуманизации нативного Fc можно заменить выбранные остатки в нечеловеческом нативном Fc на остатки, которые обычно обнаруживают в человеческом нативном Fc. Методы гуманизации антител хорошо известны в технике. Альтернативным носителем может быть белок, полипептид, пептид, антитело, фрагмент антитела,малая молекула (например, пептидомиметик), способные связываться с рецептором-утилизатором. Например, можно в качестве носителя использовать полипептид, описанный в патенте США 5739277, выданный 14 апреля 1998 г. Presta et al. Пептиды можно выбирать методом фагового дисплея по признаку связывания с рецептором-"утилизатором" FcRn. Такие связывающие рецептор-"утилизатор" соединения также охватываются понятием "носитель" и входят в объм данного изобретения. Такие носители следует выбирать вследствие увеличенного периода полужизни (например, за счт отсутствия последовательностей, распознаваемых протеазами) и пониженной иммуногенности (например, за счт того, что предпочитаются неиммуногенные последовательности, описанные при гуманизации антител). Как отмечалось выше, полимерные носители также можно использовать в качестве F1 и F2. Различные значения для связанных химических фрагментов, пригодных в качестве носителей, доступны в настоящее время, см., например, международную заявку РСТ (Договор о патентной кооперации) WO 96/11953, озаглавленную "N-Terminally Chemically Modified Protein Compositions and Methods", которая ссылкой вводится в данное описание во всей полноте. В этой публикации РСТ, среди прочего, описывается селективное связывание водорастворимых полимеров с N-концом белков. Предпочтительным полимерным носителем является полиэтиленгликоль ПЭГ. Группа ПЭГ может быть любого подходящего молекулярного веса и может быть линейной или разветвлнной. Средний молекулярный вес ПЭГ предпочтительно составляет примерно от 2 до 100 килодальтон (кДа), более предпочтительно около 5-50 кДа, наиболее предпочтительно около 5-10 кДа. Группы ПЭГ, как правило, присоединяются к соединениям по изобретению с помощью ацилирования или восстановительного алкилирования за счт взаимодействия реакционноспособной группы в ПЭГ-фрагменте (например, альдегидной, амино, тиольной или сложноэфирной группы) с реакционноспособной группой соединения по изобретению (например, альдегидной, тиольной или сложноэфирной группы). Применяемая стратегия ПЭГирования синтетических пептидов состоит в присоединении за счт конъюгирования в растворе пептида и фрагмента ПЭГ, причм каждый нест особую функциональность,так что они являются реакционноспособными (реактивными) по отношению друг к другу. Пептиды можно легко получать обычным твердофазным синтезом, известным в технике. Пептиды "предварительно активируют" с помощью соответствующей функциональной группы в конкретном сайте. Предшественники очищают и полностью характеризуют перед реакцией с фрагментом ПЭГ. Лигирование пептида с ПЭГ обычно происходит в водной фазе и его легко контролировать (мониторинг) обращнно-фазовой аналитической ВЭЖХ. ПЭГированные пептиды можно легко очистить препаративной ВЭЖХ и охарактеризовать аналитической ВЭЖХ, аминокислотным анализом и лазерной десорбционной масс-спектрометрией. Полисахаридные полимеры представляют собой другой тип водорастворимых полимеров, которые можно использовать для модификации белков. Декстраны являются полисахаридными полимерами, состоящими из отдельных субъединиц глюкозы, преимущественно связанных связями а 1-6. Сам декстран выпускается с различными интервалами молекулярной массы, легко доступен декстран с молекулярной массой 1-70 кДа. Декстран представляет собой водорастворимый полимер для применения по данному изобретению в качестве носителя как сам по себе, так и в комбинации с другим носителем (например,Fc). См., например, международные заявки WO 96/11953 и WO 96/05309. Сообщалось о применении декстрана, конъюгированного с терапевтическими или диагностическими иммуноглобулинами: см., например, европейскую патентную заявку 0315456, которая вводится в данное описание в качестве ссылки. Предпочтительно, чтобы декстран, применяемый в качестве носителя по данному изобретению, имел молекулярную массу 1-20 кДа. Линкеры Любая "линкерная " группа является необязательной. Если эта группа присутствует, е химическое строение не важно, так как прежде всего она служит в качестве спейсера. Линкер предпочтительно со- 24008248 стоит из аминокислот, связанных вместе пептидными связями. Так, в предпочтительных вариантах изобретения линкер состоит из 1-20 аминокислот, связанных пептидными связями, причм аминокислоты выбирают из 20 природных аминокислот. Одна или более из этих аминокислот могут быть гликозилированными, что хорошо понимают специалисты в данной области техники. В более предпочтительных вариантах изобретения аминокислоты от 1 до 20 выбирают из глицина, аланина, пролина, аспарагина, глутамина и лизина. Ещ более предпочтительно, когда линкер состоит из большинства стерически незатрудннных аминокислот, таких как глицин и аланин. Так, предпочтительными линкерами являются полиглицины (в частности, (Gly)5, (Gly)8), поли(Glу-Ala) и полиаланины. Комбинации Gly и Ala также являются предпочтительными в качестве линкера, называемого в данном описании К 1 и имеющего аминокислотную последовательность, представленную далее в примерах. Возможны также непептидные линкеры. Например, алкильные линкеры, такие как -NH-(CH2)sC(O)-, где можно использовать значение s=2-20. Эти алкильные линкеры могут дополнительно иметь в качестве заместителя любую пространственно незатрудннную группу, такую как низший алкил (например, C1-С 6), низший ацил, галоген (например, Cl, Br), CN, NH2, фенил и т.д. Примером непептидного линкера является линкер ПЭГ с молекулярной массой, равной от 100 до 5000 кДа, предпочтительно 100500 кДа. Пептидные линкеры можно варьировать, образуя производные описанным выше способом. Варианты и производные В объм настоящего изобретения входят варианты и производные специфических связывающих агентов. Понятно, что конкретный специфический связывающий агент по настоящему изобретению может содержать один, два или все три типа вариантов. Варианты с инсерцией или заменой могут содержать природные аминокислоты, нетрадиционные (неприродные) аминокислоты или и те, и другие. В одном примере включены варианты с инсерцией, в которых один или более аминокислотных остатков, либо природных, либо нетрадиционных аминокислот дополняют аминокислотную последовательность пептида или "пептитела". Инсерции могут быть локализованы на любом конце белка или на обоих его концах или могут быть позиционированы во внутренних областях аминокислотной последовательности "пептитела". Инсерционные варианты с дополнительными остатками по любому концу или по обоим концам могут включать, например, слитые белки или белки, содержащие аминокислотные "хвосты" или метки. Инсерционные варианты включают пептиды и "пептитела", в которых один или более аминокислотных остатков добавлено к аминокислотной последовательности пептида или "пептитела" или ее фрагменту. Варианты продуктов по изобретению включают также зрелые пептиды и "пептитела", у которых удалены лидерная или сигнальная последовательности, и образующиеся в результате белки, содержащие дополнительные аминокислотные концевые остатки, причм аминокислоты могут быть природными и неприродными. Рассматриваются специфически связывающиеся агенты (такие как "пептитела") с дополнительным метионильным остатком в аминокислотном положении -1 (Met-1-"пептитело"), так же как специфически связывающиеся агенты с дополнительными остатками метионина и лизина в положениях 2 и -1 (Met-2-Lys-1-). Варианты, содержащие дополнительные остатки Met, Met-Lys, Lys, особенно пригодны для повышенной продукции рекомбинантных белков ив бактериальных клетках-хозяевах. Изобретение также охватывает варианты специфически связывающихся агентов, содержащие дополнительные аминокислотные остатки, образующиеся при использовании специфических систем экспрессии. Например, применение промышленных векторов, которые экспрессируют заданный полипептид как часть продукта слияния с глутатион-S-трансферазой (GST), дат заданный полипептид, содержащий дополнительный остаток глицина в аминокислотном положении -1, после отщепления компонента GST от заданного полипептида. Рассматриваются также варианты, получающиеся в результате экспрессии в другой векторной системе, включая варианты, в которых в аминокислотную последовательность, как правило, на карбокси- и/или аминоконце последовательности, встроен полигистидиновый "хвост". Инсерционные варианты также включают слитые белки, в которых амино- и/или карбоксиконцы пептида или "пептитела" слиты с другим полипептидом, его фрагментом или аминокислотами, которые,как правило, не распознаются как часть последовательности любого конкретного белка. Примерами таких слитых белков являются иммуногенные полипептиды, белки с продолжительным периодом полужизни в кровотоке, такие как константные области иммуноглобулина, маркерные белки, белки или полипептиды, которые облегчают очистку заданного пептида или "пептитела", и полипептидные последовательности, которые промотируют образование мультимерных белков (такие как лейциновая застжка"молния", которая пригодна для образования/стабильности димера). Такой тип инсерционного варианта, как правило, содержит всю нативную молекулу или е значительную часть, связанную по N- или по С-концу с целым вторым полипептидом или с его частью. Например, слитые белки, как правило, используют лидерные последовательности от других видов, чтобы благоприятствовать рекомбинантной экспрессии белка в гетерологичном хозяине. Другой применяемый белок включает добавление иммунологически активной области, такой как эпитоп антитела, с целью облегчить очистку слитого белка. Включение сайта расщепления в место слияния или рядом с ним облегчает удаление "чужого" полипептида после очистки. Другие применимые слияния включают связывание функциональных областей, таких как активные сайты ферментов, области гликозилирования, сигналы- 25008248 нацеливания на клетки или трансмембранные области. Существуют различные промышленные системы экспрессии слитых белков, которые могут использоваться по данному изобретению. Особенно пригодные системы включают, но без ограничения, систему глутатион-S-трансферазы (GST) (Pharmacia), систему белка связывания мальтозы (NEB, Beverley, MA),систему FLAG (IBI, New Haven, CT) и систему 6xHis (Qiagen, Chatsworth, CA). Эти системы способны продуцировать рекомбинантные пептиды и/или "пептитела", несущие только небольшое количество дополнительных аминокислот, которые, по-видимому, незначительно влияют на активность пептида или"пептитела". Например, как система FLAG, так и система 6xHis добавляют только короткие последовательности, о которых известно, что они обе являются слабо антигенными и не оказывают вредного влияния на укладку полипептида в нативную конформацию. Другое слияние по N-концу, которое рассматривается как пригодное, представляет собой слияние дипептида Met-Lys по N-концевой области белка или пептидов. Такое слияние может дать благоприятное повышение экспрессии или активности белка. Другие слитые системы продуцируют полипептидные гибриды, в которых следует вырезать партнр слияния от заданного пептида или "пептитела". В одном варианте связан с рекомбинантным "пептителом" с помощью пептидной последовательности, содержащей специфическую последовательность распознавания протеазой. Примерами соответствующих последовательностей являются последовательности, которые распознаются протеазой вируса гравировки табака (TEV) (Life Technologies, Gaithersburg,MD) или фактором Ха (New England Biolabs, Beverley, MA). Изобретение также охватывает слитые полипептиды, которые содержат целый пептид или целое"пептитело" по данному изобретению или их часть в комбинации с усечнным тканевым фактором (tTF).tTF представляет собой агент, нацеленный на сосуды, состоящий из усечнной формы человеческого белка, вызывающего коагуляцию, который ведт себя как агент, коагулирующий кровь в кровеносных сосудах опухоли, как описано в патентах США 5877289; 6004555; 6132729; 6132730; 6156321 и в европейском патенте ЕР 0988056. Слияние tTF с aнти-Ang-2 "пептителом" или пептидом или его фрагментом облегчает доставку aнти-Ang-2 к клеткам-мишеням. В другом аспекте изобретение включает варианты с делецией, в которых удалены один или более аминокислотных остатков в пептиде или "пептителе". Делеции можно получать на одном или обоих концах пептитела или удалением одного или более остатков внутри аминокислотной последовательности"пептитела". Варианты с делецией обязательно включают все фрагменты пептида или "пептитела". Ещ в одном аспекте настоящее изобретение включает варианты пептидов или пептител по изобретению с аминокислотными заменами. Варианты с заменами включают такие пептиды и "пептитела", в которых удалены один или более аминокислотных остатков и заменены на одну или более альтернативных аминокислот, причм эти аминокислоты могут быть природными и неприродными. "Субституционные"(с заменами) варианты приводят к пептидам или "пептителам", которые "аналогичны" исходному пептиду или "пептителу", так как две молекулы содержат определнный процент идентичных аминокислот. Варианты с заменами включают замены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30 аминокислот пептида или "пептитела", при этом число замен может составлять вплоть до 10% или более аминокислот пептида или "пептитела". В одном аспекте замены являются консервативными по природе, однако, изобретение также охватывает замены, которые являются неконсервативными, и также включает нетрадиционные аминокислоты. Идентичность и подобие родственных пептидов и "пептител" можно легко рассчитать известными методами. Такие методы включают, но без ограничения, методы, описанные в Computational MolecularStockton Press, New York (1991); и Carillo et al., SIAM J. Applied Math., 48:1073 (1988). Предпочтительные методы определения родства или идентичности в процентах двух пептидов или полипептидов, или полипептида и пептида предполагают дизайн, дающий наибольшее количество совпадений между проверяемыми последовательностями. Методы определения идентичности описаны в общедоступных компьютерных программах. Предпочтительные компьютерные программы для определения идентичности двух последовательностей включают, но без ограничения, пакет программ GCG,включающий GAP (Devereux et al., Nucl. Acid. Res., 12:387 (1984); Genetics Computer Group, University ofWisconsin, Madison, WI, BLASTP, BLASTN и FASTA (Altschul et al., J. Mol. Biol., 215:403-10 (1990. Программа BLASTX является общедоступной из National Center for Biotechnology Information (NCBI) и других источников (BLAST Manual, Altschul et al. NCB/NLM/NIH Bethesda, MD 20894; Altschul et al., см. выше (1990. Для определения идентичности можно применять также общеизвестный алгоритм СмитаУотермана (Smith Waterman). Некоторые схемы совмещения (выравнивания) для сравнительного анализа первичной структуры двух аминокислотных последовательностей могут дать совмещение только короткого участка двух последовательностей, и эта малая область совмещения может иметь очень высокую степень идентичности последовательностей, даже если между двумя полноразмерными последовательностями нет заметного родства. Соответственно, в некоторых вариантах изобретения выбранный метод совмещения (программаGAP) дат в результате совмещение, которое перекрывает по меньшей мере десять процентов полной длины сравниваемого целевого полипептида, т.е. по меньшей мере 40 последовательных аминокислот,если сравниваются последовательности, содержащие по меньшей мере 400 аминокислот; 30 последовательных аминокислот, если сравниваются последовательности, содержащие по меньшей мере около 300400 аминокислот; по меньшей мере 20 последовательных аминокислот, если сравниваются последовательности, содержащие около 200-300 аминокислот; и по меньшей мере 10 последовательных аминокислот, если сравниваются последовательности, содержащие примерно 100-200 аминокислот. Например, с использованием компьютерного алгоритма GAP (Genetics Computer Group, Universityof Wisconsin, Madison, WI) два полипептида, для которых следует определить процент идентичности последовательностей, выравниваются с оптимальным совмещением их соответствующих аминокислот("общее перекрывание", как определено с помощью алгоритма). В некоторых вариантах изобретения в сочетании с алгоритмом применяют штрафную функцию за раскрытие щели (гэпа) (которое обычно рассчитывается как средняя диагональ 3 Х; "средняя диагональ" обозначает среднее значение диагонали применяемой матрицы сравнения; "диагональ" означает количественный показатель или число, отнеснное к каждой идеальной паре аминокислот при использовании конкретной матрице сравнения) и штрафную функцию за расширение щели (гэпа) (значение которого обычно составляет 1/10 от величины штрафной функции за раскрытие щели), а также матрицу сравнения, такую как РАМ 250 или BLOSUM 62. В некоторых вариантах изобретения стандартную матрицу сравнения (см. Dayhoff et al., Atlas of Protein Sequenceand Structure, 5(3) (1978) относительно матрицы сравнения РАМ 250; Henicoff et al., Proc. Natl. Acad. Sci.USA, 89:10915-10919 (1992) относительно матрицы сравнения BLOSUM 62) также применяют с помощью алгоритма. В некоторых вариантах изобретения параметры полипептидной последовательности сравнения включают следующие: Алгоритм: Needleman et al., J. Mol. Biol., 48:443-453 (1970); Матрица сравнения: BLOSUM 62 из Henikoff et al., см. выше (1992); Штрафная функция за щель: 12; Штрафная функция за протяжнность щели: 4; Порог подобия: 0. Программу GAP можно применять с приведнными выше параметрами. В некоторых вариантах изобретения вышеуказанные параметры представляют собой параметры по умолчанию для полипептидов сравнения (наряду с отсутствием "штрафная функция" за концевые щели) при использовании алгоритма GAP. В некоторых вариантах изобретения параметры последовательности сравнения полинуклеотидной молекулы (в противоположность аминокислотной последовательности) включают следующее: Алгоритм: Needleman et al., см. выше (1970); Матрица сравнения: совпадения (пары)=+10, несовпадение=0; Штрафная функция за щель: 50; Штрафная функция за протяжнность щели: 3. Программа GAP может также применяться с приведнными выше параметрами. Вышеуказанные параметры являются параметрами по умолчанию для полинуклеотидньгх молекул сравнения. Можно применять другие примеры алгоритмов, штрафной функции за раскрытие щелей, штрафной функции за расширение щелей, матриц сравнения, порогов подобия и т.д., включая значения этих показателей, представленные в Program Manual, Wisconsin Package, Version 9, September, 1997. Практический выбор, который следует сделать, очевиден для специалиста в данной области техники и зависит от конкретного сравнения, которое следует сделать, такого как ДНК-с-ДНК, белок-с-белком, белок-с-ДНК; и,кроме того, проводится ли сравнение между данными парами последовательностей (в этом случае, как правило, предпочтительными являются GAP или BestFit) или между одной последовательностью и большой базой данных последовательностей (в этом случае предпочтительными являются FASTA или BLASTA). В данном описании придерживаются общепринятых правил при употреблении двадцати традиционных аминокислот и их сокращений. См. монографию Immunology-A Synthesis (2nd Edition, E.S. Goluband D.R. Gren, Eds., Sinauer Associates, Sunderland, Mass. (1991), которая вводится в данное описание ссылкой для любых целей. Аминокислоты могут иметь либо L, либо D стереохимию (за исключением Gly, который не является ни L, ни D), а полипептиды и составы полипептидов по настоящему изобретению могут содержать комбинацию стереоизомеров. Однако предпочтительными являются L-стереоизомеры. Изобретение также охватывает молекулы с обратной последовательностью, в которых последовательность аминокислот от амино-конца до карбокси-конца является обратной. Например, если молекула имеет нормальную последовательность Х 1-Х 2-Х 3, то молекула с обратной последовательностью будет Х 3-X2-X1. Изобретение также охватывает "ретро-обратные" молекулы, в которых, как указано выше, последовательность аминокислот от амино-конца до карбокси-конца является обратной и остатки, которые обычно являются "L" энантиомерами, находятся в "D" стереоизомерной форме. Стереоизомеры (например, D-аминокислоты) двадцати традиционных аминокислот, неприродные аминокислоты, такие как -, -дизамещнные аминокислоты, N-алкиламинокислоты, молочная кислота- 27008248 и другие нетрадиционные аминокислоты могут также быть подходящими компонентами для полипептидов по данному изобретению. Примеры нетрадиционных аминокислот включают, без ограничения, аминоадипиновую кислоту, бета-аланин, бета-аминопропионовую кислоту, аминомасляную кислоту, пиперидиновую кислоту, аминокапроновую кислоту, аминогептановую кислоту, аминоизомасляную кислоту,аминопимелиновую кислоту, диаминомасляную кислоту, десмозин, диаминопимелиновая кислота, диаминопропионовая кислота, N-этилглицин, N-этиласпарагин, гидроксилизин, алло-гидроксилизин, гидроксипролин, изодесмозин, алло-изолейцин, N-метилглицин, саркозин, N-метилизолейцин, N-метилвалин,норвалин, норлейцин, оритин, 4-гидроксипролин, -карбоксиглутамат, -N,N,N-триметиллизин, -N-ацетиллизин, О-фосфосерин, N-ацетилсерин, N-формилметионин, 3-метилгистидин, 5-гидроксилизин, -Nметиларгинин и другие аналогичные аминокислоты и аминооксикислоты (например, 4-гидроксипролин). Аналогично, если не указано иначе, левый конец однонитевых полинуклеотидных последовательностей обозначается как 5' конец; направление двухнитевых полинуклеотидных последовательностей влево называется 5' направление. Направление от 5' конца к 3' концу образующихся РНК транскриптов называется направление транскрипции; участки последовательности на нити ДНК, имеющие ту же последовательность, что и РНК, и которые расположены 5' к 5' концу РНК транскрипта, называются "последовательности в обратном направлении, upstream"; участки последовательности на нити ДНК, имеющие ту же последовательность, что и РНК, и которые расположены 3' к 3' концу РНК транскрипта, называются "последовательности в прямом направлении, downstream". Понятно, что аминокислотные остатки можно разделить на классы, исходя из свойств общих боковых цепей: 1. Нейтральные гидрофобные: Аланин (Ala; А), Валин (Val; V), Лейцин (Leu; L), Изолейцин (Ilе; I),Пролин (Pro; Р), Триптофан (Trp; W), Фенилаланин (Phe; F) и Метионин (Met, M). 2. Нейтральные полярные: Глицин (Gly; G); Серин (Ser; S), Треонин (Thr; T), Тирозин (Туr; Y), Цистеин (Cys; С), Глутамин (Glu; Q), Аспарагин (Asn; N) и Норлейцин. 3. Кислые: Аспарагиновая кислота (Asp; D), Глутаминовая кислота (Glu; E). 4) Основные: Лизин (Lys; K), Аргинин (Arg; R), Гистидин (His; H). См. Lewin, В., Genes V., Oxford University Press (1994), p.11. Консервативные аминокислотные замены могут включать нетрадиционные аминокислотные остатки, которые, как правило, встраиваются скорее химическим пептидным синтезом, нежели синтезом в биологических системах. Эти замены включают, без ограничения, пептидомиметики и другие обратные или инверсные формы аминокислотных фрагментов. Неконсервативные замены могут включать замену представителя одного из этих классов на представителя другого класса. При осуществлении этих замен (изменений), согласно некоторым вариантам изобретения, можно учитывать гидропатический индекс. Каждой аминокислоте присвоен гидропатический индекс, исходя из показателей е гидрофобности и заряда. Эти индексы суть следующие: изолейцин (+4.5); валин (+4.2); лейцин (+3.8); фенилаланин (+2.8); цистеин/цистин (+2.5); метионин (+1.9); аланин (+1.8); глицин (-0.4); треонин (-0.7); серин (-0.8); триптофан (-0.9); тирозин (-1.3); пролин (-1.6); гистидин (-3.2); глутамат(-3.5); глутамин (-3.5); аспартат (-3.5); аспарагин (-3.5); лизин (-3.9) и аргинин (-4.5). Из уровня техники понятно, как важен гидропатический индекс аминокислоты для приобретения белком интерактивной биологической функции. Kyte et al., J. Mol. Biol., 157: 105-131 (1982). Известно,что некоторые аминокислоты можно заменить на другие аминокислоты, имеющие сходный гидропатический индекс или показатель и вс ещ сохраняет аналогичную биологическую активность. При изменениях на основе гидропатического индекса некоторые варианты изобретения включают замены аминокислот, гидропатические индексы которых находятся в пределах 2. Некоторые варианты изобретения включают замены аминокислот, гидропатические индексы которых находятся в пределах 1, а некоторые варианты изобретения включают замены аминокислот, гидропатические индексы которых находятся в пределах 0.5. Также из уровня техники понятно, что замену подобной аминокислоты можно эффективно провести с учтом гидрофильности, когда полученное таким образом биологически функциональное "пептитело" или полученный таким образом биологически функциональный пептид предполагается использовать в иммунологических вариантах изобретения, как в настоящем случае. В некоторых вариантах изобретения наибольшая локальная средняя гидрофильность белка, обусловленная гидрофильностью его смежных аминокислот, коррелируется с его иммуногенностью, т.е. с биологическим свойством белка. Следующие значения гидрофильности относятся к этим аминокислотным остаткам; аргинин (+3.0); лизин (+3.0); аспартат (+3.0 1); глутамат (+3.0 1); серин (+0.3); аспарагин (+0.2); глутамин (+0.2); глицин (0); треонин (- 0.4); пролин (-0.5 1); аланин (-0.5); гистидин (-0.5); цистеин (-1.0); метионин (-1.3); валин (-1.5); лейцин (-1.8); изолейцин (-1.8); тирозин (-2.3); фенилаланин (-2.5) и триптофан (-3.4). При изменениях на основе сходных значений гидрофильности некоторые варианты изобретения включают замены аминокислот, величины гидрофильности которых находятся в пределах 2. Некоторые варианты изобретения включают замены аминокислот, величины гидрофильности которых находятся в пределах 1, а некоторые варианты изобретения включают замены аминокислот, величины гидрофильности которых- 28008248 находятся в пределах 0.5. Можно также идентифицировать эпитопы первичных аминокислотных последовательностей исходя из гидрофильности. Эти области также называются "эпитопные коровые области". Примеры аминокислотных замен представлены ниже, в табл. 2. Таблица 2 Аминокислотные замены Опытные специалисты в данной области техники способны определить подходящие варианты полипептида, представленные в данном описании, используя широко известные методы. В некоторых вариантах изобретения специалист в данной области техники может идентифицировать подходящие области молекулы, которые можно изменить, не нарушая активность, нацеливаясь на участки, которые, как полагают, не являются важными для активности. В некоторых вариантах изобретения можно идентифицировать остатки и фрагменты молекул, являющиеся консервативными в аналогичных пептидах или полипептидах. В некоторых вариантах изобретения даже области, которые могут быть важны для биологической активности или структуры, можно подвергнуть консервативным аминокислотным заменам, не нарушая биологическую активность или не оказывая вредного влияния на структуру полипептида. Кроме того, специалист в данной области техники может изучить работы по теме структурафункция, в которых идентифицируют остатки в сходных пептидах, которые важны для активности или структуры. Сравнение позволяет прогнозировать важность аминокислотных остатков в белке, которые соответствуют аминокислотным остаткам, важным для активности или структуры в аналогичных белках. Специалисты в данной области техники могут выбрать химически аналогичные замены на такие прогнозированные важные аминокислотные остатки. Специалисты в данной области техники могут также проанализировать трхмерную структуру и первичную структуру аминокислотной последовательности в сравнении с такой структурой в аналогичных полипептидах. С учтом такой информации специалист в данной области техники может прогнозировать совмещение аминокислотных остатков антитела относительно его трхмерной структуры. В некоторых вариантах изобретения специалист в данной области техники может предпочесть не делать радикальных изменений с аминокислотными остатками, которые, как прогнозировалось, расположены на- 29008248 поверхности белка, так как такие остатки могут участвовать в важных взаимодействиях с другими молекулами. Кроме того, специалист в данной области техники может создать пробные варианты, содержащие единственную аминокислотную замену при каждом заданном аминокислотном остатке. Затем можно провести скрининг вариантов, используя методы анализа активности, известные специалистам в данной области техники. Такие данные можно использовать для сбора информации о подходящих вариантах. Например, если обнаруживается, что изменение в конкретном аминокислотном остатке приводит к нарушенной, нежелательно пониженной или неподходящей активности, вариантов с такими изменениями можно избежать. Другими словами, с учтом информации, собранной в таких рутинных экспериментах, специалист в данной области техники может легко определить аминокислоты, дальнейших замен которых, одних или в комбинации с другими мутациями, следует избегать. Ряд научных публикаций посвящен прогнозированию вторичной структуры. См. Moult J., Curr. Op.Rev. Biochem., 47:251-276 и Chou et al., Biophys. J., 26:367-384 (1979). Кроме того, в настоящее время компьютерные программы могут помочь при прогнозировании вторичной структуры. Один метод прогнозирования вторичной структуры основан на моделировании по гомологии. Например, два полипептида или белка, последовательности которых идентичны более чем на 30%, или подобие которых выше 40%, часто имеют подобную структурную топологию. Увеличение за последнее время структурной базы данных белков (PDB) обеспечило повышенную предсказуемость вторичной структуры, включая потенциальное число складок в структуре полипептида или белка. См. Holm et al., Nucl. Acid. Res., 27(1):244247 (1999). Было высказано предположение (Brenner et al., Curr. Op. Struct. Biol., 7(3):369-376 (1997, что в данном полипептиде или белке существует ограниченное число складок и что, если решено критическое число структур, точность прогнозирования структур резко возрастает. Дополнительные методы прогнозирования вторичной структуры включают "вытягивание нити"(Holm, см. выше (1999), и Brenner, см. выше (1997. В некоторых вариантах изобретения варианты "пептитела" включают варианты гликозилирования,в которых один или более сайтов гликозилирования, таких как N-связанный сайт гликозилирования, добавлен к "пептителу". N-Связанный сайт гликозилирования характеризуется последовательностью: AsnX-Ser или Asn-X-Thr, в которой аминокислотный остаток, обозначенный как X, может быть любым аминокислотным остатком, кроме пролина. Замена или введение (добавление) аминокислотных остатков с целью создания этой последовательности дат потенциально новый сайт для введения N-связанной углеводной цепи. Или же замены, которые элиминируют эту последовательность, удаляют имеющуюся Nсвязанную углеводную цепь. Также охватывается перегруппировка N-связанных углеводных цепей, когда один или более N-связанных сайтов гликозилирования (как правило, тех, которые являются природными) элиминируются, а один или более новых N-связанных сайтов создаются. Изобретение также охватывает "производные", которые включают "пептитела", несущие модификации, отличные от инсерций, делеций или замен аминокислотных остатков или в дополнение к этим инсерциям, делециям или заменам. Предпочтительно, модификации являются ковалентными по природе и включают, например, химическую связь с полимерами, липидами, другими органическими и неорганическими фрагментами. Производные по изобретению можно получать с целью увеличения периода полужизни "пептитела" в кровотоке или для повышения целевой способности "пептитела" по отношению к заданным клеткам, тканям или органам. Примеры производных включают фрагменты, в которых сделаны одна или более из следующих модификаций: одна или более пептидильных [-C(O)NR-] связей (связей с пептидильным фрагментом) заменены на непептидильную связь, такую как -СН 2-карбаматную связь (связь с карбаматной группой) [-CH2O(CO)NR-]; фосфонатную связь; -СН 2-сульфонамидную [-CH2-S(O)2NR-] связь; уреиленовую (мочевина)[-C(O)NR6-, где R6 обозначает низший алкил]; пептиды, в которых N-конец превращен в -NRR1 группу; в -NRC(O)R группу; в -NRC(O)OR группу; в -NRS(O)2R группу; в -NHC(O)NHR группу, где R и R1 обозначают водород или низший алкил, при условии, что R и R1, оба вместе не обозначают водород; в сукцинимидную группу; в группу бензилоксикарбонил-NH-(CBZ-NH-); или в группу бензилоксикарбонил-NH-, содержащую от 1 до 3 заместителей в фенильном кольце, выбираемых из группы, состоящей из низшего алкила, низшего алкокси, хлор и бром; и пептиды, в которых свободный С-конец дериватизирован в -C(O)R2, где R2 выбирают из группы, состоящей из низшей алкоксигруппы и -NR3R4, где R3 и R4 независимо выбираются из группы, состоящей из водорода и низшего алкила. Под "низшей" понимается группа, содержащая 1-6 углеродных атомов.
МПК / Метки
МПК: A61K 38/00, C07K 5/00, C07K 14/00, C07K 1/00
Метки: человеческим, ангиопоэтином-2, специфически, связывающиеся, агенты
Код ссылки
<a href="https://eas.patents.su/30-8248-agenty-specificheski-svyazyvayushhiesya-s-chelovecheskim-angiopoetinom-2.html" rel="bookmark" title="База патентов Евразийского Союза">Агенты, специфически связывающиеся с человеческим ангиопоэтином-2</a>
Предыдущий патент: Конструкции нуклеиновых кислот для экспрессии генов
Случайный патент: Игровой автомат












