Синергическая комбинация лиганда альфа-2-дельта и ингибитора pde5 для применения при лечении боли
Формула / Реферат
1. Комбинация, содержащая синергическое соотношение лиганда альфа-2-дельта и ингибитора PDE5 или фармацевтически приемлемой соли или сольвата любого из них.
2. Комбинация по п.1, в которой лиганд альфа-2-дельта выбран из габапентина, прегабалина, [(1R,5R,6S)-6-(аминометил)бицикло[3.2.0]гепт-6-ил]уксусной кислоты, 3-(1-аминометилциклогексилметил)-4Н-[1,2,4]оксадиазол-5-она и С-[1-(1Н-тетразол-5-илметил)циклогептил]метиламина, (3S,4S)-(1-аминометил-3,4-диметилциклопентил)уксусной кислоты, (1a,3a,5a)(3-аминометилбицикло[3.2.0]гепт-3-ил)уксусной кислоты, (3S,5R)-3-аминометил-5-метилоктановой кислоты, (3S,5R)-3-амино-5-метилгептановой кислоты, (3S,5R)-3-амино-5-метилнонановой кислоты и (3S,5R)-3-амино-5-метилоктановой кислоты или их фармацевтически приемлемой соли или сольвата.
3. Комбинация по п.1 или 2, в которой лигандом альфа-2-дельта является габапентин или его фармацевтически приемлемая соль или сольват.
4. Комбинация по п.1 или 2, в которой лигандом альфа-2-дельта является прегабалин или его фармацевтически приемлемая соль или сольват.
5. Комбинация по любому из пп.1-4, в которой ингибитор PDE5 выбран из
5-[2-этокси-5-(4-метил-1-пиперазинилсульфонил)фенил]-1-метил-3-н-пропил-1,6-дигидро-7Н-пиразоло[4,3-d]пиримидин-7-она (силденафила);
(6R,12aR)-2,3,6,7,12,12а-гексагидро-2-метил-6-(3,4-метилендиоксифенил)пиразино[2',1':6,1]пиридо[3,4-b]индол-1,4-диона (тадалафила, IC-351);
2-[2-этокси-5-(4-этилпиперазин-1-ил-1-сульфонил)фенил]-5-метил-7-пропил-3Н-имидазо[5,1-f][1,2,4]триазин-4-она (варденафила);
5-[2-этокси-5-(4-этилпиперазин-1-илсульфонил)пиридин-3-ил]-3-этил-2-[2-метоксиэтил]-2,6-дигидро-7Н-пиразоло[4,3-d]пиримидин-7-она;
5-(5-ацетил-2-бутокси-3-пиридинил)-3-этил-2-(1-этил-3-азетидинил)-2,6-дигидро-7Н-пиразоло[4,3-d]пиримидин-7-она и
1-{6-этокси-5-[3-этил-6,7-дигидро-2-(2-метоксиэтил)-7-оксо-2Н-пиразоло[4,3-d]пиримидин-5-ил]-3-пиридилсульфонил}-4-этилпиперазина
или их фармацевтически приемлемой соли или сольвата.
6. Комбинация по любому из пп.1-5, в которой ингибитором PDE5 является силденафил или его фармацевтически приемлемая соль или сольват.
7. Комбинация по любому из пп.1-5, в которой ингибитором PDE5 является варденафил или его фармацевтически приемлемая соль или сольват.
8. Комбинация по любому из пп.1-5, в которой ингибитором PDE5 является тадалафил или его фармацевтически приемлемая соль или сольват.
9. Применение комбинации по любому из пп.1-8 для терапевтического, профилактического или паллиативного лечения боли.
10. Применение по п.9, где болью является невропатическая боль.
11. Комбинация, содержащая лиганд альфа-2-дельта, за исключением габапентина, прегабалина и соединений формул (i)-(xxv)
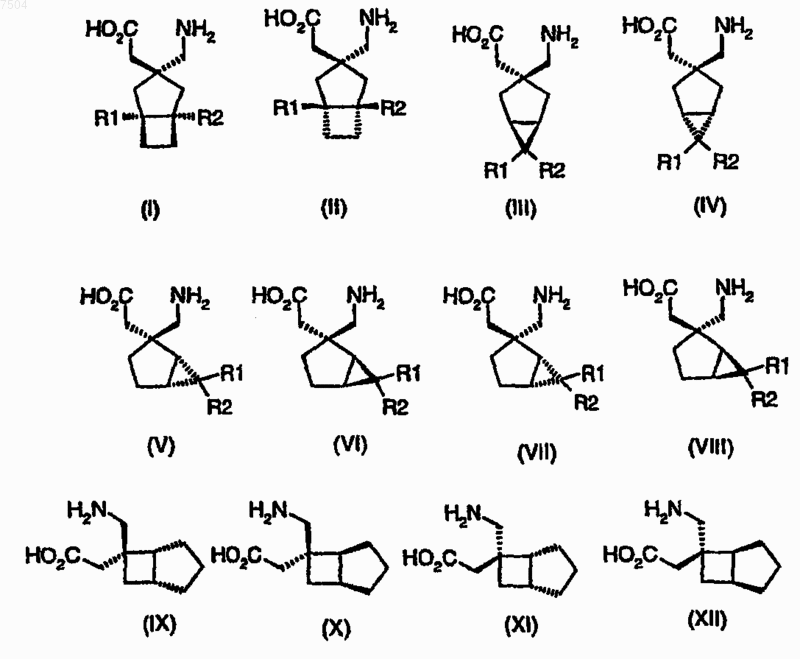
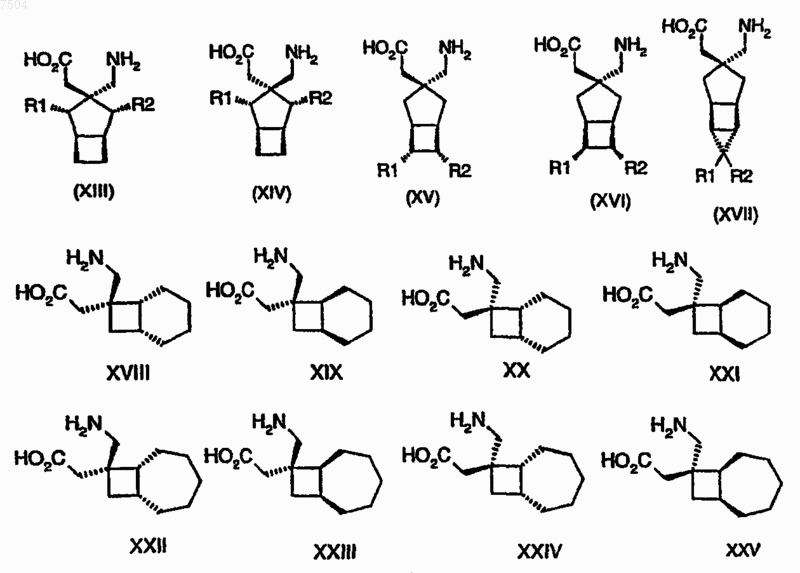
и ингибитор PDE5.
12. Фармацевтическая композиция, содержащая терапевтически эффективное количество комбинации по любому из пп.1-8 вместе с подходящим эксципиентом или носителем.
13. Синергическая комбинация для введения человеку, содержащая лиганд альфа-2-дельта и ингибитор PDE5 или их фармацевтически приемлемые соли или сольваты в мас./мас.-диапазоне комбинации, который соответствует диапазону синергической комбинации порядка от 1:1 до 10:1 мас.ч. на модели CCI-индуцированной статической аллодинии крыс.
14. Синергическая комбинация для введения человеку, содержащая лиганд альфа-2-дельта и ингибитор PDE5 или их фармацевтически приемлемые соли или сольваты по любому из пп.1-8, в которых диапазоны доз лиганда альфа-2-дельта и ингибитора PDE5 соответствуют синергическому диапазону доз 1-10 и 0,1-1 мг/кг соответственно на модели CCI-индуцированной статической аллодинии крыс.
Текст
007504 Область техники, к которой относится изобретение Данное изобретение относится к комбинациям лиганда альфа-2-дельта и ингибитора PDE5 цГМФ(PDE5), в частности, к комбинациям, которые проявляют синергическое действие, особенно для терапевтического, профилактического или паллиативного лечения боли и связанных заболеваний. Уровень техники Лиганды альфа-2-дельта могут быть определены как соединения, которые избирательно вытесняют 3 Н-габапентин из мембран головного мозга свиней, что свидетельствует о высоко аффинном взаимодействии с субъединицей альфа-2-дельта (2) управляемых потенциалом кальциевых каналов. Лиганды альфа-2-дельта также включают соединения, которые не вытесняют 3 Н-габапентин, но структурно сходны с вытесняющими соединениями, которые, как можно предполагать, связываются с альфа-2-дельта в месте, немного отличном от места для 3 Н-габапентина, или могут связываться с альфа-2-дельта головного мозга человека, но не с альфа-2-дельта свиньи. Они также могут быть известны как аналоги ГАМК(GABA). Лиганды альфа-2-дельта описаны для ряда симптомов. Наиболее известный лиганд альфа-2-дельта,габапентин (NEURONTIN), 1-(аминометил)циклогексилуксусная кислота, был впервые описан в патентной литературе в семействе патентов, включающем US 4024175. Соединение одобрено для лечения эпилепсии и невропатической боли. Второй лиганд альфа-2-дельта, прегабалин, (S)-(+)-4-амино-3-(2-метилпропил)масляная кислота,описан в публикации европейской патентной заявки номер ЕР 641330 как противосудорожное терапевтическое средство, применимое при лечении эпилепсии, и в ЕР 0934061 для лечения боли. Затем в WO 0128978 описана серия лигандов альфа-2-дельта, в частности (1,3,5)(3 аминометилбицикло[3.2.0]гепт-3-ил)уксусная кислота, изображенная ниже Совсем недавно, в международной патентной заявке номер PCT/IB 02/01146 (неопубликованной на дату приоритета данного изобретения) и опубликованной как WO 02/085839, описана серия лигандов альфа-2-дельта следующих формул:-1 007504 где R1 и R2, каждый независимо, выбран из Н, неразветвленного или разветвленного алкила с 1-6 атомами углерода, циклоалкила с 3-6 атомами углерода, фенила и бензила, при условии, что исключается, в случае трициклооктанового соединения формулы (XVII), R1 и R2 одновременно не являются водородом; для применения при лечении ряда симптомов, включая боль. В международной патентной заявке PCT/IB 03/00976, неопубликованной на дату подачи данного изобретения, описаны соединения формулы I, приведенной ниже где R1 означает водород или (C1-С 6)алкил, необязательно замещенный одним-пятью атомами фтора;R2 означает водород или (C1-С 6)алкил, необязательно замещенный одним-пятью атомами фтора; илиR3 означает (C1-C6)алкил, (С 3-С 6)циклоалкил, (С 3-С 6)циклоалкил (C1-C3)алкил, фенил, фенил(С 1-С 3) алкил, пиридил, пиридил(C1-С 3)алкил, фенил-N(Н)- или пиридил-N(Н)-, где каждый из вышеуказанных алкильных остатков может быть необязательно замещен одним-пятью атомами фтора, предпочтительно атомами фтора от нуля до трех, и где указанный фенил и указанный пиридил и фенильные и пиридильные остатки указанного фенил(C1-С 3)алкила и указанного пиридил(C1-C3)алкила соответственно могут быть необязательно замещены одним-тремя заместителями, предпочтительно заместителями от нуля до двух, независимо выбранными из хлора, фтора, аминогруппы, нитрогруппы, цианогруппы, (C1-C3) алкиламиногруппы, (C1-C3)алкила, необязательно замещенного одним-тремя атомами фтора, и (C1 С 3)алкоксигруппы, необязательно замещенной одним-тремя атомами фтора;R4 означает водород или (C1-С 6)алкил, необязательно замещенный одним-пятью атомами фтора;R5 означает водород или (C1-C6)алкил, необязательно замещенный одним-пятью атомами фтора; иR6 означает водород или (C1-C6)алкил; и фармацевтически приемлемые соли таких соединений. Ингибиторы фермента циклического гуанозин-3',5'-монофосфата фосфодиэстеразы типа пять(цГМФ PDE5) (ингибиторы PDE5) можно охарактеризовать соединениями с высокой аффинностью и избирательностью по отношению к ферменту PDE5 с небольшой аффинностью или не обладающими аффинностью по отношению к другим изоформам фосфодиэстеразы, и они описаны как полезные для лечения ряда симптомов. В частности, силденафил (5-[2-этокси-5-(4-метил-1-пиперазинилсульфонил)фенил]-1-метил-3-н-пропил-1,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он)(VIAGRA) описан для лечения ряда сердечно-сосудистых нарушений, и подтверждено, что он оказался успешным в качестве первого эффективного при пероральном приеме средства лечения нарушения эректильной дисфункции у мужчин (MED). Применение ингибиторов PDE5 для лечения невропатии описано в Европейской патентной заявке номер ЕР 1129706 и WO 01/26659. Анальгетическое действие силденафила недавно описано в Jain et al., Brain Research., 909, 170-178 (2001); Asomoza-Espinosa et al., Eur. J. Pharm., 418,195-200 (2001); и Mixcoatl-Zecutal et al., Eur. J. Pharm., 400, 81-87 (2001). Сущность изобретения В настоящее время обнаружено, что комбинированная терапия лигандом альфа-2-дельта и ингибитором PDE5 приводит к неожиданному улучшению при лечении боли. При одновременном, последовательном или раздельном введении лиганд альфа-2-дельта и ингибитор PDE5 взаимодействуют синергическим образом, контролируя боль. Неожиданная синергия позволяет уменьшить необходимую дозу каждого соединения, приводя к снижению побочных эффектов и повышению клинической эффективности соединений и лечения. Таким образом, в качестве первого аспекта в изобретении предлагается комбинированный продукт,содержащий лиганд альфа-2-дельта, за исключением прегабалина и габапентина, и ингибитор PDE5. Альтернативно, исключение также может касаться соединений (i)-(xxv), описанных в PCT/IB 02/01146. В качестве альтернативы или следующего аспекта в изобретении предлагается синергический комбинированный продукт, содержащий лиганд альфа-2-дельта и ингибитор PDE5. Примерами лигандов альфа-2-дельта для применения в случае данного изобретения являются соединения, в общем или конкретно описанные в US 4024175, в частности, габапентин, ЕР 641330, в частности, прегабалин, US 5563175, WO 9733858, WO 9733859, WO 9931057, WO 9931074, WO 9729101, WO 02085839, в частности, [(1R,5R,6S)-6-(аминометил)бицикло[3.2.0]гепт-6-ил]уксусная кислота, WO 9931075, в частности, 3-(1-аминометилциклогексилметил)-4 Н-[1,2,4]оксадиазол-5-он и С-[1-(1 Н-тетразол-5-илметил)циклогептил]метиламин, WO 9921824, в частности, (3S,4S)-(1-аминометил-3,4-диметилциклопентил)уксусная кислота, WO 0190052, WO 0128978, в частности, (1,3,5)(3-аминометилбицикло[3.2.0]гепт-3-ил)уксусная кислота, ЕР 0641330, WO 9817627, WO 0076958, в частности, (3S,5R)-2 007504 3-аминометил-5-метилоктановая кислота, PCT/IB 03/00976, в частности, (3S,5R)-3-амино-5-метилгептановая кислота, (3S,5R)-3-амино-5-метилнонановая кислота и (3S,5R)-3-амино-5-метилоктановая кислота, ЕР 1178034, ЕР 1201240, WO 9931074, WO 03000642, WO 0222568, WO 0230871, WO 0230881,WO 02100392, WO 02100347, WO 0242414, WO 0232736 и WO 0228881, и их фармацевтически приемлемые соли и сольваты, все публикации включены в данное описание посредством ссылки. Предпочтительные лиганды альфа-2-дельта согласно данному изобретению включают: габапентин,прегабалин, [(1R,5R,6S)-6-(аминометил)бицикло[3.2.0]гепт-6-ил]уксусную кислоту, 3-(1-аминометилциклогексилметил)-4 Н-[1,2,4]оксадиазол-5-он и С-[1-(1 Н-тетразол-5-илметил)циклогептил]метиламин,(3S,4S)-(1-аминометил-3,4-диметилциклопентил)уксусную кислоту, (1,3,5)(3-аминометилбицикло[3.2.0]гепт-3-ил)уксусную кислоту, (3S,5R)-3-аминометил-5-метилоктановую кислоту, (3S,5R)-3-амино 5-метилгептановую кислоту, (3S,5R)-3-амино-5-метилнонановую кислоту и (3S,5R)-3-амино-5-метилоктановую кислоту. Полезные циклические лиганды альфа-2-дельта согласно данному изобретению могут быть изображены следующей формулой (I): где X означает карбоновую кислоту или биоизостеру карбоновой кислоты;R1, Rla, R2, R2a, R3, R3a, R4 и R4a независимо выбраны из Н и C1-С 6 алкила илиR1 и R2 или R2 и R3, взятые вместе, образуют С 3-С 7 циклоалкильное кольцо, которое необязательно замещено одним или двумя заместителями, выбранными из С 1-С 6 алкила, или их фармацевтически приемлемая соль или сольват. В формуле (I) в подходящем случае R1, Rla, R2a, R3a, R4 и R4a означают Н, и R2 и R3 независимо выбраны из Н и метила, или Rla, R2a, R3a и R4a означают Н, и R1 и R2 или R2 и R3, взятые вместе, образуют С 3-С 7 циклоалкильное кольцо, которое необязательно замещено одним или двумя метильными заместителями. Подходящая биоизостера карбоновой кислоты выбрана из тетразолила и оксадиазолонила. X предпочтительно является карбоновой кислотой. В формуле (I) предпочтительно R1, Rla, R2a, R3a, R4 и R4a означают Н, и R2 и R3 независимо выбраны из Н и метила, или Rla, R2a, R3a и R4a означают Н, и R1 и R2 или R2 и R3, взятые вместе, образуют С 4 С 5 циклоалкильное кольцо, или в том случае, когда n равно 0, R1, Rla, R2a, R3a, R4 и R4a означают Н, и R2 иR3 образуют циклопентильное кольцо, или в том случае, когда n равно 1, R1, Rla, R2a, R3a, R4 и R4a означают Н, и R2 и R3 оба означают метил, или R1, Rla, R2a, R3a, R4 и R4a означают Н, и R2 и R3 образуют циклобутильное кольцо, или в том случае, когда n равно 2, R1, Rla, R2, R2a, R3, R3a, R4 и R4a означают Н, или n равен 0, R1, Rla, R2a, R3a, R4 и R4a означают Н и R2 и R3 образуют циклопентильное кольцо. Полезные ациклические лиганды альфа-2-дельта согласно данному изобретению могут быть изображены следующей формулой (II): где n равно 0 или 1, R1 означает водород или (C1-С 6)алкил; R2 означает водород или (C1-С 6)алкил; R3 означает водород или (C1-С 6)алкил; R4 означает водород или (C1-С 6)алкил; R5 означает водород или (C1-С 6) алкил и R2 означает водород или (C1-С 6)алкил, или их фармацевтически приемлемая соль или сольват. Согласно формуле (II) в подходящем случае R1 означает C1-С 6 алкил, R2 означает метил, R3-R6 означают водород и n равно 0 или 1. В более подходящем случае R1 означает метил, этил, н-пропил или нбутил, R2 означает метил, R3-R6 означают водород и n равно 0 или 1. В том случае, когда R2 является метилом, R3-R6 означают водород и n равно 0, R1 в подходящем случае является этилом, н-пропилом или нбутилом. Когда R2 является метилом, R3-R6 означают водород и n равно 1, R1 в подходящем случае является метилом или н-пропилом. Соединения формулы (II) в подходящем случае имеют 3S,SRконфигурацию. Примерами ингибиторов PDE5 для применения в данном изобретении являются: пиразоло[4,3d]пиримидин-7-оны, раскрытые в ЕР-А-0463756; пиразоло[4,3-d]пиримидин-7-оны, раскрытые в ЕР-А 0526004; пиразоло[4,3-d]пиримидин-7-оны, раскрытые в опубликованной международной патентной заявке WO 93/06104; изомерные пиразоло[3,4-d]пиримидин-4-оны, раскрытые в опубликованной международной патентной заявке WO 93/07149; хиназолин-4-оны, раскрытые в опубликованной международной-3 007504 патентной заявке WO 93/12095; пиридо[3,2-d]пиримидин-4-оны, раскрытые в опубликованной международной патентной заявке WO 94/05661; пурин-6-оны, описанные в опубликованной международной патентной заявке WO 94/00453; пиразоло[4,3-d]пиримидин-7-оны, раскрытые в опубликованной международной патентной заявке WO 98/49166; пиразоло[4,3-d]пиримидин-7-оны, раскрытые в опубликованной международной патентной заявке WO 99/54333; пиразоло[4,3-d]пиримидин-4-оны, описанные в ЕР-А 0995751; пиразоло[4,3-d]пиримидин-7-оны, раскрытые в опубликованной международной патентной заявке WO 00/24745; пиразоло[4,3-d]пиримидин-4-оны, раскрытые в ЕР-А-0995750; гексагидропиразино[2',1':6,1]пиридо[3,4-b]индол-1,4-дионы, раскрытые в опубликованной международной патентной заявке WO 95/19978; имидазо[5,1-f][1,2,4]триазиноны, раскрытые в ЕР-А-1092719 и в опубликованной международной патентной заявке WO 99/24433, и бициклические соединения, раскрытые в опубликованной международной патентной заявке WO 93/07124, все публикации включены в данное описание посредством ссылки. Следующие примеры подходящих ингибиторов PDE5 для применения в данном изобретении включают пиразоло [4,3-d]пиримидин-7-оны, раскрытые в опубликованной международной патентной заявкеWO 01/27112; пиразоло[4,3-d]пиримидин-7-оны, раскрытые в опубликованной международной патентной заявке WO 01/27113; соединения, раскрытые в ЕР-А-1092718, и соединения, раскрытые в ЕР-А 1092719; трициклические соединения, раскрытые в ЕР-А-1241170; соединения алкилсульфона, раскрытые в опубликованной международной патентной заявке WO 02/074774; соединения, раскрытые в опубликованной международной патентной заявке WO 02/072586; соединения, раскрытые в опубликованной международной патентной заявке WO 02/079203, и соединения, раскрытые в WO 02/074312, все публикации включены в данное описание посредством ссылки. Следующие примеры подходящих ингибиторов PDE5 для применения в данном изобретении включают карболиновые производные, описанные в WO 03000691, WO 02098875, WO 02064591, WO 02064590 и WO 0108688, производные пиразино[1',2':1,6]пиридо[3,4-В]индол-1,4-диона, описанные в[1',2':1,6]пиридо[3,4-В]индол-1,4-диона, описанные в WO 0228858 и WO 0194345, конденсированные гетероциклические производные, описанные в WO 0210166, ингибиторы специфичной по отношению к циклическому ГМФ фосфодиэстеразы, описанные в WO 0200658, тетрациклические соединения дикетопиперазина, описанные в WO 0194347, и соединения, описанные в заявке WO 0219213 на применение,все публикации включены в данное описание посредством ссылки. Другие ингибиторы PDE5, применимые в связи с данным изобретением, включают 4-бром-5-(пиридилметиламино)-6-[3-(4-хлорфенил)пропокси]-3(2 Н)пиридазинон; мононатриевая соль 1-[4-[(1,3-бензодиоксол-5-илметил)амино]-6-хлор-2-хинозилинил]-4-пиперидинкарбоновой кислоты;(Kyowa Hakko; см. WO 96/26940); Pharmaprojects No. 5069 (Schering Plough); GF-196960 (Glaxo Wellcome); E-8010 и Е-4010 (Eisai); Bay-38-3045 и 38-9456 (Bayer); FR 229934 и FR 226807 (Fujisawa) и Sch51866. Предпочтительные ингибиторы PDE5 для применения согласно данному изобретению включают:(i) 5-[2-этокси-5-(4-метил-1-пиперазинилсульфонил)фенил]-1-метил-3-н-пропил-1,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он (силденафил), также известный как 1-3-(6,7-дигидро-1-метил-7-оксо-3 пропил-1 Н-пиразоло[4,3-d]пиримидин-5-ил)-4-этоксифенил]сульфонил]-4-метилпиперазин (см. ЕР-А 0463756);(+)-3-этил-5-[5-(4-этилпиперазин-1-илсульфонил)-2-(2-метокси-1(R)-метилэтокси)пиридин-3 ил]-2-метил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он, также известный как 3-этил-5-5-[4-этилпиперазин-1-илсульфонил]-2-([(1R)-2-метокси-1-метилэтил]окси)пиридин-3-ил-2-метил-2,6-дигидро 7 Н-пиразоло[4,3-d]пиримидин-7-он (см. WO 99/54333);(vi) 5-[2-этокси-5-(4-этилпиперазин-1-илсульфонил)пиридин-3-ил]-3-этил-2-[2-метоксиэтил]-2,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он, также известный как 1-6-этокси-5-[3-этил-6,7-дигидро-2(2-метоксиэтил)-7-оксо-2 Н-пиразоло[4,3-d]пиримидин-5-ил]-3-пиридилсульфонил-4-этилпиперазин (см.(6R,12aR)-2,3,6,7,12,12 а-гексагидро-2-метил-6-(3,4-метилендиоксифенил)пиразино[2',1':6,1] пиридо[3,4-b]индол-1,4-дион (тадалафил, IC-351, Cialis), т.е. соединение из примеров 78 и 95 опубликованной международной патентной заявки WO 95/19978, а также соединение из примеров 1, 3, 7 и 8;[1,2,4]триазин-4-он (варденафил), также известный как 1-3-(3,4-дигидро-5-метил-4-оксо-7-пропилимидазо[5,1-f]-as-триазин-2-ил)-4-этоксифенил]сульфонил]-4-этилпиперазин, т.е. соединение из примеров 20, 19, 337 и 336 опубликованной международной патентной заявки WO 99/24433;(xiv) соединение примера 11 опубликованной международной патентной заявки WO 93/07124;(xix) 1-6-этокси-5-[3-этил-6,7-дигидро-2-(2-метоксиэтил)-7-оксо-2 Н-пиразоло[4,3-d]пиримидин-5 ил]-3-пиридилсульфонил-4-этилпиперазин и их фармацевтически приемлемые соли и сольваты. Пригодность любого конкретного ингибитора PDE5 легко можно определить посредством оценки его эффективности и избирательности, используя описанные в литературе способы, с последующей оценкой его токсичности, абсорбции, метаболизма, фармакокинетики и т.д. согласно стандартной фармацевтической практике. Предпочтительно ингибиторы PDE5 имеют IС 50 менее 100 нМ, более предпочтительно менее 50 нМ, еще более предпочтительно менее 10 нМ. Значения IС 50 для ингибиторов PDE5 можно определить, используя анализ PDE5, описанный ниже. Предпочтительно ингибиторы PDE5, используемые в фармацевтических комбинациях согласно данному изобретению, избирательны по отношению к ферменту PDE5. Предпочтительно они обладают избирательностью к PDE5 по сравнению с PDE3 большей в 100 раз, более предпочтительно большей в 300 раз. Более предпочтительно ингибитор PDE5 обладает избирательностью большей в 100 раз, более предпочтительно большей в 300 раз по сравнению как с PDE3, так и с PDE4. Специалист может легко определить отношения избирательностей. Значения IC50 для фермента PDE3 и PDE4 можно определить,используя разработанную, описанную в литературе методику, см. S.A. Ballard et al., Journal of Urology,1998, vol. 159, p. 2164-2171, и как подробно описано ниже. Полезные ингибиторы PDE5 согласно данному изобретению могут быть изображены следующей формулой (III): где А означает СН или N;R1 означает Н, C1-С 6 алкил, С 3-С 6 алкенил, С 3-С 6 циклоалкил, С 3-С 6 циклоалкенил или C1-С 3 перфторалкил, где указанная алкильная группа может иметь разветвленную или неразветвленную цепь и где указанная алкильная, алкенильная, циклоалкильная или перфторалкильная группа необязательно замещена одним или несколькими заместителями, выбранными из гидроксигруппы; C1-С 4 алкоксигрупы; С 3-С 6 циклоалкила; C1-С 3 перфторалкила; фенила, замещенного одним или несколькими заместителями,выбранными из C1-С 3 алкила, С 1-С 4 алкоксигруппы, С 1-С 4 галогеналкила или С 1-С 4 галогеналкоксигруппы,где указанные галогеналкильные и галогеналкоксигруппы содержат один или несколько атомов галогена,галоген, CN, NO2, NHR11, NHSO2R12, SO2R12, SO2NHR11, COR11, CO2R11, где R11 означает Н, С 1-С 4 алкил,С 2-С 4 алкенил, C1-С 4 алканоил, С 1-С 4 галогеналкил или С 1-С 4 галогеналкоксигруппу и где R12 означает С 1 С 4 алкил, С 2-С 4 алкенил, С 1-С 4 алканоил, C1-С 4 галогеналкил или С 1-С 4 галогеналкоксигруппу; NR7R8,CONR7R8 или NR7COR11, где R7 и R8, каждый независимо, выбран из Н, С 1-С 4 алкила, С 2-С 4 алкенила, С 1 С 4 алкоксигруппы, CO2R9, SO2R9, где указанная алкильная, алкенильная или алкоксигруппа необязательно замещены NR5R6, С 1-С 4 галогеналкилом или С 1-С 4 галогеналкоксигруппой, и где R9 означает Н, гидрокси-С 2-С 3 алкил, С 1-С 4 алканоил или С 1-С 4 алкил, который необязательно замещен фенилом, где указанная фенильная группа необязательно замещена одним или несколькими заместителями, выбранными из С 1 С 4 алкила, необязательно замещенного С 1-С 4 галогеналкилом или С 1-С 4 галогеналкоксигруппой, С 1 С 4 алкоксигруппы, галогена, CN, NO2, NHR11, NHSO2R12, SO2R12, SO2NHR11, COR11 или CO2R11; Het1; Het2 или Het3; или R1 означает Het4 или фенил, где указанная фенильная группа необязательно замещена одним или несколькими заместителями, выбранными из C1-С 4 алкила, С 2-С 4 алкенила, С 1-С 4 алкоксигруппы,галогена, CN, CF3, OCF3, NO2, NOR11, NHSO2R12, SO2R12, SO2NHR11, COR11, CO2R11;R2 означает Н, С 1-С 6 алкил, С 3-С 6 алкенил или (СН 2)n(С 3-С 6 циклоалкил), где n равно 0, 1 или 2 и где указанная алкильная или алкенильная группа необязательно замещена одним или несколькими заместителями, представляющими собой фтор;R3 означает C1-С 6 алкил, С 3-С 6 алкенил, С 3-С 6 алкинил, С 3-С 7 циклоалкил, С 1-С 6 перфторалкил или (С 3 С 6 циклоалкил)-С 1-С 6 алкил, необязательно замещенный одним или несколькими заместителями, выбранными из С 3-С 5 циклоалкила, гидроксигруппы, С 1-С 4 алкоксигруппы, С 3-С 6 алкенила, С 3-С 6 алкинила, бензилоксигруппы, NR5R6, фенила, Het1, Het2, Het3 или Het4, где С 1-С 6 алкильная и С 1-С 4 алкоксигруппы необязательно могут иметь на конце галогеналкильную группу, такую как CF3; С 3-С 6 циклоалкил; Het1, Het2,Het3 или Het4;R4 означает С 1-С 4 алкил, необязательно замещенный ОН, NR5R6, CN, CONR5R6 или CO2R7; С 2 С 4 алкенил, необязательно замещенный CN, CONR5R6 или CO2R7; С 2-С 4 алканоил, необязательно замещенный NR5R6; гидрокси-С 2-С 4 алкил, необязательно замещенный NR5R6; (С 2-С 3 алкокси)-С 1-С 2 алкил,необязательно замещенный ОН или NR5R6; CONR5R6; CO2R7; галоген; NR5R6; NHSO2NR5R6; NHSO2R8; или фенил или гетероциклил, каждый из которых необязательно замещен метилом; или R4 означает пирролидинилсульфонильную, пиперидиносульфонильную, морфолиносульфонильную или пиперазин-1 илсульфонильную группу, имеющую заместитель R10 в положении 4 пиперазинильной группы, где указанная пиперазинильная группа необязательно замещена одним или двумя С 1-С 4 алкильными группами,C1-С 3 алкоксигруппами, группами NR7R8 или CONR7R8 и необязательно имеет форму его 4-N-оксида;R5 и R6, каждый независимо, выбраны из Н и С 1-С 4 алкила, необязательно замещенного С 3-С 5 циклоалкилом или C1-С 4 алкоксигрупой, или вместе с атомом азота, с которым они связаны, образуют группу азетидинила, пирролидинила, пиперидинила, морфолинила, 4-(NR9)пиперазинила или имидазолила, где указанная группа необязательно замещена метилом или гидроксигруппой;(R R NCO)-С 1-С 6 алкил, CONR7R8, CSNR7R8 или C(NH)NR7R8, необязательно замещенный одним или несколькими заместителями, выбранными из гидроксигруппы, NR5R6, CONR5R6, фенила, необязательно замещенного С 1-С 4 алкилом или С 1-С 4 алкоксигруппой; С 2-С 6 алкенил или Het4;Het1 означает N-связанную 4-, 5- или 6-членную содержащую азот гетероциклическую группу, необязательно содержащую один или несколько дополнительных гетероатомов, выбранных из S, N или О;Het2 означает С-связанную 5-членную гетероциклическую группу, содержащую гетероатом О, S или N, необязательно содержащую один или несколько гетероатомов, выбранных из О или S;S, необязательно содержащую один или несколько гетероатомов, выбранных из О, S или N, или Het3 означает С-связанную 6-членную гетероциклическую группу, содержащую три гетероатома N;Het4 означает С-связанную 4-, 5- или 6-членную гетероциклическую группу, содержащую два или три гетероатома, выбранных из S, О или N; и где любая из указанных гетероциклических групп Het1,Het2, Het3 или Het4 может быть насыщенной, частично насыщенной или ароматической и где любая из указанных гетероциклических групп может быть необязательно замещена одним или несколькими заместителями, выбранными из C1-С 4 алкила, С 2-С 4 алкенила, С 1-С 4 алкоксигруппы, галогена, CO2R11,COR11, SO2R12 или NHR11, и/или где любая из указанных гетероциклических групп конденсирована с бензолом; или где, в том случае, когда R13 представляет собой OR3 или R3NR5; R1 означает Het, алкил-Het,арил или алкиларил, причем указанные последние пять групп все необязательно замещены и/или имеют на конце один или несколько заместителей, выбранных из галогена, цианогруппы, нитрогруппы, низшего алкила, галоген(низшего алкила), OR6, OC(O)R7, C(O)R8, С(O)OR9, C(O)NR10R11, NR12R13 и SO2NR14R15;R2 означает Н, галоген, цианогруппу, нитрогруппу, OR6, OC(O)R7, C(O)R8, С(O)OR9, C(O)NR10R11,NR12R13, SO2NR14R15, низший алкил, Het, алкил-Het, арил или алкиларил, причем указанные последние пять групп все необязательно замещены и/или имеют на конце один или несколько заместителей, выбранных из галогена, цианогруппы, нитрогруппы, низшего алкила, галоген(низшего алкила), OR6,OC(O)R7, C(O)R8, С(О)OR9, C(O)NR10R11, NR12R13 и SO2NR14R15; R3 означает Н, низший алкил, алкил-Het или алкиларил, причем указанные последние три группы все необязательно замещены и/или имеют на конце один или несколько заместителей, выбранных из галогена, цианогруппы, нитрогруппы, низшего алкила, галоген(низшего алкила), OR6, OC(O)R7, C(O)R8, С(O)OR9, C(O)NR10R11, NR12R13 и SO2NR14R15;R4 означает Н, галоген, цианогруппу, нитрогруппу, галоген(низший алкил), OR6, OC(O)R7, C(O)R8,С(O)OR9, C(O)NR10R11, NR12R13, NR16Y(O)R17, SOR18, SО 2R19R20, C(O)AZ, низший алкил, низший алкенил, низший алкинил, Het, алкил-Het, арил, алкиларил, причем указанные последние семь групп все необязательно замещены и/или имеют на конце один или несколько заместителей, выбранных из галогена,цианогруппы, нитрогруппы, низшего алкила, галоген(низшего алкила), OR6, OC(O)R7, C(O)R8, С(O)OR9,C(O)NR10R11, NR12R13 и SO2NR14R15; Y означает С или S(O), где один из R16 и R17 не присутствует, когдаY является S(O); А означает низший алкилен; Z означает OR6, галоген, Het или арил, и последние две группы обе необязательно замещены одним или несколькими заместителями, выбранными из галогена,цианогруппы, нитрогруппы, низшего алкила, галоген(низшего алкила), OR6, OC(O)R7, C(O)R8, С(O)OR9,C(O)NR10R11, NR12R13 и SO2NR14R15; R5, R6, R7, R8, R9, R18, R19 и R20 независимо означают Н или низший алкил; R10 и R11 независимо означают Н или низший алкил, причем последняя группа необязательно замещена и/или имеет на конце один или несколько заместителей, выбранных из галогена, цианогруппы,нитрогруппы, низшего алкила, галоген(низшего алкила), OR6, OC(O)R7, C(O)R8, С(O)OR9, C(O)NR10R11,NR12R13 и SO2NR14R15, или Het, или арил, необязательно замещенный одной или несколькими из указанных последних одиннадцати групп, или один из R10 и R11 может являться низшей алкоксигруппой, аминогруппой или Het, причем указанные последние две группы обе необязательно замещены низшим алкилом; R12 и R13 независимо означают Н или низший алкил или один из R12 или R13 может быть С(О)низшим алкилом или С(О)Het, в которой Het необязательно замещен низшим алкилом; R14 и R15 независимо означают Н или низший алкил или R14 и R15 вместе с атомом азота, с которым они связаны, образуют гетероциклическое кольцо; R16 и R17 независимо означают Н или низший алкил или один из R16 иR17 может представлять собой Het или арил, причем указанные последние две группы обе необязательно замещены низшим алкилом; Het означает необязательно замещенную 4-12-членную гетероциклическую группу, которая может быть ароматической или неароматической, которая может содержать одну или несколько двойных связей, которая может быть моно- или бициклической и которая содержит один или несколько гетероатомов, выбранных из N, S и О; или их фармацевтическая приемлемая соль или сольват. В формуле (III) ингибитор PDE5 может содержать группы галогенов. В данном описании галоген означает фтор, хлор, бром или йод. В формуле (III) ингибитор PDE5 может содержать одну или несколько из групп алкила, алкоксигруппы, алкенила, алкилена и алкенилена, которые могут иметь неразветвленную или разветвленную цепь. В формуле (III) предпочтительной группой соединений для применения согласно данному изобретению являются группы, в которых R1 означает Н, метил или этил; R2 означает Н, C1-С 3 алкил, необязательно замещенный ОН, или метоксигруппу; R3 означает С 2-С 3 алкил или аллил; R4 означает сульфонилпиперидиногруппу или 4-N-(R10)сульфонилпиперазин-1-ильную группу; R5 означает Н, NR7R8 илиR8, каждый независимо, означают Н или метил. В формуле (III) другой предпочтительной группой соединений для применения согласно данному изобретению являются соединения, в которых R1 означает С 1-С 2 алкил, необязательно замещенный Het; 2-(морфолин-4-ил)этил или бензил; R2 означает С 2-С 4 алкил; R13 означает OR3 или NR5R6; R3 означает С 1 С 4 алкил, необязательно замещенный одним или двумя заместителями, выбранными из циклопропила,-7 007504 циклобутила, ОН, метоксигруппы, этоксигруппы, бензилоксигруппы, NR5R6, фенила, фуран-3-ила, пиридин-2-ила и пиридин-3-ила; циклобутила; 1-метилпиперидин-4-ила; тетрагидрофуран-3-ила или тетрагидропиран-4-ила; R5 и R6, каждый независимо, выбран из Н и С 1-С 2 алкила, необязательно замещенного циклопропилом или метоксигруппой, или вместе с атомом азота, с которым они связаны, образуют группу азетидинила, пирролидинила или морфолинила; R7 и R8 вместе с атомом азота, с которым они связаны, образуют 4-R10-пиперазинильную группу, необязательно замещенную одной или двумя метильными группами, и необязательно в форме его 4-N-оксида; R10 означает Н, С 1-С 3 алкил, необязательно замещенный одним или двумя заместителями, выбранными из ОН, NR5R6, CONR5R6, фенила, необязательно замещенного метоксигруппой, бензодиоксол-5-ила и бензодиоксан-2-ила; аллил; пиридин-2-ил; пиридин-4 ил или пиримидин-2-ил; и Het выбран из пиридин-2-ила; 1-оксидопиридин-2-ила; 6-метилпиридин-2-ила; 6-метоксипиридин-2-ила; пиридазин-3-ила; пиримидин-2-ила и 1-метилимидазол-2-ила. Из указанной группы более предпочтительными являются такие соединения, в которых R1 означает C1-С 2 алкил, необязательно замещенный Het; 2-(морфолин-4-ил)этил или бензил; R2 означает С 2-С 4 алкил; R13 означаетOR3; R3 означает С 1-С 4 алкил, необязательно монозамещенный циклопропилом, циклобутилом, ОН, метоксигруппой, этоксигруппой, фенилом, фуран-3-илом или пиридин-2-илом; циклобутил; тетрагидрофуран-3-ил или тетрагидропиран-4-ил; R7 и R8 вместе с атомом азота, с которым они связаны, образуют 4R10-пиперазинильную группу, необязательно в форме его 4-N-оксида; R10 означает C1-С 3 алкил, необязательно монозамещенный ОН; и Het выбран из пиридин-2-ила; 1-оксидопиридин-2-ила; 6-метилпиридин 2-ила; 6-метоксипиридин-2-ила; пиридазин-3-ила; пиримидин-2-ила и 1-метилимидазол-2-ила. В формуле (III) следующей одной предпочтительной группой соединений для применения согласно данному изобретению являются такие соединения, в которых: R1 означает С 1-С 6 алкил или С 3-С 6 алкенил,где указанные алкильная или алкенильная группы могут иметь разветвленную цепь или неразветвленную цепь, или R1 означает С 3-С 6 циклоалкил или С 4-С 6 циклоалкенил, и где в том случае, когда R1 означает C1 С 3 алкил, указанная алкильная группа замещена; и где в том случае, когда R1 означает С 4-С 6 алкил, С 3 С 6 алкенил, С 3-С 6 циклоалкил или С 4-С 6 циклоалкенил, указанная алкильная, алкенильная, циклоалкильная или циклоалкенильная группа необязательно замещена одним или несколькими заместителями, выбранными из гидроксигруппы; C1-С 4 алкоксигруппы; С 3-С 4 циклоалкила; фенила, замещенного одним или несколькими заместителями, выбранными из C1-С 3 алкила, C1-С 4 алкоксигруппы, С 1-С 4 галогеналкила илиC1-С 4 галогеналкоксигруппы, галогена, CN, NO2, NHR11, NHCOR12, NHSO2R12, SO2R12, SO2NHR11, COR11,CO2R11, где указанная галогеналкильная группа и галогеналкоксигруппа содержат один или несколько атомов галогена; NR7R8, CONR7R8 или NR7COR11; группу Het1, которая представляет собой N-связанную 4-членную N-содержащую гетероциклическую группу; группу Het2, которая представляет собой Ссвязанную 5-членную гетероциклическую группу, содержащую гетероатом О, S или N, необязательно содержащую один или несколько гетероатомов, выбранных из N, О или S; группу Het3, которая представляет собой С-связанную 6-членную гетероциклическую группу, содержащую гетероатом О или S,необязательно содержащую один или несколько гетероатомов, выбранных из О, S или N, или группуHet3, которая представляет собой С-связанную 6-членную гетероциклическую группу, содержащую триN-гетероатома; где R7, R8, R11 и R12 имеют значения, определенные в данном описании выше, или R1 означает группу Het4, которая представляет собой С-связанную 4- или 5-членную гетероциклическую группу, содержащую один гетероатом, выбранный из S, О или N; группу Het4, которая представляет собой С-связанную 6-членную гетероциклическую группу, содержащую один, два или три гетероатома,выбранных из S или О; группу Het4, которая представляет собой С-связанную 6-членную гетероциклическую группу, содержащую три гетероатома азота; группу Het4, которая представляет собой С-связанную 6-членную гетероциклическую группу, содержащую один или два гетероатома азота, которая замещена одним или несколькими заместителями, выбранными из С 1-С 4 алкила, С 1-С 4 алкоксигруппы, CO2R11,SO2R12, COR11, NHR11 или NHCOR12, и необязательно содержащую дополнительный гетероатом, выбранный из S, О или N, где любая из указанных гетероциклических групп Het1, Het2, Het3 или Het4 является насыщенной, частично насыщенной или ароматической в зависимости от ситуации, и где любая из указанных гетероциклических групп необязательно замещена одним или несколькими заместителями,выбранными из С 1-С 4 алкила, С 3-С 4 алкенила, С 1-С 4 алкоксигруппы, галогена, CO2R11, SO2R12, COR11 илиNHR11, где R11 имеет значение, определенное выше, и/или где любая из указанных гетероциклических групп конденсирована с бензолом; или R1 означает фенил, замещенный одним или несколькими заместителями, выбранными из CF3, OCF3, SO2R12 или CO2R12, где R12 означает С 1-С 4 алкил, который необязательно замещен фенилом, С 1-С 4 галогеналкилом или C1-С 4 галогеналкоксигруппой, где указанные галогеналкильная и галогеналкоксигруппа содержат один или несколько атомов галогена; R2 означает C1 С 6 алкил; R13 означает OR3; R3 означает C1-С 6 алкил, необязательно замещенный одним или двумя заместителями, выбранными из С 3-С 5 циклоалкила, гидроксигруппы, С 1-С 4 алкоксигруппы, бензилоксигруппы,NR5R6, фенила, фуранила, тетрагидрофуранила или пиридинила, где указанные C1-С 6 алкильная группа и С 1-С 4 алкоксигруппа необязательно могут иметь на конце галогеналкильную группу, такую как CF3; илиR4 означает пиперазин-1-илсульфонильную группу, имеющую заместитель R10 в положении 4 пиперазинильной группы, где указанная пиперазинильная группа необязательно замещена одной или двумя С 1-8 007504 С 4 алкильными группами и необязательно имеет форму его 4-N-оксида; R5 и R6, каждый независимо, выбран из Н и С 1-С 4 алкила, необязательно замещенного С 3-С 5 циклоалкилом или С 1-С 4 алкоксигруппой, или вместе с атомом азота, с которым они связаны, образуют группу азетидинила, пирролидинила, пиперидинила или морфолинила; и R10 означает Н; С 1-С 4 алкил, необязательно замещенный одним или двумя заместителями, выбранными из гидроксигруппы, NR5R6, CONR5R6, фенила, необязательно замещенного С 1-С 4 алкилом или C1-С 4 алкоксигруппой; С 3-С 6 алкенил; Het4; при условии, что когда R1 означает C1-C3 алкил, замещенный фенилом, то указанная фенильная группа не замещена С 1-С 4 алкоксигруппой; CN; галогеном; CF3; OCF3 или С 1-С 4 алкилом. Более предпочтительными в данной группе соединений являются соединения, в которых R1 означает С 1-С 6 алкил, где указанный алкил может иметь разветвленную или неразветвленную цепь, или R1 означает С 3-С 6 циклоалкил, и где в том случае, когда R1 означает C1 С 3 алкил, указанная алкильная группа замещена; и в том случае, когда R1 означает С 4-С 6 алкил или С 3 С 6 циклоалкил, указанная алкильная или циклоалкильная группа необязательно замещена одним или несколькими заместителями, выбранными из: гидроксигруппы; C1-С 2 алкоксигруппы; С 3-С 5 циклоалкила;R9 и R11 имеют значения, определенные в данном описании выше; группу Het1, которая представляет собой N-связанную 4-членную N-содержащую гетероциклическую группу; группу Het3, которая представляет собой С-связанную 6-членную гетероциклическую группу, содержащую гетероатом О или S,необязательно содержащую один или несколько гетероатомов, выбранных из О, S или N, или группуHet3, которая представляет собой С-связанную 6-членную гетероциклическую группу, содержащую триN-гетероатома; или R1 означает группу Het4, которая представляет собой С-связанную 4-членную гетероциклическую группу, содержащую один гетероатом, выбранный из S, О или N; или R1 означает группуHet4, которая представляет собой С-связанную 6-членную гетероциклическую группу, содержащую один, два или три гетероатома, выбранных из S или О; где указанная гетероциклическая группа Het1,Het2, Het3 или Het4 является насыщенной, частично насыщенной или ароматической и необязательно замещена одним или несколькими заместителями, выбранными из С 1-С 4 алкила, С 1-С 4 алкоксигруппы,-CO2R11, -SO2R12, -COR11 или NHR11, где R11 и R12 имеют значения, определенные выше, и/или где любая из указанных гетероциклических групп конденсирована с бензолом; или R1 означает фенил, замещенный одним или несколькими заместителями, выбранными из CF3, -OCF3, -SO2R12, -COR11, -CO2R11, где R11 иR12 имеют значения, определенные выше; R2 означает С 1-С 6 алкил; R13 означает OR3; R3 означает метил,этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил или трет-бутил, необязательно замещенный одним или двумя заместителями, выбранными из циклопропила, циклобутила, гидроксигруппы, метоксигруппы, этоксигруппы, бензилоксигруппы, фенила, бензила, фуран-3-ила, тетрагидрофуран-2 илметила, тетрагидрофуран-3-илметила, пиридин-2-ила, пиридин-3-ила или NR5R6, где R5 и R6, каждый независимо, выбран из Н и C1-С 2 алкила; R4 означает пиперазин-1-илсульфонильную группу, имеющую заместитель, R10 в положении 4 пиперазинильной группы, где указанная пиперазинильная группа необязательно замещена одной или двумя С 1-С 4 алкильными группами и необязательно имеет форму его 4-Nоксида; и R10 означает Н, C1-С 3 алкил, необязательно замещенный одним или двумя заместителями, выбранными из гидроксигруппы, NR5R6, CONR5R6, где R5 и R6, каждый независимо, выбран из Н, С 1 С 4 алкила и С 3 алкенила. В формуле (III) следующей группой предпочтительных соединений для применения согласно данному изобретению являются соединения, в которых: R1 означает Н, низший алкил, Het, алкил-Het или алкиларил (причем указанные последние четыре группы все необязательно замещены и/или имеют на конце один или несколько заместителей, выбранных из цианогруппы, низшего алкила, OR6, С(О)OR9 илиNR12R13); R2 означает Н, галоген, низший алкил, Het или арил (причем указанные последние три группы все необязательно замещены и/или имеют на конце один или несколько заместителей, которые определены выше, и предпочтительно NR12R13 или SO2NR14R15); R3 означает С 1-С 4 алкил или С 3-С 4 циклоалкил,которые необязательно замещены и/или имеют на конце один или несколько заместителей, выбранных из галогена, цианогруппы, нитрогруппы, низшего алкила, галоген(низшего алкила), OR6, OC(O)R7,C(O)R8, С(O)OR9, C(O)NR10R11, NR12R13 и SO2NR14R15; R4 означает галоген, цианогруппу, нитрогруппу,C(O)R8, С(O)OR9, C(O)NR10R11, NR12R13, N[Y(O)R17]2, NR16Y(O)R17, SOR18, SO2R19, C(O)AZ, низший алкил, низший алкинил, Het или арил, причем указанные последние три группы все необязательно замещены и/или имеют на конце один или несколько заместителей, как определено выше; и где Y, A, Z, R10, R11,R12, R13, R14, R15, R16, R17, R5, R6, R7, R8, R9, R18, R19 и Het имеют значения, определенные в данном описании выше. Более предпочтительными в данной следующей группе являются соединения, в которых R1 означает необязательно замещенный низший алкил, более предпочтительно низший алкил, низший алкил, имеющий на конце низшую алкоксигруппу, низший алкил, имеющий на конце NR12R13, или низший алкил, имеющий на конце N-морфолиногруппу. Альтернативно, R1 может означать 4-пиперидинильную или 3-азетидинильную группу, необязательно замещенную по атому азота пиперидинильной группы низшим алкилом или С(О)OR9. В таких более предпочтительных соединениях в данной следующей группе R2 означает C(O)NR10R11, NR12R13, низший алкил, необязательно прерванный одним или несколькими из О, S или N, необязательно замещенный по N низшим алкилом или ацилом, или необязательно замещенный арил или Het. Более предпочтительно в том случае, когда R2 является прерванным низшим-9 007504 алкилом, прерывающими атомами являются один или несколько О и N, алкилированный низшим алкилом, и в том случае, когда R2 является арилом, он представляет собой необязательно замещенный фенил или пиридил. Особенно предпочтительными соединениями данной следующей группы являются соединения, в которых R2 означает C(O)NR10R11, NR12R13, С 1-4 алкил, необязательно прерванный О или N, необязательно замещенный по N низшим алкилом, необязательно замещенный фенил или необязательно замещенный пиридин-2-ил, пиридин-3-ил, пиримидин-5-ил, пиразин-2-ил, пиразол-4-ил, оксадиазол-2 ил, фуран-2-ил, фуран-3-ил, тетрагидрофуран-2-ил и имидазо[1,2-а]пиридин-6-ил. В данной более предпочтительной группе следующих соединений R3 может означать низший алкил или циклоалкил. Также X предпочтительно означает О. Такие следующие и более предпочтительные соединения имеют R4, представляющий собой галоген, низший алкил, низший алкинил, необязательно замещенный Het, необязательно замещенный арил, C(O)R8, C(O)AZ, C(O)OR9, C(O)NR10R11, NR12R13 или NR16Y(O)R17. Более предпочтительными значениями для R4 являются C(O)R8 (например, ацетил), галоген (например, йод),SO2R19 (где R19 означает низший алкил) и C(O)NR10R11 (например, где R10 и R11 независимо означают Н и низший алкил и/или один из R10 и R11 означает низшую алкоксигруппу) или NHB, где В означает Н,SO2CH3 или С(О)Het. Еще следующими предпочтительными соединениями являются соединения, в которых R4 означает йод, низший алкил, низший алкинил (причем указанные последние две группы замещены и/или имеют на конце С(О)OR9 (где R9 означает Н или С 1-6 алкил, N(H)Y(O)R17, N[Y(O)R17]2, необязательно замещенный Het или NR12R13 (где R12 и R13 вместе означают С 3-5 алкилен, прерванный О илиN-S(O)2- (необязательно замещенный арил. Более предпочтительные ингибиторы PDE5 для применения в данном изобретении особенно с лигандом альфа-2-дельта, выбранным из габапентина, прегабалина и (1,3,5)(3-аминометилбицикло[3.2.0]гепт-3-ил)уксусной кислоты и их фармацевтически приемлемых солей или сольватов, выбраны из группы 5-[2-этокси-5-(4-метил-1-пиперазинилсульфонил)фенил]-1-метил-3-н-пропил-1,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-она (силденафила);[1,2,4]триазин-4-она (варденафила); 5-[2-этокси-5-(4-этилпиперазин-1-илсульфонил)пиридин-3-ил]-3-этил-2-[2-метоксиэтил]-2,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-она; 5-(5-ацетил-2-бутокси-3-пиридинил)-3-этил-2-(1-этил-3-азетидинил)-2,6-дигидро-7 Н-пиразоло[4,3d]пиримидин-7-она и 1-6-этокси-5-[3-этил-6,7-дигидро-2-(2-метоксиэтил)-7-оксо-2 Н-пиразоло[4,3-d]пиримидин-5-ил]-3 пиридилсульфонил-4-этилпиперазина и их фармацевтически приемлемых солей и сольватов. Особенно предпочтительным ингибитором PDE5, в частности, с лигандом альфа-2-дельта, выбранного из габапентина, прегабалина и (1,3,5)(3-аминометилбицикло[3.2.0]гепт-3-ил)уксусной кислоты и их фармацевтически приемлемых солей или сольватов, является 5-[2-этокси-5-(4-метил-1 пиперазинилсульфонил)фенил]-1-метил-3-н-пропил-1,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он(силденафил) и его фармацевтически приемлемые соли и сольваты. Предпочтительной солью является цитрат силденафила. В качестве альтернативного или дополнительного аспекта данного изобретения предлагается комбинация, в частности синергическая комбинация, содержащая габапентин и ингибитор PDE5, выбранный из силденафила,1-6-этокси-5-[3-этил-6,7-дигидро-2-(2-метоксиэтил)-7-оксо-2 Н-пиразоло[4,3-d] пиримидин-5-ил]-3-пиридилсульфонил-4-этилпиперазина, 5-(5-ацетил-2-бутокси-3-пиридинил)-3-этил 2-(1-этил-3-азетидинил)-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-она, варденафила или тадалафила или их фармацевтически приемлемой соли или сольвата. Особенно предпочтительная комбинация содержит габапентин и силденафил или их фармацевтически приемлемые соли или сольваты. В качестве альтернативного или дополнительного аспекта данного изобретения предлагается комбинация, в частности синергическая комбинация, содержащая прегабалин и ингибитор PDE5, выбранный из силденафила, 1-6-этокси-5-[3-этил-6,7-дигидро-2-(2-метоксиэтил)-7-оксо-2 Н-пиразоло[4,3-d]пиримидин-5-ил]-3-пиридилсульфонил-4-этилпиперазина, 5-(5-ацетил-2-бутокси-3-пиридинил)-3-этил-2-(1 этил-3-азетидинил)-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-она, варденафила или тадалафила. Особенно предпочтительная комбинация содержит прегабалин и силденафил. В еще одном альтернативном или предпочтительном аспекте данного изобретения предлагается комбинация, в частности синергическая комбинация, содержащая[(1R,5R,6S)-6-(аминометил)бицикло[3.2.0]гепт-6-ил]уксусную кислоту или ее фармацевтически приемлемую соль или сольват и ингибитор PDE5. В подходящем случае предлагается комбинация, содержащая [(1R,5R,6S)-6(аминометил)бицикло[3.2.0]гепт-6-ил]уксусную кислоту или ее фармацевтически приемлемую соль или сольват и ингибитор PDE5, выбранный из силденафила, 1-6-этокси-5-[3-этил-6,7-дигидро-2-(2- 10007504 метоксиэтил)-7-оксо-2 Н-пиразоло[4,3-d]пиримидин-5-ил]-3-пиридилсульфонил-4-этилпиперазина, 5-(5 ацетил-2-бутокси-3-пиридинил)-3-этил-2-(1-этил-3-азетидинил)-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-она, варденафила или тадалафила или их фармацевтически приемлемой соли или сольвата, предпочтительно силденафила или его фармацевтически приемлемой соли или сольвата. В подходящем случае предлагается комбинация, содержащая (1,3,5)(3-аминометилбицикло[3.2.0]гепт-3-ил)уксусную кислоту или ее фармацевтически приемлемую соль или сольват и ингибитор PDE5, выбранный из силденафила, 1-6-этокси-5-[3-этил-6,7-дигидро-2-(2-метоксиэтил)-7-оксо 2 Н-пиразоло[4,3-d]пиримидин-5-ил]-3-пиридилсульфонил-4-этилпиперазина, 5-(5-ацетил-2-бутокси-3 пиридинил)-3-этил-2-(1-этил-3-азетидинил)-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-она, варденафила или тадалафила или их фармацевтически приемлемой соли или сольвата, предпочтительно силденафила или его фармацевтически приемлемой соли или сольвата. В качестве следующего предпочтительного аспекта данного изобретения комбинация выбрана из габапентина и силденафила; габапентина и варденафила; габапентина и тадалафила; габапентина и 1-6-этокси-5-[3-этил-6,7-дигидро-2-(2-метоксиэтил)-7-оксо-2 Н-пиразоло[4,3-d] пиримидин-5-ил]-3-пиридилсульфонил-4-этилпиперазина; габапентина и 5-(5-ацетил-2-бутокси-3-пиридинил)-3-этил-2-(1-этил-3-азетидинил)-2,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-она; прегабалина и силденафила; прегабалина и варденафила; прегабалина и тадалафила; прегабалина и 1-6-этокси-5-[3-этил-6,7-дигидро-2-(2-метоксиэтил)-7-оксо-2 Н-пиразоло[4,3-d] пиримидин-5-ил]-3-пиридилсульфонил-4-этилпиперазина; прегабалина и 5-(5-ацетил-2-бутокси-3-пиридинил)-3-этил-2-(1-этил-3-азетидинил)-2,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-она;(3S,4S)-(1-аминометил-3,4-диметилциклопентил)уксусной кислота и 5-(5-ацетил-2-бутокси-3 пиридинил)-3-этил-2-(1-этил-3-азетидинил)-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-она,или фармацевтически приемлемых солей или сольватов любого из них. Комбинация согласно данному изобретению в единичной дозированной форме подходит для введения любому млекопитающему, предпочтительно человеку. Введение может быть один раз (o.d.), два раза(b.i.d.) или три раза (t.i.d.) в сутки, в подходящем случае b.i.d. или t.i.d., в более подходящем случае b.i.d,в наиболее подходящем случае o.d Таким образом, в качестве следующего аспекта данного изобретения предлагается способ терапевтического, профилактического или паллиативного лечения боли у млекопитающего, включающий введение один раз, два раза или три раза, в подходящем случае два раза или три раза, в более подходящем случае два раза, в наиболее подходящем случае один раз в сутки эффективной,особенно синергической комбинации лиганда альфа-2-дельта и ингибитора PDE5. Определяя синергическое взаимодействие между одним или несколькими компонентами, можно точно определить оптимальный диапазон эффекта и пределы абсолютной дозы каждого компонента для- 11007504 получения эффекта путем введения компонентов в разных диапазонах соотношений мас./мас. и в разных дозах пациентам, нуждающимся в лечении. В случае человека сложность и затраты на проведение клинических исследований на пациентах делают нецелесообразным применение данной формы тестирования в качестве первичной модели синергии. Однако на основании наблюдения синергии у одного вида можно предсказывать эффект у другого вида, и существуют модели на животных, которые описаны в данной заявке, для измерения синергического эффекта, и результаты таких исследований также можно использовать для предсказания эффективной дозы и пределов соотношений концентраций в плазме и абсолютных доз и концентраций в плазме, необходимых для другого вида, путем применения фармакокинетических/фармакодинамических способов. Установленные корреляции между моделями на животных и эффектами, наблюдаемыми у человека, свидетельствуют о том, что синергия у животных лучше всего демонстрируется с использованием статических и динамических измерений аллодинии у грызунов,которые были подвергнуты хирургическим (например, модель хронического повреждения путем перевязки нерва) или химическим (например, стрептозоцин) процедурам, чтобы индуцировать аллодинию. Из-за выхода эффектов на плато на таких моделях, их значение оценивается лучше всего в отношении синергических действий, которые у пациентов с невропатической болью могли бы проявиться в виде преимуществ, позволяющих экономить дозу. Другие модели, в которых существующие средства, используемые для лечения невропатической боли, дают только частичный ответ, больше подходят для предсказания возможностей комбинаций, действующих синергически, для того, чтобы получить повышенную максимальную эффективность при максимально переносимых дозах двух компонентов. Таким образом, в следующем аспекте данного изобретения предлагается синергическая комбинация для введения человеку, содержащая лиганд альфа-2-дельта и ингибитор PDE5 или их фармацевтически приемлемые соли или сольваты в мас./мас.-диапазоне комбинации, который соответствует абсолютным диапазонам, наблюдаемым на модели животного, отличного от человека, предпочтительно на модели крыс, первоначально используемой для идентификации синергического взаимодействия. В подходящем случае диапазон соотношений для человека соответствует диапазону для животного, отличного от человека, выбранному из (мас.ч.) от 1:50 до 50:1, от 1:50 до 20:1, от 1:50 до 10:1, от 1:50 до 1:1, от 1:20 до 50:1, от 1:20 до 20:1, от 1:20 до 10:1, от 1:20 до 1:1, от 1:10 до 50:1, от 1:10 до 20:1, от 1:10 до 10:1, от 1:10 до 1:1, от 1:1 до 50:1, от 1,1 до 20:1 и от 1:1 до 10:1. В более подходящем случае диапазон для человека соответствует синергическому диапазону для животного, отличного от человека, составляющему от 1:10 до 20:1 мас.ч. Предпочтительно диапазон для человека соответствует диапазону для животного, отличного от человека, порядка от 1:1 до 10:1 мас.ч. В случае габапентина и силденафила диапазон для человека соответствует диапазону синергических доз для животного, отличного от человека, предпочтительно для модели крыс, порядка от 1:1 до 10:1 мас.ч. Для людей можно использовать несколько экспериментальных моделей боли у человека, чтобы показать, что агенты с доказанной синергией у животных также оказывают эффекты у человека, сравнимые с такой синергией. Примеры моделей для человека, которые могут подходить для данной цели, включают модель тепло/капсаицин (Petersen, K.L. and Rowbotham, M.C. (1999) NeuroReport 10, 1511-1516), модель внутрикожного введения капсаицина (Andersen, O.L., Felsby, S., Nicolaisen, L., Bjerring, P., Jsesn, T.S.and Arendt-Nielsen, L. (1996) Pain 66, 51-62), включая использование повторной травмы капсаицином(Witting, N., Svesson, P., ArendtNielsen, L. and Jensen, T.S. (2000) Somatosensory Motor Res. 17, 5-12), и реакции суммации или взвинчивания (Curatolo, M. et al. (2000) Anesthesiology 93, 1517-1530). При использовании данных моделей в качестве конечных результатов можно использовать субъективную оценку интенсивности боли или зон гипералгезии, или можно использовать более объективные конечные результаты, полагающиеся на электрофизиологические методики или методики визуализации (такие как функциональная магнитно-резонансная визуализация) (Bornhovd, К., Quante, M., Glauche, V., Bromm, В.,Weiller, С. and Buchel, С. (2002) Brain 125, 1326-1336). Все такие модели требуют подтверждения того,что доказательство объективно, прежде чем можно сделать вывод, что они дают доказательство о подтверждении синергических действий у человека, которые наблюдались в исследованиях на животных. При использовании данного изобретения на человеке подходящий диапазон соотношений лиганд альфа-2-дельта:ингибитор PDE5 выбран из диапазонов от 1:50 до 50:1, от 1:50 до 20:1, от 1:50 до 10:1, от 1:50 до 1:1, от 1:20 до 50:1, от 1:20 до 20:1, от 1:20 до 10:1, от 1:20 до 1:1, от 1:10 до 50:1, от 1:10 до 20:1,от 1:10 до 10:1, от 1:10 до 1:1, от 1:1 до 50:1, от 1:1 до 20:1 и от 1:1 до 10:1 мас.ч., в более подходящем случае от 1:10 до 20:1, предпочтительно от 1:1 до 10:1 мас.ч Для комбинации габапентина и силденафила в изобретении предлагается подходящая доза в диапазоне соотношений от 1:10 до 10:1 мас./мас., более предпочтительно от 1:5 до 5:1 соответственно. Оптимальные дозы каждого компонента для синергии можно определить согласно опубликованным способам на моделях животных. Однако для человека (даже в экспериментальных моделях боли) могут быть очень высоки затраты на исследования, чтобы определить полную взаимосвязь экспозицияответ при всех терапевтически важных дозах каждого компонента комбинации. Может быть необходимым, по меньшей мере, вначале оценить, могут ли наблюдаться эффекты, которые согласуются с синергией, при дозах, которые были экстраполированы на основании доз, которые дают оптимальную синергию у животных. При пересчете доз от животных к человеку нужно учитывать такие факторы, как отно- 12007504 сительная масса тела/площадь поверхности тела, относительная абсорбция, распределение, метаболизм и экскреция каждого компонента и относительное связывание с белками плазмы, по этим причинам оптимальное соотношение доз, предсказанное для человека (а также для пациентов), вероятно, не будет таким же, как соотношение доз, показанное как оптимальное у животных. Однако взаимосвязь между двумя значениями может быть понята и рассчитана специалистом в области фармакокинетики у животных и человека. Важными для установления связи между эффектами у животных и человека являются концентрации в плазме, полученные для каждого компонента, используемого в исследованиях на животных, так как они связаны с концентрацией в плазме каждого компонента, которая, как можно ожидать, обеспечивает эффективность у человека. Фармакокинетическое/фармакодинамическое моделирование (включая такие способы, как изоболограммы, коэффициент взаимодействия и поверхностное моделирование ответов) и расчетные кривые могут помочь предсказать синергические соотношения доз для человека, особенно, когда один из двух или оба указанных компонента уже исследованы на человеке. Важно выяснить, является ли какая-либо установленная синергия у животных или человека следствием только фармакокинетических взаимодействий. Например, ингибирование метаболизма одного соединения другим может давать ложный эффект фармакодинамической синергии. В исследованиях на животных с габапентином и силденафилом брали многократные образцы крови, и было показано, что в соответствии с известными фармакокинетическими свойствами агентов нет доказательства фармакокинетического взаимодействия при ведении соединений в дозах, которые индуцировали синергические взаимодействия при боли. Это доказывает, что синергия по отношению к боли является фармакодинамической, возникающей после того, как каждый из указанных агентов взаимодействует со своими соответствующими рецепторными и/или ферментными мишенями. Таким образом, согласно следующему аспекту данного изобретения предлагается синергическая комбинация для введения человеку, содержащая лиганд альфа-2-дельта и ингибитор PDE5 или их фармацевтически приемлемые соли или сольваты, в которой диапазон доз каждого компонента соответствует абсолютным синергическим диапазонам, наблюдаемым на модели животного, отличном от человека,предпочтительно на модели крыс, исходно используемой для идентификации синергического взаимодействия.В подходящем случае диапазон доз лиганда альфа-2-дельта у человека соответствует диапазону доз 1-20 мг/кг, в более подходящем случае 1-10 мг/кг у крыс, и соответствующий диапазон доз для ингибитора PDE5 составляет 0,1-10 мг/кг, в более подходящем случае 0,1-1 мг/кг. Для габапентина и силденафила диапазон доз у человека в подходящем случае соответствует синергическому диапазону 110 мг/кг габапентина и 0,1-1 мг/кг силденафила у крыс. В подходящем случае доза лиганда альфа-2-дельта для применения на человеке находится в диапазоне, выбранном из 1-1200, 1-500, 1-100, 1-50, 1-25, 500-1200, 100-1200, 100-500, 50-1200, 50-500 или 50100 мг, в подходящем случае 50-100 мг, b.i.d. или t.i.d., в подходящем случае t.i.d., и доза ингибитораPDE5 находится в диапазоне, выбранном из 1-200, 1-100, 1-50, 1-25, 10-100, 10-50 или 10-25 мг, в подходящем случае 10-100 мг, b.i.d или t.i.d, в подходящем случае t.i.d. Для габапентина и силденафила подходящий диапазон доз составляет 50-600:10-100 мг t.i.d. Специалисту будет понятно, что диапазон концентраций в плазме комбинаций лиганда альфа-2 дельта и ингибитора PDE5 согласно данному изобретению, требуемый для обеспечения терапевтического эффекта, зависит от вида, подвергаемого лечению, и используемых компонентов. Например, для габапентина и силденафила у крыс значения Cmax габапентина находятся в диапазоне от 0,520 до 10,5 мкг/мл и значения Cmax силденафила находятся в диапазоне от 0,02 до 2,1 мкг/мл. Можно, используя стандартные PK/PD и аллометрические способы, экстраполировать значения концентраций в плазме, наблюдаемые на модели животных, чтобы предсказать значения у другого вида,в частности у человека. Таким образом, в качестве следующего аспекта данного изобретения предлагается синергическая комбинация для введения человеку, содержащая лиганд альфа-2-дельта и ингибиторPDE5, где диапазон концентраций в плазме каждого компонента соответствует абсолютным диапазонам,наблюдаемым на модели животного, отличного от человека, предпочтительно на модели крыс, исходно используемой для идентификации синергического взаимодействия. В подходящем случае диапазон концентраций в плазме у человека соответствует диапазону от 0,05 до 10,5 мкг/мл для лиганда альфа-2 дельта и от 0,005 до 2,1 мкг/мл для ингибитора PDE5 на модели крыс. Для габапентина и силденафила диапазон концентраций в плазме у человека соответствует диапазону от 0,05 до 10,5 мкг/мл для габапентина и от 0,005 до 2,1 мкг/мл для силденафила на модели крыс. Так как свойства связываться с белком в плазме крыс и человека сходны для обоих соединений, указанные выше диапазоны концентраций в плазме соответствуют и человеку. Таким образом, в альтернативном аспекте данное изобретение относится к синергической комбинации, содержащей лиганд альфа-2-дельта и ингибитор PDE5 или их фармацевтически приемлемые соли или сольваты, при этом диапазон концентраций в плазме для компонентов включает значения Cmax до 20 мкг/мл для лиганда альфа-2-дельта и до 4 мкг/мл для ингибитора PDE5, в более подходящем случае от 0,5 до 10 мкг/мл и от 0,02 до 2,1 мкг/мл, предпочтительно от 0,05 до 20 мкг/мл и от 0,005 до 4 мкг/мл соответственно.- 13007504 Особенно предпочтительные комбинации согласно изобретению включают комбинации, в которых каждая переменная комбинации выбрана на основании подходящих параметров для каждой переменной. Еще более предпочтительные комбинации согласно изобретению включают комбинации, в которых каждая переменная комбинации выбрана на основании более подходящих, наиболее подходящих предпочтительных и более предпочтительных параметров для каждой переменной. Краткое описание чертежей Фиг. 1. Влияние (а) габапентина и (b) силденафила на сохранение CCI-индуцированной статической аллодинии. Пороги отдергивания лапы (PWT) исходного уровня (BL) на волоски von Frey определяли уCCI-животных перед введением лекарственного средства. PWT повторно оценивали вплоть до 4 ч после введения лекарственного средства. Результаты выражены в виде средней силы (г), требуемой для того,чтобы индуцировать отдергивание лапы (вертикальные столбики означают 1-й и 3-й квартили). Р 0,05,Р 0,01, Р 0,005 значимо отличны (U-критерий Манна-Уитни) от группы, обработанной наполнителем в каждой временной точке. Фиг. 2. Влияние (а) габапентина и (b) силденафила на сохранение CCI-индуцированной динамической аллодинии. Латентные периоды реакции отдергивания лапы (PWL) исходного уровня (BL) на стимул ватной палочки определяли для правой задней лапы перед введением лекарственного средства. PWL повторно определяли вплоть до 4 ч. Результаты выражены в виде среднего PWL (с). Вертикальные столбики означают SEM. Р 0,05, Р 0,01, значимые отличия (ANOVA с последующей оценкой tкритерия Даннетта) от группы, обработанной наполнителем в каждой временной точке. Фиг. 3. Влияние фиксированных соотношений доз габапентина и силденафила на сохранение CCIиндуцированной статической аллодинии. Все данные выражены во временной точке 2 ч после введения лекарственного средства. Данные доза-ответ для габапентина и силденафила отдельно взяты из фиг. 1. Фиксированные соотношения доз (а) 1:10, (b) 1:1, (с) 10:1, (d) 20:1 комбинаций габапентина и силденафила. Результаты выражены в виде средней силы (г), требуемой для индукции отдергивания лапы (вертикальные столбики означают 1-й и 3-й квартили). Фиг. 4. Влияние фиксированных соотношений доз габапентина и силденафила на сохранение ССIиндуцированной динамической аллодинии. Все данные выражены во временной точке 2 ч после введения лекарственного средства. Данные доза-ответ для габапентина и силденафила отдельно взяты из фиг. 2. Фиксированные соотношения доз (а) 1:10, (b) 1:1, (с) 10:1, (d) 20:1 комбинаций габапентина и силденафила. Результаты выражены в виде среднего PWL (с). Вертикальные столбики означают SEM. Р 0,05, Р 0,01. Значимые отличия (ANOVA с последующей оценкой t-критерия Даннетта) от группы,обработанной наполнителем в каждой временной точке. Подробное описание изобретения Соединения комбинации согласно данному изобретению могут существовать в несольватированных формах, а также в сольватированных формах, включая гидратированные формы. В общем, сольватированные формы, включающие гидратированные формы, которые могут содержать изотопные замещения (например, D2O, d6-ацетон, d6-ДМСО), эквивалентны несольватированным формам и входят в объем данного изобретения. Некоторые из соединений согласно данному изобретению имеют один или несколько хиральных центров, и каждый центр может существовать в R- или S-конфигурации. Данное изобретение включает все энантиомерные и эпимерные формы, а также их соответствующие смеси. Разделение диастереоизомеров или цис- и транс-изомеров можно осуществить обычными способами, например, фракционированной кристаллизацией, хроматографией или ВЭЖХ стереоизомерной смеси соединения согласно изобретению или его подходящей соли или производного. Ряд лигандов альфа-2-дельта согласно данному изобретению представляют собой аминокислоты. Так как аминокислоты являются амфотерными, то фармакологически совместимыми солями могут быть соли соответствующих нетоксичных неорганических или органических кислот или оснований. Подходящими кислотно-аддитивными солями являются ацетаты, аспартаты, бензоаты, безилаты, бикарбонаты/карбонаты, бисульфаты, камсилаты, цитраты, эдисилаты, эсилаты, фумараты, глюцептаты, глюконаты, глюкуронаты, гибензаты, гидрохлориды/хлориды, гидробромиды/бромиды, гидройодиды/йодиды,гидрофосфаты, изетионаты, D- и L-лактаты, малаты, малеаты, малонаты, мезилаты, метилсульфаты, 2 напсилаты, никотинаты, нитраты, оротаты, пальмоаты, фосфаты, сахараты, стеараты, сукцинатысульфаты, D- и L-тартраты и тозилаты. Подходящие соли оснований получают из оснований, которые образуют нетоксичные соли, и примерами являются соли натрия, калия, алюминия, кальция, магния,цинка, холина, диоламина, оламина, аргинина, глицина, трометамина, бензатина, лизина, меглумина и диэтиламина. Также можно получить соли с ионом четвертичного аммония, например, с ионом тетраметиламмония. Соединения согласно изобретению также могут быть образованы в виде цвиттер-иона. Кроме того, так как ряд ингибиторов PDE5 согласно данному изобретению являются аминами, и ряд лигандов альфа-2-дельта имеют кислотные функциональные группы, следующий аспект данного изобретения включает форму соли, содержащую 2 компонента, в частности, в комбинации 1:1. Подходящей формой соли является соль, образованная комбинацией 1:1 габапентина и силденафила.- 14007504 Подходящей солью для соединений согласно данному изобретению, представленных аминокислотами, является гидрохлоридная соль. Для обзора подходящих солей см. Stahl and Wermuth, Handbook ofPharmaceutical Salts: Properties, Selection, and Use, Wiley-VCH, Weinheim, Germany (2002). Также в объем изобретения входят клатраты, комплексы включения лекарственное средствохозяин, в которых в отличие от вышеуказанных сольватов лекарственное средство и молекула-хозяин присутствуют в нестехиометрических количествах. Для обзора таких комплексов см. J. Pharm. Sci., 64(8), 1269-1288 Haleblian (August 1975). Далее все ссылки на соединения согласно изобретению включают ссылки на их соли и на сольваты и клатраты соединений согласно изобретению и их солей. Также в данный объем соединений согласно изобретению включены их полиморфы. Пролекарства указанных выше соединений согласно изобретению включены в объем данного изобретения. Химически модифицированное лекарственное средство или пролекарство должно иметь другой фармакокинетический профиль, отличный от исходного, делающий возможным более легкую абсорбцию через слизистый эпителий, лучшее образование и/или растворимость соли, повышенную системную стабильность (например, для увеличения времени полужизни в плазме). Такими химическими модификациями могут быть: 1). Сложноэфирные или амидные производные, которые могут расщепляться, например, эстеразами или липазами. В случае сложноэфирных производных сложный эфир получают из остатка карбоновой кислоты молекулы лекарственного средства известными способами. В случае амидных производных амид можно получить из остатка карбоновой кислоты или остатка амина молекулы лекарственного средства известными способами. 2). Пептиды могут распознаваться специфичными или неспецифичными протеиназами. Пептид может быть связан с молекулой лекарственного средства посредством образования амидной связи с остатком амина или остатком карбоновой кислоты молекулы лекарственного средства известными способами. 3). Производные, которые накапливаются в месте действия вследствие мембранной селекции формы пролекарства или модифицированной формы пролекарства. 4). Любая комбинация с 1 по 3. Сложные эфиры аминоацилгликолевой кислоты и аминоацилмолочной кислоты известны в качестве пролекарств аминокислот (Wermuth C.G., Chemistry and Industry, 1980: 433-435). Карбонильную группу аминокислот можно этерифицировать известными способами. В данной области известны пролекарства и мягкие лекарства (Palomino E., Drugs of the Future, 1990; 15 (4): 361-368). Приведенные последние две публикации включены в данное описание посредством ссылки. Комбинация согласно данному изобретению применима для общего лечения боли, особенно невропатической боли. Физиологическая боль является важным защитным механизмом, предназначенным для того, чтобы предупредить об опасности потенциально вредных стимулов из окружающей среды. Система работает за счет специфичного набора первичных сенсорных нейронов и активируется исключительно вредными стимулами посредством периферических механизмов трансдукции (Millan 1999 Prog. Neurobio. 57: 1-164 для полного обзора). Указанные сенсорные волокна известны как ноцицепторы и характеризуются аксонами небольшого диаметра с медленными скоростями проводимости. Ноцицепторы кодируют интенсивность, продолжительность и качество вредного стимула и на основании их топографически организованной проекции на спинной мозг локализацию стимула. Ноцицепторы находятся на ноцицептивных нервных волокнах, на которых существует два основных типа волокна А-дельта (миелинизированные) и Сволокна (немиелинизированные). Активность, вызванная входным сигналом ноцицептора, после сложной обработки передается в дорсальный рог спинного мозга, либо непосредственно, либо через релейные ядра ствола головного мозга в вентробазальный комплекс таламуса и затем в кору головного мозга, где формируется болевое ощущение. В сильную острую боль и хроническую боль могут быть вовлечены одни и те же пути, запускаемые патофизиологическими процессами, и, по существу, боль перестает обеспечивать защитный механизм и вместо этого вносит вклад в ослабляющие силы симптомы, связанные с широким диапазоном патологических состояний. Боль является признаком многих травм и состояний болезни. Когда происходит существенное повреждение ткани организма вследствие болезни или травмы, характеристики активации ноцицептора изменяются. Имеет место сенситизация на периферии, локально вокруг повреждения и центрально там, где заканчиваются ноцицепторы. Это приводит к гиперчувствительности в месте повреждения и в близлежащей нормальной ткани. Указанные механизмы могут использоваться при острой боли и позволяют происходить процессам регенерации, и гиперчувствительность возвращается к нормальной чувствительности после заживления повреждения. Однако при многих состояниях хронической боли гиперчувствительность длится гораздо дольше, чем процесс заживления и обычно является следствием поражения нервной системы. Это поражение часто приводит к маладаптации афферентных волокон(Woolf and Salter 2000 Science 288: 1765-1768). Клиническая боль присутствует в том случае, когда среди симптомов пациента фигурируют дискомфорт и аномальная чувствительность. Пациенты имеют склонность быть весьма разными и могут иметь различные симптомы боли. Существует ряд типичных подти- 15007504 пов боли: 1) спонтанная боль, которая может быть тупой, жгучей или пронзающей; 2) болевые реакции на вредные стимулы ненормально повышены (гипералгезия); 3) боль порождается обычно безвредными стимулами (аллодиния) (Meyer et al., 1994 Textbook of Pain 13-44) . Хотя пациенты с болью в спине, болью при артрите, при травме ЦНС или с невропатической болью могут иметь сходные симптомы, лежащие в их основе механизмы различны, и поэтому могут требоваться различные стратегии лечения. Поэтому боль можно разделить на ряд различных областей вследствие различающейся патофизиологии,которые включают ноцицептивную, воспалительную, невропатическую боль и т.д. Следует отметить, что некоторые типы боли имеют множество этиологий и, таким образом, при классификации могут быть отнесены к нескольким областям, например боль в спине, боль при злокачественной опухоли может иметь ноцицептивные, воспалительные и невропатические компоненты. Ноцицептивная боль индуцируется повреждением ткани или сильными стимулами, которые могут стать причиной повреждения. Афференты боли активируются трансдукцией стимулов ноцицепторами в месте повреждения и вызывают сенситизацию спинного мозга на уровне, где они заканчиваются. Затем возбуждение поднимается по спинно-мозговым трактам к головному мозгу, где происходит восприятие боли (Meyer et al., 1994 Textbook of Pain 13-44). Активация ноцицепторов активирует два типа афферентных нервных волокон. Быстро передающие миелинизированные волокна А-дельта ответственны за острые и пронзающие болевые ощущения, в то время как немиелинизированные С-волокна осуществляют передачу при более низкой скорости и передают тупую или ноющую боль. Ноцицептивная острая боль от умеренной до сильной является характерным признаком боли при растяжении/вывихах, послеоперационной боли (боли после любого типа хирургической процедуры), посттравматической боли, при ожогах, инфаркте миокарда, остром панкреатите и почечной колике, но не ограничена указанным. Также связанные со злокачественной опухолью острые болевые синдромы обычно обусловлены терапевтическими взаимодействиями, такими как токсичность химиотерапии, иммунотерапия, гормональная терапия и лучевая терапия. Острая ноцицептивная боль от умеренной до сильной без ограничения является характерным признаком боли при злокачественной опухоли, которая может быть болью, связанной с опухолью (например, костная боль, головная боль и лицевая боль, боль внутренних органов) или связанной с терапией злокачественной опухоли (например, постхимиотерапевтические синдромы, хронические послеоперационные болевые синдромы, синдромы после облучения), спинной боли, которая может быть обусловлена грыжей или разрывом межпозвоночного диска или аномалиями поясничных фасеточных суставов, крестцово-подвздошных сочленений, параспинальных мышц или задней продольной связки. Невропатическую боль определяют как боль, вызванную или обусловленную первичным повреждением или дисфункцией в нервной системе (определение IASP). Повреждение нерва может быть вызвано травмой и заболеванием, и таким образом термин невропатическая боль охватывает многие расстройства с разнообразной этиологией. Указанные расстройства включают, но не ограничены указанным, диабетическую невропатию, послегерпесную невралгию, спинную боль, невропатию при злокачественной опухоли, индуцированную химиотерапией невропатию, ВИЧ-невропатию, фантомные боли конечностей, запястный сухожильный синдром, хронический алкоголизм, гипотиреоидизм, невралгию тройничного нерва, уремию, индуцированную травмой невропатию или витаминные недостаточности. Невропатическая боль является патологической, так как она не играет защитной роли. Она часто имеет место намного позже того, как исходная причина спала, обычно продолжаясь в течение многих лет, значительно снижая качество жизни пациентов (Woolf and Mannion 1999 Lancet 353: 1959-1964). Симптомы невропатической боли трудно лечить, так как они часто являются гетерогенными даже среди пациентов с одним и тем же заболеванием (Woolf and Decosterd 1999 Pain Supp. 6: S141-S147; Woolf and Mannion 1999Lancet 353: 1959-1964). Они включают спонтанную боль, которая может быть постоянной или пароксизмальной и аномально вызываемой болью, такой как гипералгезия (повышенная чувствительность к вредному стимулу) и аллодиния (чувствительность к обычно безвредному стимулу). Воспалительный процесс представляет собой сложную серию биохимических и клеточных событий, активируемых в ответ на повреждение ткани или присутствие чужеродных веществ, которые приводят к опухоли и боли (Levine and TaiWО 1994: Textbook of Pain 45-56). Артритическая боль составляет большую часть совокупности воспалительных болей. Ревматоидное заболевание является одним из самых распространенных хронических воспалительных состояний в развитых странах, и ревматоидный артрит (RA) является распространенной причиной нетрудоспособности. Точная этиология RA неизвестна, но современная гипотеза предполагает, что важными могут быть как генетические, так и микробиологические факторы (Grennan and Jayson, 1994 Textbook of Pain 397-407) . По оценкам почти 16 миллионов американцев имеют симптоматический остеоартрит (ОА) или дегенеративное заболевание суставов,большинство из которых имеют возраст более 60 лет, и как ожидается это количество увеличится до 40 миллионов, так как возраст населения увеличивается, что делает данную проблему здравоохранения проблемой огромной важности (Houge and Mersfelder, 2002 Ann. Pharmacother. 36: 679-686; McCarthy etal., 1994 Textbook of Pain 387-395). Большинство пациентов с ОА обращается за медицинской помощью из-за боли. Артрит оказывает существенное влияние на психосоциальную и физическую деятельность и,как известно, является главной причиной нетрудоспособности в старческом возрасте. Другие типы вос- 16007504 палительной боли включают, но не ограничены указанным, воспалительные заболевания кишечника(IBD). Другие типы боли включают, но не ограничены указанным,мышечно-скелетные расстройства, включая, но не ограничиваясь указанным, миалгию, фибромиалгию, спондилит, серонегативные (неревматоидные) артриты, несуставный ревматизм, дистрофинопатию,гликогенолиз, полимиозит, пиомиозит; центральную боль или таламическую боль, которая определяется как боль, вызванная повреждением или дисфункцией нервной системы, включая, но не ограничиваясь указанным, центральную боль после инсульта, множественный склероз, повреждение спинного мозга, болезнь Паркинсона и эпилепсию; сердечную и сосудистую боль, включая, но не ограничиваясь указанным, стенокардию, инфаркт миокарда, митральный стеноз, перикардит, феномен Рейно, склеродерму, ишемию скелетных мышц; висцеральную боль и желудочно-кишечные заболевания. Внутренние органы охватывают органы брюшной полости. Указанные органы включают половые органы, селезенку и часть пищеварительной системы. Боль, связанная с внутренними органами, может быть невропатической, ноцицептивной, а также воспалительной и может быть разделена на висцеральную боль пищеварительных органов и висцеральную боль непищеварительных органов. Обычно встречающиеся желудочно-кишечные (ЖК) расстройства включают функциональные расстройства кишечника (FBD) и воспалительные заболевания кишечника (IBD). Указанные ЖК-расстройства включают широкий круг патологических состояний, которые в настоящее время только умеренно контролируются, включая в случае FBD желудочнопищеводный рефлюкс, диспепсию, синдром раздраженного кишечника (IBS) и синдром функциональной абдоминальной боли (FAPS), и в случае IBD-болезнь Крона, илеит и язвенный колит, которые все постоянно вызывают висцеральную боль. Другие типы висцеральной боли включают боль, связанную с дисменореей, тазовую боль, цистит и панкреатит; головную боль, включая, но не ограничивая указанным, мигрень, мигрень с аурой, мигрень без ауры, гистаминовую головную боль, головную боль напряженного типа; рото-лицевую боль, включая, но не ограничивая указанным, зубную боль, височнонижнечелюстную мышечно-лицевую боль. Таким образом, в качестве еще одного аспекта предлагается одновременное, последовательное или раздельное применение лиганда альфа-2-дельта, за исключением соединений формулы (i)-(xxv) в PCT/IB 02/01146 и прегабалина или габапентина, где исключение прегабалина или габапентина ограничено применением при лечении невропатии, и ингибитора PDE5 в производстве лекарственного средства для терапевтического, профилактического или паллиативного лечения боли, особенно невропатической боли. В качестве предпочтительного признака применение в подходящем случае охватывает любую из комбинаций, указанных в описании выше. В качестве альтернативного аспекта предлагается способ терапевтического, профилактического или паллиативного лечения боли, особенно невропатической боли, включающий одновременное, последовательное или раздельное введение терапевтически эффективного количества лиганда альфа-2-дельта, за исключением прегабалина или габапентина, где исключение прегабалина или габапентина ограничено применением при лечении невропатии, и ингибитора PDE5 млекопитающему, нуждающемуся в указанном лечении. В качестве альтернативного аспекта исключение может охватывать соединения формулы(i)-(xxv) в PCT/IB 02/01146. В качестве предпочтительного признака способ в подходящем случае охватывает любую из комбинаций, указанных в данном описании выше. В качестве альтернативного аспекта предлагается одновременное, последовательное или раздельное применение синергической комбинации лиганда альфа-2-дельта и ингибитора PDE5 в производстве лекарственного средства для терапевтического, профилактического или паллиативного лечения боли, особенно невропатической боли. В качестве предпочтительного признака применение в подходящем случае охватывает любую из комбинаций, указанных в данном описании выше. В качестве следующего альтернативного аспекта предлагается способ терапевтического, профилактического или паллиативного лечения боли, особенно невропатической боли, включающий одновременное, последовательное или раздельное введение терапевтически синергического количества лиганда альфа-2-дельта и ингибитора PDE5 млекопитающему, нуждающемуся в указанном лечении. В качестве предпочтительного признака способ в подходящем случае охватывает любую из комбинаций, указанных в данном описании выше. Биологическую активность лигандов альфа-2-дельта согласно изобретению можно измерить в анализе связывания радиоактивных лигандов, используя [3 Н]габапентин и 2-субъединицу, полученную из ткани головного мозга свиньи (Gee N.S., Brown J.P., Dissanayake V.U.K., Offord J., Thurlow R., WoodruffG.N., J. Biol. Chem., 1996; 271: 5879-5776). Результаты могут быть выражены в мкМ или нМ аффинности связывания 2. Ингибирующие активности in vitro ингибиторов PDE5 согласно данному изобретению в отношении циклического гуанозинмонофосфата (цГМФ) можно определить путем измерения значений IC50 согласно- 17007504 подробному описанию в WO 01/27113. Функциональную активность можно оценить как описано S.A.Ballard et al. (Brit. J. Pharmacology, 1996, 118 (suppl.), abstract 153P). Элементы комбинации согласно данному изобретению можно вводить раздельно, совместно или последовательно. В качестве следующего аспекта данного изобретения предлагается упаковка, содержащая синергическую комбинацию лиганда альфа-2-дельта и ингибитора PDE5 и подходящий сосуд. Комбинацию согласно данному изобретению необязательно также можно вводить с одним или несколькими другими фармакологически активными агентами. Подходящие необязательные агенты включают:(iii) нестероидные противовоспалительные лекарственные средства (НПВС), например аспирин,диклофенак, дифлуинсал, этодолак, фенбуфен, фенопрофен, флуфенизал, флурбипрофен, ибупрофен,индометацин, кетопрофен, кеторолак, меклофенаминовая кислота, мефенаминовая кислота, набуметон,напроксен, оксапрозин, фенилбутазон, пироксикам, сулиндак, толметин, зомепирак и их фармацевтически приемлемые соли или сольваты;(iv) барбитуратные седативные средства, например амобарбитал, апробарбитал, бутабарбитал, бутабитал, мефобарбитал, метарбитал, метогекситал, пентобарбитал, фенобарбитал, секобарбитал, талбутал, тиамилал, тиопентал и их фармацевтически приемлемые соли или сольваты;(v) бензодиазепины, обладающие седативным действием, например хлордиазэпоксид, клоразепат,диазепам, флуразепам, лоразепам, оксазепам, темазепам, триазолам и их фармацевтически приемлемые соли или сольваты,(vi) H1-антагонисты, обладающие седативным действием, например дифенгидрамин, пириламин,прометазин, хлорфенирамин, хлорциклизин и их фармацевтически приемлемые соли или сольваты;(vii) разные седативные средства, такие как глутетимид, мепробамат, метаквалон, дихлоралфеназон и их фармацевтически приемлемые соли или сольваты;(viii) релаксанты скелетной мускулатуры, например баклофен, толперизон, каризопродол, хлорзоксазон, циклобензаприн, метокарбамол, орфренадин и их фармацевтически приемлемые соли или сольваты;(ix) антагонисты рецептора NMDA, например декстромезорфан +)-3-гидрокси-N-метилморфинан) и его метаболит, декстрорфан +)-3-гидрокси-N-метилморфинан), кетамин, мемантин, пирролохинолинхинон и цис-4-(фосфонометил)-2-пиперидинкарбоновую кислоту и их фармацевтически приемлемые соли или сольваты;(xiii) ингибиторы обратного захвата серотонина, например флуоксетин, пароксетин, циталопрам и сертралин;(xiv) смешанные ингибиторы обратного захвата серотонина-норадреналина, например милпаципран, венлафаксин и дулоксетин;(xv) ингибиторы обратного захвата норадреналина, например ребоксетин;(xix) неселективные ингибиторы СОХ (предпочтительно с GI-защитой), например нитрофлурбипрофен (НСТ-1026);(xxviii) смешанные агенты, такие как Tramadol. Таким образом, данное изобретение распространяется на комбинированный продукт, содержащий лиганд альфа-2-дельта, ингибитор PDE5 и один или несколько других терапевтических средств, таких как одно из средств, перечисленных выше, для одновременного, раздельного или последовательного применения при терапевтическом, профилактическом или паллиативном лечении боли, особенно невропатической боли. Комбинацию согласно данному изобретению можно вводить отдельно, но, как правило, один или оба элемента будут вводиться в смеси с подходящим фармацевтическим эксципиентом(ами), разбавителем(ями) или носителем(ями), выбранными в соответствии с предполагаемым путем введения и стандартной фармацевтической практикой. Если это уместно можно добавлять вспомогательные вещества. Вспомогательными веществами являются консерванты, антиоксиданты, корригенты или красители. Соединения согласно изобретению могут относиться к типу немедленного, отсроченного, модифицированного, длительного, пульсирующего или контролируемого высвобождения. Элементы комбинации согласно данному изобретению можно вводить, например, но не ограничиваясь указанным, следующими путями: перорально, буккально или подъязычно в форме таблеток, капсул, в форме из множества частиц и в форме из наночастиц, гелей, пленок (включая мукоадгезивные),порошка, овул, эликсиров, лепешек (включая наполненные жидкостью), жевательных форм, растворов,суспензий и спреев. Соединения согласно изобретению также можно вводить в виде осмотической дозированной формы или в форме высокоэнергетической дисперсии или в виде покрытых частиц или в быстро растворяющейся, быстро дезинтегрирующей дозированной форме, как описано в Ashley Publications,2001, Liang and Chen. Соединения согласно изобретению можно вводить в виде кристаллических или аморфных продуктов, высушенных сублимацией или высушенных распылением. Подходящие композиции соединений согласно изобретению при необходимости могут быть в гидрофильном или гидрофобном матриксе, комплексе с ионообменной смолой, в покрытой или непокрытой форме и в виде других типов, как описано в US 6106864. Такие фармацевтические композиции, например таблетки, могут содержать эксципиенты, такие как микрокристаллическая целлюлоза, лактоза, цитрат натрия, карбонат кальция, двухосновный фосфат кальция, глицин и крахмал (предпочтительно кукурузный, картофельный крахмал или крахмал из тапиоки), маннит, дезинтегрирующие агенты, такие как гликолат крахмала натрия, кросскармелоза натрия и некоторые комплексные силикаты, и связывающие вещества для гранулирования, такие как поливинилпирролидон, гидроксипропилметилцеллюлоза (НРМС), триглицериды,гидроксипропилцеллюлоза (НРС), бентонит-сахароза, сорбит, желатин и аравийская камедь. Дополнительно к твердым композициям могут быть добавлены лубриканты, такие как стеарат магния, стеариновая кислота, глицерил-бегенат, ПЭГ и тальк, или увлажнители, такие как лаурилсульфат натрия. Дополнительно могут быть включены полимеры, такие как углеводы, фосфолипиды и белки. Быстро диспергирурующиеся или растворяющиеся составы (FDDF) могут содержать следующие ингредиенты: аспартам, ацесульфам калия, лимонную кислоту, кроскармеллозу натрия, кросповидон,диаскорбиновую кислоту, этилакрилат, этилцеллюлозу, желатин, гидроксипропилметилцеллюлозу, стеарат магния, маннит, метилметакрилат, мятный корригент, полиэтиленгликоль, коллоидную двуокись кремния, диоксид кремния, гликолят крахмала натрия, стеарилфумарат натрия, сорбит или ксилит. Термины диспергирующийся или растворяющийся в используемом в данном описании смысле для описанияFDDF зависят от растворимости используемого лекарственного вещества, т.е. в том случае, когда лекарственное вещество нерастворимо, можно приготовить быстро диспергирующуюся дозированную форму,и когда лекарственное вещество растворимо, можно приготовить быстро растворяющуюся дозированную форму. Твердую дозированную форму, такую как таблетки, производят стандартным способом, например,прямым прессованием или влажным, сухим гранулированием или гранулированием расплава, методом затвердевания из расплава и методом экструзии. Сердцевины таблеток, которые могут быть одно- или многослойными, могут быть покрыты соответствующими покрытиями, известными в данной области. Твердые композиции подобного типа также могут применяться в качестве наполнителей в капсулах, таких как желатиновые, крахмальные капсулы или НРМС-капсулы. Предпочтительные эксципиенты в этом отношении включают лактозу, крахмал, целлюлозу, молочный сахар или высокомолекулярные полиэтиленгликоли. Жидкие композиции могут использоваться как наполнители в мягких и твердых капсулах, таких как желатиновая капсула. Для водных и масляных суспензий, растворов, сиропов и/или эликсиров соединения согласно изобретению можно комбинировать с различными подсластителями или корригентами, пигментами или красителями, с эмульгирующими и/или суспендирующими агентами и с разбавителями, такими как вода, этанол, пропиленгликоль, метилцеллюлоза, альгиновая кислота или альгинат натрия, глицерин, масла, гидроколлоидные агенты и их комбинации. Кроме того, композиции,содержащие указанные соединения и эксципиенты, могут быть представлены в виде сухого продукта для восстановления с использованием воды или других подходящих наполнителей перед использованием. Препараты в жидкой форме включают растворы, суспензии и эмульсии, например водные или водно-пропиленгликолевые растворы. Для парентеральной инъекции жидкие препараты могут быть приго- 19007504 товлены в растворе, в водном растворе полиэтиленгликоля. Водные растворы, подходящие для перорального применения, могут быть приготовлены посредством растворения активного компонента в воде и добавления при необходимости подходящих красителей, корригентов, стабилизаторов и загустителей. Водные суспензии, подходящие для перорального применения, могут быть приготовлены путем диспергирования тонкодисперсного активного компонента в воде с вязким материалом, таким как природные и синтетические камеди, смолы, метилцеллюлоза, натрий-карбоксиметилцеллюлоза и другие хорошо известные суспендирующие агенты. Элементы комбинации согласно данному изобретению также можно вводить инъекцией, т.е. внутривенно, внутримышечно, внутрикожно, интрадуоденально или внутрибрюшинно, внутриартериально,интратекально, интравентрикулярно, интрауретрально, внутригрудинно, интракраниально, интраспинально или подкожно, или их можно вводить посредством инфузии, безигольных инжекторов или способами инъекции имплантата. Для такого парентерального введения их лучше всего использовать в форме стерильного водного раствора, суспензии или эмульсии (или системы так, чтобы можно было включить мицеллы), которые могут содержать другие вещества, известные в данной области, например, достаточное количество солей или углеводов, таких как глюкоза, чтобы сделать раствор изотоничным крови. Водные растворы при необходимости должны быть соответствующим образом забуферены (предпочтительно до рН от 3 до 9). Для некоторых форм парентерального введения их можно использовать в форме стерильной неводной системы, такой как нелетучие масла, включая моно- или диглицериды, и жирные кислоты, включая олеиновую кислоту. Приготовление подходящих парентеральных составов в стерильных условиях, например, лиофилизацией, легко осуществимо стандартными фармацевтическими способами, хорошо известными специалистам в данной области. Альтернативно, активный ингредиент может быть в форе порошка для восстановления с использованием подходящего наполнителя (например, стерильной апирогенной воды) перед использованием. Также элементы комбинации согласно данному изобретению можно вводить интраназально или с помощью ингаляции. Их обычно доставляют в форме сухого порошка (каждый отдельно, в виде смеси,например сухой смеси с лактозой, или в виде частицы из смешанных компонентов, например, с фосфолипидами) из ингалятора для сухого порошка или подачей аэрозольной струи из контейнера под давлением, насоса, спрея, пульверизатора (предпочтительно пульверизатора с использованием электрогидродинамики для получения мелкодисперсного тумана) или распылителя с применением или без применения подходящего газа-вытеснителя, например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, гидрофторалкана, такого как 1,1,1,2-тетрафторэтан (HFA 134A [торговая марка]) или 1,1,1,2,3,3,3-гептафторпропана (HFA 227EA [торговая марка]), диоксида углерода, дополнительного перфторированного углеводорода, такого как Perflubron (торговая марка) или другого подходящего газа. В случае аэрозоля под давлением единицу дозирования можно определить за счет снабжения клапаном для доставки дозируемого количества. Контейнер под давлением, насос, спрей, пульверизатор или распылитель может содержать раствор или суспензию активного соединения, например, с использованием смеси этанола (необязательно водного раствора этанола) или подходящего агента для диспергирования,солюбилизации или длительного высвобождения и вытеснителя в качестве растворителя, который может дополнительно содержать лубрикант, например триолеат сорбитана. Могут быть приготовлены капсулы,блистеры и картриджи (сделанные, например, из желатина или НРМС) для применения в ингаляторе или инсуффляторе так, чтобы они содержали порошкообразную смесь соединения согласно изобретению,подходящей порошкообразной основы, такой как лактоза или крахмал, и модификатора эффективности,такого как 1-лейцин, маннит или стеарат магния. Перед применением в составе сухого порошка или суспензионном составе для ингаляции элементы комбинации согласно изобретению следует тонко измельчать до размера, подходящего для доставки путем ингаляции (обычно считается до размера менее 5 мкм). Тонкое измельчение можно осуществить рядом способов, например измельчением спиральной струей, измельчением струей в псевдоожиженном слое, с применением сверхкритической флюидной кристаллизации или распылительной сушки. Подходящие композиции в виде раствора для применения в пульверизаторе с использованием электрогидродинамики для получения мелкодисперсного тумана могут содержать от 1 мкг до 10 мг соединения согласно изобретению на один выпуск, и объем выпуска может варьировать от 1 до 100 мкл. Типичная композиция может содержать соединение согласно изобретению, пропиленгликоль, стерильную воду, этанол и хлорид натрия. Можно использовать альтернативные растворители вместо пропиленгликоля, например глицерин или полиэтиленгликоль. Альтернативно, элементы комбинации согласно изобретению можно вводить местно на кожу, слизистую оболочку, дермально или трансдермально, например, в форме геля, гидрогеля, лосьона, раствора,крема, мази, опудривающего средства, перевязочного материала, пены, пленки, кожного пластыря, облаток, имплантатов, губок, мочал, бинта, микроэмульсий и их комбинаций. Для таких применений соединения согласно изобретению можно суспендировать или растворять, например, в смеси с одним или несколькими из следующих веществ: минеральное масло, жидкий вазелин, белый вазелин, пропиленгликоль, соединение полиоксиэтилена-полиоксипропилена, эмульгирующий воск, нелетучие масла, включая синтетические моно- или диглицериды, и жирные кислоты, включая олеиновую кислоту, вода, моностеа- 20007504 рат сорбитана, полиэтиленгликоль, жидкий парафин, полисорбат 60, воск на основе сложных цетиловых эфиров, 2-октилдодеканол, бензиловый спирт, спирты, такие как этанол. Альтернативно, можно использовать усилители проникновения. Также можно использовать следующее: полимеры, углеводы, белки,фосфолипиды в форме наночастиц (таких как ниосомы или липосомы), либо суспендированные, либо растворенные. Кроме того, их можно доставлять с использованием ионтофореза, электропорации, фонофореза и сонофореза. Альтернативно, элементы комбинации согласно изобретению можно вводить ректально, например,в форме суппозитория или пессария. Их также можно вводит вагинальным путем. Например, указанные композиции можно приготовить смешиванием лекарственного средства с подходящими не раздражающими эксципиентами, такими как масло какао, синтетические глицеридные сложные эфиры или полиэтиленгликоли, которые являются твердыми при обычных температурах, но превращаются в жидкость и/или растворяются в полости, высвобождая лекарственное средство. Элементы комбинации согласно изобретению также можно вводить глазным путем. Для применения на глазах соединения можно приготовить в виде суспензий тонкоизмельченных веществ в изотоничном стерильном физиологическом растворе с доведенным рН или предпочтительно в виде растворов в изотоничном стерильном физиологическом растворе с доведенным рН. Может быть добавлен полимер,такой как сшитая полиакриловая кислота, поливиниловый спирт, гиалуроновая кислота, целлюлозный полимер (например, гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза, метилцеллюлоза) или гетерополисахаридный полимер (например, камедь гелана). Альтернативно, они могут быть приготовлены в мази, такой как в вазелине или минеральном масле, включенными в биодеградируемые (например,абсорбируемые гелевые губки, коллаген) или небиодеградируемые (например, силикон) имплантаты, в виде облаток, капель, линз или доставляемых посредством корпускулярных или везикулярных систем,таких как ниосомы или липосомы. Составы необязательно можно комбинировать с консервантом, таким как хлорид бензалкония. Кроме того, их можно доставлять с использованием ионтофореза. Их также можно вводить в ухо, используя, например, но без ограничения, капли. Элементы комбинации согласно изобретению также можно применять в комбинации с циклодекстрином. Известно, что циклодекстрины образуют комплексы включения и комплексы, не являющиеся включениями, с молекулами лекарственных средств. Образование комплекса лекарственное средствоциклодекстрин может модифицировать свойство растворимости, скорости растворения, маскирования вкуса, биодоступности и/или стабильности молекулы лекарственного средства. Комплексы лекарственное средство-циклодекстрин, как правило, применимы для большинства дозированных форм и путей введения. В качестве альтернативы прямому комплексообразованию с лекарственным средством циклодекстрин можно использовать в качестве вспомогательной добавки, например, в качестве носителя, разбавителя или солюбилизатора. Используемые в большинстве случаев альфа-, бета- и гаммациклодекстрины и подходящие примеры описаны в WO-A-91/11172, WO-A-94/02518 и WO-A-98/55148. Термин введенный включает доставку с использованием вирусных и невирусных методик. Механизмы вирусной доставки включают, но не ограничены указанным, аденовирусные векторы, векторы на основе аденоассоциированных вирусов (AAV), векторы на основе вируса герпеса, ретровирусные векторы, лентивирусные векторы и бакуловирусные векторы. Механизмы невирусной доставки включают опосредованную липидами трансфекцию, липосомы, иммунолипосомы, липофектин, катионные фациальные амфифилы (CFA) и их комбинации. Пути для таких механизмов доставки включают, но не ограничены указанным, мукозальный, назальный, пероральный, парентеральный, желудочно-кишечный или подъязычный пути. Таким образом, в качестве следующего аспекта данного изобретения предлагается фармацевтическая композиция, содержащая комбинацию, включающую лиганд альфа-2-дельта, за исключением габапентина, прегабалина, ингибитор PDE5 и подходящий эксципиент, разбавитель или носитель. Альтернативно, исключение может касаться соединений формулы (i)-(xxv) в PCT/IB 02/01146. В подходящем случае композиция подходит для применения при лечении боли, особенно невропатической боли. В качестве альтернативного аспекта данного изобретения предлагается фармацевтическая композиция, содержащая синергическую комбинацию, включающую лиганд альфа-2-дельта, ингибитор PDE5 и подходящий эксципиент, разбавитель или носитель. В подходящем случае композиция подходит для применения при лечении боли, особенно невропатической боли. Для введения животному, отличному от человека, термин фармацевтический в используемом в данном описании смысле можно заменить термином ветеринарный. Элемент фармацевтического препарата предпочтительно находится в единичной дозированной форме. В такой форме препарат разделен на единичные дозы, содержащие соответствующие количества активного компонента. Единичная дозированная форма может быть в виде упакованного препарата, при этом упаковка содержит дискретные количества препарата, а именно пакетированные таблетки, капсулы и порошки во флаконах или ампулах. Также единичная дозированная форма может представлять собой капсулы, таблетку, облатку или лепешку как таковые, или она может представлять собой соответствующее количество любых из них в упакованной форме. Количество активного компонента в единичном дозированном препарате можно варьировать или корректировать в соответствии с конкретным примене- 21007504 нием и эффективностью активных компонентов. Обычно лечение начинается с меньших доз, которые меньше оптимальной дозы соединения. Впоследствии доза увеличивается небольшими приращениями вплоть до достижения оптимального эффекта в данных условиях. Для удобства при желании суммарную суточную дозу можно разделить и вводить порциями в течение суток. Для ветеринарного применения комбинацию согласно данному изобретению или ее ветеринарно приемлемые соли или сольваты вводят в виде соответствующей приемлемой композиции в соответствии с обычной ветеринарной практикой, и ветеринарный врач будет определять схему дозирования и путь введения, который будет наиболее подходящим для конкретного животного. Биологические примеры Способы. Животные. Самцов крыс Sprague Dawley (200-250 г), полученных от Charles River, (Margate, Kent, U.K.), содержали в группах по 6. Всех животных выдерживали в условиях цикла 12 ч свет/темнота (свет включали в 07 ч 00 мин) с получением пищи и воды по желанию. Все эксперименты проводились исследователем, не осведомленным в отношении обработок лекарственными средствами. Хирургическая операция CCI на крысах. Животных анестезировали изофлураном. Седалищный нерв перевязывали, как описано ранее Bennett and Xie, 1988. Животных помещали на одеяло с постоянной температурой для продолжения процедуры. После хирургического препарирования общий седалищный нерв открывали в середине бедра тупым отделением вдоль двуглавой мышцы бедра. Проксимально по отношению к разветвлению седалищного нерва на три ветви примерно 7 мм нерва освобождали от прилипающей ткани и вокруг него свободно обвязывали 4 лигатуры (шелк 4-0) примерно с интервалом в 1 мм. Разрез закрывали послойно и рану обрабатывали местными антибиотиками. Влияние комбинации на сохранение ССI-индуцированной статической и динамической аллодинии. Сначала на модели CCI были определены зависимые от дозы ответы на габапентин и силденафил отдельно. Комбинации исследовали, следуя расчету фиксированного соотношения. Исследовали дозуответ для каждого фиксированного соотношения доз комбинации. В каждый день тестирования определяли пороги отдергивания лапы (PWT) исходного уровня на воздействие волосками von Frey и латентные периоды отдергивания лапы (PWL) на стимул ватной палочки перед лечением лекарственными средствами. Габапентин вводили п/о сразу после п/к-введения силденафила и PWT и PWL проверяли повторно вплоть до 5 ч. Данные выражены во временной точке 2 ч как в случае статических, так и динамических данных, так как данная временная точка представляет собой пик антиаллодинического эффекта. Оценка аллодинии. Статическую аллодинию измеряли, используя волоски Semmes-Weinstein von Frey (Stoelting, Illinois, U.S.A.). Животных помещали в клетки с дном из проволочной сетки, обеспечивающим доступ к нижней стороне их лап. Перед началом эксперимента животных приучали к данной окружающей обстановке. Статическую аллодинию тестировали, касаясь подошвенной поверхности правой задней лапы животных волосками von Frey в порядке возрастания силы (0,7; 1,2; 1,5; 2; 3,6; 5,5; 8,5; 11,8; 15,1 и 29 г) в течение времени до 6 с. После установления ответа в виде отдергивания, повторно тестировали лапу,начиная со следующего по убыванию волоска von Frey вплоть до того, как ответа не происходило. Самая большая сила 29 г, поднимающая лапу, а также вызывающая ответ, таким образом, означала точку отсечения. Самую низкую величину силы, необходимую для того, чтобы вызвать ответ, регистрировали какPWT в граммах. Динамическую аллодинию оценивали, слегка поглаживая подошвенную поверхность задней лапы ватной палочкой. Заботились о том, чтобы выполнить данную процедуру на полностью привыкших крысах, которые были неактивными, чтобы избежать регистрации общей моторной активности. По меньшей мере три измерения делали в каждой временной точке, среднее из которых представляло собой период латентности отдергивания лапы (PWL). Если реакция не проявлялась в течение 15 с, процедуру останавливали и животных оценивали по данному времени отдергивания. Таким образом, 15 с в действительности означает, что отдергивания нет. Ответ отдергивания часто сопровождался многократными вздрагиваниями или облизыванием лапы. Считали, что динамическая аллодиния имеет место, если животные отвечали на стимул ваты до 8 с поглаживания. Результаты. Влияние габапентина и силденафила отдельно на CCI-индуцированную статическую и динамическую аллодинию. Габапентин зависимым от дозы образом (10-100 мг/кг, п/о) блокировал сохранение как статической,так и динамической аллодинии при минимальной эффективной дозе (MED) 10 мг/кг (фиг. 1, 2). Доза 100 мг/кг вызывала полную блокаду указанных ответов. Силденафил зависимым от дозы образом (10-30 мг/кг п/к) блокировал сохранение статической аллодинии с минимальной эффективной дозой 10 мг/кг и с дозой в 30 мг/кг, вызывающей примерно 60% блокаду (фиг. 1). Силденафил оказывал умеренное действие на сохранение динамической аллодинии с MED 30 мг/кг, вызывающей 25% блокаду (фиг. 2).- 22007504 Влияние комбинаций габапентина и силденафила на CCI-индуцированную статическую аллодинию. Габапентин и силденафил имели пик антиаллодинического действия в точке 2 ч после введения в ССI-индуцированной статической модели. Таким образом, для четкости все данные относительно комбинаций выражали в значениях для данной временной точки. Габапентин и силденафил вводили при фиксированных соотношениях доз 1:10, 1:1, 10:1 и 20:1. При соблюдении фиксированных соотношений доз 1:10 и 20:1 комбинации габапентина и силденафила давали аддитивное взаимодействие (фиг. 3). Однако фиксированное соотношение доз 1:1 и 10:1 демонстрировало синергию, при этом статическая аллодиния полностью блокировалась суммарной дозой 20 мг/кг и 11 мг/кг, соответственно (фиг. 3). Комбинация 1:1 представляет собой в 10 раз меньшую дозу габапентина и в 3 раза меньшую дозу силденафила,чем при введении отдельно, тогда как соотношение 10:1 представляет собой в 10 раз меньшую дозу габапентина и в 30 раз меньшую дозу силденафила, чем при введении отдельно. Влияние комбинаций габапентина и силденафила на CCI-индуцированную динамическую аллодинию. Габапентин и силденафил имели пик антиаллодинического действия в точке 2 ч после введения в ССI-индуцированной динамической модели. Таким образом, для четкости все данные относительно комбинаций выражали в значениях для данной временной точки. Габапентин и силденафил вводили при фиксированных соотношениях доз 1:10, 1:1, 10:1 и 20:1. В случае динамической аллодинии наблюдали результаты, сходные с данными в случае статической аллодинии. При соблюдении фиксированных соотношений доз 1:10 и 20:1 комбинации габапентина и силденафила давали аддитивное взаимодействие(фиг. 4). Однако фиксированное соотношение доз 1:1 и 10:1 демонстрировало синергию, при этом динамическая аллодиния полностью блокировалась суммарной дозой 20 и 11 мг/кг соответственно (фиг. 3). Комбинация 1:1 представляет собой в 10 раз меньшую дозу габапентина и в 3 раза меньшую дозу силденафила, чем при введении отдельно, тогда как соотношение 10:1 представляет собой в 10 раз меньшую дозу габапентина и в 30 раз меньшую дозу силденафила, чем при введении отдельно. Сходные эксперименты также проводили на такой же модели для другого лиганда альфа-2-дельта[4,3-d]пиримидин-7-оном (соединение АА). Результаты данных экспериментов суммированы ниже и представлены в форме таблицы (табл. 1 и 2). Таблица 1 Влияние комбинаций прегабалина и силденафила на CCI-индуцированную статическую аллодинию. Прегабалин и силденафил имели пик антиаллодинического действия в точке 2 ч после введения в ССI-индуцированной статической модели. Прегабалин и силденафил вводили при фиксированных соотношениях доз 1:1 и 10:1. Указанные фиксированные соотношения доз демонстрировали синергию, при этом статическая аллодиния полностью блокировалась суммарной дозой 20 и 11 мг/кг соответственно. Комбинация 1:1 представляет собой в 3 раз меньшую дозу прегабалина и в 3 раза меньшую дозу силденафила, чем при введении отдельно, тогда как соотношение 10:1 представляет собой в 3 раза меньшую дозу прегабалина и в 30 раз меньшую дозу силденафила, чем при введении отдельно.- 23007504 Влияние комбинаций габапентина и соединения АА на CCI-индуцированную статическую аллодинию. Габапентин и соединение АА имели пик антиаллодинического действия в точке 2 ч после введения в CCI-индуцированной статической модели. Габапентин и соединение АА вводили при фиксированном соотношении доз 10:1. Данное фиксированное соотношение доз демонстрировало синергию, при этом статическая аллодиния полностью блокировалась суммарной дозой 11 мг/кг соответственно. Комбинация 10:1 представляет собой в 10 раз меньшую дозу габапентина и в 30 раз меньшую дозу соединения АА, чем при введении отдельно. Подходящие ингибиторы PDE5 согласно данному изобретению можно получить, как описано в указанных выше ссылках на патентную литературу или они является очевидными для специалистов в данной области на основании указанных документов. Подходящие соединения лигандов альфа-2-дельта согласно данному изобретению можно получить,как описано ниже или в указанных выше ссылках на патентную литературу, или они являются очевидными для специалистов в данной области на основании указанных документов. Химические примеры Пример 1. Гидрохлорид (3S,5R)-3-амино-5-метилоктановой кислоты.(R)-2,6-диметилнон-2-ен. К (S)-цитронеллилбромиду (50 г; 0,228 моль) в ТГФ (800 мл) при 0 С добавляли LiCl (4,3 г) затем CuCl2 (6,8 г). Через 30 мин добавляли хлорид метилмагния (152 мл 3 М раствора в ТГФ, Aldrich) и раствор нагревали до комнатной температуры. Через 10 ч раствор охлаждали до 0 С и осторожно добавляли насыщенный водный раствор хлорида аммония. Полученные в результате два слоя разделяли и водную фазу экстрагировали. Объединенные органические фазы сушили (MgSO4) и концентрировали, получая (R)-2,6-диметилнон-2-ен, 32,6 г, 93%, используемый без дальнейшей очистки. 1 Н ЯМР (400 МГц; CDCl3)5,1 (м, 1 Н), 1,95 (м, 2 Н), 1,62 (с, 3 Н), 1,6 (с, 3 Н), 1,3 (м, 4 Н), 1,2 (м, 2 Н),0,8 (с, 6 Н); 13 С ЯМР (100 МГц; CDCl3)131,13, 125,28, 39,50, 37,35, 32,35, 25,92, 25,77, 20,31, 19,74, 17,81,14,60.(R)-4-Метилгептановая кислота. К (R)-2,6-диметилнон-2-ену (20 г; 0,13 моль) в ацетоне (433 мл) добавляли раствор CrO3 (39 г; 0,39 моль) в H2SO4 (33 мл)/Н 2O (146 мл) в течение 50 мин. Спустя 6 ч добавляли следующее количество CrO3 (26 г; 0,26 моль) в H2SO4 (22 мл)/Н 2O (100 мл). Через 12 ч раствор разбавляли насыщенным раствором соли и раствор экстрагировали эфиром. Объединенные органические фазы сушили (MgSO4) и концентрировали. Флэш-хроматография (градиент от 6:1 до 2:1 смеси гексан/EtOAc) давала (R)-4-метилгептановую кислоту в виде масла. 12,1 г; 65%. МС, m/z (относительная интенсивность): 143 [М-Н, 100%].(4R,5S)-4-Метил-3-R)-4-метилгептаноил)-5-фенилоксазолидин-2-он. К (R)-4-метилгептановой кислоте (19 г; 0,132 моль) и триэтиламину (49,9 г; 0,494 моль) в ТГФ (500 мл) при 0 С добавляли триметилацетилхлорид (20 г; 0,17 моль). Через 1 ч добавляли LiCl (7,1 г; 0,17 моль), затем (4R,5S)-(+)-4-метил-5 фенил-2-оксазолидинон 3 (30 г; 0,17 моль). Смесь нагревали до комнатной температуры и через 16 ч фильтрат удаляли фильтрованием и раствор концентрировали при пониженном давлении. Флэшхроматография (7:1 гексан/EtOAc) давала (4R,5S)-4-метил-3-R)-4-метилгептаноил)-5-фенилоксазолидин-2-он в виде масла. 31,5 г; 79%.(12,1 г; 0,04 моль) в ТГФ (200 мл) при -50 С добавляли бис(триметилсилил)амид натрия (48 мл 1 М раствора в ТГФ). Через 30 мин добавляли трет-бутилбромацетат (15,6 г; 0,08 моль). Раствор перемешивали в течение 4 ч при -50 С и затем нагревали до комнатной температуры. Через 16 ч добавляли насыщенный водный раствор хлорида аммония и два слоя разделяли. Водную фазу экстрагировали эфиром и объединенные органические фазы сушили (MgSO4) и концентрировали. Флэш-хроматография (9:1 гексан/EtOAc) давала трет-бутиловый эфир (3S,5R)-5-метил-3-4R,5S)-4-метил-2-оксо-5-фенилоксазолидин-3-карбонил)октановой кислоты в виде белого твердого вещества, 12 г, 72%.(3S,5R)-5-метил-3-4R,5S)-4-метил-2-оксо-5-фенилоксазолидин-3-карбонил)октановой кислоты (10,8 г; 0,025 моль) в Н 2O (73 мл) и ТГФ (244 л) при 0 С добавляли предварительно смешанный раствор LiOH(0,8M раствор) и 3,65 мл Н 2O2 (30% раствор). Через 30 мин добавляли бисульфит натрия (7 г), сульфит натрия (13 г) и воду (60 мл), затем добавляли гексан (100 мл) и эфир (100 мл). Два слоя разделяли и водный слой экстрагировали эфиром. Объединенные органические фазы концентрировали до получения масла, которое растворяли в гептане (300 мл). Полученное в результате твердое вещество отфильтровы- 24007504 вали, фильтрат сушили (MgSO4) и концентрировали, получая 4-трет-бутиловый эфир (S)-2-R)-2 метилпентил)янтарной кислоты (6 г; 93%), который использовали сразу же без дальнейшей очистки. МС,m/z (относительная интенсивность): 257 [М+Н, 100%]. трет-Бутиловый эфир (3S,5R)-3-бензилоксикарбониламино-5-метилоктановой кислоты. Раствор 4 трет-бутилового эфира (S)-2-R)-2-метилпентил)янтарной кислоты (6,0 г; 23,22 ммоль) и триэтиламина(3,64 мл; 26,19 ммоль) в толуоле (200 мл) обрабатывали дифенилфосфорилазидом (5,0 мл; 23,22 мл) и перемешивали при комнатной температуре в течение 0,5 ч. Затем реакционную смесь кипятили с обратным холодильником в течение 3 ч и немного охлаждали, после этого добавляли бензиловый спирт (7,2 мл; 69,7 ммоль) и раствор нагревали еще в течение 3 ч. После того, как реакционной смеси давали возможность остыть, ее разбавляли этиловым эфиром (200 мл) и объединенный органический слой последовательно промывали насыщенным раствором NaHCO3 и насыщенным раствором соли и сушили(Na2SO4). Концентрированный органический компонент очищали хроматографией (ЖХСД), элюируя смесью 8:1 гексаны:этилацетат, получая трет-бутиловый эфир (3S,5R)-3-бензилоксикарбониламино-5 метилоктановой кислоты (6,4 г; 75,8%). МС: М+1: 364,2, 308,2. трет-Бутиловый эфир (3S,5R)-3-амино-5-метилоктановой кислоты. Раствор трет-бутилового эфира(3S,SR)-3-бензилоксикарбониламино-5-метилоктановой кислоты (2,14 г; 5,88 ммоль) в ТГФ (50 мл) обрабатывали Pd/C (0,2 г) и Н 2 при 50 фунт/кв.дюйм (344,7 кПа) в течение 2 ч. Затем реакционную смесь фильтровали и концентрировали до масла в вакууме, получая трет-бутиловый эфир (3S,SR)-3-амино-5 метилоктановой кислоты с количественным выходом. МС: М+1: 230,2; 174,1. Гидрохлорид (3S,5R)-3-амино-5-метилоктановой кислоты. Взвесь трет-бутилового эфира (3S,5R)амино-5-метилоктановой кислоты (2,59 г; 11,3 ммоль) в 6 н. НСl (100 мл) кипятили с обратным холодильником 18 ч, охлаждали и фильтровали через целит. Фильтрат концентрировали в вакууме до 25 мл и полученные в результате кристаллы собирали и сушили, получая гидрохлорид (3S,SR)-3-амино-5 метилоктановой кислоты, т.пл. 142,5-142,7 С (1,2 г; 50,56%). Вторую порцию (0,91 г) получали из фильтрата. Вычислено для C9H19NO2HCl: С: 51,55, Н: 9,61, N: 6,68, Cl: 16,91. Найдено: С: 51,69, Н: 9,72,N: 6,56, Cl: 16,63. Гидрохлоридная кислая соль (3S,5R)-3-амино-5-метилоктановой кислоты. 5,3 г 4-трет-бутилового эфира 2S-(2R-метилпентил)янтарной кислоты, находящихся в 30 мл метил-трет-бутилового эфира, подвергали взаимодействию при комнатной температуре с 3,5 мл триэтиламина, затем с 6,4 г дифенилфосфорилазида. После того как экзотермической реакции давали возможность достигнуть 45 С и после перемешивания в течение по меньшей мере 4 ч, реакционной смеси давали возможность остыть до комнатной температуры и оставляли до тех пор, пока фазы не разделились. Нижний слой отбрасывали и верхний слой промывали водой, затем разбавленным водным раствором HCl. Затем верхний слой объединяли с 10 мл 6 н. водного HCl и перемешивали при 45-65 С. Реакционную смесь концентрировали вакуумной перегонкой примерно до 10-14 мл и давали возможность кристаллизоваться при охлаждении примерно до 5 С. После сбора продукта фильтрованием, продукт промывали толуолом и повторно суспендировали в толуоле. Продукт сушили нагреванием в вакууме, получая 2,9 г (67%) белого кристаллического продукта. Продукт можно перекристаллизовать из водного HCl. Т.пл. 137 С. 1 Н ЯМР (400 МГц, D6 ДМСО)0,84-0,88 (перекрывающиеся д и т, 6 Н), 1,03-1,13 (м, 1 Н), 1,16-1,37(S)-3,7-диметилокт-6-ениловый эфир метансульфоновой кислоты. К S-(-)-цитронеллолу (42,8 г; 0,274 моль) и триэтиламину (91 мл, 0,657 моль) в СН 2 Сl2 (800 мл) при 0 С добавляли метансульфонилхлорид (26 мл, 0,329 моль) в СН 2 Сl2 (200 мл). Спустя 2 ч, при 0 С раствор промывали 1 н. HCl, затем насыщенным раствором соли. Органическую фазу сушили (MgSO4) и концентрировали, получая указанное в заголовке соединение в виде масла (60,5 г; 94%), которое использовали без дальнейшей очистки. МС,m/z (относительная интенсивность): 139 [100%], 143 [100%].(R)-2,6-Диметилокт-2-ен. К (S)-3,7-диметилокт-6-ениловому эфиру метансульфоновой кислоты (60 г; 0,256 моль) в ТГФ (1 л) при 0 С добавляли алюмогидрид лития (3,8 г; 0,128 моль). Через 7 ч добавляли дополнительно 3,8 г алюмогидрида лития и раствор нагревали до комнатной температуры. Через 18 ч добавляли еще 3,8 г алюмогидрида лития. Спустя еще 21 ч, реакцию осторожно гасили 1 н. лимонной кислотой и раствор далее разбавляли насыщенным раствором соли. Полученные в результате две фазы разделяли и органическую фазу сушили (MgSO4) и концентрировали, получая указанное в заголовке соединение в виде масла, которое использовали без дальнейшей очистки. МС, m/z (относительная интенсивность): 139 [М+Н, 100%].(7,26 г; 0,018 моль) в Н 2O (53 мл) и ТГФ (176 мл) при 0 С добавляли предварительно смешанный растворLiOH (37 мл 0,8 М раствора) и Н 2 О 2 (10,57 мл 30% раствора) и раствор нагревали до комнатной температуры. Через 2 ч добавляли бисульфит натрия (7 г), сульфит натрия (13 г) и воду (60 мл), два слоя разделяли и водный слой экстрагировали эфиром. Объединенные органические фазы концентрировали до получения масла, которое растворяли в гептане (200 мл). Полученное в результате твердое вещество отфильтровывали, фильтрат сушили (MgSO4) и концентрировали, получая указанное в заголовке соединение в виде масла (4,4 г), которое использовали без дальнейшей очистки. МС, m/z (относительная интенсивность): 243 [100%]. Трет-бутиловый эфир (3S,5R)-3-бензилоксикарбониламино-5-метилгептановой кислоты. Данное соединение получали, как описано выше, начиная с 4-трет-бутилового эфира (S)-2-R)-2-метилбутил)янтарной кислоты, получая трет-бутиловый эфир (3S,5R)-3-бензилоксикарбониламино-5 метилгептановой кислоты в виде масла (выход 73,3%). 1H ЯМР (400 МГц; CDCl3)0,84 (т, 3 Н, J=7,33 Гц), 0,89 (д, 3 Н, J=6,60 Гц), 1,12-1,38 (м, 4 Н), 1,41 (с,9 Н), 1,43-1,59 (м, 2 Н), 2,42 (м, 2 Н), 4,05 (м, 1 Н), 5,07 (т, 2 Н, J=12,95 Гц) и 7,28-7,34 (м, 5 Н). Трет-бутиловый эфир (3S, 5R) -амино-5-метилгептановой кислоты. Данное соединение получали как описано выше, начиная с трет-бутилового эфира (3S,SR)-3-бензилоксикарбониламино-5-метилгептановой кислоты вместо трет-бутилового эфира (3S,5R)-3-бензилоксикарбониламино-5-метилоктановой кислоты, получая указанное в заголовке соединение. 1 Н ЯМР (400 МГц; CDCl3)0,84 (перекрывающиеся т и д, 6 Н,), 1,08-1,16 (м, 2 Н), 1,27-1,30 (м, 2 Н),1,42 (с, 9 Н), 1,62 (уш.с, 2 Н), 2,15 (дд, 1 Н, J=8,54 и 15,62 Гц), 2,29 (дд, 1 Н, J=4,15 и 15,37 Гц) и 3,20 (уш.с,2 Н). Гидрохлорид (3S, 5R)-амино-5-метилгептановой кислоты. Взвесь трет-бутилового эфира (3S,5R)-амино-5-метилгептановой кислоты (1,44 г; 6,69 ммоль) в 3 н.HCl кипятили с обратным холодильником в течение 3 ч, фильтровали горячим через целит и концентрировали досуха. Растирание полученного в результате твердого вещества в этиловом эфире давало гидрохлорид (3S,5R)-3-амино-5-метилгептановой кислоты (0,95 г; 85%), т.пл. 126,3-128,3 С. Вычислено для(R)-4-Метилоктановая кислота. Хлорид лития (0,39 г; 9,12 ммоль) и хлорид меди (I) (0,61 г; 4,56 ммоль) объединяли в 45 мл ТГФ при температуре окружающей среды и перемешивали 15 мин, затем охлаждали до 0 С и в это время добавляли бромид этилмагния (1 М раствор в ТГФ, 45 мл, 45 ммоль). По каплям добавляли (S)-цитронеллилбромид (5,0 г; 22,8 ммоль) и раствору давали возможность медленно нагреться до температуры окружающей среды при перемешивании в течение ночи. Реакцию гасили осторожным добавлением насыщ. NH4Cl (водн.) и перемешивали с Et2O и насыщ. NH4Cl (водн.) в течение 30 мин. Фазы разделяли и органическую фазу сушили (MgSO4) и концентрировали. Неочищенный (R)2,6-диметилдек-2-ен использовали без очистки. К раствору (R)-2,6-диметилдек-2-ена (3,8 г; 22,8 ммоль) в 50 мл ацетона при 0 С добавляли реагент Джонса (2,7 М в H2SO4 (водн.), 40 мл, 108 ммоль) и раствору давали возможность медленно нагреться до температуры окружающей среды при перемешивании в течение ночи. Смесь распределяли между Et2O и Н 2O, фазы разделяли и органическую фазу промывали насыщенным раствором соли, сушили (MgSO4) и концентрировали. Остаток очищали флэш-хроматографией (8:1 гексаны:EtOAc), получая 2,14 г (59%) указанного в заголовке соединения в виде бесцветного масла: ЖХМС: m/z 156,9 (М+). Реагент Джонса получали в виде 2,7 М раствора, объединяя 26,7 г CrO3, 23 мл(4R,5S)-4-Метил-3-R)-4-метилоктаноил)-5-фенилоксазолидин-2-он. К (R)-4-метилоктановой кислоте (2,14 г; 13,5 ммоль) в 25 мл СН 2 Сl2 при 0 С добавляли 3 капли ДМФА, затем оксалилхлорид (1,42 мл; 16,2 ммоль), что приводило к интенсивному выделению газа. Раствор нагревали непосредственно до температуры окружающей среды, перемешивали 30 мин и концентрировали. Тем временем к раствору оксазолидинона (2,64 г; 14,9 ммоль) в 40 мл ТГФ при -78 С по каплям добавляли н-бутиллитий (1,6 М раствор в гексанах; 9,3 мл; 14,9 ммоль). Смесь перемешивали в течение 10 мин и в это время по каплям- 26007504 добавляли хлорангидрид кислоты в 10 мл ТГФ. Реакционную смесь перемешивали 30 мин при -78 С,затем нагревали непосредственно до температуры окружающей среды и гасили насыщ. NH4Cl. Смесь распределяли между Et2O и насыщ. NH4Cl (водн.), фазы разделяли, органическую фазу сушили (MgSO4) и концентрировали, получая 3,2 г указанного в заголовке соединения в виде бесцветного масла. ЖХМС:(3S,5R)-5-метил-3-4R,5S)-4-метил-2-оксо-5-фенилоксазолидин-3 карбонил)нонановой кислоты. К раствору диизопропиламина (1,8 мл; 12,6 ммоль) в 30 мл ТГФ при -78 С добавляли н-бутиллитий (1,6 М раствор в гексанах; 7,6 мл; 12,1 ммоль), смесь перемешивали 10 мин и в это время по каплям добавляли (4R,5S)-4-метил-3-R)-4-метилоктаноил)-5-фенилоксазолидин-2-он (3,2 г; 10,1 ммоль) в 10 мл ТГФ. Раствор перемешивали в течение 30 мин, быстро по каплям при -50 С добавляли трет-бутилбромацетат (1,8 мл; 12,1 ммоль) и смеси давали возможность медленно нагреться до 10 С в течение 3 ч. Смесь распределяли между Et2O и насыщ. NH4Cl (водн.), фазы разделяли, органическую фазу сушили (MgSO4) и концентрировали. Остаток очищали флэш-хроматографией (от 16:1 до 8:1 гексаны:EtOAc), получая 2,65 г (61%) указанного в заголовке соединения в виде бесцветного кристаллического твердого вещества, т. пл. = 84-86C.(2,65 г; 6,14 ммоль) в 20 мл ТГФ при 0 С добавляли предварительно охлажденный (0 С) раствор моногидрата LiOH (1,0 г; 23,8 ммоль) и пероксид водорода (30 мас.%, водный раствор, 5,0 мл) в 10 мл Н 2O. Смесь энергично перемешивали в течение 90 мин, затем нагревали до температуры окружающей среды и перемешивали 90 мин. Реакцию гасили при 0 С добавлением 100 мл 10% NaHSO3 (водн.), затем экстрагировали Et2O. Фазы разделяли и органическую фазу промывали насыщенным раствором соли, сушили(MgSO4) и концентрировали. Указанное в заголовке соединение использовали без очистки. трет-Бутиловый эфир (3S,5R)-3-бензилоксикарбониламино-5-метилнонановой кислоты. Данное соединение получали, как описано выше, исходя из 4-трет-бутилового эфира (S)-2-R)-2-метилгексил)янтарной кислоты вместо 4-трет-бутилового эфира (S)-2-R)-2-метилпентил)янтарной кислоты,получая указанное в заголовке соединение в виде масла (выход 71,6%). 1 Н ЯМР (400 МГц; CDCl3)0,81 (т, 3 Н, J=4,40 Гц), 0,85 (д, 3 Н, J=6,55 Гц), 1,06-1,20 (м, 7 Н), 1,36 (с,9 Н), 1,38-1,50 (м, 2 Н), 2,36 (м, 2 Н), 3,99 (м, 1 Н), 5,02 (м+с, 3 Н) и 7,28-7,28 (м, 5 Н). трет-Бутиловый эфир (3S,5R)-3-амино-5-метилнонановой кислоты. Данное соединение получали,как описано выше, начиная с трет-бутилового эфира (3S,SR)-бензилоксикарбониламино-5-метилнонановой кислоты вместо трет-бутилового эфира (3S,5R)-3-бензилоксикарбониламино-5-метилоктановой кислоты. Выход=97%. 1 Н ЯМР (400 МГц; CDCl3)0,82 (перекрывающиеся д и т, 6 Н), 1,02-1,08 (м, 1 Н), 1,09-1,36 (м, 6 Н),1,39 (с, 9 Н), 1,47 (уш.с, 1 Н), 1,80 (с, 2 Н), 2,13 (дд, 1 Н, J=8,54 и 15,61 Гц) и 2,27 (дд, 1 Н, J=4,15 и 15,38 Гц). Гидрохлорид (3S,5R)-3-амино-5-метилнонановой кислоты. Смесь трет-бутилового эфира (3S,5R)-3 амино-5-метилнонановой кислоты (1,50 г; 6,16 ммоль) в 3 н. HCl (100 мл) кипятили с обратным холодильником в течение 3 ч, фильтровали в горячем виде через целит и концентрировали до 30 мл в вакууме. Полученный в результате кристаллы собирали, промывали дополнительным количеством 3 н. HCl и сушили, получая указанное в заголовке соединение, т.пл. 142,5-143,3 С. Дополнительные порции получали из фильтрата, полчая 1,03 г (70,4%). Вычислено для C10H21NO2HCl: С: 53,68, Н: 9,91, N: 6,26, Cl: 15,85. Найдено: С: 53,89, Н: 10,11, N: 6,13. МС: М+188,1. Пример 4. (2R,4R)-2-Аминометил-4-метилгептановая кислота. 5R-Метил-3R-(4S-метил-2-оксо-5R-фенилоксазолидин-3-карбонил)октановая кислота. Раствор третбутилового эфира (3R,5R)-5-метил-3-4S,5R)-4-метил-2-оксо-5-фенилоксазолидин-3-карбонил)октановой кислоты (3,9 г; 9,34 ммоль) в дихлорметане (150 мл) обрабатывали трифторуксусной кислотой (7,21 мл; 93,4 мл) и перемешивали 18 ч при температуре окружающей среды. После удаления растворителей и реагента в вакууме полученный в результате остаток растирали в 100 мл гексанов, получая 3,38 г указанного в заголовке соединения (100%), т.пл. 142-143 С. Бензиловый эфир [4R-мeтил-2R-(4S-метил-2-оксо-5R-фенилоксазолидин-3-карбонил)гептил]карбаминовой кислоты. Раствор 5R-метил-3R-(4S-метил-2-оксо-5R-фенилоксазолидин-3-карбонил)октановой кислоты (1,98 г; 5,48 ммоль) и триэтиламина (0,92 мл; 6,57 ммоль) обрабатывали дифенилфосфорилазидом (1,2 мл; 5,48 ммоль), перемешивали 30 мин при температуре окружающей среды и затем кипятили с обратным холодильником в течение 3 ч. После кратковременного охлаждения реакционную смесь обрабатывали бензиловым спиртом (2,8 мл; 27,4 ммоль) и еще в течение 3 ч кипятили с обратным холодильником. Реакционную смесь охлаждали, разбавляли этиловым эфиром (150 мл), последовательно промывали насыщ. NaHCO3 и насыщенным раствором соли, сушили (MgSO4) и концентрировали в вакууме до получения масла. Хроматография (ЖХСД, элюирование 4:1 гексаны:этилацетат) давала указанное в заголовке соединение (2,0 г; 78,3%) в виде масла. МС М+1=467,1.- 27007504 2R-(Бензилоксикарбониламинометил)-4R-метилгептановая кислота. Раствор бензилового эфира 4Rметил-2R-(4S-метил-2-оксо-5R-фенилоксазолидин-3-карбонил)гептил]карбаминовой кислоты (4,12 г; 8,83 ммоль) в смеси 3:1 ТГФ:вода (100 мл) охлаждали до 0 С и обрабатывали смесью 0,8 н. LiOH (17,5 мл; 14 ммоль) и 30% Н 2O2 (4,94 моль; 44 ммоль). После перемешивания реакционной смеси на холоде в течение 3 ч ее гасили взвесью NaHSO3 (2,37 г) и Na2SO3 (4,53 г) в воде (30 мл) и перемешивали 1 ч. Реакционную смесь разбавляли этиловым эфиром (200 мл), распределяли, органический слой промывали насыщенным раствором соли и сушили (MgSO4). Концентрированный органический экстракт подвергали хроматографии (ЖХСД), элюируя этилацетатом, получая 1,25 г 2R-(бензилоксикарбониламинометил)4R-метилгептановой кислоты (46%). МС М+1=308,1. Гидрохлорид (2R,4R)-2-амино-4-метилгептановой кислоты. Смесь 2R-(бензилоксикарбониламинометил)-4R-метилгептановой кислоты (1,25 г; 4,07 ммоль) и Pd/C (20%; 0,11 г) в метаноле (50 мл) гидрировали при 50 фунт/кв.дюйм (344,7 кПа) в течение 18 ч. После удаления катализатора фильтрованием растворитель выпаривали в вакууме и полученное в результате твердое вещество растирали в эфире, получая гидрохлорид (2S,4R)-2-амино-4-метилгептановой кислоты (0,28 г; 40%), т.пл. 226,3-228,0 С. МС М+1=174,0. Вычислено для C9H19NO20,1 Н 2O С: 61,75, Н: 11,06, N: 8,00. Найдено: С: 61,85, Н: 10,83, N: 8,01. Пример 5. Гидрохлорид 2-аминометил-4,4-диметилгептановой кислоты. Этиловый эфир 2-циано-4,4-диметилгепта-2,6-диеновой кислоты. Раствор 2,2-диметилпент-4-еналя(5,0 г; 44 ммоль), этилового эфира циануксусной кислоты (5,12 мл; 48 ммоль), пиперидина (1,3 мл; 14 ммоль) и уксусной кислоты (4,52 мл; 80 ммоль) в 170 мл толуола кипятили с обратным холодильником в течение 18 ч в колбе, оборудованной ловушкой Дина-Старка. В ловушке собиралось несколько мл воды. Реакционную смесь охлаждали и последовательно промывали 1 н. HCl, NaHCO3 и насыщенным раствором соли. Органические слои сушили над Na2SO4 и концентрировали до получения масла. Указанное масло подвергали хроматографии, элюируя 20% EtOAc в гексане, получая комбинацию двух партий, всего 8,3 г (91%). 1 Н ЯМР (400 МГц; CDCl3) 1,28 (с, 6 Н) , 1,32 (т, 3 Н, J=7 Гц), 2,26 (д, 2 Н, J=7,6 Гц), 4,27 (кв, 2 Н, J=7,2 Гц), 5,08 (д, 1 Н, J=12 Гц), 5,10 (д, 1 Н, J=4 Гц), 5,72 (м, 1 Н). Гидрохлорид 2-аминометил-4,4-диметилгептановой кислоты. Этиловый эфир 2-циано-4,4 диметилгепта-2,6-диеновой кислоты (5,88 г; 28 ммоль) растворяли в смеси 91 мл этанола и 6 мл HCl и обрабатывали 0,4 г PtO2. Реакцию проводили при давлении водорода 100 фунт/кв.дюйм при комнатной температуре в течение 15 ч. Катализатор отфильтровывали и фильтрат концентрировали, получая 3,8 г требуемого продукта этилового эфира 2-аминометил-4,4-диметилгептановой кислоты в виде масла. МС(APCI): 216,2 (М+1)+. Полученное масло кипятили с обратным холодильником в 75 мл 6 н. HCl в течение 18 ч. По мере охлаждения реакционной смеси образовывался осадок. Твердое вещество отфильтровывали, промывали дополнительны количеством раствора HCl и растирали в эфире, получая чистое указанное в заголовке соединение. МС (APCI): 188,1 (М+1)+. 1 Н ЯМР (400 МГц; CD3OD): 0,91 (9 Н, м), 1,30 (5 Н, м), 1,81 (дд, 1 Н, J=7,2 Гц, 14,4 Гц), 2,72 (1 Н, м),3,04 (2 Н, м). Вычислено для C10H21NO2HCl: С: 53,68, Н: 9,91, N: 6,26, С 1: 15,85. Найдено: С: 53,83, Н: 10,15, N: 6,22, С 1: 15,40. Т.пл. 229,5-231,0 С. Пример 6. (S)-3-Амино-5,5-диметилоктановая кислота. 3-(4,4-Диметилгептаноил)-(R)-4-метил-(S)-5-фенилоксазолидин-2-он. Раствор 4,4-диметилгептановой кислоты (1,58 г; 10 ммоль) и триэтиламина (4,6 мл) в 50 мл ТГФ охлаждали до 0 С и обрабатывали 2,2-диметилпропионилхлоридом (1,36 мл). Через один час добавляли 4R-метил-5S-фенилоксазолидин-2 он (1,95 г; 11 ммоль) и хлорид лития (0,47 г; 11 ммоль) и смесь перемешивали в течение 18 ч. Осадок отфильтровывали и тщательно промывали дополнительным количеством ТГФ. Фильтрат концентрировали в вакууме, получая маслянистое твердое вещество. Полученное твердое вещество растворяли в 200 мл Et2O, последовательно промывали насыщенным NaHCO3, 0,5 н. HCl и насыщенным раствором NaCl,сушили (MgSO4) и концентрировали в вакууме, получая указанное в заголовке соединение в виде масла(3,0 г; 95%). 1 Н ЯМР (400 МГц; CDCl3): 0,73-0,84 (м, 12 Н), 1,10-1,22 (м, 4 Н), 1,46-1,54 (м, 2 Н), 2,75-2,87 (м, 2 Н),4,70 (м, 1 Н, J=7 Гц), 5,59 (д, 1 Н, J=7 Гц), 7,22-7,37 (м, 5 Н). трет-Бутиловый эфир 5,5-диметил-(S)-3-R)-4-метил-2-оксо-(S)-5-фенилоксазолидин-3-карбонил) октановой кислоты. Согласно примеру 1 5,07 г (16 ммоль) 3-(4,4-диметилгептаноил)-4-метил-5-фенилоксазолидин-2-она, 18 мл (1 н., 18 ммоль) раствора NaHMDS и 4,72 мл (32 ммоль) трет-бутилового эфира бромуксусной кислоты давали 3,40 г (49,3%) указанного в заголовке соединения в виде кристаллического твердого вещества. Т.пл.: 83-85 С. 4-трет-Бутиловый эфир (S)-2-(2,2-диметилпентил)янтарной кислоты. Согласно примеру 1 3,4 г (7,9 ммоль) трет-бутилового эфира 5,5-диметил-3-(4-метил-2-оксо-5-фенилоксазолидин-3-карбонил) октановой кислоты, 16 мл (12,8 ммоль) 0,8 н. LiOH и 4,5 мл 30% Н 2O2 давали 2,42 г (100%) указанного в заголовке соединения в виде масла.=+20 (МеОН). Т.пл.: 194,2-195,2 С. Пример 7. 2-Аминометил-3-(1-метилциклопропил)пропионовая кислота. Этиловый эфир 2-циано-3-(1-метилциклопропил)акриловой кислоты. К 1-метилциклопропанметанолу (Aldrich; 1,13 мл; 11,6 ммоль) в 50 мл СН 2 Сl2 добавляли нейтральную окись алюминия (2,5 г) и затем РСС (2,5 г; 11,6 ммоль) и смесь перемешивали 3 ч при температуре окружающей среды. Смесь фильтровали через 1-см слой силикагеля в вакууме и промывали Et2O. Фильтрат концентрировали до общего объемы примерно 5 мл. К остатку добавляли ТГФ (10 мл), этилцианоацетат (1,2 мл; 11,3 ммоль),пиперидин (5 капель) и, наконец, уксусную кислоту (5 капель). Все вместе перемешивали при температуре окружающей среды в течение ночи, затем распределяли между Et2O и насыщ. водн. NaHCO3. Фазы разделяли и органическую фазу промывали насыщенным раствором соли, сушили (MgSO4) и концентрировали. Флэш-хроматография остатка (1015% EtOAc/гексаны) давала 0,53 г (25%) сложного эфира в виде бесцветного масла, которое кристаллизовалось при стоянии. Вычислено для C10H13NO2: С: 67,02, Н: 7,31, N: 7,82. Найдено: С: 66,86, Н: 7,47, N: 7,70. Этиловый эфир 2-аминометил-3-(1-метилциклопропил)пропионовой кислоты. К этиловому эфиру 2-циано-3-(1-метилциклопропил)акриловой кислоты (0,45 г; 2,51 ммоль) в 16 мл смеси ЕtОН:ТГФ (1:1) добавляли RaNi (0,4 г) и смесь гидрировали в аппарате Парра при 48 фунт/кв.дюйм в течение 15,5 ч. Затем добавляли катализатор Пирлмана (0,5 г) и гидрирование продолжали еще в течение 15 ч. Смесь фильтровали и концентрировали. Флэш-хроматография остатка 234568% МеОН/СН 2 Сl2 давала 0,25 г (54%) сложного аминоэфира в виде бесцветного масла. ЖХМС: m/z 186,1 (М+1). 2-Аминометил-3-(1-метилциклопропил)пропионовая кислота. К раствору этилового эфира 2 аминометил-3-(1-метилциклопропил)пропионовой кислоты (0,25 г; 1,35 ммоль) в 10 мл метанола при 0 С добавляли 10% водн. NaOH (10 мл). Смесь перемешивали при температуре окружающей среды в течение ночи, затем концентрировали, чтобы удалить метанол. Остаток охлаждали до 0 С и подкисляли до рН 2 конц. HCl. После обеспечения возможности нагреться до температуры окружающей среды смесь наносили на ионообменную смолу DOWEX-50WX8-100 и элюировали Н 2 О до нейтральной по лакмусу. Элюирование продолжали 5% водн. NH4OH (100 мл) и щелочные фракции концентрировали, получая 0,15 г (71%) аминокислоты в виде бесцветного твердого вещества. ЖХМС: m/z 158,0 (М+1). Пример 8. (3S,5R)-3-Амино-5-метилоктановая кислота. трет-Бутиловый эфир (5S)-5-метилокта-2,6-диеновая кислота. К раствору этилового эфира (S)-3 метилгекс-4-еновой кислоты этиловый эфир (S)-3-метилгекс-4-еновой кислоты получали из (S)-транс-3 пентен-2-ола [Liang, J.; Hoard, D.W.; Van Khau, V.; Martinelli, M.J.; Moher, E.D.; Moore, R.E.; Tius, M.A. J.Org. Chem., 1999, 64, 1459] посредством перегруппировки Джонсона-Клайзена с триэтилортоацетатом согласно опубликованному в литературе протоколу [Hill, R.K.; Soman, R.; Sawada, S., J. Org. Chem., 1972,37, 3737] (1,0 г; 6,4 ммоль) в 30 мл толуола при -78 С по каплям в течение 5 мин добавляли DIBAH(1,0 М в ТГФ; 6,4 мл). Смесь перемешивали при -78 С 45 мин и в это время добавляли 5 капель метанола,что приводило к интенсивному выделению Н 2. Метанол добавляли до тех пор, пока наблюдалось выделение газа (примерно 5 мл). В это время холодную баню убирали и добавляли примерно 5 мл насыщ. водн. тартрата Na+K+. Когда смесь достигала комнатной температуры добавляли дополнительное количество насыщ. водн. тартрата Na+K+ и Et2O и перемешивание продолжали до тех пор, пока фазы не станут наиболее четкими (примерно 1 ч). Фазы разделяли и органическую фазу промывали насыщенным раствором соли, сушили (MgSO4) и концентрировали до общего объема примерно 10 мл из-за беспокойства по поводу летучести. Неочищенную смесь объединяли с дополнительной партией альдегида, полученной из 10 ммоль сложного эфира описанным выше способом, и все вместе использовали без очистки. К суспензии гидрида натрия (60% дисперсия в минеральном масле) в 25 мл ТГФ по каплям добавляли трет-бутил-Р,Р-диметилфосфоноацетат (3,0 мл; 15 ммоль) в течение 1 ч так, чтобы контролировать выделение Н 2. После завершения добавления быстро по каплям добавляли неочищенный альдегид в толуоле(общий объем примерно 20 мл) и смесь перемешивали при температуре окружающей среды в течение ночи. Смесь распределяли между Et2O и насыщ. водн. NH4Cl, фазы разделяли, органическую фазу промывали насыщенным раствором соли, сушили (MgSO4) и концентрировали. Флэш-хроматография остатка (035% EtOAc/гексаны) давала 1,0 г (29%, две стадии) ненасыщенного сложного эфира в виде бледно-желтого масла. 1 Н ЯМР (CDCl3)6,75 (м, 1 Н), 5,66 (м, 1 Н), 5,30 (м, 2 Н), 2,03-2,29 (м, 3H), 1,58 (д, J=6,1 Гц, 3H),1,41 (с, 9 Н), 0,91 (д, J=6,6 Гц, 3H). трет-Бутиловый эфир (3R,5S)-3-[бензил-(1-фенилэтил)амино]-5-метилокт-6-еновой кислоты. К раствору (S)-(-)-N-бензилметилбензиламина (0,60 мл; 2,85 ммоль) в 9,0 мл ТГФ при -78 С быстро по каплям добавляли н-бутиллитий (1,6 М в гексанах, 1,6 мл), получая насыщенную розовую окраску. Смесь перемешивали при -78 С в течение 30 мин и в это время медленно по каплям добавляли трет-бутиловый эфир (5S)-5-метилокта-2,6-диеновой кислоты (0,5 г; 2,38 ммоль) в 1,0 мл ТГФ, получая в результате бледную желтовато-коричневую окраску, которая темнела в течение 3 ч. Смесь перемешивали 3 ч при-78 С, затем гасили насыщ. водн. NH4Cl. Смеси давали возможность нагреться до КТ и перемешивали в течение ночи, затем распределяли между EtOAc и насыщ. водн. NH4Cl. Фазы концентрировали и органическую фазу сушили (MgSO4) и разделяли. Флэш-хроматография остатка (35% EtOAc/гексаны) давала 0,52 г (52%) сложного аминоэфира в виде желтого масла. 1 Н ЯМР (CDCl3)7,34 (м, 2 Н), 7,20 (м, 8 Н), 5,27 (м, 2 Н), 3,74 (м, 1 Н), 3,72 (д, J=15,9 Гц, 1H), 3,41(3S,5R)-3-Амино-5-метилоктановая кислота. К раствору трет-бутилового эфира (3R,5S)-3-[бензил(1-фенилэтил)амино]-5-метилокт-6-еновой кислоты (0,92 г; 2,18 ммоль) в 50 мл МеОН добавляли 20%Pd/C (0,20 г) и смесь гидрировали в аппарате Парра при 48 фунт/кв.дюйм в течение 23 ч. Смесь фильтровали и концентрировали. К неочищенному сложному аминоэфиру в 10 мл СН 2 Сl2 добавляли 1,0 мл трифторуксусной кислоты и раствор перемешивали при температуре окружающей среды в течение ночи. Смесь концентрировали и остаток растворяли в минимальном количестве Н 2 О и наносили на ионообменную смолу DOWEX-50WX8-100. Колонку элюировали Н 2 О вплоть до нейтральной по лакмусу, затем продолжали 5% водн. NH4OH (100 мл). Щелочные фракции концентрировали, получая 0,25 г (66%, две стадии) аминокислоту в виде не совсем белого твердого вещества. 1 Н ЯМР (CD3OD)3,41 (м, 1 Н), 2,36 (дд, J=5,1, 16,6 Гц, 1 Н), 2,25 (дд, J=8,1, 16,6 Гц, 1 Н), 1,42 (м,2 Н), 1,24 (м, 1 Н), 1,12 (м, 2 Н), 1,00 (м, 1 Н), 0,73 (д, J=6,4 Гц, 3H), 0,68 (т, J=6,8 Гц, 3H). ЖХМС: m/z 172,1 (М-1). Пример 9. 2-Аминометил-8-метилнонановая кислота. Использовали методику, аналогичную получению 2-аминометил-4,4,8-триметилнонановой кислоты, чтобы получить 2-аминометил-8-метилнонановую кислоту из 6-метил-1-гептанола, m/z 202,1 (М+). 2-Аминометил-4,8-диметилнонановая кислота.(R)-2,6-диметилгептан-1-ол. Магниевые стружки (2,04 г; 84 ммоль) и кристалл йода суспендировали в 5 мл ТГФ для добавления 1-бром-3-метилбутана (0,3 мл, точно). Смесь нагревали, чтобы начать образование реактива Гриньяра. Остающийся 1-бром-3-метилбутан (8,63 мл; 72 ммоль) разбавляли в ТГФ(60 мл) и добавляли по каплям. Смесь перемешивали при температуре окружающей среды в течение 2 ч и охлаждали до -5 С. По каплям добавляли раствор хлорида меди (1,21 г; 9 ммоль) и LiCl (0,76 г; 18 ммоль) в ТГФ (50 мл), поддерживая температуру ниже 0 С. Полученную в результате смесь перемешивали в течение 20 мин и по каплям добавляли (R)-3-бром-2-метилпропанол в ТГФ (20 мл), поддерживая температуру ниже 0 С. Смеси давали возможность медленно достичь температуры окружающей среды в течение ночи. Реакционную смесь гасили гидроксидом аммония и водой. Смесь разбавляли EtOAc и экстрагировали 320 мл EtOAc. Органическую часть промывали насыщенным раствором соли, сушили(MgSO4), фильтровали и концентрировали. Остаточное масло очищали хроматографией на силикагеле(R)-1-йод-2,6-диметилгептан. К смеси трифенилфосфина на подложке (6,55 г; 19,67 ммоль) в СН 2 Сl2 при 0 С добавляли йод (4,99 г; 19,67 ммоль) и имидазол (1,33 г; 19,67 ммоль). Смесь нагревали до температуры окружающей среды, перемешивали в течение 1 ч и охлаждали до 0 С для добавления по каплям (R)-2,6-диметилгептан-1-ола в CH2Cl2 (5 мл). Смеси давали возможность достичь температуры окружающей среды и перемешивали в течение 1 ч, в это время смесь фильтровали через слой целлита и твердые вещества промывали СН 2 Сl2. Фильтрат концентрировали и грубый продукт очищали хроматографией на силикагеле, получая (R)-1-йод-2,6-диметилгептан (2,44 г). Трет-бутиловый эфир (4R)-4,8-диметилнонановой кислоты. К диизопропиламину (0,827 мл, 5,9 ммоль) в ТГФ (8 мл) при -78 С добавляли nBuLi (2,65 мл 2,6 М раствора в пентане). Раствор перемешивали в течение 30 мин при -78 С, затем добавляли трет-бутилацетат (0,8 мл; 5,9 ммоль). Смесь перемешивали при -78 С в течение 2 ч и затем добавляли (R)-1-йод-2,6-диметилгептан (0,3 г; 1,18 ммоль) и НМРА (1,5 мл) в ТГФ (1 мл). Реакционную смесь перемешивали при -78 С и давали возможность медленно достичь температуры окружающей среды в течение ночи, затем нагревали при 35 С, чтобы дове- 30
МПК / Метки
МПК: A61P 25/00, A61K 31/197, A61P 25/02, A61K 31/522, A61K 31/4985, A61K 31/53, A61K 31/195
Метки: лиганда, альфа-2-дельта, применения, боли, лечении, синергическая, комбинация, ингибитора
Код ссылки
<a href="https://eas.patents.su/30-7504-sinergicheskaya-kombinaciya-liganda-alfa-2-delta-i-ingibitora-pde5-dlya-primeneniya-pri-lechenii-boli.html" rel="bookmark" title="База патентов Евразийского Союза">Синергическая комбинация лиганда альфа-2-дельта и ингибитора pde5 для применения при лечении боли</a>
Предыдущий патент: N, n-дизамещенные диазоциклоалканы, используемые для лечения заболеваний центральной нервной системы (цнс), вызываемых серотонинергической дисфункцией
Следующий патент: Способ получения залеплона
Случайный патент: Удилище