Новые ингибиторы гистондеацетилазы
Номер патента: 7272
Опубликовано: 25.08.2006
Авторы: Тен Холтэ Петер, Анжибо Патрик Рене, Мерпул Ливен, Вердонк Марк Густаф Селин, Пилатт Изабелль Ноэлль Констанс, Ван Брандт Свен Францискус Анна, Дяткин Алексей Борисович, Ру Брюно
Формула / Реферат
1. Соединение формулы (I)
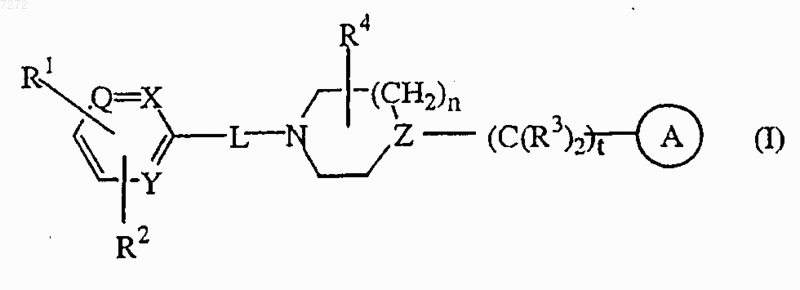
где n равен 0, 1, 2 или 3 и, когда n равен 0, тогда имеется в виду непосредственная связь;
t равен 0, 1, 2, 3 или 4 и, когда t равен 0, тогда имеется в виду непосредственная связь;
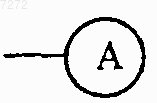
каждый Q представляет собой азот или 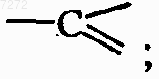
каждый X представляет собой азот или 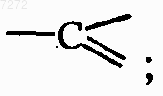
каждый Y представляет собой азот или 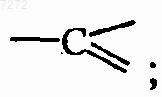
каждый Z представляет собой азот или 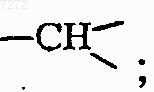
R1 представляет собой -C(O)NH(OH);
R2 представляет собой водород, галоген, гидрокси, амино, нитро, C1-6-алкил, C1-6-алкилокси, трифторметил, ди(C1-6-алкил)амино, гидроксиамино или нафталинсульфонилпиразинил;
-L- представляет собой непосредственную связь или двухвалентный радикал, выбранный из числа C1-6-алкандиила, C1-6-алкандиилокси, амино, карбонила или аминокарбонила;
каждый R3 представляет независимо атом водорода, и один атом водорода может быть заменен заместителем, выбранным из арила;
R4 представляет собой водород, гидрокси, амино, гидрокси-C1-6-алкил, C1-6-алкил, C1-6-алкилокси, арил-C1-6-алкил, аминокарбонил, гидроксикарбонил, амино-С1-6алкил, аминокарбонил-C1-6-алкил, гидроксикарбонил-C1-6-алкил, гидроксиаминокарбонил, C1-6-алкилоксикарбонил, C1-6-алкиламино-C1-6-алкил или ди(C1-6-алкил)амино-C1-6-алкил;
 представляет собой радикал, выбранный из числа
представляет собой радикал, выбранный из числа
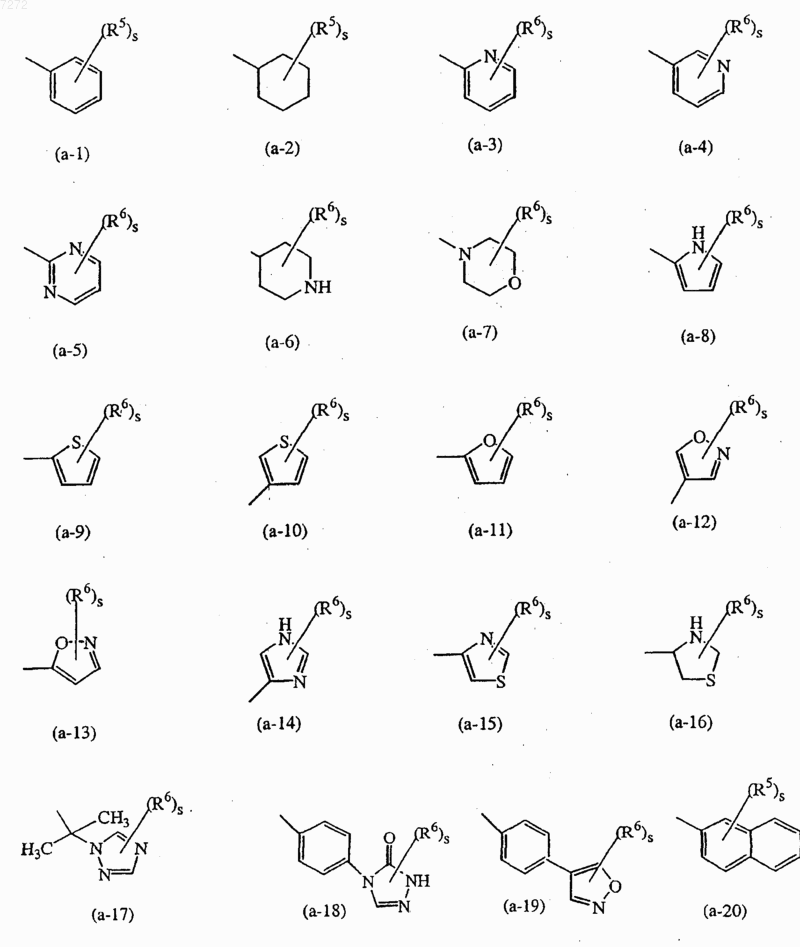
где каждый s равен независимо 0, 1, 2, 3, 4 или 5;
каждый R5 и R6 выбирают независимо из группы, в которую входят водород; галоген; гидрокси; амино; нитро; тригалоген-C1-6-алкил; тригалоген-C1-6-алкилокси; C1-6-алкил; C1-6-алкил, замещенный арилом и С3-10-циклоалкилом; C1-6-алкилокси; C1-6-алкилокси-C1-6-алкилокси; C1-6-алкилкарбонил; C1-6-алкилоксикарбонил; C1-6-алкилсульфонил; циано-C1-6-алкил; гидрокси-C1-6-алкил; гидрокси-C1-6-алкилокси; гидрокси-C1-6-алкиламино; амино-C1-6-алкилокси; ди(C1-6-алкил)аминокарбонил; ди(гидрокси-C1-6-алкил)амино; (арил)(C1-6-алкил)амино; ди(C1-6-алкил)амино-C1-6-алкилокси; ди(C1-6-алкил)амино-C1-6-алкиламино; ди(C1-6-алкил)амино-C1-6-алкиламино-C1-6-алкил; арилсульфонил; арилсульфониламино; арилокси; арилокси-C1-6-алкил; арил-С2-6-алкендиил; ди(C1-6-алкил)амино; ди(C1-6-алкил)амино-C1-6-алкил; ди(C1-6-алкил)амино(C1-6-алкил)амино; ди(C1-6-алкил)амино(C1-6-алкил)амино-C1-6-алкил; ди(C1-6-алкил)амино-C1-6-алкил(C1-6-алкил)амино; ди(C1-6-алкил)амино-C1-6-алкил(C1-6-алкил)амино-C1-6-алкил; аминосульфониламино(C1-6-алкил)амино; аминосульфониламино(C1-6-алкил)амино-C1-6-алкил; ди(C1-6-алкил)аминосульфониламино(C1-6-алкил)амино; ди(C1-6-алкил)аминосульфониламино(C1-6-алкил)амино-C1-6-алкил; циано; тиофенил; тиофенил, замещенный ди(C1-6-алкил)амино-C1-6-алкил(C1-6-алкил)амино-C1-6-алкилом, ди(C1-6-алкил)амино-C1-6-алкилом, C1-6-алкилпиперазинил-C1-6-алкилом, гидрокси-C1-6-алкилпиперазинил-C1-6-алкилом, гидрокси-C1-6-алкилокси-C1-6- алкилпиперазинил-C1-6-алкилом, ди(C1-6-алкил)аминосульфонилпиперазинил-C1-6-алкилом, C1-6-алкилоксипиперидинилом, C1-6-алкилоксипиперидинил-C1-6-алкилом, морфолинил-C1-6-алкилом, гидрокси-C1-6-алкил(C1-6-алкил)амино-C1-6-алкилом или ди(гидрокси-C1-6-алкил)амино-C1-6-алкилом; фуранил; фуранил, замещенный гидрокси-C1-6-алкилом; бензофуранил; имидазолил; оксазолил; оксазолил, замещенный арилом и C1-6-алкилом; C1-6-алкилтриазолил; тетразолил; пирролидинил; пирролил; пиперидинил-C1-6-алкилокси; морфолинил; C1-6-алкилморфолинил; морфолинил-C1-6-алкилокси; морфолинил-C1-6-алкил; морфолинил-C1-6-алкиламино; морфолинил-C1-6-алкиламино-C1-6-алкил; пиперазинил; C1-6-алкилпиперазинил; C1-6-алкилпиперазинил-C1-6-алкилокси; пиперазинил-C1-6-алкил; нафталинсульфонилпиперазинил; нафталинсульфонилпиперидинил; нафталинсульфонил; C1-6-алкилпиперазинил-C1-6-алкил; C1-6 алкилпиперазинил-C1-6-алкиламино; C1-6-алкилпиперазинил-C1-6-алкиламино-C1-6-алкил; C1-6-алкилпиперазинилсульфонил; аминосульфонилпиперазинил-C1-6-алкилокси; аминосульфонилпиперазинил; аминосульфонилпиперазинил-C1-6-алкил; ди (C1-6-алкил)аминосульфонилпиперазинил; ди(C1-6-алкил)аминосульфонилпиперазинил-C1-6-алкил; гидрокси-C1-6-алкилпиперазинил; гидрокси-C1-6-алкилпиперазинил-C1-6-алкил; C1-6-алкилоксипиперидинил; C1-6-алкилоксипиперидинил-C1-6-алкил; пиперидиниламино-C1-6-алкиламино; пиперидиниламино-C1-6-алкиламино-С1-6-алкил; (C1-6-алкилпиперидинил)(гидрокси-C1-6-алкил)амино-C1-6-алкиламино; (C1-6-алкилпиперидинил)(гидрокси-C1-6-алкил)амино-C1-6-алкиламино-C1-6-алкил; гидрокси-C1-6-алкилоксиС1-6-алкилпиперазинил; гидрокси-C1-6-алкилокси-C1-6-алкилпиперазинил-C1-6-алкил; (гидрокси-С1-6-алкил) (C1-6-алкил)амино; (гидрокси-C1-6-алкил)(C1-6-алкил)амино-C1-6-алкил; гидрокси-C1-6-алкиламино-C1-6-алкил; ди(гидрокси-C1-6-алкил)амино-С1-6-алкил; пирролидинил-С1-6-алкил; пирролидинил-C1-6-алкилокси; пиразолил; тиопиразолил; пиразолил, замещенный двумя заместителями, выбранными из числа C1-6-алкила или тригалоген-С1-6-алкила; пиридинил; пиридинил, замещенный C1-6-алкилокси, арилокси или арилом; пиримидинил; тетрагидропиримидинилпиперазинил; тетрагидропиримидинилпиперазинил-С1-6-алкил; хинолинил; индол; фенил; фенил, замещенный одним, двумя или тремя заместителями, выбранными независимо из числа галогена, амино, нитро, C1-6-алкила, C1-6-алкилокси, гидрокси-С1-4-алкила, трифторметила, трифторметилокси, гидрокси-С1-4-алкилокси, С1-4-алкилсульфонила, С1-4-алкилокси-С1-4-алкилокси, С1-4-алкилоксикарбонила, амино-С1-4-алкилокси, ди(С1-4-алкил)амино-С1-4-алкилокси, ди(С1-4-алкил)амино, ди(С1-4-алкил)аминокарбонила, ди(С1-4-алкил)амино-С1-4-алкила, ди(С1-4-алкил)амино-С1-4-алкиламино-С1-4-алкила, ди(С1-4-алкил)амино(С1-4-алкил)амиэю, ди(С1-4-алкил)амино (С1-4-алкил)амино-С1-4-алкила, ди(С1-4-алкил)амино-С1-4-алкил(С1-4-алкил)амино, ди(C1-4-алкил)аминоС1-4-алкил(С1-4-алкил)амино-С1-4-алкила, аминосульфониламино(С1-4-алкил)амино, аминосульфониламино(С1-4-алкил)амино-С1-4-алкила, ди(С1-4-алкил)аминосульфониламино(С1-4-алкил)амино, ди(С1-4-алкил)аминосульфониламино(С1-4-алкил)амино-C1-6-алкила, циано, пиперидинил-С1-4-алкилокси, пирролидинил-С1-4-алкилокси, аминосульфонилпиперазинила, аминосульфонилпиперазинил-С1-4-алкила, ди (С1-4-алкил)аминосульфонилпиперазинила, ди(С1-4-алкил)аминосульфонилпиперазинил-С1-4-алкила, гидрокси-С1-4-алкилпиперазинила, гидрокси-С1-4-алкилпиперазинил-С1-4-алкила, С1-4-алкилоксипиперидинила, С1-4-алкилоксипиперидинил-С1-4-алкила, гидрокси-С1-4-алкилокси-С1-4-алкилпиперазинила, гидрокси-С1-4-алкилокси-С1-4-алкилпиперазинил-С1-4-алкила, (гидрокси-С1-4-алкил)(С1-4-алкил)амино, (гидрокси-С1-4-алкил)(С1-4-алкил)амино-С1-4-алкила, ди(гидрокси-С1-4-алкил)амино, ди(гидрокси-С1-4-алкил)амино-С1-4-алкила, фуранила, фуранила, замещенного -CH=CH-CH=CH-, пирролидинил-С1-4-алкила, пирролидинил-С1-4-алкилокси, морфолинила, морфолинил-С1-4-алкилокси, морфолинил-С1-4-алкила, морфолинил-С1-4-алкил амино, морфолинил-С1-4-алкиламино-С1-4-алкила, пиперазинила, С1-4-алкилпиперазинила, С1-4-алкилпиперазинил-С1-4-алкилокси, пиперазинил-С1-4-алкила, С1-4-алкилпиперазинил-С1-4-алкила, С1-4-алкилпиперазинил-С1-4-алкиламино, С1-4-алкилпиперазинил-С1-4-алкиламино-C1-6-алкила, тетрагидропиримидинилпиперазинила, тетрагидропиримидинилпиперазинил-С1-4-алкила, пиперидиниламино-C1-4-алкиламино, пиперидиниламино-С1-4-алкиламино-С1-4-алкила, (С1-4-алкилпиперидинил)(гидрокси-С1-4-алкил)амино-С1-4-алкиламино, (С1-4-алкилпиперидинил)(гидрокси-С1-4-алкил)амино-С1-4-алкиламино-С1-4-алкила, пиридинил-С1-4-алкилокси, гидрокси-С1-4-алкиламино, гидрокси-С1-4-алкиламино-С1-4-алкила, ди(С1-4-алкил)амино-С1-4-алкиламино, аминотиадиазолила, аминосульфонилпиперазинил-С1-4-алкилокси или тиофенил-С1-4-алкиламино;
каждый R5 и R6 может находиться у атома азота, замещая водород;
арил, указанный выше, представляет собой фенил или фенил, замещенный одним или несколькими заместителями, выбранными, каждый независимо, из числа галогена, C1-6-алкила, C1-6-алкилокси, трифторметила, циано или гидроксикарбонила;
его N-оксидные формы, фармацевтически приемлемые соли присоединения и стереохимически изомерные формы.
2. Соединение по п.1, где n равен 1 или 2;
t равен 0, 1, 2 или 4;
каждый Q представляет собой 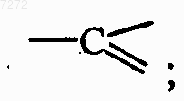
R1 представляет собой -C(O)NH(OH);
R2 представляет собой водород или нитро;
-L- представляет собой непосредственную связь или двухвалентный радикал, выбранный из C1-6-алкандиила;
R4 представляет собой водород;
 представляет собой радикал, выбранный из числа (а-1), (а-2), (а-3), (а-5), (а-6), (а-11), (а-18), (а-20), (а-21), (а-32), (а-33), (а-47) или (а-51);
представляет собой радикал, выбранный из числа (а-1), (а-2), (а-3), (а-5), (а-6), (а-11), (а-18), (а-20), (а-21), (а-32), (а-33), (а-47) или (а-51);
каждый s равен независимо 0, 1, 2 или 4;
каждый R5 и R6 выбирают независимо из числа водорода; галогена; тригалоген-C1-6-алкила; C1-6-алкила; C1-6-алкила, замещенного арилом и С3-10-циклоалкилом; C1-6-алкилокси; C1-6-алкилкарбонила; бензофуранила; нафталинсульфонила; пиридинила, замещенного арилокси; фенила или фенила, замещенного одним заместителем, выбранным независимо из числа гидрокси-С1-4-алкила или морфолинил-С1-4-алкила.
3. Соединение по п.1,
где t равен 1, 2, 3 или 4;
R1 представляет собой -C(O)NH(OH)-;
R2 представляет собой водород, галоген, гидрокси, амино, нитро, C1-6-алкил, C1-6-алкилокси, трифторметил или ди(C1-6-алкил)амино;
-L- представляет собой непосредственную связь или двухвалентный радикал, выбранный из числа C1-6-алкандиила, C1-6-алкандиилокси, амино или карбонила;
R4 представляет собой водород, гидрокси, амино, гидрокси-C1-6-алкил, C1-6-алкил, C1-6-алкилокси, арил-C1-6-алкил, аминокарбонил, амино-C1-6-алкил, C1-6-алкиламино-C1-6-алкил или ди(C1-6-алкил)амино-C1-6-алкил;
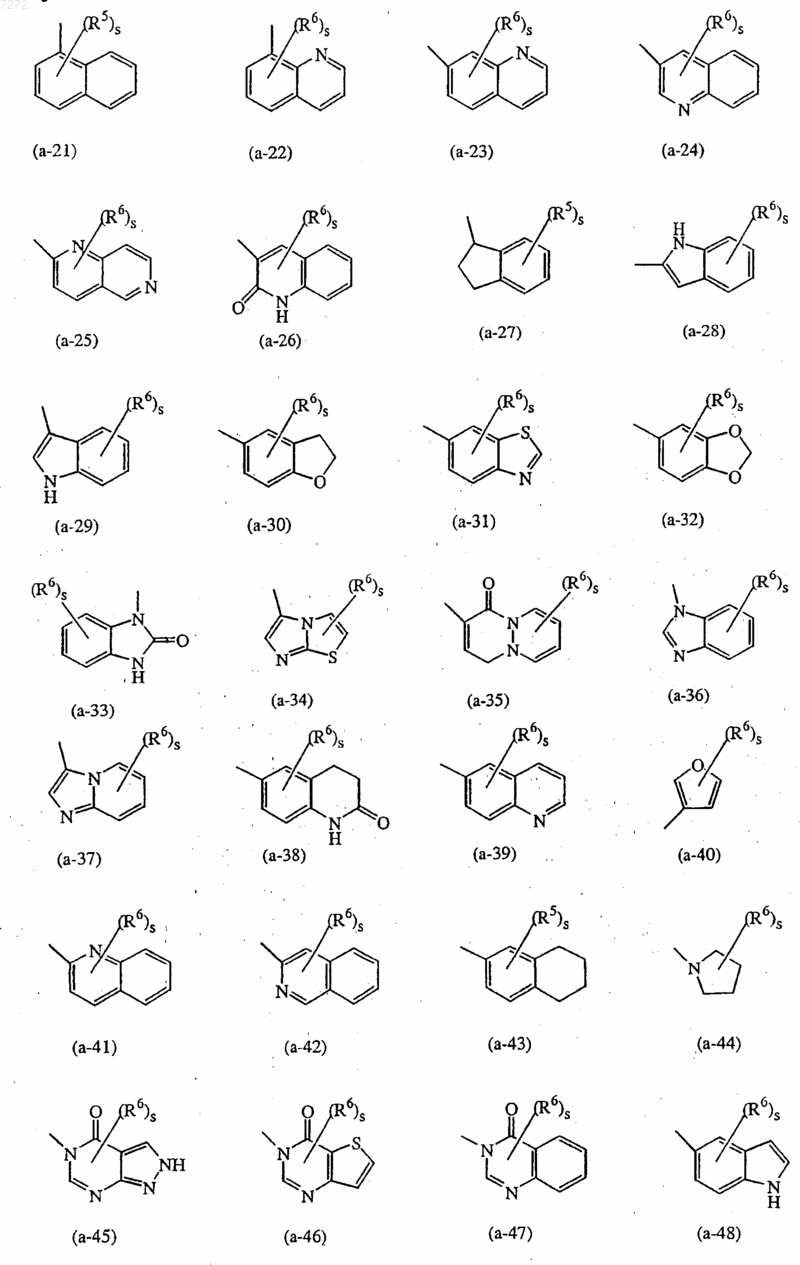
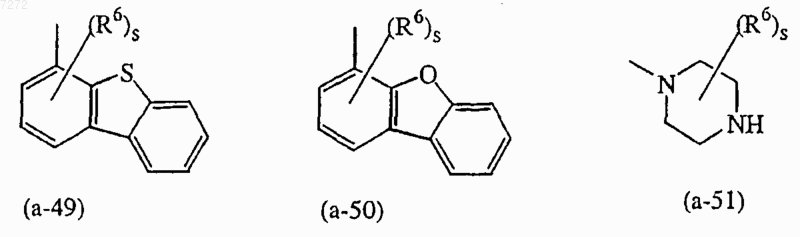
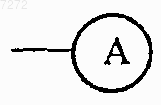 представляет собой радикал, выбранный из числа (а-1), (а-3), (а-4), (а-5), (а-6), (а-7), (а-8), (а-9), (а-10), (а-11), (а-12), (а-13), (а-14), (а-15), (а-16), (а-17), (а-18), (а-19), (а-20), (а-21), (а-22), (а-23), (а-24), (а-25), (а-26), (а-28), (а-29), (а-30), (а-31), (а-32), (а-33), (а-34), (а-35), (а-36), (а-37), (а-38), (а-39), (а-40), (а-41), (а-42), (а-44), (а-45), (а-46), (а-47), (а-48) и (а-51);
представляет собой радикал, выбранный из числа (а-1), (а-3), (а-4), (а-5), (а-6), (а-7), (а-8), (а-9), (а-10), (а-11), (а-12), (а-13), (а-14), (а-15), (а-16), (а-17), (а-18), (а-19), (а-20), (а-21), (а-22), (а-23), (а-24), (а-25), (а-26), (а-28), (а-29), (а-30), (а-31), (а-32), (а-33), (а-34), (а-35), (а-36), (а-37), (а-38), (а-39), (а-40), (а-41), (а-42), (а-44), (а-45), (а-46), (а-47), (а-48) и (а-51);
каждый s равен независимо 0, 1, 2, 3 или 4;
R5 представляет собой водород; галоген; гидрокси; амино; нитро; тригалоген-C1-6-алкил; тригалоген-C1-6-алкилокси; C1-6-алкил; C1-6-алкилокси; C1-6-алкилкарбонил; C1-6-алкилоксикарбонил; C1-6-алкилсульфонил; гидрокси-C1-6-алкил; арилокси; ди(C1-6-алкил)амино; циано; тиофенил; фуранил; фуранил, замещенный гидрокси-C1-6-алкилом; бензофуранил; имидазолил; оксазолил; оксазолил, замещенный арилом и C1-6-алкилом; C1-6-алкилтриазолил; тетразолил; пирролидинил; пирролил; морфолинил; C1-6-алкилморфолинил; пиперазинил; C1-6-алкилпиперазинил; гидрокси-C1-6-алкилпиперазинил; C1-6-алкилоксипиперидинил; пиразолил; пиразолил, замещенный одним или двумя заместителями, выбранными из числа C1-6-алкила или тригалоген-C1-6-алкила; пиридинил; пиридинил, замещенный C1-6-алкилокси, арилокси или арилом; пиримидинил; хинолинил; индол; фенил или фенил, замещенный одним или двумя заместителями, выбранными, независимо, из числа галогена, C1-6-алкила, C1-6-алкилокси или трифторметила;
R6 представляет собой водород; галоген; гидрокси; амино; нитро; тригалоген-C1-6-алкил; тригалоген-C1-6-алкилокси; C1-6-алкил; C1-6-алкилокси; C1-6-алкилкарбонил; C1-6-алкилоксикарбонил; C1-6-алкилсульфонил; гидрокси-C1-6-алкил; арилокси; ди(C1-6-алкил)амино; циано; пиридинил; фенил или фенил, замещенный одним или двумя заместителями, выбранными независимо из числа галогена, C1-6-алкила, C1-6-алкилокси или трифторметила.
4. Соединение по пп.1 и 2,
где n равен 1;
t равен 0 или 1;
каждый Q представляет собой 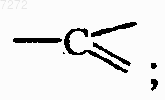
каждый X представляет собой азот;
каждый Yпредставляет собой азот;
R1 представляет собой -C(O)NH(OH);
R2 представляет собой водород;
-L- представляет собой непосредственную связь;
каждый R3 представляет независимо атом водорода;
R4 представляхт собой водород;
 представляет собой радикал, выбранный из числа (а-6), (а-11), (а-20), (а-47) или (а-51);
представляет собой радикал, выбранный из числа (а-6), (а-11), (а-20), (а-47) или (а-51);
каждый s равен независимо 0, 1 или 4; и
каждый R5 и R6 выбирают независимо из числа водорода; C1-6-алкила; C1-6-алкилокси; нафталинсульфонила или фенила, замещенного гидрокси-С1-4-алкилом или морфолинил-С1-4-алкилом.
5. Соединение по пп.1, 2 и 4, выбранное из числа соединений ь 3, ь 4, ь 8, ь 5, ь 7, ь 6 и ь 9.

6. Фармацевтическая композиция, содержащая фармацевтически приемлемые носители и в качестве активного ингредиента терапевтически эффективное количество соединения по пп.1-5.
7. Способ получения фармацевтической композиции по п.6, где тщательно смешивают фармацевтически приемлемые носители и соединение по пп.1-5.
8. Соединение по любому из пп.1-5 для применения в качестве лекарственного средства.
9. Применение соединения по любому из пп.1-5 для получения лекарственного средства для лечения пролиферативных заболеваний.
10. Способ получения соединения по п.1, отличающийся тем, что промежуточное соединение формулы (II) вводят во взаимодействие с соответствующей кислотой, такой как, например, трифторуксусная кислота, и получают гидроксамовую кислоту формулы (I-а), где R1 представляет собой -C(O)NH(OH)
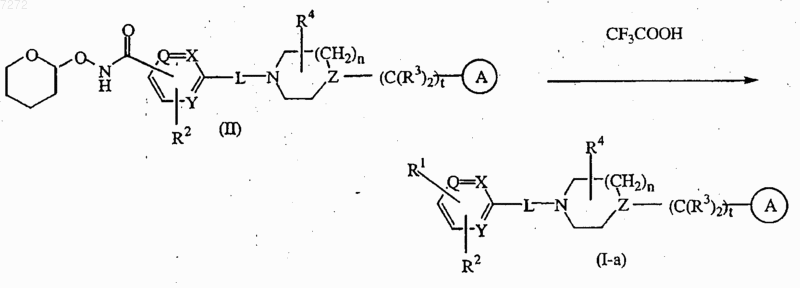
11. Способ детекции или идентификации HDAC в биологическом образце, включающий детекцию или определение образования комплекса между меченым соединением по п.1 и HDAC.
12. Сочетание противораковых средств и ингибитора HDAC по любому из пп.1-5.
Текст
007272 Данное изобретение относится к соединениям, обладающим ферментативной активностью ингибирования гистондеацетилазы (HDAC). Оно также относится к способам их получения, к композициям,содержащим их, а также к их применению как in vitro, так и in vivo, для ингибирования HDAC и в качестве лечебного средства, например в качестве лекарственного средства для подавления пролиферативных состояний, таких как рак и псориаз. Во всех эукариотических клетках геномная ДНК в хроматине ассоциирует с гистонами с образованием нуклеосом. Каждая нуклеосома состоит из октамера белка, состоящего из двух копий каждого из гистонов Н 2 А, Н 2 В, Н 3 и Н 4. ДНК обвивает такую белковую сердцевину с помощью основных аминокислот гистонов, взаимодействующих с отрицательно заряженными фосфатными группами ДНК. Самой обычной посттрансляционной модификацией таких коровых гистонов является обратимое ацетилирование -аминогрупп консервативных высокоосновных N-концевых лизиновых остатков. Устойчивое состояние ацетилирования гистонов устанавливается за счет динамического равновесия между конкурирующими гистонацетилтрансферазой(ами) и гистондеацетилазой(ами), называемыми в данном описании"HDAC". Ацетилирование и деацетилирование гистонов долгое время связывали с транскрипционным контролем. Современное клонирование генов, кодирующих различные гистонацетилтрансферазы и гистондеацетилазы, дало возможное объяснение соотношения между ацетилированием гистонов и транскрипционным контролем. Обратимое ацетилирование гистонов может привести к реконструкции хроматина и, как таковое, действует как контрольный механизм транскрипции генов. Вообще, гиперацетилирование гистонов облегчает экспрессию генов, в то время как деацетилирование гистонов коррелирует с транскрипционной репрессией. Показано, что гистонацетилтрансферазы действуют как коактиваторы транскрипции, в то время как гистондеацетилазы, как было обнаружено, принадлежат к каскаду реакций транскрипционной репрессии. Динамическое равновесие между ацетилированием и деацетилированием гистонов существенно для нормального роста клеток. Ингибирование гистондеацетилазы приводит к задержке клеточного цикла,клеточной дифференцировке, апоптозу и реверсированию трансформированного фенотипа. Поэтому ингибиторы HDAC могут иметь большой терапевтический потенциал при лечении клеточнопролиферативных заболеваний или состояний (Marks et al., Nature Reviews: Cancer, 1:194-202, 2001). Исследование ингибиторов гистондеацетилаз (HDAC) показывает, что действительно эти ферменты играют важную роль в пролиферации и дифференцировке клеток. Ингибитор трихостатин А (TSA) вызывает задержку клеточного цикла в обеих фазах G1 и G2, возвращает в исходное состояние трансформированный фенотип различных клеточных линий и индуцирует дифференцировку клеток лейкоза Френда и других. Сообщалось, что TSA (и субероиланилидгидроксамовая кислота - SAHA) ингибирует рост клеток, индуцирует терминальную дифференцировку и предотвращает образование опухолей у мышей (Finnin et al., Nature, 401:188-193, 1999). Также сообщалось, что трихостатин А пригоден при лечении фиброза, например фиброза печени, и цирроза печени (Geerts et al., заявка на европейский патент EP 0827742, опубликована 11 марта 1998 г.). В международной заявке WO 01/38322, опубликованной 31 мая 2001 г., описываются, среди прочих, ингибиторы гистондеацетилазы общей формулы Cy-L1-Ar-Y1-C(O)-NH-Z, а также композиции и способы лечения клеточно-пролиферативных заболеваний и состояний. В международной заявке WO 01/70675, опубликованной 27 сентября 2001 г., описываются ингибиторы гистондеацетилазы формулы Cy2-Cy1-X-Y1-W, а также композиции и способы лечения клеточнопролиферативных заболеваний и состояний. Проблема, которую следует решить, состоит в получении ингибиторов гистондеацетилазы с высокой ферментативной активностью, показывающих также такие выгодные свойства, как клеточная активность и повышенная биологическая доступность, предпочтительно оральная биологическая доступность,и имеющих слабые побочные действия или не имеющих их. Новые соединения настоящего изобретения решают описанные выше проблемы. Соединения отличаются от соединений известного уровня техники по строению. Соединения настоящего изобретения показывают in vitro превосходную ферментативную активность ингибирования гистондеацетилазы. Соединения настоящего изобретения обладают выгодными свойствами в отношении клеточной активности и специфическими свойствами в отношении ингибирования развития клеточного цикла в обеих контрольных точках G1 и G2 (способность индуцировать р 21). Соединения настоящего изобретения показывают хорошую метаболическую устойчивость и высокую биологическую доступность, и конкретнее, они показывают оральную биологическую доступность. Данное изобретение относится к соединениям формулы (I)t равен 0, 1, 2, 3 или 4, и когда t равен 0, тогда имеется в виду непосредственная связь; каждый Q представляет собой азот или каждый X представляет собой азот или каждый Y представляет собой азот или каждый Z представляет собой азот илиR9 выбирают независимо из числа водорода, C1-6-алкила, C1-6-алкилкарбонила, арил-C1-6-алкила,C1-6-алкилпиразинила, пиридинона, пирролидинона или метилимидазолила;R10 выбирают независимо из числа водорода или C1-6-алкила;-L- представляет собой непосредственную связь или двухвалентный радикал, выбранный из числаC1-6-алкандиила, C1-6-алкилокси, амино, карбонила или аминокарбонила; каждый R3 представляет независимо атом водорода, и один атом водорода может быть заменен заместителем, выбранным из арила; где каждый s равен независимо 0, 1, 2, 3, 4 или 5; каждый R5 и R6 выбирают независимо из группы, в которую входят водород; галоген; гидрокси; амино; нитро; тригалоген-C1-6-алкил; тригалоген-C1-6-алкилокси; C1-6-алкил; C1-6-алкил, замещенный арилом и С 3-10-циклоалкилом; C1-6-алкилокси; C1-6-алкилокси-C1-6-алкилокси; C1-6-алкилкарбонил; C1-6 алкилоксикарбонил; C1-6-алкилсульфонил; циано-C1-6-алкил; гидрокси-C1-6-алкил; гидрокси-C1-6-алкилокси; гидрокси-C1-6-алкиламино; амино-C1-6-алкилокси; ди(C1-6-алкил)аминокарбонил; ди(гидрокси-C1-6 алкил)амино; (арил)(C1-6-алкил)амино; ди(C1-6-алкил)амино-C1-6-алкилокси; ди(C1-6-алкил)амино-C1-6 алкиламино; ди(C1-6-алкил)амино-C1-6-алкиламино-C1-6-алкил; арилсульфонил; арилсульфониламино; арилокси; арилокси-C1-6-алкил; арил-С 2-6-алкендиил; ди(C1-6-алкил)амино; ди(C1-6-алкил)амино-C1-6 алкил; ди(C1-6-алкил)амино(C1-6-алкил)амино; ди(C1-6-алкил)амино(C1-6-алкил)амино-C1-6-алкил; ди(C1-6 алкил)амино-C1-6-алкил(C1-6-алкил)амино; ди(C1-6-алкил)амино-C1-6-алкил(C1-6-алкил)амино-C1-6-алкил; аминосульфониламино(C1-6-алкил)амино; аминосульфониламино(C1-6-алкил)амино-C1-6-алкил; ди(C1-6 алкил)аминосульфониламино(C1-6-алкил)амино; ди(C1-6-алкил)аминосульфониламино(C1-6-алкил)амино-3 007272(гидрокси-C1-6-алкил)(C1-6-алкил)амино-C1-6-алкил; гидрокси-C1-6 алкиламино-C1-6-алкил; ди(гидрокси-C1-6-алкил)амино-C1-6-алкил; пирролидинил-C1-6-алкил; пирролидинил-C1-6-алкилокси; пиразолил; тиопиразолил; пиразолил, замещенный двумя заместителями, выбранными из числа C1-6-алкила или тригалоген-C1-6-алкила; пиридинил; пиридинил, замещенный C1-6 алкилокси, арилокси или арилом; пиримидинил; тетрагидропиримидинилпиперазинил; тетрагидропиримидинилпиперазинил-C1-6-алкил; хинолинил; индол; фенил; фенил, замещенный одним, двумя или тремя заместителями, выбранными независимо из числа галогена, амино, нитро, C1-6-алкила, C1-6-алкилокси,гидрокси-С 1-4-алкила, трифторметила, трифторметилокси, гидрокси-С 1-4-алкилокси, С 1-4-алкилсульфонила, С 1-4-алкилокси-С 1-4-алкилокси, С 1-4-алкилоксикарбонила, амино-С 1-4-алкилокси, ди(С 1-4 алкил)амино-С 1-4-алкилокси, ди(С 1-4-алкил)амино, ди(С 1-4-алкил)аминокарбонила, ди(С 1-4-алкил)аминоС 1-4-алкила, ди(С 1-4-алкил)амино-С 1-4-алкиламино-С 1-4-алкила, ди(С 1-4-алкил)амино(С 1-4-алкил)амино,ди(С 1-4-алкил)амино(С 1-4-алкил)амино-С 1-4-алкила, ди(С 1-4-алкил)амино-С 1-4-алкил(С 1-4-алкил)амино, ди(С 1-4-алкил)мино-С 1-4-алкил(С 1-4-алкил)амино-С 1-4-алкила, аминосульфониламино(С 1-4-алкил)амино, аминосульфониламино(С 1-4-алкил)амино-С 1-4-алкила, ди(С 1-4-алкил)аминосульфониламино(С 1-4-алкил)амино, ди(С 1-4-алкил)аминосульфониламино(С 1-4-алкил)амино-С 1-6-алкила, циано, пиперидинил-С 1-4-алкилокси, пирролидинил-С 1-4-алкилокси, аминосульфонилпиперазинила, аминосульфонилпиперазинил-С 1-4 алкила, ди(С 1-4-алкил)аминосульфонилпиперазинила, ди(С 1-4-алкил)аминосульфонилпиперазинил-С 1-4 алкила, гидрокси-С 1-4-алкилпиперазинила, гидрокси-С 1-4-алкилпиперазинил-С 1-4-алкила, С 1-4-алкилоксипиперидинила, С 1-4-алкилоксипиперидинил-С 1-4-алкила, гидрокси-С 1-4-алкилокси-С 1-4-алкилпиперазинила, гидрокси-С 1-4-алкилокси-С 1-4-алкилпиперазинил-С 1-4-алкила, (гидрокси-С 1-4-алкил)(С 1-4-алкил) амино, (гидрокси-С 1-4-алкил)(С 1-4-алкил)амино-С 1-4-алкила, ди(гидрокси-С 1-4-алкил)амино, ди(гидроксиС 1-4-алкил)амино-С 1-4-алкила, фуранила, фуранила, замещенного -CH=CH-CH=CH-, пирролидинил-С 1-4 алкила, пирролидинил-С 1-4-алкилокси, морфолинила, морфолинил-С 1-4-алкилокси, морфолинил-С 1-4 алкила, морфолинил-С 1-4-алкиламино, морфолинил-С 1-4-алкиламино-С 1-4-алкила, пиперазинила, С 1-4 алкилпиперазинила, С 1-4-алкилпиперазинил-С 1-4-алкилокси, пиперазинил-С 1-4-алкила, С 1-4-алкилпиперазинил-С 1-4-алкила, С 1-4-алкилпиперазинил-С 1-4-алкиламино, С 1-4-алкилпиперазинил-С 1-4-алкиламиноC1-6-алкила, тетрагидропиримидинилпиперазинила, тетрагидропиримидинилпиперазинил-С 1-4-алкила,пиперидиниламино-С 1-4-алкиламино, пиперидиниламино-С 1-4-алкиламино-С 1-4-алкила, (С 1-4-алкилпиперидинил)(гидрокси-С 1-4-алкил)амино-С 1-4-алкиламино,(С 1-4-алкилпиперидинил)(гидрокси-С 1-4-алкил) амино-С 1-4-алкиламино-С 1-4-алкила, пиридинил-С 1-4-алкилокси, гидрокси-С 1-4-алкиламино, гидрокси-С 1-4 алкиламино-С 1-4-алкила, ди(С 1-4-алкил)амино-С 1-4-алкиламино, аминотиадиазолила, аминосульфонилпиперазинил-С 1-4-алкилокси или тиофенил-С 1-4-алкиламино; каждый R5 и R6 может находиться у атома азота, замещая водород; арил, указанный выше, представляет собой фенил или фенил, замещенный одним или несколькими заместителями, выбранными, каждый независимо, из числа галогена, C1-6-алкила, C1-6-алкилокси, трифторметила, циано или гидроксикарбонила; их N-оксидным формам, фармацевтически приемлемым солям присоединения и стереохимически изомерным формам. Термин "ингибитор гистондеацетилазы" используется для обозначения соединения, способного взаимодействовать с гистондеацетилазой и ингибировать ее активность, конкретнее, ее ферментативную активность. Ингибирование ферментативной активности гистондеацетилазы означает ослабление способности гистондеацетилазы удалять ацетильную группу из гистона. Предпочтительно такое ингибиро-4 007272 вание является специфическим, т.е. ингибитор гистондеацетилазы ослабляет способность гистондеацетилазы удалять ацетильную группу из гистона в концентрации, которая ниже, чем концентрация ингибитора, которая требуется для получения некоторого другого эффекта, неродственного биологическому. Используемый в приведенных выше определениях и далее термин "галоген" является общим для фтора, хлора, брома и иода; С 1-4-алкил определяет линейные и разветвленные насыщенные углеводородные радикалы, содержащие от 1 до 4 атомов углерода, такие как, например, метил, этил, пропил, бутил,1-метилэтил, 2-метилпропил и т.п.; C1-6-алкил включает С 1-4-алкил и его более высокие гомологи с 5-6 атомами углерода, такие как, например, пентил, 2-метилбутил, гексил, 2-метилпентил и т.п.; C1-6 алкандиил определяет двухвалентные линейные и разветвленные насыщенные углеводородные радикалы с 1-6 атомами углерода, такие как, например, метилен, 1,2-этандиил, 1,3-пропандиил, 1,4-бутандиил, 1,5 пентандиил, 1,6-гександиил, и их разветвленные изомеры, такие как 2-метилпентандиил, 3 метилпентандиил, 2,2-диметилбутандиил, 2,3-диметилбутандиил и т.п.; тригалоген-C1-6-алкил определяетC1-6-алкил, содержащий три идентичных или разных галогенозаместителя, например трифторметил; С 2-6 алкендиил определяет двухвалентные линейные и разветвленные углеводородные радикалы, содержащие одну двойную связь и 2-6 атомов углерода, такие как, например, этендиил, 2-пропендиил, 3 бутендиил, 2-пентендиил, 3-пентендиил, 3-метил-2-бутендиил и т.п.; аминоарил определяет арил, замещенный амино; и С 3-10 циклоалкил включает циклические углеводородные группы с 3-10 атомами углерода, такие как циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил,циклогептил, циклооктил и т.п. Термин "другая Zn-хелатообразующая группа" относится к группе, способной взаимодействовать сZn-ионом, который может присутствовать в сайте связывания фермента. Фармацевтически приемлемые соли присоединения охватывают фармацевтически приемлемые соли присоединения кислот и фармацевтически приемлемые соли присоединения оснований. Подразумевается, что упомянутые выше фармацевтически приемлемые соли присоединения кислот включают терапевтически активные нетоксичные формы солей присоединения кислот, которые способны образовывать соединения формулы (I). Соединения формулы (I), имеющие свойства оснований, можно превратить в их фармацевтически приемлемые соли присоединения кислот обработкой указанной формы основания подходящей кислотой. Подходящими кислотами являются, например, неорганические кислоты, такие как галогеноводородные кислоты, например хлороводородная или бромоводородная кислота; серная, азотная, фосфорная и подобные кислоты; или органические кислоты, такие как, например, уксусная, трифторуксусная, пропановая, гликолевая, молочная, пировиноградная, щавелевая, малоновая, янтарная (т.е. бутандиовая кислота), малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая кислота и подобные кислоты. Соединения формулы (I), имеющие кислотные свойства, можно превратить в их фармацевтически приемлемые соли присоединения оснований обработкой указанной формы кислоты подходящим органическим или неорганическим основанием. Соответствующие формы солей присоединения оснований включают, например, соли аммония, соли щелочных и щелочно-земельных металлов, например литиевые, натриевые, калиевые, магниевые, кальциевые соли и т.п., соли с органическими основаниями, например соли бензатина, N-метил-D-глюкамина, гидрабамина, и соли с аминокислотами, такими как, например, аргинин, лизин и т.п. Термин "соли присоединения кислот или оснований" также включает гидраты и формы присоединения растворителей, которые способны образовывать соединения формулы (I). Примерами таких форм являются, например, гидраты, алкоголяты и т.п. Термин "стереохимически изомерные формы соединений формулы (I)", используемый в данном описании, определяет все возможные соединения, состоящие из одних и тех же атомов, связанных в одной и той же последовательности связей, но имеющие разные трехмерные структуры, не являющиеся взаимозаменяемыми, которыми могут обладать соединения формулы (I). Если не упоминется или не указано иное, химическое название соединения охватывает смесь всех возможных стереохимически изомерных форм, которыми указанное соединение может обладать. Указанная смесь может содержать все диастереомеры и/или энантиомеры основной молекулярной структуры указанного соединения. Подразумевается, что все стереохимически изомерные формы соединений формулы (I) как в чистой форме, так и в форме смесей друг с другом входят в объем настоящего изобретения. Подразумевается, что N-оксидные формы соединений формулы (I) включают такие соединения формулы (I), где один или несколько атомов азота окислены до так называемого N-оксида, в частности,такие N-оксиды, где N-окисленными являются один или несколько атомов азота пиперидина, пиперазина или пиридазинила. Некоторые соединения формулы (I) также могут существовать в их таутомерных формах. Подразумевается, что такие формы, хотя и не указываются ясно в приведенной выше формуле, включены в объем настоящего изобретения. Когда бы ни использовался далее в настоящем описании термин "соединения формулы (I)", подразумевается, что он также включает фармацевтически приемлемые соли присоединения и все стереоизо-5 007272 мерные формы. Подразумевается, что используемые в данном описании термины "гистондеацетилаза" и "HDAC" относятся к любому ферменту из семейства ферментов, удаляющих ацетильную группу из -аминогрупп лизиновых остатков в N-конце гистона. Если в контексте не указано иное, подразумевается, что термин"гистон" относится к любому белку-гистону, включая H1, Н 2 А, Н 2 В, Н 3, Н 4 и Н 5, от любого вида. Человеческие белки HDAC или генные продукты включают HDAC-1, HDAC-2, HDAC-3, HDAC-4, HDAC-5,HDAC-6, HDAC-7, HDAC-8, HDAC-9 и HDAC-10 и другие белки. Гистондеацетилаза также может происходить от источника, принадлежащего к простейшим или грибам. Первая группа соединений, представляющих интерес, состоит из таких соединений формулы (I), к которым применимы одно или несколько из следующих ограничений:e) R2 представляет собой водород или нитро;f) -L- представляет собой непосредственную связь или двухвалентный радикал, выбранный из C1-6 алкандиила;h) представляет собой радикал, выбранный из числа (а-1), (а-2), (а-3), (а-5), (а-6), (а-11), (а 18), (а-20), (а-21), (а-32), (а-33), (а-47) или (а-51);j) каждый R5 и R6 выбирают независимо из числа водорода; галогена; тригалоген-C1-6-алкила; C1-6 алкила; C1-6-алкила, замещенного арилом и С 3-10-циклоалкилом; C1-6-алкилокси; C1-6-алкилкарбонила; бензофуранила; нафталинсульфонила; пиридинила, замещенного арилокси; фенила или фенила, замещенного одним заместителем, выбранным независимо из числа гидрокси-С 1-4-алкила или морфолинилС 1-4-алкила. Вторая группа соединений, представляющих интерес, состоит из таких соединений формулы (I), к которым применимы одно или несколько из следующих ограничений:h) -L- представляет собой непосредственную связь;i) каждый R3 представляет независимо атом водорода;k) представляет собой радикал, выбранный из числа (а-6), (а-11), (а-20), (а-47) или (а-51);m) каждый R5 и R6 выбирают независимо из числа водорода; C1-6-алкила; C1-6-алкилокси; нафталинсульфонила или фенила, замещенного гидрокси-С 1-4-алкилом или морфолинил-С 1-4-алкилом. Третья группа соединений, представляющих интерес, состоит из таких соединений формулы (I), к которым применимы одно или несколько из следующих ограничений:b) -L- представляет собой непосредственную связь. Четвертая группа соединений, представляющих интерес, состоит из таких соединений формулы (I),к которым применимы одно или несколько из следующих ограничений:d) -L- представляет собой непосредственную связь или двухвалентный радикал, выбранный из числа C1-6-алкандиила, C1-6-алкандиилокси, амино или карбонила; представляет собой радикал, выбранный из числа (а-1), (а-3), (а-4), (а-5), (а-6), (а-7), (а-8),f)h) R5 представляет собой водород; галоген; гидрокси; амино; нитро; тригалоген-C1-6-алкил; тригалоген-C1-6-алкилокси; C1-6-алкил; C1-6-алкилокси; C1-6-алкилкарбонил; C1-6-алкилоксикарбонил; C1-6-алкилсульфонил; гидрокси-C1-6-алкил; арилокси; ди(C1-6-алкил)амино; циано; тиофенил; фуранил; фуранил,замещенный гидрокси-C1-6-алкилом; бензофуранил; имидазолил; оксазолил; оксазолил, замещенный арилом и C1-6-алкилом; C1-6-алкилтриазолил; тетразолил; пирролидинил; пирролил; морфолинил; C1-6 алкилморфолинил; пиперазинил; C1-6-алкилпиперазинил; гидрокси-C1-6-алкилпиперазинил; C1-6-алкилоксипиперидинил; пиразолил; пиразолил, замещенный одним или двумя заместителями, выбранными из числа C1-6-алкила или тригалоген-C1-6-алкила; пиридинил; пиридинил, замещенный C1-6-алкилокси, арилокси или арилом; пиримидинил; хинолинил; индол; фенил или фенил, замещенный одним или двумя заместителями, выбранными независимо из числа галогена, C1-6-алкила, C1-6-алкилокси или трифторметила;i) R6 представляет собой водород; галоген; гидрокси; амино; нитро; тригалоген-C1-6-алкил; тригалоген-C1-6-алкилокси; C1-6-алкил; C1-6-алкилокси; C1-6-алкилкарбонил; C1-6-алкилоксикарбонил; C1-6 алкилсульфонил; гидрокси-C1-6-алкил; арилокси; ди(C1-6-алкил)амино; циано; пиридинил; фенил или фенил, замещенный одним или двумя заместителями, выбранными независимо из числа галогена, C1-6 алкила, C1-6-алкилокси или трифторметила. Группа предпочтительных соединений состоит из таких соединений формулы (I), где t равен 1, 2, 3 или 4;-L- представляет собой непосредственную связь или двухвалентный радикал, выбранный из числаR4 представляет собой водород, гидрокси, амино, гидрокси-C1-6-алкил, C1-6-алкил, C1-6-алкилокси,арил-C1-6-алкил, аминокарбонил, амино-C1-6-алкил, C1-6-алкиламино-C1-6-алкил или ди(C1-6-алкил)аминоС 1-6 алкил; представляет собой радикал, выбранный из числа (а-1), (а-3), (а-4), (а-5), (а-6), (а-7), (а-8), (а 9), (а-10), (а-11), (а-12), (а-13), (а-14), (а-15), (а-16), (а-17), (а-18), (a-19), (a-20), (a-21), (a-22), (a-23), (a-24),(a-25), (a-26), (a-28), (a-29), (a-30), (a-31), (a-32), (a-33), (a-34), (a-35), (a-36), (a-37), (a-38), (a-39), (a-40), (a41), (a-42), (a-44), (a-45), (а-46), (a-47), (а-48) и (a-51); каждый s равен независимо 0, 1, 2, 3 или 4;R5 представляет собой водород; галоген; гидрокси; амино; нитро; тригалоген-C1-6-алкил; тригалоген-C1-6-алкилокси; C1-6-алкил; C1-6-алкилокси; C1-6-алкилкарбонил; C1-6-алкилоксикарбонил; C1-6 алкилсульфонил; гидрокси-C1-6-алкил; арилокси; ди(C1-6-алкил)амино; циано; тиофенил; фуранил; фуранил, замещенный гидрокси-C1-6-алкилом; бензофуранил; имидазолил; оксазолил; оксазолил, замещенный арилом и C1-6-алкилом; C1-6-алкилтриазолил; тетразолил; пирролидинил; пирролил; морфолинил; C1-6 алкилморфолинил; пиперазинил; C1-6-алкилпиперазинил; гидрокси-C1-6-алкилпиперазинил; C1-6 алкилоксипиперидинил; пиразолил; пиразолил, замещенный одним или двумя заместителями, выбранными из числа C1-6-алкила или тригалоген-C1-6-алкила; пиридинил; пиридинил, замещенный C1-6 алкилокси, арилокси или арилом; пиримидинил; хинолинил; индол; фенил или фенил, замещенный одним или двумя заместителями, выбранными, независимо, из числа галогена, C1-6-алкила, C1-6-алкилокси или трифторметила;R6 представляет собой водород; галоген; гидрокси; амино; нитро; тригалоген-C1-6-алкил; тригалоген-C1-6-алкилокси; C1-6-алкил; C1-6-алкилокси; C1-6-алкилкарбонил; С 1-6-алкилоксикарбонил; C1-6-алкилсульфонил; гидрокси-C1-6-алкил; арилокси; ди(C1-6-алкил)амино; циано; пиридинил; фенил или фенил,замещенный одним или двумя заместителями, выбранными независимо из числа галогена, C1-6-алкила,C1-6-алкилокси или трифторметила. Другая группа предпочтительных соединений состоит из таких соединений формулы (I),где n равен 1 или 2;R2 представляет собой водород или нитро;-L- представляет собой непосредственную связь или двухвалентный радикал, выбранный из C1-6 алкандиила;R4 представляет собой водород; представляет собой радикал, выбранный из числа (а-1), (а-2), (а-3), (а-5), (а-6), (а-11), (а-18),(а-20), (а-21), (а-32), (а-33), (а-47) или (а-51); каждый s равен независимо 0, 1, 2 или 4; каждый R5 и R6 выбирают независимо из числа водорода; галогена; тригалоген-С 1-6-алкила; C1-6 алкила; C1-6-алкила, замещенного арилом и С 3-10 циклоалкилом; C1-6-алкилокси; C1-6-алкилкарбонила; бензофуранила; нафталинсульфонила; пиридинила, замещенного арилокси; фенила или фенила, замещенного одним заместителем, выбранным независимо из числа гидрокси-С 1-4-алкила или морфолинилС 1-4-алкила. Группа более предпочтительных соединений состоит из таких соединений формулы (I),где n равен 1;t равен 0 или 1; каждый Q представляет собой каждый X представляет собой азот; каждый Y представляет собой азот;-L- представляет собой непосредственную связь; каждый R3 представляет независимо атом водорода;R4 представляет собой водород; представляет собой радикал, выбранный из числа (а-6), (а-11), (а-20), (а-47) или (а-51); каждый s равен независимо 0, 1 или 4 и каждый R5 и R6 выбирают независимо из числа водорода; C1-6-алкила; C1-6-алкилокси; нафталинсульфонила или арила, замещенного гидрокси-С 1-4-алкилом или морфолинил-С 1-4-алкилом. Наиболее предпочтительными соединениями являются соединения 3,4,8,5,7,6 и 9. Соединения формулы (I) и их фармацевтически приемлемые соли и их N-оксиды и стереохимически изомерные формы можно получить обычными способами. Общий путь синтеза включает, например,этапы, перечисленные далее. а). Гидроксамовые кислоты формулы (I), где R1 представляет собой -C(O)NH(OH), причем указанные соединения относят к соединениям формулы (I-а), можно получить взаимодействием промежуточного соединения формулы (II) с подходящей кислотой, такой как, например, трифторуксусная кислота. Указанное взаимодействие осуществляют в подходящем растворителе, таком как, например, метанол.b). Промежуточные соединения формулы (II) можно получить взаимодействием промежуточного соединения формулы (III) с промежуточным соединением формулы (IV) в присутствии соответствующих реагентов, таких как моногидрохлорид N'-(этилкарбонимидоил)-N,N-диметил-1,3-пропандиамина (EDC) и 1-гидрокси-1 Н-бензотриазол (HOBT). Взаимодействие можно осуществлять в подходящем растворителе, таком как смесь DCM и ТГФ. с). Промежуточные соединения формулы (III) можно получить взаимодействием промежуточного соединения формулы (V) с подходящим основанием, таким как NaOH, в присутствии подходящего растворителя, такого как этанол. Соединения формулы (I) также можно удобно получать с использованием метода твердофазного синтеза. Вообще, твердофазный синтез включает взаимодействие промежуточного соединения при синтезе с полимерным носителем. Такое промежуточное соединение на носителе затем может проходить через ряд стадий синтеза. После каждой стадии отфильтровыванием смолы и промывкой ее несколько раз различными растворителями удаляют примеси. На каждой стадии смолу можно разделять для взаимодействия с разными промежуточными соединениями на следующей стадии, причем таким образом создается возможность синтеза большого числа соединений. После последней стадии в процедуре смолу обрабатывают реагентом или способом, отщепляющим смолу от образца. Более подробное пояснение методов, используемых в твердофазной химии, дается, например, в работах "The Combinatorial Index" (B.Bunin, Academic Press) и Novabiochem's 1999 CataloguePeptide Synthesis Handbook (Novabiochem AG,Switzerland), которые обе включены в данное описание в качестве ссылок. Соединения формулы (I) и некоторые промежуточные соединения могут содержать в своей структуре по меньшей мере один стереогенный центр. Такой стереогенный центр может присутствовать в Rили S-конфигурации. Соединения формулы (I), полученные описанными выше способами, как правило, представляют собой рацемические смеси энантиомеров, которые можно отделить друг от друга последующими процедурами разделения, известными в технике. Рацемические соединения формулы (I) можно превратить в соответствующие диастереомерные формы солей взаимодействием с подходящей хиральной кислотой. Затем указанные диастереомерные формы солей разделяют, например, селективной или фракционной кристаллизацией, и энантиомеры высвобождают из них под действием щелочи. Другой способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с использованием хиральной неподвижной фазы. Указанные стереохимически чистые изомерные формы также можно получить из соответствующих стереохимически чистых изомерных форм подходящих исходных веществ, при условии, что взаимодействие происходит стереоспецифически. Предпочтительно, если нужен-9 007272 определенный стереоизомер, следует синтезировать указанное соединение стереоспецифическими способами получения. В таких способах преимущественно будут использоваться энантиомерно чистые исходные вещества. Соединения формулы (I), их фармацевтически приемлемые соли присоединения кислот и их стереоизомерные формы имеют ценные фармакологические свойства, проявляющиеся в том, что они обладают ингибирующим действием в отношении гистондеацетилазы (HDAC). Данное изобретение относится к способу ингибирования аномального роста клеток, в том числе трансформированных клеток, путем введения эффективного количества соединения изобретения. Аномальным является рост клеток, независимый от нормальных регуляторных механизмов (например, утрата контактного ингибирования). Сюда относятся ингибирование роста опухоли как непосредственно за счет задержки роста, терминальной дифференцировки и/или апоптоза раковых клеток, так и косвенно путем ингибирования неоваскуляризации опухолей. Данное изобретение также относится к способу ингибирования роста опухолей путем введения субъекту, например млекопитающему (в более частном случае, человеку), нуждающемуся в таком лечении, эффективного количества соединения настоящего изобретения. В частности, данное изобретение относится к способу ингибирования роста опухолей путем введения эффективного количества соединений настоящего изобретения. Примерами опухолевых заболеваний, которые можно подавлять, являются,но не ограничиваются указанным, рак легких (например, аденокарцинома и, в том числе немелкоклеточный рак легких), раковые заболевания поджелудочной железы (например, панкреатическая карцинома,такая как, например, экзокринная панкреатическая карцинома), раковые заболевания ободочной кишки(например, колоректальные карциномы, такие как, например, аденокарцинома ободочной кишки и аденома ободочной кишки), рак предстательной железы, в том числе прогрессирующее заболевание, гемопоэтические опухоли лимфоидного ряда (например, острый лимфоцитарный лейкоз, В-клеточная лимфома, лимфома Беркитта), миелоидные лейкозы (например, острый миелоидный лейкоз (AML), фолликулярный рак щитовидной железы, миелодиспластический синдром (MDS), опухоли мезенхимного происхождения (например, фибросаркомы и рабдомиосаркомы), меланомы, тератокарциномы, нейробластомы, глиомы, доброкачественная опухоль кожи (например, кератоакантомы), карцинома молочной железы (например, прогрессирующий рак молочной железы), карцинома почек, карцинома яичников, карцинома мочевого пузыря и эпидермальная карцинома. Соединения по изобретению можно использовать для других лечебных целей, например дляa) сенсибилизации опухолей к радиотерапии путем введения соединения по изобретению перед, во время или после облучения опухоли для лечения рака;b) лечения артропатий и остеопаталогических состояний, таких как ревматоидный артрит, остеоартрит, ювенильный артрит, подагра, полиартрит, псориатический артрит, анкилозирующий спондилит и системная красная волчанка;c) ингибирования пролиферации клеток гладких мышц, в том числе васкулярных пролиферативных расстройств, атеросклероза и рестеноза;d) лечения воспалительных состояний и состояний кожи, таких как неспецифический язвенный колит, болезнь Крона, аллергический ринит, болезнь "трансплантат против хозяина", конъюнктивит, астма,ARDS, болезнь Бехчета, отторжение трасплантата, крапивница, аллергический дерматит, гнездная алопеция, склеродерма, экзантема, экзема, дерматомиозит, акне, диабет, системная красная волчанка, болезнь Кавасаки, рассеянный склероз, эмфизема, кистозный фиброз и хронический бронхит;e) лечения эндометриоза, маточного фиброза, дисфункционального маточного кровотечения и эндометриальной гиперплазии;m) ингибирования нервно-мышечной патологии, например амиотрофического бокового склероза;n) лечения спинально-мышечной атрофии; о) лечения других патологических состояний, поддающихся лечению путем потенциирования экспрессии гена; р) усиления генной терапии. Итак, настоящее изобретение относится к соединениям формулы (I) для применения в качестве лекарственного средства, а также к применению указанных соединений формулы (I) для получения лечебного средства для лечения одного или нескольких из вышеуказанных состояний.- 10007272 Соединения формулы (I), их фармацевтически приемлемые соли присоединения кислот и стереоизомерные формы могут иметь ценные диагностические свойства в том отношении, что их можно использовать для детекции или идентификации HDAC в биологическом образце, включая детекцию или определение образования комплекса между меченным соединением и HDAC. В способах детекции или идентификации можно использовать соединения, помеченные веществами-метками, такими как радиоизотопы, ферменты, флуоресцентные вещества, люминесцентные вещества и т.д. Примерами радиоизотопов являются 125I, 131I, 3H и 14C. Ферменты, как правило, делают детектируемыми путем соединения с соответствующим субстратом, который, в свою очередь, катализирует реакцию детекции. Их примерами являются, например, бета-галактозидаза, бета-глюкозидаза, щелочная фосфатаза, пероксидаза и малатдегидрогеназа и предпочтительна пероксидаза из хрена. Люминесцентные вещества включают, например, люминол, производные люминола, люциферин, экворин и люциферазу. Биологические образцы можно определить как ткань организма или жидкости организма. Примерами жидкостей организма являются цереброспинальная жидкость, кровь, плазма, сыворотка, моча, мокрота, слюна и т.п. С учетом их полезных фармакологических свойств, обсуждаемые соединения можно ввести в состав разных фармацевтических форм для целей введения. Для того чтобы получить фармацевтические композиции данного изобретения, эффективное количество определенного соединения в форме соли присоединения основания или кислоты в качестве активного ингредиента объединяют при тщательном перемешивании с фармацевтически приемлемым носителем, который может иметь самые разные формы в зависимости от формы препарата, нужного для введения. Такие фармацевтические композиции представляют, желательно, единичную дозированную форму, подходящую предпочтительно для введения перорально, ректально, чрезкожно или путем парентеральной инъекции. Например, при получении композиций в оральной дозированной форме можно использовать любую из обычно используемых фармацевтических сред, такую как, например, вода, гликоли, масла, спирты и т.п., в случае оральных жидких препаратов, таких как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, каолин, смазывающие вещества, связующие вещества, дезинтегрирующие вещества и т.п., в случае порошков, пилюль, капсул и таблеток. Из-за легкости их введения таблетки и капсулы представляют наиболее благоприятную оральную единичную дозированную форму, и в таком случае очевидно используют твердые фармацевтические носители. Для парентеральных композиций носитель, как правило, будет содержать стерильную воду, по меньшей мере, в большей части, хотя можно включать и другие ингредиенты, например, способствующие растворению. Можно получить, например, растворы для инъекций, в которых носитель содержит физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Также можно получить суспензии для инъекций, и в таком случае можно использовать соответствующие жидкие носители, суспендирующие вещества и т.п В композициях, подходящих для чрезкожного введения, носитель необязательно содержит вещество, усиливающие проникание, и/или подходящее смачивающее вещество, необязательно, в сочетании с небольшими количествами подходящих добавок любой природы, которые не оказывают существенного раздражающего действия на кожу. Указанные добавки могут облегчить нанесение на кожу и/или могут быть полезными при получении нужных композиций. Такие композиции можно вводить разными способами, например в виде трансдермального пластыря, в виде капли или в виде мази. Особенно выгодно получать указанные выше фармацевтические композиции в единичной дозированной форме для облегчения введения и равномерности дозировки. Используемый в данном описании и в формуле изобретения термин "единичная дозированная форма" относится к физически дискретным единицам, подходящим в качестве единичных дозировок, причем каждая единица содержит предварительно установленное количество активного ингредиента, рассчитанное на получение нужного лечебного действия, в сочетании с требуемым фармацевтическим носителем. Примерами таких единичных дозированных форм являются таблетки (в том числе таблетки с насечками или с покрытием), капсулы, пилюли, порошки в пакетиках, облатки, растворы или суспензии для инъекций, чайные ложки, столовые ложки и т.п., и множество таких разделенных дозированных форм. Специалисты в данной области техники легко могут определить эффективное количество из результатов испытаний, представленных далее. Вообще, предполагается, что терапевтически эффективное количество будет составлять от 0,005 до 100 мг на кг веса тела и, в частности, от 0,005 до 10 мг на кг веса тела. Может оказаться подходящим введение требуемой дозы в виде двух, трех, четырех или большего числа субдоз через соответствующие интервалы в течение суток. Указанная субдоза может быть составлена в виде единичных дозированных форм, например, содержащих 0,5-500 мг, и, в частности, 10-500 мг активного ингредиента на единичную дозированную форму. В другом аспекте настоящее изобретение относится к сочетанию ингибитора HDAC с другим противораковым средством, в особенности для применения в качестве лекарственного средства, конкретнее,при лечении рака или родственных заболеваний. Для лечения вышеуказанных состояний соединения изобретения можно выгодно использовать в- 11007272 сочетании с одним или несколькими другими лекарственными средствами, в частности, с другими противораковыми средствами. Примерами противораковых средств являются координационные соединения платины, например цисплатин, карбоплатин или оксалиплатин; таксановые соединения, например паклитаксел или доцетаксел; ингибиторы топоизомеразы I, такие как соединения камптотецина, например иринотекан или топотекан; ингибиторы топоизомеразы II, такие как противоопухолевые производные подофиллотоксина, например этопозид или тенипозид; противоопухолевые алкалоиды растения барвинок, например винбластин, винкристин или винорелбин; противоопухолевые производные нуклеозидов, например 5-флуороурацил, гемцитабин или капецитабин; алкилирующие агенты, такие как горчичный газ или нитрозомочевина, например циклофосфамид,хлорамбуцил, кармустин или ломустин; противоопухолевые производные антрациклинов, например даунорубицин, доксорубицин, идарубицин или митоксантрон; антитела к HER2, например Trastuzumab; антагонисты эстрогеновых рецепторов или селективные модуляторы эстрогеновых рецепторов, например тамоксифен, торемифен, дролоксифен, фаслодекс или ралоксифен; ингибиторы ароматазы, такие как экземестан, анастрозол, летразол и ворозол; дифференцирующие агенты, такие как ретиноиды, витамин D и блокаторы метаболизма ретиноевой кислоты (RAMBA), например аккутан; ингибиторы ДНК-метилтрансферазы, например азацитидин; ингибиторы киназ, например флавоперидол, иматинибмезилат или гефитиниб; ингибиторы фарнезилтрансферазы или другие ингибиторы HDAC. Термин "координационное соединение платины", используемый в данном описании, обозначает любое координационное соединение платины, ингибирующее рост опухолевых клеток, в котором платина предоставлена в форме иона. Термин "таксановые соединения" обозначает класс соединений с таксановой циклической системой, родственные или полученные из экстрактов некоторых видов деревьев тиса (Taxus). Термин "ингибиторы топоизомеразы" используется для обозначения ферментов, способных изменять топологию ДНК в эукариотических клетках. Они являются критическим фактором для важных клеточных функций и клеточной пролиферации. Существует два класса топоизомераз в эукариотических клетках, а именно, типа I и типа II. Топоизомераза I представляет собой мономерный фермент с молекулярной массой приблизительно 100000. Фермент связывается с ДНК и вводит временный однонитевой разрыв, раскручивает двойную спираль (или создает возможность для ее раскручивания) и затем закрывает разрыв перед диссоциацией от цепи ДНК. Топоизомераза II имеет подобный механизм действия,который включает индукцию разрывов в цепи ДНК или образование свободных радикалов. Термин "соединения камптотецина" используется для обозначения соединений, родственных или образованных от исходного камптотецина, представляющего собой нерастворимый в воде алкалоид, полученный из дерева Chinese Camptothecin acuminata и дерева Indian Nothapodytes foetida. Термин "подофиллотоксины" используется для обозначения соединений, родственных или полученных из исходного подофиллотоксина, экстрагированного из растения мандрагоры. Термин "противоопухолевые алкалоиды растения барвинок" используется для обозначения соединений, родственных или полученных из экстрактов растения барвинок (Vinca rosea). Термин "алкилирующие агенты" охватывает группу разных химических веществ, общим свойством которых является способность в физиологических условиях отдавать алкильные группы биологически жизнеспособным макромолекулам, таким как ДНК. С помощью большинства более важных агентов, таких как горчичные газы и нитрозомочевины, активные алкилирующие группы генерируются in vivo после сложных реакций деградации, из которых некоторые являются ферментативными. Наиболее важными фармакологическими действиями алкилирующих агентов являются действия, которые нарушают фундаментальные механизмы, касающиеся пролиферации клеток, в частности, синтез ДНК и деление клеток. Способность алкилирующих агентов влиять на функцию и целостность ДНК в быстро пролифирирующих тканях создает основу для их терапевтических применений и во многих случаях для их токсических свойств. Термин "противоопухолевые производные антрациклинов" включает антибиотики, полученные из гриба Strep. peuticus var. caesius, и их производные, характеризующиеся наличием тетрациклиновой циклической структуры с необычным сахаром даунозамином, присоединенным гликозидной связью. Показано, что амплификация белка рецептора 2 человеческого эпидермального фактора роста (HER 2) при первичных карциномах молочной железы коррелирует с плохим клиническим прогнозом для некоторых пациентов. Ttastuzumab представляет собой полученное методом рекомбинантных ДНК гумани- 12007272 зированное моноклональное антитело IgG1-каппа высокой степени чистоты, которые с высокой аффинностью и специфичностью связываются с внеклеточным доменом рецептора HER 2. Многие злокачественные опухоли молочной железы имеют эстрогенные рецепторы, и рост таких опухолей можно стимулировать эстрогеном. Термины "антагонисты эстрогеновых рецепторов" и "селективные модуляторы эстрогеновых рецепторов" используются для обозначения конкурентных ингибиторов связывания эстрадиола с эстрогеновым рецептором (ER). Селективные модуляторы эстрогеновых рецепторов, когда связываются с ER, индуцируют изменение в трехмерной структуре рецептора, ингибируя его связывание с реагирующим на эстроген элементом (ERE) в ДНК. У женщин в период после менопаузы основным источником циркулирующего эстрогена является конверсия андрогенов надпочечников и яичников (андростендиона и тестостерона) в эстрогены (эстрон и эстрадиол) ферментом ароматазой в периферических тканях. Депривация эстрогена через ингибирование или инактивацию ароматазы является эффективным и избирательным лечением для некоторых пациенток с гормонзависимым раком молочной железы в период после менопаузы. Термин "антиэстроген" используется в данном описании не только для антагонистов эстрогеновых рецепторов и селективных модуляторов эстрогеновых рецепторов, но также для ингибиторов ароматазы,описанных выше. Термин "дифференцирующие агенты" охватывает соединения, которые могут различными путями ингибировать пролиферацию клеток и индуцировать дифференцировку. Известно, что витамин D и ретиноиды играют главную роль в регуляции роста и дифференцировке широкого ряда типов здоровых и злокачественных клеток. Блокаторы метаболизма ретиноевой кислоты (RAMBA) повышают уровни эндогенных ретиноевых кислот путем ингибирования опосредуемого цитохромом Р 450 катаболизма ретиноевых кислот. Изменения метилирования ДНК находятся в числе наиболее обычных аномалий при неоплазии человека. Гиперметилирование в промоторах селективных генов, как правило, ассоциируется с инактивацией вовлеченных генов. Термин "ингибиторы ДНК-метилтрансферазы" используется для обозначения соединений, которые действуют через фармакологическое ингибирование ДНК-метилтрансферазы и реактивацию экспрессии гена супрессора опухоли. Термин "ингибиторы киназ" включает сильные ингибиторы киназ, вовлеченных в развитие клеточного цикла и запрограммированную гибель клеток (апоптоз). Термин "ингибиторы фарнезилтрансферазы" используется для обозначения соединений, сконструированных для предупреждения фарнезилирования Ras и других внутриклеточных белков. Показано, что они действуют на пролиферацию и выживаемость злокачественных клеток. Термин "другие ингибиторы HDAC" включает короткоцепные жирные кислоты, например бутират, 4-фенилбутират или вальпроевую кислоту; гидроксамовые кислоты, например субероиланилидгидроксамовую кислоту (SAHA), биарилгидроксамат А-161906, бициклические арил-N-гидроксикарбоксамиды, пироксамид, CG-1521, PXD-101,сульфонамидгидроксамовую кислоту LAQ-824, трихостатин A (TSA), оксамфлатин, скриптаид, мкарбоксициннамовую кислоту, бисгидроксамовую кислоту или аналог трапоксингидроксамовой кислоты; циклические тетрапептиды, например трапоксин, апидицин или депсипептид; бензамиды, например MS-275 или CI-994, или депудицен и другие вещества. Для лечения рака соединения по настоящему изобретению можно вводить пациенту так, как описано выше, в сочетании с облучением. Облучение означает обработку ионизирующим излучением и, в частности, гамма-излучением, в особенности, испускаемым линейными ускорителями или радионуклеидами, которые обычно применяют в настоящее время. Облучение опухоли радионуклеидами может быть наружным или внутренним. Настоящее изобретение также относится к сочетанию по изобретению противоракового средства и ингибитора HDAC по настоящему изобретению. Настоящее изобретение также относится к сочетанию по изобретению для применения в лекарственной терапии, например для ингибирования роста опухолевых клеток. Настоящее изобретение также относится к сочетаниям по изобретению для ингибирования роста опухолевых клеток. Настоящее изобретение также относится к способу ингибирования роста опухолевых клеток у человека, включающему введение субъекту эффективного количества сочетания по изобретению. Настоящее изобретение также относится к способу ингибирования аномального роста клеток, в том числе трансформированных клеток, путем введения эффективного количества сочетания по изобретению. Другое лекарственное средство и ингибитор HDAC можно вводить одновременно (например, в отдельных или в единых композициях) или последовательно в любом порядке. В последнем случае два соединения будут вводиться в течение периода и в количестве и способом, которые достаточны для того,- 13007272 чтобы иметь уверенность, что достигается благоприятный или синергический эффект. Следует иметь в виду, что предпочтительный способ и порядок введения и соответствующие дозировочные количества и режимы для каждого компонента сочетания будут зависеть от конкретных вводимых другого лекарственного средства и ингибитора HDAC, способа их введения, конкретной опухоли, от которой лечат, и конкретного хозяина, которого лечат. Оптимальный способ и порядок введения и соответствующие дозировочные количества и режим могут легко определить специалисты в данной области техники с использованием обычных методов и с учетом изложенной в данном описании информации. Координационное соединение платины выгодно вводить в дозировке 1-500 мг на квадратный метр(мг/м 2) площади поверхности тела, например 50-400 мг/м 2, в частности, в случае цисплатина в дозировке примерно 7 5 мг/м 2, и в случае карбоплатина - примерно 300 мг/м 2 на курс лечения. Таксановое соединение выгодно вводить в дозировке 50-400 мг на квадратный метр (мг/м 2) площади поверхности тела, например 75-250 мг/м 2, в частности, в случае паклитаксела в дозировке примерно 175-250 мг/м 2 и в случае доцетаксела примерно 75-150 мг/м 2 на курс лечения. Камптотециновое соединение выгодно вводить в дозировке 0,1-400 мг на квадратный метр (мг/м 2) площади поверхности тела, например 1-300 мг/м 2, в частности, в случае иринотекана в дозировке примерно 100-350 мг/м 2 и в случае топотекана примерно 1-2 мг/м 2 на курс лечения. Противоопухолевое производное подофиллотоксина выгодно вводить в дозировке 30-300 мг на квадратный метр (мг/м 2) площади поверхности тела, например 50-250 мг/м 2, в частности, в случае этопозида в дозировке примерно 35-100 мг/м 2 и в случае тенипозида примерно 50-250 мг/м 2 на курс лечения. Противоопухолевый алкалоид растения барвинок выгодно вводить в дозировке 2-30 мг на квадратный метр (мг/м 2) площади поверхности тела, в частности, в случае винбластина в дозировке примерно 312 мг/м 2, в случае винкристина в дозировке примерно 1-2 мг/м 2 и в случае винорелбина в дозировке примерно 10-30 мг/м 2 на курс лечения. Противоопухолевое нуклеозидное производное выгодно вводить в дозе 200-2500 мг на квадратный метр (мг/м 2) площади поверхности тела, например 700-1500 мг/м 2, в частности, в случае 5-FU в дозировке 200-500 мг/м 2, в случае гемцитабина в дозировке примерно 800-1200 мг/м 2 и в случае капецитабина примерно 1000-2500 мг/м 2 на курс лечения. Алкилирующие вещества, такие как горчичный газ или нитрозомочевина, выгодно вводить в дозировке 100-500 мг на квадратный метр (мг/м 2) площади поверхности тела, например 120-200 мг/м 2, в частности, в случае циклофосфамида в дозировке примерно 100-500 мг/м 2, в случае хлорамбуцила в дозировке примерно 0,1-0,2 мг/кг, в случае кармустина в дозировке примерно 150-200 мг/м 2 и в случае ломустина в дозировке примерно 100-150 мг/м 2 на курс лечения. Противоопухолевое производное антрациклина выгодно вводить в дозировке 10-75 мг на квадратный метр (мг/м 2) площади поверхности тела, например 15-60 мг/м 2, в частности, в случае доксорубицина в дозировке примерно 40-75 мг/м 2, в случае даунорубицина в дозировке примерно 25-45 мг/м 2 и в случае идарубицина в дозировке примерно 10-15 мг/м 2 на курс лечения.Trastuzumab выгодно вводить в дозировке 1-5 мг на квадратный метр (мг/м 2) площади поверхности тела, в частности, 2-4 мг/м 2 на курс лечения. Антиэстрогенное средство выгодно вводить в дозировке примерно 1-100 мг ежесуточно, в зависимости от конкретного средства и состояния, от которого лечат. Тамоксифен выгодно вводить перорально в дозировке 5-50 мг, предпочтительно 10-20 мг, дважды в сутки, при продолжении терапии в течение времени, достаточного для достижения и поддержания лечебного эффекта. Торемифен выгодно вводить перорально в дозировке примерно 60 мг один раз в сутки при продолжении терапии в течение времени,достаточного для достижения и поддержания лечебного эффекта. Анастрозол выгодно вводить перорально в дозировке примерно 1 мг один раз в сутки. Дролоксифен выгодно вводить перорально в дозировке примерно 20-100 мг один раз в сутки. Ралоксифен выгодно вводить перорально в дозировке примерно 60 мг один раз в сутки. Экземестан выгодно вводить перорально в дозировке примерно 25 мг один раз в сутки. Указанные дозировки можно вводить, например, один раз, дважды или большее число раз на курс лечения, который может повторяться примерно каждые 7, 14, 21 или 28 дней. С учетом их полезных фармакологических свойств, компоненты сочетаний по изобретению, т.е. другое лекарственное средство и ингибитор HDAC, можно ввести в разные фармацевтические формы для целей введения. Компоненты можно включить по отдельности в отдельные фармацевтические композиции или в единую фармацевтическую композицию, содержащую оба компонента. Следовательно, настоящее изобретение также относится к фармацевтической композиции, содержащей другое лекарственное средство и ингибитор HDAC вместе с одним или несколькими фармацевтическими носителями. Настоящее изобретение также относится к сочетанию по изобретению в форме фармацевтической композиции, содержащей противораковое средство и ингибитор HDAC по изобретению вместе с одним или несколькими фармацевтическими носителями. Настоящее изобретение также относится к применению сочетания по изобретению для получения фармацевтической композиции для ингибирования роста опухолевых клеток.- 14007272 Настоящее изобретение также относится к продукту, содержащему в качестве первого активного ингредиента ингибитор HDAC по изобретению и в качестве второго активного ингредиента противораковое средство, в виде комбинированного препарата для одновременного, раздельного или последовательного применения при лечении пациентов, страдающих от рака. Экспериментальная часть Далее приводятся примеры в целях иллюстрации. Далее в описании "EDC" означает моногидрохлорид N'-(этилкарбонимидоил)-N,N-диметил-1,3 пропандиамина, "DCM" означает дихлорметан, "DIEA" означает диизопропилэтиламин, "DIPE" означает диизопропиловый эфир, "ДМФА" означает диметилформамид,"EtOAc" означает этилацетат, "iPrOH" означает изопропил, "MeOH" означает метанол, "EtOH" означает этанол, "PyBrOP" означает гексафторфосфат бром-триспирролидинофосфония, "TEA" означает триэтиламин, "ТФК" означает трифторуксусная кислота и "ТГФ" означает тетрагидрофуран. А. Получение промежуточных соединений Пример A1.(300 мл) перемешивали при комнатной температуре в течение 24 ч в атмосфере азота. В осадок выпадало желтое кристаллическое вещество. Выпавшее в осадок вещество собирали на фильтре, промывали эфиром и сушили. Остаток (21,1 г, 87%) растворяли в воде и обрабатывали 3 н. раствором NaOH. Полученную смесь экстрагировали DCM (3500 мл), сушили (Na2SO4), фильтровали, удаляли растворитель при пониженном давлении, остаток сушили в вакууме при комнатной температуре в течение 16 ч и получали 18,3 г гексагидро-1-(4-нитрофенил)-1H-1,4-диазепина (промеж. соед. 1), температура плавления 115116C.b). Эфир бис-(1,1-диметилэтил)дикарбоновой кислоты (0,090 моль) в DCM (100 мл) при охлаждении на льду (ледяная баня) и перемешивании добавляли к раствору промеж. соед. 1 (0,090 моль) в DCM(200 мл). Наблюдали выделение газа. По прекращении выделения СО 2 ледяную баню удаляли и продолжали перемешивание в течение 3 ч при комнатной температуре. Реакционную смесь промывали 1 н. соляной кислотой и водой и затем сушили. Растворитель выпаривали и получали 20,5 г (70%) 1,1 диметилэтилового эфира гексагидро-4-(4-нитрофенил)-1H-1,4-диазепин-1-карбоновой кислоты (промеж. соед. 2), температура плавления 128-130C.c). Промеж. соед. 2 (0,047 моль) добавляли по частям (в течение 20 мин) к смеси моногидрата гидразина (15 мл) в метаноле (700 мл) и никеля Ренея (16,1 г) при кипячении ее с обратным холодильником. Реакционную смесь перемешивали и кипятили с обратным холодильником до тех пор, пока не исчезал желтый цвет. Смесь продолжали кипятить с обратным холодильником еще полчаса. Катализатор удаляли фильтрацией. Растворитель выпаривали и получали 13,0 г 1,1-диметилэтилового эфира 4-(4-аминофенил)гексагидро-1 Н-1,4-диазепин-1-карбоновой кислоты (промеж. соед. 3).d). Смесь промеж. соед. 3 (0,045 моль) и этилового эфира (1-этоксиэтилиден)гидразинкарбоновой кислоты (0,090 моль) в чистом виде при перемешивании грели на масляной бане при 130C в течение 1 ч. Еще через 2 ч реакционную смесь охлаждали и добавляли, растирая, 2-пропанол (примерно 100 мл). Твердое вещество отфильтровывали и сушили и получали 14 г твердого вещества. Полученное твердое вещество обрабатывали эфиром, отфильтровывали, сушили и получали 13,0 г (77%) 1,1 диметилэтилового эфира 4-[4-(1,5-дигидро-3-метил-5-оксо-4 Н-1,2,4-триазол-4-ил)фенил]гексагидро-1 Н 1,4-диазепин-1-карбоновой кислоты 1H-1,4-диазепин-1-карбоновой кислоты (промеж. соед. 4), температура плавления 238-240C.(0,01 моль; 10 мл, 1 М/ТГФ) при комнатной температуре добавляли (через шприц) к промеж. соед. 4 (0,01 моль) в ДМФА (200 мл). Начиналось образование твердой натриевой соли. Ее энергично перемешивали и добавляли еще ДМФА (200 мл). При комнатной температуре постепенно добавляли раствор 2 бромбутана (0,02 моль) в ДМФА (100 мл). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Растворитель ДМФА удаляли (вакуумный насос). К остатку добавляли воду и полученный маслянистый продукт растворяли в эфире (500 мл). Эфирный раствор концентрировали и получали 2,70 г маслянистого вещества, отверждающегося при стоянии (выход 62%), которое затем очищали колоночной флэш-хроматографией на силикагеле (элюент 1% (10% NH4OH/CH3OH)/CH2Cl2), и получали 0,55 г 1,1-диметилэтилового эфира 4-[4-[1,5-дигидро-3-метил-1-(1-метилпропил)-5-оксо-4 Н-1,2,4 триазол-4-ил]фенил]гексагидро-1 Н-1,4-диазепин-1-карбоновой кислоты (промеж. соед. 5), температура плавления 119-120C.f). Промеж. соед. 5 (0,0014 моль) в течение 30 мин при охлаждении добавляли к раствору ТФК (5 мл; ледяная баня). Растворитель удаляли при пониженном давлении. Добавляли воду и смесь насыщали карбонатом калия. Полученную смесь экстрагировали этилацетатом (250 мл), экстракт сушили над сульфатом натрия, фильтровали, удаляли растворитель и получали 0,35 г (65%) 4-[4-(гексагидро-1 Н-1,4 диазепин-1-ил)фенил]-2,4-дигидро-5-метил-2-(1-метилпропил)-3 Н-1,2,4-триазол-3-она (промеж. соед. 6).- 15007272 моль), (1R)-[1,1'-бинафталин]-2,2'-диилбисдифенилфосфина (0,016 г), Pd2(dba)3 (0,008 г) и Cs2CO3 (0,40 г) в толуоле (10 мл) помещали в пробирку высокого давления (содержащую небольшой магнитный стержень для перемешивания) в защитной камере с перчатками в атмосфере аргона. Пробирку плотно закрывали и грели на масляной бане при 120C в течение 12 ч при перемешивании. Добавляли еще (1R)-[1,1'бинафталин]-2,2'-диилбисдифенилфосфин (0,016 г), Pd2(dba)3 (0,008 г) и Cs2CO3 (0,40 г). Смесь грели на масляной бане при 120C в течение 24 ч. Реакционную смесь фильтровали для удаления неорганического твердого вещества, которое промывали примерно 20 мл CHCl3. Фильтрат концентрировали при пониженном давлении досуха. Остаток очищали флэш-хроматографией на силикагеле (элюентNH4OH/CH3OH/CH2Cl2, 0,1/0,9/99). Нужные фракции объединяли, растворитель выпаривали, остаток сушили при комнатной температуре в вакууме в течение 16 ч и получали 0,21 г (60%) метилового эфира 4-[4-[4-[1,5-дигидро-3-метил-1-(1-метилпропил)-5-оксо-4 Н-1,2,4-триазол-4-ил]фенил]гексагидро-1H-1,4 диазепин-1-ил]бензойной кислоты (промеж. соед. 7), температура плавления 152-153 С. Пример А 2. Смесь 4-[4-(фенилметил)-1-пиперазинил]бензойной кислоты (0,0145 моль), О(тетрагидро-2 Н-пиран-2-ил)гидроксиламина (0,029 моль), N,N'-метантетраилбисциклогексанамина(0,0145 моль) и 1-гидрокси-1 Н-бензотриазола (0,021 моль) в DCM, чда (200 мл), перемешивали при комнатной температуре в течение уикенда. Реакционную смесь промывали водой, сушили (MgSO4), фильтровали и выпаривали растворитель. Остаток кристаллизовали из EtOAc, отфильтровывали и сушили и получали 3,5 г и другую партию в 2,0 г - всего 5,5 г (95%) - 4-[4-(фенилметил)-1-пиперазинил]-N[(тетрагидро-2 Н-пиран-2-ил)окси]бензамида (промеж. соед. 8). Пример A3. а). Получение промежуточное соединение 9 Раствор 1-(фенилметил)пиперазина (0,068 моль) в ацетонитриле, чда (135 мл), постепенно добавляли к раствору карбоната калия (0,18 моль) и этилового эфира 2-(метилсульфонил)-5 пиримидинкарбоновой кислоты (0,082 моль) в ацетонитриле, чда (135 мл), и реакционную смесь перемешивали в течение 4 5 мин при комнатной температуре. Затем реакционную смесь оставляли на ночь. Добавляли DCM (400 мл). Добавляли воду (300 мл) и органический слой отделяли, сушили (MgSO4),фильтровали и выпаривали растворитель. Остаток (28 г) очищали колоночной хроматографией на силикагеле (элюент DCM/MeOH, 95/5). Чистые фракции собирали и выпаривали растворитель. Остаток кристаллизовали из ацетонитрила, отфильтровывали и сушили в вакууме и получали 15,1 г промежуточного соединения 9. промежуточное соединение 10 Смесь промежуточного соединения 9 (0,03 моль) и EtOH (250 мл) гидрировали при 50C с 10% Pd/C(2 г) в качестве катализатора. После поглощения Н 2 (1 экв.) катализатор отфильтровывали, и фильтрат упаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент DCM/(МеОН/NН 3),90/10). Фракции продукта реакции собирали, выпаривали растворитель и получали 6,8 г (96%) промежуточного соединения 10. с). Получение промежуточное соединение 11 Тетракис(этоксид) титана (0,0029 моль) добавляли к смеси промежуточного соединения 10 (0,0022 моль) и 1,1-диметилэтилового эфира 4-оксо-1-пиперидинкарбоновой кислоты (0,0027 моль) в 1,2 дихлорэтане (6 мл). Смесь перемешивали при 50C в течение 18 ч и затем охлаждали до комнатной температуры. Добавляли по частям NaBH(OAc)3 (0,0029 моль). Смесь перемешивали при комнатной температуре в течение 2 ч. Добавляли воду. Смесь экстрагировали DCM и фильтровали через целит. Органический слой отделяли, сушили (MgSO4), фильтровали и выпаривали растворитель досуха. Остаток (1,1 г)- 16007272 кристаллизовали из смеси диэтиловый эфир/DIPE. Выпавшее в осадок вещество отфильтровывали и сушили и получали 0,49 г (51%) промежуточного соединения 11. промежуточное соединение 12 Смесь промежуточного соединения 11 (0,0011 моль) и HCl/iPrOH (5 мл) перемешивали при 50C в течение 1 ч и затем охлаждали до комнатной температуры. Выпавшее в осадок вещество отфильтровывали, промывали EtOH, затем диэтиловым эфиром и сушили и получали 0,38 г (94%) промежуточного соединения 12 (соль HCl). е). Получение промежуточное соединение 13 Раствор 2-нафталинсульфонилхлорида (0,0011 моль) в DCM (1 мл) при 5 С в токе N2 добавляли к смеси промежуточного соединения 12 (0,001 моль) и TEA (0,0032 моль) в DCM (4 мл). Смесь перемешивали при комнатной температуре в течение ночи. Добавляли 10% раствор карбоната калия. Смесь экстрагировали DCM. Органический слой отделяли, сушили (MgSO4), фильтровали и выпаривали растворитель досуха. Остаток (0,53 г) обрабатывали смесью диэтиловый эфир/DIPE. Выпавшее в осадок вещество отфильтровывали и сушили и получали 0,42 г (77%) промежуточного соединения 13. Пример А 4. а). Получение промежуточное соединение 14 Тетракис(2-пропанолат) титана (0,0023 моль) в токе N2 добавляли к смеси 1-(2-нафталинсульфонил)пиперазина (0,0018 моль) и 1,1-диметилэтилового эфира 4-оксо-1-пиперидинкарбоновой кислоты (0,0021 моль) в 1,2-дихлорэтане (6 мл). Смесь перемешивали при 50C в течение 18 ч и затем охлаждали до комнатной температуры. Добавляли по частям NaBH(OAc)3 (0,0023 моль). Смесь перемешивали при комнатной температуре в течение 4 ч. Добавляли воду. Смесь фильтровали через целит. Смесь экстрагировали DCM. Органический слой отделяли, сушили (MgSO4), фильтровали и выпаривали растворитель досуха. Остаток (1,3 г) очищали колоночной хроматографией на силикагеле (70-200 мкм) промежуточное соединение 15 Смесь промежуточного соединения 14 (0,0014 моль) и 5 н. HCl/iPrOH (10 мл) перемешивали при 50C в течение 18 ч, затем охлаждали до комнатной температуры, фильтровали, промывали диэтиловым эфиром и сушили и получали 0,53 г (95%) промежуточного соединения 15 (соль HCl), температура плавления 260C. Пример А 5. Получение промежуточное соединение 16 Раствор 5-бром-2-фуранкарбоксальдегида (0,0171 моль) в 1,2-диметоксиэтане (15 мл) при комнатной температуре в токе N2 добавляли по каплям к раствору тетракис(трифенилфосфин)палладия (0,0045 моль) в 1,2-диметоксиэтане (50 мл). Смесь перемешивали в течение 20 мин. Добавляли суспензию [4(гидроксиметил)фенил]бороновой кислоты (0,0257 моль) в EtOH (18 мл). Смесь перемешивали в течение 20 мин. Добавляли карбонат натрия (0,15 моль). Смесь перемешивали и кипятили с обратным холодильником в течение 4 ч и затем приводили к комнатной температуре. Органический слой выпаривали. Остаток растворяли в DCM и промывали водой. Органический слой отделяли, сушили (MgSO4), фильтровали,и выпаривали растворитель. Остаток (4,1 г) очищали колоночной хроматографией на силикагеле (15-40 мкм) (элюент DCM/MeOH, 99/1). Чистые фракции собирали, выпаривали растворитель и получали 2,8 г промежуточное соединение 17 Раствор этилового эфира 2-(метилсульфонил)-5-пиримидинкарбоновой кислоты (0,0434 моль) в ацетонитриле (100 мл) при 10C в токе N2 добавляли по каплям к раствору 4-пиперидинметанамина(0,0868 моль) и карбоната калия (0,0434 моль) в ацетонитриле (200 мл). Смесь перемешивали при комнатной температуре в течение 2 ч, выливали в смесь воды со льдом и экстрагировали DCM. Органический слой отделяли, сушили (MgSO4), фильтровали и выпаривали растворитель. Остаток (14,18 г) очищали колоночной хроматографией на силикагеле (20-45 мкм) (элюент DCM/MeOH/NH4OH, от 90/10/1 до 80/20/2). Чистые фракции собирали, выпаривали растворитель и получали 3,7 г (32%) промежуточного соединения 17. промежуточное соединение 18 К N-циклогексилкарбодиимиду на N'-метилполистироле (153 мг) (NovaBiochem, кат.01-64-0211) добавляли N-ацетил-3,4,5-триметоксиантраниловую кислоту (0,2 ммоль), растворенную в ТГФ (0,5 мл), и затем 1-гидрокси-1 Н-бензотриазол, растворенный в ТГФ (0,5 мл). Смесь встряхивали в течение 10 мин при комнатной температуре. Затем к суспензии добавляли промежуточное соединение 17 (0,1 ммоль),растворенное в DCM (1 мл), после чего растворители выпаривали в токе азота при 50C и затем чистую реакционную смесь оставляли на ночь при 90C в токе азота. Продукт реакции растворяли в дихлорметане (2 мл) и раствор фильтровали через стеклянный фильтр. Остаток промывали DCM (22 мл) и фильтрат концентрировали. Затем продукт обрабатывали смесью ТГФ (1 мл) и водного раствора гидроксида натрия (1 мл, 1 н.) в течение 48 ч при комнатной температуре. Наконец, смесь нейтрализовали, добавляя соляную кислоту (1 мл, 1 н.) и сушили при 70C в токе азота и получали промежуточное соединение 18. с). Получение промежуточное соединение 19 К продукту промежуточного соединения 18 (0,1 ммоль) добавляли раствор 1-гидрокси-1 Н- 18007272 бензотриазола (0,1 ммоль), EDC (0,1 ммоль) и TEA (0,12 ммоль) в смеси DCM/ТГФ (3/4, 7 мл). Реакционную смесь встряхивали в течение 5 мин при комнатной температуре, после чего добавляли О(тетрагидро-2 Н-пиран-2-ил)гидроксиламин (0,1 ммоль). Полученный раствор встряхивали в течение ночи при комнатной температуре. Затем реакционную смесь концентрировали в токе азота при 50C до объема 5 мл, затем добавляли метилизоцианат на полимерном носителе (1,25 ммоль/г, 0,25 ммоль,Argonaut, кат.800261) и (полистирилметил)триметиламмонийбикарбонат (0,6 ммоль) (NovaBiochem,кат.01-64-0419) и полученную смесь встряхивали еще в течение 2 ч. Реакционную смесь фильтровали и фильтрат концентрировали. Осуществляли очистку продукта реакции препаративной ВЭЖХ и получали 29 мг промежуточного соединения 19. Пример А 7. Получение промежуточное соединение 20 Метансульфонилхлорид (0,006 моль) при 0C в токе N2 добавляли к раствору промежуточного соединения 27 (0,001 моль) и TEA (0,008 моль) в DCM (10 мл). Смесь перемешивали при 0C в течение 3 ч,выливали в смесь воды со льдом и экстрагировали DCM. Органический слой отделяли, сушили (MgSO4),фильтровали и выпаривали растворитель и получали 0,44 г промежуточного соединения 20. Полученный продукт использовали непосредственно на следующей стадии реакции. Пример А 8. а). Получение промежуточное соединение 21 Образец промежуточного соединения (0,1 ммоль) и 2-фенил-4 Н-3,1-бензоксазин-4-он (0,1 ммоль) отвешивали в реакционный сосуд, и добавляли толуол (2 мл). Сосуд герметично закрывали и смесь грели в течение 10 ч при 90C. Затем растворитель выпаривали и остаток растворяли в DCM (4 мл) и затем добавляли этандиоилдихлорид (1 ммоль) и ДМФА (1 ммоль). Полученную смесь встряхивали в течение ночи при 90C. Затем реакционную смесь промывали 10% водным раствором бикарбоната натрия (21 мл), фазы разделяли, органический слой концентрировали и получали промежуточное соединение 21.NaOH/MeOH (1/1/0,2, 2,2 мл) при энергичном перемешивании в течение ночи при комнатной температуре. Затем добавляли соляную кислоту (1 н., 1 мл) для нейтрализации раствора. Растворители выпаривали в вакууме и получали промежуточное соединение 22. с). Получение(0,15 ммоль). Смесь перемешивали при комнатной температуре в течение 10 мин. Добавляли О(тетрагидро-2 Н-пиран-2-ил)гидроксиламин (0,13 ммоль), растворенный в ТГФ (сухой, 1 мл), и реакционную смесь перемешивали при комнатной температуре в течение ночи. Растворители выпаривали, продукт реакции очищали с использованием ВЭЖХ с обращенной фазой и получали промежуточное соединение 23, температура плавления 219 С. В. Получение конечных соединений Пример B1. Из N-Fmoс-гидроксиламин-1-хлортритиловой смолы (NovaBiochem, кат.01-64-0165) удаляли защитную группу 50% раствором пиперидина в ДМФА (RT, 24 ч). Смолу несколько раз промывали DCM и ДМФА и замачивали в ДМФА. Добавляли в один прием 2 экв. кислоты PyBrOP и 4 экв.DIEA (в расчете на загрузку смолы). Смесь встряхивали в течение 24 ч, жидкость сливали и смолу несколько раз промывали DCM и ДМФА. Смолу замачивали в ДМФА, содержащем 2 экв. амина, встряхивали в течение 24 ч при RT, жидкость сливали и смолу промывали DCM и ДМФА. Конечный продукт отщепляли 5% ТФК в DCM, анализировали методом ВЭЖХ и MC и упаривали в предварительно взвешенных пробирках. Пример В 2. Получение соединение 1 Смесь промеж. соед. 7 (0,00075 моль), NH2OH/H2O, 50% (5 мл), KCN (0,001 моль), MeOH (10 мл) и ТГФ (10 мл) перемешивали при комнатной температуре в течение 48 ч. Растворитель выпаривали. Остаток экстрагировали DCM и промывали водой. Растворитель удаляли и маслянистый остаток (0,225 г) очищали колоночной хроматографией на силикагеле (элюент NH4OH/CH3OH/CH2Cl2, 0,05/0,95/99; затем соединение 2 Промеж. соед. 8 (0,000088 моль) перемешивали в смеси 5% ТФК/МеОН (5 мл) в течение 24 ч при 25 С. Затем реакционную смесь выливали в воду (5 мл) + 1 экв. NaHCO3. Полученную смесь экстрагировали DCM (5 мл, 2 х). Органический слой отделяли, сушили (MgSO4) , фильтровали и выпаривали растворитель (продуваним в токе N2 при 50C). Остаток сушили (вакуум, 50C) и получали 0,018 г (65%) соединения 2, температура плавления 196C. Пример В 4. а). Получение промежуточное соединение 24 Смесь промежуточного соединения 13 (0,0008 моль) и гидроксида натрия (0,0016 моль) в EtOH (10 мл) перемешивали и кипятили с обратным холодильником в течение 2 ч и затем охлаждали до комнатной температуры. Выпавшее в осадок вещество отфильтровывали, промывали EtOH, затем диэтиловым эфиром и сушили и получали 0,425 г (100%) промежуточного соединения 24 (натриевая соль).EDC (0,001 моль) добавляли в токе N2 к смеси промежуточного соединения 24 (0,0008 моль), О(тетрагидро-2 Н-пиран-2-ил)гидроксиламина (0,001 моль) и 1-гидрокси-1 Н-бензотриазола (0,001 моль) в смеси DCM/ТГФ (10 мл). Смесь перемешивали при комнатной температуре в течение 18 ч. Выпавшее в осадок вещество отфильтровывали, промывали ТГФ, затем диэтиловым эфиром и сушили и получали 0,4 г (83%) промежуточного соединения 25, температура плавления 260C. с). Получение соединение 3 ТФК (0,5 мл) добавляли к смеси промежуточного соединения 25 (0,0006 моль) и MeOH (10 мл). Смесь перемешивали при комнатной температуре в течение 5 сут. Выпавшее в осадок вещество отфильтровывали, промывали диэтиловым эфиром и сушили. Остаток обрабатывали водой, перемешивали в течение 30 мин, отфильтровывали и сушили и получали 0,143 г (38%) соединения 3 (.0,91 CF3COOH),температура плавления 210C. Пример В 5. Получение промежуточное соединение 26 Смесь промежуточного соединения 15 (0,0013 моль), этилового эфира 2-(метилсульфонил)-5 пиримидинкарбоновой кислоты (0,0017 моль) и карбоната калия (0,0039 моль) в ацетонитриле (10 мл) перемешивали при 80C в течение 18 ч. Добавляли воду. Смесь экстрагировали DCM. Органический слой отделяли, сушили (MgSO4), фильтровали и выпаривали растворитель досуха. Остаток (0,5 г) кристаллизовали из смеси CH3CN/DIPE. Выпавшее в осадок вещество отфильтровывали и сушили и получали 0,25 г (37%) промежуточного соединения 26. Промежуточное соединение 26 обрабатывали аналогично способу, описанному в примере В 4 и получали 0,126 г (74%) соединения 4 (.0,86 CF3COOH), температура плавления 230C. промежуточное соединение 27 Смесь промежуточного соединения 10 (0,0015 моль) и промежуточного соединения 16 (0,0015 моль) в MeOH (6 мл) перемешивали при 60C в течение 20 ч и затем охлаждали до 0C. Добавляли гид- 21007272 роборат натрия (0,0022 моль). Смесь доводили до комнатной температуры, затем перемешивали в течение 4 ч, выливали в смесь воды со льдом и экстрагировали DCM. Органический слой отделяли, сушили(MgSO4), фильтровали и выпаривали растворитель. Остаток (0,8 г) очищали колоночной хроматографией на силикагеле (15-40 мкм) (элюент DCM/MeOH/NH4OH, от 97/3/0,1 до 95/5/0,1). Чистые фракции собирали, выпаривали растворитель и получали 0,28 г (45%) промежуточного соединения 27. Промежуточное соединение 27 обрабатывали аналогично способу, описанному в примере В 4 и получали 0,143 г (89%) соединения 5 (.0,83 CF3COOH), температура плавления 219 С. промежуточное соединение 28 Смесь промежуточного соединения 10 (0,0042 моль) и 2-нафталинкарбоксальдегида (0,005 моль) в 1,2-дихлорэтане (10 мл) перемешивали при 50C в течение 3 ч и затем охлаждали до комнатной температуры. Добавляли по частям NaBH(OAc)3 (0,0055 моль). Смесь перемешивали при комнатной температуре в течение 2 ч. Добавляли воду. Смесь экстрагировали DCM. Органический слой отделяли, сушилиCH3CN/DIPE. Выпавшее в осадок вещество отфильтровывали и сушили и получали 1,2 г (75%) промежуточного соединения 28, температура плавления 147 С. Промежуточное соединение 28 обрабатывали аналогично способу, описанному в примере В 4 и получали 0,724 г (88%) соединения 6 (.0,83 CF3COOH), температура плавления 260 С. промежуточное соединение 29 Раствор эфира метансульфоновой кислоты и 2-нафталинэтанола (0,0029 моль) в ацетонитриле (3 мл) при 5C добавляли к смеси промежуточного соединения 10 (0,0024 моль) и карбоната калия (0,0048 моль) в ацетонитриле (6 мл). Смесь перемешивали при комнатной температуре в течение 18 ч, затем перемешивали и кипятили с обратным холодильником в течение ночи и охлаждали до комнатной температуры. Добавляли воду. Смесь фильтровали, промывали водой, затем диэтиловым эфиром и сушили и получали 0,45 г (48%) промежуточного соединения 29, температура плавления 128 С. Промежуточное соединение 29 обрабатывали аналогично способу, описанному в примере В 4 и получали 0,254 г (86%) соединения 7 (.0,79 CF3COOH), температура плавления 209C. Промежуточное соединение 19 (0,05 моль) обрабатывали ТФК (2 мл, в смеси DCM/MeOH, 1/1) в течение 10 сут. при комнатной температуре. Затем растворители выпаривали при комнатной температуре в токе азота, затем добавляли 1,4-диоксан и повторяли процедуру выпаривания. Затем образец сушили в токе азота в течение ночи при 40C и получали соединение 8 (CF3COOH). Пример B10. Получение промежуточное соединение 30 Смесь промежуточного соединения 20 (0,001 моль), морфолина (0,0013 моль) и карбоната калия(0,002 моль) в ацетонитриле (6 мл) перемешивали и кипятили с обратным холодильником в течение ночи, затем охлаждали, выливали в смесь воды со льдом и экстрагировали EtOAc. Органический слой отделяли, сушили (MgSO4), фильтровали и выпаривали растворитель. Остаток (0,79 г) очищали колоночной хроматографией на силикагеле (10 мкм) (элюент DCM/MeOH/NH4OH, 96/4/0,1). Чистые фракции собирали и выпаривали растворитель. Остаток (0,183 г) кристаллизовали из DIPE. Выпавшее в осадок вещество отфильтровывали и сушили и получали 0,086 г (47%) промежуточного соединения 30, температура плавления 120C. Промежуточное соединение 30 обрабатывали аналогично способу, описанному в примере В 4 и получали 0,432 г (87%) соединения 9 (.0,47 H2O .1,99 CF3COOH), температура плавления 140C.CF3COOH Раствор ТФК (5% в смеси DCM/MeOH, 1/1, 2 мл) добавляли к промежуточному соединению 23 и реакционную смесь перемешивали в течение 5 сут. при комнатной температуре. Затем растворители вы- 23007272 паривали при комнатной температуре в токе азота, затем добавляли 1,4-диоксан и повторяли процедуру концентрирования. Затем образец сушили в токе азота в течение ночи при 40C и получали соединение 10 (.CF3COOH). В табл. F-1 приводится перечень соединений, полученных согласно одному из примеров, приведенных выше. В таблицах используются следующие аббревиатуры: .C2HF3O2 указывается в случае соли трифторацетата. Таблица F-1 С. Фармакологический пример С помощью анализа in vitro на ингибирование гистондеацетилазы (см. пример C.1) измеряют ингибирование ферментативной активности HDAC, полученное с соединениями формулы (I). Клеточную активность соединений формулы (I) определяют на клетках опухоли А 2780 с использованием колориметрического анализа на клеточную токсичность или выживание (Mosmann Tim, Journal ofImmunological Methods, 65:55-63, 1983) (см. пример С.2). Кинетическая растворимость в водных средах определяет способность соединения оставаться в водном растворе после разведения (см. пример С.3). Исходные растворы в ДМСО разводят одним водным растворителем - буфером в 3 последовательные стадии. Для каждого разведения измеряют мутность нефелометром. Проникающая способность лекарственного средства выражает его способность перемещаться из одной среды в другую или через нее. Конкретно, это его способность перемещаться через кишечную оболочку в кровоток и/или из кровотока в мишень. Проникающую способность (см. пример С.4) можно измерить через образование фосфолипидного бислоя искусственной мембраны, иммобилизованной на фильтре. В анализе с искусственной мембраной, иммобилизованной на фильтре, формируют "сэндвич" из 96-луночного титрационного микропланшета и 96-луночного фильтра-планшета, так что каждая составная лунка разделяется на две камеры с донорским раствором на дне и акцепторным раствором сверху, разделенными диском микрофильтра в 125 мкм (размер пор 0,45 мкм), с покрытием из 2% (маc./об.) раствора диолеоилфосфатидилхолина в додекане, в условиях, в которых внутри каналов фильтра образуются многослойные бислои, когда система контактирует с водным буферным раствором. Проникаю- 27007272 щая способность соединений через такую искусственную мембрану измеряют в см/с. Целью является проверка проникания лекарственных средств через параллельную искусственную мембрану при 2 разных рН: 4,0 и 7,4. Детекцию соединения осуществляют методом УФ-спектрометрии при оптимальной длине волны от 250 до 500 нм. Метаболизм лекарственных средств означает, что жирорастворимое соединение ксенобиотик или эндобиотик ферментативно трансформируется в (а) полярный(е) водорастворимый(е) и экскретируемый(е) метаболит(ы). Основным органом для метаболизма лекарственных средств является печень. Продукты метаболизма часто менее активны, чем исходное лекарственное средство, или неактивны. Однако некоторые метаболиты могут обладать усиленной активностью или токсическим действием. Таким образом, метаболизм лекарственных средств может включать процессы как "детоксикации", так и "токсикации". Одну из главных ферментативных систем, определяющих способность организма обращаться с лекарственными средствами или химикатами, представляют цитохром-Р 450-монооксигеназы, которые являются NADPH-зависимыми ферментами. Метаболическую устойчивость соединений можно определить in vitro с использованием субклеточной ткани человека (см. пример С.5). В данном описании метаболическая устойчивость соединений выражается в % лекарственного средства, претерпевшего метаболизм после 15-минутной инкубации указанных соединений с микросомами. Количественно соединения определяют анализом методом ЖХ-МС. Супрессор опухолей р 53 транскрипционно активирует ряд генов, в том числе ген WAF1/CIP1, в ответ на повреждение ДНК. Продукт гена WAFI в 21 кДа обнаружен в комплексе, включающем циклины,циклинзависимые киназы (CDK) и ядерный антиген пролиферирующих клеток (PCNA), в нормальных клетках, но не в трансформированных клетках, и, как оказалось, является универсальным ингибитором активности CDK. Одним из следствий связывания p21WAF1 с CDK и ингибирования CDK является предотвращение CDK-зависимого фосфорилирования и последующей инактивации белка Rb, который важен для развития клеточного цикла. Следовательно, индукция p21WAF1 в ответ на контакт клеток с ингибитором HDAC является сильным и специфическим индикатором ингибирования развития клеточного цикла в обеих контрольных точках G1 и G2. Способность соединений индуцировать р 21WAF1 измеряли с помощью твердофазного иммуноферментного анализа на р 21WAF1 (WAF1 ELISA of Oncogene). Анализ на p21WAF1 является "сэндвич"иммуноферментным анализом с использованием как мышиных моноклональных, так и кроличьих поликлональных антител. Кроличьи поликлональные антитела, специфические для человеческого белкаWAF1, иммобилизовали на поверхности пластиковых лунок, имеющихся в наборе. Любое количество р 21WAF1, имеющееся в анализируемом образце, будет связываться с иммобилизованными антителами. Биотинилированные идентифицирующие моноклональные антитела также узнают человеческий белок р 21WAF1 и будут связываться с любым р 21WAF1, который удерживается иммобилизованными антителами. Идентифицирующие антитела, в свою очередь, связываются стрептавидином, конъюгированным с пероксидазой из хрена. Пероксидаза из хрена катализирует конверсию хромогенного субстрата тетраметилбензидина от бесцветного раствора до раствора синего цвета (или желтого после добавления стопреагента), интенсивность окраски которого пропорциональна количеству белка р 21WAF1, связанного с планшетом. Продукт цветной реакции определяют количественно с использованием спектрофотометра. Количество определяют, строя стандартную кривую с использованием известных концентраций р 21WAF1 (предоставляемого в лиофилизованном виде) (см. пример С.6). Пример C.1. Анализ in vitro на ингибирование гистондеацетилазы. Экстракты ядер HeLa (поставщик Biomol) инкубировали при 60 мкг/мл с 210-8 M меченного радиоактивными изотопами пептидного субстрата. В качестве субстрата для измерения активности HDAC использовали синтетический пептид, т.е. аминокислоты 14-21 гистона Н 4. Субстрат биотинилируют вNH2-концевой части со спейсером - 6-аминогексановой кислотой, защищают в COOH-концевой части амидогруппой и специфически [3H]-ацетилируют в лизине 16. Субстрат биотин-(6-аминогексановая)GlyAla-([3H]-aцетил-Lys-Arg-His-Arg-Lys-Val-NH2) добавляли в буфер, содержащий 25 мМ Hepes, 1 M сахарозы, 0,1 мг/мл BSA и 0,01% Тритона X-100, при рН 7,4. Через 30 мин реакцию деацетилирования обрывали, добавляя HCl и уксусную кислоту (конечные концентрации 0,035 и 3,8 мМ соответственно). После остановки реакции свободный 3 Н-ацетат экстрагировали этилацетатом. После перемешивания и центрифугирования определяли радиоактивность в аликвоте верхней (органической) фазы в счетчике -частиц. Для каждого эксперимента проводили параллельно инкубацию контролей (содержащих экстракт ядер HeLa и ДМСО без соединения), "пустышек" (содержащих ДМСО, но без экстракта ядер HeLa и соединения) и образцов (содержащих соединение, растворенное в ДМСО, и экстракт ядер HeLa). В первом случае соединения испытывали в концентрации 10-5 M. Когда соединения демонстрируют активность при 10-5 M, строили кривую зависимости ответа от концентрации, где соединения испытывали в концентрациях от 10-5 до 10-12 M. В каждом испытании величину для пустышки вычитали из величин как для контроля, так и для образца. Контрольный образец представлял 100% деацетилирование субстрата. Для каждого образца радиоактивность выражали как процент от средней величины для контроля. В соответ- 28007272 ствующих случаях величины IC50 (концентрация лекарственного средства, необходимая для снижения количества метаболитов на 50% от контроля) вычисляли с использованием пробит-анализа для сортируемых данных. В данном случае действие испытываемых соединений выражают в виде pIC50 (значение кологарифма величины IC50). Все испытываемые соединения показывают ферментативную активность при испытываемой концентрации 10-5 M, и 28 соединений имели IC505 (см. табл.F-2). Пример С.2. Определение антипролиферативной активности на клетках А 2780. Все испытываемые соединения растворяли в ДМСО и затем получали разведения в культуральной среде. Конечные концентрации ДМСО в анализах на пролиферацию клеток никогда не превышали 0,1%(об./об.). Контрольные образцы содержали клетки А 2780 и ДМСО без соединения, и пустышки содержали ДМСО, но без клеток. MTT растворяли в PBS в концентрации 5 мг/мл. Получали глициновый буфер,содержащий 0,1 M глицина и 0,1 M NaCl, забуференный до рН 10,5 NaOH (1 н.) (все реагенты от Merck). Клетки карциномы яичников человека А 2780 (получены в дар от Dr. Т.С. Hamilton [Fox ChaseCancer Centre, Pensilvania, USA]) культивировали в среде RPMI 1640 с добавлением 2 мМ L-глутамина,50 мкг/мл гентамицина и 10% фетальной телячьей сыворотки. Клетки обычным способом поддерживали в монослойных культурах при 37 С в увлажненной атмосфере с 5% СО 2. Клетки пересевали один раз в неделю с использованием раствора трипсин/ЭДТК при отношении разделения 1:40. Все среды и добавки получали от Life Technologies. Клетки были свободны от загрязнения микоплазмами, при определении с использованием набора Gen-Probe Mycoplasma Tissue Culture kit (поставщик BioMerieux). Клетки высевали в 96-луночные культуральные планшеты NUNC (поставщик Life Technologies) и оставляли прилипать к пластику на ночь. Используемая при высевании плотность клеток составляла 1500 клеток на лунку при общем объеме среды 200 мкл. После того, как клетки прилипнут к планшетам, среду заменяли и добавляли лекарственные средства и/или растворители до конечного объема 200 мкл. После четырехсуточной инкубации среду заменяли 200 мкл свежей среды и анализировали плотность и жизнеспособность клеток с использованием анализа на основе MTT. В каждую лунку добавляли 25 мкл раствора MTT, и затем клетки инкубировали в течение 2 ч при 37 С. Затем среду осторожно отсасывали и синий продукт МТТ-формазан растворяли, добавляя 25 мкл глицинового буфера и затем 100 мкл ДМСО. Тестируемые микропланшеты встряхивали в течение 10 мин на планшетном шейкере и измеряли поглощение при 540 нм с использованием спектрофотометра для чтения 96-луночных планшетов Emax (поставщик Sopachem). В рамках эксперимента результаты для каждого условия эксперимента являются средними результатами повторения в 3 лунках. Для целей начального скрининга соединения испытывали в одной установленной концентрации 10-6 M. В случае активных соединений эксперименты повторяли для построения полных кривых зависимости ответа от концентрации. Для каждого эксперимента параллельно проводили инкубацию контрольных образцов (не содержащих лекарственного средства) и пустышек (не содержащих ни клеток, ни лекарственного средства). Величину для пустышки вычитали из величин для всех контролей и образцов. Для каждого образца среднюю величину роста клеток (в единицах поглощения) выражают в виде процента от средней величины роста клеток для контроля. В соответствующем случае величины IC50 (концентрация лекарственного средства, необходимая для снижения роста клеток на 50% от контроля) вычисляли с использованием пробит-анализа для сортируемых данных (Finnely D.J.,Probit Analyses, 2nd Ed., Chapter 10, Graded Responses, Cambridge University Press, Cambridge, 1962). В данном случае действие испытываемых соединений выражают в виде рIС 50 (значение кологарифма величины IC50). Большинство испытываемых соединений показывали клеточную активность при испытываемой концентрации 10-б M, и 9 соединений имели pIC505 (см. табл.F-2). Пример С.3. Кинетическая растворимость в водных средах. На первой стадии разведения 10 мкл концентрированного исходного раствора активного соединения в ДМСО (5 мМ) добавляли к 100 мкл фосфатцитратного буфера, рН 7,4, и перемешивали. На второй стадии разведения аликвоту (20 мкл) раствора с первой стадии разведения также распределяли в 100 мкл фосфатцитратного буфера, рН 7,4, и перемешивали. Наконец, на третьей стадии разведения образец (20 мкл) раствора со второй стадии разведения также разводили в 100 мкл фосфатцитратного буфера, рН 7,4,и перемешивали. Все разведения осуществляли в 96-луночных планшетах. Сразу же после последней стадии разведения с помощью нефелометра измеряли мутность трех полученных растворов с последовательных стадий разведения. Разведение повторяли трижды для каждого соединения для того, чтобы исключить случайные ошибки. На основании измерений мутности осуществляли разделение на 3 класса. Соединениям с высокой растворимостью ставили оценку 3, и для таких соединений раствор после первого разведения прозрачный. Соединения со средней растворимостью получали оценку 2. В случае таких соединений раствор после первого разведения непрозрачный, а после второго разведения прозрачный. Соединения с низкой растворимостью получали оценку 1, и в случае таких соединений раствор как после первого, так и после второго разведения непрозрачный. Измеряли растворимость 6 соединений. Из указанных соединений 3 продемонстрировали оценку 3, 2 продемонстрировали оценку 2, и 1 продемонстрировало оценку 1 (см. табл. F-2). Пример С.4. Параллельный анализ проницаемости искусственной мембраны.- 29007272 Исходные образцы (аликвоты в 10 мкл исходного 5 мМ раствора в 100% ДМСО) разводили в планшете с глубокими лунками или Pre-mix, содержащем 2 мл водной буферной системы, рН 4 или рН 7,4(RSR4 System Solution Concentrate (pION. Перед добавлением образцов в планшет для сравнения в лунки добавляли по 150 мкл буфера и осуществляли контрольные измерения в УФ-свете. Затем буфер отбрасывали и использовали планшет как планшет для сравнения. Все измерения осуществляли в планшетах, устойчивых к УФ-излучению(поставщик Costar или Greiner). После контрольного измерения планшета для сравнения в его лунки добавляли по 150 мкл разведенных образцов и по 200 мкл разведенных образцов добавляли в лунки донорского планшета 1. На акцепторный фильтр-планшет 1 (поставщик Millipore, тип MAIP N45) наносили 4 мкл раствора, образующего искусственную мембрану (1,2-диолеил-sn-глицер-3-фосфохолин в додекане, содержащем 0,1% 2,6 ди-трет-бутил-4-метилфенола), и помещали поверх донорского планшета 1 для формирования "сэндвича". Сверху в лунки акцепторного планшета вносили буфер (200 мкл). Сэндвич накрывали крышкой и хранили в течение 18 ч при комнатной температуре в темноте. Контрольные измерения акцепторного планшета 2 осуществляли, добавляя в лунки по 150 мкл буфера и затем проводили УФ-измерения. После контрольного измерения акцепторного планшета 2 буфер отбрасывали и 150 мкл акцепторного раствора переносили из акцепторного фильтр-планшета 1 в акцепторный планшет 2. Затем акцепторный фильтр-планшет 1 удаляли из сэндвича. После контрольного измерения донорского планшета 2 (см. выше) 150 мкл донорского раствора переносили из донорского планшета 1 в донорский планшет 2. Снимали УФ-спектры донорского планшета 2, акцепторного планшета 2 и планшета для сравнения (с помощью SpectraMAX 190). Все спектры обрабатывали для вычисления проникающей способности с помощью программного обеспечения PSR4p Command Software. Измерения для всех соединений повторяли трижды. В качестве эталонов в каждом эксперименте использовали карбамазепин, гризеофулвин, ациклогуанизин, атенолол, фуросемид и хлоротиазид. Соединения распределяли на 3 категории как имеющие низкую проникающую способность (средний эффект 0,510-6 см/с; оценка 1), среднюю проникающую способность (110-6 см/ссредний эффект 0,510-6 см/с; оценка 2) или высокую проникающую способность ( 0,510-6 см/с; оценка 3). Два соединения испытали, и они продемонстрировали, по меньшей мере, оценку 2 при одном из измеренных рН. Пример С.5. Метаболическая устойчивость. Субклеточные препараты получали согласно Gorrod et al. (Xenobiotica, 5:453-462, 1975) путем разделения на центрифуге после механической гомогенизации ткани. Ткань печени ополаскивали в охлажденном на льду буфере 0,1 M Трис-HCl (рН 7,4) для отмывания избытка крови. Затем ткань сушили, промокая, взвешивали и нарезали на крупные куски хирургическими ножницами. Куски ткани гомогенизировали в 3 объемах охлажденного на льду 0,1 M фосфатного буфера (рН 7,4) с использованием или Potter-S (Braun, Италия), снабженного тефлоновым пестиком, или гомогенизатора Sorvall Omni-Max, в течение 710 с. В обоих случаях во время процесса гомогенизации сосуд держали во/на льду. Гомогенаты ткани центрифугировали при 9000 х g в течение 20 мин при 4 С с использованием центрифуги Sorvall или ультрацентрифуги Beckman. Полученный супернатант хранили при -80C и обозначают "S9". Затем фракцию S9 можно центрифугировать далее при 100000 х g в течение 60 мин (4 С) с использованием ультрацентрифуги Beckman. Полученный супернатант осторожно отсасывали, делили на аликвоты и обозначали "цитозоль". Осадок ресуспендировали в 0,1 M фосфатном буфере (рН 7,4) в конечном объеме 1 мл на 0,5 г массы исходной ткани и обозначали "микросомы". Все субклеточные фракции делили на аликвоты, сразу же замораживали в жидком азоте и хранили при -80C до применения. Для испытываемых образцов смесь для инкубации содержала PBS (0,1 M), соединение (5 мкМ),микросомы (1 мг/мл) и NADPH-генерирующую систему (0,8 мМ глюкозо-6-фосфата, 0,8 мМ хлорида магния и 0,8 единиц глюкозо-6-фосфатдегидрогеназы). Контрольные образцы содержали те же вещества, но микросомы заменяли микросомами, инактивированными нагреванием (10 мин при 95 С). Извлечение соединений в контрольных образцах всегда составляло 100%. Смеси предварительно инкубировали в течение 5 мин при 37C. Реакцию начинали в момент времени ноль (t=0), добавляя 0,8 мМ NADP, и образцы инкубировали в течение 15 мин (t=15). Реакцию обрывали, добавляя 2 объема ДМСО. Затем образцы центрифугировали в течение 10 мин при 900 х g, и супернатанты хранили до анализа при комнатной температуре не более 24 ч. Все инкубации повторяли дважды. Анализ супернатантов осуществляли методом ЖХ-МС. Элюирование образцов осуществляли на Xterra MS C18 (504,6 мм, 5 мкм, Waters, США). Использовали систему ВЭЖХ Alliance 2790 (поставщик Waters, США). Элюировали буфером А (25 мМ ацетата аммония(рН 5,2) в смеси Н 2 О/ацетонитрил (95/5, причем растворителем В является ацетонитрил и растворителем С метанол, при скорости потока 2,4 мл/мин. Используют градиент - возрастание концентрации орга- 30
МПК / Метки
МПК: C07D 207/14, C07D 211/58, C07D 403/04, A61K 31/4545, C12Q 1/34, C07D 401/04, A61P 35/00
Метки: новые, ингибиторы, гистондеацетилазы
Код ссылки
<a href="https://eas.patents.su/30-7272-novye-ingibitory-gistondeacetilazy.html" rel="bookmark" title="База патентов Евразийского Союза">Новые ингибиторы гистондеацетилазы</a>