Новое применение гетероциклических соединений, активных в качестве ингибиторов бета-лактамаз, и содержащие их фармацевтические композиции
Номер патента: 7220
Опубликовано: 25.08.2006
Авторы: Асзоди Жозеф, Лампила Максим, Роулендс Дэвид Ален, Фроментэн Клод
Формула / Реферат
1. Применение соединений общей формулы (I)
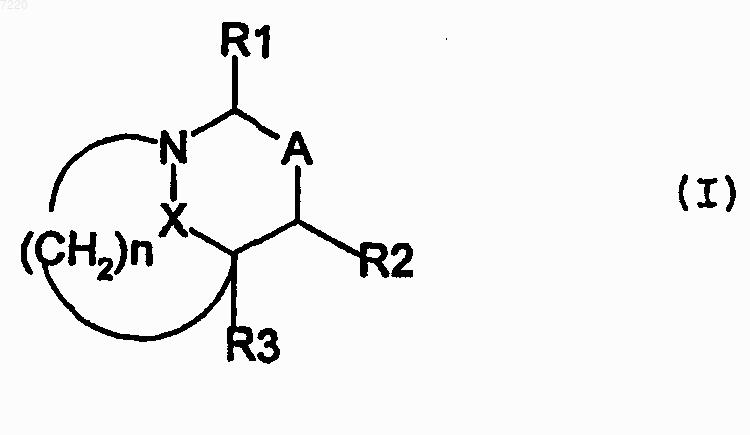
где R1 означает атом водорода, радикал COOR, CONR6, R7,
R выбирают из группы, образованной алкильным радикалом, содержащим от 1 до 6 атомов углерода, не обязательно замещенным пиридильным или карбамоильным радикалом, -СН2-алкенильным радикалом, содержащим в сумме от 3 до 9 атомов углерода, арилом, содержащим от 6 до 10 атомов углерода, или аралкилом, содержащим от 7 до 11 атомов углерода, при этом ядро арильного или аралкильного радикала не обязательно замещено радикалом ОН, NH2, NO2, алкилом, содержащим от 1 до 6 атомов углерода, алкоксигруппой, содержащей от 1 до 6 атомов углерода, или одним или несколькими атомами галогена,
R6 и R7, одинаковые или разные, выбирают из группы, образованной атомом водорода, алкильным радикалом, содержащим от 1 до 6 атомов углерода, арилом, содержащим от 6 до 10 атомов углерода, и аралкилом, содержащим от 7 до 11 атомов углерода, не обязательно замещенных карбамоильным радикалом, уреидогруппой или диэтиламиногруппой, и алкильным радикалом, содержащим от 1 до 6 атомов углерода и замещенным пиридильным радикалом,
n' равно 1 или 2,
R2 означает атом водорода или группу (CH2)n'1R5, где n'1 равно 0, 1 или 2 и значение R5 выбирают из группы, образованной радикалами COOH, CH, ОН, NH2, CO-NR6R7, COOR, OR, OСНO, OCOR, OCOOR, OCONHR, OCONH2, NHR, NHCOH, NHCOR, NHSO2R, NH-COOR, NH-CO-NHR или NHCONH2, а значения R, R6 и R7 имеют определенные выше значения;
R3 означает атом водорода;
А означает связь между двумя атомами углерода, несущими группы R1 и R2, или группу 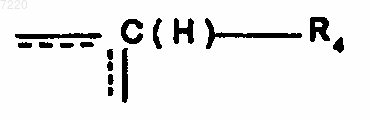 , где R4 означает атом водорода или группу (CH2)n'1R5, где n'1 и R5 имеют определенные выше значения, пунктир означает возможную дополнительную связь между одним или другим атомами углерода, несущими заместители R1 и R2,
, где R4 означает атом водорода или группу (CH2)n'1R5, где n'1 и R5 имеют определенные выше значения, пунктир означает возможную дополнительную связь между одним или другим атомами углерода, несущими заместители R1 и R2,
n равно 1,
X означает двухвалентную группу -C(O)-B-, связанную с атомом азота через атом углерода, В означает двухвалентную группу -O-(CH2)n"-, связанную с карбонилом через атом кислорода, или группу -NR8-(CH2)n"-, связанную с карбонилом через атом азота, n'' равно 0, и R8 выбирают из группы, образованной радикалом Y, OY, Y1 и OY1,
Y выбирают из группы, образованной радикалами СОН, COR, COOR, CONH2, CONHR, CONHOH, CONHSO2R, CH2COOH, CH2COOR, CH2CONHOH, CH2CONHCN, СН2тетразол, защищенный СН2тетразол, CH2SO3H, CH2SO2R, CH2PO(OR)2, CH2PO(OR)(OH), CH2PO(R)(OH) и CH2PO(OH)2,
Y1 выбирают из группы, образованной радикалами SO2R, SO2NHCOH, SO2NHCOR, SO2NHCOOR, SO2NHCONHR, SO2NHCONH2 и SO3H, при этом R имеет значение, указанное выше;
при условии, что если А означает группу 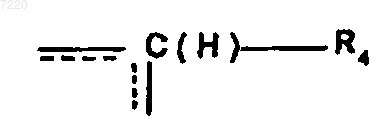 , в которой R4 является атомом водорода, и X означает группу -C(O)-O-(CH2)n", тогда R1, R2 и R3 все три одновременно не могут означать атом водорода,
, в которой R4 является атомом водорода, и X означает группу -C(O)-O-(CH2)n", тогда R1, R2 и R3 все три одновременно не могут означать атом водорода,
а также фармацевтически приемлемых солей указанных соединений для получения лекарственного средства, предназначенного для ингибирования продукции b -лактамаз патогенными бактериями.
2. Применение по п.1 соединений формулы (I), а также их фармацевтически приемлемых солей, ингибирующих продукцию b -лактамаз патогенными бактериями, для получения лекарственного средства, предназначенного для лечения бактериальных инфекций у людей и животных.
3. Применение по п.1 или 2, отличающееся тем, что R8 означает радикал Y, Y1 и OY1, причем Y и Y1 имеют значения, определенные в п.1.
4. Применение по любому из пп.1-3, отличающееся тем, что А означает группу 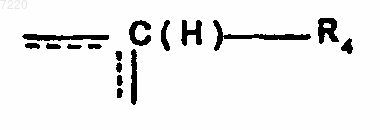 , где R4 означает атом водорода, R2 означает атом водорода и В означает группу -NR8-(CH2) n"-, где n'' равно 0 и R8 означает радикал OY1.
, где R4 означает атом водорода, R2 означает атом водорода и В означает группу -NR8-(CH2) n"-, где n'' равно 0 и R8 означает радикал OY1.
5. Применение по любому из пп.1-4, отличающееся тем, что соединения выбирают из списка, содержащего следующие соединения:
цис-7-оксо-6-окса-1-азабицикло[3.2.1]октан-4-пропановая кислота,
дифенилметиловый эфир транс-7-оксо-6-окса-1-азабицикло[3.2.1]октан-4-уксусной кислоты,
дифенилметиловый эфир цис-7-оксо-6-окса-1-азабицикло[3.2.1]октан-4-уксусной кислоты,
фенилметиловый эфир транс-3-бензоил-2-оксо-1,3-диазабицикло[2.2.1]гептан-6-карбоновой кислоты,
фенилметиловый эфир транс-2-оксо-3-(сульфокси)-1,3-диазабицикло[2.2.1]гептан-6-карбоновой кислоты,
6-[[(4-метилфенил)сульфонил]окси]-1,6-диазабицикло[3.2.1]октан-7-он,
6-[(метилсульфонил)окси]-1,6-диазабицикло[3.2.1]октан-7-он,
6-[[(4-нитрофенил)сульфонил]окси]-1,6-диазабицикло[3.2.1]октан-7-он,
дифенилметиловый эфир транс-7-оксо-6-окса-1-азабицикло[3.2.1]октан-2-карбоновой кислоты,
(4-нитрофенил)метил-транс-7-оксо-6-окса-1-азабицикло[3.2.1]октан-2-карбоксилат,
транс-7-оксо-6-окса-1-азабицикло[3.2.1]октан-2-карбоновая кислота,
фенилметил-транс-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксилат,
фенилметил-транс-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксилат,
фенилметил-транс-7-оксо-6-[(фенилсульфонил)окси]-1,6-диазабицикло[3.2.1]октан-2-карбоксилат,
фенилметил-транс-7-оксо-6-[(2-тиэнилсульфонил)окси]-1,6-диазабицикло[3.2.1]октан-2-карбоксилат,
транс-6-бензоил-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновая кислота,
метил-транс-6-бензоил-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксилат,
транс-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
транс-7-оксo-N-(фенилметил)-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
транс-7-оксо-N-(2-пиридинилметил)-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
транс-7-оксo-N-[2-(3-пиридинил)этил]-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
транс-7-оксo-N-[2-(4-пиридинил)этил]-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
транс-7-оксo-N-[2-(2-пиридинил)этил]-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
транс-N-[3-(аминокарбонил)фенил]-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
транс-N-[4-(диметиламино)фенил]-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
транс-N-[3-(диметиламино)фенил]-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
транс-7-оксo-N-[(4-пиридинил)метил]-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
транс-7-оксо-N-(3-пиридинилметил)-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
транс-N-(1-амино-1-оксо-3-фенил-2-пропил)-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
транс-N-(2-амино-2-оксоэтил)-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
транс-N-[3-[(аминокарбонил)амино]фенил]-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
транс-N-(2-амино-2-оксо-1-фенилэтил)-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
2-амино-2-оксоэтиловый эфир транс-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты,
2-(4-пиридинил)этиловый эфир транс-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбонотющ кислоты,
2-(2-пиридинил)этиловый эфир транс-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты,
6-(сульфокси)-1,6-диазабицикло[3.2.1]окт-3-ен-7-он,
3-метокси-6-(сульфокси)-1,6-диазабицикло[3.2.1]окт-3-ен-7-он, а также их соли.
6. Применение по любому из пп.1-5, отличающееся тем, что соединение выбирают из группы, образованной транс-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамидом и его солями.
7. Применение по любому из пп.1-6, отличающееся тем, что соединение формулы (I) комбинируют с антибиотиком типа b -лактаминов для получения лекарственного средства, предназначенного для одновременного, раздельного или разнесенного во времени введения активных компонентов в антибактериальной терапии.
8. Применение по п.7, отличающееся тем, что соединение формулы (I) комбинируют с антибиотиком типа пенициллинов, цефалоспоринов, карбапенемов или монобактамов.
9. Применение по п.8, отличающееся тем, что соединение формулы (I) комбинируют с антибиотиком типа цефалоспоринов.
10. Применение по п.9, отличающееся тем, что транс-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид или одну из его солей комбинируют с цефтазидимом.
11. Фармацевтические композиции, содержащие в качестве активных компонентов ингибитор b -лактамазы формулы (I), определенной в п.1, и лекарственное средство типа b -лактаминов.
12. Фармацевтические композиции по п.11, содержащие в качестве активных компонентов ингибитор b -лактамазы формулы (I), определенной в п.1, и лекарственное средство типа пенициллинов, цефалоспоринов, карбапенемов или монобактамов.
13. Фармацевтические композиции по п.11, содержащие в качестве активных компонентов ингибитор b -лактамазы формулы (I), определенной в п.1, и лекарственное средство типа цефалоспоринов.
14. Композиция по п.12, содержащая в качестве активных компонентов транс-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид или одну из его солей и цефтазидим.
Текст
007220 Настоящее изобретение относится к применению гетероциклических соединений, которые обладают свойствами ингибиторов -лактамаз и, таким образом, представляют интерес для борьбы с инфекционными заболеваниями или для их профилактики, в форме комбинаций с различными антибиотическими соединениями типа -лактаминов с целью повышения их эффективности для борьбы с патогенными бактериями, продуцирующими -лактамазы. Известно, что ферментативная инактивация антибиотиков типа -лактаминов, как соединений типа пенициллинов, так и цефалоспоринов, является препятствием для указанного типа соединений при лечении бактериальных заболеваний. Указанная инактивация представляет собой процесс деградации лактаминов и является одним из механизмов, в результате которых бактерии могут стать резистентными к лечению. Желательно нейтрализовать указанный ферментативный процесс, присоединяя к антибактериальному агенту типа -лактаминов другой агент, способный ингибировать фермент. Если ингибитор лактамазы применяют в комбинации с антибиотиком типа -лактаминов, то можно повысить его эффективность по отношению к некоторым микроорганизмам. Таким образом, для получения лекарственного средства, предназначенного для ингибирования продукции -лактамаз патогенными бактериями, в настоящем изобретении предлагаются соединения формулы (I)R выбирают из группы, образованной алкильным радикалом, содержащим от 1 до 6 атомов углерода, не обязательно замещенным пиридильным или карбамоильным радикалом, -СН 2-алкенильным радикалом, содержащим в сумме от 3 до 9 атомов углерода, арилом, содержащим от 6 до 10 атомов углерода,или аралкилом, содержащим от 7 до 11 атомов углерода, при этом ядро арильного или аралкильного радикала не обязательно замещено радикалом ОН, NH2, NO2, алкилом, содержащим от 1 до 6 атомов углерода, алкоксигруппой, содержащей от 1 до 6 атомов углерода, или одним или несколькими атомами галогена,R6 и R7, одинаковые или разные, выбирают из группы, образованной атомом водорода, алкильным радикалом, содержащим от 1 до 6 атомов углерода, арилом, содержащим от 6 до 10 атомов углерода, и аралкилом, содержащим от 7 до 11 атомов углерода, не обязательно замещенными карбамоильным радикалом, уреидогруппой или диметиламиногруппой, и алкильным радикалом, содержащим от 1 до 6 атомов углерода и замещенным пиридильным радикалом,n' равно 1 или 2, и R5 выбирают из группы, образованной радикалами COOH, CN, ОН, NH2, CONR6R7, COOR, OR, OСНO, OCOR, OCOOR, OCONHR, OCONH2, NHR, NHCOH, NHCOR, NHSO2R, NHCOOR, NH-CONHR или NHCONH2, а значения R, R6 и R7 определены выше;R2 означает атом водорода или группу (CH2)n'1R5, где n'1 равно 0, 1 или 2, и значение R5 указано выше;R3 означает атом водорода или алкильный радикал, содержащий от 1 до 6 атомов углерода; А означает связь между двумя атомами углеродами, несущими группы R1 и R2, или группу, где R4 обозначает атом водорода или группу (CH2)n'1R5, где n'1 и R5 имеют указанные выше значения, пунктир означает возможную дополнительную связь с одним или другим атомом углерода,несущим заместители R1 и R2,n равно 1 или 2,X означает двухвалентную группу -C(O)-B-, связанную с атомом азота через атом углерода, В означает двухвалентную группу -O-(CH2)n"-, связанную с карбонилом через атом кислорода, группу -NR8(CH2)n"- или -NR8-O-, связанную с карбонилом через атом азота, n равно 0 или 1, а для случая -NR8(CH2)n-R8 выбирают из группы, образованной водородом, радикалом ОН, R, OR, Y, OY, Y1, OY1, Y2,OY2, Y3, OCH2CH2SOmR, OSiRaRbRc и SiRaRbRc, а для случая -NR8-O-R8 выбирают из группы, образованной водородом, радикалом R, Y, Y1, Y2, Y3 и SiRaRbRc, при этом Ra, Rb и Rc индивидуально означают линейный или разветвленный алкильный радикал, содержащий от 1 до 6 атомов углерода, или арильный радикал, содержащий от 6 до 10 атомов углерода, причем R имеет значение, указанное выше, a m равно 0, 1 или 2,Y выбирают из группы, образованной радикалами СОН, COR, COOR, CONH2, CONHR, CONHOH,CONHSO2R, CH2COOH, CH2COOR, CH2CONHOH, CH2CONHCN, СН 2 тетразол, защищенный СН 2 тетразол, CH2SO3H, CH2SO2R, CH2PO(OR)2, CH2PO(OR)(OH), CH2PO(R)(OH) и CH2PO(OH)2,Y1 выбирают из группы, образованной радикалами SO2R, SO2NHCOH, SO2NHCOR, SO2NHCOOR,-1 007220R1, R2 и R3 все три одновременно не означают атом водорода, пой,лом, если n равно 1, а А означает группу, в которой R4 является атомом водорода и либо X означает группу -С(О)-О-(CH2)n, в которой n равно 0 или 1,либо X означает группу -CO-NR8-(CH2)n, в которой n равно 1 и R8 является изопропильной груплибо X означает группу -CO-NR8-(CH2)n, в которой n равно 0 и R8 является водородом или фени а также соли указанных соединений с основаниями или минеральными или органическими кислотами, а также внутренние соли, которые они могут образовать при необходимости. Соединения формулы (I) и их соли описаны и заявлены в международной заявке PCT/FR 01/02418,поданной 24 июля 2001 г. с приоритетом в соответствии с заявкой на патент Франции 0010121, поданной 1 августа 2000 г. Соединения формулы (I) существуют в виде чистых энантиомеров, или чистых диастереоизомеров,или в виде смеси энантиомеров, в частности рацематов, или смесей диастереоизомеров. Кроме того, индивидуальные заместители R1, R2, R4, с одной стороны, и X, с другой стороны, могут находиться в циси/или транс-положении по отношению к циклу, в котором они находятся, и, таким образом, соединения формулы (I) могут находиться в виде цис-изомеров, или транс-изомеров, или смесей изомеров. Под алкильным радикалом, содержащим от 1 до 6 атомов углерода, понимают метильный, этильный радикал, а также пропильный, бутильный, пентильный или гексильный, линейный, разветвленный или циклический радикал. Под -СН 2-алкенильным радикалом, содержащим от 3 до 9 атомов углерода, понимают, например,аллильный радикал или бутенильный, пентенильный или гексенильный радикал. Под арильным радикалом, содержащим от 6 до 10 атомов углерода, понимают фенильный или нафтильный радикал. Под аралкильным радикалом, содержащим от 7 до 11 атомов углерода, понимают бензильный, фенетильный или метилнафтильный радикал. Под алкилокси, содержащим от 1 до 6 атомов углерода, понимают, в частности, метокси-, этокси-,пропокси-, изопропоксигруппу, а также бутокси-, изобутокси-, втор-бутокси- или трет-бутоксигруппу. Под атомом галогена понимают атом фтора, хлора, брома или иода. Под скваратом понимают радикал формулы Среди кислотно-аддитивных солей продуктов формулы (I) можно привести, среди прочих, соли,образованные с минеральными кислотами, такими как соляная, бромисто-водородная, иодистоводородная, серная или ортофосфорная, или с органическими кислотами, такими как муравьиная, уксусная, трифторуксусная, пропионовая, бензойная, малеиновая, фумаровая, янтарная, винная, лимонная,щавелевая, глиоксиловая, аспарагиновая кислота, алкансульфоновые кислоты, такие как метансульфокислота и этансульфокислота, арилсульфоновые кислоты, такие как бензолсульфокислота и паратолуолсульфокислота. Среди основно-аддитивных солей продуктов формулы (I) можно привести, среди прочих, соли, образованные с минеральными основаниями, такими как, например, гидроксид натрия, калия, лития, кальция, магния или аммония, или с органическими основаниями, такими как, например, метиламин, пропиламин,триметиламин,диэтиламин,триэтиламин,N,N-диметилэтаноламин,трис(гидроксиметил)аминометан, этаноламин, пиридин, пиколин, дициклогексиламин, морфолин, бензиламин, прокаин, лизин, аргинин, гистидин, N-метилглюкамин, а также соли фосфония, такие как алкилфосфоний,арилфосфоний, алкиларилфосфоний, алкениларилфосфоний или соли четвертичных аммониев, такие как соль тетра-н-бутиламмония. Объектом настоящего изобретения является применение соединений формулы (I), а также их фармацевтически приемлемых солей для получения лекарственного средства, предназначенного для ингибирования продукции -лактамаз патогенными бактериями. Еще одним объектом настоящего изобретения является применение соединений формулы (I), а также их фармацевтически приемлемых солей, ингибирующих продукцию -лактамаз патогенными бактериями, с целью получения лекарственного средства, предназначенного для лечения инфекционных-2 007220 заболеваний у людей и животных. Объектом настоящего изобретения является, в частности, вышеозначенное применение, отличающееся тем, что в соединениях, соответствующих формуле (I), n равно 1 и А и R2 имеют определенные выше значения, R3 означает атом водорода, R1 означает атом водорода, радикал COOR или CONR6R7, гдеR6 и R7 имеют определенные выше значения и X означает группу -C(O)-B-, где В означает группу -O(СН 2)n"- или -NR8-(CH2)n", n" равно 0 и R8 имеет значения, которые определены выше, например, значения Y, Y1 и OY1, и, в частности, в соединениях, соответствующих формуле (I), А означает группу, где R4 означает атом водорода, R2 означает атом водорода и В означает группу -NR8-(CH2)n"-,где n равно 0 и R8 означает радикал OY1. Объектом настоящего изобретения является, в частности, вышеозначенное применение, отличающееся тем, что соединения выбирают из списка, содержащего следующие соединения: цис-7-оксо-6-окса-1-азабицикло[3.2.1]октан-4-пропановая кислота,дифенилметиловый эфир транс-7-оксо-6-окса-1-азабицикло[3.2.1]октан-4-уксусной кислоты,дифенилметиловый эфир цис-7-оксо-6-окса-1-азабицикло[3.2.1]октан-4-уксусной кислоты,фенилметиловый эфир транс-3-бензоил-2-оксо-1,3-диазабицикло[2.2.1]гептан-6-карбоновой кислоты,фенилметиловый эфир транс-2-оксо-3-(сульфокси)-1,3-диазабицикло[2.2.1]гептан-6-карбоновой кислоты,6-(4-метилфенил)сульфонил]окси]-1,6-диазабицикло[3.2.1]октан-7-он,6-[(метилсульфонил)окси]-1,6-диазабицикло[3.2.1]октан-7-он,6-(4-нитрофенил)сульфонил]окси]-1,6-диазабицикло[3.2.1] октан-7-он,дифенилметиловый эфир транс-7-оксо-6-окса-1-азабицикло[3.2.1]октан-2-карбоновой кислоты,(4-нитрофенил)метил-транс-7-оксо-6-окса-1-азабицикло[3.2.1]октан-2-карбоксилат,транс-7-оксо-6-окса-1-азабицикло[3.2.1]октан-2-карбоновая кислота,фенилметил-транс-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксилат,фенилметил-транс-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксилат,фенилметил-транс-7-оксо-6-[(фенилсульфонил)окси]-1,6-диазабицикло[3.2.1]октан-2-карбоксилат,фенилметил-транс-7-оксо-6-[(2-тиэнилсульфонил)окси]-1,6-диазабицикло[3.2.1]октан-2-карбоксилат,транс-6-бензоил-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновая кислота,метил-транс-6-бензоил-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксилат,транс-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,транс-7-оксо-N-(фенилметил)-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,транс-7-oкco-N-(2-пиридинилметил)-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,транс-7-оксо-N-[2-(3-пиридинил)этил]-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,транс-7-оксо-N-[2-(4-пиридинил)этил]-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,транс-7-оксо-N-[2-(2-пиридинил)этил]-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,транс-N-[3-(аминокарбонил)фенил]-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,транс-N-[4-(диметиламино)фенил]-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,транс-N-[3-(диметиламино)фенил]-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,транс-7-oксо-N-[(4-пиридинил)метил]-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,транс-7-oксо-N-(3-пиридинилметил)-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,транс-N-(1-амино-1-оксо-3-фенил-2-пропил)-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2 карбоксамид,транс-N-(2-амино-2-оксоэтил)-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,транс-N-[3-[(аминокарбонил)амино]фенил]-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2 карбоксамид,транс-N-(2-амино-2-оксо-1-фенилэтил)-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,2-амино-2-оксоэтиловый эфир транс-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты,2-(4-пиридинил)этиловый эфир транс-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2 карбоновой кислоты,2-(2-пиридинил)этиловый эфир транс-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]октан-2 карбоновой кислоты,6-(сульфокси)-1,6-диазабицикло[3.2.1]окт-3-ен-7-он,3-метокси-6-(сульфокси)-1,6-диазабицикло[3.2.1]окт-3-ен-7-он, а также их соли.-3 007220 Объектом настоящего изобретения является также вышеозначенное применение, отличающееся тем, что в составе лекарственного средства, соединение формулы (I) объединяют с антибиотиком типа лактаминов, выбранным из группы, состоящей из пенамов, пенемов, карбапенемов, цефемов, карбацефемов, оксацефемов, цефамицинов и монобактамов. Под -лактаминами понимают, например, пенициллины, такие как амоксициллин, ампициллин, азлоциллин, мезлоциллин, апалциллин, гетациллин, бакампициллин, карбенициллин, сульбенициллин, тикарциллин, пиперациллин, азлоциллин, мециллинам, пивмециллинам, метициллин, циклациллин, талампициллин, аспоксициллин, оксациллин, клоксациллин, диклоксациллин, флюклоксациллин, нафциллин или пивампициллин, цефалоспорины, такие как цефалотин, цефалоридин, цефаклор, цефадроксил, цефамандол, цефазолин, цефалексин, цефрадин, цефтизоксим, цефокситин, цефацетрил, цефотиам, цефотаксим, цефсулодин, цефоперазон, цефтизоксим, цефменоксим, цефметазол, цефалоглицин, цефонисид, цефодизим, цефпиром, цефтазидим, цефтриаксон, цефпирамид, цефбуперазон, цефозопран, цефепим, цефозелис, цефлупренам, цефузонам, цефпимизол, цефклидин, цефиксим, цефтибутен, цефдинир, цефподоксим аксетил, цефподоксим проксетил, цефтерам пивоксил, цефетамет пивоксил, цефкапен пивоксил или цефдиторен пивоксил, цефуроксим, цефуроксим аксетил, лоракарбацеф, латамоксеф, карбапенемы, такие как имипенем, меропенем, биапенем или панипенем и монобактамы, такие как азтреонам и карумонам, а также их соли. Соединения формулы (I) или их фармацевтически приемлемые соли могут быть введены одновременно с принятием антибиотиков типа -лактаминов, или отдельно, предпочтительно после антибиотиков. Это можно осуществить в виде смеси двух активных компонентов или в виде фармацевтической комбинации двух отдельных активных компонентов. Дозировка соединений формулы (I) и их фармацевтически приемлемых солей может варьировать в широких пределах, и в каждом отдельном случае должна быть приспособлена к индивидуальным условиям и к патогенному агенту, продуцирующему -лактамазы. В общем случае подходящей является суточная доза, составляющая от 0,1 до приблизительно 10 г. Кроме того, отношение ингибитора -лактамазы формулы (I) или его фармацевтически приемлемой соли к антибиотику типа -лактаминов может также варьировать в широких пределах, и в каждом отдельном случае должно быть приспособлено к индивидуальным условиям. В общем случае указанное отношение должно составлять от приблизительно 1:20 до приблизительно 1:1. Лекарственные средства, которые определены выше, применяют в виде фармацевтических композиций в смеси с инертным фармацевтическим органическим или минеральным наполнителем, пригодным для требуемого способа введения, и эти фармацевтические композиции также являются объектом настоящего изобретения. Указанные композиции могут быть твердыми или жидкими и иметь вид фармацевтических форм,используемых в настоящее время в медицине, таких как, например, обычные или дражированные таблетки, желатиновые капсулы, гранулы, суппозитории, инъецируемые препараты, мази, кремы, гели; их готовят в соответствии с обычными методами. Активный(ые) компонент(ы) может (могут) быть смешаны с наполнителями, обычно применяемыми в фармацевтических композициях, такими как тальк, гуммиарабик, лактоза, крахмал, стеарат магния, масло какао, водные или неводные носители, жиры и масла животного или растительного происхождения, парафиновые производные, гликоли, различные смачиватели, диспергаторы или эмульгаторы и консерванты. Указанные композиции могут также иметь форму лиофилизата, предназначенного для растворения в соответствующем носителе непосредственно перед употреблением, например, таком как стерильная апирогенная вода. Соединения формулы (I) могут быть получены по способу, включающему: а) стадию, в ходе которой агент карбонилирования вводят в реакцию, в случае необходимости, в присутствии основания, с соединением формулы (II) где R'1 означает атом водорода или радикал CN, защищенную группу COOH, COOR', (CH2) n'R'5, CONR6,n', R6 и R7 имеют определенные выше значения и R' и R'5 имеют, соотR7 или защищенную группу ветственно, указанные выше значения R и R5, в которых возможные реакционноспособные функциональные группы могут быть защищены;R'2 означает атом водорода или группу (CH2) n'1R'5, n'1 и R'5 имеют определенные выше значения;R3 имеет определенное выше значение; А' означает связь между двумя атомами углерода, несущими заместители R'1 и R'2, или группу, где R'4 означает атом водорода или группу (CH2)n'1R'5, где n'1 и R'5 имеют определенные выше значения, пунктир означает возможную связь с одним или другим атомами углерода, несущими заместители R'1 и R'2;N имеет определенное выше значение;HZ означает группу НО-(CH2)n"-, NHR'8-(CH2)n"- или NHR'8-O-, где n имеет определенное выше значение и R'8 означает атом водорода, защищенный радикал ОН, радикал R', OR', радикал Y' или OY',причем Y' выбирают из групп СОН, COR', COOR', CONH2, CONHR', защищенной группы CONHOH,CONHSO2R', защищенной группы CH2COOH, CH2COOR', защищенной группы CH2CONHOH,CH2CONHCN, СН 2 тетразола, замещенного группой R', CH2SO2R', CH2PO(OR')2, защищенной группыCH2PO(OH)2, радикала Y'1 или OY'1, причем Y'1 выбирают из групп SO2R', SO2NHCOH, SO2NHCOR',SO2NHCOOR', SO2NHCONH2, SO2NHCONHR' и защищенной группы SO3H, радикала Y'2 или OY'2, гдеY'2 означает защищенную группу PO(OH)2, защищенную группу PO(OH)(OR'), защищенную группуPO(OH)R' или группу PO(OR')2, или радикал Y'3, причем Y'3 выбирают из защищенного тетразола, тетразола, замещенного радикалом R', NH-или NR'-защищенного тетразола, NH- или NR'-тетразола, замещенного радикалом R', NHSO2R' и NR'SO2R', где R' имеет определенное выше значение; с целью получения промежуточного соединения формулы (III) где R'1, R'2, R3, А' и n имеют те же значения, что и выше и либо X1 является атомом водорода и X2 представляет собой группу -Z-CO-X3, при этом X3 представляет собой остаток агента карбонилирования, либо X2 представляет собой группу -ZH и X1 представляет собой группу CO-X3, при этом X3 имеет определенное выше значение;b) стадию, в ходе которой в присутствии основания циклизуют полученное ранее промежуточное соединение; иc) в случае необходимости, стадии а) предшествуют и/или за стадией b) следуют одна или несколько следующих реакций, в соответствующем порядке: защита реакционноспособных функциональных группировок,удаление защиты реакционноспособных функциональных групп,этерификация,омыление,сульфатирование,фосфатирование,амидирование,ацилирование,сульфонилирование,алкилирование,введение двойной связи,образование группы мочевины,введение тетразольной группы,восстановление карбоновой кислоты,дегидратация амида в нитрил; образование соли,ионный обмен,расщепление или разделение диастереоизомеров; окисление сульфида в сульфоксид и/или сульфон. В качестве агента карбонилирования можно использовать такой реагент, как фосген, дифосген,трифосген, арилхлорформиат, такой как фенилхлорформиат или п-нитрофенилхлорформиат, аралкилхлорформиат, такой как бензилхлорформиат, алкил или алкенилхлорформиат, такой как метилхлорформиат или аллилхлорформиат, алкилдикарбонат, такой как трет-бутилдикарбонат, диимидазол-карбонил и их смеси. Предпочтительно реакцию проводят в присутствии основания или смеси оснований, которые нейтрализуют образующуюся кислоту. Основание может, в частности, являться амином, таким как триэтиламин, диизопропилэтиламин, пиридин, диметиламинопиридин. Тем не менее, в качестве основания можно использовать исходный продукт формулы II. Его берут в избытке. Пояснения приводятся в экспериментальной части. В случае необходимости продукт формулы II используют в виде кислотно-5 007220 аддитивной соли, например, гидрохлорида или трифторацетата. В качестве основания на стадии b) можно также использовать амины, или гидриды, алкоголяты,амиды или карбонаты щелочных или щелочно-земельных металлов. Амины можно выбрать, например, из нижеприведенного списка. В качестве гидрида можно также использовать гидрид натрия или калия. В качестве алкоголята щелочного металла предпочтительно используют трет-бутилат калия. В качестве амида щелочного металла можно, в частности, использовать бис(триметилсилил)амид лития. В качестве карбоната можно, в частности, использовать карбонат или бикарбонат натрия или калия. В случае необходимости, промежуточное соединение формулы III может быть получено в виде кислотно-аддитивной соли, образованной в процессе реакции карбонилирования, и, в частности, гидрохлорида. Далее, в этой же форме его используют в реакции циклизации. В случае необходимости, циклизацию можно осуществить без выделения промежуточного соединения формулы III. Реакции, упомянутые на стадии с), являются, как правило, обычными реакциями, хорошо известными специалисту. Реакционноспособными функциональными группами, которые в случае необходимости защищают защитными группами, являются реакционноспособные функциональные группы карбоновых кислот,аминов, амидов, гидрокси и гидроксиламинов. Защиту кислотной функциональной группы осуществляют, в частности, в виде сложных алкиловых эфиров, сложных аллиловых эфиров, бензила, бензгидрила или п-нитробензила. Удаление защиты осуществляют омылением, кислотным гидролизом, гидрогенолизом или расщеплением при помощи растворимых комплексов Palladium O. Примеры указанных защитных групп и удаления защиты приведены ниже в экспериментальной части. Защиту аминов и амидов осуществляют, в частности, в виде бензилированных производных, в виде карбаматов, в частности, аллил-, бензил-, фенил- или трет-бутилкарбаматов или в виде силильных производных, таких как производные трет-бутилдиметил-, триметил-, трифенил- или даже дифенил-третбутилсилила. Удаление защиты осуществляют в зависимости от типа защитной группы с помощью натрия или лития в жидком аммиаке, гидрогенолизом или при помощи растворимых комплексов Palladium O действием кислоты или действием фторида тетрабутиламмония. Примеры приведены ниже в экспериментальной части. Защиту гидроксиламинов осуществляют, в частности, в виде сложных бензиловых или аллиловых эфиров. Расщепление сложных эфиров осуществляют гидрогенолизом или при помощи растворимых комплексов Palladium O. Пояснения приведены далее в экспериментальной части. Защиту спиртов осуществляют традиционным способом в виде простых эфиров, сложных эфиров или карбонатов. Простые эфиры могут быть простыми алкиловыми или алкоксиалкиловыми эфирами,предпочтительно, простыми метиловыми или метоксиэтоксиметиловыми эфирами, простыми ариловыми эфирами или, предпочтительно, простыми ариловыми эфирами аралкила, например, бензила, или силильными простыми эфирами, например, силильными производными, приведенными выше. Сложные эфиры могут быть любыми способными расщепляться сложными эфирами, известными специалисту, и предпочтительно ацетатом, пропионатом или бензоатом или п-нитробензоатом. Карбонаты могут, например, быть метил-, трет-бутил-, аллил-, бензил- или п-нитробензилкарбонатами. Удаление защиты осуществляют способами, известными специалисту, в частности, омылением,гидрогенолизом, расщеплением растворимых комплексов Palladium O, гидролизом в кислой среде или обработкой фторидом тетрабутиламмония в случае силильных производных. Примеры приведены в экспериментальной части. Реакцию сульфатирования осуществляют действием комплексов SO3-амины, таких как SO3 пиридин или SO3-диметилформамид, в пиридине, а полученную соль, например, соль пиридина, можно затем обменять, например, на соль другого амина, четвертичного аммония или щелочного металла. Примеры приведены в экспериментальной части. Реакцию фосфатирования осуществляют, например, действием хлорфосфата, такого как диметил-,дибензил- или дифенилхлорфосфат. Реакцию амидирования осуществляют, вначале обрабатывая карбоновую кислоту активатором, таким как алкилхлорформиат или EDCI, а затем действуют гидроксидом аммония или подходящим амином или его кислотно-аддитивной солью. Примеры приведены далее в экспериментальной части. Реакции ацилирования и сульфонилирования проводят на гидроксимочевинах соответственно действием соответствующего галогенангидрида или ангидрида карбоновой кислоты или соответствующего галогенангидрида сульфоновой кислоты. Примеры приведены далее в экспериментальной части.-6 007220 Реакцию алкилирования осуществляют действием на гидроксильные производные галогеналкила или галогеналкила, замещенного, в частности, свободным или этерифицированным карбоксильным радикалом. Пояснения приведены далее в экспериментальной части. Возможное введение в конце двойной связи, которая находится, предпочтительно, между атомами углерода, несущими заместители R4 и R1, осуществляют действием галогенпроизводного селена с последующим окислением по известным специалисту способам. Пример приведен далее в экспериментальной части. Образование карбамидной группы, которая относится к заместителю R8, осуществляют предпочтительно действием соответствующего изоцианата на свободную группу NH. Пример приведен далее в экспериментальной части. Введение тетразольной группы осуществляют действием галогенпроизводного, предпочтительно фторпроизводного, защищенного или замещенного тетразола. Удаление защиты можно осуществить гидрогенолизом. Восстановление кислот в спирты можно осуществить действием борана или, через стадию образования промежуточного смешанного ангидрида, действием боргидрида щелочного металла. Смешанный ангидрид готовят, например, с помощью алкилхлорформиата. Пояснения приведены далее в экспериментальной части. Дегидратация амида в нитрил может проходить в условиях реакций карбонилирования и циклизации. Окисление сульфидов в сульфоксид и/или сульфон можно осуществить действием надкислоты, такой как мета-хлорнадбензойная или надфталевая кислота, или любого другого реагента, известного специалисту. Получение солей кислот в случае необходимости осуществляют добавлением кислоты в растворимой фазе к соединению. Образование солей с основаниями может быть осуществлено для соединений,содержащих кислотную группу, в частности, карбоксильную группу, либо для соединений, содержащих сульфоксигруппу или производное фосфорной кислоты, или для соединений, содержащих гетероцикл,обладающий кислотными свойствами. В первом случае реакцию осуществляют добавлением соответствующего основания, приведенного выше. Во втором случае получают непосредственно соль пиридиния во время действия комплекса SO3-пиридин и получают другие соли из указанной соли пиридиния. В том или другом случае можно также осуществить ионный обмен на смоле. Примеры получения солей приведены далее в экспериментальной части. Разделение энантиомеров и диастереоизомеров можно осуществить в соответствии с методами, известными специалисту, в частности хроматографией. Помимо способов, описанных выше, соединения формулы (I) могут быть получены по способам, в которых вначале используют соединение формулы (II), где R'1, A', R'2, R3 и HZ имеют такие значения,которые приводят непосредственно (без трансформации) к значениям в соединениях, которые хотят получить. В случае необходимости те из указанных значений, которые содержат реакционноспособные функциональные группы, упомянутые выше, защищают, при этом удаление защиты происходит после стадии циклизации b или в любой другой подходящий момент при проведении синтеза. Защиту группы и удаление защиты осуществляют, как описано выше. Подобные способы приведены далее в экспериментальной части. Продукты формулы (II) известны или их получают в соответствии со способами, известными специалисту. Ссылки на литературу, а также способы получения приведены далее в экспериментальной части. Следующие примеры поясняют изобретение, но не ограничивают его. Примеры В указанных примерах используют следующие сокращения:DEAD: диэтиловый эфир азодикарбоновой кислотыSIMS: масс-спектрометрия на вторичных ионах (ВИМС)FAB: бомбардировка быстрыми атомами Пример 1. Дифенилметиловый эфир цис-7-оксо-6-окса-1-азабицикло[3.2.1]октан-4-пропановой кислоты. Смешивают 3,16 г (10,6 ммоль) гидрохлорида 3-оксо-1-(фенилметил)-4-пиперидинпропановой кислоты (М=297,7 г) (приводится в заявке на патент Японии J54098-772) и 100 мл этанола и охлаждают до-7 007220 температуры 10C. В токе азота добавляют в течение 15 мин 1,84 г NaBH4, при этом температуру поддерживают в интервале от 8 до 13C. Дают нагреться до комнатной температуры и оставляют на 1 ч 30 мин. Добавляют еще 380 мг NaBH4 и оставляют на ночь при комнатной температуре. Выпаривают растворитель при пониженном давлении, остаток растворяют в 50 мл воды и понижают рН с 10 до 2 с помощью концентрированной соляной кислоты. Снова выпаривают при пониженном давлении. Твердый остаток (приблизительно 10,8 г) промывают два раза 100 мл этанола, затем растворитель выпаривают при пониженном давлении. Таким образом получают 3,10 г гидрохлорида 3-гидрокси-1-(фенилметил)-4-пиперидинпропановой кислоты (М=299,7 г), что соответствует выходу 97%. Разводят 3,10 г (10,3 ммоль) ранее полученного соединения в 100 мл этанола, затем добавляют 900 мг предварительно насыщенного водородом 10%-ного Pd/C в 30 мл этанола. Оставляют на ночь в атмосфере водорода при нормальном давлении, затем удаляют катализатор фильтрованием, а этанол выпаривают при пониженном давлении. Получают 1,90 г гидрохлорида транс-3-гидрокси-4-пиперидинпропановой кислоты (М=209,6 г), выход 88%. Смешивают 1,79 г (8,54 ммоль) ранее полученного соединения с 20 мл этанола и 20 мл воды. Затем добавляют концентрированный раствор гидроксида натрия до тех пор, пока уровень рН не составит приблизительно 8,5. Затем добавляют 1 мл аллилового эфира хлормуравьиной кислоты и концентрированный раствор гидроксида натрия, чтобы сохранять рН в интервале от 8 до 9. Реакционную смесь экстрагируют этилацетатом, затем водную фазу подкисляют до уровня рН 2 добавлением концентрированной соляной кислоты и повторно экстрагируют этилацетатом. После сушки и выпаривания растворителя при пониженном давлении получают 1,69 г сырого продукта, который снова помещают в смесь дихлорметана и этанола, затем отфильтровывают и выпаривают растворитель при пониженном давлении. Таким образом получают 1,40 г транс-3-гидрокси-1-[(2-пропенилокси)карбонил]-4-пиперидинпропановой кислоты (М=257 г) с выходом 60%. Растворяют 3,24 г (12,6 ммоль) полученной ранее гидроксикислоты и 6,4 г трифенилфосфина в 60 мл ТГФ при температуре 0C в атмосфере азота. Затем добавляют 2,5 мл DEAD и через 15 мин реакционную смесь выпаривают при пониженном давлении и получают 12 г сырого продукта. Очищают хроматографией на силикагеле с элюированием смесью дихлорметана и этилацетата в градиенте 9/1, 8/2, 7/3,чтобы отделить цис- и транс-лактоны. Получают 2,72 г цис-лактона в смеси с небольшим количеством DEAD и оксидом фосфина. Указанный продукт растворяют в 10 мл диметоксиэтана и добавляют 8 мл раствора 1 н. NaOH. После взаимодействия в течение 1 ч реакционную смесь экстрагируют два раза этилацетатом, затем подкисляют до уровня рН 2 2 н. HCl и повторно экстрагируют этилацетатом. После сушки и выпаривания растворителя при пониженном давлении получают 1,07 г гидроксикислоты. 1,0 г сырой гидроксикислоты растворяют в смеси 5 мл дихлорметана и 2 мл метанола, затем обрабатывают избытком дифенилдиазометана в дихлорметане до исчезновения исходного продукта. Растворитель выпаривают при пониженном давлении и продукт очищают хроматографией, получая 1,39 г дифенилметилового эфира цис-3-гидрокси-1-[(2-пропенилокси)карбонил]-4-пиперидинпропановой кислоты(М=423 г) с общим выходом 26%. Далее в атмосфере азота растворяют 1,2 г (2,83 ммоль) полученного ранее продукта в 23 мл дихлорметана. Затем добавляют 390 мкл уксусной кислоты, 860 мкл Bu3SnH и 70 мг Pd (PPh3)4. Растворитель выпаривают при пониженном давлении и получают 3,82 г сырого продукта, который промывают петролейным эфиром. Получают 1,27 г продукта, который фильтруют на силикагеле с использованием дихлорметана, затем со смесью дихлорметана и метанола 95/5, затем 90/10. Таким образом получают 0,87 г дифенилметилового эфира цис-3-гидрокси-4-пиперидинпропановой кислоты (М=339 г) с выходом 77%. Растворяют 400 мг (1,00 ммоль) ранее полученного соединения в 25 мл дихлорметана, добавляют 80 мкл дифосгена (Cl3COCOCl), 336 мкл TEA, 144 мг DMAP. Оставляют взаимодействовать при комнатной температуре в течение 5 ч 30 мин, затем разбавляют дихлорметаном. Промывают 10%-ным водным раствором винной кислоты, затем фосфатным буферным раствором натрия с рН 7, органическую фазу сушат над сульфатом натрия, затем выпаривают растворитель при пониженном давлении. Таким образом получают 380 мг сырого продукта. Очищают хроматографией на силикагеле с элюированием смесью дихлорметан/этилацетат 95/5 с добавкой 0,1% воды. Получают 184 мг целевого соединения (М=365,43 г), выход 50%. Спектр 1H-ЯMP (CDCl3, 300 МГц), химические сдвиги в м.д. и мультиплетность пиков: 1,60-1,88-8 007220 Масс-спектр (электрораспыление с положительной ионизацией) m/z: [M]+ = 365. Пример 1 bis. Цис-7-оксо-6-окса-1-азабицикло[3.2.1]октан-4-пропановая кислота. Растворяют 176 мг (0,482 ммоль) полученного ранее продукта в 10 мл ацетона. Добавляют 90 мг 10%-ного Pd/C. Оставляют взаимодействовать в атмосфере водорода при нормальном давлении в течение 3 ч. Далее добавляют еще 25 мг катализатора и проводят реакцию еще в течение 1 ч 15 мин. Катализатор отфильтровывают, затем выпаривают растворитель при пониженном давлении и получают 146 мг продукта. Повторяют реакцию в 10 мл ацетона с 35 мг 10%-ного Pd/C в атмосфере водорода и проводят реакцию в течение 1 ч до ее завершения. Затем катализатор отделяют фильтрованием и фильтрат упаривают при пониженном давлении. Получают 137 мг сырого продукта, который перекристаллизовывают из смеси этилового эфира и петролейного эфира. Таким образом получают 75 мг целевого продукта (M=199 г) с выходом 78%. Спектр 1H-ЯMP (CDCl3, 250 МГц), химические сдвиги в м.д. и мультиплетность пиков: 1,30-1,63 (м) и 1,88 (м): NCH2-CH2-CH; 2,25 (т): CH2-CH2-CO; 3,06 (т) и 3,38 (м): CH2-N-CH2; 4,65 (д): C-CHO-CH2; 12,08 (с): H подвижный. ИК-спектр (вазелиновое масло): 1785, 1717 см-1 Масс-спектр (FAB) m/z: [M+H]+ = 200; 159 Пример 2. Дифенилметиловый эфир транс-7-оксо-6-окса-1-азабицикло[3.2.1]октан-4-уксусной кислоты. Смешивают в инертной атмосфере 94 мг (0,259 ммоль) гидрохлорида дифенилметилового эфира транс-3-гидрокси-4-пиперидинуксусной кислоты (М=361,87 г) (описано в Eur. J. Med. Chem - Chim. Ther- 1982 - 17(6)531-5) и 7 мл дихлорметана. Охлаждают на бане со льдом и вносят 19 мкл дифосгена. Перемешивают в течение 25 мин, затем добавляют 72 мкл TEA. Перемешивают при комнатной температуре в течение 30 мин и растворитель выпаривают при пониженном давлении. Затем добавляют 7 мл толуола. Добавляют 36 мкл TEA, затем 31 мг DMAP. Нагревают в течение 15 мин до температуры 100C, затем оставляют при комнатной температуре. Далее промывают 2 раза по 4 мл 10%-ным раствором винной кислоты в воде, затем 4 мл насыщенного раствора хлорида натрия в воде. Сушат над сульфатом магния, фильтруют и растворитель выпаривают при пониженном давлении. Получают 78 мг масла, которое хроматографируют на силикагеле, используя в качестве элюента смесь 95/5 дихлорметана и этилацетата. Таким образом получают 35,7 мг целевого соединения (М=351,405 г) в виде кристаллов белого цвета (выход 39%). Пример 2 bis. Транс-7-оксо-6-окса-1-азабицикло[3.2.1]октан-4-уксусная кислота. Смешивают в инертной атмосфере 38,7 мг (0,110 ммоль) продукта, полученного в примере 2, а также 2 мл ацетона и 38 мг 10%-ного Pd/C в качестве катализатора. Помещают в атмосферу водорода при нормальном давлении. Оставляют взаимодействовать в течение 45 мин, затем удаляют катализатор фильтрованием и растворитель выпаривают при пониженном давлении. Таким образом получают 32,6 мг сырого продукта. Перекристаллизовывают в этиловом эфире и получают 14,2 мг целевого соединения в виде кристаллов белого цвета (C8H10NO4- М=185,181 г) с выходом 69%. Пример 3. Дифенилметиловый эфир цис-7-оксо-6-окса-1-азабицикло[3.2.1]октан-4-уксусной кислоты. Смешивают 1,5 г (5,78 ммоль) транс-1-[(1,1-диметилэтокси)карбонил]-3-гидрокси-4-пиперидинуксусной кислоты (приводится в Eur. J. Med. Chem - Chim. Ther - 1982 - 17(6)531-5), 7 мл дихлорметана,3,03 г трифенилфосфина и 22 мл тетрагидрофурана. Добавляют раствор 0,91 мл DEAD в 2,5 мл тетрагидрофурана. Оставляют взаимодействовать в течение 3 ч 20 мин, затем добавляют 8,7 мл 1 н. гидроксида натрия и перемешивают в течение 1 ч 15 мин. Реакционную смесь экстрагируют 2 раза этилацетатом, затем доводят до рН 2 при помощи 2 н. соляной кислоты. Затем экстрагируют три раза этилацетатом. Органические фазы объединяют и промывают в насыщенном растворе хлорида натрия в воде, затем сушат над сульфатом магния, фильтруют и растворитель выпаривают при пониженном давлении. Таким образом получают 1,37 г кристаллов белого цвета 1,1-диметилэтил-(3 а.альфа.,7 а.альфа.)гексагидро-2-оксо-фуро[2,3-с]пиридин-6(2H)-карбоксилата (C12H21NO5-M=259,304 г) с выходом 91%. Смешивают в инертной атмосфере 1,37 г (5,28 ммоль) ранее полученного соединения и 32 мл дихлорметана. Вводят избыток раствора дифенилдиазометана в дихлорметане до исчезновения исходного продукта. Затем выпаривают растворитель при пониженном давлении и, таким образом, получают 2,81 г сы-9 007220 рого продукта, который очищают хроматографией на силикагеле, используя в качестве элюента дихлорметан, а затем смесь 95/5 дихлорметан/этилацетат. Получают 2,00 г дифенилметилового эфира цис-1-[(1,1-диметилэтокси)карбонил]-3-гидрокси-4 пиперидинуксусной кислоты в виде кристаллов белого цвета (М=425,528 г) с выходом 89%. Помещают 0,6 г (1,41 ммоль) ранее полученного соединения и 1,93 мл 7,3 M раствора хлорида водорода в метаноле. Перемешивают при комнатной температуре и через 15 мин добавляют 1 мл дихлорметана. Еще через 15 мин реакционную смесь упаривают при пониженном давлении. Вновь добавляют дихлорметан, затем снова упаривают. Эту операцию повторяют несколько раз. Затем продукт перекристаллизовывают из этилового эфира. Таким образом, получают 0,44 г гидрохлорида дифенилметилового эфира цис-3-гидрокси-4 пиперидинуксусной кислоты с общей формулой C20H23NO3, HCl (М=361,871 г) с выходом 86%. Указанная реакция приводит также к образованию различных количеств лактона гидрохлорида(3 а.альфа.,7 а.альфа.)-гексагидрофуро[2,3-c]пиридин-2(3H)-она, (М=177,6 г). Смешивают в инертной атмосфере 0,28 г (0,77 ммоль) ранее полученного соединения С 20 Н 23NО 3,НСl и 19 мл дихлорметана. Добавляют при температуре 0C 60 мкл дифосгена и перемешивают. Через 25 мин вводят 0,32 млTEA. Затем добавляют 94 мг DMAP и выдерживают при комнатной температуре. Перемешивают в течение 4 ч 15 мин, затем последовательно промывают 10%-ным водным раствором винной кислоты и насыщенным раствором хлорида натрия в воде. Затем сушат над сульфатом магния, фильтруют и растворитель выпаривают при пониженном давлении. Таким образом получают 0,265 г целевого соединения с общей формулой C21H21NO4 (М=351,405 г) с выходом 98%. Спектр 1H-ЯMP (CDCl3, 250 МГц), химические сдвиги в м.д. и мультиплетность пиков: 1,82 (м):NCH2-CH2; 2,30-2,70 (м): CO-CH2-CH; 2,93 (д) - 2,99 (дт) и 3,45 (м): CH2-N-CH2; 4,60 (д): CH-CHO-CH2; 6,87 (с): CO2CH(C6H5)2; 7,10-7,35 (м): (C6H5)2. ИК-спектр (CHCl3): 1786, 1734; 1600, 1587, 1496 см-1. Масс-спектр (ВИМС) m/z: [M+Na]+ = 374+. Пример 3 bis. Цис-7-оксо-6-окса-1-азабицикло[3.2.1]октан-4-уксусная кислота. Смешивают 55 мг (0,156 ммоль) продукта, полученного в примере 3, 3 мл этилацетата и 55 мг катализатора 10%-ного Pd/C. Помещают в атмосферу водорода при нормальном давлении. Оставляют взаимодействовать в течение 1 ч 30 мин, затем катализатор отфильтровывают и выпаривают растворитель при пониженном давлении. Таким образом получают 38 мг сырого продукта, который перекристаллизовывают из смеси пентана и этилового эфира. Таким образом получают 16 мг целевого соединения в виде кристаллов белого цвета (М=185,181 г) с выходом 55%. Спектр 1H-ЯMP (CDCl3, 250 МГц), химические сдвиги в м.д. и мультиплетность пиков: 1,63-1,86 (м) и 1,91 (м): NCH2-CH2; 2,27-2,49 (м) и 2,54 (дд): CO-CH2-CH; 2,98 (д) и 3,54 (д): CH2-N-CH2-CH2; 3,04 (дт) и 3,41 (дд): CH2-N-CH2-CH2; 4,71 (д): CH-CHO-CH2. ИК (вазелиновое масло): 1784, 1734, 1686 см-1. Масс-спектр (ВИМС) m/z: [M+H]+ = 186+, 167+. Пример 3 ter. Метиловый эфир цис-7-оксо-6-окса-1-азабицикло[3.2.1]октан-4-уксусной кислоты. Растворяют 78 мг (0,421 ммоль) соединения, полученного в примере 3bis, в 1 мл дихлорметана. По каплям добавляют избыток диазометана до тех пор, пока не появится желтое окрашивание, затем растворитель выпаривают при пониженном давлении. Получают 80 мг сырого продукта, который очищают хроматографией на силикагеле с элюированием смесью дихлорметан/этилацетат 95/5. Указанным образом получают 8,2 мг целевого соединения (М=199,208 г) с выходом 10%. Пример 4. Цис-7-оксо-6-окса-1-азабицикло[3.2.1]октан-4-ацетонитрил. Растворяют 67 мг (0,38 ммоль) гидрохлорида (3 а.альфа.,7 а.альфа.)-гексагидрофуро[2,3-c]пиридин 2(3H)-она, (М=177,6 г), полученного в примере 3, в 1 мл 4,17 M раствора аммиака в метаноле. Перемешивают в течение 5 ч, растворитель выпаривают при пониженном давлении, затем снова добавляют 1 мл раствора аммиака в метаноле и продолжают реакцию в течение 18 ч. Растворитель выпаривают при пониженном давлении и получают таким образом 79 мг цис-3 гидрокси-4-пиперидинацетамида с общей формулой C7H14O2N2 (M=158 г). Смешивают в инертной атмосфере 75 мг полученного ранее соединения в 9 мл дихлорметана. Охлаждают на бане со льдом и вводят 30 мкл дифосгена. Выдерживают при температуре от 0 до 5C в течение 40 мин, затем добавляют 0,16 мл TEA и через 5 мин 46 мг DMAP.- 10007220 Перемешивают в течение 4 ч при комнатной температуре. Промывают два раза по 2 мл 10%-ным раствором винной кислоты в воде, затем 2 мл насыщенного раствора хлорида натрия в воде. Сушат над MgSO4, фильтруют, растворитель выпаривают при пониженном давлении. Получают 35 мг сырого продукта, который растворяют в смеси 30/70 этилацетата и дихлорметана. Осадок отфильтровывают и фильтрат упаривают при пониженном давлении. Указанным образом получают 23 мг целевого соединения (М=166,18 г) в виде масла с выходом приблизительно 26%. ИК (вазелиновое масло): 2241, 1777 см-1. Масс-спектр (EI) m/z: [M]+ = 166, 137, 82, 55, 42. Пример 5. 3-Бензоил-1,3-диазабицикло[2.2.1]гептан-2-он. Смешивают в инертной атмосфере 1,01 г (5,43 ммоль) 1,1-диметилэтилового эфира 3-амино-1 пирролидинкарбоновой кислоты (М=186,25 г) (приводится в международной заявке на патент WO 9801426) и 10 мл дихлорметана, раствор охлаждают до температуры 0C, затем по каплям добавляют 0,76 мл TEA. Перемешивают в течение 15 мин, поддерживая температуру 0C, затем добавляют 0,63 мл хлористого бензоила. Выдерживают при комнатной температуре, затем разбавляют добавлением 10 мл дихлорметана. Далее промывают 10%-ным водным раствором винной кислоты, затем 10 мл воды. Сушат над сульфатом магния, фильтруют и удаляют дихлорметан выпариванием при пониженном давлении. Получают 1,30 г 1,1-диметилэтилового эфира 3-(бензоиламино)-1-пирролидинкарбоновой кислоты(М=292,36 г) в виде масла желтого цвета. Выход 82%. Смешивают 1,30 г (4,46 ммоль) указанного соединения с 10 мл метанола. Раствор охлаждают до температуры 0C, затем постепенно вводят 6,12 мл 7,3 M раствора хлористого водорода в метаноле. Затем растворитель выпаривают при пониженном давлении. Таким образом получают 1,01 г гидрохлорида N-(3-пирролидинил)бензамида (М=226,707 г),имеющего вид масла каштанового цвета с выходом, близким к 100%. Смешивают в инертной атмосфере 1,01 г (4,46 ммоль) ранее полученного соединения, а также 10 мл дихлорметана. Охлаждают до температуры 0C, затем по каплям добавляют 1,36 мл TEA. Перемешивают в течение 15 мин, затем по каплям добавляют 1,44 мл дифосгена. Поддерживают температуру 0C в течение 30 мин, затем дают подняться до комнатной температуры. Далее разбавляют дихлорметаном, промывают 10%-ным водным раствором винной кислоты, затем водой. Сушат над сульфатом магния, фильтруют и концентрируют выпариванием растворителя при пониженном давлении и получают 0,615 г сырого продукта. Очищают хроматографией на силикагеле с элюированием смесью 90/10 дихлорметан/ацетон. Указанным образом выделяют 0,320 г хлорида 3-(бензоиламино)-1-пирролидинкарбоновой кислоты, которую перекристаллизовывают. Выход 28%. Далее растворяют в инертной атмосфере 0,585 г (2,31 ммоль) указанного выше соединения в 18 мл тетрагидрофурана. Раствор охлаждают до температуры -78C, затем добавляют по каплям 2,55 мл 1M раствора бис(триметилсилил)амида лития в тетрагидрофуране. Получают раствор желтого цвета, температуру которого поддерживают на уровне -78 С в течение 20 мин, затем продолжают перемешивать в течение 1 ч, повышая температуру. Добавляют при температуре 0C 350 мкл уксусной кислоты, затем 5 мл 10%-ный раствор винной кислоты в воде. Растворяют в этилацетате, затем промывают 10%-ным раствором винной кислоты, фосфатным буферным раствором с рН=7, затем водой. Органическую фазу сушат над сульфатом магния, фильтруют и концентрируют выпариванием растворителя при пониженном давлении. Получают 0,315 г сырого продукта в виде твердого вещества желтого цвета. Указанный сырой продукт очищают хроматографией на силикагеле с элюированием смесью 90/10 дихлорметана и этилацетата. Указанным образом получают 0,140 г целевого соединения C12H12N2O2 (М=216,24 г) в виде твердого вещества белого цвета с выходом 28%. ИК (CHCl3): 1801, 1775, 1675; 1620, 1603, 1582 см-1. Масс-спектр (электрораспыление с положительной ионизацией) m/z: [M]+ = 216, 105, 77. Пример 6. Калиевая соль транс-6-[(фенилметокси)карбонил]-2-оксо-1,3-диазабицикло[2.2.1]гептан 3-уксусной кислоты. Смешивают 1 г (3,12 ммоль - М=186,25 г) 1-(1,1-диметилэтил)ового и 2-(фенилметил)ового эфира- 11007220 транс-4-амино-1,2-пирролидиндикарбоновой кислоты (приводится в J. Org. Chem. 1991, 56, 3009-3016),10 мл тетрагидрофурана, 560 мкл аллилбромацетата и 660 мкл TEA. Перемешивают при комнатной температуре в течение 14 ч, затем в течение 3 ч при температуре 50C. Затем растворяют в этилацетате и промывают 10%-ным водным раствором винной кислоты, затем насыщенным раствором хлорида натрия в воде. Органическую фазу сушат над сульфатом магния, фильтруют, затем выпаривают растворитель при пониженном давлении. Таким образом получают 1,21 г сырого продукта, который очищают хроматографией на силикагеле с элюированием смесью 80/20 дихлорметана и этилацетата. Таким образом получают 0,99 мг 1-(1,1-диметилэтил)ового и 2-(фенилметил)ового эфира транс-4(2-пропенилокси)карбонил]метил]амино]-1,2-пирролидиндикарбоновой кислоты с общей формулойC12H30N2O6 (М=418 г). К 0,99 г (2,36 ммоль) ранее полученного соединения в атмосфере азота и при температуре 0C добавляют 6 мл 4 М раствора хлористого водорода в этилацетате. Затем оставляют взаимодействовать при комнатной температуре в течение 15 мин. Растворитель выпаривают при пониженном давлении. Получают сырой продукт, который перекристаллизовывают из этилового эфира и получают 0,95 г дихлоргидрата фенилметилового эфира транс-4(2-пропенилокси)карбонил]метил]амино]-2-пирролидиндикарбоновой кислоты с общей формулойC17H23N2O4, 2HCl (М=394 г). 0,5 г указанного продукта растворяют в 20 мл дихлорметана и добавляют 1,3 мл 2 н. гидроксида натрия и 3 мл воды. Декантируют, экстрагируют дихлорметаном, сушат над сульфатом магния, затем фильтруют и выпаривают растворитель при пониженном давлении. Таким образом получают 339 мг свободного диамина. Выход составляет 83%. Растворяют 100 мг (0,314 ммоль) ранее полученного диамина в 5 мл ацетонитрила при температуре 0C и в атмосфере азота. Добавляют 21 мкл дифосгена. После взаимодействия в течение 15 мин к указанному раствору в атмосфере азота и в течение 4 ч добавляют смесь, содержащую 38 мг DMAP, 88 мкл TEA в 10 мл ацетонитрила, нагретую до температуры 70C. После завершения добавления реакционную смесь снова нагревают в течение часа, затем охлаждают, разбавляют этилацетатом и промывают последовательно 10%-ным водным раствором винной кислоты, затем насыщенным раствором хлорида натрия в воде. После сушки над сульфатом натрия, фильтрования и выпаривания растворителей при пониженном давлении получают 58 мг сырого продукта. Указанный продукт очищают хроматографией на силикагеле с элюированием смесью дихлорметан/этилацетат 8/2 и получают 19 мг 2-пропенилового эфира транс-6-[(фенилметокси)карбонил]-2-оксо 1,3-диазабицикло[2.2.1]гептан-3-ацетата с общей формулой C18H20N2O5 (М=344,57 г) с выходом 17%. Затем растворяют 24 мг (0,069 ммоль) вышеуказанного соединения в 250 мкл дихлорметана. Добавляют 3 мг Рd(РРh3)4 в атмосфере азота, затем добавляют 150 мкл 0,5 M раствора этил-2-гексаноата калия в этилацетате. Через несколько минут образуется осадок, который центрифугируют и промывают два раза 500 мкл этилацетата. Получают 24 мг целевого соединения, C15H15KN2O5 (М=342 г), с количественным выходом. Спектр 1H-ЯMP (DMSO, 300 МГц), химические сдвиги в м.д. и мультиплетность пиков: 1,83 (ддд) и 2,56: N-CH2-CHN-CH2; 2,50 и 2,79 (д): N-CH2-CHN-CH2; 3,23 (д) и 3,41 (д): =СN-CH2-C=O; 3,62 (ддд):O=C-CHN-CH2; 4,13 (с): N-CH2-CHN-CH2; 5,16 (с): =С-O-СН 2-С 6 Н 5; 7,38 (м): С 6H5-CH2. Масс-спектр (электрораспыление с положительной ионизацией) m/z: [2MK+H]+ = 723, [2MK+Na]+ = 707, [MK+K]+ = 381, [MK+Na]+ = 365; [MK+H]+ = 343. Пример 7. Метиловый эфир транс-3-бензоил-2-оксо-1,3-диазабицикло[2.2.1]гептан-6-карбоновой кислоты. Смешивают в атмосфере азота 0,471 г (1,93 ммоль) 1-(1,1-диметилэтил)ового и 2-метилового эфира транс-4-амино-1,2-пирролидиндикарбоновой кислоты (приводится в J. Org. Chem. 1991, 56, 3009-3016) и 3,5 мл сухого дихлорметана для его растворения. Раствор охлаждают до температуры 0C, затем добавляют по каплям 269 мкл TEA. Перемешивают в течение 15 мин, поддерживая температуру при 0C, затем добавляют по каплям 224 мкл хлористого бензоила. Затем дают температуре подняться до 20C в течение часа. Разбавляют 30 мл дихлорметана, затем промывают 10%-ным водным раствором винной кислоты,затем насыщенным раствором бикарбоната натрия, затем водой. Сушат над сульфатом магния, фильтруют, концентрируют выпариванием дихлорметана при пониженном давлении. Таким образом получают 0,6 г масла желтого цвета, которое очищают хроматографией на силикагеле, используя в качестве элюента смесь дихлорметан/метанол 99/1. Таким образом выделяют 0,499 г 1-(1,1-диметилэтил)ового и 2-метилового эфира транс-4- 12007220(бензоиламино)-1, 2-пирролидиндикарбоновой кислоты с общей формулой C18H24N2O5 (М=348 г) с выходом 74%. Смешивают в атмосфере азота 0,400 г (1,15 ммоль) ранее полученного соединения с 3 мл этилацетата, чтобы растворить указанное соединение, затем раствор охлаждают до температуры 0C, добавляют 2,89 мл 4 M раствора хлористого водорода в этилацетате. Через 15 мин продолжают перемешивать при комнатной температуре в течение 1 ч. Затем растворитель удаляют выпариванием при пониженном давлении. Таким образом получают 0,350 г гидрохлорида метилового эфира транс-4-(бензоиламино)-2 пирролидиндикарбоновой кислоты с общей формулой C13H15N2O3, HCl (М=284,744 г) в виде твердого вещества бежевого цвета. Смешивают 0,327 г (1,15 ммоль) ранее полученного соединения, помещенного в атмосферу азота, с 4 мл дихлорметана. Суспензию охлаждают до температуры 0C, затем добавляют 352 мкл TEA. Перемешивают в течение 15 мин при температуре 0C, затем добавляют 138 мкл дифосгена. Продолжают перемешивать в течение 5 мин при температуре 0C, затем реакционной смеси дают нагреться до комнатной температуры и оставляют на 30 мин. Далее разбавляют дихлорметаном и промывают 10%-ным водным раствором винной кислоты, затем водой и сушат над сульфатом магния. Фильтруют и удаляют растворитель выпариванием при пониженном давлении. Таким образом получают 0,360 г сырого продукта, который очищают хроматографией на силикагеле с элюированием смесью дихлорметан/ацетон 95/5. Указанным образом получают 93,7 мг гидрохлорида метилового эфира транс-4-(бензоиламино)-1(хлоркарбонил)-2-пирролидиндикарбоновой кислоты (C14H14N2O4, HCl (М=310,74 г с выходом 2 6%. Смешивают 93,7 мг (0,301 ммоль) ранее полученного соединения в атмосфере азота с 3 мл тетрагидрофурана. Понижают температуру раствора до -78 С, затем по каплям добавляют 332 мкл бис(триметилсилил)амида лития в 1M растворе в тетрагидрофуране и температуру реакционной смеси поддерживают при -78C еще в течение 5 мин. Перемешивают в течение 30 мин при комнатной температуре. Затем раствор охлаждают до температуры 0C и добавляют 55 мкл уксусной кислоты. Добавляют 20 мл этилацетата и 4 мл фосфатного буферного раствора с рН=7,0. Декантируют, промывают водой,сушат над сульфатом магния, фильтруют, концентрируют выпариванием. Таким образом получают 76 мг пены, которую очищают хроматографией на силикагеле с элюированием смесью дихлорметан/ацетон 97/3. Выделяют 5 мг чистого целевого соединения с общей формулой (C14H14N2O4, HCl (М=274,279 г с выходом 6%. ИК (CHCl3): 1805, 1779, 1743, 1669; 1603, 1589, 1486 см-1. Масс-спектр (EI) m/z: [M]+ = 274, 215, 169, 105, 77. Пример 7 bis. Фенилметиловый эфир транс-3-бензоил-2-оксо-1,3-диазабицикло[2.2.1]гептан-6 карбоновой кислоты. Повторяют условия примера 7, взяв в качестве исходного 0,92 г 1-(1,1-диметилэтил)ового и 2 метилового эфира транс-4-амино-1,2-пирролидиндикарбоновой кислоты (приводится в J. Org. Chem. 1991, 56, 3009-3016), и получают целевое соединение с общим выходом 5,4% в 4 стадии. Пример 8. Фенилметиловый эфир транс-2-оксо-3-(фенилсульфонил)-1,3-диазабицикло[2.2.1]гептан 6-карбоновой кислоты. Смешивают в атмосфере азота 2,97 г 1-(1,1-диметилэтил)ового и 2-метилового эфира (9,26 ммоль) транс-4-амино-1,2-пирролидиндикарбоновой кислоты (приводится в J. Org. Chem. 1991, 56, 3009-3016) с общей формулой C17H24N2O4 (М=320,392 г) и добавляют 25 мл дихлорметана. Охлаждают до температуры 5 С и добавляют 1,3 мл TEA. Перемешивают в течение 10 мин и затем добавляют 1,63 г бензолсульфохлорида. Продолжают перемешивать при температуре 5C в течение 15 мин, затем температуру реакционной смеси поднимают до 20C в течение 45 мин. Разбавляют с помощью дихлорметана, промывают 10%-ным водным раствором винной кислоты,затем фосфатным буферным раствором с рН=7,0, затем насыщенным раствором хлорида натрия в воде. Сушат над сульфатом магния и растворитель выпаривают при пониженном давлении. Таким образом получают 4,5 г сырого продукта, который хроматографируют на силикагеле с элюированием смесью 90/10 дихлорметана и этилацетата. Также выделяют 4,06 г 1-(1,1-диметилэтил)ового и 2-(фенилметил)ового эфира транс-4[(фенилсульфонил)амино]-1,2-пирролидиндикарбоновой кислоты с общей формулой C23H28N2O6S(М=460,552 г), что соответствует выходу 95%. Смешивают 3,83 г (8,31 ммоль) полученного ранее сульфонамида с 10 мл безводного метанола. Раствор охлаждают до температуры 0C и добавляют при указанной температуре 8,2 мл 10 M раствора соляной кислоты в метаноле.- 13007220 Оставляют перемешивать при температуре 0C в течение 5 мин, затем температуру повышают до комнатной. Через 30 мин выпаривают метанол при пониженном давлении, растворяют несколько раз в метаноле, затем в дихлорметане. Затем перекристаллизовывают гидрохлорид из этилового эфира. Таким образом получают 3,2 г гидрохлорида фенилметилового эфира транс-4-[(фенилсульфонил)амино]-2-пирролидиндикарбоновой кислоты с общей формулой C18H20N2O4S, HCl(M=396,896 г), что соответствует выходу 96%. Смешивают 2,78 г (7 ммоль) полученного ранее гидрохлорида в инертной атмосфере с 28 мл дихлорметана. Затем охлаждают до температуры от 0 до 5C, затем добавляют 2,15 мл TEA. Продолжают перемешивать в течение 15 мин при температуре в интервале от 0 до 5 С, затем добавляют 0,46 мл дифосгена. Указанную температуру поддерживают в течение 4 мин, затем добавляют 10%-ный водный раствор винной кислоты, разбавляют дихлорметаном, декантируют, промывают насыщенным раствором хлорида натрия в воде, сушат над сульфатом магния и концентрируют при пониженном давлении. Таким образом получают 3,1 г масла желтого цвета, которое очищают хроматографией на силикагеле с элюированием смесью дихлорметан/этилацетат 9/1. Выделяют 1,82 г фенилметилового эфира транс-1-(хлоркарбонил)-4-[(фенилсульфонил)амино]-2 пирролидиндикарбоновой кислоты с общей формулой C19H19ClN2O5S (М=422,89 г), что соответствует выходу 61%. Смешивают 1,81 г (4,28 ммоль) полученного ранее карбамоилхлорида в инертной атмосфере и 31 мл тетрагидрофурана. Полученный раствор охлаждают до температуры -70C, затем при указанной температуре в течение 10 мин добавляют 4,7 мл 1M раствора бис(триметилсилил)амида лития в тетрагидрофуране. Перемешивают в течение 45 мин при температуре -70C, затем повышают температуру до 0C. Реакционную смесь выдерживают при указанной температуре в течение 2 ч 30 мин. Затем добавляют 295 мкл уксусной кислоты. Разбавляют дихлорметаном, затем промывают 10%-ным водным раствором винной кислоты, фосфатным буферным раствором с рН=7 и насыщенным раствором хлорида натрия в воде. Сушат над сульфатом магния и упаривают досуха при пониженном давлении. Сырой продукт очищают хроматографией на силикагеле, используя в качестве элюента смесь дихлорметан/этилацетат 95/5. Таким образом получают 244 мг целевого соединения с общей формулой C19H18N2O5S (М=386,429 г), что соответствует выходу 14%. Спектр 1H-ЯMP (CDCl3, 400 МГц), химические сдвиги в м.д. и мультиплетность пиков: 2,15 (м):Bull. 43(8)1302-1306 (1995 с общей формулой C17H21NO5 (M=319,361 г) и 500 мл безводного этилового эфира. Добавляют к полученному раствору суспензию 10 г СеСl3 в 50 мл безводного этилового эфира. Перемешивают суспензию в течение 30 мин при температуре 20C, затем охлаждают до -60C. Далее добавляют 20 мл 3 М раствора MeMgBr в этиловом эфире. Оставляют взаимодействовать в течение 1 ч при температуре -60C, затем в течение 30 мин повышают температуру до 0C. Нейтрализуют 10%-ным водным раствором NH4Cl. Экстрагируют дихлорметаном, фильтруют, органическую фазу промывают водой, сушат над сульфатом магния и упаривают досуха при пониженном давлении. Таким образом получают 19,33 г масла, которое очищают хроматографией на силикагеле с элюированием смесью дихлорметан/бутилметиловый эфир 90/10. Получают 7,21 г 1-(1,1-диметилэтил)ового и 2-(фенилметил)ового эфира цис-4-гидрокси-4-метил 1,2-пирролидиндикарбоновой кислоты с общей формулой C18H25NO5 (М=335,404 г) с выходом 36%, а также 2,5 г эпимерного спирта. Смешивают в инертной атмосфере 3,17 г (9,45 ммоль) ранее полученного соединения и 70 мл дихлорметана. Охлаждают до температуры 5 С и по каплям добавляют 2,3 мл TEA, затем 1,28 мл метансульфонилхлорида. Перемешивают в течение 45 мин при температуре 5C.- 14007220 Промывают 10%-ным водным раствором винной кислоты, затем фосфатным буферным раствором с рН 7, затем водой. Органическую фазу сушат над сульфатом магния и упаривают досуха при пониженном давлении. Таким образом получают 3,9 г масла, которое очищают хроматографией на силикагеле с элюированием смесью дихлорметан/этилацетат 90/10. Получают 2,75 г 1-(1,1-диметилэтил)ового и 2-(фенилметил)ового эфира цис-4-метил-4[(метилсульфонил)окси]-1,2-пирролидиндикарбоновой кислоты с общей формулой C19H27NO7S(М=413,494 г), что соответствует выходу 70%. Получают раствор из 2,54 г (6,14 ммоль) полученного ранее мезилата в 40 мл диметилформамида. Затем при температуре 20C добавляют 519 мг (7,98 ммоль) NaN3, нагревают до 50C в течение 2 ч. После охлаждения выливают в 250 мл воды и экстрагируют 250 мл дихлорметана. Органическую фазу промывают водой. Сушат над сульфатом магния и упаривают досуха при пониженном давлении. Получают 2,4 г сырого продукта, который очищают хроматографией на силикагеле, используя в качестве элюента смесь дихлорметан/этилацетат 95/5. Таким образом получают 1,66 г 1-(1,1-диметилэтил)ового и 2-(фенилметил)ового эфира транс-4 азидо-4-метил-1,2-пирролидиндикарбоновой кислоты с общей формулой C18H24N4O4 (М=360,42 г), (титр приблизительно 30 вес.%), что соответствует выходу приблизительно 25%. Растворяют 1,85 г полученного ранее азида (то есть приблизительно 1,7 ммоль) в 18 мл толуола. Затем добавляют при температуре 20C 1,38 мл Bu3SnH и 84 мг AIBN. Температуру доводят до 75C и поддерживают ее в течение 2 ч. Выпаривают толуол и повторно растворяют в этилацетате. Добавляют насыщенный водный раствор фторида калия и перемешивают в течение 30 мин при комнатной температуре. Фильтруют через кларсель, декантируют и сушат органическую фазу над сульфатом магния. После выпаривания растворителя при пониженном давлении, получают 3 г масла, которое хроматографируют на силикагеле с элюированием смесью дихлорметан/метанол 9/1. Получают 560 мг 1-(1,1-диметилэтил)ового и 2-(фенилметил)ового эфира транс-4-амино-4-метил 1,2-пирролидиндикарбоновой кислоты с общей формулой C18H26N2O4 (М=334,419 г). Выход количественный. Смешивают в инертной атмосфере 578 мг (1,72 ммоль) полученного ранее амина в 30 мл дихлорметана. Охлаждают до температуры 5C и добавляют по каплям 290 мкл TEA, затем 240 мкл хлористого бензоила. Продолжают перемешивание при температуре 5C в течение 30 мин. Разбавляют дихлорметаном, промывают 10%-ным водным раствором винной кислоты, насыщенным водным раствором карбоната натрия, затем водой, органическую фазу сушат над сульфатом магния и растворитель выпаривают при пониженном давлении. Таким образом получают 950 мг масла, которое очищают хроматографией на силикагеле с элюированием смесью дихлорметан/этилацетат 90/10. Таким образом получают 732 мг 1-(1,1-диметилэтил)ового и 2-(фенилметил)ового эфира транс-4(бензоиламино)-4-метил-1,2-пирролидиндикарбоновой кислоты с общей формулой C25H30N2O5(М=438,528 г), что соответствует выходу 97%. Растворяют 636 мг (1,45 ммоль) полученного ранее амида в 1,9 мл этилацетата, охлаждают до температуры от 0 до 5 С на бане со льдом, затем добавляют 3,2 мл 4,6 M раствора хлористого водорода в этилацетате. Повышают температуру до 20C, затем через 1 ч растворитель выпаривают при пониженном давлении. Затем гидрохлорид перекристаллизовывают из этилового эфира. Таким образом получают 570 мг гидрохлорида транс-4-(бензиламино)-4-метил-2-пирролидинкарбоксилата фенилметила с общей формулой С 20 Н 22N2O3,НСl (М=374,87 г) в виде порошка белого цвета. Выход, таким образом, является количественным. Растворяют в инертной атмосфере 100 мг (0,267 ммоль) полученного ранее гидрохлорида в 1,5 мл дихлорметана. Охлаждают до температуры от 0 до 5 С, затем добавляют 90 мкл TEA. Перемешивают в течение 15 мин при температуре 5C, затем добавляют 20 мкл дифосгена. Продолжают перемешивать в течение 30 мин при температуре 5 С. Затем обрабатывают 10%-ным водным раствором винной кислоты, экстрагируют дихлорметаном,органическую фазу промывают насыщенным раствором хлорида натрия в воде, сушат над сульфатом магния и растворитель выпаривают при пониженном давлении. Таким образом получают 130 мг масла, которое очищают хроматографией на силикагеле с элюированием смесью дихлорметан/этилацетат 9/1. Таким образом получают 72 мг фенилметилового эфира транс-4-(бензоиламино)-1-(хлоркарбонил)4-метил-2-пирролидинкарбоновой кислоты с общей формулой C21H21N2O4Cl (M=400,865 г), что соответ- 15007220 ствует выходу 67%. Растворяют 373 мг (0,930 ммоль) полученного ранее соединения в 9 мл тетрагидрофурана. Затем раствор охлаждают до температуры -70C и добавляют в течение 5 мин 1 мл 1M раствора бис(триметилсилил)амида лития в тетрагидрофуране. Реакционную смесь оставляют нагреваться до температуры 0C в течение 45 мин, затем добавляют 69 мкл уксусной кислоты. Затем разбавляют дихлорметаном, промывают 10%-ным водным раствором винной кислоты, затем фосфатным буферным раствором с рН=7,0 и насыщенным раствором хлорида натрия в воде. Органическую фазу сушат над сульфатом магния, упаривают досуха при пониженном давлении,чтобы получить 330 мг сырого продукта, который очищают хроматографией на силикагеле с элюированием смесью дихлорметан/этилацетат 98/2, содержащей 0,1% об. TEA. Таким образом получают 123 мг целевого соединения с общей формулой C21H20N2O4 (М=364,404 г),что соответствует выходу 36%. Спектр 1H-ЯMP (CDCl3, 300 МГц), химические сдвиги в м.д. и мультиплетность пиков: 1,76 (с): СН 3; 2,11 (дд) и 2,73 (ддд): N-CH-CH2; 2,93 (дт) и 3,00 (д): N-CH2; 3,96 (ддд): N-CH-CH2; 5,21:CO2CH2C6H5; 7,36 (м): CH2C6H5; 7,43 (т) и 7,57 (т) и 7,72 (д): COC6H5. ИК (CHCl3): 1776, 1745, 1682; 1601, 1580, 1498 см-1. Масс-спектр (электрораспыление с положительной ионизацией) m/z: [2M+Na]+ = 751; [2 М+Н]+ = 729; [M+Na]+ = 387; [M+H]+ = 365. Пример 10. 1-Пропенилтрифенилфосфониевая соль фенилметилового эфира транс-2-оксо-3(сульфокси)-1,3-диазабицикло[2.2.1]гептан-6-карбоновой кислоты. Растворяют в инертной атмосфере 15 г (46,71 ммоль) 1-(1,1-диметилэтил)ового и 2-(фенилметил)ового эфира цис-4-гидрокси-1,2-пирролидинкарбоновой кислоты (промышленный продукт) с общей формулой C17H23NO5 (М=321,377 г) в 255 мл безводного дихлорметана. К раствору добавляют 5,42 мл 2,6-лутидина. Охлаждают до температуры -70C, затем в течение 5 мин вводят 8,25 мл ангидрида трифторметансульфокислоты. Перемешивают в течение 10 мин при температуре -70C, затем вводят при -70C 4,43 г Оаллилгидроксиламина. Затем реакционную смесь оставляют при комнатной температуре в течение 27 ч. Разбавляют дихлорметаном, затем промывают 10%-ным водным раствором винной кислоты, насыщенным водным раствором NаНСО 3 и водой. Органическую фазу сушат над сульфатом натрия и выпаривают растворитель при пониженном,давлении. Таким образом получают 23 г сырого масла, которое очищают хроматографией на силикагеле, используя в качестве элюента смесь дихлорметан/этилацетат в градиенте 95/5, 90/10, затем 80/20. Получают 7,18 г 1-(1,1-диметилэтил)ового и 2-(фенилметил)ового эфира транс-4-[(2-пропенилокси)амино]-1,2-пирролидинкарбоновой кислоты с общей формулой C20H28N2O5 (М=376,456 г), что соответствует выходу 40%. 3,25 г (8,63 ммоль) ранее полученного соединения растворяют в 3,5 мл этилацетата. Охлаждают до температуры от 0 до 5C, затем добавляют 19 мл 4,6 M раствора хлористого водорода в этилацетате. Оставляют взаимодействовать, перемешивая при температуре от 0 до 5C в течение 40 мин. Растворитель выпаривают при пониженном давлении, затем растворяют несколько раз в диэтиловом эфире и собирают жидкость над осадком. Таким образом получают 2,54 г гидрохлорида в виде осадка белого цвета, который растворяют в 55 мл дихлорметана при перемешивании. Добавляют 7,3 мл 2 н. гидроксида натрия. После декантирования органическую фазу сушат над сульфатом натрия. Дихлорметан выпаривают при пониженном давлении. Таким образом получают 2,12 г фенилметилового эфира транс-4-[(2-пропенилокси)амино]-2 пирролидинкарбоновой кислоты с общей формулой C15H20N2O3 (М=276,337 г) в виде масла с выходом 89%. Растворяют в инертной атмосфере 4,14 г (15 ммоль) ранее полученного соединения в 1,5 л ацетонитрила. Охлаждают до температуры от 0 до 5 С и добавляют 1,14 мл дифосгена. Перемешивают в течение 15 мин, затем последовательно добавляют 4,6 мл TEA и 1,83 г DMAP в 80 мл ацетонитрила. Температуру повышают до комнатной и оставляют взаимодействовать в течение 26 ч, затем половину растворителя выпаривают при пониженном давлении. Далее обрабатывают 10%-ным раствором винной кислоты, затем экстрагируют дихлорметаном. Органическую фазу промывают насыщенным раствором хлорида натрия в воде, сушат над сульфатом магния и растворитель выпаривают при пониженном давлении. Таким образом получают 43 г сырого продукта, который очищают хроматографией на силикагеле с элюированием смесью дихлорметан/этилацетат 90/10, с добавкой 0,1% TEA.- 16007220 Получают 312 мг фенилметилового эфира транс-2-оксо-3-(2-пропенилокси)-1,3-диазабицикло[2.2.1]гептан-6-карбоновой кислоты с общей формулой C16H18N2O4 (M=302,33 г), что соответствует выходу 7%. Растворяют в инертной атмосфере 70,2 мг (0,232 ммоль) ранее полученного соединения в 2,3 мл дихлорметана. Затем вводят 26,5 мкл уксусной кислоты и 134 мг Pd (P (Ph) 3)4. Оставляют взаимодействовать в течение 40 мин при комнатной температуре, затем понижают температуру до -20C и добавляют 2,96 мл 0,314 M раствора комплекса SO3-пиридин. Оставляют взаимодействовать в течение 2,5 ч, затем добавляют дихлорметан и реакционную смесь выпаривают при пониженном давлении. Затем растворяют в 40 мл дихлорметана и промывают 5 мл воды. Отделяют органическую фазу и сушат над сульфатом натрия, затем растворитель выпаривают при пониженном давлении. Таким образом получают 280 мг сырого продукта, который очищают хроматографией на силикагеле с элюированием последовательно смесью дихлорметан/ацетон 80/20 с добавкой 0,1% TEA, затем смесью дихлорметан/ацетон 50/50 с добавкой 0,1% TEA. Получают 34,0 мг целевого соединения с общей формулой C34H33N2O7SP (М=644,689 г) в виде масла желтого цвета с выходом 23%. Спектр 1H-ЯMP (CDCl3, 400 МГц), химические сдвиги в м.д. и мультиплетность пиков: 2,00 (м) и 2,48 (м): CH2-CH-C=O; 2,72 (д) и 3,12 (с): CH-CH2-N; 3,75 (м): CH2-CH-C=O2; 4,71 (с): CH-CH2-N; 5,18[Мкатион]+ = 303. Пример 11. 1-Пропенилтрифенилфосфониевая соль метилового эфира транс-2-оксо-3-(сульфокси)1,3-диазабицикло[2.2.1]гептан-6-карбоновой кислоты. Повторяют условия примера 10, взяв в качестве исходного 207 мг 1-(1,1-диметилэтил)ового и 2 метилового эфира цис-4-гидрокси-1,2-пирролидинкарбоновой кислоты. Таким образом получают 12 мг целевого продукта с общей формулой C7H10N2O7S (М=266,231 г). Масс-спектр (электрораспыление с отрицательной и положительной ионизацией) m/z:[Мкатион]+ = 303. Пример 12 а. Дифенилметиловый эфир транс-7-оксо-6-окса-1-азабицикло[3.2.1]октан-3-карбоновой кислоты. Смешивают в инертной атмосфере 8 мл дихлорметана и 347 мг (1 ммоль) гидрохлорида дифенилметилового эфира цис-5-гидрокси-3-пиперидинкарбоновой кислоты (приводится в Acta Chem. Scand. Ser. В 35(4) 289-294). Охлаждают до температуры 0C, затем добавляют 346 мкл TEA и 72 мкл дифосгена. Оставляют взаимодействовать в течение 15 мин, поддерживая температуру 0C, затем выпаривают растворитель при пониженном давлении. Растворяют в 25 мл сухого толуола. Фильтруют, чтобы удалить гидрохлорид TEA. К фильтрату добавляют 553 мкл TEA и нагревают до кипения в течение 4 ч. Затем разбавляют этилацетатом и промывают 10%-ным водным раствором винной кислоты, затем насыщенным раствором хлорида натрия в воде и сушат органическую фазу над сульфатом магния. Затем упаривают при пониженном давлении и получают 339 мг сырого продукта, который очищают хроматографией на силикагеле с элюированием смесью толуол/этилацетат 70/30. Таким образом получают 146 мг целевого соединения (М=337,378 г), что соответствует выходу 43%. Спектр 1H-ЯMP (CDCl3, 250 МГц), химические сдвиги в м.д. и мультиплетность пиков: 2,15 (ддд) и 2,73 (д кв): N-CH2-CHO-CH2; 2,92 (тт): O2C-CH-; 3,00 (д) и 3,45 (д): N-CH2-CHO; 3,48 (дд) и 4,07 (дд): NCH2-CH-CO2; 4,79 (дт): N-CH2-CHO; 6,90 (с): CO2-CH-(C6H5)2; 7,33 (м): (C6H5)2. ИК (CHCl3): 1792, 1734; 1600, 1585, 1497 см-1. Масс-спектр (EI) m/z: [M]+ = 337, 292, 183, 167. Пример 12b. Транс-7-оксо-6-окса-1-азабицикло[3.2.1]октан-3-карбоновая кислота. Смешивают 320 мг соединения, полученного в примере 12 а, 17 мл ацетона и 70 мг 20%-ного Pd/C в качестве катализатора. Перемешивают в атмосфере водорода при нормальном давлении. Через 2 ч 30 мин снова добавляют 70 мг катализатора и оставляют взаимодействовать в течение 1 ч 30 мин, затем фильтруют реакционную смесь. Растворитель выпаривают при пониженном давлении и таким образом получают 350 мг сырого продукта, который перекристаллизовывают из пентана. Фильтруют и, таким образом, получают 158 мг целевого продукта с общей формулой C7H9NO4(М=171,154 г) в виде твердого вещества серого цвета. Выход 89%. Спектр 1H-ЯMP (ДМСО, 300 МГц), химические сдвиги в м.д. и мультиплетность пиков: 2,10 (ддд) и- 17007220 2,43 (дм): N-CH2-CHO-CH2; 2,83 (тт): O2C-CH-; 3,13 (д) и 3,27 (дм): N-CH2-CHO; 3,40 (дд) и 3,72 (д): NCH2-CH-CO2H; 4,81 (м): N-CH2-CHO; 12,54 (уш.с): CO2H. ИК (вазелиновое масло): 1782, 1692 см-1. Масс-спектр (EI) m/z: [M]+ = 177, 155, 127, 82, 70. Пример 12 с. (4-Нитрофенил)метиловый эфир транс-7-оксо-6-окса-1-азабицикло[3.2.1]октан-3 карбоновой кислоты. Смешивают в инертной атмосфере 30 мг (0,175 ммоль) кислоты, полученной в примере 12b, и 0,5 мл дихлорметана. Затем добавляют 26,8 мг 4-нитробензилового спирта, 2,2 мг DMAP и 37 мг EDCI. Оставляют взаимодействовать в течение 2 ч при комнатной температуре. Затем органическую фазу разбавляют дихлорметаном, промывают 10%-ным водным раствором винной кислоты и фосфатным буферным раствором с рН 7. После сушки органической фазы над сульфатом натрия и выпаривания растворителя при пониженном давлении получают 57 мг сырого продукта, который очищают хроматографией на силикагеле с элюированием смесью толуол/этилацетат 85/15. Затем продукт перекристаллизовывают из смеси этилового эфира и пентана и получают 34 мг кристаллов белого цвета целевого соединения (М=306,277 г). Выход составляет 63,5%. Спектр 1H-ЯMP (CDCl3, 300 МГц), химические сдвиги в м.д. и мультиплетность пиков: 2,14 (ддд) и 2,84 (дм): N-CH2-CHO-CH2; 2,90 (тт): O2C-CH-; 3,10 и 3,49 (дм): N-CH2-CHO; 3,43 (дд) и 4,14 (уш.д): NCH2-CH-CO2; 5,27 [AB]: CO2-CH2-C6H5; 5,56 и 8,24 [АА'ВВ']: C-C6H5-NO2. ИК (CHCl3) : 1799, 1789, 1741; 1609, 1526, 1495 см-1. Масс-спектр (EI) m/z: [M]+ = 306, 170, 136, 126, 106, 82. Пример 13. 6-(Фенилметил)-1,6-диазабицикло[3.2.1]октан-7-он. Стадия А. К раствору 20,71 г 3-аминопиридина в 200 мл хлорида метилена добавляют при температуре от 0 до 5 С 30,7 мл TEA. Затем по каплям добавляют в течение 15 мин 25,5 мл хлористого бензоила и оставляют при комнатной температуре. Через 1 ч при перемешивании промывают водой, затем насыщенным раствором бикарбоната натрия, затем органическую фазу сушат над сульфатом натрия и выпаривают растворитель при пониженном давлении. Получают 42,29 г целевого продукта в виде кристаллов(М=198,226 г). Стадия В. К раствору 10 г продукта, полученного на стадии А, в 200 мл метанола добавляют 4,3 мл концентрированной соляной кислоты и 500 мг 5%-ного родия на гидроксиде алюминия. Гидрируют в атмосферу водорода с давлением 60-110 бар в течение 15 ч. Реакционную смесь фильтруют, ополаскивают метанолом, затем фильтрат концентрируют при пониженном давлении. Гидрохлорид приведенного продукта получают в смеси с 10%-ным гидрохлоридом исходного продукта. Растворяют продукт 250 мл хлорида метилена и добавляют 1,1 экв. 1 н. гидроксида натрия. После перемешивания в течение 15 мин хлорид метилена декантируют, органическую фазу промывают водой,сушат и упаривают при пониженном давлении. Остаток хроматографируют на силикагеле с элюированием смесью хлорид метилена-метанол-триэтиламин 92/8/3. Получают 7,4 г целевого продукта в виде кристаллов с выходом 72%. Стадия С. N-(фенилметил)-3-пиперидинамин. Растворяют 20 г продукта, полученного как описано на стадии В, в 600 мл 1,2-диметоксиэтана. К раствору в течение 30 мин добавляют 14,86 г алюмогидрида лития. Нагревают при перемешивании в инертном газе при температуре 75-80C в течение 16 ч, затем охлаждают до температуры 0C и в течение 45 мин, следя за тем, чтобы температура не превышала 12C, добавляют 11 мл воды. Перемешивают в течение 10 мин, фильтруют и остаток промывают хлоридом метилена. Фильтрат концентрируют при пониженном давлении. Получают 17,8 г целевого продукта в виде масла, которое перегоняют при пониженном давлении (температура кипения: 114-121 С/0,8 мбар). Получают 16 г целевого продукта с выходом 86%. Стадия D. 6-(Фенилметил)-1,6-диазабицикло[3.2.1]октан-7-он. Растворяют 1,06 г продукта, полученного на стадии С, в 28 см 3 толуола, затем охлаждают до 0C и добавляют в инертном газе 337 мкл дифосгена. Повышают температуру и выдерживают 2 ч при температуре 20C. Концентрируют при пониженном давлении, затем остаток хроматографируют на силикагеле с элюированием последовательно смесью хлорид метилена-ацетон 95/5, затем 80/20 и, наконец, смесью хлорид метилена-метанол-триэтиламин 92/8/3 и получают 362 мг целевого продукта C13H16N2OCPV Масс-спектр (EI) m/z: [M]+ = 216, 125, 91. ИК (CHCl3): 1718; 1498 см-1. Пример 14. 6-Бензоил-1,6-диазабицикло[3.2.1]октан-7-он. Стадия А. 3-(Бензиламино)-1-пиперидинкарбоновая кислота. Растворяют 5 г продукта, полученного на стадии В примера 13, в 1,25 л безводного толуола в атмосфере азота, затем добавляют 3,4 мл TEA и вводят при температуре от 0 до 5 С в течение 3 мин 1,47 мл- 18007220 дифосгена. Через 20 мин при температуре от 0 до 5C ее повышают до 20C, поддерживают при перемешивании в течение 75 мин, затем растворитель выпаривают при пониженном давлении. Остаток хроматографируют на силикагеле с элюированием смесью хлорид метилена-ацетон 8/2. Получают 3,44 г целевого продукта (выход 52,6%). Стадия В. 6-Бензоил-1,6-диазабицикло[3.2.1]октан-7-он. Вводят в атмосфере азота 48 мг гидрида натрия в виде 50%-ной дисперсии в масле и 20 мл ТГФ. Охлаждают до температуры от 0 до 5C, затем добавляют в один прием 266 мг продукта, полученного на стадии А. Температуру повышают до комнатной, затем добавляют 60 мкл уксусной кислоты и 10 мл фосфатного буферного раствора с рН 7. Далее добавляют немного этилацетата, затем декантируют и повторно экстрагируют этилацетатом. Органическую фазу сушат над сульфатом магния, затем растворители выпаривают при пониженном давлении. Сырой продукт хроматографируют на силикагеле с элюированием с добавкой 2%-ного ацетона. Таким образом получают 143 мг целевого продукта C13H12N2O2 (M: 228,25 г). Выход 62%. Спектр 1H-ЯMP (CDCl3, 250 МГц), химические сдвиги в м.д. и мультиплетность пиков: 1,20-2,15 (м) и 2,42 (м): NCH-CH2-CH2-; 2,80 (д) - 2,93 (д); 3,11 (м); 3,28-3,58 (м): CH2-N; 4,54 (м): CH-N; 7,43 (м); 7,55(м); 7, 69 (м): C6H5. ИК (CHCl3): 1758, 1672; 1605, 1586, 1492 см-1. Масс-спектр (EI) m/z: [M]+ = 230, 125, 105, 77. Пример 15. 7-Oксо-1,6-диазабицикло[3.2.1]октан-6-уксусная кислота. Стадия А. 5-[(1,1-Диметилэтил)диметилсилил]-1,6-диазабицикло[3-2-1]октан-7-он. Помещают в атмосферу азота 843 мг лития и конденсируют при температуре -70C 320 мл аммиака. Добавляют при температуре -70 С В течение 10 мин 7,56 г (34,8 ммоль) продукта, полученного в примере 13, в 160 мл тетрагидрофурана. Перемешивают в течение 5 мин, затем аммиак отгоняют в токе азота,медленно повышая температуру до 20C. В полученную суспензию медленно добавляют при 20C 7,9 г(1,1-диметилэтил)диметилсилилхлорида в 10 см 3 тетрагидрофурана, затем перемешивают в течение 10 мин. Далее добавляют 160 см 3 этилацетата, затем 60 см 3 10%-ного водного раствора винной кислоты. Декантируют, повторно экстрагируют этилацетатом, органическую фазу промывают водой, сушат над сульфатом натрия и растворитель выпаривают при пониженном давлении. Полученное масло хроматографируют на силикагеле с элюированием хлоридом метилена, содержащего 10% воды, затем смесью хлорид метилена-ацетон 8/2 и получают 3,04 г целевого продукта (выход: 36,2%). Спектр 1H-ЯMP (CDCl3, 250 МГц), химические сдвиги в м.д. и мультиплетность пиков: 0,21 (с) и 0,40 (с): SiCH3; 0,97 (с): SitBu; 1,5-1,8 (м) и 2,07 (м): N-CH-CH2-CH2-; 2,85 (д) и 3,32 (м); CH-CH2-N; 2,93(дт) и 3,32 (м): CH2-CH2-N; 3,65 (м): CH-N. ИК (CHCl3): 1710; 842 см-1. Масс-спектр (EI) m/z: [M]+ = 240, 225, 183, 100, 83, 57. Стадия В. Фенилметиловый эфир 7-оксо-1,6-диазабицикло[3.2.1]октан-6-уксусной кислоты. Растворяют в атмосфере азота 1,44 г (5,99 ммоль) продукта, полученного на стадии А, в 14,4 мл тетрагидрофурана, затем добавляют 941 мкл фенилметилового эфира бромуксусной кислоты и затем по каплям 6 мл 1 M раствора фторида тетра-н-бутиламмония в тетрагидрофуране. Перемешивают 10 мин при температуре 20C, затем разбавляют 15 мл этилацетата и добавляют 5 мл водного фосфатного буферного раствора с рН=7. Декантируют, повторно экстрагируют этилацетатом, органическую фазу промывают водой, сушат над сульфатом натрия и растворитель выпаривают при пониженном давлении. Остаток в виде масла хроматографируют на силикагеле с элюированием смесью хлорид метилена-ацетон 8/2 с добавкой 10% воды. Получают 140 мг целевого продукта. Выход составляет 9%. ИК (CHCl3): 1746; 1720 см-1. Масс-спектр (EI) m/z: [M]+ = 274, 183, 155, 139, 91, 83. Стадия С. 7-Оксо-1,6-диазабицикло[3.2.1]октан-6-уксусная кислота. Растворяют 137 мг продукта, полученного на стадии В, в 1,5 мл этилацетата, затем к раствору добавляют 14 мг 10%-ного Pd/C и помещают в атмосферу водорода. Через 15 мин снова добавляют 15 мгPd/C и перемешивают в течение 15 мин. Катализатор отфильтровывают, ополаскивают этилацетатом,затем ацетоном и метанолом и растворитель выпаривают при пониженном давлении. Получают суммарно 68 мг сырого продукта, который перекристаллизовывают из эфира. Получают 58 мг целевого продукта с общей формулой C15H18N2O3 (М=274,321 г). Выход составляет 63%. Спектр 1 Н-ЯМР (CDCl3, 400 МГц), химические сдвиги в м.д. и мультиплетность пиков: 1,48 (M),1,63 (м), 1,73 (M) и 1,86 (м): N-CH-CH2-CH2; 2,85-3,00 (м); 3,14 (дм) и 3,64 (м): CH2-N-CH2 и CH-N; 3,78 и 4,14 [AB]: CON-CH2-CO. Масс-спектр (EI) m/z: [M]+ = 184, 139, 125, 111, 97, 83. Пример 16. 7-Оксо-N-фенил-1,6-диазабицикло[3.2.1]октан-6-карбоксамид. Смешивают в инертном газе 1 мл тетрагидрофурана и 99 мг (0,41 ммоль) соединения, полученного на стадии А примера 15.- 19007220 Добавляют последовательно 50 мкл фенилизоцианата, затем 450 мкл 1M раствора фторида тетрабутиламмония в ТГФ. Оставляют взаимодействовать в течение 10 мин, затем разбавляют этилацетатом, промывают водой. Декантируют, органическую фазу сушат над сульфатом магния. Растворитель выпаривают при пониженном давлении. Указанным образом получают 140 мг сырого продукта, который очищают хроматографией на силикагеле, взяв в качестве элюента смесь дихлорметан/этилацетат 90/10. Получают 21 мг целевого соединения с общей формулой C13H15N3O (М=245,283 г), что соответствует выходу 20%. Спектр 1H-ЯMP (CDCl3, 250 МГц), химические сдвиги в м.д. и мультиплетность пиков: 1,78 (м),2,02 (м) и 2,17 (м): N-CH-CH2-CH2; 2,88 (д), 3,13 (дт) и 3,42 (м): CH2-N-CH2; 4,49 (м): CH-N; 7,11 (т); 7,34(т) и 7,54 (д): C6H5; 10,05: NH. ИК (CHCl3): 3302, 3266; 1734; 1700; 1602, 1553, 1501 см-1. Масс-спектр (EI) m/z: [M]+ = 245, 153, 126, 119, 98, 92. Пример 17 а. 6-[1-(Фенилметил)-1 Н-тетразол-5-ил]-1,6-диазабицикло[3.2.1]октан-7-он. Помещают в инертном газе 480 мг (2 ммоль) соединения, полученного на стадии А примера 15. Затем добавляют раствор 712 мг 5-фторо-1-(фенилметил)-1H-тетразола в 1,5 мл тетрагидрофурана,затем 2 мл 1 M раствора фторида тетрабутиламмония в ТГФ. Оставляют взаимодействовать в течение 1 мин. Затем разбавляют этилацетатом, промывают водой, декантируют. Органическую фазу сушат над сульфатом магния и растворитель выпаривают при пониженном давлении. Указанным образом получают 1,06 г маслянистого продукта, который очищают хроматографией на силикагеле смесью дихлорметан/этилацетат 90/10. Таким образом получают 143 мг целевого соединения с общей формулой C14H16N6O (M=284,324 г) в виде аморфного продукта белого цвета. Выход составляет 25%. Спектр 1H-ЯMP (CDCl3, 250 МГц), химические сдвиги в м.д. и мультиплетность пиков: 1,80 (м),2,04 (м) и 2,67 (м): N-CH-CH2-CH2; 2,83 (д) , 2,85 (дм), 3,10 (дд) и 3,44 (дд): CH2-N-CH2; 3,99 (м): CH-N; 5,63 и 5,88 [AB]: C6H5-CH2; 7,18 (м) и 7,32 (м): C6H5. Пример 17b. 6-(1 Н-Тетразол-5-ил]-1,6-диазабицикло[3.2.1]октан-7-он. Смешивают 120 мг продукта, полученного в примере 17 а и 2,4 мл смеси метанол/этилацетат 90/10,затем добавляют 2,4 мл ТГФ до получения прозрачного раствора. Далее добавляют 24 мг 10%-ного Pd/C в качестве катализатора и перемешивают в атмосфере водорода. После 3 ч взаимодействия катализатор отфильтровывают, ополаскивают смесью тетрагидрофуран/метанол, затем растворитель выпаривают при пониженном давлении. Далее продукт перекристаллизовывают из этилового эфира. Таким образом получают 72 мг целевого соединения с общей формулой C7H10N6O (М=194,198 г) в виде продукта белого цвета в виде кристаллов. Выход составляет 88%. Спектр 1H-ЯMP (ДМСО, 300 МГц), химические сдвиги в м.д. и мультиплетность пиков: 1,63 (м),1,89 (м) и 2,07 (м): N-CH-CH2-CH2; 3,14-3,20 (м) и 3,43 (м): CH2-N-CH2; 4,51 (м): CH-N. ИК (вазелиновое масло): 1744; 1594 см-1. Масс-спектр (EI) m/z: [M]+ = 194, 165, 124, 111, 98, 83, 68, 56, 41. Пример 18. 6-Ацетил-1,6-диазабицикло[3.2.1]октан-7-он. Растворяют в 1,4 мл ТГФ 140 мг (0,582 ммоль) соединения, полученного на стадии А примера 15. К полученному раствору последовательно добавляют 55 мкл уксусного ангидрида, затем 0,58 мл 1M раствора фторида тетрабутиламмония в ТГФ. Затем разбавляют этилацетатом, промывают водой, декантируют, органическую фазу сушат над сульфатом магния, затем растворитель выпаривают при пониженном давлении. Указанным образом получают 116 мг сырого масла, которое хроматографируют на силикагеле с использованием смеси дихлорметан/ацетон 80/20. Таким образом получают 18 мг целевого соединения с общей формулой C8H12N2O2 (М=168,196 г),что соответствует выходу 18%. Спектр 1H-ЯMP (ДМСО, 300 МГц), химические сдвиги в м.д. и мультиплетность пиков: 1,65-2,20(C10H17NO3, M=199,251 г) (приводится в J. Med. Chem. 1986, 29, 224-229) в 440 мл этанола. Затем добавляют 38,79 г гидрохлорида О-бензилгидроксиламина. Далее по каплям к суспензии добавляют 54 мл пиридина. Оставляют взаимодействовать, перемешивая в течение 4 ч при температуре приблизительно 25 С,затем растворитель выпаривают при пониженном давлении. Остаток растворяют в смеси дихлорметана и- 20007220 этилацетата, затем фильтруют и споласкивают фильтр дихлорметаном, далее смесью дихлорметана и этилацетата. Затем фильтрат упаривают досуха при пониженном давлении. Таким образом получают 69,8 г прозрачного масла желтого цвета, которое очищают хроматографией на силикагеле. В качестве элюента используют смесь циклогексан/этилацетат 80/20. Получают 57,21 г 1,1-диметилового эфира 3-[(фенилметокси)имино]-1-пиперидинкарбоновой кислоты с общей формулой C17H24N2O3 (M = 304,39 г) в виде масла бледно-желтого цвета. Выход составляет 85%. Растворяют 24,82 г (0,0815 ммоль) полученного ранее оксима в 163 мл этанола, охлажденного до температуры -10C под азотом. Затем добавляют 25 мл комплекса боран-пиридин, а далее по каплям в течение 1 ч 15 мин добавляют 204 мл 2 н. соляной кислоты. Раствор перемешивают в течение 1 ч 15 мин при температуре -5C, затем промывают 100 мл насыщенного раствора бикарбоната натрия и далее маленькими порциями добавляют 35 г карбоната натрия, доводя уровень рН до 7-8. Реакционную смесь экстрагируют этилацетатом. Органические фазы объединяют, сушат над сульфатом натрия, растворитель выпаривают при пониженном давлении. Таким образом получают 39,0 г бесцветной маслянистой жидкости, которую растворяют в 400 мл этилацетата. Раствор промывают водным раствором 0,05 н. соляной кислоты, затем органические фазы объединяют и растворитель выпаривают при пониженном давлении. Получают 35,5 г бесцветной маслянистой жидкости, которую очищают хроматографией на силикагеле с элюированием смесью дихлорметан/этилацетат 95/5, затем смесью дихлорметан/этилацетат 80/20. Таким образом получают 17,89 1,1-диметилового эфира 3-[(фенилметокси)амино]-1-пиперидинкарбоновой кислоты с общей формулой C17H26N2O3 (М=306,41 г) в виде бесцветного масла. Выход составляет 72%. Растворяют 6,72 г (21,9 ммоль) полученного ранее пиперидина в 22 мл этилацетата, охлажденного до -10C. В течение 30 мин по каплям добавляют 28 мл 4,0 M раствора безводной хлористо-водородной кислоты в этилацетате. Через 1 ч при температуре 0C добавляют 40 мл этилового эфира, остаток дигидрохлорида отфильтровывают и промывают этиловым эфиром. Таким образом получают 3,87 г твердого вещества белого цвета. Кристаллизацией фильтрата получают еще 1,80 г целевого продукта. Полученный продукт помещают в 60 мл 1 н. гидроксида натрия и 120 мл этилацетата. После декантирования водную фазу насыщают хлоридом натрия, затем экстрагируют два раза этилацетатом. Органические фазы объединяют и сушат над сульфатом магния, затем упаривают досуха при пониженном давлении. Указанным образом получают 3,67 г N-(фенилметокси)-3-пиперидиамина с общей формулойC12H18N2O (М=206,29 г), что соответствует выходу 81%. Растворяют 518 мг (2,5 ммоль) полученного ранее соединения в 5 мл безводного дихлорметана, затем добавляют 0,5 мл TEA. Полученную беловатую суспензию охлаждают до -65 С, затем в течение 15 мин добавляют 12,5 мл 0,10 M раствора дифосгена в дихлорметане. После взаимодействия в течение 45 мин бесцветный раствор разбавляют 15 мл дихлорметана и обрабатывают 15 мл воды. Смесь декантируют, затем водную фазу экстрагируют 20 мл дихлорметана. Объединенные органические фазы сушат над сульфатом магния, затем концентрируют досуха при пониженном давлении. Таким образом получают масло бледно-желтого цвета, которое очищают хроматографией на силикагеле с элюированием смесью этилацетата 90/10, затем смесью дихлорметан/этилацетат 80/20. Таким образом получают 196 мг целевого соединения с общей формулой C13H16N2O2, (M=232,28 г) в виде бесцветного масла. Выход составляет 34%. Спектр 1H-ЯMP (CDCl3, 300 МГц), химические сдвиги в м.д. и мультиплетность пиков: 1,59 (м) и 1,93-2,18 (м): N-CH-CH2-CH2; 2,73 (дт), 2,94 (дт), 3,17 (дт) и 3,40 (дд): CH2-N-CH2; 3,29 (т): N-CH; 4,89(д): N-O-CH2-(C6H5); 7,38: C6H5. ИК (CHCl3): 1747; 1498 см-1. Масс-спектр (EI) m/z: [M]+ = 232, 91. Пример 19b. 6-(Ацетилокси)-1,6-диазабицикло[3.2.1]октан-7-он. Растворяют 95 мг (0,41 ммоль) соединения, полученного в примере 19 а, в 5 мл метанола, добавляют 8 мг 10%-ного Pd/C, затем суспензию помещают в атмосферу водорода при нормальном давлении в течение 1 ч при температуре 25C, далее катализатор отфильтровывают. После выпаривания растворителя при пониженном давлении получают 70 мг кристаллов белого цвета. Кристаллы растворяют в 2 мл безводного дихлорметана. Раствор охлаждают до -10C под азотом. Далее добавляют 70 мкл пиридина, затем 40 мкл уксусного ангидрида и перемешивают в течение 20 мин.- 21007220 Концентрируют при пониженном давлении и получают 75 мг кристаллов белого цвета, которые очищают хроматографией на силикагеле с элюированием смесью дихлорметан/этилацетат 80/20. Получают 49 мг целевого соединения (M=184,20 г) в виде твердого вещества белого цвета. Выход составляет 65%. Спектр 1H-ЯMP (CDCl3, 300 МГц), химические сдвиги в м.д. и мультиплетность пиков: 1,60-2,2: NCH-CH2-CH2; 2,24 (с): CH3; 2,95 (д) и 3,54 (дм): N-CH2-CH; 3,07 (дт) и 3,54 (уш.дд): N-CH2-CH2; 3,94(уш.т): O=C-N-CH. ИК (CHCl3): 1798; 1764 см-1. Масс-спектр (EI) m/z: [M]+ = 184, 142, 125, 43. Пример 19 с. 6-(Бензоилокси)-1,6-диазабицикло[3.2.1]октан-7-он. Повторяют условия примера 19b, взяв в качестве исходного 205 мг соединения, полученного в примере 19 а, и 200 мг бензойного ангидрида. Таким образом получают 64 мг целевого соединения с общей формулой C13H14N2O3 (М=246,27 г) с выходом 30%. Спектр 1H-ЯMP (CDCl3, 250 МГц), химические сдвиги в м.д. и мультиплетность пиков: 1,64-1,95 (м) и 2,10-2,35 (м): CH-CH2-CH2; 3,02 (д) и 3,65 (дм): N-CH2-CH; 3,13 (дт) и 3,55 (уш.дд): N-CH2-CH2; 4,09(уш.т): O=C-N-CH; 7,49 (м): 7,65 (тт); 8,12 (м): C5H5. ИК (CHCl3): 1774, 1756; 1602, 1585, 1495 см-1. Масс-спектр (EI) m/z: [M]+ = 246, 105, 77. Пример 19d. 6-(1-Оксопропокси)-1,6-диазабицикло[3.2.1]октан-7-он. Повторяют условия примера 19 с, взяв в качестве исходного 163 мг соединения, полученного в примере 19 а, и 70 мкл хлорида пропионила. Таким образом получают 17 мг целевого соединения с общей формулой C9H14N2O3 (М=198,23 г) с выходом 12%. Спектр 1H-ЯMP (CDCl3, 300 МГц), химические сдвиги в м.д. и мультиплетность пиков: 1,25 (т):N-CH2-CH; 3,07 (дт) и 3,48 (дд): N-CH2-CH2; 3,93 (м): N-CH2-CH. ИК (CHCl3): 1792; 1763 см-1. Масс-спектр (EI) m/z: [M]+ = 198, 170, 142, 125, 97, 57. Пример 19 е. 6-(4-Метилфенил)сульфонил]окси]-1,6-диазабицикло[3.2.1]октан-7-он. Повторяют условия примера 19d, взяв в качестве исходного 139 мг соединения, полученного в примере 19 а, и 126 мг тозилхлорида. Таким образом получают 77 мг целевого соединения с общей формулой C13H16N2O4S (М=296,35 г) с выходом 44%. Спектр 1H-ЯMP (CDCl3, 250 МГц), химические сдвиги в м.д. и мультиплетность пиков: 1,55 и 2,99(M): N-CH-CH2-CH2; 2,45 (с): CH3; 2,89 (д), 3,00 (дт), 3,29 (дт) и 3,39 (дд): CH2-N-CH2; 4,04 (м): N-CH; 7,35 и 7,91 [AA'BB'] CH3-C6H4-SO2. ИК (CHCl3): 1775; 1599, 1495, 1383; 1193, 1180 см-1. Масс-спектр (EI) m/z: [M]+ = 296, 155, 141, 125, 91. Пример 19f. 6-[(Метилсульфонил)окси]-1,6-диазабицикло[3.2.1]октан-7-он. Повторяют условия примера 19 е, взяв в качестве исходного 211 мг соединения, полученного на стадии 19 а, и 80 мкл мезилхлорида. Таким образом получают 50 мг целевого соединения с общей формулой C17H12N2O4S (М=220,25 г) с выходом 25%. Спектр 1H-ЯMP (CDCl3, 250 МГц), химические сдвиги в м.д. и мультиплетность пиков: 1,56 и 2,38(м): N-CH-CH2-CH2; 3,00 (д), 3,12 (дт) и 3,49 (м): N-(CH2)2; 3,26 (с): CH3; 4,12 (м): N-CH. ИК (CHCl3): 1775; 1381, 1187 см-1. Масс-спектр (EI) m/z: [M]+ = 220, 141, 125, 97, 79. Пример 19g. 6-(4-Нитрофенил)сульфонил]окси]-1,6-диазабицикло[3.2.1]октан-7-он. Повторяют условия примера 19f, взяв в качестве исходного 270 мг соединения, полученного в примере 19 а, и 283 мг 4-нитробензолсульфонилхлорида. Таким образом получают 205,5 мг целевого соединения с общей формулой C12H13N3O6S (М=327,32 г) с выходом 54%. Спектр 1H-ЯMP (CDCl3, 250 МГц), химические сдвиги в м.д. и мультиплетность пиков: 1,64 (дт),1,84 (м), 1,99 (м), 2,31 (дм): NCH-CH2-CH2; 2,94 (д), 3,30 (дт), 3,04 (дт), 3,40 (уш.дд): N(CH2)2; 4,14: О=CN-CH; 8,25 и 8,41 [AA'BB']: NO2-C6H4SO2. ИК (CHCl3): 1776; 1610, 1590, 1538; 1393, 1191 см-1. Масс-спектр (EI) m/z: [M]+ = 327, 186, 141, 125, 111. Пример 20. 6-(4-Метилфенил)сульфонил]амино]-1,6-диазабицикло[3.2.1]октан-7-он. Растворяют 5 г (25,1 ммоль) 1,1-диметилэтилового эфира 3-оксо-1-пиперидинкарбоновой кислоты- 22007220 перемешивании, затем растворитель выпаривают при пониженном давлении. Таким образом получают с количественным выходом 9,56 г 1,1-диметилэтилового эфира 3-[2-[(4 метилфенил)сульфонил]гидразоно]-1-пиперидинкарбоновой кислоты с общей формулой C17H25N3O4S(М=367,47 г). Смешивают в инертном газе 4,5 г полученного ранее соединения (12,2 ммоль), 90 мл смеси метанол/тетрагидрофуран 50/50 и несколько кристалликов бромкрезолового зеленого. Далее добавляют 1,62 г NaBH3CN, охлаждают до температуры от 0 до 5 С и вводят, поддерживая уровень рН среды в интервале от 3,8 до 5,4, 0,7 M раствора газообразного хлорида водорода в метаноле. Оставляют взаимодействовать в течение 2,5 ч. Выпаривают при пониженном давлении 2/3 растворителей, затем добавляют 200 мл дихлорметана и промывают насыщенным водным раствором бикарбоната натрия. Органическую фазу сушат над сульфатом натрия и растворитель выпаривают при пониженном давлении. Таким образом получают 4,48 г 1,1-диметилового эфира 3-[2-[(4-метилфенил) сульфонил]гидразино]-1-пиперидинкарбоновой кислоты с общей формулой C17H27N3O4S (М=369,486 г). Выход составляет 99%. Смешивают в инертном газе при температуре 0C 4,48 г полученного ранее соединения и 9 мл этилацетата. Добавляют 30 мл 4 M раствора газообразного хлорида водорода в этилацетате, перемешивают в течение 15 мин, затем фильтруют и промывают гидрохлорид этилацетатом. Сушат при пониженном давлении и получают 3,48 г дигидрохлорида 2-(3-пиперидинил)гидразида 4-метил-бензолсульфоновой кислоты с общей формулой C12H19N3O2S, 2HCl (М=342,289 г). Выход соответствует 84%. Затем растворяют 3,48 г ранее полученного соединения и 5 мл деионизованной воды. При интенсивном перемешивании добавляют 10,2 мл водного раствора 2 н. гидроксида натрия. После 1-2 мин взаимодействия образуется осадок. Далее перемешивают в течение 10 мин, затем осадок отфильтровывают и промывают водой, затем этилацетатом. Полученное твердое вещество сушат при пониженном давлении. Таким образом получают 2,21 г 2-(3-пиперидинил)гидразида 4-метил-бензолсульфоновой кислоты с общей формулой C12H19N3O2S (М=269,328 г). Соответствующий выход 81%. Смешивают в инертном газе 500 мг (1,85 ммоль) полученного ранее амина и 20 мл тетрагидрофурана. К полученной суспензии добавляют при температуре в интервале от 0 до 5 С 112 мкл дифосгена,затем 517 мкл TEA и 23 мг DMAP. Оставляют взаимодействовать при перемешивании и повышают температуру до 20C. Далее разбавляют этилацетатом, затем промывают 10%-ным водным раствором винной кислоты,затем деминерилизованной водой. Органическую фазу сушат над сульфатом магния, затем растворитель выпаривают при пониженном давлении. Получают 769 мг сырого продукта, который растворяют в 7 мл дихлорметана и 517 мкл TEA. Оставляют взаимодействовать на ночь при перемешивании. Разбавляют дихлорметаном, промывают водой, сушат над сульфатом натрия и растворитель выпаривают при пониженном давлении. Полученную пену (395 мг) очищают хроматографией на силикагеле с использованием смеси дихлорметан/этилацетат 80/20. Получают 4 4 мг целевого соединения с общей формулой C13H17N3O2S (М=295,362 г). Выход соответствует 8%. Спектр 1H-ЯMP (CDCl3, 250 МГц), химические сдвиги в м.д. и мультиплетность пиков: 1,55-1,80 (м) и 2,18 (м): N-CH-CH2-CH2; 2,42 (с): CH3; 2,88 (д) и 2,93 (м); N-CH2-CH; 3,18-3,32 (м): N-CH2-CH2; 4,08(м): N-CH-CH2; 6,98 (уш.с): NH. ИК (CHCl3): 3264, 1737, 1599, 1490 см-1. Масс-спектр (электрораспыление с положительной ионизацией) m/z: [M+Na]+ = 318, [M+H]+= 296. Пример 21. 6-[(4-Метилфенил)сульфонил]-1,6-диазабицикло[3.2.1]октан-7-он. Растворяют в 3 мл безводного дихлорметана 305 мг (1,52 ммоль) 1,1-диметилэтилового эфира 3 амино-1-пиперидинкарбоновой кислоты (приводится в J. Med. Chem. 1992, 35, 4334-4343), с общей формулой C10H20N2O2 (М=200,282 г). Далее добавляют 212 мкл TEA, затем охлаждают до 5 С и добавляют 278 мг тозилхлорида. Перемешивают, повышая температуру-до 20C и оставляют взаимодействовать в течение 2 ч. Далее разбавляют дихлорметаном и промывают сначала 10%-ным водным раствором винной кислоты, а затем буферным раствором с рН=7. Разделяют и сушат органическую фазу над сульфатом магния, затем выпаривают растворитель при пониженном давлении. Таким образом получают масло, которое очищают хроматографией на силикагеле с элюированием смесью дихлорметан/этилацетат 9/1.C17H26N2O4S, (М=354,472 г). Соответствующий выход 82%. Смесь 425 мг полученного ранее соединения и 2,1 мл смеси трифторуксусная кислота/дихлорметан 50/50 охлаждают до температуры от 0 до 5 С. Выдерживают, перемешивая, при температуре 5C в течение 30 мин. Затем растворитель выпаривают при пониженном давлении и получают 403 мг трифторацетата 4 метил-N-(3-пиперидинил)бензолсульфонамида с общей формулой C14H19F3N2O4S (М=368,377 г). Суспендируют 228 мг ранее полученного соединения в 2 мл метанола. Обрабатывают избытком смолы DOWEX 21K 20-50 Mesh, активированной гидроксидом натрия. Фильтруют, ополаскивают смолу в метаноле, затем фильтрат упаривают при пониженном давлении. Таким образом получают 123 мг 4-метил-N-(3-пиперидинил)-бензолсульфонамида с общей формулой C12H18N2O2S (М=254,353 г). Растворяют в инертном газе 118 мг ранее полученного амина в 1,2 мл дихлорметана. Далее последовательно вводят 98 мкл TEA, затем 28 мкл дифосгена. Оставляют взаимодействовать при перемешивании в течение 30 мин при температуре от 0 до 5C. Разбавляют дихлорметаном, органическую фазу промывают 10%-ным раствором винной кислоты, затем водой. После сушки над сульфатом натрия, фильтрования и выпаривания растворителя при пониженном давлении сырой продукт очищают хроматографией на силикагеле, взяв в качестве элюента смесь дихлорметан/ацетон 95/5. Таким образом получают 112 мг хлорида 3-(4-метилфенил)сульфонил]амино]-1 пиперидинкарбоновой кислоты с общей формулой C13H17ClN2O3S (М=316,308 г). Выход составляет 76%. В инертной атмосфере смешивают 10 мг гидрида натрия (55-65%-ая суспензия в масле) и 2 мл безводного тетрагидрофурана. Затем добавляют 71 мг ранее полученного продукта. Перемешивают при комнатной температуре в течение 15 мин, затем добавляют 12 мкл уксусной кислоты и 2 мл фосфатного буферного раствора с рН=7. Перемешивают еще в течение 5 мин, затем добавляют 5 мл этилацетата, декантируют, затем повторно экстрагируют этилацетатом. Разделяют и сушат органическую фазу над сульфатом магния,фильтруют, выпаривают растворитель при пониженном давлении. Указанным образом получают 65 мг сырого продукта, который очищают хроматографией на силикагеле с элюированием смесью дихлорметан/ацетон 95/5. Таким образом получают 40 мг целевого соединения с общей формулой C13H16N2O3S (М=280,348 г). Выход составляет 64%. Спектр 1H-ЯMP (CDCl3, 250 МГц), химические сдвиги в м.д. и мультиплетность пиков (два конфомера присутствуют в пропорции 90/10): 1,46 (м), 1,76 (м) и 2,08 (дм): NCH-CH2-CH2; 2,44 (с) и 2,45 (с):[AA'BB'] CH3-С 6H4-SO2. ИК (CHCl3): 1758, 1598, 1995, 1367, 1169 см-1. Масс-спектр (EI) m/z: [M]+ = 280, 216, 155, 125, 97, 91. Пример 22. 6-Окса-1-азабицикло[3.2.1]окт-3-ен-7-он. Смешивают в инертном газе 5 мл дихлорметана и 68 мг гидрохлорида 1,2,3,6-тетрагидропиридин-3 ола (М=135,5 г) (приводится Chem. Pharm. Bull. 30(10)3617-3623(1982. Добавляют 33 мкл дифосгена и перемешивают в течение 5 мин при температуре 0C. Затем добавляют 140 мкл TEA и 61 мг DMAP. Оставляют взаимодействовать при комнатной температуре в течение 2 ч, далее разбавляют дихлорметаном и промывают 10%-ным водным раствором винной кислоты, затем водой. Декантируют и сушат органическую фазу над сульфатом магния. Растворитель выпаривают при пониженном давлении. Таким образом получают 5 мг сырого продукта, который очищают хроматографией на силикагеле с элюированием смесью дихлорметан/этилацетат 95/5. Указанным образом получают 3 мг целевого соединения с общей формулой C6H7NO2 (М=125 г). Выход составляет 5%. Пример 23. Фенилметиловый эфир транс-3-бензоил-2-оксо-4-окса-1,3-диазабицикло[3.2.1]октан-7 карбоновой кислоты. Смешивают в инертном газе 5,50 г (13,7 ммоль) 1-(1,1-диметилэтил)ового и 2-(фенилметил)ового эфира цис-4-[(метилсульфонил)окси]-1,2-пирролидинкарбоновой кислоты (приводится в J. Org. Chem. 1991, 56, 3009-3016) с общей формулой C18H25NO7S (М=399,466 г) и 110 мл диметилформамида, затем добавляют 2,58 г N-гидроксифталимида, затем 1,52 г бикарбоната калия. Нагревают при перемешивании до температуры 100C и поддерживают реакционную смесь при указанной температуре в течение 4 ч. Охлаждают до 20C, добавляют смесь 220 мл воды и льда, затем экстрагируют изопропиловым эфиром.- 24007220 Сушат над сульфатом магния, затем упаривают досуха при пониженном давлении. Остаток хроматографируют на силикагеле с элюированием смесью дихлорметан/этилацетат 90/10. Таким образом получают 3,06 г 1-(1,1-диметилэтил)ового и 2-(фенилметил)ового эфира транс-4[(1,З-дигидро-1,3-диоксо-2 Н-изоиндол-2-ил)окси]-1,2-пирролидинкарбоновой кислоты с общей формулой C25H26N2O7 (М=466,494 г). Выход соответствует 47%. Растворяют 3,24 г (6,94 ммоль) фталамида, полученного как указано ранее, в 33 мл дихлорметана. Добавляют 372 мкл гидрата гидразина. Перемешивают еще в течение 2 ч 30 мин при температуре 20C. Образовавшийся осадок отфильтровывают, ополаскивают дихлорметаном, затем растворитель выпаривают при пониженном давлении. Получают 2,91 г сырого продукта, который очищают хроматографией на силикагеле с элюированием смесью дихлорметан/этилацетат 90/10, затем 80/20 и 50/50. Таким образом получают суммарно 942 мг 1-(1,1-диметилэтил)ового и 2-(фенилметил)ового эфира транс-4-(аминоокси)-1,2-пирролидинкарбоновой кислоты с общей формулой C17H24N2O5 (М=336,39 г). Выход соответствует 40%. Смешивают в инертном газе 853 мг ранее полученного соединения (2,53 ммоль) и 8,5 мл безводного дихлорметана. Охлаждают до температуры от 0 до 5C, затем добавляют 706 мкл TEA и 588 мкл бензоилхлорида. Перемешивают в течение 10 мин при температуре от 0 до 5C, затем температуру повышают до 20C и оставляют взаимодействовать еще в течение 30 мин. Органическую фазу промывают 10%-ным водным раствором винной кислоты, затем водой. Декантируют и сушат органическую фазу над сульфатом натрия, растворитель выпаривают при пониженном давлении. Таким образом получают 1,38 г продукта, который смешивают с 25 мл дихлорметана. Охлаждают до температуры от 10 до 15 С и добавляют 123 мкл гидразингидрата. Оставляют взаимодействовать при перемешивании при температуре 20C в течение 2,5 ч. Растворитель выпаривают при пониженном давлении. Указанным образом получают 1,13 г сырого продукта, который очищают хроматографией на силикагеле с элюированием смесью дихлорметан/этилацетат 80/20. Получают 948 мг 1-(1,1-диметилэтил)ового и 2-(фенилметил)ового эфира транс-4-[(бензоиламино) окси]-1,2-пирролидинкарбоновой кислоты с общей формулой C24H28N2O6 (М=440,50 г). Общий выход 85%. Растворяют при перемешивании 948 мг ранее полученного соединения в 2 мл этилацетата. Охлаждают до температуры от 0 до 5C, затем добавляют в один прием 4,7 мл приблизительно 4,6M раствора газообразного хлорида водорода в этилацетате. Через 1 ч растворитель выпаривают при пониженном давлении и продукт промывают 3 раза этиловым эфиром. Растворитель выпаривают при пониженном давлении. Таким образом получают 842 мг фенилметилового эфира транс-4-[(бензоиламино)окси]-1,2-пирролидинкарбоновой кислоты в виде рыхлой пены белого цвета с общей формулой C19H20N2O4HCl (М=376,84 г). Выход является количественным. Растворяют 47 мг (0,125 ммоль) полученного ранее гидрохлорида в инертном газе в 0,5 мл дихлорметана. Добавляют 25,2 мкл пиридина, затем охлаждают до температуры от 0 до 5 С и добавляют 9,5 мкл дифосгена. Повышают температуру до 20C, разбавляют дихлорметаном, затем реакционную смесь промывают 10%-ным водным раствором винной кислоты и затем водой. Органическую фазу декантируют и сушат над сульфатом натрия. Затем растворитель выпаривают при пониженном давлении. Таким образом получают 43,8 мг сырого продукта, который очищают хроматографией на силикагеле с элюированием смесью дихлорметан/этилацетат 90/10. Получают 34,9 мг фенилметилового эфира транс-4-[(бензоиламино)окси]-1-(хлоркарбонил)-2 пирролидинкарбоновой кислоты с общей формулой C20H19ClN2O5 (M=402,83 г). Выход составляет 69%. Растворяют 13 мг (0,032 ммоль) ранее полученного соединения в 4 мл толуола. Добавляют 9 мкл TEA и 7,8 мг DMAP. Оставляют на ночь при нагревании до температуры 100C. Растворитель выпаривают при пониженном давлении, затем остаток очищают хроматографией с элюированием дихлорметаном. Таким образом получают 4,3 мг целевого соединения с общей формулой C20H18N2O5 (М=336,37 г). Выход составляет 40%. Спектр 1H-ЯMP (CDCl3, 300 МГц), химические сдвиги в м.д. и мультиплетность пиков: 1,97 (ддд) и 2,85 (ддд): N-O-CH-CH2-CH; 3,80 (дд) и 4,14 (дд): N-O-CH-CH2-N; 4,75 (дд): N-CH-CH2; 4,93 (т): N-O-CHCH2; 5,04 и 5,31 [AB]: O-CH2-C6H5; 7,77: и 7,25-7,50 (м) CH2-C6H5 и OC-C6H5. ИК (CHCl3): 1735; 1612, 1575, 1496 см-1.- 25007220 Пример 24. 3-Бензоил-1,3-диазабицикло[2.2.2]октан-2-он. В атмосфере азота растворяют 2,4 г (10 ммоль) гидрохлорида N-4-(пиперидинил)-бензамида (приводится в J. Med. Chem. EN. 17(1974), 736-739), с общей формулой C12H16N2O в 30 мл дихлорметана. Охлаждают до температуры 0C и при перемешивании добавляют 2,8 мл TEA и 0,66 мл дифосгена. Через несколько минут разбавляют дихлорметаном, затем промывают 10%-ным водным раствором винной кислоты и водой. Органическую фазу декантируют, сушат над сульфатом магния и растворитель выпаривают при пониженном давлении. Очищают на силикагеле с элюированием смесью дихлорметан/этилацетат 90/10. Получают 1,62 г хлорида 4-(бензоиламино)-1-пиперидинкарбоновой кислоты с общей формулойC13H15ClN2O5 (М=266,5 г). Выход соответствует 61%. В атмосфере азота растворяют 1,21 г (48 ммоль) полученного ранее соединения в 37 мл тетрагидрофурана. Раствор охлаждают до температуры -78C, затем добавляют по каплям 5 мл 1M раствора бис(триметилсилил)амида лития в тетрагидрофуране. Поддерживают при температуре -78C в течение 15 мин, затем повышают температуру до комнатной и оставляют взаимодействовать еще в течение 1 ч. Раствор охлаждают до температуры 0C, затем добавляют 720 мкл уксусной кислоты, при этом образуется осадок. Разбавляют этилацетатом, промывают 10%-ным водным раствором винной кислоты и фосфатным буферным раствором с рН=7,0. Органическую фазу декантируют и сушат над сульфатом магния. Фильтруют и растворитель выпаривают при пониженном давлении. Сырой продукт очищают хроматографией на силикагеле с элюированием смесью дихлорметан/этилацетат 90/10. Указанным образом после перекристаллизации из этилового эфира получают 0,214 г целевого соединения с общей формулой C18H14N2O2 (М=230 г). Выход составляет 20%. Спектр 1H-ЯMP (ДМСО, 250 МГц), химические сдвиги в м.д. и мультиплетность пиков: 1,71-2,02[M+Na+CH3CN]+ = 294; [M+Na]+ = 253. Пример 25. Дифенилметиловый эфир транс-7-оксо-6-окса-1-азабицикло[3.2.1]октан-2-карбоновой кислоты. Смешивают в инертной атмосфере 15 мл дихлорметана и 197 мг (0,633 ммоль) дифенилметилового эфира транс-5-гидрокси-2-пиперидинкарбоновой кислоты (приводится в Rec. Trav. Chim. (1959), 78, 648658) с общей формулой C19H21NO3. Охлаждают до температуры 0C, затем последовательно добавляют 42 мкл дифосгена, 177 мкл TEA и далее 77 мг DMAP. Оставляют взаимодействовать 4 ч при комнатной температуре. Далее реакционную смесь промывают 10%-ным водным раствором винной кислоты, затем насыщенным раствором хлорида натрия в воде. Органические фазы объединяют и сушат над сульфатом магния, растворитель выпаривают при пониженном давлении и получают 195 мг сырого продукта, который очищают хроматографией на силикагеле с элюированием дихлорметаном с добавкой 0,1% воды. Получают масло, которое перекристаллизовывают из смеси пентан/этиловый эфир. Указанным образом получают 108 мг целевого соединения в виде кристаллов белого цвета с общей формулой C20H19NO4 (М=337,338 г). Выход составляет 51%. Спектр 1H-ЯMP (CDCl3, 400 МГц), химические сдвиги в м.д. и мультиплетность пиков: 1,86 (м) и 2,03 (м): N-CH-CH2-CH2-CO; 2,27 (м): N-CH-CH2-CH2-CO; 3,07 (д) и 3,29 (м): N-CH2-CHO; 4,31 (дд): NCH-CH2; 4,73 (м): N-CH2-CHO; 6,93 (с): CO2-CH-(C6H5)2; 7,27-7,41 (м): CH(C6H5)2. ИК (CHCl3): 1788, 1736; 1496 см-1. Масс-спектр (ВИМС) m/z: [M+Na]+ = 360; [M+Li]+ = 344; [M]+ = 337, 167. Пример 26 а. (4-Нитрофенил)метиловый эфир транс-7-оксо-6-окса-1-азабицикло[3.2.1]октан-2 карбоновой кислоты. Смешивают в инертной атмосфере 66 мл дихлорметана и 1 г (3,56 ммоль) (4-нитрофенил) метилового эфира транс-5-гидрокси-2-пиперидинкарбоновой кислоты с общей формулой C13H16N2O5(М=280,282 г). Охлаждают до температуры 0C, затем добавляют 0,24 мл дифосгена. Оставляют взаимодействовать при перемешивании в течение 10 мин при температуре 0C, затем температуру повышают до комнатной. Растворитель выпаривают при пониженном давлении. Осадок растворяют в 66 мл толуола и добавляют 0,99 мл TEA. Колбу помещают на масляную баню с температурой 110C и выдерживают в течение 15 мин. Затем дают смеси охладиться до комнатной температуры. Промывают 10%-ным водным раствором винной кислоты, затем насыщенным раствором хлорида натрия в воде. Органическую фазу сушат над сульфатом магния, затем растворитель выпаривают при пониженном- 26007220 давлении. Указанным образом получают 0,885 г сырого продукта, который очищают хроматографией на силикагеле с элюированием смесью дихлорметан/этилацетат 85/15. Таким образом получают 0,184 г целевого соединения с общей формулой C14H14N2O6 (М=306,276 г) в виде масла желтого цвета. Выход соответствует 17%. Спектр 1H-ЯMP (CDCl3, 400 МГц), химические сдвиги в м.д. и мультиплетность пиков: 1,92 (м) и 2,07 (м): N-CH-CH2-CH2-CO; 2,22 (м) и 2,30 (м): N-CH-CH2-CH2-CO; 3,17 (д) и 3,35 (дм): N-CH2-CHO; 4,28 (дд): N-CH-CH2; 4,79 (м): N-CH2-CHO; 5,33 [AB]: CO2-CH2-C6H4NO2; 7,56 и 8,25 [AA'BB']: CH2-C6H4NO2. ИК (CHCl3): 1791, 1745; 1609, 1526, 1495 см-1. Масс-спектр (EI) m/z: [M]+ = 306, 262, 136, 126, 82, 55. Пример 26b. Транс-7-оксо-6-окса-1-азабицикло[3.2.1]октан-2-карбоновая кислота. Смешивают 140 мг (0,457 ммоль) сложного эфира, полученного в примере 26 а, 7 мл ацетона и 28 мг 20%-ного Pd/C в качестве катализатора. Оставляют взаимодействовать при перемешивании в течение 25 мин в атмосфере водорода при нормальном давлении. Катализатор отфильтровывают и затем растворитель выпаривают при пониженном давлении. Таким образом получают 137 мг целевого соединения с общей формулой C7H9NO4 (М=171,152 г) в виде масла в смеси с 1 моль п-толуидина. Выход составляет 97%. Спектр 1H-ЯMP (DMSO, 400 МГц), химические сдвиги в м.д. и мультиплетность пиков: 1,84 (м) и 1,95-2,05 (м): N-CH-CH2-CH2-CO; 3,13 (д) и 3,24 (дд): N-CH2-CHO; 4,02 (дд): N-CH-CH2; 4,81 (дм): NCH2-CHO. Пример 26 с. Метиловый эфир транс-7-оксо-6-окса-1-азабицикло[3.2.1]октан-2-карбоновой кислоты. Растворяют 17,25 мг (0,1 ммоль) кислоты, полученной в примере 26b, в 3 мл дихлорметана. Обрабатывают избытком диазометана в растворе дихлорметана, затем растворитель выпаривают при пониженном давлении. Указанным образом получают 30 мг сырого продукта, который очищают хроматографией на силикагеле с элюированием смесью толуол/этилацетат 90/10. Получают 6,7 мг целевого соединения (М=485,187 г). Выход составляет 36%. Пример 27. (4-Нитрофенил)метиловый эфир цис-7-оксо-6-окса-1-азабицикло[3.2.1]октан-2 карбоновой кислоты. В атмосфере азота вводят 0,802 г (2,034 ммоль) трифторацетата (4-нитрофенил)метилового эфира цис-5-гидрокси-2-пиперидинкарбоновой кислоты (приводится в Rec. Trav. Chim. (1959), 78, 648-658) с общей формулой C13H16N2O5, CF3CO2H (М=394,303 г) в 40 мл дихлорметана и охлаждают до температуры 0C. Добавляют 0,135 мл дифосгена. Перемешивают в течение 15 мин при температуре 0C, повышают температуру до комнатной и продолжают перемешивание в течение 35 мин. Растворитель выпаривают при пониженном давлении. Растворяют указанный продукт в 40 мл толуола и 1,1 мл триэтиламина. Реакционную смесь нагревают в течение 35 мин до температуры 100C, затем оставляют охлаждаться до комнатной температуры. Промывают водой, затем фосфатным буферным раствором с рН=7. Органическую фазу сушат над сульфатом натрия и растворитель выпаривают при пониженном давлении. Указанным образом получают 0,56 г сырого продукта, который очищают хроматографией на силикагеле с элюированием смесью дихлорметан/ацетон 95/5. Таким образом получают 110 мг целевого соединения с общей формулой C14H14N2O6, (М=306,275 г) в виде масла. Выход составляет 17%. Спектр 1H-ЯMP (CDCl3, 300 МГц), химические сдвиги в м.д. и мультиплетность пиков: 1,80-1,94 и 2,10-2,45: N-CH-CH2-CH2-CO; 3,07 (д), 3,04 (дм) и 3,86 (дд): CH-N-CH2; 4,80 (т): O=C-O-CH; 5,28 и 5,43[AB]: O=C-O-CH2-C6H5; 7,61 и 8,24 [AA'BB'] C6H4NO2. ИК (CHCl3): 1801, 1794, 1745, 1704; 1609, 1525, 1498 см-1. Масс-спектр (EI) m/z: [M]+ = 306, 262, 136, 126, 83, 55. Пример 28 а. 1-Пропенилтрифенилфосфониевая соль фенилметилового эфира транс-7-оксо-6(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты. Стадия А. Фенилметиловый эфир цис-5-гидрокси-1-(трифтороацетил)-2-пиперидинкарбоновой кислоты. Растворяют в инертной атмосфере 6,19 г (22,77 ммоль) гидрохлорида фенилметилового эфира 5 гидрокси-2-пиперидинкарбоновой кислоты с общей формулой C13H18ClNO3 (М=271,746 г) (приводится вRec. Trav. Chim. (1959), 78, 648-658) в 80 мл безводного дихлорметана. Охлаждают до температуры 5C и добавляют 9,5 мл TEA, затем по каплям 6,46 мл трифторуксусного ангидрида. Оставляют взаимодействовать при перемешивании при температуре 5 С в течение 1 ч, затем разбавляют дихлорметаном, промывают последовательно 10%-ным водным раствором винной кислоты,- 27007220 водным фосфатным буферным раствором с рН=7 и насыщенным раствором хлорида натрия в воде. Органическую фазу декантируют и сушат над сульфатом магния. Затем растворитель выпаривают при пониженном давлении. Таким образом получают 10 г масла красного цвета, которое растворяют в 100 мл метанола. Охлаждают до температуры 10C и медленно добавляют при максимальной температуре 20C 6,8 г (78 ммоль) бикарбоната натрия в растворе в 100 мл воды. Оставляют взаимодействовать при перемешивании при температуре 20C в течение 30 мин, экстрагируют дихлорметаном. Органическую фазу декантируют, промывают насыщенным раствором хлорида натрия в воде и сушат над сульфатом магния. Растворитель выпаривают при пониженном давлении и таким образом получают 7,6 г масла оранжевого цвета, которое очищают хроматографией на силикагеле с элюированием смесью дихлорметан/этилацетат 95/5. Таким образом получают 6 г целевого соединения с общей формулой C15H16F3NO4 (М=331,294 г). Выход составляет 68%. Стадия В. Фенилметиловый эфир транс-5-[(2-пропенилокси)амино]-1-(трифторацетил)-2-пиперидинкарбоновой кислоты. Вводят 1,74 г (5,26 ммоль) полученного ранее спирта в 29 мл ацетонитрила. Охлаждают до температуры -40C и добавляют при указанной температуре 0,61 мл 2,6-лутидина (C5H3N(CH3)2), затем 0,91 мл трифторметансульфонового ангидрида. Оставляют взаимодействовать при перемешивании в течение 30 мин при температуре -40C. Затем добавляют при той же температуре в течение 1 мин 0,7 мл (10,52 ммоль) О-аллилгидроксиламина. Температуру повышают до 0C, затем добавляют еще 0,61 мл 2,6-лутидина и оставляют взаимодействовать на ночь (15 ч) при температуре приблизительно 5C, затем еще на 2 ч при температуре 20C. Далее разбавляют дихлорметаном, промывают водным раствором бикарбоната натрия, затем 10%ным водным раствором винной кислоты и насыщенным раствором хлорида натрия в воде. Органическую фазу декантируют, сушат над сульфатом магния и растворитель выпаривают при пониженном давлении. Таким образом получают 2,1 г масла желтого цвета, которое очищают хроматографией на силикагеле с элюированием смесью толуол/этилацетат 90/10. Получают 1,23 г целевого соединения с общей формулой C18H21F3N2O4 (М=386,374 г). Выход составляет 61%. Стадия С. Фенилметиловый эфир транс-5-[(2-пропенилокси)амино]-2-пиперидинкарбоновой кислоты. Растворяют в инертной атмосфере 1,41 г (3,65 ммоль) полученного ранее соединения в 25 мл безводного метанола. Охлаждают до температуры от 0 до 5C, затем делают 3 добавления 145 мг NaBH4 с интервалами в 45 мин. Затем реакционную смесь подкисляют до рН = 2 предварительно охлажденным до 5C 1 н. водным раствором соляной кислоты. Экстрагируют этилацетатом. Водную фазу охлаждают до температуры 5C, добавляют 100 мл этилацетата и обрабатывают насыщенным раствором карбоната натрия до получения рН в интервале от 8,5 до 9. Затем амин экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором хлорида натрия в воде, затем сушат над сульфатом магния и упаривают растворитель при пониженном давлении. Таким образом получают 0,628 г целевого продукта с общей формулой C16H22N2O3 (М=290,364 г). Выход составляет 59%. Стадия D. Фенилметиловый эфир транс-7-оксо-6-(2-пропенилокси)-1,6-диазабицикло[3.2.1]окстан 2-карбоновой кислоты. Растворяют в инертной атмосфере 103 мг (0,35 ммоль) полученного ранее амина в 35 мл безводного дихлорметана. Раствор охлаждают до температуры от 0 до 5C и добавляют по каплям при указанной температуре 0,1 мл TEA, затем 21 мкл дифосгена. Оставляют взаимодействовать при перемешивании в течение 15 мин при температуре от 0 до 5C,затем температуру поднимают до 20C и добавляют 42 мг DMAP. Продолжают перемешивать при температуре 20C в течение приблизительно 5 ч. Разбавляют дихлорметаном, промывают 10%-ным водным раствором винной кислоты, затем водой. Органическую фазу сушат над сульфатом магния и упаривают растворитель при пониженном давлении. Таким образом получают 70 мг сырого продукта, который очищают хроматографией на силикагеле с элюированием смесью дихлорметан/этилацетат 98/2. Получают 48 мг целевого продукта с общей формулой C17H20N2O4 (М=316,36 г). Выход составляет[M+Na]+ = 339; [M+H]+ = 317. Стадия E. 1-Пропенилтрифенилфосфониевая соль фенилметилового эфира транс-7-оксо-6(сульфокси)-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты. Растворяют в инертной атмосфере 202 мг (0,638 ммоль) соединения, полученного на стадии D, в 5,5 мл безводного дихлорметана. К полученному раствору при температуре 20C добавляют 73 мкл уксусной кислоты, затем 369 мгPd(P(C6H5)3)4. После перемешивания в течение 30 мин при комнатной температуре образовавшуюся Nгидроксимочевину обрабатывают 5,5 мл пиридина и 358 мг комплекса SO3-пиридин. Оставляют взаимодействовать при перемешивании в течение 18 ч при температуре 20C, затем реакционную смесь концентрируют выпариванием растворителя при пониженном давлении. Растворяют 50 мл дихлорметана и промывают водой. Органическую фазу сушат над сульфатом магния и выпаривают дихлорметан при пониженном давлении. Указанным образом получают 650 мг сырого продукта, который очищают хроматографией на силикагеле с элюированием смесью дихлорметан/ацетон 60/40 с добавкой 0,1 об.% TEA. Таким образом получают 280 мг приведенной в названии соли фосфония с общей формулой[Мкатион]+ = 303. Пример 28b. Натриевая соль фенилметилового эфира транс-7-оксо-6-(сульфокси)-1,6 диазабицикло[3.2.1]октан-2-карбоновой кислоты. Растворяют 236 мг (0,364 ммоль) фосфониевой соли, полученной на стадии E примера 28 а, в 0,8 мл тетрагидрофурана и добавляют 4 капли воды. Полученный раствор пропускают через колонку со смолой DOWEX 50WX8 в форме Na+ при элюировании водой. После лиофилизации получают 127 мг целевой натриевой соли с общей формулой C14H15N2O7SNaCOO-CH2-C6H5; 7,39 (M) : C6H5. ИК (вазелиновое масло): 1744; 1495 см-1. Масс-спектр (электрораспыление с отрицательной ионизацией) m/z: [M]- = 355. Пример 28 с. Фенилметиловый эфир транс-7-оксо-6-[(фенилсульфонил)окси]-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты. Растворяют 48 мг (0,152 ммоль) производного, полученного на стадии D в примере 28 а, в 1,2 мл дихлорметана. К смеси добавляют при температуре 20C 26 мкл уксусной кислоты, затем 88 мг Pd(PPh3)4 и оставляют взаимодействовать при перемешивании в течение 2 ч при температуре 20C. Разбавляют толуолом и выпаривают растворители при пониженном давлении. К полученному сырому продукту добавляют 1,5 мл дихлорметана, 25 мкл пиридина и 24 мкл бензолсульфонилхлорида. Оставляют взаимодействовать при температуре 20C при перемешивании в течение 1 ч, затем повторно добавляют 12,5 мкл пиридина и 10 мкл бензолсульфонилхлорида. Перемешивают в течение 15 мин при температуре 20C и разбавляют дихлорметаном. Затем последовательно промывают 10%-ным водным раствором винной кислоты, фосфатным буферным раствором с рН=7 и насыщенным раствором хлорида натрия в воде. Органическую фазу сушат над сульфатом магния и растворитель выпаривают при пониженном давлении. Получают 180 мг масла желтого цвета, которое очищают хроматографией на силикагеле с элюированием смесью дихлорметан/метил-трет-бутилового эфира 95/5. Таким образом получают 20 мг целевого соединения с общей формулой C20H20N2O6S (М=416,456 г). Выход составляет 31%. Спектр 1H-ЯMP (CDCl3, 300 МГц), химические сдвиги в м.д. и мультиплетность пиков: 1,83 (м) и[M+Na+CH3CH]+ = 480; [M+Na]+ = 439; [MH]+ = 417. Пример 28d. Фенилметиловый эфир транс-7-оксо-6-[(2-тиэнилсульфонил)окси]-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты. Взяв в качестве исходного 100 мг (0,316 ммоль) соединения, полученного на стадии D в примере 28 а, повторяют условия предыдущего примера, за исключением того, что вместо бензолсульфохлорида используют 2-тиэнилсульфонилхлорид. Таким образом получают 8 мг целевого соединения с общей формулой C18H18N2O6S2 (М=422,481 г). Выход составляет 30%. Спектр 1H-ЯMP (CDCl3, 300 МГц), химические сдвиги в м.д. и мультиплетность пиков: 1,84 (м) и 2,10-2,25: N-CH-CH2-CH2; 3,02 (д) и 3,24 (дт): O=C-N-CH2; 4,06 (м): O=C-N-CH2-CH; 4,14 (дд): O=C-NCH, 5,22 (с): COO-CH2-C6H5; 7,17 (дд) : SO3-C-S-CH=CH; 7,35 (уш.с): C6H5; 7,80 (дд): SO3-C=CH; 7,87 (м):[2 М+Na]+ = 445; 339, 298, 91. Пример 28 е. Фенилметиловый эфир транс-6-(2-гидрокси-2-оксоэтокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты. Стадия А. Фенилметиловый эфир транс-7-оксо-6-[2-оксо-2-(2-пропенилокси)этокси]-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты. Растворяют в инертной атмосфере 48 мг (0,15 ммоль) соединения, полученного на стадии D в примере 28 а, в 1,5 мл безводного дихлорметана. Добавляют при температуре 20C 18 мкл уксусной кислоты, затем 88 мг Pd(P(С 6 Н 5)3)4 и оставляют взаимодействовать при температуре 20C перемешивая в течение 1 ч. Фильтруют на силикагеле с элюированием смесью дихлорметан/трет-бутилметилового эфира 7/3. Растворитель выпаривают при пониженном давлении и получают 70 мг гидроксимочевины, которую разбавляют 2 мл дихлорметана, затем добавляют 85 мкл TEA и 64 мкл бромацетата аллила. Перемешивают при температуре 20C в течение 3,5 ч. Промывают последовательно 10%-ным водным раствором винной кислоты, водным буферным раствором с рН=7 и водой. Органическую фазу сушат и выпаривают растворитель при пониженном давлении. Таким образом получают 60 мг сырого продукта, который очищают хроматографией на силикагеле с элюированием смесью дихлорметан/метил-трет-бутилового эфира 90/10 с добавкой 0,1% TEA. Получают 22 мг целевого соединения с общей формулой C19H22N2O6, (М=374,396 г). Выход составляет 39%. Стадия В. Фенилметиловый эфир транс-6-(2-гидрокси-2-оксоэтокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты. Растворяют в инертной атмосфере 22 мг (0,0587 ммоль) полученного ранее соединения в 1 мл безводного дихлорметана. Добавляют при температуре 20C 10 мкл уксусной кислоты и 34 мг Pd(P(С 6 Н 5)3)4 и оставляют взаимодействовать при температуре 20C, перемешивая в течение 30 мин. Реакционную смесь упаривают и растворяют в толуоле для удаления уксусной кислоты. Таким образом получают 49 мг сырого продукта, к которому добавляют 2 мл фосфатного буферного раствора с рН 7, затем промывают 2 раза по 1 мл дихлорметана. Выпаривают растворитель и получают 46 мг сырого продукта, который очищают хроматографией на силикагеле с элюированием сначала смесью дихлорметан/трет-бутилметиловый эфир 90/10, затем смесью дихлорметан/этанол 60/40. Указанным образом получают 4,5 мг целевого соединения с общей формулой C37H37N2O6PC18H24N2O7 (М=380,398 г). Охлаждают до температуры от 0 до 5 С, затем вводят последовательно 5 мл TEA, далее 2,44 мл метансульфохлорида.
МПК / Метки
МПК: A61K 31/439, A61P 31/04, A61K 31/4995, A61K 31/55, A61K 31/553
Метки: соединений, качестве, активных, композиции, бета-лактамаз, новое, ингибиторов, содержащие, гетероциклических, применение, фармацевтические
Код ссылки
<a href="https://eas.patents.su/30-7220-novoe-primenenie-geterociklicheskih-soedinenijj-aktivnyh-v-kachestve-ingibitorov-beta-laktamaz-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Новое применение гетероциклических соединений, активных в качестве ингибиторов бета-лактамаз, и содержащие их фармацевтические композиции</a>


































