Доставляемая перорально фармацевтическая композиция, включающая активное соединение, содержащее аминосульфонильную группу (ингибитор сох-2), полиэтиленгликоль и улавливающий свободные радикалы антиоксидант
Номер патента: 6677
Опубликовано: 24.02.2006
Авторы: Брюггер Эндрью М., Гао Пин, Баэр Джулиан М., Гидо Джейн Э., Карим Азиз, Хассан Фред, Хуан Техуа, Форбс Джеймс К., Робинс Рассел Х.
Формула / Реферат
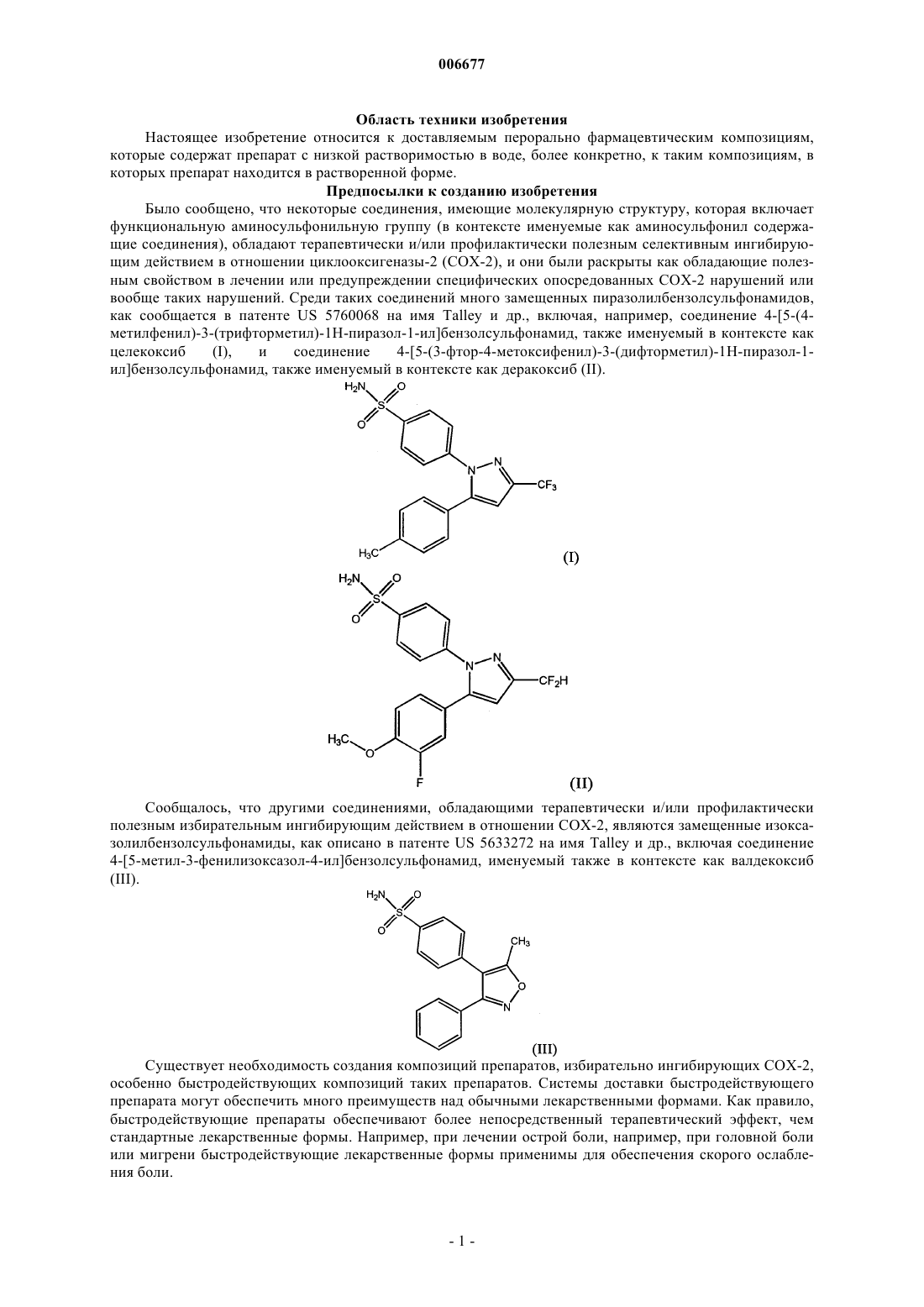
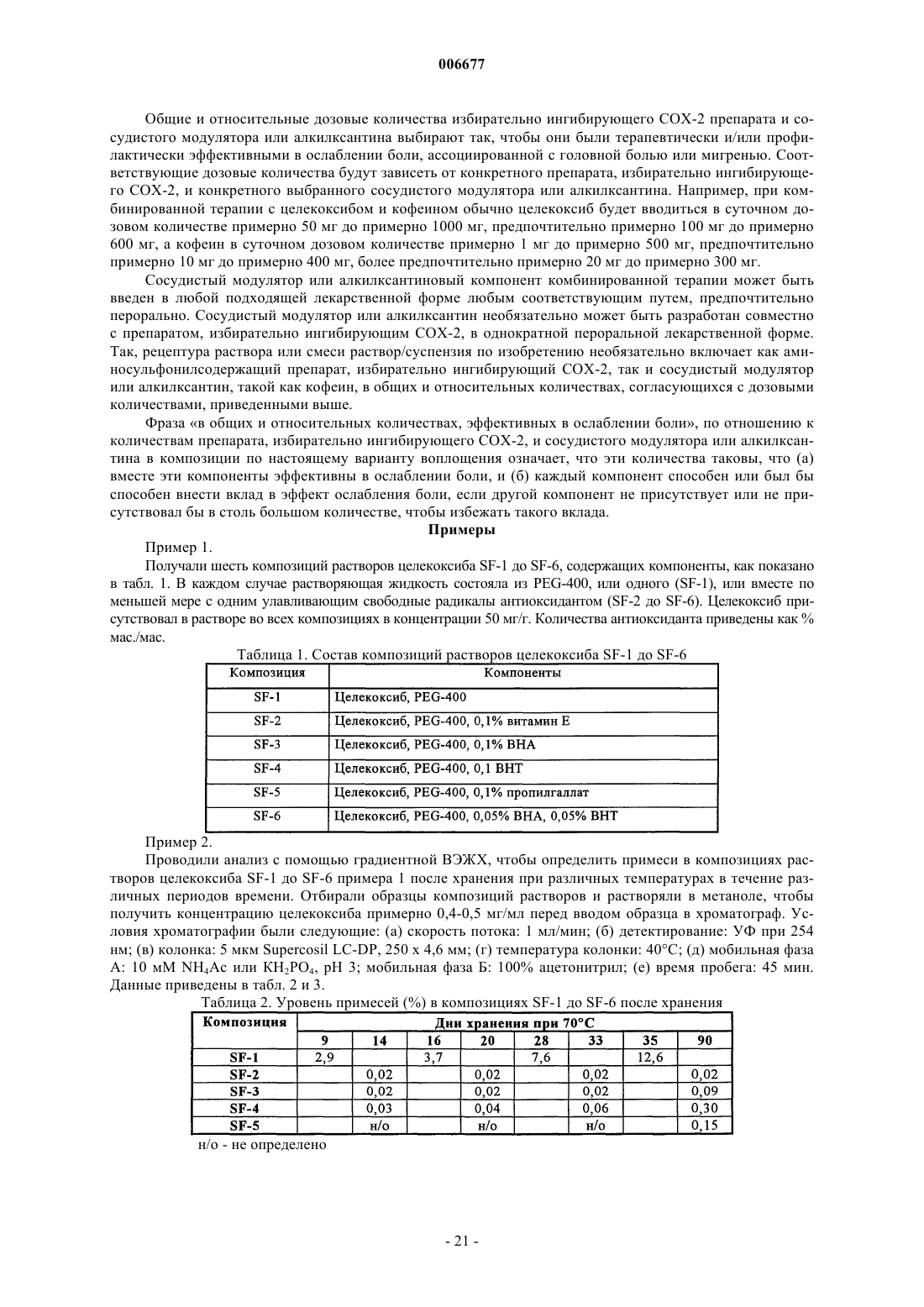
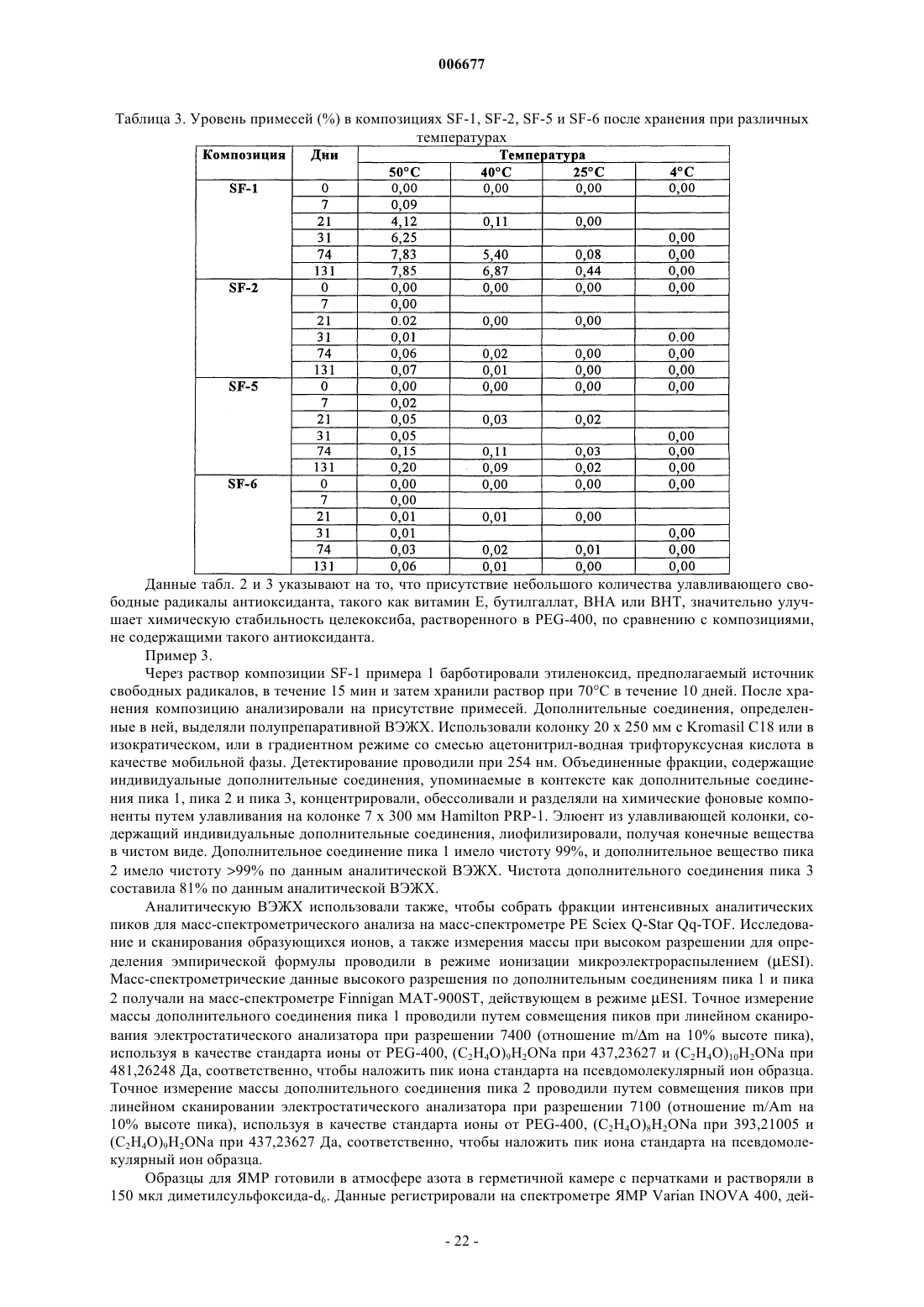
1. Доставляемая перорально фармацевтическая композиция, включающая: (а) препарат с низкой растворимостью в воде в терапевтически и/или профилактически эффективном количестве и (б) растворяющую жидкость, которая содержит по меньшей мере один фармацевтически приемлемый полиэтиленгликоль и по меньшей мере один улавливающий свободные радикалы антиоксидант, где значительная часть препарата находится в растворенной или солюбилизированной форме в растворяющей жидкости и где препарат является селективным ингибитором циклооксигеназы-2, содержащим функциональную аминосульфонильную группу, и представлен соединением формулы
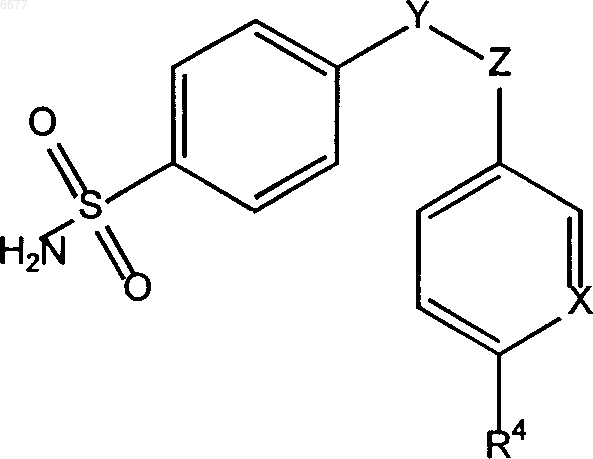
где R4 означает водород, (C1-C4)алкил или алкоксигруппу,
X означает азот или CR5, где R5 означает водород или галоид, и
Y и Z означают независимо друг от друга атомы углерода или азота, обозначая смежные атомы пяти-шестичленного цикла, который не замещен или замещен по одному или нескольким положениям оксогруппой, галоидом, метильной или галоидметильной группами,
и/или способен реагировать с полиэтиленгликолем или с продуктом деструкции полиэтиленгликоля с образованием соединения присоединения.
2. Композиция по п.1, где пяти-шестичленные циклы выбирают из группы, состоящей из циклопентенонового, фуранонового, метилпиразольного, изоксазольного и пиридинового колец, замещенных не более чем по одному положению.
3. Композиция по п.1, где препарат выбирают из группы, состоящей из целекоксиба, деракоксиба, валдекоксиба и JTE-522.
4. Композиция по п.1, где препаратом является целекоксиб.
5. Композиция по п.1, где препаратом является валдекоксиб.
6. Композиция по любому из пп.1-5, которая дополнительно включает сосудистый модулятор, где селективно ингибирующий циклооксигеназу-2 препарат и сосудистый модулятор присутствуют в общих и относительных количествах, эффективно ослабляющих боли при головной боли или мигрени.
7. Композиция по любому из пп.1-5, которая дополнительно включает производное алкилксантина, где селективно ингибирующий циклооксигеназу-2 препарат и производное алкилксантина присутствуют в общих и относительных количествах, эффективно ослабляющих боли при головной боли или мигрени.
8. Композиция по п.7, где производным алкилксантина является кофеин.
9. Композиция по любому из пп.1-8, где полиэтиленгликоль имеет среднюю молекулярную массу примерно 100-10000.
10. Композиция по любому из пп.1-8, где полиэтиленгликоль является жидкостью.
11. Композиция по любому из пп.1-10, где в растворяющей жидкости присутствует по меньшей мере один улавливающий свободные радикалы антиоксидант в общем количестве примерно 0,01-5%, предпочтительно примерно 0,01-1% по массе от композиции.
12. Композиция по любому из пп.1-11, где по меньшей мере один улавливающий свободные радикалы антиоксидант выбирают из группы, состоящей из витамина E, аскорбиновой кислоты и ее солей, бутилированного гидроксианизола, бутилированного гидрокситолуола, фумаровой кислоты и ее солей, гипофосфорной кислоты, яблочной кислоты, алкилгаллатов, тиосульфата натрия, сульфита натрия, бисульфита натрия и метабисульфита натрия.
13. Композиция по любому из пп.1-11, где по меньшей мере одним улавливающим свободные радикалы антиоксидантом является алкилгаллат, предпочтительно пропилгаллат.
14. Композиция по любому из пп.1-11, где по меньшей мере одним улавливающим свободные радикалы антиоксидантом является витамин E.
15. Композиция по любому из пп.1-14, где по существу весь препарат присутствует в композиции в растворенной или солюбилизированной форме.
16. Композиция по любому из пп 1-15, где растворяющая жидкость дополнительно включает понижающий мутность полимер.
17. Композиция по п.16, где по меньшей мере одним понижающим мутность полимером является гидроксипропилметилцеллюлоза.
18. Композиция по любому из пп.1-17, где растворяющая жидкость дополнительно включает по меньшей мере одну фармацевтически приемлемую жирную кислоту и по меньшей мере один фармацевтически приемлемый органический амин.
19. Композиция по п.18, где по меньшей мере одной жирной кислотой является олеиновая кислота.
20. Композиция по п.18 или 19, где по меньшей мере одним органическим амином является третичный амин, выбираемый из группы, состоящей из триэтаноламина и диметиламиноэтанола.
21. Композиция по любому из пп.1-20, которая включает одну или несколько дискретных стандартных доз, где терапевтически и/или профилактически эффективное количество препарата содержится в одной стандартной дозе или в небольшом количестве упомянутых стандартных доз.
22. Композиция по п.21, где каждая стандартная доза является заполненной жидкостью капсулой, имеющей капсульную оболочку.
23. Композиция по п.22, где оболочка капсулы включает снижающий мутность полимер.
24. Композиция по п.23, где снижающим мутность полимером является гидроксипропилметилцеллюлоза.
25. Способ лечения болезненного состояния или нарушения у субъекта, которому показано лечение ингибитором циклооксигеназы-2, включающий пероральное введение субъекту композиции по любому из пп.1-8.
26. Способ обезболивания, включающий пероральное введение эффективного ослабляющего боль количества композиции по любому из пп.1-5 субъекту, нуждающемуся в обезболивании.
27. Способ по п.26, где субъект страдает от головной боли или мигрени и где дополнительно субъекту вводят перорально сосудистый модулятор, причем селективно ингибирующий циклооксигеназу-2 препарат и сосудистый модулятор вводят в общих и относительных количествах, эффективных в ослаблении боли при головной боли или мигрени.
28. Способ по п.26, где субъект страдает от головной боли или мигрени и где субъекту дополнительно вводят перорально соединение алкилксантина, причем селективно ингибирующий циклооксигеназу-2 препарат и соединение алкилксантина вводят в общих и относительных количествах, эффективных в ослаблении боли при головной боли или мигрени.
29. Применение композиции по любому из пп.1-5 для получения лекарственного средства, применяемого для лечения терапевтического состояния или нарушения у субъекта, которому показано лечение ингибитором циклооксигеназы-2.
Текст
006677 Область техники изобретения Настоящее изобретение относится к доставляемым перорально фармацевтическим композициям,которые содержат препарат с низкой растворимостью в воде, более конкретно, к таким композициям, в которых препарат находится в растворенной форме. Предпосылки к созданию изобретения Было сообщено, что некоторые соединения, имеющие молекулярную структуру, которая включает функциональную аминосульфонильную группу (в контексте именуемые как аминосульфонил содержащие соединения), обладают терапевтически и/или профилактически полезным селективным ингибирующим действием в отношении циклооксигеназы-2 (СОХ-2), и они были раскрыты как обладающие полезным свойством в лечении или предупреждении специфических опосредованных СОХ-2 нарушений или вообще таких нарушений. Среди таких соединений много замещенных пиразолилбензолсульфонамидов,как сообщается в патенте US 5760068 на имя Talley и др., включая, например, соединение 4-[5-(4 метилфенил)-3-(трифторметил)-1H-пиразол-1-ил]бензолсульфонамид, также именуемый в контексте как целекоксиб(I),и соединение 4-[5-(3-фтор-4-метоксифенил)-3-(дифторметил)-1H-пиразол-1 ил]бензолсульфонамид, также именуемый в контексте как деракоксиб (II). Сообщалось, что другими соединениями, обладающими терапевтически и/или профилактически полезным избирательным ингибирующим действием в отношении СОХ-2, являются замещенные изоксазолилбензолсульфонамиды, как описано в патенте US 5633272 на имя Talley и др., включая соединение 4-[5-метил-3-фенилизоксазол-4-ил]бензолсульфонамид, именуемый также в контексте как валдекоксиб Существует необходимость создания композиций препаратов, избирательно ингибирующих СОХ-2,особенно быстродействующих композиций таких препаратов. Системы доставки быстродействующего препарата могут обеспечить много преимуществ над обычными лекарственными формами. Как правило,быстродействующие препараты обеспечивают более непосредственный терапевтический эффект, чем стандартные лекарственные формы. Например, при лечении острой боли, например, при головной боли или мигрени быстродействующие лекарственные формы применимы для обеспечения скорого ослабления боли.-1 006677 Заявки AU 200042711, 200043730 и 200043736 раскрывают композиции, включающие препарат, избирательно ингибирующий СОХ-2, агонист рецептора 5HT1 и кофеин, которые, как упоминается, применимы для лечения мигрени. Патент US 5993858 на имя Crison и Amidon раскрывает состав наполнителя для повышения биодоступности препарата с плохой растворимостью в воде. Упоминается, что состав является самомикроэмульгируемым и содержит масло или другой липидный материал, поверхностно-активный агент и гидрофильный дополнительный поверхностно-активный агент. Выбор поверхностно-активного агента, как упоминается, менее важен, чем выбор дополнительного поверхностно-активного агента, который, по сообщению, должен иметь значение HLB (гидрофильно-липофильного баланса) больше 8. Упоминается,что предпочтительным примером такого дополнительного поверхностно-активного агента являетсяLabrasol от Gattefosse, идентифицированный как продукт, составленный из среднецепочечных триглицеридов, полученных из кокосового масла, имеющий значение HLB, равное 14. Приготовленная смесь, содержащая 15 мг нифедипина в объеме 1 капсулы (0,5 мл), т.е. при концентрации 30 мг/мл, описывается как прозрачный раствор при 70 С, но полутвердое вещество при комнатной температуре. Процитированное в упомянутом выше патенте US 5993858 является предварительной работой Farah и др., в которой самомикроэмульгируемый состав был исследован для улучшения растворения индометацина in vitro. По сообщению, состав Farah и др. включал образующее масляную фазу веществоGelucire от Gattefosse Corporation, наряду с глицеридным продуктом на основе полиэтиленгликоля и остатков капроновой/каприловой кислот, имеющим значение HLB, равное 10, пропиленгликольлауратом, имеющим значение HLB, равное 4, и простым моноэтиловым эфиром диэтиленгликоля. Препараты с низкой растворимостью в воде иногда вводят перорально в виде суспензии в усвояемой водной жидкости. Например, суспензия порошка целекоксиба в яблочном соке в качестве наполнителя раскрывается в заявке WO 00/32189, включенной в контекст в виде ссылки. В заявке раскрывается также разбавленный раствор целекоксиба в смеси PEG-400 (полиэтиленгликоля, имеющего среднюю молекулярную массу примерно 400) и воды в соотношении 2:1 по объему. Композиции суспензии и раствора в заявке WO 00/32189, как отмечается, имеют сопоставимую биодоступность. Однако после перорального введения собакам время, необходимое для того, чтобы концентрация целекоксиба в сыворотке крови достигла максимального уровня (Тмакс), было меньше для композиции раствора, чем для суспензии. В приведенном выше патенте US 5760068 раскрывается, что его объект, производные пиразолилбензолсульфонамида, примерами которых являются целекоксиб и деракоксиб, может быть введен парентерально в виде изотонических растворов в ряде растворителей, включая полиэтиленгликоль и пропиленгликоль. В патенте раскрывается также, что являющиеся объектом соединения альтернативно могут находиться в капсуле с контролируемым высвобождением или в составе таблетки для перорального введения, где, например, такое соединение диспергировано в гидроксипропилметилцеллюлозе (НРМС). В приведенном выше патенте US 5633272 раскрывается, что его объект, изоксазолилбензолсульфонамиды, примером которых является валдекоксиб, может быть введен парентерально в виде изотонических растворов в ряде растворителей, включая полиэтиленгликоль и пропиленгликоль. В патенте раскрывается также, что являющиеся объектом соединения альтернативно могут находиться в капсуле с контролируемым высвобождением или в составе таблетки для перорального введения, где, например,такое соединение диспергировано в НРМС. Известно инкапсулирование жидких композиций, например, в мягкие или твердые желатиновые капсулы, чтобы обеспечить дискретную лекарственную форму. Многие аминосульфонилсодержащие селективно ингибирующие СОХ-2 препараты, включая целекоксиб, деракоксиб и валдекоксиб, имеют низкую растворимость в водной среде. Кроме того, для некоторых из них, например, целекоксиба, требуется относительно высокая доза. Эти свойства представляют практические проблемы при разработке концентрированных растворов быстродействующих препаратов для перорального введения на основе селективных ингибиторов СОХ-2. Что касается такой высокой дозы, то низкая растворимость препарата, размер капсулы или объем раствора, необходимого для обеспечения терапевтической дозы, становится лимитирующим фактором. Например, в случае препарата, который имеет растворимость 10 мг/мл данного растворителя и терапевтическую дозу 400 мг/день, потребовался бы прием внутрь 40 мл раствора. Такой объем может быть неудобным или неприемлемым для приема в усвояемой форме; данный объем представляет также особую проблему при необходимости инкапсулированной лекарственной формы, потому что капсулы, которые содержат более чем примерно 1,01,5 мл жидкости, обычно считаются слишком большими для комфортного проглатывания. Таким образом, в случае, когда раствор вводится в форме капсулы, было бы необходимо принять множество капсул,чтобы обеспечить требуемую дозу. Чтобы избежать подобных проблем, должен быть выбран такой растворитель, в котором препарат имеет относительно высокую растворимость. Более того, должен быть выбран растворитель, который не взаимодействует химически с препаратом или не разрушает его. Для растворов и/или суспензий, которые должны быть инкапсулированы в виде пероральных лекарственных форм, кроме того, должен быть выбран растворитель, который не разрушает, не размывает или не реагирует с материалом оболочки капсулы. Далее, жидкости, которые могут-2 006677 легко проникать через оболочку капсулы, например, вода в количестве больше чем примерно 5% от массы раствора и низкомолекулярные водорастворимые летучие органические соединения, такие, как спирты, кетоны, кислоты, амины и сложные эфиры, обычно непригодны для инкапсулирования. Смешиваемые с водой, нелетучие жидкости, такие как полиэтиленгликоли, были успешно применены при инкапсулировании композиций растворов. Более того, полиэтиленгликоли были также хорошими растворителями для препаратов с низкой растворимостью в воде, потому что известно, что они улучшают водорастворимость препарата. Например, целекоксиб, который имеет очень низкую растворимость в воде, высокорастворим (300 мг/г) в смеси PEG-400 и воды, 2:1. Однако заявители в настоящее время обнаружили, что полиэтиленгликоль при использовании в качестве растворителя для аминосульфонилсодержащего препарата, такого как целекоксиб, может привести к нестабильности препарата. Данная проблема представляет практические трудности при разработке химически устойчивого раствора аминосульфонилсодержащего препарата с использованием в качестве растворителя полиэтиленгликоля (который, как описано выше, может быть полезен в других отношениях). Как описано ниже, терапия селективно ингибирующими СОХ-2 препаратами с низкой растворимостью в воде показана при очень широкой совокупности опосредованных СОХ-2 состояний и нарушений,и некоторые клинически важные примеры включают такие препараты с функциональной аминосульфонильной группой. Следовательно, если проблема химической нестабильности препарата в растворе полиэтиленгликоля могла быть преодолена, значительное преимущество было бы реализовано в лечении опосредованных СОХ-2 состояний и нарушений, особенно в лечении острых нарушений, при которых желательно раннее ослабление боли или других симптомов. Особенно важным достижением в этой области явилось бы обеспечение эффективного способа лечения острой боли, например, головной боли или мигрени, с использованием химически устойчивого раствора аминосульфонилсодержащего препарата,включающего полиэтиленгликоль в качестве растворителя, если бы такой раствор мог быть получен. Краткое содержание изобретения В настоящее время обеспечена доставляемая перорально фармацевтическая композиция, включающая препарат с низкой растворимостью в воде и растворяющую жидкость, которая содержит по меньшей мере один фармацевтически приемлемый полиэтиленгликоль и по меньшей мере один фармацевтически приемлемый улавливающий свободные радикалы антиоксидант, где существенная часть препарата, по крайней мере примерно 15 мас.%, находится в растворенной или солюбилизированной форме в растворяющей жидкости и где препарат содержит функциональную аминосульфонильную группу и/или способен реагировать с полиэтиленгликолем или продуктом деструкции полиэтиленгликоля с образованием соединения присоединения. Термин растворяющая жидкость в контексте охватывает все компоненты жидкой среды, в который конкретный препарат растворен или солюбилизирован, включая, но без ограничения, один или несколько растворителей, сорастворители, антиоксиданты, ингибиторы кристаллизации, диспергаторы,поверхностно-активные вещества, дополнительные поверхностно-активные вещества, подсластители,ароматизаторы, красители и т.д. В предпочтительной в настоящее время композиции по изобретению по существу весь препарат находится в растворенной или солюбилизированной форме и в основном не существует в форме твердых частиц. Такая композиция именуется в контексте как раствор. Особенно предпочтительно, что раствор является тонкодисперсным самоэмульгируемым в стимулированной желудочной жидкости, как описано ниже. Альтернативная композиция по изобретению, в добавление к первой части препарата в растворенной или солюбилизированной форме, включает вторую часть препарата в виде частиц, диспергированных в растворяющей жидкости. В данном варианте воплощения изобретения часть препарата находится в растворе, а часть в суспензии. Такая композиция упоминается в контексте как раствор/суспензия. В предпочтительном в настоящее время варианте раствор или раствор/суспензия инкапсулированы в одну или несколько капсул, которые высвобождают препарат при разрушении оболочки капсулы вскоре после попадания в желудочно-кишечный тракт. В этом варианте воплощения изобретения оболочка капсулы необязательно включает полимерный целлюлозный компонент, в котором гидроксильные группы замещены метоксильными и/или гидроксипропоксигруппами, например НРМС. Было найдено, что композиции по изобретению решают проблему нестабильности препарата чрезвычайно эффективным способом. Так, впервые плохо растворимый в воде препарат, который содержит функциональную аминосульфонильную группу и/или способен реагировать с полиэтиленгликолем или продуктом деградации полиэтиленгликоля с образованием дополнительного соединения, присутствует в композиции устойчивого концентрированного раствора, содержащей полиэтиленгликоль в качестве растворителя. Предпочтительно такие композиции присутствуют в лекарственной форме, которая удобна для перорального введения. Композиции по изобретению особенно полезны, потому что они химически устойчивы, допускают высокую концентрацию препарата, пригодны для инкапсулироания и после их перо-3 006677 рального введения возможна быстрая абсорбция препарата в кровоток, обеспечивающая таким образом быстрое проявление терапевтического действия. Теоретически возможно предсказать, что плохо растворимый в воде препарат может обеспечить более быстрое проявление терапевтического эффекта при пероральном введении в растворе, особенно в самоэмульгируемом растворе, чем в виде частиц, поскольку не требуется процесс растворения в желудочно-кишечном тракте. Теоретически можно допустить даже большее преимущество при сравнении с твердой лекарственной формой, такой как таблетка, потому что в случае композиции раствора не требуется ни дезинтеграция, ни растворение. Препарат, введенный в усвояемом растворе, может быть дополнительно доступен для абсорбции выше по ходу пищеварительного тракта, например, в ротовой полости и пищеводе, чем препарат, который становится доступным для адсорбции только при измельчении носителя композиции в желудке или брюшной полости. Дополнительное преимущество жидких лекарственных форм в виде усвояемых растворов и растворов/суспензий для многих пациентов состоит в том, что данные лекарственные формы легко глотать. Еще одно дополнительное преимущество усвояемых жидких лекарственных форм состоит в том, что количественное измерение доз постоянно меняется, обеспечивая бесконечно широкий диапазон дозировки. Выгоды от легкого проглатывания и широкого диапазона дозировки особенно благоприятны для младенцев, детей и пожилых людей. При инкапсулировании раствор или раствор/суспензия могут обеспечить объект с полезными показателями быстрой абсорбции, ассоциированными с жидкими композициями, в добавление к удобству дискретной, легкой для глотания капсульной формы. Растворы с высокими концентрациями, допустимые по настоящему изобретению, являются полезными по нескольким причинам. Во-первых, концентрированные растворы менее дорогостоящие при упаковке и легче для транспортировки и манипулирования, чем разбавленные растворы. Во-вторых, концентрированные растворы обеспечивают гибкость введения, т.к. они могут быть введены при любой требуемой степени разбавления. И в-третьих, концентрированные растворы препаратов, особенно при инкапсулировании, не требуют приема больших объемов жидкости, что может быть неудобным для многих групп пациентов. В одном варианте воплощения изобретения обеспечивается способ обезболивания, включающий пероральное введение пациенту, нуждающемуся в обезболивании, эффективного количества ослабляющей боль композиции по изобретению, включающей аминосульфонилсодержащий препарат на основе селективного ингибитора СОХ-2. В другом варианте воплощения обеспечивается способ лечения и/или предупреждения головной боли или мигрени, включающий пероральное введение пациенту, нуждающемуся в таком лечении или предупреждении, композиции аминосульфонилсодержащего препарата на основе селективного ингибитора СОХ-2 по изобретению и сосудистого модулятора, например, метилксантина, где препарат на основе селективного ингибитора СОХ-2 и сосудистый модулятор вводят в эффективных, ослабляющих боль общем и относительных количествах. Препарат на основе селективного ингибитора СОХ-2 и сосудистый модулятор могут быть введены как компоненты отдельных композиций или как одна композиция. Такая одна композиция, включающая (а) аминосульфонилсодержащий препарат на основе селективного ингибитора СОХ-2, созданный, как предусмотрено в контексте, и (б) сосудистый модулятор, является дополнительным вариантом воплощения изобретения. В настоящее время предпочтительным метилксантином является кофеин. Другие отличительные признаки данного изобретения будут частично очевидны и частично указаны ниже. Подробное описание изобретения Новые фармацевтические композиции по настоящему изобретению включают одну или несколько доставляемых перорально стандартных доз. Термин доставляемые перорально означает в контексте способы, пригодные для перорального введения. Термин пероральное введение означает в контексте любую форму доставки терапевтического агента или композиции на его основе пациенту, где агент или композиция помещается в полость рта пациента независимо от того, проглатывается или нет агент или композиция. Таким образом, термин пероральное введение включает внутриротовое и подъязычное введение,а также введение в пищевод. Абсорбция агента может происходить в любой области или областях желудочно-кишечного тракта, включая ротовую полость, пищевод, желудок, двенадцатиперстную кишку,тощую кишку, подвздошную кишку и ободочную кишку. Термин стандартная доза означает в контексте часть фармацевтической композиции, которая содержит количество терапевтического агента, пригодное для однократного перорального введения, чтобы обеспечить терапевтический эффект. Обычно одна стандартная доза или небольшое число (примерно до 4) стандартных доз обеспечивает количество агента, достаточное для получения требуемого эффекта. Аминосульфонилсодержащий препарат Каждая стандартная доза или небольшое число стандартных доз содержит в терапевтически и/или профилактически эффективном общем количестве препарат с низкой растворимостью в воде, который-4 006677 содержит функциональную аминосульфонилсодержащую группу и/или способен реагировать с полиэтиленгликолем или продуктом деградации полиэтиленгликоля с образованием дополнительного соединения. Термин препарат с низкой растворимостью в воде или препарат с плохой растворимостью в воде относится в контексте к любому лекарственному соединению, имеющему растворимость в воде, измеренную при 37 С, не выше чем примерно 10 мг/мл и предпочтительно не выше чем примерно 1 мг/мл. Это предполагает, что композиции по изобретению особенно полезны в случае препаратов, имеющих растворимость в воде, измеренную при 37 С, не выше чем примерно 0,1 мг/мл. Будет понятно, что терапевтически и/или профилактически эффективное количество препарата для субъекта зависит, среди прочего, от массы тела субъекта. В контексте термин субъект, которому может вводиться терапевтический агент или его композиция, включает пациента-человека любого пола и возраста и также включает любое, отличное от человека, млекопитающее, особенно домашнее или сопутствующее животное, в качестве иллюстрации кошку, собаку или лошадь. Термин функциональная аминосульфонильная группа в контексте относится к функциональной группе, имеющей следующую структуру: где волнистая линия представляет связь, с помощью которой функциональная группа соединена с остатком молекулы препарата; и R означает водород или заместитель, который сохраняет способность полиэтиленгликоля или продукта его деградации реагировать с аминогруппой, смежной с R, с образованием дополнительного соединения. Иллюстративные примеры таких заместителей включают частично ненасыщенный гетероциклил, гетероарил, циклоалкенил, арил, алкилкарбонил, формил, галоид, алкил, галоидалкил, оксо, циано, нитро, карбоксил, фенил, алкокси, аминокарбонил, алкоксикарбонил, карбоксиалкил, цианоалкил, гидроксиалкил, гидроксил, алкоксиалкилоксиалкил, галоидалкилсульфонилокси,карбоксиалкоксиалкил, циклоалкилалкил, алкинил, гетероциклилокси, алкилтио, циклоалкил, гетероциклил, циклоалкенил, аралкил, гетероциклилалкил, гетероарилкарбонил, алкилтиоалкил, арилкарбонил,аралкилкарбонил, аралкенил, алкоксиалкил, арилтиоалкил, арилоксиалкил, аралкилтиоалкил, аралкоксиалкил, алкоксикарбонилалкил, аминокарбонилалкил, алкиламинокарбонил, N-ариламинокарбонил, Nалкил-N-ариламинокарбонил, алкиламинокарбонилалкил, алкиламино, N-ариламино, N-аралкиламино,N-алкил-N-аралкиламино, N-алкил-N-ариламино, аминоалкил, алкиламиноалкил, N-ариламиноалкил, Nаралкиламиноалкил, N-алкил-N-аралкиламиноалкил, N-алкил-N-ариламиноалкил, арилокси, аралкокси,арилтио, аралкилтио, алкилсульфинил, алкилсульфонил и т.д. Не ограничивающие изобретение иллюстративные примеры аминосульфонилсодержащих препаратов включают АВТ-751 от Eisai (N-(2-4-гидроксифенил)амино)-3-пиридил)-4-метоксибензолсульфонамид); алпироприд; амосулалол; ампренавир; амсакрин; аргатробан; асулакрин; азосемид;Zeria 2-[2-(4-хлорфенилсульфониламинометил)индан-5-ил]уксусную кислоту; зафирлукаст; зонисамид; и их соли. В предпочтительном варианте воплощения изобретения аминосульфонилсодержащий препарат представляет собой селективный ингибитор СОХ-2 с низкой растворимостью в воде. Соответствующими препаратами, селективно ингибирующими СОХ-2, являются соединения, имеющие формулу (IV) где А означает заместитель, выбираемый из частично ненасыщенных либо ненасыщенных гетероциклических или частично ненасыщенных либо ненасыщенных карбоциклических колец, предпочтительно гетероциклильную группу, выбираемую из пиразолильной, фураноильной, изоксазолильной, пиридинильной, циклопентенонильной и пиридазинонильной групп;X означает атом кислорода, серы или СН 2;R1 означает по меньшей мере один заместитель, выбираемый из гетероциклила, циклоалкила, циклоалкенила и арила, и является необязательно замещенным в замещаемом положении одним или несколькими радикалами, выбираемыми из алкила, галоидалкила, циано, карбоксила, алкоксикарбонила,гидроксила, гидроксиалкила, галоидалкокси, амино, алкиламино, ариламино, нитро, алкоксиалкила, алкилсульфинила, галоида, алкокси и алкилтио;R3 означает один или несколько радикалов, выбираемых из водорода, галоида, алкила, алкенила,алкинила, оксо, циано, карбоксила, цианоалкила, гетероциклилокси, алкилокси, алкилтио, алкилкарбонила, циклоалкила, арила, галоидалкила, гетероциклила, циклоалкенила, аралкила, гетероциклилалкила,ацила, алкилтиоалкила, гидроксиалкила, алкоксикарбонила, арилкарбонила, аралкилкарбонила, аралкенила, алкоксиалкила, арилтиоалкила, арилоксиалкила, аралкилтиоалкила, аралкоксиалкила, алкоксиаралкоксиалкила, алкоксикарбонилалкила, аминокарбонила, аминокарбонилалкила, алкиламинокарбонила,N-ариламинокарбонила, N-алкил-N-ариламинокарбонила, алкиламинокарбонилалкила, карбоксиалкила,алкиламино, N-ариламино, N-аралкиламино, N-алкил-N-аралкиламино, N-алкил-N-ариламино, аминоалкила, алкиламиноалкила, N-ариламиноалкила, N-apалкиламиноалкила, N-алкил-N-аралкиламиноалкила,N-алкил-N-ариламиноалкила, арилокси, аралкокси, арилтио, аралкилтио, алкилсульфинила, алкилсульфонила, аминосульфонила, алкиламиносульфонила, N-ариламиносульфонила, арилсульфонила и Nалкил-N-ариламиносульфонила, причем R3 необязательно замещен в замещаемом положении одним или несколькими радикалами, выбираемыми из алкила, галоидалкила, циано, карбоксила, алкоксикарбонила,гидроксила, гидроксиалкила, галоидалкокси, амино, алкиламино, ариламино, нитро, алкоксиалкила, алкилсульфинила, галоида, алкокси и алкилтио; иR4 выбирают из водорода и галоида. Особенно подходящими препаратами, селективно ингибирующими СОХ-2, являются соединения,имеющие формулу (V) где R4 означает водород, (С 1-С 4)алкил или алкоксигруппу, X означает азот или CR5, гдеR5 означает водород или галоид, иY и Z означают независимо друг от друга атомы углерода или азота, обозначая смежные атомы пяти-шестичленного цикла, который не замещен или замещен по одному или нескольким положениям оксогруппой, галоидом, метильной или галоидметильной группами. Такими предпочтительными пятишестичленными циклами являются циклопентеноновый, фураноновый, метилпиразольный, изоксазольный и пиридиновый циклы, замещенные не более чем по одному положению. В качестве иллюстрации композиции по изобретению пригодны для целекоксиба, деракоксиба, валдекоксиба и JTE-522, более конкретно для целекоксиба и валдекоксиба. Изобретение иллюстрировано в контексте с особой ссылкой на целекоксиб, и будет понятно, что любой препарат с низкой растворимостью в воде, который содержит функциональную аминосульфонильную группу и/или способен реагировать с полиэтиленгликолем или продуктом деградации полиэтиленгликоля с образованием дополнительного соединения, при необходимости может быть заменен полностью или частично на целекоксиб в композициях, описанных в контексте. Там, где препаратом является целекоксиб, композиция обычно включает целекоксиб в терапевтически и/или профилактически эффективном общем количестве примерно 10-1000 мг на стандартную дозу. Там, где препаратом является иной, чем целекоксиб, препарат на основе селективного ингибитора СОХ 2, количество его на стандартную дозу является терапевтически эквивалентным примерно 10-1000 мг целекоксиба. В том случае, где пациентом является ребенок или небольшое животное (например, собака), количество, к примеру, целекоксиба относительно низкое, в предпочтительном диапазоне 10-1000 мг, очевидно должно соответствовать терапевтической эффективности. В том случае, где пациентом является взрослый человек или крупное животное (например, лошадь), очевидно, что для терапевтической эффективности требуются стандартные дозы, содержащие большее количество целекоксиба. Для взрослого человека терапевтически эффективное количество целекоксиба на стандартную дозу в композиции по настоящему изобретению обычно составляет 50-400 мг. Особенно предпочтительные количества целекоксиба на стандартную дозу составляют примерно 100-200 мг, например, около 100 мг или около 200 мг. Для других препаратов на основе селективных ингибиторов СОХ-2 количество препарата на стандартную дозу может находиться в диапазоне, который, как известно, является терапевтически эффективным для таких препаратов. Предпочтительно количество препарата на стандартную дозу находится в диапазоне, обеспечивающем терапевтическую эквивалентность целекоксибу при дозовых интервалах,указанных непосредственно выше. Форма композиций по изобретению Композиции по настоящему изобретению предпочтительно находятся в форме концентрированного раствора, который может или не может быть инкапсулирован как дискретный продукт. Если инкапсулировать, то предпочтительно одного такого продукта или небольшого количества (примерно до 10, более предпочтительно не более чем примерно 4) таких продуктов достаточно для того, чтобы обеспечить дневную дозу. Альтернативно композиции по настоящему изобретению имеют форму концентрированной усвояемой жидкости. Термин усвояемая жидкость используется в контексте при упоминании не инкапсулированной, по существу гомогенной подвижной массы, такой как раствор или раствор/суспензия, вводимой перорально или проглатываемой в жидком виде, и от которой заметно отделимы однократные стандартные дозы. Термин по существу гомогенная со ссылкой на фармацевтическую композицию, которая содержит несколько компонентов, означает, что компоненты достаточно хорошо смешаны, так что индивидуальные компоненты не присутствуют в виде дискретных слоев и не образуют градиентов концентрации внутри композиции. Особая стандартная доза может быть выбрана для обеспечения требуемой частоты введения, используемой для достижения обусловленной дневной дозы. Например, дневное дозированное количество 400 мг может быть обеспечено введением дважды в день одной стандартной дозы 200 мг или двух стандартных доз по 100 мг. Количество композиции, которое вводится, и дозовый режим для лечения состояния или нарушения будут зависеть от множества факторов, включая возраст, массу, пол и состояние здоровья пациента, природу и тяжесть состояния или нарушения, путь и частоту ведения и конкретный выбранный препарат, и, таким образом, может изменяться в широких пределах. Однако предполагается, что для большинства целей режим введения однократно или дваждыв день обеспечивает требуемую терапевтическую эффективность.-7 006677 Композиция по изобретению содержит аминосульфонилсодержащий препарат с низкой растворимостью в воде, по меньшей мере часть которого находится в растворенной или солюбилизированной форме в растворяющей жидкости, пригодной для перорального введения. Растворяющая жидкость содержит по меньшей мере один фармацевтически приемлемый полиэтиленгликоль в качестве растворителя, по меньшей мере один фармацевтически приемлемый улавливающий свободные радикалы антиоксидант и необязательно один или несколько дополнительных компонентов, включая фармацевтически приемлемые наполнители. Термин наполнитель означает в контексте любое вещество, кроме терапевтического агента, используемое в качестве носителя или наполнителя для доставки терапевтического агента пациенту или добавляемое к фармацевтической композиции для улучшения манипулирования, хранения, дезинтеграции, дисперсии, растворения, высвобождения или органолептических свойств, или для того, чтобы сделать возможным образование либо благоприятствовать образованию стандартной дозы композиции в виде дискретной формы, такой как капсула, применимой для перорального введения. В качестве иллюстрации, а не ограничения, наполнители могут включать разбавители, дезинтеграторы, диспергирующие агенты, связывающие агенты, адгезивы, увлажняющие агенты, смазки, скользящие агенты, ингибиторы кристаллизации, стабилизаторы, вещества, добавляемые для маскировки или нейтрализации неприятного вкуса или запаха, ароматизаторы, красители,отдушки, консерванты и вещества, добавляемые для улучшения вида композиции. Такие необязательные дополнительные компоненты должны быть физически и химически совместимы с другими ингредиентами композиции и не должны быть вредными для реципиента. Важно, что некоторые из перечисленных выше классов наполнителей перекрывают друг друга. Композиции по настоящему изобретению можно адаптировать к введению любым подходящим пероральным путем с помощью подбора компонентов соответствующей растворяющей жидкости и дозы препарата, эффективной при предполагаемом лечении. Соответственно компоненты, используемые в растворяющей жидкости,сами могут быть твердыми веществами, полутвердыми веществами, жидкостями или их комбинациями. Усвояемые композиции по изобретению могут быть, например, в форме раствора, раствора/суспензии, эликсира, сиропа или любой другой жидкой формы, приемлемо адаптированной к пероральному введению. Такие композиции могут также содержать наполнители, выбранные, например, из эмульгирующих и суспендирующих веществ, подслащающих и ароматизирующих веществ, поверхностно-активных агентов и дополнительных поверхностно-активных агентов. Альтернативно, как подробно описано ниже, композиция по настоящему изобретению может быть приготовлена в виде дискретных форм стандартной дозы, например капсул, имеющих оболочку, которая в качестве иллюстрации включает желатин и/или снижающий мутность полимер, такой как гидроксипропилметилцеллюлоза, каждая капсула, содержащая жидкую композицию, включает предварительно обусловленное количество препарата в растворяющей жидкости. Жидкая композиция, находящаяся внутри капсулы, высвобождается путем разрушения оболочки при контакте с желудочно-кишечной жидкостью. Конкретный механизм разрушения капсульной оболочки не важен и может включать такие механизмы, как эрозия, деградация, растворение и т.д. Композиции по изобретению могут быть приготовлены любым подходящим способом фармации,который включает этап объединения препарата и компонентов растворяющей жидкости. Полиэтиленгликоль как растворитель, улавливающий свободные радикалы антиоксидант и другие необязательные компоненты растворяющей жидкости перед добавлением препарата могут сначала смешиваться; альтернативно препарат может быть смешан с растворителем до прибавления других компонентов. Порядок прибавления обычно не является важным, но обычно предпочтительно прибавлять препарат к растворяющей жидкости после прибавления антиоксиданта. Обычно композиции целекоксиба по изобретению получают путем равномерного и тщательного смешивания целекоксиба с растворяющей жидкостью таким образом, чтобы по меньшей мере часть целекоксиба, предпочтительно в основном весь целекоксиб,растворялись или солюбилизировались в растворяющей жидкости; и затем при необходимости инкапсулирование полученного раствора или раствора/суспензии, например, в твердые или мягкие капсулы. Предпочтительным вариантом воплощения изобретения является композиция, содержащая терапевтически эффективное количество аминосульфонилсодержащего препарата с низкой растворимостью в воде, например, целекоксиба или валдекоксиба, по существу полностью растворенных в растворяющей жидкости, включающей по меньшей мере один фармацевтически приемлемый полиэтиленгликоль и по меньшей мере один фармацевтически приемлемый улавливающий свободные радикалы антиоксидант. В данном варианте воплощения фактически нет доли препарата, присутствующей в форме твердых частиц. Композиции по данному варианту могут быть составлены или в усвояемой, или в дискретной лекарственной форме (например, инкапсулированной). Предпочтительно концентрированные растворы по данному варианту воплощения имеют концентрацию препарата примерно 10-75%, более предпочтительно 20-75% от массы композиции. Растворитель Любой фармацевтически приемлемый полиэтиленгликоль (PEG) может применяться в качестве растворителя в композиции по изобретению. Предпочтительно PEG имеет среднюю молекулярную массу примерно 100-10000 и более предпочтительно примерно 100-1000. Еще предпочтительнее, когда PEG-8 006677 является жидкой фракцией. Не ограничивающие изобретение примеры полиэтиленгликолей, которые могут использоваться в растворяющих жидкостях по данному изобретению, включают PEG-200, PEG350, PEG-400, PEG-450 и PEG-600. Смотри, например, Flick (1998): Industrial Solvents Handbook. 5 изд.,Noyes Data Corporation, Westwood, NJ, стр. 392. В настоящее время предпочтительный PEG имеет среднюю молекулярную массу примерно 375-450, в качестве примера служит PEG-400. Как отмечено выше, такие полиэтиленгликоли, как PEG-400, обладают многими полезными свойствами в качестве растворителей для препаратов с плохой растворимостью в воде. Например, в случае целекоксиба препарат может быть растворен или солюбилизирован при очень высокой концентрации вPEG-400, способствуя обеспечению терапевтически эффективной дозы в очень небольшом объеме растворяющей жидкости. Это особенно важно там, где образующийся раствор должен быть инкапсулирован, т.к. могут быть приготовлены капсулы удобного для проглатывания размера, содержащие терапевтически эффективную дозу даже такого препарата, как целекоксиб, для которого необходимым условием эффективности является относительно высокая доза. Однако настоящие заявители столкнулись с неожиданной проблемой, когда целекоксиб был создан в растворенной или солюбилизированной форме в PEG-400. При хранении композиции раствора целекоксиба в PEG-400 образовывалась примесь или несколько примесей. Данные примеси прослеживались при реакции целекоксиба не с самим PEG-400, но с продуктом распада PEG-400. He углубляясь в теорию, считается, что продуктом распада, который реагирует с целекоксибом, является оксид этилена. Продукты реакции включают дополнительные соединения, имеющие химические структуры, которые в настоящее время определены и раскрываются ниже. Предполагается, что любое лекарственное соединение, содержащее функциональную аминосульфонильную группу, обладает потенциалом взаимодействия подобным образом с продуктом распада полиэтиленгликоля. Проблема химической неустойчивости такого препарата в полиэтиленгликоле в качестве растворителя или в действительности любого препарата, который может реагировать с полиэтиленгликолем или продуктом его распада с образованием дополнительного соединения, в настоящее время решена. По настоящему изобретению присутствие в растворяющей жидкости улавливающего свободные радикалы антиоксиданта значительно повышает химическую стабильность препарата. Улавливающий свободные радикалы антиоксидант Известно, что некоторые лекарственные вещества в водных средах чувствительны к окислительной деградации, особенно в присутствии кислорода. Известно, что, например, перекись водорода является генератором свободных радикалов и может образовывать свободные радикалы, которые взаимодействуют с лекарственными веществами в таких средах так, что вызывают распад лекарственных средств. Антиоксиданты используют в данной области, чтобы ограничить такой распад лекарственного вещества,опосредованный перекисями. Как правило, в такой ситуации антиоксиданты действуют путем предоставления электронов и легко доступных атомов водорода, которые легче связываются свободными радикалами, чем теми, которые защищают функциональные группы препарата. См. Ansel и др. (1995): Pharmaceutical Dosage Forms and Drug Delivery Systems. 6-ое издание, стр. 117. Проблема, с которой столкнулись настоящие заявители, отличается от описанной выше ситуации,по меньшей мере, в двух отношениях. Во-первых, по настоящему изобретению считается, что именно полиэтиленгликоль, а не препарат, непосредственно деградирует под действием свободных радикалов. Во-вторых, существует убедительное доказательство, позволяющее предположить, что механизм деградации не зависит от перекиси (т.е. деградация полиэтиленгликоля происходит по независимому от кислорода механизму). Неожиданно заявители обнаружили, что присутствие небольшого количества улавливающего свободные радикалы антиоксиданта в композиции по изобретению значительно улучшает химическую стабильность препарата. Эта находка полностью отличается от описанной выше ситуации, при которой антиоксиданты ранее использовались для предотвращения деградации препарата. Не вдаваясь в теорию,считается, что улавливающий свободные радикалы антиоксидант подавляет, замедляет или приостанавливает деградацию полиэтиленгликоля, тем самым ограничивая или подавляя химическое взаимодействие между продуктами деградации полиэтиленгликоля и препаратом. Поэтому композиция по настоящему изобретению включает по меньшей мере один фармацевтически приемлемый улавливающий свободные радикалы антиоксидант. Улавливающий свободные радикалы антиоксидант является противоположностью не улавливающему свободные радикалы антиоксиданту, т.е антиоксиданту, который не обладает свойствами ловушки свободных радикалов. Не ограничивающие изобретение иллюстративные примеры соответствующих антиоксидантов, улавливающих свободные радикалы, включают -токоферол (витамин Е), аскорбиновую кислоту (витамин С) и их соли,включая аскорбат натрия, пальмитиновый эфир аскорбиновой кислоты, бутилированный гидроксианизол(ВНА), бутилированный гидрокситолуол (ВНТ), фумаровую кислоту и ее соли, гипофосфорную кислоту,яблочную кислоту, алкилгаллаты, например, пропилгаллат, октилгаллат и лаурилгаллат, тиосульфат натрия, сульфит натрия, бисульфит натрия и метабисульфит натрия. Предпочтительными улавливающими свободные радикалы антиоксидантами являются алкилгаллаты, витамин Е, ВНА и ВНТ. Более предпоч-9 006677 тительно по меньшей мере одним улавливающим свободные радикалы антиоксидантом является пропилгаллат. Один или несколько улавливающих свободные радикалы антиоксидантов присутствует в композиции по изобретению в общем количестве, эффективном для существенного снижения образования дополнительного соединения, обычно в общем количестве примерно 0,01-5%, предпочтительно примерно 0,01-2,5% и более предпочтительно примерно 0,01-1% от массы композиции. Другие наполнители Композиции по изобретению необязательно содержат фармацевтически приемлемые наполнители,отличные от полиэтиленгликоля и улавливающих свободные радикалы антиоксидантов. Например, в случае композиции раствора такие наполнители могут включать сорастворители, подсластители, ингибиторы кристаллизации, консерванты, диспергаторы, эмульгирующие вещества и т.д. Путем отбора и комбинации наполнителей могут быть предусмотрены композиции, обладающие улучшенными характеристиками в отношении концентрации препарата, растворения, диспергирования, эмульгирования, эффективности, аромата, соответствия требованиям пациента и других свойств. Композиция, особенно композиция раствора по изобретению необязательно включает один или несколько фармацевтически приемлемых сорастворителей. Не ограничивающие изобретение примеры сорастворителей включают дополнительные гликоли,спирты, например, этанол и н-бутанол; триглицериды олеиновой и линоленовой кислот, например, масло соевых бобов; триглицериды каприловой/каприновой кислот, например, Miglyol 812 от Huls; моно- и диглицериды, например, Capmul MCM от Abitec; глицериды на основе полиоксиэтилена и каприловой/каприновой кислот, такие, как моно- и диглицериды на основе полиоксиэтилена (8) и каприловой/каприновой кислот, например, Labrasol от Gattefosse; жирнокислотные сложные эфиры пропиленгликоля, например, лаурат пропиленгликоля; модифицированное полиоксиэтиленом (35) касторовое масло, например, Cremophor EL от BASF; полиоксиэтиленглицерилтриолеат, например, Tagat TO отGoldschmidt; низшие алкиловые эфиры жирных кислот, например, этиловый эфир масляной кислоты,этиловый эфир каприловой кислоты и этиловый эфир олеиновой кислоты; и вода. Композиция по изобретению, особенно композиция раствора, необязательно включает фармацевтически приемлемую жирную кислоту и фармацевтически приемлемый органический амин (в контексте упоминаемый также как пара жирная кислота/органический амин) в таких общих и относительных количествах, что композиция является тонкодисперсной самоэмульгируемой в симулированной желудочной жидкости. Термин симулированная желудочная жидкость и его аббревиатура SGF, как они используются в контексте, означают водный раствор 0,01 М хлористо-водородной кислоты и 0,15 М хлорида натрия, имеющий рН примерно 2. Не вдаваясь в теорию, считается, что пара жирная кислота/амин,когда она присутствует в композиции по изобретению, способствует образованию заряженных тонкодисперсных эмульсионных капелек при контакте композиции с водной средой, такой как SGF. Является ли композиция тонкодисперсной самоэмульгируемой в SGF, как обозначено в контексте, может быть определено в качестве иллюстрации в соответствии с опытом I. Опыт I А. Аликвотную долю 400 мкл исследуемой композиции помещают в сосуд с завинчивающейся пробкой и боковым отводом, содержащий 20 мл SGF (поддерживаемый при 37 С в течение опыта), чтобы получить анализируемую жидкость. Б. Анализируемую жидкость легко перемешивают при 75 об/мин в течение 2 мин, используя орбитальное встряхивающее устройство, чтобы благоприятствовать эмульгированию. В. Аликвотную долю 5-50 мкл анализируемой жидкости отбирают через боковой отвод, используя пипетку, и спускают из пипетки в сосуд для образцов. Г. Используют насос (например, модель RHOCKC-LF, Fluid Metering Inc., Syosset, NY), чтобы прокачать исследуемую жидкость из сосуда для образцов через комбинированный датчик рассеяние/затемнение (например, LE4000-0,5, Particle Sizing Systems, Santa Barbara, CA) со скоростью 1 мл/мин в течение 1 мин. Д. Частицы эмульсии считают по отдельности с помощью рассеяния света в диапазоне размера (т.е. диаметра) 0,5-1 мкм и с помощью затемнения света в диапазоне размера выше 1 мкм, используя программу фирмы-поставщика (например, версию 1,59). Е. Получают график зависимости количества (т.е. не взвешенных) или объема (т.е. взвешенных) эмульсионных частиц от их диаметра. Ж. Интеграция зависимости, оценивающая все разбавления, позволяет установить общее число или объем эмульсионных частиц, присутствующих в анализируемой жидкости, которые достаточно велики для определения с помощью датчика. З. Если опыт I приводит примерно к 25 или более объемным процентам эмульсионных частиц,имеющих диаметр 1 мкм или меньше, то исследуемая композиция считается тонкодисперсной самоэмульгируемой. Предпочтительные жирные кислоты имеют насыщенную или ненасыщенную (С 6-С 24)углеродную цепь. Не ограничивающие изобретение примеры соответствующих жирных кислот включают олеиновую- 10006677 кислоту, октановую кислоту, капроновую кислоту, каприловую кислоту, каприновую кислоту, элеостеариновую кислоту, лауриновую кислоту, миристиновую кислоту, пальмитиновую кислоту, стеариновую кислоту, эйкозановую кислоту, элаидиновую кислоту, линолевую кислоту, линоленовую кислоту, эйкозапентаеновую кислоту и докозагексаеновую кислоту. Олеиновая кислота является особенно предпочтительной жирной кислотой. Предпочтительные органические амины имеют (С 2-С 8)углеродную цепь с одной аминогруппой или двумя аминогруппами. Более предпочтительно органические амины могут быть выбраны из (С 2 С 8)алкиламинов, алкилендиаминов, алканоламинов, алкилалканоламинов, аминов гликолевых эфиров и ариламинов. Не ограничивающие изобретение примеры соответствующих органических аминов включают моноэтаноламин, диэтаноламин, триэтаноламин, диметиламиноэтанол, трометамин и т.д. Особенно предпочтительными органическими аминами являются третичные амины, например, триэтаноламин и диметиламиноэтанол. Предпочтительно пару жирная кислота/амин, если она присутствует, выбирают (что касается как типа, так и количества каждого компонента) таким образом, что когда композицию по изобретению подвергают исследованию в опыте I по меньшей мере 50% и более предпочтительно по меньшей мере примерно 75% по объему от подсчитанных эмульсионных частиц имеют диаметр примерно 1 мкм или меньше. Особенно предпочтительно, что существенная часть подсчитанных по объему эмульсионных частиц более предпочтительно по меньшей мере примерно 75%, еще более предпочтительно по меньшей мере примерно 85% и наиболее предпочтительно по меньшей мере примерно 90% имеют диаметр примерно 0,5 мкм или меньше. Предпочтительное молярное отношение жирной кислоты к аминогруппе (группам) органического амина составляет примерно 5:1 до примерно 1:100, более предпочтительно примерно 3:1 до примерно 1:50 и еще более предпочтительно примерно 2:1 до примерно 1:10, например, примерно 1:1. Предпочтительно жирная кислота и органический амин, если присутствуют совместно, то в количестве примерно 150%, более предпочтительно примерно 2-30% и еще более предпочтительно примерно 5-15% от массы композиции. Не углубляясь в теорию, считается, что композиция тонкодисперсного самоэмульгируемого раствора по изобретению, в особенности композиция, содержащая пару жирная кислота/органический амин,как описано выше, обеспечит препарат в форме, которая особенно быстро абсорбируется в желудочнокишечном тракте. В композиции раствора по изобретению препарат, даже при тонкодисперсном эмульгировании, при контакте с водной окружающей средой желудочно-кишечного тракта может осаждаться и агломерировать в форме твердых, обычно кристаллических, частиц. Такое осаждение и/или кристаллизация может неблагоприятно сказываться на любых преимуществах от быстрого проявления действия препарата, получаемых при его введении в растворенной форме, поскольку препарат, который снова перешел в кристаллическую форму, должен перед абсорбцией подвергнуться процессу растворения. Поэтому предпочтительные композиции дополнительно включают ингибитор кристаллизации, обозначаемый также в контексте, как понижающий мутность полимер. Заявители обнаружили, что некоторые полимеры существенно подавляют осаждение и/или кристаллизацию плохо растворимого в воде препарата, когда раствор препарата по существу в неводном растворителе контактирует с SGF. Соответственно композиции по настоящему изобретению предпочтительно включают снижающий мутность полимер. Полимер может быть целлюлозным или нет и предпочтительно в значительной степени водорастворимым. Будет понятно, что некоторые полимеры более эффективны при подавлении осаждения и/или кристаллизации отобранных препаратов с плохой растворимостью в воде, чем другие, и что не все полимеры, как описано в контексте, подавляют осаждение и/или кристаллизацию каждого препарата, плохо растворимого в воде. Применим ли конкретный полимер в качестве ингибитора кристаллизации конкретного плохо растворимого в воде препарата по изобретению, может быть легко определено одним из обычных специалистов в этой области, например, в соответствии с опытом II. Опыт II А. Соответствующее количество препарата растворяют в растворителе (например, этаноле, диметилсульфоксиде или, если препарат является кислотой либо основанием, в воде), чтобы получить концентрированный раствор препарата. Б. Объем воды или забуференного раствора с заданным значением рН помещают в первый сосуд и выдерживают при комнатной температуре. В. Аликвотную долю концентрированного раствора препарата прибавляют к содержимому первого сосуда, чтобы получить первый образец раствора, имеющий требуемую контрольную концентрацию препарата. Выбранная концентрация препарата должна быть такой, которая обеспечивает существенное осаждение и, следовательно, более высокую кажущуюся абсорбцию (т.е. мутность), чем насыщенный раствор, не вызывающий такого осаждения.- 11006677 Г. Исследуемый полимер отбирают, и во втором сосуде полимер растворяют в воде или забуференном растворе с заданным значением рН (идентичном по составу, рН и объему тому, который использован на этапе В) в количестве, достаточном для образования 0,25-2% мас./мас. полимерного раствора. Д. Для получения второго раствора образца аликвотную долю концентрированного раствора препарата, приготовленного на этапе А, прибавляют к раствору полимера во втором сосуде, чтобы получить раствор образца, имеющий конечную концентрацию препарата, равную концентрации первого раствора образца. Е. Через 60 мин после получения обоих растворов образца измеряют кажущуюся абсорбцию (т.е. мутность) каждого раствора образца, используя свет, имеющий длину волны 650 нм. Ж. Если мутность второго раствора образца меньше, чем мутность первого раствора образца, то считается, что исследуемый полимер является понижающим мутность полимером и пригоден в качестве ингибитора кристаллизации тестируемого препарата. Технический специалист, проводящий опыт II, легко определит соответствующую концентрацию полимера для опыта в диапазоне концентрации полимера, предусмотренном выше, с помощью рутинных экспериментов. В особенно предпочтительном варианте воплощения изобретения концентрацию полимера выбирают так, чтобы при осуществлении опыта II кажущееся поглощение второго раствора образца составляло не более чем примерно 50% от кажущегося поглощения первого раствора образца. В другом варианте воплощения композиции по изобретению включают ингибитор кристаллизации,содержащий по меньшей мере один целлюлозный полимер. Предпочтительные целлюлозные полимеры выбирают из НРМС, метилцеллюлозы, этилцеллюлозы, карбоксиметилцеллюлозы в натриевой форме и гидроксипропилцеллюлозы. Предпочтительнее, когда по меньшей мере один целлюлозный полимер выбирают из целлюлозных полимеров, имеющих по крайней мере часть замещаемых гидроксилов, замещенных метоксигруппами и/или гидроксипропоксигруппами. Еще предпочтительнее, когда по меньшей мере одним целлюлозным полимером является НРМС. НРМС, пригодная в качестве ингибитора кристаллизации по изобретению, при концентрации 2% в воде предпочтительно имеет вязкость примерно 100-20000 сП. Гидроксипропилметилцеллюлозы различаются по степени замещения доступных гидроксилов целлюлозного скелета метоксигруппами и гидроксипропоксигруппами. С увеличением замещения гидроксипропоксигруппами образующаяся НРМС становится более гидрофильной по своей природе. Предпочтительно использовать НРМС, имеющую примерно 15-35%, более предпочтительно примерно 19-30% и наиболее предпочтительно примерно 1924% замещения метоксигруппами и имеющую примерно 3-15%, более предпочтительно примерно 4-12% и наиболее предпочтительно примерно 7-12% замещения гидроксипропоксигруппами. Соответствующие гидроксипропилметилцеллюлозы, относительно гидрофильные по своей природе, в качестве иллюстрации доступны под торговыми марками Methocel от Dow Chemical Co. и Metolose от Shin-Etsu Chemical Co. Иллюстративной предпочтительной в настоящее время НРМС является полимер с типом замещения 2208, означающим примерно 19-24% замещения метоксигруппами и примерно 7-12% замещения гидроксипропоксигруппами, и с номинальной вязкостью примерно 400 сП при концентрации в воде 2%. Неожиданно было обнаружено, что ингибитор кристаллизации может и не быть компонентом растворяющей жидкости. Необязательно ингибитор кристаллизации, такой как НРМС, может быть компонентом оболочки капсулы, в которой инкапсулирована композиция раствора по изобретению. В одном варианте воплощения по существу ни НМРС или другой ингибитор кристаллизации не присутствует в растворяющей жидкости, но оболочка капсулы включает НРМС. Оболочка капсулы может даже преимущественно состоять из НРМС. Присутствуя, ингибитор кристаллизации предпочтительно находится в общем количестве, достаточном для того, чтобы в значительной мере подавить кристаллизацию и/или осаждение препарата при разбавлении композиции в SGF. Количество, достаточное для того, чтобы в значительной мере подавить кристаллизацию и/или осаждение препарата, в контексте означает количество, достаточное для того, чтобы предотвратить, замедлить, подавить или задержать осаждение препарата из раствора и/или предотвратить, замедлить, подавить или задержать образование кристаллических частиц препарата из растворенных частиц препарата. Достаточно ли количество ингибитора кристаллизации в данной исследуемой композиции, чтобы в значительной мере подавить кристаллизацию и/или осаждение препарата, с практической целью можно определить в соответствии с опытом III, который может также быть использован, чтобы определить, пригоден ли конкретный полимерный компонент в качестве ингибитора кристаллизации в конкретной композиции по изобретению. Опыт IIIA. Объем исследуемой композиции или в не инкапсулированной, или в инкапсулированной форме,содержащей полимерный компонент, помещают в объем SGF, чтобы образовать смесь, имеющую заданное соотношение примерно 1-2 г композиции на 100 мл SGF. Б. Смесь поддерживают при постоянной температуре примерно 37 С и перемешивают, используя мешалку типа II (USP 24) со скоростью 75 об/мин в течение периода 4 ч.B. В одной или нескольких временных точках после по меньшей мере 15 мин перемешивания, но примерно до 4 ч перемешивания извлекают аликвотную долю смеси и фильтруют, например, через нестерильный фильтр шприца Acrodisc с мембраной Versapor 0,8 мкм. Г. Фильтрат собирают в сосуд. Д. Концентрацию препарата в фильтрате измеряют, используя высокоэффективную жидкостную хроматографию (ВЭЖХ). Е. Идентично повторяют опыт со сравнительной композицией, которая, в основном, подобна исследуемой композиции, за исключением того, что лишена полимерного компонента. Там, где в исследуемой композиции полимерный компонент присутствует в растворяющей жидкости, в сравнительной композиции он заменен полиэтиленгликольным растворителем. Там, где в исследуемой композиции полимерный компонент присутствует в капсульной оболочке, в сравнительной композиции он заменен желатином. Ж. Если концентрация препарата в фильтрате, полученном из исследуемой композиции, выше, чем концентрация препарата в фильтрате, полученном из сравнительной композиции, то считается, что полимерный компонент, присутствующий в исследуемой композиции, в значительной мере подавляет кристаллизацию и/или осаждение препарата в SGF. Ингибитор кристаллизации, такой как НРМС, когда он находится в растворяющей жидкости, то обычно присутствует в общем количестве примерно 1-20%, предпочтительно примерно 1-15% и наиболее предпочтительно примерно 1-10% от массы растворяющей жидкости. Характерно, что чем выше концентрация препарата в композиции, тем больше целлюлозного полимера требуется, чтобы обеспечить эффект подавления кристаллизации. Обычно ингибитор кристаллизации, если он присутствует, и препарат находятся в массовом соотношении примерно 1:100 до примерно 1:1, предпочтительно примерно 1:50 до примерно 1:1 и более предпочтительно примерно 1:25 до примерно 1:1. Композиция по изобретению необязательно включает один или несколько фармацевтически приемлемых подсластителей. Не ограничивающие изобретение примеры соответствующих подсластителей включают маннит, пропиленгликоль, натриевую соль сахариновой кислоты, ацесульфамат калия, неотам и аспартам. Альтернативно или в добавление может быть использован вязкий подсластитель, такой как раствор сорбита, сироп (раствор сахарозы) или кукурузная патока с высоким содержанием фруктозы, и в добавление к эффектам подслащивания он может быть также полезным в повышении вязкости и замедлении осаждения. Применение подсластителей особенно полезно в усвояемых композициях по изобретению, т.к. пациент может ощутить это до проглатывания. Инкапсулированная композиция взаимодействует с органами вкуса в полости рта нетипично, и применение подсластителя является обычно излишним. Композиция по изобретению необязательно включает один или несколько фармацевтически приемлемых консервантов, иных чем улавливающие свободные радикалы антиоксиданты. Не ограничивающие изобретение примеры соответствующих консервантов включают хлорид бензалкония, хлорид бензетония, бензиловый спирт, хлорбутанол, фенол, фенилэтиловый спирт, фенилмеркуринитрат, тимеросал и т.д. Композиция по изобретению необязательно включает один или несколько фармацевтически приемлемых увлажняющих агентов. Поверхностно-активные вещества, гидрофильные полимеры и некоторые виды глины могут быть полезными в качестве увлажняющих агентов, чтобы способствовать растворению и/или диспергированию гидрофобного препарата, такого как целекоксиб. Не ограничивающие изобретение примеры соответствующих поверхностно-активных веществ включают хлорид бензалкония,хлорид бензетония, хлорид цетилпиридиния, диоктилнатрийсульфосукцинат, ноноксинол 9, ноноксинол 10, октоксинол 9, полаксамеры, моно- и диглицериды на основе полиоксиэтилена (8) и каприловой/каприновой кислот (например, Labrasol от Gattefosse), модифицированное полиоксиэтиленом (35) касторовое масло, полиоксиэтилен(20)цетостеариловый эфир, гидрированное касторовое масло, модифицированное полиоксиэтиленом (40), полиоксиэтилен(10)олеиловый эфир, полиоксиэтилен(40)стеарат,полисорбат 20, полисорбат 40, полисорбат 60, полисорбат 80 (например, Tween 80 от ICI), лаурат пропиленгликоля (например, Lauroglycol от Gattefosse), лаурилсульфат натрия, монолаурат сорбитана,моноолеат сорбитана, монопальмитат сорбитана, моностеарат сорбитана, тилоксапол и их смеси. Кроме того, композиции по изобретению необязательно включают один или несколько фармацевтически приемлемых буферных веществ, ароматизаторов, красителей, стабилизаторов и/или загустителей. Буферы могут использоваться для регулирования значения рН композиции и тем самым могут модулировать растворимость препарата. Ароматизаторы могут активировать соблюдение пациентом режима и схемы лечения, делая композицию более приятной на вкус, особенно в случае усвояемой композиции, а красители могут обеспечить продукт с эстетическим и/или характерным видом. Не ограничивающие изобретение примеры соответствующих красителей включают DC Red No. 33, FDC Red No. 3,FDC Red No. 40, DC Yellow No. 10 и С Yellow No. 6. Композиции раствор/суспензия В одном варианте воплощения изобретения растворяющая жидкость в зависимости от специфических компонентов, присутствующих в ней, применима для поддержания первой порции препарата в растворе, чтобы обеспечить терапевтически эффективное быстрое проявление действия дозы, тогда как вторая порция препарата поддерживается в нерастворимом состоянии, но в суспензии. Суспендированная- 13006677 часть обычно обеспечивает более медленное высвобождение препарата и поэтому может увеличить продолжительность терапевтического эффекта, хотя такая увеличенная продолжительность не требуется в данном варианте воплощения изобретения. Следовательно, согласно данному варианту воплощения обеспечивается композиция, включающая терапевтически эффективное количество плохо растворимого в воде аминосульфонилсодержащего препарата, частично растворенного и частично диспергированного в фармацевтически приемлемой растворяющей жидкости, которая содержит по меньшей мере один фармацевтически приемлемый полиэтиленгликоль и по меньшей мере один фармацевтически приемлемый улавливающий свободные радикалы антиоксидант. В данном варианте воплощения часть препарата находится в растворе, а часть в суспензии. Предпочтительно компоненты растворяющей жидкости подбирают так, что по меньшей мере примерно 15 мас.% препарата находится в растворенной или солюбилизированной форме в растворяющей жидкости. Один из способов модификации растворяющей жидкости с целью повышения в суспензии количества плохо растворимого в воде аминосульфонилсодержащего препарата, по сравнению с раствором, состоит в добавлении воды в количестве, необходимом для того, чтобы вызвать требуемое снижение растворимости препарата в растворяющей жидкости. В зависимости от относительной важности быстрого проявления действия и длительного действия при показании, по которому вводится препарат, относительные пропорции растворенного и суспендированного препарата могут значительно изменяться. Например, при острых болевых показаниях примерно 50% препарата может находиться в растворе, и примерно 50% препарата может быть диспергировано в виде частиц. Альтернативно при показаниях, требующих более продолжительной терапевтической эффективности, в качестве примера около 20% препарата может находиться в растворе, и примерно 80% препарата может быть диспергировано в виде частиц. Частицы препарата могут быть образованы механически, например, размалыванием либо измельчением или осаждением из раствора. Частицы, образованные непосредственно в результате таких приемов,описываются в контексте как первичные частицы и могут укрупняться, образуя вторичные агрегатные частицы. Термин размер частицы, как он использован в контексте, относится к размеру первичных частиц в самом длинном измерении, если контекст не требует иного. Считается, что размер частиц является важным параметром, оказывающим воздействие на клиническую эффективность целекоксиба и других препаратов с низкой растворимостью в воде. Размер частицы может быть выражен как процент от общего количества частиц, которые имеют меньший диаметр, чем данный эталонный диаметр. Например, удобным параметром является размер частиц D90. По определению, в порции препарата, у которой размер частиц D90 составляет 60 мкм, частицы, составляющие 90 об.%, имеют диаметр менее чем 60 мкм. Для практических целей определениеD90, основанное на 90 мас.%, а не объемных, обычно является подходящим. Композиции по данному варианту воплощения предпочтительно имеют распределение суспендированных частиц препарата по размерам так, что частицы D90 в самом длинном их измерении составляют примерно 0,5-200 мкм, предпочтительно примерно 0,5-75 мкм и более предпочтительно примерно 0,5-25 мкм. Например, если препаратом является целекоксиб, уменьшение размера частиц согласно данному варианту воплощения изобретения обычно улучшает биодоступность препарата. В добавление к этому или альтернативно суспендированные частицы целекоксиба в композиции по изобретению предпочтительно имеют средний размер частицы менее чем примерно 10 мкм, более предпочтительно примерно 0,1-10 мкм и наиболее предпочтительно примерно 0,5-5 мкм, например, примерно 1 мкм. Композиции по данному варианту воплощения могут необязательно включать добавочные наполнители, такие как ингибиторы кристаллизации, диспергаторы, сорастворители, подсластители, консерванты, эмульгирующие агенты и т.д., как описано выше. Кроме того, композиции по данному варианту воплощения могут быть разработаны или в виде усвояемой, или дискретной лекарственной формы. Дополнительно некоторые наполнители, такие как суспендирующие агенты, загущающие агенты и флокулирующие агенты, могут быть особенно полезны, когда требуются суспендированные частицы препарата, например в композициях раствор/суспензия. Путем подбора и сочетания наполнителей, композиций раствор/суспензия может быть обеспечено проявление улучшенной характеристики в отношении концентрации препарата, физической стабильности, эффективности, аромата и в итоге соблюдения пациентом режима и схемы лечения. Композиции раствор/суспензия по изобретению необязательно включают один или несколько фармацевтически приемлемых суспендирующих агентов. Суспендирующие агенты применяют для придания композиции повышенной вязкости и замедленного осаждения. Суспендирующими агентами являются различные классы веществ, включая производные целлюлозы, глину, природные смолы, синтетические смолы и смешанные агенты. Не ограничивающие изобретение примеры суспендирующих агентов, которые могут применяться в композициях по настоящему изобретению, включают гуммиарабик, агар, альгиновую кислоту, моностеарат алюминия, аттапульгит, бентонит, карбоксиметилцеллюлозу в кальциевой форме, карбоксиметилцеллюлозу в натриевой форме, желатин растительный, карбомер, например карбомер 910, декстрин, этилметилцеллюлозу, желатин, гуаровую смолу, НРМС, метилцеллюлозу, этилцел- 14006677 люлозу, этилгидроксиэтилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, каолин, силикат магния-алюминия, микрокристалличекую целлюлозу, микрокристаллическую целлюлозу с карбоксиметилцеллюлозой в натриевой форме, порошкообразную целлюлозу, силикагель, коллоидный диоксид кремния, смолу плодоворожкового дерева, пектин, альгинат натрия, пропиленгликольальгинат, тамариндовую смолу, трагакант, ксантановую смолу, повидон, загуститель Veegum, глицирризин, предварительно желатинизированный крахмал, модифицированный гликолятом натрия крахмал и их смеси. В некоторых обстоятельствах в композициях раствор/суспензия по изобретению может быть желательным применение флокулирующих агентов. Флокулирующие агенты дают возможность частицам соединяться вместе в свободные агрегаты или хлопья и включают поверхностно-активные вещества,гидрофильные полимеры, глину и электролиты. Не ограничивающие изобретение примеры соответствующих флокулирующих агентов включают лаурилсульфат натрия, докузат натрия, хлорид бензалкония,хлорид цетилпиридиния, полисорбат 80, сорбитанмонолаурат, карбоксиметилцеллюлозу в натриевой форме, ксантановую смолу, трагакант, метилцеллюлозу, PEG, силикат магния-алюминия, аттапульгит,бентонит, первичный кислый фосфат калия, хлорид алюминия, хлорид натрия и их смеси. Дискретные лекарственные формы Было найдено, что требования быстрого проявления действия композиции неожиданно хорошо выполняются с помощью препарата, содержащего раствор или раствор/суспензию по настоящему изобретению, инкапсулированного в форме дискретной стандартной дозы. Поэтому другим вариантом воплощения по настоящему изобретению является концентрированная композиция - или раствор, или раствор/суспензия, где композиция разрабатывается как одна или несколько дискретных стандартных доз,например, мягких или жестких капсул. Для инкапсулирования может быть применимо любое соответствующее вещество, например, желатин или НРМС. Как указано выше, НРМС может быть преимущественным веществом для использования в оболочке капсулы, потому что она может действовать как ингибитор кристаллизации при контакте композиции с желудочно-кишечной жидкостью. Полимерный компонент, такой как НРМС, присутствует в оболочке капсулы или является компонентом оболочки капсулы, как описано в контексте, если полимер (а) диспергирован или смешан с каким-либо другим (другими) компонентом (компонентами) оболочки капсулы, (б) является единственным компонентом оболочки капсулы или (в) присутствует в виде покрытия снаружи или внутри капсульной оболочки. В предпочтительном в настоящее время варианте воплощения ингибитор кристаллизации, предпочтительно полимер, содержащий в качестве заместителей метокси- и/или гидроксипропоксигруппы, как описано выше, и более предпочтительно НРМС, присутствует в оболочке капсулы в общем количестве примерно 5%, в основном, до 100% и предпочтительно примерно 15%, в основном, до 100% от массы оболочки. Ингибитор кристаллизации предпочтительно присутствует в оболочке в суммарном количестве,достаточном для того, чтобы в значительной степени подавить кристаллизацию препарата и/или осаждение при растворении, разбавлении и/или деградации композиции в SGF. Достаточно ли количество ингибитора кристаллизации, присутствующего в оболочке данной исследуемой композиции, чтобы в значительной мере подавить кристаллизацию препарата и/или его осаждение, для практических целей можно определить в соответствии с опытом IV, который также может быть использован, чтобы определить, является ли особый полимерный компонент полезным в качестве ингибитора кристаллизации, присутствуя в оболочке капсулы конкретной композиции по изобретению. Опыт IVA. Объем раствора или раствора/суспензии, как описано выше в контексте, заключают в капсулу,содержащую испытуемый полимер для образования исследуемой композиции, и помещают в объем SGF,чтобы получить смесь, имеющую заданное соотношение примерно 1-2 г композиции на 100 мл SGF. Б. Смесь поддерживают при постоянной температуре примерно 37 С и перемешивают, используя мешалки типа II (USP 24) со скоростью 75 об/мин в течение периода 4 ч.B. В одной или нескольких временных точках после по меньшей мере 15 мин перемешивания, но примерно до 4 ч перемешивания отбирают аликвотную часть смеси и фильтруют, например, через нестерильный фильтр шприца Acrodisk с мембраной Versapor 0,8 мкм. Г. Фильтрат собирают в сосуд. Д. Концентрацию препарата в фильтрате измеряют, используя высокоэффективную жидкостную хроматографию (ВЭЖХ). Е. Опыт идентично повторяют с композицией сравнения, включающей раствор или раствор/суспензию, которые, в основном, подобны раствору или раствору/суспензии, использованным на этапе А, но которая заключена в капсулу, не содержащую ингибитор кристаллизации (т.е. не содержит полимер или если полимер присутствует, то такой, как желатин, который не подавляет кристаллизацию и/или осаждение). Полимерный компонент заменяют желатином в капсуле, содержащей композицию сравнения. Ж. Если концентрация препарата в фильтрате, полученном от исследуемой композиции, выше, чем таковая в фильтрате, полученном от композиции сравнения, то считается, что полимерный компонент,- 15006677 присутствующий в оболочке капсулы исследуемой композиции, содержится в количестве, достаточном для того, чтобы в значительной мере подавить кристаллизацию и/или осаждение препарата в SGF. Кроме одного или нескольких таких ингибиторов кристаллизации соответствующая оболочка капсулы может включать любой дополнительный компонент, применяемый в данной области, такой как желатин, крахмал, каррагенан, альгинат натрия, пластификаторы, хлорид калия, окрашивающие агенты и т.д. Соответствующая капсула в контексте может иметь твердую или мягкую оболочку. Предпочтительно одна до примерно шести, более предпочтительно одна до примерно четырех и еще более предпочтительно одна или две такие дискретные стандартные дозы в день обеспечивают терапевтически эффективную дозу препарата. Композиции по данному варианту воплощения предпочтительно разрабатываются таким образом,что каждая дискретная стандартная доза содержит примерно 0,3-1,5 мл, более предпочтительно примерно 0,3-1 мл, например, примерно 0,8 мл или примерно 0,9 мл раствора или раствора/суспензии. Концентрированные растворы или растворы/суспензии могут быть инкапсулированы любым способом, известным в данной области, включая процедуру на формной пластине, вакуумный способ или способ ротационного штампа. См., например, Ansel и др. (1995) в Pharmaceutical Dosage Forms and DrugDelivery Systems, 6 издание, Williams и Wilkins, Baltimore, MD, стр. 176-182. В способе ротационного штампа жидкий инкапсуляционный материал, например желатин, вытекающий из напорного резервуара,с помощью машины для ротационного штампа формируется в две непрерывные полосы, которые сводятся вместе с помощью сдвоенных ротационных штампов. Одновременно измеренное количество наполнителя впрыскивается между полосами в тот самый момент, когда штампы образуют из полос карманы. Затем эти карманы из содержащего наполнитель инкапсуляционного материала герметически закрывают с помощью давления и нагрева, и капсулы подаются из машины. Мягкие капсулы могут производиться в различных формах, включая круглую, овальную, продолговатую и, среди прочих, в форме тубуса. Кроме того, при использовании полос двух разных окрасок могут быть получены двухцветные капсулы. Капсулы, которые содержат НРМС, известны в данной области и могут быть получены герметически закрытыми и/или с нанесенным покрытием, путем не ограничивающей изобретение иллюстрации согласно способам, раскрытым в патентах и заявках, приведенных ниже, каждый или каждая из которых по отдельности включены в контекст в виде ссылки. Патент US 4250997 на имя Bodenmann и др. Патент US 5264223 на имя Yamamoto и др. Патент US 5756123 на имя Yamamoto и др. Заявка WO 96/05812. Заявка WO 97/35537. Заявка WO 00/18377. Заявка WO 00/27367. Заявка WO 00/28976. Заявка WO 01/03676. Заявка ЕР 0211079. Заявка ЕР 0919228. Заявка ЕР 1029539. Не ограничивающие иллюстративные примеры соответствующих капсул, содержащих НРМС,включают капсулы XGel от Bioprogress и Qualicaps от Shionogi. Усвояемые лекарственные формы Другим вариантом воплощения по настоящему изобретению является концентрированная композиция или концентрированный раствор, или концентрированный раствор/суспензия, которая может быть непосредственно усвояемой или разбавляемой инертными разбавителями и/или другими носителями и усвояемой; такие композиции по изобретению, разбавленные или не разбавленные, упоминаются в контексте для удобства как усвояемые композиции. Усвояемые композиции могут быть получены любым подходящим способом фармации, который включает этапы объединения в ассоциацию молекул препарата с низкой растворимостью в воде, в качестве иллюстрации - целекоксиба, и растворяющей жидкости. Там, где препаратом является целекоксиб, композиции по данному варианту воплощения предпочтительно содержат примерно 40 мг/мл до примерно 750 мг/мл, более предпочтительно примерно 50 мг/мл до примерно 500 мг/мл, еще более предпочтительно примерно 50 мг/мл до примерно 350 мг/мл и наиболее предпочтительно примерно 100 мг/мл до примерно 300 мг/мл, например около 200 мг/мл целекоксиба. В дополнительном варианте воплощения предусматриваются растворы или растворы/суспензии по изобретению, для которых необходимо быть разбавленными, чтобы обеспечить разведение, пригодное для непосредственного усвояемого введения. В данном варианте воплощения растворы или растворы/суспензии по настоящему изобретению прибавляют в количестве терапевтически эффективной дозы приблизительно к 1-20 мл инертной жидкости. Предпочтительно растворы или растворы/суспензии по настоящему изобретению прибавляют примерно к 2-15 мл, более предпочтительно примерно к 5-10 мл- 16006677 инертной жидкости. Термин инертная жидкость, как он использован в контексте, относится к фармацевтически приемлемым, предпочтительно приятным на вкус жидким носителям. Такие носители обычно являются водными. Примеры включают воду, фруктовые соки, минерализованные напитки и т.д. Эффективность композиций, которые содержат избирательно ингибирующий СОХ-2 препарат В предпочтительном варианте воплощения композиции по изобретению включают аминосульфонилсодержащий препарат с низкой растворимостью в воде, избирательно ингибирующий СОХ-2. Композиции по данному варианту воплощения полезны при лечении и предупреждении очень широкого спектра нарушений, опосредованных СОХ-2, включая, но без ограничения, нарушения, характеризующиеся воспалением, болью и/или лихорадкой. Такие композиции особенно полезны в качестве противовоспалительных агентов, таких как при лечении артрита, имея дополнительное преимущество, состоящее в проявлении значительно менее опасных побочных эффектов, чем композиции обычных нестероидных противовоспалительных препаратов (NSAIDs), которые утрачивают избирательность к СОХ-2 относительно СОХ-1. В частности, такие композиции имеют сниженный потенциал желудочно-кишечной токсичности и раздражения желудочно-кишечного тракта, включая образование язвы в верхней части желудочнокишечного тракта и кровотечение, сниженный потенциал почечных побочных эффектов, таких как снижение функции почек, приводящее к задержке жидкости и обострению гипертензии, сниженное влияние на периоды кровотечения, включая подавление функции тромбоцитов, и, возможно, сниженную способность вызывать приступы астмы у астматиков, чувствительных к действию аспирина, по сравнению с композициями общеизвестных NSAIDs. Поэтому композиции по изобретению, включающие препарат,избирательно ингибирующий СОХ-2, особенно полезны в качестве альтернативы общеизвестным нестероидным противовоспалительным препаратам, где такие препараты (NSAIDs) противопоказаны, например у пациентов с язвами желудка, гастритом, регионарным энтеритом, язвенным колитом, дивертикулитом или с рецидивирующими желудочно-кишечными нарушениями; при желудочно-кишечном кровотечении, нарушениях свертываемости крови, включая анемию, такую как гипопротромбинемия, гемофилию или других проблемах, связанных с кровотечением; при болезни почек; или у пациентов перед хирургическим вмешательством, или у пациентов, принимающих антикоагулянты. Такие композиции полезны при лечении разнообразных нарушений, связанных с артритом, включая, но без ограничения, ревматоидный артрит, спондилоартропатии, подагрический артрит, остеоартрит,системную красную волчанку и юношеский артрит. Такие композиции полезны также при лечении астмы, бронхита, менструальных спазмов, преждевременных родов, тендинита, бурсита, аллергического неврита, цитомегаловирусной инфекции, апоптоза, включая апоптоз, индуцированный ВИЧ, люмбаго, болезни печени, включая гепатит, связанных с кожей состояний, таких как псориаз, экзема, угри, ожоги, дерматит и повреждение, вызванное ультрафиолетовым излучением, включая солнечный ожог, и послеоперационного воспаления, включая воспаление после офтальмологической операции, такой как операция по удалению катаракты или операции,связанной с рефракцией глаза. Такие композиции полезны при лечении желудочно-кишечных состояний, таких как воспаление кишечника, болезнь Крона, гастрит, синдром раздраженной толстой кишки и язвенный колит. Такие композиции полезны в лечении воспаления при таких заболеваниях, как мигреневые цефалгии, узелковый периартериит, тиреоидит, апластическая анемия, болезнь Ходжкина, склеродома, ревматическая лихорадка, диабет типа I, заболевание нервно-мышечного синапса, включая миастению беременных, поражение белого вещества, включая множественный склероз, саркоидоз, нефротический синдром, синдром Бехчета, полимиозит, гингивит, нефрит, аллергия, опухание, происходящее после повреждения, включая отек мозга, ишемия миокарда и тому подобное. Такие композиции полезны при лечении офтальмологических заболеваний, таких как ретинит,конъюнктивит, ретинопатии, увеит, светобоязнь, и при остром повреждении глазной ткани. Такие композиции полезны при лечении легочных воспалений, таких, которые ассоциированы с вирусными инфекциями и фиброзно-кистозной дегенерацией, и при резорбции кости, такой как резорбция,ассоциированная с остеопорозом. Такие композиции полезны при лечении некоторых нарушений центральной нервной системы, такихкак кортикальные деменции, включая болезнь Альцгеймера, нейродегенерацию и повреждение центральной нервной системы от припадка, ишемии и травмы. Термин лечение в настоящем контексте включает частичное или полное подавление деменции, включая болезнь Альцгеймера, сосудистую деменцию, деменцию после нескольких инфарктов, пресенильную деменцию, алкогольную деменцию и сенильную деменцию. Такие композиции полезны при лечении аллергических ринитов, респираторного дистресссиндрома, шока, вызванного эндотоксином, и болезни печени. Такие композиции полезны при лечении боли, включая, но без ограничения, боль после операции,зубную боль, мышечную боль и боль, возникающую при онкологическом заболевании. Такие композиции полезны, например, для ослабления боли, лихорадки и воспаления при различных состояниях, включая ревматическую лихорадку, грипп и другие вирусные инфекции, включая насморк, поясничную и шейную боль, дисменорею, головную боль, зубную боль, растяжения и деформации, миозит, невралгию,- 17006677 синовит, артрит, включая ревматоидный артрит, дегенеративные суставные заболевания (остеоартрит),подагру и анкилозирующий спондилоартрит, бурсит, ожоги и травмы после хирургических и стоматологических вмешательств. Такие композиции полезны при лечении и предупреждении сердечно-сосудистых нарушений, связанных с воспалением, включая сосудистые заболевания и заболевание коронарной артерии, аневризму,сосудистое отторжение, артериосклероз, атеросклероз, включая атеросклероз сердечного трансплантата,инфаркт миокарда, эмболию, припадок, тромбоз, включая венозный тромбоз, стенокардию, включая нестабильную стенокардию, воспаление коронарной бляшки, вызванное бактериями воспаление, включая индуцированное хламидиями воспаление, индуцированное вирусное воспаление и воспаление, ассоциированное с хирургическим вмешательством, таким, как сосудистая трансплантация, включая методику коронарно-артериального шунтирования, процедуры по реваскуляризации, включая ангиопластику, установку стента, эндартерэктомию или другие инвазивные манипуляции, затрагивающие артерии вены и капилляры. Такие композиции полезны при лечении связанных с ангиогенезом нарушений у пациента, например, для подавления ангиогенеза опухоли. Такие композиции полезны при лечении новообразований,включая метастазы; офтальмологических состояний, таких как отторжение роговичного трансплантата,глазной неоваскуляризации, сетчаточной неоваскуляризации, включая неоваскуляризацию после повреждения или инфекции, диабетической ретинопатии, дегенерации желтого пятна, ретролентальной фиброплазии и неоваскулярной глаукомы; язвенных заболеваний, таких как язва желудка; патологических,но не злокачественных состояний, таких как гемангиомы, включая детские гемангиомы, ангиофибромы носоглотки, и бессосудистый некроз кости и нарушений женской репродуктивной системы, таких как эндометриоз. Такие композиции полезны в предупреждении и лечении доброкачественных и злокачественных опухолей и новообразований, включая рак, такой как колоректальный, рак мозга, эпителиальноклеточная неоплазия (эпителиальная карцинома), такой как базально-клеточная карцинома, аденокарцинома, рак жедудочно-кишечного тракта, такой как рак губы, рак полости рта, рак пищевода, рак тонкого кишечника, рак желудка, рак ободочной кишки, рак печени, рак мочевого пузыря, рак поджелудочной железы, рак яичника, рак шейки матки, рак легкого, рак грудной железы, рак кожи, такой как чешуйчатоклеточный и базально-клеточный рак, рак предстательной железы, карцинома почки и другие известные опухоли, которые воздействуют на эпителиальные клетки по всему организму. Предполагается, что новообразованиями, для которых композиции по изобретению являются особенно полезными, являются рак желудочно-кишечного тракта, опухоль (пищевода) Барретта, рак печени, рак мочевого пузыря, рак поджелудочной железы, рак яичника, рак предстательной железы, рак шейки матки, рак легкого, рак грудной железы и рак кожи. Такие композиции могут быть также использованы для лечения фиброза,который наблюдается при радиационной терапии. Такие композиции могут быть использованы для лечения пациентов с аденоматозными полипами, включая пациентов с семейным аденоматозным полипозом (FAP). Кроме того, такие композиции могут быть использованы для предотвращения образования полипов у пациентов с повышенным риском FAP. Такие композиции подавляют индуцированное простаноидами сокращение гладкой мышцы путем ингибирования синтеза сократительных простаноидов и поэтому могут быть использованы при лечении дисменореи, преждевременных родов, астмы и связанных с эозинофилами нарушений. Они также могут быть использованы для ослабления разрежения костей, особенно у женщин в период постменопаузы (т.е. для лечения остеопороза), и для лечения глаукомы. Благодаря быстрому проявлению терапевтического эффекта, которым могут обладать композиции по изобретению, данные композиции имеют особые преимущества над прежними композициями для лечения острых нарушений, опосредованных СОХ-2, особенно для ослабления боли, например головной боли, включая синусовую головную боль и мигрень. Предпочтительным применением композиций по настоящему изобретению является лечение ревматоидного артрита и остеоартрита, в основном, устранение боли (особенно боли после челюстнолицевой хирургии, боли после общей хирургии, боли после хирургической ортопедии и острого внезапного обострения остеоартрита), предупреждение и лечение головной боли и мигрени, лечение болезни Альцгеймера и химиопрофилактика рака ободочной кишки. Для лечения ревматоидного артрита или остеоартрита такие композиции по изобретению могут применяться, чтобы обеспечить суточную дозу целекоксиба примерно 50 мг до примерно 1000 мг, предпочтительно примерно 100 мг до примерно 600 мг, более предпочтительно примерно 150 мг до примерно 500 мг, еще более предпочтительно примерно 175 мг до примерно 400 мг, например, около 200 мг. Суточная доза целекоксиба, составляющая примерно 0,7 до примерно 13 мг/кг массы тела, предпочтительно примерно 1,3 до примерно 8 мг/кг массы тела, более предпочтительно примерно 2 до примерно 6,7 мг/кг массы тела и еще более предпочтительно примерно 2,3 до примерно 5,3 мг/кг массы тела, например около 2,7 мг/кг массы тела, как правило, является надлежащей при введении в композиции по изобретению. Суточная доза может вводиться в виде одной до примерно четырех доз в день, предпочтительно в виде одной или двух доз в день.- 18006677 Для лечения болезни Альцгеймера или злокачественной опухоли такие композиции по изобретению могут применяться, чтобы обеспечить суточную дозу целекоксиба примерно 50 мг до примерно 1000 мг,предпочтительно примерно 100 мг до примерно 800 мг, более предпочтительно примерно 150 мг до примерно 600 мг и еще более предпочтительно примерно 175 мг до примерно 400 мг, например, около 400 мг. Суточная доза, составляющая примерно 0,7 до примерно 13 мг/кг массы тела, предпочтительно примерно 1,3 до примерно 10,7 мг/кг массы тела, более предпочтительно примерно 2 до примерно 8 мг/кг массы тела и еще более предпочтительно примерно 2,3 до примерно 5,3 мг/кг массы тела, например, около 5,3 мг/кг массы тела, является, как правило, надлежащей при введении в композиции по изобретению. Суточная доза может вводиться в виде одной до примерно четырех доз в день, предпочтительно в виде одной или двух доз в день. Обычно для ослабления боли и особенно для лечения и предупреждения головной боли и мигрени такие композиции по изобретению могут применяться, чтобы обеспечить суточную дозу целекоксиба примерно 50 мг до примерно 1000 мг, предпочтительно примерно 100 мг до примерно 600 мг, более предпочтительно примерно 150 мг до примерно 500 мг и еще более предпочтительно примерно 175 мг до примерно 400 мг, например, около 200 мг. Как правило, суточная доза целекоксиба, составляющая примерно 0,7 до примерно 13 мг/кг массы тела, предпочтительно примерно 1,3 до примерно 8 мг/кг массы тела, более предпочтительно примерно 2 до примерно 6,7 мг/кг массы тела и еще более предпочтительно примерно 2,3 до примерно 5,3 мг/кг массы тела, например, около 2,7 мг/кг массы тела, является надлежащей при введении в композиции по изобретению. Суточная доза может вводиться в виде одной до примерно четырех доз в день. Предпочтительным является введение при частоте одна стандартная доза 50 мг четыре раза в день, одна стандартная доза 100 мг либо две стандартных дозы по 50 мг дважды в день или одна стандартная доза 200 мг, две стандартных дозы по 100 мг либо четыре стандартных дозы по 50 мг один раз в день. Для других препаратов, избирательно ингибирующих СОХ-2, иных чем целекоксиб, надлежащие дозы могут быть выбраны с помощью ссылок на патентную литературу, процитированных выше. Помимо пригодности для лечения человека, такие композиции по изобретению полезны в ветеринарии при лечении сопутствующих животных, экзотических животных, сельскохозяйственных животных и тому подобных, особенно млекопитающих. Конкретнее такие композиции по изобретению полезны для лечения опосредованных СОХ-2 нарушений у лошадей, собак и кошек. Данный вариант воплощения изобретения ориентирован далее на терапевтический способ лечения состояния или нарушения в тех случаях, когда показано лечение препаратом, ингибирующим СОХ-2,способ, включающий пероральное введение композиции по изобретению пациенту, нуждающемуся в этом. Дозовый режим для предупреждения, ослабления боли или улучшения симптомов состояния или нарушения предпочтительно соответствует лечению один раз в день или дважды в день, но может быть модифицирован в соответствии с разнообразными факторами. Они включают тип, возраст, массу, пол,диету, состояние здоровья пациента и природу и тяжесть нарушения. Таким образом, фактически используемый дозовый режим может изменяться в широких пределах и поэтому может отклоняться от предпочтительных дозовых режимов, изложенных выше. Первоначальное лечение может начинаться при дозовом режиме, указанном выше. Лечение обычно продолжается, как это требуется, в течение периода нескольких недель до нескольких месяцев или лет,пока состояние или нарушение не станет контролируемым или ликвидируемым. Пациенты, подвергающиеся лечению композицией по изобретению, могут контролироваться рутинно, любым из способов,хорошо известных в данной области для определения эффективности терапии. Непрерывный анализ данных такого мониторинга позволяет проводить модификацию режима лечения в ходе терапии так, что оптимально эффективные дозы вводятся в любой момент времени, и так, что может быть определена продолжительность лечения. Таким способом режим и схема дозирования могут быть рационально модифицированы в ходе курса терапии, чтобы вводить наименьшее количество композиции, обладающее удовлетворительной эффективностью и чтобы введение продолжалось столько, сколько необходимо для успешного лечения состояния или нарушения. Композиции по настоящему изобретению могут быть применены в комбинированной терапии с опиоидами и другими анальгетиками, включая анальгетики с наркотическими свойствами, антагонисты-рецептора, антагонисты -рецептора, ненаркотические (т.е. не вызывающие привыкания) анальгетики,ингибиторами поглощения моноаминов, регуляторами аденозина, производными каннабиоидов, антагонистами вещества Р, антагонистами рецептора нейрокинина-1 и, среди прочих, блокаторами натриевых каналов. В предпочтительных терапевтических комбинациях используют композицию по изобретению с одним или несколькими соединениями, выбранными из ацеклофенака, ацеметацина, ацетамидокапроновой кислоты, ацетаминофена, ацетаминосалола, ацетанилида, ацетилсалициловой кислоты (аспирина), S-аденозилметионина, алклофенака, алфентанила, аллилпродина, алминопрофена,алоксиприна, альфапродина, бис(ацетилсалицилата) алюминия, амфенака, аминохлортеноксазина, 3 амино-4-гидроксимасляной кислоты, 2-амино-4-пиколина, аминопропилона, аминопирина, амиксетрина,салицилата амония, ампироксикама, амтолметингуацила, анилеридина, антипирина, салицилата антипи- 19006677 рина, антрафенина, апазона, бендазака, бенорилата, беноксапрофена, бензпиперилона, бензидамина, бензилморфина, бермопрофена, безитрамида, -бисаболола, бромфенака, n-бромацетанилида, ацетата 5 бромсалициловой кислоты, бромсалигенина, буцетина, буклоксиновой кислоты, буколома, буфексамака,бумадизона, бупренорфина, бутацетина, бутибуфена, бутофанола, ацетилсалицилата кальция, карбамазепина, карбифена, карпрофена, карсалама, хлорбутанола, хлортеноксазина, холинсалицилата, цинхофена,цинметацина, цирамадола, клиданака, клометацина, клонитазена, клониксина, клопирака, клова, кодеина,метилбромида кодеина, фосфата кодеина, сульфата кодеина, кропропамида, кротетамида, дезоморфина,дексоксадрола, декстроморамида, дезоцина, диампромида, диклофенака натрия, дифенамизола, дифенпирамида, дифлунизала, дигидрокодеина, дигидрокодеиноненолацетата, дигидроморфина, дигидроксиалюминийацетилсалицилата, дименоксадола, димефептанола, диметилтиамбутена, диоксафетилбутирата,дипипанона, дипроцетила, дипирона, дитазола, дроксикама, эморфазона, энфенамовой кислоты, эпиризола, эптазоцина, этерсалата, этензамида, этогептазина, этоксазена, этилметилтиамбутена, этилморфина,этодолака, этофенамата, этонитазена, эвгенола, фелбинака, фенбуфена, фенклозиновой кислоты, фендозала, фенопрофена, фентанила, фентиазака, фепрадинола, фепразона, флоктафенина, флуфенаминовой кислоты, флуноксапрофена, флуоресона, флупиртина, флупроквазона, флурбипрофена, фосфосала, гентизиновой кислоты, глафенина, глюкаметацина, гликольсалицилата, гуайазулена, гидрокодона, гидроморфона, гидроксипетидина, ибуфенака, ибупрофена, ибупроксама, имидазолсалицилата, индометацина,индопрофена, изофезолака, изоладола, изометадона, изониксина, изоксепака, изоксикама, кетобемидона,кетопрофена, кеторолака, n-лактофенетида, лефетамина, леворфанола, лофентанила, лоназолака, лорноксикама, локсопрофена, лизинацетилсалицилата, магнийацетилсалицилата, меклофенаминовой кислоты,мефенаминовой кислоты, меперидина, мептазинола, месаламина, метазоцина, гидрохлорида метадона,метотримепразина, метиазиновой кислоты, метофолина, метопорона, мофебутазона, мофезолака, моразона, морфина, гидрохлорида морфина, сульфата морфина, морфолинсалицилата, мирофина, набуметона,налбуфина, 1-нафтилсалицилата, напроксена, нарцеина, нефопама, никоморфина, нифеназона, нифлуминовой кислоты, нимесулида, 5'-нитро-2'-пропоксиацетанилида, норлеворфанола, норметадона, норморфина, норпипанона, олсалазина, опиума, оксацепрола, оксаметацина, оксапрозина, оксикодона, оксиморфона, оксифенбутазона, папаверетума, паранилина, парсалмида, пентазоцина, перизоксала, фенацетина, фенадоксона, феназоцина, гидрохлорида феназопиридина, феноколла, феноперидина, фенопиразона, фенилацетилсалицилата, фенилбутазона, фенилсалицилата, фенирамидола, пикетопрофена, пиминодина, пипебузона, пиперилона, пипрофена, пиразолака, пиритрамида, пироксикама, пранопрофена, проглуметацина, прогептазина, промедола, пропацетамола, пропирама, пропоксифена, пропифеназона, проквазона, протизиновой кислоты, рамифеназона, ремифентанила, римазолиумметилсульфата, салацетамида, салицина, салициламида, салициламид-о-уксусной кислоты, салицилсерной кислоты, салсалта, салверина, симетрида, салицилата натрия, суфентанила, сульфалазина, сулиндака, супероксиддисмутазы, супрофена, суксибузона, талнифлумата, тенидапа, теноксикама, терофеномата, тетрандрина, тиазолинобутазона, тиапрофеновой кислоты, тиарамида, тилидина, тиноридина, толфенаминовой кислоты, толметина, трамадола, тропесина, виминола, ксенбуцина, ксимопрофена, залтопрофена и зомепирака (см. TheMerck Index. 12 издание (1996), Therapeutic Category and Biological Activity Index, перечни, озаглавленные там "Анальгетик", "Противовоспалительное средство" и "Антипиретик"). Особенно предпочтительная комбинированная терапия включает применение композиции по данному варианту воплощения с опиоидным соединением, более конкретно, где опиоидным соединением является кодеин, меперидин, морфин или его производное. Состав соединения, которое должно быть введено в комбинации с препаратом, избирательно ингибирующим СОХ-2, может быть разработан отдельно от препарата или совместно с препаратом в композиции по изобретению. Там, где состав избирательно ингибирующего СОХ-2 препарата разработан совместно со вторым препаратом, например опиоидным препаратом, второй препарат может быть создан в лекарственной форме экстренного высвобождения, быстрого проявления действия, замедленного высвобождения или двухступенчатого высвобождения. В варианте воплощения по изобретению, особенно там, где опосредованным СОХ-2 состоянием является головная боль или мигрень, данная композиция избирательно ингибирующего СОХ-2 препарата вводится путем комбинированной терапии с сосудистым модулятором, предпочтительно производным ксантина, обладающим вазомодулирующим действием, более предпочтительно с производным алкилксантина. Способы комбинированной терапии, где производное алкилксантина вводится совместно с композицией препарата, избирательно ингибирующего СОХ-2, как предусмотрено в контексте, охватываются настоящим вариантом воплощения независимо от того, является или нет алкилксантин сосудистым модулятором и относится или нет терапевтическая эффективность комбинации в какой-либо степени к вазомодулирующему действию. Термин алкилксантин в контексте охватывает производные ксантина,содержащие одну или несколько (С 1-С 4)алкильных групп, предпочтительно метильные заместители, и фармацевтически приемлемые соли таких производных ксантина. Особенно предпочтительными являются диметилксантины и триметилксантины, включая кофеин, теобромин и теофиллин. Наиболее предпочтительным алкилксантиновым производным является кофеин.- 20006677 Общие и относительные дозовые количества избирательно ингибирующего СОХ-2 препарата и сосудистого модулятора или алкилксантина выбирают так, чтобы они были терапевтически и/или профилактически эффективными в ослаблении боли, ассоциированной с головной болью или мигренью. Соответствующие дозовые количества будут зависеть от конкретного препарата, избирательно ингибирующего СОХ-2, и конкретного выбранного сосудистого модулятора или алкилксантина. Например, при комбинированной терапии с целекоксибом и кофеином обычно целекоксиб будет вводиться в суточном дозовом количестве примерно 50 мг до примерно 1000 мг, предпочтительно примерно 100 мг до примерно 600 мг, а кофеин в суточном дозовом количестве примерно 1 мг до примерно 500 мг, предпочтительно примерно 10 мг до примерно 400 мг, более предпочтительно примерно 20 мг до примерно 300 мг. Сосудистый модулятор или алкилксантиновый компонент комбинированной терапии может быть введен в любой подходящей лекарственной форме любым соответствующим путем, предпочтительно перорально. Сосудистый модулятор или алкилксантин необязательно может быть разработан совместно с препаратом, избирательно ингибирующим СОХ-2, в однократной пероральной лекарственной форме. Так, рецептура раствора или смеси раствор/суспензия по изобретению необязательно включает как аминосульфонилсодержащий препарат, избирательно ингибирующий СОХ-2, так и сосудистый модулятор или алкилксантин, такой как кофеин, в общих и относительных количествах, согласующихся с дозовыми количествами, приведенными выше. Фраза в общих и относительных количествах, эффективных в ослаблении боли, по отношению к количествам препарата, избирательно ингибирующего СОХ-2, и сосудистого модулятора или алкилксантина в композиции по настоящему варианту воплощения означает, что эти количества таковы, что (а) вместе эти компоненты эффективны в ослаблении боли, и (б) каждый компонент способен или был бы способен внести вклад в эффект ослабления боли, если другой компонент не присутствует или не присутствовал бы в столь большом количестве, чтобы избежать такого вклада. Примеры Пример 1. Получали шесть композиций растворов целекоксиба SF-1 до SF-6, содержащих компоненты, как показано в табл. 1. В каждом случае растворяющая жидкость состояла из PEG-400, или одного (SF-1), или вместе по меньшей мере с одним улавливающим свободные радикалы антиоксидантом (SF-2 до SF-6). Целекоксиб присутствовал в растворе во всех композициях в концентрации 50 мг/г. Количества антиоксиданта приведены как % мас./мас. Таблица 1. Состав композиций растворов целекоксиба SF-1 до SF-6 Пример 2. Проводили анализ с помощью градиентной ВЭЖХ, чтобы определить примеси в композициях растворов целекоксиба SF-1 до SF-6 примера 1 после хранения при различных температурах в течение различных периодов времени. Отбирали образцы композиций растворов и растворяли в метаноле, чтобы получить концентрацию целекоксиба примерно 0,4-0,5 мг/мл перед вводом образца в хроматограф. Условия хроматографии были следующие: (а) скорость потока: 1 мл/мин; (б) детектирование: УФ при 254 нм; (в) колонка: 5 мкм Supercosil LC-DP, 250 х 4,6 мм; (г) температура колонки: 40 С; (д) мобильная фаза А: 10 мМ NH4Ac или КН 2 РО 4, рН 3; мобильная фаза Б: 100% ацетонитрил; (е) время пробега: 45 мин. Данные приведены в табл. 2 и 3. Таблица 2. Уровень примесей (%) в композициях SF-1 до SF-6 после хранения- 21006677 Таблица 3. Уровень примесей (%) в композициях SF-1, SF-2, SF-5 и SF-6 после хранения при различных температурах Данные табл. 2 и 3 указывают на то, что присутствие небольшого количества улавливающего свободные радикалы антиоксиданта, такого как витамин Е, бутилгаллат, ВНА или ВНТ, значительно улучшает химическую стабильность целекоксиба, растворенного в PEG-400, по сравнению с композициями,не содержащими такого антиоксиданта. Пример 3. Через раствор композиции SF-1 примера 1 барботировали этиленоксид, предполагаемый источник свободных радикалов, в течение 15 мин и затем хранили раствор при 70 С в течение 10 дней. После хранения композицию анализировали на присутствие примесей. Дополнительные соединения, определенные в ней, выделяли полупрепаративной ВЭЖХ. Использовали колонку 20 х 250 мм с Kromasil C18 или в изократическом, или в градиентном режиме со смесью ацетонитрил-водная трифторуксусная кислота в качестве мобильной фазы. Детектирование проводили при 254 нм. Объединенные фракции, содержащие индивидуальные дополнительные соединения, упоминаемые в контексте как дополнительные соединения пика 1, пика 2 и пика 3, концентрировали, обессоливали и разделяли на химические фоновые компоненты путем улавливания на колонке 7 х 300 мм Hamilton PRP-1. Элюент из улавливающей колонки, содержащий индивидуальные дополнительные соединения, лиофилизировали, получая конечные вещества в чистом виде. Дополнительное соединение пика 1 имело чистоту 99%, и дополнительное вещество пика 2 имело чистоту 99% по данным аналитической ВЭЖХ. Чистота дополнительного соединения пика 3 составила 81% по данным аналитической ВЭЖХ. Аналитическую ВЭЖХ использовали также, чтобы собрать фракции интенсивных аналитических пиков для масс-спектрометрического анализа на масс-спектрометре РЕ Sciex Q-Star Qq-TOF. Исследование и сканирования образующихся ионов, а также измерения массы при высоком разрешении для определения эмпирической формулы проводили в режиме ионизации микроэлектрораспылением (ESI). Масс-спектрометрические данные высокого разрешения по дополнительным соединениям пика 1 и пика 2 получали на масс-спектрометре Finnigan MAT-900ST, действующем в режиме ESI. Точное измерение массы дополнительного соединения пика 1 проводили путем совмещения пиков при линейном сканирования электростатического анализатора при разрешении 7400 (отношение m/m на 10% высоте пика),используя в качестве стандарта ионы от PEG-400, (С 2H4 О)9 Н 2ONa при 437,23627 и (C2H4O)10H2ONa при 481,26248 Да, соответственно, чтобы наложить пик иона стандарта на псевдомолекулярный ион образца. Точное измерение массы дополнительного соединения пика 2 проводили путем совмещения пиков при линейном сканировании электростатического анализатора при разрешении 7100 (отношение m/Am на 10% высоте пика), используя в качестве стандарта ионы от PEG-400, (C2H4O)8H2ONa при 393,21005 и(C2H4O)9H2ONa при 437,23627 Да, соответственно, чтобы наложить пик иона стандарта на псевдомолекулярный ион образца. Образцы для ЯМР готовили в атмосфере азота в герметичной камере с перчатками и растворяли в 150 мкл диметилсульфоксида-d6. Данные регистрировали на спектрометре ЯМР Varian INOVA 400, дей- 22006677 ствующем на рабочей частоте 399,80 МГц и снабженном микроградиентным пробоотборником инверсной конфигурации от Nalorac. Использовали данные экспериментов непосредственно из стандартной библиотеки фирмы-поставщика без каких-либо модификаций. Пик 1 Целекоксиб и дополнительное соединение пика 1 по отдельности помещали на покрытые золотом предметные стекла микроскопа для анализов методами ИК-спектроскопии и спектроскопии комбинационного рассеяния света. Данные микроинфракрасного зеркального отражения собирали от 4000 до 650 см-1 при разрешении 4 см-1 с помощью спектрометра Nicolet 760, снабженного охлаждаемым жидким азотом детектором МСТ. Чувствительность, выраженная как коэффициент усиления прибора, составила 8. Данные подверглись обработке в преобразователе Фурье с использованием функции аподизации Хаппа-Гензеля и представлены графиком зависимости % пропускания от частоты. Окончательные спектры были суммой 200 отдельных сканов. Данные микроспектроскопии комбинационного рассеяния света собирали от 3700 до 100 см-1 с помощью спектрометра комбинационного рассеяния света с Фурьепреобразователем Nicolet 960. Чувствительность, выраженная как коэффициент усиления прибора, составила 64. Данные подверглись обработке в преобразователе Фурье с использованием функции аподизации Хаппа-Гензеля и представлены графиком зависимости поглощения от частоты. Окончательные спектры были суммой 10000 отдельных сканов. Было найдено, что молекулярная масса дополнительного соединения пика 1 составляет 469 Да, на 88 Да больше, чем у целекоксиба, и свидетельствует о наличии двух дополнительных этанольных остатков. Молекулярная масса компонента фракции аналитического пика была подтверждена измерением точной массы при высоком разрешении и составила 469,12831 Да, в пределах 0,2 ч/млн от теории дляC21H22F3N3O4S. Точная масса соединения пика 1 без ионизирующего протона измерена равной 469,12826 Да. Эмпирическая формула, использующая для лучшего совпадения правила валентностей, былаC21H22F3N3O4S и в пределах 0,1 ч/млн по массе от теории, таким образом подтверждая молекулярную массу данного вещества. Считается, что дополнительным соединением пика 1 является N,N-бис(2 гидроксиэтил)-4-[5-(4-метилфенил)-3-(трифторметил)-1H-пиразол-1-ил]бензолсульфонамид, имеющий структуру (V) Анализ методом ЯМР дополнительного соединения пика 1 дал результаты, подобные таковым для объемного препарата. Основное различие состояло в отсутствии протонов группы -SO2NH2 и появлении резонансных пиков, согласующихся с наличием двух функциональных групп -СН 2 СН 2 ОН. Метиленовые протоны и атомы углерода имели отличающиеся химические сдвиги, что совпадало с предложенной структурой. ИК-спектры и спектры комбинационного рассеяния света целекоксиба и дополнительного соединения пика 1 очень близки, что указывало на объем структуры такой же, как у целекоксиба. Однако были очевидны и некоторые спектральные различия между двумя молекулами. Деформационные колебания группы N-H в спектре целекоксиба при 3236 и 3342 см-1 отсутствуют в данных для дополнительного соединения пика 1, свидетельствуя о том, что присутствующая в целекоксибе аминогруппа не присутствует в дополнительном соединении пика 1. Колебания группы N-H, имеющиеся в ИК-спектре целекоксиба, в аналогичных данных для дополнительного соединения пика 1 заменены интенсивной широкой полосой поглощения с центром при 3430 см-1. Эта широкая полоса типична для деформационных колебаний группы О-Н, но слишком интенсивна, чтобы соответствовать одной гидроксильной группе, означая, что дополнительное соединение пика 1 обладает по меньшей мере двумя гидроксильными группами вместо присутствующей в целекоксибе аминогруппы. Другим основным спектральным различием между колебательными спектрами целекоксиба и дополнительного соединения пика 1 является присутствие в спектре комбинационного рассеяния дополнительного соединения пика 1 полос деформационных колебаний при 2967 и 2991 см-1, которые не присутствуют в аналогичных данных для целекоксиба. Эти различия указывают на присутствие добавочных групп СН 2 в дополнительном соединении по сравнению с целекоксибом. Данные как ИК-спектров, так и спектров комбинационного рассеяния согласуются с предложенной структурой.- 23006677 Считается, что соединение, имеющее структуру (V), является новым и полезным в качестве аналитического маркера, например, при определении стабильности целекоксиба в тех фармацевтических композициях, где целекоксиб контактирует или контактировал с полиэтиленгликолем или этиленоксидом,и/или в качестве препарата, селективно ингибирующего СОХ-2, или его депо-формы. Пик 2 Было найдено, что молекулярная масса дополнительного соединения пика 2 составляет 425 Да, на 44 Да больше, чем у целекоксиба, и свидетельствует о наличии одного дополнительного этанольного остатка. Молекулярная масса компонента фракции аналитического пика подтверждена измерением точной массы при высоком разрешении и составила 425,10239 Да, в пределах 0,9 ч/млн от теории дляC19H18F3N3O3S. Точная масса дополнительного соединения пика 2 без ионизирующего протона была измерена равной 425,10168 Да. Эмпирическая формула, использующая для лучшего совпадения правила валентностей, была C19H18F3N3O3S и в пределах 1,0 ч/млн по массе от теории, таким образом подтверждая молекулярную массу данного вещества. Считается, что дополнительным соединением пика 2 является Данные ЯМР для дополнительного соединения пика 2 были подобны таковым для дополнительного соединения пика 1 в том, что данное вещество также содержало функциональную группу -СН 2 СН 2 ОН, но интегрирование сигналов протонов определило присутствие только одного этанольного заместителя. Присутствие в веществе группы -NH- было также очевидным по данным протонного спектра. Химические сдвиги протонов и углеродов были в соответствии с предложенной структурой. Соединение, имеющее структуру (VI), считается новым и полезным в качестве аналитического маркера, например, при определении стабильности целекоксиба в тех фармацевтических композициях, где целекоксиб контактирует или контактировал с полиэтиленгликолем или этиленоксидом, и/или в качестве препарата, селективно ингибирующего СОХ-2, и/или его депо-формы. Пик 3 Дополнительное соединение пика 3 присутствовало в недостаточной концентрации для того, чтобы получить соответствующее количество вещества для спектроскопического анализа. Пример 4. Получали три раствора целекоксиба (10 мг/г) (с метанолом в качестве растворителя), один, не содержащий перекиси (S1), один, содержащий 150 ч/млн перекиси водорода (S2), и один, содержащий 150 ч/млн /трет-бутилпероксида (S3). Проводили анализ методом ВЭЖХ, как описано в примере 2, чтобы определить присутствие или отсутствие примесей после хранения при различных температурах в течение разных периодов времени (табл. 4). Таблица 4. Химическая стабильность растворов целекоксиба S1-S3 Эти данные означают, что присутствие перекиси водорода или трет-бутилпероксида в концентрации 150 ч/млн не оказывает воздействия на стабильность целекоксиба в метаноле. Эти данные согласу- 24006677 ются с заключением о том, что химическая неустойчивость в системе, включающей аминосульфонилсодержащий препарат, например целекоксиб, и полиэтиленгликоль, не опосредуется перекисями. Пример 5. Получали две композиции растворов целекоксиба SF-7 и SF-8 и две композиции растворов с наполнителем (плацебо) SF-9 и SF-10, содержащие компоненты, приведенные в табл. 5. Таблица 5. Состав (мг) композиций растворов SF-7 до SF-10 После хранения в течение 90 дней при различных температурах во всех композициях с помощью градиентной ВЭЖХ измеряли остаток пропилгаллата, исходная фракция которого имела содержание 1 мг/г. Образцы всех композиций растворяли в метаноле, чтобы получить перед впрыскиванием соответствующую концентрацию. Условия хроматографии были следующими: (а) скорость потока: 1 мл/мин; (б) детектирование: УФ при 254 нм; (в) впрыскиваемый объем: 15 мкл; (г) колонка: 3,5 мкм Zorbax XBD-C8,50 х 4,6 мм; (д) температура колонки: 25 С; (е) мобильная фаза А: 0,1% трифторуксусная кислота в воде; Эти данные означают, что в композициях, включающих аминосульфонилсодержащий препарат (в настоящем примере целекоксиб), и в тех, в которых такого препарата нет, пропилгаллат расходуется по существу с равной скоростью в течение 90 дней. Более того, скорость расхода зависит от температуры,скорость увеличивается по мере повышения температуры. Данные результаты предполагают, что улавливающий свободные радикалы антиоксидант расходуется не по опосредованному препаратом механизму, и подтверждают настоящую теорию о том, что стабилизация препарата является результатом взаимодействия между продуктами деградации полиэтиленгликоля и улавливающим свободные радикалы антиоксидантом. Пример 6 Получали композицию раствора целекоксиба SF-11, имеющую состав, представленный в табл. 7. Таблица 7. Состав (мг/г) композиции раствора целекоксиба SF-11 Помещали 1 г композиции SF-11 по отдельности в каждую из нескольких твердых желатиновых капсул (Capsugel), чтобы получить исследуемую композицию 1. Суспензию целекоксиба для сравнительных целей получали следующим образом.- 25006677 Б. Прибавляли этанол (до 100 мл), чтобы получить смесь, и смесь встряхивали до получения однородного раствора.B. Переносили аликвоту 5 мл однородного раствора в новую колбу на 100 мл, содержащую 200 мг целекоксиба, чтобы получить предварительную смесь. Г. Прибавляли 75 мл яблочного сока к предварительной смеси, чтобы получить промежуточную суспензию целекоксиба. Д. Промежуточную суспензию целекоксиба оставляли стоять в течение 5 мин и затем встряхивали,чтобы получить суспензию целекоксиба для сравнительных целей. Параметры биодоступности у человека, полученные при введении исследуемой композиции 1, при сопоставлении со сравнительной композицией суспензии целекоксиба из примера 5 и с коммерческой капсулой,содержащей 200 мг целекоксиба (Celebrex от Pharmacia), оценивали в рандомизированном, четырехэтапном,сбалансированном, перекрестном исследовании на 24 субъектах. Четвертая композиция, не относящаяся к настоящему изобретению, была также включена в исследование, но о ней не сообщается. Продолжительность исследования составила приблизительно 15 дней, и субъектам безвыборочным способом давали каждому одну из четырех лекарственных форм в дни 1, 5, 9 и 12; введению каждой дозы предшествовал восьмичасовой период голодания, в течение которого давали 180 мл воды. Уровни препарата в плазме крови для каждого субъекта определяли при предварительной дозе через 15, 30, 45 мин и через 1, 1,5, 2, 3, 4, 6, 8, 12 и 24 ч после введения дозы. Рассчитывали Смакс и площадь под кривой (AUC) по данным в соответствии со стандартной методикой в этой области. Как показано в табл. 8, прием внутрь исследуемой композиции 1 приводил к значению Смакс более чем в 2,5 раза более высокому, чем значения, полученные от приема внутрь сравнительной композиции целекоксиба или коммерческой капсулы целекоксиба. Прием внутрь исследуемой композиции 1 также приводил к AUC на 43% больше величины, полученной от приема внутрь сравнительной суспензии целекоксиба, а Тмакс фактически было одинаковым. Таблица 8. Биодоступность целекоксиба in vivo у человека Пример 7. Получали две композиции растворов целекоксиба SF-12 и SF-13 и две композиции растворов плацебо Р-2 и Р-3, имеющие составы, представленные в табл. 9. Таблица 9. Состав (мг) композиций растворов целекоксиба SF-12 и SF-13 и композиций растворов плацебо Р-2 и Р-3 Количества 500 мг и 1000 мг композиций растворов SF-12 и SF-13, соответственно, по отдельности помещали в каждую из нескольких мягких желатиновых капсул, чтобы получить исследуемые композиции 2 (100 мг целекоксиба) и 3 (200 мг целекоксиба), соответственно. Исследуемая композиция 4 состояла из двух капсул исследуемой композиции 3, что приводило к дозе целекоксиба 400 мг. Композициями растворов плацебо Р-2 и Р-3 заполняли мягкие капсулы, соответствующие по размеру капсулам, содержащим композиции растворов S-12 и S-13, соответственно, чтобы получить композицию плацебо 2 и композицию плацебо 3. Проводили рандомизированное исследование двойным слепым методом в параллельных группах,контролируемое активным веществом и плацебо в однократных дозах, чтобы оценить обезболивающую эффективность исследуемых композиций 2, 3 и 4, по сравнению с подходящим и визуально соответствующим плацебо, на человеческой модели боли после внутриротового хирургического вмешательства. Послеоперационных пациентов (после удаления двух или нескольких трудно прорезываемых зубов мудрости, требующего устранения отростков кости), которые сообщали об умеренной или острой боли после внутриротового хирургического вмешательства по квалифицирующей боль шкале (CPS; 0 означает отсутствие боли, 1 означает слабую боль, 2 означает умеренную боль и 3 означает острую боль) и базис- 26006677 ной интенсивности боли 50 мм по визуальной аналоговой шкале (VAS; в соответствии с интенсивностью боли пациент устанавливал передвижную планку, представляющую его или ее уровень боли, на горизонтальной шкале длиной 100 мм, левый край (0 мм) маркирован никакой боли и правый край(100 мм) маркирован очень сильная боль) через 6 ч после завершения хирургического вмешательства отбирали и произвольно распределяли по группам для исследования. Каждый пациент был произвольно определен в одну из четырех групп для лечения (приблизительно 55 человек в группе) и через 6 ч после завершения хирургической операции получал исследуемое лекарственное средство, назначенное его или ее группе, как из флакона А, так и из флакона Б, как показано на схеме лекарственной терапии в табл. 10. Две дополнительные композиции, не являющиеся иллюстративными по настоящему изобретению, были также включены в исследование, но о них не сообщается. Таблица 10. Схема изучения лекарственной терапии, установленная для пациентов в группах лечения 1-4 Боль оценивали по базовому значению (0 ч) и через 0,25, 0,50, 0,75, 1,0, 1,25, 1,50, 1,75, 2, 3, 4, 5, 6,7, 8, 9, 10, 11, 12, 16 и 24 ч после введения изучаемого лекарственного средства. Каждый пациент индивидуально определял и записывал время ощутимого ослабления боли и время выраженного ослабления боли, используя два секундомера. Время начала обезболивания затем рассчитывали для каждого пациента путем проведения анализа зависимости времени от события, объединяя данные, полученные пациентами с помощью секундомеров,по оценкам ощутимого и выраженного ослабления боли. Базовая интенсивность боли для каждой группы приведена в табл. 11. Среднее время начала обезболивания приведено в табл. 12. Таблица 11. Базовая интенсивность боли Эти данные показывают, что у пациентов в каждой исследуемой группе была сопоставимая базовая интенсивность боли. Таблица 12. Среднее время начала обезболивания Как определено в подобном исследовании боли, сообщенном в заявке WO 01/91750, включенной в контекст путем цитирования, капсулы с 200 мг Celebrex обладают средним временем проявления обезболивания 41 мин. Данные в табл. 12 показывают, что пациенты, принимающие исследуемые композиции 2, 3 или 4, ощущают сравнительно быстрое наступление обезболивания со средним временем 31 мин или меньше. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Доставляемая перорально фармацевтическая композиция, включающая: (а) препарат с низкой растворимостью в воде в терапевтически и/или профилактически эффективном количестве и (б) растворяющую жидкость, которая содержит по меньшей мере один фармацевтически приемлемый полиэтиленгликоль и по меньшей мере один улавливающий свободные радикалы антиоксидант, где значительная часть препарата находится в растворенной или солюбилизированной форме в растворяющей жидкости и где препарат является селективным ингибитором циклооксигеназы-2, содержащим функциональную аминосульфонильную группу, и представлен соединением формулы где R4 означает водород, (С 1-С 4)алкил или алкоксигруппу,X означает азот или CR5, где R5 означает водород или галоид, иY и Z означают независимо друг от друга атомы углерода или азота, обозначая смежные атомы пяти-шестичленного цикла, который не замещен или замещен по одному или нескольким положениям оксогруппой, галоидом, метильной или галоидметильной группами,и/или способен реагировать с полиэтиленгликолем или с продуктом деструкции полиэтиленгликоля с образованием соединения присоединения. 2. Композиция по п.1, где пяти-шестичленные циклы выбирают из группы, состоящей из циклопентенонового, фуранонового, метилпиразольного, изоксазольного и пиридинового колец, замещенных не более чем по одному положению. 3. Композиция по п.1, где препарат выбирают из группы, состоящей из целекоксиба, деракоксиба,валдекоксиба и JTE-522. 4. Композиция по п.1, где препаратом является целекоксиб. 5. Композиция по п.1, где препаратом является валдекоксиб. 6. Композиция по любому из пп.1-5, которая дополнительно включает сосудистый модулятор, где селективно ингибирующий циклооксигеназу-2 препарат и сосудистый модулятор присутствуют в общих и относительных количествах, эффективно ослабляющих боли при головной боли или мигрени. 7. Композиция по любому из пп.1-5, которая дополнительно включает производное алкилксантина,где селективно ингибирующий циклооксигеназу-2 препарат и производное алкилксантина присутствуют в общих и относительных количествах, эффективно ослабляющих боли при головной боли или мигрени. 8. Композиция по п.7, где производным алкилксантина является кофеин. 9. Композиция по любому из пп.1-8, где полиэтиленгликоль имеет среднюю молекулярную массу примерно 100-10000. 10. Композиция по любому из пп.1-8, где полиэтиленгликоль является жидкостью. 11. Композиция по любому из пп.1-10, где в растворяющей жидкости присутствует по меньшей мере один улавливающий свободные радикалы антиоксидант в общем количестве примерно 0,01-5%, предпочтительно примерно 0,01-1% по массе от композиции. 12. Композиция по любому из пп.1-11, где по меньшей мере один улавливающий свободные радикалы антиоксидант выбирают из группы, состоящей из витамина Е, аскорбиновой кислоты и ее солей,бутилированного гидроксианизола, бутилированного гидрокситолуола, фумаровой кислоты и ее солей,гипофосфорной кислоты, яблочной кислоты, алкилгаллатов, тиосульфата натрия, сульфита натрия, бисульфита натрия и метабисульфита натрия. 13. Композиция по любому из пп.1-11, где по меньшей мере одним улавливающим свободные радикалы антиоксидантом является алкилгаллат, предпочтительно пропилгаллат. 14. Композиция по любому из пп.1-11, где по меньшей мере одним улавливающим свободные радикалы антиоксидантом является витамин Е. 15. Композиция по любому из пп.1-14, где по существу весь препарат присутствует в композиции в растворенной или солюбилизированной форме. 16. Композиция по любому из пп. 1-15, где растворяющая жидкость дополнительно включает понижающий мутность полимер. 17. Композиция по п.16, где по меньшей мере одним понижающим мутность полимером является гидроксипропилметилцеллюлоза. 18. Композиция по любому из пп.1-17, где растворяющая жидкость дополнительно включает по меньшей мере одну фармацевтически приемлемую жирную кислоту и по меньшей мере один фармацевтически приемлемый органический амин. 19. Композиция по п.18, где по меньшей мере одной жирной кислотой является олеиновая кислота. 20. Композиция по п.18 или 19, где по меньшей мере одним органическим амином является третичный амин, выбираемый из группы, состоящей из триэтаноламина и диметиламиноэтанола. 21. Композиция по любому из пп.1-20, которая включает одну или несколько дискретных стандартных доз, где терапевтически и/или профилактически эффективное количество препарата содержится в одной стандартной дозе или в небольшом количестве упомянутых стандартных доз. 22. Композиция по п.21, где каждая стандартная доза является заполненной жидкостью капсулой,имеющей капсульную оболочку. 23. Композиция по п.22, где оболочка капсулы включает снижающий мутность полимер.- 28006677 24. Композиция по п.23, где снижающим мутность полимером является гидроксипропилметилцеллюлоза. 25. Способ лечения болезненного состояния или нарушения у субъекта, которому показано лечение ингибитором циклооксигеназы-2, включающий пероральное введение субъекту композиции по любому из пп.1-8. 26. Способ обезболивания, включающий пероральное введение эффективного ослабляющего боль количества композиции по любому из пп.1-5 субъекту, нуждающемуся в обезболивании. 27. Способ по п.26, где субъект страдает от головной боли или мигрени и где дополнительно субъекту вводят перорально сосудистый модулятор, причем селективно ингибирующий циклооксигеназу-2 препарат и сосудистый модулятор вводят в общих и относительных количествах, эффективных в ослаблении боли при головной боли или мигрени. 28. Способ по п.26, где субъект страдает от головной боли или мигрени и где субъекту дополнительно вводят перорально соединение алкилксантина, причем селективно ингибирующий циклооксигеназу-2 препарат и соединение алкилксантина вводят в общих и относительных количествах, эффективных в ослаблении боли при головной боли или мигрени. 29. Применение композиции по любому из пп.1-5 для получения лекарственного средства, применяемого для лечения терапевтического состояния или нарушения у субъекта, которому показано лечение ингибитором циклооксигеназы-2.
МПК / Метки
МПК: A61K 31/635, A61K 47/10, A61P 29/00, A61K 31/415, A61K 47/48
Метки: соединение, включающая, содержащее, аминосульфонильную, фармацевтическая, композиция, улавливающий, активное, сох-2, группу, перорально, свободные, радикалы, полиэтиленгликоль, антиоксидант, доставляемая, ингибитор
Код ссылки
<a href="https://eas.patents.su/30-6677-dostavlyaemaya-peroralno-farmacevticheskaya-kompoziciya-vklyuchayushhaya-aktivnoe-soedinenie-soderzhashhee-aminosulfonilnuyu-gruppu-ingibitor-soh-2-polietilenglikol-i-ulavlivayushh.html" rel="bookmark" title="База патентов Евразийского Союза">Доставляемая перорально фармацевтическая композиция, включающая активное соединение, содержащее аминосульфонильную группу (ингибитор сох-2), полиэтиленгликоль и улавливающий свободные радикалы антиоксидант</a>
Предыдущий патент: Гербицидные средства, содержащие бензоилпиразолы и защитные вещества
Случайный патент: Система видеомониторинга