Ингибиторы серинпротеазы
Номер патента: 5943
Опубликовано: 25.08.2005
Авторы: Джоунз Стюарт Дональд, Мейер Майкл Джон, Энгел Дэвид Биренбаум, Шихан Скотт Мартин, Кэмп Николас Пол, Янг Стивен Клинтон, Уайли Вилльям Александер, Уилли Майкл Роберт, Мюррей Кристофер Вилльям, Уотсон Брайан Морган, Мастерс Джон Джозеф, Гуццо Питер Роберт, Либешютц Джон Вальтер
Формула / Реферат
1. Соединение формулы (I), ингибирующее серинпротеазу
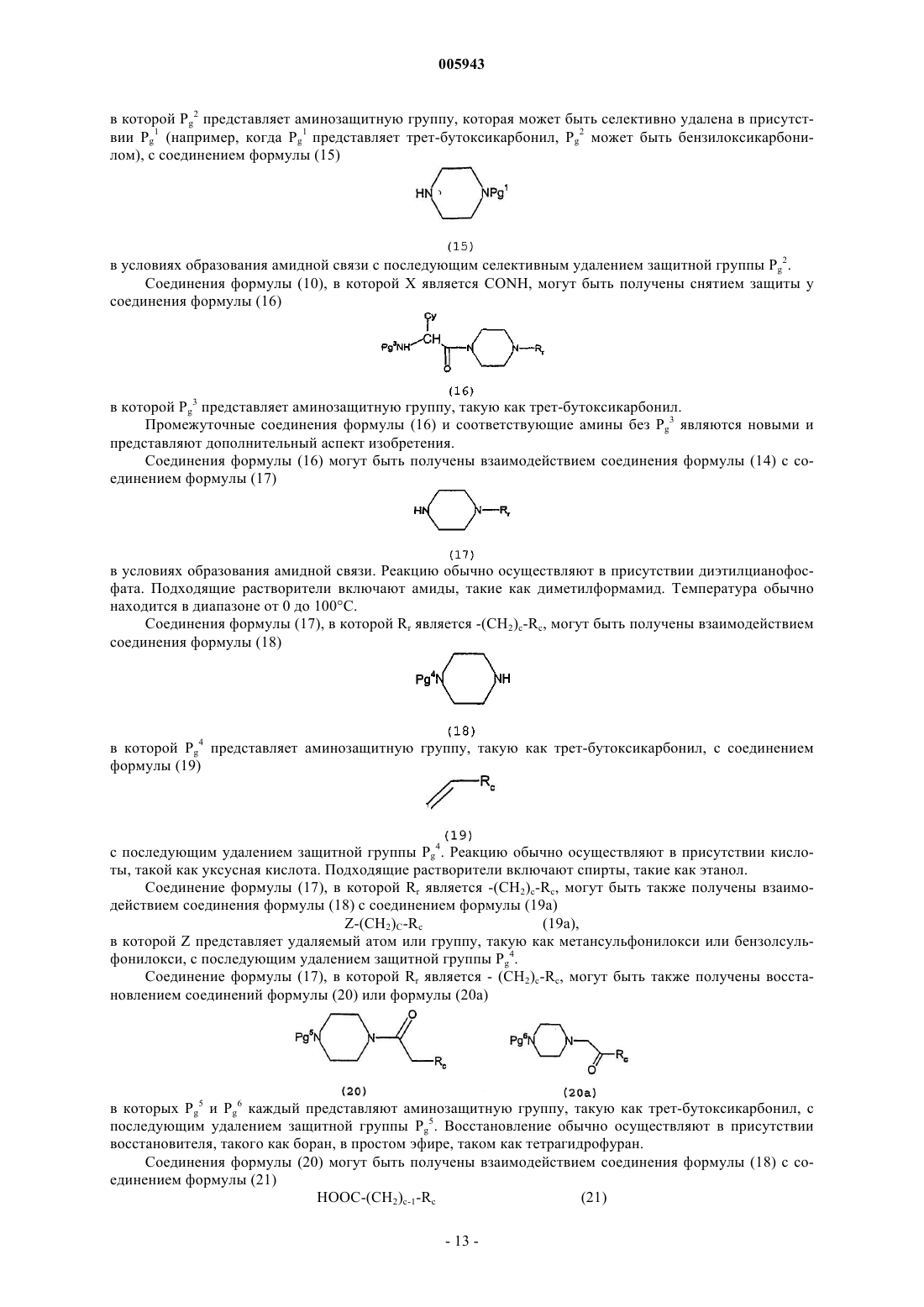
где R2 представляет
(i) фенил, необязательно замещенный в положении 3 и/или 4 галогеном, нитро, тиолом, галогеналкокси, гидразидо, алкилгидразидо, амино, циано, галогеналкилом, алкилтио, алкенилом, алкинилом, ациламино, три- или дифторметокси, карбокси, ацилокси, MeSO2- или R1, и необязательно замещенный в положении 6 амино, гидрокси, галогеном, алкилом, карбокси, алкоксикарбонилом, циано, амидо, аминоалкилом, алкокси или алкилтио;
(ii) нафт-2-ил, необязательно замещенный в положении 6 или 7 галогеном, галогеналкокси, галогеналкилом, циано, нитро, амино, гидразидо, алкилтио, алкенилом, алкинилом или R1j, и необязательно замещенный в положении 3 амино, гидрокси, галогеном, алкилом, карбокси, циано, амидо, аминоалкилом, алкокси или алкилтио;
(iii) изохинолин-7-ил, индол-5-ил, индол-6-ил, индазол-5-ил, индазол-6-ил, бензотиазол-6-ил или бензизоксазол-5-ил, необязательно замещенный в положении 3 галогеном, галогеналкокси, галогеналкилом, циано, нитро, амино, гидразидо, алкилтио, алкенилом, алкинилом или R1j;
(iv) бензимидазол-5-ил или бензотиазол-6-ил, необязательно замещенный в положении 2 амино;
(v) тиен-2-ил или тиен-3-ил, необязательно замещенный в положении 4 или 5 галогеном, галогеналкокси, галогеналкилом, циано, нитро, амино, гидразидо, алкилтио, алкенилом, алкинилом или R1;
(vi) 3,4-метилендиоксифенил, 2,3-дигидроиндол-6-ил, 3,3-дихлор-2-оксоиндол-6-ил или 1-метил-3-аминоиндазол-5-ил;
(vii) бензотиазол-2-ил, имидазо[1,2-a]пиримидин-2-ил или тетрагидроимидазо[1,2-a]пиримидин-2-ил;
(viii) пиразол-2-ил, необязательно замещенный в положении 5 галогеном, галогеналкокси, галогеналкилом, циано, нитро, амино, гидразидо, алкилтио, алкенилом, алкинилом или R1;
(ix) пирид-2-ил, необязательно замещенный в положении 5 галогеном, галогеналкокси, галогеналкилом, циано, нитро, амино, гидразидо, алкилтио, алкенилом, алкинилом или R1;
(x) пирид-3-ил, необязательно замещенный в положении 6 галогеном, галогеналкокси, галогеналкилом, циано, нитро, амино, гидразидо, алкилтио, алкенилом, алкинилом или R1;
(xi) бензофур-2-ил, необязательно замещенный в положении 3 амино, гидрокси, галогеном, алкилом, карбокси, циано, амидо, аминоалкилом, алкокси или алкилтио и в положении 5 или 6 галогеном, галогеналкокси, галогеналкилом, циано, нитро, амино, гидразидо, алкилтио, алкенилом, алкинилом или R1j;
(xii) индол-2-ил, необязательно замещенный на атоме азота индола алкилом и необязательно замещенный в положении 5 или 6 галогеном, галогеналкокси, галогеналкилом, циано, нитро, амино, гидразидо, алкилтио, алкенилом, алкинилом или R1j;
(xiii) индол-6-ил, замещенный в положении 5 амино, гидрокси, галогеном, алкилом, карбокси, алкоксикарбонилом, циано, амидо, аминоалкилом, алкокси или алкилтио и необязательно замещенный в положении 3 галогеном, галогеналкокси, галогеналкилом, циано, нитро, амино, гидразидо, алкилтио, алкенилом, алкинилом или R1j; или
(xiv) бензо[b]тиофен-2-ил, необязательно замещенный в положении 3 амино, гидрокси, галогеном, алкилом, карбокси, циано, амидо, аминоалкилом, алкокси или алкилтио и в положении 5 или 6 галогеном, галогеналкокси, галогеналкилом, циано, нитро, амино, гидразидо, алкилтио, алкенилом, алкинилом или R1j;
R1 представляет водород, гидрокси, алкокси, алкил, алкиламиноалкил, алканоил, гидроксиалкил, алкоксиалкил, алкоксикарбонил, алкиламинокарбонил, алкиламино, карбоксил, карбоксиметил, амидо или амидометил;
R1j представляет водород, гидрокси, алкокси, алкил, алканоил, гидроксиалкил, алкоксиалкил, алкоксикарбонил, алкиламино, карбоксил, карбоксиметил, амидо или амидометил;
CY представляет необязательно замещенную R3a фенильную, пиридильную, тиенильную, тиазолильную, нафтильную, пиперидильную, фуранильную, пирролильную, изоксазолильную, изотиазолильную, пиразолильную, оксазолильную, имидазолильную, 1,2,4-тиадиазолильную, 1,3,4-тиадиазолильную, пиримидинильную, пиридазинильную, хинолильную, изохинолильную, бензофурильную, бензотиенильную или циклоалкильную группу, или фенильную группу, замещенную R3iXi, где Xi представляет связь, O, NH или CH2, и R3i представляет фенильную, пиридильную или пиримидильную группу, необязательно замещенную R3a; и
каждый R3a независимо представляет водород, гидроксил, алкокси, аралкилокси, алкил, алкиламиноалкил, гидроксиметил, карбокси, алкоксиалкил, алкоксикарбонил, алкиламинокарбонил, аминометил, CONH2, CH2CONH2, (1-6C)алканоиламино, алкоксикарбониламино, амино, галоген, циано, нитро, тиол, алкилтио, алкилсульфонил, алкилсульфенил, алкилсульфонамидо, алкиламиносульфонил, аминосульфонил, галогеналкокси, галогеналкил, группу формулы -C(X3)N(R11)R12 (где X3 является O или S и R11 и R12 независимо выбраны из водорода, метила, этила или вместе с атомом азота, к которому они присоединены, образуют пирролидин-1-ильную, пиперидин-1-ильную или морфолиногруппу;
или -OCH2O-, которая связана с двумя смежными циклическими атомами в CY;
Rr является -(CH2)c-Rc, -CHReRf, -CH2-CHReRf, -CH2-CH2-CHReRf или Rg, где c равно 1 или 2;
Rc представляет тиенил, тиазолил (который может иметь в качестве заместителя аминогруппу), изотиазолил, оксазолил, изоксазолил, пиразолил, имидазолил, пиридил (который может иметь в качестве заместителя алкилсульфонильную, аминосульфонильную, алкиламиносульфонильную, алкиламинокарбонильную, амино, амидо, (1-4C)алкоксикарбонильную, карбоксильную, ацетиламино-, хлор, фтор, циано-, (1-3C)алкильную, трифторметильную, метоксильную, этоксильную, нитро, гидроксильную, алкилсульфониламино-, триазолильную или тетразолильную группу), пиримидинил, пиридазинил, пиразинил или фенил (который может иметь в качестве заместителя метильную, метиламино-, диметиламино-, карбоксильную, диалкиламиносульфонильную, алкилсульфонильную, аминосульфонильную, алкиламиносульфонильную, алкиламинокарбонильную, амино-, амидо-, алкоксикарбонильную, ацетиламино, хлор, фтор, циано, метоксильную, этоксильную, нитро-, гидроксильную, алкилсульфониламино-, триазолильную или тетразолильную группу);
каждый из Re и Rf независимо представляет водород или C1-3-алкил; или CHReRf представляет циклопентил (который может иметь в качестве заместителя в положении 3 или 4 гидроксильную, амино-, (1-3C)алкоксильную, (1-3C)гидроксиалкильную, (1-3C)алкильную, карбоксильную, метоксикарбонильную или этоксикарбонильную группу), циклогексил (который может иметь в качестве заместителя в положении 3 или 4 гидроксильную, амино-, (1-3C)алкоксильную, (1-3C)гидроксиалкильную, (1-3C)алкильную, карбоксильную, метоксикарбонильную или этоксикарбонильную группу), тетрагидропиран-4-ил, тетрагидротиопиран-4-ил, пирролидин-3-ил (который может иметь в качестве заместителя в положении 1 гидроксильную, амино-, (1-3C)алкоксильную, (1-3C)гидроксиалкильную, (1-3C)алкильную, карбоксильную, метоксикарбонильную или этоксикарбонильную группу), пиперидин-4-ил (который может иметь в качестве заместителя в положении 1 гидроксильную, амино-, (1-3C)алкоксильную, (1-3C)гидроксиалкильную, (1-3C)алкильную, карбоксильную, метоксикарбонильную или этоксикарбонильную группу), или индан-2-ил; и
Rg представляет 2-метилсульфонилфенил, который может иметь в качестве заместителя группу 4-фтор или Rg представляет l6-1,1-диоксобензо[b]тиофен-7-ил;
или его физиологически переносимая соль.
2. Соединение по п.1, где
CY представляет необязательно замещенную R3a фенильную, пиридильную, тиенильную, тиазолильную, нафтильную, пиперидинильную или циклоалкильную группу;
каждый R3а независимо выбран из водорода, гидроксила, метокси, этокси, метила, этила, метиламинометила, диметиламинометила, гидроксиметила, карбокси, метоксиметила, метоксикарбонила, этоксикарбонила, метиламинокарбонила, диметиламинокарбонила, аминометила, CONH2, CH2CONH2, ацетиламино, метоксикарбониламино, этоксикарбониламино, трет.-бутоксикарбониламино, амино, фтора, хлора, циано, нитро, тиола, метилтио, метисульфонила, этилсульфонила, метилсульфенила, метилсульфониламидо, этилсульфониламидо, метиламиносульфонила, этиламиносульфонила, аминосульфонила, трифторметокси и трифторметила, и
Rr является -(CH2)c-Rc, -CHReRf, -CH2-CHReRf или Rg, где c равно 1 или 2; Rc представляет пиридил или фенил (при этом фенил может иметь в качестве заместителя фтор, хлор, метильную, CONH2, SO2NH2, метиламиносульфонильную, диметиламиносульфонильную, метоксильную или метилсульфонильную группу); каждый из Re и Rf независимо представляет водород или C1-3-алкил; или CHReRf представляет циклопентил (который может иметь в качестве заместителя в положении 3 или 4 метильную, этильную или гидроксиметильную группу), циклогексил (который может иметь в качестве заместителя в положении 3 или 4 метильную, этильную или гидроксиметильную группу), тетрагидропиран-4-ил, тетрагидротиопиран-4-ил, пирролидин-3-ил (который может иметь в качестве заместителя 1-метильную группу), пиперидин-4-ил (который может иметь в качестве заместителя 1-метильную группу) или индан-2-ил; и Rg представляет l 6-1,1-диоксобензо[b]тиофен-7-ил.
3. Соединение по п.1 или п.2, где R2 представляет
(i) фенил, необязательно замещенный в положении 3 и/или 4 фтором, хлором, бромом, иодом, нитро, дифторметокси, трифторметокси, амино, циано, трифторметилом, метилтио, винилом, карбокси, ацетокси, MeSO2-, гидрокси, метокси, этокси, метилом, метоксикарбонилом, метиламино, этиламино или амидо и необязательно замещенный в положении 6 амино, гидрокси, фтором, метоксикарбонилом, циано или аминометилом (предпочтительно фенил, замещенный в положении 4 хлором, амино, винилом, метиламино, метилом или метокси, необязательно замещенный в положении 3 амино или гидрокси и необязательно замещенный в положении 6 амино или гидрокси);
(ii) нафт-2-ил, необязательно замещенный в положении 6 гидрокси и необязательно замещенный в положении 3 амино или гидрокси;
(iii) изохинолин-7-ил, индол-5-ил, индол-6-ил, индазол-5-ил, индазол-6-ил, бензотиазол-6-ил или бензизоксазол-5-ил, необязательно замещенный в положении 3 хлором, бромом, амино, метилом или метокси (предпочтительно индол-6-ил, необязательно замещенный в положении 3 хлором, бромом, метилом или метокси);
(iv) бензимидазол-5-ил или бензотиазол-6-ил, необязательно замещенный в положении 2 амино;
(v) тиен-2-ил или тиен-3-ил, необязательно замещенный в положении 4 или 5 метилтио, метилом или ацетилом;
(vi) 3,4-метилендиоксифенил, 2,3-дигидроиндол-6-ил, 3,3-дихлор-2-оксоиндол-6-ил или 1-метил-3-аминоиндазол-5-ил;
(viii) бензотиазол-2-ил, имидазо[1,2-а]пиримидин-2-ил или тетрагидроимидазо[1,2-а]пиримидин-2-ил;
(viii) пиразол-2-ил, замещенный в положении 5 метилом;
(ix) 5-хлорпирид-2-ил;
(x) пирид-3-ил или 6-хлорпирид-3-ил;
(xi) бензофур-2-ил, 5-хлорбензофур-2-ил, 3-метилбензофур-2-ил, 5-метилбензофур-2-ил или 5-метоксибензофур-2-ил;
(xii) индол-2-ил, необязательно замещенный в атоме азота индола метилом и необязательно замещенный в положении 5 или 6 фтором, хлором, бромом, метилом или метокси;
(xiii) индол-6-ил, замещенный в положении 5 хлором, фтором или гидрокси и необязательно замещенный в положении 3 хлором или метилом; или
(xiv) бензо[b]тиофен-2-ил, необязательно замещенный в положении 3 фтором, хлором или метилом и необязательно замещенный в положении 5 или 6 фтором, хлором, метилом, гидрокси или метокси.
4. Соединение по п.3, где R2 представляет
(i) фенил, 2-аминофенил, 3-аминофенил, 2-амино-4-фторфенил, 2-амино-4-хлорфенил, 2-амино-4-нитрофенил, 2-амино-4-метилфенил, 3,4-диаминофенил, 3-амино-4-фторфенил, 3-амино-4-хлорфенил, 3-амино-4-бромфенил, 3-амино-4-гидроксифенил, 3-амино-4-карбоксиметилфенил, 3-амино-4-метилфенил, 3-амино-4-метоксифенил, 2-фторфенил, 4-фтор-3-цианофенил, 3-хлорфенил, 3-хлор-4-гидроксифенил, 4-хлорфенил, 4-хлор-2-гидроксифенил, 4-хлор-3-гидроксифенил, 4-хлор-3-метилфенил, 4-хлор-3-метоксифенил, 4-бромфенил, 4-бром-3-метилфенил, 4-иодфенил, 2-цианофенил, 3-цианофенил, 4-цианофенил, 2-гидроксифенил, 2-гидрокси-4-метоксифенил, 3-гидроксифенил, 3-гидрокси-4-метилфенил, 2,4-дигидроксифенил, 3,4-дигидроксифенил, 3-гидрокси-4-метоксифенил, 4-дифторметоксифенил, 4-трифторметоксифенил, 4-трифторметилфенил, 4-метилтиофенил, 4-метоксикарбонилфенил, 4-ацетоксифенил, 4-метансульфонилфенил, 3-метилфенил, 4-метилфенил, 4-винилфенил, 4-метоксифенил, 4-этоксифенил, 4-метокси-3-хлорфенил, 4-метокси-3-метилфенил, 3-метиламинофенил, 4-метиламинофенил, 4-этиламинофенил или 2-аминометилфенил;
(ii) нафт-2-ил, 3-аминонафт-2-ил, 3-гидроксинафт-2-ил или 6-гидроксинафт-2-ил;
(iii) изохинолин-7-ил, индол-5-ил, индол-6-ил, 3-хлориндол-6-ил, 3-броминдол-6-ил, 3-метилиндол-6-ил, 3-метоксииндол-6-ил, индазол-5-ил, 3-аминоиндазол-5-ил, индазол-6-ил, бензотиазол-6-ил, 3-аминобензизоксазол-5-ил;
(iv) бензимидазол-5-ил, 2-аминобензимидазол-5-ил или бензотиазол-6-ил;
(v) тиен-2-ил, 5-метилтиен-2-ил, 5-метилтиотиен-2-ил, 5-ацетилтиен-2-ил или тиен-3-ил;
(vi) 3,4-метилендиоксифенил, 2,3-дигидроиндол-6-ил, 3,3-дихлор-2-оксоиндол-6-ил или 1-метил-3-аминоиндазол-5-ил;
(vii) бензотиазол-2-ил, имидазо[1,2-a]пиримидин-2-ил или тетрагидроимидазо[1,2-a]пиримидин-2-ил;
(viii) 5-метилпиразол-2-ил;
(ix) 5-хлорпирид-2-ил;
(x) пирид-3-ил, 6-хлорпирид-3-ил;
(xi) бензофур-2-ил, 5-хлорбензофур-2-ил, 3-метилбензофур-2-ил, 5-метилбензофур-2-ил, 6-метоксибензофур-2-ил;
(xii) индол-2-ил, 5-фториндол-2-ил, 5-хлориндол-2-ил, 5-метилиндол-2-ил, 5-метоксииндол-2-ил, 6-метоксииндол-2-ил и 1-метилиндол-2-ил;
(xiii) 5-фториндол-6-ил или
(xiv) бензо[b]тиофен-2-ил, 5-хлорбензо[b]тиофен-2-ил или 6-хлорбензо[b]тиофен-2-ил.
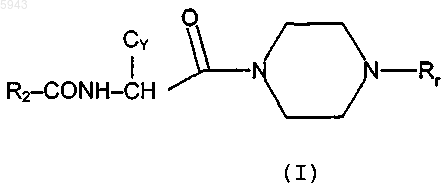
5. Соединение по п.2 или п.3, где R2 выбран из одной группы формулы (A')-(G'):
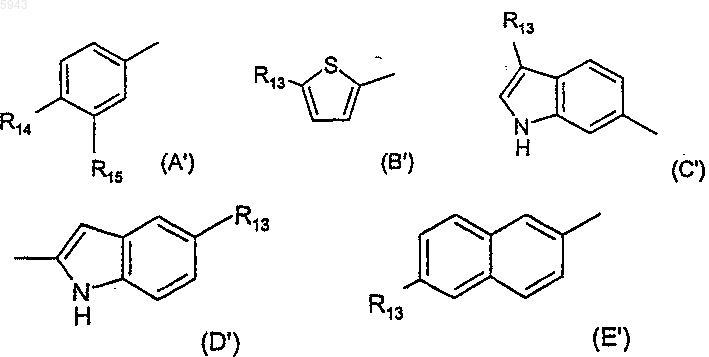
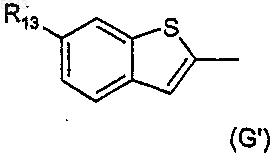
где R13 выбран из водорода, фтора [за исключением для (C')], хлора или метила и R14 выбран из водорода, метила, этила, фтора, хлора и метокси и R15 выбран из водорода, метила, фтора, хлора и амино.
6. Соединение по п.5, где R2 представляет 4-хлорфенил, 4-метоксифенил, 3-амино-4-хлорфенил, индол-2-ил, 5-хлориндол-2-ил, индол-6-ил, 3-хлориндол-6-ил или 3-метилиндол-6-ил.
7. Соединение по одному любому из пп.1-6, где CY выбран из
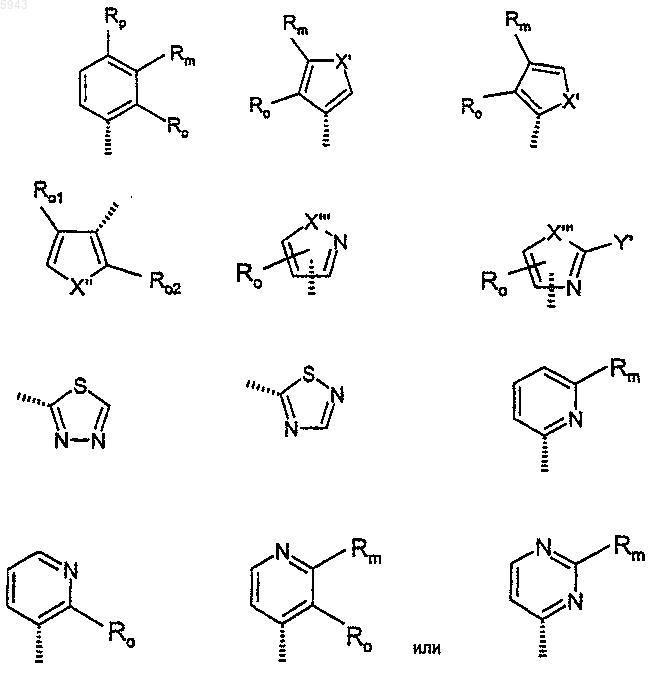
где X' выбран из O, S и NMe;
X" выбран из O и S;
X"' выбран из O, S, NH и NMe;
Y' выбран из водорода, амино и метила;
Ro выбран из водорода, метила, фтора, хлора, трифторметила, метокси, метилтио, метилсульфинила и метилсульфонила;
Rm выбран из водорода, метила, фтора, хлора, трифторметила, метокси, метилтио, метилсульфинила, метилсульфонила, карбокси, метоксикарбонила и группы формулы -C(X3)N(R11)R12 (где X3 является O или S и R11 и R12 независимо выбраны из водорода, метила или этила или вместе с атомом азота, к которому юэш присоединены, образуют пирролидин-1-ильную, пиперидин-1-ильную или морфолиногруппу);
Rp выбран из водорода и фтора; или
Ro и Rm или Rm и Rp образуют группу -OCH2O-; или Ro и Rm вместе с кольцом, к которому они присоединены, образуют 5- или 6-членное арильное или гетероарильное кольцо (где гетероарильное кольцо содержит 1 или 2 гетероатома, выбранные из азота, кислорода и серы);
один из Ro1 и Ro2 является водородом и другой является Ro.
8. Соединение по одному любому из пп.1-7, где CY выбран из фенила, 2-хлорфенила, 2-метоксифенила, 4-карбамоилфенила, пирид-2-ила, пирид-4-ила, тиен-2-ила, тиен-3-ила, фуран-2-ила, фуран-3-ила, имидазол-2-ила, тиазол-2-ила, тиазол-4-ила, тиазол-5-ила и хинолин-4-ила.
9. Соединение по одному любому из пп.1-8, где Rr представляет группу -CHReRf, -CH2-CHReRf или -CH2-CH2-CHReRf.
10. Соединение по п.9, где -CHReRf представляет 2-пропил, 3-пентил, циклопентил, циклогексил, 4-метилциклогексил, тетрагидротиопиран-4-ил, пирролидин-3-ил, 1-метилпирролидин-3-ил, 1-(2-пропил)пирролидин-3-ил, пиперидин-4-ил, 1-метилпиперидин-4-ил, 1-(2-пропил)пиперидин-4-ил или индан-2-ил.
11. Соединение по п.10, где Rr является 1-метилпиперидин-4-илом.
12. Соединение по одному любому из пп.1-11, в котором атом углерода в CH-группе, связанной с CY, имеет конформацию, которая соответствует строению D-a -аминокислоты NH2-CH(CY)-COOH.
13. Соединение по п.1, выбранное из
1-(индол-6-карбонил-D-фенилглицинил)-4-[2-(4-пиридинил)этил]пиперазина;
1-(3-хлориндол-6-карбонил-D-фенилглицинил)-4-[2-(4-пиридинил)этил]пиперазина;
1-(4-метоксибензоил-D-фенилглицинил)-4-(1-метилпиперидин-4-ил)пиперазина;
1-(индол-6-карбонил-D-фенилглицинил)-4-(1-метилпиперидин-4-ил)пиперазина;
1-(4-метоксибензоил-D-(2-хлорфенил)глицинил)-4-(1-метилпиперидин-4-ил)пиперазина;
1-(индол-6-карбонил-D-(2-хлорфенил)глицинил)-4-(1-метилпиперидин-4-ил)пиперазина и
1-(4-метоксибензоил-D-(2-трифторметилфенил)глицинил)-4-(1-метилпиперидин-4-ил)пиперазина;
и его физиологически приемлемые соли.
14. Соединение по п.13, которое представляет собой 1-(индол-6-карбонил-D-фенилглицинил)-4-(1-метилпиперидин-4-ил) пиперазин или его физиологически приемлемую соль.
15. Фармацевтическая композиция, содержащая соединение по одному любому из пп.1-14 вместе по меньшей мере с одним фармацевтически приемлемым носителем или экципиентом.
16. Соединение по одному любому из пп.1-14, предназначенное для применения в терапии.
17. Применение соединения по одному любому из пп.1-14 для производства лекарственного препарата, предназначенного для лечения тромботического заболевания.
18. Способ лечения организма человека или животного для устранения тромботического заболевания, включающий введение в организм эффективного количества соединения по п.1.
19. Фармацевтическая композиция, содержащая соединение по одному любому из пп.1-14, для устранения тромботического заболевания.
20. Соединение формулы

в которой CY является таким, как он определен в п.1, или его соль.
Текст
005943 Данное изобретение относится к соединениям, которые являются ингибиторами серинпротеаз, к содержащим их фармацевтическим композициям и к их применению для лечении человека или животного. Серинпротеазы представляют собой группу протеолитических ферментов, которые имеют общий каталитический механизм, характеризующийся особенно реакционноспособным сериновым остатком. Примеры серинпротеаз включают трипсин, триптазу, химотрипсин, эластазу, тромбин, плазмин, калликреин, комплемент С 1, акросомальную протеазу, лизосомальную протеазу, кокуназу, -литическую протеазу, протеазу А, протеазу В, серинкарбоксипептидазу II, субтилизин, урокиназу, фактор VIIa, факторIХа и фактор Ха. Серинпротеазы интенсивно исследовались в течение нескольких десятилетий и в настоящее время терапевтическое значение ингибиторов сернипротеаз является полностью понятным. Ингибиторы серинпротеазы играют главную роль в регуляции широкого множества физиологических процессов, включающих свертывание, фибринолиз, оплодотворение, развитие, злокачественное развитие болезни, нервно-мышечную активность и воспаление. Хорошо известно, что указанные соединения ингибируют множество циркулирующих протеаз, а также протеазы, которые являются активированными или высвобождаются в ткани. Кроме того, становится также ясным, что ингибиторы серинпротеазы подавляют опасные клеточные процессы, такие как адгезия, миграция, продуцирование свободных радикалов и апоптоз. Кроме того, эксперименты на животных показывают, что внутривенно введенные ингибиторы серинпротеазы, варианты или клетки, выражающие ингибиторы серинпротеазы, обеспечивают защитное действие против повреждения тканей. Предсказывается, что ингибиторы серинпротеазы имеют потенциальные полезные применения при лечении заболеваний в широком разнообразии клинических областей, таких как онкология, неврология,гематология, пульмонология, иммунология, воспалительные и инфекционные болезни. Ингибиторы серинпротеазы могут быть в особенности полезными при лечении тромботических заболеваний, астмы, эмфиземы, цирроза, артрита, карциномы, меланомы, рестеноза, атеромы, травмы, шока и реперфузионного повреждения. Так, например, ингибитор фактора Ха имеет значение как терапевтическое средство, применяемое в качестве антикоагулянта, например, при лечении и профилактике тромботических расстройств. Использование ингибитора фактора Ха в качестве антикоагулянта является желательным с точки зрения селективности его действия. Многие клинически подтвержденные антикоагулянты, вследствие неспецифического характера их действия на каскад коагуляции, дают нежелательные результаты. Имеются также хорошо известные связи недостатка ингибиторов l протеазы с эмфиземой и циррозом и недостатка ингибиторов С 1 эстеразы с ангионевротическим отеком. В настоящее время найдено, что некоторые ароматические соединения, несущие объемные липофильные боковые цепи, являются в особенности эффективными в качестве ингибиторов серинпротеаз,глазным образом протеаз с отрицательно заряженными карманами специфичности Р 1, и в особенности серинпротеазы тромбина и, что наиболее важно, в качестве ингибиторов фактора Ха. Ингибиторы фактора Ха данного изобретения являются потенциально пригодными для профилактики или лечения тромбоэмболических болезней, среди прочих, таких как венозный тромбоз, эмболия легких, артериальный тромбоз, ишемия миокарда, инфаркт миокарда и церебральный тромбоз. Они потенциально активны при лечении резкого закрытия сосуда, связанного с тромболитической терапией и рестенозом, например, после транслюминальной пластической операции на коронарных сосудах или обходного сосудистого шунтирования коронарных или периферических артерий и при сохранении сосуда больного в раскрытом состоянии при продолжительном гемодиализе. Ингибиторы фактора Ха данного изобретения могут оказывать благотворное влияние, образуя часть комплексной терапии антикоагулянтом различного действия или тромболитическим средством. В WO 99/11658 и WO 99/11657 сообщалось, что определенные производные бензамидина и аминоизохинолина, несущие объемную липофильную боковую цепь, являются превосходными ингибиторами серинпротеаз. К сожалению, было обнаружено, что производные бензамидина, раскрытые в WO 99/11658, обладают плохой пероральной биологической доступностью. Неожиданно было обнаружено, что некоторые другие ароматические соединения также показывают ингибирующую активность против серинпротеаз, в особенности против фактора Ха, несмотря на отсутствие амидина или 1-аминоизохинолиновой функциональной группы, которая, как считалось ранее, является ответственной за активность в качестве ингибитора фактора Ха. Многие из указанных соединений обладают также другими структурными особенностями, которые дополнительно отличают их от соединений WO 99/11658 и WO 99/11657. При испытании соединений изобретения они, по сравнению с бензамидинами, раскрытыми в WO 99/11658, обычно показывали очень высокую пероральную биологическую доступность. Кроме того,было найдено, что соединения изобретения, по сравнению с аминоизохинолинами с подобной активностью в отношении фактора Ха и подобной структурой, превосходно ведут себя в анализе с определением протромбинового времени (РТ). Анализ РТ представляет собой анализ коагуляции и во многих случаях широко допускается, что непосредственно действующие ингибиторы фактора Ха, которые хорошо ведут-1 005943 себя в анализе РТ, более вероятно являются хорошими противотромботическими средствами. В WO 99/09053 раскрыты некоторые производные 2-аминобензамида в качестве потенциальных антагонистов рецептора мотилина и в патенте США 3268513 предлагаются подобные производные 2 аминобензамида в качестве потенциальных антибактериальных средств. Однако новые соединения настоящего изобретения до этого не предлагались в качестве потенциальных ингибиторов серинпротеазы. Таким образом, в соответствии с одним аспектом изобретение предусматривает соединение ингибитора серинпротеазы формулы (I)(xi) бензофур-2-ил, необязательно замещенный в положении 3 амино, гидрокси, галогеном, алкилом, карбокси, циано, амидо, аминоалкилом, алкокси или алкилтио и в положении 5 или 6 галогеном,галогеналкокси, галогеналкилом, циано, нитро, амино, гидразидо, алкилтио, алкенилом, алкинилом или(xii) индол-2-ил, необязательно замещенный на атоме азота индола алкилом и необязательно замещенный в положении 5 или 6 галогеном, галогеналкокси, галогеналкилом, циано, нитро, амино, гидразидо, алкилтио, алкенилом, алкинилом или R1j;(xiii) индол-6-ил, замещенный в положении 5 амино, гидрокси, галогеном, алкилом, карбокси, алкоксикарбонилом, циано, амидо, аминоалкилом, алкокси или алкилтио и необязательно замещенный в положении 3 галогеном, галогеналкокси, галогеналкилом, циано, нитро, амино, гидразидо, алкилтио,алкенилом, алкинилом или R1J; или(xiv) бензо[b]тиофен-2-ил, необязательно замещенный в положении 3 амино, гидрокси, галогеном,алкилом, карбокси, циано, амидо, аминоалкилом, алкокси или алкилтио и в положении 5 или 6 галогеном, галогеналкокси, галогеналкилом, циано, нитро, амино, гидразидо, алкилтио, алкенилом, алкинилом или R1J;R1j представляет водород, гидрокси, алкокси, алкил, алканоил, гидроксиалкил, алкоксиалкил, алкоксикарбонил, алкиламино, карбоксил, карбоксиметил, амидо или амидометил; СY представляет необязательно замещенную R3a фенильную, пиридильную, тиенильную, тиазолильную, нафтильную, пиперидильную, фуранильную, пирролильную, изоксазолильную, изотиазолильную, пиразолильную, оксазолильную, имидазолильную, 1,2,4-тиадиазолильную, 1,3,4-тиадиазолильную,пиримидинильную, пиридазинильную, хинолильную, изохинолильную, бензофурильную, бензотиениль-2 005943 ную или циклоалкильную группу, или фенильную группу, замещенную R3iXi, где Xi представляет связь,О, NH или СН 2, и R3i представляет фенильную, пиридильную или пиримидильную группу, необязательно замещенную R3 а; и каждый R3a независимо представляет водород, гидроксил, алкокси, аралкилокси, алкил, алкиламиноалкил, гидроксиметил, карбокси, алкоксиалкил, алкоксикарбонил, алкиламинокарбонил, аминометил,CONH2, CH2CONH2, (1-6C)алканоиламино, алкоксикарбониламино, амино, галоген, циано, нитро, тиол,алкилтио, алкилсульфонил, алкилсульфенил, алкилсульфонамидо, алкиламиносульфонил, аминосульфонил, галогеналкокси, галогеналкил, группу формулы -С(X3)N(R11)R12 (где X3 является О или S и R11 и R12 независимо выбраны из водорода, метила, этила или вместе с атомом азота, к которому они присоединены, образуют пирролидин-1-ильную, пиперидин-1-ильную или морфолиногруппу; или -ОСН 2 О-, которая связана с двумя смежными циклическими атомами в CY;Rr является -(CH2)C-RC, -CHReRf, -CH2-CHReRf, -CH2-CH2-CHReRf или Rg, где с равно 1 или 2; Rc представляет тиенил, тиазолил (который может иметь в качестве заместителя аминогруппу), изотиазолил, оксазолил, изоксазолил, пиразолил, имидазолил, пиридил (который может иметь в качестве заместителя алкилсульфонильную, аминосульфонильную, алкиламиносульфонильную, алкиламинокарбонильную, амино, амидо, (1-4 С)алкоксикарбонильную, карбоксильную, ацетиламино-, хлор, фтор, циано-,(1-3 С)алкильную, трифторметильную, метоксильную, этоксильную, нитро, гидроксильную, алкилсульфониламино-, триазолильную или тетразолильную группу), пиримидинил, пиридазинил, пиразинил или фенил (который может иметь в качестве заместителя метильную, метиламино-, диметиламино-, карбоксильную, диалкиламиносульфонильную, алкилсульфонильную, аминосульфонильную, алкиламиносульфонильную, алкиламинокарбонильную, амино-, амидо-, алкоксикарбонильную, ацетиламино, хлор, фтор,циано, метоксильную, этоксильную, нитро-, гидроксильную, алкилсульфониламино-, триазолильную или тетразолильную группу); каждый из Re и Rf независимо представляет водород или C1-3-алкил; илиCHReRf представляет циклопентил (который может иметь в качестве заместителя в положении 3 или 4 гидроксильную, амино-, (1-3 С)алкоксильную, (1-3 С)гидроксиалкильную, (1-3 С)алкильную, карбоксильную, метоксикарбонильную или этоксикарбонильную группу), циклогексил (который может иметь в качестве заместителя в положении 3 или 4 гидроксильную, амино-, (1-3 С)алкоксильную, (1-3 С)гидроксиалкильную, (1-3 С)алкильную, карбоксильную, метоксикарбонильную или этоксикарбонильную группу),тетрагидропиран-4-ил, тетрагидротиопиран-4-ил, пирролидин-3-ил (который может иметь в качестве заместителя в положении 1 гидроксильную, амино-, (1-3 С)алкоксильную, (1-3 С)гидроксиалкильную,(1-3 С)алкильную, карбоксильную, метоксикарбонильную или этоксикарбонильную группу), пиперидин 4-ил (который может иметь в качестве заместителя в положении 1 гидроксильную, амино-, (1-3 С)алкоксильную, (1-3 С)гидроксиалкильную, (1-3 С)алкильную, карбоксильную, метоксикарбонильную или этоксикарбонильную группу), или индан-2-ил; и Rg представляет 2-метилсульфонилфенил, который может иметь в качестве заместителя группу 4-фтор или Rg представляет 6-1,1-диоксобензо[b]тиофен-7-ил; или его физиологически переносимая соль. В соответствии с другим аспектом изобретение относится к соединениям ингибитора серинпротеазы формулы (I)(xi) бензофур-2-ил, необязательно замещенный в положении 3 амино, гидрокси, галогеном, алкилом, карбокси, циано, амидо, аминоалкилом, алкокси или алкилтио и в положении 5 или 6 галогеном,галогеналкокси, галогеналкилом, циано, нитро, амино, гидразидо, алкилтио, алкенилом, алкинилом или(xii) индол-2-ил, необязательно замещенный на атоме азота индола алкилом и необязательно замещенный в положении 5 или 6 галогеном, галогеналкокси, галогеналкилом, циано, нитро, амино, гидразидо, алкилтио, алкенилом, алкинилом или R1J;(xiii) индол-6-ил, замещенный в положении 5 амино, гидрокси, галогеном, алкилом, карбокси, алкоксикарбонилом, циано, амидо, аминоалкилом, алкокси или алкилтио и необязательно замещенный в положении 3 галогеном, галогеналкокси, галогеналкилом, циано, нитро, амино, гидразидо, алкилтио,алкенилом, алкинилом или R1J; или(xiv) бензо[b]тиофен-2-ил, необязательно замещенный в положении 3 амино, гидрокси, галогеном,алкилом, карбокси, циано, амидо, аминоалкилом, алкокси или алкилтио и в положении 5 или 6 галогеном, галогеналкокси, галогеналкилом, циано, нитро, амино, гидразидо, алкилтио, алкенилом, алкинилом или R1j;R1j представляет водород, гидрокси, алкокси, алкил, алканоил, гидроксиалкил, алкоксиалкил, алкоксикарбонил, алкиламино, карбоксил, карбоксиметил, амидо или амидометил; СY представляет необязательно замещенную R3a фенильную, пиридильную, тиенильную, тиазолильную, нафтильную, пиперидинильную или циклоалкильную группу; каждый R3a независимо выбран из водорода, гидроксила, метокси, этокси, метила, этила, метиламинометила, диметиламинометила, гидроксиметила, карбокси, метоксиметила, метоксикарбонила, этоксикарбонила, метиламинокарбонила, диметиламинокарбонила, аминометила, CONH2, CH2CONH2, ацетиламино, метоксикарбониламино, этоксикарбониламино, трет-бутоксикарбониламино, амино, фтора, хлора, циано, нитро, тиола, метилтио, метисульфонила, этилсульфонила, метилсульфенила, метилсульфониламидо, этилсульфониламидо, метиламиносульфонила, этиламиносульфонила, аминосульфонила, трифторметокси и трифторметила,Rr является -(СН 2)с-Rc -CHReRf, -CH2-CHReRf или Rg, где с равно 1 или 2; Rc представляет пиридил или фенил (фенил может иметь в качестве заместителя фтор, хлор, метил, CONH2, SO2NH2, метиламиносульфонильную, диметиламиносульфонильную, метоксильную или метилсульфонильную группу); каждый из Re и Rf независимо представляет водород или C1-3 алкил; или CHReRf представляет циклопентил(который может иметь в качестве заместителя в положении 3 или 4 метильную, этильную или гидроксиметильную группу), циклогексил (который может иметь в качестве заместителя в положении 3 или 4 метильную, этильную или гидроксиметильную группу), тетрагидропиран-4-ил, тетрагидротиопиран-4-ил,пирролидин-3-ил (который может иметь в качестве заместителя 1-метильную группу), пиперидин-4-ил(который может иметь в качестве заместителя 1-метильную группу) или индан-2-ил; и Rg представляет 6-1,1-диоксобензо[b]тиофен-7-ил; или к его физиологически переносимой соли. В соединениях изобретения атом углерода в СН-группе, связанной с СY, предпочтительно имеет конформацию, которая может соответствовать строению Dаминокислоты NH2-CR1b (СY)-СООН, гдеNН 2 представляет часть Х-Х. Подобно, четвертый заместитель R1b в альфа-углероде предпочтительно представляет метильную или гидроксиметильную группу или водород. Следует иметь в виду, что соединения формулы (I) могут существовать в рацемической или хиральной форме, и что предпочтительныйD-изомер может быть введен в рацемической смеси с L-изомером или в отдельности. Если не указано иначе, арильные группы в соединениях изобретения предпочтительно содержат от 5 до 10 циклических атомов, необязательно включающих 1, 2 или 3 гетероатома, выбранные из О, N и S; алкильные, алкенильные или алкинильные группы или алкиленовые фрагменты предпочтительно содержат до 6 углеродов, например, C1-6 или C1-3; циклические группы предпочтительно имеют от 3 до 8 атомов; и конденсированные полициклические группы предпочтительно содержат от 8 до 16 циклических атомов. Примерами особых значений для -CHReRf в группе -CHReRf, -CH2-CHReRf или -CH2-CH2-CHReRf являются 2-пропил, 3-пентил, циклопентил, циклогексил, 4-метилциклогексил, тетрагидротиопиран-4-ил,пирролидин-3-ил, 1-метилпирролидин-3-ил, 1-(2-пропил)пирролидин-3-ил, пиперидин-4-ил, 1-метилпи-4 005943 перидин-4-ил, 1-(2-пропил)пиперидин-4-ил и индан-2-ил. Когда Rr имеет формулу -CHReRf, предпочтительным значением для Rr является 1-метилпиперидин 4-ил.Rr предпочтительно имеет формулу -(CH2)c-Rc, с предпочтительно равно 2, предпочтительно Rr является -(CH2)c-Rc; где с равно 2; Rc представляет тиенил, тиазолил (который может иметь в качестве заместителя аминогруппу), изотиазолил, оксазолил, изоксазолил, пиразолил, имидазолил, пиридил (который может иметь в качестве заместителя амино-, метоксикарбонильную, карбоксильную, фтор, циано-,метильную, метилсульфонильную, аминосульфонильную, метиламиносульфонильную или диметиламиносульфонильную или трифторметильную группу), пиримидинил, пиридазинил, пиразинил или фенил(при этом фенил может иметь в качестве заместителя фтор, хлор, циано-, метильную, амино-, метилсульфонильную, аминосульфонильную, метиламиносульфонильную, диметиламиносульфонильную, метиламино-, диметиламино-, карбоксильную, метоксикарбонильную или метоксильную группу).Rc предпочтительно представляет тиазолил (который может иметь в качестве заместителя аминогруппу), пиразолил, имидазолил, пиридил (который может иметь в качестве заместителя метилсульфонильную, аминосульфонильную, метиламиносульфонильную, диметиламиносульфонильную, фтор, циано-, метильную или трифторметильную группу), пиримидинил, пиридазинил, пиразинил или фенил (фенил может иметь в качестве заместителя фтор, хлор, циано-, метильную, амино, метиламино, диметиламино, карбоксильную, метоксикарбонильную, метилсульфонильную, аминосульфонильную, метиламиносульфонильную, диметиламиносульфонильную или метоксильную группу). Более предпочтительно Rc представляет тиазолил (который может иметь в качестве заместителя аминогруппу), пиразолил, имидазолил, пиридил (который может иметь в качестве заместителя фтор,циано, метильную или трифторметильную группу), пиридазинил или пиразинил. Еще более предпочтительно Rc представляет тиазол-2-ил, 2-аминотиазол-4-ил, пиразол-1-ил, пиразол-4-ил, пиридазин-3-ил, имидазол-1-ил, имидазол-4-ил, пиразин-2-ил, пирид-2-ил, пирид-3-ил, пирид 4-ил, 3-форпирид-4-ил, 2-цианопирид-4-ил, 2-метилпирид-4-ил или 2-трифторметилпирид-6-ил. Все же более предпочтительно Rc представляет пиразолил, имидазолил, пиридил, пиридазинил или пиразинил.Rc предпочтительно представляет пирид-2-ил, пирид-3-ил или пирид-4-ил. Наиболее предпочтительно гетероциклическая группа выбрана из формулm равно 0 или 1; Х 0 представляет СН или N; когда R3 присутствует в качестве заместителя в ароматическом кольце, он выбран из водорода, алкилсульфонила, аминосульфонила, алкиламиносульфонила, алкиламинокарбонила, амино, амидо, алкоксикарбонила, ацетиламино, хлора, фтора, циано, метокси, этокси, нитро, гидрокси, алкилсульфониламино, триазолила и тетразолила, и когда R3 присутствует в качестве заместителя в насыщенном кольце, он выбран из водорода, гидрокси, амино, (1-3 С)алкокси, (1-3 С)гидроксиалкила, (1-3 С)алкила, карбокси, метоксикарбонила и этоксикарбонила.m равно 1. Конкретные гетероциклические группы включают, например где Ri представляет водород или (1-6 С)алкил.Ri предпочтительно представляет водород, метил или этил. Более предпочтительно Ri представляет водород или метил. Циклическая группа (CY), присоединенная к альфа-углероду, представляет необязательно замещенную R3a: фенильную, пиридильную, тиенильную, тиазолильную, нафтильную, пиперидинильную, фуранильную, пирролильную, изоксазолильную, изотиазолильную, пиразолильную, оксазолильную, имидазолильную, 1,2,4-тиадиазолильную, 1,3,4-тиадиазолильную, пиримидинильную, пиридазинильную, хинолильную, изохинолильную, бензофурильную, бензотиенильную или циклоалкильную группу, или фенильную группу, замещенную R3iXi, где Xi представляет связь, О, NH или СН 2 и R3i представляет фе-6 005943 нильную, пиридильную или пиримидильную группу, необязательно замещенную R3a. Циклическая группа (СY), присоединенная к альфа-углероду, более предпочтительно представляет необязательно замещенную R3 а фенильную, пиридильную (такую как пирид-2-ил, пирид-3-ил или пирид 4-ил), тиенильную (такую как тиен-2-ил или тиен-3-ил), тиазолильную (такую как тиазол-2-ил, тиазол-4 ил или тиазол-5-ил), нафтильную (такую как нафтил-1-ил), пиперидинильную (такую как пиперидин-4 ил) или циклоалкильную группу, такую как циклогексильная группа. Примерами особых значений для R3 а являются: водород; гидроксил; алкокси, такой как метокси или этокси, или аралкилокси, такой как бензилокси; алкил, такой как метил или этил, или алкиламиноалкил, такой как метиламинометил или диметиламинометил; гидроксиметил или карбокси; для алкоксиалкила: метоксиметил; для алкоксикарбонила: метоксикарбонил или этоксикарбонил; для алкиламинокарбонила: метиламинокарбонил или диметиламинокарбонил; аминометил, CONH2 или CH2CONH2;(1-6 С)алканоиламино, такой как ацетиламино; для алкоксикарбониламино: метоксикарбониламино, этоксикарбониламино или трет-бутоксикарбониламино; амино; для галогена: фтор или хлор; циано; нитро; тиол; для алкилтио: метилтио; для алкилсульфонила: метилсульфонил или этилсульфонил; для алкилсульфенила: метилсульфенил; для алкилсульфонамидо: метилсульфониламидо или этилсульфониламидо; для алкиламиносульфонила: метиламиносульфонил или этиламиносульфонил; аминосульфонил; для галогеналкокси: трифторметокси; для галогеналкила: трифторметил; для группы формулы -С (X3) N (R11) R12 (где X3 является О или S и R11 и R12 независимо выбраны из водорода, метила, этила или вместе с атомом азота, к которому они присоединены, образуют пирролидин-1-ильную, пиперидин-1-ильную или морфолиногруппу): -CONH2, -CONHMe, -CON(Me)2, -C(S)NH2,-C(S)NHMe, -C(S)N(Me)2, пирролидин-1-илкарбонил, пиперидин-1-илкарбонил или морфолинокарбонил; и -ОСН 2 О-, которая связана с двумя смежными циклическими атомами в СY.X3 предпочтительно представляет О. Примеры более подходящих значений для R3 а включают водород, гидроксил, метокси, этокси, метил, этил, гидроксиметил, карбокси, метоксиметил, метоксикарбонил, этоксикарбонил, метиламинокарбонил, диметиламинокарбонил, аминометил, CONH2, CH2CONH2, ацетиламино, метоксикарбониламино,этоксикарбониламино, трет-бутоксикарбониламино, амино, фтор, хлор, бром, циано, нитро, тиол, метилтио, метилсульфонил, этилсульфонил, метилсульфенил, метилсульфониамидо, этилсульфониламидо,метиламиносульфонил, этиламиносульфонил, аминосульфонил, трифторметокси, трифторметил, бром,-ОСН 2 О-(который связан с двумя смежными циклическими атомами в CY) и C(X3)N(R11)R12 (где X3 является О или S и R11 и R12 независимо выбраны из водорода, метила или этила или вместе с атомом азота, к которому они присоединены, образуют пирролидин-1-ильную, пиперидин-1-ильную или морфолиногруппу). Примеры еще более подходящих значений для R3a включают водород, гидроксил, метокси, этокси,метил, этил, гидроксиметил, карбокси, метоксиметил, метоксикарбонил, этоксикарбонил, метиламинокарбонил, диметиламинокарбонил, аминометил, CONH2, CH2CONH2, ацетиламино, метоксикарбониламино, этоксикарбониламино, трет-бутоксикарбониламино, амино, фтор, хлор, циано, нитро, тиол, метилтио, метилсульфонил, этилсульфонил, метилсульфенил, метилсульфониламидо, этилсульфониламидо,метиламиносульфонил, этиламиносульфонил, аминосульфонил, трифторметокси и трифторметил.Rm выбран из водорода, метила, фтора, хлора, трифторметила, метокси, метилтио, метилсульфинила, метилсульфонила, карбокси, метоксикарбонила и группы формулы -C(X3)N(R11)R12 (где X3 является О или S и R11 и R12 независимо выбраны из водорода, метила или этила или вместе с атомом азота, к которому они присоединены, образуют пирролидин-1-ильную, пиперидин-1-ильную или морфолиногруппу);Rp выбран из водорода и фтора; илиRo и Rm или Rm и Rp образуют группу -ОСН 2 О-; или Ro и Rm вместе с кольцом, к которому они присоединены, образуют 5- или 6-членное арильное или гетероарильное кольцо (где гетероарильное кольцо содержит 1 или 2 гетероатома, выбранные из азота, кислорода и серы); один из Ro1 и Ro2 является водородом и другой является Ro;CY более предпочтительно выбран из фенила (необязательно замещенного метилом, этилом, проп 2-илом, фенокси, гидрокси, этокси, бензилокси, проп-2-илокси, нитро, амино, ацетиламино, метилсульфониламино, диметиламино, хлором, метокси, трифторметилом, метилтио, метилсульфонилом, третбутилтио, трет.-бутилсульфонилом, аминосульфонилом или карбамоилом), пиридила, тиенила, фуранила, имидазолила, тиазолила (необязательно замещенного амино), нафтила, изохинолила и хинолила. Еще более предпочтительно СY выбран из фенила, 2-хлорфенила, 2-метоксифенила, 4-карбамоилфенила, пирид-2-ила, пирид-3-ила, пирид-4-ила, тиен-2-ила, тиен-3-ила, фуран-2-ила, фуран-3-ила, имидазол-2-ила, тиазол-2-ила, тиазол-4-ила, тиазол-5-ила, нафтила, изохинолин-5-ила, изохинолин-8-ила,хинолин-4-ила, хинолин-5-ила и хинолин-8-ила. Другие примеры значений для СY представляют 4-аминофенил, 4-N-метиламидофенил, 4-(N,Nдиметил)амидофенил, 2-метилфенил, 2-фторфенил, 3-фторфенил, 4-фторфенил, 4-гидроксифенил, 4 метоксифенил, 4-карбоксифенил, 3-этилсульфониламинофенил, 2-метилтиазол-4-ил, 1-метилпиперидин 4-ил, циклопентил, циклогексил, нафт-1-ил, 2-аминотиазол-4-ил, 2-трифторметилфенил, 3-метилтиофенил, 2-метилсульфонилфенил, 3-бромфенил, 3-цианофенил и бензо[b]тиофен-3-ил. Все же еще более предпочтительно СY выбран из фенила, 2-хлорфенила, 2-метоксифенила, 4 карбамоилфенила, пирид-2-ила, пирид-4-ила, тиен-2-ила, тиен-3-ила, фуран-2-ила, фуран-3-ила, имидазол-2-ила, тиазол-2-ила, тиазол-4-ила, тиазол-5-ила и хинолин-4-ила. Наиболее предпочтительно CY выбран из фенила, 2-метоксифенила, 4-карбамоилфенила и пирид-2 ила. Наиболее предпочтительно СY представляет фенил. В соответствии с еще одним аспектом R2 представляет:(xi) бензофур-2-ил, необязательно замещенный в положении 3 амино, гидрокси, галогеном, алкилом, карбокси, циано, амидо, аминоалкилом, алкокси или алкилтио и в положении 5 или 6 галогеном,галогеналкокси, галогеналкилом, циано, нитро, амино, гидразидо, алкилтио, алкенилом, алкинилом или(xii) индол-2-ил, необязательно замещенный на атоме азота индола алкилом и необязательно замещенный в положении 5 или 6 галогеном, галогеналкокси, галогеналкилом, циано, нитро, амино, гидразидо, алкилтио, алкенилом, алкинилом или R1J;(xiii) индол-6-ил, замещенный в положении 5 амино, гидрокси, галогеном (таким как фтор или хлор), алкилом, карбокси, алкоксикарбонилом, циано, амидо, аминоалкилом, алкокси или алкилтио и необязательно замещенный в положении 3 галогеном, (таким как хлор), галогеналкокси, галогеналкилом,циано, нитро, амино, гидразидо, алкилтио, алкенилом, алкинилом или R1j; или(xiv) бензо[b]тиофен-2-ил, необязательно замещенный в положении 3 амино, гидрокси, галогеном,алкилом, карбокси, циано, амидо, аминоалкилом, алкокси или алкилтио и в положении 5 или 6 галогеном, галогеналкокси, галогеналкилом, циано, нитро, амино, гидразидо, алкилтио, алкенилом, алкинилом или R1j. Примерами особых значений для заместителей, которые могут присутствовать в R2, являются: для галогена: фтор, хлор, бром или иод; нитро; тиол; для галогеналкокси: дифторметокси или трифторметокси; гидразидо; для алкилгидразидо: метилгидразидо; амино; циано; для галогеналкила: трифторметил; для алкилтио: метилтио; для алкенила: винил; для алкинила: этинил; для ациламино: ацетиламино; карбокси; для ацилокси: ацетокси; гидрокси; для алкила: метил или этил; амидо (CONH2); для аминоалкила: аминометил и для алкокси: метокси или этокси; Предпочтительно R2 необязательно замещен 1 или 2 заместителями, выбранными из фтора, хлора,амино, метила, этила и метокси. Примерами особых значений для R1 являются: водород; гидрокси; для алкокси: метокси или этокси; алкил, такой как метил или этил, алкиламиноалкил, такой как диметиламинометил, или алканоил,-9 005943 такой как ацетил; для гидроксиалкила: гидроксиметил; для алкоксиалкила: метоксиметил; для алкоксикарбонила: метоксикарбонил; для алкиламинокарбонила: метиламинокарбонил; для алкиламино: метиламино, этиламино или диметиламино; карбоксил или карбоксиметил, и амидо (СОNН 2) или амидометил. Примерами особых значений для R1j являются: водород; гидрокси; для алкокси: метокси или этокси; алкил, такой как метил или этил, или алканоил, такой как ацетил; для гидроксиалкила: гидроксиметил; для алкоксиалкила: метоксиметил; для алкоксикарбонила: метоксикарбонил; для алкиламино: метиламино, этиламино или диметиламино; карбоксил или карбоксиметил и амидо (CONH2) или амидометил. В соответствии с еще одним аспектом R2 представляет:(i) фенил, необязательно замещенный в положении 3 и/или 4 фтором, хлором, бромом, иодом, нитро, дифторметокси, трифторметокси, амино, циано, трифторметилом, метилтио, винилом, карбокси, ацетокси, МеSО 2, гидрокси, метокси, этокси, метилом, метоксикарбонилом, метиламино, этиламино или амидо и необязательно замещенный в положении 6 амино, гидрокси, фтором, метоксикарбонилом, циано или аминометилом (предпочтительно фенил, замещенный в положении 4 хлором, амино, винилом, метиламино, метилом или метокси, необязательно замещенный в положении 3 амино или гидрокси и необязательно замещенный в положении 6 амино или гидрокси);(iii) изохинолин-7-ил, индол-5-ил, индол-6-ил, индазол-5-ил, индазол-6-ил, бензотиазол-6-ил или бензотиазол-5-ил, необязательно замещенный в положении 3 хлором, бромом, амино, метилом или метокси (предпочтительно индол-6-ил, необязательно замещенный в положении 3 хлором, бромом, метилом или метокси);(xii) индол-2-ил, необязательно замещенный в атоме азота индола метилом и необязательно замещенный в положении 5 или 6 фтором, хлором, бромом, метилом или метокси;(xiii) индол-6-ил, замещенный в положении 5 хлором, фтором или гидрокси и необязательно замещенный в положении 3 хлором или метилом; или(xiv) бензо[b]тиофен-2-ил, необязательно замещенный в положении 3 фтором, хлором или метилом и необязательно замещенный в положении 5 или 6 фтором, хлором, метилом, гидрокси или метокси. Особыми значениями для R2 являются:R2 предпочтительно является одним, выбранным из группы формул (А' ) - (G'): где R13 выбран из водорода, фтора [за исключением для (С')], хлора или метила и R14 выбран из водорода,метила, этила, фтора, хлора и метокси и R15 выбран из водорода, метила, фтора, хлора и амино. Более предпочтительно R2 имеет формулу (А') (где R14 выбран из водорода, метила, этила, фтора,хлора и метокси и R15 выбран из водорода, метила, фтора, хлора и амино) или формулу (В') (где R13 является хлором), или формулу (С') (где R13 выбран из водорода, метила и хлора), или формулу (D') (где R13 выбран из водорода, метила, фтора и хлора), или формулу (Е') (где R13 является водородом), или формулу (G') (где R13 является хлором). Еще более предпочтительным R2 представляет 4-хлорфенил, 4-метоксифенил, 3-амино-4 хлорфенил, индол-2-ил, 5-хлориндол-2-ил, индол-6-ил, 3-хлориндол-6-ил или 3-метилиндол-6-ил. Другой группой R2, представляющей особый интерес, является 3-аминобензизоксазол-5-ил. Все же более предпочтительно R2 имеет формулу (А') или (С') и R13, R14 и R15 являются такими, как они определены выше. Наиболее предпочтительно R2 имеет формулу (А' ) и R14 является метокси и R15 является водородом или формулу (С') и R13 представляет водород, метил или хлор. Другое предпочтительное соединение настоящего изобретения представляет одно из соединений формулы где СY и R2 являются такими, как они определены выше. Предпочтительное соединение настоящего изобретения имеет формулу где СY, R2 и Rc являются такими, как они определены выше.- 11005943 Особое значение имеют следующие соединения: 1-(индол-6-карбонил-D-фенилглицинил)-4-[2-(4-пирилинил)этил]пиперазин; 1-(3-хлориндол-6-карбонил-D-фенилглицинил)-4-[2-(4-пиридинил)этил]пиперазин; 1-(4-метоксибензоил-D-фенилглицинил)-4-(1-метилпиперидин-4-ил)пиперазин; 1-(индол-6-карбонил-D-фенилглицинил)-4-(1-метилпиперидин-4-ил)пиперазин; 1-(4-метоксибензоил-D-(2-хлорфенил)глицинил)-4-(1-метилпиперидин-4-ил)пиперазин; 1-(индол-6-карбонил-D-(2-хлорфенил)глицинил)-4-(1-метилпиперидин-4-ил)пиперазин и 1-(4-метоксибензоил-D-(2-трифторметилфенил)глицинил)-4-(1-метилпиперидин-4-ил)пиперазин; и их физиологически переносимые соли. Было найдено, что соединения данной группы имеют хорошее пероральное действие и требуемый фармакологический/токсикологический профиль. Соединения изобретения могут быть получены по общепринятым химическим синтетическим методикам или способами, проиллюстрированными следующими примерами. Соединения формулы (I) могут быть получены образованием связи CO-NH из соответствующих промежуточных соединений. Так, например, взаимодействием соединения формулы (10): с соединением формулы R2-COOH в условиях, известных для образования амидной связи. Реакцию обычно осуществляют в присутствии реагента на основе бензотриазола, такого как 1-гидроксибензотриазол или 1-гидрокси-7-азабензотриазол, в инертном органическом растворителе, таком как диметилформамид и/или метиленхлорид. Реакционную смесь обычно доводят до 0 С и затем добавляют дегидратирующий агент, такой как дициклогексилкарбодиимид или 1-(3-диметиламинопропил)-3-этилкарбодиимид. В данной области известны другие подходящие реагенты и растворители, например, галогенангидриды, такие как R2-COCl. Данные реакции могут быть использованы для образования промежуточных соединений. Соединения формулы (I), в которой Rr является -(СН 2)с-Rc, может быть также получено восстановительным сочетанием соединения формулы (11) Реакцию обычно осуществляют в присутствии восстановителя, такого как цианоборгидрид натрия. Подходящие растворители включают спирты, такие как метанол, необязательно с использованием в качестве растворителя галогенированного углеводорода, такого как 1,2-дихлорэтан, и уксусную кислоту. Реакцию сочетания обычно осуществляют при температуре в диапазоне от 0 до 100 С. Промежуточные соединения формулы (11) могут быть получены взаимодействием соединения формулы (13)R2-COOH в условиях, известных для образования амидной связи, например, в условиях, которые указаны выше для образования соединения формулы (I), с последующим снятием защиты. Соединения формулы (13) могут быть получены взаимодействием соответствующего Nзащищенного глицина формулы (14)- 12005943 в которой Pg2 представляет аминозащитную группу, которая может быть селективно удалена в присутствии Pg1 (например, когда Pg1 представляет трет-бутоксикарбонил, Рg2 может быть бензилоксикарбонилом), с соединением формулы (15) в условиях образования амидной связи с последующим селективным удалением защитной группы Рg2. Соединения формулы (10), в которой X является CONH, могут быть получены снятием защиты у соединения формулы (16) в которой Рg3 представляет аминозащитную группу, такую как трет-бутоксикарбонил. Промежуточные соединения формулы (16) и соответствующие амины без Рg3 являются новыми и представляют дополнительный аспект изобретения. Соединения формулы (16) могут быть получены взаимодействием соединения формулы (14) с соединением формулы (17) в условиях образования амидной связи. Реакцию обычно осуществляют в присутствии диэтилцианофосфата. Подходящие растворители включают амиды, такие как диметилформамид. Температура обычно находится в диапазоне от 0 до 100 С. Соединения формулы (17), в которой Rr является -(CH2)c-Rc, могут быть получены взаимодействием соединения формулы (18) с последующим удалением защитной группы Рg4. Реакцию обычно осуществляют в присутствии кислоты, такой как уксусная кислота. Подходящие растворители включают спирты, такие как этанол. Соединение формулы (17), в которой Rr является -(СН 2)с-Rс, могут быть также получены взаимодействием соединения формулы (18) с соединением формулы (19 а)(19 а),в которой Z представляет удаляемый атом или группу, такую как метансульфонилокси или бензолсульфонилокси, с последующим удалением защитной группы Рg4. Соединение формулы (17), в которой Rr является - (СН 2)с-Rc, могут быть также получены восстановлением соединений формулы (20) или формулы (20a) в которых Рg5 и Рg6 каждый представляют аминозащитную группу, такую как трет-бутоксикарбонил, с последующим удалением защитной группы Рg5. Восстановление обычно осуществляют в присутствии восстановителя, такого как боран, в простом эфире, таком как тетрагидрофуран. Соединения формулы (20) могут быть получены взаимодействием соединения формулы (18) с соединением формулы (21)- 13005943 в условиях образования амидной связи. Альтернативно соединения формулы (20) могут быть получены взаимодействием соединения формулы (18) с соединением формулы (21 а)(21b),в присутствии сильного основания, такого как гидрид натрия. Следовательно настоящее изобретение также предусматривает способ получения соединения формулы (I), включающей:(a) взаимодействие соединения формулы (10) с соединением формулы R2-COOH в условиях образования амидной связи или(b) когда Rr является -(СН 2)с-Rc, взаимодействие соединения формулы (11) с соединением формулы(12); где R2, СY, с и Rr являются такими, как они определены выше, и формулы (10), (11) и (12) также является такими, как они определены выше, с последующим образованием физиологически приемлемой соли, если необходима соль. Аминокислота формулы (23)(23) или N-защищенный глицин формулы (14) могут быть получены (например) одним или несколькими из следующих способов:(i) из арильных или гетероарильных альдегидов синтезом Стрекера (Strecker) или его модификацией, синтезом гидантоина Бухерера-Бергса (Bucherer-Bergs) или по методике Уги (Ugi) ("Isonitrile Chemistry", Ugi I. Ed.; Academic: New York, 1971, 145-1999, "Multicomponent Reactions with Isocyanides",Domling, A.; Ugi, I. Angew. Chem. Int. Ed. 2000, 39, 3168; Amino Acid Derivatives by Multicomponent Reactions", Dyker, G. Angew, Chem. Int. Ed. Engl. 1997, 36, 1700; и см. также "A new Class of Convertible Isocyanides in the Ugi Four-Component Reaction", Lindhorst, Т.; Bock H.; Ugi I. Tetrahedron, 1999, 55, 7411) с удалением и заменой защитных групп;(ii) из стиролов, следуя методике Шарплесса (Sharpless) (J. Am. Chem. Soc. 1998, 120, 1207-1217);(iii) из арилбороновых кислот, следуя методике Петасиса (Petasis) (Tetrahedron, 1997, 53, 1646316470) с удалением и заменой защитных групп;(iv) из арильных и гетероарильных уксусных кислот азидированием по Эвансу (Evan's) (Synthesis 1997, 563-540) или оксимированием с последующим восстановлением и введением защитных групп; или(v) из существующих арилглицинов модификацией функциональных групп, например, алкилированием гидроксильных групп, карбонилированием в присутствии палладия трифлатов, полученных из гидроксильных групп, и последующим преобразованием сложных эфиров карбоновых кислот, для получения карбоновых кислот гидролизом, для получения карбоксамидов активацией карбоновой кислоты и сочетанием с аминами, для получением аминов реакцией Курциуса (Curtius) в присутствии карбоновой кислоты;(vi) из алифатических, карбоциклических и неароматических гетероциклических альдегидов и кетонов с использованием реакции Хорнера-Эммонса (Horner-Emmons) со сложным триметиловым эфиром(vii) восстановлением из оксимов формулы в которой Рg является защитной группой для карбокси (оксимы, в которых CY является гетероарильной группой, могут быть получены из соединений формулы Альтернативно оксимы могут быть получены нитрозированием соединения формулы СY-СН 2 СООРg или реакцией гидроксиламина с соединением формулы CY-CO-COOPg). Специалистам в данной области известно, что на определенных стадиях синтеза соединения формулы (I) может стать необходимой защита химический активной функциональной группы в молекуле для предотвращения нежелательных побочных реакций. Защита аминогрупп и карбоксигрупп карбоновых кислот описана в: Mc Omie, Protecting Groups inEd., John Wiley and Sons, 4, 1991. Примеры защитных групп для карбокси включают C1-С 6-алкильные группы, такие как метильная, этильная, трет-бутильная и трет-амильная; арил(С 1-С 4)алкильные группы,такие как бензильная, 4-нитробензильная, 4-метоксибензильная, 3,4-диметоксибензильная, 2,4-диметоксибензильная, 2,4,6-триметоксибензильная, 2,4,6-триметилбензильная, бензгидрильная и тритильная; силильные группы, такие как триметилсилильная и трет-бутилдиметилсилильная; и аллильные группы,такие как аллильная и 1-(триметилсилилметил)проп-1-ен-3-ильная. Примеры защитных групп для амина (PG) включают ацильные группы, такие как группы формулыRCO, в которой R представляет C1-6-алкил, С 3-10-циклоалкил, фенил-С 1-6-алкил, фенил, C1-6-алкокси, фенил-С 1-6-алкокси или С 3-10-циклоалкокси, где фенильная группа может быть необязательно замещена,например, одним или двумя атомами галогена, С 1-С 4-алкилом и С 1-С 4-алкокси. Предпочтительные аминозащитные группы включают бензилоксикарбонил (CBz), третбутоксикарбонил (Воc) и бензил. В соответствии с другим аспектом изобретение относится к способу получения соединения формулы I, включающему снятие защиты у соединения формулы (I'):(I)',2 2 где R ' представляет R (который определен выше) или защищенный R2, CY' представляет СY (который определен выше) или защищенный СY и Lp(D)n' представляет Lp(D)n (который определен выше) или защищенный Lp(D)n; при условии,что присутствует по меньшей мере одна защитная группа. Если необходимо, могут быть образованы физиологически переносимые соли с использованием известных в данной области способов. Понятно, что соединения формулы (I) могут быть выделены в форме солей или сольватов (которые могут быть физиологически переносимыми или не быть таковыми) и что все такие соли и сольваты следовательно включены в объем настоящего изобретения. Все новые представленные в данном описании промежуточные соединения, например, соединения формулы и их соли представляют дополнительные аспекты изобретения. Соединения изобретения могут быть введены любым подходящим способом, например, в желудочно-кишечный тракт (например, ректально или перорально), нос, легкие, мускулатуру или сосудистую сеть или чрезкожно. Соединения могут быть введены в любой форме, подходящей для введения, например, в виде таблеток, порошков, капсул, растворов, дисперсий, суспензий, сиропов, аэрозолей, суппозиториев, гелей, эмульсий, пластырей и т.д. Такие композиции могут содержать компоненты, общепринятые при получении фармацевтических препаратов, например, разбавители, носители, модификаторы рН,подсластители, наполнители и дополнительные активные агенты. Композиции предпочтительно должны быть стерильными и в форме раствора или суспензии, подходящей для инъекции или вливания. Такие композиции образуют еще один аспект изобретения. Далее представлены примеры фармацевтических композиций соединений в соответствии с изобретением. Состав 1 Твердые желатиновые капсулы получают с использованием следующих ингредиентов: Вышеуказанные ингредиенты в количестве 460 мг смешивают и наполняют ими твердые желатиновые капсулы. Состав 2. Таблетки, каждая из которых содержит 60 мг активного ингредиента, получают следующим образом. Активный ингредиент, крахмал и целлюлозу пропускают через сито N4 5 меш США и тщательно перемешивают. С образованными порошками, которые затем пропускают через сито N14 меш США,смешивают раствор поливинилпирролидона. Полученные таким образом гранулы сушат при 50 С и пропускают через сито N18 меш США. Натрийкарбоксиметилированный крахмал, стеарат магния и тальк,предварительно пропущенные через сито N60 меш США, добавляют затем к гранулам, которые после смешивания прессуют на таблетирующей машине с получением таблеток, каждая из которых весит 150 мг. С точки зрения данного аспекта изобретение предусматривает фармацевтическую композицию, содержащую ингибитор серинпротеазы в соответствии с изобретением вместе по меньшей мере с одним фармацевтически приемлемым носителем или экципиентом. Фармацевтическая композиция может также необязательно содержать по меньшей мере одно дополнительное противотромботическое и/или тромболитическое средство. С точки зрения дополнительного аспекта изобретение предусматривает применение ингибитора серинпротеазы в соответствии с изобретением для производства лекарственного средства, предназначенного для использования в способе лечения человека или животного (например, млекопитающего, птиц или рептилий) для устранения (т.е. лечения или профилактики) состояния, восприимчивого к указанному ингибитору (например, такого состояния, как тромботическое заболевание, восприимчивое к ингибитору фактора Ха), при этом данный способ включает введение человеку или животному эффективного количества ингибитора серинпротеазы в соответствии с изобретением. Доза ингибирующего соединения изобретения будет зависеть от природы и тяжести заболевания,подвергаемого лечению, способа введения лекарственного средства, массы тела и специфических особенностей больного. Однако обычно лекарственное средство вводят в количестве от 0,01 до 100 мкмоль/кг массы тела. Все приведенные в данном описании публикации включены в него в качестве ссылки. Далее изобретение будет дополнительно описано со ссылкой на следующие неограничивающие примеры. Экспериментальная часть Использованные сокращения соответствуют номенклатуре IUPAC-IUB. В описании используются следующие сокращения: водн. (водный), экв. ([молярный] эквивалент), Воc (третичный бутилоксикарбонил), СМА (хлороформ: метанол, концентрированный гидроксид аммония 80:18:2), DCC (1,3 дициклогексилкарбодиимид), DCM (дихлорметан), DEPC (диэтилцианофосфонат), DIPEA (диизопропилэтиламин), DMEA (диметилэтиламин), ДМФ (диметилформамид), ДМСО (диметилсульфоксид, пердейтерированный, если для ЯМР), EDCI (гидрохлорид (1-(3-диметиламинопропил)-3-этилкарбодиимида),EtOAc (этилацетат), EtOH (этанол), HATU ([О-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилуронийгексафторфосфат), HOAt (1-гидрокси-7-азабензотриазол), HOEt (1-гидроксибензстриазол), ВЭЖХ (высокоэффективная жидкостная хроматография), IS-MS (масс-спектр ионного распыления), ОФ-ВЭЖХ (высокоэффективная жидкостная хроматография с обращенной фазой), SCX (сильная катионообменная смола), TFA (трифторуксусная кислота), ТГФ (тетрагидрофуран), ТСХ (тонкослойная хроматография с Rf в качестве относительной подвижности), ДСК (дифференциальная сканирующая калориметрия), ТГА(термический гравиметрический анализ). Все концентрации растворов выражены в об.%/об.%, если не указано иначе. Реагенты получали из различных коммерческих источников. ИК означает, что снимали инфракрасный спектр. 1 Н ЯМР, ЯМР, 1 Н-ЯМР или 1 Н ЯМР означают, что снимали спектр протонного магнитного резонанса. Анализ ВЭЖХ (методы A-D)(Метод А) Колонка Vydac C18 (4,6250 мм), элюирование при линейном градиенте от 90/10 до 50/50(Метод В) Колонка Waters Symmetry, C18 (4,6250 мм). Система для элюирования имела линейный градиент от 95:5 (0,2% TFA в Н 2 О/0,2% TFA в CH3CN) до 5:95 (0,2% TFA в Н 2 О/0,2% TFA в CH3CN), в- 16005943 течение 20 мин с последующим элюированием 0,2% TFA в CH3CN в течение 15 мин. Объемный расход составлял 1 мл/мин. Детектирование в УФ осуществляли при 254 нм, если не указано иначе.(Метод С) Градиентная система Shimadzu, снабженная автоматическим пробоотборником, детектор с изменяемой длиной волны при объемном расходе 0,4 мл/мин. Элюент А состоял из водного TFA (0,1%) и элюент В: 90% MeCN в водном TFA (0,1%) при градиенте элюирования (0 мин 20% В, затем от 20% до 100% в течение 15 мин); колонка Luna C18 (2,1150 мм, размер частиц 5 мкм).(Метод D) Колонка Microsorb-MV C18 (4,6250 мм). Система для элюирования имела линейный градиент от 90:10 (2,5% TFA в Н 2 О):(2,5% TFA в ацетонитриле) до 10:90 (2,5% TFA в Н 2 О):(2,5% TFA в ацетонитриле) в течение 25 мин при 30 С и объемном расходе 1 мл/мин. Детектирование в УФ осуществляли при 254 нм, если не указано иначе.API-MS (масс-спектр химической ионизации при атмосферном давлении) снимали на PESciex API 150EX с нагретым распылителем и азотом в качестве газа-реагента в форме положительного иона.CI-MS (масс-спектр химической ионизации) получали на масс-спектрометре прямого ввода Shimadzu 5000 с использованием в способе химической ионизации в качестве газа-реагента метана.MALDI-TOF, Лазерная десорбционная ионизация на матрице - масс-спектометрии с определением времени пролета, время удержания RT."D-" или "R-" в названии продукта в данном описании указывает, что продукт был получен, начиная с использования хирального исходного соединения, например, D-фенилглицина. Получение исходных соединений и промежуточных соединений Промежуточные замещенные соединения глицина для исходных соединений и промежуточных соединений, включая такие соединения в которых аминогруппа и/или карбоксильная группа является защищенной, могут быть подходяще получены с использованием одной из указанных ниже методик или подобной методикой. Может быть удобным или предпочтительным изменение порядка стадий при получении соединения изобретения и использование подобной методики с другим промежуточным соединением. В особенности может быть подходящим при получении предпочтительное использование в самом начале ацильной группы R2-CO- по сравнению с аминозащитной группой. Сокращения, кроме вышеперечисленных в данном описании, включают: TEMPO: 2,2,6,6 тетраметил-1-пиперидинилокси, свободный радикал; (DHQD)2PHAL: простой 1,4-фталазиндииловый диэфир гидрохинидина; к.д. или кд: круглодонный; РРh3: трифенилфосфин; Вос 2O или ангидрид Воc: дитрет.-бутилдикарбонат. Получение промежуточных соединений КЕ-1-КЕ-5 Следующие соединения получали в соответствии с указанным методом (Метод КЕ-А) из указанных исходных соединений, если не описано иначе. Промежуточное соединение КЕ-1. Этилоксохинолин-8-илацетат. Метод КЕ-А. К перемешиваемому раствору 8-бромхинолина (10,1 г, 48,5 ммоль) в ТГФ (500 мл) при -7 С добавляли по каплям 1,3 М раствор втор-бутиллития (37,3 мл, 4 8,5 ммоль) в циклогексане. Через 5 мин добавляли диэтилоксалат (8 мл, 58,3 ммоль) и раствору давали возможность медленно нагреваться в течение ночи до комнатной температуры. На следующее утро реакционную смесь гасили добавлением насыщенного водного раствора NH4C1 и в вакууме удаляли растворитель. Остаток распределяли между этилацетатом и насыщенным водным раствором NaHCO3; слои разделяли и затем водную фазу промывали насыщенным раствором соли, сушили MgSO4, фильтровали и концентрировали в вакууме. Остаток подвергали хроматографии на силикагеле при элюировании смесью 20% этилацетат/гексан - 25% этилацетат/гексан. Фракции, содержащие продукт, объединяли и концентрировали в вакууме с получением 5,88 г (53%) указанного в заголовке соединения. 1 Н ЯМР IS-MS, m/e 230,1 (М+1). Промежуточное соединение КЕ-2. Этилоксохинолин-5-илацетат. Получали из 5-бромхинолина и диэтилоксалата с использованием метода КЕ-А. 1 Н ЯМР IS-MS, m/e 230,0 (М+1). Промежуточное соединение КЕ-3. Этилоксотиазол-5-илацетат. В круглодонную колбу (500 см 3), снабженную спиртовым термометром, мембранной крышкой и капельной воронкой, в атмосфере азота добавляли при перемешивании безводный диэтиловый эфир (100 см 3). Колбу охлаждали до -78 С и добавляли 2 М н-бутиллитий (60 см 3, 120 ммоль). Затем через капельную воронку в течение 30 мин добавляли раствор силилтиазола (16 г, 16 см 3, 100 ммоль) в безводном диэтиловом эфире (100 см 3). Смесь перемешивали в течение 1 ч, в результате получали суспензию персикового цвета. К суспензии быстро добавляли диэтилоксалат (16,3 см 3, 17,5 г, 120 ммоль) с получением коричневого раствора, в результате температура поднялась до -30 С. Раствору давали возможность опять охладиться до -78 С и перемешивали в течение 30 мин. Реакционную смесь контролировали 1H ЯМР (CDCl3). Коричневый раствор вливали при энергичном перемешивании в течение 30 мин в 5%-ный раствор хлористо-водородной кислоты (300 см 3). Эфирный слой отделяли и промывали насыщенным раствором- 17005943 бикарбоната (приблизительно 80 см 3), сушили над сульфатом магния и концентрировали в вакууме с получением оранжевого масла. Масло очищали флэш-хроматографией (смесь 10% этилацетат/гексан) с получением желтого масла (7,31 г, 39,47 ммоль) [выход 40%]. с - синглет, т - триплет, д - дублет, дд - двойной дублет, шир. - широкий, шир.д - широкий дублет,шир.с -широкий синглет, кв - квартет. 1 Н-ЯМР (CDCl3) 1,42 (3 Н, т), 4,45 (2 Н, кв.), 8,89 (1 Н, с), 9,10 (1 Н, с). Промежуточное соединение КЕ-4. Этилоксотиазол-2-илацетат. Получали из тиазола и диэтилоксалата с использованием метода КЕ-А. В этом случае температуру поддерживали при -35 С и вместо втор-бутиллития в циклогексане использовали н-бутиллитий в гексане. 1H ЯМР IS-MS, m/e 165,0 (М+1). Промежуточное соединение КЕ-5. Этилоксоизохинолин-8-илацетат. Получали из 8-бромизохинолина и диэтилоксалата с использованием метода КЕ-А, при этом вторбутиллитий в циклогексане замещали н-бутиллитием в гексане. 1 Н ЯМР IS-MS, m/e 230,0 (М+1). Анализ С 13 Н 11NО 3: Вычислено: С 68,11; Н 4,84; N 6,11; Найдено: С 68,11; Н 5,00; N 6,14. Получение промежуточных соединений ОХ-1-ОХ-9. Следующие соединения получали в соответствии с указанным методом (метод ОХ-А или метод ОХ-В) из указанных исходных соединений, если не указано иначе. Промежуточное соединение ОХ-1. Этилгидроксиаминопиридин-2-илацетат. Метод ОХ-А. К перемешиваемому раствору этил 2-пиридилацетата (12,6 г, 76,3 ммоль) в уксусной кислоте (19 мл) при 5 С добавляли раствор нитрита натрия (6,05 г, 87,7 ммоль) в воде (12 мл) со скоростью, достаточной для поддержания температуры реакционной массы ниже 15 С. После завершения добавления через 30 мин добавляли еще 30 мл воды. Образовавшийся белый осадок фильтровали, промывали водой,насыщенным водным раствором NаНСО 3 и опять водой. Твердое вещество сушили в вакууме с получением 14,1 г (95%) указанного в заголовке соединения. 1 Н ЯМР IS-MS, m/e 194,9 (М+1). Анализ C9H10N2O3: Вычислено: С 55,67; Н 5,19; N 14,43; Найдено: С 55,79; Н 5,14; N 14,13. Промежуточное соединение ОХ-2. Этилгидроксииминопиридин-3-илацетат. С использованием методики Тикка и др. [Acta Chimica, Hungarica, 114 (3-4), 355] из этил 3 пиридинилацетата и н-бутилнитрита получали смесь этилгидроксииминопиридин-3-илацетата и нбутилгидроксииминопиридин-3-илацетата. 1 Н ЯМР IS-MS, m/e 195 (М+1), 223,1 (М+1). Промежуточное соединение ОХ-3. Этилгидроксииминохинолин-8-илацетат. Метод ОХ-В. К перемешиваемому раствору этилоксохинолин-8-илацетата (5,5 г, 24 ммоль) в этаноле (140 мл) добавляли ацетат натрия (2,16 г, 26,4 ммоль) и затем гидрохлорид гидроксиламина (2,67 г, 38,4 ммоль). Смесь кипятили с обратным холодильником, через 7 ч удаляли нагревательный кожух и раствор перемешивали в течение ночи при комнатной температуре. На следующее утро в вакууме удаляли растворитель и остаток распределяли между этилацетатом и насыщенным водным раствором NаНСО 3. Слои разделяли и органическую фазу промывали насыщенным раствором соли, сушили Na2SO4, фильтровали и концентрировали в вакууме. Образовавшуюся пену перекристаллизовывали из смеси дихлорметан/гексан с получением первой порции, состоящей из 2,5 г указанного в заголовке соединения в виде не совсем белого твердого вещества, и затем второй порции массой 0,31 г. Затем маточный раствор концентрировали в вакууме, остаток растворяли в минимальном количестве дихлорметана. После этого раствор подвергали хроматографии на силикагеле с использованием в качестве элюента смеси 30% этилацетат/гексан и затем смеси 40% этилацетат/гексан и, наконец, этилацетата. Фракции, содержащие продукт,объединяли и концентрировали в вакууме с получением 1,94 г указанного в заголовке соединения, общий выход которого составлял 4,75 г (81%). 1 Н ЯМР IS-MS, m/e 245,0 (М+1). Промежуточное соединение ОХ-4. Этилгидроксииминохинолин-5-илацетат. Получали из этилоксохинолин-5-илацетата с использованием метода ОХ-В. 1 Н ЯМР IS-MS, m/е 245,0 (М+1). Промежуточное соединение OX-5. Этилгидроксииминотиазол-5-илацетат. В круглодонную колбу (500 см 3) при перемешивании добавляли к этанолу (приблизительно 180 3 см ) этилоксотиазол-5-илацетат (6,30 г, 34,02 ммоль). Затем добавляли ацетат натрия (3,06 г, 37,30 ммоль) и гидрохлорид гидроксиламина (3,78 г, 54,43 ммоль) с получением не совсем белой суспензии.- 18005943 Сyспензию кипятили с обратным холодильником при 85 С в течение 1 ч. Реакционную смесь контролировали ТСХ (смесь 60% гексан/этилацетат; r.f.исходного соединения 0,5, r.f. продукта 0,3). Реакционную смесь охлаждали и концентрировали в вакууме. Продукт переносили в этилацетат (приблизительно 200 см 3) и промывали 5%-ным раствором хлористоводородной кислоты. Этилацетатный слой сушили над сульфатом магния и выпаривали досуха с получением твердого вещества кремового цвета (6,372 г,31,825 ммоль) [выход 94%]. 1 Н-ЯМР (CDCl3) 1,40 (3 Н, м), 4,40 (2 Н, м), 8,06 (1/3H, с), 8,78 (1/3H, с), 8,95 (2/3 Н, с), 8,98 (2/3 Н, с). Промежуточное соединение ОХ-6. Этил -оксиминотиазол-4-ацетат. В двугорлую круглодонную колбу (100 см 3) со спиртовым термометром добавляли концентрированную серную кислоту (25 см 3) и охлаждали при перемешивании до 0 С. К полученному раствору добавляли этил -оксимино-2-аминотиазол-4-ацетат (5,00 г, 23,231 ммоль). Затем добавляли воду (10 см 3) и охлаждали до -10 С. После этого в течение одного часа медленно добавляли раствор нитрита натрия(1,683 г, 24, 393 ммоль) в воде (5 см"5), поддерживая температуру ниже -5 С. В отдельную круглодонную колбу (500 см 3) добавляли воду (180 см 3) и охлаждали до 3 С. Реакционный раствор вливали при перемешивании в холодную воду и затем охлаждали до -5 С. К полученному раствору в течение 10 мин при поддержании температуры при -5 С добавляли по каплям 50%-ную фосфорноватую кислоту (90 см 3). Раствору давали возможность нагреться до комнатной температуры и он перемешивался в течение ночи. Продукт экстрагировали диэтиловым эфиром (приблизительно 3150 см 3) и промывали водой. Эфирный слой концентрировали в вакууме и подвергали флэш-хроматографии(смесь 50% этилацетат/н-гексан) с получением при концентрировании в вакууме оранжевого масла (0,60 г, 3,00 ммоль) [выход 13%]. 1 Н-ЯМР (CDCl3) 1,35 (3 Н, м), 4,35 (2 Н, м), 8,4 (1 Н, с), 8,9 (1 Н, с), 14,4 (1 Н, с). Промежуточное соединение ОХ-7. Этил -оксимино-2-метилтиазол-4-ацетат. Указанное в заголовке соединение (0,64 г) получали из этилхлороксиминоацетоацетата (1,44 г) с использованием метода Hatanaka et al. (Journal of Medicinal Chemistry, 1973, 16(9), 978-984). 1 Н-ЯМР (CDCl3) 1,35 (3 Н, т), 2,7 (3H, c), 4,35 (2H, кв), 8,2 (1H, c). Этил -хлороксиминоацетоацетат. Указанное в заголовке соединение (1,44 г) получали из этилоксиминоацетоацетата (1,73 г) с использованием метода Hatanaka et al. (Journal of Medicinal Chemistry, 1973, 16(9), 978-984). 1H-ЯMP (CDC13) 1,25 (3 Н, т), 4,3 (2H, кв), 4,55 (2H, с), 9,45 (1H, с), содержит по данным ЯМР 20% исходного соединения. Этил оксиминоацетоацетат. Указанное в заголовке соединение (12,4 5 г) получали из этилацетоацетата (10,00 г) с использованием метода Фишера (Organic Synthesis Coll. Vol.3, 513-516). 1H-ЯMP (CDCl3) 1,25 (3 Н, т), 2,35 (3 Н, с), 4,3 (2 Н, кв), 8,8 (1 Н, шир.). Промежуточное соединение ОХ-8. Этилгидроксииминотиазол-2-илацетат. Получали из этилоксотиазол-2-илацетата с использованием метода ОХ-В. 1 Н ЯМР IS-MS, m/e 198,9 (М-1). Промежуточное соединение ОХ-9. Этилгидроксиминоизохинолин-8-илацетат. Получали из этилоксоизохинолин-8-илацетата с использованием метода ОХ-В. 1 Н ЯМР. IS-MS, m/e 245,0 (М+1). Анализ C13H12N2O3: Вычислено: С 63,93; Н 4,95; N 11,47; Найдено: С 63,68; Н 4,60; N 11,34. Получение промежуточных соединений AL-1-AL-3. Следующие соединения получали в соответствии с указанным методом (метод AL-A или метод ALB) из указанных исходных соединений, если не описано иначе. Промежуточное соединение AL-1. R-3-Бром-(1-трет-бутоксикарбониламино-2-гидроксиэтил)бензол. Метод AL-A. Гидроксид натрия (3,33 г, 83,25 ммоль) растворяли в воде (220 мл) и 20 мл полученного раствора отбирали и добавляли к осмату калия (410 мг, 1,11 ммоль). Оставшийся раствор гидроксида натрия (200 мл) добавляли к перемешиваемому раствору трет-бутилкарбамата (9,9 г, 84,5 ммоль) в н-пропаноле (110 мл), после чего добавляли свежеполученный трет-бутилгипохлорит (9,65 мл, 83,5 ммоль). После перемешивания в течение 5 мин раствор охлаждали до 0 С. Добавляли раствор (DHQD)2PHAL (1,30 г, 1,67 ммоль) в н-пропаноле (110 мл), затем раствор 3-бромстирола (5 г, 27,31 ммоль) в н-пропаноле (220 мл) и после этого добавляли по каплям раствор осмата калия/гидроксида натрия. Реакционную смесь перемешивали в течение ночи. Добавляли насыщенный водный раствор сульфита натрия (150 мл) и реакционную смесь перемешивали в течение 15 мин. Водный слой отделяли и экстрагировали этилацетатом(3x200 мл). Объединенные органические слои промывали насыщенным раствором соли и сушили надMgSO4. В результате удаления растворителя в вакууме получали неочищенный продукт, который очищали хроматографией (силикагель, смесь гексан: этилацетат 3:2, затем осуществляли повторную хрома- 19005943 тографию с использованием толуола, градиентное элюирование гексаном - смесью гексан:этилацетат 4:1) с получением указанного в заголовке продукта (4,18 г, 49%). Температура плавления=90-91 С. 1 Н ЯМР (CDCl3). Промежуточное соединение AL-2. R-3-Метоксикарбонил-(1-трет-бутоксикарбониламино-2 гидроксиэтил)бензол. Метод AL-B. В стеклянный стакан, содержащий стержень для перемешивания, помещали Pd(OAc)2 (871 мг, 3,88 ммоль), РРh3 (1,96 г, 7,47 ммоль), NaOAc (1,48 г, 18,04 ммоль) и ДМФ (82 мл). К указанному перемешиваемому раствору добавляли раствор R-3-бром-(1-трет-бутоксикарбониламино-2-гидроксиэтил)бензола(4,27 г, 13,5 ммоль) в МеОН (82 мл). Полученный раствор продували азотом и помещали в автоклав с мешалкой. Систему, находящуюся под давлением СО 4,1 бар (60 фунтов/дюйм 2), нагревали при 95 С в течение 36 ч. Смесь охлаждали до комнатной температуры, фильтровали через диатомовую землю и распределяли между этилацетатом и водой. Органический слой промывали водой (3 х) и насыщенным раствором соли (1 х) и сушили над MgSO4. В результате удаления растворителя в вакууме получали неочищенный продукт, который очищали хроматографией (силикагель, градиентное элюирование смесью 3035% этилацетат/гексан) с получением указанного в заголовке продукта (3,53 г, 89%). Температура плавления = 73-75 С с разложением. 1 Н ЯМР (CDCl3).API-MS, m/e=240 (M-C4H9+1). Промежуточное соединение AL-3. R-3-Циано-(1-трет-бутоксикарбониламино-2-гидроксиэтил)бензол. Получали из 3-цианостирола с использованием метода AL-A. 3-цианостирол получали по указанному ниже методу. Температура плавления=76 С. 1H ЯМР (CDCl3). Получение 3-цианостирола. К перемешиваемой суспензии метилтрифенилфосфонийбромида (75 г, 209,71 ммоль) в сухом ТГФ(750 мл) при 0 С в атмосфере азота добавляли по каплям H-BuLi (83 мл, 2,5 М в гексане, 207,50 ммоль). Смесь нагревали до комнатной температуры. Добавляли 5 порциями 3-цианобензальдегид (25 г, 190,65 ммоль) в виде твердого вещества и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь гасили в воде и в вакууме удаляли растворитель. Остаток растворяли в минимальном количестве ТГФ и с использованием эфира осаждали трифенилфосфиноксид. Твердое вещество фильтровали через диатомовую землю и фильтрат концентрировали. В результате перегонки в трубке с шаровым расширением (Kugelrhor) при 90 С/33 Па (0,25 мм Нg) получали продукт в виде бесцветного маслаH ЯМР (CDCl3). Получение промежуточных соединений РАЕ-1-РАЕ-18. Следующие соединения получали в соответствии с указанным методом (метод РАЕ-А, метод РАЕВ, метод РАЕ-С, метод PAE-D или метод РАЕ-Е) из указанных исходных соединений, если не описано иначе. Промежуточное соединение РАЕ-1. Сложный этиловый эфир Boc-D,L-(2-пиридинил)глицина. Метод РАЕ-А. К раствору этилгидроксииминопиридин-2-ил-ацетата (7,8 г, 40,15 ммоль) в этаноле (175 мл) и ледяной уксусной кислоте (20 мл) добавляли 5% Pd/C и смесь встряхивали в аппарате для гидрирования в атмосфере водорода при давлении 4,1 бар (45 фунтов/дюйм 2) в течение 4 ч. Смесь фильтровали через диатомовую землю и концентрировали в вакууме. Остаток растворяли в смеси ТГФ/Н 2 О (1/1, 240 мл) и обрабатывали ди-трет-бутилдикарбонатом (14,23 г, 65,2 ммоль) и бикарбонатом натрия (21,4 г, 326 ммоль). После перемешивания при комнатной температуре в течение 2 ч раствор концентрировали в вакууме и остаток распределяли между EtOAc и водой. Органическую фазу промывали насыщенным раствором соли, сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали хроматографией на силикагеле с использованием ступенчатого градиента элюента 1020% этилацетата в дихлорметане с получением при этом 8,11 г (72%) указанного в заголовке соединения в виде желтого масла. 1H ЯМР IS-MS, m/e 281,1 (M+l). Промежуточное соединение РАЕ-2. Сложный этиловый эфир Boc-D,L-(3-пиридинил)глицина. Получали из этилгидроксииминопиридин-3-илацетата с использованием метода РАЕ-А. 1 Н ЯМР IS-MS, m/e 281,1 (М+1). Промежуточное соединение РАЕ-3. Сложный этиловый эфир Boc-D,L-(8-хинолинил)глицина. Метод РАЕ-В. К перемешиваемому раствору этилгидроксииминохинолин-8-илацетата (2,4 г, 9,8 ммоль) в 50%-ном- 20005943 водном растворе муравьиной кислоты (50 мл) при 0 С добавляли цинковый порошок (2 г, 31 ммоль). Через 1 мин смесь фильтровали через диатомовую землю и фильтрат загружали на колонку с SCX. После промывания колонки метанолом продукт элюировали смесью дихлорметана и 2N NH3 в метаноле при соотношении компонентов в смеси 3:1. Фракции, содержащие продукт, объединяли и концентрировали в вакууме с получением 2,24 г светло-оранжевого масла (IS-MS, m/e 231,0 (М+1. Масло (2,14 г, 9,3 ммоль) растворяли в ТГФ (40 мл) и к перемешиваемому раствору добавляли триэтиламин (1,4 мл, 10,2 ммоль) и затем ди-трет-бутилдикарбонат (2,1 г, 9,8 ммоль). Через 45 мин в вакууме удаляли растворитель и остаток распределяли между этилацетатом и водой. Затем органическую фазу промывали насыщенным водным раствором NаНСО 3, сушили Na2SO4, фильтровали и концентрировали в вакууме. Остаток растворяли в минимальном объеме дихлорметана и подвергали хроматографии на силикагеле с использованием в качестве элюента 5% этилацетата в гексане. Фракции, содержащие продукт,объединяли и концентрировали с получением 2,5 г (81%) указанного в заголовке соединения. 1 Н ЯМР IS-MS, m/е 331,0 (М+1). Промежуточное соединение РАЕ-4. Сложный этиловый эфир Boc-D,L-(5-хинолинил)глицина. Получали из этилгидроксииминохинолин-5-илацетата с использованием метода РАЕ-В. 1 Н ЯМР IS-MS, m/e 331,0 (М+1). Промежуточное соединение РАЕ-5. Сложный метиловый эфир N-4-метоксибензоил-N-2,4-диметоксибензил-D,L-(2-трифторметилфенил)глицина. Метод РАЕ-С. К 2-трифторметилбензальдегиду (1 г, 5,7 ммоль) при перемешивании добавляли 2,4-диметоксибензиламин (0,86 мл, 5,7 ммоль) и метанол (2 мл). Через 5 мин раствор разбавляли 100 мл толуола и концентрировали в вакууме (дважды). Затем остаток растворяли в безводном метаноле (12 мл) и добавляли 1,1-диметил-2-(метоксикарбонилокси)этилизонитрил [Tetrahedron, 55 (1999) 7411-7420] (0,9 г, 5,7 ммоль) и затем 4-метоксибензойную кислоту (0,87 г, 5,7 ммоль). После перемешивания в течение 72 ч в вакууме удаляли растворитель и остаток подвергали хроматографии на силикагеле с использованием ступенчатого градиента элюента 30% этилацетата в гексане - 50% этилацетата в гексане. Фракции, содержащие продукт, объединяли и концентрировали в вакууме, затем остаток растворяли в этилацетате,промывали насыщенным водным раствором NаНСО 3, сушили Na2SO4, фильтровали и концентрировали с получением 1,7 6 г (48%) густого масла (ЯМР, IS-MS, m/e 633,0 (М+1. Масло (0,5 г, 0,79 ммоль) затем растворяли в толуоле (5 мл) и концентрировали в вакууме (дважды) с получением белой пены. После этого остаток растворяли в ТГФ (3 мл) и добавляли трет-бутоксид калия (0,11 г, 0,95 ммоль). Через 15 мин добавляли 12N НСl (0,079 мл, 0,95 ммоль) и раствору давали возможность стоять в течение ночи в холодильнике. На следующее утро растворитель удаляли и остаток подвергали хроматографии на силикагеле с использованием в качестве элюента 30% этилацетата в гексане. Фракции, содержащие продукт,объединяли и концентрировали с получением 0,32 г (79%) указанного в заголовке соединения.H ЯМР IS-MS, m/e 518,0 (М+1). Промежуточное соединение РАЕ-6. Сложный этиловый эфир Boc-D,L-(5-тиазолил)глицина. В круглодонную колбу (250 см 3) при перемешивании добавляли к тетрагидрофурану (приблизительно 100 см 3) сложный этиловый эфир D,L-(5-тиазолил)глицина (4,60 г, 24,7 ммоль), при этом получали желтый раствор. Затем при перемешивании в течение 1 ч добавляли ангидрид Воc (5,439 г, 24,948 ммоль) и триэтиламин (3,79 см 3, 2,75 г, 27,17 ммоль). Реакционную смесь контролировали ТСХ (смесь 60% гексан/этилацетат, r.f. исходного соединения 0,05, r.f. продукта 0,5). Реакционную смесь концентрировали в вакууме и продукт переносили в этилацетат (приблизительно 150 см 3) , промывали 5%-ным раствором хлористоводородной кислоты (приблизительно 30 см 3) и насыщенным раствором бикарбоната(приблизительно 30 см 3). Этилацетатный слой сушили над сульфатом магния и выпаривали досуха с получением оранжевого масла (7,42 г, 24,70 ммоль) [выход 100%]. 1 Н-ЯМР (CDCl3) 1,30 (3 Н, т), 1,48 (9 Н, с), 4,28 (2 Н, кв), 5,68 (1 Н, шир.), 7,88 (1 Н, с), 8,78 (1 Н, с). Сложный этиловый эфир D,L-(5-тиазолил)глицина В круглодонную колбу (250 см 3) при перемешивании добавляли к этанолу (приблизительно 80 см 3) этиловый эфир 5-тиазолилоксиминоуксусной кислоты (6,37 г, 31,825 ммоль). Затем добавляли 50% раствор муравьиной кислоты (50 см 3) с цинковым порошком (5,10 г, 81,83 ммоль) и смеси давали возможность перемешиваться в течение ночи. Реакционную смесь контролировали ТСХ (смесь 60% гексан/этилацетат; r.f. исходного вещества 0,3, r.f. продукта 0,05). Реакционный раствор фильтровали через диатомовую землю и фильтрат концентрировали в вакууме. Его подщелачивали до рН 9 безводным карбонатом калия и продукт переносили в раствор хлороформа/изопропанола (приблизительно 200 см 3). Раствор промывали насыщенным бикарбонатом (приблизительно 50 см 3), сушили над сульфатом магния и концентрировали в вакууме с получением коричневого масла (4,60 г, 24,70 ммоль) [выход 78%]. 1H-ЯMP (CDCl3) 1,25 (3 Н, т), 1,95 (2 Н, шир.), 4,22 (2 Н, кв), 4,85 (1 Н, с), 7,80 (1 Н, с), 8,70 (1 Н, с). Промежуточное соединение РАЕ-7. Сложный этиловый эфир N-Boc-D,L-(4-тиазолил)глицина. К раствору сложного этилового эфира D,L-(4-тиазолил)глицина (0,460 г, 2,470 ммоль) в тетрагидрофуране (20 см 3) добавляли ди-трет-бутилдикарбонат (0,530 г, 2,470 ммоль) и триэтиламин (0,344 см 3,2,470 ммоль). Смеси давали возможность перемешиваться в течение 1 ч и раствор концентрировали в- 21005943 вакууме. Масло переносили в этилацетат (приблизительно 50 см 3), промывали 0,5%-ным раствором хлористо-водородной кислоты (приблизительно 20 см 3) и насыщенным раствором бикарбоната натрия (приблизительно 20 см 3). Полученное вещество сушили над сульфатом магния и концентрировали в вакууме с получением оранжевого масла (0,709 г, 2,477 ммоль) [выход 100%]. 1H-ЯMP (CDCl3) 1,15 (3 Н, т), 1,35 (9 Н, с), 4,1 (2 Н, м), 5,45 (1 Н, д), 5,75 (1 Н, д), 7,3 (1 Н, д), 8,7 (1 Н,д). Сложный этиловый эфир D,L-(4-тиазолил)глицина. Указанное в заголовке соединение (0,46 г) получали из этилоксиминотиазол-4-ацетата (0,60 г) с использованием метода Hatanaka et al. (Journal of Medicinal Chemistry, 1973, 16(9), 978-984). 1H-ЯMP (CDCl3) 1,25 (3 Н, т), 1,8-2,3 (2H, шир.), 4,1 (2H, м), 4,75 (1H, c), 7,25 (1H, д), 8,7 (1H, д). Промежуточное соединение РАЕ-8. Сложный этиловый эфир N-Boc-D,L-(2-метилтиазол-4 ил)глицина. К раствору сложного этилового эфира D,L-(2-метилтиазол-4-ил)глицина (0,397 г, 1,982 ммоль) в тетрагидрофуране (20 см 3) добавляли ди-трет-бутилдикарбонат (0,475 г, 2,180 ммоль) и триэтиламин(0,304 см 3, 2,180 ммоль). Полученную смесь перемешивали в течение 1 ч и раствор концентрировали в вакууме. Масло переносили в зтилацетат (приблизительно 50 см 3), промывали 0,5%-ным раствором хлористоводородной кислоты (приблизительно 20 см 3) и насыщенным раствором бикарбоната натрия (приблизительно 20 см 3) . Полученное вещество затем сушили над сульфатом магния и концентрировали в вакууме с получением желтого масла (0,654 г, 2,177 ммоль) [выход -100%]. 1 Н-ЯМР (CDCl3) 1,1 (3 Н, с), 1,35 (9 Н, с), 2,6 (3 Н, с), 4,15 (3 Н, м), 5,3 (1 Н, д), 5,7 (1 Н, с), 7,0 (1 Н, с). Сложный этиловый эфир D,L-(2-метилтиазол-4-ил)глицина. Указанное в заголовке соединение (0,40 г) получали из этилоксимино-2-метилтиазол-4-ацетата(0,62 г) с использованием метода Hatanaka et al. (Journal of Medicinal Chemistry, 1973, 16(9), 978-984). 1 Н-ЯМР (CDCl3) 1,15 (3 Н, т), 1,95 (2H, шир.), 2,6 (3 Н, с), 4,15 (2H, м), 4,65 (1 Н, с), 6,95 (1 Н, с). Промежуточное соединение РАЕ-9. Сложный метиловый эфир Boc-R-(4-гидроксифенил)глицина. К перемешиваемой смеси гидрохлорида сложного метилового эфира R-(4-гидроксидфенил)глицина(14 г) и бикарбоната натрия (11,7 г) в ТГФ (150 мл) и воде (50 мл) одной порцией добавляли ди-третбутилдикарбонат (15,9 г). Смесь быстро перемешивали, обеспечивая тщательное перемешивание в течение 4 ч. Добавляли гексан (75 мл) и органический слой отделяли и промывали насыщенным раствором бикарбоната натрия, затем насыщенным раствором соли и затем сушили сульфатом магния. Высушенные вещества отфильтровывали, промывали небольшим количеством ТГФ и выпаривали досуха и после этого высоковакуумным насосом удаляли последние следы ди-трет-бутилдикарбоната. Выход: 19,7 г, 96%. 1 Н ЯМР Гидрохлорид сложного метилового эфира R-(4-гидроксифенил)глицина. В сухую 250 мл трехгорлую круглодонную колбу, снабженную низкотемпературным термометром,одной мембраной для создания азотной защитной среды и другой для введения шприцом тионилхлорида,добавляли R-4-гидроксифенилглицин (12,5 г) и сухой метанол (24 мл). Смесь перемешивали (магнитной мешалкой) и охлаждали до внутренней температуры -20 С с использованием смеси СО 2 (тв.)/ацетон. К охлажденной смеси в течение 10 мин добавляли по каплям с использованием шприца тионилхлорид(внимание: реакция тионилхлорида с метанолом является сильноэкзотермической и скорость добавления должна быть такой, чтобы тионилхлорид эффективно перемешивали в смеси и чтобы температура не превышала -20 С). Сразу после завершения добавления смеси давали возможность нагреваться до комнатной температуры с вечера до утра (16-18 ч). Добавляли безводный диэтиловый эфир (150 мл) и отфильтровывали образовавшийся белый осадок, который промывали небольшим количеством эфира и сушили. Выход: 15,5 г, 95%. 1 Н ЯМР. Промежуточное соединение PAE-10. Гидрохлорид сложного метилового эфира Boc-R-(4-трифторметансульфонилоксифенил)глицина. К перемешиваемому раствору сложного метилового эфира Вос-R-(4-гидроксифенил)глицина (19 г) в дихлорметане (400 мл) добавляли 2,6-лутидин (9,44 мл) и 4-диметиламинопиридин (1,65 г) и смесь охлаждали на бане со льдом. В течение 5 мин добавляли трифторметансульфоновый ангидрид (13,74 мл) и затем реакционной смеси давали возможность нагреться до комнатной температуры в течение 4 ч. Органический раствор промывали водой (2150 мл), 1N HCl (2150 мл) и затем насыщенным раствором бикарбоната натрия (150 мл). Органическую часть сушили сульфатом магния и затем выпаривали до образования масла. Смесь очищали флэш-хроматографией (SiO2 250 г, с использованием в качестве элюента смеси гексан/дихлорметан 1:1 и затем чистого дихлорметана). Затем фракции чистого продукта объединяли и выпаривали, полностью удаляли высоковакуумным насосом следы растворителя, при этом получали белое твердое вещество, 19 г, 77%. 1 Н ЯМР. Промежуточное соединение РАЕ-11. Сложный метиловый эфир Boc-R-(4-метоксикарбонилфенил) глицина.- 22005943 Метод PAE-D. В автоклав Парра со стеклянным вкладышем помещали сложный метиловый эфир Boc-R-4 трифторметансульфонилоксифенилглицина (15 г), метанол (32,6 мл), бис-1,3-дифенилфосфинилпропан(448 мг), ацетат палладия (II) (255 мг), триэтиламин (10,2 мл) и диметилформамид (72 мл). В реакторе создавали давление 0,68 бар (10 фунтов/дюйм 2), при этом выделялся газ (повторяли пять раз для удаления из системы всего присутствующего кислорода). Затем осторожно вводили газообразный монооксид углерода (соблюдать крайнюю осторожность: в газовом цилиндрическом реакторе создается давление гораздо выше давления разрыва предохранительной мембраны реактора Парра, в идеале следует использовать регулятор давления для уменьшения давления от 6,8 бар (100 фунтов/дюйм 2) до 1,4 бар (20 фунтов/дюйм 2) и выпускали три раза (к воздухозаборнику вытяжной вентиляции). Затем добавляли монооксид углерода до создания давления 6,8 бар (100 фунтов/дюйм 2) и включали мешалку. Реактор медленно нагревали до температуры внутри аппарата 65 С и затем осуществляли перемешивание при 65 С в течение ночи. (На ранних стадиях добавляли большее количество монооксида углерода для поддержания давления 6,8 бар, 100 фунтов/дюйм 2). Через 18 ч полученную пробу удаляли и исследовали ТСХ. После этого реакционную смесь охлаждали до 30 С, при этом выделялся газ и реактор пять раз промывали,как и прежде, азотом. Реакционную смесь распределяли между этилацетатом и водой и органический слой промывали 1 М хлористо-водородной кислотой и затем насыщенным раствором бикарбоната натрия. Раствор сушили MgSO4 и выпаривали. В результате флэш-хроматографии полученного масла получали продукт, который очищали ТСХ, 10,6 г, 90%. 1H ЯМР. Промежуточное соединение РАЕ-12. Сложный метиловый эфир Boc-R-(4-бензилоксикарбонилфенил)глицина. Получали из сложного метилового эфира Boc-R-4-трифторметансульфонилоксифенилглицина и бензилового спирта с использованием метода PAE-D. 1 Н ЯМР. Промежуточное соединение РАЕ-13. Сложный метиловый эфир Boc-R-(4-карбоксифенилглицина). Сложный метиловый эфир Boc-R-(4-бензилоксикарбонилфенил) глицина (500 мг) растворяли в ТГФ, содержащем Pd/C 10% (100 мг) и гидрировали при 1 атм в течение 2 ч. В результате удаления катализатора фильтрацией и выпаривания растворителя получали сложный метиловый эфир Boc-R-(4 карбоксифенил)глицина (330 мг, 87%). 1H ЯМР. Промежуточное соединение РАЕ-14. Сложный метиловый эфир Boc-R-(4-карбоксамидофенил) глицина. Метод РАЕ-E. К раствору сложного метилового эфира Boc-R-(4-карбоксифенил) глицина (3,5 г) в ДМФ (30 мл) добавляли EDCI (2,60 г, 1,36 ммоль) и HOBt (1,4 г, 10,4 ммоль), смесь перемешивали в течение 10 мин перед охлаждением на бане со льдом и в течение 5 мин барботировали газообразный аммиак. Смесь перемешивали в течение 2 ч при комнатной температуре и затем разбавляли этилацетатом и промывали водой. Водный раствор экстрагировали небольшим количеством этилацетата и объединенную органическую часть промывали насыщенным раствором соли. Органический раствор выпаривали до образования масла, которое очищали флэш-хроматографией, (SiO2, смесь дихлорметан/этилацетат 0-25%) с получением сложного метилового эфира Boc-R-(4-карбоксамидофенил)глицина (1,7 г, 48%). 1H ЯМР. Промежуточное соединение РАЕ-15. Сложный метиловый эфир Boc-R-(4-метилкарбоксамидофенил)глицина. Получали из сложного метилового эфира Boc-R-(4-карбоксифенил)глицина и метиламина с использованием метода РАЕ-Е. 1 Н ЯМР. Промежуточное соединение РАЕ-16. Сложный метиловый эфир N-4-метоксибензоил-N-2,4 диметоксибензил-D,L-(хинолин-4-ил)глицина. Получали из хинолин-4-карбоксальдегида с использованием метода РАЕ-С. 1 Н ЯМР. Промежуточное соединение РАЕ-17. Этил Вос-Р,L-тиазол-2-илглицин. Получали из этилгидроксииминотиазол-2-илацетата с использованием метода РАЕ-В. В данном случае реакцию осуществляли с использованием Zn/муравьиной кислоты в течение 15 мин. 1 Н ЯМР IS-MS, m/e 287,0 (М+1). Промежуточное соединение РАЕ-18. Этил Вос-Р,L-изохинолин-8-илглицин. Получали из этилгидроксииминоизохинолин-8-илацетата с использованием метода РАЕ-В. В данном случае осуществляли реакцию в течение 30 мин с использованием Zn/муравьиной кислоты, последующее концентрирование и распределение остатка между смесью хлороформ/изопропанол 3/1 и насыщенным водным раствором NaHCO3. Защиту группой Воc осуществляли, как указано выше. Очистку осуществляли хроматографией на силикагеле (Biotage Quad System) с использованием в качестве элюента 10% этилацетата в метиленхлориде. Н ЯМР IS-MS, m/e 331,0 (М+1). Анализ C18H22N2O4: Вычислено: С 65,44; Н 6,71; N 8,48; Найдено: С 65,05; Н 6,67; N 8,49. Получение промежуточных соединений РАА-1-РАА-28. Следующие соединения получали в соответствии с указанным методом (метод РАА-А, метод РААВ, метод РАА-С, метод PAA-D или метод PAA-F) из указанных исходных соединений, если не указано иначе. Промежуточное соединение РАА-1. Boc-D,L-(2-хлорфенил)глицин. Метод РAA-A. 2-Хлорбензальдегид (20 ммоль, 2,252 мл) и 2,4-диметоксибензиламин (20 ммоль, 3,004 мл) добавляли вместе и перемешивали в течение 2 ч. Добавляли DCM (5 мл) и отделяли и удаляли воду. Добавляли трет-бутилизонитрил (20 ммоль, 2,262 мл) и перемешивали в течение 10 мин, затем добавляли уксусную кислоту (20 ммоль, 1,145 мл). Перемешивание продолжали в течение 3 дней. Затем реакционную смесь обрабатывали TFA (30 мл) и триэтилсиланом (5 мл). Через 3 ч смесь выпаривали досуха, добавляли 6 М НСl (100 мл) и образовавшуюся смесь кипятили с обратным холодильником при 130 С и интенсивном перемешивании. Смеси давали возможность охладиться и экстрагировали EtOAc (50 мл 2); водную фракцию выпаривали досуха и обрабатывали 2 М раствором NaOH. Смесь экстрагировали EtOAc (50 мл 2), к водной фракции добавляли избыток ангидрида Воc (5,2 г) в диоксане (20 мл) и перемешивали всю ночь. Смесь экстрагировали диэтиловым эфиром (100 мл 2), подкисляли до рН 1 (конц. НС 1) и экстрагировали EtOAc (50 мл 2). Объединенные органические фракции промывали водой и выпаривали досуха в высоком вакууме. Получали продукт Вос-2-хлорфенилглицин (4,252 г, 74,5%). 1 Н-ЯМР (CD3CN/D2O) 7,3 (4 Н, м), 5,5 (1 Н, С), 1,3 (9 Н, с). MS 286 (М+1). Промежуточное соединение РАА-1'(R)-Бензилоксикарбонил-(2-хлорфенил)глицин. Получали из 2-хлорстирола с использованием метода Шарплесса (Sharpless) et al. J.A. C.S. (1998),Vol.120, N6, 1207-1217. Промежуточное соединение РАА-1, альтернативное получение. Boc-D,L-(2-хлорфенил)глицин. Получали из 2-хлорбензальдегида с использованием метода PAA-F. В данном случае при добавлении 2-хлорбензальдегида температуру реакции не контролировали и реакционную смесь перемешивали в течение 2 ч. Осуществляли экстракцию промежуточного аминонитрила этиловым эфиром вместо этилацетата и затем дополнительную очистку добавлением газообразного НСl к эфирным экстрактам и последующую декантацию маточного раствора с выделением полутвердой гидрохлоридной соли. Осуществляли защиту аминокислоты группой Воc при температуре от 0 С до комнатной температуры в течение 1 ч и конечную экстракцию с использованием этилацетата вместо этилового эфира. 1 Н ЯМР IS-MS, m/e 284 (М-1). Промежуточное соединение РАА-2. Boc-D,L-(3-фторфенил)глицин. Получали из 3-фторбензальдегида с использованием метода РАА-А. 1 Н-ЯМР (CD3CN/D2O) 7,3 (1 Н, м), 7,1 (3 Н, м), 5,2 (1 Н, с), 1,3 (9 Н, с). MS 270 (М+1). Промежуточное соединение РАА-3. Boc-D,L-(4-фторфенил)глицин. Получали из 4-фторбензальдегида с использованием метода РАА-А. 1 Н-ЯМР (CD3CN/D2O) 7,3 (2 Н, м), 6,9 (2 Н, м) , 5,0 (1 Н, с), 1,3 (9 Н, с). MS 270 (М+1). Промежуточное соединение РАА-4. Boc-D,L-(2-метилфенил)глицин. Получали из 2-метилбензальдегида с использованием метода РАА-А. 1 Н-ЯМР (CD3CN/D2O) 7,3 (4 Н, м), 5,5 (1 Н, с), 2,5 (3 Н, с), 1,3 (9 Н, с). MS 266 (М+1). Промежуточное соединение РАА-5. Boc-D,L-(3-тиенил)глицин. Получали из 3-тиофенкарбоксальдегида с использованием метода РАА-А. 1H-ЯМР (CD3CN/D2O) 7,5 (2 Н, м), 7,1 (1 Н, д), 5,3 (1 Н, с), 1,3 (9 Н, с). MS 258 (М+1). Промежуточное соединение РАА-6. Boc-D,L-(2-фторфенил)глицин. Получали обработкой Р,L-2-фторфенилглицина (Aldrich) ангидридом Воc (1,1 экв.) и 2 М NaOH (1 экв.) в этаноле. После указанной выше водной обработки получали защищенную аминокислоту. 1 Н ЯМР. Промежуточное соединение РАА-7. Boc-P,L-(2-метоксифенил)глицин. Получали из 2-метоксибензальдегида с использованием метода РАА-А. 1 Н ЯМР. Промежуточное соединение РАА-7, альтернативное получение. Boc-D,L-(2-метоксифенил)глицин. Получали из 2-метоксибензальдегида с использованием метода PAA-F. В данном случае реакционную смесь охлаждали до 0 С перед добавлением 2-метоксибензальдегида и затем перемешивали при комнатной температуре всю ночь. Осуществляли экстракцию промежуточного аминонитрила диэтиловым эфиром вместо этилацетата, дополнительную очистку добавлением 1 М НСl в диэтиловом эфире и последующую фильтрацию кристаллической гидрохлоридной соли. Осуществляли защиту аминокислоты группой Воc при температуре от 0 С до комнатной температуры в течение 3 ч и конечную экстрак- 24005943 цию с использованием дихлорметана вместо диэтилового эфира. 1 Н ЯМР IS-MS, m/е 280,1 (М-1). Анализ C14H19NO5: Вычислено: С 59,78; Н 6,81; N 4,98; Найдено: С 59,68; Н 6,78; N 4,95. Промежуточное соединение РАА-8. Boc-D,L-(2-трифторметил)фенилглицин. Получали из 2-трифторметилбензальдегида с использованием метода РАА-А. 1 Н ЯМР. Промежуточное соединение РАА-8, альтернативное получение. Boc-D,L-(2-трифторметилфенил) глицин. Получали из 2-трифторметилбензальдегида с использованием метода PAA-F. В данном случае при добавлении 2-трифторметилбензальдегида температуру реакции не контролировали и реакционную смесь перемешивали в течение 2 ч. Осуществляли экстракцию промежуточного аминонитрила диэтиловым эфиром вместо этилацетата, дополнительную очистку добавлением газообразного НСl к эфирным экстрактам и последующую декантацию маточного раствора с выделением полутвердой гидрохлоридной соли. Осуществляли защиту аминокислоты группой Воc при температуре от 0 С до комнатной температуры в течение 1 ч и конечную экстракцию с использованием этилацетата вместо диэтилового эфира. 1H ЯМR IS-MS, m/e 318 (М-1). Промежуточное соединение РАА-9. Вос-D,L-(8-хинолин)глицин. Метод РАА-В. К перемешиваемому раствору сложного этилового эфира Вос-D,L-(8-хинолинил) глицина (2,29 г, 6,93 ммоль) в 1,4-диоксане (11 мл) добавляли раствор гидрата LiOH (0,32 г, 7,6 ммоль) в воде. Через 2 ч в вакууме удаляли растворители и остаток растворяли в воде и промывали диэтиловым эфиром. Затем водную фазу подкисляли до рН 3 твердой лимонной кислотой и экстрагировали этилацетатом. После этого органическую фазу промывали насыщенным раствором соли, сушили Na2SO4, фильтровали и концентрировали с получением 2,06 г (98%) указанного в заголовке соединения. 1Boc-D,L-(5-хинолинил)глицин. Получали из сложного этилового эфира Boc-D,L-(5-хинолинил) глицина с использованием метода РАА-В. 1H ЯМР. IS-MS, m/e 303,0 (М+1). Промежуточное соединение РАА-11. Вос-D-(3-бромфенил)глицин. Получали из R-3-брoм-(1-третбутоксикарбониламино-2-гидроксиэтил)бензола с использованием метода РАА-С. Температура плавления=130-132 С с разложением. 1 Н ЯМР (CDCl3). API-MS, m/e=286 (М-СО 2 Н+1). Промежуточное соединение РАА-12. Вос-D-(3-метоксикарбонилфенил)глицин. Метод РАА-С. К перемешиваемому раствору R-3-метоксикарбонил-1-(1-трет.-бутоксикарбониламино-2-гидроксиэтил)бензола (338 мг, 1,14 ммоль) в ацетоне (7,2 мл) добавляли 5% NаНСО 3 (3 мл). Реакционную смесь охлаждали до 0 С. К перемешиваемой суспензии добавляли КВr (14 мг, 0,12 ммоль), TEMPO (181 мг,1,16 ммоль) и по каплям NaOCl (2,81 мл, 5,25%). Через 1 ч при 0 С добавляли TEMPO (136 мг, 0,88 ммоль) и NaOCl (1,09 мл, 5,25%). Реакционную смесь дополнительно перемешивали в течение 0,5 ч при 0 С и добавляли 5% NаНСО 3 (4,3 мл). Реакционной смеси давали возможность нагреваться до комнатной температуры в течение ночи. В вакууме удаляли ацетон и неочищенный продукт распределяли между этилацетатом и водой. Водный слой промывали этилацетатом (2 х) и подкисляли до рН 5 10%-ной лимонной кислотой и экстрагировали этилацетатом (4 х). Объединенные органические экстракты сушили над MgSO4. В результате удаления растворителя в вакууме получали продукт (305 мг, 86%). 1 Н ЯМР API-MS, m/e=254 (М-С 4 Н 9+1). Промежуточное соединение РАА-13. Вос-D-(3-цианофенил)глицин. Получали из R-3-циано-(1-трет-бутоксикарбониламино-2-гидроксиэтил)бензола с использованием метода РАА-С. 1 Н ЯМР (CDCl3). API-MS, m/e=221 (М-С 4 Н 9+1). Промежуточное соединение РАА-14. Вос-D-(3-этансульфониламинофенил)глицин. К перемешиваемому раствору 3-(этансульфониламинофенил) глицина (20 г, 77,43 ммоль) и карбоната натрия (8,2 г, 77,43 ммоль) в смеси ТГФ:вода 3:1 (200 мл) при 0 С добавляли ди-третбутилдикарбонат (18,5 г, 85,17 ммоль). После перемешивания в течение 30 мин удаляли холодную баню и еще через 30 мин при комнатной температуре удаляли растворитель; и остаток распределяли между этилацетатом и водой. Водный слой подкисляли до рН 2 KHSO4 и дважды экстрагировали этилацетатом. Объединенные этилацетатные экстракты промывали водой, сушили Na2SO4, фильтровали и концентрировали в вакууме с получением 17,51 г (63%) белого твердого вещества. 1 Н ЯМР IS-MS, m/e 357,0 (М-1). Промежуточное соединение РАА-15. N-Boc-D,L-(5-тиазолил)глицин. В круглодонную колбу (150 см 3) к этанолу (приблизительно 100 см 3) при перемешивании добавля- 25005943 ли сложный этиловый эфир Boc-D,L-(5-тиазолил)глицина (7,00 г, 24,70 ммоль). Добавляли 2 М раствор гидроксида натрия (25 см 3, 50 ммоль) и обеспечивали возможность перемешивания в течение 1 ч. Реакционную смесь контролировали ТСХ (смесь 60% гексан/этилацетат; r.f. исходного вещества 0,5, r.f. продукта 0). Реакционную смесь концентрировали в вакууме и продукт переносили в насыщенный раствор бикарбоната (приблизительно 50 см 3) и промывали этилацетатом (приблизительно 30 см 3). Водный слой подкисляли до рН 2 концентрированной хлористоводородной кислотой и продукт экстрагировали раствором хлороформ/изопропанол (приблизительно 360 см 3). Органический слой сушили над сульфатом магния и выпаривали досуха с получением оранжевого твердого вещества (4,47 г, 17,30 ммоль) [выход 74%]. 1 Н-ЯМР (CDCl3) 1,35 (9 Н, с), 5,60 (1 Н, д), 5,83 (1 Н, д), 7,88 (1 Н, с), 8,80 (1 Н, с). Промежуточное соединение РАА-16. N-Boc-D,L-(4-тиазолил)глицин. Метод PAA-D. К раствору сложного этилового эфира N-Boc-D,L-(4-тиазолил)глицина (0,700 г,2,470 ммоль) в метаноле (приблизительно 15 см 3) добавляли 2 М гидроксид натрия (2,47 см 3, 4,94 0 ммоль) и смеси давали возможность перемешиваться в течение 90 мин. Раствор концентрировали в вакууме и переносили в воду (приблизительно 20 см 3) . Водный раствор промывали этилацетатом (приблизительно 20 см 3) и затем подкисляли до рН 2 5%-ным раствором хлористо-водородной кислоты (приблизительно 50 см 3). Продукт экстрагировали этилацетатом (приблизительно 330 см 3), сушили над сульфатом магния и концентрировали в вакууме с получением бледно-желтого масла (0,582 г, 2,254 ммоль)[выход 91%]. 1 Н-ЯМР (CDCl3) 1/35 (9 Н, с), 5,5 (1 Н, д) , 5,8 (1 Н, д) , 7,35 (1 Н, д), 8,75 (1 Н, д), 9,8-10,2 (1 Н, шир.). Промежуточное соединение РАА-17. N-Boc-D,L-(2-метилтиазол-4-ил)глицин. Получали из сложного этилового эфира N-Boc-D,L-(2-метилтиазол-4-ил)глицина с использованием метода PAA-D. 1 Н-ЯМР (CDCl3) 1,35 (9 Н, с), 2,6 (3 Н, с), 5,4 (1 Н, д) , 5,9 (1 Н, с), 7,1 (1 Н, с). Промежуточное соединение РАА-18. N-Boc-D,L-(2-бензилоксикарбониламино-4-тиазолил)глицин. Получали из D,L-(2-бензилоксикарбониламино-4-тиазолил)глицина. Бензилоксикарбонильную защитную группу удаляли из тиазолиламиногруппы в подходящий момент времени при получении конечного соединения с использованием традиционного метода, например, такого как нагревание раствора промежуточного соединения в смеси HBr/уксусная кислота при 60 С с последующим выпариванием и традиционным выделением, например, с использованием ионообменной хроматографии с SCX.D,L-(2-бензилоксикарбониламино-4-тиазолил)глицин. Получали методом Hardy, К.; Harrington, F. and Stachulski, A.-J. Chem. Soc. Perkin Trans. I (1984) 1227-1235. Промежуточное соединение РАА-19. Boc-R-(4-метоксикарбонилфенил)глицин. К раствору сложного метилового эфира Boc-R-(4-метоксикарбонилфенил)глицина (692 мг) в ТГФ(10 мл) добавляли раствор гидрата гидроксида лития (90 мг) в воде (7 мл). Смесь сразу же становилась мутной и через 15 мин стала прозрачной. Через 30 мин ТСХ показала, что реакция завершилась. Добавляли этилацетат (20 мл) и воду (20 мл) и отделяли водный слой. Водный раствор подкисляли 2 М хлористо-водородной кислотой и экстрагировали этилацетатом (320 мл). Затем органический раствор промывали водой 2 и насыщенным раствором соли 2, сушили MgSO4 и выпаривали с получением сложного моноэфира (650 мг, 98%), очищенного ТСХ. 1H ЯМР. Промежуточное соединение РАА-20. Boc-R-(4-метоксифенил)глицин. Сложный метиловый эфир Boc-R-(4-гидроксифенил)глицина превращали в Boc-R-4-метоксифенилглицин с использованием метода алкилирования, описанного Basak et al. (Tetrahedron Lett, 1998,39(27), 4883-4886) и затем осуществляли гидролиз сложного метилового эфира гидроксидом лития в водном растворе ТГФ. 1 Н ЯМР. Промежуточное соединение РАА-21. N-4-Метоксибензоил-N-2,4-диметоксибензил-Р,L-(2-трифторметилфенил)глицин. Получали из сложного метилового эфира N-4-метоксибензоил-N-2,4-диметоксибензил-D,L-(2 трифторметилфенил)глицина с использованием метода РАА-В (3 эквивалента гидрата LiOH). 1 Н ЯМР IS-MS, m/e 503,9 (m+1). Промежуточное соединение РАА-22. N-4-метоксибензоил-N-2,4-диметоксибензил-D,L-(тиен-2 ил)глицин. Метод РАА-Е. К раствору 2-тиофенбороновой кислоты (5,0 г, 39,0 ммоль, 1 экв.) в 275 мл метиленхлорида при к.т. добавляли 3,4-диметоксибензиламин (5,89 мл, 39,0 ммоль, 1 экв.) и затем моногидрат глиоксиловой кислоты (3,6 г, 39 ммоль, 1 экв.). Реакционной смеси давали возможность перемешиваться в течение 56 ч при к.т., после чего полученный осадок фильтровали и промывали метиленхлоридом с получением 9,3 г(78%) N-2,4-диметоксибензил-D,L-(тиен-2-ил)глицина в виде не совсем белого твердого вещества.(IS-MS, m/e 308 (m+1. Порцию твердого вещества (5,0 г, 16,3 ммоль, 1 экв.) при к.т. растворяли в ацетоне (20 мл) и 1N растворе гидроксида натрия (20 мл). К полученному раствору одновременно добавляли по каплям анизоилхлорид (2,78 г, 16,3 ммоль, 1 эквив.) в 20 мл ацетона и 2N гидроксид натрия. После перемешивания при к.т. в течение 1 ч реакционную смесь охлаждали до 0 С и подкисляли до рН 2-3. Добавляли диэтиловый эфир и продукт экстрагировали в органическую фазу. Объединенные органические фазы промывали насыщенным раствором соли, сушили над сульфатом натрия, фильтровали и концентрировали с получением 5,1 г (71%) указанного в заголовке соединения в виде белого твердого вещества.IS-MS, m/e 440 (m+1). Промежуточное соединение РАА-23. N-Boc-N-2,4-диметоксибензил-D,L-(тиен-2-ил)глицин. К раствору N-2,4-диметоксибензил-D,L-(тиен-2-ил)глицина (1,0 г, 3,2 ммоль, 1 экв.) в 6 мл ацетона и 6 мл воды при к.т. добавляли триэтиламин (0,97 мл, 7,0 ммоль, 2,1 экв.) и затем 2-(трет.бутоксикарбонилоксиимино)-2-фенилацетонитрил (Boc-ON) (0,76 г, 3,1 ммоль, 0,95 экв.). После перемешивания при к.т. в течение ночи реакционную смесь разбавляли водой и промывали простым эфиром. Затем водную фазу подкисляли 0,5 М лимонной кислотой и продукт экстрагировали в диэтиловый эфир. Объединенные органические фазы промывали насыщенным раствором соли, сушили над сульфатом натрия, фильтровали и концентрировали с получением 0,38 г (29%) указанного в заголовке соединения в виде неочищенного желтого масла.IS-MS, m/e 408 (М+1). Промежуточное соединение РАА-24. Вос-D,L-изохинолин-8-илглицин. Получали из этил Вос-D,L-изохинолин-8-илглицина с использованием метода РАА-В. Продукт осаждали из щелочного водного раствора доведением рН до 3 твердой лимонной кислотой. 1 Н ЯМР IS-MS, m/e 303,0 (М+1). Анализ C16H18N2O40,5 Н 2 О: Вычислено: С 61,73; Н 6,15; N 9,00; Найдено: С 61,62; Н 5,66; N 8,84. Промежуточное соединение РАА-25. Вос-D,L-нафталин-1-илглицин. Метод PAA-F. Часть А. Гидрохлорид D,L-нафталин-1-илглицина. К раствору цианида натрия (10,0 г, 0,22 ммоль) 640 мл воды добавляли хлорид аммония (11,4 г, 0,22 ммоль) и смесь перемешивали до полного растворения. Затем добавляли раствор 1-нафтальдегида (31,0 г,0,22 ммоль) в 40 мл метанола и полученной смеси давали возможность перемешиваться при комнатной температуре в течение двух дней. После этого добавляли еще 150 мл воды и неочищенный продукт экстрагировали в EtOAc. Объединенные органические слои промывали водой, сушили над Na2SO4, фильтровали и концентрировали с получением неочищенного масла. Неочищенный остаток подвергали хроматографии на силикагеле при элюировании смесью EtOAc: СН 2 Сl2 10:1 с получением 35 г светлокоричневого масла. Данное масло затем растворяли в 250 мл 5N НСl и кипятили с обратным холодильником в течение 9 ч. Реакционной смеси давали возможность охладиться до комнатной температуры и продукту давали возможность кристаллизоваться в течение всей ночи. В результате фильтрования смеси получали 13,6 г (29%) указанного в заголовке соединения в виде светло-коричневых кристаллов. 1 Н ЯМР IS-MS, m/e 201,9 (М+1). Часть В. Вос-D,L-нафталин-1-илглицин. К раствору гидрохлорида D,L-нафталин-1-илглицина (13,6 г, 57,2 ммоль) и 2N раствору гидроксида натрия (57 мл, 115 ммоль) в 120 мл 1,4-диоксана и 60 мл воды добавляли (Вос)2O (15 г, 69 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч, после чего рН раствора доводили до 5 добавлением 1N серной кислоты. Затем продукт экстрагировали в EtOAc и объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали с получением 14 г (81%) указанного в заголовке соединения в виде светло-коричневой пены. 1 Н ЯМР IS-MS, m/e 300,1 (М-1). Промежуточное соединение РАА-26. Boc-D,L-(2-метилтиофенил)глицин. К раствору 2-(метилтио)бензальдегида (15 г, 98,7 ммоль) в 100 мл этанола добавляли карбонат аммония (23,1 г, 296 ммоль) и раствор цианида калия (12 г, 148 ммоль) в 100 мл воды. Реакционную смесь нагревали и перемешивали при 70 С в течение 3 ч, после чего реакционную смесь концентрировали при пониженном давлении. Продукт экстрагировали в этилацетат и объединенные органические фазы промывали насыщенным раствором соли, сушили над Na2SO4, фильтровали и концентрировали. Образовавшийся неочищенный остаток переносили в 70 мл этилацетата и добавляли 70 мл 5N гидроксида натрия. Реакционную смесь кипятили с обратным холодильником в течение трех дней, после чего при пониженном давлении удаляли этилацетат. К водной смеси последовательно добавляли 100 мл диоксана, Вос 2O(42 г, 192 ммоль) и 100 мл 2,5N гидроксида натрия. Затем реакционную смесь кипятили с обратным холодильником в течение 48 ч. После охлаждения до комнатной температуры реакционную смесь разбавляли водой и водную фазу промывали этиловым эфиром. Затем водный слой подкисляли до рН 2 и продукт экстрагировали в этилацетат. Объединенные органические экстракты промывали насыщенным рас- 27005943 твором соли, сушили над MgSO4, фильтровали и концентрировали с получением 21,7 г неочищенного остатка. В результате очистки хроматографией на силикагеле (градиентное элюирование смесью дихлорметан:метанол:уксусная кислота от 97:2:1 до 95:4:1) получали 5,0 г (17%) указанного в заголовке соединения. 1 Н ЯМР ES-MS, m/e 296 (М-1). Промежуточное соединение РАА-27. Boc-D,L-(2-метилсульфонилфенил)глицин. К раствору Boc-D,L-(2-метилтиофенил)глицина (4,5 г, 15,2 ммоль) в 75 мл метанола добавляли раствор оксона (14 г, 23 ммоль) в воде. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, после чего при пониженном давлении удаляли метанол. Продукт экстрагировали в этилацетат и объединенные органические слои промывали насыщенным раствором соли, сушили над MgSO4,фильтровали и концентрировали с получением 4,35 г (87%) указанного в заголовке соединения. 1H ЯМР ES-MS, m/e 230 (М+1-С 5 Н 9 О 2). Промежуточное соединение РАА-28. Boc-D,L-(бензо[b]тиофен-3-ил)глицин. Может быть получен методом Kukolja, S. et al. J.Med. Chem. 1985, 28, 1886-1896. Получение промежуточных соединений А-1 - А-12. Следующие соединения получали в соответствии с указанным методом (метод А-А или метод А-В) из указанных исходных соединений, если не указано иначе. Промежуточное соединение А-1. Гидрохлорид 1-[2-(4-пиридинил)этил]пиперазина. Метод А-А. А. 1-Вос-пиперазин (30 г, 285 ммоль), 4-винилпиридин (40 г, 216 ммоль) и уксусную кислоту (12,9 г, 215 ммоль) смешивали в этаноле (400 мл) и нагревали с обратным холодильником в течение 18 ч. Смесь охлаждали до комнатной температуры и концентрировали в вакууме. Остаток растворяли в воде и этилацетате и нейтрализовали насыщенным раствором NаНСО 3. Слои разделяли. Водный слой экстрагировали этилацетатом. Органические слои объединяли, промывали насыщенным раствором соли, сушили(Na2SO4), фильтровали и концентрировали. Неочищенный продукт очищали хроматографией на SiO2 с получением 1-Вос-4-[2-(4-пиридинил)этил]пиперазина (55,9 г, 87%) в виде не совсем белого твердого вещества. 1H ЯМР (CDCl3) CI-MS, m/e=292 (M+l). В. l-Boc-4-[2-(4-пиридинил)этил]пиперазин (25 г, 85,8 ммоль) растворяли в метаноле (100 мл) и охлаждали до 0 С. Добавляли насыщенный НСl в метаноле (100 мл) и смеси давали возможность нагреваться до комнатной температуры в течение 1 ч. Смесь концентрировали в вакууме и получали гидрохлорид 1-[2-(4-пиридинил)этил]пиперазина (23,8 г, 92%) в виде белого твердого вещества. 1 Н ЯМР (CD3OD) CI-MS, m/e=192 (M+l). Альтернативно 1-Вос-4-[2-(4-пиридинил)этил]пиперазин (1,0 г, 3,43 ммоль) растворяли в этиловом эфире. Добавляли этилацетат (15 мл), насыщенный НСl и смесь перемешивали в течение 30 мин при комнатной температуре. Смесь концентрировали в вакууме и получали гидрохлорид 1-[2-(4 пиридинил)этил]пиперазина (900 мг, 87%) в виде рыжевато-коричневого твердого вещества. 1 Н ЯМР (CD3OD) CI-MS, m/e=192 (M+l). Промежуточное соединение А-2. 1-[2-(2-Пиридинил)этил]пиперазин. Получали из Вос-пиперазина и 2-винилпиридина с использованием метода А-А. 1 Н ЯМР (CD3OD) CI-MS, m/e=192 (M+l). Промежуточное соединение А-3. 1-[2-(2-Пиразинил)этил]пиперазин. Получали из Вос-пиперазина и 2-винилпиразина с использованием метода А-А. 1H ЯМР (CD3OD) API-MS, m/e=193 (M+1). Промежуточное соединение А-5. 1-[2-(3-Пиридинил)этил]пиперазин. Метод А-В. К раствору борана ТГФ (2,0 М в ТГФ, 39,5 мл, 78,6 ммоль) в ТГФ (200 мл) при 0 С добавляли 1 Вос-4-[(3-пиридинил)ацетил]пиперазин (8,0 г, 26,2 ммоль). Смесь кипятили с обратным холодильником в течение 8 ч и охлаждали до комнатной температуры. Избыток борана гасили метанолом и 3N НСl. Смесь перемешивали в течение 3 ч при комнатной температуре и в вакууме удаляли растворители. Неочищенный продукт очищали хроматографией (SiO2, СН 2 Сl2:СМА 4:1) с получением 1-[2-(3-пиридинил) этил]пиперазина (2,82 г, 36%) в виде светло-желтого масла. 1 Н ЯМР (CD3OD) API-MS, m/e=192 (M+1). Промежуточное соединение А-6. 1-[2-(4-Имидазолил)этил]пиперазин. Получали из 1-Вос-4-[(4-имидазолил)ацетил]пиперазина с использованием метода А-В. 1 Н ЯМР IS-MS, m/е=181,2 (М+1). Промежуточное соединение А-7. 1-[2-(1-Имидазолил)этил]пиперазин. Получалм из 1-Boc-4-[(1-имидазолил)ацетил]пиперазина с использованием метода А-В. Н ЯМР IS-MS, m/e=181,4 (M+1). Промежуточное соединение А-8. 1-[2-(1-Пиразолил)этил]пиперазин. Получали из 1-Вос-4-[(1-пиразолил)ацетилпиперазина с использованием метода А-В. 1 Н ЯМР IS-MS, m/e=181,4 (М+1). Промежуточное соединение А-9. 1-(2-Тиазол-2-илэтил]пиперазин. А. Раствор Вос 2 О (26 г, 120 ммоль) в метиленхлориде (50 мл) медленно добавляли к раствору этилпиперазин-1-илацетата (20 г, 116 ммоль) в СН 2 С 12 (500 мл). Смесь перемешивали в течение 1 ч при комнатной температуре. В вакууме удаляли растворитель с получением этил 4-Bос-пиперазин-1-илацетата(31,9 г, 100%) в виде белого твердого вещества. 1 Н ЯМР (CDCl3) CI-MS, m/e=273 (M+1).B. Гидрохлорид N-метокси-N-метиламина (4,3 г, 44,1 ммоль) растворяли в метиленхлориде (25 мл). Раствор охлаждали до -78 С и медленно добавляли раствор триметилалюминия (44,1 мл, 44,1 ммоль, 1 М в гептане). Смесь перемешивали при 0 С в течение 30 мин, давали нагреваться до комнатной температуры и перемешивали в течение 30 мин. Затем смесь охлаждали до 0 С и добавляли по каплям раствор этил 4-Вос-пиперазин-1-илацетата (10 г, 36,8 ммоль). Через 15 мин холодную баню удаляли и продолжали перемешивание всю ночь. Смесь разбавляли этилацетатом и водой. Слои разделяли и водный слой экстрагировали этилацетатом. Органические слои объединяли, промывали насыщенным раствором соли, сушили (Na2SO4), фильтровали и концентрировали с получением N-метокси-N-метил-4-Вос-пиперазин-1 илацетамида в виде светло-желтого масла (6,02 г, 57%), которое застывало при стоянии. Продукт использовали без дальнейшей очистки. 1 Н ЯМР (CDCl3) CI-MS, m/e=288 (M+l).C. К раствору 2-бромтиазола (2,0 г, 12,2 ммоль) в диэтиловом эфире (50 мл) при -78 С медленно добавляли н-бутиллитий (1 М в гексане, 12,2 мл, 12,2 ммоль). Смесь перемешивали при -78 С в течение 1 ч. Затем медленно добавляли раствор N-метокси-N-метил-4-Вос-пиперазин-1-илацетамида (3,0 г, 10,4 ммоль) в тетрагидрофуране. Смеси давали возможность медленно нагреваться до -20 С и перемешивали в течение 4 ч. Затем смесь последовательно разбавляли водой и этилацетатом. Водный слой экстрагировали этилацетатом и органические слои объединяли, промывали насыщенным раствором соли, сушили(Na2SO4), фильтровали и концентрировали. Неочищенный продукт очищали хроматографией (SiO2,CH2C12:CMA 20:1-6:1) с получением 1-Вос-4-(2-оксо-2-тиазол-2-илэтил)пиперазина (2,2 г, 68%) в виде бесцветного масла. 1 Н ЯМР (CDC13) CI-MS, m/e=312 (M+1).D. 1-Boc-4-(2-оксо-2-тиазол-2-илэтил)пиперазин (5,0 г, 16,1 ммоль) растворяли в метаноле (25 мл). К полученному раствору добавляли сульфат магния (2 г) и затем п-тозилгидразин (3,9 г, 20,2 ммоль). Смесь перемешивали в течение 48 ч, затем ее фильтровали и фильтрат концентрировали в вакууме. Остаток (6,0 г, около 12 ммоль) повторно растворяли в метаноле (120 мл) и добавляли триацетоксиборгидрид натрия (10,1 г, 48 ммоль). Смесь нагревали с обратным холодильником в течение ночи. Смесь охлаждали до 0 С и медленно добавляли концентрированную НСl (15 мл). Смеси давали возможность нагреваться до комнатной температуры и перемешивали в течение 1 ч. Смесь концентрировали до половины объема и помещали на колонку с SCX (30 г, предварительно обработанную 5%-ной уксусной кислотой в метаноле) и промывали метанолом (500 мл) . Продукт элюировали насыщенным раствором гидроксида аммония в метаноле (500 мл) и в вакууме удаляли растворитель. Затем неочищенный продукт очищали хроматографией (SiO2, СН 2 Сl2:СМА 12:1-4:1) с получением 1-(2-тиазол-2-илэтил)пиперазина (1,9 г,57%). 1H ЯМР (CDC13) CI-MS, m/e=198 (M+l). Промежуточное соединение А-10. Гидрохлорид 1-[2-(2-бензилоксикарбониламинотиазол-4-ил) этил]пиперазина. Указанное в заголовке соединение (85%) получали из 1-Вoс-4-[2-(2-бензилоксикарбониламинотиазол-4-ил)ацетил]пиперазина с использованием операций, по существу эквивалентных тем, которые описаны в методе А-В. 1 Н ЯМР (CD3OD) CI-MS, m/e=347 (M+l). Промежуточное соединение А-11. Тригидрохлорид 1-[2-(3-фторпиридин-4-ил)этил]пиперазина. А. В круглодонную колбу загружали н-бутиллитий (1,8 М в гексане, 35 мл, 64,4 ммоль) и разбавляли ТГФ (25 мл). Раствор охлаждали до 0 С и медленно добавляли раствор N,N-диизопропиламина (9,0 мл, 65 ммоль) в ТГФ (25 мл). Смесь перемешивали при 0 С в течение 20 мин и охлаждали до -78 С. Добавляли по каплям раствор 3-фторпиридина (20 г, 206 ммоль) (температуру смеси поддерживали ниже-70 С), что приводило к образованию красного осадка. Смесь перемешивали при -78 С в течение 4 ч. Медленно добавляли этиленоксид (4,бМ в ТГФ, 67,2 мл, 309 ммоль) и смеси давали возможность нагреваться до комнатной температуры в течение всей ночи. Смесь разбавляли водой и СН 2 Сl2. Слои разделяли и водный слой экстрагировали CH2Cl2. Органические слои объединяли, промывали насыщенным раствором соли, сушили (Na2SO4), фильтровали и концентрировали с получением темно-коричневого масла. Остаток очищали хроматографией (SiO2, CH2Cl2:CMA 19:1-6:1) с получением 3-фтор-4-(2 гидроксиэтил)пиридина (6,7 г, 23%) в виде рыжевато-коричневого масла.B. 3-Фтор-4-(2-гидроксиэтил)пиридин (4,0 г, 28,3 ммоль) и триэтиламин (8,3 мл, 60 ммоль) растворяли в СН 2 Сl2 (40 мл) и охлаждали до 0 С. К полученному раствору добавляли по каплям метансульфонилхлорид (2,0 мл, 31,2 ммоль). Смесь перемешивали при 0 С в течение 1 ч. Смесь разбавляли водой и разделяли слои. Водный слой экстрагировали СН 2 Сl2. Органические слои объединяли, промывали насыщенным раствором соли, сушили (Na2SO4), фильтровали и концентрировали в вакууме с получением 3 фтор-4-(2-метансульфонилоксиэтил)пиридина (5,2 г, 83%) в виде масла розового цвета. 1 Н ЯМР (CDCl3) CI-MS, m/e=220 (M+1).Cs2CO3 (7,7 г, 23,7 ммоль) и смесь нагревали до 55 С в течение 18 ч. Смесь охлаждали до комнатной температуры и разбавляли водой и этилацетатом. Слои разделяли и водный слой экстрагировали этилацетатом. Органические слои объединяли, промывали насыщенным раствором соли, сушили (Na2SO4), фильтровали и концентрировали в вакууме с получением раствора продукта и ДМФ. Остаток растворяли в диэтиловом эфире и воде. Слои разделяли и водный слой экстрагировали диэтиловым эфиром. Органические слои объединяли, промывали насыщенным раствором соли, сушили (Na2SO4), фильтровали и концентрировали в вакууме. Неочищенный продукт очищали хроматографией (SiO2, СН 2 Сl2:СМА 15:1-6:1) с получением 1-Вос-4-[2-3-фторпиридин-4-ил)этил]пиперазина (6,2 г, 84%). 1 Н ЯМР (CDCl3) CI-MS, m/e=310 (M+1).D. 1-Boc-4-[2-(3-фторпиридин-4-ил)этил]пиперазин (6,0 г, 19,4 ммоль) растворяли в метаноле (20 мл) и анизоле (6 мл). К полученному раствору добавляли концентрированную хлористо-водородную кислоту (15 мл) и смесь перемешивали в течение 1 ч. В вакууме удаляли растворитель, при этом получали желтое твердое вещество. Остаток суспендировали в диэтиловом эфире и обрабатывали ультразвуком в течение 1 ч. Продукт извлекали вакуумной фильтрацией и твердое вещество сушили в вакууме, при этом получали тригидрохлорид 1-[2-(3-фторпиридин-4-ил)этил]пиперазина (5,2 г, 84%) в виде не совсем белого твердого вещества. 1H ЯМР (CD3OD) CI-MS, m/e=210 (C11H16FN3+1). Промежуточное соединение А-12. 1-[2-(2-цианопиридин-4-ил)этил]пиперазин. А. К суспензии LiAlH4 (9,2 г, 242 ммоль) в диэтиловом эфире (600 мл) добавляли этил 4 пиридилацетат (20 г, 121 ммоль). Для способствования перемешиванию добавляли диатомовую землю(около 50 мл). Смесь перемешивали всю ночь. Смесь охлаждали до 0 С и добавляли водный растворNaOH (15%) до прекращения выделения газа. Смесь перемешивали в течение 1 ч. Твердое вещество удаляли фильтрацией и фильтрат концентрировали в вакууме. Неочищенный продукт очищали хроматографией (SiO2, СН 2 Сl2.метанол 40:1-20:1) с получением 4-(2-гидроксиэтил)пиридина (8,1 г, 54%) в виде янтарной жидкости. 1 Н ЯМР (CDCl3) CI-MS, m/e=124 (M+1).CH2Cl2 (100 мл) и охлаждали до -78 С. К полученному раствору добавляли трет-бутилдиметилсилилхлорид (11,0 г, 66 ммоль). Смеси давали возможность нагреваться до комнатной температуры в течение ночи. Смесь непосредственно помещали на слой SiCO2 и элюировали смесью СН 2 Сl2:метанол 100:0-10:1 с получением 4-[2-(трет-бутилдиметилсилилокси)этил]пиридина (15,3 г, 97%). 1 Н ЯМР (CDCl3) CI-MS, m/e=238 (M+1).C. 4-[2-(трет-бутилдиметилсилилокси)этил]пиридин (15,2 г, 64 ммоль) растворяли в СН 2 Сl2 (200 мл). К полученному раствору добавляли м-хлорпербензойную кислоту и раствор перемешивали при комнатной температуре в течение 72 ч. Раствор промывали водным раствором NaOH (1M) и слои разделяли. Водный слой экстрагировали CH2Cl2. Органические слои объединяли, сушили (K2 СО 3), фильтровали и концентрировали в вакууме с получением 4-[2-(трет-бутилдиметилсилилокси)этил]пиридин-Nоксида (13,4 г, 83%). 1D. 4-[2-(трет-Бутилдиметилсилилокси)этил]пиридин-N-оксид (13,4 г, 52,9 ммоль) растворяли в триэтиламине (14,8 мл, 105 ммоль). Добавляли триметилсилилцианид (28,4 мл, 212 ммоль) и смесь нагревали до 90 С в течение 3 ч. Смеси давали возможность охладиться до комнатной температуры и оставляли на ночь. Смесь распределяли между водой и СН 2 Сl2. Слои разделяли и водный слой экстрагировали СН 2 Сl2. Органические слои объединяли, промывали водой и насыщенным раствором соли, сушили(K2 СО 3), фильтровали и концентрировали с получением темного масла (14 г). Остаток очищали хроматографией (SiO2, СН 2 Сl2:этилацетат 40:1) с получением 4-[2-(трет-бутилдиметилсилилокси)этил]-2 цианопиридина (12,8 г, 92%) в виде желтого масла. 1 Н ЯМР CI-MS, m/e=263 (M+1).E. В круглодонную колбу загружали 4-[2-(трет-бутилдиметилсилилокси)этил]-2-цианопиридин(12,8 г, 48,8 ммоль) и раствор тетрабутиламмонийфторида (1 М в ТГФ, 73 мл, 73 ммоль) и смесь перемешивали при комнатной температуре всю ночь. Смесь разбавляли водой и этилацетатом. Слои разделяли и водный слой экстрагировали этилацетатом. Органические слои объединяли, промывали водой и насы- 30
МПК / Метки
МПК: C07D 295/18, A61P 29/00, A61K 31/496
Метки: ингибиторы, серинпротеазы
Код ссылки
<a href="https://eas.patents.su/30-5943-ingibitory-serinproteazy.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы серинпротеазы</a>
Предыдущий патент: Способ визуальной индикации вскрытия узкогорлой тары и укупорочное устройство для его осуществления
Следующий патент: Фибринолитически активный полипептид
Случайный патент: Дроссельный вентиль