2-фенил-1-[4-(2-аминоэтокси)бензил]индол в комбинации с эстрогенами
Формула / Реферат
1. Фармацевтическая композиция, содержащая один или несколько эстрогенов и соединение, имеющее структуру
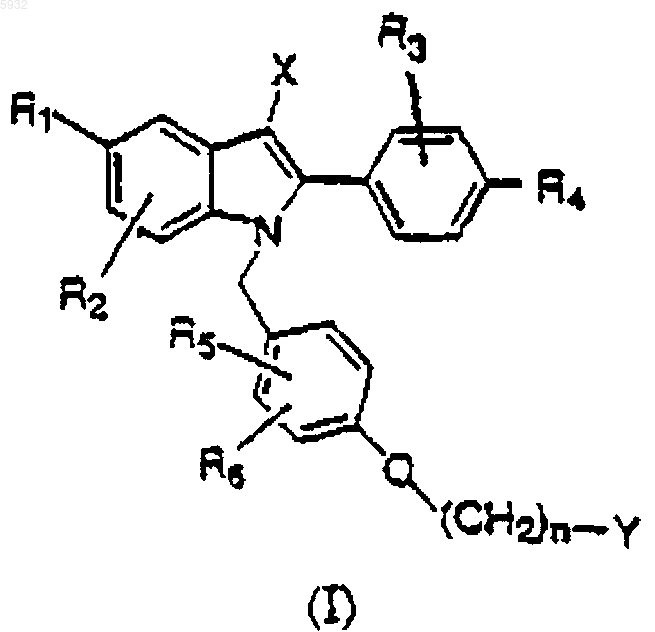
где R1 представляет OH;
R2, R3, R5 и R6 представляют H;
R4 представляет OH;
X представляет C1-C6алкил;
n равно 2 или 3;
Y представляет фрагмент
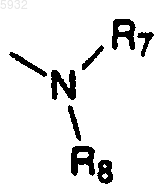
где R7 и R8 соединены вместе в виде -(CH2)p-, где p обозначает целое число от 2 до 6, с образованием кольца;
или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или эксципиент.
2. Фармацевтическая композиция по п.1, содержащая соединение,
где X представляет CH3;
Y обозначает фрагмент
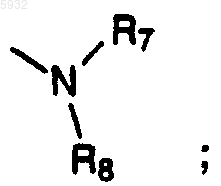
и R7 и R8 соединены вместе в виде -(CH2)r, где r обозначает целое число от 4 до 6, с образованием кольца;
или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или эксципиент.
3. Фармацевтическая композиция по п.1, в которой соединение представляет собой 1-[4-(2-азепан-1-ил-этокси)бензил]-2-(4-гидроксифенил)-3-метил-1H-индол-5-ол или его фармацевтически приемлемую соль.
4. Фармацевтическая композиция по любому из пп.1-3, в которой один или несколько эстрогенов выбраны из эквиилина, эквииленина, эстрадиена, этинилэстрадиола, 17b-эстрадиола, 17альфа-дигидроэквииленина, 17b-дигидроэквииленина, менстранола, конъюгированных эстрогенов, эстрона, 17альфа-эстрадиолсульфата, дельта-8,9-дигидроэстрона, эквиола или энтеролактона или их фармацевтически приемлемых соли или сложного эфира.
5. Фармацевтическая композиция по п.4, в которой фармацевтически приемлемой солью одного или нескольких эстрогенов является натриевая соль.
6. Способ лечения или предупреждения разрежения кости у млекопитающего, включающий введение млекопитающему, нуждающемуся в таком лечении, эффективного количества эстрогена и эффективного количества соединения, определенного в любом из пп.1-3 или его фармацевтически приемлемой соли.
7. Способ лечения или предупреждения патологических состояний или синдромов, которые вызваны дефицитом эстрогенов или связаны с дефицитом эстрогенов у млекопитающего, включающий введение млекопитающему, нуждающемуся в таком лечении, эффективного количества эстрогена и эффективного количества соединения, определенного в любом из пп.1-3 или его фармацевтически приемлемой соли.
8. Способ лечения или предупреждения сердечно-сосудистого заболевания у млекопитающего, включающий введение млекопитающему, нуждающемуся в таком лечении, эффективного количества эстрогена и эффективного количества соединения, определенного в любом из пп.1-3 или его фармацевтически приемлемой соли.
9. Способ лечения или предупреждения заболевания у млекопитающего, являющегося следствием пролиферации или аномального развития, влияний или роста эндометриальной ткани или подобной ей ткани, включающий введение млекопитающему, нуждающемуся в таком лечении, эффективного количества эстрогена и эффективного количества соединения, определенного в любом из пп.1-3, или его фармацевтически приемлемой соли.
10. Способ лечения по п.9, где указанное заболевание представляет собой эндометриоз.
11. Продукт, содержащий один или несколько эстрогенов и соединение структуры (I), определенное в любом из пп.1-3, в качестве комбинированного препарата для одновременного, раздельного или последовательного применения в лечении или предупреждении сердечно-сосудистого заболевания или заболевания у млекопитающего, которое является следствием пролиферации или аномального развития, влияний или роста эндометриальной ткани или подобной ей ткани, или патологических состояний или синдромов, которые вызваны дефицитом эстрогенов или связаны с дефицитом эстрогенов.
Текст
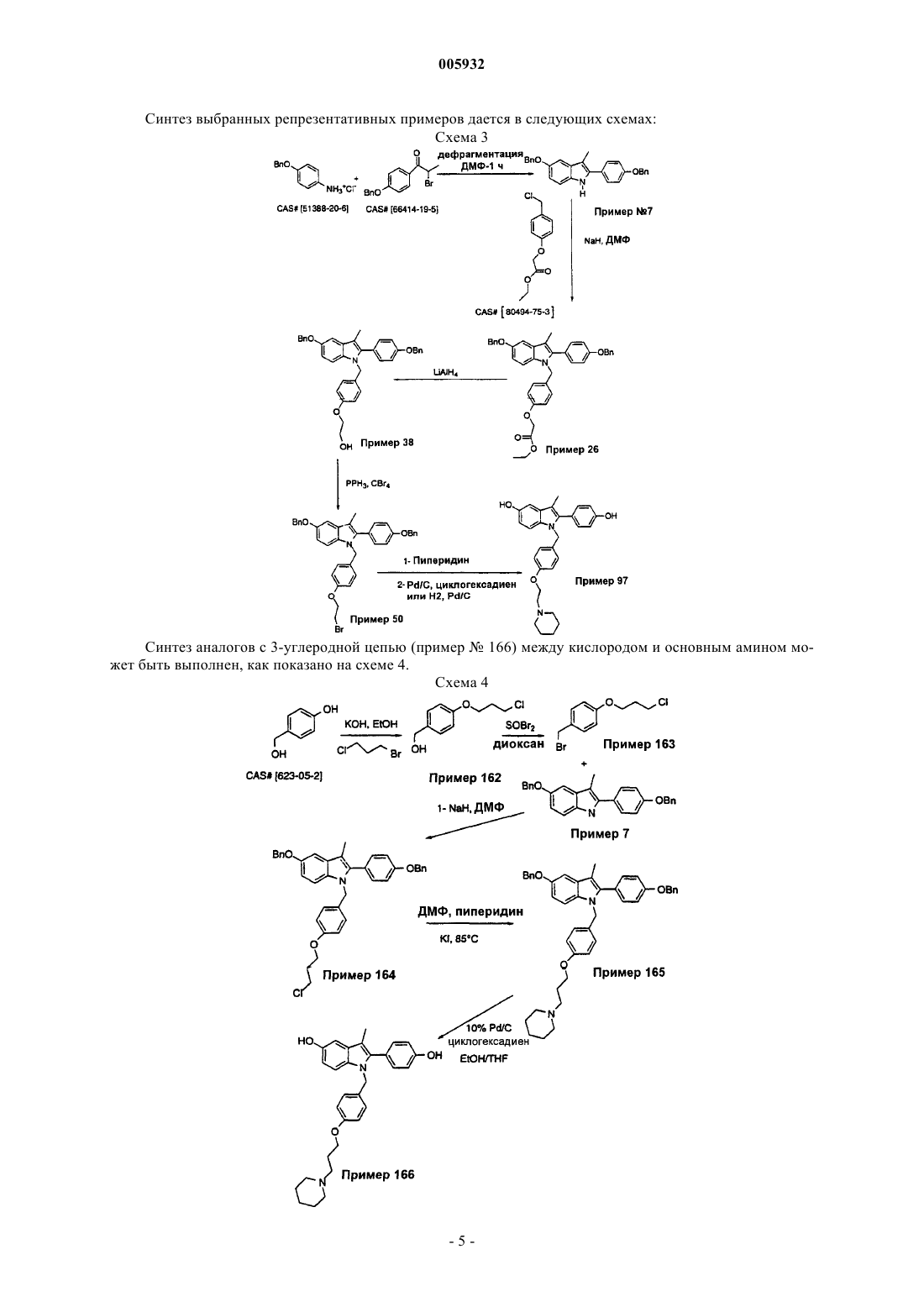
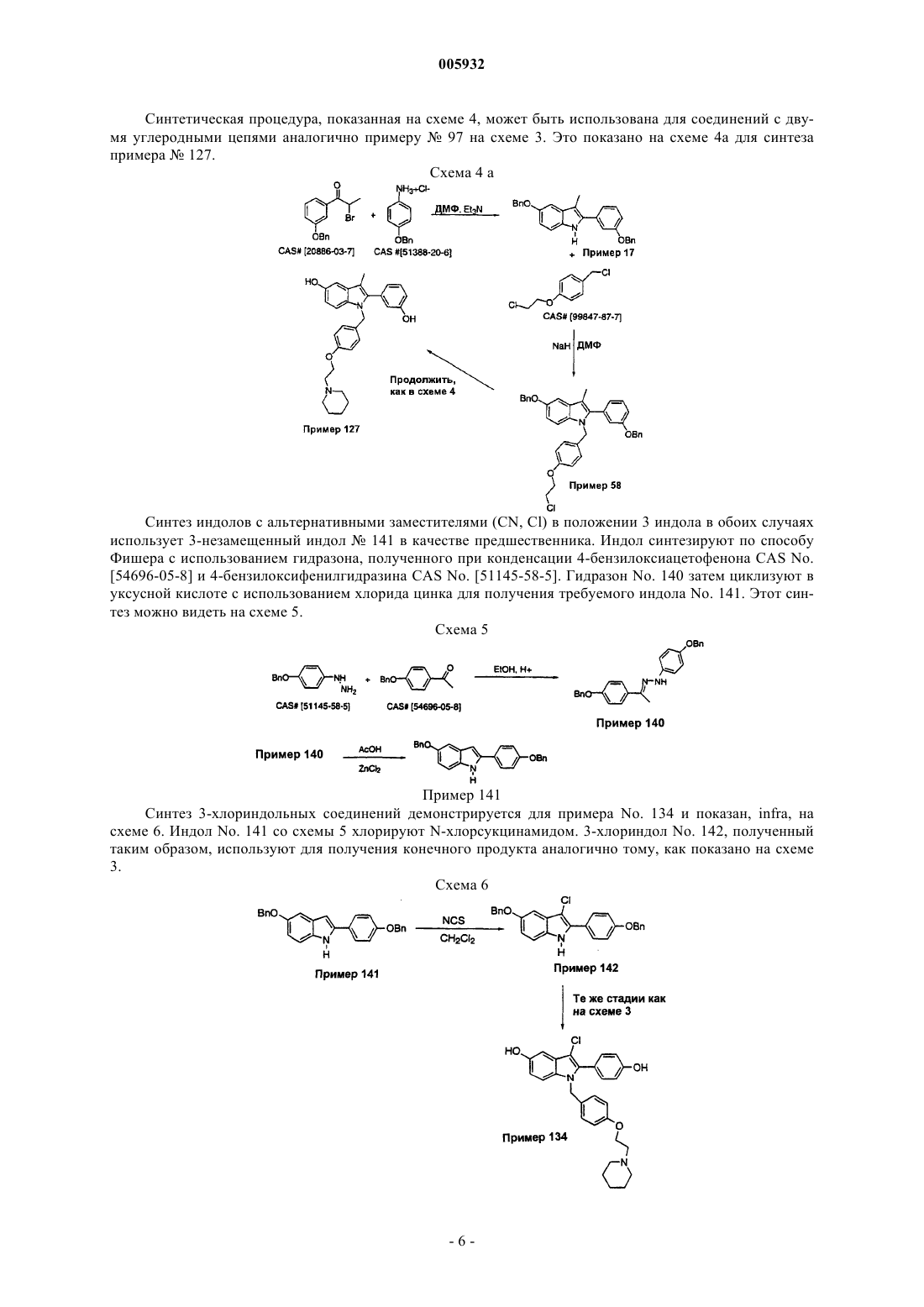
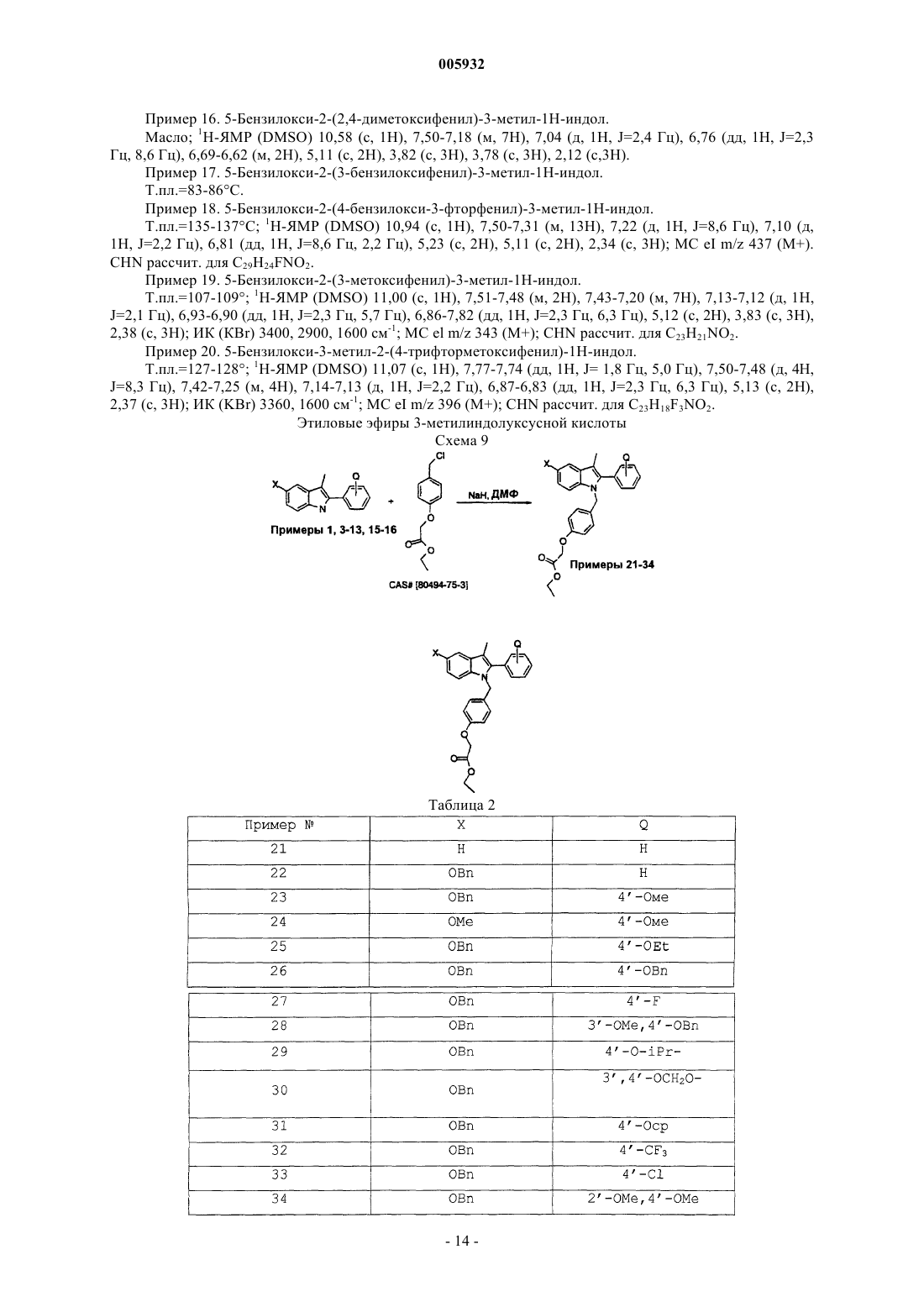
005932 Данное изобретение относится к применению новых соединений 2-фенил-1-[4-(2-аминоэтокси)бензил]индола, которые пригодны в качестве эстрогенных агентов, в комбинации с эстрогенами, а также фармацевтическим композициям и способам, использующим эти соединения. Предпосылки изобретения Имеются хорошие прецеденты применения гормональной заместительной терапии для предотвращения разрежения (рарефикации) кости у постклимактерических женщин. Обычный курс лечения предусматривает восполнение эстрогена с использованием таких композиций, содержащих эстрон, эстриол,этинилэстрадиол, 17-эстрадиол, этерифицированные эстрогены или конъюгированные эстрогены, выделенные из природных источников (т.е. конъюгированные эстрогены Premarin от Wyeth-Ayerst) или синтетические эстрогены. У некоторых пациентов терапия может быть противопоказана вследствие пролиферативных эффектов несдерживаемых эстрогенов (эстрогенов, не предоставляемых в комбинации с прогестинами) на ткани матки. Эта пролиферация связана с увеличенным риском в отношении эндометриоза и/или рака эндометрия. Эффекты несдерживаемых эстрогенов на ткани молочной железы являются менее ясными и вызывают некоторое опасение. Потребность в эстрогенах, которые могут поддерживать щадящее кость действие с минимизацией пролиферативных эффектов в матке и молочной железе, является очевидной. Было показано, что некоторые нестероидные антиэстрогены поддерживают костную массу в модели подвергнутых овариэктомии крыс, а также в клинических испытаниях на человеке. Тамоксифен (продаваемый в виде цитрата тамоксифена под товарным названием Novadex Zeneka Pharmaceuticals, Wilmington, Delaware), например, является ценным паллиативом для лечения рака молочной железы и, как было показано, оказывает действие, подобное действию агониста эстрогена, на кость в случае человека. Однако он является также частичным агонистом в матке, и это является причиной некоторого беспокойства. Было показано, что ралоксифен, бензотиофеновый антиэстроген, стимулирует рост матки у подвергнутой овариэктомии крысы в меньшей степени, чем тамоксифен, сохраняя в то же время способность сохранять кость. Соответствующий обзор тканеселективных эстрогенов можно найти в статье "Tissue-Selective Actions Of Estrogen Analogs", Bone Vol. 17, No. 4, October 1995, 181S-190S. Применение индолов в качестве антагонистов эстрогена сообщалось Von Angerer, Chemical Abstracts, Vol. 99, No. 7 (1983), Abstract No. 53886u. Также см. J. Med. Chem. 1990, 33, 2635-2640; J. Med.Chem. 1987, 30, 131-136. Также см. Ger. Offen., DE 3821148/A1 891228 и WO 96/03375. Эти соединения предшествующего уровня техники имеют общие структурно сходные черты с соединениями данного изобретения, но являются функционально отличающимися. В случае соединений, содержащих основной амин, отсутствует фенильная группа для придания жесткости боковой цепи. В WO А 95/17383 (Karo Bio АВ) описаны индольные антиэстрогены с длинными прямыми цепями. В другом родственном патенте WO A 95/10741 описаны 5-гидроксииндолы с большим диапазоном боковых цепей. В WO 93/23374 (Otsuka Pharmaceutical, Japan) описаны соединения, имеющие структурное сходство с соединениями данного изобретения, за исключением структуры, называемой R3, в формулах I и II, приведенных ниже, которая определена как тиоалкил, и эта ссылка не раскрывает соединения,имеющие цепи у азота индола, имеющие такую же структуру, как структуры, обеспечиваемые данным изобретением. В своей статье Postmenopausal Hormone replacement therapy with estrogen periodically supplementedwith antiestrogens. Am. J. Obstet. Gynecol., Vol. 140, No. 7 1981, pp. 787-792, Kauppila et al. описывают свое исследование постменопаузальной терапии эстрогеном с семинедельными приемами эстрогена с последующими 10-дневными приемами антиэстрогенного цитрата кломифена. Также в своей статье Comparison of Megestrol Acetate and Clomiphene Citrate as Supplemental Medication in Postmenopausal Oestrogen Replacement Therapy, Arch. Gynecol. (1983) 234:49-58, Kauppila et al. описывают комбинаторные терапии эстрогеном постклимактерических женщин со случайным дополнением ацетатом мегестрола или цитратом кломифена. В патенте US 4 894 373 (Young) описано применение антиэстрогенов, в том числе кломифена и его изомеров, цитратов и производных, в отсутствие эстрогена для лечения постклимактерических симптомов и лечения или предупреждения остеопороза. В патенте US 5 552 401 (Cullinan et al.) описаны соединения бензотиофена как применимые для лечения различных медицинских показаний, связанных с постклимактерическим синдромом и фиброидным заболеванием матки, эндометриозом и пролиферацией клеток гладких мышц аорты, причем эти соединения используют в фармацевтических композициях, необязательно содержащих эстроген или прогестин. Патенты US 5 646 137 и 5 591 753 (оба выданы Blacket al.) описывают способы лечения остеопороза композициями арилбензотиофеновых соединений типа ралоксифена в сочетании с прогестином, выбранным из медроксипрогестерона, норетиндрона или норетинодрела или их фармацевтически приемлемых солей. В патенте US 5 550 107 (Labrie) описано изобретение, включающее лечение рака молочной железы или эндометриального рака антиэстрогеном вместе с по меньшей мере одним соединением, выбранным из группы, состоящей из андрогена, прогестина, по меньшей мере одного ингибитора образования половых гормонов, в частности 17-гидроксистероиддегидрогеназной и ароматазной активности, по меньшей мере одного ингибитора секреции пролактина, одного ингибитора секреции гормона роста и одного ингибитора секреции АСТН. В патенте US 5 672(Black et al.) описано применение ароилбензотиофенов и эстрогенов в ингибировании разрежения костей. Описание изобретения Данное изобретение обеспечивает фармацевтические композиции и способы их применения, содержащие соединение формулы (I), приведенной ниже, в сочетании с эстрогенами, предпочтительно в сочетании с одним или несколькими фармацевтически приемлемыми носителями или эксципиентами. Среди применений композиций данного изобретения находится ослабление симптомов постклимактерического синдрома у женщин, в том числе периклимактерических и постклимактерических симптомов. Данные композиции и способы лечения могут быть использованы для минимизации нежелательных побочных эффектов лечения или терапии с использованием эстрогенов и могут быть использованы для минимизации количеств эстрогена (эстрогенов), необходимых для конкретной схемы лечения. Соединения общего типа структуры, показанного в формуле (I), являются агонистами/антагонистами эстрогена и описаны в Европейском патенте ЕР-А-0802183, опубликованном 22 октября 1997 года, содержание которого включено здесь в качестве ссылки. Эти соединения способны противодействовать эффектам 17-эстрадиола, обнаруживая в то же время малую стимуляцию матки при отдельном введении. Данное изобретение включает в сочетании с одним или несколькими эстрогенами использование соединений формулы (I), приведенной ниже где R7 и R8 соединены вместе в виде -(СН 2)p-, где р обозначает целое число от 2 до 6, с образованием кольца,и их фармацевтически приемлемых солей. Более предпочтительные композиции данного изобретения представляют собой композиции, которые содержат, вместе с одним или несколькими фармацевтическими носителями или эксципиетами:a) один или несколько эстрогенов иb) одно или несколько соединений, выбранных из общей структуры I, приведенной выше, где Х представляет СН 3;R7 и R8 соединены вместе в виде -(СН 2)r, где r обозначает целое число от 4 до 6, с образованием кольца; и их фармацевтически приемлемые соли. Кольца, образованные соединенными в виде цепочки R7 и R8, упомянутые выше, могут включать,но не ограничиваются ими, кольца азиридина, азетидина, пирролидина, пиперидина, гексаметиленамина или гептаметиленамина. Наиболее предпочтительным соединением данных композиций является соединение, имеющее структурную формулу I, представляющее собой 1-[4-(2-азепан-1-илэтокси)бензил]-2-(4-гидроксифенил)-3-метил-1 Н-индол-5-ол или его фармацевтически приемлемую соль. Данное изобретение включает сульфаты, сульфаматы и сульфатные сложные эфиры фенольных групп. Сульфаты могут быть легко получены реакцией свободных фенольных соединений с триоксидом серы, скомплексованным с амином, таким как пиридин, триметиламин, триэтиламин и т.д. Сульфаматы-2 005932 могут быть получены обработкой свободного фенольного соединения требуемым амино- или алкиламино-, или диалкиламиносульфамилхлоридом в присутствии подходящего основания, такого как пиридин. Сульфатные сложные эфиры могут быть получены реакцией свободного фенола с требуемым алкансульфонилхлоридом в присутствии подходящего основания, такого как пиридин. Дополнительно данное изобретение включает соединения, содержащие фосфаты при феноле, а также диалкилфосфаты. Фосфаты могут быть получены реакцией данного фенола с подходящим хлорфосфатом. Диалкилфосфаты могут быть гидролизованы с получением свободных фосфатов. Также заявлены фосфинаты, когда данный фенол взаимодействует с требуемым хлорангидридом диалкилфосфиновой кислоты с образованием целевого диалкилфосфината данного фенола. Данное изобретение включает приемлемые формы солей, образованные по реакции присоединения с неорганическими или органическими кислотами. Применимы неорганические кислоты, такие как хлористо-водородная кислота, бромисто-водородная кислота, иодисто-водородная кислота, серная кислота,фосфорная кислота, азотная кислота, а также органические кислоты, такие как уксусная кислота, пропионовая кислота, лимонная кислота, малеиновая кислота, яблочная кислота, винная кислота, фталевая кислота, янтарная кислота, метансульфоновая кислота, толуолсульфоновая кислота, нафталинсульфоновая кислота, камфорсульфоновая кислота, бензолсульфоновая кислота. Известно, что соединения,имеющие основный азот, могут образовывать комплексы со многими различными кислотами (как протонными, так и апротонными), и обычно является предпочтительным введение соединения данного изобретения в форме кислотно-аддитивной соли. Кроме того, данное изобретение включает соли четвертичного аммония описанных в нем соединений. Они могут быть получены реакцией нуклеофильных аминов боковой цепи с подходящим реакционноспособным алкилирующим агентом, таким как алкилгалогенид или бензилгалогенид. Соединения, используемые в данном изобретении, получают по способу, предусматривающему следующее: а) реакцию соединения формулы где n, R1-R6 и Х имеют определенные выше значения и hаl обозначает хлор или бром с соединением формулыHNR7R8 где R7 и R8 имеют определенные выше значения с образованием соответствующего соединения формулы I; или b) реакцию соединения формулы где R1-R4 и Х имеют определенные выше значения в присутствии основания, например NaH, с соединением формулы где n, R5, R6 и Y имеют определенные выше значения и hal обозначает галоген, например Сl или Вr,с образованием соответствующего соединения формулы I; если требуется, защиту любых реакционноспособных групп-заместителей во время каждого описанного выше способа и удаление защиты; и если требуется, превращение присутствующей фенольной группы в фосфат, сульфат, сульфамат или сульфатный сложный эфир; и, кроме того, если требуется, превращение соединения формулы I в фармацевтически приемлемую соль. Способы Соединения данного изобретения могут быть синтезированы в общем виде в соответствии со схемой 1, приведенной ниже. Начальный синтез индола выполняют нагреванием подходящим образом замещенного альфабромкетона (b) с требуемым анилином (а) в ДМФ с получением индола (с). Затем этот продукт алкилируют бензилхлоридом (е) с получением замещенного индола (f). Бензилхлорид (е) может быть легко получен из альдегида (d) в 2 стадии, как показано. Продукт (g) может быть получен из (f) восстановлением сложного эфира, превращением спирта в бромид, замещением бромида требуемым амином в подходящем растворителе, таком как ТГФ или ДМФ, и, наконец, удалением защитных групп, если требуется. Удаление защитных групп является необходимым, когда R1 или R2 или оба являются защищенным фенолом. Предпочтительной защитной группой является бензильная группа, которая может быть легко удалена несколькими общепринятыми способами, в частности гидрогенолизом. Для синтеза соединений с X, являющимся Н, галогеном, трифторметилом, циано, нитро, может быть предпочтительным альтернативный синтез, показанный на схеме 2. Образование галогенов в положении 3 может быть легко осуществлено с помощью таких реагентов, как N-хлорсукцинамид,N-бромсукцинамид или N-иодсукцинамид. Полученное 3-иодиндольное соединение может быть использовано в качестве предшественника для 3-трифторметилсоединения посредством реакции сочетания с использованием палладиевого катализатора и бистрифторметилртути (II). Соединение с цианогруппой в положении 3 может быть получено электрофильным цианированием, или альтернативно положение 3 может быть формилировано (например, солью формилиминия), затем формильную группу превращают в оксим и затем дегидратируют до нитрила. Альтернативно, 3-цианосоединение может быть синтезировано реакцией 3-незамещенного индола с хлорсульфонилизоцианатом и затем триэтиламином. Соединение с нитрогруппой в положении 3 может быть получено обработкой индола нитритом натрия и уксусной кислотой. Специалисту в данной области понятно, что эти способы не являются ограничивающими и доступны и другие пути синтеза. Схема 2-4 005932 Синтез выбранных репрезентативных примеров дается в следующих схемах: Схема 3 Синтез аналогов с 3-углеродной цепью (пример 166) между кислородом и основным амином может быть выполнен, как показано на схеме 4. Схема 4-5 005932 Синтетическая процедура, показанная на схеме 4, может быть использована для соединений с двумя углеродными цепями аналогично примеру 97 на схеме 3. Это показано на схеме 4 а для синтеза примера 127. Схема 4 а Синтез индолов с альтернативными заместителями (CN, Cl) в положении 3 индола в обоих случаях использует 3-незамещенный индол 141 в качестве предшественника. Индол синтезируют по способу Фишера с использованием гидразона, полученного при конденсации 4-бензилоксиацетофенона CAS No.[54696-05-8] и 4-бензилоксифенилгидразина CAS No. [51145-58-5]. Гидразон No. 140 затем циклизуют в уксусной кислоте с использованием хлорида цинка для получения требуемого индола No. 141. Этот синтез можно видеть на схеме 5. Схема 5 Пример 141 Синтез 3-хлориндольных соединений демонстрируется для примера No. 134 и показан, infra, на схеме 6. Индол No. 141 со схемы 5 хлорируют N-хлорсукцинамидом. 3-хлориндол No. 142, полученный таким образом, используют для получения конечного продукта аналогично тому, как показано на схеме 3. Схема 6-6 005932 3-цианоаналоги синтезируют из индола-предшественника No. 141, как показано на схеме 7. Реакция индола-предшественника No. 141 с хлорсульфонилизоцианатом с последующим добавлением триэтиламина дает 3-цианоиндол No. 155. Боковая цепь может быть создана превращением бензилового спиртаCAS No. [111728-87-1] в бензилбромид No. 156 с использованием тионилбромида в ТГФ. Этот индол алкилируют боковой цепью в ДМФ с использованием гидрида натрия с получением промежуточного продукта No. 157. Затем этот продукт может быть превращен в конечный продукт No. 138 аналогично тому, как показано на схеме 4. Схема 7 Соединения формулы (I) являются частичными антагонистами эстрогена и проявляют высокую аффинность в отношении рецептора эстрогена. Однако в противоположность многим эстрогенам эти соединения не вызывают увеличения сырого веса матки. Эти соединения являются антиэстрогенными в матке и могут полностью противодействовать трофическим эффектам антагонистов эстрогена в ткани матки. Эти соединения применимы в лечении и предупреждении патологических состояний или синдромов, которые вызваны или связаны с недостаточностью эстрогенов. Тканеселективность позволяет использовать их для желательной эстрогенной активности в некоторых тканях, таких как кость, с одновременным ограничением этой активности в других тканях, таких как ткань матки. Эстрогены, применимые в композициях данного изобретения, включают эстрон, эстриол, эквиилин,эстрадиен, эквииленин этинилэстрадиол, 17-эстрадиол, 17-дигидроэквииленин, 17-дигидроэквииленин (патент US 2 834 712), 17-дигидроэквиилин, 17-дигидроэквиилин, менстранол и конъюгированные эстрогенные гормоны, такие как гормоны в продуктах Premarin Wyeth-Ayerst Laboratories. Фитоэстрогены, такие как эквол или энтеролактон, могут быть также использованы в композициях и способах данного изобретения. Предпочтительный вариант данного изобретения включает фармацевтические композиции и способы лечения, использующие конъюгированные эстрогенные гормоны, такие как гормоны в продуктахPremarin Wyeth-Ayerst Laboratories, с одним или несколькими соединениями формулы (I), перечисленными здесь. Этерифицированные эстрогены, такие как продаваемые Solvay Pharmaceuticals, Inc. под товарным названием Estratab, могут быть также использованы с композициями данного изобретения. Предпочтительными для применения с данным изобретением являются также соли применимых эстрогенов, наиболее предпочтительно соли натрия. Примерами этих предпочтительных солей являются натрийэстронсульфат, натрийэквиилинсульфат, натрий-17 альфа-дигидроэквиилинсульфат, натрий 17 альфа-эстрадиолсульфат, натрий-дельта-8,9-дигидроэстронсульфат, натрийэквииленинсульфат, натрий-17 бета-дигидроэквиилинсульфат, натрий-17 альфа-дигидроэквииленинсульфат, натрий-17 бетаэстрадиолсульфат, натрий-17 бета-дигидроэквииленинсульфат, эстрон-3-натрийсульфат, эквиилин-3 натрийсульфат, 17 альфа-дигидроэквиилин-3-натрийсульфат, 3 бета-гидроксиэстра-5(10), 7-диен-17-он-3 натрийсульфат, 5 альфа-прегнан-3 бета-20R-диол-20-натрийсульфат, 5 альфа-прегнан-3 бета,16 альфа-диол 20-он-3-натрийсульфат, дельта(8,9)-дегидроэстрон-3-натрийсульфат, эстра-3 бета,17 альфа-диол-3-натрийсульфат, 3 бета-гидроксиэстр-5(10)-ен-17-он-3-натрийсульфат или 5 альфа-прегнан-3 бета,16 альфа, 20Rтриол-3-натрийсульфат. Предпочтительные соли эстрона включают, но не ограничиваются ими, соли натрия и соли пипериновой кислоты (пиператные соли). Соединения данного изобретения формулы (I) являются тканеселективными соединениями, обладающими способностью вести себя подобно агонистам эстрогенов, например, снижая холестерин и пре-7 005932 дотвращая разрежение кости, или подобно антагонистам эстрогенов. Таким образом, эти соединения в композициях данного изобретения применимы для лечения многих болезней, в том числе остеопороза,гипертрофии предстательной железы, бесплодия, рака молочной железы, эндометриальной гиперплазии,эндометриального рака, эндометриоза, кистозной железистой гиперплазии, гиперплазии матки, гиперплазии шейки матки, доброкачественной гиперплазии предстательной железы, сердечно-сосудистого заболевания, контрацепции, болезни Альцгеймера и меланомы. Композиции данного изобретения могут быть также использованы для лечения разрежения кости, являющегося следствием вторичного остеопороза, в том числе разрежения, классифицируемого как эндокринный по природе, в том числе являющегося следствием избытка глюкокортикоидов, гиперпаратиреоза, гипертиреоза, гипогонадизма, гиперпролактинемии и сахарного диабета. Разрежение кости может быть также индуцировано лекарственными средствами, например, разрежение, являющееся следствием лечения гепарином, потребления алкоголя или применения табака, барбитуратов или кортикостероидов. Индуцированное лекарственными средствами разрежение кости может также происходить из лечения гонадотропин высвобождающим гормоном(GnRH или LHRH), или синтетическими антагонистами, или агонистами GnRH, такими как инъекционный препарат ацетата лейпролида, продаваемый ТАР Pharmaceuticals Inc. под товарным названиемLUPRON, или имплантат ацетата госерелина, продаваемый Zeneca Pharmaceuticals под товарным названием Zoladex. Такое разрежение кости может быть также следствием неподвижности индивидуума,хронической почечной недостаточности, синдрома малабсорбции (недостаточности всасывания), болезни печени, хронической обструктивной болезни легких (ХОБЛ), ревматоидного артрита или саркоидоза. Кроме того, эти композиции могут быть использованы для гормональной заместительной терапиии в случае постклимактерических женщин или в других состояниях с недостатком эстрогенов, когда было бы благоприятным пополнение эстрогенов. Симбиотическая активность соединений и эстрогена (эстрогенов) данных способов лечения представляет интерес, в частности, в преодолении нежелательных последствий эстрогенной терапии, таких как внезапное сильное кровотечение и/или избыточная стимуляция эндометрия, которые могут приводить к эндометриальной гиперплазии или эндометриозу. Эти композиции могут быть, следовательно, использованы в способах лечения или предупреждения избыточной эстрогенной стимуляции матки у млекопитающего. Композиции данного изобретения могут быть также использованы в способах лечения разрежения кости, которое может быть следствием нарушения баланса в образовании новых костных тканей и резорбцией (рассасыванием) старых тканей индивидуума, приводящего к общей потере костной ткани. Подобное исчезновение костной ткани происходит в большом диапазоне индивидуумов, в частности, у постклимактерических женщин, женщин, которые были подвергнуты гистерэктомии/удалению матки с придатками, женщин, которые проходят или которые проходили длительную кортикостероидную терапию, женщин, испытывающих дисгенезию гонад, и женщин, страдающих от синдрома Кушинга. Особые потребности в восполнении костной ткани могут быть также удовлетворены с использованием этих композиций у индивидуумов с переломами костей, дефектными костными структурами и пациентов, подвергаемых связанным с костями операциям и/или имплантации протеза. Кроме вышеописанных проблем эти композиции могут быть использованы в лечении остеоартрита, болезни Педжета, остеомаляции, размягчения костей, эндометриального рака, множественной миеломы (болезни Калера) и других форм раковых заболеваний, оказывающих пагубное влияние на ткани костей. Понятно, что способы лечения заболеваний, перечисленных здесь, предусматривают введение индивидууму, нуждающемуся в подобном лечении, фармацевтически эффективного количества одного или нескольких соединений формулы (I) или их фармацевтически приемлемой соли вместе с терапевтически требуемым количеством эстрогена. Данное изобретение включает в себя также фармацевтические композиции, использующие одно или несколько данных соединений и/или их фармацевтически приемлемых солей вместе с одним или несколькими фармацевтически приемлемыми носителями, эксципиентами и т.д. Эстрогены регулируют ряд физиологических процессов. Первичные ткани-мишени для эстрогенов включают половые пути (яичник, матку, влагалище), ткань молочной железы, скелет, сердечнососудистую систему и центральную нервную систему (ЦНС). Уменьшение эстрогенных гормонов в кровотоке приводит к ряду изменений. Происходит прекращение репродуктивной функции с сопутствующими аменореей, атрофией матки и увеличением сухости влагалища (отсутствием кератинизации). Ткань молочной железы становится относительно неактивной. Наблюдается увеличение скорости потери костной массы (2-7%) в сравнении с нормальными 0,5-1,0%/год, что наблюдается у всех индивидуумов после достижения возраста 35 лет. Имеет место изменение профиля липидов с увеличениями липопротеина низкой плотности (LDL) и уменьшениями липопротеина высокой плотности (HDL), обычно измеряемых,и связанный с этим изменением повышенный риск сердечно-сосудистого случаев (сердечного приступа,мозгового удара). Изменения в центральной нервной системе включают в себя увеличение вазомоторных симптомов ("приливов") и потенциальные изменения в познании и памяти. Эстрогенная заместительная терапия (ERT) нормализует некоторые из этих изменений, в частности изменения, связанные с сердечно-сосудистой системой (понижает LDL, увеличивает HDL, снижает риск сердечного приступа), скелетом (поддержание костной массы, снижение риска переломов) и центральной нервной системой (уменьшает частоту и тяжесть "приливов"). Хотя половые пути и отвечают на эту-8 005932 терапию, не все ответные реакции являются положительными. Что касается положительной стороны,уменьшается сухость влагалища. Однако отрицательные ответные реакции матки включают гипертрофию и гиперплазию вместе с подобным менструациям кровотечением. Имеется также действие на молочную железу и существуют данные о корреляции терапии с использованием экзогенных эстрогенов с увеличенным риском рака молочной железы. В настоящее время женщинам с интактной маткой обычно не прописывают только эстрогены, но прописывают эстрогены в комбинации с прогестином для уменьшения стимуляции матки. Хотя риск эндометриального рака уменьшается до уровней контролей, не обработанных гормонами, другие побочные эффекты прогестинов снижают частоту согласия женщин на гормональную заместительную терапию. Тканеселективные эстрогенные (TSE) соединения данного изобретения обеспечивают положительные скелетные и сердечно-сосудистые воздействия, подобные воздействию эстрогенов, без отрицательных эффектов, связанных с маткой и молочной железой. Комбинации TSE и эстрогенов производят положительные эффекты эстрогенов на ЦНС, кости и сердечно-сосудистой системе, причем такая комбинация обеспечивает дополнительные или аддитивные эффекты на костной и сердечно-сосудистой системе. Основной переменной является способность TSE ингибировать эстрогенные влияния на матку и молочную железу, которые являются двумя главными отрицательными эффектами "несдерживаемых" эстрогенов. Понятно, что доза, схема введения и способ введения соединений формулы (I) будут меняться в соответствии с заболеванием и проходящим лечение индивидуумом и будут определяться лечащим врачом. Предпочтительно введение одного или нескольких соединений начинается при низкой дозе, и доза увеличивается до тех пор, пока не достигаются желательные эффекты. Подобным образом, должно быть понятно, что доза (дозы) эстрогена (эстрогенов), используемого в данных композициях, будет выбираться в соответствии с общепринятыми способами. Наиболее предпочтительно эта доза должна быть подвергнута мониторингу для достижения требуемого результата с минимальным необходимым количеством эстрогена (эстрогенов). Эффективное введение соединений формулы (I) может достигаться при дозе от приблизительно 0,01 мг/день до приблизительно 1000 мг/день. Предпочтительным является введение от приблизительно 1 мг/день до приблизительно 600 мг/день в виде одной дозы или в виде двух или более разделенных общих доз. Наиболее предпочтительно, суточная доза находится между приблизительно 1 мг/день и приблизительно 150 мг/день. Такие дозы могут вводиться любым способом, применимым в доставке этих активных соединений реципиенту, в том числе перорально, парентерально (в том числе внутривенной,внтрибрюшинной и подкожной инъекциями, посредством имплантатов и т.д.), интравагинально и трансдермально. Для целей этого описания подразумевается, что трансдермальные введения включают в себя все введения через поверхность тела и внутренние выстилки проходов тела, в том числе эпителиальные ткани и ткани слизистой оболочки. Такие введения могут проводиться с использованием соединений данного изобретения или их фармацевтически приемлемых солей в лосьонах, кремах, пенных составах,пластырях, суспензиях, растворах и суппозиториях (ректальных и вагинальных). Пероральные композиции, содержащие активные соединения формулы (I), могут содержать любые общепринятые пероральные формы, в том числе таблетки, капсулы, трансбуккальные формы, пастилки,лепешки и пероральные жидкости, суспензии или растворы. Капсулы могут содержать смеси активного соединения (активных соединений) с инертными наполнителями и/или разбавителями, такими как фармацевтически приемлемые крахмалы (например, кукурузный, картофельный и маниоковый крахмал),сахара, синтетические подслащивающие агенты, порошкообразные целлюлозы, такие как кристаллическая и микрокристаллическая целлюлоза, мука, желатины, камеди и т.д. Применимые композиции таблеток могут быть приготовлены общепринятыми способами прессования, мокрой грануляции или сухой грануляции и использовать фармацевтически приемлемые разбавители, связывающие агенты, смазывающие агенты, дезинтеграторы, суспендирующие или стаблизирующие агенты, в том числе, но не только, стеарат магния, стеариновую кислоту, тальк, лаурилсульфат натрия, микрокристаллическую целлюлозу, кальцийкарбоксиметилцеллюлозу, поливинилпирролидон, желатин, альгиновую кислоту, аравийскую камедь, ксантановую камедь, цитрат натрия, комплексные силикаты, карбонат кальция, глицин,декстрин, сахарозу, сорбит, дикальцийфосфат, сульфат кальция, лактозу, каолин, маннит, хлорид натрия,тальк, сухие крахмалы и порошкообразный сахар. Пероральные композиции, описанные здесь, могут использовать стандартные композиции с задержанным или пролонгированным временем высвобождения лекарственного средства для изменения абсорбции активного соединения (соединений). Композиции суппозиториев могут быть приготовлены из традиционных материалов, в том числе какао-масла, с добавлением или без добавления восков для изменения точки плавления суппозитория и глицерина. Водорастворимые основы для суппозиториев, такие как полиэтиленгликоли различной молекулярной массы,также могут быть использованы. Должно быть понятно, что эстроген данного изобретения должен вводиться в дозах общепринятой схемы приема лекарственного средства в соответствии с толерантностью к нему реципиента и конкретным планом лечения или поддержания. Соединения формулы (I), приведенные здесь, будут вводиться в-9 005932 количестве, необходимом для проявления агонистического или антагонистического действия в отношении активности эстрогена (эстрогенов) композиции до требуемого уровня. В случае применения конъюгированных эстрогенов, USP, предпочтительно, чтобы суточная доза составляла от 0,1 до 5,0 мг, более предпочтительно между приблизительно 0,3 мг и приблизительно 2,5 мг, наиболее предпочтительно между приблизительно 0,3 мг и приблизительно 1,25 мг/день. Для местранола или этинилэстрадиола суточная доза может быть от приблизительно 1 мкг до приблизительно 0,15 мг/день и доза от приблизительно 1 мкг до приблизительно 0,3 мг/день может быть использована для этинилэстрадиола, предпочтительно между приблизительно 2 мкг и приблизительно 15 мг/день этинилэстрадиола. Соединения данного изобретения могут быть приготовлены в неразбавленном виде или с фармацевтическим носителем для введения, доля которого определяется растворимостью и химической природой данного соединения, выбранным путем введения и стандартной фармакологической практикой. Фармацевтический носитель может быть твердым или жидким. Твердый носитель включает одно или несколько веществ, которые могут также действовать в качестве улучшающих вкус и запах агентов, смазывающих веществ, солюбилизаторов, суспендирующих агентов, наполнителей, скользящих веществ, вспомогательных облегчающих прессование средств, связывающих или дезинтегрирующих таблетку агентов; он может быть также инкапсулирующим материалом. В порошках носитель является тонкоизмельченным твердым веществом, который находится в смеси с тонкоизмельченным активным ингредиентом. В таблетках активный ингредиент смешивают с носителем, имеющим необходимые для прессования свойства, в подходящих соотношениях и прессуют с получением желательной формы и размера. Порошки и таблетки предпочтительно содержат до 99% активного ингредиента. Подходящие твердые носители включают в себя, например, фосфат кальция, стеарат магния, тальк, сахара, лактозу, декстрин, крахмал, желатин, целлюлозу, метилцеллюлозу, натрийкарбокси-метилцеллюлозу, поливинилпирролидон, низкоплавящиеся воски и ионообменные смолы. Жидкие носители используют в приготовлении растворов, суспензий, эмульсий, сиропов, эликсиров и находящихся под давлением композиций. Активный ингредиент может быть растворен или суспендирован в фармацевтически приемлемом жидком носителе, таком как вода, органический растворитель, смесь обоих или фармацевтически приемлемые масла или жиры. Жидкий носитель может содержать другие подходящие фармацевтические добавки, такие как солюбилизаторы, эмульгаторы, буферы,консерванты, подслащивающие вещества, улучшающие вкус и запах агенты, суспендирующие агенты,загущающие агенты, красители, регуляторы вязкости, стабилизаторы или осморегуляторы. Подходящие примеры жидких носителей для перорального и парентерального введения включают в себя воду (частично содержащую добавки, описанные выше, такие как, например, производные целлюлозы, предпочтительно раствор натрийкарбоксиметилцеллюлозы), спирты (в том числе одноатомные и многоатомные спирты, например гликоли) и их производные, лецитины и масла (например, фракционированное кокосовое масло и арахисовое масло). Для парентерального введения носитель может быть также масляным эфиром, таким как этилолеат и изопропилмиристат. Стерильные жидкие носители применимы в стерильных композициях в жидкой форме для парентерального введения. Жидкий носитель для находящихся под давлением композиций может быть галогенированным углеводородом или другим фармацевтически приемлемым пропеллентом. Жидкие фармацевтические композиции, которые являются стерильными растворами или суспензиями, могут быть использованы, например, посредством внутримышечной, внутрибрюшинной или подкожной инъекции. Стерильные растворы могут быть также введены внутривенно. Соединения данного изобретения могут также вводиться перорально в форме жидкой или твердой композиции. Соединения данного изобретения могут вводиться ректально или вагинально в форме общепринятых суппозитория, кремов, гелей и т.д. Для введения внутриносовой или внутрибронхиальной ингаляцией или инсуффляцией соединения данного изобретения готовят в виде водного или частично водного раствора, который затем может использоваться в форме аэрозоля. Соединения данного изобретения могут также вводиться чрескожно посредством применения чрескожного пластыря, содержащего активное соединение и носитель, который является инертным для данного активного соединения, является нетоксичным для кожи и делает возможной доставку этого агента для системной абсорбции в кровоток через кожу. Этот носитель может иметь ряд форм, таких как кремы и мази, пасты, гели и герметические устройства. Кремы и мази могут быть вязкими, жидкими или полутвердыми эмульсиями типа масло-в-воде или типа вода-в-масле. Могут быть также пригодными пасты, состоящие из абсорбирующих порошков,диспергированных в петролатуме или гидрофильном петролатуме, содержащем активный ингредиент. Различные герметические устройства могут быть использованы для высвобождения активного ингредиента в кровоток, такие как полупроницаемая мембрана, покрывающая резервуар, содержащий активный ингредиент с носителем или без носителя, или матрикс, содержащий активный ингредиент. Другие герметические устройства известны в литературе. Необходимые дозы меняются в зависимости от конкретных используемых композиций, пути введения, тяжести представленных симптомов и конкретного проходящего лечение субъекта. Лечение должно обычно начинаться с малых доз, более низких, чем оптимальная доза данного соединения. После этого дозу увеличивают до тех пор, пока не достигается оптимальное действие при данных обстоятельствах;- 10005932 точные дозы для перорального, парентерального, трансдермального введения, ректальных или вагинальных суппозиториев или внутриносовых или внутрибронхиальных и других введений будет определяться врачом на основании опыта, полученного при лечении конкретного индивидуального субъекта. Предпочтительно фармацевтическая композиция находится в унифицированной (стандартной) дозированной форме, например в виде таблеток или капсул. В такой форме композиция разделена на содержащие унифицированную дозу подходящие количества активного ингредиента; унифицированные дозированные формы могут быть упакованными композициями, например упакованными в пакетики порошками, флаконами, ампулами, заранее заполненными шприцами или саше, содержащими жидкости. Унифицированная дозированная форма может быть, например, самой капсулой или таблеткой или она может быть подходящим количеством любых подобных композиций в форме упаковки. Соединение (соединения) формулы (I) и эстроген (эстрогены) данных композиций могут быть введены в отдельных дозированных единицах, таких как отдельные пилюли, таблетки, порошки и т.д., или объединены в одну композицию. После определения оптимальных доз для соединений формулы (I) и эстрогенов этих композиций может быть предпочтительным включение обоих в одну композицию для обеспечения легкости введения. Должно быть также понятно, что описанные здесь композиции могут содержать и могут не содержать другие фармацевтически активные компоненты. Растворители, используемые для описанных здесь реакций, были безводными растворителямиAldrich Sure Seal без дополнительной очистки. Реагенты были обычно Aldrich и их использовали без дополнительной очистки. Все реакции проводили в атмосфере азота. Хроматографию проводили с использованием силикагеля 230-400 меш (Merck Grade 60, Aldrich Chemical Company). Тонкослойную хроматографию проводили с пластинками с силикагелем Silica Gel 60 F254 из ЕМ Science. 1H-ЯМР-спектры получали на приборе Brucker АМ-400 в ДМСО и химические сдвиги приведены в миллионных долях(м.д.). Точки плавления определяли на приборе Thomas-Hoover и они являются некорректированными. ИК-спектры регистрировали на диффракционной решетке Perkin Elmer или спектрофотометрах PerkinElmer 784. Масс-спектры регистрировали на масс-спектрометрах Kratos MS 50 или Finnigan 8230. Элементные анализы получали при помощи элементного анализатора Perkin Elmer. Аналитические величины для соединений с сообщенным анализом CHN имели отличия 0,4% от теоретических величин. Синтез -бромкетонов Способ a. Синтез альфа-бромкетонов выполняют обычно простым растворением исходного фенилкетона в этиловом эфире (0,05-0,10 М) и добавлением по каплям при комнатной температуре 1,1 эквивалента брома. Реакцию можно подвергать мониторингу при помощи ТСХ на потребление исходных материалов. Реакцию обрабатывают промыванием водным раствором бикарбоната натрия и затем 10% водным раствором сульфита натрия. Эфирный слой промывают насыщенным раствором соли и сушат над сульфатом магния. Концентрирование реакционной смеси обычно дает бромкетоны с хорошим выходом и хорошей чистотой. Эти бромкетоны берутся "как таковые" (без очистки или характеристики) для следующей стадии. 3-Метилиндолы Схема 8 Способ 1, проиллюстрированный для примера 7 5-бензидокси-2-(4-бензилоксифенил)-3-метил 1H-индол. Колбу загружали гидрохлоридом 4-бензилоксианилина CAS No. [51145-58-5] (45 г, 0,23 моль), 4'бензилокси-2-бромфенилпропиофеноном САS No. [66414-19-5] (21 г, 0,066 моль) и 50 мл ДМФ. Реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 30 мин, затем охлаждали до комнатной температуры и затем распределяли между 250 мл EtOAc и 100 мл 1 н. НСl(водн.). EtOAc слой промывали NaHCO3 (водн.) и насыщенным раствором соли, затем сушили над МgSO4. Раствор концентрировали и остаток помещали в CH2Cl2 и добавляли гексаны для осаждения 25 г неочищенного твердого вещества. Твердое вещество растворяли в CH2Cl2, упаривали, помещали на силикагель и хроматографировали с использованием смеси СН 2 Сl2/гексан (1:5) с получением 9,2 г рыжевато-коричневого твердого вещества (33%); т.пл. 150-152 С; 1H-ЯМР (DMSO) 10,88 (с, 1 Н), 7,56 (д, 2 Н,J=8,8 Гц), 7,48 (д, 4 Н, J=7,9 Гц), 7,42-7,29 (м, 6 Н), 7,21 (д, 1 Н, J=7,0 Гц), 7,13 (д, 2 Н, J=8,8 Гц), 7,08 (д, 1 Н,J=2,2 Гц), 6,94 (дд, 1 Н, J=8,8, 2,4 Гц), 5,16 (с, 2 Н), 5,11 (с, 2 Н), 2,33 (с, 3H); ИК (КВr) 3470, 2880, 2820,1620 см-1; МС eI m/z 419. Способ 2 (показанный на схеме 8), также проиллюстрированный для примера 7. Используемые реагенты были такими же, что и в способе 1, за исключением дополнительного использования в данном способе триэтиламина. Бромкетон CAS No. [66414-19-5] (50,0 г, 0,16 моль) в 200 мл ДМФ обрабатывали гидрохлоридом анилина CAS No. [51145-58-5] (44 г, 0,22 моль) и реакцию продували азотом в течение приблизительно 10 мин. Добавляли триэтиламин (54,6 мл) и реакционную смесь нагревали при 120 С в течение 2 ч. ТСХ-анализ (EtOAc/гексан) показывает, что исходный материал исчезает с образованием более полярного пятна. Реакционной смеси давали остыть и добавляли еще 48 г гидрохлорида анилина. Реакционную смесь нагревали до 150 С в течение 2 ч. Добавляли еще 5 г гидрохлорида анилина и реакционную смесь нагревали при 150 С еще в течение 30 мин. Реакционной смеси давали остыть до комнатной температуры и затем ее выливали в приблизительно 1,5 л воды и экстрагировали 2 л этилацетата. Твердые вещества растворяли в дополнительном количестве этилацетата при необходимости. Этилацетатный слой промывали 1 л 1 н. раствора NaOH (водн.), 1 л воды, насыщенным раствором соли, затем сушили над сульфатом магния и фильтровали. Органические слои концентрировали с получением неочищенного твердого вещества, которое перемешивали с 500 мл метанола и фильтровали. Затем твердое вещество перемешивали с 500 мл этилового эфира и фильтровали. Твердое вещество перемешивали альтернативно с метанолом и эфиром до беловатой окраски, и оно имело точку плавления, одинаковую с точкой плавления, приведенной для No. 7 в способе 1. Реакция дает 36 г продукта. Физические данные для индолов Следующие 3-метилиндолы (No.1-No.20) синтезировали в соответствии с процедурой, представленной на схеме 2, с использованием способа 2 с применением подходящим образом замещенных бром- 14005932 Экспериментальная процедура для синтеза этиловых эфиров 3-метилиндолуксусной кислоты Способ 3, проиллюстрированный для примера 26. Этиловый эфир 4-[5-бензилокси-2-(4-бензилоксифенил)-3-метилиндол-1-илметил]феноксиуксусной кислоты. Раствор 5-бензилокси-2-(4-бензилоксифенил)-3-метил-1H-индол (пример индола 7) (32 г, 77 ммоль) в ДМФ [0,15 л) охлаждали до 0 С и обрабатывали гидридом натрия (2,2 г, 89 ммоль). Реакционную смесь перемешивали в течение 20 мин и затем добавляли бензилхлорид CAS No. [80494-75-3] (29,г,127 ммоль) и реакционную смесь перемешивали в течение 18 ч при комнатной температуре. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Этилацетатный слой промывали насыщенным раствором соли и сушили над сульфатом магния. Этилацетат концентрировали и растирали с эфиром с получением 21 г белого твердого вещества. Фильтрат концентрировали и растирали с эфиром с получением дополнительных 7 г белого твердого вещества с общим выходом 28 г; т.пл.=129-131 С; 1HЯМР (DMSO) 7,47 (д, 4 Н, J=7,2 Гц), 7,39 (кв, 4 Н, J=7,9 Гц), 7,36-7,32 (м, 1 Н), 7,29 (д, 2 Н, J=8,8 Гц), 7,19(д, 1 Н, J=9,0 Гц), 7,13-7,09 (м, 4 Н), 6,80 (дд, 1 Н, J=8,8 Гц, 2,4 Гц), 6,73 (с, 4 Н), 5,16 (с, 2 Н), 5,13 (с, 2 Н),5,11 (с, 2 Н), 4,66 (с, 2 Н), 4,11 (кв, 2 Н, J=7,2 Гц), 2,15 (с, 3H), 1,16 (т, 3H, J=7,2 Гц); МС eI m/z 612. Физические данные для этиловых эфиров индолов Следующие продукты алкилирования индолов были получены в соответствии со схемой 9 с использованием способа 3 с подходящим образом замещенным 3-метилиндолом, выбранным из (1-16) в качестве исходного материала. Пример 21. Этиловый эфир 4-[2-фенил-3-метилиндол-1-илметил]феноксиуксусной кислоты. Масло; 1H-ЯМР (DMSO) 7,57-7,30 (м, 7 Н), 7,13-7,02 (м, 2 Н), 6,77-6,70 (м, 4 Н), 5,22 (с, 2H), 4,65 (с,2 Н), 4,09 (KB, 2H, J=7,2 Гц), 2,20 (с, 3H), 1,15 (т, 3H, J=7,0 Гц); МС eI m/z 399 (М+). Пример 22. Этиловый эфир 4-[5-бензилокси-2-фенил-3-метилиндол-1-ил-метил]феноксиуксусной кислоты. Масло; 1H-ЯМР (DMSO) 7,50-7,40 (м, 10 Н), 7,22 (д, 1 Н, J=8,4 Гц), 7,14 (д, 1 Н, J=2,5 Гц), 6,83 (д, 1 Н,J=2,5 Гц), 6,72 (с, 4 Н), 5,18 (с, 2H), 5,11 (с, 2H), 4,65 (с, 2H), 4,10 (кв, 2H, J=7,2 Гц), 2,16 (с, 3H), 1,14 (т,3H, J=7,0 Гц); МС eI m/z 505 (М+). Пример 23. Этиловый эфир 4-[5-бензилокси-2-(4-метоксифенил)-3-метилиндол-1-илметил]феноксиуксусной кислоты. Т.пл.=90-96 С; 1H-ЯМР (DMSO) 7,47 (д, 2H, J=6, 8 Гц), 7,41-7,37 (м, 2H), 7,33-7,27 (м, 3H), 7,19 (д,1 Н, J=8,8 Гц), 7,12 (д, 1 Н, J=2,4 Гц), 7,03 (д, 2H, J=8,8 Гц), 6,80 (дд, 1 Н, J=8,8 Гц, 2,4 Гц), 6,74 (с, 4 Н), 5,16- 16005932 Экспериментальная процедура для синтеза 3-метилиндолфенэтанолов Способ 4, проиллюстрированный для примера 38. 2-4-[5-Бензилокси-2-(4-бензилоксифенил)-3-метилиндол-1-илме-тил]феноксиэтанол. Раствор 26 из предыдущей стадии (5,5 г, 8,8 ммоль) в ТГФ (50 мл) охлаждали до 0 С и добавляли по каплям раствор LiAlH4, (10 мл, 1 М) в ТГФ. Спустя 30 мин при 0 С реакцию осторожно гасили водой и распределяли между EtOAc и 1 н. НСl. EtOAc слой сушили с МgSO4, концентрировали и хроматографировали на силикагеле со смесью EtOAc/гексан (2:3) в качестве элюента с получением 4/0 г 38 в виде белой пены; 1H-ЯМР (DMSO) 7,48-7,46 (м, 4 Н), 7,42-7,27 (м, 8 Н), 7,20 (д, 1 Н, J=8,8 Гц), 7,12-7,10 (м, 3H),6,80 (дд, 1 Н, J=8,8 Гц, 2,4 Гц), 6,73 (с, 4 Н), 5,15 (с, 2 Н), 5,13 (с, 2 Н), 5,11 (с, 2 Н), 4,80 (т, 1 Н, J=5,5 Гц),3,86 (т, 2 Н, J=4, 8 Гц), 3,63 (кв, 2H, J=5,3 Гц), 2,15 (с, 3H). Физические данные для индолфенэтанолов Следующие соединения получали в соответствии со схемой 10 и способом 4 с использованием подходящим образом замещенного этилового эфира индола, выбранного из 21-34. Пример 35. 2-4-[2-Фенил-3-метилиндол-1-илметил]феноксиэтанол. Масло; 1H-ЯМР (DMSO) 7,57-7,32 (м, 7 Н), 7,13-7,02 (м, 2H), 6,74 (с, 4 Н), 5,21 (с, 2H), 4,80 (с, 1 Н),3,86-3,83 (м, 2H), 3,62 (с, 2H), 2,20 (с, 3H); МС eI m/z 357 (М+). Пример 36. 2-4-[5-Метокси-2-(4-метоксифенил)-3-метилиндол-1-илметил]феноксиэтанол. Масло; 1H-ЯМР (DMSO) 7,27 (д, 2 Н, J=8,8 Гц), 7,17 (д, 1 Н, J=8,8 Гц), 7,03 (д, 2 Н, J=8,6 Гц), 6,99 (д,1 Н, J=2,5 Гц), 6,78-6,70 (м, 5 Н), 5,14 (с, 2 Н), 4,80 (шс, 1 Н), 3,85 (т, 2 Н, J=5,0 Гц), 3,78 (с, 3H), 3,76 (с, 3H),3,63 (т, 2 Н, J=5,0 Гц), 2,16 (с, 3H); МС eI m/z 417 (М+). Пример 37. 2-4-[5-Бензилокси-2-(4-этоксифенил)-3-метилиндол-1-илметил]феноксиэтанол. Пена; 1H-ЯМР (DMSO) 7,45 (д, 2 Н, J=7,2 Гц), 7,40-7,25 (м, 5 Н), 7,17 (д, 1 Н, J=8,8 Гц), 7,11 (д, 1 Н,J=2,2 Гц), 7,01 (д, 2 Н, J=6,8 Гц), 6,78 (дд, 1 Н, J=8,8 Гц, 2,4 Гц), 6,73 (с, 4 Н), 5,15 (с, 2 Н), 5,10 (с, 2 Н), 4,80 Экспериментальная процедура для синтеза 3-метилиндолфенетилбромидов Способ 5, проиллюстрированный для примера 50. Пример 50. 5-Бензилокси-2-(4-бензилоксифенил)-1-[4-(2-бромэтокси)бензил]-3-метил-1 Н-индол. К раствору соединения примера 38 (3,3 г, 5,8 ммоль) в ТГФ (50 мл) добавляли СВr4 (2,9 г, 8,7 ммоль) и РРН 3 (2,3 г, 8,7 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч и затем концентрировали и хроматографировали на силикагеле с использованием градиентного элюирования от смеси EtOAc/гексан (1:4) до EtOAc с получением 3,2 г белого твердого вещества: т.пл.=131-134 С; 1H-ЯМР (DMSO) 7,64-7,30 (м, 10 Н), 7,29 (д, 2 Н, J=8,8 Гц), 7,20 (д, 1 Н, J=8,8 Гц), 7,127,09 (м, 3H), 6,80 (дд, 1 Н, J=8,8 Гц, 2,4 Гц), 6,77-7,73 (м, 4 Н), 5,16 (с, 2 Н), 5,13 (с, 2 Н), 5,11 (с, 2 Н), 4,20 (т,2 Н, J=5,3 Гц), 3,73 (т, 2 Н, J=5,5 Гц), 2,15 (с, 3H);MS FAB m/z 631/633 (М+Н+, присутствует Вr). Физические данные для индолфенетилбромидов Следующие соединения получали в соответствии со схемой 11, как описано в способе 5, с использованием подходящим образом замещенного индола, выбранного из 35-45. Пример 47. 1-[4-(2-Бромэтокси)бензил]-2-фенил-3-метил-1H-индол. Масло; 1H-ЯМР (DMSO) 7,57-7,32 (м, 7 Н), 7,13-7,02 (м, 2 Н), 6,74 (с, 4 Н), 5,21 (с, 2 Н), 4,19 (т, 2 Н,J=5,2 Гц), 3,71 (т, 2 Н, J=5,5 Гц), 2,20 (с, 3H); МС eI m/z 419 (М+). Пример 48. 5-Метокси-2-(4-метоксифенил)-1-[4-(2-бромэтокси)бензил]-3-метил-1 Н-индол. Масло; 1H-ЯМР (DMSO) 7,27 (д, 2 Н, J=8,8 Гц), 7,17 (д, 1 Н, J=8,8 Гц), 7,03 (д, 2 Н, J=8,6 Гц), 6,99 (д,1 Н, J=2,5 Гц), 6,80-6,69 (м, 5 Н), 5,14 (с, 2 Н), 4,19 (т, 2 Н, J=5,4 Гц), 3,78 (с, 3H), 3,76 (с, 3H), 3,72 (т, 2 Н,J=5,5 Гц), 2,16 (с, 3H); МС eI m/z 479 (М+). Пример 49. 5-Бензилокси-2-(4-этоксифенил)-1-[4-(2-бромэтокси)бензил]-3-метил-1 Н-индол.(т, 2 Н, J=5,5 Гц), 3,72 (т, 2 Н, J=5,5 Гц), 2,16 (с, 3H); МС eI m/z 559 (М+). Данные для некоторых 3-метилиндолфенилэтилхлоридов, используемых в качестве промежуточных продуктов. Схема 12 Экспериментальная процедура для синтеза 3-метилиндолфенетилхлоридов Способ 5 а, проиллюстрированный для примера 58. 5-Бензилокси-2-(3-бензилоксифенил)-1-[4-(2 хлорэтокси)бензил]-3-метил-1 Н-индол. К раствору 9,7 г (0,0231 моль) 5-бензилокси-3-метил-2-(3-бензилоксифенил)-1H-индола (пример индола 17) в 80 мл сухого ДМФ добавляли 0,85 г гидрида натрия (60% в минеральном масле). После перемешивания этой смеси в течение 30 мин (до прекращения выделения пузырьков) добавляли 4,8 г 1 хлорметил-4-(2-хлорэтокси)бензола CAS No. [99847-87-7]. Реакционной смеси давали реагировать при комнатной температуре в течение ночи. К реакционной смеси добавляли 200 мл этилацетата и затем ее промывали водой (3 х 100 мл). Органический раствор собирали, промывали насыщенным солевым раствором, извлекали, сушили над сульфатом магния, фильтровали и упаривали досуха на роторном испарителе. Продукт перекристаллизовывали из этилацетата. Т.пл.=125-127 С. 1H-ЯМР (DMSO) 7,48-7,46 (д, 2 Н, J=6,8 Гц), 7,40-7,35 (м, 7 Н), 7,33-7,28 (м, 2 Н),7,23-7,21 (д, 1 Н, J=8,8 Гц), 7,13-7,12 (д, 1 Н, J=2,2 Гц), 7,07-7,04 (м, 1 Н), 6,94-6,92 (д, 2 Н, J=6,1 Гц), 6,836,80 (дд, 1 Н, J=2,5 Гц, 6,3 Гц), 6,78-6,72 (м, 4 Н), 5,14 (с, 2 Н), 5,11 (С, 2 Н), 5,04 (с, 2 Н), 4,13-4,10 (т, 2 Н,J=5,1 Гц), 3,86-3,84 (т, 2 Н, J=5,1 Гц), 2,14 (с, 3H); ИК 3420, 2900 см-1; МС eI m/z 587 (М+); CHN pac-счит. для С 38 Н 34 СlNO3. Физические данные для индолфенетилхлоридов Следующие соединения получали в соответствии со схемой 12, как описано в способе 5 а, с использованием подходящим образом замещенных индолов 18,20. Пример 59. 5-Бензилокси-2-(4-бензилокси-3-фторфенил)-1-[4-(2-хлорэтокси)бензил]-3-метил-1 Ниндол. Т.пл.=88-91 С; 1H-ЯМР (DMSO) 7,49-7,43 (м, 4 Н), 7,43-7,28 (м, 7 Н), 7,26-7,21 (м, 2 Н), 7,13-7,09 (м,2 Н), 6,88-6,72 (м, 5 Н), 5,21 (с, 2 Н), 5,18 (с, 2 Н), 5,11 (с, 2 Н), 4,13 (т, 2 Н, J=5,2 Гц), 3,87 (т, 2 Н, J=5,2 Гц),2,16 (с, 3H); МС eI m/z 605 (М+); CHN рассчит. для C38H33ClFNO3. Пример 60. 5-Бензилокси-1-[4-(2-хлорэтокси)бензил]-3-метил-2-(4-трифторметоксифенил)-1Hиндол. Т.пл.=108-110 С; 1H-ЯМР (DMSO) 7,49-7,48 (м, 6 Н), 7,40-7,25 (м, 4 Н), 7,17-7,16 (д, 1 Н, J=2,9 Гц),6,88-6,84 (м, 1 Н), 6,77-6,72 (м, 4 Н), 5,20 (с, 2 Н), 5,14-5,13 (д, 2 Н, J=2,3 Гц), 4,16-4,11 (м, 2 Н), 3,89-3,84 (м,2 Н), 2,19-2,17 (м, 3H); ИК 3400, 2900, 1600 см-1; МС eI m/z 566 (M+); CHN рассчит. для С 32 Н 27 СIF3NO3 + 0,25 H2O. Аминоэтоксииндолы Схема 13 Экспериментальная процедура для синтеза 3-метиламиноэтоксииндолов Способ 6, проиллюстрированный для примера 63. Замещение бромида 5-бензилокси-2-(4-бензилоксифенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси) бензил]-1H-индол. Раствор примера 50 (3,2 г, 5,0 ммоль) в ТГФ (50 мл) обрабатывали пиперидином (5,0 мл, 50 ммоль) и нагревали при температуре кипения с обратным холодильником. Спустя 5 ч реакционную смесь концентрировали и помещали в EtOAc, промывали насыщенным NaHCO3, сушили над сульфатом магния и хроматографировали на колонке силикагеля с использованием градиентного элюированияEtOAc/гексан - EtOAc. Продукт (2,7 г) был белым твердым веществом с т.пл.=93-95 С; 1 Н-ЯМР (DMSO) 7,48-7,46 (м, 4 Н), 7,42-7,38 (м, 4 Н), 7,38-7,32 (м, 2 Н), 7,29 (д, 2 Н, J=8,8 Гц), 7,19 (д, 1 Н, J=9,0 Гц), 7,127,10 (м, 3H), 6,80 (дд, 1 Н, J=8,8 Гц, 2,4 Гц), 6,73 (с, 4 Н), 5,15 (с, 2 Н), 5,13 (с, 2 Н), 5,11 (с, 2 Н), 3,93 (т, 2 Н,J=5,7 Гц), 2,60-2,50 (м, 2 Н), 2,41-2,30 (м, 4 Н), 2,15 (с, 3H), 1,47-1,42 (м, 4 Н), 1,36-1,32 (м, 2 Н); MS FABm/z 637 (М+Н+). Альтернативная процедура Способ 6 а. Замещение хлоридов. Синтез, проиллюстрированный для продукта 76. Пример 76. 5-Бензилокси-2-(3-бензилоксифенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси)бензил]1H-индол. К раствору 1,1 г (0,00953 моль) 5-бензилокси-2-(3-бензилоксифенил) -1-[4-(2-хлорэтокси)бензил]-3 метил-1 Н-индола (пример 58) в 10 мл ДМФ добавляли 1,1 мл (0,0112 моль) пиперидина и 0,93 г (0,0561 моль) иодида калия. Реакционную смесь нагревали до 40-50 С в течение 4 ч. После охлаждения реакционной смеси до комнатной температуры добавляли 150 мл этилацетата и смесь промывали водой (3 х 100 мл). Органический раствор собирали, промывали насыщенным солевым раствором, извлекали, сушили над сульфатом магния, фильтровали и упаривали с получением 1,0 г продукта после очистки. Т.пл.=125-126 С; 1H-ЯМР (DMSO) 7,48-7,45 (д, 2 Н, J=7,2 Гц), 7,41-7,35 (м, 7 Н), 7,33-7,28 (м, 2 Н),7,23-7,21 (д, 1 Н, J=9,0 Гц), 7,13-7,12 (д, 1 Н, J=2,4 Гц), 7,06-7,03 (м, 1 Н), 6,95-6,91 (м, 2 Н), 6,83-6,80 (дд,1 Н, J=2,4 Гц, 6,3 Гц), 6,75-6,70 (м, 4 Н), 5,13 (с, 2 Н), 5,11 (с, 2 Н), 5,02 (с, 2 Н), 3,93-3,90 (т, 2 Н, J=6,0 Гц),2,56-2,53 (т, 2 Н, J=5,9 Гц), 2,49-2,48 (м, 4 Н), 2,14 (с, 3H), 1,46-1,40 (м, 4 Н), 1,35-1,31 (м, 2 Н); ИК (KBr) 3400, 2900 см-1; МС eI m/z 636 (М+). СНN рассчит. для С 43 Н 44 Н 2O3 + 0,25 Н 2 О. Физические данные для аминозамещенных соединений Следующие соединения получали по схеме 13 с использованием способа 6, за исключением примеров 76-84, которые получали с использованием способа 6 а. Пример 61. 5-Бензилокси-2-(4-этоксифенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-1Hиндол. Т.пл.=188-191 С; 1H-ЯМР (DMSO) 7,45 (д, 2 Н, J=7,3 Гц), 7,40-7,25 (м, 5 Н), 7,17 (д, 1 Н, J=8,8 Гц),7,11 (д, 1 Н, J=2,2 Гц), 7,01 (д, 2 Н, J=6,8 Гц), 6,78 (дд, 1 Н, J=8,8 Гц, 2,4 Гц), 6,73 (с, 4 Н), 5,15 (с, 2 Н), 5,10(1S,2R)-2-азабицикло[2.1.1]гептан, используемый для замещения бромида, получали в соответствии с процедурой, приведенной в Syn. Comm. 26(3), 577-584 (1996). Т.пл.=95-100 С; 1H-ЯМР (DMSO) 7,32-6,55 (м, 21 Н), 5,10-4,90 (м, 6 Н), 3,69 (т, 2 Н, J=5,9 Гц), 2,652,5 (м, 3H), 2,10 (с, 2 Н), 2,0 (с, 3H), 1,50-1,0 (м, 7 Н). Пример 72. 5-Бензилокси-2-(4-фторфенил)-3-метил-1-[4-(2-азепан-1-ил-этокси)бензил]-1H-индол. Масло; 1H-ЯМР (DMSO) 7,50-7,43 (м, 2 Н), 7,42-7,33 (м, 4 Н), 7,32-7,20 (м, 4 Н), 7,13 (д, 1 Н, J=2,4 Гц),6,83 (дд, 1 Н, J=2,4 Гц, 6,7 Гц), 6,71 (с, 4 Н), 5,14 (с, 2 Н), 5,11 (с, 2 Н), 3,89 (т, 2 Н, J=5,9 Гц), 3,20 (м, 4 Н),2,74 (т, 2 Н, J=6,0 Гц), 2,15 (с, 3H), 1,60-1,40 (м, 8 Н); МС eI m/z 562 (М+). Пример 72 а. 5-Бензилокси-2-(4-фторфенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-1Hиндол. Масло; 1H-ЯМР (DMSO) 7,32-6,53 (м, 16 Н), 5,00 (с, 2 Н), 4,96 (с, 2 Н), 3,77 (т, 2 Н, J=5,8 Гц), 3,22-3,14(т, 2 Н, J=6,0 Гц), 2,49-2,48 (м, 4 Н), 2,13 (с, 3H), 1,51 (с, 8 Н); ИК 3400, 2900 см-1; МС eI m/z 650 (М+); CHN рассчит. для С 44 Н 46N2O3. Данные и процедуры для соединений из табл. 11 (таблицы с данными для рецепторов ER, infra) текста Гидрирование индолов, содержащих бензиловый эфир (эфиры) Способ 7, проиллюстрированный для примера 97. 2-(4-Гидроксифенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси)бен-зил]-1 Н-индол-5-ол. Суспензию 10% Pd/C (1,1 г) в EtOH обрабатывали раствором соединения 63 (2,2 г, 3,4 ммоль) в ТГФ/EtOH. Добавляли циклогексадиен (6,0 мл, 63 ммоль) и реакционную смесь перемешивали в течение 48 ч. Катализатор отфильтровывали через целит и реакционную смесь концентрировали и хроматографировали на силикагеле с использованием градиентного элюирования MeOH/CH2Cl2 (1:19 - 1:10) с получением 0,8 г продукта в виде белого твердого вещества; т.пл. 109-113 С; СНN рассчит. для C29H32N2O3+0,5 Н 2O; 1H-ЯМР 9,64 (с, 1 Н), 8,67 (с, 1 Н), 7,14 (д, 2 Н, J=8,6 Гц), 7,05 (д, 1 Н, J=8,6 Гц), 6,84 (д, 2 Н, J=8,8 Гц), 6,79 (д, 1 Н, J=2,2 Гц), 6,74 (с, 4 Н), 6,56 (дд, 1 Н, J=8,8 Гц, 2,4 Гц), 5,09 (с, 2 Н), 3,95-3,93 (м, 2 Н), 2,602,51 (м, 2 Н), 2,39-2,38 (м, 4 Н), 2,09 (с, 3H), 1,46-1,45 (м, 4 Н), 1,35-1,34 (м, 2 Н); ИК (KBr) 3350 (шир),2920, 1620, 1510 см-1; MS (EI) m/z 456. Альтернативно, соединения могут быть растворены в растворе ТГФ/EtOH (или другом подходящем растворителе) и гидрированы Н 2 и 10% Pd/C с использованием баллона или гидрогенизатора Парра. Любая процедура является эффективной. Во многих примерах данные соединения превращали в кислотноаддитивные соли. Процедура получения соли НСl приведена ниже (способ 8). Способ 8. 1,0 г свободного основания примера 97 из процедуры гидрирования, описанной выше,в большой тест-пробирке растворяли в 20 мл МеОН. Раствор обрабатывали медленным добавлением 2,6 мл 1,0 н. НСl и затем 4,0 мл деионизованной воды. Пробирку частично открывали для поддержания медленного выпаривания растворителей. После приблизительно десяти минут начинали появляться кристаллы и после 4 ч раствор фильтровали и твердые кристаллы промывали водой. Продукт присутствовал в виде 0,42 г белых кристаллических пластинок с точкой плавления 184-185 С. Маточный раствор давал дополнительный выход 0,30 г белого твердого вещества с точкой плавления 177-182 С. СНN рассчит. для С 29 Н 32N2O3 + НСl + 1 Н 2O. Альтернативно, данные соединения могут быть превращены в соли четвертичного аммония. Пример процедуры для синтеза соединения примера 107 дается ниже (способ 9). Способ 9. Пример 107. Метиодид 2-(4-гидроксифенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-1 Ниндол-5-ола. 0,8 г соединения примера 97 растворяли в 18 мл ТГФ и обрабатывали с 2 мл метилиодида. Раствор нагревали при температуре кипения с обратным холодильником в течение часа. Реакции давали остыть до комнатной температуры и твердые вещества фильтровали с получением 0,72 г кристаллического твердого вещества. Т.пл.=214-217 С, CHN рассчит. для С 29 Н 32N2O3 + СН 3I + 0,5 Н 2O. Пример 106. Метиодид 2-(4-гидроксифенил)-3-метил-1-[4-(2-диметил-1-илэтокси)бензил]-1 Ниндол-5-ола получали аналогично 107, за исключением использования соединения примера 100 в качестве исходного материала: т.пл.=245-250 С; 1H-ЯМР (DMSO) 9,66 (с, 1 Н), 8,69 (с, 1 Н), 7,16 (д, 2 Н, J=8,4 Гц), 7,05 (д, 1 Н, J=8,8 Гц), 6,84 (д, 1 Н, J=8,6 Гц), 6,81-6,75 (м, 6 Н), 6,56 (дд, 1 Н, J=2,4 Гц, 8,7 Гц), 5,12 (с,2 Н), 4,34 (м, 2 Н), 3,70 (т, 2 Н, J=4,6 Гц), 3,11 (с, 9 Н), 2,09 (с, 3H); ИК (KBr) 3250, 1500, 1250; MC eI m/z 416 (М+); CHN рассчит. для C26H28N2O3 + 1,09 СН 3I + 0,8 Н 2 О. Физические данные для конечных соединений с удаленными защитными группами Следующие соединения являются либо свободными основаниями, либо солями НСl, либо ацетатными солями. Их получали согласно процедуре, описанной в способе 7, с использованием подходящего бензилового эфира в качестве предшественника. Если соединение из табл. 1 не содержит свободной фенольной группы, то его необязательно дебензилировать, и способ 7 не используется. Физические данные для этих соединений ( 85,90,91) представлены также ниже. Пример 85. 4-3-Метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-1 Н-индол (НСl). Т.пл.=134-137 С; 1H-ЯМР (DMSO) 10,33 (с, 1 Н), 7,56-7,38 (м, 6 Н), 7,32 (д, 1 Н, J=8,1 Гц), 7,14-7,0 (м,2 Н), 6,80 (с, 4 Н), 5,24 (с, 2 Н), 4,28 (т, 2 Н, J=5,0 Гц), 3,50-3,40 (м, 4 Н), 3,0-2,95 (м, 2 Н), 2,10 (с, 3H), 1,801,60 (м, 5 Н), 1,40-1,35 (м, 1 Н); ИК 3400, 2900, 1510, 1250 см-1; MS (+) FAB m/z 425 [M+H]+; CHN рассчит. для С 29 Н 32N2O +1,0 НСl +1,0 Н 2 О.- 28005932 Т.пл.=168-171 С; 1H-ЯМР (DMSO) 10,11 (шс, 1 Н), 9,70 (с, 1 Н), 8,71 (с, 1H), 7,15 (д, 2 Н, J=8,6 Гц),7,05 (д, 1 Н, J=8,8 Гц), 6,85 (д, 2 Н, J=8,8 Гц), 6,80-6,77 (м, 5 Н), 6,56 (дд, 1H, J=8,8 Гц, 2,2 Гц), 5,11 (с, 2 Н),4,26 (т, 2 Н, J=4,6 Гц), 3,48-3,30 (м, 4 Н), 3,22-3,08 (м, 2 Н), 2,09 (с, 3H), 1,83-1,76 (м, 4 Н), 1,67-1,48 (м, 4 Н); ИК (KBr) 3500 шир, 2900, 1610; MS FAB m/z 471 (M+H+); CHN рассчит. для C30H34N2O3 + 2,5H2O + HCl. Пример 98. Ацетатная соль соединения примера 97. Получали осаждением свободного основания 97 из ацетона и уксусной кислоты. Т.пл.=174178 С. Пример 99. 1-[4-(2-Азокан-1-илэтокси)бензил]-2-(4-гидроксифенил)-3-метил-1 Н-индол-5-ол. Т.пл.=98-102 С; 1H-ЯМР (DMSO) 9,63 (с, 1H), 8,68 (с, 1H), 7,15-7,13 (м, 2 Н), 7,05 (д, 1H, J=8,5 Гц),6,83 (дд, 2 Н, J=2,0 Гц, 6,6 Гц), 6,79 (д, 1 Н, J=2,2 Гц), 6,73 (с, 4 Н), 6,55 (дд, 1 Н, J=2,2 Гц, 8,6 Гц), 5,08 (с,2 Н), 3,89 (т, 2 Н, J=5,7 Гц), 2,74 (т, 2 Н, J=5,4 Гц), 2,55 (шс, 4 Н), 2,08 (с, 3H), 1,55 (с, 2 Н), 1,46 (с, 8 Н); ИК 3400, 2900, 1250 см-1; МС eI m/z 484 (М+); CHN рассчит. для C31H36N2O3 + 0,30 Н 2O. Пример 100. 2-(4-Гидроксифенил)-3-метил-1-[4-(2-диметил-1-илэтокси)бензил]-1H-индол-5-ол. Т.пл.=95-105 С; ИК (KBr) 3400 шир, 2900, 1610 см-1; МС eI m/z 416 (М+); CHN рассчит. для
МПК / Метки
МПК: A61K 31/40, A61P 9/00
Метки: комбинации, эстрогенами, 2-фенил-1-[4-(2-аминоэтокси)бензил]индол
Код ссылки
<a href="https://eas.patents.su/30-5932-2-fenil-1-4-2-aminoetoksibenzilindol-v-kombinacii-s-estrogenami.html" rel="bookmark" title="База патентов Евразийского Союза">2-фенил-1-[4-(2-аминоэтокси)бензил]индол в комбинации с эстрогенами</a>