Новые 1, 1- и 1, 2-дизамещенные циклопропановые производные, способ их получения и содержащие их фармацевтические композиции
Номер патента: 5185
Опубликовано: 30.12.2004
Авторы: Лестеж Пьер, Гильоно Клод, Гольдстейн Соло, Локхар Бриан, Шартон Ив
Формула / Реферат
1. Соединения формулы (I)
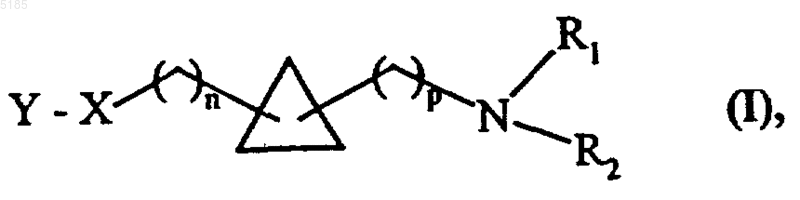
в которой
p обозначает целое число от 0 до 6 включительно,
n обозначает целое число от 0 до 6 включительно,
R1 и R2, которые могут быть одинаковыми или разными, каждый независимо друг от друга обозначает группу, выбранную из атома водорода, линейной или разветвленной (C1-C6)алкильной группы, арильной группы и арил(C1-C6)алкильной группы, которая содержит линейный или разветвленный алкильный остаток, или R1+R2 совместно с азотным атомом, с которым они связаны, образуют насыщенную моноциклическую систему, включающую от 5 до 6 членов,
X обозначает группу, выбранную из атома кислорода, атома серы, группы -CH=CH-, метилена, группы формулы -HC=N-O- и группы формулы -O-CH2-CH=CH-, причем в соединениях формулы (I) кислородный атом этих групп связан с остатком Y,
Y обозначает группу, выбранную из арила, гетероарила, арил(C1-C6)алкила, в котором алкильный остаток является линейным или разветвленным, гетероарил(C1-C6)алкила, в котором алкильный остаток является линейным или разветвленным, -C(O)-A и -C(S)-A,
A обозначает группу, выбранную из линейного или разветвленного (C1-C6)алкила, гетероарила и NR3R4, где каждый из R3 и R4, которые могут быть одинаковыми или разными, обозначает группу, выбранную из водородного атома, линейной или разветвленной (C1-C6)алкильной группы,
их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием, при условии, что
в случае 1,1-дизамещенных соединений формулы (I),
p имеет значения, отличные от нуля, когда X обозначает метиленовую группу, n обозначает ноль, Y обозначает арильную или гетероарильную группу, а каждый из R1 и R2, которые могут быть одинаковыми или разными, обозначает водородный атом, линейную или разветвленную (C1-C4)алкильную группу, бензильную группу, фенилэтильную группу или совместно с азотным атомом, с которым они связаны или насыщенную карбоциклическую систему, включающую от 5 до 7 членов,
p имеет значения, отличные от нуля, когда X обозначает метиленовую группу, n обозначает ноль, Y обозначает ацетильную группу, а каждый из R1 и R2, которые могут быть одинаковыми или разными, обозначает водородный атом, линейную или разветвленную (C1-C4)алкильную группу, фенильную группу, бензильную группу, R1 и R2 одновременно не могут обозначать метильные группы
либо когда каждый из p и n обозначает 1, X обозначает кислородный атом, а Y обозначает группу, выбранную из п-нитробензоила, п-аминобензоила, п-хлорфениламинокарбонила или ацетила,
либо когда p обозначает ноль, n обозначает 1, X обозначает кислородный атом или атом серы, а Y обозначает 2-хинолильную группу, замещенную в 3 положении линейной или разветвленной (C3-C4)алкильной группой, или фенильную группу,
Y не обозначает 1,2-бензизоксазол-3-ильную группу, когда n обозначает 1, p обозначает ноль, а X обозначает кислородный атом,
в случае 1,2-дизамещенных соединений формулы (I),
R1 и R2 одновременно не могут обозначать водородный атом, когда каждый из p и n обозначает ноль, а X и Y совместно обозначают феноксигруппу (необязательно замещенную одной или двумя одинаковыми или разными группами, выбранными из метокси, диметиламиногруппы, атома галогена, метила, трифторметила, нитро- и аминогрупп), фенилсульфанильную группу, бензилоксигруппу, бензильную группу или 2-фенилэтильную группу,
R1 и R2 одновременно не могут обозначать метильную группу, когда каждый из p и n обозначает ноль, а X и Y совместно обозначают феноксигруппу (необязательно замещенную группой, выбранной из атома хлора и трифторметила), фенилсульфанильную группу или бензильную группу,
а также при условии, что соединения формулы (I) отличны от следующих соединений:
(1-бензилциклопропил)метанамин,
(1-бензилциклопропил)-N,N-диметилметанамин,
2-(феноксициклопропил)метанамин,
2-(феноксиметил)циклопропанамин,
(N,N-диметил)-2-(ацетоксиметил)циклопропанметанамин,
N-{2-[2-(бензилокси)этил]циклопропил}-N,N-диметиламин;
под арильной группой подразумевают фенильную, дифенильную, нафтильную, дигидронафтильную, тетрагидронафтильную, инданильную или инденильную группу, причем каждая из этих групп необязательно замещена одной или несколькими одинаковыми или разными группами, выбранными из атомов галогена, линейной или разветвленной (C1-C6)алкильной, гидроксильной, циано-, нитрогрупп, линейной или разветвленной (C1-C6)алкокси, линейной или разветвленной (C2-C7)ацильной, линейной или разветвленной (C1-C6)алкоксикарбонильной, линейной или разветвленной (C1-C6)тригалоалкильной, линейной или разветвленной (C1-C6)тригалоалкоксигрупп и аминогрупп, необязательно замещенных одной или двумя линейными или разветвленными (C1-C6)алкильными группами;
под гетероарильной группой подразумевают моноциклическую ароматическую или бициклическую систему, включающую от 5 до 12 членов, содержащую от одного до трех одинаковых или разных гетероатомов, выбранных из атомов кислорода, азота и серы, одно из колец которой в случае бициклической системы обладает ароматическим характером, а другое кольцо которой может быть ароматическим или частично гидрогенизированным, причем каждая из этих групп необязательно замещена одной или несколькими одинаковыми или разными группами, выбранными из заместителей, указанных выше для арильной группы.
2. Соединения формулы (I) по п.1, отличающиеся тем, что n обозначает целое число от 0 до 2 включительно, их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
3. Соединения формулы (I) по п.1, отличающиеся тем, что каждый из R1 и R2, которые могут быть одинаковыми или разными, обозначает водородный атом или линейную или разветвленную (C1-C6)алкильную группу, их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
4. Соединения формулы (I) по п.1, отличающиеся тем, что X обозначает кислородный атом, их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
5. Соединения формулы (I) по п.1, отличающиеся тем, что Y обозначает группу, выбранную из -C(O)NR3R4, где R3 и R4 имеют такие же значения, как указанные для формулы (I), ацетила, -C(O)-гетероарила, арил-C1-C6алкила, который включает линейный или разветвленный алкильный остаток, и гетероарила, их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
6. Соединения формулы (I) по п.1, отличающиеся тем, что Y обозначает пиридильную группу, их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
7. Соединения формулы (I) по п.1, отличающиеся тем, что они представляют собой соединения формулы (IA)
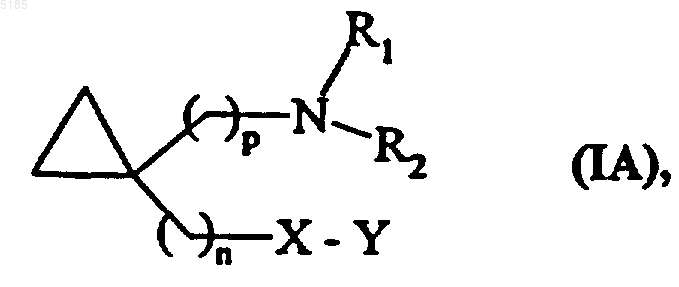
в которой n, p, X, Y, R1 и R2 имеют такие же значения, как указанные для формулы (I), их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
8. Соединения формулы (I) по п.1, отличающиеся тем, что они представляют собой соединения формулы (IB)

в которой n, p, X, Y, R1 и R2 имеют такие же значения, как указанные для формулы (I), их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
9. Соединения формулы (I) по п.1, отличающиеся тем, что р обозначает целое число, значение которого составляет 0 или 1, их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
10. Соединения формулы (IB) по п.8, отличающиеся тем, что р обозначает 0 или 1, n обозначает 0 или 1, каждый из R1 и R2, которые могут быть одинаковыми или разными, обозначает водородный атом или линейную или разветвленную (C1-C6)алкильную группу, X обозначает кислородный атом, а Y обозначает группу, выбранную из фенил(C1-C6)алкила, в котором алкильный остаток является линейным или разветвленным, пиридила и -C(O)-A, где A обозначает линейную или разветвленную (C1-C6)алкильную группу, моно(C1-C6)алкиламино- или ди(C1-C6)алкиламиногруппу, в которой алкильный остаток(остатки) является линейным или разветвленным, их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
11. Соединения формулы (IA) по п.7, отличающиеся тем, что p обозначает 0 или 1, n обозначает целое число от 0 до 3 включительно, каждый из R1 и R2, которые могут быть одинаковыми или разными, обозначает водородный атом, линейную или разветвленную (C1-C6)алкильную группу или совместно с азотным атомом, с которым они связаны, они образуют пирролидинильный радикал, X обозначает кислородный атом, атом серы или группу -CH=CH-, а Y обозначает группу, выбранную из фенила (необязательно замещенного гидроксильной группой, линейной или разветвленной (C1-C6)алкильной группой или атомом галогена), пиридила, пиридил(C1-C6)алкила, в котором алкильный остаток является линейным или разветвленным (причем пиридильный радикал в каждой из этих групп необязательно замещен группой, выбранной из атома галогена и линейной или разветвленной (C1-C6)алкильной группы), и -C(O)-A, где A обозначает группу, выбранную из линейного или разветвленного (C1-C6)алкила, линейного или разветвленного моно(C1-C6)алкиламино-, линейной или разветвленной ди-C1-C6алкиламиногруппы и пиридила, их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
12. Соединения формулы (I) по п.1, которые представляют собой
2-[1-(диметиламино)циклопропил]этилметилкарбамат,
2-[1-(диметиламино)циклопропил]этилдиметилкарбамат,
[1-(диметиламино)циклопропил]метилдиметилкарбамат,
[1-(диметиламино)циклопропил]метилацетат,
2-[1-(диметиламино)циклопропил]этилацетат,
1-[(диметиламино)метил]циклопропилацетат,
[1-(диметиламино)циклопропил]метилникотинат,
N,N-диметил-l-[(3-пиридилокси)метил]циклопропанамин,
N-метил-1-[(3-пиридилокси)метил]циклопропанамин,
N,N-диметил-1-[(3-пиридилметокси)метил]циклопропанамин,
N,N-диметил-1-[2-(3-пиридилокси)этил]циклопропанамин,
4-{[2-[1-(диметиламино)циклопропил]этил]сульфанил}фенол,
(+)-цис-2-(диметиламино)циклопропилметилкарбамат,
(+)-транс-2-(диметиламино)циклопропилметилкарбамат,
(+)-цис-2-(диметиламино)циклопропилацетат,
(+)-транс-2-(диметиламино)циклопропилацетат,
(+)-цис-2-(диметиламино)циклопропилметилацетат,
(+)-транс-2-(диметиламино)циклопропилметилацетат,
(+)-цис-2-[(бензилокси)метил]-N,N-диметилциклопропанамин,
(+)-транс-2-[(бензилокси)метил]-N,N-диметилциклопропанамин,
(+)-транс-2-[(диметиламино)метил]циклопропилацетат,
дигидрохлорид 1-[(3-пиридилокси)метил]циклопропанамина,
гидрохлорид N-метил-1-{[(6-метил-3-пиридил)окси]метил}циклопропанамина,
гидрохлорид N-метил-1-{[(6-хлор-3-пиридил)окси]метил}циклопропанамина,
гидрохлорид N-{1-[(3-фторфенокси)метил]циклопропил}-N-метиламина,
фумарат 3-[1-(диметиламино)циклопропил]пропилдиметилкарбамата,
фумарат 3-[1-(диметиламино)циклопропил]пропилметилкарбамата,
дигидрохлорид N-метил-1-[(2-пиридилсульфанил)метил]циклопропанамина,
дигидрохлорид N-метил-1-[3-(3-пиридилокси)пропил]циклопропанамина,
дигидрохлорид N-метил-1-[2-(3-пиридил)этил]циклопропанамина,
фумарат N-метил-1-[(Z)-2-(3-пиридил)этенил]циклопропанамина,
фумарат [1-(1-пирролидинил)циклопропил]метилдиметилкарбамата,
гидрохлорид N,N-диметил-1-[2-(3-пиридил)этил]циклопропанамина,
фумарат 3-{[1-(1-пирролидинил)циклопропил]метокси}пиридина,
фумарат N-метил-1-[2-(3-пиридилокси)этил]циклопропанамина,
гидрохлорид 2-[1-(метиламино)циклопропил]этилдиметилкарбамата и
фумарат 2-[1-(1-пирролидинил)циклопропил]этилдиметилкарбамата,
их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
13. Способ получения соединений формулы (I), отличающийся тем, что при его осуществлении в качестве исходного материала используют соединение формулы (II)
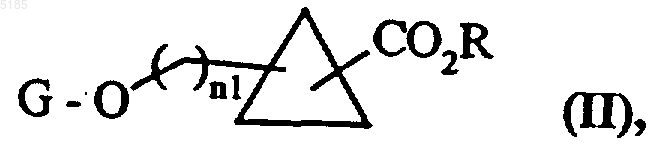
в которой G обозначает защитную группу для гидроксильных функциональных групп, которую обычно применяют в органическом синтезе, R обозначает водородный атом или линейную или разветвленную (C1-C6)алкильную группу, а n1 обозначает 0 или 1,
причем соединения формулы (II)
либо вводят во взаимодействие с жидким аммиаком в присутствии цианида щелочного металла в спиртовом растворителе с получением соединений формулы (III)
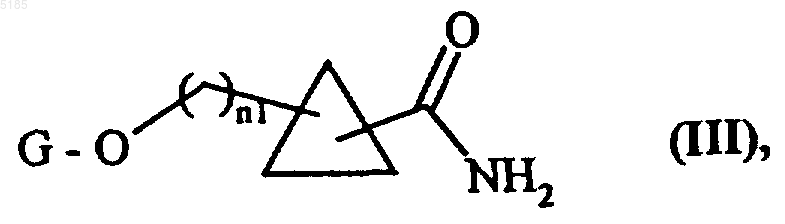
в которой G обозначает защитную группу для гидроксильных функциональных групп, а n1 обозначает 0 или 1,
и соединения формулы (III) обрабатывают дигалогенидом в присутствии основания, такого как гидроксид натрия, с получением соединений формулы (IV)
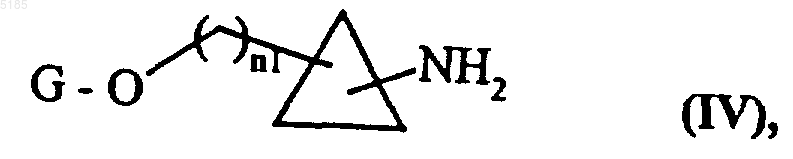
в которой G и n1 имеют значения, указанные выше,
первичную аминогруппу соединений формулы (IV) селективно защищают защитной группой G2, обычно применяемой в органической химии, такой как БОК (трет-бутоксикарбонил), с получением соединений формулы (V)
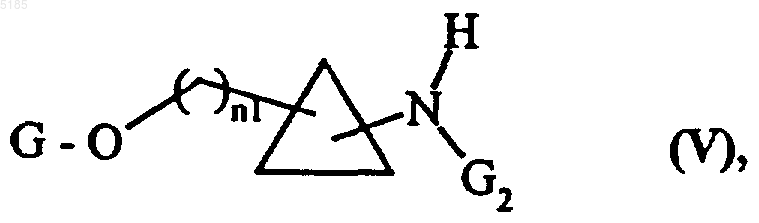
в которой n1, G и G2 имеют такие же значения, как указанные выше,
после чего соединения формулы (V) последовательно обрабатывают в основной среде соединением формулы (VIA)
R1-L1 (VIA),
в которой R1 имеет такие же значения, как указанные для формулы (I), а L1 обозначает обычную для органического синтеза уходящую группу,
защитную группу, у аминогруппы которых далее удаляют, и соединения
либо не подвергают никакой последующей обработке и в результате получают соединения формулы (VIIA)
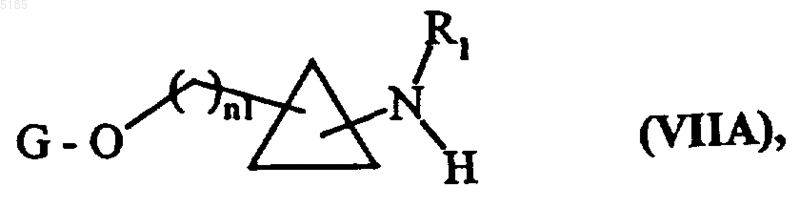
в которой R1, n1 и G имеют значения, указанные выше,
либо вводят во взаимодействие с соединением формулы (VIB)
R2a-L1 (VIB),
в которой R2a имеет такие же значения, как R2, которые указаны для формулы (I), за исключением водородного атома, а значения L1 указаны выше, получая соединения формулы (VIIB)

в которой R1, R2a, n1 и G имеют такие же значения, как указанные выше, причем совокупность соединений формул (VIIA) и (VIIB) образует соединения формулы (VII)
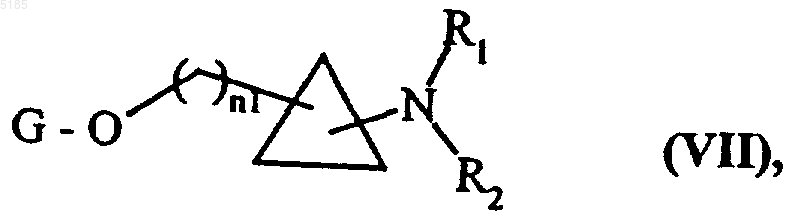
в которой n1, G, R1 и R2a, имеют такие же значения, как указанные выше,
защитную группу для гидроксильной группы соединений формулы (VII) удаляют, после чего соединения
либо обрабатывают соединением формулы (VIII)
Y-L1 (VIII),
в которой Y имеет такие же значения, как указанные для формулы (I), р L1 имеет такие же значения, как указанные выше, получая соединения формулы (I/a) как частный случай соединений формулы (I)
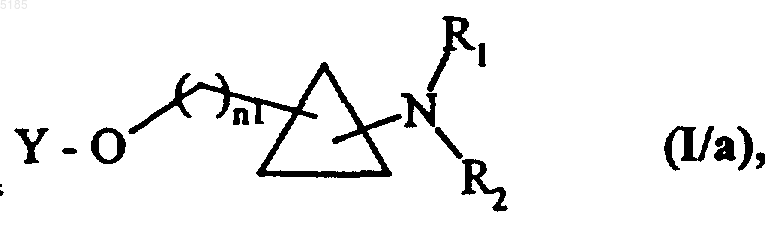
в которой n1, Y, R1 и R2 имеют такие же значения, как указанные для формулы (I),
либо обрабатывают SOCl2 с получением соединений формулы (IX)
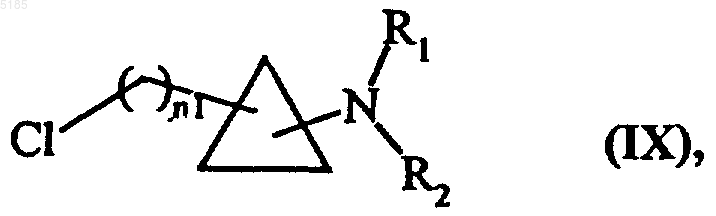
в которой n1, R1 и R2 имеют такие же значения, как указанные выше,
проводят реакцию соединений формулы (IX) в основной среде с соединением формулы (X)
Y1-SH (X),
в которой Y1 обозначает арильную группу, арил(C1-C6)алкильную группу, в которой алкильный остаток является линейным или разветвленным, гетероарильную группу или гетероарил(C1-C6)алкильную группу, в которой алкильный остаток является линейным или разветвленным, с получением соединений формулы (I/b) как частный случай соединений формулы (I)
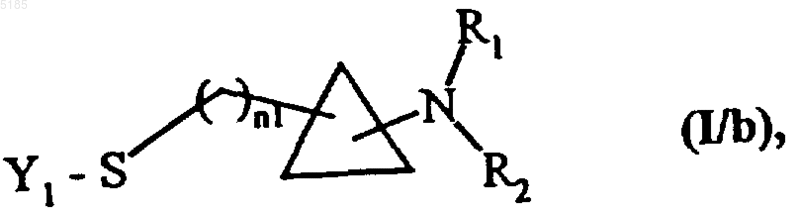
в которой Y1, n1, R1 и R2 имеют такие же значения, как указанные выше,
либо, когда n1 обозначает 1, обрабатывают воздействием обычного для органического синтеза окислителя, получая соединения формулы (XI)
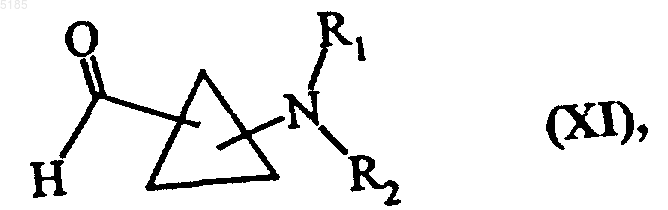
в которой R1 и R2 имеют такие же значения, как указанные выше,
и соединения формулы (XI)
либо обрабатывают гидроксиламином формулы (XII)
H2N-OY2 (XII),
в которой Y2 обозначает водородный атом или группу Y1, которая имеет указанные выше значения, получая соединения формулы (I/c) как частный случай соединений формулы (I)
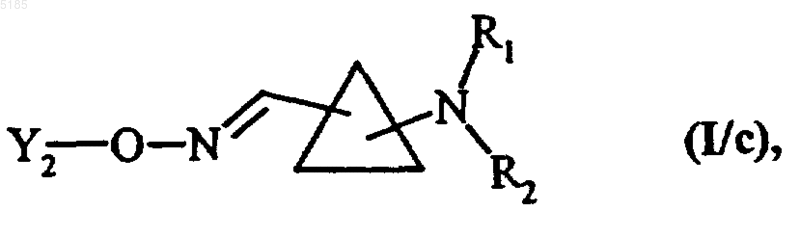
в которой Y2, R1 и R2 имеют такие же значения, как указанные выше,
соединения формулы (I/c), у которых в частном случае Y2 обозначает водородный атом, обрабатывают воздействием соединения формулы (XIV)
Y3-L1 (XIV),
в которой L1 имеет такие же значения, как указанные выше, а Y3 обозначает группу формулы -C(O)-A или -C(S)-A, значения которой указаны в описании формулы (I), получая соединения формулы (I/d) как частный случай соединений формулы (I)
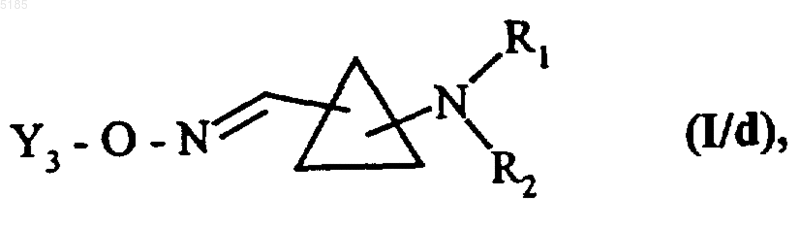
в которой Y3, R1 и R2 имеют такие же значения, как указанные выше,
либо обрабатывают в условиях проведения реакции Виттига, а затем обрабатывают воздействием обычного для органического синтеза восстановителя, получая соединения формулы (I/e) как частный случай соединений формулы (I)
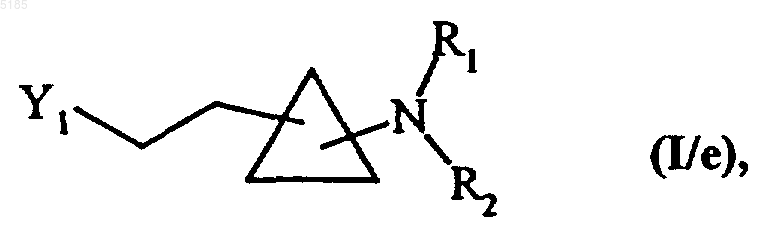
в которой Y1, R1 и R2 имеют такие же значения, как указанные выше,
либо обрабатывают воздействием соединения формулы Ph3P=CH-CO2Et, а затем восстанавливают воздействием обычного для органического синтеза восстановителя, получая соединения формулы (XV)
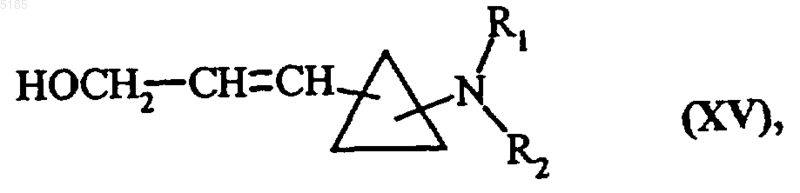
в которой R1 и R2 имеют такие же значения, как указанные выше,
соединения формулы (XV) обрабатывают соединением формулы (VIII), которая описана выше, получая соединения формулы (I/f) как частный случай соединений формулы (I)
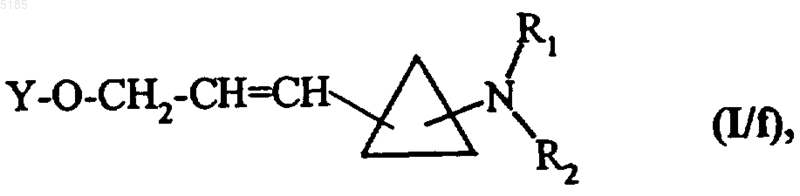
в которой Y1, R1 и R2 имеют такие же значения, как указанные для формулы (I),
либо, когда n1 обозначает 1, превращают в их соответствующие галоидированные производные в обычных для процессов в органической химии условиях, а затем вводят во взаимодействие с цианидом щелочного металла в среде диметилсульфоксида с получением соединений формулы (XVI)
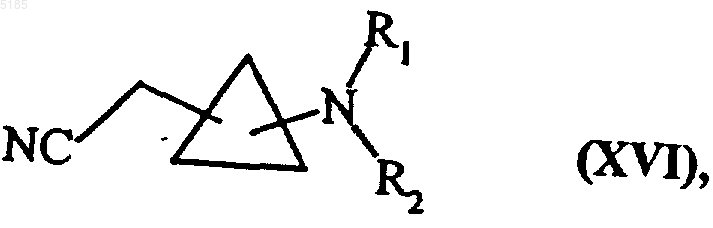
в которой R1 и R2 имеют такие же значения, как указанные выше,
и соединения формулы (XVI) в обычных условиях превращают в сложные эфиры, а затем обрабатывают восстановителем с получением соединений формулы (XVIIA)
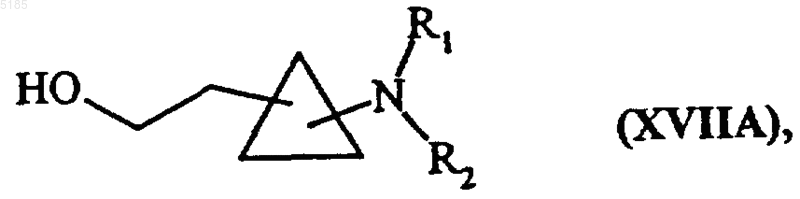
в которой R1 и R2 имеют такие же значения, как указанные выше, и соединения формулы (XVIIA) можно подвергать вновь, повторно тому же самому ряду обработок, в результате которых получают соединения формул (XVI) и (XVIIA), с получением соединений формулы (XVIIB)

в которой R1 и R2 имеют такие же значения, как указанные выше, а n3 обозначает целое число от 3 до 6 включительно, причем совокупность соединений формул (XVIIA) и (XVIIB) образует соединения формулы (XVIII)
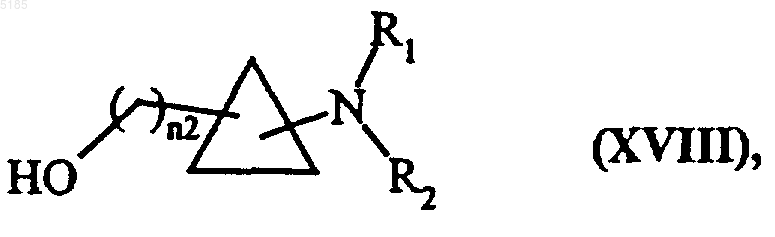
в которой R1 и R2 имеют такие же значения, как указанные выше, а n2 обозначает целое число от 2 до 6 включительно, и соединения формулы (XVIII)
либо вводят во взаимодействие с соединением формулы Y-L1, которая описана выше, получая соединения формулы (I/g) как частный случай соединений формулы (I)
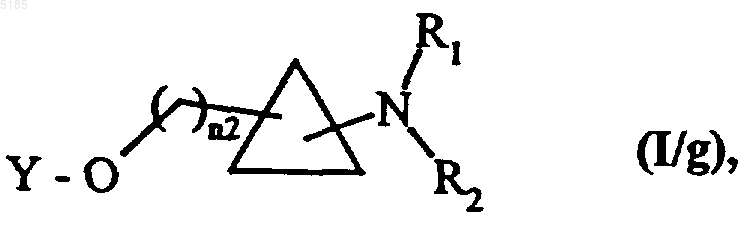
в которой Y, n2, R1 и R2 имеют такие же значения, как указанные выше,
либо вводят во взаимодействие с SOCl2 и затем обрабатывают соединением формулы (X), которая описана выше, получая соединения формулы (I/h) как частный случай соединений формулы (I)

в которой Y1, n2, R1 и R2 имеют такие же значения, как указанные выше,
либо обрабатывают воздействием окислителя, после чего проводят реакцию полученного альдегидного промежуточного продукта с гидроксиламином формулы (XII), которая описана выше и в которой Y2 конкретно обозначает водородный атом, а затем, если необходимо, полученные соединения обрабатывают воздействием соединения формулы (XIV), которая описана выше, получая соединения формулы (I/i) как частный случай соединений формулы (I)
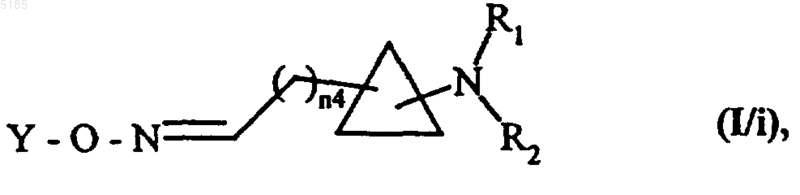
в которой R1, R2 и Y имеют такие же значения, как указанные для формулы (I), а n4 обозначает целое число, значение которого равно (n2-1), где n2 имеет такие же значения, как указанные выше,
либо после обработки воздействием окислителя обрабатывают в условиях проведения реакции Виттига, а затем обрабатывают в обычных для органического синтеза восстановительных условиях, получая соединения формулы (I/j) как частный случай соединений формулы (I)
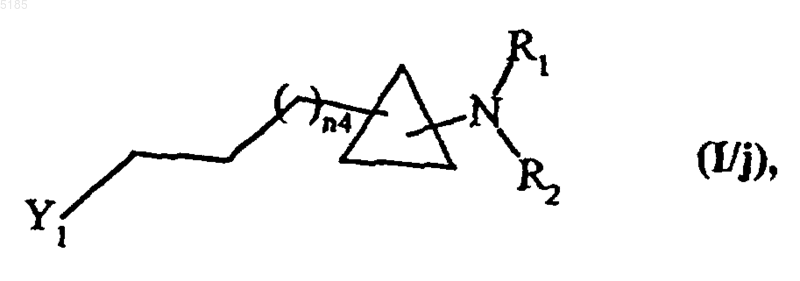
в которой Y1, n4, R1 и R2 имеют такие же значения, как указанные выше,
либо в присутствии Me3Al в неполярном растворителе вводят во взаимодействие с соединением формулы (XIX)
HNR1R2 (XIX),
в которой R1 и R2 имеют такие же значения, как указанные для формулы (I), с получением соединений формулы (XX)
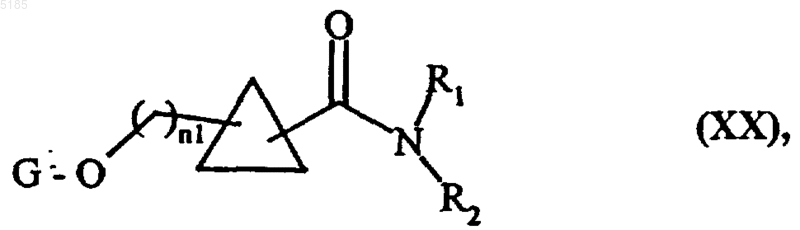
в которой n1, G, R1 и R2 имеют такие же значения, как указанные выше, и соединения формулы (XX) обрабатывают воздействием восстановителя, который обычно используют в органичесъюь синтезе, с получением соединений формулы (XXI)
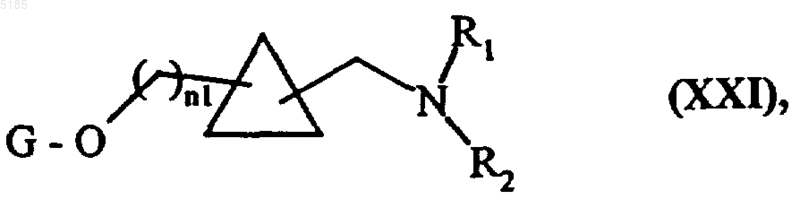
в которой G, n1, R1 и R2 имеют такие же значения, как указанные выше, и соединения формулы (XXI) можно вводить во всю совокупность тех взаимодействий, в которых участвуют соединения формулы (VII), с получением соединений формулы (I/k) как частный случай соединений формулы (I)
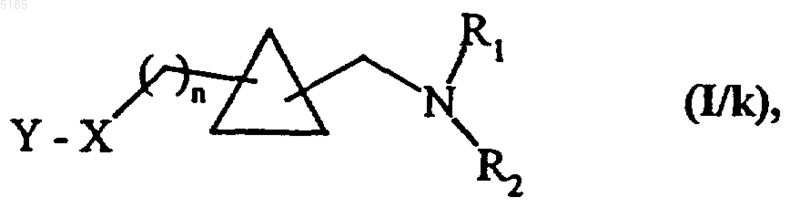
в которой X, Y, n, R1 и R2 имеют такие же значения, как указанные для формулы (I),
либо вводят во взаимодействие с тионилхлоридом, когда R обозначает водородный атом, а затем помещают в водную среду в присутствии диазометана с получением соединений формулы (XXII)
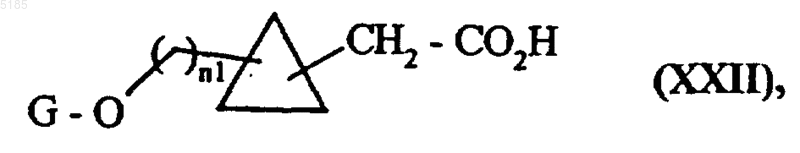
в которой n1 и G имеют такие же значения, как указанные выше,
и соединения формулы (XXII) можно вновь вводить несколько раз в такой же ряд взаимодействий с получением соединений формулы (XXIII)

в которой n1 и G имеют такие же значения, как указанные выше, а p1 обозначает целое число от 2 до 6 включительно, и
соединения формулы (XXIII) вводят во взаимодействие с дифенилфосфорилазидом, гидролизуют, а затем обрабатывают соединением формулы (VIA), как изложено выше, с получением соединений формулы (XXIV)
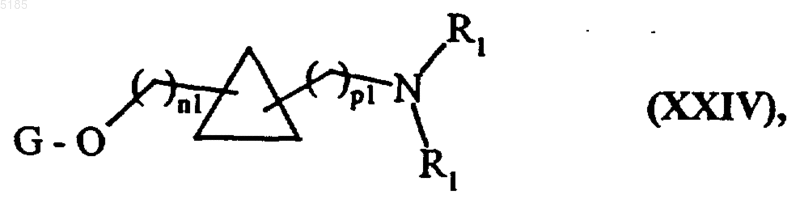
в которой R1 имеет такие же значения, как указанные для формулы (I), а G, n1 и p1 имеют такие же значения, как указанные выше,
и соединения формулы (XXIV) можно вводить во всю совокупность тех взаимодействий, в которых участвуют соединения формулы (VII), с получением соединений формулы (I/l) как частный случай соединений формулы (I)
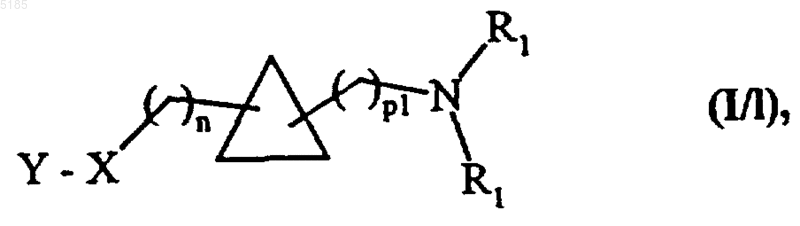
в которой X, Y, R1 и n имеют такие же значения, как указанные для формулы (I), а p1 имеет такие же значения, как указанные выше,
причем совокупность соединений формул с (I/a) по (I/l) составляет всю совокупность соединений по изобретению, которые очищают, когда это соответствует необходимости, согласно обычной технологии очистки, которые можно разделять на их различные изомеры в соответствии с обычной технологией разделения и которые превращают, когда это соответствует необходимости, в их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
14. Фармацевтические композиции, в качестве действующего компонента включающие по меньшей мере одно соединение по одному любому из пп. с 1 по 12 отдельно или в сочетании с одним или несколькими инертными, нетоксичными, фармацевтически приемлемыми наполнителями или носителями.
15. Фармацевтические композиции по п.14, включающие по меньшей мере один действующий компонент по одному любому из пп. с 1 по 12 для использования в качестве никотинового лиганда a4b2-рецепторов.
16. Фармацевтические композиции по п.14, включающие по меньшей мере один действующий компонент по одному любому из пп. с 1 по 12 для применения при лечении недостаточности памяти, связанной со старением головного мозга и с нейродегенеративными заболеваниями, а также для лечения нарушений настроения, синдрома Туретта, синдрома гиперактивности с недостаточностью внимания, вызванной резким прекращением курения и болями.
17. Фармацевтические композиции по п.14, включающие по меньшей мере один действующий компонент по одному любому из пп. с 1 по 12 для применения при лечении недостаточности памяти, связанной с болезнью Альцгеймера, болезнью Паркинсона, болезнью Пика, болезнью Корсакова или опухолью лобной доли и субкортикальной деменции.
Текст
1 Настоящее изобретение относится к новым 1,1- и 1,2-дизамещенным циклопропановым производным, способу их получения и содержащим их фармацевтическим композициям. Соединения по настоящему изобретению представляют особую ценность с фармакологической точки зрения, поскольку вследствие их специфического взаимодействия с никотиновыми рецепторами типа 42 центральной нервной системы они могут применяться для лечения невропатологии, связанных со старением головного мозга, нарушений психического состояния, боли и синдрома отказа от табака. Старение населения вследствие увеличения ожидаемой продолжительности жизни при рождении сопровождается существенным увеличением количества случаев, связанных с возрастом невропатологий и прежде всего заболеваний болезнью Альцгеймера. Основными клиническими симптомами старения головного мозга и прежде всего связанных с возрастом невропатологии являются дефициты мнемонической и когнитивной функций, которые могут приводить к деменции. Широко известно, что среди различных нейромедиаторов ацетилхолин играет основную роль в функциях памяти и что при определенных нейродегенеративных болезнях или при наличии неадекватной активации,как в случае старения головного мозга, происходит крупномасштабное разрушение холинергических нейронных путей. По этой причине многочисленные терапевтические подходы были нацелены на предотвращение разрушения нейромедиатора путем ингибирования ацетилхолинэстеразы или направлены на поиск заместителя, восполняющего дефицит нейромедиатора. В последнем случае были предложены холинергические агонисты мускаринового типа, специфические для постсинаптических рецепторовM1. В последнее время было установлено, что холинергическое ухудшение, связанное с болезнью Альцгеймера, воздействует на нейроны,несущие никотиновые рецепторы, в большей степени, чем на нейроны, несущие мускариновые рецепторы (Schroder и др., "Alzheimer disease: therapeutic strategies", Birkhauser Boston,181-185, 1994). Кроме того, результаты многочисленных исследований свидетельствуют о том, что никотин обладает стимулирующими память свойствамиNeuropsychopharmacol., 16, 181-191, 1992) и что благодаря этим свойствам он влияет как на мнемонические функции (Psychopharmacol., 123,88-97, 1996), так и на способность к вниманию и активность ЦНС (Psychopharmacol., 118: 195205, 1994). Кроме того, никотин оказывает нейрозащитные действия по сравнению с экситотоксичными агентами, такими как глутамат(Brain Res., 644, 181-187, 1994). Очень вероятно, что все эти данные могут согласоваться с результатами эпидемиологиче 005185 2 ских исследований, которые свидетельствуют о малом количестве случаев заболевания болезнью Альцгеймера и болезнью Паркинсона у курильщиков. Кроме того, в некоторых исследованиях было установлено, что никотин может применяться для лечения нарушений психического равновесия, таких как состояния депрессии, страха или шизофрения. Наконец, установлено, что никотин обладает анталгическими свойствами. Все терапевтические свойства никотина, а также свойства, описанные для других никотиновых агентов, основаны на активности в отношении рецепторов центральной нервной системы, которые структурно и фармакологически отличаются от периферических рецепторов(рецепторов мышц и ганглия). Для центральной нервной системы наиболее характерными являются рецепторы типа 42 и они обусловливают большую часть терапевтических воздействий никотина (Life Sci., 56, 545-570, 1995). В некоторых публикациях, таких как Synlett., 7, 1053-1054, 1999; J. Med. Chem. 28(12),1953-1957, 1985 и 23(3), 339-341, 1980; 13(5),820-826, 1970; 15(10), 1003-1006, 1972; J. Am.DE 3608727, ЕР 124208 или WO 94/10158, описаны и заявлены соединения, содержащие 1,1 или 1,2-дизамещенный циклопропановый фрагмент. Ни в одной из этих ссылок не описано или не сделано предположение о том, что эти соединения обладают фармакологической активностью, специфической в отношении никотиновых рецепторов, и более конкретно в отношении никотиновых рецепторов типа 42 центральной нервной системы, что является новым свойством соединений, описанных авторами. Таким образом, в прототипах нет никакой информации, на основе которой можно было бы предсказать специфические и неожиданные характеристики продуктов, описанных в настоящей заявке. Таким образом, соединения по настоящему изобретению являются новыми и они представляют собой обладающие выраженным избирательным действием лиганды никотинового рецептора подтипа 42 центральной нервной системы. Поэтому они могут применяться для лечения дефицитов памяти, связанных со старением головного мозга и нейродегенеративными болезнями, такими как болезнь Альцгеймера,болезнь Паркинсона, болезнь Пика, болезнь Корсакова и деменции передней доли и подкорки головного мозга, а также для лечения нарушений психического равновесия, синдрома Туретта, синдрома гиперактивности, сопровождающегося дефицитом внимания, синдрома отказа от табака и боли. Объектом настоящего изобретения являются соединения формулы (I) в которой р обозначает целое число от 0 до 6 включительно,n обозначает целое число от 0 до 6 включительно,R1 и R2, которые могут быть одинаковыми или разными, каждый независимо друг от друга обозначает группу, выбранную из атома водорода, линейной или разветвленной (С 1-С 6) алкильной группы, арильной группы и арил(С 1-С 6) алкильной группы, которая содержит линейный или разветвленный алкильный остаток, или R1 +R2 совместно с азотным атомом, с которым они связаны, образуют насыщенную моноциклическую или бициклическую систему, включающую от 3 до 10 членов, необязательно содержащую второй гетероатом, выбранный из атомов кислорода, азота и серы,X обозначает группу, выбранную из атома кислорода, атома серы, группы -СН = СН-, метилена, группы формулы -HC = N-O- и группы формулы -О-СН 2-СН = СН-, причем в соединениях формулы (I) кислородный атом этих групп связан с остатком Y,Y обозначает группу, выбранную из арила,гетероарила, арил(С 1-С 6)алкила, в котором алкильный остаток является линейным или разветвленным, гетероарил(С 1-С 6)алкила, который содержит линейный или разветвленный алкильный остаток, -С(О)-А и -C(S)-A,А обозначает группу, выбранную из линейного или разветвленного (C1-С 6)алкила, арила, гетероарила, арил(С 1-С 6)алкила, в котором алкильный остаток является линейным или разветвленным, гетероарил(С 1-С 6)алкила, в котором алкильный остаток является линейным или разветвленным, и NR3-R4, где каждый из R3 иR4, которые могут быть одинаковыми или разными, обозначает группу, выбранную из водородного атома, линейной или разветвленной С 1 С 6 алкильной группы, арильной группы и арил(С 1-С 6)алкильной группы, в которой алкильный остаток является линейным или разветвленным, или R3 + R4 совместно с азотным атомом, с которым они связаны, образуют моноциклическую или бициклическую (С 3 С 10)систему,их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием, при условии, что в случае 1,1-дизамещенных соединений формулы (I) р имеет значения, отличные от нуля, когда X обозначает метиленовую группу, n обозначает ноль, Y обозначает арильную или гетероарильную группу, а каждый из R1 и R2, которые могут быть одинаковыми или разными, обозначает водородный атом, линейную или разветвленную (С 1-С 4)алкильную группу, бензильную группу, фенилэтильную группу или совместно с азотным ато 005185 4 мом, с которым они связаны, образуют морфолиновую группу, тиоморфолиновую группу или насыщенную карбоциклическую систему,включающую от 5 до 7 членов,р имеет значения, отличные от нуля, когдаX обозначает метиленовую группу, n обозначает ноль, Y обозначает ацетильную группу, а каждый из R1 и R2, которые могут быть одинаковыми или разными, обозначает водородный атом,линейную или разветвленную (С 1-С 4)алкильную группу, фенильную группу, бензильную группу или совместно с азотным атомом, с которым они связаны, образуют пиперидильную или морфолиновую группу, R1 и R2 одновременно не могут обозначать метальные группы; либо когда каждый из р и n обозначает 1, X обозначает кислородный атом, a Y обозначает группу, выбранную из n-нитробензоила, nаминобензоила,n-хлорфениламинокарбонила или ацетила,либо когда р обозначает ноль, n обозначает 1, X обозначает кислородный атом или атом серы, a Y обозначает 2-хинолильную группу,замещенную в 3-м положении линейной или разветвленной (С 3-С 4)алкильной группой, или фенильную группу, Y не обозначает 1,2 бензизоксазол-3-ильную группу, когда n обозначает 1, р обозначает ноль, а X обозначает кислородный атом,в случае 1,2-дизамещенных соединений формулы (I) R1 и R2 одновременно не могут обозначать водородный атом, когда каждый из р и n обозначает ноль, а X и Y совместно обозначают феноксигруппу (необязательно замещенную одной или двумя одинаковыми или разными группами, выбранными из метокси, диметиламиногруппы, атома галогена, метила, трифторметила, нитро- и аминогрупп), фенилсульфанильную группу, бензилоксигруппу, бензильную группу или 2-фенилэтильную группу,R1 и R2 одновременно не могут обозначать метальные группы, когда каждый из р и n обозначает ноль, а X и Y совместно обозначают феноксигруппу (необязательно замещенную группой, выбранной из атома хлора и трифторметила), фенилсульфанильную группу или бензильную группу, а также при условии, что соединения формулы (I) отличны от следующих соединений:(1-бензилциклопропил)метанамин,(1-бензилциклопропил)-N,N-диметилметанамин,2-(феноксициклопропил)метанамин,2-(феноксиметил)циклопропанамин,(N,N-диметил)-2-(ацетоксиметил)циклопропанметанамин,N-2-[2-(бензилокси)этил]циклопропилN,N-диметиламин. Под арильной группой подразумевают фенильную, дифенильную, нафтильную, дигидронафтильную, тетрагидронафтильную, инданильную или инденильную группу, причем ка 5 ждая из этих групп необязательно замещена одной или несколькими одинаковыми или разными группами, выбранными из атомов галогена, линейной или разветвленной (С 1-С 6)алкильной, гидроксильной, циано-, нитрогрупп, линейной или разветвленной (С 1-С 6)алкокси, линейной или разветвленной С 2-С 7 ацильной, линейной или разветвленной С 1-С 6 алкоксикарбонильной, линейной или разветвленной С 1-С 6 тригалоалкильной, линейной или разветвленной С 1-С 6 тригалоалкоксигруппы и аминогрупп, необязательно замещенных одной или двумя линейными или разветвленными алкильными С 1C6 группами. Под гетероарильной группой подразумевают моноциклическую ароматическую или бициклическую систему, включающую от 5 до 12 членов, содержащую от одного до трех одинаковых или разных гетероатомов, выбранных из атомов кислорода, азота и серы, одно из колец которой в случае бициклической системы обладает ароматическим характером, а другое кольцо которой может быть ароматическим или частично гидрогенизированным, причем каждая из этих групп необязательно замещена одной или несколькими одинаковыми или разными группами, выбранными из заместителей, указанных выше для арильной группы. В общем 1,1-дизамещенные и 1,2-дизамещенные соединения относятся к соединениям, включающим соответственно остатки Среди фармацевтически приемлемых кислот можно упомянуть, хотя ими их список не ограничен,соляную кислоту,бромистоводородную кислоту, серную кислоту, фосфорную кислоту, уксусную кислоту, трифторуксусную кислоту, молочную кислоту, пировиноградную кислоту, малоновую кислоту, янтарную кислоту, глутаровую кислоту, фумаровую кислоту, винную кислоту, малеиновую кислоту,лимонную кислоту, аскорбиновую кислоту, щавелевую кислоту, метансульфоновую кислоту,камфорную кислоту и т.д. Среди фармацевтически приемлемых оснований можно упомянуть, хотя ими их список не ограничен, гидроксид натрия, гидроксид калия, триэтиламин, трет-бутиламин и т.д. Предпочтительными соединениями по изобретению являются те соединения, у которых n обозначает целое число от 0 до 2 включительно. Предпочтительными соединениями по изобретению являются те соединения, у которых р обозначает 0 или 1. Предпочтительными в соответствии с изобретением заместителями R1 и R2 являются водородный атом и линейная или разветвленная алкильная C1-С 6 группа. 6 Заместителем X, который предпочтителен в соответствии с изобретением, является кислородный атом. Заместителями Y, которые предпочтительны в соответствии с изобретением, являются группы, выбранные из -C(O)NR3R4, где R3 и R4 имеют такие же значения, как указанные для формулы (I), ацетила, -С(О)-гетероарила, арилС 1-С 6 алкила, который включает линейный или разветвленный алкильный остаток, и гетероарила. Предпочтительной гетероарильной группой среди охватываемых значениями Y является пиридильная группа. В соответствии с предпочтительным вариантом выполнения изобретения предпочтительными соединениями являются 1,1-дизамещенные соединения формулы (I), отвечающие формуле (IA) в которой n, р, X, Y, R1 и R2 имеют такие же значения, как указанные для формулы (I). В соответствии с другим предпочтительным вариантом выполнения изобретения предпочтительными соединениями являются 1,2 дизамещенные соединения формулы (I), отвечающие формуле (IB) в которой n, р, X, Y, R1 и R2 имеют такие же значения, как указанные для формулы (I). В особенно предпочтительном варианте предпочтительные соединения по изобретению представляют собой соединения формулы (IB),в которой р обозначает 0 или 1, n обозначает 0 или 1, каждый из R1 и R2, которые могут быть одинаковыми или разными, обозначает водородный атом или линейную или разветвленную алкильную C1-C6 группу, Х обозначает кислородный атом, а Y обозначает группу, выбранную из фенил-C1-C6-алкила, содержащего линейный или разветвленный алкильный остаток,пиридила и -С(О)-А, где А обозначает линейную или разветвленную алкильную C1-C6 группу, моно-C1-С 6 алкиламино- или ди-C1-C6 алкиламиногруппу, содержащую линейный или разветвленный алкильный остаток (остатки). В другом особенно предпочтительном варианте предпочтительные соединения по изобретению представляют собой соединения формулы (IA),в которой р обозначает 0 или 1, n обозначает целое число от 0 до 3 включительно,каждый из R1 и R2, которые могут быть одинаковыми или разными, обозначает водородный атом или линейную или разветвленную алкильную C1-C6 группу или совместно с азотным атомом, с которым они связаны, они образуют пирролидинильный радикал, X обозначает кисло 7 родный атом, атом серы или группу -СН = СН-,a Y обозначает группу, выбранную из фенила(необязательно замещенного гидроксильной группой, линейной или разветвленной алкильной C1-C6 группой или атомом галогена), пиридила, пиридил-C1-C6 алкила, содержащего линейный или разветвленный алкильный остаток(причем пиридильный радикал в каждой из этих групп необязательно замещен группой, выбранной из атома галогена и линейной или разветвленной алкильной C1-C6 группу), и -С(О)-А, где А обозначает группу, выбранную из линейного или разветвленного C1-C6 алкила, линейного или разветвленного моно-C1-C6 алкиламино-, линейной или разветвленной ди-C1-C6 алкиламиногруппы и пиридила. В особенно предпочтительном варианте предпочтительные соединения по изобретению представляют собой: 2-[1-(диметиламино)циклопропил]этилметилкарбамат,2-[1-(диметиламино)циклопропил]этилдиметилкарбамат,[1-(диметиламино)циклопропил]метилдиметилкарбамат,[1-(диметиламино)циклопропил]метилацетат,2-[1-(диметиламино)циклопропил]этилацетат,1-[(диметиламино)метил]циклопропилацетат,[1-(диметиламино)циклопропил]метилникотинат,N,N-диметил-1-[(3-пиридилокси)метил] циклопропанамин,N-метил-1-[(3-пиридилокси)метил]циклопропанамин,N,N-диметил-1-[(3-пиридилметокси)метил]циклопропанамин,N,N-диметил-1-[2-(3-пиридилокси)этил] циклопропанамин,4-[2-[1-(диметиламино)циклопропил] этил]сульфанилфенол,-цис-2-(диметиламино)циклопропилметилкарбамат,-транс-2-(диметиламино)циклопропилметилкарбамат,-цис-2-(диметиламино)циклопропилацетат,-транс-2-(диметиламино)циклопропилацетат,-цис-2-(диметиламино)циклопропилметилацетат,-транс-2-(диметиламино)циклопропилметилацетат,-цис-2-[(бензилокси)метил]-N,N-диметилциклопропанамин,-транс-2-[(бензилокси)метил]-N,N-диметилциклопропанамин,-транс-2-[(диметиламино)метил]циклопропилацетат, 005185N-метил-1-[2-(3-пиридилокси) этил]циклопропанамина,гидрохлорид 2-[1-(метиламино)циклопропил]этилдиметилкарбамата и фумарат 2-[1-(1-пирролидинил)циклопропил]этилдиметилкарбамата. Единое целое с объектами изобретения составляют изомеры, равно как и аддитивные соли предпочтительных соединений с фармацевтически приемлемой кислотой или основанием. Объектом настоящего изобретения является также способ получения соединений формулы (I), который характеризуется тем, что при его осуществлении в качестве исходного материала используют соединение формулы (II) в которой G обозначает защитную группу для гидроксильных функциональных групп, которую обычно применяют в органическом синтезе, R обозначает водородный атом или линейную или разветвленную алкильную C1-C6 группу, a n обозначает 0 или 1,причем соединения формулы (II) либо вводят во взаимодействие с жидким аммиаком в присутствии цианида щелочного металла в спиртовом растворителе с получением соединений формулы (III) в которой G обозначает защитную группу для гидроксильных функциональных групп, a n1 обозначает 0 или 1, и соединения формулы (III) обрабатывают дигалогенидом в присутствии основания, такого как гидроксид натрия, с получением соединений формулы (IV) в которой G и n1 имеют значения, указанные выше, первичную аминогруппу соединений формулы (IV) селективно защищают защитной группой G2, обычно применяемой в органической химии, такой как БОК (трет-бутокси карбонил), с получением соединений формулы в которой n1, G и G2 имеют такие же значения,как указанные выше,после чего соединения формулы (V) последовательно обрабатывают в основной среде соединением формулы (VIA)R1-L1 (VIA),в которой R1 имеет такие же значения, как указанные для формулы (I), a L1 обозначает обычную для органического синтеза уходящую группу,защитную группу у аминогруппы которых далее удаляют и соединения либо не подвергают никакой последующей обработке и в результате получают соединения формулы (VIIA) в которой R1, n1 и G имеют значения, указанные выше, либо вводят во взаимодействие с соединением формулы (VIB)R2a-L1 (VIB),в которой R2a имеет такие же значения, как R2,которые указаны для формулы (I), за исключением водородного атома, а значения L1 указаны выше, получая соединения формулы (VIIB) в которой R1, R2a, n1 и G имеют такие же значения, как указанные выше, причем совокупность соединений формул (VIIА) и (VIIB) образует соединения формулы (VII) в которой n1, G, R1 и R2a, имеют такие же значения, как указанные выше, защитную группу для гидроксильной группы соединений формулы(VII) удаляют, после чего соединения либо обрабатывают соединением формулы (VIII)Y-L1 (VIII),в которой Y имеет такие же значения, как указанные для формулы (I), а L1 имеет такие же значения, как указанные выше, получая соединения формулы (I/a) как частный случай соединений формулы (I) в которой n1, Y, R1 и R2 имеют такие же значения, как указанные для формулы (I), либо обрабатывают SOCl2 с получением соединений формулы (IX) в которой n1, R1 и R2 имеют такие же значения,как указанные выше, проводят реакцию соединений формулы (IX) в основной среде с соединением формулы (X)Y1-SH (X),в которой Y1 обозначает арильную группу, арилалкильную C1-C6 группу, которая содержит линейный или разветвленный алкильный остаток, гетероарильную группу или гетероарилалкильную C1-C6 группу, которая содержит линейный или разветвленный алкильный остаток, с получением соединений формулы (I/b) как частный случай соединений формулы (I) в которой Y1, n1, R1 и R2 имеют такие же значения, как указанные выше, либо, когда n1 обозначает 1, обрабатывают воздействием обычного для органического синтеза окислителя, получая соединения формулы (XI) в которой R1 и R2 имеют такие же значения, как указанные выше, и соединения формулы (XI) либо обрабатывают гидроксиламином формулыH2N-OY2 (XII),в которой Y2 обозначает водородный атом или группу Yl, которая имеет указанные выше значения,получая соединения формулы (I/с) как частный случай соединений формулы (I) в которой Y2, R1 и R2 имеют такие же значения,как указанные выше, соединения формулы (I/с),у которых в частном случае Y2 обозначает водородный атом, обрабатывают воздействием соединения формулы (XIV)Y3-L1 (XIV),в которой L1 имеет такие же значения, как указанные выше, a Y3 обозначает группу формулы-С(О)-А или -C(S)-A, значения которой указаны в описании формулы (I), получая соединения формулы (I/d) как частный случай соединений формулы (I) 11 в которой Y3, R1 и R2 имеют такие же значения,как указанные выше,либо обрабатывают в условиях проведения реакции Виттига, а затем обрабатывают воздействием обычного для органического синтеза восстановителя, получая соединения формулы(I/е) как частный случай соединений формулы в которой Y1, R1 и R2 имеют такие же значения,как указанные выше,либо обрабатывают воздействием соединения формулы Ph3P = CH-CO2Et, a затем восстанавливают воздействием обычного для органического синтеза восстановителя, получая соединения формулы (XV) в которой R1 и R2 имеют такие же значения, как указанные выше, соединения формулы (XV) обрабатывают соединением формулы (VIII),которая описана выше, получая соединения формулы (I/f) как частный случай соединений формулы (I) в которой Y, R1 и R2 имеют такие же значения,как указанные для формулы (I),либо, когда n1 обозначает 1; превращают в их соответствующие галоидированные производные в обычных для процессов в органической химии условиях, а затем вводят во взаимодействие с цианидом щелочного металла в среде диметилсульфоксида с получением соединений формулы (XVI) в которой R1 и R2 имеют такие же значения, как указанные выше, и соединения формулы (XVI) в обычных условиях превращают в сложные эфиры, а затем обрабатывают восстановителем с получением соединений формулы (XVIIA) в которой R1 и R2 имеют такие же значения, как указанные выше, и соединения формулы(XVIIA) можно подвергать вновь, повторно тому же самому ряду обработок, в результате которых получают соединения формул (XVI) и 12 в которой R1 и R2 имеют такие же значения, как указанные выше, а n3 обозначает целое число от 3 до 6 включительно, причем совокупность соединений формул (XVIIA) и (XVIIB) образует соединения формулы (XVIII) в которой R1 и R2 имеют такие же значения, как указанные выше, а n2 обозначает целое число от 2 до 6 включительно, и соединения формулы(XVIII) либо вводят во взаимодействие с соединением формулы Y-L1, которая описана выше,получая соединения формулы (I/g) как частный случай соединений формулы (I) в которой Y, n2, R1 и R2 имеют такие же значения, как указанные выше,либо вводят во взаимодействие с SOCl2 и затем обрабатывают соединением формулы (X),которая описана выше, получая соединения формулы (I/h) как частный случай соединений формулы (I) в которой Y1, n2, R1 и R2 имеют такие же значения, как указанные выше,либо обрабатывают воздействием окислителя, после чего проводят реакцию полученного альдегидного промежуточного продукта с гидроксиламином формулы (XII), которая описана выше и в которой Y2 конкретно обозначает водородный атом, а затем, если необходимо, полученные соединения обрабатывают воздействием соединения формулы (XIV), которая описана выше, получая соединения формулы (I/i) как частный случай соединений формулы (I) в которой R1, R2 и Y имеют такие же значения,как указанные для формулы (I), а n4 обозначает целое число, значение которого равно (n2 - 1),где n2 имеет такие же значения, как указанные выше,либо после обработки воздействием окислителя обрабатывают в условиях проведения реакции Виттига, а затем обрабатывают в обычных для органического синтеза восстановительных условиях, получая соединения формулы(I/j) как частный случай соединений формулы 13 в которой Y, n4, R1 и R2 имеют такие же значения, как указанные выше,либо в присутствии Me3Al в неполярном растворителе вводят во взаимодействие с соединением формулы (XIX):HNR1R2 (XIX),в которой R1 и R2 имеют такие же значения, как указанные для формулы (I), с получением соединений формулы (XX) в которой n1, G, R1 и R2 имеют такие же значения, как указанные выше, и соединения формулы (XX) обрабатывают воздействием восстановителя, который обычно используют в органическом синтезе, с получением соединений формулы (XXI) в которой G, n1, R1 и R2 имеют такие же значения, как указанные выше, и соединения формулы (XXI) можно вводить во всю совокупность тех взаимодействий, в которых участвуют соединения формулы (VII), с получением соединений формулы (I/k) как частный случай соединений формулы (I) в которой X, Y, n, R1 и R2 имеют такие же значения, как указанные для формулы (I),либо вводят во взаимодействие с тионилхлоридом, когда R обозначает водородный атом,а затем помещают в водную среду в присутствии диазометана с получением соединений формулы (XXII) в которой n1 и G имеют такие же значения, как указанные выше,и соединения формулы (XXII) можно вновь вводить несколько раз в такой же ряд взаимодействий с получением соединений формулы (XXIII) в которой n1 и G имеют такие же значения, как указанные выше, a p1 обозначает целое число от 2 до 6 включительно, и соединения формулы(XXIII) вводят во взаимодействие с дифенилфосфорилазидом, гидролизуют, а затем обрабатывают соединением формулы (VIA), как изложено выше, с получением соединений формулы 14 в которой R1 имеет такие же значения, как указанные для формулы (I), a G, n1 и p1 имеют такие же значения, как указанные выше, и соединения формулы (XXIV) можно вводить во всю совокупность тех взаимодействий, в которых участвуют соединения формулы (VII), с получением соединений формулы (I/l) как частный случай соединений формулы (I) в которой X, Y, R1 и n имеют такие же значения,как указанные для формулы (I), a p1 имеет такие же значения, как указанные выше,причем совокупность соединений формул с (I/a) по (I/1) составляет всю совокупность соединений по изобретению, которые очищают,когда это соответствует необходимости, согласно обычной технологии очистки, которые можно разделять на их различные изомеры в соответствии с обычной технологией разделения и которые превращают, когда это соответствует необходимости, в их аддитивные соли с фармацевтически приемлемой кислотой или основанием. Следует отметить, что в случае соединений формулы (XI), когда каждый из R1 и R2 обозначает метильную группу, альдегид оказывается нестойким. В соответствии с одним из вариантов осуществления способа получения некоторые соединения формулы (IA) по изобретению могут быть получены с использованием в качестве исходного материала соединений формулы (a1) в которой R обозначает линейную или разветвленную алкильную C1-C6 группу, и один из сложноэфирных остатков соединений формулы(a1) гидролизуют, после чего эти соединения обрабатывают воздействием дифенилфосфорилазида и метанола или трет-бутанола в полярной и апротонной среде с получением соединений формулы (b1) в которой R имеет такие же значения, как указанные выше, a R10 обозначает метальную группу или трет-бутильную группу, и карбаматную группу соединений формулы (b1) обрабатывают воздействием соединения формулы (c1)R1Hal (c1),в которой R1 имеет такие же значения, как указанные для формулы (I), a Hal обозначает атом галогена, с получением соединений формулы 16 или разветвленную C1-C6 группу, с получением целевых соединений формулы (II) в которой R, R1 и R10 имеют такие же значения,как указанные выше, и соединения формулы (d1) восстанавливают с получением соединений формулы (e1) в случае, когда R10 обозначает метильную группу, или с получением соединений формулы (е 2), когда R10 обозначает третбутильную группу в которой R1 имеет такие же значения, как указанные выше, и в обычных для органического синтеза условиях у соединений формулы (е 2) удаляют защитную группу карбаматной группы с получением соединений формулы (е 3) в которой R1 имеет такие же значения, как указанные выше, причем соединения формул (e1) и(е 3) можно вводить во все взаимодействия, в которых участвуют соединения формулы (VII) при осуществлении общего способа получения соединений формулы (I), получая соединения формулы (I/m) как частный случай соединений формулы (I) в которой R1, n, X и Y имеют такие же значения,как указанные для формулы (I), a R20 обозначает метальную группу или трет-бутильную группу в соответствии с тем, что в качестве данного соединения используют соединение формулы (e1) или (е 3). Соединения формул (II), (VIA), (VIB),(VIII), (X), (XII), (XIV), (XVIII), (a1) и (c1) либо являются техническими продуктами, либо могут быть получены в соответствии с обычными для органического синтеза методами, хорошо известными специалисту в данной области техники. 1,2-Дизамещенные соединения формулы(II) могут быть, в частности, получены с использованием в качестве исходного материала гидроксиаллильных или гидроксивинильных соединений, гидроксильная группа которых защищена обычной для органического синтеза защитной группой. В присутствии тетраацетата родия проводят реакцию приведенных ниже соединений формулы (II/а) в которой G обозначает защитную группу, а n1 обозначает 0 или 1, с соединением формулы Что касается обычных методов защиты и удаления защитных групп для гидроксильных или аминогрупп [в описании общего способа получения соединений формулы (I) указаны группы G и G2], то специалист в данной области техники может обратиться к книге T.W. Green"Protective Groups in Organic Synthesis", WilleyInterscience, Нью-Йорк, 1981. Обычно под изомерами соединений по изобретению понимают оптические изомеры,такие как энантиомеры и диастереоизомеры. Более конкретно соединения по изобретению в чистых энантиомерных формах могут быть выделены с использованием в качестве исходных материалов смесей энантиомеров, которые вводят в реакцию с разделяющим рацемат агентом,который можно высвободить, причем сам этот агент находится в форме чистого энантиомера,который позволяет получать соответствующие диастереоизомеры. Далее диастереоизомеры разделяют в соответствии в технологией разделения, которая специалисту в данной области техники известна хорошо, в частности кристаллизацией или хроматографией, после чего с применением известного для органического синтеза метода удаляют разделяющий агент,получая чистый энантиомер. Соединения по изобретению, которые находятся в форме смеси диастереоизомеров, выделяют в чистом виде с применением обычной технологии разделения, такой как хроматография. Благодаря своим фармакологической активности в качестве никотиновых лигандов и их избирательному действию в отношении рецепторов подтипа 42 соединения по настоящему изобретению могут применяться для лечения дефицитов памяти, связанных со старением головного мозга и нейродегенеративными болезнями, такими как болезнь Альцгеймера, болезнь Паркинсона, болезнь Пика, болезнь Корсакова и деменции передней доли и подкорки головного мозга, а также для лечения нарушений психического равновесия, синдрома Туретта, синдрома гиперактивности, сопровождающегося дефицитом внимания, синдрома отказа от табака и боли. Настоящее изобретение также относится к фармацевтическим композициям, содержащим в качестве действующего вещества по крайней мере одно соединение формулы (I), его изомер или его аддитивная соль с фармацевтически приемлемой кислотой или основанием, индивидуально или в сочетании с одним или несколькими фармацевтически приемлемыми инертными нетоксичными эксципиентами или носителями. 17 Среди фармацевтических композиций по изобретению следует особо отметить композиции, пригодные для перорального, парентерального (внутривенного, внутримышечного или подкожного), чрез- или транскожного, интравагинального, ректального, назального, перлингвального, буккального, глазного введения или введения в дыхательные пути. Фармацевтические композиции по изобретению для парентеральных инъекций предпочтительно включают водные и неводные стерильные растворы, дисперсии эмульсии, а также стерильные порошки для восстановления инъецируемых растворов или дисперсий. Фармацевтические композиции по изобретению для перорального введения в твердой форме предпочтительно включают таблетки или драже, сублингвальные таблетки, саше, желатиновые капсулы и гранулы, а для перорального,назального, буккального или глазного введения в жидкой форме предпочтительно включают эмульсии, растворы, суспензии, капли, сиропы и аэрозоли. Фармацевтические композиции для ректального или вагинального введения предпочтительно представляют собой суппозитории, а композиции для чрез- или транскожного введения предпочтительно включают порошки, аэрозоли, кремы, мази, гели и бляшки. Указанные выше фармацевтические композиции служат для иллюстрации изобретения,но никоим образом не ограничивают его объем. Среди фармацевтически приемлемых инертных нетоксичных эксципиентов или носителей следует отметить, не ограничиваясь ими,например, разбавители, растворы, консерванты,смачивающие агенты, эмульгаторы, диспергирующие агенты, связующие вещества, вещества,способствующие набуханию, разрыхлители,ретарданты, замасливатели, абсорбенты, суспендирующие агенты, красители, ароматизаторы и т.д. Пригодная доза варьируется в зависимости от возраста и веса пациента, пути введения, используемой фармацевтической композиции,природы и серьезности болезни и применения каких-либо совместных терапий. Дозы находятся в диапазоне от 1 мг до 500 мг в день и они могут вводиться в виде однократной дозы или в виде разделенных доз. Приведенные ниже примеры служат для иллюстрации изобретения, но никоим образом не ограничивают его объем. Используемые исходные продукты представляют собой известные продукты или продукты, которые могут быть получены согласно известным методам синтеза. Различные процессы получения позволяют синтезировать промежуточные продукты, которые используются при получении соединений по изобретению. Структуры соединений, описанных в примерах и процессах получения, были определены 18 с помощью обычных спектрофотометрических методов (инфракрасная спектрометрия, ядерный магнитный резонанс, масс-спектрометрии, ). Температуры плавления определяли либо с помощью метода нагревательной пластины Кофлера, либо с помощью микроскопа с нагревательной пластиной (столом). Если соединение находится в форме соли, то приводятся температуры плавления и данные элементарного микроанализа относятся к соединению в форме соли. В некоторых конкретных случаях результатом осуществления способа получения соединений по изобретению может быть преимущественное образование одного энантиомера или диастереоизомера перед другим. Процесс получения А. Гидрохлорид цис-2-(диметиламино)циклопропанола. Стадия 1. 2-(Винилокси)тетрагидро-2 Нпиран. Смесь 1,52 моля 2-(2-хлорэтокси)тетрагидро-2 Н-пирана, 93 г гидроксида натрия, измельченного до порошка, и 25 г моносульфата тетрабутиламмония перемешивают в течение 1 ч, а затем перегоняют при 50 С под давлением 20 Т. Далее дистиллят сушат над сульфатом натрия, обеспечивая выделение целевого продукта. Стадия 2. Этил-2-(тетрагидро-2 Н-пиран-2 илокси)циклопропанкарбоксилат. В раствор 0,75 моля соединения, полученного на стадии 1, в 200 мл диэтилового эфира вводят 1,5 г ацетата родия, а затем в течение 6 ч раствор 93 г этилдиазоацетата в 50 мл диэтилового эфира. После перемешивания при комнатной температуре в течение 16 ч реакционную смесь фильтруют, после чего перегоняют при 50-90 С под давлением 0,5 Т. Полученный остаток повторно перегоняют при 80-84 С под давлением 0,2 Т, выделяя целевой продукт. Стадия 3. 2-(Тетрагидро-2 Н-пиран-2-илокси)циклопропанкарбоксамид. Раствор 0,25 моля соединения, полученного на стадии 2, 2 г цианида натрия, 300 мл 2 н. раствора аммиака в метаноле и 80 мл жидкого аммиака в автоклаве выдерживают при 65 С в течение 5 дней, а затем концентрируют досуха. Остаток растворяют в смеси дихлорметана/насыщенного раствора карбоната калия,фильтруют через броунмиллерит, а затем обрабатывают обычным путем. После выпаривания под пониженным давлением остаток растирают в порошок в петролейном эфире, фильтруют,промывают и сушат, выделяя целевой продукт. Стадия 4. 2-(Тетрагидро-2 Н-пиран-2-илокси)циклопропиламин. В охлажденный раствор 2,2 моля гидроксида натрия в 800 мл воды вводят 33 г хлора, а затем 52 г соединения, полученного на стадии 3. После достижения комнатной температуры реакционную смесь выдерживают при 65 С в течение 16 ч, затем охлаждают до 20 С и насы 19 щают карбонатом калия. После экстракции диэтиловым эфиром объединенные органические фазы сушат, а затем концентрируют под пониженным давлением, выделяя целевой продукт. Стадия 5. трет-Бутил-2-(тетрагидро-2 Нпиран-2-илокси)циклопропилкарбамат. 0,65 моля триэтиламина вводят в раствор 0,25 моля соединения, полученного на стадии 4,в 300 мл дихлорметана. Смесь охлаждают до 0 С и в течение одного часа добавляют 0,3 моля дитрет-бутилдикарбоната в 250 мл дихлорметана. После достижения комнатной температуры реакционную смесь перемешивают в течение 20 ч, а затем добавляют 200 мл насыщенного раствора карбоната натрия. После разделения органические фазы обрабатывают обычным путем, а затем концентрируют под пониженным давлением. Хроматография остатка на силикагеле(дихлорметан/этилацетат в соотношении 95/5) позволяет выделить целевой продукт в форме диастереоизомерной смеси. Стадия 6. цис-трет-Бутил-N-метил[2-(тетрагидро-2 Н-пиран-2-илокси)циклопропил]карбамат и транс-трет-бутил-N-метил[2-(тетрагидро-2 Н-пиран-2-илокси)циклопропил]карбамат. 26 г соединения, полученного на стадии 5,в 20 мл диметилформамида вводят в охлажденный до 0 С раствор 4,4 г гидрида натрия в 250 мл диметилформамида. После достижения комнатной температуры смесь перемешивают в течение 2 ч, а затем в течение 15 мин добавляют 15,6 г метилиодида. После перемешивания в течение 16 ч реакционную смесь концентрируют и растворяют в смеси диэтилового эфира/ насыщенного раствора карбоната натрия. Далее органические фазы обрабатывают обычным путем с последующим концентрированием. Хроматография на силикагеле (циклогексан/тетрагидрофуран)позволяет выделить транс-изомер, а затем цис-изомер целевого продукта. Стадия 7. цис-N,N-Диметил-2-(тетрагидро 2 Н-пиран-2-илокси)циклопропанамин. 46 мл 65%-ного продукта Red-Al в толуоле вводят в охлажденный до 0 С раствор 7,5 г цис-изомера, полученного на предыдущей стадии, в 75 мл тетрагидрофурана. Реакционную смесь перемешивают при 0 С в течение 2 ч и при комнатной температуре в течение 16 ч, а затем охлаждают до 0 С и гидролизуют с использованием 100 мл дистиллированной воды. После экстракции диэтиловым эфиром объединенные органические фазы обрабатывают обычным путем, а затем концентрируют. Хроматография остатка на силикагеле (дихлорметан/тетрагидрофуран в соотношении 90/10) позволяет выделить целевой продукт. Стадия 8. Гидрохлорид -цис-2-(диметиламино)циклопропанола. 6 мл 4 н. раствора соляной кислоты в диоксане в инертной атмосфере добавляют к 1,8 г соединения, полученного на стадии 7, в 30 мл 20 диэтилового эфира. После выдержки в течение 16 ч при комнатной температуре смесь фильтруют, промывают диэтиловым эфиром, а затем сушат под пониженным давлением, выделяя целевой продукт. Температура плавления: 160-162 С. Процесс получения Б. Гидрохлорид транс-2-(диметиламино)циклопропанола. Стадия 1. транс-N,N-Диметил-2-(тетрагидро-2 Н-пиран-2-илокси)циклопропанамин. Продукт получают в соответствии с методом, описанным на стадии 7 процесса получения А, используя в качестве исходного материала транс-изомер, полученный на стадии 6 процесса получения А. Стадия 2. Гидрохлорид -транс-2-(диметиламино)циклопропанола продукт получают в соответствии с методом, описанным на стадии 8 процесса получения А, используя в качестве исходного материала соединение, полученное в примере 1. Продукт перекристаллизовывают из ацетонитрила. Температура плавления: 118-120 С. Процесс получения В. -транс-Метил-2[(бензилокси)метил]циклопропил(метил)карбамат. Стадия 1. Этил-2-[(бензилокси)метил]циклопропанкарбоксилат. 31,2 г этилдиазоацетата с помощью шприца вводят в раствор 0,3 моля аллилбензилового эфира в 150 мл диэтилового эфира. После перемешивания в течение 16 ч вновь добавляют 31,2 г этилдиазоацетата. По прошествии 24 ч смесь фильтруют. Органическую фазу промывают насыщенным раствором NaHCO3, а затем обрабатывают обычным путем. Хроматография на силикагеле (дихлорметан) позволяет получить целевой продукт. Стадия 2. 2-[(Бензилокси)метил]циклопропанкарбоновая кислота. Раствор 0,23 моля соединения, полученного на стадии 1, в 500 мл этанола, 230 мл 1 н. раствора гидроксида натрия и 5 мл диметилсульфоксида кипятят с обратным холодильником в течение 2 ч, а затем концентрируют. Остаток растворяют в смеси воды/диэтилового эфира. После обычной обработки объединенные органические фазы концентрируют. Хроматография остатка на силикагеле(дихлорметан/тетрагидрофуран в соотношении 97/3) позволяет выделить смесь цис-/трас-изомеров полученных продуктов, в некоторых фракциях которых преобладает цис-изомер, а в некоторых превалирует транс-изомер. Стадия 3. -транс-Метил-2-[(бензилокси) метил]циклопропилкарбамат. 14,7 г дифенилфосфорилазида добавляют к 11 г транс-изомера продукта, полученного на стадии 2, в 100 мл толуола и 5,4 г триэтиламина. Смесь выдерживают при 80 С в течение 2 ч 30 мин, а затем добавляют 2,6 г метанола. После перемешивания при 80 С в течение 16 ч реакци 21 онную смесь охлаждают, промывают насыщенным раствором NaHCO3, сушат, а затем концентрируют. Хроматография остатка на силикагеле(дихлорметан) позволяет выделить целевой продукт в виде транс-/цисдиастереоизомеров в соотношении 94/6. Стадия 4. -транс-Метил-2-[(бензилокси) метил]циклопропил(метил)карбамат. 2,1 г гидрида натрия порциями вводят в охлажденный до 0 С раствор 10,2 г соединения,полученного на стадии 3, в 150 мл диметилформамида. По прошествии 30 мин выдержки при 0 С и затем в течение 24 ч при комнатной температуре добавляют 7,24 г метилиодида и перемешивают в течение 72 ч. После выпаривания растворителя остаток растворяют в диэтиловом эфире и промывают насыщенным растворомNaHCO3, а затем 10%-ным раствором хлорида лития. По завершении обычной обработки хроматография остатка на силикагеле (дихлорметан) позволяет выделить целевой продукт. Процесс получения Г. -цис-метил-2[(бензилокси)метил]циклопропил(метил)карбамат. Стадия 1. -цис-Метил-2-[(бензилокси) метил]циклопропилкарбамат. Продукт получают в соответствии с методом, описанным на стадии 3 процесса получения В, используя в качестве исходного материала цис-изомер, полученный на стадии 2 процесса получения В. Продукт выделяют в виде цис/транс-диастереоизомеров в соотношении 77/22. Стадия 2. -цис-метил-2-[(бензилокси) метил]циклопропил (метил)карбамат. Продукт получают в соответствии с методом, описанным на стадии 4 процесса получения В, используя в качестве исходного материала продукт, полученный на стадии 1. Процесс получения Д. Гидрохлорид транс 2-[(диметиламино)метил]циклопропанол. Стадия 1. N,N-Диметил-2-(тетрагидро-2 Нпиран-2-илокси)циклопропанкарбоксамид. 6,1 г диметиламина при -15 С вводят в 70 мл 2 М раствора триметилалюминия в толуоле и 250 мл толуола. По прошествии 20 мин температуру смеси доводят до комнатной, а затем,после 1 ч 30 мин добавляют 26,3 г соединения,полученного на стадии 2 процесса получения А,в 75 мл толуола. Далее реакционную смесь выдерживают при 85 С в течение 16 ч, а затем охлаждают на ледяной бане, добавляют 270 мл 0,5 н. соляной кислоты и смесь фильтруют и разделяют. Объединенные органические фазы обрабатывают обычным путем, после чего концентрируют под пониженным давлением, получая целевой продукт в виде транс-/цис-диастереоизомеров в соотношении 80/20. Стадия 2. транс-N,N-Диметил-N-[2(тетрагидро-2 Н-пиран 2-илокси)циклопропил] метиламин. 14 г соединения, полученного на стадии 1,в 50 мл диэтилового эфира медленно вводят в 22 суспензию 3,1 г AlLiH4 в 120 мл диэтилового эфира. После кипячения с обратным холодильником в течение 16 ч реакционную смесь охлаждают до 0 С, гидролизуют, фильтруют, а затем концентрируют под пониженным давлением. Хроматография остатка на силикагеле (дихлорметан/метанол в соотношении 90/10) позволяет выделить целевой продукт в виде транс-/цисдиастереоизомеров в соотношении 99/1. Стадия 3. Гидрохлорид транс-2-[(диметиламино)метил]циклопропанола. Этот продукт получают в соответствии с методом осуществления стадии 8 процесса получения А, используя в качестве исходного материала соединение, полученное на стадии 2, и добавлением в реакционную смесь этанола. Температура плавления: 93-96 С. Процесс получения Е. [1-(Диметиламино) циклопропил]метанол. Стадия 1. 1-(Метоксикарбонил)циклопропанкарбоновая кислота 1,45 л 1 н. раствора гидроксида натрия вводят в охлажденный до 5 С раствор 1,45 мл метил-1,1-циклопропандикарбоксилата в 2,5 л метанола. После перемешивания при комнатной температуре в течение 4 дней смесь на три четверти концентрируют,экстрагируют диэтиловым эфиром, а затем обрабатывают обычным путем, что позволяет выделить целевой продукт. Стадия 2. Метил-1-[(метоксикарбонил) амино]циклопропанкарбоксилат 300 г дифенилфосфорилазида вводят в нагретый до 80 С раствор 1,09 моля соединения, полученного на стадии 1, в 1,09 л толуола и 153 мл триэтиламина. Реакция протекает с заметной экзотермией. Когда выделение газа полностью прекращается,реакционную смесь охлаждают до 50 С, добавляют 66,3 мл метанола и смесь вновь выдерживают при 70 С в течение 2 ч. После охлаждения и обычной обработки хроматография на силикагеле (дихлорметан/метанол в соотношении 97/3) позволяет выделить целевой продукт. Стадия 3. Метил-1-[(метоксикарбонил)(метил)амино]циклопропропанкарбоксилат. 24,7 г гидрида натрия порциями вводят в охлажденный до 5 С раствор 99,7, г соединения,полученного на стадии 2, в 1,7 л безводного диметилформамида. После 15 мин выдержки при 5 С и затем в течение 3 ч при комнатной температуре по капля добавляют 38,2 мл метилиодида. После реакции в течение 20 ч смесь выпаривают. Остаток растворяют в диэтиловом эфире,а затем обрабатывают обычным путем. Хроматография на силикагеле (дихлорметан) позволяет выделить целевой продукт. Стадия 4. [1-(диметиламино)циклопропил] метанол. 44 г соединения, полученного на стадии 3,растворенного в 350 мл тетрагидрофурана, в течение 30 мин вводят в раствор 44 г LiAlH4 в 1,05 л тетрагидрофурана. После кипячения с обратным холодильником в течение 20 ч смесь 23 охлаждают до 5 С и добавляют 44 мл воды, 44 мл 4 н. раствора гидроксида натрия, а затем 132 мл воды. Фильтрование с последующим концентрированием под пониженным давлением позволяют выделить целевой продукт. Температура плавления 50 С. Процесс получения Ж. Гидрохлорид 1[(диметиламино)метил]циклопропанол. Стадия 1. 1-Гидрокси-N,N-диметилциклопропанкарбоксамид. 17,1 мл триметилсилилхлорида по каплям вводят в раствор 6 г 1-гидроксициклопропанкарбоновой кислоты в 120 мл дихлорметана и 10,5 пиридина. После перемешивания в течение 4 ч при комнатной температуре смесь охлаждают до 0 С и добавляют 10 капель диметилформамида, а затем 5,4 мл оксалилхлорида. Реакционную смесь перемешивают при 0 С в течение 1 ч и при комнатной температуре в течение 1 ч,затем добавляют раствор 2,4 г диметиламина в 10 мл пиридина. Перемешивание продолжают в течение 20 ч, после чего охлаждают до 0 С и добавляют 14 г лимонной кислоты в 120 мл метанола. После достижения в течение одного часа комнатной температуры реакционную смесь промывают 1 н. раствором соляной кислоты, а затем насыщенным раствором NaHCO3, после чего насыщенным раствором NaCl. Органическую фазу обрабатывают обычным путем, и хроматография на силикагеле (дихлорметан/ тетрагидрофуран в соотношении 90/10) позволяет выделить целевой продукт. Стадия 2. 1,5 г соединения, полученного на стадии 1, в 20 мл диэтилового эфира медленно вводят в раствор 0,9 г AlLiH4 в 30 мл диэтилового эфира. После кипячения с обратным холодильником в течение 5 ч реакционную смесь охлаждают и гидролизуют со льдом. Водную фазу отделяют, насыщают карбонатом калия и экстрагируют дихлорметаном. Органические фазы сушат и концентрируют под пониженным давлением. Остаток растворяют в 25 мл диэтилового эфира и 2 мл 4 н. раствора соляной кислоты в диоксане. Осадок отфильтровывают,что позволяет выделить целевой продукт. Процесс получения З. Гидрохлорид 2-[1(диметиламино)циклопропил]этанол. Стадия 1. Гидрохлорид 1-(хлорметил)-N,Nдиметилциклопропанамина. 80 мл эфирного раствора НСl вводят в раствор 18,4 г соединения из процесса получения Е в 240 мл диэтилового эфира. Полученный осадок отфильтровывают, промывают диэтиловым эфиром, сушат, а затем разбавляют 320 мл толуола, в который при этом по каплям добавляют 32 мл тионилхлорида. По прошествии 3 ч выдержки при 60 С смесь охлаждают до 5 С,фильтруют, промывают толуолом и сушат, что позволяет выделить целевой продукт. Температура плавления: 198 С. Стадия 2. [1-(Диметиламино)циклопропил] ацетонитрил. 24 30,3 г соединения, полученного на стадии 1, вводят в раствор 43 г цианида натрия и 3,5 г иодида калия в 400 мл диметилсульфоксида. После перемешивания в течение 20 ч при комнатной температуре добавляют 490 мл 10%-ного водного раствора карбоната натрия, а затем хлорид натрия. Смесь экстрагируют диэтиловым эфиром. После обычной обработки органических фаз хроматография на силикагеле позволяет выделять целевой продукт. Стадия 3. Метил [1-(диметиламино)циклопропил]ацетат. В охлажденный до 5 С раствор 14,5 г соединения, полученного на стадии 2, в 230 мл безводного метанола добавляют 40 мл 2 н. водного метанольного раствора НСl, а затем газообразного НСl до насыщения. Смесь перемешивают при комнатной температуре в течение 20 ч, после чего выпаривают. Остаток растворяют в растворе карбоната натрия и экстрагируют дихлорметаном. После обычной обработки органических фаз хроматография на силикагеле(дихлорметан/тетрагидрофуран в соотношении 95/5) позволяет выделить целевой продукт. Стадия 4. Гидрохлорид 2-[1-(диметиламино)циклопропил]этанола. 10,2 г соединения, полученного на стадии 3, растворенного в 200 мл тетрагидрофурана,медленно добавляют в раствор 5 г AlLiH4 в 300 мл тетрагидрофурана. После кипячения с обратным холодильником в течение 2 ч реакционную смесь охлаждают до 5 С и добавляют 10,7 мл воды, 10,7 мл 4 н. гидроксида натрия, а затем 32,1 мл воды. После фильтрования и концентрирования под пониженным давлением хроматография на силикагеле (дихлорметан/тетрагидрофуран в соотношении 95/5) позволяет выделить целевой продукт, который обработкой раствора соляной кислотой в диоксане превращают в его гидрохлоридную форму. Процесс получения И. трет-Бутил-1(гидроксиметил)циклопропил(метил)карбамат. Стадия 1. Метил-1-[(трет-бутоксикарбонил)амино]циклопропанкарбоксилат. Раствор 80 г 1-(метоксикарбонил)циклопропанкарбоновой кислоты и 78 мл триэтиламина в 550 мл толуола, в который добавляют 152 г дифенилфосфорилазида, выдерживают при 80 С. После прекращения выделения газа температуру доводят до 50 С и добавляют 61 г трет-бутанола. После реакции в течение 7 ч при 80 С смесь концентрируют. Остаток растворяют в диэтиловом эфире, промывают насыщенным раствором Na2CO3, затем 1 н. раствором соляной кислоты, после чего раствором NaHCO3. После сушки и выпаривания органической фазы остаток растворяют в 300 мл циклогексана, а затем концентрируют досуха. Полученный остаток растирают в порошок в пентане, фильтруют,после чего сушат, что позволяет выделить целевой продукт. 25 Стадия 2. Метил-1-[(трет-бутоксикарбонил)(метил)амино]циклопропанкарбоксилат. Этот продукт получают в соответствии с методом осуществления стадии 3 в процессе получения Е, используя в качестве исходного материала соединение, приготовленное на стадии 1. Стадия 3. трет-Бутил-1-(гидроксиметил) циклопропил(метил)карбамат. 100 мл 2 М раствора гидрохлорида лития в тетрагидрофуране вводят в раствор 23 г соединения, полученного на стадии 2, в 100 мл тетрагидрофурана. После перемешивания в течение 20 ч при комнатной температуре и последующего кипячения с обратным холодильником в течение 8 ч реакционную смесь охлаждают до 0 С, гидролизуют, разбавляют диэтиловым эфиром, разделяют, сушат и концентрируют. Хроматография остатка на силикагеле (дихлорметан/тетрагидрофуран в соотношении 95/5) позволяет выделить целевой продукт. Процесс получения К: 1-(2-Хлорэтил)-N,Nдиметилциклопропанамин. Этот продукт получают в соответствии с методом осуществления стадии 1 в процессе получения З, используя в качестве исходного материала соединение процесса получения З. Процесс получения Л. трет-Бутил-1-(гидроксиметил)циклопропилкарбамат. Этот продукт получают в соответствии с методом осуществления стадии 3 в процессе получения И, используя в качестве исходного материала соединение, приготовленное на стадии 1 процесса получения И. Температура плавления: 80-82 С. Процесс получения М. 3-[1-(диэтиламино) циклопропил]-1-пропанол. Стадия 1. трет-Бутил-1-формилциклопропил(метил)карбамат. Раствор 8,3 г диметилсульфоксида в 25 мл дихлорметана при -60 С вводят в раствор 6,2 г оксалилхлорида в 110 мл дихлорметана. По прошествии 20 мин в реакционную смесь добавляют 8,9 г соединения из процесса получения И, разбавленного дихлорметаном, и, наконец, после реакции в течение 30 мин 20 мл триэтиламина. После достижения комнатной температуры добавляют 50 мл воды и смесь подвергают обычной обработке. Хроматография остатка на силикагеле (дихлорметан/тетрагидрофуран в соотношении 97/3) позволяет выделить целевой продукт. Стадия 2. Этил-3-1-[(трет-бутоксикарбонил)(метил)амино]циклопропил-2-пропеноат. 1,15 г продукта, полученного на стадии 1,и 2,01 г (этоксикарбонилметилен)трифенилфосфорана в 30 мл дихлорметана кипятят с обратным холодильником в течение 20 ч, концентрируют под пониженным давлением, а затем хроматографируют на силикагеле (дихлорметан/ 26 тетрагидрофуран в соотношении 97/3), что позволяет выделить целевой продукт. Температура плавления: 52 С. Стадия 3. Этил-3-1-[(трет-бутоксикарбонил)(метил)амино]циклопропилпропаноат. 8,0 г продукта, полученного на стадии 2,растворенного в 200 мл этанола, гидрогенизируют в течение 4 ч при 20 С и под давлением 5 бар в присутствии 1,0 г 10%-ного палладия на угле. После фильтрования и концентрирования досуха хроматография на силикагеле (дихлорметан/тетрагидрофуран в соотношении 97/3) позволяет выделить целевой продукт (в виде жидкости). Стадия 4. 3-[1-(диметиламино)циклопропил]-1-пропанол. 8,5 г продукта, полученного на стадии 3,растворенного в 100 мл тетрагидрофурана, добавляют к 6,9 литийалюминийгидрида, суспендированного в 200 мл тетрагидрофурана. После кипячения с обратным холодильником в течение 16 ч смесь охлаждают до 5 С и гидролизуют последовательно 6,9 мл воды, 6,9 мл 4 н. раствора гидроксида натрия, а затем 20,7 мл воды. После обычной обработки хроматография остатка на силикагеле позволяет выделить целевой продукт (в виде жидкости). Процесс получения Н. трет-Бутил-1(бромметил)циклопропил(метил)карбамат. В раствор 4 г соединения из процесса получения И в 100 мл диэтилового эфира при 20 С вводят 7,9 г трифенилфосфина, а затем 9,9 г тетрабромметана. После перемешивания в течение 24 ч, фильтрования и концентрирования досуха хроматография на силикагеле (дихлорметан) позволяет выделить целевой продукт. Температура плавления: 62-64 С. Процесс получения О: трет-Бутил-(2 Е)-3(3-пиридил)-2-пропеноат. В раствор 45 г (2 Е)-3-(3-пиридил)-2 пропионовой кислоты в 300 мл диэтилового эфира эфирный раствор НСl вводят до тех пор,пока рН не достигает значения кислой среды. Получаемый осадок отфильтровывают, промывают диэтиловым эфиром и сушат под пониженным давлением. Далее продукт растворяют в 600 мл тионилхлорида и кипятят с обратным холодильником в течение 2 ч, после чего концентрируют под пониженным давлением и последовательно растворяют в толуоле, а затем в диэтиловом эфире. После этого полученный осадок разбавляют 1 л тетрагидрофурана, перемешивают при 5 С и добавляют 67 г третбутанолята калия в 2,5 л тетрагидрофурана. После реакции в течение 3 ч при 5 С и 1 ч при 20 С реакционную смесь подвергают обычной обработке, что после выпаривания под пониженным давлением позволяет получить целевой продукт. Температура плавления: продукт в виде масла. 27 Процесс получения П. Трифенил(3-пиридилметил)фосфонийхлорид. 13,1 г трифенилфосфина вводят в раствор 8,2 г гидрохлорида 3-пиколилхлорида в 120 мл диметилформамида. После перемешивания в течение 5 мин смесь кипятят с обратным холодильником в течение 30 мин в микроволновом аппарате, а затем охлаждают до 5 С. Полученные кристаллы отфильтровывают, промывают диметилформамидом, а затем диэтиловым эфиром и сушат под пониженным давлением, что позволяет выделить целевой продукт. Температура плавления: 315-318 С. Пример получения Р. [1-(1-Пирролидинил) циклопропил]метанол. Стадия 1. 1-(1-Пирролидинил)циклопропанкарбонитрил. Смесь, включающую каплю триметилсилилхлорида и 67,8 г [(1-этоксициклопропил) окси]триметилсилана в 65 мл метанола, добавляют к 62,6 г пирролидингидрохлорида и 28,7 г цианида калия, растворенного в 260 мл метанола. После перемешивания в течение 20 мин при 20 С, а затем в течение 20 ч при 50 С реакционную смесь концентрируют досуха, растворяют в дихлорметане, фильтруют и вновь концентрируют досуха. Остаток хроматографируют на силикагеле (СН 2 Сl2), что позволяет выделить целевой продукт. Стадия 2: 1-(1-пирролидинил)циклопропанкарбоксамид. При 20 С в течение 5 ч поток газообразного НСl барботируют через смесь, содержащую 5,2 г продукта, полученного на стадии 1,растворенного в 100 мл метанола. Смесь концентрируют досуха, затем растворяют в 20 мл водного раствора карбоната натрия и 20 мл дихлорметана. После обычной обработки хроматография на силикагеле позволяет выделить целевой продукт. Температура плавления: 62 С. Стадия 3. Этил-1-(1-пирролидинил)циклопропанкарбоксилат. При 0 С раствор, содержащий 11,4 г триэтилоксонийтетрафторбората и 40 мл дихлорметана, по каплям вводят в суспензию, включающую 1,54 г продукта, полученного на стадии 2,10 г вторичного кислого фосфата натрия и 120 мл дихлорметана. После выдержки в течение 20 ч при 20 С добавляют 40 мл 10%ного водного раствора карбоната натрия. Смесь разделяют и водную фазу экстрагируют дихлорметаном. Объединенные органические фазы сушат над сульфатом натрия, а затем концентрируют досуха. Остаток растворяют в 1 н. водной смоляной кислоте и образовавшийся раствор оставляют при 20 С на 3 ч. Смесь подщелачивают карбонатом натрия и экстрагируют дихлорметаном. Объединенные дихлорметановые фазы сушат над сульфатом натрия и концентрируют досуха. Хроматография на силикагеле (дихлор 005185 28 метан/тетрагидрофуран в соотношении 95/5) позволяет выделить целевой продукт. Стадия 4. [1-(1-пирролидинил)циклопропил]метанол. 20,5 г продукта, полученного на стадии 3,и 100 мл тетрагидрофурана в течение 5 мин выливают в суспензию, включающую 8,57 г литийалюминийгидрида и 400 мл тетрагидрофурана. Смесь кипятят с обратным холодильником в течение 2 ч, охлаждают до 5 С и гидролизуют последовательным добавлением 9 мл воды, 9 мл 4 н. раствора гидроксида натрия и затем 27 мл воды. Соединение алюминия отфильтровывают и промывают тетрагидрофураном. Объединенные фильтраты концентрируют досуха, что позволяет получить целевой продукт (в виде жидкости). Процесс получения С. трет-Бутил-1-(2 гидроксиэтил)циклопропил(метил)карбамат. Стадия 1. трет-Бутил-1-(бромметил)циклопропил(метил)карбамат. В раствор, содержащий 50,7 г продукта процесса получения И и 1,25 л диэтилового эфира, вводят 100,1 г трифенилфосфина, а затем 125,5 г тетрабромметана. При 20 С в течение 20 ч осуществляют перемешивание, проводят отфильтровывание нерастворимого материала и концентрирование смеси досуха. Остаток хроматографируют на силикагеле (СН 2 Сl2), что позволяет выделить целевой продукт. Температура плавления: 53 С. Стадия 2: трет-бутил-1-(цианометил)циклопропил(метил)карбамат. Смесь, содержащую 26,4 г продукта стадии 1, 26 г цианида калия и 2,6 г иодида калия в 264 мл диметилсульфоксида при 70 С перемешивают в течение 20 ч. Смесь охлаждают и добавляют 400 мл 10%-ного карбоната натрия в воде. После экстракции диэтиловым эфиром и обычной обработки выпаривание остатка под пониженным давлением позволяет выделить целевой продукт. Стадия 3. Метил-[1-(метиламино)циклопропил]ацетат. 89 мл 4 н. метанольного раствора НСl вводят в раствор, содержащий 22,2 г продукта, полученного на стадии 2, растворенного в 450 мл метанола. При температуре ниже 40 С барботируют 200 г газообразного НСl. Смесь оставляют стоять в течение 20 ч при комнатной температуре, а затем концентрируют досуха. Остаток растворяют в 80 мл 10%-ного карбоната натрия. После обычной обработки хроматография на силикагеле (СН 2 Сl2/этанол в соотношении 97/3) позволяет выделить целевой продукт. Стадия 4. Метил-1-[(трет-бутоксикарбонил)(метил)амино]циклопропилацетат. Раствор, содержащий 17,5 г дитрет-бутилдикарбоната и 120 мл дихлорметана, при 5 С по каплям вводят в раствор, включающий 9,5 г продукта, полученного на стадии 3, и 0,88 г (3 диметиламино)пиридина в 120 мл дихлормета 29 на. После выдержки в течение 2 ч при 5 С и затем в течение 2 ч при 20 С смесь промывают водным раствором хлорида аммония, после чего 10%-ным раствором бикарбоната натрия. После обычной обработки выпаривание под пониженным давлением позволяет выделить целевой продукт. Стадия 5. трет-Бутил-1-(2-гидроксиэтил) циклопропил(метил)карбамат. При 20 С в течение 20 мин 20 мл 2 М боргидрида лития в тетрагидрофуране выливают в смесь, содержащую 4,86 г продукта, полученного на стадии 4, и 20 мл тетрагидрофурана. После перемешивания в течение 20 ч при комнатной температуре и последующего кипячения с обратным холодильником в течение 1 ч смесь охлаждают до 5 С, а затем гидролизуют с использованием смеси, включающей 8 мл воды и 4 мл 10%-ного водного раствора карбоната натрия. Водную фазу несколько раз экстрагируют диэтиловым эфиром. После обычной обработки хроматография остатка на силикагеле (СН 2 Сl2/ тетрагидрофуран в соотношении 98/2) позволяет выделить целевой продукт (в виде жидкости). Процесс получения Т. 2-[1-(1-пирролидинил)циклопропил]этанол. Стадия 1. трет-Бутил-1-(бромметил)циклопропилкарбамат. Этот продукт получают в соответствии с методом, описанным в процессе получения Н, используя в качестве исходного материала продукт примера получения Л. Температура плавления: 96 С. Стадия 2: трет-Бутил-1-(цианометил)циклопропилкарбамат. Этот продукт получают в соответствии с методом, описанным в процессе получения 3, стадия 2, используя в качестве исходного материала продукт, полученный по изложенному выше. Температура плавления: 89 С. Стадия 3: Метил-[1-(амино)циклопропил] ацетат. Этот продукт получают в соответствии с методом, описанным в процессе получения 3,стадия 3, используя в качестве исходного материала продукт, полученный по изложенному выше. Стадия 4. Метил[1-(2,5-диоксо-1-пирролидинил)циклопропил]ацетат. Раствор, содержащий 1,29 г продукта, полученного на предыдущей стадии, и 1 г янтарного ангидрида в 30 мл толуола кипятят с обратным холодильником в течение 1 ч, а затем добавляют 2,8 мл триэтиламина. После кипячения с обратным холодильником в течение 20 ч смесь концентрируют досуха. Далее остаток растворяют в толуоле и в дальнейшем выпаривают под пониженным давлением. Хроматография остатка на силикагеле (дихлорметан/тетрагидрофуран в соотношении 97/3) позволяет выделить целевой продукт. Стадия 5. 2-[1-(1-Пирролидинил)циклопропил]этанол. 30 Этот продукт получают в соответствии с методом, описанным в процессе получения И,стадия 4, используя в качестве исходного материала продукт, полученный по изложенному выше (в виде жидкости). Процесс получения У. трет-Бутилметил-1(2-оксоэтил)циклопропилкарбамат. Этот продукт получают в соответствии с методом, описанным в процессе получения М,стадия 1, используя в качестве исходного материала продукт процесса получения С. Температура плавления: 93 С. Пример 1. Гидрохлорид -цис-2-(диметиламино)циклопропилацетата. В инертной атмосфере раствор 0,28 г соединения из процесса получения А в 4 мл уксусной кислоты, в который добавляют 0,22 г ацетилхлорида, при комнатной температуре перемешивают в течение 16 ч, а затем концентрируют. Остаток растворяют в 10 мл диоксана и вновь концентрируют досуха. Эту операцию повторяют до тех пор, пока не происходит кристаллизация. Полученные кристаллы разбавляют 10 мл диэтилового эфира, отфильтровывают и сушат, что позволяет получить целевой продукт. Температура плавления: аморфное вещество. Данные элементного микроанализа: С НN Сl рассч., %: 46,11 7,90 7,68 19,44 обнаруж., %: 46,01 7,70 7,48 19,63 Пример 2. Гидрохлорид -цис-2-(диметиламино)циклопропилметилкарбамата. Раствор 0,4 г соединения из процесса получения А в 30 мл ацетонитрила и 0,25 г метилизоцианата выдерживают при 80 С в течение 8 ч, а затем выпаривают. Остаток растворяют в смеси воды/диэтилового эфира и раствор насыщают карбонатом калия. Органическую фазу обрабатывают обычным путем, а остаток хроматографируют на силикагеле(дихлорметан/метанол в соотношении 97/3). Полученное соединение обычным путем переводят в его гидрохлоридную форму. Полученный продукт кристаллизуют из смеси 5% ацетонитрила в диэтиловом эфире. Температура плавления: 105-110 С. Данные элементного микроанализа: С НN Сl рассч., %: 41,65 7,89 13,88 17,56 обнаруж., %: 41,68 7,88 13,93 18,25 Пример 3. Гидрохлорид -транс-2(диметиламино)циклопропилацетата. Этот продукт получают в соответствии с методом, описанным в примере 1, используя в качестве исходного материала соединение процесса получения Б. Температура плавления: 148-150 С. Данные элементного микроанализа:N Сl рассч., %: 46,80 7,85 7,80 19,83 обнаруж., %: 46,67 7,82 7,50 19,97 Пример 4. Гидрохлорид -транс-2(диметиламино)циклопропилметилкарбамата. Этот продукт получают в соответствии с методом, описанным в примере 2, используя в качестве исходного материала соединение процесса получения Б. Температура плавления: 158-160 С. Данные элементного микроанализа: С НN Сl рассч., %: 42,60 7,8,1 14,19 17,96 обнаруж., %: 42,54 7,69 13,97 18,09 Пример 5. Гидрохлорид -транс-2-[(бензилокси)метил]-N,N-диметилциклопропанамина. Охлажденный до 5 С раствор 7 г соединения из процесса получения В в 140 мл тетрагидрофурана, в который добавляют 60 мл 65%-ного раствора продукта Red-Аl в толуоле, перемешивают в течение 2 ч при 5 С и в течение 16 ч при комнатной температуре, а затем охлаждают до 0 С и гидролизуют. Далее раствор разбавляют диэтиловым эфиром, фильтруют, выпаривают и органическую фазу концентрируют. Обычным путем продукт в остатке переводят в его гидрохлоридную форму, что позволяет получить целевой продукт. Температура плавления: 118-120 С. Данные элементного микроанализа: С НN Сl рассч., %: 64,59 8,34 5,79 14,66 обнаруж., %: 64,14 8,46 5,78 14,54 Пример 6. Гидрохлорид -цис-2-[(бензилокси)метил]-N,N-диметилциклопропанамина. Этот продукт получают в соответствии с методом, описанным в примере 5, используя в качестве исходного материала соединение процесса получения Г. Температура плавления: 90-92 С. Данные элементного микроанализа: С НN Сl рассч., %: 64,59 8,34 5,79 14,66 обнаруж., %: 64,35 8,07 5,84 14,84 Пример 7. Гидрохлорид -транс-[2(диметиламино)циклопропил]-метилацетата Стадия 1. Гидрохлорид -транс-[2-(диметиламино)циклопропил]метанола. 1,2 г натрия порциями вводят в раствор 4 г соединения из примера 5 в 200 мл конденсированного, жидкого аммиака. По прошествии 3 ч добавляют 100 мл диэтилового эфира, а затем 5 мл этанола. Перемешивание осуществляют в течение 16 ч, а затем смесь концентрируют и растворяют в дихлорметане. Органическую фазу обрабатывают обычным путем, после чего выпаривают. Хроматография на силикагеле (дихлорметан/метанол в соотношении 90/10) позволяет выделить целевой продукт, который переводят в его гидрохлоридную форму. Температура плавления: 88-90 С. 32 Стадия 2. Гидрохлорид -транс-[2-(диметиламино)циклопропил]метилацетата. Этот продукт получают в соответствии с методом, описанным в примере 1, используя в качестве исходного материала соединение, полученное на стадии 1. Температура плавления: 144-146 С. Данные элементного микроанализа: С НN Сl рассч., %: 49,61 8,33 7,23 18,31 обнаруж., %: 49,58 8,34 7,11 18,09 Пример 8. Гидрохлорид -цис-[2(диметиламино)циклопропил]метилацетата. Стадия 1. Гидрохлорид -цис-[2-(диметиламино)циклопропил]метанола. Этот продукт получают в соответствии с методом, описанным в примере 7, стадия 1, используя в качестве исходного материала соединение из примера 6. Температура плавления: 112-114 С. Стадия 2. Гидрохлорид -цис-[2-(диметиламино)циклопропил]метилацетата. Этот продукт получают в соответствии с методом, описанным в примере 1, используя в качестве исходного материала соединение, полученное на стадии 1. Температура плавления: 108-110 С. Данные элементного микроанализа: С НN Сl рассч., %: 49,61 8,33 7,23 18,31 обнаруж., %: 49,37 8,34 7,16 18,24 Пример 9. Гидрохлорид -транс-[2[(диметиламино)метил]циклопропил]ацетата. Этот продукт получают в соответствии с методом, описанным в примере 1, используя в качестве исходного материала соединение из процесса получения Д. Температура плавления: 100-105 С. Данные элементного микроанализа: С НN Сl рассч., %: 49,61 8,33 7,23 18,31 обнаруж., %: 49,32 8,37 7,11 18,26 Пример 10. Гидрохлорид [1-(диметиламино)циклопропил]метилацетата. Этот продукт получают в соответствии с методом, описанным в примере 1, используя в качестве исходного материала соединение из процесса получения Е. Температура плавления: 100-102 С. Данные элементного микроанализа: С НN Сl рассч., %: 49,61 8,33 7,23 18,31 обнаруж., %: 49,27 8,37 7,16 18,28 Пример 11. Гидрохлорид [1-(диметиламино)циклопропил]метилдиметилкарбамата. В инертной атмосфере в раствор 2,1 г соединения из процесса получения Е в 20 мл пиридина вводят 1,95 г диметилкарбамоилхлорида, а затем, после выдержки в течение 48 ч при комнатной температуре, такое же количество реагента. Реакционную смесь кипятят с обратным холодильником в течение 3 ч, после чего 33 выпаривают. Остаток растворяют в диоксане, а затем вновь концентрируют, растворяют в диэтиловом эфире и промывают раствором NaHCO3. Органическую фазу экстрагируют 0,1 н. раствором НСl, карбонатом натрия, водной фазе придают щелочность, а затем экстрагируют диэтиловым эфиром. Органические фазы обрабатывают обычным путем и концентрируют. Хроматография остатка на силикагеле (дихлорметан/тетрагидрофуран в соотношении 90/10) позволяет выделить целевой продукт, который переводят в его гидрохлоридную форму. Температура плавления: 166-168 С. Данные элементного микроанализа: С НN Сl рассч., %: 48,54 8,60 12,58 15,92 обнаруж., %: 48,55 8,53 12,22 15,61 Пример 12. Гидрохлорид 1-[(диметиламино)метил]циклопропилацетата. Этот продукт получают в соответствии с методом, описанным в примере 1, используя в качестве исходного материала соединение из процесса получения Ж. Температура плавления: 166-170 С. Данные элементного микроанализа: С НN Сl рассч., %: 49,61 8,33 7,23 18,31 обнаруж., %: 49,52 8,46 7,21 18,88 Пример 13. Гидрохлорид 2-[1-(диметиламино)циклопропил]этилацетата. Этот продукт получают в соответствии с методом, описанным в примере 1, используя в качестве исходного материала соединение из процесса получения 3. Температура плавления: 79-81 С. Данные элементного микроанализа: С НN Сl рассч., %: 51,16 8,78 6,53 16,78 обнаруж., %: 51,05 8,60 6,90 16,94 Пример 14. Фумарат 2-[1-(диметиламино) циклопропил]этилдиметилкарбамата. При 5 С раствор 1,3 г соединения из процесса получения З в 25 мл тетрагидрофурана, в который добавляют 0,4 г гидрида натрия, перемешивают в течение 10 мин при 5 С, в течение 1 ч при комнатной температуре, а затем в течение 2 ч при 40 С и, наконец, температуру доводят до 5 С. Далее медленно добавляют 1,2 г диметилкарбамоилхлорида и реакционную смесь перемешивают в течение 1 ч при 5 С, в течение 1 ч при комнатной температуре, а затем в течение 7 ч при 40 С и, наконец, концентрируют под пониженным давлением. Остаток растворяют в дихлорметане, промывают насыщенным раствором хлорида натрия, сушат и концентрируют. Хроматография на силикагеле (этилацетат) позволяет выделить целевой продукт, который обычным путем переводят в его фумаратную форму. Температура плавления: 148-149 С. Данные элементного микроанализа:N рассч., %: 53,15 7,65 8,86 обнаруж., %: 52,71 7,52 8,56 Пример 15. Фумарат 2-[1-(диметиламино) циклопропил]этилметилкарбамата. 0,63 г метилизоцианата вводят в охлажденный до 5 С раствор 1,3 г соединения из процесса получения З в 26 мл диэтилового эфира,после чего смесь кипятят с обратным холодильником в течение 4 ч. Операции добавления метилизоцианата повторяют три раза, чередуя их с периодами кипячения с обратным холодильником в течение 4 ч. После завершения взаимодействия смесь концентрируют под пониженным давлением. Хроматография остатка на силикагеле (дихлорметан/метанол в соотношении 95/5) позволяет выделить целевой продукт, который обычным путем переводят в его фумаратную форму. Температура плавления: 118-119 С. Данные элементного микроанализа: С НN рассч., %: 51,65 7,33 9,27 обнаруж., %: 51,67 7,38 9,08 Пример 16. Гидрохлорид [1-(диметиламино)циклопропил]метилникотината. Раствор 0,9 г гидрохлорида хлорангидрида никотиновой кислоты, 0,76 г соединения из процесса получения Е и 0,06 г 4-диметиламинопиридина в 15 мл пиридина выдерживают при 80 С в течение 5 ч, а затем концентрируют под пониженным давлением. Остаток растворяют в смеси диэтилового эфира с насыщенным раствором NaHCO3. Органическую фазу обрабатывают обычным путем, а затем концентрируют. Хроматография остатка на силикагеле(дихлорметан/метанол в соотношении 97/3) позволяет выделить целевой продукт, который обычным путем переводят в его гидрохлоридную форму. Температура плавления: 130 С. Данные элементного микроанализа: С НN Сl рассч., %: 45,01 6,61 8,75 22,14 обнаруж., %: 45,05 6,70 8,61 21,03 Пример 17. Гидрохлорид N,N-диметил-1[(3-пиридилметокси)метил]циклопропанамина. 1,32 г гидрида натрия вводят в раствор 3,4 г соединения из процесса получения Е в 55 мл диметилформамида. Реакционную смесь выдерживают при 45 С в течение 1 ч 30 мин, а затем температуру доводят до комнатной, после чего охлаждают до 0 С. Добавляют 0,036 моля 3-пиколилхлорида. Реакционную смесь перемешивают в течение 16 ч при комнатной температуре, а затем в течение 5 ч при 50 С, после чего концентрируют под пониженным давлением. Остаток растворяют в насыщенном растворе карбоната натрия с последующей экстракцией этилацетатом. Органическую фазу обрабатывают обычным путем и выпаривают. Хроматография остатка на силикагеле (дихлорметан/мета 35 нол в соотношении 97,5/2,5) позволяет выделить целевой продукт, который обычным путем переводят в его гидрохлоридную форму. Температура плавления: 205-210 С. Данные элементного микроанализа: С НN Сl рассч., %: 51,62 7,22 10,03 25,40 обнаруж., %: 51,72 7,22 9,78 25,46 Пример 18. Гидрохлорид N-метил-1-[(3 пиридилокси)метил]циклопропанамина. Стадия 1. трет-Бутил-N-метил-1-[(3-пиридилокси)метил]циклопропилкарбамат. 4,7 мл диэтилазодикарбоксилата вводят в охлажденный до 0 С раствор 7,9 г трифенилфосфина в 80 мл тетрагидрофурана. По прошествии 45 мин температуру реакционной смеси доводят до комнатной и добавляют 2,9 г 3 гидроксипиридина и 4 г соединения из процесса получения И, суспендированного в 49 мл тетрагидрофурана. После перемешивания в течение 24 ч смесь концентрируют под пониженным давлением, а затем добавляют 100 мл 1 н. соляной кислоты. Водную фазу экстрагируют этилацетатом, добавлением твердого карбоната калия придают щелочность, а затем повторно экстрагируют диэтиловым эфиром. Объединенные органические фазы обрабатывают обычным путем, а затем выпаривают. Хроматография на силикагеле (дихлорметан/тетрагидрофуран в соотношении 97/3) позволяет выделить целевой продукт. Стадия 2. Гидрохлорид N-метид-1-[(3 пиридилокси)метил]циклопропанамина. Раствор, содержащий 0,32 г соединения,полученного на стадии 1, в 3 мл диоксана и 3 мл 4 н. соляной кислоты в диоксане перемешивают при комнатной температуре и в инертной атмосфере, а затем разбавляют диэтиловым эфиром. Далее жидкую фазу отделяют и остаток растворяют в 25 мл этанола. Раствор концентрируют до 2-миллилитрового объема, после чего разбавляют 20 мл диэтилового эфира и перемешивают. Образовавшийся осадок отфильтровывают, промывают и сушат, что позволяет выделить целевой продукт. Температура плавления: 152-155 С. Данные элементного микроанализа: С НN Сl рассч., %: 46,82 6,52 10,92 27,64 обнаруж., %: 46,83 6,48 10,68 27,68 Пример 19. Гидрохлорид N,N-диметил-1[(3-пиридилокси)метил]циклопропанамина. 1,07 г соединения из примера 18, разбавленного 1,2 мл воды, добавляют в охлажденный до 0 С раствор 1,38 г муравьиной кислоты, 1,12 мл 37%-ного формальдегида в воде и 0,15 мл дистиллированной воды. Реакционную смесь кипятят с обратным холодильником в течение 16 ч, после чего охлаждают до 0 С и добавляют 10 мл 4 н. раствора гидроксида натрия. Смесь экстрагируют диэтиловым эфиром. Органическую фазу обрабатывают обычным путем и вы 005185 36 паривают. Остаток растворяют в этаноле, вновь концентрируют, а затем разбавляют 20 мл диэтилового эфира и 4 мл 4 н. раствора соляной кислоты в диоксане. Смесь перемешивают в течение 20 мин, фильтруют, промывают диэтиловым эфиром и сушат, что позволяет выделить целевой продукт. Температура плавления: 215-220 С. Пример 20. Дигидрохлорид N,N-диметил 1-[2-(3-пиридилокси)этил]циклопропанамина. Раствор, включающий 0,58 г натриевой соли 3-гидроксипиридина в 5 мл диметилсульфоксида и 0,46 г соединения из процесса получения К, кипятят с обратным холодильником в течение 16 ч, а затем температуру доводят до комнатной и растворяют в смеси диэтилового эфира/насыщенного раствора карбоната натрия. После отделения водную фазу экстрагируют этилацетатом, органические фазы далее промывают 1 н. раствором гидроксида натрия, а затем 10%-ным раствором хлорида лития. После концентрирования остаток растворяют в 20 мл диэтилового эфира и обычным путем получают дигидрохлорид целевого продукта. Температура плавления: 173-175 С. Данные элементного микроанализа: С НN Сl рассч., %: 50,75 7,31 11,34 24,97 обнаруж., %: 50,76 7,28 9,72 24,37 Пример 21. Гидрохлорид 4-[2-[1(диметиламино)циклопропил]этил]сульфанил фенола. Раствор, включающий 0,4 г 90%-ного 4 гидрокситиофенола, 0,46 г соединения из процесса получения К в 10 мл диметилформамида и 0,7 г карбоната калия, в течение 24 ч перемешивают при комнатной температуре, после чего разбавляют диэтиловым эфиром. Смесь подкисляют добавлением 15 мл 1 н. соляной кислоты, а затем разделяют. Органическую фазу повторно экстрагируют 15 мл 1 н. соляной кислоты, а водной фазе придают щелочность и экстрагируют этилацетатом. После сушки ацетилированных фаз и их концентрирования полученный остаток соответствует целевому продукту, который обычным путем переводят в его гидрохлоридную форму. Температура плавления: 193-195 С. Пример 22. Дигидрохлорид 1-[(3-пиридилокси)метил]циклопропанамина. Стадия 1. трет-Бутил-1-[(3-пиридилокси) метил]циклопропилкарбамат. Этот продукт получают в соответствии с методом, описанным в примере 18, стадия 1,используя в качестве исходного материала соединение из процесса получения Л. Температура плавления: 112-114 С. Стадия 2. Дигидрохлорид 1-[(3-пиридилокси)метил]циклопропанамина. Этот продукт получают в соответствии с методом, описанным в примере 18, стадия 2, 37 используя в качестве исходного материала соединение, полученное на стадии 1. Температура плавления: 120-122 С. Пример 23. Гидрохлорид N-метил-1-[(6 метил-3-пиридил)окси]метилциклопропанамина. Стадия 1. трет-Бутилметил 1-[(6-метил-3 пиридил)окси]метилциклопропилкарбамат. Этот продукт получают в соответствии с методом, описанным в примере 18, стадия 1,используя в качестве исходного материала соединение из процесса получения И и 6 метилпиридин-3-ол. Температура плавления: 62-64 С. Стадия 2. Гидрохлорид N-метил-1-[(6 метил-3-пиридил)окси]метил]циклопропанамина. Этот продукт получают в соответствии с методом, описанным в примере 18, стадия 2,используя в качестве исходного материала соединение, полученное на стадии 1. Температура плавления: 172-175 С. Пример 24. Гидрохлорид N-метил-1-[(6 хлор-3-пиридил)окси]метилциклопропанамина. Стадия 1. трет-Бутилметил 1-[(6-хлор-3 пиридил)окси]метилциклопропилкарбамат. Этот продукт получают в соответствии с методом, описанным в примере 18, стадия 1,используя в качестве исходного материала соединение из процесса получения И и 2-хлор-5 гидроксипиридин. Температура плавления: 70-72 С. Стадия 2. Гидрохлорид N-метил-1-[(6 хлор-3-пиридил)окси]метилциклопропанамина. Этот продукт получают в соответствии с методом, описанным в примере 18, стадия 2,используя в качестве исходного материала соединение, полученное на стадии 1. Температура плавления: 120-122 С. Пример 25. Гидрохлорид N-1-[(3-фторфенокси)метил]циклопропил-N-метиламина. Стадия 1. трет-Бутилметил 1-[(6-метил-3 пиридилокси)метил]циклопропилкарбамат. Этот продукт получают в соответствии с методом, описанным в примере 18, стадия 1,используя в качестве исходного материала соединение из процесса получения И и 3 фторфенол. Стадия 2. Гидрохлорид N-[1-(3-фторфенокси)метил]циклопропил-N-метиламин. Этот продукт получают в соответствии с методом, описанным в примере 18, стадия 2,используя в качестве исходного материала соединение, полученное на стадии 1. Температура плавления: 98-100 С. Пример 26. Фумарат 3-[1-(диметиламино) циклопропил]пропилдиметилкарбамата. Этот продукт получают в соответствии с методом, описанным в примере 11, используя в 38 качестве исходного материала соединение, синтезированное в процессе получения М. Температура плавления: 110-111 С. Пример 27. Фумарат 3-[1-(диметиламино) циклопропил]пропилметилкарбамата. Этот продукт получают в соответствии с методом, описанным в примере 15, используя в качестве исходного материала соединение, синтезированное в процессе получения М. Температура плавления: 150-151 С. Пример 28. Дигидрохлорид N-метил-1-[(2 пиридилсульфанил)метил]циклопропанамина. Стадия 1. трет-Бутилметил-[1-[(2-пиридилсульфанил)метил]циклопропил]карбамат. 1,75 г карбоната калия вводят в раствор 1,33 г 2-меркаптопиридина и 2,65 г соединения из процесса получения Н в 25 мл диметилформамида. После перемешивания в течение 24 ч при 20 С реакционную смесь растворяют в диэтиловом эфире, фильтруют и концентрируют. Хроматография остатка на силикагеле (дихлорметан) позволяет выделить целевой продукт. Температура плавления: 62-64 С. Стадия 2. Дигидрохлорид N-метил-1-[(2 пиридилсульфанил)метил]циклопропанамина. Этот продукт получают в соответствии с методом, описанным в примере 18, стадия 2,используя в качестве исходного материала соединение, полученное на стадии 1. Температура плавления: 174-178 С. Пример 29. Дигидрохлорид N-метил-1-[3(3-пиридилокси)пропил]циклопропанамина. Стадия 1. трет-Бутилметил-1-[3-(3-пиридилокси)пропил]циклопропилкарбамат. Этот продукт получают в соответствии с методом, описанным в примере 18, стадия 1,используя в качестве исходного материала соединение из процесса получения М. Стадия 2. Дигидрохлорид N-метил-1-[3-(3 пиридилокси)пропил]циклопропанамина. Этот продукт получают в соответствии с методом, описанным в примере 18, стадия 2,используя в качестве исходного материала соединение, полученное на стадии 1. Температура плавления: 118-120 С. Пример 30. Дигидрохлорид N-метил-1-[2(3-пиридил)этил]циклопропанамина. Стадия 1. трет-Бутилметил-1-[(Z)-2-(3 пиpидил)этeнил]циклoпpoпилкарбамат. 24,7 г продукта, полученного в процессе получения П, вводят в смесь, включающую 6,5 г трет-бутанолята калия в 100 мл диметилсульфоксида. После перемешивания в течение 1 ч добавляют 5,5 г продукта, синтезированного на стадии 1 процесса получения М, в 20 мл диметилсульфоксида. После реакции в течение 1 ч 30 мин смесь разбавляют диэтиловым эфиром и добавляют 120 мл воды. Органические фазы экстрагируют 1 н. соляной кислотой, после чего обрабатывают обычным путем. Хроматография остатка на силикагеле (дихлорметан/тетрагидро 39 фуран в соотношении 97/3) позволяет выделить целевой продукт. Стадия 2. трет-Бутилметил-1-[2-(3-пиридил)этил]циклопропилкарбамат. 5,1 г продукта, полученного на стадии 1,растворенного в 120 мл метанола, гидрогенизируют в присутствии 1 г 10%-ного палладия на угле (20 С, 1 бар, 3 ч). Катализатор отфильтровывают и промывают метанолом. Концентрирование досуха и сушка при 45 С под давлением 0,5 торра позволяют выделить целевой продукт. Стадия 3. Дигидрохлорид N-метил-1-[2-(3 пиридил)этил]циклопропанамина. 20 мл 4 н. соляной кислоты в диоксане вводят в смесь, включающую 4,4 г продукта, полученного на стадии 2, в 20 мл диоксана. В течение 4 ч осуществляют перемешивание при 20 С,после чего добавляют 20 мл диэтилового эфира. Наблюдают кристаллизацию. Кристаллы отфильтровывают, промывают диэтиловым эфиром и сушат при 50 С и под давлением 0,5 торра, что позволяет выделить целевой продукт. Температура плавления: 202-205 С. Пример 31. Фумарат N-метил-1-[(2)-2-(3 пиридил)этенил]циклопропанамина. 12 мл 4 н. соляной кислоты в диоксане вводят в смесь, включающую 2,3 г продукта, полученного на стадии 1 в примере 30, в 12 мл диоксана. В течение 4 ч осуществляют перемешивание при 20 С, после чего добавляют 30 мл диэтилового эфира и перемешивание при 20 С продолжают в течение 16 ч. Образуется осадок,находящуюся наверху фазу отделяют, остаток растворяют в водном растворе карбоната натрия, после чего несколько раз экстрагируют диэтиловым эфиром. Объединенные эфирные фазы сушат над сульфатом натрия и концентрируют досуха. Остаток растворяют в этаноле и добавляют 1,2 г фумаровой кислоты, растворенной в этаноле. Отфильтровывание кристаллов после их образования и промывка диэтиловым эфиром позволяют выделить целевой продукт. Температура плавления: 116-118 С. Пример 32. Фумарат [1-(1-пирролидинил) циклопропил]метилдиметилкарбамата. 0,62 г гидрида натрия вводят в раствор 1,98 г продукта процесса получения Р в 40 мл тетрагидрофурана. Смесь перемешивают в течение 20 мин при 5 С, в течение 1 ч при 20 С и в течение 2 ч при 40 С, после чего охлаждают до 5 С и добавляют 1,8 мл диметилкарбамоилхлорида, растворенного в 10 мл тетрагидрофурана. По прошествии 30 мин в течение 20 ч реакционную смесь выдерживают при комнатной температуре, а затем выпаривают. Остаток растворяют в дихлорметане и обрабатывают обычным путем. Хроматография на силикагеле (дихлорметан/метанол в соотношении 97/3) позволяет выделить целевой продукт, который добавлением 0,95 г фумаровой кислоты превращают в фумарат. Температура плавления: 123-124 С. 40 Пример 33. Гидрохлорид-N,N-диметил-1[2-(3-пиридил)этил]циклопропанамина. 1,5 г соединения из примера 30 растворяют в 10%-ном водном растворе карбоната натрия. Далее смесь экстрагируют диэтиловым эфиром,сушат над сульфатом натрия и концентрируют досуха. Затем к полученному остатку при 5 С добавляют 1,17 мл формальдегида и 1,43 г муравьиной кислоты, после чего 0,15 мл воды. Смесь кипятят с обратным холодильником в течение 5 ч, охлаждают до 5 С с последующим приданием щелочности добавлением 4 н. раствора гидроксида натрия. Экстракция диэтиловым эфиром с последующим выпариванием водной фазы позволяют получить остаток, который растворяют в смеси 20 мл диэтилового эфира и 3 мл диоксана/4 н. соляной кислоты. Полученную смесь разбавляют 50 мл диэтилового эфира и перемешивают в течение 20 ч, а затем фильтруют и сушат, что позволяет выделить целевой продукт. Температура плавления: 200-203 С. Пример 34. Фумарат 3-[1-(1-пирролидинил)циклопропил]метоксипиридина. 15,2 г диизопропилазодикарбоксилата при-15 С по каплям вводят в смесь, включающую 19,7 г трифенилфосфина и 300 мл тетрагидрофурана, а затем смесь охлаждают до -20 С, после чего небольшими порциями добавляют 4,95 г 3-гидроксипиридина, растворенного в 25 мл тетрагидрофурана, с последующим добавлением 7,06 г соединения из процесса получения Р, растворенного в 25 мл тетрагидрофурана. По прошествии 20 ч выдержки при -20 С смесь концентрируют досуха, после чего к остатку добавляют циклогексана. После фильтрования и концентрирования фильтрата остаток хроматографируют на силикагеле (толуол/этанол в соотношении 85/15), что позволяет выделить целевой продукт, который обработкой этанольным раствором фумаровой кислоты переводят в фумаратную форму. Температура плавления: 118-120 С. Пример 35. Фумарат N-метил-1-[2-(3-пиридилокси)этил]циклопропанамина. Стадия 1. трет-Бутилметил-1-[2-(3 пиридилокси)этил]циклопропилкарбамат. В раствор 1,7 г трифенилфосфина и 0,6 г 3 гидроксипиридина в 25 мл тетрагидрофурана последовательно вводят 1,3 г соединения из процесса получения С и 1,35 г диизопропилазодикарбоксилата. После 20 ч реакции при комнатной температуре смесь концентрируют, а затем растворяют в диэтиловом эфире и экстрагируют 1 н. соляной кислотой. После обычной обработки органические фазы выпаривают под пониженным давлением. Хроматография на силикагеле (дихлорметан/тетрагидрофуран в соотношении 97/3) позволяет выделить целевой продукт. Стадия 2. Фумарат N-метил-1-[2-(3 пиридилокси)этил]циклопропанамина. 41 Раствор 1,2 г продукта, полученного на стадии 1, растворенного в 5 мл диоксана и 4 мл 4 н. соляной кислоты в диоксане, в течение 20 ч перемешивают при комнатной температуре,после чего добавляют 10 мл диэтилового эфира. Образовавшийся осадок отделяют, растворяют в 15 мл воды и добавлением карбоната калия раствору придают щелочность. Далее водную фазу экстрагируют дихлорметаном. Органическую фазу подвергают обычной обработке, что после концентрирования под пониженным давлением позволяет выделить целевой продукт, который обработкой этанольным раствором фумаровой кислоты переводят в фумаратную форму. Температура плавления: 110-112 С. Пример 36. Гидрохлорид 2-[1-(метиламино)циклопропил]этилдиметилкарбамата. Стадия 1. 2-1-[(трет-бутоксикарбонил)(метил)амино]циклопропилэтилдиметилкарбамат. Этот продукт получают в соответствии с методом, описанным в примере 11, используя в качестве исходного материала соединение из процесса получения С. Стадия 2. Гидрохлорид 2-[1-(метиламино) циклопропил]этилдиметилкарбамата. Этот продукт получают в соответствии с методом, описанным в примере 18, стадия 2,используя в качестве исходного материала соединение, полученное на предыдущей стадии. Температура плавления: 104-108 С. Пример 37. Фумарат 2-[1-(1-пирролидинил)циклопропил]этилдиметилкарбамата. Этот продукт получают в соответствии с методом, описанным в примере 36, используя в качестве исходного материала соединение из процесса получения Т. Температура плавления: 108-110 С. Фармакологические исследования соединений по изобретению. Пример 38. Вытеснение связывания [125I]-бунгаротоксина на никотиновых рецепторах электрического органа электрического ската. Данное исследование, которое проводили согласно методу, описанному в J. Pharmacol.Exp. Ther., 271, 624-631, 1994, направлено на оценку аффинности соединений по настоящему изобретению к никотиновым рецепторам "мускульного" типа. Мембраны (1-5 мкг/мл) электрического органа электрического ската инкубируют (1 ч,22 С) в присутствии серийных концентраций(0,01-10 мкМ) каждого из соединений по изобретению (полученных путем разбавления исходного 10 мМ маточного раствора в ДМСО) в присутствии [125I]бунгаротоксина (S.A.: 7,4 ТБк/ммоль: 0,2 нМ) в буфере Кребса (трис-НСl 50 мМ, KСl 5 мМ, MgCl2 1 мМ, СаСl2 2 мМ, NaCl 100 мМ, рН 7,4), дополненном 0,01% БСА (бычий сывороточный альбумин), в конечном объеме 500 мкл. Неспецифическое связывание оп 005185 42 ределяют путем инкубации мембран в присутствии -бунгаротоксина (1 мкМ). Результаты свидетельствуют о том, что при концентрациях вплоть до 10 мкМ соединения по настоящему изобретению не проявляют существенной аффинности к никотиновым рецепторам "мускульного" типа. Пример 39. Вытеснение связывания [3 Н] эпибатидина на никотиновых рецепторах клеток линии IMR-32. Данное исследование, которое проводили согласно методу, описанному в Molec. Pharmacol., 48., 280-287, 1995, направлено на оценку аффинности соединений по настоящему изобретению к никотиновым рецепторам "ганглиозного" типа (American Soc. Neuroscience, 26, 138,2000). Мембраны (250 мкг/мл) клеток нейробластомы линии IMR-32 инкубируют (2 ч, 20 С) в присутствии серийных концентраций (0,01-10 мкМ) каждого из соединений по изобретению(полученных путем разбавления исходного 10 мМ маточного раствора в ДМСО) и[3 Н]эпибатидина (S.A.: 2464 ГБ к/ммоль: 1,5 нМ) в фосфатном буфере (NaH2PO4 20 мМ, рН 7,4) в конечном объеме 250 мкл. Неспецифическое связывание определяют путем инкубации мембран в присутствии 300 мкМ (-)никотина. Результаты свидетельствуют о том, что при концентрациях вплоть до 10 мкМ большинство соединений по настоящему изобретению не проявляют существенной аффинности к никотиновым рецепторам "ганглиозного" типа. Пример 40. Вытеснение связывания [3 Н]оксотреморина-М на мускариновых рецепторах головного мозга крысы. Данное исследование, которое проводили согласно методу, описанному в работе NaumynSchmiedeberger, опубликованной в Arch. Pharmacol., 363, 429-438, 2001, направлено на оценку аффинности соединений по настоящему изобретению к мускариновым рецепторам. Мембраны (250 мкг/мл) головного мозга крыс инкубируют (2 ч, 20 С) в присутствии серийных концентраций (0,01-10 мкМ) каждого из соединений по изобретению (полученных путем разбавления исходного 10 мМ маточного раствора в ДМСО) и [3 Н] -оксотреморина-М (S.A.: 3174 ГБ к/ммоль: 2 нМ) в фосфатном буфере(NaH2PO4 20 мМ, рН 7,4) в конечном объеме 250 мкл. Неспецифическое связывание определяют путем инкубации мембран в присутствии атропина (1 мкМ). Аффинность соединений по настоящему изобретению в отношении мускариновых рецепторов характеризуют на основе определения величины Ki. Результаты свидетельствуют о том, что при концентрациях вплоть до 10 мкМ большинство соединений по настоящему изобретению не проявляют аффинности к мускариновым рецепторам. Некоторые соединения по изобретению имеют величину Кi порядка 10 мкМ."типа 7" головного мозга крыс. Данное исследование, которое проводили согласно методу, описанному в Molec. Pharmacol., 30, 427-436, 1986, направлено на оценку аффинности соединений по настоящему изобретению к никотиновым рецепторам типа 7 центральной нервной системы. Мембраны (1000 мкг/мл) головного мозга крыс инкубируют (5 ч, 37 С) в присутствии серийных концентраций (0,01-10 мкM) каждого из соединений по изобретению (полученных путем разбавления исходного 10 мМ маточного раствора в ДМСО) и [125I]бунгаротоксина (S.A.: 7,4 ТБк/ммоль: 1 нМ) в буфере Кребса (трисHCl 50 мМ, KСl 5 мМ, MgCl2 1 мМ, СаСl2 2 мМ,NaCl 100 мМ, рН 7,4), дополненном 0,05% БСА в конечном объеме 500 мкл. Неспецифическое связывание определяют путем инкубации мембран в присутствии -бунгаротоксина (1 мкМ). Аффинность соединений по настоящему изобретению для никотиновых рецепторов типа 7 характеризуют на основе определения величиныKi. Результаты свидетельствуют о том, что при концентрациях вплоть до 10 мкМ большинство соединений по настоящему изобретению не проявляют аффинности к никотиновым рецепторам типа 7 центральной нервной системы. Некоторые соединения по изобретению имеют величину Ki порядка 10 мкМ. Пример 42. Вытеснение связывания [3 Н] цитизина на никотиновых рецепторах "типа 42" головного мозга крыс. Данное исследование, которое проводили согласно методу, описанному в Molec. Pharmacol., 39, 9-12, 1990, направлено на оценку аффинности соединений по настоящему изобретению к никотиновым рецепторам типа 42 центральной нервной системы. Мембраны (250 мкг/мл) головного мозга крыс инкубируют (2 ч, 20 С) в присутствии серийных концентраций (0,01-10 мкМ) каждого из соединений по изобретению (полученных путем разбавления исходного 10 мМ маточного раствора в ДМСО) и [3 Н] -цитизина (S.A.: 1184 ГБк/ммоль: 2 нМ) в фосфатном буфере(NaH2PO4 20 мМ, рН 7,4) в конечном объеме 250 мкл. Неспецифическое связывание определяют путем инкубации мембран в присутствии 10 мкМ(-) никотина. Аффинность соединений по настоящему изобретению для никотиновых рецепторов типа 42 характеризуют на основе определения величины Ki. Полученные результаты свидетельствуют о том, что соединения по настоящему изобретению обладают выраженной аффинностью в отношении никотиновых рецепторов типа 42 центральной нервной системы, составляющей величину порядка 10-100 нМ. 44 Эти результаты, а также результаты, полученные в примерах 39-42, показывают, что соединения по настоящему изобретению являются эффективными лигандами никотиновых рецепторов центральной нервной системы, обладающими специфичностью в отношении рецепторов типа 42. Пример 43. Измерения in vivo высвобождения ацетилхолина с помощью интракортикального микродиализа у находящихся в сознании крыс линии Wistar. Системное введение никотина и никотиновых агонистов приводит к увеличению in vivo уровня ацетилхолина в различных областях головного мозга (Neurochem. Res., 21, 1181-1186,1996; Eur. J. Pharmacol., 351, 181-188, 1998; Br. J.Pharmacol., 127, 1486-1494, 1999). В среднюю префронтальную область коры головного мозга самцов крыс линии Wistar имплантируют зонд для микродиализа. Через шесть или семь дней после имплантации зонды подвергают перфузии раствором Рингера (NaCl 147 мМ, КСl 2,7 мМ,СаСl2 1,2 мМ, MgCl2 1 мМ, неостигмин 20 нМ) со скоростью потока 1 мкл/мин, при этом животное может двигаться. После пребывания в течение 2 ч в клетке для животных им вводят внутрибрюшинно тестируемый продукт. Группе контрольных животных вводят растворитель,используемый для тестируемого продукта. После этого каждые 30 мин в течение 4 ч собирают продукты диализа (30 мкл) для измерения внесинаптических концентраций ацетилхолина с помощью ЖХВР с амперометрическим обнаружением. Результаты выражают в виде пг ацетилхолина/диализата и проводят сравнения внутри групп методом дисперсионного анализа с использованием 2 параметров (обработка и время), при этом измерения повторяют через определенный промежуток времени. Полученные результаты свидетельствуют о том, что соединения по настоящему изобретению приводят к увеличению высвобождения ацетилхолина in vivo в коре головного мозга в зависимости от дозы (от +74% до +138%) в диапазоне доз от 0,3 до 3 мг/кг i.p.; это свидетельствует о том, что соединения по настоящему изобретению являются агонистами рецепторов типа 42. Пример 44. Абдоминальные сокращения,вызываемые фенилпарабензохиноном (ПБХ) у мышей линии NMRI. Внутрибрюшинное введение спиртового раствора ПБХ вызывает абдоминальные крампиBiol., 95, 729-731, 1957). Крампи представляют собой повторяющиеся сокращения абдоминальных мышц, сопровождающиеся вытягиванием задних конечностей. Большая часть аналгетиков снимает эти абдоминальные крампи (Brit. J.Pharmacol. Chem., 32, 295-310, 1968). В момент времени t = 0 мин животных взвешивают и тес 45 тируемое соединение вводят путем i.p. инъекции. Группе контрольных животных вводят растворитель, используемый для тестируемых соединений. В момент времени t = 30 мин вводят путем i.p. инъекции спиртовой раствор ПБХ(0,2%) в объеме 0,25 мл/мышь. Сразу после введения ПБХ животных помещают в плексигласовые цилиндры (L (длина) = 19,5 см; I.D. (внутренний диаметр) = 5 см). В промежуток времени от t = 35 мин до t = 45 мин наблюдают за реакцией животных и экспериментатор регистрирует общее количество абдоминальных крампи для каждого животного. Результаты выражают в виде процента уменьшения (ингибирования) количества абдоминальных крампи по сравнению с количеством, зарегистрированным для контрольных животных, для обладающей активностью дозы соединения. Полученные результаты показывают, что уменьшение составляет от 50 до 80% для доз действующего вещества, находящихся в диапазоне от 3 до 20 мг/кг i.p., что свидетельствует о том, что соединения по изобретению обладают анталгическими свойствами. Пример 45. Социальное узнавание у крыс линии Wistar. Тест на социальное узнавание,описанный впервые в 1982 г (J. Соmр. Physiol.,96, 1000-1006, 1982), в последующие годы был предложен различными авторами (Psychopharmacology, 91, 363-368, 1987; Psychopharmacology, 97, 262-268, 1989) для изучения воздействий новых соединений на мнемокогнитивные функции. Этот тест основан на природном наличии обонятельной памяти у крыс и на их природной тенденции к забыванию и позволяет оценивать степень запоминания на основе узнавания взрослой крысой молодого животного,принадлежащего к тому же роду. Молодую крысу (возрастом 21 день), выбранную случайным образом, помещают на 5 мин в клетку, в которой обитает взрослая крыса. С помощью видеоустройства экспериментатор наблюдает за поведением социального узнавания взрослой крысы и измеряет его общую продолжительность. Затем молодую крысу удаляют из клетки,в которой находится взрослая крыса, и помещают в ее собственную клетку до повторного контакта. Взрослой крысе вводят тестируемое соединение и через 2 ч ее снова приводят в контакт с молодой крысой (на 5 мин). При этом снова наблюдают за поведением социального узнавания и измеряют его продолжительность. Критерием оценки является выраженная в секундах разность (Т 2-Т 1) между временами "узнавания" для двух контактов. Полученные результаты показывают, что разность (Т 2-Т 1) составляет от -31 с до -45 с для доз, находящихся в диапазоне от 1 до 3 мг/кгi.p., что свидетельствует о том, что соединения по изобретению даже в малых дозах очень сильно повышают степень запоминания. 46 Пример 46. Узнавание объекта крысами линии Wistar Тест на узнавание объекта на крысах линии Wistar (Behav. Brain Res., 31, 47-59,1988) основан на спонтанной исследовательской активности животного и позволяет оценить характеристики эпизодической памяти у людей. Этот тест позволяет оценить изменения активности, связанные со старением (Eur. J. Pharmacol., 325, 173-180, 1997) и с холинергическими дисфункциями (Pharm. Biochem. Behav., 53(2),277-283, 1996), и он основан на разнице во времени исследования двух объектов близкой формы - одного знакомого, другого нового. До опыта животным дают привыкнуть к окружающей среде (помещение без объекта). На первой стадии крыс помещают (на 3 мин) в помещение, в котором находятся 2 одинаковых объекта. Измеряют продолжительность исследования каждого объекта. На второй стадии опыта (3 мин),проводимой через 24 ч, один из двух объектов заменяют новым объктом. Измеряют продолжительность исследования каждого объекта. Критерием оценки является выраженная в секундах разность, Дельта, между временами исследования на второй стадии опыта нового объекта и похожего на него объекта. Контрольные животные, предварительно обработанные носителем путем перорального введения за 60 мин до каждой стадии, исследуют знакомый объект и новый объект одинаковым образом, что свидетельствует о том, что введенный ранее объект забыт. Животные, обработанные соединением,усиливающим мнемокогнитивные функции, в основном исследуют новый объект, что свидетельствует о том, что введенный ранее объект запомнен. Полученные результаты свидетельствуют о наличии разницы, Дельта, составляющей приблизительно 6 с, для доз, находящихся в диапазоне от 0,3 до 1 мг/кг, вводимых перорально,что свидетельствует о том, что соединения по изобретению даже в малых дозах существенно повышают степень запоминания. Пример 47. Фармацевтические композиции для 1000 таблеток, каждая из которых содержит по 10 мг действующего вещества Соединение из примера 18 10 г Гидроксипропилметилцеллюлоза 10 г Пшеничный крахмал 15 г Лактоза 90 г Стеарат магния 2 г ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы (I)p обозначает целое число от 0 до 6 включительно, 47n обозначает целое число от 0 до 6 включительно,R1 и R2, которые могут быть одинаковыми или разными, каждый независимо друг от друга обозначает группу, выбранную из атома водорода, линейной или разветвленной (С 1-С 6)алкильной группы, арильной группы и арил(С 1 С 6)алкильной группы, которая содержит линейный или разветвленный алкильный остаток, илиR1+R2 совместно с азотным атомом, с которым они связаны, образуют насыщенную моноциклическую систему, включающую от 5 до 6 членов,X обозначает группу, выбранную из атома кислорода, атома серы, группы -СН=СН-, метилена, группы формулы -HC=N-O- и группы формулы -О-СН 2-СН=СН-, причем в соединениях формулы (I) кислородный атом этих групп связан с остатком Y,Y обозначает группу, выбранную из арила,гетероарила, арил(С 1-С 6)алкила, в котором алкильный остаток является линейным или разветвленным, гетероарил(С 1-С 6)алкила, в котором алкильный остаток является линейным или разветвленным, -С(О)-А и -C(S)-A,А обозначает группу, выбранную из линейного или разветвленного (С 1-С 6)алкила, гетероарила и NR3R4, где каждый из R3 и R4, которые могут быть одинаковыми или разными,обозначает группу, выбранную из водородного атома, линейной или разветвленной (С 1-С 6)алкильной группы,их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием, при условии, что в случае 1,1-дизамещенных соединений формулы (I),p имеет значения, отличные от нуля, когдаX обозначает метиленовую группу, n обозначает ноль, Y обозначает арильную или гетероарильную группу, а каждый из R1 и R2, которые могут быть одинаковыми или разными, обозначает водородный атом, линейную или разветвленную(С 1-С 4)алкильную группу, бензильную группу,фенилэтильную группу или совместно с азотным атомом, с которым они связаны или насыщенную карбоциклическую систему, включающую от 5 до 7 членов,p имеет значения, отличные от нуля, когдаX обозначает метиленовую группу, n обозначает ноль, Y обозначает ацетильную группу, а каждый из R1 и R2, которые могут быть одинаковыми или разными, обозначает водородный атом,линейную или разветвленную (С 1-С 4)алкильную группу, фенильную группу, бензильную группу,R1 и R2 одновременно не могут обозначать метильные группы либо когда каждый из p и n обозначает 1, X обозначает кислородный атом, a Y обозначает группу, выбранную из п-нитробензоила, паминобензоила,п-хлорфениламинокарбонила или ацетила, 005185 48 либо когда р обозначает ноль, n обозначает 1, X обозначает кислородный атом или атом серы, a Y обозначает 2-хинолильную группу,замещенную в 3 положении линейной или разветвленной (С 3-С 4)алкильной группой, или фенильную группу,Y не обозначает 1,2-бензизоксазол-3 ильную группу, когда n обозначает 1, p обозначает ноль, а X обозначает кислородный атом,в случае 1,2-дизамещенных соединений формулы (I),R1 и R2 одновременно не могут обозначать водородный атом, когда каждый из p и n обозначает ноль, а X и Y совместно обозначают феноксигруппу (необязательно замещенную одной или двумя одинаковыми или разными группами, выбранными из метокси, диметиламиногруппы, атома галогена, метила, трифторметила, нитро- и аминогрупп), фенилсульфанильную группу, бензилоксигруппу, бензильную группу или 2-фенилэтильную группу,R1 и R2 одновременно не могут обозначать метильную группу, когда каждый из p и n обозначает ноль, а X и Y совместно обозначают феноксигруппу (необязательно замещенную группой, выбранной из атома хлора и трифторметила), фенилсульфанильную группу или бензильную группу,а также при условии, что соединения формулы (I) отличны от следующих соединений:(1-бензилциклопропил)метанамин,(1-бензилциклопропил)-N,N-диметилметанамин,2-(феноксициклопропил)метанамин,2-(феноксиметил)циклопропанамин,(N,N-диметил)-2-(ацетоксиметил)циклопропанметанамин,N-2-[2-(бензилокси)этил]циклопропилN,N-диметиламин; под арильной группой подразумевают фенильную, дифенильную, нафтильную, дигидронафтильную, тетрагидронафтильную, инданильную или инденильную группу, причем каждая из этих групп необязательно замещена одной или несколькими одинаковыми или разными группами, выбранными из атомов галогена, линейной или разветвленной (C1-С 6)алкильной, гидроксильной, циано-, нитрогрупп, линейной или разветвленной (C1-C6)алкокси, линейной или разветвленной (С 2-С 7)ацильной,линейной или разветвленной (С 1-С 6)алкоксикарбонильной, линейной или разветвленной (С 1 С 6)тригалоалкильной, линейной или разветвленной (С 1-С 6)тригалоалкоксигрупп и аминогрупп, необязательно замещенных одной или двумя линейными или разветвленными (С 1-С 6) алкильными группами; под гетероарильной группой подразумевают моноциклическую ароматическую или бициклическую систему, включающую от 5 до 12 членов, содержащую от одного до трех одинаковых или разных гетероатомов, выбранных 49 из атомов кислорода, азота и серы, одно из колец которой в случае бициклической системы обладает ароматическим характером, а другое кольцо которой может быть ароматическим или частично гидрогенизированным, причем каждая из этих групп необязательно замещена одной или несколькими одинаковыми или разными группами, выбранными из заместителей, указанных выше для арильной группы. 2. Соединения формулы (I) по п.1, отличающиеся тем, что n обозначает целое число от 0 до 2 включительно, их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 3. Соединения формулы (I) по п.1, отличающиеся тем, что каждый из R1 и R2, которые могут быть одинаковыми или разными, обозначает водородный атом или линейную или разветвленную (С 1-С 6)алкильную группу, их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 4. Соединения формулы (I) по п.1, отличающиеся тем, что X обозначает кислородный атом, их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 5. Соединения формулы (I) по п.1, отличающиеся тем, что Y обозначает группу, выбранную из -C(O)NR3R4, где R3 и R4 имеют такие же значения, как указанные для формулы(I), ацетила, -С(О)-гетероарила, арил-С 1-С 6 алкила, который включает линейный или разветвленный алкильный остаток, и гетероарила, их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 6. Соединения формулы (I) по п.1, отличающиеся тем, что Y обозначает пиридильную группу, их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 7. Соединения формулы (I) по п.1, отличающиеся тем, что они представляют собой соединения формулы (IA) в которой n, р, X, Y, R1 и R2 имеют такие же значения, как указанные для формулы (I), их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 8. Соединения формулы (I) по п.1, отличающиеся тем, что они представляют собой соединения формулы (IB) в которой n, р, X, Y, R1 и R2 имеют такие же значения, как указанные для формулы (I), их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 50 9. Соединения формулы (I) по п.1, отличающиеся тем, что р обозначает целое число,значение которого составляет 0 или 1, их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 10. Соединения формулы (IB) по п.8, отличающиеся тем, что р обозначает 0 или 1, n обозначает 0 или 1, каждый из R1 и R2, которые могут быть одинаковыми или разными, обозначает водородный атом или линейную или разветвленную (С 1-С 6)алкильную группу, X обозначает кислородный атом, a Y обозначает группу, выбранную из фенил(С 1-С 6)алкила, в котором алкильный остаток является линейным или разветвленным, пиридила и -С(О)-А, где А обозначает линейную или разветвленную (С 1 С 6)алкильную группу, моно(С 1-С 6)алкиламиноили ди(С 1-С 6)алкиламиногруппу, в которой алкильный остаток(остатки) является линейным или разветвленным, их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 11. Соединения формулы (IA) по п.7, отличающиеся тем, что p обозначает 0 или 1, n обозначает целое число от 0 до 3 включительно,каждый из R1 и R2, которые могут быть одинаковыми или разными, обозначает водородный атом, линейную или разветвленную (С 1-С 6)алкильную группу или совместно с азотным атомом, с которым они связаны, они образуют пирролидинильный радикал, X обозначает кислородный атом, атом серы или группу -СН=СН-, a(необязательно замещенного гидроксильной группой, линейной или разветвленной (С 1-С 6) алкильной группой или атомом галогена), пиридила, пиридил(С 1-С 6)алкила, в котором алкильный остаток является линейным или разветвленным (причем пиридильный радикал в каждой из этих групп необязательно замещен группой, выбранной из атома галогена и линейной или разветвленной (С 1-С 6)алкильной группы), и-С(О)-А, где А обозначает группу, выбранную из линейного или разветвленного (С 1-С 6)алкила,линейного или разветвленного моно(С 1-С 6)алкиламино-, линейной или разветвленной ди-С 1 С 6 алкиламиногруппы и пиридила, их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 12. Соединения формулы (I) по п.1, которые представляют собой 2-[1-(диметиламино)циклопропил]этилметилкарбамат,2-[1-(диметиламино)циклопропил]этилдиметилкарбамат,[1-(диметиламино)циклопропил]метилдиметилкарбамат,[1-(диметиламино)циклопропил]метилацетат,2-[1-(диметиламино)циклопропил]этилацетат, 51 1-[(диметиламино)метил]циклопропилацетат,[1-(диметиламино)циклопропил]метилникотинат,N,N-диметил-l-[(3-пиридилокси)метил] циклопропанамин,N-метил-1-[(3-пиридилокси)метил]циклопропанамин,N,N-диметил-1-[(3-пиридилметокси)метил]циклопропанамин,N,N-диметил-1-[2-(3-пиридилокси)этил] циклопропанамин,4-[2-[1-(диметиламино)циклопропил] этил]сульфанилфенол,-цис-2-(диметиламино)циклопропилметилкарбамат,-транс-2-(диметиламино)циклопропилметилкарбамат,-цис-2-(диметиламино)циклопропилацетат,-транс-2-(диметиламино)циклопропилацетат,-цис-2-(диметиламино)циклопропилметилацетат,-транс-2-(диметиламино)циклопропилметилацетат,-цис-2-[(бензилокси)метил]-N,N-диметилциклопропанамин,-транс-2-[(бензилокси)метил]-N,N-диметилциклопропанамин,-транс-2-[(диметиламино)метил]циклопропилацетат,дигидрохлорид 1-[(3-пиридилокси)метил] циклопропанамина,гидрохлорид N-метил-1-[(6-метил-3-пиридил)окси]метилциклопропанамина,гидрохлорид N-метил-1-[(6-хлор-3-пиридил)окси]метилциклопропанамина,гидрохлорид N-1-[(3-фторфенокси)метил] циклопропил-N-метиламина,фумарат 3-[1-(диметиламино)циклопропил]пропилдиметилкарбамата,фумарат 3-[1-(диметиламино)циклопропил]пропилметилкарбамата,дигидрохлорид 52 фумарат 2-[1-(1-пирролидинил)циклопропил]этилдиметилкарбамата,их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 13. Способ получения соединений формулы (I), отличающийся тем, что при его осуществлении в качестве исходного материала используют соединение формулы (II) в которой G обозначает защитную группу для гидроксильных функциональных групп, которую обычно применяют в органическом синтезе, R обозначает водородный атом или линейную или разветвленную (С 1-С 6)алкильную группу, а n1 обозначает 0 или 1,причем соединения формулы (II) либо вводят во взаимодействие с жидким аммиаком в присутствии цианида щелочного металла в спиртовом растворителе с получением соединений формулы (III) в которой G обозначает защитную группу для гидроксильных функциональных групп, a n1 обозначает 0 или 1,и соединения формулы (III) обрабатывают дигалогенидом в присутствии основания, такого как гидроксид натрия, с получением соединений формулы (IV) в которой G и n1 имеют значения, указанные выше,первичную аминогруппу соединений формулы (IV) селективно защищают защитной группой G2, обычно применяемой в органической химии,такой как БОК(третбутоксикарбонил), с получением соединений формулы (V) в которой n1, G и G2 имеют такие же значения,как указанные выше,после чего соединения формулы (V) последовательно обрабатывают в основной среде соединением формулы (VIA)(VIA),в которой R1 имеет такие же значения, как указанные для формулы (I), а L1 обозначает обычную для органического синтеза уходящую группу,защитную группу, у аминогруппы которых далее удаляют, и соединения либо не подвергают никакой последующей обработке и в результате получают соединения формулы (VIIA) в которой R1, n1 и G имеют значения, указанные выше,либо вводят во взаимодействие с соединением формулы (VIB)(VIB),в которой R2a имеет такие же значения, как R2,которые указаны для формулы (I), за исключением водородного атома, а значения L1 указаны выше, получая соединения формулы (VIIB) в которой R1, R2a, n1 и G имеют такие же значения, как указанные выше, причем совокупность соединений формул (VIIA) и (VIIB) образует соединения формулы (VII) в которой n1, G, R1 и R2a, имеют такие же значения, как указанные выше,защитную группу для гидроксильной группы соединений формулы (VII) удаляют,после чего соединения либо обрабатывают соединением формулы(VIII),в которой Y имеет такие же значения, как указанные для формулы (I), а L1 имеет такие же значения, как указанные выше, получая соединения формулы (I/a) как частный случай соединений формулы (I) в которой n1, Y, R1 и R2 имеют такие же значения, как указанные для формулы (I),либо обрабатывают SOCl2 с получением соединений формулы (IX) в которой n1, R1 и R2 имеют такие же значения,как указанные выше,проводят реакцию соединений формулы(X),в которой Y1 обозначает арильную группу,арил(С 1-С 6)алкильную группу, в которой алкильный остаток является линейным или разветвленным, гетероарильную группу или гетероарил(С 1-С 6)алкильную группу, в которой алкильный остаток является линейным или разветвленным, с получением соединений формулы (I/b) как частный случай соединений формулы (I) в которой Y1, n1, R1 и R2 имеют такие же значения, как указанные выше,либо, когда n1 обозначает 1, обрабатывают воздействием обычного для органического синтеза окислителя, получая соединения формулы в которой R1 и R2 имеют такие же значения, как указанные выше,и соединения формулы (XI) либо обрабатывают гидроксиламином формулы (XII)(XII),в которой Y2 обозначает водородный атом или группу Y1, которая имеет указанные выше значения, получая соединения формулы (I/с) как частный случай соединений формулы (I) в которой Y2, R1 и R2 имеют такие же значения,как указанные выше,соединения формулы (I/с), у которых в частном случае Y2 обозначает водородный атом,обрабатывают воздействием соединения формулы (XIV)(XIV),в которой L1 имеет такие же значения, как указанные выше, a Y3 обозначает группу формулы-С(О)-А или -C(S)-A, значения которой указаны в описании формулы (I), получая соединения формулы (I/d) как частный случай соединений формулы (I) в которой Y3, R1 и R2 имеют такие же значения,как указанные выше,либо обрабатывают в условиях проведения реакции Виттига, а затем обрабатывают воздействием обычного для органического синтеза восстановителя, получая соединения формулы(I/е) как частный случай соединений формулы в которой Y1, R1 и R2 имеют такие же значения,как указанные выше,либо обрабатывают воздействием соединения формулы Ph3P=CH-CO2Et, a затем восстанавливают воздействием обычного для органического синтеза восстановителя, получая соединения формулы (XV) 55 в которой R1 и R2 имеют такие же значения, как указанные выше,соединения формулы (XV) обрабатывают соединением формулы (VIII), которая описана выше, получая соединения формулы (I/f) как частный случай соединений формулы (I) в которой Y, R1 и R2 имеют такие же значения,как указанные для формулы (I),либо, когда n1 обозначает 1, превращают в их соответствующие галоидированные производные в обычных для процессов в органической химии условиях, а затем вводят во взаимодействие с цианидом щелочного металла в среде диметилсульфоксида с получением соединений формулы (XVI) в которой R1 и R2 имеют такие же значения, как указанные выше,и соединения формулы (XVI) в обычных условиях превращают в сложные эфиры, а затем обрабатывают восстановителем с получением соединений формулы (XVIIA) в которой R1 и R2 имеют такие же значения, как указанные выше, и соединения формулы(XVIIA) можно подвергать вновь, повторно тому же самому ряду обработок, в результате которых получают соединения формул (XVI) и в которой R1 и R2 имеют такие же значения, как указанные выше, а n3 обозначает целое число от 3 до 6 включительно, причем совокупность соединений формул (XVIIA) и (XVIIB) образует соединения формулы (XVIII) в которой R1 и R2 имеют такие же значения, как указанные выше, а n2 обозначает целое число от 2 до 6 включительно, и соединения формулы(XVIII) либо вводят во взаимодействие с соединением формулы Y-L1, которая описана выше,получая соединения формулы (I/g) как частный случай соединений формулы (I) в которой Y, n2, R1 и R2 имеют такие же значения, как указанные выше, 005185 56 либо вводят во взаимодействие с SOCl2 и затем обрабатывают соединением формулы (X),которая описана выше, получая соединения формулы (I/h) как частный случай соединений формулы (I) в которой Y1, n2, R1 и R2 имеют такие же значения, как указанные выше,либо обрабатывают воздействием окислителя, после чего проводят реакцию полученного альдегидного промежуточного продукта с гидроксиламином формулы (XII), которая описана выше и в которой Y2 конкретно обозначает водородный атом, а затем, если необходимо, полученные соединения обрабатывают воздействием соединения формулы (XIV), которая описана выше, получая соединения формулы (I/i) как частный случай соединений формулы (I) в которой R1, R2 и Y имеют такие же значения,как указанные для формулы (I), а n4 обозначает целое число, значение которого равно (n2-1), гдеn2 имеет такие же значения, как указанные выше,либо после обработки воздействием окислителя обрабатывают в условиях проведения реакции Виттига, а затем обрабатывают в обычных для органического синтеза восстановительных условиях, получая соединения формулы(I/j) как частный случай соединений формулы в которой Y1, n4, R1 и R2 имеют такие же значения, как указанные выше,либо в присутствии Ме 3 Аl в неполярном растворителе вводят во взаимодействие с соединением формулы (XIX)(XIX),в которой R1 и R2 имеют такие же значения, как указанные для формулы (I), с получением соединений формулы (XX) в которой n1, G, R1 и R2 имеют такие же значения, как указанные выше, и соединения формулы (XX) обрабатывают воздействием восстановителя, который обычно используют в органическом синтезе, с получением соединений формулы (XXI) в которой G, n1, R1 и R2 имеют такие же значения, как указанные выше, и соединения формулы (XXI) можно вводить во всю совокупность тех взаимодействий, в которых участвуют соединения формулы (VII), с получением соединений формулы (I/k) как частный случай соединений формулы (I) в которой X, Y, n, R1 и R2 имеют такие же значения, как указанные для формулы (I),либо вводят во взаимодействие с тионилхлоридом, когда R обозначает водородный атом,а затем помещают в водную среду в присутствии диазометана с получением соединений формулы (XXII) в которой n1 и G имеют такие же значения, как указанные выше,и соединения формулы (XXII) можно вновь вводить несколько раз в такой же ряд взаимодействий с получением соединений формулы (XXIII) в которой n1 и G имеют такие же значения, как указанные выше, a p1 обозначает целое число от 2 до 6 включительно, и соединения формулы (XXIII) вводят во взаимодействие с дифенилфосфорилазидом,гидролизуют, а затем обрабатывают соединением формулы (VIA), как изложено выше, с получением соединений формулы (XXIV) в которой R1 имеет такие же значения, как указанные для формулы (I), a G, n1 и p1 имеют такие же значения, как указанные выше,и соединения формулы (XXIV) можно вводить во всю совокупность тех взаимодействий, в которых участвуют соединения формулы(VII), с получением соединений формулы (I/l) как частный случай соединений формулы (I) в которой X, Y, R1 и n имеют такие же значения,как указанные для формулы (I), a p1 имеет такие же значения, как указанные выше,причем совокупность соединений формул с (I/a) по (I/l) составляет всю совокупность соединений по изобретению, которые очищают,когда это соответствует необходимости, согласно обычной технологии очистки, которые можно разделять на их различные изомеры в соответствии с обычной технологией разделения и которые превращают, когда это соответствует необходимости, в их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 14. Фармацевтические композиции, в качестве действующего компонента включающие по меньшей мере одно соединение по одному любому из пп. с 1 по 12 отдельно или в сочетании с одним или несколькими инертными, нетоксичными, фармацевтически приемлемыми наполнителями или носителями. 15. Фармацевтические композиции по п.14,включающие по меньшей мере один действующий компонент по одному любому из пп. с 1 по 12 для использования в качестве никотинового лиганда 42-рецепторов. 16. Фармацевтические композиции по п.14,включающие по меньшей мере один действующий компонент по одному любому из пп. с 1 по 12 для применения при лечении недостаточности памяти, связанной со старением головного мозга и с нейродегенеративными заболеваниями, а также для лечения нарушений настроения,синдрома Туретта, синдрома гиперактивности с недостаточностью внимания, вызванной резким прекращением курения и болями. 17. Фармацевтические композиции по п.14,включающие по меньшей мере один действующий компонент по одному любому из пп. с 1 по 12 для применения при лечении недостаточности памяти, связанной с болезнью Альцгеймера,болезнью Паркинсона, болезнью Пика, болезнью Корсакова или опухолью лобной доли и субкортикальной деменции.
МПК / Метки
МПК: A61K 31/13, C07D 213/30, C07D 213/80, C07D 295/096, C07C 321/28, C07C 217/52, A61K 31/15, C07C 271/12, C07D 213/70, C07D 213/65, C07C 219/24
Метки: композиции, 2-дизамещенные, новые, фармацевтические, способ, содержащие, получения, циклопропановые, производные
Код ссылки
<a href="https://eas.patents.su/30-5185-novye-1-1-i-1-2-dizameshhennye-ciklopropanovye-proizvodnye-sposob-ih-polucheniya-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Новые 1, 1- и 1, 2-дизамещенные циклопропановые производные, способ их получения и содержащие их фармацевтические композиции</a>
Предыдущий патент: Пестицидная композиция
Следующий патент: Средство для нормализации поступления химических элементов в клетку
Случайный патент: Полимерная композиция для производства труб и способ ее получения


































