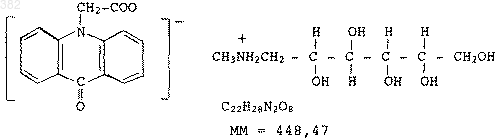Полимерные конъюгаты бета-1а-интерферона и их использование
Номер патента: 4789
Опубликовано: 26.08.2004
Авторы: Хочман Паула, Ранкель Лаура, Пепински Блэйк, Витти Эдриан, Брикельмэйер Маргот
Формула / Реферат
1. Композиция, содержащая гликозилированный b1a-интерферон с аминокислотной последовательностью SEQ ID NO:25, связанный с неприродным полимером по N-концу указанного гликозилированного b1a-интерферона, причем указанный полимер содержит полиалкиленгликолевый радикал.
2. Композиция по п.1, в которой полиалкиленгликолевый фрагмент связан с b1a-интерфероном посредством группы, выбранной из альдегидной группы, малеимидной группы, винилсульфоновой группы, галогенацетатной группы, множества гистидиновых остатков, гидразиновой группы и аминотиоловой группы.
3. Композиция по п.1, в которой гликозилированный b1a-интерферон является более активным, чем b1b-интерферон при измерении в анализе противовирусной активности.
4. Композиция по п.3, в которой b1a-интерферон сохраняет 50-100% эффективности b1a-интерферона без указанного полимера при измерении в анализе противовирусной активности.
5. Композиция b1a-интерферона по п.1, в которой полимер имеет молекулярную массу приблизительно от 5 приблизительно до 40 кДа.
6. Фармацевтическая композиция, содержащая композицию b1a-интерферона по п.5.
7. Композиция, содержащая мутантный b-интерферон, связанный с неприродным полимером по N-концу указанного мутантного b-интерферона, причем указанный полимер содержит полиалкиленгликолевый радикал, где указанный мутантный b-интерферон представляет собой полипептид, содержащий аминокислотную последовательность, выбранную из группы, содержащей SEQ ID NO:26-40.
8. Физиологически активная композиция b-интерферона, содержащая физиологически активный b1a-интерферон с аминокислотной последовательностью SEQ ID NO:25, связанный с полимером, содержащим полиалкиленгликолевый радикал, где физиологически активный b1a-интерферон и полиалкиленгликолевый фрагмент взаимно расположены таким образом, что физиологически активный b1a-интерферон в физиологически активной композиции b-интерферона обладает повышенной активностью относительно физиологически активного b1b-интерферона при измерении в анализе противовирусной активности.
9. Композиция по п.8, в которой
а) b1a-интерферон связан с полимером на N-концевом участке;
б) b1a-интерферон связан с полимером на C-концевом участке или вблизи C-концевого участка; или
в) b1a-интерферон связан с полимером посредством гликанового радикала.
10. Устойчивый водорастворимый комплекс конъюгированного b1a-интерферона, содержащий b1a-интерферон, связанный с полиэтиленгликолевым радикалом, где b1a-интерферон имеет аминокислотную последовательность SEQ ID NO:25 и связан с полиэтиленгликолевым фрагментом лабильной связью по N-концу, причем указанная лабильная связь расщепляется биохимическим гидролизом и/или протеолизом.
11. Применение b1a-интерферона с аминокислотной последовательностью SEQ ID NO:25 для получения фармацевтической композиции для профилактического или терапевтического лечения воспалительных, аутоиммунных, ангиогенных, опухолевых или вирусных заболеваний, поддающихся лечению b1a-интерфероном, у млекопитающего, где указанный b1a-интерферон с аминокислотной последовательностью SEQ ID NO:25 связан с полиэтиленгликолевым радикалом.
12. Применение по п.11, согласно которому
а) b1a-интерферон связан с полимером на N-концевом участке;
б) b1a-интерферон связан с полимером на C-концевом участке или вблизи C-концевого участка; или
в) b1a-интерферон связан с полимером посредством гликанового радикала.
13. Способ продления активности b1a-интерферона с аминокислотной последовательностью SEQ ID NO:25 в системе in vivo или in vitro, предусматривающий соединение указанного b1a-интерферона с радикалом неприродного полимера с получением конъюгата полимер-b1a-интерферон и введение указанного конъюгата в систему in vivo или in vitro.
14. Способ по п.13, согласно которому
а) b1a-интерферон связывают с полимером на N-концевом участке;
б) b1a-интерферон связывают с полимером на C-концевом участке или вблизи C-концевого участка; или
в) b1a-интерферон связывают с полимером посредством гликанового радикала.
15. Способ по п.13, согласно которому указанный полимер содержит полиалкиленгликолевый радикал.
Текст
1 Предпосылки изобретения Применение полипептидов и белков для системного лечения конкретных заболеваний в настоящее время широко используется в медицинской практике. Роль, которую эти вещества играют в терапии, так важна, что многочисленные усилия исследователей направлены на их синтез в больших количествах с помощью технологии рекомбинантных ДНК. Многие из этих полипептидов являются эндогенными молекулами, биологическое действие которых осуществляется очень эффективно и специфично. Основной фактор, ограничивающий применимость этих белковых веществ для их намеченного применения, состоит в том, что при парентеральном введении они выводятся из организма в течение короткого времени. Это может происходить в результате протеазного метаболизма или при клиренсе с вовлечением обычных механизмов удаления белков, таких как фильтрация в почках. Пероральный путь введения этих веществ является еще более проблематичным, так как кроме протеолиза в желудке, высокая кислотность желудка разрушает их до того, как они достигнут желаемых тканеймишеней. Проблемы, связанные с этими путями введения белков, хорошо известны в фармацевтической промышленности, и в попытках решить их используются различные стратегии. Опубликовано огромное количество работ,связанных со стабилизацией белков. Известны различные пути конъюгирования белков с полимерными материалами, включая использование декстранов, поливинилпирролидонов, гликопептидов, полиэтилен-гликоля и полиаминокислот. Имеются сообщения, что полученные в результате конъюгированные полипептиды сохраняют свою биологическую активность и растворимость в воде для парентеральных путей введения. Интерфероны представляют собой семейство пептидов, на котором были сфокусированы многочисленные клинические исследования и усилия, предпринятые для усовершенствования способов их введения и биологического усвоения. Наличие интерферона было определено при различных клинических болезненных состояниях. Применимость бета-интерферона человека, одного из членов этого семейства, лучше всего установлена для лечения рассеянного склероза. Для лечения этого заболевания в Европе и США недавно были лицензированы две формы рекомбинантного бета-интерферона. Одна форма представляет собой бета-1 аинтерферон (торговые марка и названиеAVONEX, mfg. Biogen, Inc., Cambridge, MA), и здесь далее называемая "бета-1 а-интерферон" или "IFN-бета-1 а", или "IFN1a" или"интерферон 1a", используя взаимозаменяемо. Другая форма представляет собой бета-1bинтерферон (торговые марка и названиеBATASERON, berlex, Richmond, CA), здесь далее называемый "бета-1b-интерферон". Бета 1 а-интерферон продуцируется в клетках млекопитающих с использованием нативной последовательности гена человека и гликозилируется,тогда как бета-1b-интерферон продуцируется бактериями Е. coli с использованием модифицированной последовательности гена человека,которая содержит генетически введенную замену цестеина на серин в аминокислотном положении 17 и не гликозилируется. Ранее некоторые из авторов непосредственно сравнили относительную эффективностьin vitro бета-1 а-интерферона и бета-1bинтерферона в функциональных исследованиях и показали, что удельная активность бета-1 аинтерферона приблизительно в 10 раз выше,чем удельная активность бета-1b-интерферона(Runkel et al., 1998, Pharm. Res. 15: 641-649). В результате исследований, призванных идентифицировать структурную основу этих различий в активности, авторы идентифицировали гликозилирование как единственное из известных структурных отличий между продуктами, которое влияет на удельную активность. Эффект углевода был более очевидным благодаря своему стабилизирующему воздействию на структуру. Стабилизирующий эффект углевода наблюдали в экспериментах по термической денатурации и SEC анализе. Отсутствие гликозилирования также коррелирует с усилением агрегации и повышенной чувствительностью к термической денатурации. Ферментативное удаление углевода из бета-1 а-интерферона с помощьюPNGaзы F вызывает интенсивное осаждение дегликозилированного продукта. Эти исследования показывают, что, несмотря на сохранение одинаковой последовательности у бета-1 а-интерферона и бета-1bинтерферона, они различны биохимически и,таким образом, многое из того, что известно о бета-1b-интерфероне, не может быть применено к бета-1 а-интерферону, и наоборот. Сущность изобретения Авторы использовали преимущества гликозилированного бета-интерферона по сравнению с его негликозилированными формами. В частности, авторы разработали композицию бета-1 а-интерферона с повышенной активностью по сравнению с бета-1b-интерфероном,которая также имеет салюторные свойства конъюгированных с ПЭГ белков, как правило,без существенной потери активности по сравнению с неконъюгированными формами бета-1 аинтерферона. Так, если модификации произведены таким образом, что продукты (конъюгаты полимер-бета-1 а-интерферон) сохраняют всю или большую часть своей биологической активности, в результате, могут быть получены следующие свойства: изменение фармакокинетики и фармакодинамики, что приводит к увеличению периода полужизни и изменению распре 3 деления в тканях (например, способность оставаться в сосудистом русле в течение длительного периода времени), повышенная стабильность в растворе, сниженная иммуногенность, защищенность от протеолитического расщепления и последующей потери активности. Такая готовая препаративная форма является существенным достижением в фармацевтической и медицинской областях и может внести значительный вклад в лечение различных заболеваний, в которых применяется интерферон, таких как рассеянный склероз, фиброз и другие воспалительные или аутоиммунные заболевания, злокачественные опухоли, гепатит и другие вирусные заболевания. В частности, способность сохраняться в течение длительного времени в сосудистом русле позволяет использовать бета-1bинтерферон для подавления ангиогенеза и для проникновения через гематоэнцефалический барьер. Коме того, улучшение термической стабильности путем создания конъюгатов полимербета-1a-интерферон является преимуществом в том случае, когда в готовой препаративной форме бета-1 а-интерферон используется в виде порошка для последующего применения посредством ингаляции. Авторы использовали знание кристаллографической структуры бета-1 а-интерферона и разработали конъюгат полимер-бета-1 а-интерферон, в котором полимер связан с бета-1 аинтерфероном в таком(их) участке(ах), которые позволяют конъюгату сохранять полную активность бета-1 а-интерферона по сравнению с неконъюгированным бета-1 а-интерфероном. Один аспект настоящего изобретения представляет собой конъюгированный комплекс бета-1 а-интерферона, где бета-1a-интерферон ковалентно связан с полимером, включенным как интегрированный в него участок полиалкиленгликоля. В одном конкретном аспекте настоящее изобретение относится к физиологически активной композиции бета-1 а-интерферона, содержащей физиологически активный бета-1 аинтерферон, соединенный с полимером, содержащим полиалкиленгликолевый фрагмент, где бета-1a-интерферон и полиалкиленгликолевый фрагмент собраны таким образом, что физиологически активный бета-1 а-интерферон в этой композиции имеет увеличенный период полужизни по сравнению с бета-1 а-интерфероном самим по себе (то есть в неконъюгированной форме, без соединенного с ним полимера). Другой аспект данного изобретения представляет собой композицию бета-1 аинтерферона, содержащую физиологически активный бета-1 а-интерферон, соединенный с полимером, в которой интерферон является гибридным белком, предпочтительно гибридным иммуноглобулином. В таких комплексах тесная близость с N-окончанием (место конъюгирования с полимером) и С-окончанием (участок 4 слияния с Ig фрагментом) предполагает, что конъюгирование с полимером может снизить иммуногенность гибридного белка. В другом аспекте настоящее изобретение относится к физиологически активному бета-1 аинтерферону, соединенному с полимером, содержащему полиалкиленгликолевый фрагмент,где бета-1a-интерферон и полиалкиленгликолевый фрагмент собраны таким образом, что физиологическая активность бета-1 а-интерферона в композиции имеет повышенную активность по отношению к бета-1a-интерферону самому по себе (то есть к его неконъюгированной форме, без соединения с полимером). Другое воплощение изобретения представляет собой конъюгированный белок бета-1 аинтерферон, в котором бета-1 а-интерфероновый фрагмент мутирован для получения мутеинов сизбирательно повышенной антивирусной и/или антипролиферативной активностью по сравнению с немутированными формами бета-1 аинтерферона. Это изобретение относится еще к одному аспекту, а именно к стабильному, водорастворимому комплексу конъюгированного бета-1aинтерферона, содержащему физиологически активный бета-1a-интерферон, ковалентно связанный с физиологически совместимым полиэтиленгликолевым фрагментом. В таком комплексе бета-1a-интерферон может быть ковалентно связан с физиологически совместимым полиэтиленгликолевым фрагментом лабильной ковалентной связью по свободным аминокислотным группам бета-1 а-интерферона, где лабильная ковалентная связь разрывается in vivo биохимическим гидролизом и/или протеолизом. В другом аспекте настоящее изобретение относится к дозированной форме, содержащей фармацевтически приемлемый носитель и стабильный водорастворимый комплекс бета-1 аинтерферона, соединенного с физиологически совместимым полиэтиленгликолем. В другом аспекте композиции ковалентно связанного бета-1a-интерферона, такие как описанный выше, могут использовать названный бета-1 а-интерферон для диагностических или invitro применений, где бета-1 а-интерферон представляет, например, диагностический реагент для иммуноанализа или другого диагностического применения или применения не in vivo. При подобном нетерапевтическом применении комплексы настоящего изобретения могут полезно использоваться в качестве стабилизирующих композиций, которые могут, например,представлять препарат в соответствующих растворителях или входить в другую готовую препаративную форму, основанную на растворе,для обеспечения стабильной композиционной формы, обладающей повышенной устойчивостью к разрушению. Модификация бета-1 а-интерферона с нетоксичным полимером может обеспечить опре 5 деленные преимущества. Если модификация проводится способом, в котором продукты(конъюгаты полимер-бета-1 а-интерферон) сохраняют большую часть своей биологической активности, в результате, могут быть получены следующие свойства: измененная фармакокинетика и фармакодинамика, приводящая к повышению периода полужизни и к изменению распределения в тканях (например, к способности находиться в сосудистом русле в течение длительного периода времени), повышенная стабильность в растворе, сниженная иммуногенность, защита модифицированного бета-1 аинтерферона от протеолитического переваривания и последующей потери активности; повышенная термическая стабильность, приводящая к более эффективной готовой препаративной форме порошкообразного бета-1 а-интерферона для перорального применения или для ингаляции. Описанный выше бета-1 а-интерферон с улучшенными свойствами может быть эффективен в терапии при пероральном, аэрозольном или парентеральном применении. При использовании модифицированного бета-1 аинтерферона также возможны другие пути введения, такие как назальный или чрескожный. Другой аспект настоящего изобретения представляет собой способ подавления ангиогенеза и неоваскуляризации, включающий применение эффективного количества композиции по данному изобретению. В результате повышения содержания и длительности нахождения интерферона в сосудистом русле, конъюгированный с ПЭГ продукт изобретения должен быть особенно эффективным в качестве ингибитора ангиогенеза. При нетерапевтическом (например, диагностическом) применении также предполагается конъюгирование диагностического и/или реакционноспособного видов бета-1 а-интерферона. Полученный в результате конъюгированный агент является устойчивым к разрушающим факторам окружающей среды, включая опосредованный растворителем или раствором процесс разложения. Как результат такой повышенной устойчивости и повышенной стабильности бета-1a-интерферона, стабильность активного ингредиента способна к значительному увеличению, с сопутствующей способностью композиции,содержащей бета-1 аинтерферон, к конкретному конечному использованию, для которого она предназначена. Другие аспекты, черты и модификации данного изобретения будут более очевидны из последующего описания и формулы изобретения. Краткое описание чертежей Фиг. 1. Связывание аланинзамещенных мутантов бета-1a-интерферона с димерным гибридным белком, содержащим внеклеточный домен рецепторной цепи интерферона I, 004789IFNAR2/Ig (IFNAR2 эктодомен, гибридный с константным доменом IgGl человека). Сродство к связыванию аланинзамещенных мутантов IFN (Al-Е) для IFNAR2 рецепторной цепи было определено, как описано в примере 1 (подраздел D). Гистограмма представляет их связывающие свойства в этом исследовании относительно дикого типа his-IFN-бета (% д.т.). Значения % д.т. были рассчитаны как(сродство дикого типа his-IFN-бета)/сродство мутанта IFN-бета х 100. Показан % д.т. (О) для единичных экспериментов (n=3) и среднее значение % д.т. (х) для множества экспериментов. Мутанты А 2, АВ 1, АВ 2, и Е не связывалиIFNAR2/Fc в 500-кратно более высоких концентрациях, чем д.т. his-IFN-бета ЕС 50 . Фиг. 2. Связывание аланинзамещенных мутантов бета-1a-интерферона с рецепторным комплексом поверхности клетки интерферона I("IFNAR1/2 комплекс"), экспрессирующим на клетках лимфомы Дауди-Беркитта. Рецепторсвязывающие свойства аланинзамещенных мутантов (A1-Е) были определены при использовании основанного на FACS анализа связывания с рецепторами поверхности клетки, как описано в примере 1 (подраздел D). Гистограмма представляет их сродство к связыванию рецептора относительно дикого типа hisIFN-бета (% д.т.). % д.т. для каждого мутанта был рассчитан как (сродство дикого типа hisIFN-бета)/сродство мутанта IFN-бета х 100. Показаны значения % д.т. (О) для единичного эксперимента и среднее значение % д.т. для множества экспериментов (х). Фиг. 3. Антивирусная активность аланинзамещенных мутантов бета-1 а-интерферона. Антивирусная активность аланинзамещенных мутантов (А 1-Е) была определена на человеческих А 549 клетках, обработанных ЕМС вирусом, как описано в примере 1 (подраздел Е). Гистограмма представляет их активность в этом исследовании относительно дикого типаhis-IFN-бета (% д.т.). % д.т. был рассчитан как концентрация д.т. his-IFN-бета [50% сре]/концентрация мутанта IFN-бета [50% сре]х 100. Показаны % д.т. (О) для множества анализов и среднее значение экспериментальных данных(х). Фиг. 4. Антипролиферативная активность аланинзамещенных мутантов бета-1 аинтерферона. Антипролиферативная активность аланинзамещенных мутантов (А 1-Е) была определена на клетках лимфомы Дауди-Беркитта, как описано в примере 1 (подраздел Е). Гистограмма представляет их активность в этом исследовании относительно дикого типа his-IFN-бета (% д.т). % д.т. был рассчитан как концентрация д.т. 7 множества анализов и среднее значение экспериментальных данных (х). Фиг. 5. Относительные антивирусная и антипролиферативная виды активности аланинзамещенных мутантов бета-1 а-интерферона. Сравнивалась относительная активность аланинзамещенных мутантов (А 1-Е) в противовирусном (х ось) и антипролиферативном (у ось) исследовании. Средний процент дикого типа his-IFN-бета (% д.т., х), представленный на фиг. 3 и 4, использовался для сравнения. Те мутанты, которые показывают изменение координат по обеим активностям, опускаются на вертикальную линию. Мутанты, которые показывают изменение в антивирусной активности,которая является не пропорциональной изменению пролиферативной активности, значительно отходят вниз от диагональной линии (DE1, D,C1). Значение было определено из рассмотрения допустимых отклонений, свойственных среднему % д.т. использованных значений. Фиг. 6. Локализация участка конъюгации с ПЭГ через пептидное картирование. Конъюгированный с ПЭГ и не модифицированный -1 а-интерфероны были подвергнуты анализу пептидного картирования. Образцы переваривались эндопротеиназой Lys-C и подвергались ВЭЖХ с обратной фазой на С 4 колонке. Колонка промывалась градиентом 0-70% ацетонитрила в 0,1% трифторуксусной кислоте. Эфлюент из колонки контролировался при 214 нм. Набор а,не модифицированный интерферон 1a. Набор b, конъюгированный с ПЭГ -1a-интерферон. Стрелки отмечают положение элюирования N-терминального эндопротеиназного Lys пептида -1a-интерферона,содержащего аминокислотные остатки 1-19. Фиг. 7. Антивирусная активность конъюгированного с ПЭГ и неконъюгированного бета 1 а-интерферона. Активность бета-1 а-интерферона или конъюгированного с ПЭГ бета-1 а-интерферона в концентрациях, обозначенных на Х оси, была оценена в антивирусных исследованиях, использующих клетки карциномы легкого человека (А 549), обработанные вирусом энцефаломиокардита. После инкубации с вирусом в течение 2 дней жизнеспособные клетки были окрашены МТТ, чашки читались при 450 нм, и поглощение, отражающее жизнеспособность клетки,показано на Y оси. Допустимые отклонения показываются как отрезок погрешности. Концентрация бета-1 а-интерферона или конъюгированного с ПЭГ бета-1 а-интерферона, которая обеспечивает 50% гибель вируса ("50% цитопатический эффект") (50% максимум OD450) составляла приблизительно 11 пг/мл, и 50% цитопатический эффект для конъюгированного с ПЭГ бета-1 а-интерферона составил приблизительно 11 пг/мл. 8 Фиг. 8. Оценка стабилизации конъюгатов с использованием термической денатурации. Конъюгированный с ПЭГ бета-1 аинтерферон и необработанный контроль бета 1 а-интерферона в 20 мМ HEPES рН=7,5, 20 мМNaCl нагревали с установленной скоростью 1/мин. За денатурацией следовал контроль изменения поглощения при 280 нм. (а) Не модифицированный бета-1 а-интерферон; (b) конъюгированный с ПЭГ бета-1 а-интерферон. Фиг. 9. Измерения антивирусной активности бета-1 а-интерферона в плазме мышей, обработанных бета-1 а-интерфероном или конъюгированным с ПЭГ бета-1 а-интерфероном. Мышам было введено внутривенно или 50000 единиц бета-1a-интерферона, или 50000 единиц конъюгированного с ПЭГ бета-1aинтерферона (содержащего 20 К ПЭГ). Кровь от этих мышей получена ретро-орбитально в различное время после инъекции интерферона, как обозначено на Х оси. Имеются по крайней мере 3 мыши, обескровленные в каждый указанный момент времени, и плазму получали и замораживали до момента оценки активности бета-1 аинтерферона в антивирусных исследованиях,использующих клетки карциномы легкого человека (А 549), обработанные вирусом энцефаломиелокардита. Жизнеспособные клетки были окрашены раствором МТТ, чашки читались при 450 нм для определения поглощения, отражающего жизнеспособность клетки и активность бета-1 а-интерферона. Для каждой чашки были построены калибровочные кривые с использованием бета-1 а-интерферона, которые использовались для определения величины активности бета-1 а-интерферона в каждом образце. Представлены данные от отдельных животных. Фиг. 10. Полная последовательность ДНК гистидин-меченного гена бета-интерферона и его белкового продукта. Показаны полные последовательности ДНК (SEQ ID NO: 1) и белка (SEQ ID NO: 2) гистидин-меченного IFN-бeтa-1a. Отщепленная сигнальная последовательность VCAM-1 оставляет 3 остатка аминоокончаний (SerGlyGly) выше гистидиновой метки (His6, положения 49). Последовательность линкера энтерокиназы(AspAspAspAspLys) отделена от метки гистидина спейсером (положения 10-12, SerSerGly). Исходная последовательность белка IFN-бета-1a перекрывает положения (Met18-Asnl83). Подробное описание изобретения Определения При использовании здесь термин "ковалентно связанный" означает, что определенные фрагменты являются или непосредственно ковалентно связанными друг с другом, или связаны не непосредственно, а через промежуточный фрагмент или фрагменты, такие как мостик,спейсер, или линкерный фрагмент или фрагменты. 9 Интерферон - "интерферон" (также называемый "IFN") представляет собой небольшой видоспецифичный одноцепочечный полипептид, продуцирующийся клетками млекопитающих в ответ на воздействие ряда индукторов,таких как вирусы, полипептиды, митогены и т.п. Наиболее предпочтительным интерфероном,использующимся в данном изобретении, является гликозилированный человеческий бетаинтерферон, который гликозилирован по 80 остатку (Asn 80) и который предпочтительно получают посредством технологии рекомбинантных ДНК. Этот предпочтительный гликозилированный бета-интерферон имеет названия "бета-1 а-интерферон", или "IFN-бета-1 а", или "IFN-1a", или "интерферон-бета-1a", или "интерферон 1 а", используемые взаимозаменяемо. Предполагается,что термин"бета-1 аинтерферон" включает в себя его мутанты (например, пример 1), при условии, что эти мутанты также гликозилированы по 80 остатку (Asn 80). Известны методики рекомбинантных ДНК для синтеза белков, включая интерфероны. Смотри, например, патент США 4399216,5149636, 5179017 (Axel et al.) и 4470461 (Kaufman). Предпочтительные полинуклеотиды бета 1 а-интерферона, которые могут использоваться в способах настоящего изобретения, получены из последовательностей гена бета-интерферона дикого типа различных позвоночных животных,предпочтительно млекопитающих, при использовании способов, известных специалистам в этой области, таких как способы, описанные в следующих патентах США: патент США 5641656 (выданный 24 июня 1997: DNA encoding avian type I interferon proprotein and matureleukocyte interferons). Мутанты бета-1 а-интерферона могут использоваться в соответствии с данным изобретением. Мутации получают, используя общеизвестные способы направленного мутагенеза,известные специалистам в области техники. Кроме того, данное изобретение предоставляет функционально эквивалентные полинуклеотиды бета-1a-интерферона, которые кодируют функ 004789 10 ционально эквивалентные полипептиды бета-1 аинтерферона. Первый полинуклеотид, кодирующий бета-1 а-интерферон, является "функционально эквивалентным" по отношению ко второму полинуклеотиду,кодирующему бета-1 аинтерферон, если он удовлетворяет по крайней мере одному из следующих условий:(a): "функциональный эквивалент" является первым полинуклеотидом, который гибридизируется со вторым полинуклеотидом при стандартных условиях гибридизации и/или является вырожденным по отношению к последовательности первого полинуклеотида. Наиболее предпочтительно, он кодирует мутантный интерферон, имеющий активность бета-1 а-интерферона;(b) "функциональный эквивалент" является первым полинуклеотидом, который кодирует экспрессию аминокислотной последовательности, кодируемой вторым полинуклеотидом. В изложении сущности изобретения термин "интерферон" включает, не ограничиваясь этим, перечисленные выше агенты, а также их функциональные эквиваленты. Таким образом,при использовании здесь термин "функциональный эквивалент" относится к белку бета-1 аинтерферона или полинуклеотиду, кодирующему белок бета-1 а-интерферона, который имеет такое же или улучшенное полезное воздействие на млекопитающего-реципиента, как и интерферон, который считают его функциональным эквивалентом. Среднему специалисту в данной области понятно, что функционально эквивалентный белок может быть получен с помощью рекомбинантных технологий, например путем экспрессии "функционально эквивалентной ДНК". Соответственно, настоящее изобретение охватывает белки бета-1 а-интерферона, которые кодируются встречающимися в природе ДНК, а также искусственными ДНК, которые кодируют тот же самый белок, который кодируется встречающейся в природе ДНК. Благодаря вырожденности кодирующих нуклеотидных последовательностей для кодирования бета-1 аинтерферона могут использоваться другие полинуклеотиды. Они включают целые последовательности или их части, которые заменены на отличные кодоны, которые кодируют тот же самый аминокислотный остаток последовательности, таким образом вызывая молчащую замену. Такие измененные последовательности рассматриваются как эквиваленты данных последовательностей. Например, Phe (F) кодируется двумя кодонами, ТТС или ТТТ, Туr (Y) кодируется ТАС или ТАТ и His (H) кодируется САС или CAT. С другой стороны, Trp (W) кодируется единственным кодоном, TGG. Соответственно, понятно, что для данной последовательности ДНК, кодирующей конкретный интерферон,будет много вырожденных последовательностей ДНК, которые будут его кодировать. Эти выро 11 жденные последовательности ДНК рассматриваются в объеме данного изобретения."Гибрид" - относится к колинеарной связи двух или большего количества белков или их фрагментов через их индивидуальные пептидные каркасы посредством генетической экспрессии полинуклеотидной молекулы, кодирующей эти белки. Предпочтительно, чтобы белки или их фрагменты происходили из различных источников. Так, предпочтительные гибридные белки включают белки бета-1aинтерферона или фрагмент, ковалентно связанный со вторым фрагментом, который не является интерфероном. Конкретно,"бета-1aинтерферон/Ig гибрид" является белком, включающим молекулу бета-1 а-интерферона данного изобретения, или его фрагмент, связанный с Nконцом цепи иммуноглобулина, причем Nконцевая часть иммуноглобулина заменена на бета-1 а-интерферон. Термин "рекомбинант" при использовании здесь означает, что белок получен из рекомбинантных, экспрессирующих систем млекопитающего. Белок, экспрессирующийся в большинстве культур бактерий, например Е. coli, не будет гликозилирован, так что эти экспрессирующие системы не являются предпочтительными. Белок, экспрессирующийся в дрожжах,может содержать олигосахаридные структуры,которые отличаются от экспрессированных в клетках млекопитающих. Термин "биологически активный" при использовании в данном описании для характеристики бета-1 а-интерферона означает, что конкретная молекула гомологична по аминокислотным последовательностям с воплощениями настоящего, раскрытого здесь изобретения в достаточной степени, чтобы быть способной к антивирусной активности, что измеряется в таком in vitro антивирусном исследовании, какой показан в примере 1 (смотри ниже). Термин "терапевтическая композиция" при использовании здесь определяется как композиция, включающая белки изобретения и другие физиологически совместимые ингредиенты. Терапевтическая композиция может содержать наполнители, такие как вода, минералы и носители, такие как белок. Термин "эффективное количество" агента изобретения означает то количество, которое дает результат или оказывает влияние на конкретное состояние, подвергающееся лечению."Аминокислота" - мономерная единица пептида, полипептида или белка. Существует 20 аминокислот, обнаруженных в природных пептидах, полипептидах и белках, все из которых являются L-изомерами. Термин также включает аналоги аминокислот и D-изомеры аминокислот белков и их аналоги."Модифицированная" аминокислота представляет собой природную или неприродную аминокислоту, в которой обычно существую 004789 12 щая боковая цепь или концевая группа изменена в результате химической реакции. Такие модификации включают,например,гаммакарбоксилирование, бета-карбоксилирование,сульфатирование, сульфонирование, фосфорилирование, амидизацию, этерификацию, Nацетилирование, карбобензилирование, тозилирование и другие модификации, известные в области техники. "Производный полипептид" представляет собой полипептид, содержащий одну или большее количество производных аминокислот. Термин "белок" означает любой полимер,состоящий по существу из любых из этих 20 аминокислот. Хотя "полипептид" часто используется по отношению к большим полипептидам,а "пептид" часто используется по отношению к небольшим полипептидам, использование этих терминов в технике различно. Термин "белок" при использовании здесь относится к пептидам,белкам и полипептидам, если не указано другое."Мутантная форма" обозначает любое изменение в генетическом материале организма, в особенности любое изменение (то есть делеция,замещение, добавление или альтерация) в полинуклеотидной последовательности дикого типа или любое изменение в белке дикого типа. Термин "мутеин" является взаимозаменяемым с термином "мутантная форма"."Дикий тип" - встречающаяся в природе полинуклеотидная последовательность экзона белка, или ее фрагмент, или последовательность белка, или ее фрагмент, соответственно, как они обычно существуют "in vivo"."Стандартные условия гибридизации" означают условия солевого состава и температурные условия, в основном, эквивалентные 0,5 хSSC до около 5 х SSC и 65 С и для гибридизации и промывки. Термин "стандартные условия гибридизации" при использовании здесь соответственно означает прикладное определение и охватывает диапазон условий гибридизации. Более строгие условия могут, например, включать гибридизацию с буфером для скрининга бляшек (0,2% поливинилпирролидона, 0,2%Ficoll 400; 0,2% бычьего сывороточного альбумина, 50 мМ Трис-HCl (рН 7,5); 1 М NaCl; 0,1% пирофосфата натрия; 1% SDS); 10% сульфата декстрана, и 100 мкг/мл денатурированной, разрушенной ультразвуком ДНК спермы лосося при 65 С в течение 12-20 ч, и промывку 75 ммNaCl/7,5 мМ цитрата натрия (0,5 хSSC)/1% SDS при 65 С. Более мягкие условия могут, например, включать гибридизацию с буфером для скрининга бляшек, 10% сульфата декстрана и 110 мкг/мл денатурированной, разрушенной ультразвуком ДНК спермы лосося при 55 С в течение 12-20 ч, и промывку 300 мМ NaCl/30 мМ цитрата натрия (2,0 хSSC)/1% SDS в 55 С. Смотри также Current Protocols in Molecular Biology, John WileySons, Inc. New York, Sections 6.3.1-6.3.6 (1989)."Последовательность,контролирующая экспрессию" - полинуклеотидная последовательность, которая контролирует и регулирует экспрессию генов, будучи оперативно связана с этими генами."Оперативно связанный" - полинуклеотидная последовательность (ДНК, РНК) является оперативно связанной с последовательностью,управляющей экспрессией, если управляющая экспрессией последовательность контролирует и регулирует транскрипцию и трансляцию этой полинуклеотидной последовательности. Термин"оперативно связанный" включает наличие соответствующего стартового сигнала (например,ATG) в начале полинуклеотидной последовательности, которая должна экспрессироваться, и сохранение правильной рамки считывания для обеспечения экспрессии полинуклеотидной последовательности под контролем последовательности, контролирующей экспрессию, и продукцию целевого полипептида, кодируемого этой полинуклеотидной последовательностью."Экспрессирующий вектор" - полинуклеотид, такой как ДНК-плазмида или фаг (наряду с другими обычными примерами), который допускает экспрессию по крайней мере одного гена, когда вектор экспрессии введен в клеткухозяина. Вектор может быть способным или не способным к репликации в клетке. Термин "выделенный" (использованный наряду с "существенно чистый") - когда применяется в отношении нуклеиновой кислоты, то есть полинуклеотидных последовательностей,которые кодируют полипептиды, означают РНК- или ДНК-полинуклеотид, часть геномного полинуклеотида, кДНК или синтетического полинуклеотида, который благодаря своему происхождению или получению (i) не связан со всем полинуклеотидом, с которым он связан в природе (например, присутствует в клеткехозяине как вектор экспрессии, или его части); или (ii) связан с нуклеиновой кислотой или другим химическим фрагментом, отличным от того,с которым он связан в природе; или (iii) не встречается в природе. Под термином "выделенный", кроме того, понимают полинуклеотидную последовательность, которая (i) амплифицируется "in vitro", например, полимеразной цепной реакцией (PCR); (ii) является химически синтезируемой; (iii) рекомбинантно продуцируется клонированием; или (iv) очищена как расщеплением, так и разделением в геле. Таким образом, "существенно чистая нуклеиновая кислота" представляет собой нуклеиновую кислоту, которая не соседствует непосредственно с одной или обеими кодирующими последовательностями, с которыми она обычно соседствует в природном геноме организма, из которого нуклеиновая кислота получена. Существенно чистая ДНК также включает рекомбинантную ДНК, которая является частью гибрид 004789 14 ного гена, кодирующего дополнительные последовательности. Термин "выделенный" (используемый наряду с "существенно чистый"), когда он применен по отношению к полипептидам, означает полипептид или его фрагмент, который благодаря своему происхождению или манипуляции(i) присутствует в клетке-хозяине как продукт экспрессии фрагмента вектора экспрессии; или(ii) связан с белком или другим химическим фрагментом, отличным от того, с которым он связан в природе; или (iii) не встречается в природе. Под "выделенный", кроме того, понимается белок, который (i) химически синтезирован; или (ii) экспрессирован в клетке-хозяине и очищен от примесных белков. Термин обычно означает полипептид, который был отделен от других белков и нуклеиновых кислот, с которыми он встречается в природе. Предпочтительно полипептид также отделен от веществ типа антител или гелеобразной матрицы (полиакриламид), которые используются для его очистки. Термин "гетерологичный промотер" при использовании здесь представляет собой промотер, который в природных условиях не связан с геном или очищенной нуклеиновой кислотой."Гомологичный" при использовании здесь является синонимом термину "идентичный" и относится к подобию последовательностей двух полипептидов, молекул или двух нуклеиновых кислот. Когда положение в обеих из двух сравниваемых последовательностей занято одной и той же основной или аминокислотной мономерной субъединицей (например, если положение в каждой из двух молекул ДНК занято аденином или положение в каждом из двух полипептидов занято лизином), то соответствующие молекулы являются гомологичными по этому положению. Процент гомологии двух последовательностей определяют как число парных или гомологичных положений, общих для двух последовательностей, деленное на число сравниваемых положений х 100. Например, если 6 из 10 положений в двух последовательностях являются равносильными или гомологичными, то две последовательности являются гомологичными на 60%. Например, последовательности ДНКCTGACT и CAGGTT гомологичны на 50% (3 из 6 общих положений являются равносильными). Обычно сравнение проводят при выравнивании двух последовательностей, вытянутых в линию,с получением максимальной гомологии. Такое совмещение может обеспечиваться при использовании, например, метода Needleman et al., J.Mol. Biol. 48:443-453 (1970), удобно осуществляемого такими компьютерными программами,как Align program (DNAstar, Inc). Гомологичные последовательности имеют идентичные или подобные аминокислотные остатки, где подобные остатки представляют собой консервативные замены на соответствующие аминокислот 15 ные остатки в выровненной последовательности отнесения, или "разрешенные точковые мутации". В этом отношении, "консервативные замены" остатков в упомянутой последовательности представляют собой те замены, которые являются физически или функционально подобными упомянутым остаткам, например, которые имеют сходные размер, форму, электрический заряд, химические свойства, включая способность формировать ковалентные или водородные связи, или им подобные. Особенно предпочтительными консервативными заменами являются такие, которые соответствуют критериям, определенным для "принятой точковой мутации" в Dayhoff et al., 5: Atlas of Protein Sequence and Structure, 5: Suppl. 3, chapter 22: 354352, Nat. Biomed. Res. Foundation, Washington,D.C. (1978). Термин "полинуклеотидная последовательность" и "нуклеотидная последовательность" здесь также используются взаимозаменяемо."Ангиогенез" и неоваскуляризация" означают в самом широком смысле образование новых кровеносных сосудов. В частности, ангиогенез также относится к образованию новых сосудов в области опухоли."IFNAR2", "IFNAR1", "IFNAR1/2" относится к белкам, которые, как известно, составляют рецептор поверхности клетки интерферонаIFNAR2 может один связывать интерферон альфа или бета. Технология настоящего изобретения использует, если не указано иное, общепринятые методики биологии клетки, культивирования клеток, молекулярной биологии, микробиологии, рекомбинантной ДНК, белковой химии и иммунологии, которые входят в уровень техники. Такие методики описаны в литературе. Смотри, например, Molecular Cloning: A Laboratory Manual, 2nd edition (Sambrook, Fritsch andEmbryo, Cold Spring Harbor Laboratory Press,1986. Бета-интерферон Бета-1 а-интерферон пригоден в качестве агента для лечения, вызова ремиссии, или ослабления болезненного состояния, физиологического состояния, симптомов или этиологических факторов, или для их оценки или диагностики. Термин также относится к бета-1aинтерферону, который сам по себе является частью гибридного белка, такого как гибридный белок иммуноглобулин-бета-1a-интерферон, как описано в совместно поданных заявках, серийный номер 60/104572 и 60/120161. Получение гибридных белков обычно хорошо известно квалифицированным специалистам в этой области техники. Авторы обнаружили уникальный(e) участок(ки) для присоединения полимера, которое не уничтожало бы функцию бета-1 аинтерферона. Кроме того, авторы также использовали способы сайт-направленного мутагенеза для независимого исследования участка(ов) для присоединения полимера (смотри пример 1). Вкратце, авторы предприняли мутационный анализ человеческого бета-1a-интерферона с целью картирования остатков, необходимых для активности и рецепторного связывания. Доступность 3-D кристаллической структуры бета 1 а-интерферона человека (смотри выше и пример 1) позволяет нам идентифицировать, для замещения аланина (или серина), подвергнутые растворению остатки, доступные для рецепторного связывания интерферона бета и сохранить аминокислоты, включенные в межмолекулярные связи. Набор 15 изученных аланиновых мутаций был разработан для замещения между вторым и восьмым остатками по отдельным областям каждой из спиралей (А, В, С, D, Е) и петель (АВ 1, АВ 2, АВ 3, CD1, CD2, DE1, DE2) бета-1 а-интерферона. Смотри пример 1. Амино-терминальная метка гистидина("his" метка) была включена для аффинной очистки мутантов, экспрессирующих клетки млекопитающего, (фиг. 10 и SEQ ID NO: 1 и 2 для кДНК и выведенных последовательностей аминокислоты, соответственно). Функциональные последствия этих мутаций оценены в антивирусном и антипролиферативном исследовании. Анализ нерадиоактивного связывания был разработан для анализа этих мутантов на их связывание с рецептором интерферона бета клеточной поверхности (IFNAR1/2 рецептор поверхности клетки). Кроме того, ELISA анализ, использующий гибридный белок IFNAR2 эктодомен/Ig для связывания интерферона,применялся для картирования взаимодействия поверхностей между бета-1 а-интерфероном иIFNAR2 (смотри пример 1). Эти мутационные анализы продемонстрировали, что N- и Сокончания находятся в части молекулы бета 17 интерферона, не существенные для связывания рецептора или биологической функции. Мутанты, кроме того, представляют различные фрагменты бета-1a-интерферона данного изобретения, которые могут быть особенно полезны, поскольку они проявляют новые свойства, не обнаруживаемые в диком типе бета-1 аинтерферона (смотри пример 1). Авторы идентифицировали три типа эффектов, вызванные целенаправленным мутагенезом. Эти эффекты могут быть полезны в некоторых случаях для разработки лекарственного средства интерферона. Три типа эффектов представляют собой следующие: (а) мутанты с более высокой антивирусной активностью, чем у дикого типа бета 1 а-интерферона (например мутант С 1); (b) мутанты, которые проявляют активность как в антивирусном, так и в антипролиферативном анализе, но для которых антипролиферативная активность является непропорционально низкой относительно антивирусной активности, при сравнении с диким типом бета-1 а-интерферона(например, мутанты C1, D и DE1); и (с) функциональные антагонисты (например, A1, B2,CD2 и DE1), которые проявляют антивирусную и антипролиферативную активность, которые являются непропорционально низкими относительно рецепторного связывания при сравнении с диким типом бета-1 а-интерферона. Фрагмент полимера В широких пределах области действия настоящего изобретения, отдельная молекула полимера может использоваться для конъюгирования с бета-1 а-интерфероном, хотя также предполагается, что также может присоединяться более чем одна молекула полимера. Композиции конъюгированного бета-1 а-интерферона данного изобретения могут находить применение как при использовании in vivo, так и не invivo. Кроме того, известно, что конъюгированный полимер может использовать любые другие группы, фрагменты или другие конъюгированные виды как соответствующие конечному применению. Например, это может быть полезно в некоторых применениях для ковалентного связывания с полимером функционального фрагмента, передающего полимеру устойчивость к УФ-разложению, или антиоксидантные свойства, или другие свойства или характеристики. Еще одним примером может быть выгодная при некоторых применениях функционализация полимера, что делает его реактивнoспособным или способным в особенности к перекрестному связыванию для увеличения различных свойств или характеристик полностью конъюгированного материала. Соответственно,полимер может обладать любыми функциональными возможностями, повторяющимися группами, связями или другими составными частями структуры, которые не препятствуют эффективности композиции конъюгированного бета-1 а-интерферона в его назначении. Другие 18 цели и преимущества существующего изобретения будут более очевидны из последующего раскрытия и формулы изобретения. Иллюстративные полимеры, которые могут полезно использоваться для достижения этих желательных характеристик, описаны здесь ниже в схемах реакции примеров. В применениях ковалентно связанного пептида полимер может быть функционализирован и затем соединен со свободной(ыми) аминокислотой(ами) пептида(ов) с образованием лабильных связей. Бета-1 а-интерферон наиболее предпочтительно конъюгирован через терминальную реактивную группу на полимере, хотя конъюгаты могут также быть разветвленными от нетерминальных реактивных групп. Полимер с реактивной(ыми) группой(ами) называется здесь как"активированный полимер". Реактивная группа выборочно реагирует со свободными аминоили другими реактивными группами белка. Активированный(е) полимер(ы) взаимодействует(ют) таким образом, что соединение может происходить в любой доступной аминогруппе бета-1a-интерферона,такой как альфааминогруппы или эпсилон-аминогруппы лизинов. Свободные карбоксильные группы, соответственно активированные карбонильные группы, гидроксильные, гуанидильные, окисленные углеводные фрагменты и меркаптогруппы бета-1a-интерферона (если они доступны) могут также использоваться как место присоединения. Хотя полимер может быть присоединен в любом участке молекулы бета-1 а-интерферона,наиболее предпочтительным участком для связи полимера являетсяN-конец бета-1 аинтерферона. Второй участок находится в или около С-конца и через фрагменты сахара. Таким образом, изобретение рассматривает в качестве своего наиболее предпочтительного воплощения (i) N-концевые связанные полимерные конъюгаты бета-1 а-интерферона;(ii) Сконцевые связанные полимерные конъюгаты бета-1 а-интерферона; (iii) соединенные с сахаром конъюгаты полимерных конъюгатов; (iv) а также N-, С- и соединенные с сахаром полимерные конъюгаты гибридных белков бета-1 аинтерферона. Обычно используют от приблизительно 1,0 до приблизительно 10 молей активированного полимера на моль белка в зависимости от концентрации белка. Конечное количество представляет баланс между максимальным увеличением степени реакции при минимизации неспецифичных модификаций продукта, в то же самое время определяя химическую структуру,которая позволяет сохранить оптимальную активность, одновременно оптимизируя, если возможно, период полужизни белка. Предпочтительно сохранение по крайней мере прибли 19 зительно 50% биологической активности белка,и наиболее предпочтительно 100% сохранение. Реакции могут проводиться любым соответствующим способом, используемым для взаимодействия биологически активных веществ с инертными полимерами, предпочтительно при рН около 5-7, если реактивные группы находятся на альфа-аминогруппе N-конца. Обычно процесс включает подготовку активированного полимера (который может иметь по крайней мере одну концевую гидроксильную группу) и последующую реакцию белка с активированным полимером для получения растворенного белка, пригодного для получения готовой препаративной формы. Вышеупомянутая реакция модификации может проводиться несколькими способами, которые могут включать один или большее количество этапов. Как упомянуто выше, наиболее предпочтительные воплощения данного изобретения используют N-конец бета-1 а-интерферона для связи с полимером. Соответствующие способы доступны для выборочного получения Nконцевого модифицированного бета-1aинтерферона. Примером одного способа является восстановительное гидроалкилирование, в котором используется дифференциальная реактивная способность различных типов первичных аминогрупп (эпсилон-аминогруппы на лизине против аминогрупп на N-концевом метионине), доступных для получения производных на бета-1 а-интерфероне. При соответствующих условиях отбора может быть достигнуто, в основном, селективное получение производных бета-1 а-интерферона на его N-конце с карбонильной группой, содержащей полимер. Реакция проводится при таком рН, который позволяет пользоваться преимуществом рКа различий между эпсилон-аминогруппами остатков лизина и таковых альфа-аминогруппы N-концевого остатка бета-1 а-интерферона. Этот тип химического строения известен специалистам в уровне техники. Авторы использовали схему реакции, в которой эта избирательность поддерживается проведением реакции при низком рН (обычно 5-6) при условиях, где ПЭГ-альдегидный полимер взаимодействует с бета-1 а-интерфероном в присутствии цианоборгидрида натрия. Это следует после очистки ПЭГ-бета-1 а-интерферона и анализа с SDS-PAGE, MALDI масс-спектрометрией и секвенирования/картирования пептида, давая в результате бета-1a-интерферон, N-конец которого специфично направляется фрагментом ПЭГ. Кристаллическая структура бета-1 аинтерферона такова, что N- и С-концы расположены близко к друг другу (смотри Karpusas etal., 1997, Proc. Natl. Acad. Sci. 94: 11813-11818). Таким образом, модификации С-конца бета-1 аинтерферона должны также иметь минимальное влияние на его активность. В то время как не 20 имеется никакой простой химической стратегии для нацеливания полиалкиленгликолевого полимера типа ПЭГ на С-конец, легко генетически сконструировать участок, который может использоваться как мишень для полимерного фрагмента. Например, введение Суs в участок,который находится в или около С-конца, привело бы к специфической модификации с использованием малеимида, винил-сульфона или галогенацетат-активированного полиалкиленгликоля (например, ПЭГ). Эти производные могут использоваться конкретно для модификации проектируемых цистеинов благодаря высокой избирательности этих реактивов для Суs. Другие стратегии, такие как введение метки гистидина, которая может являться мишенью (Fancyet al., (1996) Chem.Biol. 3: 551), или дополнительный гликозилированный участок, представляют другие альтернативы для модификации Сконца бета-1 а-интерферона. Гликан на бета-1 а-интерфероне также находится в положении, которое допускало бы дальнейшую модификацию без изменения активности. Также известны способы для создания сахаров-мишеней как участков для химической модификации, и поэтому вероятно, что полимер полиалкиленгликоля может быть добавлен непосредственно и специфично к сахарам на бета-1 а-интерфероне, полученным через окисление. Например, может быть получен полиэтиленгликоль-гидразид, который образует относительно устойчивые связи гидразина путем конденсации с альдегидами и кетонами. Это свойство использовалось для модификации белков через окисление олигосахаридных связей. Смотри Andresz, Н. et al., (1978), Makromol.Chem. 179: 301. В частности, обработка ПЭГкарбоксиметилгидразида с нитритом дает ПЭГкарбоксиметилазид, который является электрофильно активной группой, реактивной по отношению к аминогруппам. Эта реакция может использоваться также для получения полиалкиленгликоль-модифицированных белков. Смотри патенты США 4101380 и 4179337. Авторы ранее обнаружили, что тиол линкер-медиированная химическая структура может, кроме того, облегчать перекрестное сшивание белков. В частности, авторы получили гомотипичные мультимеры LFA-3 и CD4, используя такой способ, как генерирование реакционноспособных альдегидов на углеводных фрагментах с периодатом натрия, образуя конъюгаты цистамина через альдегиды и вызывая перекрестную сшивку через группы тиола на цистаминах. Смотри Pepinsky, В. et al., (1991), J. Biol.Chem., 266: 18244-18249 и Chen, L.L. et al,(1991) J. Biol. Chem., 266: 18237-18243. Поэтому авторы предполагают, что этот тип химического строения также был бы пригоден для модификации с полимерами полиалкиленгликоля, когда линкер встраивается в сахар и полимер полиалкиленгликоля связывается с линкером. В то 21 время как аминотиол или гидразинсодержащий линкер допускает добавление одной группы полимера, структура линкера может быть изменена таким образом, чтобы добавлялись множественные полимеры и/или чтобы изменялась пространственная ориентация полимера относительно бета-1 а-интерферона. В технологии настоящего изобретения остатки полиалкиленгликоля С 1-С 4 алкильных полиалкиленгликолей, предпочтительно полиэтиленгликоля (ПЭГ), или остатки поли(окси)алкиленгликоля таких гликолей полезно встраиваются в интересующие авторов полимерные системы. Таким образом, полимер, к которому присоединен белок, может быть гомополимером полиэтиленгликоля (ПЭГ) или представляет собой полиоксиэтилированный полиол,при условии, что во всех случаях полимер растворим в воде при комнатной температуре. Неограниченные примеры таких полимеров включает гомополимеры оксида полиалкилена, такие как ПЭГ или полипропиленгликоли, полиоксиэтилированные гликоли, их сополимеры и блоксополимеры, при условии, что сохраняется водорастворимость блок-сополимера. Примеры полиоксиэтилированных полиолов включают,например, полиоксиэтилированный глицерин,полиоксиэтилированный сорбит, полиоксиэтилированную глюкозу или им подобные. Глицериновый каркас полиоксиэтилированного глицерина является тем же самым каркасом, который встречается в природе, например, у животных и человека в моно-, ди- и триглицеридах. Таким образом, это разветвление не обязательно было бы замечено как инородный организму агент. Как альтернатива к оксидам полиалкилена могут использоваться декстран, поливинилпирролидоны, полиакриламиды, поливиниловые спирты, углевод-основные полимеры и им подобные. Квалифицированным специалистам ясно, что предшествующий список приведен для иллюстрации и что рассматриваются все полимерные материалы, имеющие описанные здесь качества. Полимер не требует какого-то определенного молекулярного веса, но предпочтительно,чтобы молекулярный вес составлял приблизительно от 300 до 100000, более предпочтительно от 10000 до 40000. В частности, размеры 20000 или больше являются лучшими при предотвращении потери белков из-за фильтрации в почках. Дериватизация полиалкиленгликоля имеет ряд выгодных свойств для готовой препаративной формы конъюгатов полимер-бета-1aинтерферона в технологии настоящего изобретения, так как связана со следующими свойствами производных полиалкиленгликоля: улучшение водорастворимости при отсутствии в то же самое время проявлений какой-либо антигенной или иммуногенной реакции; высокие степени биосовместимости; отсутствие in vivo 22 биоразложения производных полиалкиленгликоля; и простота выведения из живых организмов. Кроме того, в другом аспекте настоящего изобретения можно использовать бета-1 аинтерферон, ковалентно связанный с полимерным компонентом, в котором природа конъюгации включает легко разрывающиеся ковалентные химические связи. Это позволяет осуществлять контроль в период времени, в течение которого полимер может отщепляться от бета-1 аинтерферона. Эта ковалентная связь между лекарственным средством в виде бета-1 аинтерферона и полимером может расщепляться при химических или ферментативных реакциях. Продукт полимер-бета-1 а-интерферона сохраняет приемлемую степень активности. Одновременно части полиэтиленгликоля присутствуют в конъюгированном полимере, чтобы обеспечить конъюгированный полимер-бета-1aинтерферона с высокой водорастворимостью и способностью к пролонгированному циркулированию в крови. В результате этих улучшенных характеристик, изобретение рассматривает парентеральное, назальное и пероральное введение как активного полимер-бета-1 аинтерферона, так и после гидролитического расщепления и биодоступность бета-1 аинтерферона per se при применении in vivo. Следует понимать, что описанные здесь схемы реакции предлагаются только для иллюстрации, а не для ограничения реакций и структур, которые могут использоваться для модификации бета-1a-интерферона, например для достижения растворимости, стабилизации и сродства к мембране клетки для парентерального и перорального введения. Реакцию полимера с бета-1 а-интерфероном для получения наиболее предпочтительных N-концевых конъюгированных продуктов легко проводят сиспользованием большого многообразия схем реакции. Активность и стабильность конъюгатов бета-1aинтерферона могут быть изменены несколькими способами при использовании полимеров с различным размером молекулы. Растворимость конъюгатов может быть изменена путем изменения соотношения и размера фрагмента полиэтиленгликоля, встроенного в полимерную композицию. Применение Уникальное свойство полиалкиленгликоль-производных полимеров настоящего изобретения, ценное для терапевтических применений, состоит в их общей биосовместимости. Полимеры имеют различные свойства водорастворимости и не являются токсичными. Их считают неиммуногенными и неантигенными, и они не противоречат биологической активности фрагмента бета-1 а-интерферона, когда конъюгированы с ним при описанных здесь условиях. Они длительно циркулируют в крови и легко выводятся из живого организма. 23 Обнаружено, что продукты настоящего изобретения полезны в поддерживании периода полужизни терапевтического бета-1aинтерферона и могут, например, быть приготовлены для терапевтического применения путем растворения в воде или приемлемой жидкой среде. Введение можно осуществить парентеральным путем, в аэрозолях или перорально. Тонкие коллоидные суспензии могут быть получены для парентерального введения для получения эффекта депо или для перорального введения, тогда как аэрозольная готовая препаративная форма может быть жидкой или в виде сухого порошка в природном виде. В сухом,лиофилизированном состоянии или в растворах конъюгаты полимер-бета-1a-интерферона настоящего изобретения должны иметь хорошую устойчивость при хранении. Термоустойчивость конъюгированного бета-1 а-интерферона (пример 3) выгодна при получении порошкообразных готовых препаративных форм, при котором имеется этап дегидрирования. Смотри, например, РСТ/США/95/06008 ("Methods and Compositions for Dry Powder of Interferons"). Терапевтические полимерные конъюгаты настоящего изобретения могут использоваться для профилактики или лечения любого состояния или заболевания, для которого эффективным компонентом является бета-1 а-интерферон. Кроме того, полимер-основные конъюгаты настоящего изобретения могут использоваться в диагностике состояний или заболеваний в биологических системах или видах, так же, как для диагностических целей в нефизиологических системах. В терапевтическом использовании настоящее изобретение рассматривает способ лечения животного объекта или латентно восприимчивых к такому(им) состоянию(ям) или заболеванию и нуждающегося в подобном лечении,включая применение таким животным эффективного количества полимерного конъюгата настоящего изобретения, которое является терапевтически эффективным для названного состояния или заболевания. Объект, подвергаемый лечению полимерным конъюгатом настоящего изобретения, включает млекопитающих и наиболее предпочтительно человека. В зависимости от конкретного состояния или заболевания, которое нужно излечить, животным могут назначаться полимерные конъюгаты данного изобретения в любой соответствующей терапевтически эффективной и безопасной дозировке,которая легко может быть определена специалистом и без излишнего экспериментирования. Из-за видовых различий интерферонов I может быть необходимо получить конъюгаты интерферон-полимер, как описано здесь, с интерферонами соответствующего вида. Антиклеточная пролиферативная активность бета-1a-интерферона хорошо известна. В частности, некоторые из описанных здесь по 004789 24 лимерных конъюгатов бета-1 а-интерферона полезны для лечения опухолей, в том числе злокачественных, таких как остеогенная саркома,лимфома, острый лимфолейкоз, рак груди, меланома и назофарингеальная карцинома, так же,как аутоиммунных состояний, таких как фиброз, волчанка и рассеянный склероз. Кроме того, ожидается, что противовирусная активность, проявляемая конъюгированными белками, в частности некоторыми описанными здесь мутантными конъюгатами бета-1 а-интерферона,может использоваться для лечения вирусных заболеваний, таких как инфекции ЕСМ, грипп и другие инфекции дыхательных путей, бешенство и гепатит. Также ожидается, что описанная здесь иммуномодуляторная активность бета-1 аинтерферона может использоваться при лечении аутоиммунных и воспалительных заболеваний,таких как фиброз, рассеянный склероз. Способность интерферонов ингибировать образование новых сосудов (то есть игибирование ангиогенеза и неоваскуляризации) делает возможным для конъюгатов данного изобретения лечить ангиогенные заболевания, такие как диабетическая ретинопатия, ретинопатия недоношенных,дегенерация желтого пятна, отторжение роговичного трансплантата, неоваскулярная глаукома, ретролентальная фиброплазия, покраснение радужки и синдром Ослер-Вебера. Кроме того, антиэндотелиальная активность интерферона была известна в течение некоторого времени, и один потенциальный механизм воздействия интерферона может состоять в том, чтобы вмешиваться в эндотелиальную активность клетки, ингибируя продукцию или эффективность ангиогенных факторов, продуцируемых опухолевыми клетками. Некоторые сосудистые опухоли, такие как гемангиома, являются особенно чувствительными к лечению интерфероном. Лечение альфа-интерфероном является единственным зарегистрированным способом лечения этого заболевания. Ожидается,что лечение конъюгатом бета-1 аинтерферона данного изобретения предложит существенные фармацевтические выгоды в смысле фармакокинетики и фармакодинамики,так как ожидается, что конъюгаты будут оставаться в сосудистом русле в течение более длительного времени, чем неконъюгированные интерфероны, таким образом приводя к более действенной и эффективной терапии для использования в качестве антиангиогенного агента. Смотри пример 8. Конъюгаты полимер-бета-1 а-интерферона данного изобретения могут применяться per se как в форме фармацевтически приемлемых сложных эфиров, солей, так и других физиологически функциональных производных. В таких фармацевтических и медикаментозных готовых препаративных формах бета-1 а-интерферон предпочтительно используется вместе с одним или большим количеством фармацевтически 25 приемлемых носителей и необязательно любых других терапевтических ингредиентов. Носитель(и) должен быть фармацевтически приемлем в смысле совместимости с другими ингредиентами препарата и не должен приносить вреда его реципиенту. Бета-1a-интерферон обеспечивается в количестве, эффективном для достижения желательного фармакологического эффекта, как описано выше, и в количестве, соответствующем достижению желательной суточной дозы. Готовые препаративные формы включают те, которые подходят как для парентерального,так и для непарентерального введения, и специфические способы введения включают пероральный, ректальный, буккальный, местный,назальный, глазной, подкожный, внутримышечный, внутривенный, чрескожный, интратекальный, интраартикулярный, внутриартериальный,субарахноидальный, бронхиальный, в лимфатические сосуды, вагинальный и внутриматочный. Предпочтительными являются готовые препаративные формы, пригодные для перорального,назального и парентерального введения. Когда бета-1 а-интерферон используется в готовой препаративной форме, включающей жидкий раствор, готовая форма может быть введена преимущественно перорально или парентерально. Когда бета-1 а-интерферон используется в жидкой готовой препаративной форме в виде жидкой суспензии или порошка в биологически совместимом носителе, готовая форма может полезно вводиться перорально, ректально или бронхиально. Когда бета-1 а-интерферон применяется непосредственно в виде порошкообразного твердого вещества, бета-1 а-интерферон может быть введен преимущественно перорально. Альтернативно, его можно вводить через нос или бронхиально, через распыление порошка в газе-носителе, формировать газообразную дисперсию порошка, которая аспирируется пациентом из дыхательной цепи, включающей соответствующее устройство для распыления. Готовые препаративные формы, включающие полимерные конъюгаты настоящего изобретения, могут быть удобно представлены в виде единичных дозированных форм и могут быть получены любыми способами, известными в уровне фармацевтической техники. Такие способы обычно включают стадию введения активного(ых) ингредиента(ов) в связь с носителем,который состоит из одного или большего количества добавочных компонентов. Как правило,готовые препаративные формы получают при равномерном и тесном внесении активного(ых) ингредиента(ов) в соединение с жидким носителем, или тонкоизмельченным твердым носителем, или обоими, и затем, если необходимо,осуществляют получение из продукта дозированных форм желательной готовой препаративной формы. 26 Готовые препаративные формы настоящего изобретения, пригодные для перорального введения, могут быть представлены в виде дискретных единиц, таких как капсулы, облатки,таблетки или лепешки, каждая из которых содержит предварительно определенное количество активного ингредиента в виде порошка или гранулы; или в виде суспензии в водной жидкости или неводной жидкости, такой как сироп,эликсир, эмульсия или дозированная форма жидкого лекарственного средства. Таблетка может быть приготовлена путем прессования или формования, необязательно с одним или несколькими добавочными ингредиентами. Прессованные таблетки могут быть получены путем прессования в подходящем устройстве, причем активное соединение имеет легкосыпучую форму, такую как порошок или гранулы, которые необязательно смешивают со связывающим агентом, дезинтегратором, смягчающим агентом, инертным разбавителем, поверхностно-активным веществом или разряжающим агентом. Формованные таблетки,включающие смесь порошкообразных полимерных конъюгатов с подходящим носителем, могут быть изготовлены путем формования в подходящем устройстве. Сироп может быть получен добавлением активного соединения к концентрированному водному раствору сахара, например сахарозы, к которой может также быть добавлен любой добавочный ингредиент(ы). Такой(ие) добавочный(е) ингредиент(ы) может(гут) включать ароматизатор, подходящий консервант, агенты для замедления кристаллизации сахара и агенты для увеличения растворимости любого другого ингредиента, такого как полигидроксильный спирт, например глицерин или сорбит. Готовые препаративные формы, пригодные для парентерального введения, соответственно включают стерильный водный препарат активного конъюгата, который предпочтительно является изотоническим для крови реципиента(например, физиологический солевой раствор). Такие готовые препаративные формы могут включать суспендирующие агенты и загущающие агенты или другие системы микрочастиц,которые предназначены для нацеливания соединения на компоненты крови или один или большее количество органов. Готовые препаративные формы могут быть представлены в форме единичной или многоразовой дозы. Назальные готовые препаративные формы в виде спреев включают очищенные водные растворы активного конъюгата и консервирующие агенты и изотонические агенты. Такие готовые препаративные формы предпочтительно доведены до рН и изотонического состояния, совместимого с назальными:слизистыми мембранами. Готовые препаративные формы для ректального введения могут быть представлены в виде суппозиториев с соответствующим носи 27 телем, таким как масло какао, гидрогенизированные жиры или гидрогенизированная жирная карбоновая кислота. Глазные готовые препаративные формы,такие как глазные капли, получают способом,подобным способу получения назальных спреев, за исключением того, что рН и изотонические факторы предпочтительно доведены для соответствующих для глаз. Местные готовые препаративные формы включают конъюгаты настоящего изобретения,растворенные или суспендированные в одной среде или более, такой как минеральное масло,нефть, полигидроксиспирты или другие основы,используемые для местных фармацевтических готовых препаративных форм. В дополнение к вышеупомянутым ингредиентам готовые препаративные формы данного изобретения могут, кроме того, включать один или большее количество добавочных ингредиентов и выбранных из разбавителей, буферов,вкусовых добавок, дезинтеграторов, поверхностно-активных агентов, загустителей, смягчающих компонентов, консервантов (включая антиоксиданты) и им подобных. Соответственно, существующее изобретение рассматривает предоставление подходящих полимеров для стабилизации in vivo бета-1 аинтерферона в растворе, как предпочтительное иллюстративное нетерапевтическое применение. Полимеры могут использоваться, например, для повышения термоустойчивости и устойчивости к ферментативному разложению бета-1 а-интерферона. Усиление характеристики термоустойчивости бета-1 а-интерферона посредством конъюгирования способом настоящего изобретения представляет способ увеличения срока годности, стабильности при комнатной температуре и устойчивости к исследовательским реагентам и наборам. Следующие примеры предоставлены для иллюстрации настоящего изобретения и не должны быть рассмотрены в качестве ограничения. В частности, понятно, что описанные здесь эксперименты in vivo с животными могут быть изменены так, чтобы были возможны другие модификации и вариации основной методологии. Например, в примере 5 специалисты могут использовать другие исследования с неопирином или могут изменять количество и вид использованных приматов. Эти модификации и вариации к примерам должны расцениваться как соответствующие духу и области действия настоящего изобретения. Пример 1. Исследования структура/активность человеческого бета-1 а-интерферона с использованием мутаций в виде аланин/сериновых замещений: анализ сайтов рецепторного связывания и функциональных доменов. А. Обзор. Пространственный мутационный анализ человеческого бета-1a-интерферона (IFN-бeтa 004789 28 1a) был предпринят с целью картирования остатков, требующихся для осуществления активности и рецепторного связывания. Наличие 3-D кристаллической структуры человеческого бета 1 а-интерферона (см. Karpusas et al., 1997, Proc.Natl. Acad. Sci. 94:11813-11818) позволило заявителям идентифицировать для аланиновых(или сериновых) замещений остатки, находящиеся в контакте с растворителем, доступные для взаимодействия с рецептором бетаинтерферона, и сохранить аминокислоты, включенные в образование межмолекулярных связей. Панель из 15 аланиновых последовательных мутаций была создана, чтобы заменить от 2 до 8 остатков вдоль различных областей каждой из спиралей (А, В, С, D, Е) и петель (АВ 1, АВ 2,АВ 3, CD1, CD2, DE1, DE2) бета-1 аинтерферона. Для аффинной очистки включили аминоконцевой маркер, состоящий из 6 гистидиновых остатков, а также участок энтерокиназной линкерной последовательности для удаления аминоконцевого удлинения. Полученные интерфероны равнозначно обозначают как "hisмеченный интерферон (IFN)-бета" или "Нis6 бета-интерферон" и т.п. Экспрессионные плазмиды с различными мутантными формами меченного IFN-бета конструировали с использованием генной конструкции IFN-бета дикого типа в качестве матрицы для мутагенеза. Стратегия мутагенеза включает вначале введение уникальных сайтов расщепления рестрикционными ферментами на всем протяжении гена his-меченного IFN бета дикого типа, затем замену различных последовательностей ДНК между выбранными сайтами рестрикции на синтетические олигонуклеотидные дуплексы, которые кодируют мутации с аланиновыми (или сериновыми) замещениями. Наконец, мутантные гены IFN субклонировали в плазмиде, которая направляет экспрессию в клетках млекопитающих, в клеточной линии 293 почек человека. Функциональные результаты этих мутаций оценивали в антивирусном и антипролиферативном тестах. Нерадиоактивный анализ связывания IFN разработали для анализа данных мутантных форм на связывание с поверхностным рецептором ("комплекс IFNAR1/2") клеток человеческой лимфомы Дауди-Беркитта. Кроме того,разработали анализ для картирования поверхностей взаимодействия между мутантными формами his-IFN-бета и IFNAR2, в котором использовали гибридный белок IFNAR2/Fс, включающий внеклеточный домен IFNAR2, рецепторного белка IFN, соединенный с шарнирным участком, СН 2 и СН 3 доменами человеческого IgG1. 1. Создание гена бета-интерферона как матрицы для мутагенеза. Стратегия заявителей, направленная на получение аланин- (или серин-) замещенных мутантных форм IFN-бета, состояла в создании вначале модифицированного гена IFN-бета, ко 29 торый кодировал белок дикого типа, но который нес уникальные сайты расщепления рестрикционными ферментами, рассеянные на всем протяжении гена. Уникальные сайты использовали для замены последовательностей дикого типа на синтетические олигонуклеотидные дуплексы,которые кодируют мутантные кодоны. Для получения экспрессионной кассеты IFN-бeтa-1a,подходящей для создания мутантных генов,кДНК IFN-бета (GenBank, каталожный номер Е 00029) амплифицировали с помощью ПЦР(PCR). Начальное клонирование гена IFN-бета в плазмиде pMJB 107, полученной из pACYC184(см. Rose, et. al., 1988, Nucleic Acids Res. 16(1) 355), было необходимо для проведения сайт-направленного мутагенеза данного гена в плазмиде, утратившей специфические сайты рестрикции, которые образуются в процессе мутагенеза. ПЦР праймеры, использующиеся для субклонирования кодирующей последовательности гена человеческого IFN-бета, также позволили заявителям ввести линкерную последовательность энтерокиназы выше по ходу транскрипции и в рамке считывания с геном IFN-бета (5' ПЦР праймер 5' TTCTCCGGAGACGATGATGACAAGATGAGCTACAACTTGCTTGGATTCGTTATCAGTTTCGGAGGTAACCTGTAAGTC3' (SEQ ID Nо: 4: "BET-022" и фланкирующими сайтами ферментативной рестрикции (BspEI и Xho I), использующимися для клонирования в сайтах плазмиды pMJB107. Полученную ДНК обозначают ПЦР фрагмент А. Эффективную сигнальную последовательность из сигнальной последовательности адгезионной молекулы-1 клеток кровеносных сосудов человека (VCAM-1) и 6 гистидиновых остатков в качестве маркера ввели в конечную конструкцию из второго фрагмента ДНК, созданную из pDSW247 (фрагмент В). ПлазмидуpDSW247 получали из рСЕР 4 (Invitrogen,Carlsbad, CA), из которой удален ген EBNA-1 и которая несет сигнальную последовательностьVCAM-1 (VCAMss), находящуюся в рамке считывания с 6 гистидиновыми остатками в качестве маркера и присоединенную выше их по ходу транскрипции. ПЦР праймеры, которые использовали для создания кассетного фрагментаCCGGA-3': SEQ ID NO: 6), включающие фланкирующие сайты расщепления рестрикционными ферментами (NotI and BspEI), которые позволяют вырезать фрагмент В ДНК. Для создания плазмидного вектора, несущего сигнальную последовательность VCAM-1,his-маркер и ген бета-интерферона, заявители провели трехфрагментное лигирование, исполь 004789 30 зуя очищенные в геле фрагменты ДНК из плазмидного вектора pMJB107 (полученные в результате расщепления NotI и XhoI), ПЦР фрагмент А (полученный в результате расщепленияBspEl и Xhol) и фрагмент В (полученный в результате расщепления NotI и BspEl). Лигированную плазмиду использовали для трансформации клеток Е. coli, или JA221, или XL1-Blue,и устойчивые к ампициллину колонии собирали и тестировали на наличие вставок путем анализа рестрикционной карты. Проводили препаративное получение ДНК, и последовательность вставки подтверждали путем секвенирования ДНК. Полученную конструкцию назвалиpCMG260. 2. Создание аланинзамещенных мутантных форм человеческого бета-интерферона вpCMG260. Плазмиду pCMG260 использовали в качестве матрицы для множественных раундов мутагенеза (U.S.E. набор для направленного мутагенеза (Boehringer-Mannheim, в результате которого были введены уникальные сайты рестрикционного расщепления в положения вдоль последовательности, кодирующей белок IFNбета, но полученная в результате последовательность белка не была изменена. Мутантные плазмиды использовали для трансформации штаммов E. coli JA221 или XL1-Blue, и рекомбинантные колонии отбирали по устойчивости к хлорамфениколу. Хлорамфеникол-устойчивые колонии затем тестировали на присутствие требуемого уникального сайта ферментативной рестрикции с помощью анализа рестрикционного картирования ДНК. Были подтверждены структуры полученной плазмиды IFN-бета,pCMG275.8, содержащей полный набор уникальных сайтов рестрикционного ферментативного расщепления, и последовательности ДНК данного гена. Полная последовательность ДНК(SEQ ID NO: 1) модифицированного гена hisмеченного интерферона-бета, вместе c кодирующей белок последовательностью (SEQ IDNO: 2), приведена на фиг. 10. Полный набор аланинзамещенных мутаций приведен в табл. 1 (ниже). Названия мутантов определяют структурные области (спирали и петли), в которые введены данные мутации. Полная панель аланиновых (сериновых) замещений дает в результате 65 мутаций на 165 аминокислот человеческого IFN-бета. Панель мутантных форм создана изpCMG275.8 путем замещения сегментов ДНК,находящихся между уникальными свитами рестрикции, на синтетические олигонуклеотидные дуплексы, которые несут информацию генетического кодирования, как изображено в табл. 2(см. ниже). Для создания различных аланинзамещенных мутантных форм плазмид векторpCMG275.8 (полученный в результате расщепления соответствующим рестрикционным ферментом, как определено в списке, приведенном 31 ниже для каждой структурной области IFNбета), очищенный в геле, и олигонуклеотидные дуплексы (кодирующие последовательности цепей, как показано в табл. 2) сшивали вместе. Лигированные смеси использовали для трансформации штамма E. coli JA221, и рекомбинантные колонии выбирали по устойчивости к ампициллину. Устойчивые к ампициллину колонии тестировали на присутствие вставок мутаций путем скрининга соответствующих сайтов ферментативной рестрикции. Для двух мутантных форм (А 2 и CD2) стратегия клонирования заключается в использовании двух дуплексов синтетических нуклеотидов (как показано в табл. 2), которые несут комплементарные липкие концы, что позволяет лигировать один с другим и с каркасом вектора IFN-бета при трехстадийном лигировании. Следующий список иллюстрирует сайты, которые использовали для клонирования мутантных олигонуклеотидов из табл. 2. Схема клонирования (подраздел В) показывает позиции данных уникальных сайтов гена бета-интерферона. Таблица 1 Положения мутаций замещения аланина HUIFN Линия, обозначающая IFN-, показывает последовательность человеческого IFN- дикого типа. Аланиновые или сериновые замены остатков IFN- показаны для каждой мутантной формы, и черточки, расположенные ниже соответствующих областей, обозначают последовательности дикого типа. Структуры спиралей и петель обозначены сплошными линиями ниже мутантных форм. Петля DE охватывает промежуток между спиралями D и Е. Две дополнительные аланинзамещенные мутантные фомы(Н 93 А, Н 97 А и Н 121 А) получали и анализировали в антивирусных анализах для того, чтобы оценить влияние мутации соответствующих гистидинов, которые образуют хелатные комплексы с цинком в корковом структурном димере. Обе вышеуказанные мутантные формы полностью сохраняют активность дикого типа в антивирусных анализах, что позволяет предположить, что цинк-опосредованное образование димера не является существенным для проявления активности IFN-. В. Конструкция экспрессирующих плазмид EBNA 293. Гены мутантных форм и дикого типа IFNбета, соединенные с сигнальной последовательностью VCAM-1, his-маркером и энтерокиназной линкерной последовательностью, очищали в геле в виде ферментов величиной в 761 пар оснований, полученных в результате действия рестрикционных ферментов NotI и BamHI. Очищенные гены субклонировали в расщепленном под действием NotI и BamHI плазмидном векторе pDSW247, как изображено на схеме. Плазмида pDSW247 представляет собой экспрессирующий вектор для белка клеток почки человека EBNA 293 (Invitrogen, Carlsbad, CA). Она содержит промотор гена цитомегаловируса и регуляторные элементы EBV, которые необходимы для обеспечения высокого уровня экспрессии гена в этой системе, а также как селектируемые маркеры для Е. coli (устойчивого к ампициллину) и EBNA 293 клетки (устойчивые к гигромицину), как видно на схеме стратегии клонирования (ниже). Лигированные плазмиды использовались для трансформации или JA221,или XL1-Blue клеток Е. coli, и ампициллинустойчивые колонии были отобраны и тестиро 33 ваны на вставку анализом рестрикционной карты. Получили препаративное количество ДНК,и последовательность вставок подтверждали путем секвенирования ДНК. Положительные клоны, обнаруживающее наличие желательных мутировавших последовательностей, использовались для трансфекции клеток почек человекаEBNA 293, как описано ниже. Полная стратегия клонирования представлена ниже. Схематическое изображение стратегии клонирования и IFN- экспрессирующих плазмид С. Экспрессия и количественное определение аланинзамещенных форм IFN-бета-1 а. Человеческие клетки EBNA 293 (Invitrogen, Carlsbad, CA, Chittenden, Т. (1989) J. Virol. 63: 3016-3025) хранили в виде субконфлюентных культур в модифицированной по способу Дальбекко среде Игла с добавлением 10% фетальной бычьей сыворотки, 2 мМ глутамина и 250 нг/мл генетицина (Life Technologies,Gaithersburg, MD). Экспрессионные плазмидыpDSW247 для обеспечения временной экспрессии трансфицировали в клетки EBNA 293 с помощью метода с использованием липофектамина (Gibco/BRL, Life Technologies). Кондиционированную среду собирали через 3-4 дня после трансфекции, обломки клеток удаляли путем центрифугирования, и концентрацию his-IFNбета определяли с помощью ELISA. Анализ ELISA проводили с использованием поликлональных кроличьих антител (IgG,очищенные на белке А, образование антител вызывали против очищенного человеческогоIFN-бета-1 а) для покрытия 96-луночных планшетов ELISA, и биотинилированную форму таких же поликлональных кроличьих IgG использовали в качестве второго реагента для обеспечения возможности определения интерферона с помощью стрептавидин-связанной пероксидазы хрена (HRP: Jackson ImmunoResearch, W. Grove, PA). Серии разведений бета 1a-интерферона использовали для получения стандартных концентрационных кривых. Кондиционированную среду от трансфицированных клеток EBNA, содержащую his-IFN-бета, разбавляли до получения образцов с концентрациями, варьирующими от 10 до 0,3 нг/мл в тестеELISA. Для подтверждения концентраций IFNбета в среде, определенных с помощью ELISA,проводили вестерн-блоттинг. Восстановленные супернатанты культуры и стандарты IFN-бета 1 а подвергали анализу методом SDS-PAGE на гелях с градиентом полиакриламида 10-20%(Novex, San Diego, CA) и помещали на мембраны PDVF. Иммуноактивные полосы определяли с помощью кроличьей поликлональной антисыворотки против IFN-бета-1 а (447, Biogen, Inc.,вторая антисыворотка, которая была получена против IFN-бeтa-1a), с последующей обработкой HRP-связанными антикроличьими IgG ослаD. Анализ мутантных форм бетаинтерферона на связывание с рецептором. Рецептор-связывающие свойства мутантных форм бета-интерферона, описанных в разделе С, оценивали с помощью двух различных анализов связывания. В одном анализе измеряли связывание мутантных форм бета-интерферона с гибридным белком, IFNAR2/Ig, включающим внеклеточный домен цепи человеческого рецептора IFNAR2, соединенного с частью константной области человеческого IgG. IFNAR2-Fc экспрессировали в клетках яичников китайского хомяка (СНО) и очищали с помощью аффинной хроматографии на сефарозе с иммобилизованным белком А в соответствии с инструкциями производителя (Pierce Chem. Co., Rockford, IL, по каталогу 20334). Связывание мутантных форм бета-интерферона с IFNAR2-Fс измеряли с помощью анализа формата ELISA. Планшеты для ELISA получали путем покрытия плоскодонных 96-луночных планшетов 50 мкл/лунку мышиных моноклональных антител против человеческого IgG1 (CDG5-AA9, Biogen, Inc.) в течение ночи при 4 С, при концентрации 10 мкг/мл в буфере для покрытия (50 мМ NaHCО 3,0,2 мМ MgCl2, 0,2 мМ CaCl2, pH 9,6). Планшеты дважды промывали PBS, содержащим 0,05%Tween-20, и блокировали 0,5% обезжиренным сухим молоком в PBS в течение 1 ч при комнатной температуре. После двух дополнительных промывок к каждой лунке добавляли 50 мкл 1 мкг/мл IFNAR2-Fc в 0,5% молоке в PBS, содержащем 0,05% Tween-20, и инкубировали в течение 1 ч при комнатной температуре, после чего планшеты промывали еще 2 раза. Связывание мутантных форм бета-интерферона с IFNAR2Fc измеряли путем добавления 50 мкл/лунку мутантных форм бета-интерферона в кондиционированной среде, серийно разведенных в модифицированной по Дальбекко среде Игла(DMEM), дополненной 10% фетальной бычьей сывороткой, и инкубировали 2 ч при 4 С. Разведения мутантных форм бета-интерферонаoбычно варьировали приблизительно от 1 мкМ до 10 пМ. После промывания концентрацию бета-интерферона, связанного с планшетом,определяли путем добавления 50 мкл/лунку смеси, состоящей из разбавленных 1:1000 кро 35 личьих поликлональных антител против интерферона (447) и меченных пероксидазой хрена(HRP) антикроличьих IgG осла (Jackson ImmunoResearch), и инкубации в течение 15 мин при 4 С. После двух промывок добавляли субстратHRP и планшет инкубировали при 4 С, после чего считывали поглощение при 450 нм на аппарате для прочтения планшет ELISA. Строили график зависимости поглощения от концентрации мутантной формы бета-интерферона, и сродство связывания мутантной формы бетаинтерферона с IFNAR2-Fс определяли путем приведения данных к простому гиперболическому уравнению связывания. Результаты этих анализов приведены на фиг. 1, в которой связывающее сродство для каждого мутанта, определенное по крайней мере в трех независимых экспериментах, выражали в виде процента от величины, измеренной для Нis6-бета-1 аинтерферона дикого типа. Во втором анализе использовали измерение сродства, с которым мутантные формы бета-интерферона связываются с клетками Дауди,экспрессирующими обе рецепторные цепи, IFNAR1 и IFNAR2, которые вместе составляют рецептор бета-интерферона. В этом анализе,который проводят с использованием FACS, использовали блокирование моноклональных антител, направленных против внеклеточного домена IFNAR1, ЕА 12 (Biogen, Inc.), для того,чтобы различить незанятый (свободный) рецептор от рецептора, с которым связан бетаинтерферон. Клетки Дауди (20 мкл с концентрацией 2,5 х 107 клеток/мл) помещали в 96 луночные планшеты ELISA с V-образным дном и инкубировали в течение 1 ч при 4 С с различными концентрациями мутантных форм бетаинтерферона (20 мкл в FACS-буфере; 5% FBS,0,1% NaN3 в PBS). Желательные серийные разведения мутантных форм бета-интерферона варьировали от 0,5 мкМ до 0,5 пМ. К каждой лунке добавляли 100 нг биотинилированных мышиных моноклональных антител ЕА 12 (10 мкл) против IFNAR1, и планшеты инкубировали еще 2 мин при комнатной температуре, после чего их дважды промывали FACS-буффером(4 С). Затем клетки инкубировали 30 мин при 4 С с 50 мкл/лунку разбавленного 1:200 Rфикоэритрин-конъюгированного стрептавидинаFACS-буфера, содержащего 0,5% параформальдегида, и переносили в полистироловые пробирки 12 х 75 мм (Falcon 2052). Затем образцы анализировали с помощью проточной цитометрии на FACScan (Becton Dickinson). Строили график зависимости среднего значения интенсивности канальной флюоресценции (MFCI) от концентрации мутантной формы бетаинтерферона: связывающее сродство определяли как концентрацию мутантной формы бетаинтерферона, соответствующую 50% ингибиро 004789 36 ванию окрашивания антител. Каждую мутантную форму тестировали много раз. На фиг. 2 показано связывающее сродство к рецептору для каждой мутантной формы бетаинтерферона, определенное с помощью этого метода, выраженное как процент от сродства,измеренного для Нis6-бета-1 а-интерферона дикого типа в каждом эксперименте. Е. Анализ функции мутантных форм бетаинтерферона. Мутантные формы бета-интерферона также тестировали на функциональную активность,используя in vitro анализы на антивирусную активность и способность бета-интерферона ингибировать пролиферацию клеток. Минимум три антивирусных анализа, каждый с тройными повторами точек данных, проводили для каждой мутантной формы. Нis6-бета-1 а-интерферон дикого типа был включен в каждый эксперимент в качестве образца отнесения. Антивирусный анализ проводили путем обработки клеток карциномы легкого человека А 549 (АТСС CCL 185) в течение ночи 2-кратными серийными разведениями мутантной формы бетаинтерферона в концентрациях, охватывающих интервал от полной защиты против вируса до отсутствия защиты от гибели клеток в результате действия вируса. На следующий день клетки заражали в течение 2 дней вирусом энцефаломиокардита (ВЭМК (ECMV при разбавлении,которое приводит к полной гибели клеток в отсутствие интерферона. Содержимое планшетов затем окрашивали метаболическим красителем МТТ (2,3-бис[2-метокси-4-нитро-5-сульфофенил]2 Н-тетразолин-5-карбоксианалид) (М-5655, Sigma,St. Louis, МО). Получали базовый раствор МТТ с концентрацией 5 мг/мл в PBS, подвергали стерильной фильтрации, и 50 мкл этого раствора разбавляли в клеточных культуральных средах(100 мкл на лунку). После инкубации при комнатной температуре в течение 30-60 мин раствор МТТ/среда отбрасывали, клетки промывали 100 мкл PBS, и, наконец, метаболизированный краситель солюбилизировали в 100 мкл 1,2N растворе соляной кислоты в 90% изопропаноле. Количество живых клеток (как видно по присутствию красителя) определяли по поглощению при 450 нм. Данные анализировали путем нанесения на график величины поглощения против концентрации мутантной формы бетаинтерферона, и активность каждой мутантной формы определяли как концентрацию, при которой наступала гибель 50% клеток. На фиг. 3 показана активность каждой мутантной формы,выраженная в виде процента от активности, измеренной в каждом эксперименте для hisмеченного бета-1 а-интерферона дикого типа. Мутантные формы бета-интерферона также оценивали на активность в антипролиферативном анализе. Клетки человеческой лимфомы Дауди-Беркитта (АТССCCL 213) высевали в концентрации 2 х 105 клеток/мл в RPMI 1620, 37 дополненной 10% определенной фетальной телячьей сывороткой (Hyclone, Logan Utah) и 2 мМ L-глутамином. Каждая лунка также содержит заданную концентрацию мутантной формы бета-интерферона в конечном общем объеме 100 мкл среды на лунку; использующиеся концентрации бета-интерферона были выбраны так,чтобы охватывать интервал от максимального ингибирования пролиферации клеток Дауди до отсутствия ингибирования (т.е. полная пролиферация). Повторы экспериментальных точек использовали для каждой концентрации тестируемой мутантной формы бета-интерферона, и во всех экспериментах был включен параллельный набор необработанных клеток. Клетки инкубировали в течение 2 дней при 37 С в инкубаторах с 5% CO2, после чего к каждой лунке добавляли 1 мкКи на лунку меченного тритием тимидина метил-3H)тимидин,AmershamTRK758) в 50 мкл среды и инкубировали в течение еще 4 ч. Клетки собирали, используя харвестер планшет LKB, и включение меченного тритием тимидина измеряли, используя планшет-ридер LKB бета. Получали средние значения повторов экспериментальных данных, и определяли стандартные отклонения. Данные наносили на график как среднее количество импульсов в минуту против концентрации мутантной формы бета-интерферона, и активность каждого мутанта определяли как концентрацию,требующуюся для получения 50% ингибирования максимального наблюдающегося роста. Для каждой мутантной формы проводили многочисленные анализы. На фиг. 4 показаны результаты, выраженные в виде процента от активности,обнаруженной для his-меченного бета-1 а-интерферона дикого типа в каждом эксперименте.F. Свойства мутантных форм бетаинтерферона. Было обнаружено, что активность гистидин-меченного бета-1a-интерферона дикого типа в антивирусном и антипролиферативном анализах была в каждом приблизительно в 3 раза ниже, чем соответствующая активность,обнаруженная для немеченого бета-1 аинтерферона дикого типа. Из-за того, что все мутантные формы бета-интерферона А 1-Е содержат идентичную his-меченную последовательность в их N-концевых областях, влияние мутаций на свойства молекулы определяли путем сравнения активностей данных мутантных форм в антивирусном, антипролиферативном анализах и анализе связывания с активностью,наблюдаемой для his-меченного бета-1 аинтерферона дикого типа. Исходя из этого, заявители допускали, что вариации активностей мутантных форм А 1-Е, сравниваемые с hisмеченным бета-1 а-интерфероном дикого типа,качественно и количественно приблизительно соответствуют эффектам, которые те же мутации будут оказывать в отсутствие N-концевогоhis-маркера. Эквивалентное допущение для ме 004789 38 ченных или гибридных конструкций других растворимых цитокинов обычно считается верным практикующими специалистами, использующими мутагенез с последовательными аланиновыми замещениями, особенно если in vitro функциональная активность меченной или гибридной конструкции близка к активности цитокина дикого типа, как в случае, описанном в данном документе. См., например, Pearce K.H. Jr.,et al., J. Biol. Chem. 272:20595-20602 (1997) и JonesJ.T., et al., J. Biol. Chem. 213:11667-11674 (1998). Данные, приведенные на фиг. 1-4, позволяют предположить наличие трех типов эффектов, которые вызваны направленным мутагенезом. Эти эффекты в некоторых условиях могут быть благоприятными для разработки лекарственного препарата на основе интерферона. К данным трем типам эффектов относятся следующие: (а) мутантные формы с более высокой антивирусной активностью, чем активность бета-1 а-интерферона дикого типа (например, мутантная форма С 1); (b) мутантные формы, которые проявляют активность как в антивирусном,так и в антипролиферативном анализе, но для которых антипролиферативная активность является непропорционально низкой по отношению к антивирусной активности, по сравнению с диким типом бета-1 а-интерферона (например,мутантные формы C1, D и DE1); и (с) функциональные антагонисты (например, A1, B2, CD2 иDE1), которые демонстрируют антивирусную и антипролиферативную активность, которые являются непропорционально низкими по отношению к связыванию рецептора, по сравнению с диким типом бета-1 а-интерферона. Можно видеть, что некоторые мутантные формы относятся более чем к одному классу. Обзор этих классов приведен ниже. Хотя заявители характеризуют данные классы мутантных форм относительно перечисленных примеров, должно быть понятно, что другие мутации в данных областях могут приводить к подобным или даже увеличенным влияниям на активность.(a) Мутантная форма С 1 обладает антивирусной активностью, которая приблизительно в 6 раз выше, чем активность his-меченного бета 1 а-интерферона дикого типа. Ожидается, что эта и другие мутантные формы данного типа будут полезными для уменьшения количества бета-интерферона, которое должно быть введено для достижения заданного уровня антивирусного эффекта. Полагают, что уменьшение количества вводимого белка приведет к уменьшению иммуногенности данного белка и может также уменьшить побочные эффекты, касающиеся токсичности, не основанной на механизме действия белка. Ожидается, что мутации в данном классе являются благоприятными в ситуациях, когда терапевтическое улучшение, наступившее в результате введения бетаинтерферона, является следствием его антивирусного действия и когда антипролиферативная 39 активность сопровождается токсичностью или нежелательными побочными эффектами.(b) Относительные активности (% от дикого типа) аланинзамещенных мутантных форм в антивирусном и антипролиферативном анализах сравнивают на фиг. 5. Согласованно измененные активности (т.е. антивирусная и антипролиферативная активности, которые отличаются на один и тот жe коэффициент от активностейhis-меченного бета-1 а-интерферона дикого типа) обнаруживали в большинстве мутантных форм (которые лежат на диагональной линии). Однако некоторые мутантные формы имеют более сильные изменения в активности в одном анализе относительно другого, по сравнению сhis-меченным бета-1 а-интерфероном дикого типа, как видно по смещению от диагонали. Три такие мутантные формы показаны в табл. 3,приведенной ниже. Мутантная форма С 1 обнаруживает антивирусную активность, которая в 6 раз выше, чем активность his-меченного бета-1 а-интерферона дикого типа, но ее активность в антипролиферативном анализе является подобной активности дикого типа. Таким образом, мутантная форма С 1 обладает антивирусной активностью, превышающей в 5,2 раза ее антипролиферативную активность, по сравнению с his-меченным бета-1 а-интерфероном дикого типа. Подобным образом, мутантная формаD проявляет 65% активности дикого типа в антивирусном анализе, но только 20% активности дикого типа в антипролиферативном анализе, и,таким образом, обладает антивирусной активностью, которая в 3,4 превышает ее антипролиферативную активность по сравнению с диким типом. Мутантная форма DE1 проявляет 26% активности дикого типа в антивирусном анализе, но только 8,5% в антипролиферативном анализе, и, таким образом, обладает антивирусной активностью, которая в 3,0 раза превышает ее антипролиферативную активность по сравнению с his-меченным бета-1 а-интерфероном дикого типа. При введении в концентрации, достаточной для достижения желаемого уровня антивирусной активности, эти мутантные белки будут обнаруживать существенно более низкие уровни антипролиферативной активности, чем белок дикого типа. Ожидается, что мутации в этом классе, так же, как и в классе (а), являются благоприятными в ситуациях, когда терапевтическое улучшение, наступившее в результате введения бета-интерферона, является следствием его антивирусного действия и когда антипролиферативная активность сопровождается токсичностью или нежелательными побочными эффектами. Таблица 3 Мутантная Антивирусная Антипролифератив- АВ/АП форма активность (АВ), ная активность (АП),% от дикого типа % от дикого типа С 1 571 109 5,2(с) Мутантные формы с антивирусной и антипролиферативной активностями, которые являются низкими относительно рецепторного связывания, по сравнению с his-меченным бета 1 а-интерфероном дикого типа (см. табл. 4, приведенную ниже). Мутантная форма А 1 проявляет антивирусную и антипролиферативную активности, которые являются в 2,0 раза и в 1,8 раза выше, чем активности, наблюдающиеся дляhis-меченного бета-1 а-интерферона дикого типа,но связывает родственный рецептор на клетках Дауди со сродством, которое в 29 раз превышает сродство дикого типа. Связывание данной мутантной формы с рецептором IFN-бета, таким образом, увеличено приблизительно в 15 раз по сравнению с антивирусной и антипролиферативной активностями данного белка. Подобным образом, мутантные формы В 2, CD2 и DE1 показывают увеличение связывания по отношению к антивирусной активности в 4,6, 4,6 и 18 раз соответственно и по отношению к антипролиферативной активности в 3,5, 15 и 54 раза. Ожидается, что эти белки будут полезными в качестве функциональных антагонистов активности эндогенного IFN-бета и, возможно, других эндогенных интерферонов типа I, так как они обладают способностью связывать и занимать рецептору и, кроме того, генерируют только небольшую часть функционального ответа в клетках-мишенях, который можно наблюдать в случае IFN-бета дикого типа. Таблица 4 Анти- Антипроли- Клеточная Мутант- вирусная феративная связыСвязыва- Связываная активность активность вающая ние/АВ ние/АП формаG. Зависимость мутеина от трехмерной структуры интерферона. В то время как опубликованные кристаллические структуры негликозилированной формы мышиного бета-интерферона (Т. Senda, S.Mediated Dimer of Human Interferon-2b Revealed by X-ray Crystallography. Structure. 4: 1453-1463 (1996 предоставили модели полипептидного каркаса человеческого бетаинтерферона, заявители недавно установили структуру гликозилированной формы бета-1aинтерферона (М. Karpusas, M. Nolte, С.В.Goelz. The Crystal Structure of Human Interferon 41at 2.2 A resolution. Proc. Natl. Acad. Sci. USA 94:11813-11818 (1997. Результаты наших мутационных анализов могут быть суммированы относительно 3Dструктуры бета-1 а-интерферона (не представлено в данном документе). Некоторые мутации остатков приводят к уменьшению активности(от 2- до 5-кратное уменьшение). Мутировавшие участки соответствуют замещениям, приведенным в табл. 1 и 2. Остатки, существенные для антивирусной и антипролиферативной активности, локализованы к нижней половинеIFN-бета-1a молекулы (набор а и b). Мутации в верхней половине молекулы, где расположены амино- и карбоксиконцы, не оказывали никакого влияния на биологическую активность или рецепторное связывание. Мутации в А 2 спирали, АВ 2 петле и Е спирали являются наиболее значительными по их воздействию на функцию и приводят к значительному снижению как активности, так и рецепторного связывания поверхности клетки. Эта область (А 2 спираль, АВ и АВ 2 петля и Е спираль) соответствует участку связывания IFNAR2, так как в нашем исследовании ни одна из этих мутантных форм не связывала IFNAR/Fc. Хотя мутации, которые являются важными для связывания IFNAR2, также влияют на клеточное связывание. На связывающие свойства клеточной поверхности также влияют остатки в других участках молекулы (спираль В 1, спираль С 2). Как можно видеть на 3D моделях (не показано), изображающих эффекты аланинзамещенных мутантных форм, что N-концевые, Сконцевые участки и участки гликозилированной спирали С молекулы IFN-бета-1 а не принадлежат участку, связывающему рецептор. Мутации в этих участках не уменьшают биологической активности или уменьшают связывание рецептора клеточной поверхности. Пример 2. Получение и исследование конъюгированного бета-1 а-интерферона. А. Получение конъюгированного с ПЭГ интерферона. Не оформленную в готовую препаративную форму массу промежуточного вещества бета-1 а-интерферона (продается как AVONEX) при 250 мкг/мл в 100 мМ фосфате натрия рН 7,2,200 мМ NaCl разбавляют равным объемом 100 мМMES, и рН доводят НСl до 5,0. Образец наносят на колонку FF SP-cефарозы (Pharmacia, Piscataway, NJ) при 6 мг бета-1 а-интерферона/мл смолы. Колонку промывают 5 мМ фосфатом натрия рН 5,5, 75 мМ NaCl, и продукт элюируют 30 мМ фосфатом натрия рН 6,0, 600 мМNaCl. Элюированные фракции анализируют по поглощению при 280 нм, и концентрацию интерферона в образцах оценивают, исходя из поглощения, используя коэффициент экстинкции 1,51 для 1 мг/мл раствора. К 1 мг/мл раствора бета-1 а-интерферона из 42 6,0 до 50 мМ, цианоборгидрид натрия (Aldrich,Milwaukee, WI) добавляют до 5 мМ, и 20 К альдегида ПЭГ (Shearwater Polymers, Huntsville,AL) добавляют до 5 мг/мл. Образцы инкубируют при комнатной температуре в течение 20 ч. Конъюгированный с ПЭГ интерферон очищают от продуктов реакции последовательной ступенчатой хроматографией на Superose 6 FPLC калиброванной колонке (Pharmacia) с 5 мМ фосфатом натрия рН 5,5, 150 мМ NaCl в качестве подвижной фазы и SP-Sepharose FF. Калиброванная колонка дает разделение исходного материала модифицированного и не модифицированного бета-1a-интерферона (хроматография не представлена здесь). ПЭГ-бета-1aинтерферонсодержащий элюционный пул после гель-фильтрации разбавляют 1:1 водой и наносят на колонку SP-Sepharose при 2 мг бетаинтерферона/мл смолы. Колонку промывают 5 мМ фосфатом натрия рН 5,5, 75 мМ NaCl, и затем конъюгированный с ПЭГ бета-1aинтерферон элюируют из колонки 5 мМ фосфатом натрия рН 5,5, 800 мМ NaCl. Элюированные фракции анализируют на содержание белка поглощением при 289 нм. Концентрация конъюгированного с ПЭГ интерферона дается в эквивалентах интерферона, поскольку половина ПЭГ не участвует в поглощении при 280 нм. В. Биохимическое исследование конъюгированного с ПЭГ интерферона. Образцы анализируют на степень модификации с помощью SDS-PAGE (гель, не представленный здесь). Добавление единственного ПЭГ приводит к сдвигу в очевидной массе интерферона с 20 до 55 кДа, который легко выявляют при анализе. В конъюгированном с ПЭГ образце не обнаружено ни очевидного немодифицированного бета-1 а-интерферона, ни более высоких массовых форм, полученных в результате присутствия дополнительных групп ПЭГ. Присутствие отдельного ПЭГ проверяютMALDI масс-спектрометрией. Специфичность реакции конъюгирования с ПЭГ оценивают по пептидной карте. 20 мкг аликвоты конъюгированного с ПЭГ и немодифицированного бета-1 аинтерферона в качестве контроля в 240 мкл 200 мМ Трис НСl рН 9,0, 1 мМ EDTA подвергают перевариванию с 1,5 мкг лизилэндопротеиназы от Achromobacter (Wako Bioproducts, Richmond,VA) в течение 3-4 ч при 27 С. 200 мг гуанидина НСl добавляют к каждому образцу, и расщепленные продукты фракционируют на колонкеVydac C4 (0,46 х 25 см), используя 30-минутный градиент от 0 до 70% ацетонитрила в 0,1% TFA при скорости потока 1,4 мл/мин. Эфлюент из колонки проверяют по поглощению при 214 нм. Результаты исследования показаны на фиг. 6. Все предсказанные пептиды от переваривания бета-1 а-интерферона эндопротеиназой Lys-C были идентифицированы по последовательности их N-конца и с помощью массспектрометрии, и из них только пептид, кото 43 рый содержал N-конец интерферона (АР 8), был изменен при модификации, что стало очевидно по его исчезновению с карты. Таким образом,данные картирования показывают, что модификация ПЭГ направлена на N-конец белка, так как только модификация N-конца приводит к определенной потере этого пептида. Дополнительное свидетельство для подобного заключения было получено при выделении конъюгированного с ПЭГ N-концевого пептида после переваривания эндопротеиназой Lys-C и дальнейшего расщепления пептида бромцианом(CNBr), после чего образец подвергали анализу последовательности лазерной десорбционной ионизацией с помощью матрицы после изменения источника (MALDI PSD). CNBr переваривание N-концевого пептида далее расщепляет этот пептид на два фрагмента, причем концевой метионин (M1) содержит фрагмент ПЭГ иSYNLLGFLQR (остатки 2-11 в полученной последовательности бета-интерферона). Анализ последовательности идентифицировал немодифицированный пептид SYNLLGFLQR, который был предсказан, как результат такой обработки. Антивирусная активность образцов бета 1 а-интерферона была тестирована на клетках карциномы легкого человека (А 549 клетки),которые были подвергнуты воздействию вируса энцефаломиокардита (ЕМС) с использованием способов, включающих МТТ окрашивание,упомянутое выше. Кратко, А 549 клетки были предварительно обработаны в течение 24 ч бета 1 а-интерфероном или ПЭГ-модифицированным бета-1 а-интерфероном (4000, 2000, 1000, 500,250, 125, 75, 62,5, 31,25, 50, 33,3, 22,2, 14,8, 9,9,6,6, 4,39 пг/мл) до встречи с вирусом. Исследование проводилось с дублированием данных для каждой концентрации бета-1 а-интерферона. Допустимые отклонения показаны, как полоски погрешности на фиг. 7. Концентрация бета-1 аинтерферона (в препарате или массе), которая предлагает лизис 50% вирусов ("50% цитопатический эффект") (50% максимум OD450), составила около 11 пг/мл, и 50% цитопатический эффект для ПЭГ-модифицированного бета-1aинтерферона составил около 11 пг/мл. Таким образом, конъюгирование с ПЭГ не изменило антивирусную активность бета-1a-интерферона. В этом исследовании авторы обычно находят,что специфическая активность бета-1 аинтерферона приблизительно в 10 раз выше,чем специфическая активность бета-1bинтерферона, и, таким образом, конъюгированный с ПЭГ бета-1 а-интерферон является значительно более активным, чем любой продукт бета-1b-интерферона. Бета-1 а-интерферон был также конъюгирован с ПЭГ 5 К ПЭГ-альдегидным фрагментом,который был приобретен у Fluka, Inc. (Cat. No. 75936, Ronkonkoma, NY), при следовании той же схеме, которая описана для модификации с 20 К ПЭГ-альдегидом, за исключением того, что 44 в реакцию входило 2 мг/мл 5 К ПЭГ. Модификация с 5 К ПЭГ была также высоко специфична для N-конца и не изменяла антивирусную активность бета-1 а-интерферона. Подобно аддукту 20 К, 5 К ПЭГ-бета-1 а-интерферон был неотличим от немодифицированного бета-1 аинтерферона в антивирусном исследовании. Пример 3. Защита бета-1 а-интерферона от стресс-индуцированной агрегации, конъюгированной с ПЭГ. Агрегация бета-интерферона оказывает вредное воздействие на активность. Предварительно авторы показали, что гликозилирование оказывает неблагоприятное воздействие на стабильность бета-1a-интерферона при сравнении с негликозилированными формами бетаинтерферона, и сделали заключение, что гликозилирование вносит вклад в более высокую специфическую активность бета-1 а-интерферона(Runkel L. et al., Pharm. Res. 15: 641-649). Для выяснения, может ли конъюгирование с полимером полиалкиленгликоля далее стабилизировать бета-интерферон, авторы подвергли конъюгированный с ПЭГ бета-1 а-интерферон тепловому стрессу, используя следующий протокол. Проводили термическую денатурацию, используя CARY 3 УФ-спектрофотометр, снабженный компьютерным контролем, с термоэлектрически нагреваемым держателем кюветы. Растворы бета-1a-интерферона в 20 мм HEPES рН 7,5, 20 мМ NaCl уравновешивали при 25 С в 1 мл кювете. Температура держателя кюветы затем поднималась с 25 до 80 С со скоростью 2 С/мин, и денатурация белка проводилась под непрерывным контролем поглощения при 280 нм. Средняя точка согласованно протекающего процесса, Тm, была получена по кривым плавления путем определения температуры, при которой измеренное поглощение было средним между значениями, определенными линиями,экстраполируемыми от линейных областей с каждой стороны согласованно протекающих перемещений. Результаты этого исследования показаны на фиг. 8. Тогда как не конъюгированный с ПЭГ бета-1 а-интерферон подвергается денатурации и агрегированию с 50% перемещением при 60 С,у конъюгированного с ПЭГ интерферона нет заметной агрегации даже при 80 С. В отдельном исследовании авторы расширяли стресс термической обработкой до 95 С, и даже при такой высокой температуре авторы не наблюдали никакой заметной агрегации. Таким образом, соединение с этим полимером полиэтиленгликоля имеет полное и благоприятное воздействие на стабильность белка. Подобная стабилизация наблюдалась с модифицированным бета-1 аинтерфероном, содержащим 20 К и 5 К ПЭГ. Пример 4. Измерение антивирусной активности бета-1 а-интерферона в плазме мышей,обработанных бета-1 а-интерфероном и конъюгированным с ПЭГ бета-1 а-интерфeроном. 45 Мышам (С 57 В 1/6) вводят внутривенно через хвостовую вену или 50000 единиц бета-1 аинтерферона, или 50000 единиц конъюгированного с ПЭГ бета-1 а-интерферона, содержащего 20 К ПЭГ или равный объем буфера, в качестве контроля. Кровь от этих мышей получают ретроорбитально, в различные моменты времени после инъекции (немедленно, через 0,25, 1, 4, 24 и 48 ч). Для каждого момента времени используют по крайней мере 3 мыши. Цельную кровь собирают в пробирки, содержащие антикоагулянт, клетки удаляют, и полученную плазму замораживают до момента испытания. Затем эти образцы и плазмы тестируют в антивирусных исследованиях. Образцы плазмы разбавляют 1:10 в свободной от сыворотке среде и пропускают через 0,2 мкм фильтр. Разбавленные образцы тестируют в антивирусных исследованиях. Образцы титруют в обозначенных лунках 96-луночного планшета с культурой, содержащей А 549 клетки. На каждом планшете анализируют разведения стандартного бета-1 а-интерферона (10; 6,7; 4,4; 2,9; 1,3; 0,9 и 0,6 ед./мл) и четыре образца плазмы. А 549 клетки предварительно обрабатывают разведенными образцами плазмы в течение 24 ч до обработки ЕМС вирусом. После двухдневной инкубации с вирусом жизнеспособные клетки окрашивают раствором МТТ (в 5 мг/мл в фосфатном буфере) в течение 1 ч, промывают фосфатным буфером и растворяют 1,2N НСl в изопропаноле. Лунки читают при 450 нм. Для каждого планшета строят калибровочные кривые и используют для определения величины активности бета-1 а-интерферона в каждом тестируемом образце. Активности в образцах от различных мышей наносят на график против моментов времени (фиг. 9). Более медленное выведение конъюгированного с ПЭГ бета-1a-интерферона из кровообращения как функция времени показывает,что период полужизни в конъюгированных с ПЭГ образцах намного длиннее, чем таковой у необработанного контроля бета-1a-интерферона. Тогда как контроль был в значительной степени выведен через 4 ч, значительная фракция конъюгированного с ПЭГ продукта определялась через 48 ч. Беря за основу начальные уровни активности в сыворотке и активность,сохраняющуюся через 48 ч, авторы делают вывод, что период полужизни конъюгированного с ПЭГ интерферона увеличен по сравнению с периодом полужизни немодифицированного бета 1 а-интерферона. Второе значительное открытие этого исследования состоит в том, что очень небольшое количество конъюгированной с ПЭГ формы было потеряно в течение фазы распределения, что доказывается одинаково высокими уровнями активности в 0 момент времени и через 60 мин. Данные указывают, что, в отличие от контрольного бета-1a-интерферона, распреде 004789 46 ление конъюгированного с ПЭГ продукта в значительной степени ограничено сосудистым руслом. Пример 5. Сравнительная фармакокинетика и фармакодинамика у приматов (общие схемы). Сравнительные исследования проводятся с конъюгатами полимер-бета-1 а-интерферон и нативным бета-1 а-интерфероном (в виде не оформленной в готовую препаративную форму массы промежуточного вещества бета-1 аинтерферона в фосфате натрия, и NaCl, pH 7,2) для определения их относительной стабильности и активности у приматов. В этих исследованиях фармакокинетику и фармакодинамику конъюгата полимер-бета-1 а-интерферон у приматов сравнивали с таковыми нативного бета 1 а-интерферона, и приемлемые выводы могут быть распространены на людей. Животные и способы Способ исследования Способ представляет собой исследование в параллельных группах с повторяющимися дозами для оценки сравнительной фармакокинетики и фармакодинамики конъюгированного и неконъюгированного бета-1 а-интерферона. Для этого исследования использовали здоровых приматов (предпочтительно обезьяны резус). До введения дозы оценивали состояние здоровья всех животных по видимым признакам заболевания в Ветеринарной Лаборатории 2 раза в течение 14 дней до применения препарата; одна оценка должна проводиться не раньше,чем за 24 ч до первого применения препарата. Препарат получают только здоровые животные. Оценка включает общее физическое исследование и предшествующую введению дозы картину крови для определения исходной клинической патологии и исходного уровня антител к бета 1 а-интерферону. В пределах 24 ч до испытательного введения препарата все животные взвешиваются, и регистрируется температура тела. 12 параметров регистрируются и назначаются группам для получения 1 MU/кг бета-1 аинтерферона в виде конъюгата ПЭГ-бета-1 аинтерферона или в неконъюгированном виде. Введение осуществляется или подкожно (SC),или внутривенно (IV). Все животные не должны ранее получать бета-1 а-интерферон. Каждое животное получает дозу препарата по 2 раза; дозы делятся на 4 недели. Объем дозы составляет 1,0 мл/кг. Проводят забор крови для фармакокинетического тестирования в различные интервалы времени, следующие за каждой инъекцией. После каждого введения изучаемого лекарственного средства также берут пробы крови для измерения интерферон-индуцируемого маркера биологического ответа, сывороточного неоптерина. Оценки в процессе исследования включают клинические наблюдения за признаками токсичности, проводимые через 30 мин и 1 ч после получения дозы. Регистрируются ежедневный осмотр клетки и общего вида, наблюдение за признаками интоксикации, дискомфорта и изме 47 нения в поведении. В течение следующего после приема дозы 21 дня через регулярные интервалы регистрируются вес и температура тела. Способы исследования Уровни бета-интерферона в сыворотке количественно выражены с помощью биоанализа цитопатического эффекта (СРЕ). СРЕ измеряет уровни интерферон-медиированной антивирусной активности. Уровень антивирусной активности в образце отражает число молекул активного интерферона, содержащихся в этом образце в момент забора крови. Подобный подход представляет собой стандартный способ оценки фармакокинетики бета-интерферона. СРЕ анализ, использованный в настоящем исследовании, и обнаруживает способность бетаинтерферона предохранять клетки карциномы легкого человека (А 549, CCL-185, АТСС,Rockville, MD) от цитотоксичности, связанной с вирусом энцефаломиелокардита (ЕМС). Клетки предварительно инкубируют в течение 15-20 ч с образцами сыворотки, чтобы произошло индуцирование и синтез интерферон-индуцируемых белков, которые затем обеспечивают противовирусный ответ. После этого добавляют ЕМС вирус и инкубируют еще в течение 30 ч, а затем проводят оценку цитотоксичности, используя краситель кристаллический фиолетовый. Внутренний стандарт бета-интерферона, а также внутренний стандарт конъюгата ПЭГ тестируют одновременно с образцами на каждом испытательном планшете. Этот стандарт калиброван против стандарта естественного интерферона фибробласта человека (WHC Второй международный стандарт интерферона фибробласта человека Gb-23-902-53). Каждый испытательный планшет имеет также лунки контроля клеточного роста, не содержащие ни какого-либо интерферона, ни ЕМС, и вирусные контрольные лунки, содержащие клетки и ЕМС, но не содержащие бета-интерферон. Также готовятся контрольные планшеты, содержащие стандарт и образцы для определения эффекта, если таковой имеется, образцов на рост клетки. Эти планшеты красятся без добавления вируса. Каждый образец и стандарт тестируют в двойном экземпляре на каждом из двух исследовательских планшетов, получая четыре варианта данных на образец. Представляется среднее геометрическое значение этих четырех копий. Разрешающая способность этого исследовании - 10 ед./мл. Концентрации неоптерина в сыворотке определены в клинических фармакологических единицах c использованием коммерчески доступных анализов. Фармакокинетика и статистические методы Используется компьютерная программаRstripTM (MicroMath, Inc., Salt Lake City, UT) для адаптации данных к фармакокинетическим моделям. Среднее геометрическое значение концентраций для каждой группы наносится на 48 график по отношению ко времени. Так как результаты исследований выражены в растворениях, среднегеометрические значения считаются более подходящими, чем среднеарифметические значения. Уровни интерферона в сыворотке приведены в соответствие с начальными значениями, и необнаруживаемые сывороточные концентрации установлены, как 5 ед./мл, что составляет половину нижнего предела обнаружения. Для IV данных, две отдельные IV инфузионные модели приспособлены для определяемых сывороточных концентраций для каждого субъекта, и SC данные приспособлены для двух отдельных инъекционных моделей. Рассчитывались следующие фармакокинетические параметры:(ii) области под кривой от 0 до 48 ч, AUC,используя правило трапеции;(iii) период полужизни при выведении; и от IV инфузионных данных (если использовали IV):(iv) распределение периода полужизни (ч);(л). Для вычисления полужизни при выведении после SC и IM инъекций используется компьютерная программа WinNonlin (Научная Консультационная компания, Apex, NC). Для неоптерина средние арифметические значения в зависимости от времени представлены для каждой группы. Рассчитано Емакс., максимальное отклонение от исходного значения. Смакс., AUC и Емакс. подвергают одноступенчатому анализу, чтобы сравнить группы дозирования. Смакс. и AUC до анализа подвергают логарифмическому преобразованию; представлены средние геометрические значения. Пример 6. Сравнительная оценка фармакокикетики конъюгированного с ПЭГ бета-1 а-интерферона и бета-1 а-интерферона у обезьян резус. Материалы и методы Бета-1 а-интерферон и конъюгированный с ПЭГ бета-1a-интерферон вводили обезьянам резус в 1-ый день 1 раз и еще раз на 29 день внутривенным (IV) или подкожным путем (SC),как описано в общей схеме примера 5. В 1 день 6 обезьян получили IFN бета-1 а (3 обезьяны на 1 путь введения), и другие 6 обезьян получили конъюгированный с ПЭГ IFN бета-1a (3 на путь введения). На 29 день дозы повторили. Доза IV вводилась как медленная болюсная инъекция в краниальную или ножную подкожную вену. Доза SC вводилась под кожу на спине после выбривания места инъекции. Забор крови производили через бедренную вену в точно установленные моменты времени и давали ей свернуться для получения сыворотки. Сыворотку исследовали на определение уровней функциональных веществ лекарственного средства, 49 используя утвержденный антивирусный СРЕ способ и для уровней сывороточного неоптерина и бета-2-микроглобулина, как фармакодинамической меры активности. Фармакологические параметры были рассчитаны с использованием компьютерной программы WinNonlin, версия 2.0(Научная Консультационная компания, Apex, NC). Данные концентрации анализировали стандартными, не зависимыми от модели способами (ненезависимый анализ) для получения фармакокинетических параметров. Область под кривой (AUC) была рассчитана с использованием правила трапеции. Статистические исследования, включая среднеарифметическое значение и допустимое отклонение, проводили с использованием компьютерной программы MicrosoftExel, версия 5.0 (Microsoft Co, Redmond WA). Значения концентрации, представленные ниже как предельные значения количества (BLQ), не использовались в фармакокинетическом анализе. Из-за того, что различные компьютеры и компьютерные программы различным образом округляют или сокращают числа, значения в некоторых таблицах (например, средние значения, допустимые отклонения или индивидуальные значения) могут слегка отличиться от таковых в других таблицах, от индивидуальных расчетных данных или от данных статистического анализа. Эти различия не влияют ни на целостность, ни на интерпретацию этих данных. Выводы и обсуждение В каждом пути введения конъюгированный с ПЭГ бета-1a-интерферон показывал более высокую биодоступность (что измерено по области под кривой сывороточной концентрации от времени). Кроме того, конъюгированный с ПЭГ бета-1 а-интерферон имел более высокую абсолютную биодоступность по сравнению с бета-1a-интерфероном при введении SC путем. Фармакокинетические параметры суммированы в табл. 5. Применение конъюгированного с ПЭГ бета-1 а-интерферона как IV, так и SC путями приводит к увеличению периода полужизни так же, как AUC IFN бета-1a. Таблица 5 Среднее значение (допустимое отклонение)IV или SC введения (доза 1) 1 MU/кг IFN b-1a или конъюгированного с ПЭГ IFN В-1 а обезьянам резуса Готовая препаративная форма 50 После IV введения первой дозы среднее значение (допустимое отклонение) пиковой сывороточной концентрации (Смакс.) IFN бета-1a и конъюгированного с ПЭГ IFN бета-1a составило 6400 (0) и 10800 (3,5) ед./мл соответственно. Среднее (стандартное отклонение) AUC значений составило 4453 (799) и 34373 (3601) ед. ч/мл соответственно. После первого SC введения среднее значение (стандартное отклонение) Cмакс. IFN бета-1a и конъюгированного с ПЭГ IFN бета-1a составило 277 (75) и 1080(381) ед./мл соответственно. Среднее (стандартное отклонение) AUC значения составило 4753 (3170) и 44952 (1443) ед. ч/мл соответственно. Уровни как сывороточного неоптерина,так и сывороточного бета-2-микроглобулина обработки IFN-бета и регистрированным IFNбета были выше, показывая фармакологическую активность продуктов. При высоких дозах используемых тестируемых соединений не имелось никаких отличий в фармакологической активности IFN бета-1a и конъюгированного с ПЭГ IFN бета-1a при введении любым путем(данные представлены). Пример 7. Сравнительная оценка фармакокинетики конъюгированного с ПЭГ бета-1 аинтерферона и бета-1 а-интерферона у крыс после введения различными способами. Цель этого исследования состоит в определении сравнительной биодоступности бета 1 а-интерферона и конъюгированного с ПЭГ бета 1 а-интерферона при нескольких путях введения. Материалы и способы Авторы использовали самок крыс Lewis(по 190 г каждая) для фармакокинетического исследования с 2 крысами на путь введения/состав. Крысам устанавливали катетер в яремную вену и вводили или человеческий бета 1 а-интерферон, или 5 К конъюгированного с ПЭГ человеческого бета-1 а-интерферона, или 20 К человеческого бета-1 а-интерферона (в носителе, состоящем из 14 мг/мл HSA в 50 мМ фосфата натрия, 100 мМ NaCl pH 7,2) внутривенно, интраперитонеально, перорально, подкожно, интратрахеально. Кровь обрабатывали несколько раз в течение 72 ч через 0,5 мин, 15 мин, 30 мин, 75 мин, 3 ч, 24 ч, 48 ч и 72 ч. Схема представлена в табл. 6. Анализ цитопатического эффекта (СРЕ) проводился на образцах сыворотки для определения бета-1 а-интерферона. Результаты, полученные с немодифицированным бета-1 а-интерфероном и бета-1 аинтерфероном, конъюгированным с ПЭГ 20 К ПЭГ, представлены в табл. 7. Во всех случаях конъюгирование с ПЭГ приводило к значительным увеличениям в Т 1/2 и AUC. Таблица 7 Фармакокинетические параметры после IV, SC, IP или IT введения бета-1 а-интерферона (IFN) и конъюгированного с ПЭГ IFN-бета-1a (IFN-ПЭГ) у крыс Готовая препаративная форма (путь введения) Пример 8. Антиангиогенный эффект полимер-конъюгированного бета-1 а-интерферона: оценка способности конъюгированного с ПЭГ бета-1 а-интерферона ингибировать пролиферацию эндотелиальных клеток in vitro Венозные эндотелиальные клетки человека(Cell System, Cat. 2VO-P75) и микроваскулярные эндотелиальные клетки кожи человека (CellSystem, Cat. 2M1-C25) поддерживаются в культуре с набором сред CS-C (Cell System, Cat. 4ZO-500). За 24 ч до эксперимента клетки обрабатывают трипсином и ресуспендируют в аналитической среде, 90% М 199 и 10% фетальной бычьей сыворотке, и доводят до желательной плотности клеток. Затем клетками покрывают 24- и 96-луночные планшеты, покрытые желатином, или при 12500 клетках/лунку, или 2000 клетках/лунку, соответственно. После инкубации в течение ночи аналитическую среду заменяли свежей средой, содержащей 20 нг/мл рекомбинантного основного фактора роста фибробластов человека (BectonDickinson, Cat. 40060) и различные концентрации конъюгированного и неконъюгированного белка бета-1 а-интерферона или положительный контроль (эндостатин может использоваться как положительный контроль, и как антитело кbFGF). Конечный объем доводится до 0,5 мл в 24-луночном планшете или 0,2 мл в 96 луночном планшете. 52 Через 72 ч клетки обрабатывают трипсином для Coulter подсчета, замораживают дляCyQuant флуоресцентного считывания или метят [3 Н]тримидином. Сравнивают ингибирование пролиферации эндотелиальных клеток invitro конъюгированным и неконъюгированным бета-1 а-интерфероном, показывая, что конъюгирование с ПЭГ не связано со способностью интерферона проявлять данную функцию в этом исследовании. Это исследование in vitro тестирует молекулы бета-1a-интерферона данного изобретения на воздействие на пролиферацию эндотелиальных клеток, которое может быть показательно для антиангиогенного эффекта in vivo. Смотри O'Reilly,M.S., T. Boehm, Y. Shing, N. Fukal, G. Vasios, W.Angiogensig and Tumor Growth. Cell 88, 277-285. Пример 9. In vivo модель для тестирования антиангиогенного эффекта и эффекта неоваскуляризации конъюгированного бета-1a-интерферона. Многообразные модели были разработаны для тестирования антиангиогенного эффекта и эффекта антинеоваскуляризации описанных здесь молекул. Некоторые из этих моделей были описаны в патентах США 5733876 (31 марта 1998: "Способ ингибирования ангиогенеза") и 5135919 (4 августа, 1992: "Способ и фармацевтическая композиция для ингибирования ангиогенеза"). Другие исследования - анализ беспанцирных хориолантойных мембран (САМ) S.(1985); модель Folkman, J. et al. -ангиогенез способом мышиного спинного воздушного мешка;J. Ехр. Med., 133, 275 (1971) и анализ роговичного micropocket крыс, Gimbrone, M.A. Jr. et al.,J. Natl. Cancer Inst. 52, 413 (1974), в котором васкуляризация роговицы вызвана у взрослых самцов крыс линии Sprague-Dawley (CharlesRiver, Japan) имплантацией в каждую роговицу шариков 500 нг основного FGF (бычий, R и DSystems Inc.), импрегнированных в EVE (этиленвинилацетатный сополимер). Другие способы тестирования конъюгированного с ПЭГ бета-1a-интерферона мыши на антиангиогенные эффекты на животной модели включают (не ограничиваясь ими) схемы скринирования новых возможных противораковых агентов, как описано в original Cancer Chemotherapythe supplement In Vivo Cancer Model, 1976-1982,NIH Publication No 84-2635, February 1984. Из-за межвидового барьера интерферона I для оценки антиангиогенной активности полимер-конъюгированного бета-1a-интерферона на моделях грызунов получали полимерконъюгированные препараты бета-интерферона грызунов. Такие скринирующие способы иллюстрируются схемой для тестирования антиангиогенных эффектов конъюгированного с ПЭГ 53 бета-интерферона мыши на имплантированной подкожно карциноме легкого Левиса Лунга. Происхождение опухолевой линии: возникла спонтанно в 1951 как карцинома легкого у C57BL/6 мыши. Обобщение способов тестирования: фрагмент опухоли внедрен подкожно в подмышечную область B6D2F1 мыши. Тестируемый агент(т.е. конъюгированный с ПЭГ интерферон данного изобретения) вводится в различных дозах,подкожно (SC) или внутрибрюшинно (IP) в течение большого количества дней после имплантации опухоли. Измеренный параметр представляет среднюю продолжительность жизни. Результаты выражены как процент от продолжительности жизни контроля. Животные: Распространение: C57BL/6 мыши. Тестирование: B6D2F1 мыши. Вес: Мыши должны иметь вес в пределах 3 г при минимальном весе 18 г для самцов и 17 г для самок. Пол: в одном эксперименте использовался один пол для теста и контроля. Источник: в одном эксперименте при возможности использовали один источник для всех животных. Величина экспериментальной группы: 10 животных на испытательную группу. Передача опухоли: Разведение: Фрагмент: Готовят фрагмент 2-4 мм из подкожной донорской опухоли. Время: 13-15 дней. Место: фрагмент имплантируют подкожно в подмышечную область с пункцией в паховую область. Тестирование: Фрагмент: Готовят фрагмент 2-4 мм из подкожной донорской опухоли. Время: 13-15 дней. Место: Имплантируют фрагмент подкожно в подмышечную область пункцией в паховую область. График тестирования: 0 день: Имплантирование опухоли. Получение бактериальных культур. Тестовое соединение положительного контроля для каждого нечетного эксперимента. Подготовка материалов. Ежедневная регистрация случаев смерти. 1 день: Проверка культуры. Отбраковка эксперимента при загрязнении. Randomize животных. Обработка по инструкции (в 1 день и в последующие дни). 2 день: Проверка культуры. Отбраковка эксперимента при загрязнении. 5 день: Оценка токсичности агента по весу 2 дня и дня начала тестирования. 14 день: Контроль дня ранней гибели. 48 день Контроль no-take дня. 60 день: Конец и оценка эксперимента. Исследование легких на рост опухоли. 54 Контроль качества: План соединения для положительного контроля (NSC 26271 (Cytoxan в дозе 100 мг/кг/введение в каждом нечетном эксперименте, режим которого является внутрибрюшинным только в 1 день. Более низкое тест/контроль ограничение для положительного контроля составляет 140%. Средняя продолжительность жизни необработанного контроля 19-35,6 дней. Оценка: Измеренный параметр представляет среднюю продолжительность жизни. Вычисляют средний вес тела животного в течение 1 дня и 5 дня, вычисляют соотношение тест/контроль для всех тестируемых групп. Вычисляют средний вес тела животного дня начала эксперимента и последнего дня. Вычисляют соотношение тест/контроль для всех тестовых групп с 65% выживания на 5 день. Соотношение тест/контроль критерий 86% указывает на токсичность. Чрезмерное изменение веса тела(тест с отрицательным контролем) может также использоваться в оценке токсичности. Критерии активности: Начальное соотношение тест/контроль, большее чем или равное 140%, рассматривается необходимым для проявления умеренной активности. Воспроизводимое значение соотношения тест/контроль,большее чем или равное 150%, рассматривается как значительная активность. Список последовательностей ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Композиция, содержащая гликозилированный 1a-интерферон с аминокислотной последовательностью SEQ ID NO:25, связанный с неприродным полимером по N-концу указанного гликозилированного 1a-интерферона, причем указанный полимер содержит полиалкиленгликолевый радикал. 2. Композиция по п.1, в которой полиалкиленгликолевый фрагмент связан с 1aинтерфероном посредством группы, выбранной из альдегидной группы, малеимидной группы,винилсульфоновой группы, галогенацетатной группы, множества гистидиновых остатков,гидразиновой группы и аминотиоловой группы. 3. Композиция по п.1, в которой гликозилированный 1a-интерферон является более активным, чем 1b-интерферон при измерении в анализе противовирусной активности. 4. Композиция по п.3, в которой 1aинтерферон сохраняет 50-100% эффективности 1a-интерферона без указанного полимера при измерении в анализе противовирусной активности. 5. Композиция 1a-интерферона по п.1, в которой полимер имеет молекулярную массу приблизительно от 5 приблизительно до 40 кДа. 6. Фармацевтическая композиция, содержащая композицию 1 а-интерферона по п.5. 7. Композиция, содержащая мутантный интерферон, связанный с неприродным полиме
МПК / Метки
МПК: A61K 47/48, A61P 31/12
Метки: бета-1а-интерферона, использование, конъюгаты, полимерные
Код ссылки
<a href="https://eas.patents.su/30-4789-polimernye-konyugaty-beta-1a-interferona-i-ih-ispolzovanie.html" rel="bookmark" title="База патентов Евразийского Союза">Полимерные конъюгаты бета-1а-интерферона и их использование</a>
Следующий патент: Композиции на основе слитого белка ов и способы их применения
Случайный патент: Погружной стакан с оболочкой в шлаковой зоне, способ его изготовления и состав оболочки