Замещенные трициклические соединения
Номер патента: 3992
Опубликовано: 25.12.2003
Авторы: Драхейм Сьюзн Е., Бах Николас Дж., Дийяр Робер Д., Морин Джон М.Мл.
Формула / Реферат
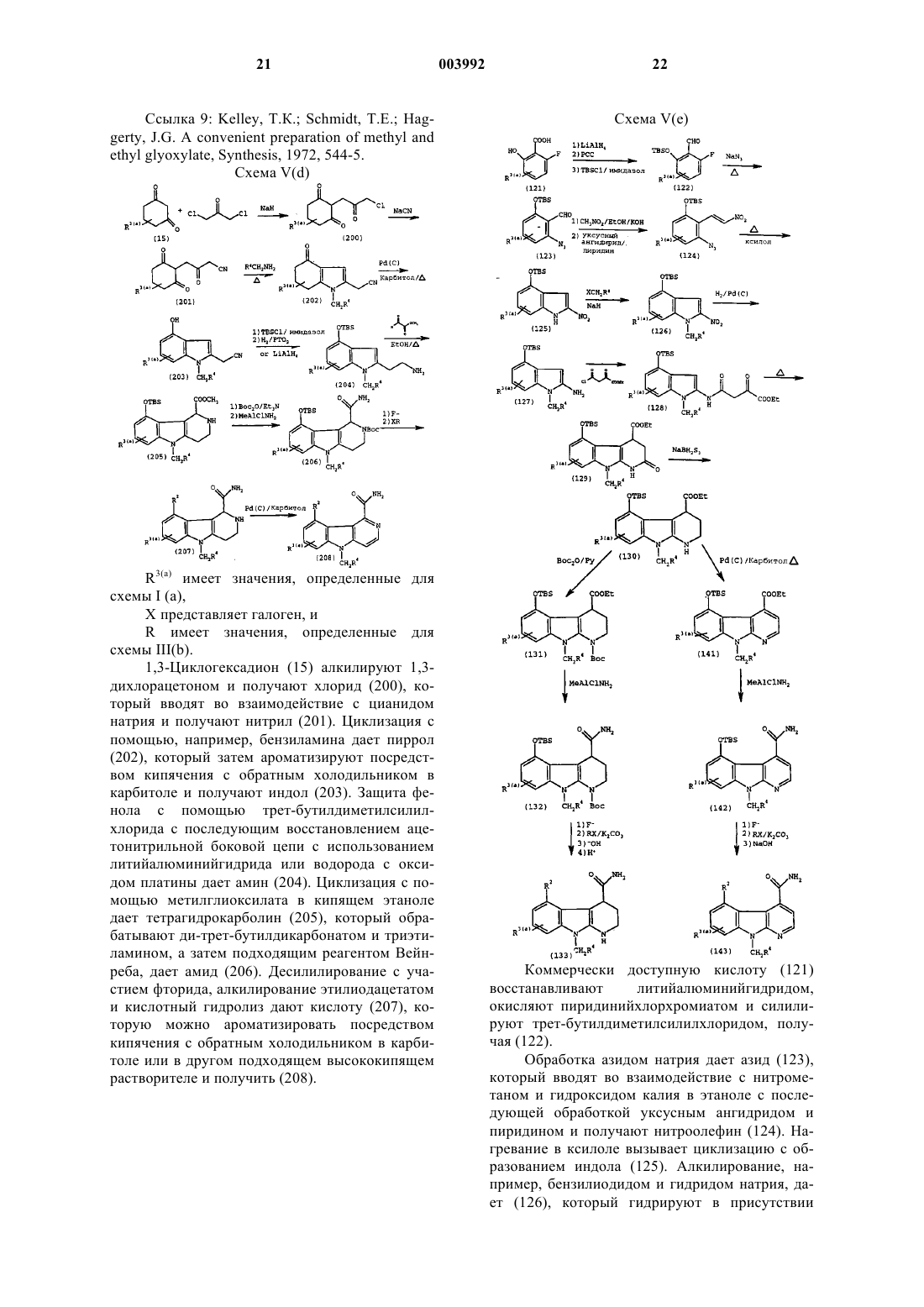
1. Применение соединения формулы (III)
где
R20 представляет собой -CH2-R4, где R4 представляет собой фенил;
R21 представляет собой водород, метил, этил (не препятствующие заместители);
R1' представляет собой -NHNH2 или -NH2;
R2' представляет собой -OH, -O(CH2)tR5, где R5 представляет собой CN или фенил и t равно 1-5, или -(OCH2)-(кислотную группу);
или его фармацевтически приемлемой соли, рацемата, сольвата, таутомера, оптического изомера или пролекарственного производного;
для ингибирования опосредуемого сФЛА2 высвобождения жирных кислот.
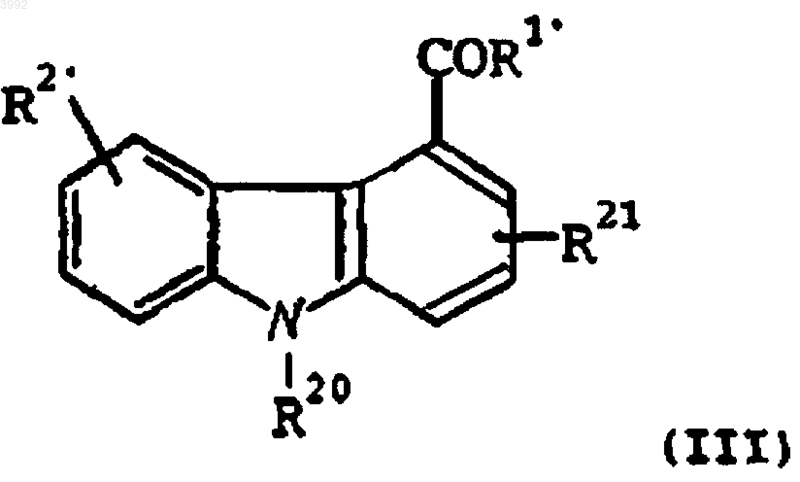
2. Применение соединения формулы (I)
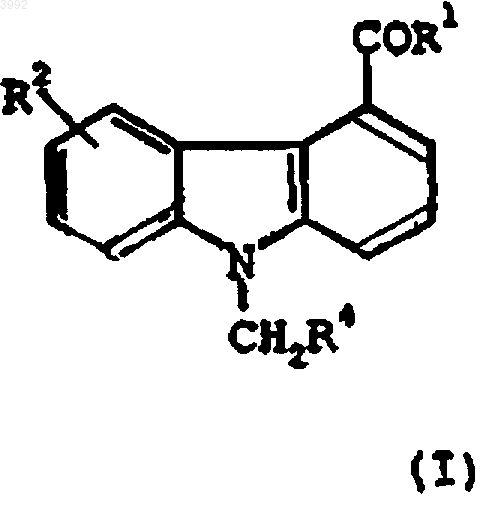
где
R1 представляет собой -NHNH2 или -NH2;
R2 представляет собой -OH или -O(CH2)mR5, где R5 представляет собой фенил и m равно 1-3; и
R4 представляет собой фенил;
или его фармацевтически приемлемая соль, рацемат, оптический изомер, сольват, таутомер или пролекарственное производное;
для ингибирования опосредуемого сФЛА2 высвобождения жирных кислот.
3. Применение по п.2, где соединение представляет собой
4-[(9-бензил-4-карбамоил-1,2,3,4-тетрагидрокарбазол-6-ил)окси]масляную кислоту;
3-[(9-бензил-4-карбамоил-1,2,3,4-тетрагидрокарбазол-6-ил)окси]пропилфосфоновую кислоту;
2-[(9-бензил-4-карбамоил-1,2,3,4-тетрагидрокарбазол-6-ил)окси]метилбензойную кислоту;
3-[(9-бензил-4-карбамоил-7-н-октил-1,2,3,4-тетрагидрокарбазол-6-ил)окси]пропилфосфоновую кислоту;
4-[(9-бензил-4-карбамоил-7-этил-1,2,3,4-тетрагидрокарбазол-6-ил)окси]масляную кислоту;
3-[(9-бензил-4-карбамоил-7-этил-1,2,3,4-тетрагидрокарбазол-6-ил)окси]пропилфосфоновую кислоту;
3-[(9-бензил-4-карбамоил-7-этил-1,2,3,4-тетрагидрокарбазол-6-ил)окси]пропилфосфоновую кислоту;
(S)-(+)-4-[(9-бензил-4-карбамоил-7-этил-1,2,3,4-тетрагидрокарбазол-6-ил)окси]масляную кислоту;
4-[9-бензил-4-карбамоил-6-(2-цианоэтил)-1,2,3,4-тетрагидрокарбазол-6-ил]оксимасляную кислоту;
4-[9-бензил-4-карбоксамидо-7-(2-фенилэтил)-1,2,3,4-тетрагидрокарбазол-6-ил]оксимасляную кислоту;
4-[9-бензил-4-карбоксамидокарбазол-6-ил]оксимасляную кислоту;
метил 2-[(9-бензил-4-карбамоил-1,2,3,4-тетрагидрокарбазол-6-ил)окси]метилбензоат;
гидразид 9-бензил-5,7-диметокси-1,2,3,4-тетрагидрокарбазол-4-карбоновой кислоты,
9-бензил-5,7-диметокси-1,2,3,4-тетрагидрокарбазол-4-карбоксамид;
натриевую соль [9-бензил-4-карбамоил-7-метокси-1,2,3,4-тетрагидрокарбазол-5-ил]оксиуксусной кислоты;
4-[9-бензил-4-карбамоил-7-(2-цианоэтил)-1,2,3,4-тетрагидрокарбазол-6-ил]оксимасляную кислоту;
[9-бензил-4-карбамоил-7-метоксикарбазол-5-ил]оксиуксусную кислоту;
метил [9-бензил-4-карбамоил-7-метоксикарбазол-5-ил]оксиуксусную кислоту;
9-бензил-7-метокси-5-цианометилокси-1,2,3,4-тетрагидрокарбазол-4-карбоксамид;
9-бензил-7-метокси-5-(1Н-тетразол-5-илметил)окси-1,2,3,4-тетрагидрокарбазол-4-карбоксамид;
[9-бензил-4-карбамоил-8-метил-1,2,3,4-тетрагидрокарбазол-5-ил]оксиуксусную кислоту;
[9-бензил-4-карбамоил-8-метилкарбазол-5-ил]оксиуксусную кислоту;
[9-бензил-4-карбамоил-1,2,3,4-тетрагидрокарбазол-5-ил]оксиуксусную кислоту и
[9-бензил-4-карбамоилкарбазол-5-ил]оксиуксусную кислоту
или его фармацевтическую соль, рацемат, сольват, таутомер, оптический изомер или пролекарственное производное.
4. Способ селективного ингибирования сФЛА2 у млекопитающего, нуждающегося в таком лечении, включающий введение указанному млекопитающему фармацевтически эффективного количества соединения формулы (III), указанного в п.1.
5. Способ по п.4, в котором млекопитающим является человек.
6. Способ селективного ингибирования сФЛА2 у млекопитающего, нуждающегося в таком лечении, включающий введение указанному млекопитающему фармацевтически эффективного количества соединения формулы (II)
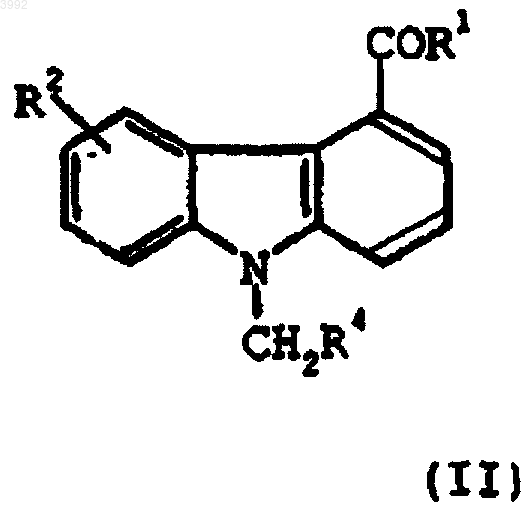
где
R1 представляет собой -NHNH2 или -NH2;
R2 представляет собой -OH или -O(CH2)mR5, где m равно 1-3 и R5 представляет собой -CN или фенил;
R4 представляет фенил;
или его фармацевтически приемлемой соли, рацемата, оптического изомера, таутомера, сольвата или пролекарственного производного.
7. Способ по п.6, в котором млекопитающим является человек.
8. Способ селективного ингибирования сФЛА2 у млекопитающего, нуждающегося в таком лечении, включающий введение указанному млекопитающему фармацевтически эффективного количества соединения формулы (III) в количестве, достаточном для ингибирования опосредуемого сФЛА2 высвобождения жирной кислоты и, посредством этого, ингибирования или предотвращения метаболизма арахидоновой кислоты и его вредных продуктов.
9. Способ по п.8, где млекопитающим является человек.
10. Применение соединения формулы (III)
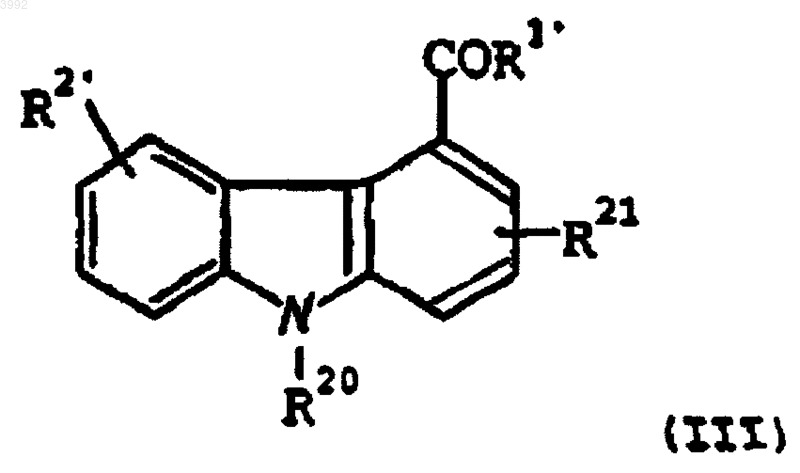
где
R20 представляет собой -CH2-R4, где R4 представляет собой фенил;
R21 представляет собой водород, метил, этил (не препятствующие заместители);
R1' представляет собой -NHNH2 или -NH2;
R2' представляет собой -OH, -O(CH2)tR5, где R5 представляет собой CN или фенил и t равно 1-5, или -(OCH2)-(кислотную группу);
или его фармацевтически приемлемой соли, рацемата, сольвата, таутомера, оптического изомера или пролекарственного производного;
для селективного ингибирования сФЛА2 у млекопитающего, нуждающегося в таком лечении.
11. Применение соединения формулы (I)
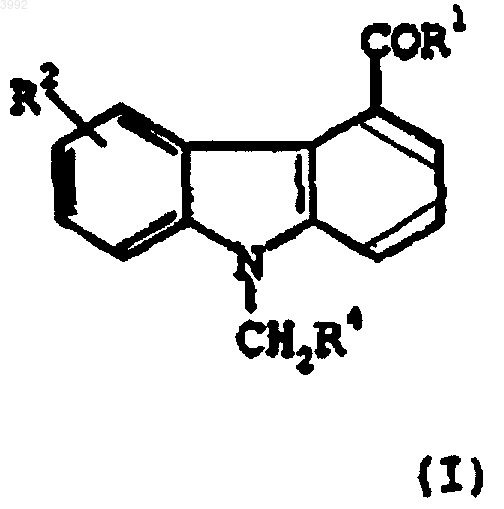
где
R1 представляет собой -NHNH2 или -NH2;
R2 представляет собой -OH или -O(CH2)mR5, где R5 представляет собой фенил и m равно 1-3; и
R4 представляет собой фенил;
или его фармацевтически приемлемой соли, рацемата, сольвата, таутомера, оптического изомера или пролекарственного производного;
для селективного ингибирования сФЛА2 у млекопитающего, нуждающегося в таком лечении.
12. Применение соединения формулы (III)
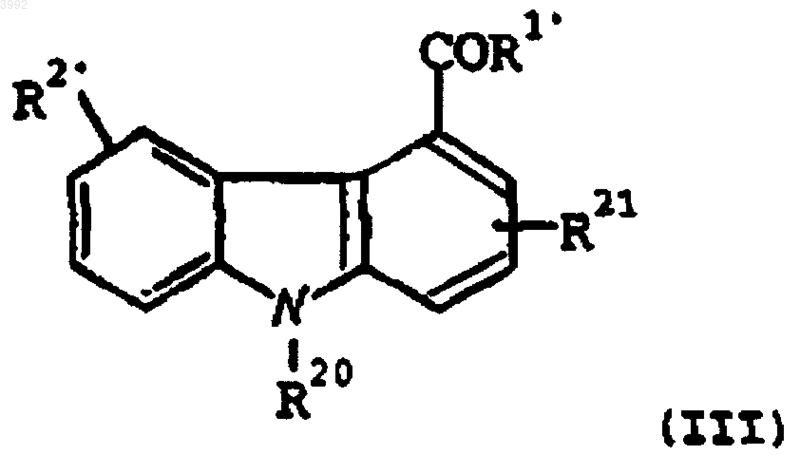
где
R20 представляет собой -CH2-R4, где R4 представляет собой фенил;
R21 представляет собой водород, метил, этил (не препятствующие заместители);
R1' представляет собой -NHNH2 или -NH2;
R2' представляет собой -OH, -O(CH2)tR5, где R5 представляет собой CN или фенил и t равно 1-5, или -(OCH2)-(кислотную группу);
или его фармацевтически приемлемой соли, рацемата, сольвата, таутомера, оптического изомера или пролекарственного производного;
для производства лекарственного средства для селективного ингибирования сФЛА2 у млекопитающего, нуждающегося в таком лечении.
13. Применение соединения формулы (I)
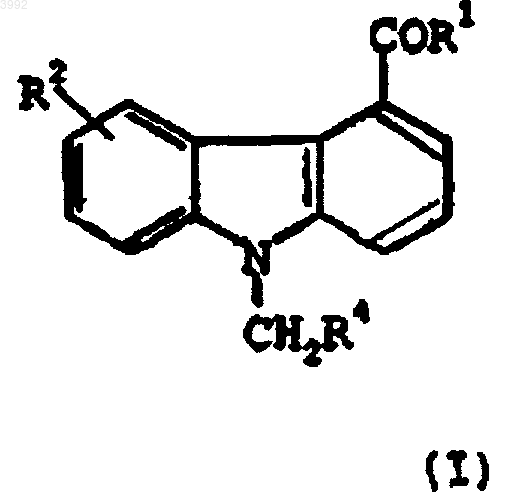
где
R1 представляет собой -NHNH2 или -NH2;
R2 представляет собой -OH или -O(CH2)mR5, где R5 представляет собой фенил и m равно 1-3; и
R4 представляет собой фенил;
или его фармацевтически приемлемой соли, рацемата, сольвата, таутомера, оптического изомера или пролекарственного производного;
для производства лекарственного средства для селективного ингибирования сФЛА2 у млекопитающего, нуждающегося в таком лечении.
Текст
1 Предпосылки изобретения Область техники, к которой относится изобретение Данное изобретение относится к новым замещенным трициклическим соединениям,полезным для ингибирования опосредованного сФЛА 2 высвобождения жирных кислот в случае таких состояний, как септический шок. Информация о предпосылках Строение и физические свойства человеческой непанкреатической секреторной фосфолипазы А 2 (далее называемой "сФЛА 2") досконально описано в двух статьях, а именно, вTizard, Richard; and Pepinsky, R. Blake; The Journal of Biological Chemistry, Vol. 264, No. 10, издание 5 апреля 1989, стр. 5768-5775; содержание которых включено в настоящее описание для сведения. Считается, что сФЛА 2 является ферментом, ограничивающим скорость метаболизма арахидоновой кислоты, который гидролизует фосфолипиды мембран. Таким образом, важно разработать соединения, которые ингибируют опосредуемое сФЛА 2 высвобождение жирных кислот (например, арахидоновой кислоты). Такие соединения могли бы быть ценными при общем лечении состояний, вызываемых и/или поддерживаемых сверхпродуцированием сФЛА 2,таких как септический шок, респираторный дистресс-синдром у взрослых, панкреатит, травматический шок, бронхиальная астма, аллергический ринит, ревматоидный артрит и т.п. Существует потребность в разработке новых соединений и способов лечения вызываемых сФЛА 2 заболеваний. В патентах США 3939177 и 3979391,Alexander, et al. описывают 1,2,3,4-тетрагидрокарбазолы, которые могут использоваться в качестве антибактериальных средств. Сущность изобретения Данное изобретение относится к применению трициклических соединений, изображаемым приведенной ниже общей формулой (III)R2' представляет собой -ОН, -O(CH2)tR5,где R5 представляет собой CN или фенил и t равно 1-5, или -(ОСН 2)- (кислотную группу); или их фармацевтически приемлемых солей, рацематов, сольватов, таутомеров, оптических изомеров или пролекарственных производных для ингибирования опосредуемого сФЛА 2 высвобождения жирных кислот. Предложенное изобретение относится также к применению соединения формулы (I)-O(CH2)mR5, где R5 представляет собой фенил иR4 представляет собой фенил; или его фармацевтически приемлемой соли, рацемата, оптического изомера, сольвата,таутомера или пролекарственного производного для ингибирования опосредуемого сФЛА 2 высвобождения жирных кислот. Следующим аспектом изобретения является способ селективного ингибирования сФЛА 2 у млекопитающего, нуждающегося в таком лечении, включающий введение указанному млекопитающему фармацевтически эффективного количества соединения формулы (III). Еще одним аспектом изобретения является способ селективного ингибирования сФЛА 2 у млекопитающего, нуждающегося в таком лечении, включающий введение указанному млекопитающему фармацевтически эффективного количества соединения формулы (II)R4 представляет фенил; или его фармацевтически приемлемой соли, рацемата, оптического изомера, таутомера,сольвата или пролекарственного производного. Далее объектом изобретения является способ селективного ингибирования сФЛА 2 у млекопитающего, нуждающегося в таком лечении,включающий введение указанному млекопитающему фармацевтически эффективного количества соединения формулы (III) в количестве,достаточном для ингибирования опосредуемого 3 сФЛА 2 высвобождения жирной кислоты и, посредством этого, ингибирования или предотвращения метаболизма арахидоновой кислоты и его вредных продуктов. Следующим аспектом изобретения является применение соединения формулы (III) 4 селективного ингибирования сФЛА 2 у млекопитающего, нуждающегося в таком лечении. Объектом изобретения является также применение соединения формулы (I)R2' представляет собой -ОН, -O(CH2)tR5,где R5 представляет собой CN или фенил и t равно 1-5, или -(ОСН 2)- (кислотную группу); или его фармацевтически приемлемой соли, рацемата, сольвата, таутомера, оптического изомера или пролекарственного производного для селективного ингибирования сФЛА 2 у млекопитающего, нуждающегося в таком лечении. Еще одним аспектом изобретения является применение соединения формулы (I)-O(CH2)mR5, где R5 представляет собой фенил иR4 представляет собой фенил; или его фармацевтически приемлемой соли, рацемата, сольвата, таутомера, оптического изомера или пролекарственного производного для селективного ингибирования cФЛА 2 у млекопитающего, нуждающегося в таком лечении. Далее объектом изобретения является применение соединения формулы (III)R2' представляет собой -ОН, -O(CH2)tR5,где R5 представляет собой CN или фенил и t равно 1-5, или -(ОСH2)- (кислотную группу); или его фармацевтически приемлемой соли, рацемата, сольвата, таутомера, оптического изомера или пролекарственного производного для производства лекарственного средства для-O(CH2)mR5, где R5 представляет собой фенил иR4 представляет собой фенил; или его фармацевтически приемлемой соли, рацемата, сольвата, таутомера, оптического изомера или пролекарственного производного для производства лекарственного средства для селективного ингибирования сФЛА 2 у млекопитающего, нуждающегося в таком лечении. Другие цели, особенности и преимущества настоящего изобретения станут очевидными из последующего описания и прилагаемой формулы изобретения. Подробное описание изобретения Определения В описании использованы обычные термины, используемые для обозначения химических соединений, и они не требуют пояснения. Что касается термина "кислотная группа",то в данном описании он обозначает органическую группу, которая, когда присоединена к трициклическому ядру через подходящие связующие атомы (называемые здесь далее "кислотным линкером"), действует как донор протонов, способный к связыванию водорода. Примерами кислотных групп являются группы-СO2 Н, -5-тетразолил, -SO3H, 5 где n равно 1-8, R89 представляет собой металл или -(C1-С 10)алкил, и R99 представляет собой водород или -(C1-С 10)алкил. Соли описанных выше трициклических соединений составляют дополнительный аспект изобретения. В тех случаях, когда соединения изобретения содержат кислотные функциональные группы, можно получить различные соли,которые более растворимы в воде и физиологически более подходящие, чем исходные соединения. Характерными примерами фармацевтически приемлемых солей являются, но не ограничиваются ими, соли щелочных и щелочноземельных металлов, таких как литий, натрий,калий, кальций, магний, алюминий и т. п. Соли удобно получать из свободной кислоты с помощью обработки кислоты основанием в растворе или путем воздействия на кислоту ионообменной смолы. Включенными в определение фармацевтически приемлемых солей являются относительно нетоксичные соли, полученные при присоединении неорганических или органических оснований и соединений по настоящему изобретению, например, аммониевые, четвертичные аммониевые и соли аминовых катионов, происходящих из азотистых оснований с основностью,достаточной для образования солей с соединениями по данному изобретению (см., например,S.M. Berge, et al., Pharmaceutical Salts", J. Phar.Sci., 66: 1-19 (1977. Соединения по изобретению могут иметь хиральные центры и существовать в оптически активных формах. Данное изобретение охватывает R- и S-изомеры и рацемические смеси. Отдельный конкретный стереоизомер можно получить известными способами с использованием стереоспецифических реакций с исходными веществами, содержащими асимметричные центры, уже расщепленными, или, альтернативно, с помощью последующего расщепления смесей стереоизомеров с использованием известных способов. Пролекарствами являются производные соединений по изобретению, которые содержат химически или метаболически отщепляемые группы, и становятся при сольволизе или в физиологических условиях соединениями по изобретению, фармацевтически активными in vivo. Производные соединений по данному изобретению обладают активностью как в своей кислотной форме, так и в форме производных оснований, но форма производных кислот часто имеет преимущества по растворимости, совместимости с тканями или отсроченному высвобождению в организме млекопитающего (см. Bundgard, H., Design of Prodrugs, pp. 7-9, 21-24, Elsevier, Amsterdam 1985). Пролекарства включают производные кислот, такие как сложные эфиры, полученные взаимодействием исходного кислотного соединения с подходящим спиртом,или амиды, полученные путем взаимодействия 6 исходной кислоты с подходящим амином. Предпочтительными пролекарствами являются алифатические сложные эфиры (например, метиловый, этиловый, пропиловый, изопропиловый,бутиловый,втор-бутиловый,третбутиловый эфир) или ароматические эфиры,образованные кислотными группами, "подвешенными" на соединениях данного изобретения. В некоторых случаях желательно получить пролекарства типа двойных сложных эфиров,таких как (ацилокси)алкиловые эфиры или алкоксикарбонил)окси)алкиловые эфиры. Предпочтительные эфиры включают морфолиноэтилокси и диэтиламинокарбонилметокси. Предпочтительными соединениями по изобретению являются соединения, выбранные из группы, включающей: 4-[(9-бензил-4-карбамоил-1,2,3,4-тетрагидрокарбазол-6-ил)окси]масляную кислоту; 3-[(9-бензил-4-карбамоил-1,2,3,4-тетрагидрокарбазол-6-ил)окси]пропилфосфоновую кислоту; 2-[(9-бензил-4-карбамоил-1,2,3,4-тетрагидрокарбазол-6-ил)окси]метилбензойную кислоту; 3-[(9-бензил-4-карбамоил-7-н-октил-1,2,3,4-тетрагидрокарбазол-6-ил)окси]пропилфосфоновую кислоту; 4-[(9-бензил-4-карбамоил-7-этил-1,2,3,4 тетрагидрокарбазол-6-ил)окси]масляную кислоту; 3-[(9-бензил-4-карбамоил-7-этил-1,2,3,4 тетрагидрокарбазол-6-ил)окси]пропилфосфоновую кислоту; 3-[(9-бензил-4-карбамоил-7-этил-1,2,3,4 тетрагидрокарбазол-6-ил)окси]пропилфосфоновую кислоту;[9-бензил-4-карбамоилкарбазол-5-ил]оксиуксусную кислоту или их фармацевтические соли, рацематы,сольваты, таутомеры, оптические изомеры или пролекарственные производные. Методы синтеза Соединения получают в соответствии с ниже приведенными схемами I(а) и (с). Схема I(а)R2(a) представляет -СН 3 или -ОН. Соответствующим образом замещенный альдегид обрабатывают реагентом Виттига и 8 получают соответствующим образом замещенный нитробензол (1), который можно восстановить до анилина (2) путем обработки восстановителем, таким как водород, в присутствииPd/C, предпочтительно, при комнатной температуре. Соединение (2) N-алкилируют при температурах примерно от 0 до 20 С с использованием алкилирующего агента, такого как соответствующим образом замещенный альдегид, и цианборгидрида натрия с образованием (3). С другой стороны, на первой стадии алкилирования можно использовать соответствующим образом замещенный бензилгалогенид. Получающееся в результате промежуточное соединение затем N-алкилируют посредством обработки 2 карбэтокси-6-бромциклогексаноном, предпочтительно при температурах порядка 80 С, и получают (4). Продукт (4) циклизуют до тетрагидрокарбазола (5) посредством кипячения с обратным холодильником с ZnCl2 в бензоле в течение примерно 1-2 суток предпочтительно при 80 С(ссылка 1). Соединение (5) превращают в гидразид (6) посредством обработки гидразином при температурах порядка 100 С, или в амид (7) посредством взаимодействия с метилхлоралюминийамидом в бензоле (ссылка 2). С другой стороны, (7) можно получить посредством обработки (6) активным катализатором - никелем Ренея. Легко представить, что когда R3(a) представляет алкил, при этой процедуре будет также достигаться конверсия в амид. Соединения (6) и (7) можно деалкилировать, предпочтительно, при температуре от 0 С до комнатной с помощью деалкилирующего агента, такого как трибромид бора или тиоэтоксид натрия, и получить соединение (7), где R2(a) представляет -ОН, которое затем можно далее превратить в соединение (9) посредством реалкилирования с основанием, таким как гидрид натрия, и алкилирующим агентом, таким как Вr(СН 2)mR5, где R5 представляет карбоксилат,или диэфир фосфокислоты или нитрил, как определено выше. Конверсию R2 до карбоновой кислоты можно осуществить посредством обработки водным основанием. Когда R2 представляет нитрил, конверсии в тетразол можно достичь путем взаимодействия с азидом трибутилолова. Когда R2 представляет диэфир фосфоновой кислоты, превращения в кислоту можно достичь путем взаимодействия с деалкилирующим агентом, таким как триметилсилилбромид. Моноэфир можно получить при взаимодействии диэфира с водным основанием. Когда R2 и R3 оба представляют метокси,можно осуществить селективное деметилирова 9 ние посредством обработки этантиолатом натрия в диметилформамиде при 100 С. Ссылка 1. Julia, M.; Lenzi, J. PrepatationSoc. Chim. France, 1962, 2262-2263. Ссылка 2. Levin, J.I., Turos, E.; Weinreb,S.M. An alternative procedure for the aluminiummediated conversion of esters to amids. Syn. Соmm., 1982, 12, 989-993. Альтернативный синтез промежуточного соединения (5) показан ниже на cхеме I(b). Схема I(b)PG представляет защитную группу,R3(a) имеет значения, определенные выше для cхемы I. Анилин (2) N-алкилируют 2-карбэтокси-6 бромциклогексаноном в диметилформамиде в присутствии бикарбоната натрия в течение 8-24 ч при 50 С. Предпочтительными защитными группами являются метильная, карбонатная и силильная группы, такая как трет-бутилдиметилсилил. Продукт реакции (4') циклизуют до(5') с использованием ZnCl2 в бензоле при условиях, описанных выше для cхемы I(а). NАлкилирование (5') с образованием (5) осуществляют путем обработки гидридом натрия и подходящим алкилгалогенидом в диметилформамиде при комнатной температуре в течение 4-8 ч. Схема I(с)X представляет галоген,R3(a) имеет значения, определенные выше для cхемы I(а). Цинковую соль а-метоксииндола (40) алкилируют альфа-бром-валеролактоном (41) и получают (42), в которых раскрывают кольцо с(47), которые этерифицируют и затем циклизуют до тетрагидрокарбазолов (48) с помощью кислот Льюиса (например, хлорида алюминия) или инициаторов радикалов (например, гидрида трибутилолова). Альтернативно, раскрыть кольцо в (42) можно с помощью гидразина и получить гидразиды (43), которые расщепляют до амидов (44) с помощью катализатора никеля Ренея и циклизуют с помощью кислот до тетрагидрокарбазолов (45).N-Алкилирование осуществляют путем обработки гидридом натрия и соответствующим алкилгалогенидомXCH2R4 в диметилформамиде, как описано выше. Тетрагидропроизводные можно дегидрировать с помощью палладия-на-угле в кипящем карбитоле, как описано ниже, и получить нужные карбазолы (см. cхему III(а. Рацематы соединений формулы I можно превратить в их соответствующие энантиомеры так, как описано ниже на cхеме II. Схема IIR3(a) имеет значения, определенные выше для cхемы I. Описанный выше на cхеме I карбазол (5) гидролизуют до карбоновой кислоты (10) путем обработки водным основанием предпочтительно при температуре от комнатной до примерно 100 С. Промежуточное соединение затем превращают в хлорангидрид с использованием,например, оксалилхлорида и диметилформамида, и затем проводят дальнейшее взаимодействие с литиевой солью (S)- или (R)-4-алкил-2 оксазолидина при температуре примерно -75 С и получают (11 а) и (11b), которые можно разделить посредством хроматографии. Диастереомеры превращают в соответствующие бензиловые эфиры (12) посредством кратковременной обработки при температурах примерно от 0 С до комнатной температуры бензилоксидом лития (ссылка 3). Сложные эфиры (12) затем превращают в (7) предпочтительно посредством обработки метилхлоралюминийамидом (см. выше ссылку 2) или, с другой стороны, посредством гидрирования с исполь 11 зованием, например, водорода и палладия-наугле, как описано выше, и получают кислоту, а затем осуществляют реакцию с ацилазидом,таким как дифенилфосфорилазид, с последующей обработкой аммиаком. С использованием описанной выше на cхеме I процедуры можно получить соединение (9 а) или 9(b). Ссылка 3. Evans, D.A.; Ennis, M.D.; Mathre,D.J. Asymmetric alkylation reactions of chiral imide enolates. A practical approach to the enantioselective synthesis of alpha-substituted carboxylicacid derivatives. J. Am. Chem. Soc., 1982, 104,1737-1738. Соединения формулы I, где Z представляет фенил, можно получить так, как это следует из приведенных ниже cхем III(а)-(d). Схема III(а) 1,2,3,4-тетрагидрокарбазол-4-карбоксамид или 4-карбоксгидразид (13) дегидрируют посредством кипячения с обратным холодильником в растворителе, таком как карбитол, в присутствии Pd/C с получением карбазол-4 карбоксамида. Промежуточные соединения и конечные продукты можно выделить и очистить обычными методами, например, путем испарения растворителей, с последующим промыванием остатка водой и затем очисткой обычными методами, такими как хроматография или перекристаллизация. Специалисты в этой области техники быстро оценят то, что исходные вещества или доступны коммерчески, или их можно легко получить известными методами из коммерчески доступных исходных веществ. Все другие реагенты, используемые для получения соединений в данном изобретении, являются коммерчески доступными. Схема III(b)R3(a) имеет значения, определенные выше для cхемы I(а); R представляет -(CH2)mR5; и X представляет галоген. Дион (15) и производное бензойной кислоты (16) конденсируют по общей методике Ames и Ribiero (ссылка 4) в инертном растворителе,предпочтительно этаноле, в присутствии основания, предпочтительно этоксида натрия, и соли меди, предпочтительно ацетате меди(II), и получают продукт реакции конденсации (17). Можно использовать другие растворители, такие как метанол, пропанол, изопропанол, третбутанол и подобные. Можно также использовать другие основания, такие как калиевые, натриевые и литиевые соли соответствующих спиртовых растворителей. Восстановлением нитрогруппы восстановителем, таким как водород, в присутствии палладия-на-угле, в инертном растворителе, таком как этанол, при 1-60 атмосферах, при температуре 0-60 С, получают продукт с замкнутым циклом (18) (ссылка 1). Кислоту (18) превращают в сложный метиловый эфир (19) посредством обработки метанолом в присутствии кислоты, такой как соляная кислота. С другой стороны, кислоту (18) можно превратить в сложный эфир (19) посредством обработки метилиодидом в присутствии основания, такого как карбонат калия или карбонат натрия, в инертном растворителе, таком как диметилформамид или диметилсульфоксид. Соединение (19) N-алкилируют соответствующим образом замещенным галогенидом в присутствии основания, такого как гидрид натрия или карбонат калия, в инертном растворителе, таком как диметилформамид или диметилсульфоксид, и получают кетон (20). Кетон (20) дегидрируют путем обработки палладием-на-угле в инертном растворителе,таком как карбитол или цимол, и получают фенольное производное (21). Сложный эфир (21) превращают в соответствующий амид (22) в стандартных условиях с помощью аммиака или аммониевой соли, такой как ацетат аммония, в инертном растворителе,таком как вода или спирт, или с помощью МеСlАlNН 2 в инертном растворителе, таком как толуол, при температуре от 0 до 110 С. Алкилирование по фенольному кислороду соединения (22) соответствующим галоидоэфиром, таким как метилбромацетат, в присутствии основания, такого как карбонат калия или карбонат натрия, в инертном растворителе, таком как диметилформамид или диметилсульфоксид,позволяет получить эфирамид (23). Для получения соответствующих сложных эфиров можно использовать другие галоидоэфиры, такие как этилбромацетат, пропилбромацетат, бутилбромацетат и подобные соединения. Омыление соединения (23) гидроксидом натрия в инертном растворителе, таком как метанол-вода, позволяет получить карбазол (24). 13 Промежуточные и конечные продукты можно выделить и очистить обычными методами, такими как хроматография или перекристаллизация. Полученные изомеры и промежуточные соединения можно разделить стандартными способами, такими как перекристаллизация или хроматография. Ссылка 4. D.E. Ames and О. Ribiero, J.X представляет галоген. Производные бензойной кислоты (16) (X = Сl, Вr или I), описанные выше, восстанавливают в соответствующие анилины (25) восстановителем, таким как SnCl2 в хлористоводородной кислоте, в инертном растворителе, таком как этанол. Анилин (25) и дион (15) конденсируют в условиях дегидратирования, например, с использованием общей методики Irida et al. (ссылка 5), с инертным растворителем, таким как толуол, или без него, с кислотой в каталитическом количестве, такой как п-толуолсульфоновая кислота, или без нее, и получают продукт реакции сочетания (26). Соединение (26) N-алкилируют с соответствующим образом замещенным алкил- или арилгалогенидом, в присутствии основания,такого как гидрид натрия, в инертном растворителе, таком как толуол, диметилформамид или диметилсульфоксид, и получают кетон (27) . Кетон (27) циклизуют по общей методикеIida et al. (ссылка 5) или Kasahara, et al. (ссылка 6), в присутствии палладиевого катализатора,такого как Pd(OAc)2, триарилфосфина, такого как три-о-толилфосфин, основания, такого как бикарбонат натрия или триэтиламин, в инертном растворителе, таком как ацетонитрил или триэтиламин, и получают соединение (20). Соединение (20) можно обработать так, как показано выше на cхеме III(b), с образованием в качестве продукта реакции карбазола (24). Альтернативно, промежуточное соединение (26) можно циклизовать до соединения (19) с ис 003992 14 пользованием условий с палладиевым катализатором, описанных выше для процедур превращения соединения (27) в (20). Альтернативно, промежуточное соединение (26) можно циклизовать до соединения (19) с применением общего метода Osuka, et al.(ссылка 7), с использованием основания, такого как гидрид натрия, и соли меди, такой как иодид меди (I), в инертном растворителе, таком как триамид гексаметилфосфорной кислоты. Соединение (19) можно превратить в карбазол (24) как продукт реакции, как описано выше для cхемы III(b). Промежуточные и конечные продукты реакций можно выделить и очистить обычными методами, такими как хроматография или перекристаллизация. Полученные изомеры и промежуточные соединения можно разделить стандартными способами, такими как перекристаллизация или хроматография. Ссылки: 5) Н. Iida et al., J. Org. Chem., 45, 2938R3(a) имеет значения, определенные выше для cхемы I(а); иX представляет галоген. Производные бензойной кислоты (16) (X = Сl, Вr или I) и производные борной кислоты (27)(или доступные коммерчески или легко получаемые известными методами из коммерчески доступных исходных веществ) конденсируют по общей методике Miyaura, et al. (ссылка 8 а) илиTrecourt, et al., (ссылка 8b) в присутствии палладиевого катализатора, такого как Pd(Ph3P)4, основания, такого как бикарбонат натрия, в инертном растворителе, таком как толуол или этанол, и получают соединение (28).(29) посредством обработки триалкилфосфитом или фосфином, таким как триэтилфосфит или трифенилфосфин, по общей методике Cadoganet al. (ссылка 6). Соединение (29) N-алкилируют соответствующим образом замещенным алкил- или арилгалогенидом в присутствии основания, такого как гидрид натрия или карбонат калия, в инертном растворителе, таком как толуол, дометилформамид или диметилсульфоксид, и получают карбазол (30). Соединение (30) превращают в соответствующий амид (31) в стандартных условиях с помощью аммиака или аммониевой соли, такой как ацетат аммония, в инертном растворителе,таком как вода или спирт, или с помощью метилхлоралюминийамида в инертном растворителе, таком как толуол, при температуре от 0 до 110 С. Соединение (31) можно деалкилировать с применением деалкилирующего агента, такого как трибромид бора или тиоэтоксид натрия, и получить соединение (22). Соединение (22) можно превратить в продукт реакции карбазол(24), как показано выше на cхеме III(b). Схема III(e) Альтернативно, восстановление нитрогруппы соединения (28) восстановителем, таким как водород, в присутствии палладия-на-угле в инертном растворителе, таком как этанол, при давлении 1-60 атмосфер и температуре 0-60 С,позволяет получить соответствующий анилинal. (ссылка 8b) . Анилин обрабатывают серной кислотой и нитритом натрия, затем азидом натрия с образованием промежуточного азида,который циклизуют до карбазола (29) посредством нагревания в инертном растворителе, таком как толуол. Соединение (29) превращают в карбазол (24) так, как показано на cхеме III(b). Ссылки: 8) а. N. Miyaura, et al., Synth. Commun., 11,513 (1981);cхемы I (а). 4-Метоксииндол (40) ацилируют метилоксалилхлоридом и получают индол-3-глиоксильное производное (60). Альтернативно, обработку оксалилхлоридом и затем аммиаком можно использовать для получения амида, который можно использовать на последующих стадиях так же, как и эфир. Соединение (61) конденсируют с нитрометаном в присутствии основания и получают нитроолефин (61), который восстанавливают до амина (62) посредством, например, обработки водородом и палладием-на-угле. Амин (62) при реакции с соответствующим образом замещенным альдегидом и кислотой дает карболины (63). При взаимодействии (60) с метоксиметиленовым реагентом Виттига получают енольный эфир (64), который гидролизуют до альдегида (65) и восстанавливают гидридом до спирта (66). Взаимодействием этого спирта с альдегидом и кислотой получают пираноиндол (69). Превращением гидроксильной функциональной группы (66) в галогеновую или сульфатную функциональную группу путем обработки трифенилфосфином и СН 4 Х (где X представляет галоген) или путем обработки триэтиламином и метансульфонилхлоридом, соответственно, получают соединения формулы (67),где X представляет галоген, или получают сульфат (67), после чего замещением натриевой солью тиолуксусной кислоты получают (70),который, в свою очередь, гидролизуют с основанием до тиола (71), который вводят во взаимодействие с соответствующим образом заме 17 щенным альдегидом и кислотой и получают тиопираноиндолы (72). Промежуточное соединение (67) можно также ввести во взаимодействие с азидом натрия и получить азидопроизводные (68), которые восстанавливают водородом в присутствии катализатора и получают амины (63), которые превращают в карболины (64), как описано выше. Промежуточные соединения (63), (69) и(72) можно N-алкилировать, как описано выше на cхеме I, с использованием гидрида натрия и соответствующим образом замещенного алкилгалогенида XCH2R4. Схема IV(b)R имеет значения, определенные для cхемы III(b). Защиту кислорода осуществляют посредством обработки (77) трет-бутилдиметилсилилхлоридом и имидазолом в апротонном полярном растворителе, таком как тетрагидрофуран или метиленхлорид с образованием (78). Алкилирование индола (78) в положение 3 осуществляют путем обработки н-бутиллитием,а затем хлоридом цинка при температурах, начиная примерно с 10 С, с нагревом до комнатной температуры, с последующим взаимодействием с подходящим галоидалкилэфиром, таким как этил- или бромацетат. Реакцию проводят предпочтительно при комнатной температуре в подходящем апротонном полярном растворителе, таком как тетрагидрофуран. Затем можно осуществить алкилирование по азоту индола посредством взаимодействия(79) с подходящим алкилгалогенидом в присутствии бис(триметилсилил)амида калия и получить (80). Соединение с эфирной функциональной группой (80) превращают в триметилсилилке 003992(триметилсилил)амидом калия и триметилсилилхлоридом. Обработка кетенацеталя (81) бис(хлорметил)сульфидом и бромидом цинка в метиленхлориде позволяет получить циклизованный продукт реакции (82). Конверсию в амид (83) можно осуществить посредством реакции Вейнреба с метилхлоралюминийамидом. После удаления защищающей кислород группы фторидом, таким как TBAF, и сопутствующей реакции образующегося в результате аниона,например, с этилбромацетатом получают сложный эфир (84). Отщепление защитной группы эфира дает нужную кислоту (85). Схема IV(d)cхемы I(а), и R имеет значения, определенные для cхемы III(b). Обработкой кетенацеталя (81) простым бис(хлорметиловым) эфиром и бромидом цинка в метиленхлориде получают продукт реакции с замкнутым циклом (90). Конверсию в амид (91) можно осуществить посредством реакции Вейнреба с метилхлоралюминийамидом. Удаление группы, защищающей кислород, с помощью фторида, такого как TBAF, и сопутствующая реакция получающегося в результате аниона с этилбромацетатом дают сложный эфир (92). Отщепление защитной группы от эфирной группы дает нужную кислоту (93). Соединения, в которых Z представляет ароматическое или гетероциклическое кольцо,содержащее азот, можно получить так, как показано ниже на cхемах V(a)-(e). Схема V(a) 19 Защищенный галоиданилин (180) конденсируют с N-бензил-3-пиперидоном и получают енамин (181). Раскрытие кольца осуществляют путем обработки (181) ацетатом палладия(II) и полученный в результате продукт превращают в(182) посредством обработки бромистым цианом. Алкилирование (182) осуществляют путем обработки соответствующим алкилбромидом с использованием в качестве основания гидрида натрия. Гидролиз этого N-алкилированного продукта реакции основным пероксидом водорода при стандартных условиях обеспечивает(183). Деметилирование (183) осуществляют посредством обработки трибромидом бора в метиленхлориде. Полученный в результате фенол (184) превращают, посредством Оалкилирования метилбромацетатом в стандартном порядке в присутствии основания и гидролиза с пероксидом водорода, в промежуточную соль, которую затем протонируют в водной кислоте и получают нужный -карболин (185). Схема V(b)cхемы I(а). Кетенацеталь (81), полученный так, как показано на cхеме IV(c), вводят во взаимодействие с бензил-бис(метоксиметил)амином в присутствии хлорида цинка и получают тетрагидробета-карболин (100). Обработка (100) гидроксидом лития, нейтрализация хлористо-водородной кислотой и последующая обработка этилалюминийдихлоридом и аммиаком дают десилилированный амид (101), в котором R20 представляет водород,и который можно алкилировать, например,этилбромацетатом и получить сложный эфир(102) . С другой стороны, при обработке (100) соответствующим реагентом Вейнреба получают 20 амид (101) (R20 представляет трет-бутилдиметилсилил), который десилилируют с помощью тетра-н-бутиламмонийфторида и алкилируют,например, этилбромацетатом, и получают сложный эфир (102). Гидролиз с участием гидроксида лития дает кислоту (103), которую можно гидрировать на соответствующем катализаторе и получить тетрагидро-бета-карболин(78) последовательно обрабатывают одним эквивалентом н-бутиллития, газообразным диоксидом углерода, одним эквивалентом третбутиллития и 1-диметиламино-2-нитроэтаном и получают (110). Нитроалкен (110) восстанавливают литийалюминийгидридом до амина (111),который циклизуют с метилглиоксилатом(ссылка 9) в кипящем этаноле и получают тетрагидрокарболин (112). Алкилирование по обоим атомам азота (112) приводит к промежуточному соединению (113), которое обрабатывают соответствующим реагентом Вейнреба и получают амид (114). Десилилирование с помощью фторида и алкилирование, например, этилиодацетатом, дает сложный эфир (115), который можно гидрировать на подходящем катализаторе и гидролизовать с основанием, после чего получают кислоту (116). Ароматизацию (116) до карболина (117) осуществляют посредством кипячения с обратным холодильником в карбитоле в присутствии палладия-на-угле.cхемы III(b). 1,3-Циклогексадион (15) алкилируют 1,3 дихлорацетоном и получают хлорид (200), который вводят во взаимодействие с цианидом натрия и получают нитрил (201). Циклизация с помощью, например, бензиламина дает пиррол(202), который затем ароматизируют посредством кипячения с обратным холодильником в карбитоле и получают индол (203). Защита фенола с помощью трет-бутилдиметилсилилхлорида с последующим восстановлением ацетонитрильной боковой цепи с использованием литийалюминийгидрида или водорода с оксидом платины дает амин (204). Циклизация с помощью метилглиоксилата в кипящем этаноле дает тетрагидрокарболин (205), который обрабатывают ди-трет-бутилдикарбонатом и триэтиламином, а затем подходящим реагентом Вейнреба, дает амид (206). Десилилирование с участием фторида, алкилирование этилиодацетатом и кислотный гидролиз дают кислоту (207), которую можно ароматизировать посредством кипячения с обратным холодильником в карбитоле или в другом подходящем высококипящем растворителе и получить (208). Коммерчески доступную кислоту (121) восстанавливают литийалюминийгидридом,окисляют пиридинийхлорхромиатом и силилируют трет-бутилдиметилсилилхлоридом, получая (122). Обработка азидом натрия дает азид (123),который вводят во взаимодействие с нитрометаном и гидроксидом калия в этаноле с последующей обработкой уксусным ангидридом и пиридином и получают нитроолефин (124). Нагревание в ксилоле вызывает циклизацию с образованием индола (125). Алкилирование, например, бензилиодидом и гидридом натрия, дает (126), который гидрируют в присутствии 23 палладия-на-угле и получают амин (127). Ацилирование хлорангидридом коммерчески доступного моноэтилового эфира щавелевоуксусной кислоты дает (128), который циклизуют при нагревании до лактама (129). Посредством обработки NaBH2S3 можно осуществить селективное восстановление лактамкарбонила и получить амин (130). Посредством защиты амина (130) ди-третбутилдикарбонатом и пиридином получают(131), который превращают, с помощью соответствующего реагента Вейнреба, в амид (132). Десилилирование с помощью фторида, алкилирование, например, этилиодацетатом в присутствии карбоната калия, гидролиз в присутствии основания и кислотный гидролиз приводят к образованию тетрагидро-альфакарболина (133). С другой стороны, амин (130) можно ароматизировать посредством кипячения с обратным холодильником в карбитоле или другом подходящем высококипящем растворителе и получить альфа-карболин (141), который превращают, с помощью соответствующего реагента Вейнреба, в амид (142). Десилилирование с помощью фторида, алкилирование этилиодацетатом в присутствии карбоната калия, гидролиз в присутствии основания, как описано выше,приводят к образованию альфа-карболина (143). Обратные индолы, т.е., соединения, в которых В представляет углерод, a D представляет азот, можно получить так, как показано ниже на Арилгидразины (209) конденсируют с соответствующими пропиональдегидами с образованием гидразонов, которые циклизуют в индолы (210) посредством обработки трихлоридом фосфора при комнатной температуре (ссылка 1). Индолы N-алкилируют при реакции с основанием, таким как гидрид натрия, и сложным алифатическим бромированным эфиром, получая индолы (211), которые циклизуют до тетрагидрокарбазолов (212) с помощью кислот Льюиса(например, хлорида алюминия) или с помощью инициаторов радикалов (например, гидрида трибутилолова). Соединения (212) можно превратить в карбазолы посредством процедур 24 Соединения формулы III, где А представляет пиридил, можно получить так, как показано ниже на cхеме VIII. Схема VIII(а)R имеет значения, определенные для cхемы III(b), и X представляет галоген. Коммерчески доступный 4-карбометоксииндол (150) при взаимодействии, например, с бензилиодидом в присутствии основания, такого как гидрид натрия, дает индол (151). Ацилирование хлорангидридом N-фталоилглицина,катализированное кислотой Льюиса, такой как тетрахлорид олова, дает промежуточное соединение (152), от которого посредством обработки гидразином в кипящем этаноле можно отщепить защитную группу и получить амин (153). Циклизация (153) с формальдегидом по ПиткеСпенглеру дает (154), который затем ароматизируют посредством кипячения с обратным холодильником в карбитоле или в другом подходящем высококипящем растворителе. Получающийся в результате бета-карболин (155) обрабатывают соответствующим реагентом Вейнреба и получают амид (156), который алкилируют, например, этилбромацетатом, получая(157), омылением которого получают бетакарболин (158).(160) обрабатывают 3 эквивалентами третбутиллития, а затем диоксидом углерода, 1 эквивалентом н-бутиллития, 1-диметиламино-2 нитроэтаном и кислотой, получая карбоновую кислоту (161), которую можно этерифицировать и получить (162). Алкилирование в положении 1 с последующим гидрированием приводит к образованию аминоэтилиндола (164). Циклизация фосгеном до (165) с последующей ароматизацией дает карболин (166). Обработка (166) соответствующим реагентом Вейнреба дает амид(167), который можно алкилировать, например,этилбромацетатом, и омылить гидроксидом натрия с получением карболина (168). Схема VIII(с)cхемы III(b). 1,3-Дионы (170) или доступны коммерчески, или их легко получить известными методами из коммерчески доступных исходных веществ. Получение производных анилина (25)(Х=Сl, Вr или I) показано выше на cхеме III (с). Аминогруппу (170) защищают подходящей защитной группой, такой как карбоэтоксильная,бензильная, CBZ- или ВОС-защитная группа и подобными группами. Дион (170) и анилиновое производное (25) конденсируют по общей методике Chen et al.(ссылка 10) или Yang et al. (ссылка 11), в инертном растворителе, таком как метанол, толуол или метиленхлорид, или без него, с кислотой,такой как п-толуолсульфоновая кислота или трифторуксусная кислота, или без нее, с Nхлорсукцинимидом или без него, и диметилсульфидом, получая продукт конденсации (172). Соединение (171) циклизуют в присутствии основания с солью меди (I) в инертном растворителе по общей методике Yang et al (ссылка 8). Производное (171) обрабатывают основанием, таким как гидрид натрия, в инертном растворителе, таком как НМРА, при температуре от 0 до 25 С. Добавляют соль меди (I), такую как иодид меди(I), и полученную смесь перемешивают при температуре от 25 до 150 С в течение 1-48 ч, получая соединение (173). Соединение (171) можно также циклизовать по методике Chen et al. (ссылка 10). Производное (171) обрабатывают основанием, таким как бикарбонат натрия, и палладиевым катализатором, таким как Pd(Ph3P)4, в инертном растворителе, таком как НМРА, при температуре от 25 до 150 С, получая соединение (172). Соединение (172) N-алкилируют соответствующим образом замещенным бензилгалогенидом в присутствии основания, такого как гидрид натрия или карбонат калия, в инертном растворителе, таком как диметилформамид или диметилсульфоксид, получая кетон (173). Удаляют защищающую азот группу из (172) в стандартных условиях и получающийся в результате кетон дегидрируют с помощью обработки палладием-на-угле в инертном растворителе, таком как карбитол или цимол, получая фенольное производное (174). Сложный эфир (174) превращают в соответствующий амид (175) в стандартных условиях при действии аммиака или аммониевой соли,такой как ацетат аммония, в инертном растворителе, таком как вода или спирт, или при действии MeClAlNH2 в инертном растворителе,таком как толуол, при температуре от 0 до 110 С. Алкилирование по фенольному кислороду соединения (38) соответствующим галоидэфиром, таким как метилбромацетат, в присутствии основания, такого как карбонат калия или натрия, в инертном растворителе, таком как диме 27 тилформамид или диметилсульфоксид, позволяет получить эфирамид (176). Для получения соответствующих сложных эфиров можно использовать также другие галоидэфиры, такие как этилбромацетат, пропилбромацетат, бутилбромацетат и подобные. С помощью омыления соединения (176) гидроксидом натрия в инертном растворителе,таком как метанол с водой, получают (177). Промежуточные и конечные продукты реакций можно выделить и очистить обычными способами, такими как хроматография или перекристаллизация. Полученные изомеры и промежуточные соединения можно разделить стандартными способами, такими как перекристаллизация или хроматография. Ссылки: 10) L.-C. Chen et al., Synthesis, 385 (1995); 11) S.-C. Yang et al., Heterocycles, 32, 2399(1991). В дальнейшем получение соединений данного изобретения поясняется примерами. Данные примеры являются только иллюстративными и никоим образом не предназначены для ограничения данного изобретения. Пример 1. Получение 9-бензил-6-метокси 1,2,3,4-тетрагидрокарбазол-4-карбоксамида. А. Получение гидразида 9-бензил-6 метокси-1,2,3,4-тетрагидрокарбазол-4-карбоновой кислоты. Соединение (5) (R2=6-MeO, R3(a)=H,4and Mumaw, C.E., J. Am. Chem. Soc., 1950, 72,2127-2129) растворяют в диметилформамиде и перемешивают в присутствии избытка бикарбоната натрия в течение пяти суток, получая этил 3-N-бензил-4-метоксианилино-2-циклогексанонкарбоксилат (4), который обрабатывают хлоридом цинка в кипящем бензоле, получая (5)(R2=6-MeO, R3=H). Раствор 0,5 г соединения (5) и 2-3 мл гидразингидрата в 30 мл этанола кипятят с обратным холодильником в течение 66 ч, охлаждают и фильтруют, получая указанное в подзаголовке соединение (405 мг, 80%), т. пл. 185-187 С. Элементный анализ для C21H23N3O2: вычислено: С 72,18; Н 6,63; N 12,02; найдено : С 71,90; Н б,68; N 11,87. В. Получение 9-бензил-6-метокси-1,2,3,4 тетрагидрокарбазол-4-карбоксамида. Смесь 0,3 г соединения, полученного выше в части А, 2-3 г катализатора - никеля Ренея и 100 мл этанола кипятят с обратным холодильником в течение 2,5 ч, охлаждают и раствор декантируют и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя с градиентом метиленхлорид/1-3% метанол, и получают указанное в заголовке соединение(220 мг, 80%), т. пл. 154-156 С/диэтиловый эфир. Элементный анализ для C21H22N2O2: вычислено: С 75,42; Н 6,63;N 8,38; найдено: С 75,58; Н 6,62; N 8,24. Пример 2. Получение 4-[(9-бензил-4 карбамоил-1,2,3,4-тетрагидрокарбазол-6-ил) окси]масляной кислоты. Раствор 280 мг соединения (7) (R2=6-MeO,3R =H, R4=фeнил) в 25 мл дихлорметана обрабатывают 3 мл 1 М раствора трибромида бора в дихлорметане в течение 2,75 ч, промывают водой, насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме, получая 290 мг сырого соединения (7) (R2=6-ОН,R3=H), которое растворяют в 10 мл тетрагидрофурана и 50 мл диметилсульфоксида и обрабатывают 40 мг гидрида натрия (60% в минеральном масле) в течение 10 мин, а затем 0,15 мл этил 4-бромбутирата в течение 1,75 ч. Раствор разбавляют этилацетатом и водой и органическую фазу промывают водой, насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя с градиентом метиленхлорид/0-2% метанол, и получают 340 мг соединения (9) (R2=O(CH2)4CO2Et, R3=H), которое растворяют в 25 мл этанола, содержащих 23 мл 2N раствора гидроксида натрия, и перемешивают в течение 4,25 ч, подкисляют соляной кислотой и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и концентрируют в вакууме, получая указанное в заголовке соединение (300 мг, 90%), т. пл. 199200 С. Элементный анализ для C24H26N2O4: вычислено: С 70,92; Н 6,45; N 6,89; найдено: С 70,63; Н 6,49; N 6,87. Пример 3. Получение дигидрата 3-[(9 бензил-4-карбамоил-1,2,3,4-тетрагидрокарбазол 6-ил)окси]пропилфосфоновой кислоты. А. Получение диметил-3-[(9-бензил-4 карбамоил-1,2,3,4-тетрагидрокарбазол-6-ил) окси]пропилфосфоновой кислоты. Раствор 840 мг соединения (7) (R2(a)=OH,3R =H) (полученного так, как в примере 2) в 20 мл тетрагидрофурана и 70 мл диметилсульфоксида обрабатывают 120 мг гидрида натрия (60% в минеральном масле) в течение 10 мин, а затем 700 мг диметил 3-бромпропилфосфоната в течение 5 ч. Раствор разбавляют водой и этилацетатом. Органическую фазу промывают водой, насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме, получая указанное в подзаголовке соединение (940 мг, 75%,твердое аморфное вещество). Элементный анализ для C25H31N2O5P: вычислено: С 63,82; Н 6,64; N 5,95; найдено: С 63,94; Н 6,58; N 6,15. В. Раствор 450 мг соединения из части А и 1,5 мл триметилсилилбромида в 25 мл дихлор 29 метана перемешивают в течение 16 ч и затем упаривают в вакууме. Остаток растворяют в 25 мл метанола, перемешивают в течение 2,5 ч,упаривают в вакууме и кристаллизуют из смеси этилацетата и метанола, получая указанное в заголовке соединение (325 мг, 78%), т. пл. 200201 С. Элементный анализ для C21H23N3O2P2H2O: вычислено: С 57,73; Н 6,53; N 5,86; найдено: С 57,51; Н 5,94; N 6,00. Пример 4. Получение гидрата 2-[(9-бензил-4-карбамоил-1,2,3,4-тетрагидрокарбазол-6 ил)окси]метилбензойной кислоты.R =H, R4=фенил) (полученного так, как в примере 2) в 20 мл тетрагидрофурана и 70 мл диметилсульфоксида обрабатывают 100 мг гидрида натрия (60% в минеральном масле) в течение 10 мин, а затем 575 мг метил 2-бромметилбензоата в течение 2,5 ч. Раствор разбавляют водой и этилацетатом. Органическую фазу промывают водой, насыщенным раствором соли и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя с градиентом метиленхлорид/0-2% метанол, и получают указанное в подзаголовке соединение (840 мг, 90%), т. пл. 119120C/Et2O. Элементный анализ для C29H28N2O4: вычислено: С 74,34; Н 6,02; N 5,98; найдено: С 74,22; Н 6,03; N 5,70.B. Получение гидрата 2-[(9-бензил-4-карбамоил-1,2,3,4-тетрагидрокарбазол-6-ил)окси] метилбензойной кислоты. Раствор 670 мг соединения из части А и 5 мл 2N раствора гидроксида натрия в 100 мл этанола и 15 мл тетрагидрофурана перемешивают в течение 16,5 ч, подкисляют соляной кислотой и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле,элюируя с градиентом метиленхлорид/2-4% метанол, и получают указанное в заголовке соединение (230 мг, 34%, твердое аморфное вещество). Элементный анализ для C28H26N2O4H2O: вычислено: С 71,17; Н 5,97; N 5,93; найдено : С 71,31; Н 5,68; N 5,65. Пример 5. Получение гидразида 9-бензил 5,7-диметокси-1,2,3,4-тетрагидрокарбазол-4 карбоновой кислоты.A. Получение N-бензил-3,5-диметоксианилина. Раствор 25 г (0,163 моль) 3,5-диметоксианилина и 18,3 мл (0,18 моль) бензальдегида в 300 мл метанола охлаждают в воде со льдом и обрабатывают 10,3 г (0,18 моль) цианборгидрида натрия по частям. Раствор перемешивают при 30 охлаждении в течение 3 ч, обрабатывают 1-2 г боргидрида натрия в течение 30 мин, разбавляют водой и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя с градиентом гексан/15-70% эфир, и получают 28,0 г (71%) 9 бензил-3,5-диметоксианилина в виде масла. Элементный анализ для C15H17NO2: вычислено: С 74,05; Н 7,04; N 5,76; найдено : С 74,30; Н 7,12; N 5,70.B. Получение гидразида 9-бензил-5,7 диметокси-1,2,3,4-тетрагидрокарбазол-4 карбоновой кислоты. Раствор 9,72 г соединения из части А и 4,98 г 2-карбэтокси-6-бромциклогексанона (J.Sheehan and C.E. Mumaw, J. Am. Chem. Soc., 72,2127-2129 (1950 в 125 мл бензола кипятят с обратным холодильником в течение 72 ч, охлаждают, фильтруют и упаривают в вакууме. Остаток (12 г) и 10 г хлорида цинка кипятят с обратным холодильником в 250 мл бензола в течение 6 ч, охлаждают и упаривают в вакууме. Остаток растворяют в этилацетате, промывают 1N соляной кислотой, промывают водой, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле,элюируя с градиентом толуол/0-5% этилацетат,и получают соединение (5) (R2=5-MeO, R3=7MeO, R4=фенил), 1,88 г которого растворяют в 100 мл этанола, содержащего 10 мл гидразингидрата, кипятят с обратным холодильником в течение 5 суток и охлаждают. Раствор декантируют, разбавляют этилацетатом, промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Получают 1,1 г (60%) указанного в заголовке соединения,т. пл. 189-190C/CH2Cl2-EtOH. Элементный анализ для C22H25N3O3: вычислено: С 69,64; Н 6,64; N 11,07; найдено : С 69,59; Н 6,74; N 10,84. Пример 6. Получение 9-бензил-5,7-диметокси-1,2,3,4-тетрагидрокарбазол-4-карбоксамида. Смесь 980 мг соединения примера 5, 2 мг никеля Ренея, 1-2 мл гидразингидрата и 125 мл этанола кипятят с обратным холодильником в течение 1 ч, раствор декантируют, разбавляют этилацетатом, промывают водой, насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя с градиентом метиленхлорид/1-3% метанол, и получают указанное в заголовке соединение (820 мг, 84%), т. пл. 190-192C/EtOH. Элементный анализ для C22H24N2O3: вычислено: С 72,51; Н 6,64; N 7,69; найдено: С 71,88; Н 6,89; N 7,81. Пример 7. Получение натриевой соли [9 бензил-4-карбамоил-7-метокси-1,2,3,4-тетрагидрокарбазол-5-ил]оксиуксусной кислоты. 31 А. Получение 9-бензил-5-гидрокси-7 метокси-1,2,3,4-тетрагидрокарбазол-4-карбоксамида. Раствор 1,75 г (4,8 ммоль) соединения примера 6 в 50 мл диметилформамида смешивают с раствором тиоэтоксида натрия (13,5 ммоль) в 75 мл диметилформамида и затем нагревают при 100 С в течение 21 ч. Смесь охлаждают, разбавляют водой, подкисляют соляной кислотой и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя с градиентом метиленхлорид/0-4% метанол, и получают 825 г(50%) указанного в подзаголовке продукта, т. пл. 225-7 С/этанол. Элементный анализ для C21H22N2O3: вычислено: С 71,98; Н 6,33; N 7,99; найдено: С 71,71; Н 6,37; N 7,72.B. Получение этилового эфира [9-бензил 4-карбамоил-7-метокси-1,2,3,4-тетрагидрокарбазол-5-ил]оксиуксусной кислоты. Раствор 700 мг (2,0 ммоль) продукта части А в 70 мл диметилформамида и 15 мл тетрагидрофурана обрабатывают 100 мг гидрида натрия(60% в минеральном масле; 2,5 ммоль) в течение 10 мин, а затем 0,3 мл (2,7 ммоль) этилбромацетата в течение 3 ч. Смесь разбавляют этилацетатом, промывают водой, насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя с градиентом метиленхлорид/1-2% метанол, и получают 670 мг(77%) указанного в подзаголовке продукта, т. пл. 167-169 С/эфир. Элементный анализ для C25H28N2O5: вычислено: С 68,79; Н 6,47; N 6,42; найдено: С 69,57; Н 6,39; N 5,77.C. Получение [9-бензил-4-карбамоил-7 метокси-1,2,3,4-тетрагидрокарбазол-5-ил]оксиуксусной кислоты. Суспензию 650 мг продукта части В в 20 мл тетрагидрофурана и 70 мл этанола обрабатывают 5 мл 2N раствора гидроксида натрия и получающийся в результате раствор перемешивают в течение 15,5 ч. Раствор разбавляют этилацетатом и водой и подкисляют соляной кислотой. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия, концентрируют в вакууме и фильтруют,получая 540 мг (87%) указанного в заголовке продукта, т. пл. 251-254 С. Элементный анализ для C23H24N2O5: вычислено: С 67,63; Н 5,92; N 6,86; найдено : С 67,73; Н 5,74; N 6,82.D. Получение натриевой соли [9-бензил-4 карбамоил-7-метокси-1,2,3,4-тетрагидрокарбазол-5-ил]оксиуксусной кислоты. Суспензию 120 мг продукта части С в 20 мл этанола обрабатывают 0,15 мл 2,0N раствора гидроксида натрия и нагревают до полного рас 003992 32 творения. Полученный в результате раствор концентрируют в вакууме, разбавляют этилацетатом и снова концентрируют в вакууме, оставляя стоять в течение ночи. Выпавший осадок отфильтровывают и сушат на воздухе, получая 80 мг (63%) указанного в заголовке продукта в виде аморфного твердого вещества. Элементный анализ для C23H23NaN2O5 0,4H2O: вычислено: С 63,18; Н 5,39; N 6,40; найдено: С 63,31; Н 5,48; N 6,25. Пример 8. Получение дигидрата 3-[(9 бензил-4-карбамоил-7-н-октил-1,2,3,4-тетрагидрокарбазол-6-ил)окси]пропилфосфоновой кислоты.A. Получение этил 9-бензил-6-метокси-7 н-октил-1,2,3,4-тетрагидрокарбазол-4-карбоксилата. Смесь 1,3 г 9-бензил-4-метокси-5-н-октиланилина (3) (полученного по методике примера 9, часть А, с использованием н-гептилтрифенилфосфонийбромида), 1,0 г 2-карбэтокси-6 бромциклогексанона, 675 мг бикарбоната натрия и 40 мл диметилформамида перемешивают в течение 5 суток, разбавляют этилацетатом,промывают водой, насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток и 10 г хлорида цинка в 250 мл бензола кипятят с обратным холодильником в течение 6 ч, охлаждают, разбавляют этилацетатом, промывают 1N соляной кислотой, насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя с градиентом гексан/10-15% диэтиловый эфир, и получают соединение (5) (R2=6-MeO, R3 а=7-н-октил,R4=фенил), 930 мг которого растворяют в 30 мл бензола и обрабатывают 15 мл 0,67 М раствора метилхлоралюминийамида при 50 С в течение 16 ч. Смесь охлаждают, разлагают льдом и 1N соляной кислотой и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме, получая указанное в подзаголовке соединение (795 мг, 91%), т. пл. 131133C/Et2O. Элементный анализ для С 29 Н 38N2 О 2: вычислено: С 77,97; Н 8,58; N 6,27; найдено: С 77,75; Н 8,62; N 5,99.B. Получение 9-бензил-6-гидрокси-7-ноктил-1,2,3,4-тетрагидрокарбазол-4-карбоксамида. Раствор 770 мг соединения части А в 75 мл дихлорметана обрабатывают 10 мл 1 М раствора трибромида бора в дихлорметане в течение 1,75 ч и затем разлагают льдом и 1N соляной кислотой. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя с градиентом метиленхлорид/1-3% метанол, и получают 33 указанное в подзаголовке соединение (360 мг,47%), т. пл. 223-225 С. Элементный анализ для С 28 Н 36N2O2: вычислено: С 77,74; Н 8,39; N 6,48; найдено : С 77,97; Н 8,45; N 6,40. С. Получение дигидрата 3-[(9-бензил-4 карбамоил-7-н-октил-1,2,3,4-тетрагидрокарбазол-6-ил)окси]пропилфосфоновой кислоты. Раствор 360 мг соединения части В в 10 мл тетрагидрофурана и 70 мл диметилформамида обрабатывают 40 мг гидрида натрия (60% в минеральном масле) в течение 15 мин, а затем 230 мг диметил 3-бромпропилфосфоната в течение 4 ч, разбавляют водой и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя с градиентом метиленхлорид/1-5% метанол, и получают соединение (9) (R2=6-(МеО)2 Р=O(СН 2)3, R3=7-ноктил, R4=фенил), 290 мг которого растворяют в 30 мл дихлорметана и 1 мл триметилсилилбромида, перемешивают в течение 20 ч и упаривают в вакууме. Остаток растворяют в 30 мл метанола, перемешивают в течение 2,25 ч, упаривают в вакууме и кристаллизуют из смеси бензол метанол - диэтиловый эфир, получая указанное в заголовке соединение (185 мг, 67%), т. пл. 160162 С. Элементный анализ для С 31 Н 43 Н 2O5 Р 2 Н 2O: вычислено: С 63,03; Н 8,02; N 4,74; найдено: С 63,18; Н 7,53; N 4,93. Пример 9. Получение 4-[(9-бензил-4-карбамоил-7-этил-1,2,3,4-тетрагидрокарбазол-6-ил) окси]масляной кислоты. А. Получение бензил 9-бензил-6-метокси 7-этил-1,2,3,4-тетрагидрокарбазол-4-карбоксилата. Суспензию 22 г (0,13 моль) 5-нитрозалового альдегида, 10 мл (0,16 моль) метилиодида,28 мг (0,2 моль) карбоната калия, 75 мл диметилсульфоксида и 125 мл 2-бутанона кипятят с обратным холодильником в течение 20 ч, охлаждают, разбавляют этилацетатом, промывают водой, насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя с градиентом гексан/10-50% эфир, и получают 15 г (67%) (1) (R2=4-MeO, R3(a)=3-CHO). Суспензию 19,6 г (0,055 моль) метилтрифенилфосфонийбромида в 300 мл тетрагидрофурана охлаждают до -5 С и постепенно обрабатывают 35 мл н-бутиллития (1,6 М раствор в гексане, 0,055 моль). Охлаждающую баню удаляют и смесь оставляют нагреваться до комнатной температуры в течение 45 мин. К этому желтому раствору постепенно добавляют раствор 9,1 г (0,050 моль) полученного выше альдегида, все перемешивают в течение 2 ч, разбавляют водой и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и 34 упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя с градиентом гексан/15-50% эфир, и получают (1) (R2=4-MeO,R3(a) = 3-CH2=CH) (7,7 г, 86%). Этот продукт реакции и 3 г 10-% Pd/C в 200 мл этанола перемешивают при давлении водорода в 1 атмосферу в течение 6 ч, фильтруют и упаривают в вакууме, получая (2) (R2=4MeO, R3(a) =3-CH3CH2). Этот неочищенный продукт и 5 мл бензальдегида в 150 мл метанола перемешивают при 0-5 С и в это время добавляют по частям 2,5 г цианборгидрида натрия. После дополнительной выдержки в течение 60 мин при этой температуре смесь разбавляют водой и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя с градиентом гексан/5-15% эфир, и получают 9-бензил-4-метокси-5-этиланилин (6,0 г, 60%). Смесь 3,3 г 9-бензил-4-метокси-5-этиланилина, 3,7 г 2-карбэтокси-6-бромциклогексанона,1,3 г бикарбоната натрия и 100 мл диметилформамида перемешивают в течение 5 суток, разбавляют этилацетатом, промывают водой, насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток и 10 г хлорида цинка в 250 мл бензола кипятят с обратным холодильником в течение 1,75 ч, охлаждают, разбавляют этилацетатом, промывают 1N соляной кислотой, насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя с градиентом гексан/10-20% диэтиловый эфир, и получают 2,6 г (50%) указанного в подзаголовке соединения, т. пл. 85-86C/EtOH. Элементный анализ для C25H29NO3: вычислено: С 76,70; Н 7,47; N 3,58; найдено: С 77,00; Н 7,56; N 3,69.B. Получение 9-бензил-6-метокси-7-этил 1,2,3,4-тетрагидрокарбазол-4-карбоксамида. Раствор 2,6 г соединения части А в 75 мл бензола и 30 мл 0,67 М раствора метилхлоралюминийамида в смеси бензол / толуол нагревают при 50 С в течение 24 ч, охлаждают, расслаивают 1N соляной кислотой и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме, получая 2,2 г (91%) указанного в подзаголовке соединения, т. пл. 168-169 С/СН 2 Сl2-EtOH. Элементный анализ для С 23 Н 26N2O2: вычислено: С 76,21; Н 7,23; N 7,73; найдено: С 76,55; Н 7,74; N 6,84.C. Получение 4-[(9-бензил-4-карбамоил-7 этил-1,2,3,4-тетрагидрокарбазол-6-ил)окси] масляной кислоты. Раствор 2,1 г соединения части В в 150 мл дихлорметана и 15 мл 1 М раствора трибромида бора в дихлорметане перемешивают в течение 2 35 ч, разлагают льдом и водой и органическую фазу промывают насыщенным раствором соли,сушат над сульфатом натрия и упаривают в вакууме, получая соединение (7) (R2(a)=6-HO,R3=7-этил, R4=фенил) (1,6 г, 80%), т. пл. 255 С(разл.)/метиленхлорид-этанол. Раствор 750 мг этого вещества в 20 мл тетрагидрофурана и 70 мл диметилформамида обрабатывают 100 мг гидрида натрия (60% в минеральном масле) в течение 10 мин, а затем 0,33 мл этил 4 бромбутирата в течение 4,5 ч, разбавляют этилацетатом, промывают водой, насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя с градиентом метиленхлорид/1-3% метанол, и получают соединение (9) (R2=6-EtO2CCH2CH2CH2O, R3=7-этил)(625 мг, 64%), т. пл. 134-136 С/этиленхлоридэтанол, которое растворяют в 10 мл тетрагидрофурана и 40 мл этанола, содержащих 3 мл 2 N раствора гидроксида натрия, и перемешивают в течение 22 ч. Раствор подкисляют соляной кислотой и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме, получая 410 мг (73%) указанного в заголовке соединения, т. пл. 208-210C/ CH2Cl2EtOH. Элементный анализ для С 26 Н 30N2 О 40,4 Н 2O: вычислено: С 64,05; Н 7,15; N 5,54; найдено: С 71,76; Н 6,90; N 6,56. Пример 10. Получение 3-[(9-бензил-4 карбамоил-7-этил-1,2,3,4-тетрагидрокарбазол-6 ил)окси]пропилфосфоновой кислоты.A. Получение диметил 3-[(9-бензил-4 карбамоил-7-этил-1,2,3,4-тетрагидрокарбазол-6 ил)окси]пропилфосфоната. Раствор 750 мг соединения примера 8 в 20 мл тетрагидрофурана и 75 мл диметилформамида обрабатывают 100 мг гидрида натрия (60% в минеральном масле) в течение 10 мин, а затем 510 мг диметил 3-бромпропилфосфоната в течение 5,25 ч, разбавляют этилацетатом, промывают водой, насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле,элюируя с градиентом метиленхлорид/1-5% метанол, и получают 655 мг (61%) указанного в подзаголовке соединения в виде твердого аморфного вещества. Элементный анализ для C27H35N2O5P: вычислено: С 64,12; Н 7,15; N 5,54; найдено: С 64,27; Н 7,00; N 5,92.B. Получение 3-[(9-бензил-4-карбамоил-7 этил-1,2,3,4-тетрагидрокарбазол-6-ил)окси] пропилфосфоновой кислоты. Раствор соединения части А и 1 мл триметилсилилбромида в 30 мл дихлорметана перемешивают в течение 18 ч, упаривают в вакууме,растворяют остаток в 25 мл метанола, перемешивают в течение 3,75 ч и концентрируют в 36 вакууме. Получают 475 мг (80%) указанного в заголовке соединения, т. пл. 235-238 С (разл.). Элементный анализ для C25H31N2O5P: вычислено: С 63,82; Н 6,64; N 5,95; найдено: С 63,56; Н 6,62; N 6,07. Пример 11. Получение (S)-(+)-4-[(9-бензил-4-карбамоил-7-этил-1,2,3,4-тетрагидрокарбазол-6-ил)окси]масляной кислоты. А. Получение (S)-(-)-1-[(S)-(+)-9-бензил-6 метокси-7-этил-1,2,3,4-тетрагидрокарбазол-4 ил]карбонил-4-бензил-2-оксазолидинона. Раствор 8,9 г соединения примера 8, часть А, в 25 мл тетрагидрофурана, 150 мл этанола и 25 мл 5N раствора гидроксида натрия перемешивают в течение 21 ч, разбавляют водой, подкисляют 5N соляной кислотой и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме, получая 7,6 г (92%) соответствующей кислоты, которую суспендируют в 200 мл дихлорметана, содержащего 0,5 мл диметилформамида, и обрабатывают 2,2 мл оксалилхлорида в течение 30 мин, а затем упаривают в вакууме. Остаток растворяют в 100 мл тетрагидрофурана и постепенно добавляют к раствору, полученному путем добавления 25 ммоль н-бутиллития к 25 ммолям (S)-(-)4-бензил-2-оксазолидинона в 150 мл тетрагидрофурана, при -75 С. После перемешивания в течение 2 ч при этой температуре раствор разбавляют водой и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя с градиентом гексан/15-60% эфир, и получают сначала 3,3 г(28%) (S,S)-диастереомера, а затем 1,2 г (11%) смеси и затем 3,3 г (28%) (R,S)-диастереомера. Элементный анализ для С 33 Н 34N2O4; вычислено: С 75,84; Н 6,56; N 5,36; найдено: С 76,09; Н 6,44; N 5,42.B. Получение (S)-(+)-9-бензил-6-метокси 7-этил-1,2,3,4-тетрагидрокарбазол-4-карбоксамида. Раствор 3,2 г (6 ммоль) соединения, указанного в заголовке части А, в 50 мл тетрагидрофурана при -5 С добавляют к раствору, полученному путем добавления 60 ммолей нбутиллития к 60 ммолям бензилового спирта в 150 мл тетрагидрофурана. Полученный в результате раствор перемешивают в течение 20 мин, разбавляют водой и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя с градиентом гексан/10-15% эфир, и получают 2,6 г (93%) бензилового эфира карбазол-4-карбоновой кислоты, который обрабатывают 4 эквивалентами метилхлоралюминийамида в 100 мл бензола при 50 С в течение 18 ч, охлаждают, разлагают соляной кислотой со льдом и экстрагируют этил 37 ацетатом. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме, получая 2,5 г (100%) указанного в подзаголовке соединения,т. пл. 184-186 С, вращение при 589 +39,7. Элементный анализ для С 23 Н 26N2O2: вычислено: С 76,21; Н 7,23; N 7,73; найдено: С 76,19; Н 7,29; N 7,69.C. Получение (S)-(+)-9-бензил-6-гидрокси 7-этил-1,2,3,4-тетрагидрокарбазол-4-карбоксамида. Раствор 2,4 г полученного выше 6-метоксипроизводного в 200 мл дихлорметана обрабатывают 20 мл 1 М раствора трибромида бора в дихлорметане в течение 2,5 ч, разлагают водой со льдом, промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме, получая 2,2 г (100%) 6-гидрокситетрагидрокарбазола, т. пл. 240-242C/EtOHCH2Cl2. Элементный анализ для C22H24N2O2: вычислено: С 75,84; Н 6,94; N 8,04; найдено: С 76,01; Н 7,18; N 8,13.D. Получение (S)-(+)-этил 4-[(9-бензил-4 карбамоил-7-этил-1,2,3,4-тетрагидрокарбазол-6 ил)окси]бутирата. Раствор 2,1 г (6 ммоль) полученного выше 6-гидроксикарбазола в 25 мл тетрагидрофурана и 125 мл диметилформамида обрабатывают 280 мг гидрида натрия (60% в минеральном масле; 7 ммоль) в течение 5 мин, а затем 1,0 мл (7 ммоль) этил 4-бромбутирата в течение 1,5 ч, разбавляют водой и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя с градиентом дихлорметан/0-5% метанол, и получают 760 мг(29%) указанного в подзаголовке продукта, т. пл. 188-190 С/МеОН, вращение при 589 +32,2. Элементный анализ для С 28 Н 34N2O4: вычислено: С 72,70; Н 7,41; N 6,06; найдено: С 72,94; Н 7,34; N 6,20. Е. Получение (S)-(+)-4-[(9-бензил-4-карбамоил-7-этил-1,2,3,4-тетрагидрокарбазол-6-ил) окси]масляной кислоты. Раствор 635 мг полученного выше эфира и 250 мг гидроксида лития в 15 мл воды и 50 мл тетрагидрофурана перемешивают в течение 5 ч,промывают эфиром, подкисляют 1N соляной кислотой и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме, получая 260 мг (44%) указанного в заголовке продукта, т. пл. 188-190 С,вращение при 589 +22,8. Элементный анализ для C26H30N2O4: вычислено: С 71,87; Н 6,96; N 6,45; найдено: С 72,08; Н 7,11; N 6,32. Пример 12. Получение 4-[9-бензил-4 карбамоил-7-(2-цианоэтил)-1,2,3,4-тетрагидрокарбазол-6-ил]оксимасляной кислоты. 38 А. Получение метил 2-метокси-5-нитроциннамата. Раствор 11,0 г (0,06 моль) 2-метокси-5 нитробензальдегида и 23,1 г (0,07 моль) метилтрифенилфосфоранилиденацетата в 250 мл тетрагидрофурана кипятят с обратным холодильником в течение 1,5 ч, охлаждают, разбавляют водой и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя дихлорметаном, и получают 14,0 г (97%) указанного в подзаголовке продукта, т. пл. 156-158 С. Элементный анализ для С 11 Н 11NO5: вычислено: С 55,70; Н 4,67; N 5,90; найдено: С 55,92; Н 4,64; N 6,01. В. Получение этил 9-бензил-6-метокси-7(3-амино-3-оксопропил)-1,2,3,4-тетрагидрокарбазол-4-карбоксилата. Смесь 14 г полученного выше циннамата,5 г 10% Pd/C, 100 мл тетрагидрофурана и 150 мл этанола перемешивают при давлении водорода 1 атмосфера в течение 14 ч, фильтруют и упаривают в вакууме, получая 11,5 г (94%) метил 3(2-метокси-5-аминофенил)пропионата (2), который растворяют в 200 мл метанола, содержащего 7 мл бензальдегида, и охлаждают до 0-5 С. После добавления по частям 5 г цианборгидрида натрия раствор перемешивают в течение 3 ч при той же температуре, разлагают водой и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле,элюируя с градиентом гексан/10-25% эфир, и получают метил 3-(9-бензил-2-метокси-5-аминофенил)пропионат (11,4 г, 70%). Смесь 4,5 г(30 ммоль) бикарбоната натрия и 75 мл диметилформамида перемешивают в течение четырех суток, разбавляют водой и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток и 15 г хлорида цинка в 300 мл бензола кипятят с обратным холодильником с водоотделителем в течение 6 ч, охлаждают, разбавляют этилацетатом и хорошо перемешивают с 1N соляной кислотой. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя с градиентом гексан/0-25% эфир, и получают 3,0 г (40%) этил 9-бензил-6-метокси-7-(2-метоксикарбонилэтил)-1,2,3,4-тетрагидрокарбазол-4-карбоксилата, который растворяют в 90 мл бензола и обрабатывают 4 эквивалентами метилхлоралюминийамида при 50 С в течение 3 ч. Смесь охлаждают, разлагают соляной кислотой со льдом и экстрагируют этилацетатом. Органическую фазу 39 промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме,получая 1,97 г (73%) этил 9-бензил-6-метокси-7(3-амино-3-оксопропил)-1,2,3,4 тетрагидрокарбазол-4-карбоксилата, т. пл. 125130 С. Элементный анализ для C24H27N3O3: вычислено: С 71,87; Н 6,96; N 6,45; найдено: С 71,62; Н 7,02; N 6,51.C. Получение 9-бензил-6-метокси-7-(2 цианоэтил)-1,2,3,4-тетрагидрокарбазол-4-карбоксамида и 9-бензил-6-метокси-7-(3-амино-3 оксопропил)-1,2,3,4-тетрагидрокарбазол-4 карбоксамида. Суспензию 2,0 г полученного выше эфира в 100 мл бензола нагревают при 50 С с 4 эквивалентами метилхлоралюминийамида в течение 66 ч, охлаждают, разлагают соляной кислотой со льдом, встряхивают с этилацетатом и фильтруют, получая 380 мг (21%) 9-бензил-6-метокси(3-амино-3-оксопропил)-1,2,3,4-тетрагидрокарбазол-4-карбоксамида, т. пл. 253255 С. Элементный анализ для С 24 Н 27N3O3: вычислено: С 71,09; Н 6,71; N 10,36; найдено: С 70,85; Н 6,83; N 10,20. Фильтрат экстрагируют этилацетатом и органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя с градиентом дихлорметан/2-7% метанол, и получают указанный выше бисамид (395 мг, 22%) и указанный в подзаголовке продукт (560 мг, 33%), т. пл. 177180 С/эфир. Элементный анализ для С 24 Н 25N3O2: вычислено: С 74,39; Н 6,50; N 10,85; найдено: С 72,55; Н 6,50; N 10,09.D. Получение 9-бензил-6-гидрокси-7-(2 цианоэтил)-1,2,3,4-тетрагидрокарбазол-4 карбоксамида. Раствор 500 мг продукта реакции из части С и 10 мл 1 М раствора трибромида бора в дихлорметане и 75 мл дихлорметана перемешивают в течение 45 ч, разлагают водой со льдом,промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле,элюируя с градиентом дихлорметан/2-5% метанол, и получают указанный в подзаголовке продукт (225 мг, 47%), т. пл. 238-240 С. Элементный анализ для C23H23N3O2: вычислено: С 73,97; Н 6,21; N 11,25; найдено: С 73,74; Н 6,29; N 11,48.E. Получение этил 4-[9-бензил-4-карбоксамидо-7-(2-цианоэтил)-1,2,3,4-тетрагидрокарбазол-6-ил]оксибутирата. Раствор 210 мг (0,6 ммоль) полученного выше 6-гидрокситетрагидрокарбазола в 5 мл тетрагидрофурана и 20 мл диметилформамида обрабатывают 40 мг гидрида натрия (60% в минеральном масле; 0,8 ммоль) в течение 5 мин, а 40 затем 0,1 мл (0,9 ммоль)этил 4-бромбутирата в течение 2 ч, разбавляют водой и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя с градиентом дихлорметан/1-3% метанол, и получают указанный в подзаголовке продукт (190 мг, 70%), т. пл. 122-124 С/эфир. Элементный анализ для С 29 Н 33N3O4: вычислено: С 71,44; Н 6,82; N 8,62; найдено: С 71,51; Н 6,77; N 8,38.F. Получение [9-бензил-4-карбоксамидо-7(2-цианоэтил)-1,2,3,4-тетрагидрокарбазол-6-ил] оксимасляной кислоты. Раствор 175 мг полученного выше сложного эфира и 2 мл 2 N раствора гидроксида натрия в 20 мл этанола перемешивают в течение 15 ч,разбавляют 1N соляной кислотой и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме, получая указанный в заголовке продукт (125 мг,76%), т. пл. 184-192 С. Элементный анализ для C27H29N3O4: вычислено: С 70,57; Н 6,36; N 9,14; найдено : С 70,78; Н 6,52; N 9,38. Пример 13. Получение 4-[9-бензил-4-карбоксамидо-7-(2-фенилэтил)-1,2,3,4-тетрагидрокарбазол-6-ил]оксимасляной кислоты.A. Получение 3-(2-фенилэтенил)-4-метоксинитробензола. Суспензию 14,3 г (33 ммоль) бензилтрифенилфосфонийбромида в 200 мл тетрагидрофурана охлаждают до -5 С и постепенно обрабатывают 21 мл раствора н-бутиллития (1,6 М раствор в гексане; 34 ммоль). Охлаждающую баню удаляют и смесь перемешивают, оставляя нагреваться до комнатной температуры на 60 мин. Быстро добавляют по каплям раствор 5,4 г (30 ммоль) 2-метокси-5-нитрозалового альдегида в 50 мл тетрагидрофурана и затем раствор перемешивают в течение 2 ч, разбавляют водой,подкисляют соляной кислотой и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя с градиентом гексан/15-25% эфир, и получают указанный в подзаголовке продукт (7,8 г, 93%),т. пл. 109-111 С/эфир-гексан. Элементный анализ для C15H13NО 3: вычислено: С 70,58; Н 5,13; N 5,49; найдено: С 70,82; Н 5,17; N 5,60.B. Получение N-бензил-3-(2-фенилэтил)-4 метоксианилина. Смесь 7,8 г продукта из части А, 4 г 10%Pd/C, 25 мл тетрагидрофурана и 175 мл этанола перемешивают при давлении водорода 1 атмосфера в течение 6,5 ч, фильтруют и упаривают в вакууме. Остаток растворяют в 200 мл метанола, содержащего 3 мл бензальдегида, и охлаж 41 дают до -5 С. Добавляют по частям цианборгидрид натрия (6 г) и раствор перемешивают при охлаждении в течение 3 ч, разбавляют водой и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя с градиентом гексан/5-10% эфир, и получают указанный в подзаголовке продукт (4,8 г, 50%, две стадии) в виде масла. Элементный анализ для C22H23NO: вычислено: С 83,24; Н 7,30; N 4,41; найдено: С 83,53; Н 7,30; N 4,69.C. Получение N-бензил-6-метокси-7-(2 фенилэтил)-1,2,3,4-тетрагидрокарбазол-4-карбоксамида. Смесь 1,6 г (5 ммоль) продукта части В,1,5 г (6 ммоль) этил 3-бром-2-циклогексанонкарбоксилата, 1,0 г (12 ммоль) бикарбоната натрия и 40 мл диметилформамида перемешивают в течение 6 суток, разбавляют этилацетатом, промывают водой, насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток и 3,5 г (30 ммоль) хлорида цинка в 250 мл бензола кипятят с обратным холодильником с водоотделителем в течение 6 ч,охлаждают, разбавляют этилацетатом и хорошо перемешивают с 1N соляной кислотой. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя с градиентом гексан/1020% эфир, и получают 910 мг (39%) этил 9 бензил-6-метокси-7-(2-фенилэтил)-1,2,3,4 тетрагидрокарбазол-4-карбоксилата в виде масла, который растворяют в 60 мл бензола, смешивают с 10-15 мл 0,67 М раствора метилхлоралюминийамида в смеси бензол:толуол (2:1) и нагревают при 50 С в течение 16 ч. Смесь охлаждают, разлагают водой со льдом и экстрагируют смесью дихлорметан:изопропанол (3:1). Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя с градиентом дихлорметан/1-2% метанол, и получают указанный в подзаголовке продукт (630 мг, 76%), т. пл. 165-166 С/этанол. Элементный анализ для C29H30N2O2: вычислено: С 79,42; Н 6,90; N 6,39; найдено: С 79,64; Н 6,90; N 6,32.D. Получение 9-бензил-6-гидрокси-7-(2 фенилэтил)-1,2,3,4-тетрагидрокарбазол-4-карбоксамида. Раствор 610 мг продукта реакции из части С в 100 мл дихлорметана обрабатывают 5 мл 1 М раствора трибромида бора в дихлорметане в течение 4 ч, разлагают водой со льдом и экстрагируют дихлорметан:изопропанол (3:1). Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме, получая указанный в под 003992 42 заголовке продукт (580 мг, 100%), т. пл. 209211 С/этанол. Элементный анализ для C28H28N2O2: вычислено: С 78,84; Н 7,09; N 6,57; найдено : С 78,54; Н 6,79; N 6,33.E. Получение этил 4-[9-бензил-4-карбоксамидо-7-(2-фенилэтил)-1,2,3,4-тетрагидрокарбазол-6-ил]оксимасляной кислоты. Раствор 560 мг (1,3 ммоль) продукта из части D в 50 мл диметилформамида и 10 мл тетрагидрофурана перемешивают с 60 мг гидрида натрия (60% в минеральном масле; 1,5 ммоль) в течение 5 мин, а затем с 0,2 мл (1,4 ммоль) этил 4-бромбутирата в течение 3 ч, разбавляют этилацетатом, промывают водой, насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя с градиентом дихлорметан/1-2% метанол, и получают указанный в подзаголовке продукт (535 мг, 75%), т. пл. 144-146 С/этанол. Элементный анализ для С 34H38N2O4: вычислено: С 75,81; Н 7,11; N 5,20; найдено: С 75,71; Н 7,10; N 5,12.F. Получение 4-[9-бензил-4-карбоксамидо 7-(2-фенилэтил)-1,2,3,4-тетрагидрокарбазол-6 ил]оксимасляной кислоты. Раствор 520 мг продукта из части Е и 4 мл 2 N раствора гидроксида натрия в 25 мл тетрагидрофурана и 25 мл этанола перемешивают в течение 16 ч, разбавляют этилацетатом, подкисляют соляной кислотой, промывают насыщенным раствором соли, сушат над сульфатом натрия, концентрируют в вакууме и фильтруют,получая указанный в заголовке продукт (230 мг,44%), т. пл. 202-205 С. Элементный анализ для С 32 Н 34N2O4: вычислено: С 75,27; Н 6,71; N 5,49; найдено: С 75,04; Н 6,69; N 5,41. Пример 14. Получение 4-[9-бензил-4-карбоксамидокарбазол-6-ил]оксимасляной кислоты. А. Получение 9-бензил-6-метоксикарбазол-4-карбоксамида. Смесь 2,5 г тетрагидрокарбазола из примера 1, часть А, и 5 г 5% Pd/C в 130 мл карбитола кипятят с обратным холодильником в течение 7 ч, охлаждают и упаривают в вакууме. Остаток кристаллизуют из смеси дихлорметан-этанол,получая указанный в подзаголовке продукт (1,1 г, 44%), т. пл. 226-228 С. Элементный анализ для C12H18N2O2: вычислено: С 76,34; Н 5,49; N 8,48; найдено: С 76,61; Н 5,75; N 8,41.B. Получение 9-бензил-6-гидроксикарбазол-4-карбоксамида. Суспензию 1,0 г 6-метоксикарбазола, полученного выше в части А, и 10 мл 1 М раствора трибромида бора в 250 мл дихлорметана перемешивают в течение 2 ч, разлагают водой со льдом и экстрагируют смесью дихлорметан:изопропанол (3:1). Органическую фазу про 43 мывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме,получая указанный в подзаголовке продукт (1,0 г, 100%), т. пл. 246-248 С. Элементный анализ для C20H16N2O20,3H2O: вычислено: С 74,66; Н 5,20; N 8,71; найдено: С 74,46; Н 5,19; N 8,45.C. Получение 4-[9-бензил-6-карбоксамидокарбазол-6-ил]оксимасляной кислоты. Раствор 700 мг (2,2 ммоль) полученного выше 6-гидроксикарбазола в 25 мл тетрагидрофурана и 75 мл диметилформамида обрабатывают 100 мг гидрида натрия (60% в минеральном масле; 2,5 ммоль) в течение 5 мин, а затем 0,35 мл (2,5 ммоль) этил 4-бромбутирата в течение 3 ч, разбавляют водой и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя с градиентом дихлорметан/0-3% метанол, и получают O-алкилированное производное (700 мг,74%, т. пл. 150-152 С), которое растворяют в 75 мл этанола и 5 мл 2N раствора гидроксида натрия, перемешивают в течение 16 ч, подкисляют 1N соляной кислотой и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме, получая указанный в заголовке продукт (475 мг, 72%), т. пл. 252-254 С. Элементный анализ для С 24 Н 22N2O4: вычислено: С 71,63; Н 5,51; N 6,96; найдено: С 71,39; Н 5,66; N 6,72. Пример 15. Получение [9-бензил-4-карбамоил-7-метоксикарбонил-5-ил]оксиуксусной кислоты. Смесь 430 мг продукта примера 7, часть D,2,0 г 5% Pd/C и 20 мл карбитола нагревают до появления флегмы и кипятят с обратным холодильником в течение 21 ч, охлаждают и фильтруют. Фильтрат разбавляют водой, подкисляют соляной кислотой и тщательно экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток растирают с дихлорметаном и фильтруют для удаления твердого тетрагидрокарбазола. Фильтрат упаривают в вакууме, получая указанный в заголовке продукт (125 мг, 31%). Элементный анализ для С 23 Н 20N2O50,4 Н 2O: вычислено: С 67,11; Н 5,09; N 6,81; найдено: С 67,24; Н 5,19; N 6,75. Пример 16. Получение метил [9-бензил-4 карбамоил-7-метоксикарбазол-5-ил]оксиуксусной кислоты.Pd/C и 100 мл карбитола кипятят с обратным холодильником в течение 17 ч, фильтруют в 44 горячем состоянии и твердое вещество тщательно промывают этилацетатом. Объединенные фильтраты промывают водой, насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме, получая указанный в подзаголовке продукт (1,4 г, 70%), т. пл. 240-243 С. Элементный анализ для C22H20N2O3: вычислено: С 73,32; Н 5,59; N 7,77; найдено: С 74,26; Н 5,73; N 8,04.B. Получение 9-бензил-4-карбамоил-5-гидрокси-7-метоксикарбазола. Раствор 1,2 г (3,3 ммоль) продукта части А и 10 ммолей этантиолата натрия в 100 мл диметилформамида нагревают при 100 С в течение 42 ч, охлаждают, разбавляют водой и доводят рН до 5-6, добавляя соляную кислоту. Смесь экстрагируют этилацетатом, органическую фазу промывают водой, насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя этилацетатом, и получают 550 мг(разл.). Элементный анализ для C21H18N2O3: вычислено: С 72,82; Н 5,24; N 8,09; найдено: С 72,54; Н 5,19; N 8,04.C. Получение метил [9-бензил-4-карбамоил-7-метоксикарбазол-5-ил]оксиуксусной кислоты. Раствор 430 мг (1,2 ммоль) продукта, полученного в части В, в 40 мл диметилформамида и нескольких мл тетрагидрофурана обрабатывают 60 мг гидрида натрия (60% в минеральном масле; 1,5 ммоль) в течение 15 мин, а затем 0,13 мл (1,4 ммоль) метилбромацетата в течение 16 ч, разбавляют этилацетатом, промывают водой, насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя с градиентом дихлорметан/1-3% метанол, и получают указанное в заголовке соединение (320 мг, 62%), т. пл. 170-172 С. Элементный анализ для С 24 Н 22N2O5: вычислено: С 68,89; Н 5,30; N 6,69; найдено: С 68,64; Н 5,41; N 6,57.D. Получение натриевой соли [9-бензил-4 карбамоил-7-метоксикарбазол-5-ил]оксиуксусной кислоты. К суспензии 60 мг (0,15 ммоль) продукта реакции, полученного в части С, в 30 мл этанола добавляют 0,075 мл 2,0N раствора гидроксида натрия. Смесь нагревают до полного растворения, охлаждают, концентрируют в вакууме, разбавляют этилацетатом, концентрируют в вакууме, охлаждают и фильтруют, получая продукт реакции в виде твердого аморфного вещества 45 Раствор 1,47 г (4,19 ммоль) продукта примера 7, часть А, в 146 мл диметилформамида и 31 мл тетрагидрофурана обрабатывают 210 мг гидрида натрия (60% в минеральном масле; 5,24 ммоль) в течение 10 мин, а затем 0,39 мл (0,66 ммоль) бромацетонитрила в течение 3,5 ч. Смесь разбавляют этилацетатом, промывают водой, насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на силикагеле, элюируя с градиентом 0-4% метанола в метиленхлориде,и получают указанный в заголовке продукт(1,34 г, 82%). Элементный анализ для С 23 Н 23N3O3: вычислено: С 70,93; Н 5,95; N 10,79; найдено: С 70,67; Н 6,06; N 10,83. Пример 18. Получение 9-бензил-7 метокси-5-(1 Н-тетразол-5-илметил)окси-1,2,3,4 тетрагидрокарбазол-4-карбоксамида. Часть соединения примера 17 (0,45 г; 1,16 ммоль) нагревают с 5 мл гидрида три-нбутилолова при 95 С в течение 1 ч. Реакционную смесь затем добавляют к смеси 125 мл ацетонитрила, 25 мл тетрагидрофурана и 50 мл уксусной кислоты и перемешивают в течение 2 ч. Смесь экстрагируют 4 раза гексаном и остаток упаривают в вакууме. Кристаллизацией из ацетона и гексана получают указанное в заголовке соединение (0,30 г, 60%). Элементный анализ для C23H24N6O3: вычислено: С 63,88; Н 5,59; N 19,43; найдено: С 64,06; Н 5,64; N 19,28. Пример 19. Получение 2-[(2,9-бис-бензил 4-карбамоил-1,2,3,4-тетрагидро-бета-карбол-5 ил)окси]уксусной кислоты. А. Получение 4-(трет-бутилдиметилсилил) оксииндола. К раствору 4-гидроксииндола (20 г, 150 ммоль) в 300 мл безводного СН 2 Сl2 при температуре окружающей среды добавляют имидазол(15,3 г, 225 ммоль). Полученную в результате смесь обрабатывают трет-бутилдиметилсилилхлоридом (25 г, 165 ммоль). После перемешивания в течение ночи при температуре окружающей среды реакционную смесь выливают в 300 мл воды. Слои разделяют и водную фазу экстрагируют CH2Cl2 (2 х 100 мл). Объединенные органические слои сушат над сульфатом натрия, фильтруют и концентрируют в вакууме до черного масла. Сырой остаток очищают на Prep 500 (силикагель; 0-5% этилацетат/гексаны) и получают указанное в заголовке соединение в виде светло-фиолетового воскообразного твердого вещества с количественным выходом.[M+1]+ 248, [М-1]- 246. Элементный анализ для C14H21NOSi: вычислено: С 67,96; Н 8,55; N 5,66; найдено: С 69,10; Н 8,79; N 5,70. 46 Раствор индола (78) (247 г, 1,00 ммоль) в сухом тетрагидрофуране (2 мл) в атмосфере азота охлаждают до -10 С и затем добавляют по каплям в течение 30 с с помощью шприца 1,6 М раствор н-бутиллития в гексанах (0,625 мл, 1,00 ммоль). Полученный в результате раствор перемешивают в течение 15 мин и добавляют в один прием 1 М раствор хлорида цинка в эфире (1,0 мл, 1,0 ммоль). Раствор перемешивают в течение 2 ч при нагревании до температуры окружающей среды. К этому раствору добавляют в один прием этилиодацетат (0,118 мл, 1,00 ммоль). Реакционная смесь темнеет, но остается прозрачной. Смесь перемешивают в течение 3 ч при температуре окружающей среды и концентрируют в вакууме. Остаток очищают прямо на силикагеле (колонка 30 х 35 мм), элюируя метиленхлоридом. При концентрации соответствующих фракций получают 192 мг (57,8%) указанного в заголовке продукта в виде белого твердого вещества.[M+l]+ 334, [М-1]- 332. Элементный анализ для C18H27NO3Si: вычислено: С 64,86; Н 8,11; N 4,20; найдено: С 65,11; Н 8,02; N 4,24.C. Получение этил [2,9-бис-бензил-5-(третбутилдиметилсилил)окси-1,2,3,4-тетрагидробета-карболин]-4-уксусной кислоты. Раствор сложного эфира (79) (5,08 г, 15,2 ммоль) в сухом тетрагидрофуране (100 мл) охлаждают до -78 С и затем обрабатывают, добавляя по каплям, 0,5 М раствором бис(триметилсилил)амида калия в толуоле (32 мл, 16 ммоль). Полученный раствор перемешивают в течение 10 мин и затем добавляют в один прием бензилиодид (3,32 г, 15,2 ммоль). Охлаждающую баню удаляют, смесь быстро нагревают до 0 С, а затем медленно до температуры окружающей среды. После перемешивания в течение 75 мин при температуре окружающей среды смесь концентрируют в вакууме. Остаток растворяют в эфире и промывают последовательно 10% водным раствором лимонной кислоты, водой и насыщенным раствором бикарбоната натрия. Эфирный раствор сушат над сульфатом магния и концентрируют в вакууме. Остаток очищают на силикагеле (колонка 70 х 30 мм), элюируя 500 мл смеси метиленхлорид/гексаны (1:1), а затем 500 мл метиленхлорида. Соответствующие фракции объединяют и концентрируют в вакууме, получая 5,90 г (91%) этил [1-бензил-4(трет-бутилдиметил-силил)оксииндол]-3-уксусной кислоты в виде коричневого масла. Бензиламин (2,14 г, 20,0 ммоль) и параформальдегид (1,80 г, 120 ммоль) соединяют и кипятят с обратным холодильником в безводном метаноле (10 мл) в течение 2 ч. Смесь концентрируют в вакууме и сушат в вакууме в течение 30 мин, получая неочищенный бензил бис(метоксиметил)амин в виде содержащего 47 воду белого масла. Это вещество используют непосредственно без дополнительной очистки. К охлажденному раствору этил [1-бензил 4-(трет-бутилдиметилсилил)оксииндол]-3-уксусной кислоты (190 мг, 0,45 ммоль) в сухом тетрагидрофуране (2 мл) добавляют по каплям,с помощью шприца, 0,5 М раствор бис(триметилсилил)амида калия в толуоле (0,98 мл, 0,49 ммоль). После перемешивания смеси в течение 10 мин добавляют в один прием триметилсилилхлорид (0,057 мл, 0,45 ммоль). Смесь нагревают до температуры окружающей среды, а затем концентрируют в вакууме. Остаток сушат в течение 30 мин в вакууме и получают триметилсилилкетенацеталь (81). Оставшийся кетенацеталь (81) сразу же растворяют в метиленхлориде (30 мл), к которому добавляют свежеполученный бензил бис(метоксиметил)амин (175 мг,0,90 ммоль). Смесь охлаждают до -78 С и обрабатывают 1 М раствором хлорида цинка в эфире(0,9 мл, 0,9 ммоль). Смесь нагревают до температуры окружающей среды и перемешивают еще в течение 45 мин. Смесь промывают насыщенным раствором бикарбоната натрия, затем пропускают через слой силикагеля, элюируя смесью этилацетат/гексан (1:4). Нужные фракции объединяют и концентрируют в вакууме, а затем очищают в патроне с SCX (1 г, Varian) с метанолом и аммиаком. Нужные фракции объединяют, концентрируют и окончательно очищают на силикагеле, элюируя метиленхлоридом и получая 34 мг (14%) указанного в заголовке трициклического индола.[M+l]+ 555. Элементный анализ для С 34 Н 42N2 О 3Si: вычислено: С 73,64; Н 7,58; N 5,05; найдено: С 73,42; Н 7,61; N 5,15.D. Получение этил 2-[(2,9-бис-бензил-4 карбамоил-1,2,3,4-тетрагидро-бета-карбол-5-ил) окси]уксусной кислоты. Раствор 565 мг (1,02 ммоль) соединения,полученного в части С, в 10 мл смеси метанол/ тетрагидрофуран (1:1) обрабатывают в атмосфере азота 5 мл (5 ммоль) 1N раствора гидроксида лития. Смесь недолго нагревают, перемешивают при температуре окружающей среды в течение 2 ч и затем концентрируют в вакууме примерно до 5 мл. Доводят рН раствора до 5-6 с помощью 1N соляной кислоты. Полученный осадок собирают и сушат, получая 430 мг(102%) гидроксикислоты. Данный продукт суспендируют с гидроксибензотриазолом (160 мг, 1,19 ммоль) и гидрохлоридом 1-(3-диметиламинопропил)-3-этилкарбодиимида (940 мг, 2,30 ммоль) в 30 мл смеси тетрагидрофуран/метиленхлорид (1:1). Смесь энергично перемешивают в течение 10 мин, насыщают газообразным аммиаком, энергично перемешивают в течение 1 ч и затем концентрируют в вакууме. Остаток обрабатывают этилацетатом и насыщенным раствором бикарбоната 48 натрия. Этилацетатный раствор сушат над безводным сульфатом магния, фильтруют и концентрируют в вакууме. Остаток пропускают через слой силикагеля с помощью этилацетата. Элюент упаривают и получают 175 мг (43%) карбоксамида. Данное соединение растворяют в 3 мл сухого тетрагидрофурана, охлаждают до -70 С и обрабатывают 0,5 М раствором бис (триметилсилил)амида калия в толуоле (0,85 мл, 0,425 ммоль). Раствор перемешивают в течение 10 мин и затем добавляют в один прием этилбромацетат. Реакционную смесь перемешивают в течение 6 ч при нагревании до температуры окружающей среды. Смесь концентрируют в вакууме и остаток очищают на силикагеле, элюируя этилацетатом и получая 86 мг (41%) указанного в заголовке соединения.[M+1]+ 498. Элементный анализ для С 30 Н 31N3O4: вычислено: С 72,43; Н 6,24; N 8,45; найдено: С 72,54; Н 6,36; N 8,64. Е. Получение 2-[(2,9-бис-бензил-4-карбамоил-1,2,3,4-тетрагидро-бета-карбол-5-ил)окси] уксусной кислоты. Раствор соединения, полученного в частиD (78 мг, 0,16 ммоль), в 2 мл смеси тетрагидрофуран/метанол (1:1) перемешивают с 1 М раствором гидроксида лития (0,63 мл, 0,63 ммоль) в течение 3 ч. Смесь концентрируют в вакууме и получают белое твердое вещество. Это твердое вещество суспендируют в 2 мл воды и доводят рН до 5-6 1N соляной кислотой с образованием некоторого другого твердого белого вещества. Новое твердое вещество собирают посредством фильтрации и сушат в вакууме, получая 68 мг[M+1]+ 470. Элементный анализ для С 28 Н 27N3O40,8 Н 2O: вычислено: С 69,49; Н 5,96; N 8,68; найдено : С 69,50; Н 5,64; N 8,54. Терапевтическое применение трициклических соединений Полагают, что описанные здесь соединения достигают своего благоприятного лечебного действия главным образом за счет прямого ингибирования человеческой сФЛА 2, а не за счет действия в качестве антагонистов арахидоновой кислоты и других активных веществ ниже арахидоновой кислоты в метаболизме арахидоновой кислоты, таких как 5-липоксигеназа, циклооксигеназа и т. п. Способ изобретения для ингибирования опосредуемого сФЛА 2 высвобождения жирных кислот включает контактирование сФЛА 2 с терапевтически эффективным количеством соединения формулы (III) или его соли. Соединения изобретения можно использовать в способе лечения млекопитающего (например, человека) для снижения патологиче 49 ских эффектов септического шока, респираторного дистресс-синдрома у взрослых, панкреатита, травмы, бронхиальной астмы, аллергического ринита и ревматоидного артрита; при этом указанный способ включает введение млекопитающему соединения формулы (III) в терапевтически эффективном количестве. "Терапевтически эффективное количество" представляет количество, достаточное для ингибирования опосредуемого сФЛА 2 высвобождения жирной кислоты и, за счет этого, ингибирования или предотвращения метаболизма арахидоновой кислоты и его вредных продуктов. Лечебное количество соединения изобретения, необходимое для ингибирования сФЛА 2, можно легко определить путем взятия образца жидкости организма и анализа ее на содержание cФЛА 2 обычными способами. Фармацевтические композиции изобретения Как отмечалось ранее, соединения данного изобретения полезны для ингибирования опосредуемого сФЛА 2 высвобождения жирных кислот, таких как арахидоновая кислота. Термином "ингибирование" обозначается предотвращение или терапевтически существенное снижение с помощью соединений изобретения вызываемого сФЛА 2 высвобождения жирных кислот. "Фармацевтически приемлемый" означает,что носитель, разбавитель или эксципиент должен быть совместимым с другими ингредиентами композиции и не оказывать вредного действия на реципиента. Вообще, соединения данного изобретения наиболее желательно вводить в дозе, которая будет давать эффективные результаты, не вызывая каких-либо серьезных побочных действий, и могут вводиться или в виде разовой стандартной дозы, или, если желательно, дозировку можно разделить на удобные субъединицы,вводимые в подходящее время в течение суток. Конкретная доза соединения, вводимого по данному изобретению для получения лечебного или профилактического действия, будет, конечно, определяться конкретными обстоятельствами, сопровождающими данный случай, в том числе, например, способом введения, возрастом,массой и реакцией отдельного пациента, состоянием, которое лечат, и тяжестью симптомов у пациента. Типичные суточные дозы будут содержать нетоксичные уровни активного соединения данного изобретения примерно от 0,01 мг/кг до, примерно, 50 мг на кг массы тела. Предпочтительно, фармацевтическая композиция представляет стандартную лекарственную форму. Стандартная лекарственная форма сама может представлять капсулу или таблетку,или соответствующее их число. Количество активного ингредиента в стандартной дозе композиции можно варьировать в интервале примерно от 0,1 до, примерно, 1000 мг или больше, в соответствии с конкретным случаем лечения. Можно представить, что возможно осуществить 50 обычные изменения в дозировке, в зависимости от возраста и состояния пациента. Дозировка также будет зависеть от способа введения."Хроническое" состояние означает постепенно ухудшающееся и длительно продолжающееся состояние. Как таковое, такое состояние лечат, когда оно диагностировано, и в ходе болезни лечение продолжают. "Острое" состояние представляет быстрое обострение болезни после периода ремиссии. При остром случае соединение вводят при появлении симптомов и прекращают введение, когда симптомы исчезают. Панкреатит, травматический шок, бронхиальная астма, аллергический ринит и ревматоидный артрит могут представлять как острый случай, так и хронический случай. Таким образом, лечение этих состояний предполагает как острые, так и хронические формы. Септический шок и респираторный дистресс-синдром у взрослых, с другой стороны, являются острыми состояниями, которые лечатся, когда диагностированы. Соединение можно вводить различными путями, включая пероральный, введение аэрозолей, ректальный способ, трансдермальный,подкожный, внутривенный, внутримышечный и интраназальный пути. Фармацевтические композиции изобретения получают путем соединения (например,смешивания) терапевтически эффективного количества соединений изобретения с фармацевтически приемлемым носителем или разбавителем для него. Фармацевтические композиции настоящего изобретения получают известными способами с использованием хорошо известных и легко доступных ингредиентов. При приготовлении композиций настоящего изобретения активный ингредиент обычно следует смешивать с носителем или разбавлять носителем, или заключить его в носитель, который может находиться в форме капсулы, саше,бумажного пакетика или другой емкости. Когда носитель служит в качестве разбавителя, он может представлять твердое, полутвердое или жидкое вещество, которое действует как носитель, или он может находиться в форме таблетки, пилюль, порошков, пастилок, эликсиров,суспензий, эмульсий, растворов, сиропов, аэрозолей (в виде твердого вещества или в жидкой среде) или мазей, содержащих, например, до 10 мас.% активного соединения. Соединения настоящего изобретения предпочтительно вносят в композиции перед введением. Для фармацевтических композиций можно использовать любой подходящий известный носитель. В такой композиции носитель может представлять твердое вещество, жидкость или смесь твердого вещества и жидкости. Твердые формы композиций включают порошки, таблетки и капсулы. Твердый носитель может представлять одно или несколько веществ, которые могут также действовать как корригенты, сма 51 зывающие вещества, солюбилизаторы, суспендирующие агенты, связующие, дезинтеграторы таблеток и инкапсулирующий материал. Таблетки для перорального введения могут содержать подходящие эксципиенты, такие как карбонат кальция, карбонат натрия, лактоза,фосфат кальция, вместе с дезинтегрирующими агентами, такими как маис, крахмал или альгиновая кислота, и/или связующими, например,желатином или аравийской камедью, и смазывающими веществами, такими как стеарат магния, стеариновая кислота или тальк. В порошках носитель представляет тонко измельченное твердое вещество, которое находится в смеси с тонко измельченным активным ингредиентом. В случае таблеток активный ингредиент смешивают в подходящем соотношении с носителем, обладающим необходимыми связующими свойствами, и прессуют, придавая нужную форму и размер. Порошки и таблетки содержат, предпочтительно, примерно от 1 до,примерно, 99 мас.% активного ингредиента,который представляет новое соединение данного изобретения. Подходящими твердыми носителями являются карбонат магния, стеарат магния, тальк, сахар лактоза, пектин, декстрин,крахмал, желатин, трагакант, метилцеллюлоза,натрийкарбоксиметилцеллюлоза, низкоплавкие воски и масло какао. Композиции в форме стерильных жидкостей включают суспензии, эмульсии, сиропы и эликсиры. Активный ингредиент можно растворить или суспендировать в фармацевтически приемлемом носителе, таком как стерильная вода,стерильный органический растворитель или их смесь. Активный ингредиент часто можно растворить в подходящем органическом растворителе, например, в водном пропиленгликоле. Другие композиции можно приготовить путем диспергирования тонко измельченного активного ингредиента в водном растворе крахмала или натрийкарбоксиметилцеллюлозы, или в подходящем масле. Приведенные далее фармацевтические композиции 1-8 являются только поясняющими примерами и не предназначаются никоим образом для ограничения объема изобретения. "Активный ингредиент" обозначает соединение,соответствующее формуле (III), или его фармацевтически приемлемую соль, сольват или пролекарство. Композиция 1. Получают твердые желатиновые капсулы с использованием перечисленных далее ингредиентов. Количество(мг/ капсулу) 5-Гидрокси-7-(5-цианопентил)-9-метил-1,2,3,4-тетрагидрокарбазол-4-карбоксамид Сухой крахмал Стеарат магния Всего 52 Композиция 2. Получают таблетки с использованием перечисленных ниже ингредиентов. Количество(мг/таблетку) 6-(3-(4-Карбоксифенил)проп-1-ил)окси-8 гептил-9-(5-этилфенил)фенил)метилкарбазол-4-карбоксамид Микрокристаллическая целлюлоза Высокодисперсный диоксид кремния Стеариновая кислота Всего Компоненты смешивают и прессуют с образованием таблеток, каждая массой 665 мг. Композиция 3. Получают аэрозольный раствор, содержащий перечисленные далее компоненты. Масса Гидразид 5-(ди-трет-бутоксифосфонил) метокси-7-децил-9-(5-пропилтиофенил) метил-1,2,3,4-тетрагидрокарбазол-4 карбоновой кислоты Этанол Пропеллент 22 (хлордифторметан) Всего Активное соединение смешивают с этанолом и смесь добавляют к части пропеллента 22,охлаждают до -30 С и переносят в заливочное приспособление. Затем требуемое количество загружают в емкость из нержавеющей стали и разбавляют остальным пропеллентом. Затем емкость снабжают клапанными устройствами. Композиция 4. Таблетки, каждая из которых содержит 60 мг активного ингредиента,получают из перечисленных ниже ингредиентов следующим образом. Гидразид 5-(ди-трет-бутоксифосфонил)метокси-7-децил-9-(5-пропилтиофенил)метил 1,2,3,4-тетрагидрокарбазол-4-карбоновой кислоты Крахмал Микрокристаллическая целлюлоза Поливинилпирролидон ( в виде 10% раствора в воде) Натрийкарбоксиметилкрахмал Стеарат магния Тальк Всего Активный ингредиент, крахмал и целлюлозу просеивают через сито 45 меш, США, и тщательно смешивают. С полученным порошком смешивают водный раствор, содержащий Поливинилпирролидон, и смесь затем просеивают через сито 14 меш, США. Полученные таким образом гранулы сушат при 50 С и просеивают через сито 18 меш, США. Затем к гранулам добавляют предварительно просеянные через сито 60 меш, США, натрийкарбоксиметилкрахмал, стеарат магния и тальк и гранулы, после перемешивания, прессуют в таблетки на таблетирующей машине, получая таблетки, каждая массой 150 мг. Композиция 5. Капсулы, каждая из которых содержит 80 мг активного ингредиента,получают следующим образом. 53 5-Этоксикарбонилметокси-8-(5-карбамоилпент-1 ил)-9-(3,5-дипропилфенил)метил-1,2,3,4-тетрагидрокарбазол-4-карбоксамид Крахмал Микрокристаллическая целлюлоза Стеарат магния Всего Активный ингредиент, целлюлозу, крахмал и стеарат магния смешивают, просеивают через сито 45 меш, США, и наполняют твердые желатиновые капсулы смесью в количестве 200 мг. Композиция 6. Суппозитории, каждый из которых содержит 225 мг активного ингредиента, получают из перечисленных ниже ингредиентов следующим образом. 6-Гидрокси-8-(4-(N,N-диэтиламино)бут-1-ил)-9(5-фторфенил) метил-4-карбоксамид 225 мг Глицериды насыщенных жирных кислот 2000 мг Всего 2225 мг Активный ингредиент просеивают через сито 60 меш, США, и суспендируют в глицеридах насыщенных жирных кислот, предварительно расплавленных с использованием минимально необходимого нагрева. Затем смесь выливают в форму для суппозиториев номинальной емкостью 2 г и охлаждают. Композиция 7. Получают, как описано ниже, суспензии, содержащие на каждую 5-мл дозу 50 мг активного ингредиента. 5-(Пропоксикарбонил) метокси-9-циклопентилмети-1,2,3,4-тетрагидрокарбазол-4-карбоксамид 50 мг Натрийкарбоксиметилцеллюлоза 50 мг Сироп 1,25 мл Раствор бензойной кислоты 0,10 мл Корригентq.v. Очищенная вода до общего объема 5 мл Активный ингредиент просеивают через сито 45 меш, США, и смешивают с натрийкарбоксиметилцеллюлозой и сиропом с образованием однородной пасты. Раствор бензойной кислоты, корригент и краситель разбавляют частью воды и добавляют при перемешивании к пасте. Затем добавляют достаточное количество воды для получения требуемого объема. Композиция 8. Композицию для внутривенного вливания можно получить следующим образом. Гидразид 5-(ди-трет-бутоксифосфонил)метокси-7 децил-9-(5-пропилтиофенил)метил-1,2,3,4-тетрагидрокарбазол-4-карбоновой кислоты 100 мг Изотонический физиологический раствор 1000 мл Раствор перечисленных выше ингредиентов обычно вводят субъекту внутривенно со скоростью 1 мл в минуту. Аналитические эксперименты Пример анализа 1 Приведенную далее процедуру хромогенного анализа используют для идентификации и оценки ингибиторов рекомбинантной человеческой секреторной фосфолипазы А 2. Описанный здесь анализ приспособлен для высокообъемного скрининга с использованием 96-луночных титрационных микропланшетов. Общее описание этого метода анализа дается в статье(включена в настоящее в качестве ссылки). Реагенты Буфер для реакции СаСl22 Н 2O (1,47 г/л); КСl (7,455 г/л); Сывороточный бычий альбумин (свободный от жирных кислот) (1 г/л) (Sigma A-7030,продукт Sigma Chemical Co., Сент-Луис, Миссури, США). Трис-НСl (3,94 г/л) рН 7,5 (доводят с помощью NaOH). Буфер для фермента 0,05 NaOAc3H2O, рН 4,5; 0,2 NaCl; рН доводят до 4,5 уксусной кислотой.DTNB - 5,5'-дитиобис-2-нитробензойная кислота. Рацемический дигептаноилтио-РС рацемический 1,2-бис(гептаноилтио)-1,2 дидезокси-sn-глицеро-3-фосфорилхолин. Тритон Х-100 готовят с содержанием 6,249 мг/мл в буфере для реакции, что эквивалентно 10 нМ. Тритон Х-100 является полиоксиэтиленовым неионным детергентом, поставляемым Pierce Chemical Company, 3747 N.Meridian Road, Rockford, Illinois 61101. Реакционная смесь Отмеренный объем рацемического дигептаноилтио-РС, поставляемого в хлороформе с концентрацией 100 мг/мл, переводят в сухое состояние и снова растворяют в 10 мМ водном растворе неионного детергента тритона Х 100. К раствору добавляют буфер для реакции, затем DTNB и получают реакционную смесь. Полученная таким образом реакционная смесь содержит 1 мМ субстрата дигептаноилтио-РС, 0,29 мМ детергента тритона Х-100 и 0,12 мМ DTNB в забуференном водном растворе при рН 7,5. Процедура анализа 1. Добавляют во все лунки 0,2 мл реакционной смеси. 2. Добавляют в соответствующие лунки 10 нл испытуемого соединения (или растворителя "пустышки") и смешивают в течение 20 с. 3. Добавляют в соответствующие лунки 50 нг сФЛА 2 (10 мкл). 4. Инкубируют планшеты при 40 С в течение 30 мин. 5. С помощью автоматических аппаратов для прочтения планшетов считывают поглощение в лунках при 405 нм. Все соединения испытывают трижды. Обычно, испытывают соединения при конечной 55 концентрации 5 нг/мл. Соединения считаются активными, когда они обнаруживают 40% или более высокое ингибирование при сравнении с неингибированными контрольными реакционными смесями при измерении при 405 нм. Отсутствие появления окрашивания при 405 нм служит доказательством ингибирования. Соединения, у которых первоначально обнаружена активность, анализируют повторно для подтверждения их активности, и, если они достаточно активны, определяют значения IС 50. Обычно, значения IС 50 определяют посредством серийного разбавления испытуемого соединения в два раза, так чтобы конечная концентрация в реакционной смеси изменялась от 45 до 0,35 нг/мл. Более сильные ингибиторы требуют значительно большего разбавления. Во всех случаях % ингибирования, генерированного ферментными реакционными смесями, содержащими ингибиторы, относительно контрольных реакционных смесей без ингибитора, измеряют при 405 нм. Каждый образец титруют трижды и для построения графика и вычисления значений IC50 полученные результаты усредняют. IC50 определяют с помощью графика зависимости величины ингибирования от log концентрации в интервале 10-90%. Соединения данного изобретения (примеры 1-19) испытывали по примеру анализа 1 и было найдено, что они эффективны при концентрациях менее 100 мкМ. Пример анализа 2 Метод Самцов морских свинок расы Hartley (500700 г) умерщвляют путем цервикального смещения и их сердца и легкие удаляют целыми и помещают в аэрируемый (95% O2:5% СO2) буфер Кребса. Из паренхимальных сегментов(8x4x25 мм), нарезанных параллельно наружному краю нижних долей легких, иссекают дорсальные плевральные полоски (4x1x25 мм). Две соседние плевральные полоски, полученные из одной доли и представляющие образец одной ткани, соединяют по любому концу и прикрепляют, независимо, к металлическому держателю. Один держатель прикрепляют к датчику силового смещения Grass, модель FTO3C, продукт Grass Medical Instruments Co., Миннесота,США. Изменения изотермического напряжения отображаются на мониторе и на устройстве,регистрирующем температуру (продукт ModularInstruments, Malvern, Пенсильвания). Все ткани помещают в снабженные кожухом 10-мл кюветы для тканей, в которых поддерживается температура 37 С. Кюветы для тканей непрерывно аэрируют, и они содержат модифицированный раствор Кребса следующего состава (миллимоли): NaCl - 118,2; КСl - 4,6; СаСl22 Н 2O - 2,5;MgSO47H2O - 1,2; NaHCO3 - 24,8; КН 2 РO4 - 1,0; и декстроза - 10,0. Плевральные полоски из противоположных долей легкого используют для 56 парных экспериментов. Предварительные результаты, полученные из кривых зависимости напряжения, показывают, что оптимальным является остаточное напряжение от 800 мг. Тканям дают прийти в состояние равновесия в течение 45 мин, в течение которых жидкость в кюветах периодически заменяют. Кривые зависимости ответная реакция - кумулятивная концентрация Сначала на ткани воздействуют 3 раза КСl(40 мМ), чтобы проверить жизнестойкость тканей и получить стойкую ответную реакцию. После регистрации максимальной реакции на КСl ткани промывают и дают возможность вернуться в исходное состояние перед следующим воздействием. Кривые зависимости ответной реакции от кумулятивной концентрации получают на плевральных полосках путем полуlog10 инкрементного увеличения концентрации агониста (сФЛА 2) в тканевой ванне, в то время как в контакте с тканями остается предыдущая концентрация (см. выше, ссылка 1). Концентрацию агониста увеличивают после достижения плато сжатия, выведенного предыдущей концентрацией. Кривую зависимости от концентрации получают для каждой ткани. Чтобы свести к минимуму колебания между тканями, полученными от разных животных,реакции сжатия выражают в виде процента от максимальной реакции, полученной при последнем воздействии КСl. При исследовании действия различных лекарственных средств на сократительное действие сФЛА 2 соединения и соответствующие носители для них добавляют к тканям за 30 мин до начала получения кривых зависимости ответной реакции от концентрации. Статистический анализ Данные от разных экспериментов объединяют и представляют в виде процента максимальной реакции на КСl (среднеесркв. откл.). Чтобы оценить вызванные лекарственным средством сдвиги вправо на кривых зависимости ответной реакции от концентрации, кривые анализируют одновременно с использованием статистических методов нелинейного моделирования, подобных методам, описанным Waud(1976), уравнение 26, с. 163 (ссылка 2). Модель включает четыре параметра: максимальную реакцию ткани, которую считают одной и той же для каждой кривой, ED50 для контрольной кривой, крутизну кривых и рА 2 - концентрацию антагониста, которая требует двукратного возрастания содержания агониста для достижения эквивалентной реакции. С использованием статистических методов нелинейного моделирования, подобных методам, описанным Waud(1976), уравнение 27, с. 164 (ссылка 2), определяют, что наклон Schild равен 1. Наклон Schild,равный 1, показывает, что модель соответствует предположениям о конкурентном антагонисте; следовательно, рА 2 можно интерпретировать 57 как кажущуюся Кв- константу диссоциации ингибитора. Чтобы оценить вызванное лекарственным средством подавление максимальных реакций,определяют сФЛА 2-реакции (10 нг/мл) в отсутствие и в присутствии лекарственного средства и вычисляют процент подавления для каждой пары тканей. Ссылка 1. Van, J.M., Cumulative doseresponse curves. II. Technique for the making ofCellular Pharmacology, eds. Narahashi, Bianchi, 1: 145-178, 1976. Соединения данного изобретения (примеры 1-19) испытывали по примеру анализа 2, и было найдено, что они эффективны при концентрациях ниже 20 мкМ. Пример анализа 3 Анализ сФЛА 2 трансгенных мышей Материалы и методы Мыши, используемые при этих исследованиях, являются трансгенными мышами гемизиготной линии 2608a (Fox et al., 1996) в возрасте 6-8 недель, стимулированными ZnSO4. Трансгенные мыши из этой линии экспрессируют человеческую сФЛА 2 в печени и других тканях, и,как правило, уровень человеческой сФЛА 2 в их системе кровообращения достигает приблизительно 17310 нг/мл при максимальной стимуляции ZnSO4 (Fox et al., 1996). Мышей содержат при постоянной влажности и температуре и дают им пищу и воду без ограничений. Освещение в клетке поддерживают в режиме 12-часового свето-темнового цикла, и все эксперименты осуществляют в одно и то же время суток рано утром в светлое время. При испытании с внутривенным введением соединения или носитель вводят в виде болюса IV в хвостовую вену в объеме 0,15 мл. Носитель состоит из 1-5% диметилсульфоксида, 15% этанола и 10-30% полиэтиленгликоля 300 в Н 2O; концентрацию этих ингредиентов подгоняют в соответствии с растворимостью соединения. У мышей берут кровь ретроорбитально перед введением лекарственного средства или носителя и через 30 мин, 2 и 4 ч после введения. Для каждой дозы берут три-шесть мышей. Каталитическую активность ФЛА 2 в сыворотке анализируют с помощью модифицированного анализа смешанного мицеллообразования с фосфатидилхолином и дезоксихолином (Foz, etal., 1996, Schadlich, et al., 1987) с использованием 3 мМ дезоксихолата натрия и 1 мМ 1 пальмитоил-2-олеоил-sn-глицеро-3-фосфохолина. В случае испытаний с пероральным введением соединения растворяют в смеси 1-5% этанол/10-30% полиэтиленгликоль 300 в Н 2O или 58 суспендируют в 5% декстрозе в Н 2O и вводят перорально через зонд. Сыворотку получают из ретроорбитальной крови и анализируют на каталитическую активность ФЛА 2, как описано выше. Ссылки.Schadlich, H.R., M. Buchler, and H.G. Beger,1987, J. Clin. Chem. Clin. Biochem., 25, 505. Соединения данного изобретения испытывали по примеру анализа 3, и было найдено, что они эффективны. Хотя настоящее изобретение проиллюстрировано выше некоторыми конкретными вариантами его воплощения, не имеется в виду, что этими конкретными примерами должен ограничиваться объем изобретения, описанный в прилагаемой формуле изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение соединения формулы (III)R2' представляет собой -ОН, -O(CH2)tR5,где R5 представляет собой CN или фенил и t равно 1-5, или -(ОСН 2)-(кислотную группу); или его фармацевтически приемлемой соли, рацемата, сольвата, таутомера, оптического изомера или пролекарственного производного; для ингибирования опосредуемого сФЛА 2 высвобождения жирных кислот. 2. Применение соединения формулы (I)-O(CH2)mR5, где R5 представляет собой фенил иR4 представляет собой фенил; или его фармацевтически приемлемая соль, рацемат, оптический изомер, сольват, таутомер или пролекарственное производное; для ингибирования опосредуемого сФЛА 2 высвобождения жирных кислот. 59 3. Применение по п.2, где соединение представляет собой 4-[(9-бензил-4-карбамоил-1,2,3,4-тетрагидрокарбазол-6-ил)окси]масляную кислоту; 3-[(9-бензил-4-карбамоил-1,2,3,4-тетрагидрокарбазол-6-ил)окси]пропилфосфоновую кислоту; 2-[(9-бензил-4-карбамоил-1,2,3,4-тетрагидрокарбазол-6-ил)окси]метилбензойную кислоту; 3-[(9-бензил-4-карбамоил-7-н-октил-1,2,3,4-тетрагидрокарбазол-6-ил)окси]пропилфосфоновую кислоту; 4-[(9-бензил-4-карбамоил-7-этил-1,2,3,4 тетрагидрокарбазол-6-ил)окси]масляную кислоту; 3-[(9-бензил-4-карбамоил-7-этил-1,2,3,4 тетрагидрокарбазол-6-ил)окси]пропилфосфоновую кислоту; 3-[(9-бензил-4-карбамоил-7-этил-1,2,3,4 тетрагидрокарбазол-6-ил)окси]пропилфосфоновую кислоту;[9-бензил-4-карбамоилкарбазол-5-ил]оксиуксусную кислоту или его фармацевтическую соль, рацемат,сольват, таутомер, оптический изомер или пролекарственное производное. 4. Способ селективного ингибирования сФЛА 2 у млекопитающего, нуждающегося в таком лечении, включающий введение указанному млекопитающему фармацевтически эффективного количества соединения формулы(III), указанного в п.1. 5. Способ по п.4, в котором млекопитающим является человек. 6. Способ селективного ингибирования сФЛА 2 у млекопитающего, нуждающегося в таком лечении, включающий введение указанному млекопитающему фармацевтически эффективного количества соединения формулыR4 представляет фенил; или его фармацевтически приемлемой соли, рацемата, оптического изомера, таутомера,сольвата или пролекарственного производного. 7. Способ по п.6, в котором млекопитающим является человек. 8. Способ селективного ингибирования сФЛА 2 у млекопитающего, нуждающегося в таком лечении, включающий введение указанному млекопитающему фармацевтически эффективного количества соединения формулы(III) в количестве, достаточном для ингибирования опосредуемого сФЛА 2 высвобождения жирной кислоты и, посредством этого, ингибирования или предотвращения метаболизма арахидоновой кислоты и его вредных продуктов. 9. Способ по п.8, где млекопитающим является человек. 10. Применение соединения формулы (III)
МПК / Метки
МПК: A61P 11/00, A61K 31/403
Метки: соединения, трициклические, замещенные
Код ссылки
<a href="https://eas.patents.su/30-3992-zameshhennye-triciklicheskie-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные трициклические соединения</a>
Предыдущий патент: Производные 2-аминопиридинов, способ ингибирования синтазы оксида азота, фармацевтические композиции и способы лечения
Следующий патент: Сульфонамиды для лечения заболеваний, связанных с эндотелином
Случайный патент: Способ увеличения производительности установки для получения мочевины