Биспиперидины в качестве противотромботических агентов, их применение, способ их получения (варианты), промежуточные продукты и терапевтическая композиция
Номер патента: 3674
Опубликовано: 28.08.2003
Авторы: Жибуло Тьерри, Йю Кристоф, Лезюр Брижитт, Анри Маргерит
Формула / Реферат
1. Соединения формулы
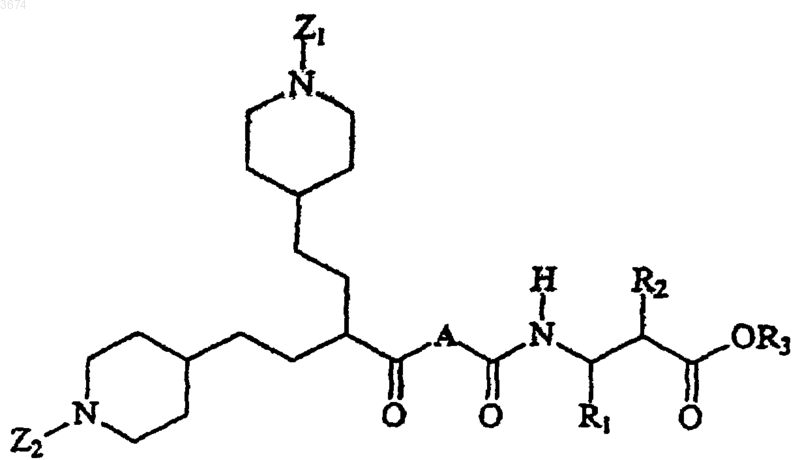
Формула I
в которой
i) R1 либо выбирают из
C1-C4-алкильной, C3-C12-моно- или бициклической циклоалкильной, C2-C4-алкенильной или C2-C4-алкинильной групп, причем эти группы необязательно замещены группами, выбранными из галогенов и гидроксильной группы;
моно-, би- или трициклических C6-C14-арильных групп;
гетероарильных групп, выбранных из пиридильной, тиенильной, фурильной, хинолильной, бензодиоксанильной, бензодиоксолильной, бензотиенильной, бензофурильной и пиразинильной групп;
фенил(C1-C4)-алкильной и нафтил(C1-C4)-алкильной групп, необязательно замещенных арильным кольцом;
причем арильные и гетероарильные группы могут быть замещены одной или более группами, независимо выбранными из галогенов, C1-C4-алкильной, трифторметильной, C1-C4-алкилтио-, C1-C4-алкилсульфонильной, C1-C4-алкилоксильной групп, нитрогруппы и групп -COOR, -CH2COOR или -O-CH2-COOR, причем R представляет собой C1-C4-алкильную группу;
групп формулы
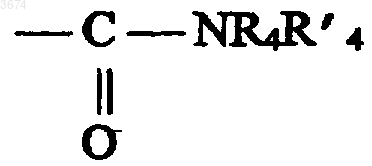
в которой R4 и R'4 выбирают из C1-C8-алкильной и моно- или полициклических C3-C12-циклоалкильных групп, причем эти группы необязательно замещены группами, выбранными из галогенов и гидроксильной группы, R'4 также может представлять собой водород или в качестве альтернативы R4 и R'4 вместе образуют тетраметиленовую или пентаметиленовую группу, причем эти последние две группы сами могут быть замещены C6-C14-арильным или (C6-C14)арил(C1-C4)алкильным остатком;
групп формулы
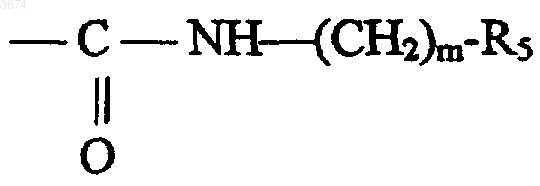
в которой m представляет собой число от 1 до 4, a R5 выбирают из фенильной, метоксифенильной, индолильной, бензодиоксолильной, бензодиоксанильной, бензотиенильной и бензофурильной групп;
и R2 представляет собой водород;
ii) либо R1 представляет собой водород, a R2 выбирают из
групп формулы
-NH-CO-R6,
причем R6 выбирают из C1-C4-алкоксильной, C3-C7-циклоалкоксильной, бензилоксильной, метоксифенильной, диметоксифенильной, бензодиоксолильной и бензодиоксанильной групп; и
из групп формулы
-NH-SO2-R7,
причем R7 выбирают из
C1-C5-алкильных групп, необязательно замещенных одной или более группами, выбранными из галогенов, гидроксильных групп и трифторметильной группы;
C2-C5-алкенильных групп;
моно- или бициклических C3-C12-циклоалкильных групп;
моно-, би- или трициклических C6-C14-арильных групп;
гетероарильных групп, выбранных из пиридильной, фурильной, тиенильной, хинолильной, бензодиоксанильной, бензодиоксолильной, изоксазолильной, бензодиоксинильной, бензотиенильной, тиазолильной, пиразолильной, бензофурильной и бензотиазолильной групп;
фенил(C1-C4)-алкильной и нафтил(C1-C4)-алкильной групп;
и групп формулы
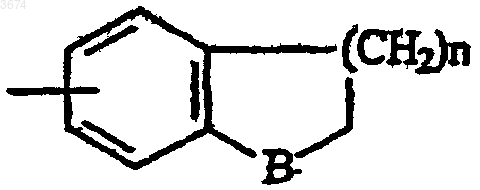
в которой n = 1, 2 или 3, а В выбирают из -CH2-, O или S и -NH-,
причем арильные или гетероарильные группы необязательно замещены одной или более группами, независимо выбранными из галогенов, C1-C4-алкильной, C3-C7-циклоалкильной, трифторметильной групп, C1-C4-алкилтиогруппы, C1-C4-алкилоксильной, C1-C4-алкилсульфонильной групп, нитрогруппы, ди((C1-C4)алкил)аминогруппы и групп -COOR, -CH2COOR или -O-CH2COOR, a R представляет собой C1-C4-алкильную группу, фенильную и нафтильную группы и гетероарильные группы, выбранные из тиенильной, фурильной и пиридильной групп;
iii) R3 выбирают из атома водорода, C1-C4-алкильной группы и фенил(C1-C4)-алкильной группы;
iv) A выбирают из групп -NH-CHR10-, -NH-CHR10-CH2- и
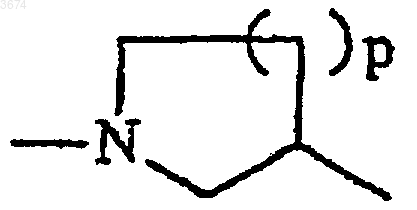
где p = 1 или 2,
R10 выбирают из водорода, C1-C4-алкильной группы и C6-C14-арильной группы; и
v) Z1 и Z2 представляют собой водород или аминозащитную группу;
или их аддитивные соли с фармацевтически приемлемыми кислотами.
2. Соединения по п.1 формулы
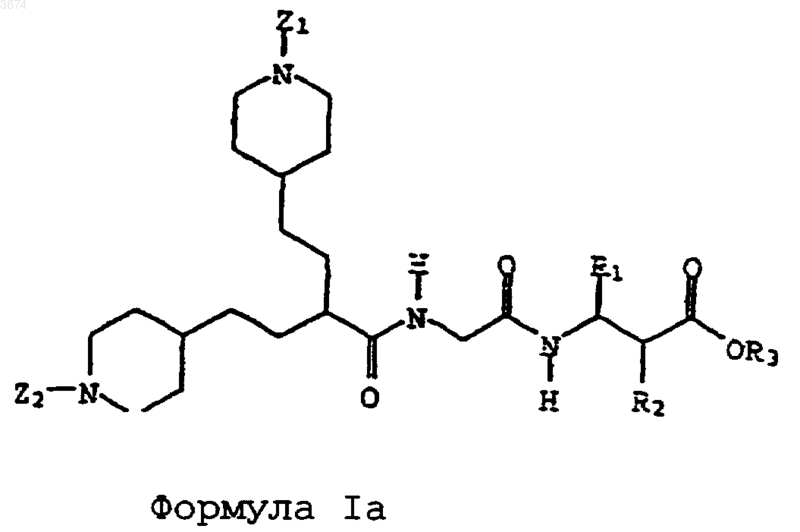
в которой
i) R1 либо выбирают из
C1-C4-алкильной, C3-C12-моно- или бициклической циклоалкильной, C2-C4-алкенильной или C2-C4-алкинильной групп, причем эти группы необязательно замещены группами, выбранными из галогенов и гидроксильной группы;
моно-, би- или трициклических C6-C14-арильных групп;
гетероарильных групп, выбранных из пиридильной, тиенильной, фурильной, хинолильной, бензодиоксанильной, бензодиоксолильной, бензотиенильной, бензофурильной и пиразинильной групп;
фенил(C1-C4)-алкильной и нафтил(C1-C4)-алкильной групп, необязательно замещенных арильным кольцом;
причем арильные и гетероарильные группы могут быть замещены одной или более группами, независимо выбранными из галогенов, C1-C4-алкильной, трифторметильной, C1-C4-алкилтио-, C1-C4-алкилсульфонильной, C1-C4-алкилоксильной групп, нитрогруппы и групп -COOR, -CH2COOR или -O-CH2-COOR, причем R представляет собой C1-C4-алкильную группу;
групп формулы
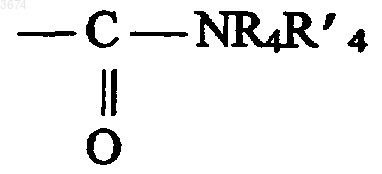
в которой R4 и R'4 выбирают из C1-C8-алкильной и моно- или полициклических C3-C12-циклоалкильных групп, причем эти группы необязательно замещены группами, выбранными из галогенов и гидроксильной группы, R'4 также может представлять собой водород или в качестве альтернативы R4 и R'4 вместе образуют тетраметиленовую или пентаметиленовую группу, причем эти последние две группы сами могут быть замещены, в частности, C6-C14-арильным или (C6-C14)арил(C1-C4)алкильным остатком;
групп формулы
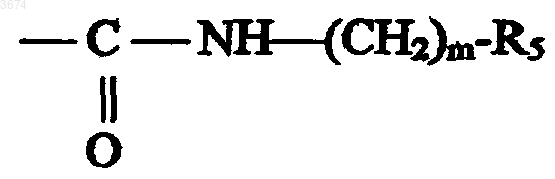
в которой m представляет собой число от 1 до 4, a R5 выбирают из фенильной, метоксифенильной, индолильной, бензодиоксолильной, бензодиоксанильной, бензотиенильной и бензофурильной групп;
и R2 представляет собой водород;
ii) либо R1 представляет собой водород, a R2 выбирают из групп формулы
-NH-CO-R6,
причем R6 выбирают из C1-C4-алкоксильной, C3-C7-циклоалкоксильной, бензилоксильной, метоксифенильной, диметоксифенильной, бензодиоксолильной и бензодиоксанильной групп;
и из групп формулы
-NH-SO2-R7,
причем R7 выбирают из
C1-C5-алкильных груяя, необязательно замещенных одной или более группами, выбранными из галогенов, гидроксильных групп и трифторметильной группы;
моно- или бициклических C3-C12-циклоалкильных групп;
моно-, би- или трициклических C6-C14-арильных групп;
гетероарильных групп, выбранных из пиридильной, тиенильной, хинолильной, бензодиоксанильной, бензодиоксолильной и изоксазолильной групп;
фенил(C1-C4)-алкильной и нафтил(C1-C4)-алкильной групп;
и групп формулы
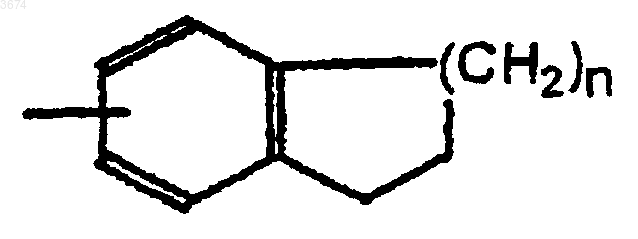
в которой n = 1, 2 или 3,
причем арильная или гетероарильная группы необязательно замещены одной или более группами, независимо выбранными из галогенов, C1-C4-алкильной, трифторметильной, C1-C4-алкилтиогруппы, C1-C4-алкилоксильной, C1-C4-алкилсульфонильной группы, нитрогруппы, ди((C1-C4)алкил)аминогруппы и групп -COOR, -CH2COOR или -O-CH2COOR, причем R представляет собой C1-C4-алкильную группу;
iii) R3 выбирают из атома водорода, C1-C4-алкильной группы и фенил (C1-C4)-алкильной группы;
iv) и Z1 и Z2 представляют собой водород или аминозащитную группу;
или их аддитивные соли с фармацевтически приемлемыми кислотами.
3. Соединения по п.1, в которых R1 представляет собой H, a R2 представляет собой группу формулы -NH-SO2-R7.
4. Соединения по п.3, в которых R7 выбирают из нафтильной, замещенной нафтильной, фенилтиенильной и бифенильной групп.
5. Соединения по п.1, которые представляют собой
этил(2S)-2-[(2-нафтилсульфонил)амино]-3-{[2-({4-(4-пиперидил)-2-[2-(4-пиперидил)этил]бутаноил}амино)ацетил]амино}пропаноат;
3-(1,3-бензодиоксол-5-ил)-3-{[2-({4-(4-пиперидил)-2-[2-(4-пиперидил)этил]бутаноил}амино)ацетил]амино}пропановую кислоту;
2-[(фенилсульфонил)амино]-3-{[2-({4-(4-пиперидил)-2-[2-(4-пиперидил)этил]бутаноил}амино)ацетил]амино}пропановую кислоту;
(2S)-2-[(2-нафтилсульфонил)амино]-3-{[2-({4-(4-пиперидил)-2-[2-(4-пиперидил)этил]бутаноил}амино)ацетил]амино}пропановую кислоту;
2-[([1,1'-бифенил]-4-илсульфонил)амино]-3-{[2-({4-(4-пиперидил)-2-[2-(4-пиперидил)этил]бутаноил}амино)ацетил]амино}пропановую кислоту;
2-[(1-нафтилсульфонил)амино]-3-{[2-({4-(4-пиперидил)-2-[2-(4-пиперидил)этил]бутаноил}амино)ацетил]амино}пропановую кислоту;
2-[(2-тиенилсульфонил)амино]-3-{[2-({4-(4-пиперидил)-2-[2-(4-пиперидил)этил]бутаноил}амино)ацетил]амино}пропановую кислоту;
(2S)-2-{[(6-метокси-2-нафтил)сульфонил]амино}-3-{[2-({4-(4-пиперидил)-2-[2-(4-пиперидил)этил]бутаноил}амино)ацетил]амино}пропановую кислоту;
2-[(мезитилсульфонил)амино]-3-{[2-({4-(4-пиперидил)-2-[2-(4-пиперидил)этил]бутаноил}амино)ацетил]амино}пропановую кислоту;
2-{[(4-метилфенил)сульфонил]амино}-3-{[2-({4-(4-пиперидил)-2-[2-(4-пиперидил)этил]бутаноил}амино)ацетил]амино}пропановую кислоту;
2-({[3-(трифторметил)фенил]сульфонил}амино)-3-{[2-({4-(4-пиперидил)-2-[2-(4-пиперидил)этил]бутаноил}амино)ацетил]амино}пропановую кислоту;
2-{[(3-нитрофенил)сульфонил]амино}-3-{[2-({4-(4-пиперидил)-2-[2-(4-пиперидил)этил]бутаноил}амино)ацетил]амино}пропановую кислоту;
2-{[(3,5-диметил-4-изоксазолил)сульфонил]амино}-3-{[2-({4-(4-пиперидил)-2-[2-(4-пиперидил)этил]бутаноил}амино)ацетил]амино}пропановую кислоту;
2-({[5-(диметиламино)-1-нафтил] сульфонил}амино)-3-{[2-({4-(4-пиперидил)-2-[2-(4-пиперидил)этил]бутаноил}амино)ацетил]амино}пропановую кислоту;
2-{[(6,7-диметокси-2-нафтил)сульфонил]амино} -3-{[2-({4-(4-пиперидил)-2-[2-(4-пиперидил)этил]бутаноил}амино)ацетил]амино}пропановую кислоту;
2-[(3-пиридилсульфонил)амино]-3-{[2-({4-(4-пиперидил)-2-[2-(4-пиперидил)этил]бутаноил}амино)ацетил]амино} пропановую кислоту;
2-[(1,3-бензодиоксол-5-илсульфонил)амино]-3-{[2-({4-(4-пиперидил)-2-[2-(4-пиперидил)этил]бутаноил}амино)ацетил]амино}пропановую кислоту;
2-[(2,3-дигидро-1,4-бензодиоксин-6-илсульфонил)амино]-3-{[2-({4-(4-пиперидил)-2-[2-(4-пиперидил)этил]бутаноил}амино)ацетил]амино}пропановую кислоту;
2-[(1-бензотиофен-2-илсульфонил)амино]-3-{[2-({4-(4-пиперидил)-2-[2-(4-пиперидил)этил]бутаноил}амино)ацетил]амино}пропановую кислоту;
2-{[(2,5-диметил-3-фурил)сульфонил]амино}-3-{[2-({4-(4-пиперидил)-2-[2-(4-пиперидил)этил]бутаноил}амино)ацетил]амино}пропановую кислоту;
2-{[(4-фтор-1-нафтил)сульфонил]амино}-3-{[2-({4-(4-пиперидил)-2-[2-(4-пиперидил)этил]бутаноил}амино)ацетил]амино}пропановую кислоту;
2-{[(4-хлор-1-нафтил)сульфонил]амино}-3-{[2-({4-(4-пиперидил)-2-[2-(4-пиперидил)этил]бутаноил}амино)ацетил]амино}пропановую кислоту;
2-[(1-бензофуран-2-илсульфонил)амино]-3-{[2-({4-(4-пиперидил)-2-[2-(4-пиперидил)этил]бутаноил}амино)ацетил]амино}пропановую кислоту;
2-[(2,3-дигидро-1H-инден-5-илсульфонил)амино]-3-{[2-({4-(4-пиперидил)-2-[2-(4-пиперидил)этил]бутаноил}амино)ацетил]амино}пропановую кислоту;
2-{[(5-фенил-2-тиенил)сульфонил]амино}-3-{[2-({4-(4-пиперидил)-2-[2-(4-пиперидил)этил]бутаноил}амино)ацетил]амино}пропановую кислоту;
2-[(5,6,7,8-тетрагидро-2-нафталенилсульфонил)амино]-3-{[2-({4-(4-пиперидил)-2-[2-(4-пиперидил)этил]бутаноил}амино)ацетил]амино}пропановую кислоту;
2-[(2-нафтилсульфонил)амино]-3-{[3-({4-(4-пиперидил)-2-[2-(4-пиперидил)этил]бутаноил}амино)пропаноил]амино}пропановую кислоту;
(2R)-2-[(2-нафтилсульфонил)амино]-3-{[2-({4-(4-пиперидил)-2-[2-(4-пиперидил)этил]бутаноил}амино)ацетил]амино}пропановую кислоту,
или их аддитивные соли с фармацевтически приемлемыми кислотами.
6. Способ получения соединений формулы (I) по п.1 посредством
a) проведения реакции кислоты формулы
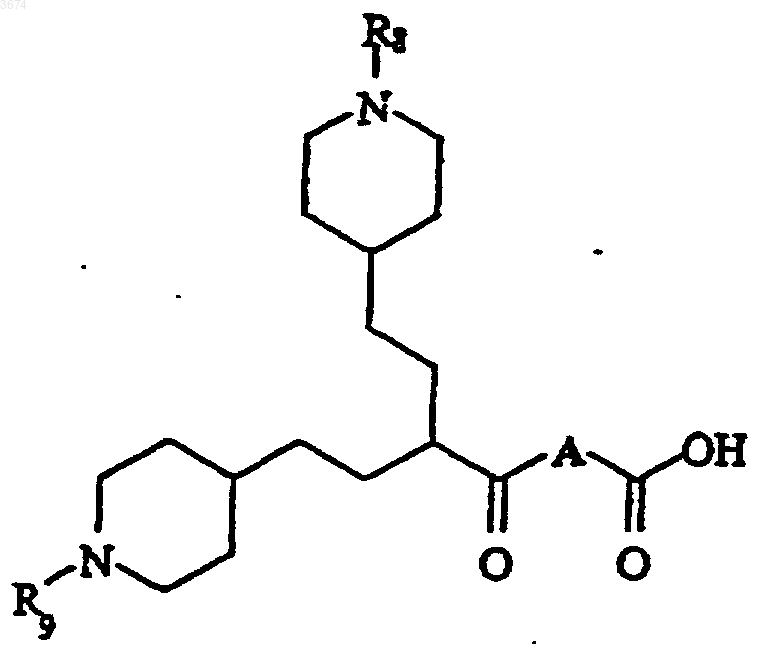
Формула II
в которой R8 и R9 представляют собой защитные группы, с амином формулы
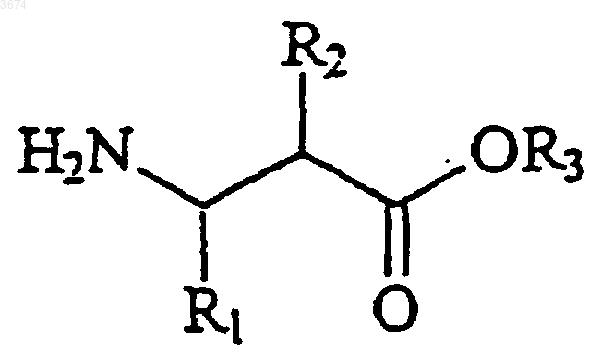
Формула III
с получением соединений формулы (Ib)
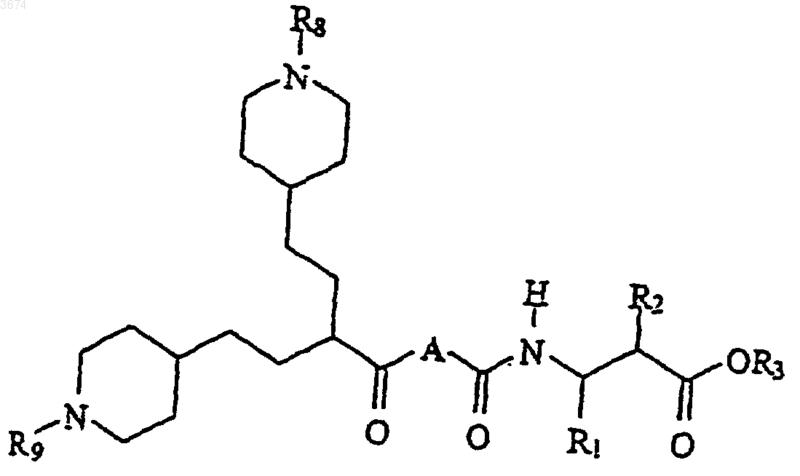
Формула Ib
b) необязательно, преобразования группы R2 в другую группу R2 и
c) необязательно, удаления защитных групп.
7. Способ получения соединений формулы (I) по п.1 посредством
a) проведения реакции кислоты формулы
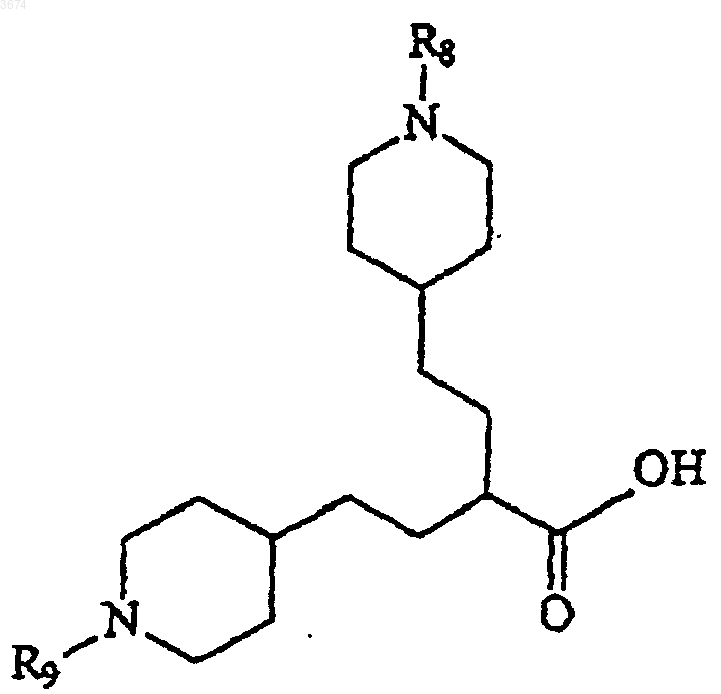
Формула IV
в которой R8 и R9 представляют собой защитные группы, с амином формулы
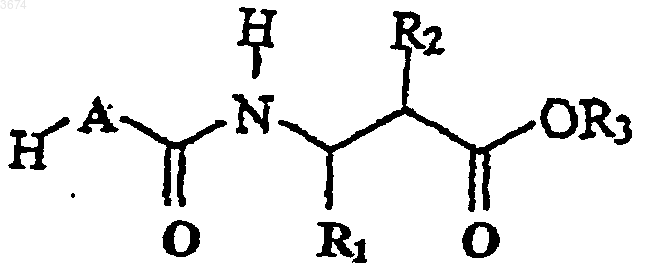
Формула V
с получением соединений формулы (Ib)
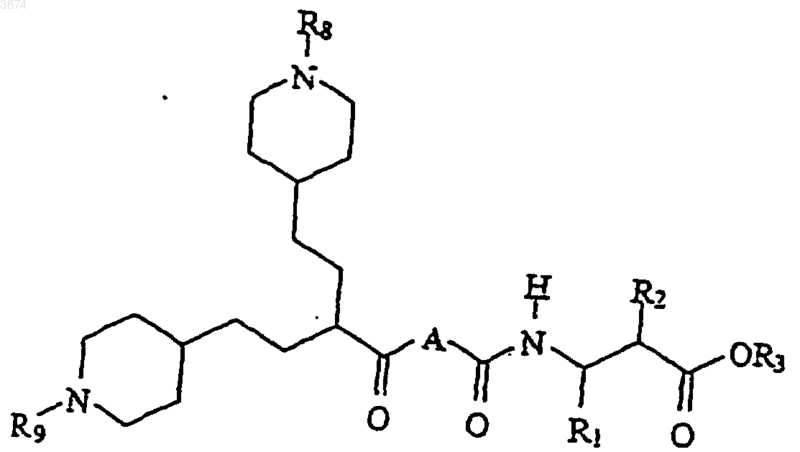
Формула Ib
b) необязательно, преобразования группы R2 в другую группу R2 и
c) необязательно, удаления защитных групп.
8. Терапевтическая композиция, включающая в качестве активного компонента соединение по п.1.
9. Применение соединения по п.1 для изготовления антитромботического лекарственного препарата.
10. Способ ингибирования связывания фибриногена с тромбоцитами крови у млекопитающего, включающий введение этому млекопитающему эффективного количества соединения по п.1.
11. Способ ингибирования агрегации тромбоцитов крови пациента, включающий введение этому пациенту эффективного количества соединения по п.1.
12. Способ лечения тромбоза у пациента, включающий введение этому пациенту эффективного количества соединения по п.1.
13. Способ предотвращения тромботического риска у пациента, включающий введение этому пациенту эффективного количества соединения по п.1.
14. Соединения формулы
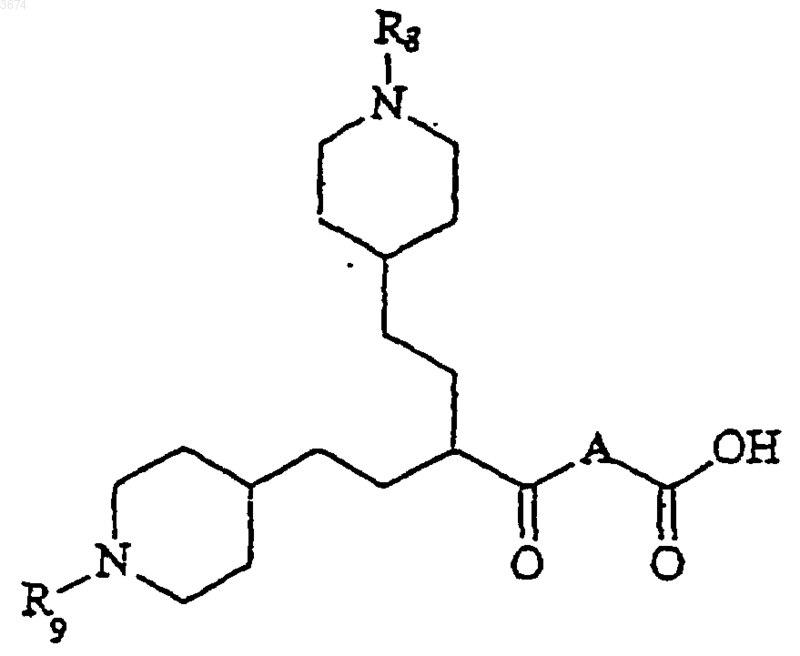
Формула II
в которой R8 и R9 представляют собой защитные группы, а А имеет значение, указанное в п.1.
15. Соединения формулы
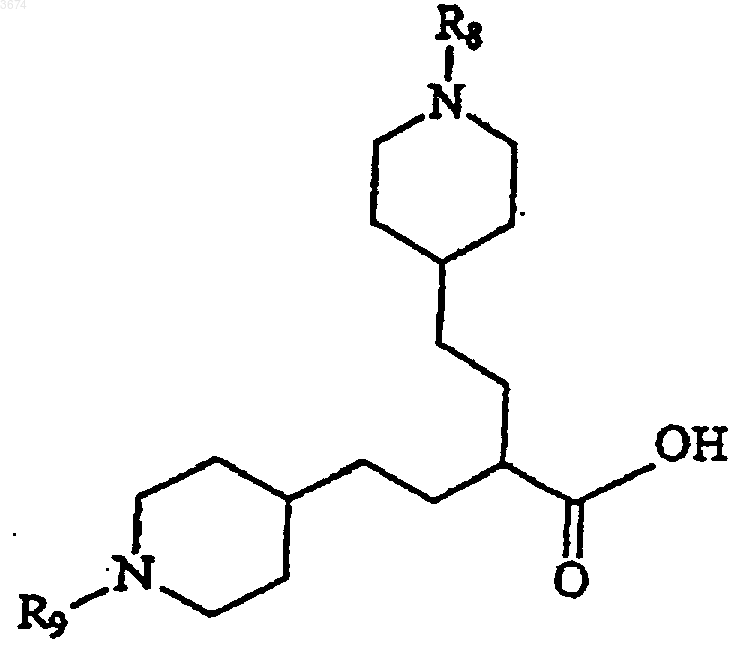
Формула IV
в которой R8 и R9 представляют собой защитные группы.
Текст
1 Настоящее изобретение касается новых соединений, которые являются ингибиторами связывания фибриногена с рецепторами тромбоцитов Gp II/IIIa и которые можно применять в терапии в качестве противотромботических агентов. При патологических процессах, ведущих к образованию тромба (сгустка), а затем к его увеличению, ключевым этапом является агрегация тромбоцитов, поскольку именно она ведет к тому, что это явление становится опасным. Конкретно, с начала образования тромба, в частности, в артериальных кровеносных сосудах,в результате нескольких независимых друг от друга биохимических реакций происходит агрегация все более возрастающего количества тромбоцитов, в результате превращения растворимого фибриногена в нерастворимые фибриновые волокна, что ведет к увеличению размера массы тромбоцитов, вначале в том месте, где произошло патологическое изменение артериального сосуда, а затем эта масса все более заполняет просвет сосуда. В этом механизме агрегации тромбоцитов активация рецепторов Gp IIb/IIIa является источником усиления агрегации тромбоцитов. Фибриноген, который может связываться с помощью двух своих димеров с этими рецепторами, усиливает связывание тромбоцитов между собой и таким образом вызывает образование массы тромбоцитов, формирующей тромб, в месте разрыва атеросклеротической бляшки. Этот механизм агрегации тромбоцитов особенно активен при всех артериальных тромбозах, независимо от того, появляются ли они во время проведения операции на сосудах сердца (чрескожная пластическая операция на сосудах, выполняющаяся через просвет сосуда; введение стентов), во время операции на сердце(аортокоронарное шунтирование; операция на сердечных клапанах), во время острых болезней сердца (инфаркт миокарда, нестабильная стенокардия, острые коронарные синдромы и т.п.),или во время церебральной ишемии, или, наконец, во время ишемии миокарда, которые могут осложнить проведение противотромботического лечения. Уменьшение или предотвращение активации тромбоцитов, находящихся в контакте с поврежденной антисклеротической бляшкой,таким образом, представляет собой новый и эффективный терапевтический подход к лечению тромбоза, в частности артериального тромбоза, а, следовательно, эффективный способ предотвращения острых коронарных синдромов, включая нестабильную стенокардию и инфаркт миокарда. Соединения, которые ингибируют связывание фибриногена с его рецепторами, описаны ЕР-А-0478362 и в J. Med. Chem., 1995, 38, 3332. 2 Настоящее изобретение направлено на создание новых конкурентных ингибиторов связывания фибриногена с рецепторами Gp IIb/IIIa. Настоящее изобретение направлено также на получение соединений, которые можно вводить пероральным путем, что позволяет обеспечить их пролонгированное действие и избежать риска кровотечения. Одним из объектов настоящего изобретения являются соединения общей формулы (I)C1-C4-алкильной, С 3-C12-моно- или бициклической циклоалкильной, С 2-С 4-алкенильной или С 2-С 4-алкинильной групп, причем эти группы необязательно замещены группами, выбранными из галогенов и гидроксильной группы; моно-, би- или трициклических С 6-С 14 арильных групп; гетероарильных групп, выбранных из пиридильной, тиенильной, фурильной, хинолильной, бензодиоксанильной, бензодиоксолильной,бензотиенильной, бензофурильной и пиразинильной групп; фенил(С 1-С 4)-алкильной и нафтил(С 1-С 4)алкильной групп, необязательно замещенных арильным кольцом; причем арильные и гетероарильные группы могут быть замещены одной или более группами, независимо выбранными из галогенов, С 1 С 4-алкильной,трифторметильной,С 1-С 4 алкилтио-, С 1-С 4-алкилсульфонильной, C1-C4 алкилоксильной групп, нитрогруппы и групп в которой R4 и R'4 выбирают из C1-C8-алкильной и моно- или полициклических С 3-С 12-циклоалкильных групп, причем эти группы необязательно замещены группами, выбранными из галогенов и гидроксильной группы, R'4 также может представлять собой водород, или в качестве альтернативы R4 и R'4 вместе образуют тетраметиленовую или пентаметиленовую группу,причем эти последние две группы сами могут быть замещены, в частности С 6-С 14-арильным или (C6-C14)арил(C1-С 4)-алкильным остатком; групп формулы 3 в которой m представляет собой число от 1 до 4,а R5 выбирают из фенильной, метоксифенильной, индолильной, бензодиоксолильной, бензодиоксанильной, бензотиенильной и бензофурильной групп; иR2 выбирают из групп формулы-NH-SO2-R7,причем R7 выбирают из С 1-С 5-алкильных групп, необязательно замещенных одной или более группами, выбранными из галогенов, гидроксильных групп и трифторметильной группы; С 2-С 5-алкенильных групп; моно- или бициклических С 3-С 12-циклоалкильных групп; моно-, би- или трициклических С 6-С 14 арильных групп; гетероарильных групп, выбранных из пиридильной, фурильной, тиенильной, хинолильной, бензодиоксанильной, бензодиоксолильной,изоксазолильной, бензодиоксинильной, бензотиенильной, тиазолильной, пиразолильной, бензофурильной и бензотиазолильной групп; фенил(C1-C4)-алкильной и нафтил(С 1-С 4)алкильной групп; и групп формулы в которой n = 1, 2 или 3, а В выбирают из -CH2-,О или S и -NH-,причем арильные или гетероарильные группы необязательно замещены одной или более группами, независимо выбранными из галогенов, С 1-С 4-алкильной, С 3-С 7-циклоалкильной,трифторметильной групп,C1-C4-алкилтиогруппы, С 1-С 4-алкилоксильной, C1-C4-алкилсульфонильной групп, нитрогруппы, диС 1 С 4)алкил)аминогруппы и группiii) R3 выбирают из атома водорода, С 1-С 4 алкильной группы и фенил(C1-C4)-алкильной группы;iv) А выбирают из групп -NH-CHR10-, -NHCHR10-СН 2- иv) и Z1 и Z2 представляют собой водород или аминозащитную группу; и их аддитивные соли с фармацевтически приемлемыми кислотами. Одна из конкретных групп соединений формулы (I) представлена соединениями формулы (Iа)R1 либо выбирают из С 1-С 4-алкильной, С 3-С 12-моно- или бициклической циклоалкильной, С 2-С 4-алкенильной или С 2-С 4-алкинильной групп, причем эти группы необязательно замещены группами, выбранными из галогенов и гидроксильной группы; моно-, би- или трициклической С 6-С 14 арильных групп; гетероарильных групп, выбранных из пиридильной, тиенильной, фурильной, хинолильной, бензодиоксанильной, бензодиоксолильной,бензотиенильной, бензофурильной и пиразинильной групп; фенил(С 1-С 4)-алкильной и нафтил(С 1-С 4)алкильной групп, необязательно замещенных арильным кольцом; причем арильные и гетероарильные группы могут быть замещены одной или более группами, независимо выбранными из галогенов, С 1 С 4-алкильной,трифторметильной,С 1-С 4 алкилтио-, С 1-С 4-алкилсульфонильной, C1-C4 алкилоксильной групп, нитрогруппы и групп в которой R4 и R'4 выбирают из C1-C8-алкильной и моно- или полициклических С 3-С 12-циклоалкильных групп, причем эти группы необязательно замещены группами, выбранными из галогенов и гидроксильной группы, R'4 также может представлять собой водород, или в качестве альтернативы R4 и R'4 вместе образуют тетраметиленовую или пентаметиленовую группу,причем эти последние две группы сами могут быть замещены, в частности, С 6-С 14-арильным или (С 6-С 14)арил(C1-С 4)алкильным остатком; групп формулы в которой m представляет собой число от 1 до 4,a R5 выбирают из фенильной, метоксифенильной, индолильной, бензодиоксолильной, бензодиоксанильной, бензотиенильной и бензофурильной групп; иR2 выбирают из групп формулы-NH-SO2-R7,причем R7 выбирают из С 1-С 5-алкильных групп, необязательно замещенных одной или более группами, выбранными из галогенов, гидроксильных групп и трифторметильной группы; моно- или бициклических С 3-С 12-циклоалкильных групп; моно-, би- или трициклических С 6-С 14 арильных групп; гетероарильных групп, выбранных из пиридильной, тиенильной, хинолильной, бензодиоксанильной, бензодиоксолильной и изоксазолильной групп; фенил(C1-C4)-алкильной и нафтил(C1-C4)алкильной групп; - и групп формулы в которой n = 1, 2 или 3,причем арильная или гетероарильная группы необязательно замещены одной или более группами, независимо выбранными из галогенов, С 1-С 4-алкильной, трифторметильной, C1C4-алкилтиогруппы, С 1-С 4-алкилоксильной, C1C4-алкилсульфонильной группы, нитрогруппы,диС 1-C4)алкил)аминогруппы и групп -COOR,-CH2COOR или -O-CH2COOR, причем R представляет собой С 1-С 4-алкильную группу;iii) R3 выбирают из атома водорода, С 1-С 4 алкильной группы и фенил(C1-C4)-алкильной группы;iv) и Z1 и Z2 представляют собой водород или аминозащитную группу; и их аддитивные соли с фармацевтически приемлемыми кислотами. Одна из предпочтительных групп соединений представлена соединениями, в которых R1 представляет собой Н, a R2 представляет собой группу формулы -NH-SO2-R7. Наиболее предпочтительными соединениями являются такие, в которых R7 представляет собой группу, выбранную из нафтильной, 003674 6 замещенной нафтильной, бифенильной и фенилтиенильной групп. В качестве примеров арильных групп можно упомянуть фенильную, -нафтильную,-нафтильную, флуоренильную и бифенильную группы. С 1-С 5-алкильные группы могут быть линейными или разветвленными. В качестве примеров можно упомянуть метильную, этильную,пропильную, изопропильную, бутильную, изобутильную, трет-бутильную и пентильную группы. Моноциклические циклоалкильные группы могут, например, представлять собой циклопентильную или циклогексильную группы. Полициклические циклоалкильные группы могут, например, представлять собой адамантильную, норборнильную и камфорильную группы. Алкинильные группы могут, например,представлять собой этинильную, пропаргильную или бутинильную группы. Алкенильные группы могут, например,представлять собой винильную, пентенильную или аллильную группы. С 1-С 4-алкоксильные группы также могут быть линейными или разветвленными. В качестве примеров можно упомянуть метоксильную,этоксильную, пропоксильную, изопропоксильную, бутоксильную, изобутоксильную и третбутоксильную группы. Галогены можно выбрать из фтора, хлора,брома и йода. Аминозащитными группами, которые можно упомянуть, являются этоксикарбонильная, бензилоксикарбонильная, n-нитробензилоксикарбонильная и t-бутоксикарбонильная группы. Аддитивные соли с фармацевтически приемлемыми кислотами обозначают соли,обладающие биологическими свойствами свободных оснований и не оказывающие нежелательных эффектов. Эти соли могут быть, в частности, солями, образованными с минеральными кислотами, такими как соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота или фосфорная кислота; кислыми солями металлов, такими как динатрийортофосфат и монокалийсульфат, а также органическими кислотами. Соединения формулы (I) можно получить путем:a1) проведения реакции кислоты формулы 7 в которой R8 и R9 представляют собой защитные группы, с амином формулы или а 2) проведения реакции кислоты формулы в которой R8 и R9 представляют собой защитные группы, с амином формулы с получением соединений формулы (Ib)b) необязательно, путем преобразования группы R2 в другую группу R2, иc) необязательно, путем удаления защитных групп. Соединения формулы (II) можно получить в соответствии с нижеприведенной схемой реакции (если R8 и R9 представляют собой Воc) Схема 1 8 Аддитивные соли получают как обычно,путем проведения реакции соединения формулы(I) с фармацевтически приемлемой кислотой в подходящем растворителе. И, наоборот, из аддитивных солей можно получить основания путем обработки сильным основанием. Нижеследующие примеры иллюстрируют получение соединений формулы (I). А. Получение кислоты формулы IV. Синтез 4-[1-(трет-бутоксикарбонил)-4 пиперидил]-2-2-[1-(трет-бутоксикарбонил)-4 пиперидил]этилбутановой кислоты (соединение 3). А-1. Синтез дигидрохлорида 4-(4 пиридил)-2-[2-(4-пиридил)этил]бутановой кислоты (соединение 1). К раствору 4-винилпиридина (165 г, 1,49 моль) и диэтилмалоната (120 г, 0,75 моль) в 400 мл этанола добавляют натрий (3,5 г, 0,15 моль). Смесь подвергают дефлегмации в течение 18 ч. Большую часть этанола выпаривают, а остаток переносят в эфир (около 300 мл), а затем промывают соляным раствором. Растворитель выпаривают, получив масло, которое подвергают дефлегмации в 400 мл 12N соляной кислоты в течение 12 ч. Полученную смесь выпаривают до сухого состояния, в результате чего получают красно-коричневое масло, которое переносят примерно в 1 л изопропанола и дают отстояться при комнатной температуре. Полученный раствор фильтруют, промывают изопропанолом и ацетоном и высушивают под вакуумом, в результате чего получают 190 г твердого вещества бежевого цвета. Выход = 74% Температура плавления = 172 С 1A-2. Синтез дигидрохлорида 4-(4 пиперидил)-2-[2-(4-пиперидил)этил]бутановой кислоты (соединение 2). Смесь дигидрохлорида 4-(4-пиридил)-2-[2(4-пиридил)этил]бутановой кислоты (118 г,0,344 моль) в 1,5 л уксусной кислоты гидрируют в присутствии 10%-го палладия-на-угле (10 г),под давлением в 689,5 (100 psi) кПа при температуре 60 С, в течение 24 ч. Смесь фильтруют и выпаривают, в результате получают масло, которое эмульгируют в эфире, получив взвесь. Эту взвесь фильтруют, промывают эфиром и высушивают, в результате чего получают 126 г твердого вещества бежевого цвета. Выход = 104% (содержащее уксусную кислоту) Температура плавления = 180 С 1A-3. Синтез 4-[1-(трет-бутоксикарбонил)4-пиперидил]-2-2-[1-(трет-бутоксикарбонил)-4 9 пиперидил]этилбутановой кислоты (соединение 3). ди-трет-Бутилдикарбонат (90 г, 0,413 моль) добавляют при комнатной температуре к раствору дигидрохлорида 4-(4-пиперидил)-2-[2(4-пиперидил)этил]бутановой кислоты (71,5 г,0,203 моль) в 300 мл (1,2 моль) 4 М NaOH и 300 мл трет-бутанола. Перемешивание продолжают в течение 4 ч. Органическую фазу выделяют, а затем промывают 1N HCl и водой, высушивают над сульфатом натрия и выпаривают, получив в результате сырой продукт. Добавляют циклогексан, и смесь оставляют для кристаллизации при температуре около 0 С. Затем продукт отфильтровывают, промывают циклогексаном и высушивают под вакуумом, в результате чего получают 71 г белого твердого вещества. Выход = 73% Температура плавления = 162 С 1H-NMR (400 МГц, СDСl3):1.05 (m, 4H),1.25 (m, 4H), 1.35 (m, 3H), 1,45 (s, 19H), 1.6 (bd,6 Н), 2.25 (m, 1H), 2.88 (bt, 4H), 4.05 (bs, 4H). В. Получение соединений формулы II. В-1. Синтез 2-[(4-[1-(трет-бутоксикарбонил)-4-пиперидил]-2-2-[1-(трет-бутоксикарбонил)-4-пиперидил]этил-бутаноил)амино] уксусной кислоты (соединение 4). 2,4,6-Трифтор-1,3,5-триазин (3,6 г, 26,7 ммоль) добавляют, при комнатной температуре,к раствору 4-[1-(трет-бутоксикарбонил)-4-пиперидил]-2-2-[1-(трет-бутоксикарбонил)-4-пиперидил]этилбутановой кислоты (18,6 г, 38,6 ммоль) в 150 мл дихлорметана и пиридина (3,1 г, 32,2 ммоль). После перемешивания, продолжавшегося в течение 3 ч, добавляют воду. Органическую фазу промывают водой, высушивают над сульфатом натрия, а затем фильтруют. Этот фильтрат сразу же используют на следующей стадии. Раствор добавляют к смеси метилглицинатгидрохлорида (4,9 г, 39 ммоль) и диизопропилэтиламина (11 г, 85,3 ммоль) в 50 мл дихлорметана. Перемешивание продолжают при комнатной температуре в течение 1 ч, а затем добавляют 1N соляную кислоту. Органическую фазу промывают водой, высушивают над сульфатом натрия и выпаривают, в результате чего получают масло, которое сразу же гидролизуют. Раствор продукта, полученного, как описано выше, в 150 мл тетрагидрофурана, 30 мл воды и моногидрата гидроксида лития (4,2 г,100 ммоль) перемешивают при комнатной температуре в течение 30 мин. Органический растворитель выпаривают, а остаток переносят в воду, подкисляют до рН 2 и экстрагируют этилацетатом. Экстракты промывают водой, высушивают над сульфатом натрия и выпаривают, в результате чего получают 18,2 г белого твердого вещества. Выход = 88% (за три стадии)H-NMR (400 МГц, CDCl3):0.95-1.65 (m,36H), 2.04 (m, 1H), 2.65 (bt, 4H), 4.0 (bd, 6H),6.39 (bs, 1H). Синтез В-1 использовали для получения следующих соединений: В-2. 3-[(4-[1-(трет-Бутоксикарбонил)-4 пиперидил]-2-2-[1-(трет-бутоксикарбонил)-4 пиперидил]этилбутаноил)амино]пропановая кислота (соединение 5). Исходный материал: гидрохлорид этил-3 аминопропаноата. Выход = 86%. В-3. 3-[(4-[1-(трет-Бутоксикарбонил)-4 пиперидил]-2-2-[1-(трет-бутоксикарбонил)-4 пиперидил]этилбутаноил)амино]-3-метилпропановая кислота (соединение 6). Исходный материал: этил-3-аминобутаноат. Выход = 49% 1B-5. (3R)-1-(4-[1-(трет-Бутоксикарбонил)4-пиперидил]-2-2-[1-(трет-бутоксикарбонил)-4 пиперидил]этилбутаноил)гексагидро-3-пиридинкарбоновая кислота (соединение 8). Исходный материал: этил-(R)-нипекотатL-тартрат. Выход = 66% С. Получение соединений формулы Ib. С-1. Получение соединений формулы Ib(R1 Н, R2 = Н). 1) трет-Бутил-4-3-[1-(1,3-бензодиоксол 5-ил)-3-этокси-3-оксопропил]амино-2-оксоэтил)амино]карбонил-5-[1-(трет-бутоксикарбонил)-4-пиперидил]пентилтетрагидро-1(2 Н)пиридинкарбоксилат (соединение 9). Изобутилхлорформиат (1,5 г, 11 ммоль) добавляют при комнатной температуре к раствору 4-[1-(трет-бутоксикарбонил)-4-пиперидил]-2-2-[1-(трет-бутоксикарбонил)-4-пиперидил]этилбутаноил)амино]уксусной кислоты 11 при 50 С в течение 2 ч, а затем добавляют 2N соляную кислоту. Органическую фазу промывают водой, высушивают над сульфатом натрия,а затем очищают с помощью флэшхроматографии (дихлорметан/метанол, 20/1), в результате чего получают 6,7 г белого твердого вещества. Выход = 88%. 1(m, 8H), 5.3 (q, 1H), 6.55 (t, 1H), 6.75 (m, 3H),7.55 (d, 1H). Описанный выше способ использовали для получения следующих соединений: 2) трет-Бутил-4-(5-[1-(трет-бутоксикарбонил)-4-пиперидил]-3-[(2-[3-этокси-1-(4-изопропилфенил)-3-оксопропил]амино-2-оксоэтил)амино]карбонилпентил)тетрагидро-1(2 Н)пиридинкарбоксилат (соединение 10). Исходный материал: гидрохлорид этил-3 амино-3-(4-изопропилфенил)пропионата. Выход: 82%. 1(соединение 20). Изобутилхлорформиат (1,7 г, 12,4 ммоль) добавляют при комнатной температуре к раствору 2-[(4-[1-(трет-бутоксикарбонил)-4-пиперидил]-2-2-[1-(трет-бутоксикарбонил)-4-пиперидил]этилбутаноил)амино]уксусной кислоты(соединение 4) (6,9 г, 11 ммоль) в 150 мл этилацетата и N-метилморфолина (5 г, 49,5 ммоль). Получают суспензию белого цвета. После перемешивания, продолжавшегося в течение 10 мин,добавляют раствор бензил-(3S)-3-амино-4-(1 адамантиламино)-4-оксобутаноат трифторацетата (6,9 г, 11,2 ммоль) в 20 мл этилацетата. Перемешивание продолжают при комнатной температуре в течение 18 ч. Добавляют 2N соляную кислоту. Органическую фазу промывают водой,высушивают над сульфатом натрия и выпаривают, получая сырой продукт, который очищают с помощью флэш-хроматографии (дихлорметан/метанол, 20/1), в результате чего получают 6,6 г твердого вещества бежевого цвета. Выход = 68%. Описанный выше способ использовали для получения следующих соединений: 13) трет-Бутил-4-3-([2-(1-2-(1 Ниндол-4-ил)этил]амино]карбонил-(1S)-3 бензилокси-3-оксопропиламино)-2-оксоэтил] аминокарбонил)-5-[1-(трет-бутоксикарбонил)4-пиперидил]пентилтетрагидро-1(2 Н)-пиридинкарбоксилат (соединение 21). Исходный материал: бензил-(3S)-3-амино 4-[2-(1 Н-индол-4-ил)этиламино]-4-оксобутаноат трифторацетат. Выход = 49% 1(m, 2H), 2.05 (m, 1H), 2.65 (m, 6H), 3.1 (dd, 1H),3.55 (m, 1H), 3.9 (d, 2H), 4.05 (bs, 5 Н), 4.82 (m,1 Н), 5.15 (dd, 2H), 6.3 (t, 1H), 6.45 (d, 1H), 7.3 (m,6H). 20) трет-Бутил-4-3-([2-1S)-3-(бензилокси)-3-оксо-1-[(4-бензилпиперидино)карбонил] пропиламино)-2-оксоэтил]аминокарбонил)-5[1-(трет-бутоксикарбонил)-4-пиперидил]пентилтетрагидро-1(2H)-пиридинкарбоксилат (соединение 28). Исходный материал: бензил-(3S)-3-амино 4-оксо-4-(4-бензилпиперидино)бутаонат трифторацетат. Выход = 55% С-2. Получение соединений формулы Ib(R1 = Н, R2 Н) 1) Синтез трет-бутил-4-[(10S)-3-2-[1(трет-бутоксикарбонил)-4-пиперидил]этил-10(этоксикарбонил)-4,7,12-триоксо-14-фенил-13 окса-5,8,11-триазатетрадек-1-ил]тетрагидро 1(2H)-пиридинкарбоксилат (соединение 29). Изобутилхлорформиат (13 г, 95,2 ммоль) добавляют при комнатной температуре к раствору 2-[(4-[1-(трет-бутоксикарбонил)-4-пиперидил]-2-2-[1-(трет-бутоксикарбонил)-4-пиперидил]этилбутаноил)амино]уксусной кислоты(соединение 4) (46 г, 85,2 ммоль) в 550 мл этилацетата и N-метилморфолина (19 г, 188 ммоль) и получают суспензию. После перемешивания,продолжавшегося в течение 20 мин, добавляют гидрохлорид этил-(2S)-3-амино-2-[(бензилокси)карбонил]аминопропаноата (26,3 г, 86,9 ммоль). Перемешивание продолжают в течение 18 ч при комнатной температуре, а затем реакционную среду промывают водой, 1N соляной кислотой и водой, после чего высушивают над сульфатом натрия и выпаривают, получая в результате сырой продукт, который очищают с помощью флэш-хроматографии (дихлорметан/метанол, 20/1), и в результате получают 61 г белого твердого вещества. Выход = 91% 1 16 5.08 (s, 2H), 5.95 (d, 1H), 6.4 (bs, 1H), 6.9 (bs,1H), 7.4 (bs, 5H). Описанный выше способ использовали для получения следующих соединений: 2) трет-Бутил-4-[5-[1-(трет-бутоксикарбонил)-4-пиперидил]-3-([2-(2-[(циклогексилсульфонил)амино]-3-метокси-3-оксопропил амино)-2-оксоэтил]аминокарбонил)пентил] тетрагидро-1(2 Н)-пиридинкарбоксилат (соединение 30). Исходный материал: метил-3-амино-2[(циклогексилсульфонил)амино]пропаноат трифторацетат. Выход = 81% 1 18 76,1 ммоль), 10% палладия-на-угле (5 г) в 400 мл этанола и 77 мл 1N хлористо-водородного этанола гидрогенируют при комнатной температуре под давлением около 170 кПа (25 psi) в течение 30 мин. Полученную смесь фильтруют и выпаривают, в результате чего получают 52 г твердого вещества бежевого цвета. Выход = 99% 1(m, 1H), 3.68 (m, 1H), 3.9 (d, 2H), 4.02 (bs, 4H),4.18 (q, 2H), 6.38 (bt, 1H), 6.72 (bt, 1H). Описанный выше способ использовали для получения следующих соединений: 10) Синтез трет-бутил-4-3-[(3-[(2S)-2 амино-3-этокси-3-оксопропил]амино-3-оксопропил)амино]карбонил-5-[1-(трет-бутоксикарбонил)-4-пиперидил]пентилтетрагидро-1(2H)пиридинкарбоксилата (соединение 38). Исходный материал: соединение 33. Выход = 97% 11) Синтез трет-бутил-4-[5-[1-(трет-бутоксикарбонил)-4-пиперидил]-3-([2-2S)-3 этокси-3-оксо-2-[(фенилсульфонил)амино] пропиламино)-2-оксоэтил]аминокарбонил) пентил]тетрагидро-1(2 Н)-пиридинкарбоксилат(соединение 39). трет-Бутил-4-3-[(2-[(2S)-2-амино-3 этокси-3-оксопропил]амино-2-оксоэтил) амино]карбонил-5-[1-(трет-бутоксикарбонил)4-пиперидил]пентилтетрагидро-1(2 Н)-пиридинкарбоксилат (соединение 37) (3,31 г, 4,8 ммоль) растворяют в 50 мл дихлорметана, содержащего триэтиламин (1,04 г, 5 ммоль), а затем добавляют бензолсульфонилхлорид (0,9 г, 5 ммоль) при температуре около 5 С. После выдержки в течение 2 ч при комнатной температуре добавляют воду. Органическую фазу промывают 1N HCl, а затем водой, высушивают над сульфатом натрия, после чего выпаривают, получая сырой продукт, который очищают с помощью флэш-хроматографии(m, 3H), 7.82 (d, 2H). Описанный выше способ использовали для получения следующих соединений: 12) трет-Бутил-4-[5-[1-(трет-бутоксикарбонил)-4-пиперидин]-3-([2-2S)-3-этокси-3 оксо-2-[(1,3-бензодиоксол-5-илкарбонил) амино]пропиламино)-2-оксоэтил]амино карбонил)пентил]тетрагидро-1(2H)-пиридинкарбоксилат (соединение 40). Исходный материал: хлорид пиперониловой кислоты.(bt, 1H), 6.75 (d, 1H), 6.95 (bt, 1H), 7.35-7.5 (m,6H). 28) трет-Бутил-4-[(10S)-3-2-[1-(третбутоксикарбонил)-4-пиперидил]этил-10(этоксикарбонил)-4,7,12,12-тетраоксо-14-фенил 126-тиа-5,8,11-триазатетрадек-1-ил]тетрагидро 1(2H)-пиридинкарбоксилат (соединение 56). Исходный материал: продукт гидрогенирования соединения 55. Выход = 96% 1(bt, 4H), 3.4 (m, 1H), 3.55 (m, 2H), 3.7 (m, 1H),4.0 (q, 2H), 4.05 (bs, 4H), 5.9 (d, 1H), 6.5 (m, 2H),7.5 (t, 2H), 7.6 (d, 1H), 7.85 (d, 1H). 61) трет-Бутил-4-[(10S)-3-2-[1-(третбутоксикарбонил)-4-пиперидил]этил-13-(7,7 диметил-2-оксобицикло[2.2.1]гепт-1-ил)-10(этоксикарбонил)-4,7,12,12-тeтpaoкcо-126-тиa5,8,11-тpиaзaтpидeк-1-ил]тетрагидро-1(2 Н)пиридинкарбоксилат (соединение 89). В соответствии со способом, описанным для соединения 29, начиная с гидрохлорида этил-(2S)-3-амино-2-([(7,7-диметил-2-оксоби 31 цикло[2.2.1]гепт-1-ил)метил]сульфониламино) пропаноата и соединения 4. Выход =78% 1(2R)-3-(2-[(4-[1-(трет-Бутоксикарбонил)-4-пиперидил]-2-2-[1-(трет-бутоксикарбонил)-4-пиперидил]этилбутаноил)амино] ацетиламино)-2-[(2-нафтилсульфонил)амино] пропановая кислота (соединение 90). Изобутилхлорформиат (3,3 г, 24,2 ммоль) добавляют при комнатной температуре к раствору 2-[(4-[1-(трет-бутоксикарбонил)-4-пиперидил]-2-2-[1-(трет-бутоксикарбонил)-4-пиперидил]этилбутаноил)амино]уксусной кислоты(тетрагидрофурана) и N-метилморфолина (5 г,49,5 ммоль). Получают суспензию. После 20-минутного перемешивания добавляют смесь (2R)-3-амино 2-[(2-нафтилсульфонил)амино]пропановой кислоты (8 г, 25 ммоль) и воды (80 мл) при 0 С. Перемешивание продолжают при температуре 05 С в течение 30 мин, а затем при комнатной температуре в течение 18 ч. Тетрагидрофуран выпаривают, а водный раствор подкисляют до рН 2 1N соляной кислотой. Смесь экстрагируют эфиром. Экстракты промывают водой, высушивают над сульфатом натрия и выпаривают, получая в результате сырой продукт, который очищают с помощью флэш-хроматографии (дихлорметан/метанол/уксусная кислота, в соотношении 10:0,5:0,5), с получением 8,3 г твердого вещества бежевого цвета. Выход =51% 1D. Получение соединений формулы Ib в соответствии с путем реакции a2: реакция кислоты формулы IV с амином формулы V. 63) трет-Бутил-4-[5-[1-(трет-бутоксикарбонил)-4-пиперидил]-3-([2-(3-этокси-2-[(2-нафтилсульфонил)амино]-3-оксопропиламино)-2 оксо-1-фенилэтил]аминокарбонил)пентил] тетрагидро-1(2 Н)-пиридинкарбоксилат (соединение 91). Гидрохлорид этил-3-[(2-амино-2-фенилэтаноил)амино]-2-[(2-нафтилсульфонил)амино] пропаноата (1,7 г, 3 ммоль) и диизопропилэтиламин (0,8 г, 6,2 ммоль) добавляют при комнатной температуре к раствору 4-[1-(трет 003674 32 бутоксикарбонил)-4-пиперидил]-2-2-[1-(третбутоксикарбонил)-4-пиперидил]этилбутаноилфторида (см. синтез В-1) (1,55 г, 3 ммоль) в 50 мл дихлорметана. После продолжавшегося в течение 3 ч перемешивания добавляют воду. Органическую фазу промывают водой, высушивают над сульфатом натрия и выпаривают, получая сырой продукт, который очищают с помощью флэш-хроматографииH-NMR (400 MГц, CDCl3):0.95 (m, 3H),1.00 (m,4H), 1.20 (m, 4H), 1.40 (m, 2 Н), 1.47 (s,20H), 1.60 (m, 6 Н), 2.05 (m, 1H), 2.60 (bd, 4H),3.50 (m, 1H), 3.58 (m, 1H), 3.65 (m, 1H), 3.80 (m,2H), 3.99 (m, 4H), 5.45 (m, 1H), 5.75 (dd, 1H),6.40 (dt, 1H), 6.85 (dd, 1H), 7.35 (m, 5H), 7.52 (m,2H), 7.75 (d, 1H), 7.95 (m, 3H), 8.37 (d, 1H). Этот способ использовали для получения следующего соединения: 64) трет-Бутил-4-[5-[1-(трет-бутоксикарбонил)-4-пиперидил]-3-([2-(3-этокси-2-[(2 нафтилсульфонил)амино]-3-оксопропиламино)-1-метил-2-оксоэтил]аминокарбонил) пентил]тетрагидро-1(2 Н)-пиридинкарбоксилат(t, 1H), 7.65 (m, 2H), 7.80 (d, 1H), 7.90 (d, 1H),8.00 (d, 2H), 8.40 (s, 1H). Пример 1. Гидрохлорид этил-3-(1,3 бензодиоксол-5-ил)-3-[2-(4-(4-пиперидил)-2[2-(4-пиперидил)этил]бутаноиламино)ацетил] аминопропаноата (CRL42725). трет-Бутил-4-3-[1-(1,3-бензодиоксол-5 ил)-3-этокси-3-оксопропил]амино-2-оксоэтил) амино]карбонил-5-[1-(трет-бутоксикарбонил)4-пиперидил]пентилтетрагидро-1(2 Н)-пиридинкарбоксилат (соединение 9) (3,3 г, 4,35 ммоль) растворяют в 5 мл диоксана, а затем добавляют 10 мл 4N раствора диоксан-соляной кислоты. Смесь перемешивают при комнатной температуре в течение 20 мин, а затем отделяют диоксан путем отстаивания. Добавляют эфир и затем отделяют его также с помощью отстаивания, после чего полученный материал выпаривают до сухого состояния. Получают белый порошок, который растворяют примерно в 150 мл воды, затем фильтруют и фильтрат подвергают сушке вымораживанием, получая в результате 2,4 г белого твердого вещества. Выход = 87%(bs, 2H). Способ, описанный в примере 1, использовали для получения следующих соединений. Пример 2. Дигидрохлорид этил-3-[3-(2 этокси-2-оксоэтокси)фенил]-3-[2-(4-(4 пиперидил)-2-[2-(4-пиперидил)этил]бутаноил амино)ацетил]аминопропаноата (CRL42640). Исходный материал: соединение 13. Выход = 92% 1(d, 1H), 8.85 (bd, 2H), 9.1 (bd, 2H). Пример 5. Дигидрохлорид 3-(1,3-бензодиоксол-5-ил)-3-[2-(4-(4-пиперидил)-2-[2-(4 пиперидил)этил]бутаноиламино)ацетил]аминопропановой кислоты (CRL42630). 1 г (23,8 ммоль) моногидрата гидроксида лития добавляют к раствору трет-бутил-4-3[1-(1,3-бензодиоксол-5-ил)-3-этокси-3-оксопропил]амино-2-оксоэтил)амино]карбонил-5[1-(трет-бутоксикарбонил)-4-пиперидил]пентилтетрагидро-1(2H)-пиридинкарбоксилата(соединения 9) (7,6 г, 10 ммоль) в 80 мл тетрагидрофурана и 20 мл воды. После 4 ч выдерживания при комнатной температуре органический растворитель выпаривают. Добавляют воду и смесь подкисляют до рН 2, а затем экстрагируют этилацетатом. Экстракты промывают водой и высушивают над сульфатом натрия. Фильтрат 34 выпаривают, получая 6,3 г кислоты. Полученную таким образом кислоту растворяют в 10 мл этилацетата, а затем добавляют 50 мл 3N раствора этилацетат-соляной кислоты. Перемешивание продолжают в течение 30 мин при комнатной температуре. Смесь разделяют путем отстаивания. После добавления воды (около 200 мл) с последующей сушкой вымораживанием получают 4,7 г белого твердого вещества. Выход =78%H-NMR (400 MГц, CD3OD):1.5 (m,12H), 1.95 (m, 4H), 2.25 (m, 1H), 2.75 (bs, 2H),2.9 (m, 4H), 3.3 (m, 4H), 3.85 (s, 2H), 5.29 (bs,1H), 5.95 (s, 2H), 6.8 (d, 2H), 6.85 (m, 3H). Способ, описанный в примере 5, использовали для получения следующих соединений. Пример 6. Дигидрохлорид 3-(4-изопропилфенил)-3-[2-(4-(4-пиперидил)-2-[2-(4-пиперидил)этил]бутаноиламино)ацетил]аминопропановой кислоты (CRL42548). Исходный материал: соединение 10. Выход =98% 52 растворяют в 30 мл этилацетата и добавляют 150 мл 3N этилацетат-соляной кислоты при комнатной температуре. Перемешивание продолжают в течение 40 мин, а затем добавляют этилацетат. Путем высушивания под вакуумом получают белый порошок. После добавления 500 мл воды с помощью сушки вымораживанием получают 5,92 г белого твердого вещества. Выход = 98%(s, 1H), 8.7 (bs, 2H), 8.95 (bd, 2H). Изучение ингибирующей активности соединений формулы I в отношении агрегации тромбоцитов проводили in vitro, т.е. путем осуществления прямого контакта растворов различных концентраций этих соединений с тромбоцитами, свежевыделенными из образца цельной крови, взятого в стандартизованных условиях у лабораторных животных (морских свинок) и у здоровых людей, не получавших никаких веществ или лекарств, которые могли бы помешать свертыванию крови. Активность, направленную против агрегации тромбоцитов,изучали также в условиях ex vivo/vitro, т.е. после введения веществ согласно настоящему изобретению морским свинкам, чтобы измерить интенсивность и продолжительность антиагрегирующего воздействия,индуцированного фракцией испытуемого продукта, адсорбированной и циркулирующей в крови. 1. Фармакологические испытания in vitro 1.1. Испытания на тромбоцитах морских свинок. Кровь берут посредством внутрисердечной пункции у самцов морских свинок линииDunkin-Hartley (с массой тела около 330 г) в количестве по 4,5 мл на 0,5 мл тринатрийцитрата (концентрация водного раствора: 1,55%),чтобы не допустить даже следов свертывания. Обогащенную тромбоцитами плазму (PRP) получают посредством центрифугирования пробирок с пробами цельной крови в течение 15 мин при 150 г.PRP собирают в виде пулов. Тромбоциты, содержащиеся в этих пулах, подсчитывают с помощью автоматического счетчика элементов крови Coulter ZM; при необходимости осуществляют разбавление, чтобы концентрация тромбоцитов в плазме составляла между 200000 и 400000 тромбоцитов/мм 3. Одновременно другие образцы из этих пулов служат для получения обедненной тромбоцитами плазмы (РРР), получаемой посредством центрифугирования при 1500 г в течение 15 мин. ния, в интервале от 10-8 М до 10-5 М (пример концентраций: 10-8 М, 510-7 М, 310-7 М, 10-7 М, 810-6 М, 610-6 М, 410-6 М, 210-6 М,10-6 М, 510-5 М, 10-5 М). Для каждого соединения заранее готовят водные растворы с концентрацией в 10-3 М. Контрольный тест с целью проверки возможного влияния растворителей(эталонное значение) на агрегацию тромбоцитов включают в каждую серию измерений, и измерения проводят после 3 мин контактирования при 37 С со взбалтыванием. На основе данных о процентах ингибирования агрегации тромбоцитов, измеренных для каждой концентрации каждого соединения, рассчитывают концентрацию, вызывающую 50% ингибирование (ИК 50). 2. Фармакологические испытанияex vivo/vitro на морских свинках Оценку активности соединений, направленной против агрегации тромбоцитов, изучают на таких же самых морских свинках, о которых говорилось выше (линии Dunkin-Hartley). Введение каждого испытуемого соединения в интервале доз от 150 до 10 мг/кг и каждого носителя (5 мл/кг) осуществляют гастральным (желудочным) способом (g.r.), за 1, 2, 4, 6, 8 или 12 ч до того, как у голодавших морских свинок берут пробы крови. Распределение вариантов эксперимента между животными рандомизированное. Берут пробы крови, а затем обрабатывают их так, как описано выше для исследований invitro. Результаты ингибирования агрегации тромбоцитов, полученные для каждой испытывавшейся концентрации, позволяют рассчитать концентрации ИК 50 для каждого испытуемого соединения, а также кинетику ингибирующего влияния и продолжительность его действия. Полученные результаты сведены в нижеследующей таблице. Кинетическое исследование агрегации тромбоцитов осуществляют путем добавления раствора коллагена (1 мкг/мл) к объему PRP с использованием агрегометра Chrono-log Corporation (490-D1 или 560 VS), в котором используется принцип оптического обнаружения появления тромба. Определение 50%-й ингибирующей концентрации (ИК 50) осуществляют путем добавления данного объема растворителя (контрольный вариант - эталон) и увеличивающихся концентраций (1,510-8 М, 710-8 М, 1,510-7 М, 310-7 М, 710-7 М, 1,510-6 М и 710-5 М) соединений к образцам пулов PRP. Измерения ингибирования агрегации осуществляют после 3 мин контактирования при 37 С со взбалтыванием. 1.2. Испытание на человеческих тромбоцитах. Венозную кровь берут у группы, состоящей из десяти здоровых человек одинакового возраста, путем прокалывания вены на локтевом сгибе и собирают ее в стеклянную пробирку,содержащую водный 0,129 М раствор цитрата натрия (1 об. раствора цитрата на 9 об. крови). После этого каждую пробирку центрифугируют первый раз при 20 С и 100 г в течение 15 мин,чтобы получить обогащенную тромбоцитами плазму (PRP); после удаления этой PRP пробирку снова центрифугируют, на этот раз при 2000 г в течение 15 мин, чтобы получить обедненную тромбоцитами плазму (РРР). Для каждого идентифицированного образца PRP тромбоциты подсчитывают с помощью счетчика Coulter ZM. Затем каждый образец используют для изучения изменчивости ингибирования агрегации тромбоцитов, вызываемой добавлением глюкозного раствора коллагена(реагент Chromo-par), из фирмы Coultronics (используемого в концентрации 5 мкг/мл); изменчивость наблюдается в результате добавления возрастающих концентраций каждого соедине% ингибирования для морских свинок ex vivo при гастральном введении Объектом настоящего изобретения, таким образом, также являются фармацевтические композиции, включающие эффективное количество соединения формулы (I) или его соли с фармацевтически приемлемыми кислотами. Более конкретно, объектом настоящего изобретения являются композиции для ингибирования агрегации тромбоцитов крови, включающие эффективное количество одного из этих соединений. Объектом изобретения также является- способ ингибирования связывания фибриногена с тромбоцитами крови у млекопитающего, включающий введение этому млекопитающему эффективного количества одного из этих соединений,- способ лечения тромбоза у пациента,включающий введение этому пациенту эффективного количества одного из этих соединений, 57- способ предотвращения риска образования тромба у пациента, включающий введение этому пациенту эффективного количества одного из этих соединений. Соединения формулы (I) можно применять, в частности, в следующих областях:i) Экстренное предотвращение риска образования тромба во время хирургической операции на сердце (коронарное шунтирование) или во время внутривенной кардиологической операции (чрескожная пластическая операция на сосудах, выполняющаяся через просвет сосуда; эндартеректомия, введение стента): в этих ситуациях данные соединения добавляют к известному превентивному лечению артериального тромботического риска; осуществляют пероральное введение ацетилсалициловой кислоты,начинающееся перед хирургическим вмешательством (от 150 до 500 мг/день, перорально), а затем продолжающееся, как указано ниже; осуществляют внутривенное вливание нефракционированного гепарина, начинающееся во время хирургического вмешательства, а затем продолжающееся в течение от 48 до 96 ч. Введение соединения формулы I можно осуществлять либо перорально (от 0,5 до 1,5 мг/кг) одновременно с введением аспирина, либо путем внутривенного вливания (от 0,25 до 1 мг/кг/24 ч),сочетающегося или не сочетающегося с болюсом. После 48-го часа, если введение проводилось внутривенно, его заменяют на пероральное введение (от 0,25 до 10 мг/кг, в два приема, с интервалом в 12 ч), чтобы улучшить стационарное лечение, а затем амбулаторное лечение.(ii) Вторичная профилактика артериального тромботического риска у пациентов, склонных к появлению случаев нестабильной стенокардии или инфаркта миокарда: в этих ситуациях, высокая биологическая доступность соединений по настоящему изобретению, т.е. быстрое получение циркулирующих концентраций, которые являются эффективными, поскольку они способны ингибировать связывание фибриногена с тромбоцитами, делает возможным введение заявленных медицинских продуктов пероральным путем во время периода, в течение которого для пациентов существует риск артериального тромбоза. В этих ситуациях данные соединения можно вводить преимущественно с периодичностью от 1 до 3 пероральных доз в день,исходя из их высокой биологической доступности и большой длительности действия, причем дозу выбирают в интервале от 0,5 до 10 мг/кг. Фармацевтические композиции, включающие один из активных элементов, описанных в настоящей заявке на патент, включают активное вещество либо в форме основания,либо в форме фармацевтически приемлемой соли, или в качестве альтернативы в форме пролекарства, включающего функциональную группу сложного эфира, причем эта функциональная группа разрушается in vivo после перо 003674 58 рального введения. Эти фармацевтические композиции включают применяющиеся при изготовлении лекарственных препаратов вспомогательные средства и носители, известные специалистам в данной области техники. Последние выбирают из ряда фармацевтических средств, признанных фармакопеями. В качестве примеров средств, используемых для изготовления лекарственных препаратов, предназначенных для перорального применения, можно упомянуть крахмал, стеарат магния, тальк, желатин, агар, пектин, лактозу, полиэтиленгликоли и т.п. Лекарственные формы, которые можно использовать, выбирают из следующих возможных форм: расщепляемые и нерасщепляемые таблетки, гелевые капсулы, лепешки, гранулы,порошки. В соответствии с особенностями патологии, подлежащей лечению, и морфологии каждого пациента, ежедневная пероральная доза составляет от 0,02 до 50 мг/кг/день, которую принимают за 1-3 раза, с одинаковыми интервалами, чтобы поддерживать эффективный уровень оккупации рецепторов тромбоцитовGpIIb/IIIa. При внутривенном введении лекарственные формы, предназначенные для применения в острой фазе лечения, изготовлены таким образом, чтобы можно было подобрать индивидуальную дозировку на основании ингибирования агрегации тромбоцитов, которая наиболее эффективна вследствие того, что она позволяет производить немедленные изменения в послеоперационном лечении. В этом контексте, лиофилизат и готовый к применению раствор для вливания делают возможным индивидуальный подбор доз, в интервале от 0,01 до 20 мг/кг/день. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулыi) R1 либо выбирают из С 1-С 4-алкильной, С 3-С 12-моно- или бициклической циклоалкильной, С 2-C4-алкенильной или С 2-С 4-алкинильной групп, причем эти группы необязательно замещены группами, выбранными из галогенов и гидроксильной группы; моно-, би- или трициклических С 6-С 14 арильных групп; гетероарильных групп, выбранных из пиридильной, тиенильной, фурильной, хинолильной, бензодиоксанильной, бензодиоксолильной, 59 бензотиенильной, бензофурильной и пиразинильной групп; фенил(C1-C4)-алкильной и нафтил(С 1-С 4)алкильной групп, необязательно замещенных арильным кольцом; причем арильные и гетероарильные группы могут быть замещены одной или более группами, независимо выбранными из галогенов, С 1 С 4-алкильной,трифторметильной,С 1-С 4 алкилтио-, С 1-С 4-алкилсульфонильной, C1-C4 алкилоксильной групп, нитрогруппы и групп в которой R4 и R'4 выбирают из C1-C8-алкильной и моно- или полициклических С 3-С 12-циклоалкильных групп, причем эти группы необязательно замещены группами, выбранными из галогенов и гидроксильной группы, R'4 также может представлять собой водород, или в качестве альтернативы R4 и R'4 вместе образуют тетраметиленовую или пентаметиленовую группу,причем эти последние две группы сами могут быть замещены С 6-С 14-арильным или (C6C14)арил(С 1-С 4)алкильным остатком; групп формулы в которой m представляет собой число от 1 до 4,a R5 выбирают из фенильной, метоксифенильной, индолильной, бензодиоксолильной, бензодиоксанильной, бензотиенильной и бензофурильной групп; и R2 представляет собой водород;R2 выбирают из групп формулы-NH-SO2-R7,причем R7 выбирают из С 1-С 5-алкильных групп, необязательно замещенных одной или более группами, выбранными из галогенов, гидроксильных групп и трифторметильной группы; С 2-С 5-алкенильных групп; моноили бициклических С 3-С 12 циклоалкильных групп; моно-, би- или трициклических С 6-С 14 арильных групп; гетероарильных групп, выбранных из пиридильной, фурильной, тиенильной, хинолильной, бензодиоксанильной, бензодиоксолильной,изоксазолильной, бензодиоксинильной, бензо 003674 в которой n = 1, 2 или 3, а В выбирают из -СН 2-,О или S и -NH-,причем арильные или гетероарильные группы необязательно замещены одной или более группами, независимо выбранными из галогенов, С 1-С 4-алкильной, С 3-С 7-циклоалкильной,трифторметильной групп, C1-C4-алкилтиогруппы, С 1-С 4-алкилоксильной, C1-C4-алкилсульфонильной групп, нитрогруппы, диС 1 С 4)алкил)аминогруппы и группiii) R3 выбирают из атома водорода, С 1-С 4 алкильной группы и фенил(C1-C4)-алкильной группы;iv) А выбирают из групп -NH-CHR10-,-NH-CHR10-CH2- иv) Z1 и Z2 представляют собой водород или аминозащитную группу; или их аддитивные соли с фармацевтически приемлемыми кислотами. 2. Соединения по п.1 формулыi) R1 либо выбирают из С 1-С 4-алкильной, С 3-C12-моно- или бициклической циклоалкильной, С 2-С 4-алкенильной или С 2-С 4-алкинильной групп, причем эти группы необязательно замещены группами, выбранными из галогенов и гидроксильной группы; моно-, би- или трициклических С 6-С 14 арильных групп; гетероарильных групп, выбранных из пиридильной, тиенильной, фурильной, хинолильной, бензодиоксанильной, бензодиоксолильной,
МПК / Метки
МПК: A61K 31/445, A61P 7/02, C07D 211/34
Метки: промежуточные, продукты, агентов, способ, композиция, биспиперидины, применение, варианты, качестве, терапевтическая, получения, противотромботических
Код ссылки
<a href="https://eas.patents.su/30-3674-bispiperidiny-v-kachestve-protivotromboticheskih-agentov-ih-primenenie-sposob-ih-polucheniya-varianty-promezhutochnye-produkty-i-terapevticheskaya-kompoziciya.html" rel="bookmark" title="База патентов Евразийского Союза">Биспиперидины в качестве противотромботических агентов, их применение, способ их получения (варианты), промежуточные продукты и терапевтическая композиция</a>
Предыдущий патент: Производные 4-фенилпиридина, их применение, лекарственное средство
Следующий патент: Белки, связывающие интерлейкин-18, их получение и применение
Случайный патент: Агенты, связывающиеся с ядерными рецепторами