Кальцилитические соединения, фармацевтические композиции и способ скрининга кальцилитических соединений
Номер патента: 2984
Опубликовано: 26.12.2002
Авторы: Бэрмор Роберт М., Кинэн Ричард М., Дел Мар Эрик Дж., Томпсон Мервин, Шихэн Дерек, Кэллэхэн Джеймс Ф., Котека Никеш Р., Ван Вагенен Брэдфорд К.
Формула / Реферат
1. Соединение формулы
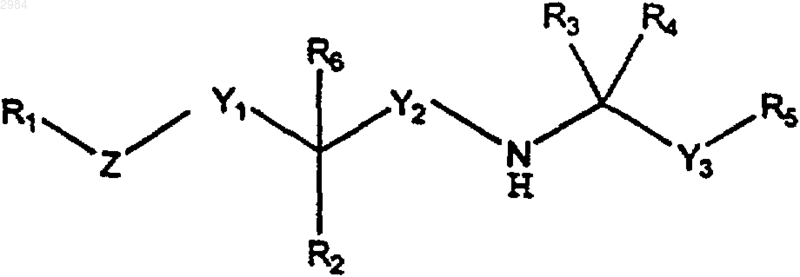
где R1 выбирают из группы, включающей арил, (С4-С20)алкил и циклоалкил;
R2 выбирают из группы, включающей (C1-C4)алкил, циклоалкил, алкокси, Н, ОН, =O, С(О)ОН, С(О)О-(C1-C4)алкил, С(О)NH-(C1-C4)алкил, C(O)N((C1-C4)алкил)2, SH, S-(C1-C4)алкил, NH2, NH-(C1-C4)алкил и N((C1-C4)алкил)2;
R3 и R4 представляют собой, каждый независимо, (C1-C4)алкил или, взятые вместе, образуют циклопропил;
R5 представляет собой либо необязательно замещенный нафтил, имеющий от одного до четырех заместителей, независимо выбранных из группы, включающей метил, этил, изопропил, метокси, Cl, F, Вr и гало-(C1-C4)алкокси, либо замещенный фенил, имеющий от одного до четырех заместителей при, по меньшей мере, одном заместителе в мета- или пара-положении, выбранных из группы, включающей (C1-C4)алкил, метокси, Cl, F, Вr и гало-(C1-C4)алкокси, при условии, что указанный замещенный фенил может также иметь от 2 до 3 дополнительных заместителей;
R6, если он присутствует, представляет собой либо водород, либо (C1-C4)алкил, либо (С2-С4)алкенил, причем R6 отсутствует в том случае, когда R2 представляет =O;
Y1 представляет собой ковалентную связь или (C1-C6)алкилен;
Y2 представляет собой (C1-C6)алкилен;
Y3 представляет собой (C1-C6)алкилен;
Z выбирают из группы, включающей О, S и алкилен; при условии, что, если Z представляет собой О либо S, то Y1 не является ковалентной связью; и дополнительно при условии, что Y1 и Z могут вместе быть ковалентной связью;
при условии, что R1 не является 6-СN-2-пиридилом, замещенным 6-СN-2-пиридилом либо 3-СN-2-пиридилом или парагидроксифенилом либо замещенным парагидроксифенилом;
дополнительно при условии, что если R1 представляет необязательно замещенный фенил, то его необязательный заместитель не представляет собой бензил (-СН2Рh);
дополнительно при условии, что если R5 представляет замещенный фенил, то он не может быть 3,5-диметоксифенилом;
дополнительно при условии, что если R5 представляет 3,4-диметоксифенил, то R1 не представляет собой СН3(СН2)5O-фенил; 2-циклопентилфенил; 2-Сl-фенил; 2-СN-фенил; 2-(3-фуранил)фенил; или 4-(1,2-бензизотиазол);
дополнительно при условии, что если R5 представляет 4-метоксифенил, то R1 не представляет собой 2-циклопентилфенил; 2-СН3-фенил; 2-бензилфенил; 3-СН3, 4-СН3SO2-фенил; 4-(1,2-бензизотиазол);
дополнительно при условии, что если R5 представляет 4-Сl-фенил, то R1 не представляет собой 2-СН3-фенил, 5-изопропилфенил; 2-СН3-фенил; 4-СН3-фенил; фенил; 2-Сl-фенил; 4-Сl-фенил; 2-метокси; 4-СН3СНСН-фенил; 3,4-СН3-фенил; 2,4-СН3-фенил; 2,3-СН3-фенил; 2-изопропил, 5-СН3-фенил; пиридил; 1-имидазол или 4-(1,2-бензизотиазол); и
дополнительно при условии, что если R5 представляет 3,5-диметил, 4-метоксифенил, то R1 не представляет собой 4-СН3, 6-CN-2-пиридил или тиофенкарбоксамид;
или его фармацевтически приемлемые соли;
причем указанное соединение имеет IC50 <10 мкМ при испытании его в качестве ингибитора рецептора кальция.
2. Соединение формулы
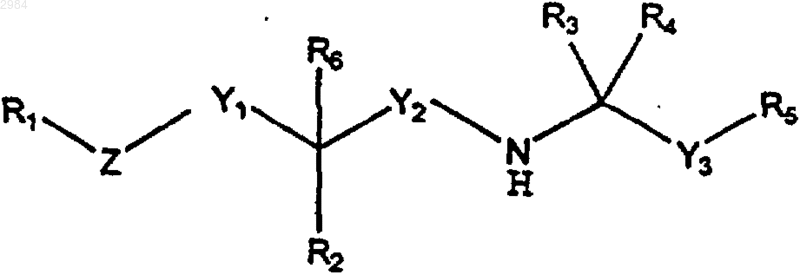
где R1 представляет собой 2-СN-фенил, 2,3-дихлорфенил, 2-нитрофенил, 2-циано-3-хлорфенил, необязательно замещенный пиридил, необязательно замещенный бензотиопиранил, необязательно замещенный карбазол или (С4-С20)алкил;
R2 выбирают из группы, включающей (C1-C4)алкил, циклоалк, (С1-С12)алкокси, Н, ОН, =O, С(О)ОН, С(О)О-(C1-C4)алкил, C(O)NH-(C1-C4)алкил, С(О)N((C1-C4)алкил)2, SH, S-(C1-C4)алкил, NH2, NH-(C1-C4)алкил и N((C1-C4)алкил)2;
R3 и R4 представляют собой, каждый независимо, (C1-C4)алкил или, взятые вместе, образуют циклопропил;
R5 представляет собой либо замещенный нафтил, имеющий от одного до четырех заместителей, независимо выбираемых из группы, включающей метил, этил, изопропил, метокси, Cl, F, Вr и галогензамещенный алкокси, содержащий 1 атом углерода, либо замещенный фенил, имеющий от одного до четырех заместителей, в том числе, по меньшей мере, один заместитель в мета- или пара-положении, выбранный из группы, включающей (C1-C4)алкил, метокси, F, Cl, Вr и галогензамещенный алкокси, содержащий 1 атом углерода, при условии, что указанный замещенный фенил R5 может также иметь от 2 до 3 дополнительных заместителей;
R6, если он присутствует, представляет собой либо водород, либо (C1-C4)алкил, либо (С2-С4)алкенил, причем R6 отсутствует в том случае, когда R2 представляет =O;
Y1 представляет собой ковалентную связь, (C1-C6)алкилен или (С2-С6)алкенилен;
Y2 представляет собой (C1-C6)алкилен;
Y3 представляет собой (C1-С6)алкилен;
Z выбирают из группы, включающей ковалентную связь, О, S, NH, N-(C1-C4)алкил, (C1-С6)алкилен, (С2-С6)алкенилен и (С2-С6)алкинилен, при условии, что, если Z представляет собой О, S, NH или N-(C1-C4)алкил, то Y1 не является ковалентной связью, и дополнительно при условии, что вместе взятые Y1 и Z могут быть ковалентной связью;
при условии, что R1 не является 6-СN-2-пиридилом, замещенным 6-СN-2-пиридилом либо 3-СN-2-пиридилом или парагидроксифенилом либо замещенным парагидроксифенилом;
и дополнительно при условии, что если R5 представляет замещенный фенил, то он не может быть 3,5-диметоксифенилом;
и его фармацевтически приемлемые соли.
3. Соединение по п.2, где
Y1 представляет метилен;
Y2 представляет метилен; и
Y3 представляет метилен.
4. Соединение по п.3, где R1 представляет собой 2-СN-фенил, 2,3-дихлорфенил, 2-нитрофенил или 2-циано-3-хлорфенил.
5. Соединение по п.3, где R1 представляет необязательно замещенный пиридил, необязательно замещенный бензотиопиранил или необязательно замещенный карбазол, где необязательно замещенный пиридил, необязательно замещенный бензотиопиранил или необязательно замещенный карбазол необязательно замещен 1-4 заместителями, независимо выбранными из группы, включающей незамещенный C1-C7алкил, C1-C7алкокси, гало-(C1-C4)алкокси, СF3, F, Cl, Вr, CN и NO2.
6. Соединение по п.3, где R1 представляет незамещенный (С4-C20)алкил; (С4-С20)алкил, монозамещенный необязательно замещенным циклоалкилом, имеющим до четырех заместителей, каждый из которых независимо выбран из группы, включающей алкокси, (C1-C4)галоалкил, S-незамещенный алкшы, (C1-C4)галоалкокси, незамещенный алкил, незамещенный алкенил, галоген, SH, CN, NO2, NH2 и ОН; (С4-С20)алкил, монозамещенный необязательно замещенным фенилом, имеющим до четырех заместителей, каждый из которых независимо выбран из группы, включающей алкокси, (C1-C4)галоалкил, S-незамещенный алкил, (C1-C4)галоалкокси, незамещенный алкил, незамещенный алкенил, галоген, SH, CN, NO2, NH2 и ОН; или необязательно замещенный циклоалкил, имеющий до четырех заместителей, каждый из которых независимо выбран из группы, включающей алкокси, (C1-C4)галоалкил, S-незамещенный алкил, (C1-C4)галоалкокси, незамещенный алкил, незамещенный алкенил, галоген, SH, CN, NO2, NH2 и ОН.
7. Соединение по п.6, где R1 представляет незамещенный (С4-С20)алкил или необязательно замещенный циклоалкил.
8. Соединение по любому из пп.2-7, где
R2 представляет ОН или метокси,
R6 представляет водород,
R3 и R4 независимо представляют метил или этил, и
Z представляет О, S или незамещенный алкилен.
9. Соединение по п.8, где R1 представляет ОН и Z представляет О.
10. Соединение по п.8, которое представляет собой N-[2-гидрокси-3-(3-хлор-2-цианофенокси)пропил]-1,1-диметил-2-(4-метоксифенил)этиламин или его фармацевтически приемлемую соль.
11. Соединение по пп.2-7, где
R2 представляет водород,
R6 представляет водород,
R3 и R4 независимо представляют метил или этил, и
Z представляет О или метилен.
12. Фармацевтическая композиция, предназначенная для лечения заболевания или расстройства, которое характеризуется одним или несколькими следующими признаками: (1) аномальный костный или минеральный гомеостаз; (2) аномальное количество внеклеточного или внутриклеточного мессенджера, которое уменьшается при помощи соединения, способного влиять на активность одного или нескольких рецепторов кальция; или (3) аномальное действие внеклеточного или внутриклеточного мессенджера, которое уменьшается при помощи соединения, способного влиять на активность одного или нескольких рецепторов кальция, отличающаяся тем, что указанная композиция содержит терапевтически эффективное количество кальцилитического соединения, имеющего формулу
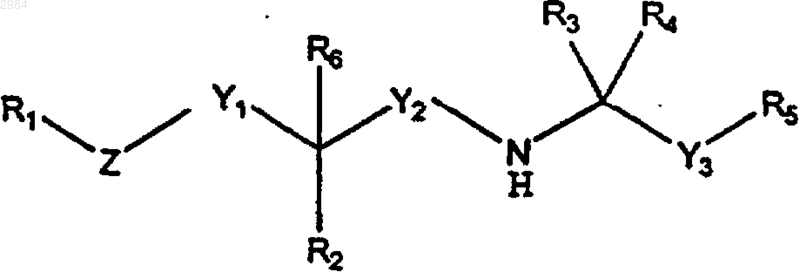
где R1 выбирают из группы, включающей арил, (С4-С20)алкил и циклоалкил;
R2 выбирают из группы, включающей (C1-C4)алкил, циклоалкил, алкокси, Н, ОН, =O, С(О)ОН, С(О)О-(C1-C4)алкил, С(О)NH-(C1-C4)алкил, С(О)N((C1-C4)алкил)2, SH, S-(C1-C4)алкил, NH2, NH-(C1-C4)алкил и N((C1-C4)-алкил)2;
R3 и R4 представляют собой, каждый независимо, (C1-C4)алкил или, взятые вместе, образуют циклопропил;
R5 представляет собой арил;
R6, если он присутствует, представляет собой либо водород, либо (C1-C4)алкил, либо (С2-С4)алкенил, причем R6 отсутствует в том случае, когда R2 представляет =O;
Y1 представляет собой (C1-C6)алкилен;
Y2 представляет собой метилен;
Y3 представляет собой (C1-С6)алкилен;
Z выбирают из группы, включающей О, S и алкилен;
при условии, что R1 не является 6-СN-2-пиридилом, замещенным 6-СN-2-пиридилом либо 3-СN-2-пиридилом или парагидроксифенилом либо замещенным парагидроксифенилом;
или его фармацевтически приемлемых солей;
и фармацевтически приемлемый носитель или наполнитель.
13. Композиция по п.12, отличающаяся тем, что указанная композиция предназначена для лечения заболевания или расстройства, характеризуемого указанным аномальным костным или минеральным гомеостазом.
14. Композиция по п.12, отличающаяся тем, что указанная композиция предназначена для лечения заболевания или расстройства, выбранного из группы, включающей остеосаркому, заболевание околозубной ткани, заживление переломов, остеоартрит, ревматоидный артрит, болезнь Педжета, злокачественную гуморальную гиперкальциемию и остеопороз.
15. Композиция по п.14, отличающаяся тем, что указанное заболевание или расстройство представляет собой остеопороз.
16. Фармацевтическая композиция, содержащая кальцилитическое соединение в терапевтически эффективном количестве, достаточном для увеличения уровня ПТГ в сыворотке, причем указанное соединение имеет формулу
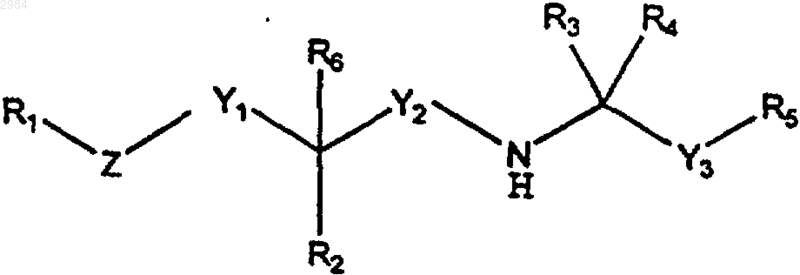
где R1 выбирают из группы, включающей арил, (С4-С20)алкил и циклоалкил;
R2 выбирают из группы, включающей (C1-C4)алкил, циклоалк, алкокси, Н, ОН, =O, С(О)ОН, С(О)О-(C1-C4)алкил, С(О)NH-(C1-C4)алкил, С(О)N((C1-C4)алкил)2, SH, S-(C1-C4)алкил, NH2, NH-(C1-C4)алкил, и N((C1-C4)алкил)2;
R3 и R4 представляют собой, каждый независимо, (C1-C4)алкил или, взятые вместе, образуют циклопропил;
R5 представляет собой арил;
R6, если он присутствует, представляет собой либо водород, либо (C1-C4)алкил, либо (С2-С4)алкенил, причем R6 отсутствует в том случае, когда R2 представляет =O;
Y1 представляет собой (C1-C6)алкилен;
Y2 представляет собой метилен;
Y3 представляет собой (C1-C6)алкилен;
Z выбирают из группы, включающей О, S и алкилен;
при условии, что R1 не является 6-СN-2-пиридилом, замещенным 6-CN-2-пиридилом либо 3-СN-2-пиридилом или парагидроксифенилом либо замещенным парагидроксифенилом;
или его фармацевтически приемлемые соли.
17. Композиция по п.16, отличающаяся тем, что введение указанной композиции вызывает увеличение уровня ПТГ в сыворотке, продолжающееся до одного часа.
18. Композиция по п.16, отличающаяся тем, что введение указанной композиции вызывает увеличение уровня ПТГ в сыворотке, продолжающееся от 1 до 12 ч.
19. Композиция по п.18, отличающаяся тем, что указанная продолжительность составляет примерно от 2 до 4 ч.
20. Композиция по п.16, отличающаяся тем, что введение указанной композиции вызывает увеличение уровня ПТГ в сыворотке на величину, которая в 0,5 раза больше, чем пиковое значение ПТГ в сыворотке у указанного пациента.
21. Композиция по п.16, отличающаяся тем, что введение указанной композиции вызывает увеличение уровня ПТГ в сыворотке на величину, которая в 0,5-5 раз больше, чем пиковое значение ПТГ в сыворотке у указанного пациента.
22. Композиция по п.16, отличающаяся тем, что введение указанной композиции вызывает увеличение уровня ПТГ в сыворотке на величину, которая в 5-10 раз больше, чем пиковое значение ПТГ в сыворотке у указанного пациента.
23. Композиция по п.16, отличающаяся тем, что введение указанной композиции вызывает увеличение уровня ПТГ в сыворотке на величину, которая не менее чем в 10 раз больше, чем пиковое значение ПТГ в сыворотке у указанного пациента.
24. Композиция по любому из пп.12-23, отличающаяся тем, что R5 представляет собой либо необязательно замещенный фенил, либо необязательно замещенный нафтил.
25. Композиция по п.24, отличающаяся тем, что
R1 представляет собой арил;
Y1 представляет собой метилен;
Y2 представляет собой метилен;
Y3 представляет собой метилен; и
Z выбирают из группы, включающей О, S, и незамещенный алкилен.
26. Композиция по п.25, отличающаяся тем, что
R2 представляет собой ОН или алкокси;
R6 представляет собой водород; и
Z выбирают из группы, включающей О, S и незамещенный алкилен.
27. Композиция по п.25, отличающаяся тем, что
R2 представляет собой ОН или метокси, и
R3 и R4 представляют собой, каждый независимо, (C1-C4)алкил.
28. Композиция по п.24, отличающаяся тем, что Z представляет собой О или метилен, R2 представляет ОН, R3 представляет метил или этил и R4 представляет метил или этил.
29. Композиция по п.28, отличающаяся тем, что R5 представляет собой замещенный фенил, имеющий от одного до четырех заместителей, каждый из которых независимо выбирают из группы, включающей метокси, (C1-C4)алкил, ОСF3, CFH2, CHF2, СF3, ОСН2СF3, F, Сl, Вг, I, ОН, SH, CN, NO2, NH2, диоксиметилен, NH-(C1-C4)алкил, N((C1-C4)алкил)2, С(О)-(C1-C4)алкил, S-(C1-C4)алкил, S(О)-(C1-C4)алкил, S(О)2-(C1-C4)алкил, ОС(О)-(C1-C4)алкил, SC(О)-(C1-C4)алкил, ОС(S)-(C1-C4)алкил, NHC(O)-(C1-С4)алкил, N((C1-C4)алкил)С(О)(C1-C4)алкил, NHC(S)-(C1-C4)алкил, N((C1-C4)алкил)С(S)(C1-C4)алкил, NHS(О)(C1-C4)алкил, N((C1-С4)алкил)S(O)(C1-C4)алкил, С(О)ОН, С(О)О-(C1-C4)алкил, C(O)NH2, С(О)NH(C1-C4)алкил, С(О)N((C1-C4)алкил)2, S(O)2NH2, S(O)2NH(C1-C4)алкил, и S(О)2N((C1-C4)алкил)2.
30. Композиция по п.28, отличающаяся тем, что каждый из заместителей при R5 независимо выбирают из группы, включающей метокси, галогензамещенный алкил, содержащий 1 атом углерода, S-(C1-C4)алкил, галогензамещенный алкокси, содержащий 1 атом углерода, (C1-C4)алкил, (С2-С4)алкенил, галоген, SH, CN, NO2, NH2 и ОН.
31. Композиция по п.28, отличающаяся тем, что R5 представляет собой замещенный фенил, имеющий, по меньшей мере, один заместитель в мета- или пара-положении, выбранный из группы, включающей (C1-C4)алкил, метокси, F, Cl, Вr и галогензамещенный алкокси, содержащий 1 атом углерода, при условии, что указанный замещенный фенил R5 может также иметь от 2 до 3 дополнительных заместителей.
32. Композиция по п.30 или 31, отличающаяся тем, что R1 представляет необязательно замещенный фенил, необязательно замещенный пиридил, необязательно замещенный бензотиопиранил или необязательно замещенный карбазол.
33. Композиция по п.32, отличающаяся тем, что R1 представляет замещенный фенил, имеющий от одного до четырех заместителей, каждый из которых независимо выбран из группы, включающей алкокси, галогензамещенный алкил, содержащий 1 атом углерода, S-(C1-C4)алкил, галогензамещенный алкокси, содержащий 1 атом углерода, (C1-C4)алкил, (С2-С4)алкенил, галоген, SH, CN, NO2, NH2, ОН и сульфамоил.
34. Композиция по п.32, отличающаяся тем, что R1 представляет 2-СN-фенил, 2,3-дихлорфенил, 2-нитрофенил или 2-циано-3-хлорфенил.
35. Композиция по п.28, отличающаяся тем, что R5 представляет собой замещенный нафтил, имеющий от одного до четырех заместителей, каждый из которых независимо выбирают из группы, включающей алкокси, галогензамещенный алкил, содержащий 1 атом углерода, S-(C1-C4)алкил, галогензамещенный алкокси, содержащий 1 атом углерода, (C1-C4)алкил, (С2-С4)алкенил, галоген, SH, CN, NO2, NH2 и ОН.
36. Композиция по п.35, отличающаяся тем, что R1 представляет замещенный фенил, имеющий от одного до четырех заместителей, каждый из которых независимо выбран из группы, включающей алкокси, галогензамещенный алкил, содержащий1 атом углерода, S-(C1-C4)алкил, галогензамещенный алкокси, содержащий 1 атом углерода, (C1-C4)алкил, (С2-С4)алкенил, галоген, SH, CN, NO2, NH2, ОН и сульфамоил.
37. Композиция по п.28, отличающаяся тем, что R5 представляет собой нафтил.
38. Композиция по п.37, отличающаяся тем, что R1 представляет необязательно замещенный фенил, необязательно замещенный пиридил, необязательно замещенный бензотиопиранил или необязательно замещенный карбазол.
39. Композиция по п.38, отличающаяся тем, что R1 представляет замещенный фенил, имеющий от одного до четырех заместителей, каждый из которых независимо выбран из группы, включающей алкокси, галогензамещенный алкил, содержащий 1 атом углерода, S-(C1-C4)алкил, галогензамещенный алкокси, содержащий 1 атом углерода, (C1-C4)алкил, (С2-С4)алкенил, галоген, SH, CN, NO2, NH2, OH.
40. Композиция по п.39, отличающаяся тем, что R1 представляет 2-СN-фенил, 2,3-дихлорфенил, 2-нитрофенил или 2-циано-3-хлорфенил.
41. Композиция по п.24, отличающаяся тем, что указанное соединение выбирают из группы, включающей
(R)-N-(2-гидрокси-3-(3-хлор-2-цианофенокси)пропил)-1,1-диметил-2-(4-метоксифенил)этиламин;
(R)-N-[2-гидрокси-3-((2,3-дихлор-4-дипропилсульфамоил)фенокси)-1-пропил]-N-(1,1-диметил-2-(4-метоксифенил)этил)амин;
N-(2-гидрокси-3-феноксипропил)-1,1-диметил-2-(2-нафтил)этиламин;
(R)-N-(2-гидрокси-3-(2,3-дихлорфенокси)пропил)-1,1-диметил-2-(4-метоксифенил)этиламин;
(R)-N-(2-гидрокси-3-(2-цианофенокси)пропил)-1,1-диметил-2-(4-метоксифенил)этиламин;
(R)-N-(2-гидрокси-3-(2-нитрофенокси)пропил)-1,1-диметил-2-(4-метоксифенил)этиламин;
и их фармацевтически приемлемые соли.
42. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически эффективное количество кальцилитического соединения, имеющего формулу
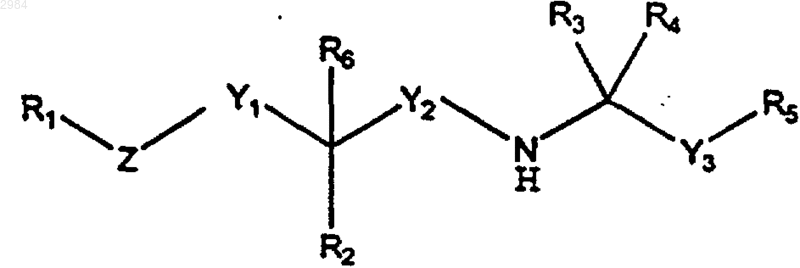
где R1 представляет собой 2-СN-фенил, 2,3-дихлорфенил, 2-нитрофенил, 2-циано-3-хлорфенил, необязательно замещенный пиридил, необязательно замещенный бензотиопиранил, необязательно замещенный карбазол или (С4-С20)алкил;
R2 выбирают из группы, включающей (C1-C4)алкил, (C5-C15)циклоалк, (C1-C12)алкокси, Н, ОН, =O, С(О)ОН, С(О)О-(C1-C4)алкил, С(О)NH-(C1-C4)алкил, С(О)N((C1-C4)алкил)2, SH, S-(C1-C4)алкил, NH2, NH-(C1-C4)алкил, и N((C1-C4)алкил)2;
R3 и R4 представляют собой, каждый независимо, (C1-C4)алкил или, взятые вместе, образуют циклопропил;
R5 представляет собой либо замещенный нафтил, имеющий от одного до четырех заместителей, независимо выбираемых из группы, включающей метил, этил, изопропил, метокси, Cl, F, Вr и галогензамещенный алкокси, содержащий 1 атом углерода, либо замещенный фенил, имеющий от одного до четырех заместителей, в тюь числе, по меньшей мере, один заместитель в мета- или пара-положении, выбранный из группы, включающей (C1-C4)алкил, метокси, F, Cl, Вr и галогензамещенный алкокси, содержащий 1 атом углерода, при условии, что указанный замещенный фенил R5 может также иметь от 2 до 3 дополнительных заместителей;
R6, если он присутствует, представляет собой либо водород, либо (C1-C4)алкил, либо (С2-С4)алкенил, причем R6 отсутствует в том случае, когда R2 представляет =O;
Y1 представляет собой ковалентную связь, (C1-C6)алкилен или (С2-С6)алкенилен;
Y2 представляет собой (C1-С6)алкилен;
Y3 представляет собой (C1-C6)алкилен;
Z выбирают из группы, включающей ковалентную связь, О, S, NH, N-(C1-C4)алкил, (C1-C6)алкилен, (С2-С6)алкенилен, и (C2-С6)алкинилен, при условии, что, если Z представляет собой О, S, NH или N-(C1-C4)алкил, то Y1 не является ковалентной связью, и дополнительно при условии, что вместе взятые Y1 и Z могут быть ковалентной связью;
при условии, что R1 не является 6-СN-2-пиридилом, замещенным 6-СN-2-пиридилом либо 3-CN-2-пиридилом или парагидроксифенилом либо замещенным парагидроксифенилом;
и дополнительно при условии, что если R5 представляет замещенный фенил, то он не может быть 3,5-диметоксифенилом;
или его фармацевтически приемлемых солей.
43. Способ скрининга кальцилитического соединения, включающий стадию измерения способности соединения ингибировать активность одного или более рецепторов кальция, причем указанное соединение имеет формулу
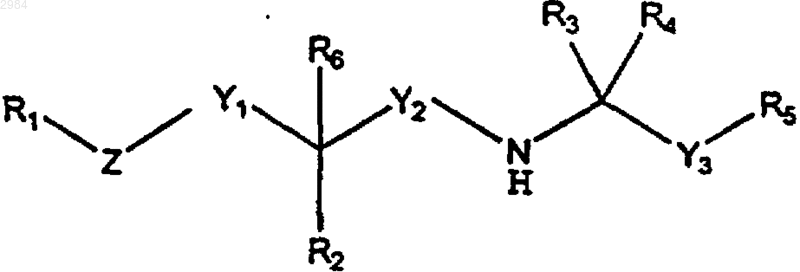
где R1 выбирают из группы, включающей арил, (С4-С20)алкил и циклоалк;
R2 выбирают из группы, включающей (C1-C4)алкил, циклоалк, алкокси, Н, ОН, =O, С(О)ОН, С(О)О-(C1-C4)алкил, С(О)NH-(C1-C4)алкил, С(О)N((C1-C4)алкил)2, SH, S-(C1-C4)алкил, NH2, NH-(C1-C4)алкил и N((C1-C4)алкил)2;
R3 и R4 представляют собой, каждый независимо, (C1-C4)алкил или, взятые вместе, образуют циклопропил;
R5 представляет собой арил;
R6, если он присутствует, представляет собой либо водород, либо (C1-C4)алкил, либо (С2-С4)алкенил, причем R6 отсутствует в том случае, когда R2 представляет =O;
Y1 представляет собой ковалентную связь, алкилен или алкенилен;
Y2 представляет собой алкилен;
Y3 представляет собой алкилен;
Z выбирают из группы, включающей О, S, NH, N-(C1-C4)алкил, алкилен, алкенилен и алкинилен, при условии, что, если Z представляет собой либо О, S, NH, либо N-(C1-C4)алкил, то Y1 не является ковалентной связью; и дополнительно при условии, что Y1 и Z могут вместе быть ковалентной связью;
и его фармацевтически приемлемые соли.
44. Способ по п.43, который осуществляют в условиях, при которых ингибируется поток внеклеточного Са2+ внутрь клетки.
Текст
1 Настоящее изобретение относится к соединениям, способным ингибировать активность рецептора кальция, и к применению таких соединений. Предпочтительно описанные здесь соединения назначают пациентам для достижения терапевтического эффекта. Обоснование изобретения Некоторые клетки организма реагируют не только на химические сигналы, но также на ионы, такие как внеклеточные ионы (Са 2+). Внеклеточный Са 2+ находится под строгим гомеостатическим контролем и регулирует различные процессы, такие как свертывание крови, нервная и мышечная возбудимость и правильное образование костей. Протеины, являющиеся рецепторами кальция, дают определенные специализированные клетки для отклика на изменение концентрации внеклеточного Са 2+. Например, внеклеточный Са 2+ подавляет секрецию паратироидного гормона (ПТГ) из паратироидных клеток (клеток паращитовидной железы), тормозит всасывание кости остеокластами и стимулирует секрецию кальцитонина из С-клеток. ПТГ является главным эндокринным фактором регуляции гомеостазиса Са 2+ в крови и внеклеточных жидкостях. ПТГ, действуя на клетки кости и почек, увеличивает уровень Са 2+ в крови. Это увеличение внеклеточного Са 2+ затем действует как сигнал отрицательной обратной связи, подавляя секрецию ПТГ. Обратная зависимость между внеклеточным Са 2+ и секрецией ПТГ образует важный механизм,поддерживающий гомеостаз Са 2+ в организме. Внеклеточный Са 2+ действует непосредственно на клетки паращитовидной железы для регуляции секреции ПТГ. Было подтверждено существование поверхностного протеина паратироидных клеток, который обнаруживает изменение внеклеточного Са 2+ (Brown et al., Nature, 366:574, 1993). В паратироидных клетках этот протеин - рецептор кальция действует как рецептор для внеклеточного Са 2+, обнаруживает изменение концентрации ионов внеклеточного Са 2+ и инициирует функциональный клеточный отклик - секрецию ПТГ. Внеклеточный Са 2+ может оказывать влияние на различные клеточные функции, обзор которых дан в Nemeth et al., Cell Calcium 11:319,1990. Роль внеклеточного Са 2+ в парафолликулярных и паратироидных клетках обсужденаNemeth et al Cell Calcium 11:323, 1990. Показано, что эти клетки ведут себя подобно рецепторам кальция (см. Brown et al., Nature, 366:574,1993; Mithal et al., J.Bone Miner. Res.9, Suppl.1,s282, 1994; Rogers et al., J.Bone Miner. Res.9,Suppl. 1, s409, 1994; Garrett et al., Endocrinology 136: 5211, 1995). Роль внеклеточного Са 2+ в рассасывании костей обсуждена Zaidi, BioscienceReports 10:493, 1990. Способность различных молекул имитировать внеклеточный Са 2+ in vitro обсуждена в та 002984WO 94/18959 и Nemeth et al., PCT/US 94/12117,международная публикация WO 95/11211 характеризует молекулы, активные в качестве рецепторов кальция, и относит к кальцилитикам соединения, способные подавлять активность рецептора кальция. Например, в WO 94/18959 на с. 8, строках 2-13, утверждается:"Заявитель также первым описал способы,которыми молекулы, активные на этих рецепторах Са 2+, могут быть идентифицированы и использованы как лидирующие молекулы при исследованиях, разработке, проектировании, модификации и/или конструировании полезных кальцимиметиков или кальцилитиков, которые активны на рецепторах Са 2+. Такие кальцимиметики или кальцилитики являются полезными для лечения различных болезненных состояний,характеризуемых ненормальным уровнем одного или нескольких компонентов, например, полипептидов, таких как гормоны, ферменты или факторы роста, проявление и/или выделение которых регулируется активностью на одном или нескольких рецепторов Са 2+ или находится под ее влиянием." Приведенные выше ссылки не следует считать уровнем техники, относящимся к предложенной формуле изобретения. Настоящее изобретение характеризует кальцилитические соединения. Термин "кальцилитические соединения" относится к соединениям, способным подавлять активность рецептора кальция. Способность соединения "подавлять активность рецептора кальция" означает,что соединение вызывает понижение активности одного или нескольких рецепторов кальция,возбуждаемой внеклеточным Ca2+. Использование кальцилитических соединений для подавления активности рецепторов кальция и/или достижения благоприятного эффекта у пациента описано ниже. Ниже также описаны способы, которые могут быть применены для получения дополнительных кальцилитических соединений. Примером описываемых кальцилитических соединений является структура I производных ,-дизамещенного арилалкиламина,имеющих химическую формулу Структура IR3 и R4, каждый независимо, представляет низший алк или вместе образуют циклопропил;Y1 представляет или ковалентную связь,алкилен, или алкенилен;Z выбирают из группы, включающей ковалентную связь, О, S, NH, N-низший алк, алкилен, алкенилен и алкинилен, при условии, что,если Z или О, S, NH или N-низший алк, то Y1 не является ковалентной связью, и при дополнительном условии, что Y1 и Z могут вместе быть ковалентной связью; и его фармацевтически приемлемые соли и комплексы. Термины арил, алк c длинной цепью, низший алк, циклоалк, алкокси, алкилен, алкенилен и алкинилен вместе с возможными заместителями определены в разделе II ниже. Раздел II ниже также дает определения для других химических групп, описанных в настоящем описании. Предпочтительные кальцилитические соединения имеют IC50 50 мкМ, более предпочтительно IC50 10 мкМ и еще более предпочтительно IC50 1 мкМ, измеренную с использованием "Испытания ингибитора рецептора кальция", описанного в примере 1 ниже. Таким образом, первый аспект настоящего изобретения описывает способ лечения пациента путем приема пациентом терапевтически эффективного количества производного ,дизамещенного арилалкиламина структуры I. Лечение может проводиться, например, для того, чтобы замедлить развитие заболевания у пациента, имеющего заболевание, или для того,чтобы профилактически замедлить или предотвратить наступление заболевания. Терапевтически эффективным количеством является количество соединения, которым достигается терапевтический эффект замедления развития заболевания у пациента, имеющего заболевание, или профилактического замедления или предотвращения наступления болезни. Предпочтительно это то количество, которое до некоторой степени снимает один или более из симптомов заболевания или расстройства у пациента, возвращает к нормальному или частично, или полностью один или несколько физиологических или биохимических параметров, 002984 4 связанных с заболеванием или расстройством или вызванных ими; и/или уменьшает вероятность наступления заболевания или расстройства. Термин "пациент" относится к млекопитающему, у которого соединения, характеризуемые их способностью подавлять активность рецептора кальция in vivo или in vitro, будут иметь благоприятный эффект. Предпочтительно, пациентом является человек. Пациенты, которым благоприятен прием терапевтического количества кальцилитического соединения, могут быть выявлены при использовании стандартных методик, известных медикам. Заболевания или расстройства, которые могут лечиться путем ингибирования активности одного или нескольких рецепторов кальция, включают один или несколько из следующих типов: (1) те, которые характеризуются аномальным костным и минеральным гомеостазом; (2) те, которые характеризуются аномальным количеством внеклеточного или внутриклеточного мессенджера, на продуцирование которого может влиять активность одного или нескольких рецепторов кальция; (3) те, которые характеризуются аномальным эффектом (например, эффектом, отличающимся по виду или величине) внеклеточного или внутриклеточного мессенджера, который сам может быть усилен активностью одного или нескольких рецепторов кальция; и (4) другие заболевания или расстройства, где подавление активности одного или нескольких рецепторов кальция усиливает благоприятный эффект, например, при заболеваниях или расстройствах, где продуцирование внутриклеточного или внеклеточного мессенджера, стимулированное активностью рецептора,компенсирует аномальное количество другого мессенджера. Считается, что примеры внеклеточных мессенджеров, на чью секрецию и/или эффект может влиять подавление активности рецептора кальция, включают неорганические ионы, гормоны, нейромедиаторы, факторы роста и хемокины. Примеры внутриклеточных мессенджеров включают cAMP, cGMP, IР 3, кальций, магний и диацилглицерин. Предпочтительно пациентом является человек, имеющий заболевание или расстройство,характеризуемое одним или несколькими следующими признаками: (1) аномальный костный или минеральный гомеостаз; (2) аномальное количество внеклеточного или внутриклеточного мессенджера, которое уменьшается посредством соединения, способного влиять на активность одного или нескольких рецепторов кальция; (3) аномальный эффект внеклеточного или внутриклеточного мессенджера,который уменьшается посредством соединения, способного влиять на активность одного или нескольких рецепторов кальция. Предпочтительно болезнь или расстройство характеризуется аномальным костным и 5 минеральным гомеостазом, более предпочтительно кальциевым гомеостазом. Аномальный кальциевый гомеостаз характеризуется одной или более из следующих активностей: (1) аномальное увеличение или уменьшение кальция в сыворотке; (2) аномальное увеличение или уменьшение выделения кальция с мочей; (3) аномальное увеличение или уменьшение уровня костного кальция, что проявляется, например,при измерении минеральной плотности кости;(4) аномальное поглощение вводимого с пищей кальция; (5) аномальное увеличение или уменьшение продуцирования и/или выпуска мессенджеров, которые влияют на уровень кальция в сыворотке, таких как ПТГ и кальцитонин; и (6) аномальное изменение отклика,вызываемого мессенджерами, который влияет на уровень кальция в сыворотке. Аномальное увеличение или уменьшение в этих различных аспектах кальциевого гомеостаза является относительным по сравнению с тем, которое проявляется у популяции в целом и обычно связывается с заболеванием или расстройством. Предпочтительно кальцилитические соединения используются для лечения заболеваний, выбранных из группы, включающей заболевание паращитовидной железы, саркому кости, околозубную болезнь, излечение переломов,остеоартриты, ревматоидные артриты, болезнь Педжета, гуморальное злокачественное повышенное содержание кальция в крови и остеопороз. Другой аспект настоящего изобретения описывает способ лечения пациента, включающий стадию введения пациенту количества кальцилитического соединения, достаточного для увеличения уровня ПТГ в сыворотке. Предпочтительно способ осуществляется путем введения такого количества соединения, которое способно вызвать увеличение продолжительности и/или количества ПТГ сыворотки, достаточного для оказания терапевтического эффекта. Увеличение ПТГ сыворотки может быть использовано для того, чтобы достичь терапевтического эффекта замедления заболевания у пациента, имеющего болезнь, или профилактически задержать или предотвратить наступление заболевания. Профилактическое лечение может быть проведено, например, лицу с аномально низким уровнем ПТГ сыворотки, или лицу, не имеющему низкий уровень ПТГ сыворотки, но для которого увеличение ПТГ даст благоприятный эффект. Аномально низким ПТГ сыворотки является уровень ПТГ сыворотки ниже того,который встречается у популяции в среднем, и является предпочтительно тем количеством,которое связывается с болезнью или наступлением болезни. Повышенные уровни ПТГ сыворотки могут быть применены для лечения различных типов заболеваний, включающих костные и минеральные заболевания. 6 В различных осуществлениях соединение вводится пациенту для того, чтобы вызвать увеличение ПТГ сыворотки продолжительностью до 1 ч, примерно от 1 до 24 ч, примерно от 1 до 12 ч, примерно от 1 до 6 ч, примерно от 1 до 5 ч,примерно от 2 до 5 ч, примерно от 2 до 4 ч или примерно от 3 до 6 ч. В других дополнительных примерах осуществления изобретения соединение вводят пациенту для того, чтобы вызвать увеличение ПТГ сыворотки в 0,5 раз, 0,5-5 раз, 5-10 раз и, по меньшей мере, в 10 раз выше пикового значения ПТГ сыворотки пациента. Пиковый уровень сыворотки измеряется по отношению к пациенту, не подвергавшемуся лечению. Другой аспект настоящего изобретения характеризует кальцилитические соединения структуры I. Другой аспект настоящего изобретения характеризует фармацевтические композиции,включающие фармацевтически приемлемый носитель и описанное здесь кальцилитическое соединение. Фармацевтическая композиция содержит кальцилитическое соединение в форме,подходящей для введения млекопитающим,предпочтительно человеку. Предпочтительно фармацевтическая композиция содержит количество кальцилитического соединения в соответствующей фармацевтической форме дозировки, достаточное для того, чтобы оказать терапевтический эффект на человека. Однако для лечения пациента могут быть применены многократные дозы фармацевтических композиций. Соображения и факторы относительно дозированных форм, подходящих для введения,известны из практики и включают возможные токсические эффекты, растворимость, путь введения и поддержание активности. Например,фармацевтические композиции, вводимые инъекцией в кровепоток, должны быть растворимыми. Другой аспект настоящего изобретения характеризует метод скрининга для структуры I производных ,-дизамещенного арилалкиламина, способных подавлять активность рецептора кальция. Метод включает стадии контактирования клетки, имеющей рецептор кальция со структурой I производного ,-дизамещенного арилалкиламина и измерения способности соединения подавлять активность рецептора кальция. Метод скрининга может быть осуществленin vivo или in vitro и особенно полезен для идентификации тех производных ,-дизамещенного арилалкиламина структуры I, которые наиболее способны действовать как кальцилитические соединения. Анализ in vivo включает измерение физиологического параметра, связанного с активностью рецептора кальция, такого как уровни гормона сыворотки или концентрация иона кальция сыворотки. Анализ in vitro вклю 7 чает измерение способности кальцилитических соединений влиять на концентрацию внутриклеточного кальция или на клеточную секрецию гормона. Примеры гормонов, на уровень которых могут влиять кальцилитические соединения, включают ПТГ и кальцитонин. Описанные здесь кальцилитические соединения могут быть использованы как часть способов in vivo или in vitro. Предпочтительно соединения используются in vivo, чтобы достичь благоприятного эффекта для пациента. Примеры использований in vivo и другие использования in vivo включают использование в способе идентификации других кальцилитических соединений и использование в качестве инструмента для исследования активности рецептора кальция или физиологических эффектов подавления активности рецептора кальция в различных организмах. Другие характерные особенности и преимущества изобретения будут ясны из подробного описания, примеров и формулы изобретения. Настоящее описание показывает способность кальцилитических соединений оказывать физиологически релевантное влияние на клетки,иллюстрируя способность таких соединений увеличивать секрецию ПТГ, и также выявляет положение мишени для кальцилитических соединений. Можно считать, что настоящее изобретение является первым, демонстрирующим,что кальцилитические соединения могут увеличивать секрецию ПТГ. Рецепторы кальция присутствуют в клетках различного типа и могут регулировать различные отклики у клеток различного типа. Хотя считается, что описанные здесь кальцилитические соединения действуют на рецептор кальция через сайт, модулирующий активность рецептора кальция, если другое не оговорено ясно в формуле, что соединение оказывает эффект,воздействуя на рецептор кальция через такой сайт, здесь нет намерения свести заявленные способы или соединение к требованию подавления активности рецептора кальция или к любому конкретному способу действия. Скорее настоящее описание демонстрирует, что соединения, способные подавлять (ингибировать) активность рецептора кальция, чья кальцилитическая активность может быть измерена invivo или in vitro, вызывает значительные физиологические эффекты. Например, настоящее описание демонстрирует способность различных кальцилитических соединений предотвращать ингибирование ПТГ Са 2+ и тем самым приводить к увеличению высвобождения ПТГ. Соединения, связанные с сайтом, модулирующим активность рецептора кальция, могут быть идентифицированы при использовании соединения-метки, связанного с сайтом, в формате опыта по конкурентному связыванию. 8 Описанные здесь предпочтительные кальцилитические соединения представляют собой производные структуры I ,-дизамещенного арилалкиламина, способные подавлять активность рецептора кальция. Другие аспекты настоящего изобретения включают анализы, которые могут быть использованы для идентификации тех производных структуры I ,дизамещенного арилалкиламина, которые, как ожидается, должны быть эффективными при подавлении активности рецептора кальция,и/или при проявлении терапевтического эффекта у пациента; предпочтительные группы производных структуры I ,-дизамещенного арилалкиламина; и использование описанных здесь соединений для лечения различных заболеваний или расстройств.I. Активность рецептора кальция Рецептор кальция откликается на изменения концентраций внеклеточного кальция. Точные изменения, являющиеся результатом активности рецептора кальция, зависят от конкретных рецептора и клетки, содержащей рецептор. Например, эффект in vitro кальция на рецептор кальция в клетке паращитовидной железы включает следующее. 1. Увеличение внутреннего кальция [Са 2+]i. Увеличение вызвано притоком внешнего кальция и/или мобилизацией внутреннего кальция. Характеристики увеличения внутреннего кальция включают следующее:(a) быстрое (время до пика 5 с) и скоротечное увеличение [Са 2+]i, которое является невосприимчивостью к ингибированию 1 мкМLa3+ или 1 мкМ Gd3+ и снимается предварительной обработкой иономицином (в отсутствии внеклеточного Са 2+);(b) увеличение не ингибируется дигидропиридинами;(c) скоротечное увеличение снимается предварительной обработкой в течение 10 мин 10 мМ фтористым натрием;(d) скоротечное увеличение уменьшается предварительной обработкой активатором протеина киназы С(ПКС), таким как форболмиристатацетат (ФМА), мезерин или (-)-индолактам V. Общий эффект активатора протеина киназы С заключается в том, чтобы сдвинуть кривую концентрация-отклик кальция вправо, не меняя максимальный отклик; иpertussis (100 нг/мл в течение 4 ч) не влияет на увеличение. 2. Быстрое (менее 30 с) увеличение образования инозитол-1,4,5-трифосфата и/или диацилглицерина. Предварительная обработка токсином pertussis (100 нг/мл в течение 4 ч) не влияет на это увеличение. 3. Ингибирование образования циклической АМР, стимулированного допамином и 9 изопротенеролом. Этот эффект блокируется предварительной обработкой токсином pertussis(100 нг/мл в течение более 4 ч). 4. Ингибирование секреции ПТГ. Предварительная обработка токсином pertussis (100 нг/мл в течение 4 ч) не влияет на ингибирование секреции ПТГ. Кальцилитическая активность соединения может быть определена с использованием таких методик, как те, что описаны в примерах ниже,и те, что описаны в публикациях, таких как Nemeth et al., PCT/US 92/07175, международная публикация WO 93/04373, Nemeth et al., PCT/US 93/01642, международная публикация WO 94/18959 и Nemeth et al., PCT/US 94/12117, международная публикация WO 95/11211 (каждый из которых вводится сюда в качестве ссылки). Кальцилитическая активность варьируется в зависимости от типа клетки, в которой измеряется активность,например,кальцилитическое соединение обладает одним или несколькими и предпочтительно всеми из следующих характеристик, если испытываются invitro клетки паращитовидной железы. 1. Соединение блокирует частично или полностью способность увеличенных концентраций внеклеточного Са 2+:(a) увеличивать [Са 2+]i,(b) мобилизовать внутриклеточный Са 2+,(c) увеличивать образование инозитол 1,4,5-трифосфата,(d) уменьшать образование циклической(е) подавлять секрецию ПТГ. 2. Соединение блокирует увеличение потока СГ в овоцитах Xenopus, введенных инъекций с поли (A)+-mRNA из бычьих или человеческих паратироидных клеток, вызванные внеклеточным Са 2+, но не в овоцитах Xenopus, введенных инъекцией с водой. 3. Подобным образом соединение блокирует отклик у овоцитов Xenopus, введенных инъекцией с клонированной нуклеиновой кислотой, экспрессирующей рецепторы кальция,вызванный внеклеточным Са 2+ или кальцимиметическим соединением (т.е. соединением,способным имитировать эффект внеклеточного Са 2+, включая соединения, усиливающие эффект внеклеточного Са 2+). Рецепторы кальция присутствуют в различных клетках. Фармакологические реакции в ответ на внеклеточный Са 2+ совместимы с наличием рецептора кальция в нижеперечисленных клетках; паратироидные клетки (клетки паращитовидной железы), остеокласты кости, околопочечноклубочные клетки, клетки, расположенные у внутреннего конца почечных трубочек, периферические клетки почечных трубочек,клетки центральной нервной системы, клетки периферической нервной системы, клетки толстой восходящей части петли Хенле и/или сбор 002984 10 ного протока, кератиноциты эпидермиса, парафолликулярные клетки щитовидной железы (Склетки), клетки кишечника, тробопласты плаценты, тромбоциты, сосудистые клетки гладких мышц, клетки предсердия, клетки, выделяющие гастрин, клетки, выделяющие глюкагон, мезангиальные почечные клетки, околососковые клетки, эндокринные и экзокринные клетки поджелудочной железы, жировые/сальные клетки, иммунные клетки, клетки желудочнокишечного тракта, клетки кожи, клетки надпочечника, клетки гипофиза, клетки гипоталамуса и клетки органа, лежащего под сводом головного мозга. Наличие рецептора кальция было подтверждено с использованием физических данных, таких как гибридизация с нуклеиновой кислотой, кодирующей рецептор кальция, для следующих клеток: паратироидные клетки(клетки паращитовидной железы), клетки центральной нервной системы, клетки периферической нервной системы, клетки толстой восходящей части петли Хенле и/или сборного протока почек, парафолликулярные клетки щитовидной железы (С-клетки), клетки кишечника,клетки желудочно-кишечного тракта, клетки гипофиза, клетки гипоталамуса и клетки органа,лежащего под сводом головного мозга, и эндокринные и экзокринные клетки поджелудочной железы.II. Производные ,-дизамещенного арилалкиламина Структура I производных ,-дизамещенного арилалкиламина имеет следующую химическую формулу: Структура I где R1 выбирается из группы, включающей арил, алк с длинной цепью и циклоалк. Предпочтительно R1 представляет любой из следующих: необязательно замещенный фенил, необязательно замещенный пиридил, необязательно замещенный бензотиопиранил, необязательно замещенный карбазол, необязательно замещенный нафтил, необязательно замещенный тетрагидронафтил, необязательно замещенный алкил с длинной цепью, необязательно замещенный алкенил с длинной цепью или необязательно замещенный циклоалк. Более предпочтительно R1 представляет любой из следующих: необязательно замещенный фенил, необязательно замещенный нафтил,необязательно замещенный пиридил, необязательно замещенный бензотиопиранил, необязательно замещенный карбазол, необязательно замещенный алкил с длинной цепью, необязательно замещенный алкенил с длинной цепью или монозамещенный длинноцепной алкил или 11 алкенил, где заместитель представляет или необязательно замещенный фенил или необязательно замещенный циклоалкил, при условии,что необязательно замещенный фенил или необязательно замещенный циклоалкил может иметь от одного до четырех заместителей, независимо выбранных из группы, состоящей из алкокси, низший галоалкил, S-незамещенный алкил, низший галоалкокси, незамещенный алкил, незамещенный алкенил, галоген, SH, CN,NO2, NH2 и ОН;R2 выбирается из группы, состоящей из низшего алк, циклоалк, алкокси, Н, ОН, =O,С(O)ОН, С(O)O-низший алк, С(O)NН-низший алк, С(O)N(низший алк)2, SH, S-низший алк,NH2, NH-низший алк и N(низший алк)2. Более предпочтительно R2 представляет ОН или алкокси и еще более предпочтительно R2 представляет ОН или метокси;R3 и R4, каждый независимо, представляет низший алк или вместе циклопропил. Предпочтительно R3 и R4, каждый независимо, представляет низший алкил, более предпочтительноR3 и R4, каждый независимо, представляет метил или этил;R5 представляет арил. Предпочтительно R5 представляет или необязательно замещенный нафтил, или необязательно замещенный фенил. Более предпочтительно R5 представляет замещенный фенил, имеющий заместитель в метаили пара-положении и необязательно содержащий дополнительные заместители;Y1 представляет ковалентную связь, алкилен или алкенилен. Предпочтительно Y1 представляет или ковалентную связь, или низший алкилен. Более предпочтительно Y1 представляет метилен;Z выбирается из группы, включающей ковалентную связь, О, S, NH, N-низший алк, алкилен, алкенилен и алкинилен, при условии, что если Z представляет любой из О, S, NH или Nнизший алк, то Y1 не является ковалентной связью, и при дополнительном условии, что Y1 и Z могут вместе быть ковалентной связью. Предпочтительно Z выбирается из группы, включающей ковалентную связь, О, S, NH, N-низший алк и алкилен. Более предпочтительно Z представляет любой из О, S, низшего алкилена, и еще более предпочтительно Z представляет O; 12 и его фармацевтически приемлемые соли и комплексы."Алк" относится к алкилу, алкенилу или алкинилу. "Низший алк" относится к низшему алкилу, низшему алкенилу или низшему алкинилу, предпочтительно к низшему алкилу."Алкенил" относится к необязательно замещенной углеводородной группе, содержащей,по меньшей мере, одну двойную связь углеродуглерод между атомами углерода и содержащую 2-15 соединенных вместе атомов углерода. Алкенильная углеводородная группа может иметь прямую цепь или включать одну или более боковых ветвей. Разветвленный или прямоцепной алкенил предпочтительно имеет от 2 до 7 атомов углерода, каждый из которых может быть необязательно замещен. Заместители алкенила, каждый независимо, выбирается из группы, включающей низший алкил, низший алкенил, галоген, алкокси, низший галоалкил,низший галоалкокси, метилендиокси, незамещенный арил, незамещенный циклоалкил, ОН,SH, CN, NO, NO2, NH2, CH=NNHC(O)NH2,CH=NNHC(S)NH2,CH2O-низший алкил,С(O)низший алкил, C(O)NH2, С(O)NH-низший алкил, С(O)N(низший алкил)2, C(O)OH, С(O)Oнизший алкил, NH-низший алкил, N(низший алкил)2,NHC(O)незамещенный арил,NHC(O)низший алкил, N=N-незамещенный арил, NHC(O)NH2, N(низший алкил)С(O) низший алкил, NHC(S)низший алкил, N(низший алкил)C(S)низший алкил, NHS(O)низший алкил,N(низший алкил)S(O)низший алкил, ОС(O) низший алкил, ОСН 2 С(O)ОН, ОС(S)низший алкил, S(O)низший алкил, SC(O)низший алкил,S-низший алкил, S-низший галоалкил, SO2 низший алкил,SО 2-низший галоалкил,S(O)2NН 2, S(O)2NН-низший алкил и S(O)2N(низший алкил)2. Предпочтительно присутствует не более трех заместителей. Еще более предпочтительно алкенил представляет низший алкенил,который является незамещенным алкенилом с разветвленной или прямой цепью, имеющим от 2 до 4 атомов углерода."Алкил" относится к необязательно замещенной углеводородной группе, присоединенной одинарными связями углерод-углерод и имеющей 1-15 соединенных вместе атомов углерода. Алкильная углеводородная группа может иметь прямую цепь или содержать одну или несколько боковых ветвей. Алкил с разветвленной или прямой цепью предпочтительно имеет от 1 до 7 атомов углерода, каждый из которых может быть необязательно замещен. Заместители алкила, каждый независимо, выбирается из заместителей, описанных выше для алкенила. Предпочтительно присутствует не более трех заместителей. Более предпочтительно алкил представляет собой низший алкил, который является незамещенным алкилом с разветвленной или прямой цепью длиной от 1 до 4 атомов углерода."Алкинил" относится к необязательно замещенной углеводородной группе, содержащей,по меньшей мере, одну тройную связь углеродуглерод между атомами углерода и включающую 2-15 соединенных вместе атомов углерода. Алкинильная углеводородная группа может иметь прямую цепь или одну или несколько боковых цепей. Алкинил с прямой или разветвленной цепью преимущественно имеет от 2 до 7 атомов углерода, каждый из которых может быть необязательно замещен. Заместители алкинила каждый независимо выбирается из заместителей, описанных выше для алкенила. Предпочтительно присутствует не более трех заместителей. Более предпочтительно алкинил представляет собой низший алкинил, который является незамещенным алкинилом с разветвленной или прямой цепью, имеющей от 2 до 4 атомов углерода."Алкенилен" относится к необязательно замещенной углеводородной цепи, содержащей,по меньшей мере, одну двойную связь углеродуглерод между атомами углерода. Алкениленовая цепь имеет от 2 до 6 атомов углерода и присоединена по двум положениям к другим функциональным группам структурных фрагментов. Заместители алкенилена, каждый независимо,выбирается из заместителей, описанных выше для алкенила. Предпочтительно присутствует не более трех заместителей. Более предпочтительно алкенилен представляет собой "низший алкенилен", который является незамещенным алкениленом с разветвленной или прямой цепью,имеющей от 2 до 3 атомов углерода."Алкокси" относится к кислороду, присоединенному к незамещенному алкилу длиной от 1 до 12 атомов углерода, предпочтительно от 1 до 2 атомов углерода. Более предпочтительно алкокси представляет метокси."Алкилен" относится к необязательно замещенной углеводородной цепи, содержащей только одинарные связи углерод-углерод между атомами углерода. Алкиленовая цепь имеет от 1 до 6 атомов углерода и присоединена по двум положениям к другим функциональным группам структурных фрагментов. Заместители алкилена каждый независимо выбирается из заместителей, описанных выше для алкенила. Предпочтительно присутствует не более трех заместителей. Более предпочтительно алкилен представляет собой "низший алкилен", который является незамещенным алкиленом с разветвленной или прямой цепью, имеющей от 1 до 3 атомов углерода."Алкинилен" относится к необязательно замещенной углеводородной цепи, включающей, по меньшей мере, одну тройную связь углерод-углерод между атомами углерода. Алкиниленовая цепь имеет от 2 до 6 атомов углерода и присоединена по двум положениям к другим функциональным группам структурных фрагментов. Заместители алкинилена каждый неза 002984 14 висимо выбирается из заместителей, описанных выше для алкенила. Более предпочтительно алкинилен представляет собой "низший алкинилен", который является незамещенным алкиниленом с разветвленной или прямой цепью,имеющей от 2 до 3 атомов углерода."Арил" относится к необязательно замещенной ароматической группе, по меньшей мере, с одним кольцом, имеющим систему сопряженных пи-электронов, включающей до двух систем из сопряженных или конденсированных колец. Арил включает карбоциклический арил,гетероциклический арил и биарильные группы,все из которых могут быть необязательно замещены. Предпочтительно арил представляет необязательно замещенный фенил, необязательно замещенный пиридил, необязательно замещенный бензотиопиранил, необязательно замещенный карбазол, необязательно замещенный нафтил, или необязательно замещенный тетрагидронафтил. Для арила R1 левой стороны структуры I и для арила R5 правой стороны структуры I предпочтительны разные заместители. Предпочтительно арил имеет не более пяти независимо выбранных заместителей. Предпочтительно, когда R1 представляет арил, этот арил является необязательно замещенным фенилом, необязательно замещенным пиридилом, необязательно замещенным бензотиопиранилом, необязательно замещенным карбазолом, необязательно замещенным нафтилом или необязательно замещенным тетрагидронафтилом. Предпочтительно заместители R1, каждый независимо, выбирается из группы, включающей незамещенный алкил, незамещенный алкенил, галоген, алкокси, низший галоалкил,низший галоалкокси, диоксиметилен, незамещенный арил, незамещенный циклоалкил, ОН,SH, CN, NO, NO2, NH2, диоксиметилен,CH=NNHC(O)NH2, CH=NNHC(S)NH2, СН 2 Онезамещенный алкил, С(O)незамещенный алкил, C(O)NH2, С(O)NН-незамещенный алкил,С(O)N(незамещенный алкил)2, C(O)OH, С(O)Oнезамещенный алкил, NH-незамещенный алкил,N(незамещенный алкил)2, NHC(O)незамещенный арил, NHC(O)незамещенный алкил, N=Nнезамещенный арил, NHC(O)NH2, N(незамещенный алкил)С(O)незамещенный алкил,NHC(S)незамещенный алкил, N(незамещенный алкил)С(S)незамещенный алкил, NHS(O)незамещенный алкил, N(незамещенный алкил)S(O)незамещенный алкил,NS(О)2 арил,ОС(O)незамещенный алкил, ОСН 2 С(O)ОН,ОС(S)незамещенный алкил, S(O)незамещенный алкил, SC(O)незамещенный алкил, S-незамещенный алкил, S-незамещенный галоалкил,SО 2-незамещенный алкил, SО 2-незамещенный галоалкил, S(O)2NH2, S(О)NН-незамещенный алкил и S(O)2N(незамещенный алкил)2. Предпочтительно каждый из заместителей арила R1 независимо выбирается из группы, 15 включающей алкокси, диоксиметилен, N(СН 3)2,С(O)ОСН 3, фенил, низший галоалкил, Sнезамещенный алкил, низший галоалкокси, незамещенный алкил, незамещенный алкенил,галоген, SH, CN, NO2, NH2 и ОН. Более предпочтительно каждый из заместителей арила R1 независимо выбирается из группы, включающей незамещенный алкил C1-C7, C1-C7 алкокси, низший галоалкокси, СF3, F, Cl, Br, CN и NO2. В другом предпочтительном осуществлении R1 представляет 2-цианфенил, 2,3-дихлорфенил, 2-нитрофенил, или 2-циан-3-хлорфенил. Каждый из заместителей арила R5 правой стороны независимо выбирается из заместителей, описанных выше для алкенила. В предпочтительном осуществлении каждый из заместителей арила R5 независимо выбирается из группы, включающей метокси, низший галоалкокси,CFH2, CHF2, СF3, ОСН 2 СF3, F, Cl, Br, I, ОН, SH,CN, NO2, NH2, диоксиметилен, NH-низший алкил, N(низший алкил)2, С(O)низший алкил, Sнизший алкил, S(O)низший алкил, S(O2)низший алкил, ОС(О)низший алкил, SC(O)низший алкил, ОС(S)низший алкил, NHC(O)низший алкил, N(низший алкил)С(O)низший алкил,NHC(S)низший алкил,N(низший алкил)С(S)низший алкил, NHS(O)низший алкил,N(низший алкил)S(O)низший алкил, С(O)ОН,С(O)O-низший алкил, C(O)NH2, C(O)NHнизший алкил,С(O)N(низший алкил)2,S(O)2NH2,S(O)2NH-низший алкил иS(O)2N(низший алкил)2. В другом предпочтительном осуществлении каждый из заместителей арила R5 независимо выбирается из группы, включающей диоксиметилен, метокси, низший галоалкил, Sнизший алкил, низший галоалкокси, низший алкил, галоген, SH, CN, ОН, Cl, F и Br. Предпочтительными галогенами являются Cl, F и Вr."Карбоциклический арил" относится к ароматическому кольцу или системе колец,имеющему все атомы углерода. Атомы углерода необязательно замещены."Циклоалк" относится к необязательно замещенному циклическому алкилу или необязательно замещенному неароматическому циклическому алкенилу и включает моноциклические и полициклические структуры, такие как бициклические и трициклические. Циклоалк имеет от 3 до 15 атомов углерода, предпочтительно от 5 до 12 атомов углерода. Необязательные заместители для циклоалк независимо выбираются из группы, описанной выше для алкенила. Предпочтительно присутствует не более трех заместителей. Более предпочтительно циклоалк является незамещенным и еще более предпочтительно он представляет незамещенный циклический алкил. Предпочтительные циклоалкильные группы включают циклогексил и адамантил."Галоалк" относится к замещенному алкилу или замещенному алкенилу, имеющему не более 4 атомов углерода, где заместители явля 002984 16 ются галогенами и присутствует, по меньшей мере, один галоген. Предпочтительно галоалк представляет алкил с длиной от 1 до 3 атомов углерода, и галогены независимо представляют собой или Сl, или F, более предпочтительно алкил имеет 2 атома углерода, более предпочтительно галоалкил представляет низший галоалкил, который имеет 1 атом углерода."Гетероциклический арил" относится к арилу, имеющему от 1 до 3 гетероатомов в качестве атомов кольца в ароматическом кольце, а остальные атомы кольца являются атомами углерода. Подходящие гетероатомы включают кислород, серу и азот. Примеры гетероциклического арила включают индолил, пиридил, хинолинил и изохинолинил."Длинноцепной алк" относится к длинноцепному алкилу, длинноцепному алкенилу или к длинноцепному алкинилу; предпочтительно к длинноцепному алкилу или длинноцепному алкенилу. Более предпочтительно длинноцепной алк имеет от 4 до 20 атомов углерода."Длинноцепной алкенил" относится к необязательно замещенной углеводородной группе, включающей, по меньшей мере, одну двойную связь углерод-углерод между атомами углерода, которая содержит 2-20 соединенных вместе атомов углерода. Длинноцепной алкенил имеет от 4 до 20 атомов углерода. Углеводородная группа длинноцепного алкенила может иметь прямую цепь или включать одну или несколько боковых цепей. Заместители длинноцепного алкенила независимо выбираются из списка заместителей алкенила, перечисленных выше. Предпочтительно длинноцепной алкенил может быть или незамещенным или иметь один циклоалк или фенильный заместитель. Более предпочтительно заместитель циклоалк, если он присутствует, является незамещенным, и более предпочтительно заместитель циклоалк, если он присутствует, представляет или циклогексил,или адамантил."Длинноцепной алкил" относится к необязательно замещенной углеводородной группе,соединенной одинарными связями углеродуглерод, которая содержит 1-20 соединенных вместе атомов углерода. Предпочтительно длинноцепной алкил имеет от 4 до 20 атомов углерода. Углеводородная группа длинноцепного алкила может иметь прямую цепь или включать одну или несколько боковых цепей. Заместители длинноцепного алкила независимо выбираются из списка заместителей алкенила,приведенного выше. Предпочтительно длинноцепной алкил является или незамещенным или имеет один циклоалк или фенильный заместитель. Более предпочтительно заместитель циклоалк, если он присутствует, является незамещенным, и более предпочтительно заместитель циклоалк, если он присутствует, является или циклогексилом или адамантилом."Длинноцепной алкинил" относится к необязательно замещенной углеводородной группе, содержащей, по меньшей мере, одну тройную связь углерод-углерод между атомами углерода, которая содержит 2-20 соединенных вместе атомов углерода. Предпочтительно длинноцепной алкинил имеет от 4 до 20 атомов углерода. Углеводородная группа длинноцепного алкинила может иметь прямую цепь или включать одну или несколько боковых цепей. Заместители длинноцепного алкинила независимо выбираются из списка заместителей алкенила, приведенного выше. Предпочтительно длинноцепной алкинил является или незамещенным или имеет один циклоалк или фенильный заместитель. Более предпочтительно заместитель циклоалк, если он присутствует, является незамещенным, и более предпочтительно заместитель циклоалк, если он присутствует, является или циклогексилом или адамантилом."Галоалкокси" относится к кислороду, соединенному с "галоалк". Предпочтительно галоалкокси является "низшим галоалкокси", который представляет кислород, соединенный с низшим галоалкилом. А. Производные ,-дизамещенного-фенетиламина Более предпочтительными кальцилитическими соединениями являются производные структуры I, где R1, R2, R3, R4, R6, Z, Y1 и Y2 являются такими, как описаны выше для производных ,-дизамещенного арилалкиламина,включая предпочтительные группы (см. разделR5 является фенилом, замещенным однимчетырьмя независимо выбранными заместителями, или необязательно замещенным нафтилом, имеющим до четырех независимо выбранных заместителей. Заместители R5 представлены в разделе II, выше, включая предпочтительные осуществления. Более предпочтительно R5 представляет собой или замещенный фенил,содержащий заместитель в мета- или параположении, где более предпочтительно заместитель, присутствующий в мета- или параположении, представляет метил, этил, изопропил, метокси, Cl, F, Вr или галоалкокси. Активность различных кальцилитических соединений измеряли, используя описанный ниже тест на рецептор кальция. Примеры соединений, имеющих IC50 50 мкМ, включают соединения 1, 9, 17, 25, 29, 42, 56, 79, 90, 101 и 164; примеры предпочтительных соединений,имеющих IC50 10 мкМ, включают соединения 2, 3, 7, 8, 26, 27, 32, 33, 35, 37, 39, 41, 45, 48, 49,59, 61, 66, 68, 71, 75, 93, 98, 103, 104, 110, 111,114, 123, 124, 125, 128, 132, 144, 147, 152, 155,158, 161, 162, 169 и 170; и примеры более предпочтительных соединений, имеющих IC50 1 мкм, включают соединения 5, 6, 19, 20, 21,28, 38, 40, 43, 44, 46, 47, 50, 51, 63, 64, 65, 67, 69, 002984 В одном осуществлении R1, R2, R3 и R4 являются такими, как описаны выше для производных ,-дизамещенного арилалкиламина структуры I, включая предпочтительные группыR5 представляет или необязательно замещенный нафтил, имеющий от одной до четырех заместителей, независимо выбранных из группы, состоящей из метила, этила, изопропила,метокси, Cl, F, Вr или низшего галоалкокси, где предпочтительно нафтил является незамещенным; или замещенный фенил, имеющий от одного до четырех заместителей, где, по меньшей мере, один заместитель находится в мета- или пара-положении, выбранных из группы, состоящей из низшего алкила, метокси, Cl, F, Вr и низшего галоалкокси, более предпочтительно метокси в пара- или мета-положении; еще более предпочтительно остальные заместители в R5 независимо выбраны из группы, состоящей из метокси, низшего галоалкила, S-низшего алкила, низшего галоалкокси, низшего алкила, галогена, SH, CN, ОН, Cl, F и Вr; при условии, что R1 не является 6-СN-2 пиридилом; и при дополнительном условии, что если R5 представляет 3,4-диметоксифенил, то R1 не представляет собой СН 3(СН 2)5 О-фенил; 2 циклопентилфенил; 2-Сl-фенил; 2-СN-фенил; 2(3-фуранил)фенил; или 4-(1,2-бензизотиазол); предпочтительноR5 не является 3,4 диметоксифенилом; при дополнительном условии, что если R5 представляет 4-метоксифенил, то R1 не представляет собой 2-циклопентилфенил; 2-СН 3 фенил; 2-бензилфенил; 3-СН 3, 4-СН 3SO2-фенил; или 4-(1,2-бензизотиазол); при дополнительном условии, что если R5 представляет 4-Сl-фенил, то R1 не представляет собой 2-СН 3-фенил, 5-изопропилфенил; 2-СН 3 фенил; 4-СН 3-фенил; фенил; 2-Сl-фенил; 4-Сlфенил; 2-метокси; 4-СН 3 СНСН-фенил; 3,4-СН 3 фенил; 2,4-СН 3-фенил; 2,3-СН 3-фенил; 2 изопропил-5-СН 3-фенил; пиридил; или 1 имидазол; или 4-(1,2-бензизотиазол); предпочтительно R4 или не является 4-Сl, или R4 представляет 3,4-дихлорфенил; иR1 не представляет собой 4-СН 3-6-СN-2 пиридил или тиофенекарбоксамид; предпочтительно R5 не является 3,5-диметил-4-метоксифенил. В другом осуществлении R2, R3 и R4 являются такими, как описаны выше для производных ,-дизамещенного арилалкиламина структуры I, включая предпочтительные группы (см. раздел II, выше);R5 представляет или необязательно замещенный нафтил, имеющий от одного до четырех заместителей, независимо выбранных из группы, состоящей из метила, этила, изопропила, метокси, Cl, F, Вr и низшего галоалкокси,где предпочтительно нафтил является незамещенным; или замещенный фенил, имеющий от одного до четырех заместителей, где, по меньшей мере, один заместитель находится в метаили пара-положении, выбранных из группы,состоящей из метила, этила, изопропила, метокси, Cl, F, Вr и низшего галоалкокси, более предпочтительно метокси в пара- или метаположении; еще более предпочтительно остальные заместители в R5 независимо выбраны из группы, состоящей из метокси, низшего галоалкила, S-низшего алкила, низшего галоалкокси,низшего алкила, галогена, SH, CN, ОН, Cl, F и Вr; иR1 представляет или 2-цианфенил, 2,3 дихлорфенил, 2-нитрофенил, 2-циан-3-хлорфенил, необязательно замещенный пиридил, необязательно замещенный бензотиопиранил, или необязательно замещенный карбазол, где необязательно присутствующие заместители для пиридила, бензотиопиранила и карбазола таковы,как описаны в разделе II выше для заместителей арила R1, включая предпочтительные заместители, и еще более предпочтительно независимо выбираемые из группы, состоящей из метокси,низшего галоалкила, S-низшего алкила, низшего галоалкокси, низшего алкила, галогена, SH, CN,ОН, Cl, F и Вr. С. Стереохимия группы R2 Описанные здесь различные кальцилитические соединения могут иметь различную стереохимию вокруг различных групп. В осуществлении настоящего изобретения соединения структуры I имеют следующую абсолютную конфигурационную структуру относительно R2III. Фармацевтические композиции Описанные здесь кальцилитические соединения могут быть приготовлены в виде фармацевтических композиций, чтобы обеспечить 20 введение соединения пациенту. Предпочтительные рецептуры включают фармацевтически приемлемый носитель и кальцилитическое соединение, как оно описано в разделе II, выше,включая различные осуществления. Примеры подходящих носителей приведены ниже в разделе V "Введение лекарства" и включают карбонат кальция, фосфат кальция,лактозу, глюкозу, сахарозу, желатин, растительные масла, полиэтиленгликоли и физиологически совместимые растворители.IV. Лечение заболеваний или расстройств Соединения, подавляющие активность рецептора кальция, могут быть использованы для того, чтобы вызвать благоприятный эффект у пациента, страдающего от различных заболеваний и расстройств. Заболевания или расстройства, которые могут лечиться с использованием кальцилитического соединения, известны из практики и могут быть определены, используя в качестве руководства настоящее описание. Например, заболевания или расстройства могут быть определены, исходя из функциональных реакций клеток, регулируемых активностью рецептора кальция. Заболевания или расстройства, которые могут лечиться с использованием описанных здесь кальцилитических соединений, включают те, которые обусловлены различными клеточными дефектами, связанными с активностью рецептора кальция в различных клетках, такими как дефектный рецептор кальция или аномальное число рецепторов кальция, дефектный внутриклеточный протеин, вводимый в действие рецептором кальция, или дефектный протеин или аномальное количество протеинов, действующих на рецептор кальция. Функциональные реакции клеток, регулируемые рецептором кальция, известны из опыта,включая секрецию ПТГ клетками паращитовидной железы, секрецию кальцитонина Склетками, рассасывание кости остеокластами, и секрецию Ca2+ клетками почек. Такие функциональные реакции связываются с различными заболеваниями или расстройствами. Например, изолированный остеокласт реагирует на увеличение концентрации внеклеточного Ca2+ соответствующим увеличением [Ca2+],частично обусловленным мобилизацией внутриклеточного Ca2+. Увеличение [Ca2+] в остеокластах сопряжено с замедлением рассасывания кости. Выделение ренина околопочечноклубочными клетками подавляется увеличением концентраций внеклеточного Ca2+. Внеклеточный Са 2+ вызывает мобилизацию внутриклеточногоCa2+ в этих клетках. Другие почечные клетки реагируют на внеклеточный Ca2+ следующим образом: повышенный [Ca2+] ингибирует образование 1,25(OH)2-витамина D клетками, расположенными у внутреннего конца почечных трубочек, стимулирует образование связанного с 21 кальцием протеина в периферических клетках почечных трубочек, и ингибирует обратное всасывание Са 2+ и Мg2+ в почечных канальцах толстой восходящей части петли Хенле, и понижает действие вазопрессина в кортикальной сборной протоке. Другие примеры функциональных реакций, вызванных внеклеточным Са 2+, включают промотирование дифференциации бокаловидных клеток кишечника, околососковых клеток и клеток кожи; ингибирование секреции атриального натримочегонного пептида в предсердии; снижение аккумуляции сАМР в тромбоцитах; изменение секреции гастрина и глюкагона; воздействие на расположенные вокруг сосуда нервы для модификации клеточной секреции сосудоактивных факторов; и возбуждение клеток центральной нервной системы и периферической нервной системы. Заболевания и расстройства, которые можно лечить или предотвратить, основываясь на возбуждении клеток, включают костные и связанные с минеральным обменом заболевания или расстройства; недостаточность паращитовидных желез; заболевания центральной нервной системы, такие как припадки, удар, травма головы, повреждение спинного мозга, поражение нервных клеток, вызванное гипоксией, такое как встречающееся при остановке сердца или болезни новорожденных, эпилепсия, нейродегенеративные заболевания, такие как болезнь Альцгеймера, болезнь Хантингтона и болезнь Паркинсона, слабоумие, напряженность мышц,депрессия, беспокойство, паническое расстройство, навязчивое состояние, посттравматический стресс, шизофрения, синдром злокачественной нервной формы проказы и синдром Туретта; заболевания, связанные с избыточным выделением воды почками, такие как синдром нарушенной секреции АДГ (антидиуретический гормон), цирроз, застойная сердечная недостаточность и нефроз; гипертонию; предупреждение и/или уменьшение отравления почек катионными антибиотиками (например, аминогликозидными антибиотиками); нарушения перистальтики кишечника, такие как диарея и судороги толстой кишки; язвенные болезни желудочно-кишечного тракта; заболевания желудочно-кишечного тракта с избыточным поглощением кальция, такие как саркоидоз; заболевания аутоиммунной системы и отторжение трансплантированных органов; чешуйчатая клеточная карцинома; и панкреатит. Хотя кальцилитические соединения по настоящему изобретению будут, как правило, использоваться для лечения человека, они могут быть также использованы для лечения других видов теплокровных животных, таких как другие приматы, сельскохозяйственные животные,такие как свиньи, крупный рогатый скот и домашняя птица; и спортивных животных, таких как лошади, собаки и кошки. 22 Предпочтительно кальцилитические соединения используются для лечения костных и связанных с минеральным обменом заболеваний или расстройств. Костные и связанные с минеральным обменом заболевания или расстройства составляют отдельный класс расстройств, поражающих почти каждую главную систему органов в организме. Примеры костных и связанных с минеральным обменом заболеваний или расстройств включают саркому кости, околозубную болезнь, заживающие переломы, остеоартрит, ревматоидный артрит, деформирующий остит, гуморальное злокачественное повышенное содержание кальция в крови и пористость кости (остеопороз). Более предпочтительно кальцилитические соединения используются для лечения остеопороза, болезни, характеризуемой пониженной плотностью костей и увеличенной восприимчивостью к переломам. Остеопороз сопряжен со старением, особенно у женщин. Одним из путей лечения остеопороза является изменение секреции ПТГ. ПТГ может оказывать катаболический или анаболический эффект на кости. Вызывает ли ПТГ катаболический или анаболический эффект зависит от того,как изменен уровень ПТГ в плазме. Если концентрация ПТГ в плазме хронически завышена,как при гиперпаращитовидных состояниях,имеет место конечная потеря кости. Напротив,прерывистые повышения уровней ПТГ в плазме,как это достигается при введении экзогенного гормона, приводят к образованию новой костной ткани. Анаболическое действие ПТГ на костную ткань описано, например, Dempster et al.,Endocrin. Rev. 14:690-709, 1993. Как показано в приведенных ниже примерах, кальцилитические соединения стимулируют секрецию ПТГ. Такие кальцилитические соединения могут быть использованы для увеличения образования кости у пациента, например,путем введения с перерывами, чем достигаются прерывистые повышения циркулирующих количеств ПТГ.V. Введение соединения Кальцилитические соединения, описанные настоящим изобретением, могут быть использованы в формах для различных способов введения, включая системное и топическое или локализованное введение. Методики и рецептуры в общем можно найти в Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing Co.,Easton, PA, 1990, введенном сюда в качестве ссылки. Подходящие формы дозировки, в частности, зависят от использования или пути введения, например, орально, подкожно, через слизистую оболочку, или инъекцией (парентерально). Такие формы дозировки должны позволить соединению достичь клетки-мишени независимо от того, присутствует ли клетка-мишень в многоклеточном хозяине или в культуре. Например, 23 фармакологические соединения или композиции, вводимые инъекцией в кровепоток, должны быть растворимыми. Другие факторы известны из практики и включают рассмотрение таких факторов как токсичность и дозировочные формы, которые мешают соединению или композиции проявить свое действие. Соединения могут быть также приготовлены в виде их фармацевтически приемлемых солей или комплексов. Фармацевтически приемлемые соли являются нетоксичными солями в количествах и концентрациях, при которых они могут вводиться пациенту. Приготовление таких солей может обеспечить их фармакологическое использование путем такого изменения физических характеристик соединения, которое не мешает ему проявить свой физиологический эффект. Полезные изменения физических свойств включают снижение точки плавления,чтобы обеспечить введение через слизистую оболочку, и увеличение растворимости для того,чтобы обеспечить введение более высоких концентраций лекарства. Фармацевтически приемлемые соли различных соединений могут быть представлены в виде комплексов. Примеры комплексов включают комплекс 8-хлоротеофиллина (аналогичный, например, комплексу дименгидринат: дифенгидрамин 8-хлортеофиллин (1:1); Dramamine) и различные комплексы включения циклодекстрина. Фармацевтически приемлемые соли включают соли присоединения кислот, такие как содержащие сульфат, гидрохлорид, фумарат, малеат, фосфат, сульфамат, ацетат, цитрат, лактат,тартрат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат, циклогексилсульфамат и хинат. Фармацевтически приемлемые соли могут быть получены из кислот,таких как соляная кислота, малеиновая кислота,серная кислота, фосфорная кислота, сульфаминовая кислота, уксусная кислота, лимонная кислота, молочная кислота, винная кислота, малоная кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, паратолуолсульфоновая кислота, циклогексилсульфаминовая кислота, фумаровая кислота и хинная кислота. Фармацевтически приемлемые соли включают также соли присоединения оснований,такие как содержащие бензатин, хлорпрокаин,холин, диэтаноламин, этилендиамин, меглумин,прокаин, алюминий, кальций, литий, магний,калий, натрий, аммоний, алкиламин и цинк, если присутствуют кислотные функциональные группы, такие как карбоновая кислота или фенол (см., например, Remington's PharmaceuticalSciences, 18th ed., Mack Publishing Co., Easton,PA, 1990, p. 1445). Такие соли могут быть получены при использовании подходящих соответствующих оснований. 24 Фармацевтически приемлемые соли могут быть получены стандартными способами. Например, соединение в форме свободного основания растворяют в подходящем растворителе,таком как водный или водно-спиртовый в растворе, содержащем подходящую кислоту, и затем выделяют выпариванием раствора. В другом примере соль получают реакцией свободного основания и кислоты в органическом растворителе (см., например, патент PCT/US 92/03736,введенный сюда в качестве ссылки). Для облегчения введения соединения могут быть также использованы носители или среды. Примеры носителей включают карбонат кальция, фосфат кальция, различные сахара,такие как лактоза, глюкоза или сахароза, или типы крахмала, производные целлюлозы, желатин, растительные масла, полиэтиленгликоли и физиологически совместимые растворители. Примеры физиологически совместимых растворителей включают стерильные растворы воды для инъекций, солевой раствор и декстрозу. Кальцилитические соединения могут быть введены различными путями, включая внутривенное, внутрибрюшинное, подкожное, внутримышечное, пероральное, топическое (через кожу) введение или введение через слизистую оболочку. Для системного применения предпочтительно введение перорально. Для перорального введения, например, соединения могут быть приготовлены в обычных для перорального введения дозировочных формах, таких как капсулы, таблетки и жидкие препараты, такие как сиропы, эликсиры и концентрированные капли. Альтернативно могут использоваться инъекции (парентеральное введение), например,внутримышечно, внутривенно, внутрибрюшинно и подкожно. Для инъекций соединения по изобретению готовятся в жидких растворах,предпочтительно в физиологически совместимых буферах или растворах, таких как солевой раствор, раствор Ханка или раствор Рингера. Кроме того, соединения могут быть приготовлены в твердой форме и растворены или суспендированы непосредственно перед использованием. Могут быть также приготовлены лиофилизированные формы. Системное введение может быть также осуществлено трансмукозально (через слизистую оболочку) или трансдермально (через кожу). Для трансмукозального или трансдермального введения в рецептуре используют пенетранты, подходящие для проникновения через барьер. Такие пенетранты, в общем, известны из практики и для, например, трансмукозального введения включают соли желчных кислот и производные фузидовой кислоты. Кроме того,для улучшения проницаемости могут быть использованы детергенты. Трансмукозальное введение, например, может осуществляться спреями для носа, ректальными или вагинальными свечами. 25 Для топического применения соединения по изобретению могут быть введены в формы мазей, бальзамов, гелей или кремов, как это, в общем, известно из практики. Количества различных кальцилитических соединений, которые должны быть введены,может быть определено по стандартным методикам, принимая в расчет такие факторы какIC50 и EC50 соединения, период биологического полураспада соединения, возраст, размер и вес пациента и характер болезни или расстройства пациента. Важность этих и других факторов,которые должны рассматриваться, известна рядовым специалистам. Обычно это количество между примерно 0,1 и 50 мг/кг, предпочтительно между 0,01 и 20 мг/кг веса обрабатываемого животного.VI. Примеры Примеры, приведенные ниже, а также другие приведенные здесь примеры, предназначены не для того, чтобы ограничить заявленное изобретение, а для иллюстрации различных аспектов и примеров осуществления настоящего изобретения. Пример 1. Тест на ингибитор рецептора кальция. Этот пример показывает использование анализа ингибитора рецептора кальция. Кальцилитическую активность измеряли путем определения IC50 испытуемого соединения при блокировании увеличения внутриклеточного Ca2+,вызванного внеклеточным Ca2+ в клетках НЕК 293 4.0-7, устойчиво экспрессированных рецептором кальция человека. Клетки НЕК 293 4.0-7 готовили, как описано Rogers et al., J.Bone MinerRes. 10 Suppl. 1:S483, 1995 (включенном сюда в качестве ссылки). Возрастание внутриклеточного Са 2+ было вызвано увеличением внеклеточного Ca2+ от 1 до 1,75 мМ. Внутриклеточный Са 2+ измеряли, используя флюоресцентный индикатор кальция fluo-3. Процедура была следующей. 1. Клетки содержали в колбах Е-150 в селекционной среде (DMEM (модифицированная по способу Дульбекко среда Игла) с добавлением 10% фетальной бычьей сыворотки и 200 мкг/мл гидромицина В) под 5% CO2:95% воздуха при 37 С и выращивали до 90% слияния. 2. Среду декантировали и клеточный монослой дважды промывали физиологическим раствором с фосфатным буфером (ФРФБ), поддерживаемым при 37 С. После второй промывки добавляли 6 мл 0,2% ЭДТК в ФРФБ и инкубировали в течение 4 мин при 37 С. После инкубации клетки диспергировали осторожным перемешиванием. 3. Клетки из 2 или 3 колбы собирали и осаждали (100 хг). Клеточный осадок ресуспендировали в 10-15 мл SPF-PCB+ и снова осаждали центрифугированием. Эту промывку делали дважды. 26 Свободный от сульфата и фосфата паратироидный клеточный буфер (SPF-PCB) содержит 20 мМ Na-Hepes, рН 7,4, 126 мМ NaCl, 5 мМ КСl и 1 мМ MgCl2. SPF-PCB готовили и хранили при 4 С. В день использования SPF-PCB дополняли 1 мг/мл D-глюкозы и 1 мМ CaCl2 и затем делили на две части. К одной части добавляли альбумин бычьей сыворотки (BSA; фракция V, ICN) до 5 мг/мл (SPF-PCB+). Этот буфер использовали для промывки, суспендирования и поддержания клеток. Часть, свободную от BSA,использовали для разведения клеток в кювете при измерениях флюоресценции. 4. Осадок ресуспендировали в 10 мл SPFPCB+, содержащем 2,2 мкМ Fluo-3 (MolecularProbes) и инкубировали при комнатной температуре в течение 35 мин. 5. После инкубационного периода клетки осаждали центрифугированием. Полученный осадок промывали SPF-PCB+. После этой промывки клетки ресуспендировали в SPF-PCB+ при плотности 1-2106 клеток/мл. 6. Для регистрации сигналов флюоресценции 300 мкл клеточной суспензии разводили в 1,2 мл SPF буфера, содержащего 1 мМ CaCl2 и 1 мг/мл D-глюкозы. Измерения флюоресценции проводили при 37 С с постоянным перемешиванием, используя спектрофлюориметр. Длины волн возбуждения и эмиссии измеряли при 485 и 535 нм соответственно. Для калибровки сигналов флюоресценции добавляли дигитонин (5 мг/мл в этаноле), чтобы получить Fmах, и кажущийся Fmin определяли, добавляя Tris-EGTATris-основания, 0,3 М EGTA). Концентрацию внутриклеточного кальция рассчитывали, используя следующее уравнение: Внутриклеточный кальций = (F-Fmin/Fmax)Kd; где Kd = 400 нм. 7. Для определения потенциальной кальцилитической активности испытуемых соединений клетки инкубировали с испытуемым соединением (или вектором в качестве контроля) в течение 90 с перед увеличением концентрации внеклеточного Са 2+ с 1 до 2 мМ. Кальцилитические соединения определяли по их способности блокировать зависящим от концентрации образом возрастания концентрации внутриклеточного Са 2+, вызванные внеклеточным Са 2+. В общем, те соединения, которые имеют в тесте на ингибитор рецептора кальция более низкие значения IC50, являются более предпочтительными соединениями. Соединения, имеющие IC50 выше, чем 50 мкМ рассматривались как неактивные. Предпочтительными соединениями являются соединения, имеющие IC50 1050 мкМ, более предпочтительные соединения имеют IC50 1-10 мкМ и наиболее предпочтительные соединения имеют IC50 меньше 1 мкМ. Примеры соединений, имеющих IC50 больше 50 мкМ, включают соединения 22, 24, 27 34, 36, 52, 53, 54, 55, 58, 60, 62, 70, 84, 92, 99 и 102. Пример 2. Активность адренергического рецептора. Производные ,-дизамещенного арилалкиламина структуры I включают соединения,которые имеют как кальцилитическую активность, так и активность -адренергического рецептора. Если необходимо, -адренергическая активность может быть снижена путем использования соответствующих функциональных групп и структурных модификаций. Модификации, которые могут быть использованы для понижения активности адренергического рецептора, включают использование альтернативных групп R2 и использование полной стереохимии, обратной той, которая встречается у активных антагонистов адренергического рецептора, что обеспечивается соединениями, соответствующими Rэнантиомеру, когда R2 представляет ОН. Активность -адренергического рецептора и связывание -адренергического рецептора могут быть измерены с использованием стандартных методов (см., например, Riva et al., Mol. Pharmacol. 36:201-210, 1989). В одном осуществлении настоящего изобретения кальцилитические соединения имеютIC50 1 нМ при значениях -адренергического рецептора, измеренных с использованием "Теста на связывание -адренергического рецептора", описанного ниже. В других осуществлениях использования "Теста на связывание адренергического рецептора" кальцилитические соединения имеют IС 50 1 мкМ и IC50 10 мкМ."Тест на связывание -адренергического рецептора" проводили следующим образом: инкубацию вели в полипропиленовых реакционных пробирках в водяной бане при 37 С. В каждую пробирку добавляли 50 мкл испытуемого образца и после этого 300 мкл тест-буфера(50 мМ Tris-HCl, pH 7,5) и 50 мкл 20 нМ [3H]дигидроалпренолола. Реакцию связывания инициировали добавлением 100 мкл 3,75 мг/мл хорошо промытых крысиных кортикальных мембран в тест-буфере и инкубацией при 37 С в течение 30 мин. Неспецифическое связывание определяли в присутствии 10 мкл алпренолола. Конечная концентрация реагентов: 2 нМ [3 Н]дигидроалпренолола и 75 мг/мл крысиной кортикальной мембраны в реакционном объеме 0,5 мл. Реакцию связывания завершали быстрой фильтрацией с охлажденным на льду тестбуфером на фильтрах GF/C (Brandel, Gaithersburg, MD), которые вымачивались в течение 15 мин в тест-буфере. Реакционную смесь вначале разбавляли 3 мл холодного тест-буфера (4 С) и затем выливали на фильтр с последующими промывками 33 мл. Фильтровальные диски помещали в 7 мл полипропиленовые сцинтиля 002984Scientific, Pittsburgh, PA) и подсчитывали в течение ночи. Пример 3. Стимуляция секреции ПТГ. Этот пример показывает способность различных кальцилитических соединений оказывать биологический эффект на секрецию ПТГ. Секрецию ПТГ определяли, используя диссоциированные бычьи паратироидные клетки, как описано ниже для соединений 32, 33 и 38. Все из соединений 32, 33 и 38 стимулировали секрецию ПТГ при EC50 ниже, чем 10 мкМ. Стимуляцию секреции ПТГ определяли следующим образом. Приготовление разложенных бычьих паратироидных клеток Паратироидный клеточный буфер (РСВ) содержит (мМ): NaCl - 126; КСl - 4; MgSO4 - 1; К 2 НРO4/КН 2 РO4 - 0,7; Na-Hepes, pH 7,45 и варьирующиеся в зависимости от требований количества CaCl2 (реактивная квалификация). РСВ обычно дополняется альбумином бычьей сыворотки BSA fraction V; ICN Biomedicals, Inc.,Costa Mesa, CA; каталог 81-003) и 1 мг/мл Dглюкозы (реактивная квалификация), если указано. Буфер очистки Percoll готовили непосредственно перед использованием смешением 8 млPercoll (Pharmacia LKB, Alameda, CA, каталог 17-0891-01) и 7 мл раствоpa PCB, который имеет в два раза более высокую концентрацию,не содержит фосфат и содержит 2 мМ CaCl2. Паратироидные железы получали от скота через минуты после забоя на скотобойне и перевозили ночным экспрессом на льду в PCB, содержащем 1,25 мМ CaCl2. Железы нарезали и измельчали в охлажденном на льду PCB, содержавшем 1,25 мМ CaCl2, 1 мг/мл D-глюкозы и 2% BSA. Диссоциированные клетки получали разложением коллагеназой при интенсивном встряхивании измельченной ткани при 37 С в(Boehringer Mannheim, Indianapolis, IN; каталог 1249 002), от 2 до 5 единиц деоксирибонуклеазы (Sigma, St Louis, МО; каталог D-0876), 1 мг/мл D-глюкозы и 1,25 мМ CaCl2 (реактивная квалификация). Клеточную суспензию растирали через 30-минутные интервалы, используя 25 и 10-мл пипетки, по мере того, как размельченная ткань переваривалась, и клетки диспергировались. Клетки собирали через 1-часовые интервалы фильтрацией клеточной суспензии через 250 мкм сита Nitex в 15 мл полистирольные пробирки для центрифугирования и вращали при 100 хg в течение 5 мин при 22 С. Собранный осадок клеток ресуспендировали в буфере очистки Percoll и очищали центрифугированием при 14.500 хg в течение 20 мин при 4 С. Диссоциированные паратироидные клетки уравновешивали при плотности плавучести 1,048-1,062 выше плотной полосы красных кровяных телец и 29 ниже размытой полосы, содержащей адипоциты, нити коллагена и поврежденные клетки. Диссоциированные паратироидные клетки удаляли стерильной пипеткой и промывали 3-4 раза в стерильных условиях смесью 1:1 средыHam's F-12 и модифицированной по способу Дульбекко среды Игла (F-12/DMEM; Sigma, St.(Sigma, St.Louis, МО; каталог 1397). Клетки, наконец, ресуспендировали в F12/DMEM, дополненной антибиотиками при более низких концентрациях (10 ед./мл пенициллина, 10 мкг/мл стрептомицина и 4 мкг/мл гентамицина). Эта последняя среда не содержит сыворотку и содержит ITS+ (инсулин, трансферрин, селеновая кислота, BSA и линолиевая кислота; Соllaborative Biomedical Products, Bedford, MA; каталог 40352). Клетки инкубировали в колбах Т-75 при 37 С во влажной атмосфере, при содержании 5% CO2 в воздухе. Паратироидные клетки отбирали для использования путем декантации колб спустя 18-24 ч в первичной культуре. Использованные при этом концентрации гентамицина и стрептомицина значительно ниже величиныEC50 для мобилизации внутриклеточного кальция (150 и 600 мкМ соответственно). Измерение секреции паратироидного гормона (ПТГ) Свободный от сульфата и фосфата паратироидный клеточный буфер (SPF-PCB) содержит(мМ): NaCl - 126; КСl - 5; MgCl2 - 1; Na-Hepes,pH 7,45 и меняющееся в зависимости от требований количество CaCl2 (реактивная квалификация). SPF-PCB обычно дополняется альбумином бычьей сыворотки BSA fraction V; ICN Biomedicals, Inc., Costa Mesa, CA; каталог 81-003) и 1 мг/мл D-глюкозы (реактивная квалификация),если указано. Инкубации проводили в трех сериях в 1275 мм полипропиленовых или полистирольных пробирках, в которые добавляли 2,5 мкл испытуемого соединения. Пробирки выдерживали на льду до полного добавления лекарства,затем переносили в водяную баню с температурой 37 С и инициировали реакцию добавлением 0,2 мл суспензии диссоциированных клеток с плотностью от 1 до 2 миллионов клеток на мл вSPF-PCB, содержащем 0,5 мМ Са 2+, 1 мг/мл Dглюкозы и 0,1% BSA. Инкубацию вели в течение 30 мин и реакцию завершали, помещая пробирки на лед. Клетки осаждали осторожным центрифугированием (500 х g в течение 10 мин при 4 С), и 0,1 мл супернатанта удаляли и хранили при -20 С. Бычьий ПТГ с аминовым окончанием определяли радиоиммуноанализом (РИА), используя в качестве стандартов козью анти-hПТГ антисывороку H2, очищенную ЖХВР 125I-hПТГ (1 002984bПТГ стандартов (от 1000 пкг/25 мкл до 3,8 пкг/25 мкл) проводили в 50 мМ Tris, pH 7,4, содержащем 0,5 мМ азида Na и 2% альбумина бычьей сыворотки (разбавитель). Стандарты и образцы инкубировали в течение 2-3 суток при 4 С в присутствии антисыворотки, после чего добавляли 1500-2000 импульсов в минуту метки на пробирку. После дополнительной инкубации в течение 1-2 суток при 4 С добавляли древесный уголь, покрытый декстраном, чтобы разделить связанную и свободную метку. Содержимое каждой пробирки перемешивали и древесный уголь осаждали центрифугированием. Супернатанты декантировали в 1275 мм полистирольные пробирки и подсчитывали импульсы вPackard Cobra гамма-счетчике. Пример 4. Общая методика получения кальцилитических соединений. Описанные в настоящем изобретении кальцилитические соединения могут быть получены при использовании стандартных методик. Например, общая стратегия получения описанных здесь предпочтительных соединений может быть осуществлена так, как это описано в этом разделе. Примеры будут ниже иллюстрировать синтезы конкретных соединений. Используя описанную здесь последовательность в качестве образца, любой рядовой специалист может легко получить другие соединения структуры I. Все реактивы и растворители были получены от промышленных поставщиков. Исходные материалы (например, амины и эпоксиды) были синтезированы по стандартным способам и методикам. Анализы методом газовой хроматографии с масс-спектроскопическим детектором захвата электронов (ГХ/МС-ЭЗ) проводили на газовых хроматографах HP-5890 Серия II,оборудованных колонками HP-Ultra-2 или HP5MS (300,25 мм внутр. диаметр), и использовали селективные масс-спектрометрические детекторы (MSD) HP-5971 или HP-5972. Разделения жидкостной хроматографией среднего давления (ЖХСД) проводили на силикагелеUV-6 (254 нм) и коллектор фракций FOXY 200. Жидкостную хроматографию высокого разрешения (ЖХВР) проводили, используя насосыRAININ HP-XL и детекторы Dynamix UV-1 (254 нм). Примеры конкретных условий разделения и детали приведены в описаниях отдельных экспериментов, приводимых в нижеследующих примерах. Хиральные разделения ЖХВР проводили с использованием Beckman System Gold ЖХВР и УФ-детектора (254 нм) на колонках 31 спектры снимали при 300 и 75 мГц соответственно. ЯМР-резонансы приведены в ррм по отношению к тетраметилсилану (ТМС) со следующими дескрипторами для наблюдаемых множественностей: s (синглет), d (дуплет), t(триплет), q (квартет), dd (дуплет дуплетов или двойной дуплет), m (мультиплет). Константы спаривания JAB приведены в Гц. Проводили элементный анализ и данные FT-IR были приобретены у Oneida Research Services, Inc.,Whitesboro, NY 13492. Общую процедуру, использованную для синтеза многих соединений, проводили следующим образом: раствор глицидилового эфира(например,1,2-эпокси-3-феноксипропан,1 ммоль) и избыток амина (обычно 1,1-диметил-2(4-метоксифенил)этиламин, 1,5 ммоль) в абсолютном этаноле (2 мл) перемешивали в течение ночи при 5-60 С. Продукт очищали одним из трех общих методов: (1) превращение в хлористо-водородную соль с последующей жидкостной хроматографией высокого разрешения с обращенной фазойHCl/ацетонитрил); (2) превращение в хлористоводородную соль с последующей перекристаллизацией из смеси вода-метанол или из ацетонитрила; и (3) очистка хроматографией с нормальной фазой (колоночная хроматография или препаративная тонкослойная хроматография(ТСХ). Хлористо-водородные соли получали также путем реакции соответствующего свободного основания в диэтиловом эфире с 1 М НСl (в диэтиловом эфире). Пример 5. Получение N-[2-гидрокси-3-(1 нафтокси)пропил]-1,1-диметил-2-(4-фторфенил) этиламин гидрохлорида. Соединение 2. Суспензию гидрида натрия (4,0 г 60% NaH в минеральном масле, 100 ммоль) в диметилформамиде (ДМФ, 100 мл) при перемешивании обрабатывали 1-нафтолом (14,42 г, 100 ммоль). После перемешивания в течение 1 ч при температуре окружающей среды (комнатная температура) реакционную смесь обрабатывали эпихлоргидрином (10,18 г, 110 ммоль) и перемешивали в течение 1 ч при 100 С. Реакционную смесь разбавляли водой и переносили в делительную воронку, используя диэтиловый эфир(500 мл). Органическую фазу промывали 10% водным NaHCO3 (3200 мл), сушили над безводным сульфатом натрия, фильтровали и концентрировали перегонкой на Kugelrohr (100 микрон), получая 1-нафтилглицидиловый эфир в виде прозрачного бесцветного масла; ГХ/МСЭЗ, m/z (отн. инт.) 200 (М+, 61), 184 (1), 169 (5),157 (12), 144 (79), 129 (16), 115 (100), 101 (3), 89 32 фенил)этиламина (334 мг, 2 ммоль) в абсолютном этаноле (2 мл) при перемешивании нагревали при 50-60 С в течение 16 ч. Хроматографией полученной реакционной смеси на окиси кремния (530 см) с использованием градиента от хлороформа до 5% метанола в хлороформе получали свободное основание названного в заголовке соединения: ГХ/МС-ЭЗ, m/z (отн. инт.) 368 (M+, 1), 352 (2), 258 (100), 183 (5), 157 (4),127 (5), 115 (18), 109 (23), 71 (30). Свободное основание в диэтиловом эфире обрабатывали избытком 1 М НСl (диэтиловый эфир). Полученное твердое вещество перекристаллизовывали из горячего ацетонитрила,получая 300 мг названного в заголовке соединения в виде твердого кристаллического вещества: 1(ТГФ, 800 мл) добавляли 244 мл 2,5 М нбутиллития (610 ммоль) в гексане. Реакционную смесь перемешивали в течение 30 мин при комнатной температуре, охлаждали до -78 С и добавляли по каплям изомасляную кислоту (26,8 г,305 ммоль) и гексаметилфосфорамид (ГМФА,54,7 г, 305 ммоль). Реакционную смесь перемешивали в течение 30 мин при комнатной температуре и добавляли 4-метоксибензилхлорид(43,4 г, 277 ммоль). Реакционную смесь перемешивали в течение 48 ч при комнатной температуре и обрабатывали 10% НСl (200 мл). Реакционную смесь концентрировали до 300 мл и разбавляли до 600 мл водой. Полученный раствор экстрагировали диэтиловым эфиром (2300 мл) и объединенные эфирные экстракты промывали 10% НСl (2200 мл). Эфирный экстракт затем экстрагировали 1N NaOH (3200 мл). Объединенные 1N NaOH промывки подкисляли(рН 1) добавлением концентрированной НСl, и полученный раствор экстрагировали диэтиловым эфиром (3300 мл). Объединенные эфирные экстракты сушили над безводным сульфатом магния, фильтровали и концентрировали,получая 32,6 г 2,2-диметил-3-(4-метоксифенил) пропионовой кислоты в виде масла: ГХ/МС-ЭЗ, 33(6). Триэтиламин (16,8 г, 166 ммоль) и 2,2 диметил-3-(4-метоксифенил)пропионовую кислоту (32,6 г, 157 ммоль) растворяли в 30 мл воды и достаточном количестве ацетона, чтобы сохранить растворимость при 0 С. Затем по каплям добавляли раствор этилхлороформата(20,1 г, 185 ммоль) в ацетоне (100 мл). После этого по каплям добавляли водный раствор (95 мл) азида натрия (12,9 г, 198 ммоль) и полученную реакционную смесь перемешивали в течение 45 мин при комнатной температуре. Затем промежуточный ацилазид экстрагировали толуолом (200 мл). Органический экстракт промывали водой, сушили над безводным сульфатом магния и нагревали при 100 С до тех пор,пока не прекращалось выделение азота (45 мин). Толуол удаляли под вакуумом и заменяли бензиловым спиртом. После этого раствор нагревали при 100 С в течение 16 ч. Избыток бензилового спирта удаляли под вакуумом. Полученный бензилкарбамат растворяли в абсолютном этаноле (200 мл) и восстанавливали в присутствии гидроокиси палладия (2 г) под давлением водорода 6,3 атм в течение 4 ч при комнатной температуре. Реакционную смесь фильтровали и концентрировали до желтого масла. Перегонка под вакуумом дала 13,0 г 1,1 диметил-2-(4-метоксифенил)этиламина в виде прозрачного бесцветного масла: ГХ/МС-ЭЗ, m/z(отн.инт.) 180 (М+1,1), 164 (5), 121 (25), 91 (5),78 (19), 58 (100). 1,2-Эпокси-3-феноксипропан (150 мг, 1 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламин (269 мг, 1,5 ммоль) применяли для получения свободного основания названного в заголовке соединения. По способу примера 5, выше,хлористо-водородную соль получали разбавлением реакционной смеси НСl (3 ммоль) и водой. Жидкостная хроматография высокого разрешения с обращенной фазой (ЖХВР-ОФ, 0,1% НСl в ацетонитриле) полученного раствора дает 35 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ, m/z (отн.инт.) 314 (М 15, 1), 209 (19), 208 (100), 163 (6), 120 (19), 114 Энантиомеры (R)- и (S)-N-(2-гидрокси-3 феноксипропил)-1,1-диметил-2-(4-метоксифенил)этиламин гидрохлорида (соединения 32 и 33) получали хиральной ЖХВР свободного основания на ChiralCel OD (202,5 см), применяя комбинацию гексан-изопропанол, содержащую 0,1% диэтиламина (10 мл/мин) и измерение оптической плотности при 260 нм. ГХ/МС-ЭЗ каждого энантиомера дает m/z (отн.инт.) 330(16), 77 (10), 70(11). Гидрохлорид каждого энантиомера получали взаимодействием свободного основания в диэтиловом эфире с избытком 1 М НСl (диэтиловый эфир). Выпаривание растворителя давало хлористо-водородный продукт в виде твердого вещества. Пример 8. Получение N-[2-гидрокси-3-(4 хлорфенокси)пропил]-1,1-диметил-2-(4-метоксифенил)этиламин гидрохлорида. Соединение 5. По способу примера 6, выше, 4-хлорфенил глицидиловый эфир (185 мг, 1 ммоль) и 1,1 диметил-2-(4-метоксифенил)этиламин (269 мг,1,5 ммоль) использовали для получения 272 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ, m/z (отн.инт.) 348 (М-15,1), 244 (35), 243 (15), 242 (100), 163 (9), 121 (24),114 (7), 71 (24), 70 (26), 58 (15), 42 (7). Пример 9. Получение N-[2-гидрокси-3-(4 трет-бутилфенокси)пропил]-1,1-диметил-2-(4 метоксифенил)этиламин гидрохлорида. Соединение 6. По способу примера 5, выше, 4-третбутилфенилглицидиловый эфир (206 мг, 1 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламин (269 мг, 1,5 ммоль) использовали для получения свободного основания титульного соединения. Гидрохлорид получали разбавлением реакционной смеси НСl (3 ммоль) и водой, что приводило к выпадению продукта в осадок. Смесь нагревали до растворения и давали ей медленно остывать для кристаллизации продукта. Кристаллы выделяли фильтрацией, промывали водой/МеОН, и сушили под вакуумом, получая 106 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ, m/z Энантиомеры (R)- и (S)-N-[2-гидрокси-3(4-трет-бутилфенокси)пропил]-1,1-диметил-2(4-метоксифенил)этиламин гидрохлорида (соединения 20 и 21) получали по способу примера 7, выше. ГХ/МС-ЭЗ каждого энантиомера дает(10), 135 (4), 121 (36), 91 (8), 70 (11). Гидрохлорид каждого энантиомера получали взаимодействием свободного основания в диэтиловом эфире с избытком 1 М НСl (диэтиловый эфир). Выпаривание растворителя давало хлористо-водородный продукт в виде твердого вещества. Пример 11. Получение N-[2-гидрокси-3-(4 метоксифенокси)пропил]-1,1-диметил-2-(4 метоксифенил)этиламин гидрохлорида. Соединение 7. По способу примера 8, выше, 4 метоксифенилглицидиловый эфир (180 мг, 1 ммоль) и 1,1-диметил-2-(4-метоксифенил) этиламин (269 мг, 1,5 ммоль) использовали для получения 231 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ, m/z По способу примера 9, выше, 2 метилфенилглицидиловый эфир (164 мг, 1 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламин (269 мг, 1,5 ммоль) использовали для получения 257 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ, m/z По способу примера 6, выше, 4 глицидилокси-2-индолкарбоксамид (232 мг, 1 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламин (269 мг, 1,5 ммоль) использовали для получения 222 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ, m/z К суспензии 50% KF-Celite (0,35 г, 3 ммоль) в безводном ацетонитриле (10 мл) при перемешивании добавляли 1,1-диметил-2-(4 метоксифенил)этиламин (0,27 г, 1,5 ммоль) и 3 феноксипропилбромид (0,484 г, 2,25 ммоль). Реакционную смесь кипятили с обратным холодильником под азотом в течение 6 ч, после чего перемешивали при комнатной температуре в течение 62 ч. Смесь фильтровали и фильтрат выпаривали. Гидрохлорид получали растворением остатка в НСl/метанол. Полученный раствор концентрировали и сушили в лиофилизаторе. Остаток перерастворяли в сухом метаноле и разбавляли диэтиловым эфиром, что приводило к получению в осадке 210 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ, m/z (отн.инт.) 298 (М-15, 2), 193 По способу примера 5, выше, 1 нафтилглицидиловый эфир (1,0 г, 5 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламин (1,0 мг, 5,6 ммоль) использовали для получения свободного основания титульного соединения. Хроматография реакционной смеси на силикагеле при использовании 5% метанола в хлороформе дает 1,66 г (88%) очищенного продукта: ГХ/МС-ЭЗ, m/z (отн.инт.) 364 (М-15, 1), 258(3 Н, c), 0,92 (3 Н, с); 13 С-ЯМР (CDCl3)158.0, 154.3, 134.4,131.2 (2 углерода), 129.9, 127.4, 126.3, 125.8,125.2, 121.8, 120.5, 113.3 (2 углерода), 104.8,70.4, 68.5, 55.0, 53.2, 46.4, 44.5, 26.9, 26.8. Часть свободного основания в диэтиловом эфире обрабатывали избытком 1 М НСl (диэтиловый эфир). Образующееся твердое вещество перекристаллизовывали из горячего ацетонитрила, получая титульное соединение в виде белого твердого вещества. Пример 16. Получение N-(2-гидрокси-3 трет-бутоксипропил)-1,1-диметил-2-(4-метоксифенил)этиламина. Соединение 25. По способу примера 15, выше, третбутилглицидиловый эфир (142 мг, 1,0 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламин (197 мг, 1,1 ммоль) использовали для получения 106 мг титульного соединения в виде прозрачного бесцветного масла: ГХ/МС-ЭЗ, m/z (отн.инт.) 310 (М+1, 0,3), 294 (0,5), 222 (1,8), 188 (67, 9),163 (14,6), 132 (100), 121 (19,1); 1 По способу примера 15, выше, нбутилглицидиловый эфир (143 мкл, 1,0 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламин (197 мг, 1,1 ммоль) использовали для получения 81 мг титульного соединения в виде прозрачного бесцветного масла: ГХ/МС-ЭЗ, m/z (отн.инт.) 310 (М+1, 0,01), 174 (100), 163 (19), 132 (18), 121 По способу примера 15, выше, изопропилглицидиловый эфир (126 мкл, 1,0 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламин (197 мг, 1,1 ммоль) использовали для получения 53 мг титульного соединения в виде прозрачного бесцветного масла: ГХ/МС-ЭЗ, m/z (отн.инт.) 296 (М+1, 0.2), 280 (1.4), 222 (1.5), 174 (100), 132 По способу примера 15, выше, 2 этилгексилглицидиловый эфир (209 мкл, 1,0 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламин (197 мг, 1,1 ммоль) использовали для получения 55 мг титульного соединения в виде прозрачного бесцветного масла: ГХ/МС-ЭЗ, m/z Энантиомеры (R)- и (S)-N-[2-гидрокси-3(2-этил)гексаноксипропил]-1,1-диметил-2-(4 метоксифенил)этиламин гидрохлорида получали по способу примера 7, выше. ГХ/МС-ЭЗ каждого энантиомера дает m/z (отн.инт.) 366(9), 121 (21), 115 (11), 100 (4), 71 (21). Хлористо-водородную соль каждого энантиомера получали реакцией свободного амина в диэтиловом эфире с избытком 1 М НСl (диэтиловый эфир). Выпаривание растворителя дает хлористо-водородный продукт в виде твердого вещества. Пример 21. Получение N-(2-гидрокси-3 аллилоксипропил)-1,1-диметил-2-(4-метоксифенил)этиламина. Соединение 29. По способу примера 15, выше, аллилглицидиловый эфир (119 мкл, 1,0 ммоль) и 1,1 диметил-2-(4-метоксифенил)этиламин (197 мг,1,1 ммоль) использовали для получения 79 мг титульного соединения в виде прозрачного бесцветного масла: ГХ/МС-ЭЗ, m/z (отн.инт.) 294 По способу примера 4, выше, 2 нафтилглицидиловый эфир (400 мг, 2 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламин (358 мг, 2 ммоль) использовали для получения свободного основания титульного соединения: ГХ/МС-ЭЗ, m/z (отн.инт.) 364 (М-15, 1), 258(100), 183 (2), 163 (3), 144 (4), 127 (10), 121 (22),115 (20), 71 (11). Свободное основание в диэтиловом эфире обрабатывали избытком 1 М НСl(диэтиловый эфир). Образующееся твердое вещество перекристаллизовывали из горячего ацетонитрила, получая 496 мг хлористоводородного продукта в виде белого твердого вещества. Пример 23. Получение N-(2-гидрокси-3 фенилпропил)-1,1-диметил-2-(4-метоксифенил) этиламин гидрохлорида. Соединение 37. По способу примера 6, выше, из 2,3 эпоксипропилбензола (1 ммоль) и 1,1-диметил 2-(4-метоксифенил)этиламина (1,25 ммоль) получали 179 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ, m/z По способу примера 6, выше, из 3 метоксифенилглицидилового эфира (1,5 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламина(1,9 ммоль) получали 403 мг титульного соединения в виде белого твердого вещества: ГХ/МСЭЗ, m/z (отн.инт.) 344 (М-15, 1), 239 (21), 238 Раствор 3-фторфенола (1,8 г, 16,1 ммоль) в ацетоне (100 мл) обрабатывали карбонатом калия (6,65 г, 48,2 ммоль) и кипятили с обратным холодильником под азотом в течение 15 мин. Затем шприцом вводили эпибромгидрин (4,4 г,32,1 ммоль) и смесь кипятили с обратным холодильником в течение 3 ч. Смесь охлаждали и фильтровали и фильтрат выпаривали до сухого остатка. Остаток распределяли в смеси эфир/вода и слои разделяли. Эфирный слой промывали насыщенным NaCl, сушили над сульфатом натрия и выпаривали. Полученное масло перегоняли под вакуумом, получая 1,2 г 3-фторфенилглицидилового эфира. По способу примера 6, выше, из 3 фторфенилглицидилового эфира (1,5 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламина (1,9 ммоль) получали 398 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ,m/z (отн.инт.) 332 (М-15, 1), 227 (22), 226 (100),163 (7), 151 (6), 120 (22), 114 (6), 94 (7), 71 (11),70 (16), 57 (8). Пример 26. Получение N-[2-гидрокси-3-(2 хлорфенокси)пропил]-1,1-диметил-2-(4-метоксифенил)этиламин гидрохлорида. Соединение 40. По способу примера 25, выше, из 2 хлорфенилглицидилового эфира (1,0 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламина (1,25 ммоль) получали 279 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ,m/z (отн.инт.) 348 (М-15, 5) 245 (21), 244 (100), 41 242 (100), 163 (29), 121 (82), 114 (24), 77 (21), 71 По способу примера 25, выше, из 2 фторфенилглицидилового эфира (1,5 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламина (1,9 ммоль) получали 385 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ,m/z (отн.инт.) 332 (М-15, 2), 227 (20), 226 (100),163 (4), 125 (3), 121 (15), 78 (4), 77 (4), 71 (7), 70 По способу примера 25, выше, из 3 хлорфенилглицидилового эфира (1,0 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламина (1,25 ммоль) получали 168 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ,m/z (отн.инт.) 348 (М-15, 0.9), 245 (7), 244 (35),243 (25), 242 (100), 163 (7), 121 (22), 71 (11), 70 По способу примера 25, выше, из 4 фторфенилглицидилового эфира (1,5 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламина (1,9 ммоль) получали 398 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ,m/z (отн.инт.) 332 (М-15, 1), 227 (20), 226 (100),163 (5), 125 (4), 121 (15), 114 (3), 95 (4), 71 (8),70 (10), 58 (5). Пример 30. Получение N-[2-гидрокси-3-(3 метилфенокси)пропил]-1,1-диметил-2-(4-метоксифенил)этиламин гидрохлорида. Соединение 45. По способу примера 25, выше, из 3 метилфенилглицидилового эфира (2,0 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламина (2,5 ммоль) получали 400 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ,m/z (отн.инт.) 328 (М-15, 1), 223 (16), 222 (100),163 (5), 147 (5), 121 (18), 114 (6), 91 (8), 76 (4),71 (6), 70 (11). По способу примера 25, выше, из 3 трифторметилфенилглицидилового эфира (2,0 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламина (2,5 ммоль) получали 600 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ, m/z (отн.инт.) 382 (М-15, 1), 277 По способу примера 25, выше, из 2 трифторметилфенилглицидилового эфира (2,0 ммоль) и 1,1-диметил-2-(4-метоксифенил) этиламина (2,5 ммоль) получали 690 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ, m/z (отн.инт.) 382 (М-15, 1),277 (16), 276 (100), 163 (10), 121 (22), 114 (8), 96 По способу примера 25, выше, из 2-третбутилфенилглицидилового эфира (2,0 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламина (2,5 ммоль) получали 540 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ,m/z (отн.инт.) 370 (М-15, 1), 265 (19), 264 (100),163 (5), 121 (17), 114 (6), 91 (8), 77 (3), 71 (9), 70 По способу примера 25, выше, из 2 метоксифенилглицидилового эфира (2,0 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламина(2,5 ммоль) получали 60 мг титульного соединения в виде белого твердого вещества: ГХ/МСЭЗ, m/z (отн.инт.) 344 (М-15, 0,1), 239 (15), 238 По способу примера 25, выше, из 2-третбутилфенилглицидилового эфира (2,0 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламина (2,5 ммоль) получали 400 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ,m/z (отн.инт.) 370 (М-15, 1), 265 (19), 264 (100),163 (5), 121 (15), 114 (5), 110 (3), 91 (4), 71 (6),70 (9), 57 (3). Пример 36. Получение N-[2-гидрокси-3-(4 трифторметилфенокси)пропил]-1,1-диметил-2(4-метоксифенил)этиламин гидрохлорида. Соединение 51. По способу примера 25, выше, из 4 трифторметилфенилглицидилового эфира (1,43 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламина (1,8 ммоль) получали 270 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ, m/z (отн.инт.) 382 (М-15, 3), 277 По способу примера 5, выше, из 1,2 эпокси-3-феноксипропана (600 мг, 4 ммоль) и 1,1-диметил-2-фенилэтиламина (596 мг, 4 ммоль) получали титульное соединение: ГХ/МС-ЭЗ, m/z (отн.инт.) 284 (М+1, 1), 208(100), 162 (1), 133 (7), 91 (27), 77 (15), 70 (22). Свободное основание в диэтиловом эфире обрабатывали избытком 1 М НСl (диэтиловый эфир). Образующееся твердое вещество перекристаллизовывали из горячего ацетонитрила, получая 596 мг хлористо-водородного продукта в виде белого твердого вещества. Пример 38. Получение N-(2-метокси-3 феноксипропил)-1,1-диметил-2-(4-метоксифенил)этиламин гидрохлорида. Соединение 59.N-бромсукцинимид (1,78 г, 10 ммоль) растворяли в 50 мл метанола и перемешивали при комнатной температуре в течение двух суток. Продукт, смесь 1:1 2-бром-1-метокси-3-феноксипропана и 1-бром-2-метокси-3-феноксипропана выделяли испарением метанола и растворением 44 остатка в смеси гептан/эфир/вода. Органический слой промывали сначала водой, затем рассолом, сушили над сульфатом натрия и выпаривали до сухого остатка. Сырую смесь (1,47 г, 6 ммоль) растворяли в 6 мл ацетонитрила, к которому добавляли 50% KF-Celite (0,7 г, 12 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламин(0,54 г, 3 ммоль). Смесь кипятили с обратным холодильником под азотом в течение 48 ч, после чего охлаждали и отфильтровывали. Фильтрат упаривали до сухого остатка, и остаток переносили в воду/эфир. Эфирный слой сушили над сульфатом натрия и концентрировали до сухого остатка. Остаток растворяли в 10 мл диэтилового эфира и высаживали в виде НСl соли добавлением 10 мл 1 М НСl (диэтиловый эфир). Отобранное твердое вещество очищали ЖХВР-ОФ,получая 330 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ, m/z По способу примера 5, выше, 1 октилглицидиловый эфир (187 мг, 1,0 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламин (197 мг, 1,1 ммоль) использовали для получения 105 мг титульного соединения в виде прозрачного бесцветного масла: ГХ/МС-ЭЗ, m/z (отн.инт.) 366 (М+1, 0,08), 350 (0,08), 244 (100), 222 (5.8),163 (12), 121 (18); 1 По способу примера 5, выше, 1 гексилглицидиловый эфир (175 мг, 1,0 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламин (197 мг, 1,1 ммоль) использовали для получения 95 мг титульного соединения в виде прозрачного бесцветного масла: ГХ/МС-ЭЗ, m/z (отн.инт.) 216 (М-121), 163 (11), 121 (22), 114 (14); 1 По способу примера 5, выше, 1 децилглицидиловый эфир (235 мг, 1,0 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламин (197 мг, 1,1 ммоль) использовали для получения 175 мг титульного соединения в виде прозрачного бесцветного масла: ГХ/МС-ЭЗ, m/z (отн.инт.) 394 (М+1, 1), 378 (6), 273 (97), 272 (100), 222 (9),163 (37), 121 (61); 1 По способу примера 25, выше, из фенилглицидилсульфида (3,9 ммоль) и 1,1-диметил-2(4-метоксифенил)этиламина (4,9 ммоль) получали 194 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ, m/z (отн.инт.) 330 (М-15, 4), 226 (21), 225 (58), 224 (100), 163 По способу примера 5, выше, 1,2 эпоксидекан (204 мг, 1,0 ммоль) и 1,1-диметил 2-(4-метоксифенил)этиламин (197 мг, 1,1 ммоль) использовали для получения 73 мг титульного соединения в виде прозрачного бесцветного масла: ГХ/МС-ЭЗ, m/z (отн.инт.) 214 По способу примера 5, выше, 1,2 эпоксидодекан (240 мкл, 1,0 ммоль) и 1,1 диметил-2-(4-метоксифенил)этиламин (197 мг,1,1 ммоль) использовали для получения 68 мг титульного соединения в виде прозрачного бесцветного масла: ГХ/МС-ЭЗ, m/z (отн.инт.) 363 По способу примера 5, выше, 1,2-эпокси-9 децен (202 мг, 1,0 ммоль) и 1,1-диметил-2-(4 метоксифенил)этиламин (197 мг, 1,1 ммоль) использовали для получения 80 мг титульного соединения в виде прозрачного бесцветного масла: ГХ/МС-ЭЗ, m/z (отн.инт.) 334 (М+1,0.02), 318 (0.7), 212 (100), 194 (13), 163 (11), 121 По способу примера 5, выше, додецилглицидиловый эфир (242 мг, 1,0 ммоль) и 1,1 диметил-2-(4-метоксифенил)этиламин (197 мг,1,1 ммоль) использовали для получения 121 мг титульного соединения в виде прозрачного бесцветного масла: ГХ/МС-ЭЗ, m/z (отн.инт.) 422 По способу примера 9, выше, 1,2-эпокси-3(1-адамантилметокси)пропан (410 мг, 1,8 ммоль) и 1,1-диметил-2-(4-метоксифенил) этиламин (403 мг, 2,25 ммоль) использовали для получения 625 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ, m/z По способу примера 6, выше, 1,2-эпокси-3 циклогексилметоксипропан (212 мг, 1,2 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламин (279 мг, 1,6 ммоль) использовали для получения 200 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ, m/z (отн.инт.) 334 (М 15, 1), 229 (15), 228 (100), 163 (9), 132 (5), 121(43,5 г, 151 ммоль) в хлороформе (250 мл) вводили в реакцию с 4-фенил-1-бутеном (20 г, 151 ммоль). Реакционную смесь перемешивали в течение 1 ч при комнатной температуре и промывали бикарбонатом натрия, сульфитом натрия и насыщенным хлористым натрием. Раствор сушили над сульфатом натрия и выпаривали до сухого остатка, получая 3,4-эпоксибутилбензол (100%). По способу примера 6, выше, 3,4 эпоксибутилбензол (1,4 ммоль) и 1,1-диметил-2(4-метоксифенил)этиламин (1,7 ммоль) использовали для получения 235 мг титульного соединения в виде белого твердого вещества: ГХ/МСЭЗ, m/z (отн.инт.) 312 (М-15, 0.1), 207 (16), 206 4-Метоксициннамонитрил гидрировали в этаноле с гидроокисью палладия на угле, получая 3-(4-метоксифенил)пропионитрил. Смесь безводного хлорида церия (III) (1,99 г, 8,1 ммоль) с сухим ТГФ (12 мл) перемешивали в течение 3 ч при комнатной температуре, охлаждали до -78 С и обрабатывали MeLi (5,8 мл, 8,1 ммоль). После перемешивания в течение 1 ч при-78 С реакционную смесь вводили в реакцию с 3-(4-метоксифенил)пропионитрилом (0,45 г, 2,8 ммоль). Реакционную смесь перемешивали в течение 5 ч при -78 С и затем реакцию гасили гидроокисью аммония. После нагревания до комнатной температуры реакционную смесь фильтровали, фильтрат разбавляли водой и экстрагировали диэтиловым эфиром. Слой диэтилового эфира сушили над сульфатом натрия и выпаривали. Сырое масло очищали хроматографией с нормальной фазой, получая 150 мг 1,1-диметил-2-(4-метоксифенил)этиламина в виде светло-желтого масла. По способу примера 6, выше, 1,2-эпокси-3 феноксипропан (0,62 ммоль) и 1,1-диметил-2-(4 метоксифенил)этиламин (0,78 ммоль) использовали для получения 105 мг титульного соединения в виде белого твердого вещества: ГХ/МСЭЗ, m/z (отн.инт.) 343 (М+, 4), 209 (14), 208 (99),161 (13), 122 (9), 121 (100), 77 (17), 72 (25), 71 По способу примера 16, выше, 1-адамантилглицидиловый эфир (350 мг, 1,0 ммоль) и 49 1,1-диметил-2-(4-метоксифенил)этиламин (197 мг, 1,0 ммоль) использовали для получения 207 мг титульного соединения в виде прозрачного бесцветного масла: ГХ/МС-ЭЗ, m/z (отн.инт.) 338 (М+1, 0,1), 372 (0,3), 266 (65), 163 (1), 135 Раствор 2,4,6-трифенилпиридинийтетрафторбората (2,97 г, 7,5 ммоль) в этаноле (15 мл) смешивали с 4-метилбензиламином (1 г, 8,25 ммоль). Реакционную смесь оставляли при перемешивании на ночь при комнатной температуре и разбавляли диэтиловым эфиром для осаждения продукта. Продукт перекристаллизовывали из смеси этанол/диэтиловый эфир, получая 3,15 г N-(4-метилбензил)-2,4,6-трифенилпиридинийтетрафторбората в виде коричневого твердого вещества. Гидрид натрия (0,92 г, 60% масляная суспензия, 22,9 ммоль) добавляли в метанол (10 мл) при 0 С, после чего добавляли 2-нитропропан(2,04 г, 22,9 ммоль). Реакционную смесь перемешивали в течение 30 мин при комнатной температуре и метанол выпаривали под пониженным давлением. Затем к сухой натриевой соли 2-нитропропана добавляли раствор N-(4 метилбензил)-2,4,6-трифенилпиридинийтетрафторбората (3,15 г, 7,6 ммоль) в ДМСО (25 мл). Смесь оставляли на ночь при перемешивании при 60 С под азотом. Реакционную смесь разбавляли водой и продукт экстрагировали диэтиловым эфиром. Эфирный слой промывали насыщенным NaCl и сушили над сульфатом натрия. Эфирный раствор обрабатывали ионообменной смолой Amberlyst 15, чтобы абсорбировать 2,4,6-трифенилпиридин. Смолу отфильтровывали и фильтрат выпаривали, получая 1,3 г чистого 1-(4-метилфенил)-2-метил-2-нитропропана. 1-(4-Метилфенил)-2-метил-2-нитропропан(1,3 г) в этаноле (30 мл) гидрировали в течение 5 ч при давлении водорода 4,6 атм, используя никель Ренея в качестве катализатора. После удаления катализатора фильтрацией и выпаривания растворителя получали 1,15 г 1,1-диметил-2-(4 метоксифенил)этиламина в виде прозрачного масла. 50 По способу примера 6, выше, 1,2-эпокси-3 феноксипропан (1,3 ммоль) и 1,1-диметил-2-(4 метоксифенил)этиламин (0,6 ммоль) использовали для получения 85 мг титульного соединения в виде белого твердого вещества: ГХ/МСЭЗ, m/z (отн.инт.) 298 (М-15, 7), 209 (47), 208 По способу примера 6, выше, 1,2-эпокси-3 феноксипропан (200 мг, 1,3 ммоль) и 1,1 диметил-1-(3-метоксифенил)этиламин (263 мг,1,5 ммоль) использовали для получения 340 мг титульного соединения в виде белого твердого вещества: ГХ/МС ЭЗ, m/z (отн.инт.), 209 (14),208 (100), 206 (6), 121 (11), 114 (5), 107 (5), 91 К раствору 3-хлорпероксибензойной кислоты (70% чистоты, 4,2 г, 17 ммоль) в 40 мл хлороформа добавляли металлилфениловый эфир (2,5 г, 16,87 ммоль). Смесь перемешивали при комнатной температуре в течение 5 ч и затем обрабатывали, вливая в эфир и бикарбонат натрия. Органическую фазу промывали бисульфитом натрия, бикарбонатом натрия и хлористым натрием, сушили над безводным сульфатом натрия и выпаривали, получая 2,3 г 1,2 эпокси-2-метил-3-феноксипропана. По способу примера 6, выше, 1,2-эпокси-2 метил-3-феноксипропан (0,092 г, 0,56 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламин (0,10 г, 0,56 ммоль) использовали для получения 120 мг титульного соединения в виде белого твердого вещества: ГХ/МС- ЭЗ, m/z (отн.инт.) 328 (М 15, 1), 223 (15), 222 (100), 163 (13), 147 (13), 121 По способу примера 6, выше, 1,2-эпокси-3 феноксипропан (950 мг, 6,3 ммоль) и 1,1 диметил-2-(4-хлорфенил)этиламин (1,45 г, 7,9 ммоль) использовали для получения 150 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ, m/z (отн.инт.) 318 (М-15, 51 7), 209 (47), 208 (100), 127 (11), 125 (33), 114 По способу примера 6, выше, 1,2-эпокси-3 феноксипропан (1,3 г, 8,8 ммоль) и 1,1-диметил 2-(4-хлорфенил)этиламин (2,0 г, 11 ммоль) использовали для получения 338 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ, m/z (отн.инт.) 318 (М-15, 1), 209 Свободное основание (1,5 г) соединения 19 хроматографировали через ChiraCel OD (202,5 см), используя этанол-гексан (1:4, плюс 0,1% диэтиламина) при 10 мл/мин (270 нм). Хроматография каждого энантиомера через Vydac C-18(525 см) при использовании градиента от 0,1% НСl до ацетонитрила (50 мл/мин, 264 нм) дает хлористо-водородную соль соединения 105 (464 мг) []26D=15,3 (с=0,928, СНСl3), т.пл. 113115 С и соединения 106 (463 мг) []26D=-13,8C При использовании способа примера 5,выше,1,2-эпокси-3-[4-метокси-(1-нафтокси)] пропан (462 мг, 2 ммоль) и 1,1-диметил-2-(4 метоксифенил)этиламин (120 мг, 0,67 ммоль) дают после препаративной ТСХ и ЖХВР-ОФ 116 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ, m/z (отн.инт.) При использовании способа примера 5,выше, 1,2-эпокси-3-[4-хлор-(1-нафтокси)]пропан (469 мг, 2 ммоль) и 1,1-диметил-2-(4 метоксифенил)этиламин (120 мг, 0,67 ммоль) дают после препаративной ТСХ и ЖХВР-ОФ 131 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ, m/z (отн.инт.) 414 (M+, 0,5), 398 (1), 292 (100), 121 (33), 71 (43). Пример 60. Получение (R)-N-[2-гидрокси 3-(3-хлор-2-цианофенокси)пропил]-1,1-диметил-2-(4-метоксифенил)этиламин гидрохлорида. Соединение 109. К раствору 18-краун-6 (3,96 г, 15 ммоль) в 30 мл ацетонитрила добавляли сухой ацетат калия (1,47 г, 15 ммоль) и 2-хлор-6-фторбензонитрил (1,56 г, 10 ммоль). Реакционную смесь кипятили с обратным холодильником под азотом в течение 25 ч, затем охлаждали до комнатной температуры. Добавляли гидроокись натрия (2 мл 10 М раствора, 20 ммоль) и воду (5 мл) и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Ацетонитрил удаляли в роторном испарителе и остаток принимали на эфир и воду. Щелочной водный слой трижды промывали эфиром. Водный слой затем подкисляли НСl, и продукт экстрагировали эфиром. Эфирный слой сушили над безводным сульфатом натрия, фильтровали и концентрировали. Полученное твердое вещество кристаллизовали из смеси метанол/вода, получая 1,11 г 3-хлор-2-цианофенола. 3-Хлор-2-цианофенол (0,55 г, 3,58 ммоль) растворяли в 10 мл диметилформамида и раствор охлаждали до 0 С. Гидрид натрия (0,158 г,3,94 ммоль 60% в масле), промытый гексаном и диметилформамидом, за одну минуту добавляли к охлажденному раствору. После перемешивания в течение 10 мин при комнатной температуре добавляли (2R)-(-)-глицидил-3-нитробензолсульфонат и перемешивали в течение 16 ч. Реакционную смесь выливали на эфир и разбавленную гидроокись натрия. Эфирный слой отделяли и водный слой дополнительно экстрагировали эфиром. Объединенные эфирные экстракты промывали водой и насыщенным рассолом, сушили над безводным сульфатом натрия,фильтровали и концентрировали, получая 0,7 г 53 По способу примера 6, выше, (R)-3-хлор-2 цианофенилглицидиловый эфир (0,7 г, 3,34 ммоль) и 1,1-диметил-(4-метоксифенил)этиламин (0,72 г, 4,0 ммоль) использовали для получения 570 мг титульного соединения в виде белого твердого вещества. 1 По способу примера 52, выше, 4 этилбензиламин (4,0 г, 29,6 ммоль) использовали для получения 3,6 г 1,1-диметил-2-(4 этилфенил)этиламина. По способу примера 6,выше, 1,2-эпокси-3-феноксипропан (0,43 г, 2,9 ммоль) и 1,1-диметил-2-(4-этилфенил)этиламин(0,5 г, 2,8 ммоль) использовали для получения 600 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ, m/z (отн.инт.) 313 (М-15, 1), 209 (23), 208 (100), 133 (5), 119 По способу примера 52, выше, 4 трифторметоксибензиламин (2,0 г, 10,5 ммоль) использовали для получения 2,2 г 1,1-диметил 2-(4-трифторметоксифенил)этиламина. По способу примера 6,выше,1,2-эпокси-3 феноксипропан (0,12 г, 0,8 ммоль) и 1,1-диметил-2-(4-трифторметоксифенил)этиламин(0,175 г, 0,8 ммоль) использовали для получения 15 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ, m/z (отн.инт.) 368 (М-15,2), 209 (39), 208 (100), 175 (20), 133 По способу примера 52, выше, 4 изопропилбензиламин (4,89 г, 32,8 ммоль) использовали для получения 4,1 г 1,1-диметил-2 002984(4-изопропилфенил)этиламина. По способу примера 6, выше, 1,2-эпокси-3-феноксипропан(0,173 г, 1,15 ммоль) и 1,1-диметил-2-(4 изопропилфенил)этиламин (0,275 г, 1,44 ммоль) использовали для получения 89 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ, m/z (отн.инт.) 326 (М-15,1), 209 (14),208 (100), 133 (9), 117 (5), 114 (5), 105 (5), 91 (6),77 (8), 71 (8), 70 (13), 58 (5). Пример 64. Получение N-(2-гидрокси-3 феноксипропил)-1-этил-1-метил-2-(4-метоксифенил)этиламин гидрохлорида. Соединение 113. 4-Гидроксибензиловый спирт (0,35 г, 2,82 ммоль) и фторид тетрабутиламмония (0,147 г,0,56 ммоль) растворяли в 3 мл 2-нитробутана и грели при 130-145 С под азотом в течение 20 ч. Реакционную смесь охлаждали и распределяли между водой и эфиром. Эфирный слой отделяли, промывали насыщенным рассолом, сушили над безводным сульфатом натрия и концентрировали. Сырой продукт очищали препаративной ТСХ, используя этилацетат/гексан в качестве элюента. Выход 1-этил-1-метил-2-(4-гидроксифенил)нитроэтана составил 0,21 г. К суспензии 40 вес.% фтористого калия на окиси алюминия (0,73 г, 5 ммоль) в 3 мл ацетонитрила добавляли 1-этил-1-метил-2-(4-гидроксифенил)нитроэтан (0,21 г, 1,0 ммоль) и йодометан (0,21 г, 1,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 4 суток, затем фильтровали и промывали ацетонитрилом. Ацетонитрил удаляли в роторном испарителе и остаток распределяли между эфиром и водой. Эфирный слой отделяли,промывали бисульфитом натрия, карбонатом натрия и насыщенным рассолом, затем сушили над безводным сульфатом натрия и концентрировали. Выход 1-этил-1-метил-2-(4-метоксифенил)нитроэтана составил 0,183 г. Моногидрат хлористого никеля (0,107 г,0,404 ммоль) растворяли в 5 мл метанола, после чего добавляли борогидрид натрия (0,05 г, 1,2 ммоль). После перемешивания в течение 5 мин добавляли 1-этил-1-метил-2-(4-метоксифенил) нитроэтан (0,18 г, 0,807 ммоль) в 3 мл метанола и перемешивали в течение 5 мин. Затем в течение 5 мин добавляли порциями борогидрид натрия (0,11 г, 2,83 ммоль). После этого реакционную смесь оставляли перемешиваться на ночь,подсоединенной к баллону с водородом. Реакционную смесь фильтровали и метанол удаляли в роторном испарителе. Остаток принимали в эфир и разбавленную гидроокись натрия. Эфирный слой отделяли, промывали насыщенным рассолом, сушили над безводным сульфатом натрия и концентрировали. Выход 1-этил-1 55 метил-2-(4-метоксифенил)этиламина составил 0,127 г. По способу примера 6, выше, 1,2-эпокси-3 феноксипропан (0,086 г, 0,57 ммоль) и 1-этил-1 метил-2-(4-метоксифенил)этиламин (0,11 г, 0,57 ммоль) использовали для получения 90 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ, m/z (отн.инт.) 314 (М 29,2), 223 (15), 222 (100), 128 (6), 121 (20), 107 Безводный хлорид церия (III) (13,6 г, 55,2 ммоль) суспендировали в 80 мл сухого тетрагидрофурана и перемешивали под азотом в течение 16 ч. Эту суспензию охлаждали в ледяной бане, и добавляли этилмагнийхлорид (27,6 мл,55,18 ммоль 2 М раствор в ТГФ) за 5 мин. После перемешивания в течение 1 ч к суспензии добавляли 4-метоксифенилацетат (3,98 г, 22,07 ммоль) и перемешивали еще в течение 2 ч. После этого реакционную смесь распределяли между эфиром и насыщенным хлористым аммонием. Эфирный слой отделяли, промывали разбавленной НСl, водой и рассолом, сушили над безводным сульфатом натрия и концентрировали. Выход 1,1-диэтил-2-(4-метоксифенил)этанола составил 4,65 г. Порошок цианистого натрия (1,18 г, 24 ммоль) помещали в колбу и покрывали 5,5 мл уксусной кислоты. Смесь серной кислоты (3 мл) и уксусной кислоты (2,75 мл) охлаждали до 0 С и затем за 3 мин добавляли к суспензии цианида. Смесь перемешивали в течение 30 мин при комнатной температуре, после чего добавляли 1,1-диэтил-2-(4-метоксифенил)этанола (4,6 г, 22 ммоль). Смесь оставляли при перемешивании на ночь, затем выливали в смесь льда и гидроокиси натрия. Продукт экстрагировали эфиром, эфирный слой сушили над безводным сульфатом натрия и концентрировали. Остаток суспендировали в 20% гидроокиси натрия и кипятили с обратным холодильником под азотом в течение ночи. Реакционную смесь охлаждали, разбавляли водой и экстрагировали эфиром. Эфирный слой отделяли, промывали рассолом, сушили над безводным сульфатом натрия и концентрировали. Остаток очищали ЖХВР с обращенной фазой(С-18 с использованием 0,1% НСl/ацетонитрил в качестве элюента), получая 1,91 г 1,1-диэтил-2-(4-метоксифенил)этиламина. По способу примера 6, выше, 1,2-эпокси-3 феноксипропан (0,15 г, 1,0 ммоль) и 1,1-диэтил 2-(4-метоксифенил)этиламин (0,249 г, 1,2 ммоль) использовали для получения 244 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ, m/z (отн.инт.) 328 (М-29, 002984 2,3-Дихлорфенол (0,69 г, 4,24 ммоль) растворяли в 15 мл ацетона, после чего добавляли порошковый карбонат калия (1,6 г, 11,57 ммоль). Эту смесь перемешивали в течение 2 ч,после чего добавляли (2R)-(-)-глицидил-3 нитробензолсульфонат и оставляли при перемешивании на ночь. Реакционную смесь обрабатывали, вливая в смесь вода-эфир. Эфирный слой отделяли, промывали рассолом, сушили над безводным сульфатом натрия и концентрировали. Выход (R)-2,3-дихлорфенилглицидилового эфира составил 0,837 г. По способу примера 6, выше, (R)-2,3 дихлорфенилглицидиловый эфир (0,837 г, 3,82 ммоль) и 1,1-диметил-2-(4-метоксифенил) этиламин (0,75 г, 4,18 ммоль) использовали для получения 860 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ, m/z 2,3-Дихлорфенол (0,69 г, 4,24 ммоль) растворяли в 15 мл ацетона, после чего добавляли порошковый карбонат калия (1,6 г, 11,57 ммоль). Эту смесь перемешивали в течение 2 ч,после чего добавляли (2S)-(+)-глицидил-3 нитробензолсульфонат и оставляли при перемешивании на ночь. Реакционную смесь обрабатывали, вливая в смесь вода-эфир. Эфирный слой отделяли, промывали насыщенным рассолом, сушили над безводным сульфатом натрия и концентрировали. Выход (S)-2,3-дихлорфенилглицидилового эфира составил 0,84 г. По способу примера 6, выше, (S)-2,3 дихлорфенилглицидиловый эфир (0,84 г, 3,82 ммоль) и 1,1-диметил-2-(4-метоксифенил) этиламин (0,75 г, 4,18 ммоль) использовали для получения 860 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ, m/z По способу примера 64, выше, 4-гидрокси 3-метилбензиловый спирт (1,0 г, 7,25 ммоль), 2 нитропропан (5 мл) и тетрабутиламмонийфторид (0,38 г, 0,145 ммоль) использовали для получения 0,8 г 1,1-диметил-2-(4-метокси-3 метилфенил)этиламина. По способу примера 6, выше, 1,2-эпокси-3 феноксипропан (0,151 г, 1,0 ммоль) и 1,1 диметил-2-(4-метокси-3-метилфенил)этиламин(0,2 г, 1,0 ммоль) использовали для получения 130 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ, m/z (отн.инт.) 328 (М-15, 1), 209 (14), 208 (100), 177 (5), 135 Порошковый цианистый натрий (9,0 г, 184 ммоль) и 2,6-диметоксибензонитрил добавляли к 50 мл диметилсульфоксида и нагревали до 145 С под азотом в течение 110 мин. Реакционную смесь охлаждали и выливали на эфир и разбавленную НСl. Эфирный слой отделяли,дважды промывали разбавленной кислотой и один раз насыщенным рассолом, сушили над безводным сульфатом натрия и концентрировали. Выход 2-циано-3-метоксифенола составил 8,1 г. 2-Циано-3-метоксифенол (1 г, 6,7 ммоль) и порошковый карбонат калия (2,78 г, 20,1 ммоль) перемешивали в 15 мл ацетона в течение 5 мин,после чего добавляли эпибромогидрин (1,38 г,10,1 ммоль). Смесь перемешивали в течение 72 ч, после чего выливали на эфир/воду. Эфирный слой отделяли, промывали карбонатом натрия и рассолом, сушили над безводным сульфатом натрия и концентрировали. Полученное сырое твердое вещество растирали со смесью эфир/гексан, фильтровали и сушили под вакуумом, получая 0,44 г 2-циано-3-метоксифенилглицидилового эфира. По способу примера 6, выше, 2-циано-3 метоксифенилглицидиловый эфир (0,205 г, 1,0 ммоль) и 1,1-диметил-2-(4-метокси-3-метилфенил)этиламин (0,215 г, 1,2 ммоль) использовали для получения 265 мг титульного соединения в виде белого твердого вещества: 1 По способу примера 69, выше, 3-хлор-2 цианофенол (приготовленный с использованием способа примера 60, выше) (0,48 г, 3,13 ммоль),карбонат калия (1,3 г, 9,38 ммоль) и эпибромогидрин (0,86 г, 6,25 ммоль) были использованы для получения 93 мг 3-хлор-2-цианофенилглицидилового эфира. По способу примера 6, выше, 3-хлор-2 цианофенилглицидиловый эфир (0,093 г, 0,44 ммоль) и 1,1-диметил-(4-метоксифенил)этиламин (0,095 г, 0,53 ммоль) использовали для получения 134 мг титульного соединения в виде белого твердого вещества: 1 По способу примера 52, выше, 2 аминометилнафталин (2,51 г, 16 ммоль) применяли для получения 1,9 г 1,1-диметил-2-(2-нафтилэтиламина). По способу примера 6, выше, 1,2-эпокси-3 феноксипропан (0,163 г, 1,1 ммоль) и 1,1 диметил-2-(2-нафтил)этиламин (0,26 г, 1,3 ммоль) использовали для получения 243 мг титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ, m/z (отн.инт.) 334 (М-15,1), 209 (14), 208 (100), 141 (16), 115 (7), 76 (5),70 (7). Пример 72. Получение N-(2-гидрокси-3 феноксипропил)-1,1 диметил-2-(3,4-диметилфенил)этиламин гидрохлорида. Соединение 121. По способу примера 52, выше, 3,4 диметилбензиламин (5 г, 37 ммоль) применяли для получения 2,29 г 1,1-диметил-2-(3,4 диметилфенил)этиламина. По способу примера 6, выше, 1,2-эпокси-3 феноксипропан (0,165 г, 1,1 ммоль) и 1,1 диметил-2-(3,4-диметилфенил)этиламин (0,22 г,1,2 ммоль) использовали для получения 268 мг 59 титульного соединения в виде белого твердого вещества: ГХ/МС-ЭЗ, m/z (отн.инт.) 312 (М-15,1), 209 (14), 208 (100), 133 (5), 119 (13), 114 (5),107 (5), 91 (5), 76 (10), 71 (8), 70 (14), 58 (6). Пример 73. Получение (R)-N-[2-гидрокси 3-(2-цианофенокси)пропил]-1,1-диметил-2-(4 метоксифенил)этиламин гидрохлорида. Соединение 122. По способу примера 60, выше, 2 цианофенол (0,54 г, 4,5 ммоль), гидрид натрия(0,188 г, 4,7 ммоль) и (2R)-(-)-глицидил-3 нитробензолсульфонат (1,06 г, 4,1 ммоль) использовали для получения 350 мг (R)-2 цианофенилглицидилового эфира. По способу примера 6, выше, (R)-2 цианофенилглицидиловый эфир (0,35 г, 2,0 ммоль) и 1,1-диметил-(4-метоксифенил)этиламин (0,35 г, 1,96 ммоль) использовали для получения 600 мг титульного соединения в виде белого твердого вещества: 1(225 мл), насыщенным водным бикарбонатом натрия (325 мл), и рассолом (25 мл). Органическую фазу сушили над сульфатом магния и растворители удаляли под вакуумом. Полученное желтое масло использовали без дальнейшей очистки. К раствору окиси сафрола (196 мг, 1,1 ммоль) в ацетонитриле (1,0 мл) добавляли перхлорат лития (107 мг). Раствор перемешивали при температуре окружающей среды, чтобы полностью растворить твердый перхлорат лития. К этому раствору добавляли 1,1-диметил-2(4-метоксифенил)этиламин (180 мг, 1,0 ммоль) и реакционную смесь оставляли на ночь перемешивали при 50 С. К охлажденной реакционной смеси добавляли воду (5 мл) и затем экстрагировали ее метиленхлоридом (31 мл). Объединенные органические фазы промывали водой(1 мл) и рассолом (1 мл) и сушили над сульфатом магния. Сырое оранжевое масло очищали(ЖХСР, силикагель, 1% МеОН/СНСl3) и растворяли в метиленхлориде (5 мл). Хлористоводородную соль получали добавлением избытка 1 М HCl/эфир. Растворители удалили под вакуумом, получая 139 мг густого масла: ГХ/МСЭЗ, m/z (отн.инт.) 342 (М+, 0,1), 237 (15), 236 По способу примера 9, выше, 1,2-эпокси 10-гидроксидекан (172 мг, 1 ммоль) и 1,1 диметил-2-(4-метоксифенил)этиламин (230 мг,1,5 ммоль) были использованы для получения хлористо-водородной соли титульного соединения. ЖХСР свободного амина (силикагель, 1% МеОН/СНСl3) с последующей обработкой избытком 1 М HCl/эфир дает 130 мг титульного соединения в виде белого порошка: ГХ/МС-ЭЗ,m/z (отн.инт.) 336 (M+-15, 1), 231 (14), 230 (100),212 (9), 163 (10), 122 (5), 121 (42), 91 (8), 78 (6),77 (5), 71 (13), 70 (11), 58 (8), 55 (8), 41 (6). Пример 75. Получение N-[2-гидрокси-3(3,4-метилендиоксифенил)пропил]-1,1-диметил 2-(4-метоксифенил)этиламин гидрохлорида. Соединение 124. По способу примера 9, выше, 1,2-эпокси-3(3,4-метилендиоксифенокси)пропан (194 мг, 1 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламин (180 мг, 1 ммоль) были использованы для получения хлористо-водородной соли титульного соединения. ЖХСР свободного амина (силикагель, 1% МеОН/СНСl3) с последующей обработкой избытком 1 М HCl/эфир дает 88 мг белого порошка ГХ/МС-ЭЗ, m/z (отн.инт.) 374 (М+,.0), 253 (15), 252 (100), 137 (8), 121 (16), 114 (8),71 (12), 70 (8). Пример 77. Получение N-[2-гидрокси-3-(6 фенилгексанокси)пропил]-1,1-диметил-2-(4 метоксифенил)этиламина. Соединение 126. Окись сафрола получали путем перемешивания раствора сафрола (1,48 мл, 10 ммоль) и мхлорпероксибензойной кислоты (2,70 г, 11 ммоль) в метилендихлориде (25 мл) в течение ночи. Реакцию гасили, выливая смесь на воду(50 мл). Водный слой экстрагировали эфиром(325 мл). Органические слои объединяли и По способу примера 9, выше, 6 фенилгексилглицидиловый эфир (337 мг, 1,44 ммоль) и 1,1-диметил-2-(4-метоксифенил)этиламин (180 мг, 1 ммоль) использовали для получения титульного соединения. Препаративную ТСХ (20 см 20 см 2 мм, силикагель, элюирование 1% МеОН/СНСl3) использовали для очистки продукта и получения 275 мг свободно
МПК / Метки
МПК: A61K 31/137, C07C 217/34, A61P 5/22
Метки: кальцилитических, фармацевтические, способ, скрининга, кальцилитические, соединения, композиции, соединений
Код ссылки
<a href="https://eas.patents.su/30-2984-kalciliticheskie-soedineniya-farmacevticheskie-kompozicii-i-sposob-skrininga-kalciliticheskih-soedinenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Кальцилитические соединения, фармацевтические композиции и способ скрининга кальцилитических соединений</a>


































