Средства растительного происхождения для подавления аппетита
Номер патента: 2885
Опубликовано: 31.10.2002
Авторы: Леармонт Робин Алек, Ван Херден Фани Ретиф, Влеггар Роберт, Махарай Винес, Виттал Рори Десмонд, Хорак Рулоф Мартинюс
Формула / Реферат
1. Способ получения экстракта растения из рода Trichocaulon или из рода Hoodia, содержащего агент, подавляющий аппетит, из соединений общей формулы (2)
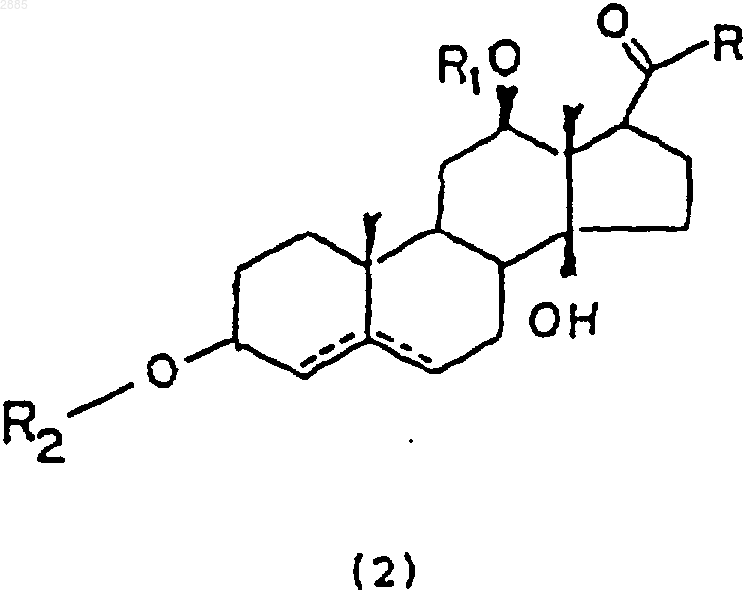
в которой R является алкилом;
R1 представляет собой атом водорода, алкил, тиглоил, бензоил или любую другую органическую сложноэфирную группу;
R2 представляет собой атом водорода, один или несколько 6-деоксиуглеводов, один или несколько 2,6-дидеоксиуглеводов, или молекулы глюкозы или их сочетания;
и в которой пунктиром указано на необязательное наличие дополнительной связи между С4-С5 или С5-С6,
включающий стадии обработки растительного материала растворителем для экстрагирования фракции, обладающей активностью подавления аппетита, отделения экстрагирующего раствора от остального растительного материала, удаление растворителя из экстрагирующего раствора и выделение экстракта.
2. Способ по п.1, в котором растение из рода Trichocaulon выбирают из видов Trichocaulon piliferum и Trichocaulon officinale, а растение из рода Hoodia выбирают из видов Hoodia currorii, Hoodia gordonii и Hoodia lugardii.
3. Способ по п.1 или 2, который включает стадию концентрирования активного агента в экстрагируемом материале, посредством дополнительной экстракции растворителем.
4. Способ по пп.1, 2 или 3, в котором растворитель на стадии или стадиях экстракции представляет собой один или несколько растворителей, выбранных из хлористого метилена, воды, метанола, гексана, этилацетата или их смесей.
5. Способ по любому из пп.1-4, который включает стадию концентрирования активного агента в экстрагируемом материале посредством хроматографического разделения.
6. Способ по п.5, в котором при хроматографическом разделении используют один или несколько элюентов, выбранных из хлороформа, метанола, гексана, этилацетата или их смесей.
7. Способ по п.5 или 6, который включает проведение хроматографического разделения на колонке, сбор элюата во фракциях из колонки, оценку фракций, чтобы определить их активность для подавления аппетита, и выбор, по меньшей мере, одной фракции, содержащей агент, подавляющий аппетит.
8. Способ по любому из предшествующих пунктов, в котором экстракт обрабатывают, чтобы получить сыпучий порошок.
9. Экстракт, содержащий агент, подавляющий аппетит, который получают способом по любому из предшествующих пунктов.
10. Композиция, обладающая активностью подавления аппетита, которая содержит экстракт по п.9.
11. Композиция по п.10, содержащая фармацевтический эксципиент, разбавитель или носитель.
12. Композиция по п.10 или 11 в форме единичной дозировки.
13. Применение экстракта по п.9 в производстве медикамента, обладающего активностью подавления аппетита.
14. Экстракт по п.9, применяемый в качестве медикамента, обладающего активностью подавления аппетита.
15. Способ подавления аппетита посредством введения человеку или животному эффективной дозы композиции по пп.10,11 или 12.
16. Способ по п.1, включающий стадии прессования растительного материала для отделения сока от твердого растительного материала и выделения сока, не содержащего растительный материал для образования экстракта.
17. Способ по п.16, в котором экстракт сушат, чтобы получить сыпучий порошок.
18. Экстракт, содержащий агент, подавляющий аппетит, который получают способом по п.16 или 17.
19. Композиция, обладающая активностью подавления аппетита, которая содержит экстракт по п.18.
20. Композиция по п.19, содержащая фармацевтический эксципиент, разбавитель или носитель.
21. Композиция по п.19 или 20 в форме единичной дозировки.
22. Применение экстракта по п.19 в производстве медикамента, обладающего активностью подавления аппетита.
23. Экстракт по п.18, применяемый в качестве медикамента, обладающего активностью подавления аппетита.
24. Способ подавления аппетита посредством введения человеку или животному эффективной дозы композиции по пп.19, 20 или 21.
25. Экстракт, получаемый из растения из рода Trichocaulon или из рода Hoodia, который содержит агент, подавляющий аппетит, имеющий формулу
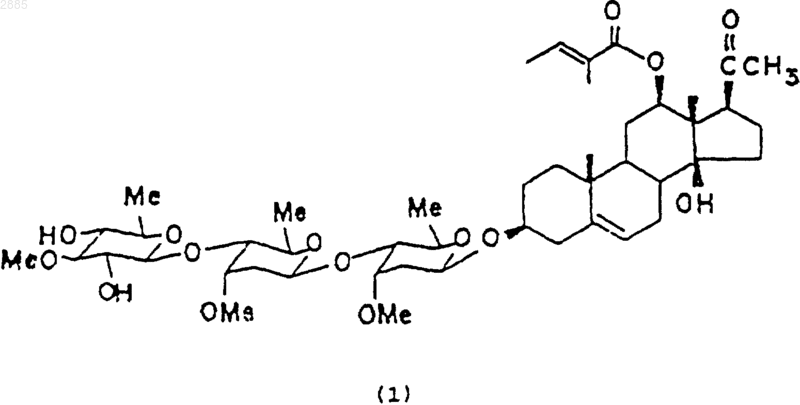
26. Экстракт по п.25, в котором растение из рода Trichocaulon выбирают из видов Trichocaulon piliferum и Trichocaulon officinale, а растение из рода Hoodia выбирают из видов Hoodia currorii, Hoodia gordonii и Hoodia lugardii.
27. Экстракт по п.26, из которого удалены практически все неактивные примеси.
28. Экстракт по любому одному из пп.25-27 в виде сыпучего порошка.
29. Композиция, обладающая активностью подавления аппетита, которая содержит экстракт по любому одному из пп.25-28.
30. Композиция по п.29, содержащая фармацевтический эксципиент, разбавитель или носитель.
31. Композиция по п.29 или 30 в форме единичной дозировки.
32. Применение экстракта по любому одному из пп.25-28 в производстве медикамента, обладающего активностью подавления аппетита.
33. Экстракт по любому одному из пп. 25-28, применяемый в качестве медикамента, обладающего активностью подавления аппетита.
34. Способ подавления аппетита посредством введения человеку или животному эффективной дозы композиции по пп.29, 30 или 31.
35. Соединение, имеющее общую структурную формулу (2)
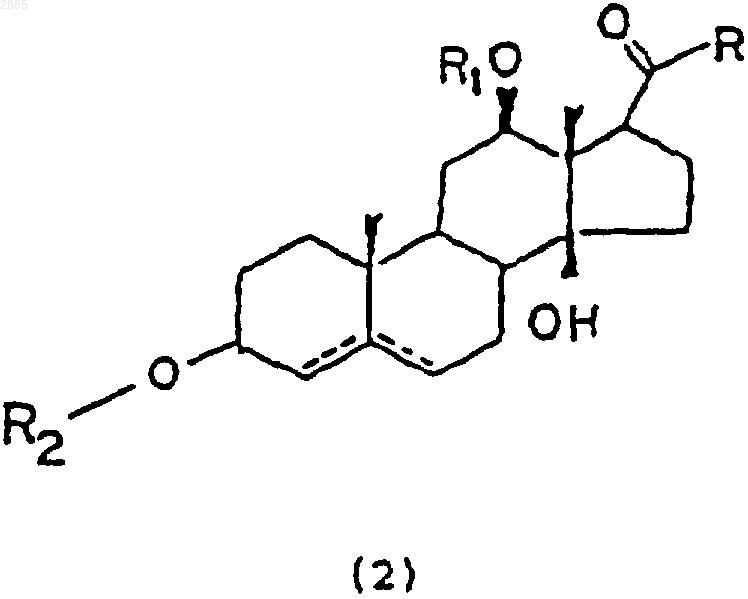
в которой R является алкилом;
R1 представляет собой атом водорода, алкил, тиглоил, бензоил или любую другую органическую сложноэфирную группу;
R2 представляет собой атом водорода, один или несколько 6-деоксиуглеводов, один или несколько 2,6-дидеоксиуглеводов или молекулы глюкозы или их сочетания
и в которой пунктиром указано на необязательное наличие дополнительной связи между С4-С5 или С5-С6.
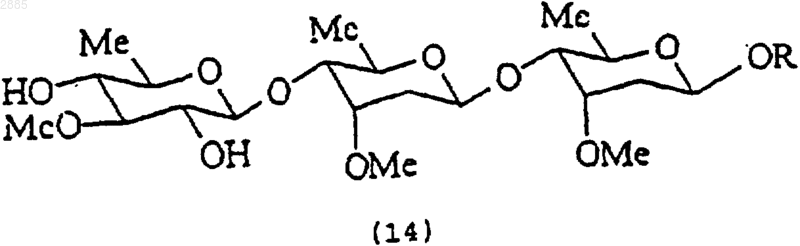
36. Соединение по п.35, в котором имеется связь между С5-С6, R является метилом, R1 представляет собой тиглоил, R2 представляет собой 3-O-[-b-D-теветопиранозил-(1R 4)-b-D-цимаропиранозил-(1R 4)-b-D-цимаропиранозил] и имеет структурную формулу

37. Соединение, имеющее общую структурную формулу, в которой R является алкилом и
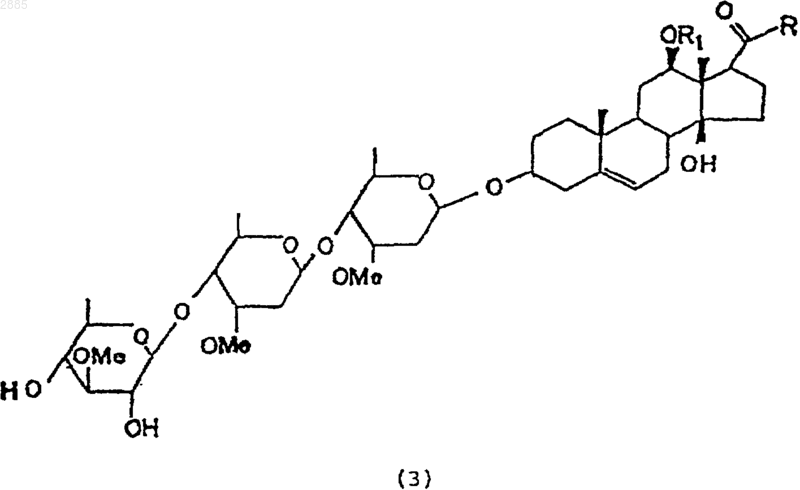
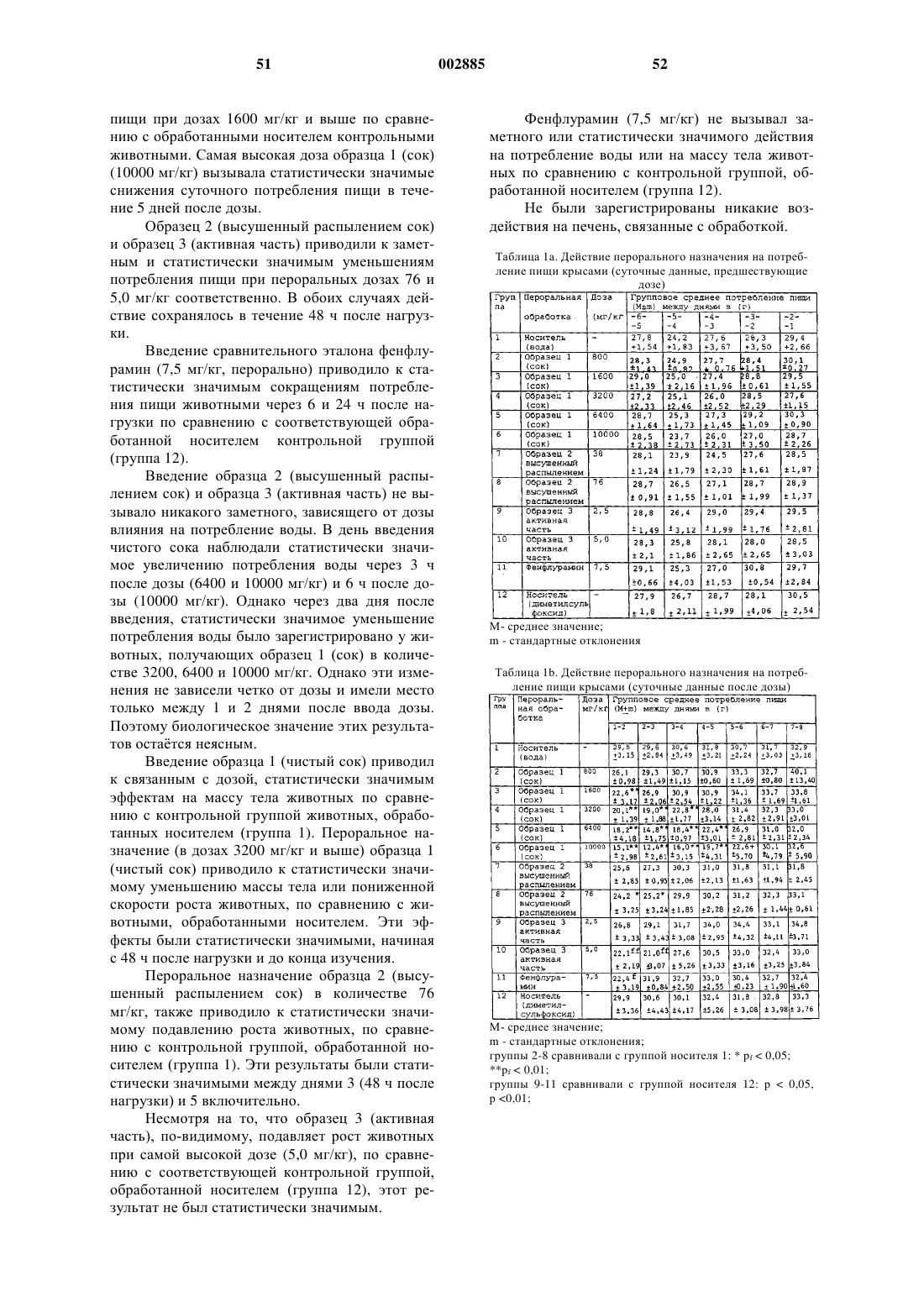
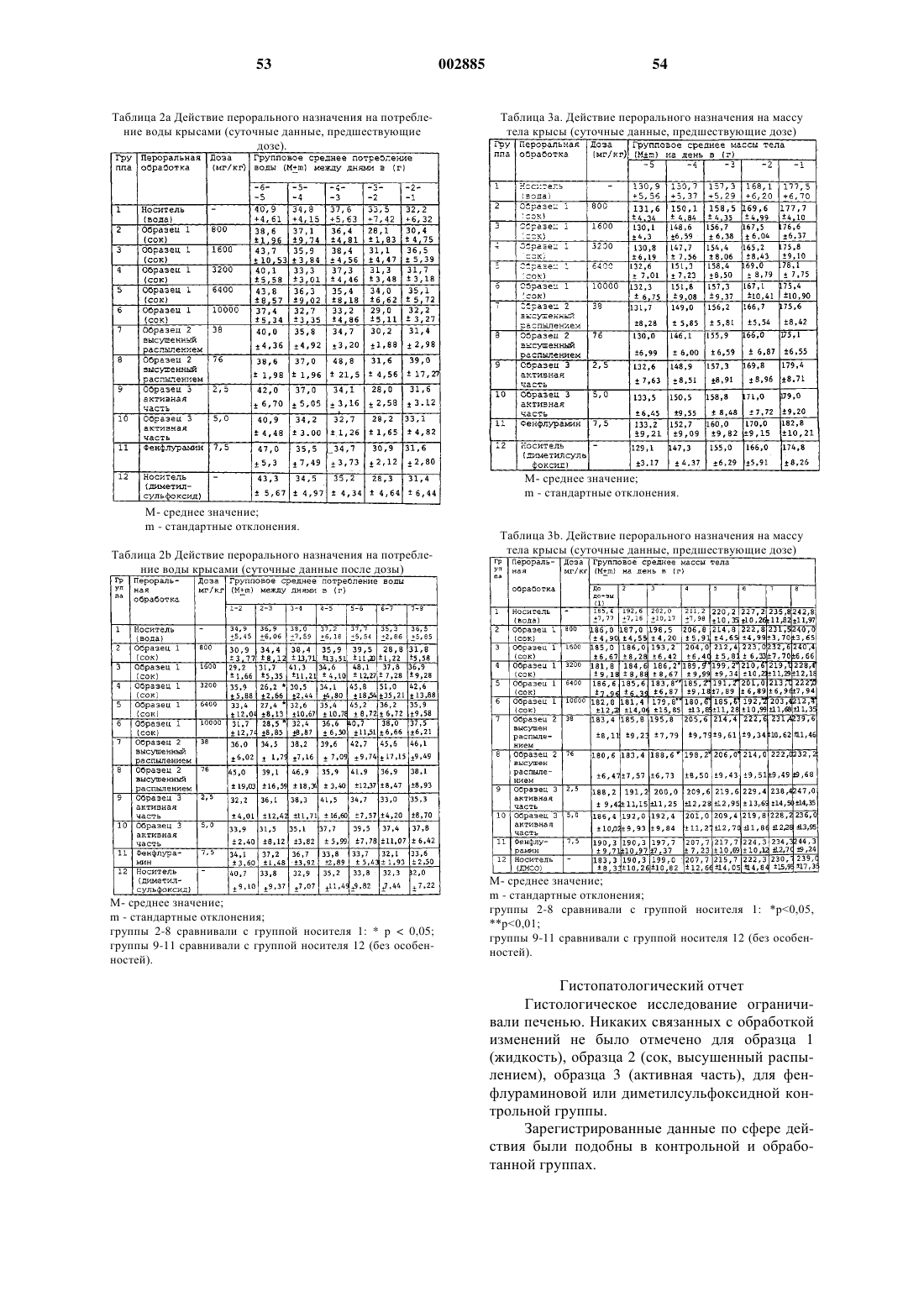
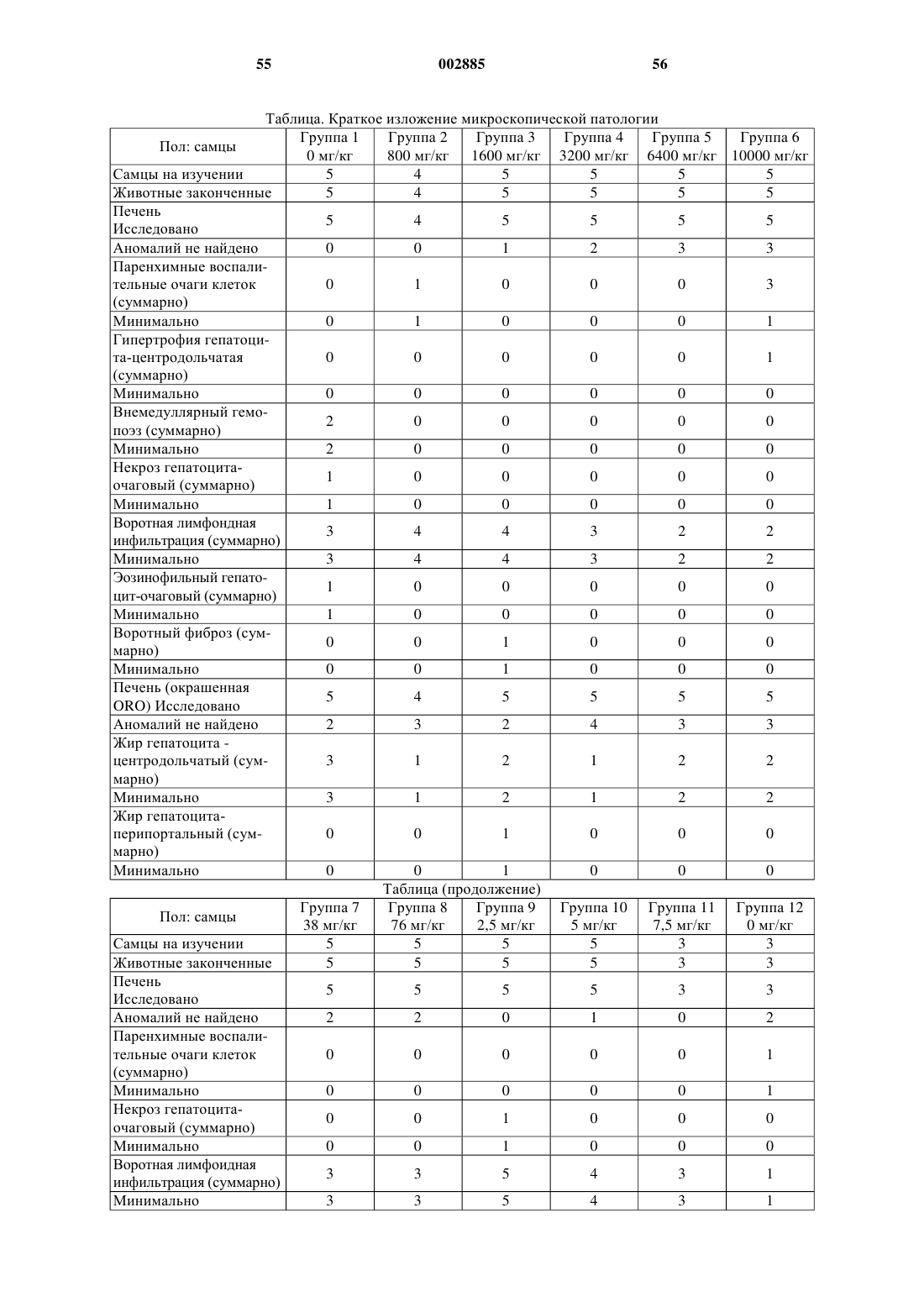
R1 представляет собой атом водорода, алкил, тиглоил, бензоил или любую другую органическую сложноэфирнуто группу.
38. Соединение, имеющее общую структурную формулу, в которой R является алкилом и
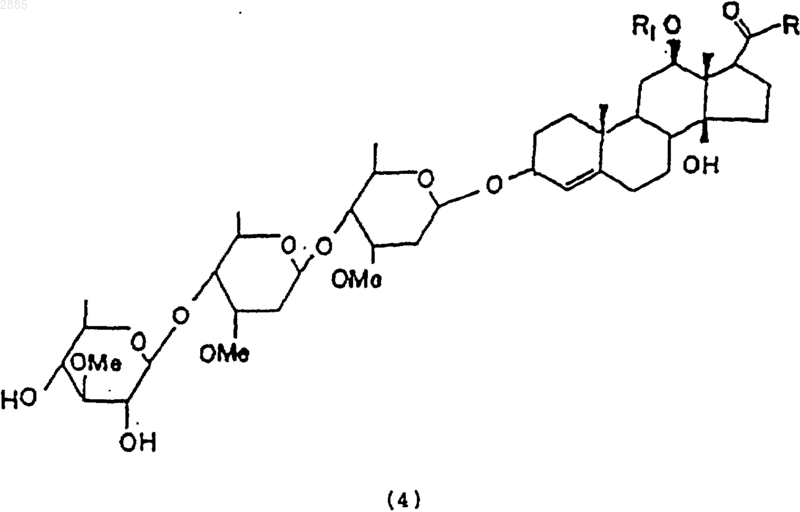
R1 представляет собой атом водорода, алкил, тиглоил, бензоил или любую другую органическую сложноэфирную группу.
39. Соединение, имеющее общую структурную формулу
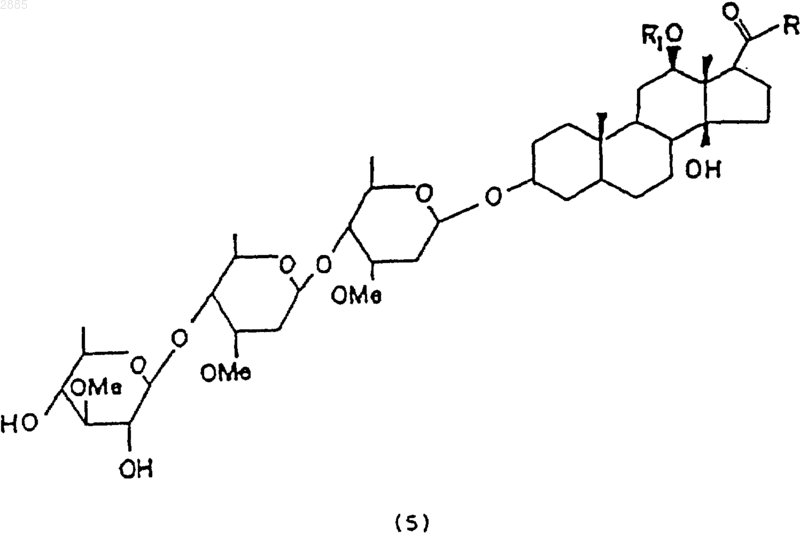
в которой R является алкилом и R1 представляет собой атом водорода, алкил, тиглоил, бензоил или любую другую органическую сложноэфирную группу.
40. Соединение, имеющее общую структурную формулу
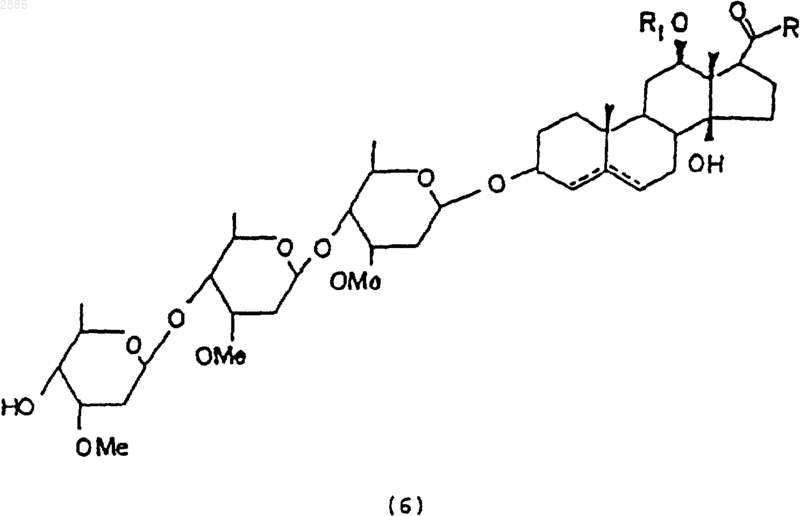
в которой R является алкилом и R1 представляет собой атом водорода, алкил, тиглоил, бензоил или любую другую органическую сложноэфирную группу.
41. Соединение, имеющее общую структурную формулу
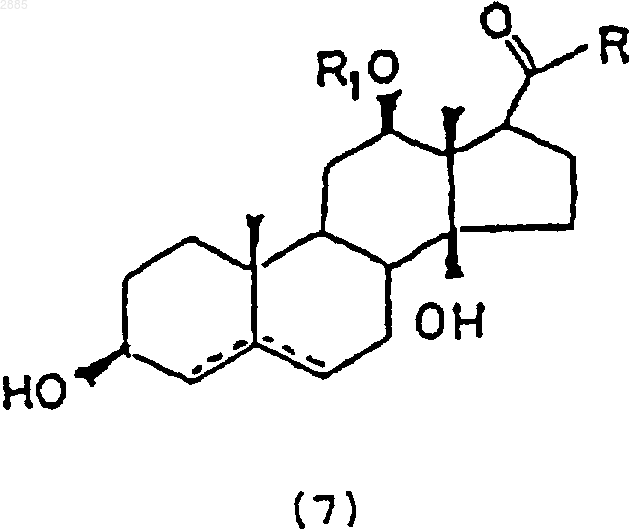
в которой R является алкилом; R1 представляет собой атом водорода, алкил, тиглоил, бензоил или любую другую органическую сложноэфирную группу
42. Соединение, имеющее общую структурную формулу
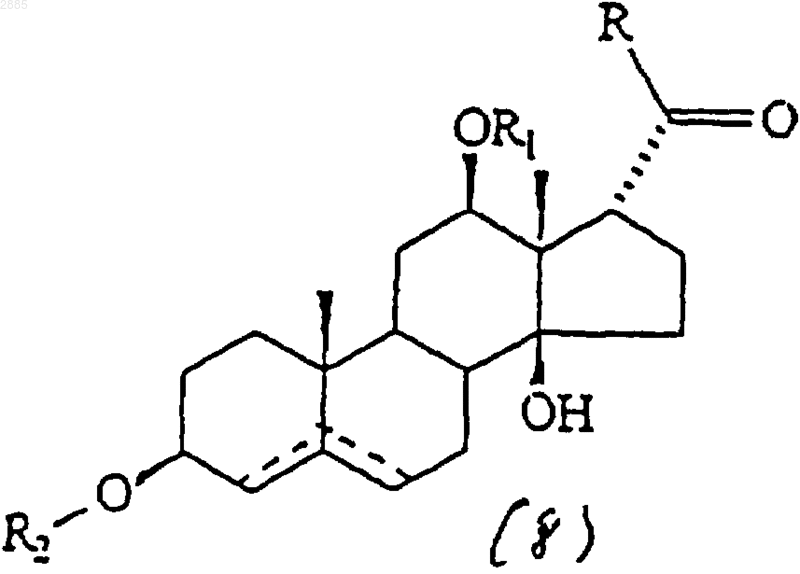
в которой R является алкилом и R1 представляет собой атом водорода, алкил, тиглоил, бензоил или любую другую органическую сложноэфирную группу; R2 представляет собой атом водорода, один или несколько 6-деоксиуглеводов, или один или несколько 2,6-дидеоксиуглеводов, или молекулы глюкозы или их сочетания;
и в которой пунктиром обозначено необязательное наличие дополнительной связи между С4-С5 или С5-С6.
43. Соединение, имеющее общую структурную формулу
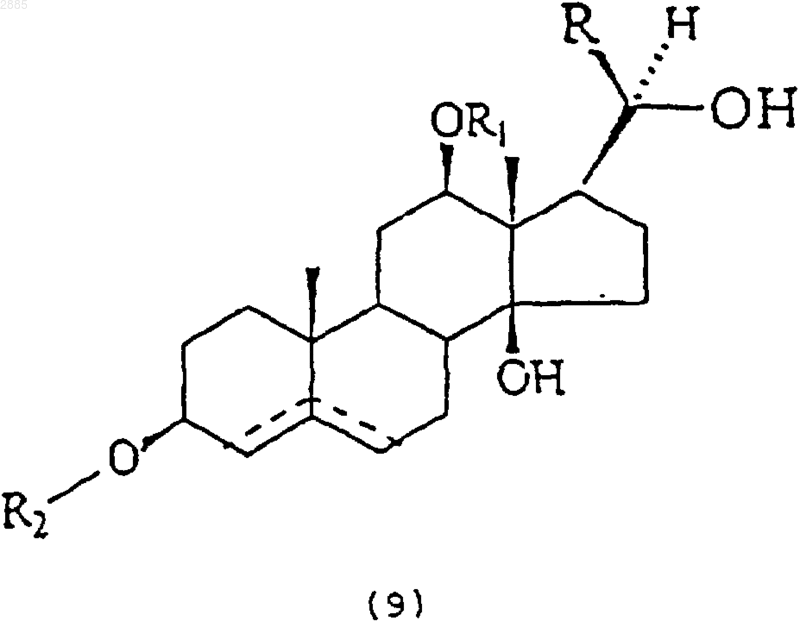
в которой R является алкилом и R1 представляет собой атом водорода, алкил, тиглоил, бензоил или любую другую органическую сложноэфирную группу;
R2 представляет собой атом водорода, один или несколько 6-деоксиуглеводов, или один или несколько 2,6-дидеоксиуглеводов, или молекулы глюкозы или их сочетания;
и в которой пунктиром обозначено на необязательное наличие дополнительной связи между С4-С5 или С5-С6.
44. Соединение, имеющее общую структурную формулу

в которой R является алкилом и
R1 представляет собой атом водорода, алкил, тиглоил, бензоил или любую другую органическую сложноэфирную группу;
R2 представляет собой атом водорода, один или несколько 6-деоксиуглеводов, или один или несколько 2,6-дидеоксиуглеводов, или молекулы глюкозы или их сочетания;
и в которой пунктиром обозначено на необязательноеналичие дополнительной связи между С4-С5 или С5-С6.
45. Соединение, имеющее общую структурную формулу
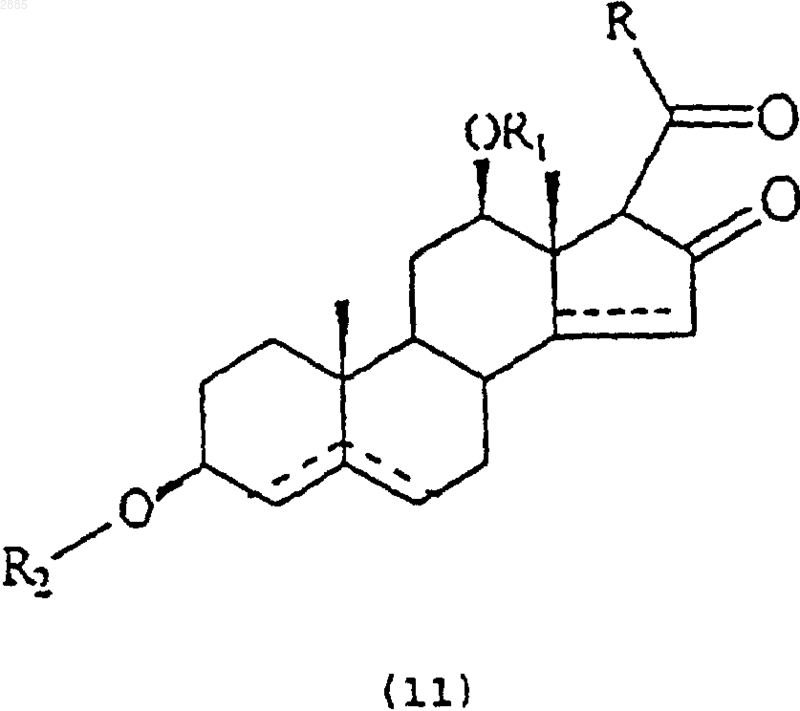
в которой R является алкилом и
R1 представляет собой атом водорода, алкил, тиглоил, бензоил или любую другую органическую сложноэфирную группу;
R2 представляет собой атом водорода, один или несколько 6-деоксиуглеводов, или один или несколько 2,6-дидеоксиуглеводов, или молекулы глюкозы или их сочетания;
и в которой пунктиром указано на необязательное наличие дополнительной связи между С4-С5, С5-С6 или С14-С15.
46. Соединение, имеющее общую структурную формулу
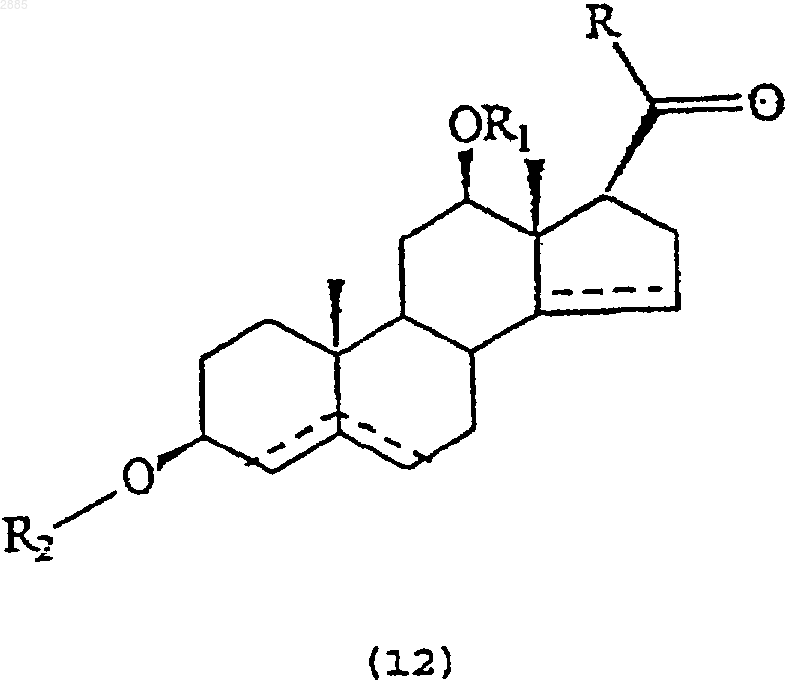
в которой R является алкилом и
R1 представляет собой атом водорода, алкил, тиглоил, бензоил или любую другую органическую сложноэфирную группу;
R2 представляет собой атом водорода, один или несколько 6-деоксиуглеводов, или один или несколько 2,6-дидеоксиуглеводов, или молекулы глюкозы или их сочетания;
и в которой пунктиром указано на необязательное наличие дополнительной связи между С4-С5, С5-С6 или С14-С15.
47. Соединение, имеющее общую структурную формулу
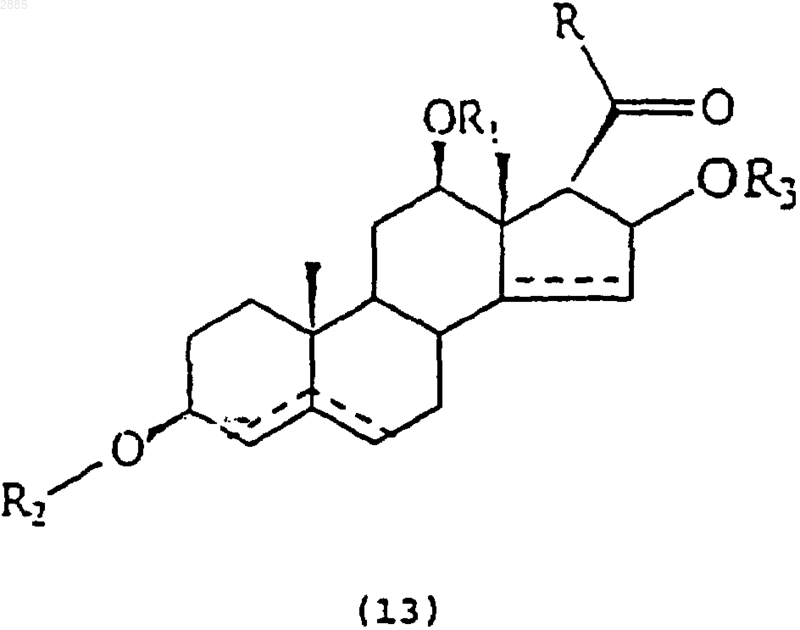
в которой R является алкилом и
R1 представляет собой атом водорода, алкил, тиглоил, бензоил или любую другую органическую сложноэфирную группу;
R2 представляет собой атом водорода, один или несколько 6-деоксиуглеводов, или один или несколько 2,6-дидеоксиуглеводов, или молекулы глюкозы или их сочетания;
и в которой пунктиром указано на необязательное наличие дополнительной связи между С4-С5, С5-С6 или С14-С15; и
R3 представляет собой атом водорода, алкил, арил, ацил или гликокси.
48. Соединение, имеющее общую структурную формулу
в которой R представляет собой атом водорода, алкил, арил или любой стероид, обладающий СН-бета-гидроксигруппой, С12-бета-гидрокси функциональной группой, С17-ацильной группой, С5-С6 олефин или их сочетания.
49. Способ получения стероидного промежуточного соединения формулы

который включает следующие стадии:
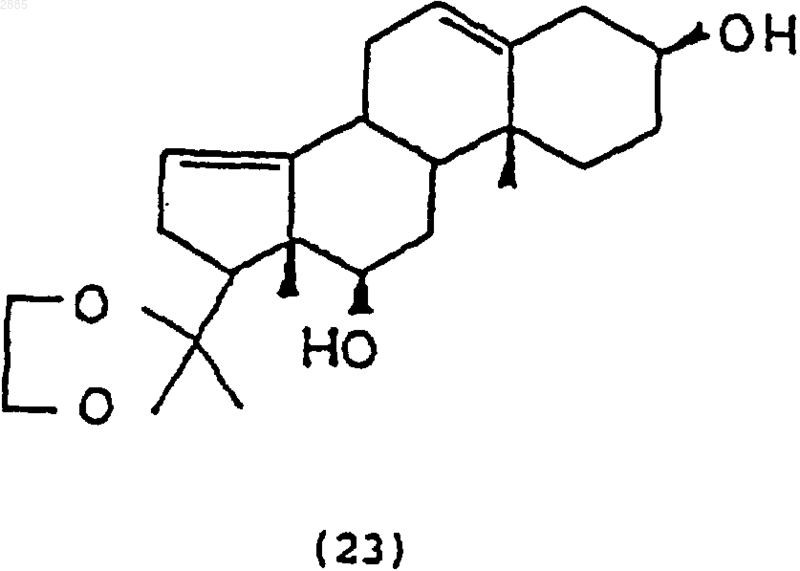
а) обработка соединения
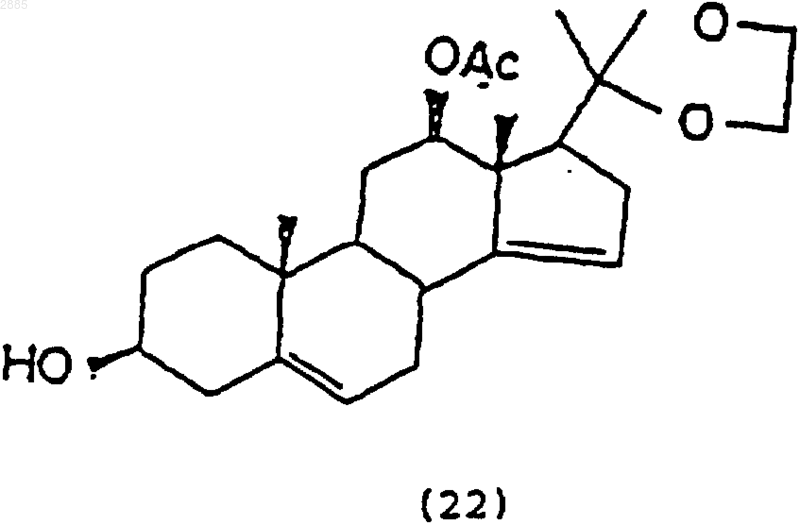
восстанавливающим агентом, чтобы получить соединение 3b,12b-дигидрокси-20,20-этилендиоксипрегна-5,14-диен формулы
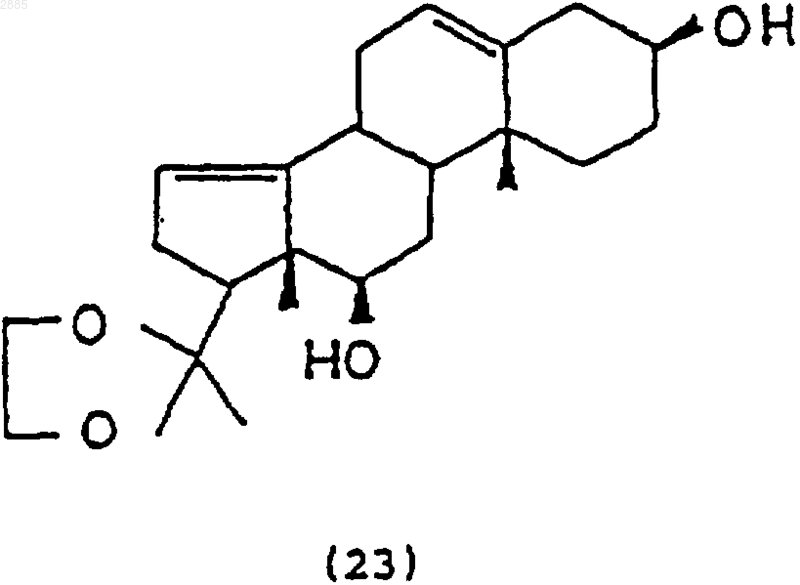
b) обработка соединения (23) N-бромацетамидом (NBA) и основанием, чтобы получить соединение 3b,12b-дигидрокси-14,15-эпокси-20,20-этилендиоксипрегн-5-ен формулы

с) обработка соединения (24) восстанавливающим агентом, чтобы получить соединение 3b,12b,14b-тригидрокси-20,20-этилендиоксипрегн-5-ен формулы

и d) обработка соединения (25) кислотой и водой, чтобы получить соединение (15).
50. Способ получения соединения (15), который включает следующие стадии:
а) обработка соединения (22) хлористым паратолуолсульфонилом и основанием,
чтобы получить соединение 3b,12b-дигидрокси-20,20-этилендиоксипрегна-5,14-диен-3-тозил-12-ацетат формулы
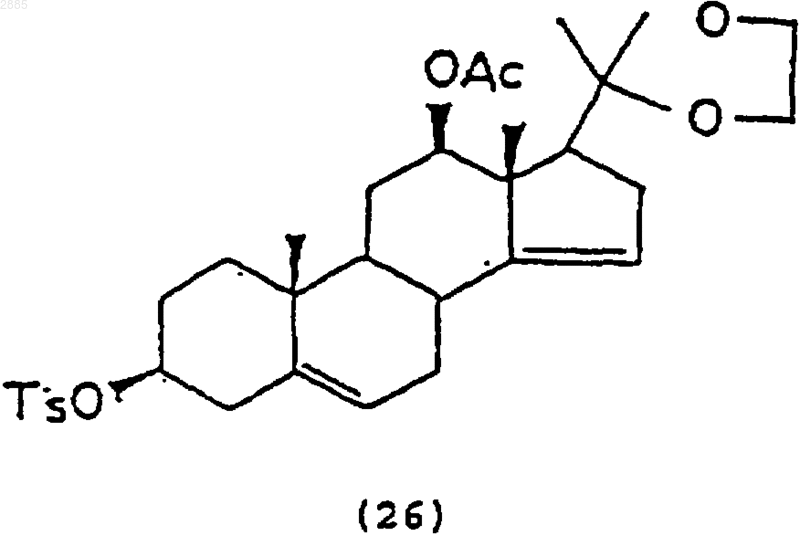
b) обработка соединения (26) ацетатом калия в растворителе, чтобы получить соединение 6b,12b-дигидрокси-20,20-этилендиокси-3,5a-циклопрегнан-14-ен-12-ацетат формулы
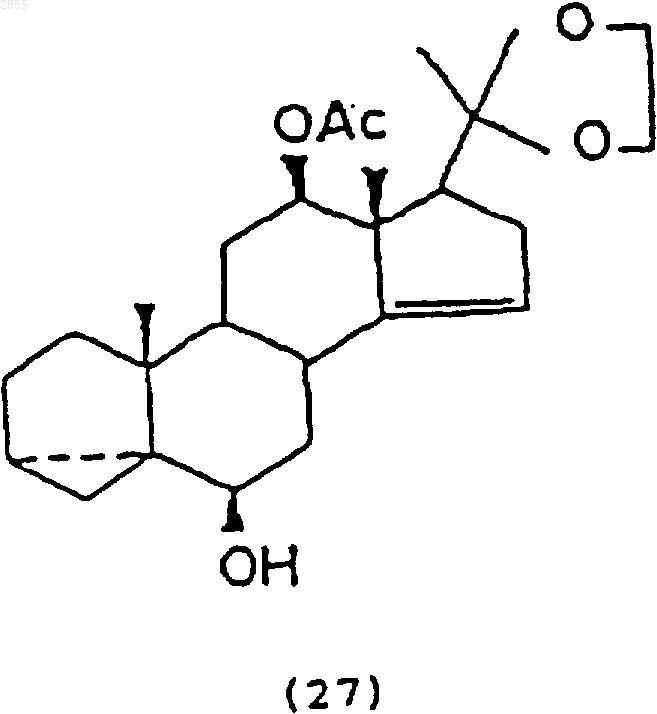
с) обработка соединения (27) восстанавливающим агентом, чтобы получить соединение 6b,12b-дигидрокси-20,20-этилендиокси-3,5a-циклопрегнан-14-ен формулы
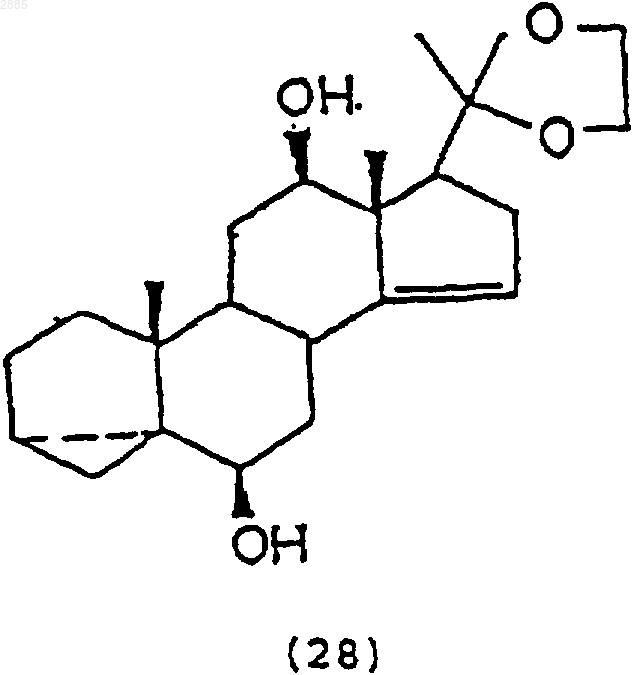
d) обработка соединения (28) N-бромацетамидом и основанием, чтобы получить соединение 6b,12b,-20,20-этилендиокси-14,15-эпокси-3,5a-циклопрегнан формулы
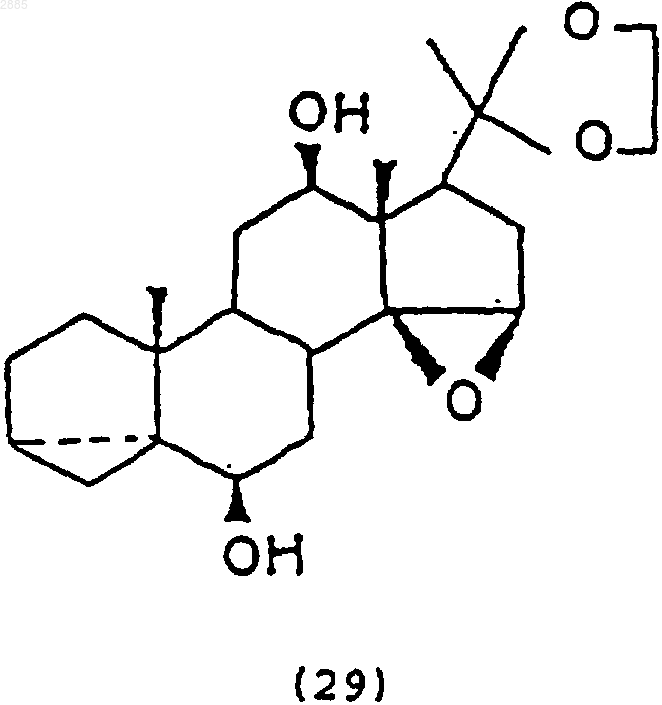
е) обработка соединения (29) восстанавливающим агентом, чтобы получить соединение 6b,12b,14b-тригидрокси-20,20-этилендиокси-3,5a-циклопрегнан формулы
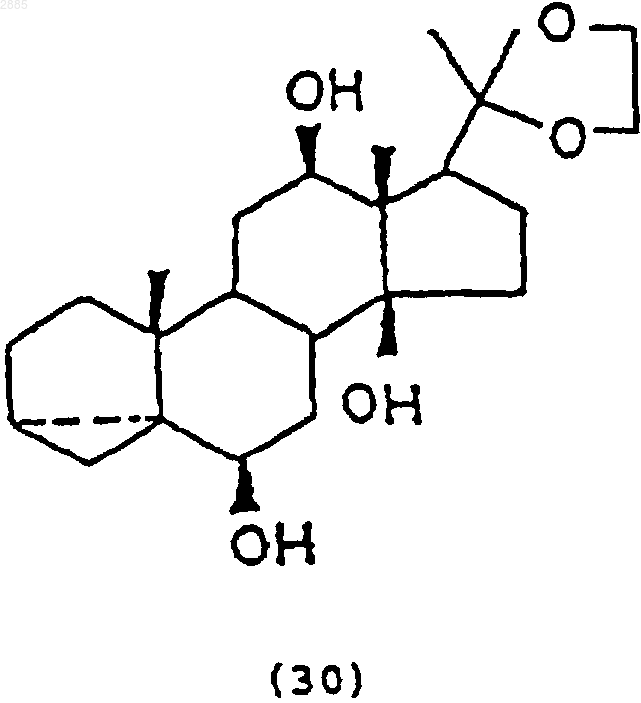
и f) обработка соединения (30) кислотой и растворителем, чтобы получить соединение(15).
51. Способполучения углеводного промежуточного соединения в виде активированной моносахаридной цимарозной группы, который включает следующие стадии:
1) обработка соединения формулы
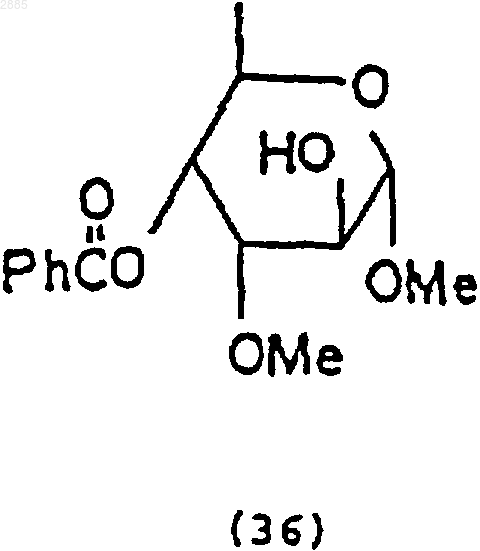
фенилтиотриметилсиланом (PhSSiMe3), йодистым цинком (ZnI2) и йодистым тетрабутиламмонием (Bu4N+I), чтобы получить соединение 4-O-бензоил-3-O-метил-6-деокси-ab-D-фенилтиоальтрозид формулы
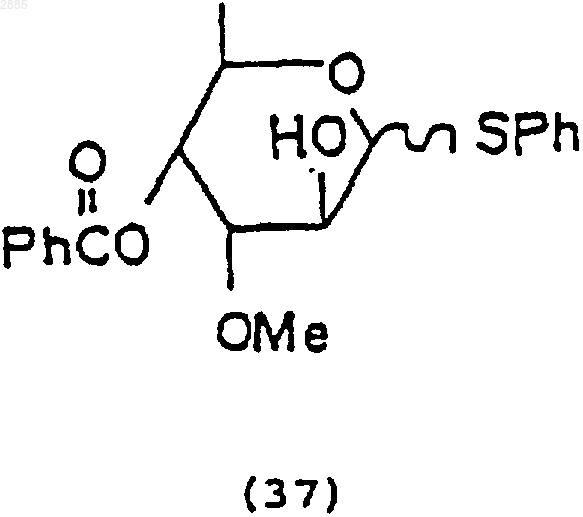
2) необязательная обработка соединения (37) трифторидомдиэтиламиносеры (DAST), чтобы получить соединение 4-O-бензоил-3-O-метил-2-фенилтио-2,6-дидеокси-ab-D-фторцимаропиранозид, имеющее формулу
 или
или
3) необязательная обработка соединения (37) трет-бутилдиметилсилилхлоридом и имидазолом в растворителе, чтобы получить 4-O-бензоил-3-O-метил-2-O-трет-бутилдиметилсилил-ab-D-фенилтиоальтрозид, имеющий формулу
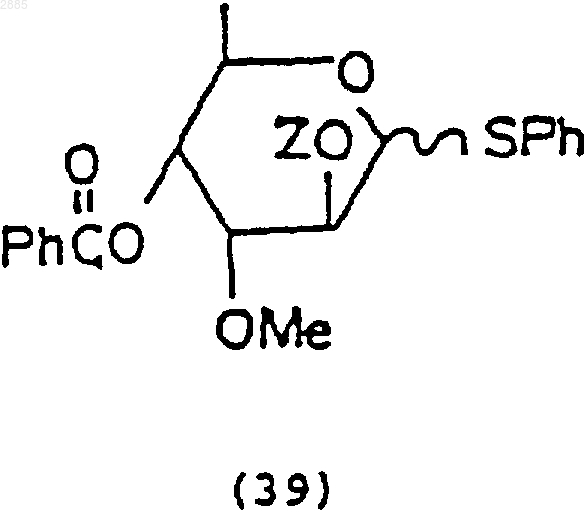
в которой Z = трет-бутилдиметилсилил=ТВDМS; и
4) обработка соединения (39) основанием, чтобы получить моносахарид, 3-O-метил-2-O-трет-бутилдиметилсилил-(ab-D-фенилтиоальтрозид), имеющий формулу
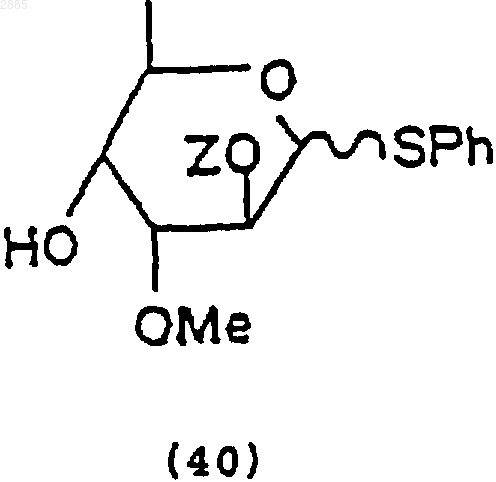
в которой Z = трет-бутилдиметилсилил = TBDMS.
52. Способ получения углеводного промежуточного соединения в виде активированной теветозной группы, который включает следующие стадии:
1) обработка соединения

фенилтиотриметилсиланом и триметилсилилтрифторметансульфонатом, чтобы получить соединение 4-O-бензоил-3-O-метил-1-фенилтио-6-деокси-ab-глюкопиранозид, имеющий формулу
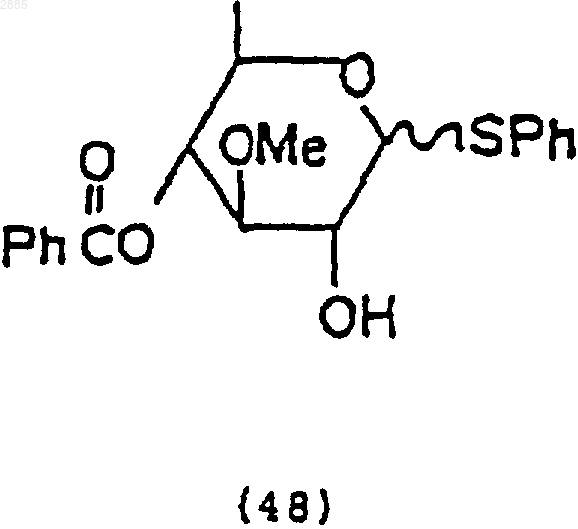
2) обработка соединения (48) хлористым пивалоилом и растворителем, чтобы получить соединение 4-O-бензоил-3-O-метил-2-O-пивалоил-1-фенилтио-6-деокси-ab-глюкопиранозид, имеющий формулу
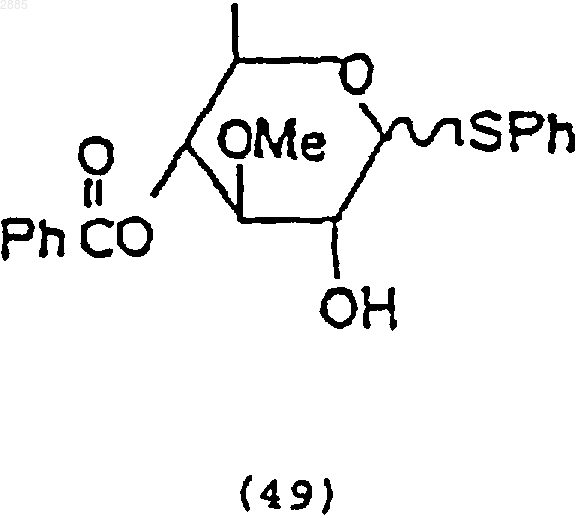 и
и
3) обработка соединения (49) бромирующим агентом и трифторидом диэтиламиносеры, чтобы получить моносахаридное соединение 4-O-бензоил-3-О-метил-2-O-пивалоил-1-фтор-6-деокси-b-глюкопиранозид, находящийся в виде стереоизомеров, имеющих формулы
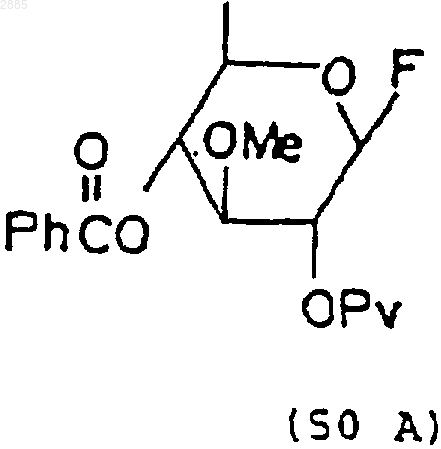
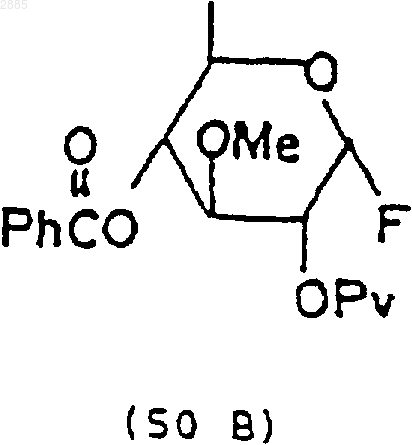
53. Стероидное промежуточное вещество формулы (15), которое получают по способу п.49 или 50.
54. Углеводное промежуточное соединение формулы (40), которое получают по способу п.51.
55. Углеводное промежуточное соединение формулы (50А) или (50В), которое получают по способу п.52.
56. Способ сочетания моносахаридной цимарозы со стероидным промежуточным соединением, который включает стадии
взаимодействия цимарозной группы (38) со стероидным промежуточным соединением (15) по п.53 в присутствии хлористого олова в растворителе, чтобы получить соединение 3-O-[4-O-бензоил-2-фенилтио-b-D-цимаропиранозил]-12,14-b-дигидроксипрегнан-5-ен-20-он формулы
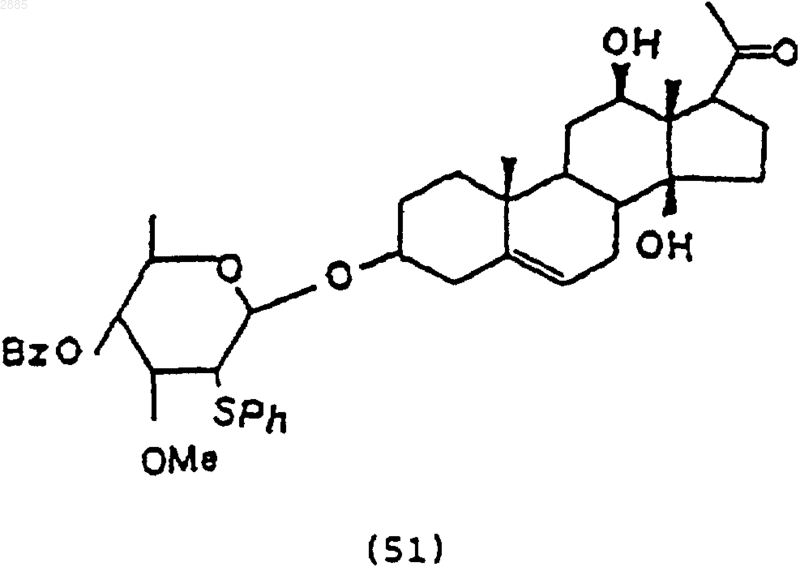
и обработки соединения (51) хлоридом тиглиновой кислоты в пиридине и после этого основанием, чтобы получить соединение 3-O-[4-бензоил-2-фенилтио-b-D-цимаропиранозил]-12b-тиглоил-14b-гидроксипрегнан-5-ен-20-он формулы
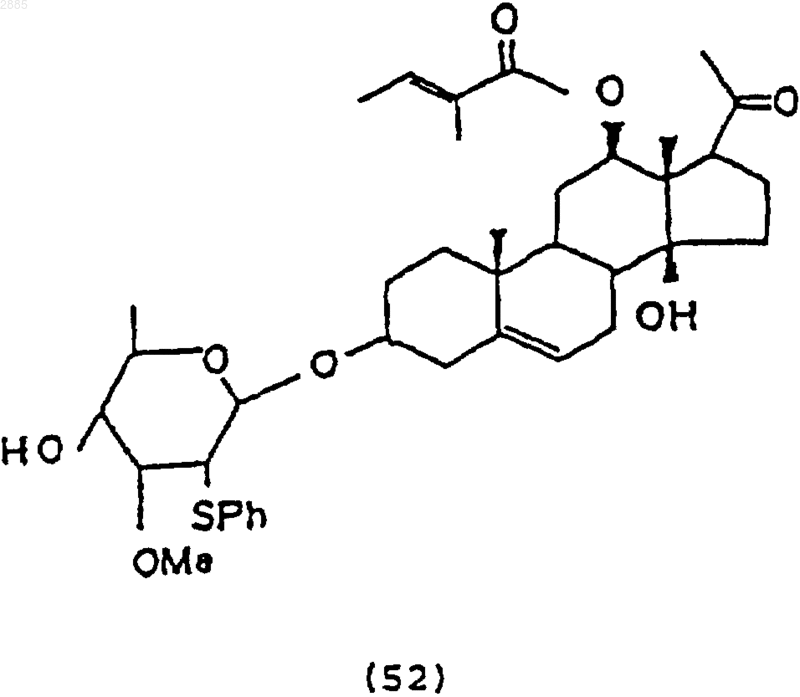
57. Соединение формулы (52), которое получают способом по п.56.
58. Способ сочетания моносахаридной цимарозной группы с моносахаридной теветозной группой и сочетания образовавшегося дисахарида с соединением формулы (52) по п.57, который включает следующие стадии:
1) сочетание селективно защищенной цимарозной группы (40) по п.54 и моносахаридной теветозной группы (50А) по п.55, используя хлористое олово (SnCl2) и трифторметансульфонат серебра, чтобы получить соединение формулы

в которой Z = трет-бутилдиметилсилил= TBDMS;
2) обработка соединения (53) фтористым тетрабутиламмонием, чтобы получить соединение формулы
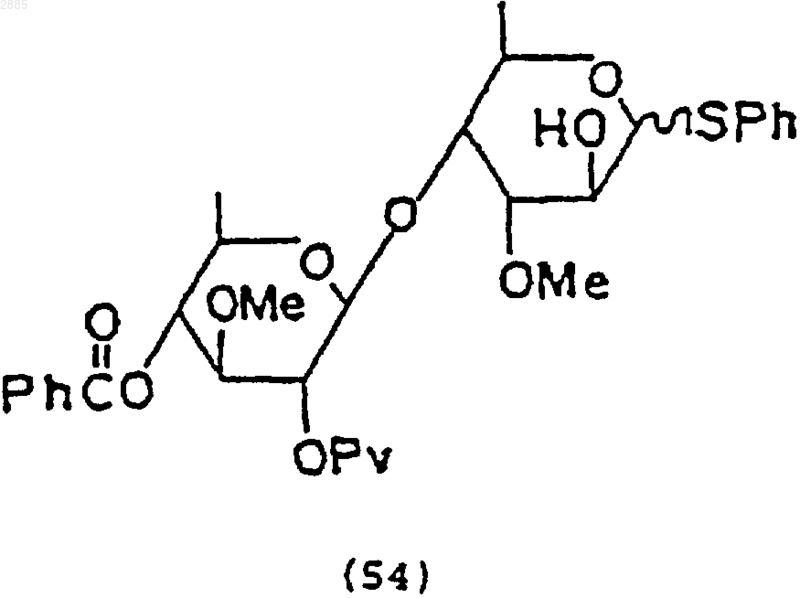
3) обработка соединения (54) трифторидом диэтиламиносеры, чтобы получить соединение формулы
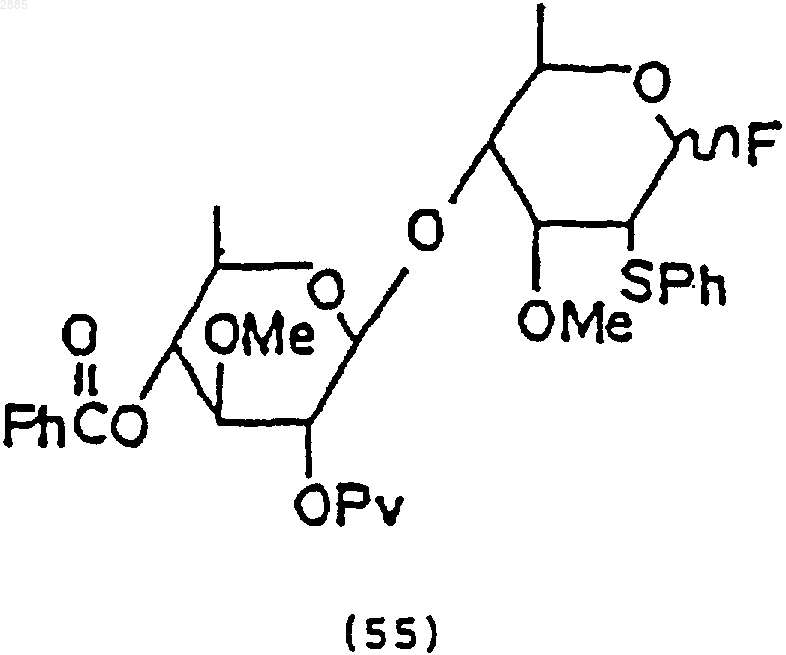
(4) взаимодействие соединения (55) с соединением (52) по п.57, чтобы получить соединение формулы
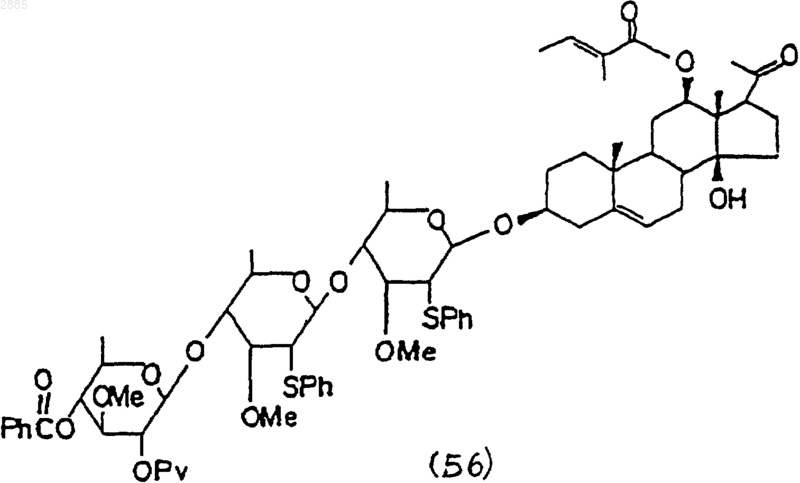 и
и
5) обработка соединения (56) в реакции с никелем Ренея и после этого с основанием, чтобы получить соединение (1) по п.36.
59. Способ получения трисахарида и сочетания полученного трисахарида со стероидным производным, который включает следующие стадии:
1) сочетание селективно защищенной цимарозной группы (40) по п.55 и соединения (45), используя хлористое олово (SnCl2), трифторметансульфонат серебра (AgOTf) и дихлориддициклопентадиенил циркония (Cp2ZrCl2), чтобы получить соединение формулы

в которой Z = трет-бутилдиметилсилил= TBDMS;
2) обработка соединения фтористым тетрабутиламмонием и трифторидом диэтиламиносеры, чтобы получить соединение трисахарида, имеющего формулу
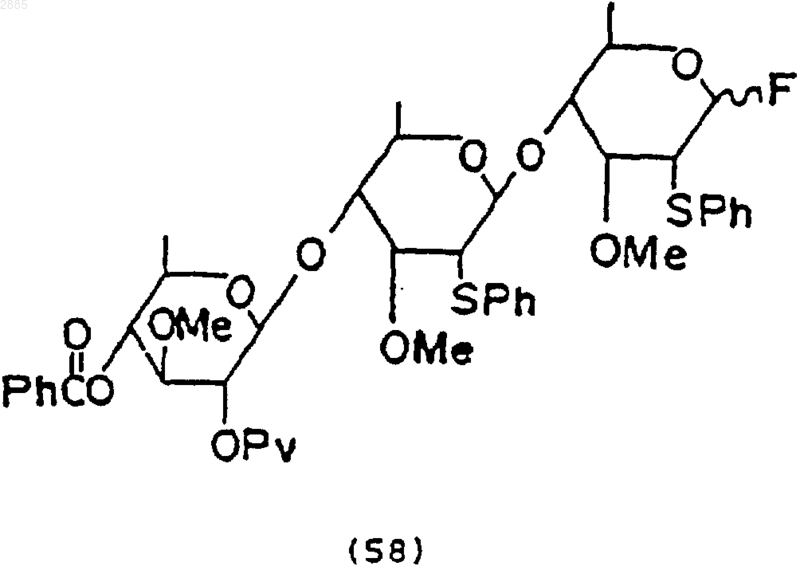 и
и
3) сочетание трисахарида формулы (58) со стероидным промежуточным соединением формулы
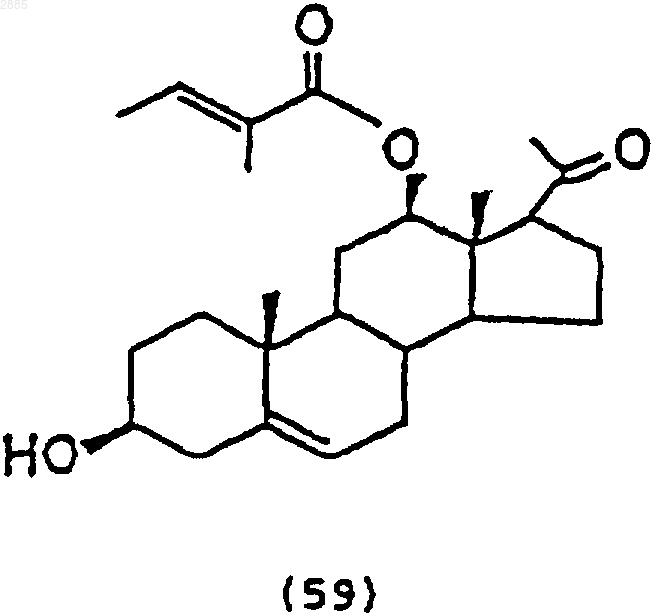
с использованием хлористого олова, трифторметансульфоната серебра (AgOTf) и дихлорида дициклопентадиенилциркония (Cp2ZrCl2), чтобы получить соединение (1) по п.36.
60. Композиция, обладающая активностью подавления аппетита, которая содержит соединение по одному из пп.35-48.
61. Композиция по п.60, в которой соединение является соединением формулы (1) по п.36.
62. Композиция по п.60 или 61, содержащая фармацевтическую среду, разбавитель или носитель.
63. Композиция по пп.60, 61 или 62 в форме единичной дозировки.
64. Применение соединения по любому одному из пп.35-48 в производстве медикамента, обладающего активностью подавления аппетита.
65. Применение по п.64, отличающееся тем, что используют соединение формулы (1) по п.36.
66. Соединение по любому одному из пп.35-48, применяемое в качестве медикамента, обладающего активностью подавления аппетита.
67. Соединение по п.66, которое представляет собой соединение формулы (1) по п.36.
68. Способ подавления аппетита посредством введения человеку или животному эффективной дозы композиции по любому одному из пп.60-63.
69. Продукт или напиток, содержащий эффективное количество соединения по любому одному из пп.35-48, обладающего активностью подавления аппетита при проглатывании.
70. Продукт или напиток по п.69, в котором соединение является соединением формулы (1) по п.36.
71. Применение соединения формулы (1) по п.36, выделенного из растения из рода Trichocaulon или из рода Hoodia в производстве медикамента, обладающего активностью подавления аппетита.
72. Применение по п.71, в котором соединение выделяют из видов Trichocaulon piliferum и Trichocaulon officinale или из видов Hoodia currorii, Hoodia gordonii и Hoodia lugardii.
73. Композиция, обладающая активностью подавления аппетита, которая содержит соединение формулы (1), выделенное из растения из рода Trichocaulon или из рода Hoodia.
74. Композиция по п.73, в которой соединение выделяют и/или очищают из растения видов Trichocaulon piliferum и Trichocaulon officinale или из видов Hoodia currorii, Hoodia gordonii и Hoodia lugardii.
75. Композиция по п.73, в которой соединение выделяют и/или очищают из экстракта, полученного из растения видов Trichocaulon piliferum и Trichocaulon officinale или из растения видов Hoodia currorii, Hoodia gordonii и Hoodia lugardii.
76. Композиция по пп.73, 74 или 75, которая содержит фармацевтическую среду, разбавитель или носитель.
77. Композиция по п.76 в форме единичной дозировки.
78. Соединение формулы (1) по п.35, выделенное шч растения рода Trichocaulon или рода Hoodia для применения в качестве медикамента, обладающего активностью подавления аппетита.
79. Соединение по п.78, в котором соединение выделяют из растения вида Trichocaulon piliferum или Trichocaulon officinale и из Hoodia currorii, Hoodia gordonii или Hoodia lugardii.
80. Способ подавления аппетита посредством введения человеку или животному эффективной дозы композиции по одному из пп.73-77.
81. Соединение, имеющее структурную формулу
82. Соединение, имеющее структурную формулу
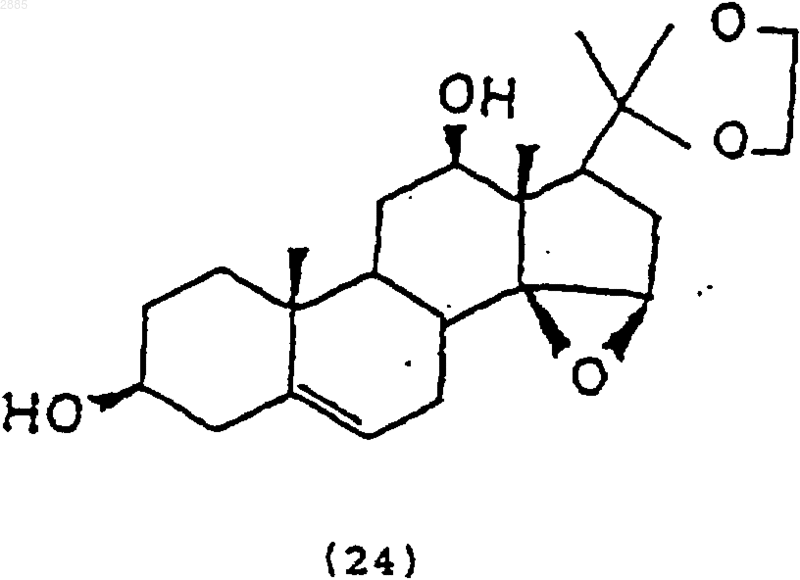
83. Соединение, имеющее структурную формулу
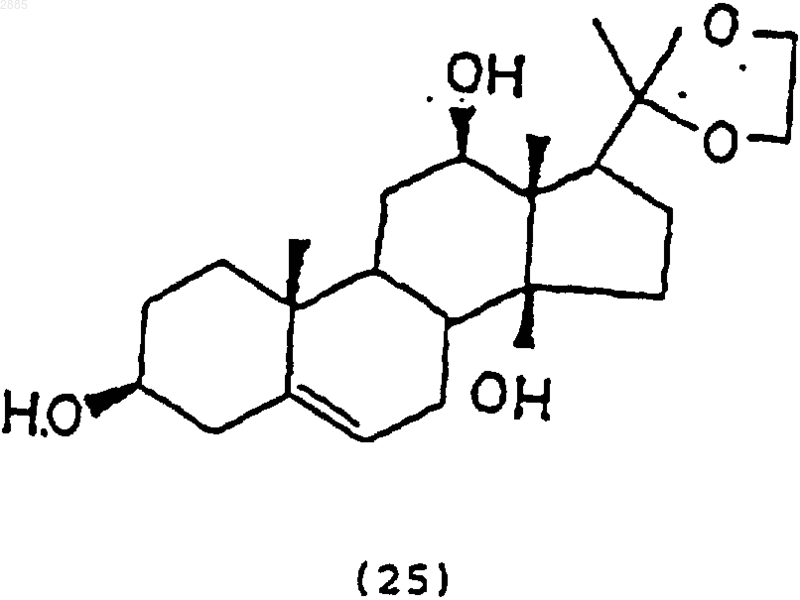
84. Соединение, имеющее структурную формулу
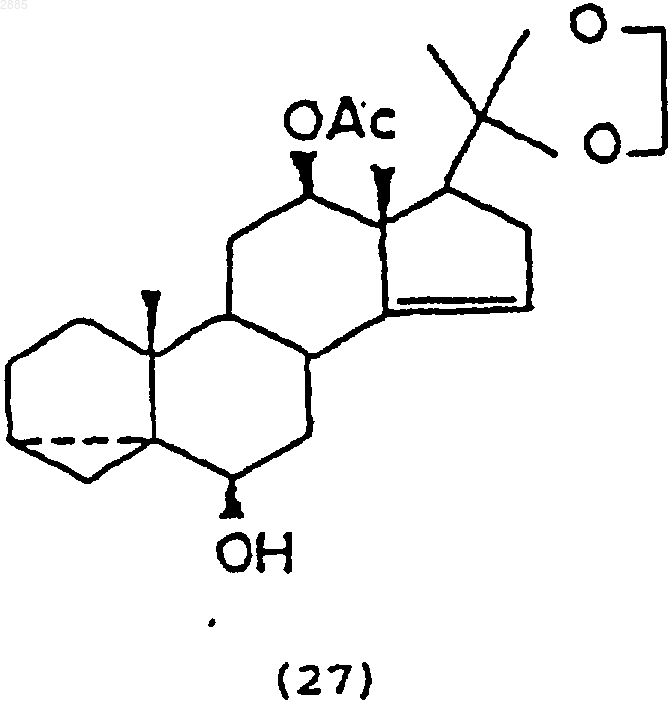
85. Соединение, имеющее структурную формулу
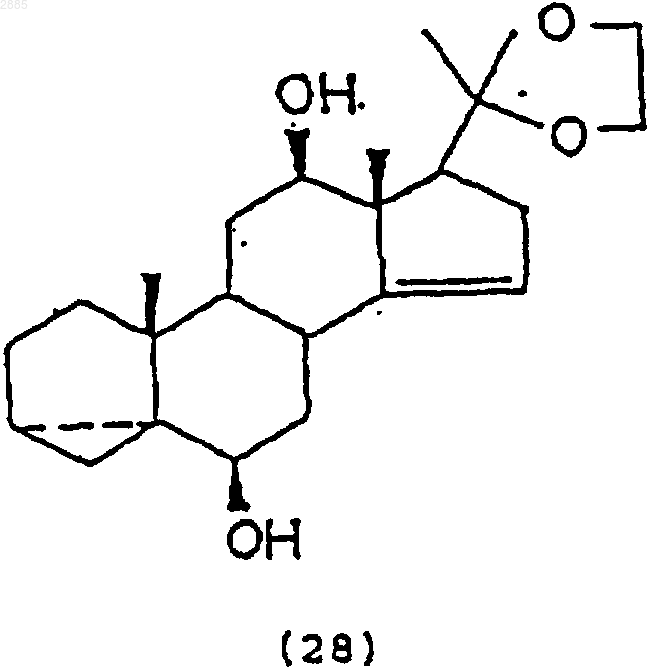
86. Соединение, имеющее структурную формулу
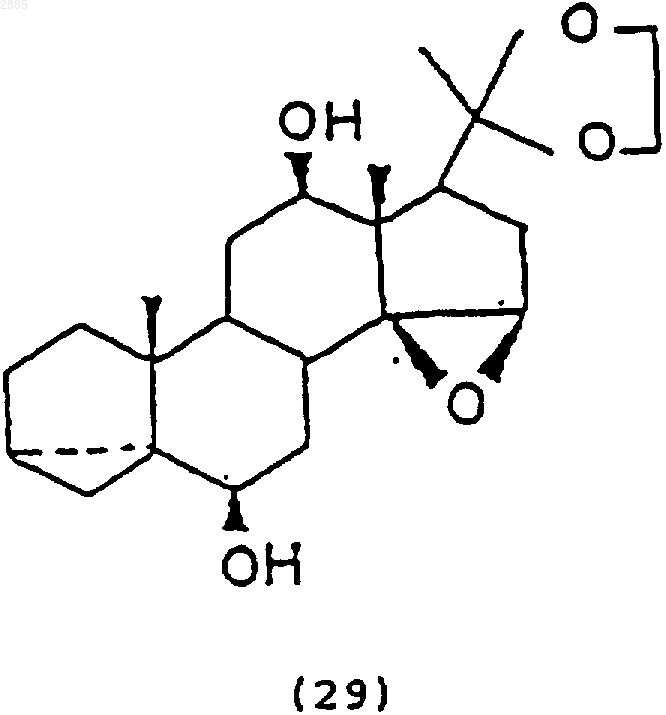
87. Соединение, имеющее структурную формулу

88. Соединение, имеющее структурную формулу
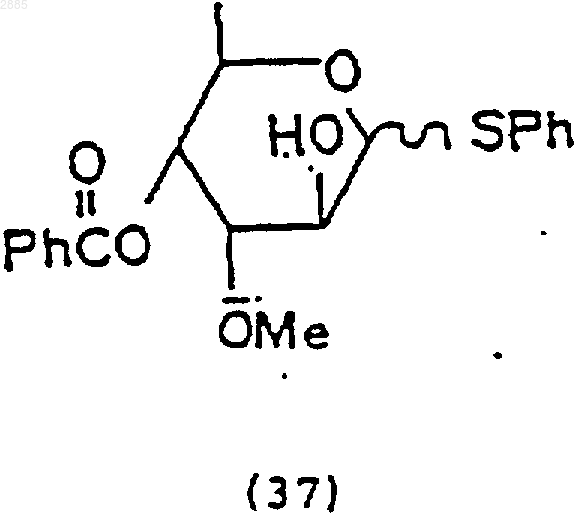
89. Соединение, имеющее структурную формулу
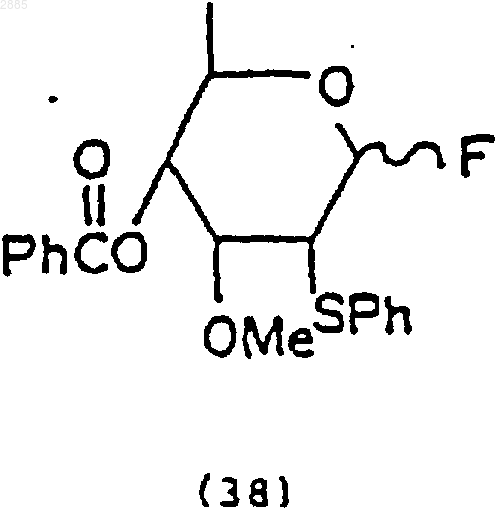
90. Соединение, имеющее структурную формулу
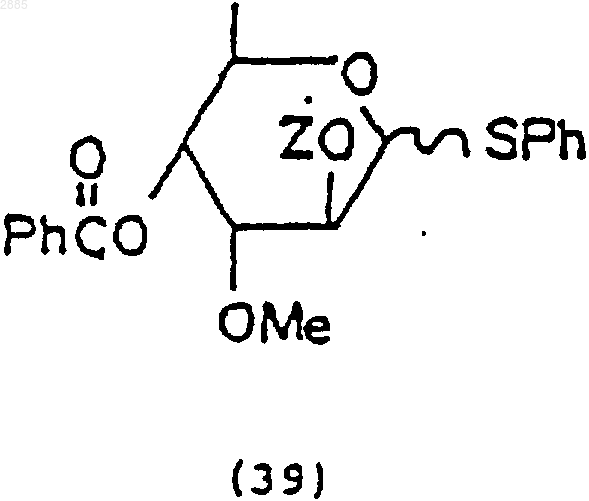
в которой Z = трет-бутилдиметилсилил.
91. Соединение, имеющее структурную формулу
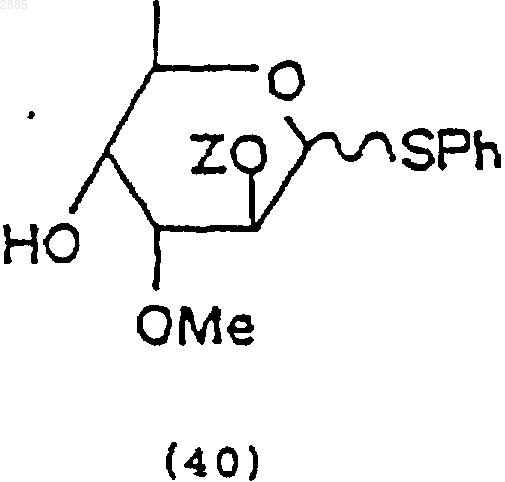
в которой Z = трет-бутилдиметилсилил.
92. Соединение, имеющее структурную формулу
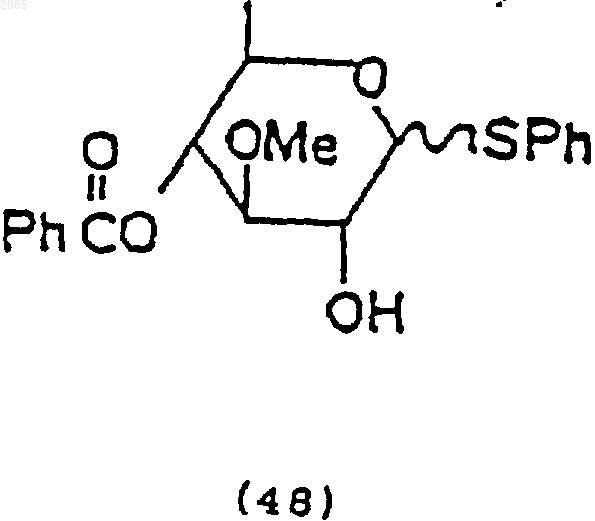
93. Соединение, имеющее структурную формулу
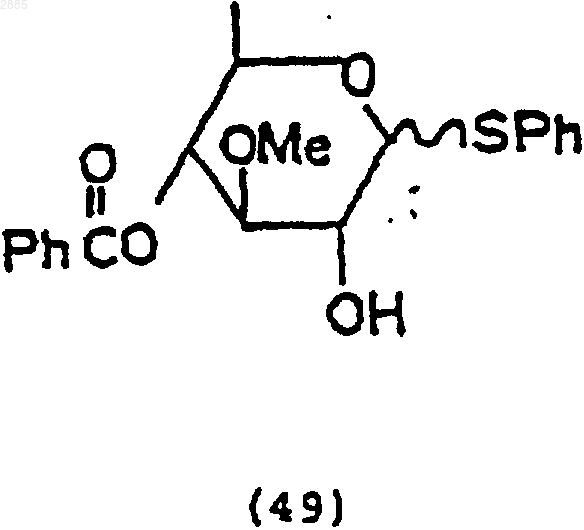
94. Соединение, находящееся в виде стереоизомеров, имеющих структурны формулы
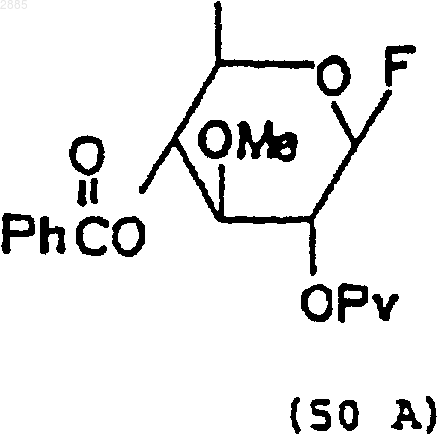
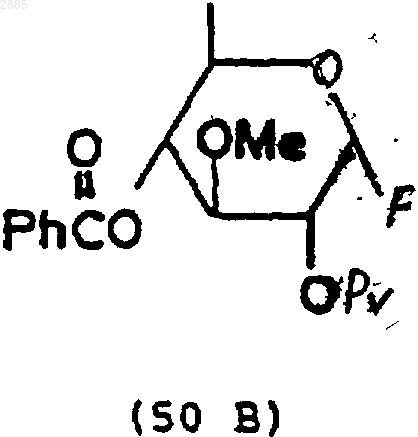
95. Соединение, имеющее структурную формулу

96. Соединение, имеющее структурную формулу
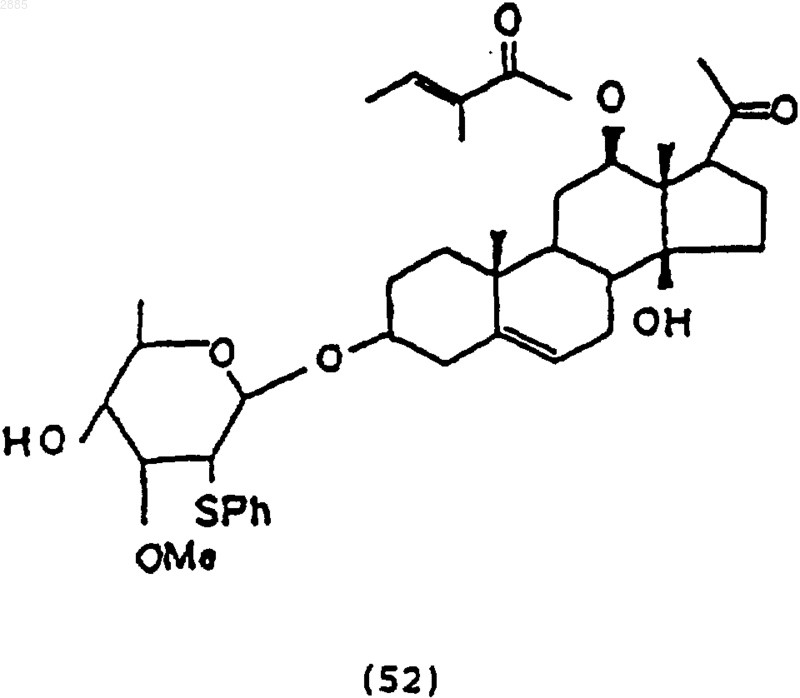
97. Соединение, имеющее структурную формулу
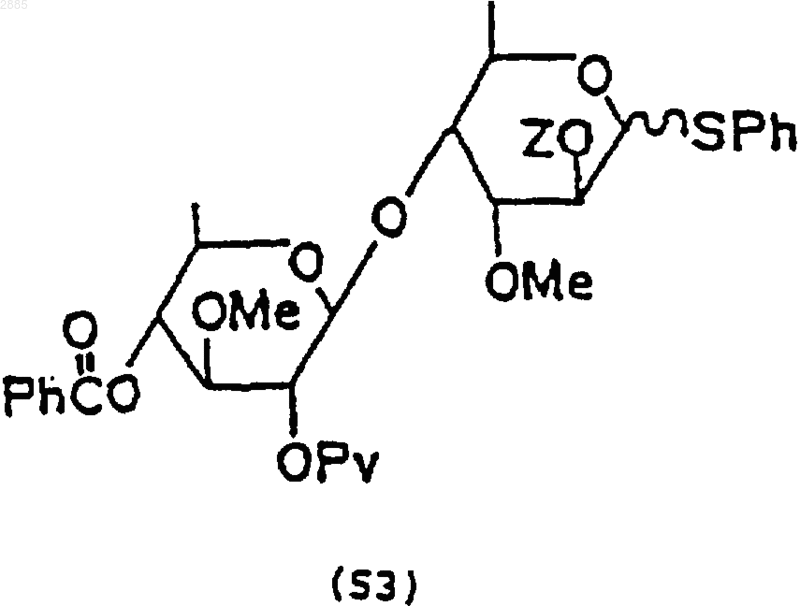
в которой Z = трет-бутилдиметилсилил.
98. Соединение, имеющее структурную формулу
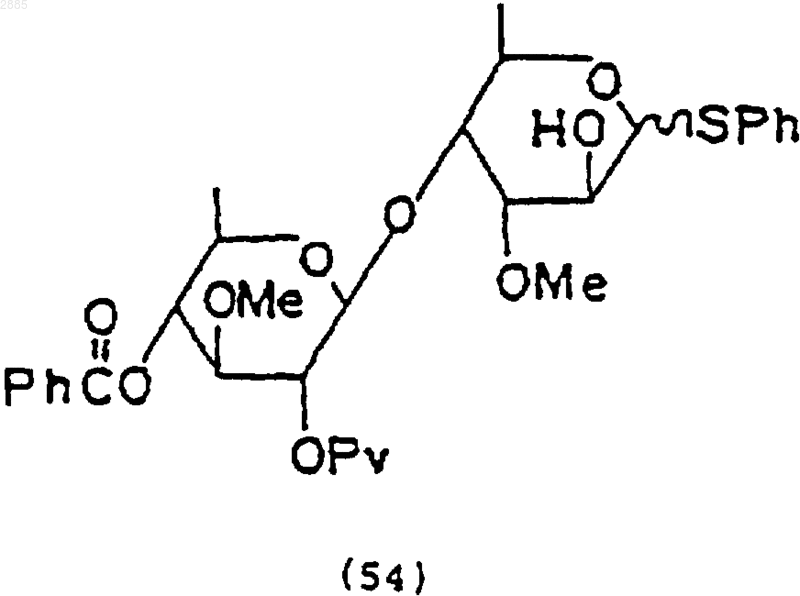
99. Соединение, имеющее структурную формулу
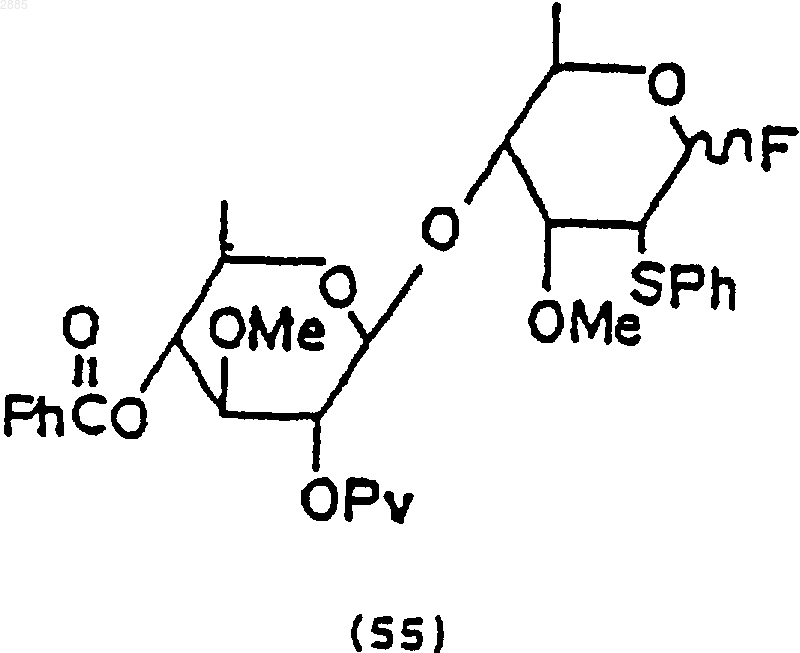
100. Соединение, имеющее структурную формулу
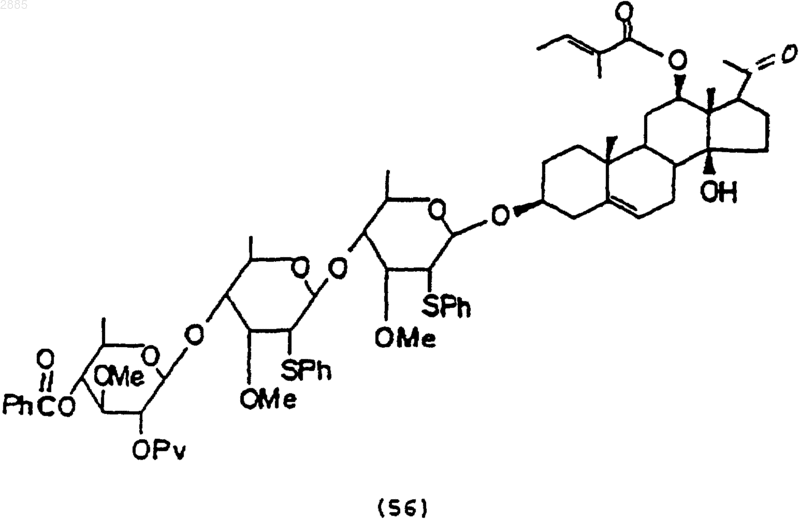
101. Соединение, имеющее структурную формулу
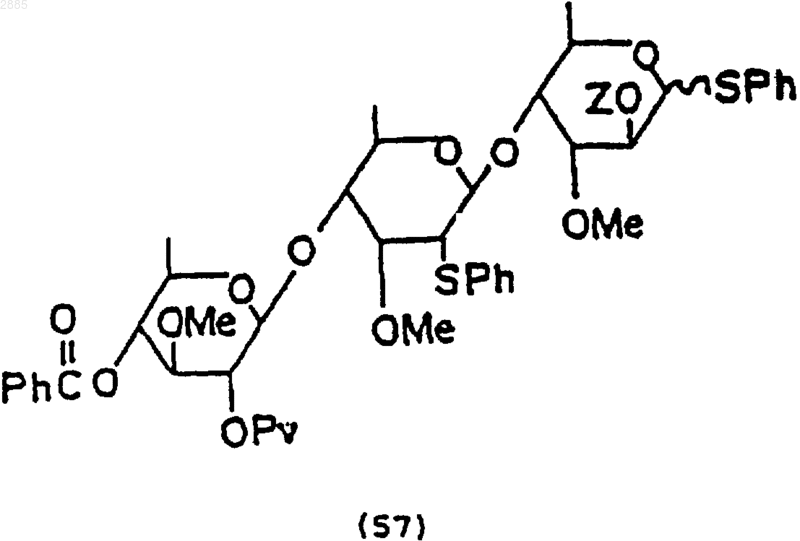
где Z - трет-бутилдиметилсилил.
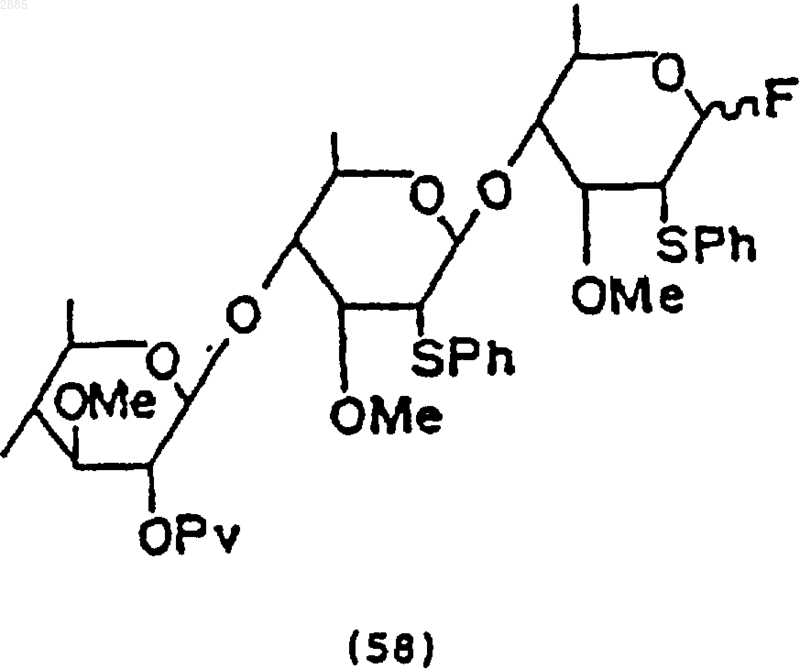
102. Соединение, имеющее структурную формулу
103. Способ преодоления ожирения у людей или животных, заключающийся в назначении этому человеку или животному эффективного для преодоления ожирения количества экстракта по любому одному из пп.9, 18, 25, 26, 27 или 28.
104. Способ преодоления ожирения у людей или животных, заключающийся в назначении этому человеку или животному эффективного для преодоления ожирения количества композиции экстракта по п.10 или 19.
105. Способ преодоления ожирения у людей или животных, заключающийся в назначении этому человеку или животному эффективного для преодоления ожирения количества вещества по п.35 или 36.
106. 3-O-[b-D-теверозил-(1R4)-b-D-цимаропиранозил-(1R 4)-b-D-цимаропиранозид]-12b-O-тиглоил-14b-гидроксипрегнан-5-ен-20-он.
Текст
1 Область техники, к которой относится изобретение Это изобретение относится к стероидным гликозидам, к композициям, содержащим такие стероидные гликозиды, и к новому применению таких стероидных гликозидов, и содержащих их композиций. Изобретение дополнительно относится к способу экстракции и выделения этих стероидных гликозидов из растительного материала, к способу синтетического получения этих стероидных гликозидов, к продуктам такой экстракции и к такому способу синтеза. В конкретном приложении это изобретение относится к агенту, подавляющему аппетит,к способу синтетического получения агента,подавляющего аппетит, к способу экстракции агента, подавляющего аппетит, из растительного материала, к композиции, подавляющей аппетит и содержащей агент, подавляющий аппетит, и к способу подавления аппетита. В соответствии с изобретением разработан способ получения экстракта растения из родаTrichocaulon или из рода Hoodia, причем этот экстракт содержит агент, подавляющий аппетит; этот способ включает стадии обработки собранного растительного материала растворителем,чтобы экстрагировать фракцию, обладающую активностью подавления аппетита, отделения экстрагирующего раствора от остального растительного материала, удаление растворителя из экстрагирующего раствора и выделение экстракта. Выделенный таким образом экстракт может быть дополнительно очищен, например, с использованием подходящих методик экстракции растворителем. Это изобретение также относится к растительному экстракту, полученному из растений группы, включающей род Trichocaulon и родHoodia, и обладающему активностью подавления аппетита. Этот экстракт может быть получен из растительного материала, такого как стебли и корни указанных растений из рода Trichocaulon или из рода Hoodia. Род Trichocaulon и род Hoodia включает сочные растения, произрастающие в засушливых областях, таких, что находятся в Южной Африке. В одном приложении изобретения активный экстракт, подавляющий аппетит, получают из видов Trichocaulon piliferum. Для получения активного экстракта, подавляющего аппетит, также можно использовать видыTrichocaulon officinale. В другом приложении изобретения активный экстракт, подавляющий аппетит, можно получать из видов Hoodia currorii, Hoodia gordonii или Hoodia lugardii. Биологические испытания, проведенные заявителем на крысах, показали, что некоторые экстракты обладают активностью подавления аппетита. Растительный материал может быть гомогенизирован в присутствии подходящего растворителя, например, смеси растворителей метанол/хлористый метилен, с помощью устрой 002885 2 ства, такого как смеситель Уоринга. Затем экстракционный раствор может быть отделен от оставшегося растительного материала с помощью подходящей методики разделения, такой как, например, фильтрация или центрифугирование. Растворитель может быть удален с помощью роторного испарителя, предпочтительно в водяной бане при температуре 60 С. Затем выделенный сырой экстракт может быть дополнительно экстрагирован хлористым метиленом и водой, до того как он будет разделен на хлорметиленовый экстракт и водный экстракт. Растворитель из хлорметиленового экстракта можно удалить предпочтительно путем выпаривания на роторном испарителе, а полученный экстракт можно дополнительно очищать посредством экстракции метанолом/гексаном. Затем продукт экстракции метанолом/гексаном может быть разделен, чтобы получить метанольный экстракт и гексановый экстракт. Метанольный экстракт можно выпарить, удаляя растворитель,для того чтобы получить частично очищенный активный экстракт. Этот частично очищенный активный экстракт может быть растворен в метаноле и может быть дополнительно фракционирован посредством хроматографии на колонне с использованием силикагеля, в качестве адсорбционной среды,и смеси 30% метанола в хлороформе, в качестве элюента. Можно получить множество различных фракций, причем каждую фракцию можно оценить, используя подходящие методики биологического анализа, чтобы определить ее активность подавления аппетита. Фракцию, имеющую активность подавления аппетита, предпочтительно можно дополнительно фракционировать, например, посредством хроматографии на колонне с использованием силикагеля, в качестве адсорбционной среды,и смеси растворителей хлороформ : метанол 9:1,и полученные подфракции подвергают биологическому анализу на активность подавления аппетита. По желанию, подфракцию, проявляющую активность подавления аппетита, можно дополнительно фракционировать и очистить,обычно используя методику хроматографии на колонне с использованием силикагеля, в качестве адсорбционной среды, и смеси растворителей этилацетат:гексан 9:1. Полученные очищенные фракции можно снова оценить посредством подходящей методики биологического анализа на активность подавления аппетита. Заявитель установил, что, по меньшей мере, одна такая очищенная фракция обладает хорошей активностью подавления аппетита, причем активное начало в этой фракции было идентифицировано с помощью традиционных химических методик, включающих ядерный магнитный резонанс (ЯМР), и было обнаружено, что оно представляет собой соединение структурной формулы (1) В соответствии с номенклатурой это активное начало (1) является соединением -3-O[-D-теветопиранозил-(14)D-цимаропиранозил-(14)D-цимаропиранозил]-12-Oтиглоилокси-14-гидрокси-14-прегн-5-ен-20-он(С 47 Н 74 О 15 М+878). В соответствии с другим аспектом изобретения разработан способ получения экстракта растения из рода Trichocaulon или из родаHoodia, причем этот экстракт содержит агент,подавляющий аппетит; способ включает стадии прессования собранного растительного материала с получением из него отдельного сока и выделения сока, не содержащего твердого растительного материала, с образованием экстракта. Этот экстракт может быть высушен, чтобы удалить влагу, например, путем сушки распылением, высушивания вымораживанием или высушивания в вакууме, до получения сыпучего порошка. Это изобретение относится к композиции,обладающей активностью подавления аппетита и содержащей экстракт, который описан выше. Эта композиция может быть смешана с фармацевтическим наполнителем, разбавителем или носителем и по выбору ее готовят в форме единичной дозировки. Изобретение также относится к применению описанного выше экстракта в производстве медикамента, обладающего активностью подавления аппетита, и к способу подавления аппетита посредством введения человеку или животному эффективной дозы описанной выше композиции. Соединение (1) является новым соединением и это изобретение касается соединения (1) и некоторых аналогов или производных этого стероидного трисахарида, обладающего активностью подавления аппетита. Молекулы, выбранные в качестве аналогов или производных,предназначаются для воздействия на свойства этого стероидного трисахарида с целью увеличения активности действующего компонента. При выборе этих аналогов были учтены следующие эффекты: 1. Гидрофобные взаимодействия и липофильность. Модификации функциональных групп активной молекулы имеют целью изменить гидрофобность и липофильность молекулы. Было показано, что повышенная липофильность кор 002885 4 релирует с повышенной биологической активностью, пониженной растворимостью в воде,повышенной детергентностью/расщеплением клеток, повышенным накоплением в тканях,ускоренным метаболизмом и элиминированием,повышенным связыванием плазменного белка и повышенной скоростью начала действия. 2. Электронные свойства и константы ионизации. Модификации функциональных групп молекулы имеют целью изменить кислотность и основность, которые могли бы играть основную роль при регулировании транспорта вещества к месту его действия и при его связывании на этом заданном месте. 3. Водородные связи. Модификации карбоксильных и карбонильных функциональных групп в активной молекуле имеют целью изменить взаимодействия между белками в биологических системах и химически модифицированными функциональными группами. 4. Стерические параметры. Целью изменения стерических характеристик молекулы может быть усиление связи с ее рецепторами и таким образом повышение ее биологической активности. Следующие ниже химические модификации в молекуле предназначаются для воздействия на гидрофобность и липофильность, электронные свойства, водородные связи и стерические параметры молекулы:a) химическая модификация группы С-12 и сложноэфирной функциональной группы;c) химическая модификация карбонила С 20 и ацетильной группы С-17;d) химическая модификация кольца D стероидного или агликонового цикла; е) модификация углеводов трисахаридной функциональной группы. Соответственно, это изобретение относится к соединению, имеющему общую структурную формулу (2)R1 представляет собой атом водорода, алкил, тиглоил, бензоил или любую другую органическую сложноэфирную группу;R2 представляет собой атом водорода,один или несколько 6-деоксиуглеводов, один или несколько 2,6-дидеоксиуглеводов, или молекулы глюкозы или их сочетания; и в которой пунктиром обозначено необязательное наличие дополнительной связи между С 4-С 5 или С 5-С 6. Это изобретение также относится к соединению, которое описано выше и в котором имеется дополнительная связь между С 5-С 6, R является метилом, R1 представляет собой тиглоил,R2 представляет собой 3-О-[-D-теветопиранозил-(14)D-цимаропиранозил-(14)Dцимаропиранозил] и имеет структурную формулу в которой R является алкилом; иR1 представляет собой атом водорода, или тиглоил, или бензоил, или любую другую органическую сложноэфирную группу Другие активные аналоги или производные соединения (1), подавляющего аппетит, согласно изобретению представляют собой соединения, имеющие следующие структурные формулыR1 представляет собой атом водорода, или тиглоил, или бензоил, или любую другую органическую сложноэфирную группуR1 представляет собой атом водорода, или тиглоил, или бензоил, или любую другую органическую сложноэфирную группуR1 представляет собой атом водорода, или тиглоил, или бензоил, или любую другую органическую сложноэфирную группуR1 представляет собой атом водорода, или тиглоил, или бензоил, или любую другую органическую сложноэфирную группуR1 представляет собой атом водорода, алкил, тиглоил, бензоил или любую другую органическую сложноэфирную группу;R2 представляет собой атом водорода,один или несколько 6-деокси углеводов, или один или несколько 2,6-дидеокси углеводов,или молекулы глюкозы или их сочетания; и в которой пунктиром обозначено необязательное наличие дополнительной связи между С 4-С 5 или С 5-С 6.R1 представляет собой атом водорода, алкил, тиглоил, бензоил или любую другую органическую сложноэфирную группу;R2 представляет собой атом водорода,один или несколько 6-деокси углеводов, или один или несколько 2,6-дидеокси углеводов,или молекулы глюкозы или их сочетания; и в которой пунктиром обозначено необязательное наличие дополнительной связи между С 4 С 5 или С 5-С 6.R1 представляет собой атом водорода, алкил, тиглоил, бензоил или любую другую органическую сложноэфирную группу;R2 представляет собой атом водорода,один или несколько 6-деокси углеводов, или один или несколько 2,6-дидеокси углеводов,или молекулы глюкозы или их сочетания; и в которой пунктиром обозначено необязательное наличие дополнительной связи между С 4-С 5 или С 5-С 6.R1 представляет собой атом водорода, алкил, тиглоил, бензоил или любую другую органическую сложноэфирную группу;R2 представляет собой атом водорода,один или несколько 6-деокси углеводов, или один или несколько 2,6-дидеокси углеводов,или молекулы глюкозы или их сочетания; и в которой пунктиром обозначено необязательное наличие дополнительной связи между С 4-С 5, С 5-С 6, или С 14-С 15.R1 представляет собой атом водорода, алкил, тиглоил, бензоил или любую другую органическую сложноэфирную группу;R2 представляет собой атом водорода,один или несколько 6-деокси углеводов, или один или несколько 2,6-дидеокси углеводов,или молекулы глюкозы или их сочетания; и в которой пунктиром обозначено необязательное наличие дополнительной связи между С 4-С 5, С 5-С 6, или С 14-С 15; иR3 представляет собой атом водорода, алкил, арил, ацил или гликокси. в которой R представляет собой атом водорода,алкил, арил, или любой стероид, обладающий С 14-бета-гидроксигруппой,или С 12-бетагидрокси функциональной группой, или С 17 ацильной группой, или С 5-С 6 олефин, или их сочетания. Это изобретение еще дополнительно относится к способу синтетического получения соединения, обладающего активностью подавления аппетита. В этом способе в качестве исходного материала используют стероид (или промежуточное вещество или его предшественник), причем стероид имеет химическую формулу (15) Стероид (15) может быть получен из соединения, имеющего формулу (22), по способу,который включает стадии 1) обработка прогестерона, имеющего формулу в которой R является алкилом; иR1 представляет собой атом водорода, алкил, тиглоил, бензоил или любую другую органическую сложноэфирную группу;R2 представляет собой атом водорода,один или несколько 6-деокси углеводов, или один или несколько 2,6-дидеокси углеводов,или молекулы глюкозы или их сочетания; и в которой пунктиром обозначено необязательное наличие дополнительной связи между С 4-С 5, С 5-С 6, или С 14-С 15. микроорганизмом Calonectria decora, для получения соединения 12,15-дигидроксипрогестерон формулы (17) 2) обработка соединения (17) хлористым тозилом и пиридином, для получения соединения 12-гидрокси-15-(паратолуолсульфонил)прогестерон формулы (18) 3) обработка соединения (18) коллидином при 150 С, для получения соединения 12 гидрокси-14-прогестерон формулы (19) с) обработка соединения (24) восстанавливающим агентом, например литийалюминийгидридом (LiAlH4), например, при кипячении с обратным холодильником, чтобы получить соединение 3,12,14-тригидрокси-20,20-этилендиоксипрегн-5-ен формулы (25) 4) обработка соединения (19) хлористым ацетилом и уксусным ангидридом при 120 С,чтобы получить соединение 3,12-диацетоксипрегна-3,5,14-триен-20-он формулы (20) 5) обработка соединения (20) этиленгликолем и каталитическим количеством паратолуолсульфоновой кислоты, чтобы получить соединение 3,12-диацетокси-20,20-этилендиоксипрегна-3,5,14-триен формулы (21) 6) обработка соединения (21) боргидридом натрия, чтобы получить соединение 3,12 дигидрокси-20,20-этилендиоксипрегна-5,14 диен-12-ацетат формулы (22). В первой альтернативной методике способ получения стероида (15) согласно изобретению включает стадии а) обработка соединения (22) восстанавливающим агентом, например, литийалюминийгидридом, чтобы получить соединение 3,12-дигидрокси-20,20-этилендиоксипрегна-5,14-диен формулы (23)b) обработка соединения (23) N-бромацетамидом (NBA) и основанием, например, пиридином, чтобы получить соединение 3,12 и d) обработка соединения (25) кислотой,например уксусной кислотой, и водой, чтобы получить стероидное промежуточное соединение 3,12,14-тригидроксипрегн-5-ен (15). На схеме реакций А отображена методика получения стероидного промежуточного соединения (15) из соединения (22) в соответствии с первой альтернативной методикой изобретения (включает получение соединения (22) из соединения (16) в целях иллюстрации). Схема реакций Аd) обработка соединения (28) Nбромацетамидом (NBA), необязательно уксусной кислотой и основанием, например, пиридином, чтобы получить соединение 6,12 дигидрокси-20,20-этилендиокси-14,15-эпокси 3,5-циклопрегнан формулы (29) е) обработка соединения (29) восстанавливающим агентом,например, литийалюминийгидридом, и например, тетрагидрофураном, чтобы получить соединение 6,12,14-тригидрокси-20,20-этилендиокси-3,5-циклопрегнан формулы Во второй альтернативной методике способ получения стероида (15) согласно изобретению включает стадии а) обработка соединения (22) (3,12 дигидрокси-20,20-этилендиоксипрегна-5,14 диен-12-ацетата) хлористым паратолуолсульфонилом и основанием, например, пиридином,чтобы получить соединение 3,12-дигидрокси 20,20-этилендиоксипрегна-5,14-диен-3-тозил 12-ацетат формулы (26) и f) обработка соединения (30) кислотой,например хлористо-водородной кислотой, и растворителем, например ацетоном, чтобы получить соединение (15). На схеме реакций В изображена методика получения стероидного промежуточного соединения (15) из соединения (22) в соответствии со второй альтернативной методикой изобретения. Схема реакций Вb) обработка соединения (26) ацетатом калия в растворителе, например, ацетоне, чтобы получить соединение 6,12-дигидрокси-20,20 этилендиокси-3,5-циклопрегнан-14-ен-12 ацетат формулы (27) Соединение (1) может быть синтезировано из первого углеводного промежуточного соеди 13 нения, в виде активированной моносахаридной цимарозной группы, которое может быть получено из соединения, имеющего формулу (36). Это соединение (36) можно получить посредством способа, который включает стадии: 1) обработка метилD-глюкозы, имеющей формулу (31) бензальдегидом и хлористым цинком, чтобы получить соединение метил-4,6-О-бензилиден-D-глюкопиранозид формулы (32) 2) обработка соединения (32) хлористым тозилом и пиридином при 0 С, чтобы получить соединение метил-4,6-O-бензилиден-2-O-тозил-D-глюкопиранозид формулы (33) 3) обработка соединения (33) метилатом натрия (NaOMe) при 100 С, чтобы получить соединение метил-4,6-О-бензилиден-3-О-метил-D-альтропиранозид формулы (34) 4) обработка соединения (34) Nбромсукцинимидом (NBS), чтобы получить соединение метил-6-бром-4-О-бензоил-3-О-метил 6-деоксиD-альтропиранозид формулы (35) Это изобретение распространяется на способ получения углеводного промежуточного соединения в виде активированной моносахаридной цимарозной группы, который включает стадии: 1) обработка соединения (36) фенилтиотриметилсиланом (PhSSiMe3), йодистым цинком(37) трифторидом диэтиламиносеры (DAST),например, при 0 С, чтобы получить соединение 4-O-бензоил-3-O-метил-2-фенилтио-2,6-дидеокси- -D-фторцимаропиранозид, имеющее формулу(40), в которой Z = трет-бутилдиметилсилил. На схеме реакций С изображена методика синтеза активированной моносахаридной цимарозной группы (40) из соединения (36) в соот 15 ветствии с изобретением (включает получение соединения (36) из соединения (31) в целях иллюстрации). Схема реакций С 3) обработка соединения (43) уксусной кислотой, чтобы получить соединение 3-O-метил-D-глюкопиранозу формулы (44) 4) обработка соединения (44) метанолом и хлористо-водородной кислотой, чтобы получить соединение метил 3-О-метилD-глюкопиранозид формулы 5) обработка соединения (45) бензальдегидом и хлористым цинком, чтобы получить соединение метил 4,6-O-бензилиден-3-O-метил-глюкопиранозид формулы (46) В синтез соединения (1) также можно вовлекать второе углеводное промежуточное соединение, в виде активированной моносахаридной теветозной группы, которое может быть получено из соединения, имеющего формулу(47). Это соединение (47) можно получить посредством способа, который включает стадии: 1) обработка метилD-глюкозы, имеющей формулу (41) ацетоном и серной кислотой, чтобы получить соединение 1,2:5,6-ди-О-изопропилиденDглюкофуранозу формулы (42) 2) обработка соединения (42) гидридом натрия и йодистым метилом, чтобы получить соединение 1,2:5,6-ди-О-изопропилиден-3-ОметилD-глюкофуранозу формулы (43) 6) обработка соединения (46) Nбромсукцинимидом, хлористым никелем и боргидридом натрия, чтобы получить соединение метил 4-O-бензоил-3-О-метил-6-деокси-глюкопиранозид, имеющий формулу (47) Это изобретение относится к способу получения активированной моносахаридной теветозной группы, который включает стадии 1) обработка соединения (47) фенилтиотриметилсиланом и триметилсилилтрифторметансульфонатом, чтобы получить соединение 4O-бензоил-3-O-метил-1-фенилтио-6-деокси-глюкопиранозид, имеющий формулу (48) 2) обработка соединения (48) хлористым пивалоилом и растворителем, например, пиридином, чтобы получить соединение 4-Oбензоил-3-O-метил-2-O-пивалоил-1-фенилтио-6 деоксиглюкопиранозид, имеющий формулу На схеме реакций D изображена методика синтеза активированной моносахаридной теветозной группы 50 А) и (50 В из соединения 18 идным промежуточным соединением, который включает стадии: 1) взаимодействие цимарозной группы (38) со стероидным промежуточным соединением(15), например, при -15 С, и в присутствии хлористого олова в растворителе, например, эфире,чтобы получить соединение 3-O-[4-O-бензоил 2-фенилтиоD-цимаропиранозил]-12,14-дигидроксипрегн-5-ен-20-он формулы и 2) обработка соединения (51) хлоридом тиглиновой кислоты в пиридине и после этого основанием, например, метилатом натрия(NaOMe), чтобы получить соединение 3-O-[2 фенилтиоD-цимаропиранозил]-12-тиглоилокси-14-гидрокси-14-прегн-5-ен-20-он формулы Это изобретение распространяется на способ, который включает сочетание моносахаридной цимарозной группы с моносахаридной теветозной группой и сочетание образовавшегося дисахарида с объединенным стероидным продуктом (52), чтобы получить соединение (1). Способ сочетания моносахаридной цимарозной группы с моносахаридной теветозной группой и сочетания образовавшегося дисахарида с объединенным стероидным продуктом(52) может включать стадии 1) сочетание селективно защищенной цимарозной группы (40) и селективно защищенной теветозной группой (50 А), например, при-15 С, используя хлористое олово (SnCl2) и трифторметансульфонат серебра, чтобы получить соединение формулы (53) В соответствии с еще одним аспектом изобретения в нем разработан способ синтетического получения соединения формулы (1), и его аналогов, и производных, который включает стадии синтеза подходящего стероидного промежуточного соединения или его предшественника и сочетания необходимого числа подходящих моносахаридов со стероидным промежуточным соединением. Это изобретение также касается способа сочетания моносахаридной цимарозы со стеро в которой Z = трет-бутилдиметилсилил 2) обработка соединения (53) фтористым тетрабутиламмонием, чтобы получить соединение формулы (54) 3) обработка соединения (54) трифторидом диэтиламиносеры (DAST), например, при 0 С,чтобы получить соединение формулы (55)(4) взаимодействие соединения (55) с соединением (52), чтобы получить соединение формулы (56) и 5) обработка соединения (56) в реакции с никелем Ренея и после этого с основанием, например, метилатом натрия, чтобы получить соединение (1), которое описано выше. На схеме реакций Е изображена методика синтеза промежуточных соединений (52) и (55) и их сочетание, чтобы получить соединение Согласно изобретению разработан альтернативный способ, который включает сочетание цимарозной группы и теветозной группы с образованием трисахарида и сочетание этого трисахарида с производным стероида, чтобы получить соединение формулы (1). Способ образования трисахарида и сочетания полученного трисахарида с производным стероида может включать следующие стадии: 1) сочетание селективно защищенной цимарозной группы (40) и соединения (45), используя хлористое олово (SnCl2), трифторметансульфонат серебра (AgOTf) и дихлорид дициклопентадиенилциркония (Cp2ZrCl2), чтобы получить соединение формулы в которой Z = трет-бутилдиметилсилил 2) обработка соединения (57) фтористым тетрабутиламмонием и трифторидом диэтиламиносеры, чтобы получить соединение трисахарида, имеющего формулу (58) и 3) сочетание трисахарида (58) со стероидным промежуточным соединением формулы используя хлористое олово, трифторметансульфонат серебра и дихлорид дициклопентадиенилциркония, чтобы получить соединение (1). Стероидное промежуточное соединение(59) можно получить посредством обработки стероида (15) хлоридом тиглиновой кислоты. На схеме реакций F изображена методика синтеза трисахарида (58) и синтез соединения(1) путем сочетания трисахарида (58) со стероидным промежуточным соединением (59). Схема реакций F понентом является полученное синтетически соединение формулы (1), или его производные,или аналоги, которые приведены выше, со ссылкой на соединения (2)-(14). В соответствии с другим аспектом изобретения разработан способ подавления аппетита посредством введения человеку или животному соответствующей дозы агента, подавляющего аппетит, который содержит экстракт из растения рода Trichocaulon или из рода Hoodia. Этот экстракт может быть введен в композицию или рецептуру, также содержащую другие фармацевтически приемлемые компоненты. Агент, подавляющий аппетит, может быть выделенным природным соединением или синтезированным химическим соединением формулы (1), Описанные выше промежуточные соединения (23), (24), (25), (27), (28), (29), (30), (37),(38), (39), (40), (48), (49), (50), (51), (53), (54),(55), (56), (57) и (58) являются новыми соединениями и это изобретение распространяется на эти соединения, как таковые. Было установлено, что соединение (1) 3-O[-D-теветопиранозил-(14)D-цимаропиранозил-(14)D-цимаропиранозил]-12-Oтиглоилокси-14-гидрокси-14-прегн-5-ен-20-он,его различные аналоги, и его производные обладают активностью подавления аппетита. Это изобретение также относится к композиции или рецептуре, обладающей активностью подавления аппетита, в которой активным компонентом является экстракт, полученный из растения из рода Trichocaulon или из родаHoodia, или их производных. Это растение может быть из видов Trichocaulon piliferum, илиTrichocaulon officinale, или из видов Hoodia currorii, Hoodia gordonii, или Hoodia lugardii. Это изобретение также относится к композиции или рецептуре, обладающей активностью подавления аппетита, в которой активным ком или его производными, или его аналогами, которые приведены выше. Композиция или рецептура, подавляющая аппетит, может состоять из агента, подавляющего аппетит, смешанного с фармацевтическим эксципиентом, разбавителем или носителем. Также могут быть добавлены другие подходящие добавки, включающие стабилизатор, а также другие компоненты. Это изобретение относится к применению соединения (1), или его производных, или его аналогов в производстве медикамента, обладающего активностью подавления аппетита. Это изобретение дополнительно относится к применению соединения (1), или его производных, или его аналогов, которые приведены выше, для применения в качестве медикамента,обладающего активностью подавления аппетита. Изобретение также относится к способу подавления аппетита посредством введения человеку или животному эффективной дозы описанной выше композиции. В изобретении описан способ экстракции стероидного гликозида, обладающего активностью подавления аппетита, из растительного материала, полученного из растения из родаTrichocaulon или из рода Hoodia. Таким образом, это изобретение относится к экстракту, полученному из растительного материала родаTrichocaulon или из рода Hoodia и содержащему практически чистый стероидный гликозид формулы (1). Изобретение также относится к пищевым продуктам или напиткам, содержащим эффективное количество стероидного гликозида формулы (1), или его производных, или его анало 23 гов, описанных выше, которые при поглощении оказывают эффект подавления аппетита. Молекулярно-генетические исследования привели к значительно лучшему пониманию регулирования аппетита, насыщения и веса тела. В этих исследованиях были выявлены многочисленные центральные пути регулирования,медиируемые рядом нейропептидов. Поддержание нормального веса тела достигается с помощью сложного баланса между поступлением энергии, потреблением пищи и расходом энергии. Гомеостаз энергии подвергается значительному числу воздействий, которые в конечном счете контролируются мозгом. Различные сигналы включают такие чувства, как ощущение аромата и вкуса, и желудочно-кишечные сигналы, такие как раздутость желудочно-кишечного тракта, химические сигналы желудочной мукозе и образовавшиеся в крови метаболиты, такие как жирные кислоты и глюкоза. В основном было установлено, что нейропептид Y (NPY), который отрицательно регулируется лептином, является одним из регуляторов поведения при питании. Было также показано, что экспрессия эндогенного антагониста для рецепторов меланокортина, является основой для ожирения конкретной модели (мышь ob/ob). Разумеется, дефицит на рецептор меланокортина МС 4 полностью реплицирует синдром ожирения. Другие медиаторы, которые, как было показано, играют роль в энергетическом балансе, включают бомбезин, галонин и глюкагоноподобный пептид-1. Не связывая себя теорией, заявитель полагает, что соединение (1) и его аналоги, которые описаны выше, действуют как агонисты рецептора меланокортина МС 4. Результатом этого может быть регулирование нейропептида Y, а также увеличение содержания холецистокинина. Наряду с другими эффектами, влиянием холецистокинина может быть ингибирование освобождения желудка. Соответственно, это изобретение относится к композиции, обладающей активностью подавления аппетита и включающую агонист рецептора меланокортина МС 4. Этот агонист может быть экстрактом или соединением, которое описано выше, в частности соединением формулы (1). Композиция может быть смешана с фармацевтическим эксципиентом, разбавителем или носителем, причем, по желанию, ее готовят в форме единичной дозировки. Это изобретение дополнительно относится к применению агониста рецептора меланокортина МС 4 при производстве медикамента, обладающего активностью подавления аппетита, к агонисту рецептора меланокортина МС 4, предназначенному для использования в качестве медикамента, обладающего активностью подавления аппетита, к способу подавления аппетита путем введения человеку или животному эффективной дозы композиции, содержащей опи 002885 24 санный выше агонист рецептора меланокортина МС 4, и к применению агониста рецептора меланокортина МС 4 для подавления аппетита и,или преодоления ожирения у людей или животных. Далее это изобретение и его эффективность будут дополнительно описаны со ссылкой на следующие примеры и чертежи, без ограничения объема изобретения. На фиг. 1 показана последовательная схема общего способа экстракции первого неочищенного экстракта, подавляющего аппетит, из растительного материала растения из рода Trichocaulon или Hoodia. На фиг. 2 представлены результаты биологического анализа, проведенного на крысах с использованием частично очищенного метанольного экстракта Trichocaulon piliferum. На фиг. 3 и 4 представлена схема предпочтительного варианта осуществления способа изобретения для получения экстракта растительного материала из рода Trichocaulon илиHoodia; и На фиг. 5 и 6 графически показаны представление изменения процентного веса тела крыс различных групп в течение от -7 до 7 суток и от 0 до 7 суток соответственно при исследовании повторной дозы, с использованием экстракта сока и высушенного распылением экстракта сока растительного материала из рода Hoodiagordonii. Пример 1. Общий способ экстракции первого неочищенного экстракта, подавляющего аппетит, и очищенного подавляющего аппетит экстракта растительного материала из рода Trichocaulon или из рода Hoodia, иллюстрируется с помощью последовательной схемы фиг. 1. Пример 2. Биологические анализы, проведенные на крысах с использованием частично очищенного метанольного экстракта, полученного способом,согласно примеру 1, показывают, что экстракт действительно проявляет активность подавления аппетита. Эта активность подавления аппетита активным экстрактом может быть продемонстрирована с помощью типичного примера влияния метанольного экстракта Trichocaulonpiliferum на крыс как графически представлено на фиг. 2. Из фиг. 2 можно видеть, что в испытанной группе крыс, получивших дозу экстракта на пятые сутки, проявляется значительно пониженное потребление пищи в течение следующих двух суток, в то время как в контрольной группе не отмечено сопоставимое снижение потребления пищи. Потребление пищи в испытуемой группе возвращается к норме и фактически увеличивается, начиная с 8 суток и далее. Пример 3. Предпочтительный вариант воплощения способа согласно изобретению для полученного 25 экстракта, обладающего активностью подавления аппетита, проиллюстрирован схематически с помощью примера на фиг. 3 и 4, которые вместе характеризуют этот обширный способ. Однако можно использовать различные другие методики, как будет понятно специалистам в этой области техники. Обратимся к фиг. 3: растительный материал из рода Trichocaulon или из рода Hoodia поступает в смеситель 3 по питающей линии 1,например, смеситель Уоринга, с растворителем,в виде раствора метиленхлорид/метанол, вводимого по питающей линии 2. Гомогенизированный продукт подают по линии 4 на стадию разделения 5, например, в виде фильтра или центрифуги, а остаточный растительного материала удаляют по линии 27. Смесь растворитель/экстракт подают по линии 6 на стадию выпаривания 7, где растворитель удаляют, например, с помощью роторного испарителя. Высушенный неочищенный экстракт подают по линии 8 на стадию дополнительной экстракции 9 с добавлением раствора метиленхлорид/вода, введенного по питающей линии 29 для дополнительной экстракции, и затем по линии 11 на стадию разделения 13,откуда водную фракцию удаляют по линии 31. Растворенную фракцию экстракта подают по линии 15 на стадию высушивания 17, где растворитель выпаривают, например, с помощью роторного испарителя. Обратимся к фиг. 4: высушенный экстракт подают по линии 10 на стадию экстракции 12. На эту стадию экстракции 12 также подают по линии 14 раствор метанол/гексан для дальнейшей очистки и экстракции высушенного экстракта. Смесь экстракт/метанол/гексан подают по линии 16 на стадию разделения 18, откуда гексановую фракцию удаляют по линии 20, и затем смесь метанол/экстракт подают по линии 22 на стадию высушивания 24. На стадии высушивания 24 растворитель удаляют, например,выпаривают с помощью роторного испарителя. Высушенный, частично очищенный активный экстракт подают по линии 26, с добавлением метанола по линии 28, на стадию растворения 30, и растворенную фракцию подают по линии 36 в хроматографическую колонку 38. В этой колонке 38 фракцию, растворимую в метаноле, дополнительно фракционируют, с использованием силикагеля и растворителя 30% метанол/хлороформ, на различные фракции, которые схематично обозначены как фракции I-V. В соответствии с фактической методикой фракционирования, осуществленной заявителем, при фракционировании получают следующие количества фракций: I (3,9 г), II (2,6 г),III (2,1 г), IV (1,1 г) и V (2,0 г). Эти фракции оценивают индивидуально методом подходящего биологического анализа (эта стадия не показана), и те фракции, обозначенные как фракцииI и II, которые проявили заметную активность 26 подавления аппетита, подают по питающим линиям 40 и 42 в колонны 44 и 46 соответственно,где их дополнительно фракционируют и очищают на хроматографической колонке, снова используя силикагель и систему хлороформ: метанол = 9:1. Подфракции II(А)-(С), полученные из колонки 44, при испытании не показали заметной активности подавления аппетита, и их можно возвращать в цикл для дополнительной хроматографической очистки. Подфракции I (A)-(L), полученные из колонки 46, также оценивали (стадия испытания не показана), и было установлено, что подфракция I(С) обладает заметной активностью подавления аппетита. Подфракцию I(С) подают по линии 48 для дальнейшего фракционирования и очистки, используя силикагель и элюент 9:1 этилацетат: гексан. После испытания найдено, что из полученных очищенных фракций, фракция I(С)(ii) обладает заметной активностью. Очищенный продукт идентифицируют методом ядерной магнитной спектроскопии(ЯМР), (показано в табл. 1 и 2 ниже), оно является соединением (1). Таблица 1. Данные 1 Н (300,13 МГц) ЯМР для соединение (1) в CDCl3 Соединение (1) Атомa,b,c в каждой колонке могут взаимно заменяться;d,e в каждой колонке могут взаимно заменяться;относится к группе атомов тиглоата. Таблица 2. Данные 13 С (75,25 МГц) ЯМР, относящиеся к соединению (1) в СDСl3 Агликоновая группа Сахарная группа Углерод Углерод[D]20589 = 12, 67 (C=3, СНСl3); Температура плавления 147-152 С. Примеры 4-13 иллюстрируют методики синтеза, с помощью которых можно получить промежуточные соединения и стероид (15) согласно первой альтернативной методике. Пример 4. 12,15-Дигидроксипрогестерон (17). Культуры Calonectria decora (ATCC 14767) получают инокулированием культуральной среды, содержащей 900 г сахарозы, 30 г гидрофосфата калия, 300 мл концентрата Чапека, 300 мл жидкости для замачивания кукурузы и 30 л дистиллированной воды в 150 колбах, емкостью 500 мл. Через 5 суток встряхивания при 26 С добавляют 150 г прогестерона (16) в суспензии 1,5 л Твина 80 (0,1%-ный раствор). Культуры инкубируют еще в течение 5 суток и затем обрабатывают путем центрифугирования, декантации, экстракции средой с хлороформом с по 002885(45%) дигидроксипрогестерона (17). Спектр 1H-ЯМР (СDСl3): 5,71 (1 Н, с, Н-4); 4,12-4,22 (1 Н, м, Н-15); 4,43 (1 Н, ш. с, ОН); 3,463,53 (1 Н, дд, J=4,6 Гц, Н-12); 2,16 (3 Н, с, Н-21); 1,18 (3 Н, с, Н-19); 0,74 (3 Н, c, Н-18). Пример 5. 12-Гидрокси-15-(паратолуолсульфонил)прогестерон (18). Растворяют в 300 мл сухого пиридина 75 г(0,22 моль) дигидроксипрогестерона (17) и охлаждают до 0C. Добавляют по каплям 46 г(0,24 моль) сульфонилхлорида толуола в 200 мл сухого пиридина в реакционную смесь при 0 С. Реакционную смесь перемешивают в течение ночи при 0 С, и реакцию прерывают, добавляя 500 мл воды. Водный слой экстрагируют 1 л этилацетата, и органический экстракт промывают 6M соляной кислотой (3 раза по 1 л), 500 мл водного насыщенного раствора бикарбоната натрия, 500 мл водного насыщенного раствора хлорида натрия и 500 мл воды. Органический слой высушивают сульфатом магния, фильтруют и выпаривают, чтобы получить 98 г (92%) паратолуолсульфонированного прогестерона(19). Раствор 98 г (0,19 моль) тозилированного прогестерона (18) в 500 мл 2,4,6-триметилколлидина кипятят с обратным холодильником 3 ч при 150 С. Реакционную смесь охлаждают и выливают в 500 мл воды. Водный слой экстрагируют 1 л этилацетата, после чего органический слой промывают 6-молярной соляной кислотой (3 раза по 1 л), 500 мл водного насыщенного раствора бикарбоната натрия, 500 мл водного насыщенного раствора хлорида натрия и 500 мл воды. После высушивания сульфатом магния и фильтрования этилацетат выпаривают,и сырую смесь очищают хроматографически на силикагеле, элюируемым смесью 1:10 ацетона и хлороформа, чтобы получить 50 г (78%) 12 гидрокси-14-прогестерона (19) в виде темнокрасного масла. Спектр 1 Н-ЯМР(CDCl3): 5,73 (1 Н, с, Н-4); 5,28 (1 Н, дд, J=2,2 Гц, Н-15); 4,41 (1 Н, ш.с, ОН); 3,49-3,52 (1 Н, дд, J=4,3 Гц, Н-12); 2,80-2,84 (1 Н,дд, J=9,2 Гц, Н-17); 2,14 (3 Н, с, Н-21); 1,19 (3 Н,с, Н-19); 0,89 (3 Н, с, Н-18). Пример 7. 3,12-Диацетоксипрегна-3,5,14 триен-20-он (20). Раствор 50 г (0,15 моль) гидрокси-14 прогестерона (19) в 1,5 л хлористого ацетила и 750 мл уксусного ангидрида кипятят с обратным холодильником в течение 2 ч. Реакционную смесь выливают в 1 л холодного этилацетата и 29 при перемешивании добавляют водный насыщенный раствор бикарбоната натрия, до тех пор пока не прекратится выделение пузырьков газа. Отделяют этилацетатный слой от слоя раствора бикарбоната натрия и промывают дополнительными порциями (3 раза по 700 мл) водного насыщенного раствора бикарбоната натрия, после этого 700 мл водного насыщенного раствора хлорида натрия и окончательно 700 мл воды. Органический слой высушивают сульфатом магния, фильтруют и выпаривают, чтобы получить 60 г (93%) 3,12-диацетоксипрегна-3,5,14 триен-20-она (20) в виде оранжевого масла. Спектр 1H-ЯMP (CDCl3): 5,68 (1 Н, с, Н-4); 5,44 (1 Н, м, Н-6); 5,31 (1 Н, дд, J=2,2 Гц, Н-15); 4,82-4,86 (1 Н, дд, J=4,5 Гц, Н-12); 3,10-3,18 (1 Н,т, J=9,5 Гц, Н-17); 2,18 (3 Н, с, 12-ацетил); 2,08(3 Н, с, Н-21); 1,02 (3 Н, с, Н-19); 1,01 (3 Н, с, Н 18). Пример 8. 3,12-Диацетокси-20,20-этилендиоксипрегна-3,5,14-триен (21). Растворяют в 1 л бензола 60 г (0,14 ммоль) диацетоксисоединения (20) и добавляют 60 мл этиленгликоля и 1 г паратолуолсульфоновой кислоты. (Бензол предварительно обезвоживают кипячением с ловушкой Дина-Старка). Смесь кипятят при перемешивании и азеотропным удалением воды в течение 16 ч. К охлажденному раствору добавляют 500 мл водного насыщенного раствора бикарбоната натрия. Затем эту смесь промывают 500 мл раствора хлорида натрия, 500 мл воды и сушат сульфатом магния. Растворитель выпаривают, и сырую смесь очищают хроматографически на колонке с силикагелем, элюируемой смесью этилацетата и гексана (2:8), чтобы получить 35 г (53%) этилендиоксипрегна-3,5,14-триена (21). Спектр 1 Н-ЯМР (СDСl3): 5,68 (1 Н, с, Н-4); 5,45 (1 Н, м, Н-6); 5,31 (1 Н, дд, J=2,2 Гц, Н-15); 4,73-4,85 (1 Н, дд, J=4,4 Гц, Н-12); 3,78-3,98 (4 Н,м, этилендиокси); 2,16 (3 Н, с, 3-ацетил); 1,29(3 Н, с, Н-21); 1,12 (3 Н, с, Н-19); 1,02 (3 Н, с, Н 18). Пример 9. 3,12-Дигидрокси-20,20-этилендиоксипрегна-5,14-диен-12-ацетат (22). Суспендируют в 500 мл этанола 35 г (0,077 моль) диенолацетата (21) и при 0 С добавляют 2,8 г (0,074 моль) боргидрида натрия. Реакционной смеси дают нагреться до комнатной температуры и перемешивают ее в течение ночи. Большую часть растворителя удаляют в вакууме, смесь разбавляют 500 мл воды и экстрагируют 500 мл этилацетата. Последующая обработка включает хроматографирование на силикагеле, элюируемым смесью ацетона и хлороформа (1:10), чтобы получить 25 г (80%) 3cпирта (22). Спектр 1 Н-ЯМР(СDСl3): 5,41 (1 Н, м, Н-6); 5,28 (1 Н, дд, J=2,2 Гц, Н-15); 4,72-4,81 (1 Н, дд,J=4,4 Гц, Н-12); 3,82-4,02 (4 Н, м, этилендиокси); 3,45-3,59 (1 Н, м, Н-3); 2,03 (3 Н, с, 12-ацетил); 30 1,28 (3 Н, с, Н-21); 1,10 (3 Н, с, Н-19); 1,01 (3 Н, с,Н-18). Пример 10. 3,12-Дигидрокси-20,20-этилендиоксипрегна-5,14-диен (23). По каплям 3-спирт (22) в 300 мл осушенного тетрагидрофурана (25 г, 60,2 ммоль) добавляют в суспензию 2,7 г (72,2 ммоль) литийалюминийгидрида в 500 мл осушенного тетрагидрофурана. Реакционную смесь перемешивают 24 ч при комнатной температуре, после чего осторожно добавляют 2,7 мл воды и перемешивают дополнительно 10 мин. Затем добавляют 2,7 мл 15%-го раствора гидроксида натрия, и суспензию перемешивают в течение 10 мин,фильтруют, высушивают сульфатом магния и растворитель выпаривают, чтобы получить 20 г(3 Н, с, Н-19); 0,96 (3 Н, с, Н-18). Спектр 13C-ЯMP (CDCl3): 152,4 (С-14); 140,2 (С-15); 121,1 (С-15); 119,7 (С-6); 111,1 (С 20); 79,8 (С-12); 71,6 (С-3); 63,7 и 63,6 (этилендиокси); 58,8 (С-17); 19,0 (С-19); 11,9 (С-18). 3,12-Дигидрокси-14,15-эпокси-20,20 этилендиоксипрегн-5-ен; 3,12-дигидрокси 5,6-эпокси-20,20-этилендиоксипрегн-14-ен. Добавляют 211 мг (1,5 ммоль) Nбромацетамида к перемешиваемому раствору 500 мг (1,34 ммоль) 5,14-диена (23) в 100 мл ацетона, 2,5 мл уксусной кислоты и 5 мл воды при 0 С. Через 15 мин к реакционной смеси добавляют 50 мл 5%-го раствора сульфита натрия. Ацетон выпаривают, и водный слой экстрагируют дихлорметаном (3 раза по 50 мл). Органический слой высушивают сульфатом магния,фильтруют и выпаривают. К продукту добавляют 1 мл пиридина и смесь перемешивают 0,5 ч. Затем к реакционной смеси добавляют 100 мл дихлорметана, и дихлорметан промывают 5%ным раствором лимонной кислоты (3 раза по 100 мл), 50 мл водного насыщенного раствора бикарбоната натрия и 50 мл воды. Органический слой высушивают сульфатом магния,фильтруют и выпаривают, чтобы получить 360 мг (69%) смеси 14,15- и 5,6-эпоксидов в виде белой пены. Эту смесь эпоксидов не удалось разделить хроматографически на колонке с силикагелем. Пример 11. 3,12-Дигидрокси-14,15-эпокси-20,20-этилендиоксипрегн-5-ен (24). Смесь 14,15- и 5,6-эпоксидов (14,4 г; 37 ммоль) в 200 мл осушенного тетрагидрофурана добавляют в суспензию 1,69 г (44,4 ммоль) литийалюминийгидрида в 300 мл осушенного тетрагидрофурана. Реакционную смесь перемешивают 24 ч при комнатной температуре, после чего ее обрабатывают, как описано ранее, посредством добавления 1,69 мл воды и 1,69 мл 31 15%-го раствора гидроксида натрия. После фильтрации и выпаривания растворителя сырой продукт очищают хроматографически на колонке с силикагелем, используя смесь метанола и хлороформа (1:9) в качестве растворителя, чтобы получить 300 мг (2,1%) не прореагировавшего 14,15-эпокси-20,20-этилендиоксипрегн-5-ена(С-15); 22,3 (С-21); 19,2 (С-19); 9,5 (С-18). Пример 12. 3,12,14-Тригидрокси-20,20 этилендиоксипрегн-5-ен (25). 14,15-Эпоксид (24) (300 мг; 0,77 ммоль) в 10 мл осушенного тетрагидрофурана добавляют в суспензию 300 мг (7,89 ммоль) литийалюминийгидрида в тетрагидрофуране. Реакционную смесь кипятят с обратным холодильником 48 ч. После добавления 0,3 мл воды и 0,3 мл 15%-го раствора гидроксида натрия и фильтрации, как описано ранее, смесь очищают хроматографически на колонке с силикагелем, используя смесь метанола и хлороформа (1:9) в качестве растворителя, чтобы получить 250 мг (83%) Тригидроксипрегнена (25). Спектр 1H-ЯMP (CDCl3): 5,38 (1 Н, м, Н-6); 3,98 (4 Н, м, этилендиокси); 3,43-3,53 (1 Н, м, Н 3); 3,25-3,32 (1 Н, дд, J=4,1 Гц, Н-12); 1,32 (3 Н, с,Н-21); 1,01 (3 Н, с, Н-19); 0,98 (3 Н, с, Н-18). Спектр 13C-ЯMP (CDCl3): 139,1 (С-5); 122,1(С-3); 23,4 (С-21); 19,4 (С-19); 8,9 (С-18). Пример 13. 3,12,14-Тригидроксипрегн 5-ен (15). Этилендиоксипрегнен (25) (250 мг, 0,64 ммоль) растворяют в 13,4 мл уксусной кислоты и в воде, после этого при сушке вымораживанием получают 200 мг (89%) тригидроксистероида(3 Н, с, Н-21); 1,01 (3 Н, с, Н-19); 0,90 (3 Н, с, Н 18). Спектр 13 С-ЯМР (СDСl3) : 217,7 (С-20); 138,9 (С-5); 122,2 (С-6); 85,5 (С-14); 73,6 (С-12); 71,6 (С-3); 57,0 (С-17); 55,1 (С-13); 43,6 (С-9); 42,1 (С-4); 37,3 (С-1); 36,8 (С-10); 35,9 (С-8); 34,5 (С-15); 32,9 (С-21); 31,5 (С-16); 30,1 (С-2); 27,4 (С-7); 24,4 (С-11); 19,4 (С-19); 8,3 (С-18). Примеры 14-19 иллюстрируют методики синтеза, с помощью которых можно получить промежуточные соединения и стероид (15) согласно второй альтернативной методике. Пример 14. 20,20-Этилендиокси-3-толуол-парасульфонилоксипрегна-5,14-диен-12 олацетат (26). Раствор 650 мг хлористого паратолуолсульфонила (3,4 ммоль) в 10 мл пиридина по каплям добавляют в смесь 1,3 г (3,1 ммоль) 20,20-этилендиоксипрегна-5,14-диен-3,12 диол-12-ацетата (22) в 15 мл пиридина при 0 С. Реакционную смесь оставляют перемешиваться в течение 24 ч при комнатной температуре, после чего в реакционную смесь добавляют воду. Раствор экстрагируют (2 раза по 50 мл) этилацетатом, этилацетный слой промывают лимонной кислотой (5 раз по 50 мл), 100 мл водного насыщенного раствора бикарбоната натрия, 100 мл водного насыщенного раствора хлорида натрия и 100 мл воды. Этилацетный слой высушивают сульфатом магния, фильтруют, выпаривают, и очищают методом флэш-хроматографии на колонке, используя смесь (8:2 по объему) гексана и этилацетата в качестве элюента, чтобы получить 1,5 г (84%) -O-тозилстероида (26). Найдено М (молекулярная масса) = 570,271; для(22,4 ммоль) ацетата калия в 250 мл воды и 500 мл ацетона кипятят с обратным холодильником при 60 С в течение 16 ч. Ацетон выпаривают, и водный слой экстрагируют 200 мл этилацетата. Этилацетный слой высушивают сульфатом магния, фильтруют и выпаривают. При разделении смеси методом флэш-хроматографии, используя смесь (9:1 по объему) хлороформа и ацетона в качестве элюента, получают 530 мг (61%) 3,5 цикло-производного (27) в виде желтого масла. Найдено М = 416,262; для С 25 Н 36 О 5S требуется М= 416,263. 1 Н-ЯМР : 0,288 (1 Н, дд, J=8,1; 4,9 Гц, 4 Нa); 0,477 (1H, дд, J=4,4 Гц и 4,4 Гц, 4-Hb); 1,025C-ЯМР : 11,678 т (С-4); 12,298 к (С-18); 19,971 к (С-19); 23,623 к (С-21); 24,153 к (ацетатметил); 63,700 т (этилендиокси); 63,788 т (этилендиокси); 73,591 д (С-6); 80,551 д (С-12); 111,126 с (С-20); 118,778 д (С-15); 152,959 (С-14); 170,991 с (эфирокарбонил). Пример 16. 20,20-Этилендиокси-3,5-цикло-5-прегн-14-ен-6,12-диол (28). Раствор 500 мг (1,2 ммоль) 3,5-циклопроизводного (27) в 20 мл тетрагидрофурана по каплям добавляют в суспензию 50 мг (1,3 ммоль) литийалюминийгидрида в 10 мл тетрагидрофурана. Реакционную смесь перемешивают 4 ч, и реакцию прерывают, добавляя 50 мкл воды. Спустя 30 мин добавляют 50 мкл 15%-го раствора гидроксида натрия, и перемешивание продолжают еще в течение 30 мин. Добавляют 150 мкл воды, и реакционную смесь фильтруют. Тетрагидрофурановый раствор высушивают сульфатом магния, фильтруют, выпаривают и очищают методом флэш-хроматографии, используя смесь (8:2 по объему) хлороформа и ацетона в качестве элюента, получают 370 мг(29). Добавляют 150 мг (1,1 ммоль) Nбромацетамида в раствор 340 мг (0,91 ммоль) 20,20-этилендиокси-3,5-цикло-5-прегн-14-ен 6,12-диола (28) в 20 мл ацетона, 0,25 мл воды и 0,25 мл уксусной кислоты при 0 С. Спустя 15 мин к реакционной смеси добавляют 20 мл 5%го раствора сульфита натрия. Ацетон выпаривают при пониженном давлении, и оставшийся раствор экстрагируют дихлорметаном (3 раза по 30 мл). Дихлорметановый слой высушивают сульфатом магния, фильтруют и выпаривают до концентрированного объема 50 мл. К смеси добавляют 0,5 мл пиридина и смесь перемешивают еще 1 ч. Затем дихлорметановый слой промывают 5%-ным раствором лимонной кислоты(3 раза по 30 мл), 30 мл водного насыщенного раствора бикарбоната натрия и 30 мл воды. Дихлорметановый слой высушивают сульфатом(30). Добавляют раствор 170 мг (0,44 ммоль) эпоксида (29) в 10 мл тетрагидрофурана в суспензию 20 мг (0,53 ммоль) литийалюминийгидрида в 5 мл тетрагидрофурана. Реакционную смесь кипятят с обратным холодильником 2 ч,после чего добавляют 20 мкл воды, и перемешивание продолжают в течение 30 мин. Добавляют 20 мкл 15%-го раствора гидроксида натрия, и перемешивание продолжают еще в течение 30 мин. Добавляют дополнительно 60 мкл воды, и суспензию перемешивают 1 ч. После фильтрации суспензию высушивают сульфатом магния, фильтруют и выпаривают тетрагидрофуран. При разделении полученной смеси методом флэш-хроматографии, используя смесь (9:1 по объему) хлороформа и метанола в качестве элюента, получают 90 мг (53%) целевого триода(1 Н, с, ОН). 13 С-ЯМР : 11,668 т (С-4); 11,971 к (С-18); 19,511 к (С-19); 23,520 к (С-21); 63,612 т (этилендиокси); 63,711 т (этилендиокси); 73,483 д (С-6); 76,051 д (С-12); 84,307 с (С-14); 111,099 с (С-20). Пример 19. 3,12,14-Тригидрокси-14 прегн-5-ен-20-он (15). Смесь 80 мг триола (30) (0,20 ммоль) в 20 мл ацетона и 10 мл хлористо-водородной кислоты (1 М) кипятят с обратным холодильником при 60 С в течение 2 ч. Реакционную смесь охлаждают и добавляют 20 мл насыщенного раствора бикарбоната натрия. Ацетон выпаривают,и водный слой экстрагируют хлороформом (3 раза по 20 мл). Хлороформовый слой высуши 35 вают сульфатом магния, фильтруют и выпаривают, получая эпимерные тригидроксистероиды(15 а и 15b) (42 мг, 61%). При разделении 15 мг эпимерной смеси (15 а и 15b) методом флэшхроматографии, используя смесь (9:1 по объему) хлороформа и метанола в качестве элюента,получают 10 мг чистого 17-эпимера (15 а); температура пл. 224-229 С (из ацетона) (в литературе 226-223 С). Найдено М = 348,234; С-72,32; Н-9,21%; для С 21 Н 32 О 4 требуется С-72,38; Н 9,26%; М= 348,236; и 3 мг 17-эпимера (15b); температура пл. 183-191 С (из ацетона) (в литературе 184-196 С). 3,12,14-Тригидрокси-14-прегн-5-ен 20-он (15 а). 1(1 Н, с, ОН); 5,383 (1 Н, м, Н-5). 13 С-ЯМР : 11,678 т (С-4); 8,275 к (С-18); 19,414 к (С-19); 24,400 т (С-11); 24,581 т (С-16); 27,443 т (С-7); 30,062 т (С-2); 32,972 к (С-21); 34,543 т (С-15); 35,864 д (С-8); 36,975 с (С-10); 37,337 т (С-1); 42,144 т (С-4); 43,565 д (С-9); 55,101 с (С-13); 57,038 д (С-17); 71,597 д (С-3); 73,558 д (С-12); 85,566 с (С-14); 122,223 д (С-6); 138,932 с (С-5); 217,011 с (С-20). 3,12,14-Тригидрокси-14-прегн-5-ен-20 он (15b). 1 Н-ЯМР : 0,996 (1 Н, с, Н-19); 1,144 (3 Н, с,Н-18); 2,221 (3 Н, с, Н-21); 3,339 (1 Н, дд, J=9,4 и 9,4 Гц, 17-Н); 3,492 (1 Н, м, Н-3); 3,629 (1 Н, дд,J=11,1 Гц и 3,9 Гц, Н-12); 3,712 (1 Н, с, ОН); 4,325 (1 Н, с, ОН); 5,383 (1 Н, м, Н-5). Примеры 20-28 иллюстрируют методики синтеза, с помощью которых можно получить промежуточные соединения, чтобы получить первый моносахарид (40). Пример 20. Метил-4,6-О-бензилиденDглюкопиранозид (32). Смесь 30 г (0,15 моль) метилDглюкопиранозида, 70 мл бензальдегида и 20 г хлористого цинка перемешивают 24 ч при комнатной температуре. Реакционную смесь выливают в ледяную воду и смесь перемешивают еще 15 мин. Белый осадок отфильтровывают и промывают диэтиловым эфиром. Твердое вещество перемешивают 15 мин с 10%-ным раствором метабисульфита натрия, фильтруют и промывают водой. Твердое вещество кристаллизуется из смеси хлороформа и эфира, образуя бензилиденовый продукт (32) (31 г, 72%). Пример 21. Метил-4,6-O-бензилиден-2-OтозилD-глюкопиранозид (33). К раствору 31 г (0,12 моль) бензилиденглюкозы (32) в 100 мл пиридина по каплям добавляют 25 г (1,2 экв.) хлористого паратозолсульфонила в 100 мл пиридина при 0 С. Реакционную смесь перемешивают 48 ч при комнатной температуре. К реакционной смеси добав 002885 36 ляют лед. Образовавшееся белое твердое вещество промывают водой и перекристаллизовывают из горячего этанола, получая тозилированную глюкозу (33) (28 г, 60%). Пример 22. Метил-4,6-О-бензилиден-3-ОметилD-альтропиранозид (34). Тозилат (33) (28 г, 64 ммоль) в растворе метилата натрия (7 г натрия в 150 мл метанола) нагревают 48 ч в автоклаве при 110 С. Реактор охлаждают и в реакционную смесь добавляют твердый диоксид углерода. После фильтрации метанол выпаривают, и затем твердое вещество обрабатывают водой. Водный слой экстрагируют 3 раза хлороформом. Хлороформовый слой высушивают сульфатом магния, фильтруют и выпаривают. Сырую смесь очищают на хроматографической колонке с силикагелем, элюируемой смесью 9:1 хлороформа и ацетона, чтобы получить альтрозид (34) (10 г, 52%) Пример 23. Метил-6-бром-4-O-бензоил-3O-метил-6-деоксиD-альтропиранозид (35). Добавляют 10 г (33 ммоль) бензилиденальтрозида (34) к раствору 7,6 г N-бромсукцинимида и карбоната бария (20 г) в четыреххлористом углероде, и реакционную смесь 3 ч кипятят с обратным холодильником при 75 С. Реакционную смесь фильтруют и слой четыреххлористого углерода промывают водой. Органический слой высушивают сульфатом магния,фильтруют и выпаривают, чтобы получить соединение 6-бромальтрозид (35) (9 г, 69%). Пример 24. Метил-4-О-бензоил-3-О-метил 6-деоксиD-альтропиранозид (36). Добавляют по каплям 18 г боргидрида натрия в 30 мл воды к раствору бромальтрозида(35) (9 г, 23 ммоль) и 18 г хлорида никеля в 300 мл этанола при 0 С. Реакционную смесь 1 ч кипятят с обратным холодильником при 75 С и затем ее фильтруют. Этанол выпаривают, и оставшийся водный слой экстрагируют хлороформом (3 раза). Хлороформовый слой высушивают сульфатом магния, фильтруют и выпаривают, чтобы получить 6-деоксиальтрозид (36) (5 г, 72%). Пример 25. 4-O-Бензоил-3-О-метил-6 деоксиD-фенилтиоальтропиранозид (37). Фенилтиотриметилсилан (5 мл) и триметилсилилтрифторметансульфонат (2 мл) добавляют при 0 С к раствору 6-деоксиальтрозида(36) (5 г, 17 ммоль) в 200 мл дихлорметана. Реакционную смесь перемешивают 6 ч при комнатной температуре. К реакционной смеси добавляют насыщенный раствор бикарбоната натрия. Дихлорметановый слой высушивают сульфатом магния, фильтруют и выпаривают. Сырую смесь очищают на хроматографической колонке с силикагелем, элюируемой смесью 9:1 хлороформа и ацетона, чтобы получить фенилтиоальтрозид (37) (4 г, 63%). 37 Пример 26. 4-O-Бензоил-3-O-метил-2-фенилтио-2,6-дидеоксиD-фторцимаропиранозид (38). Трифторид диэтиламиносеры (0,65 г) быстро добавляют при 0 С к раствору фенилтиоальтрозида (37) (0,5 г, 1,33 ммоль) в дихлорметане. Реакционную смесь перемешивают 0,5 ч при 0 С и затем добавляют насыщенный раствор бикарбоната натрия. Дихлорметановый слой отделяют от водного слоя, высушивают сульфатом магния, фильтруют и выпаривают, чтобы получить -фторцимарозу (38)(450 мг, 90%). Пример 27. 4-O-Бензоил-3-O-метил-2-Oтрет-бутилдиметилсилилD-фенилтиоальтрозид (39). 6-Деоксиальтрозид (37) (5 г) силилируют,используя 3 г трет-бутилдиметилсилилхлорида и 3 г имидазола в 50 мл пиридина. Реакционную смесь обрабатывают, экстрагируя ее этилацетатом, промывают этилацетатный слой 6-нормальной соляной кислотой, затем бикарбонатом натрия и окончательно водой. Этилацетатный слой высушивают сульфатом магния, фильтруют и выпаривают, чтобы получить силилированный бензоилфенилтиоальтрозид (39) (80%). Пример 28. 3-O-Метил-2-O-трет-бутилдиметилсилилD-фенилтиоальтрозид (40). Силилированный бензоилфенилтиоальтрозид (39) (6 г) обрабатывают метилатом натрия(100 мл) в течение 4 ч. Метанол выпаривают и к реакционной смеси добавляют воду. Водный слой подкисляют уксусной кислотой (до рН 5) и экстрагируют этилацетатом. Этилацетатный слой промывают водой, высушивают сульфатом магния, фильтруют и выпаривают, чтобы получить силилированный метилфенилтиоальтрозид(40) (75%). Примеры 29-37 иллюстрируют методики синтеза, с помощью которых можно приготовить промежуточные соединения, чтобы получить второй моносахарид (50). Пример 29. 1,2:5,6-Ди-О-изопропилиден-D-глюкофураноза (42). Добавляют по каплям 40 мл серной кислоты в раствор -D-глюкозы (41) (50 г, 0,28 моль),в 1 л ацетона при 0 С. Реакционную смесь перемешивают 24 ч и затем ее нейтрализуют, использую 6 М раствор гидроксида натрия. Ацетон выпаривают, и водный слой экстрагируют хлороформом (2 раза). Хлороформовый слой высушивают сульфатом магния, фильтруют и выпаривают. При кристаллизации из циклогексана получают диизопропилиден-глюкозу (42) (41 г,57%). Пример 30. 1,2:5,6-Ди-О-изопропилиден-3 О-метилD-глюкофураноза (43).-D-глюкофуранозу (42) (41 г, 0,16 моль) добавляют по каплям к суспензии 5 г гидрида натрия в 200 мл тетрагидрофурана. Спустя 0,5 ч к реакционной смеси добавляют по каплям 25 г 38 йодистого метила в 100 мл тетрагидрофурана и затем смесь перемешивают 24 ч. В реакционную смесь добавляют воду и затем смесь экстрагируют 3 раза эфиром. Эфирный слой высушивают сульфатом магния, фильтруют и выпаривают, чтобы получить метилзащищенную глюкозу(43) (38 г, 0,14 моль) растворяют в 700 мл уксусной кислоты (50%), и этот раствор кипятят с обратным холодильником 18 ч. После охлаждения выпаривают уксусную кислоту. Сырой продукт очищают на хроматографической колонке,элюируемой смесью хлороформ: метанол: ацетон: вода (70: 27: 2: 1), чтобы получить 3-ОметилD-глюкопиранозид (44) (13 г, 50%). Пример 32. Метил 3-О-метилDглюкопиранозид (45). 3-О-МетилD-глюкопиранозид (44) (10 г) растворяют в 50 мл метанола и 1 мл концентрированной хлористо-водородной кислоты и кипятят с обратным холодильником в течение ночи. Добавляют твердый бикарбонат натрия, и реакционную смесь фильтруют. Метанол выпаривают, чтобы получить метил 3-O-метилDглюкопиранозид (45) (95%). Пример 33. Метил 4,6-O-бензилиден-3-Ометилглюкопиранозид (46). Глюкопиранозид (45) (8 г) перемешивают при комнатной температуре в растворе 20 мл бензальдегида и хлористого цинка (5 г). Спустя 24 ч добавляют лед, и водный слой экстрагируют хлороформом. Хлороформовый слой высушивают сульфатом магния, фильтруют и выпаривают. Бензальдегид удаляют посредством вакуумной перегонки, и продукт очищают на хроматографической колонке с силикагелем,элюируемой смесью ацетона и хлороформа(0,5:9,5), чтобы получить бензилиден-глюкопиранозид (46) (60%). Пример 34. Метил 4-O-бензоил-3-O-метил 6-деоксиглюкопиранозид (47). Бензилиденовое соединение (46) (5 г) кипятят с обратным холодильником при 80 С в смеси 3,7 г N-бромсукцинимида и 4 г карбоната бария в четыреххлористом углероде. Спустя 4 ч реакционную смесь фильтруют, и четыреххлористый углерод промывают водой, высушивают сульфатом магния, фильтруют и выпаривают,чтобы получить бромистое соединение (70%). Это бромистое соединение (4,3 г) растворяют в растворе хлористого никеля (8,6 г) в 300 мл этанола при 0 С. В этот раствор по каплям добавляют 8,6 г боргидрида натрия в 50 мл воды в течение 15 мин. Реакционную смесь кипятят с обратным холодильником при 100 С в течение 45 мин, охлаждают, фильтруют и выпаривают. Добавляют хлороформ и хлороформовый слой промывают водой, высушивают сульфатом маг 39 ния, фильтруют и выпаривают, чтобы получить 6-деоксисахар (47) (70%). Пример 35. 4-O-Бензоил-3-O-метил-1 фенилтио-6-деоксиглюкопиранозид (48). Деоксиглюкопиранозид (47) (3 г) растворяют в 50 мл дихлорметана. В этот раствор добавляют 2 г фенилтиотриметилсилана и 0,2 мл триметилсилилтрифторметансульфоната. Раствор перемешивают при комнатной температуре в течение ночи и после этого добавляют насыщенный раствор бикарбоната натрия. Дихлорметановый слой высушивают сульфатом магния, фильтруют и выпаривают. Продукт очищают хроматографически на колонке с силикагелем, элюируемой смесью этилацетата и гексана (2:8), чтобы получить соединение (48) (60%). Пример 36. 4-O-Бензоил-3-O-метил-2-Oпивалоил-1-фенилтио-6-деоксиглюкопиранозид (49). К раствору 2 г глюкопиранозида (48) в 20 мл пиридина добавляют 2 мл хлористого пивалоила. Раствор перемешивают при комнатной температуре в течение ночи, и затем добавляют воду. Водный слой экстрагируют этилацетатом и органический слой промывают 6 н. соляной кислотой. Этилацетатный слой высушивают сульфатом магния, фильтруют и выпаривают,чтобы получить пивалоиловый эфир (49) (80%). Пример 37. 4-O-Бензоил-3-O-метил-2-Oпивалоил-1-фтор-6-деоксиглюкопиранозид(50). К раствору 2 г пивалоилового эфира (49) в 100 мл дихлорметана при 0 С добавляют 1,2 гN-бромсукцинимида и 1,2 г трифторидом диэтиламиносеры. Спустя 1 ч добавляют насыщенный раствор бикарбоната натрия. Дихлорметановый слой высушивают сульфатом магния, фильтруют и выпаривают. -Фторпиранозид (50) очищают хроматографически на колонке с силикагелем, элюируемой смесью этилацетата и гексана (2:8), (выход 45%). Пример 38 иллюстрирует методику синтеза, с помощью которой можно получить соединение 3-O-[4-O-бензоил-2-фенилтиоD-цимаропиранозил]-12,14-дигидроксипрегн-5-ен-20 он (51). Пример 38. 3-O-[4-O-бензоил-2-фенилтио-D-цимаропиранозил]-12,14-дигидроксипрегн-5-ен-20-он (51). Добавляют 190 мг хлористого олова (1 ммоль) к раствору 100 мг (0,28 ммоль) 3,12,14-тригидроксипрегнан-5-ен-20-она(15) и фторцимаропиранозида (38) (210 мг, 0,56 ммоль) в осушенном диэтиловом эфире и молекулярными ситами 4 при -15 С. Реакционную смесь выдерживают при -15 С в течение 3 суток. К реакционной смеси добавляют насыщенный раствор бикарбоната натрия. Эфирный слой высушивают сульфатом магния, фильтруют и выпаривают. Продукт очищают хроматографически на колонке с силикагелем, элюируемой 40 смесью хлороформа и метанола (9,5:0,5), чтобы получить глюкозид (51) (30 мг, 15%). Примеры 39-41 иллюстрирует методику синтеза, с помощью которой можно сочетать цимарозную группу с теветозной группой. Пример 39. Теветозо-цимарозный дисахарид (53). Перемешивают 1 ч при комнатной температуре 1,5 г теветозы (50 А), 1,3 г цимарозы (40) и молекулярные сита 4 в дихлорметане. Реакционную смесь охлаждают до -15 С, и добавляют 0,8 г хлористого олова (SnCl2) и 1,1 г трифторметансульфоната серебра. Смесь перемешивают 16 ч при -15 С, после чего добавляют 0,5 мл триэтиламина. Продукт реакции фильтруют и выпаривают дихлорметан. Дисахарид(53) очищают хроматографически на колонке с силикагелем, элюируемой смесью этилацетата и гексана (2:8), выход 15%. Пример 40. Теветозо-цимарозный дисахарид (54). К раствору 200 мг дисахарида (53) в 20 мл тетрагидрофурана добавляют 0,4 мл фтористого тетрабутиламмония. Смесь перемешивают 1 ч при комнатной температуре, после чего добавляют насыщенный раствор бикарбоната натрия. Реакционную смесь экстрагируют этилацетатом и этилацетатный слой высушивают сульфатом магния, фильтруют и выпаривают. Дисахарид(54) очищают хроматографически на колонке с силикагелем, элюируемой смесью хлороформа и ацетона (9,5:0,5), выход 60%. Пример 41. Теветозо-цимарозный дисахарид (55). К раствору 80 мг дисахарида (54) в 10 мл дихлорметана добавляют 80 мкл трифторида диэтиламиносеры при 0 С. Смесь перемешивают 0,5 ч при 0 С и комнатной температуре, после чего добавляют насыщенный раствор бикарбоната натрия и еще больше дихлорметана. Дихлорметан высушивают сульфатом магния,фильтруют и выпаривают. Дисахарид (55) очищают хроматографически на колонке с силикагелем, элюируемой смесью этилацетата и гексана (1:9), выход 65%. Пример 42. Ниже представлены результаты следующих трех биологических испытаний агента, подавляющего аппетит, а именноc) тест потери аппетита от пероральной дозы; а) тест Ирвина. Целью этого теста является оценка подавляющего аппетит агента изобретения, полученного из экстракта растений, как описано выше, в соответствии с упрощенным тестом Ирвина на успокаивающее и седативное действие на животных. 41 Методика эксперимента Агент, подавляющий аппетит, экстрагируют из растительного материала способом, который описан заявителем выше, и назначают его двум из четырех групп животных (по три в каждой группе): одну группу вообще не обрабатывали, одна группа получала растворитель - диметилсульфоксид (ДМСО), одна группа получала дозу испытываемого образца, равную 50 мг/кг и одна группа получала дозу испытываемого образца 300 мг/кг. Обработку проводят посредством внутрибрюшинной инъекции и наблюдения осуществляют в конкретные моменты времени, вплоть до пяти часов после обработки. При интерпретации результатов учитывают только те симптомы, которые отличаются от наблюдаемых у животных, обработанных ДМСО. Результаты Было ясно, что растворитель ДМСО оказывал заметное воздействие на животных, особенно на механизм терморегуляции. У всех животных, обработанных растворителем, отдельно,или в сочетании с испытываемым образцом,отмечено значительное снижение температуры тела. Животные в группе малой дозировки демонстрируют пониженную расселенность в клетке и пониженную двигательную активность,как во всех других группах, включая контрольную. Отмечена апатичность в такой же степени,что и для группы, обработанной ДМСО. Спустя 15-60 мин после обработки наблюдается уменьшение дыхания. Также в большей степени, чем в группе, обработанной ДМСО, наблюдается птозис (закрывание век). Наблюдается реакция ушей, а также положительная реакция пальцев, что указывает на испуганность. После обработки температура тела упала до 32,7 С. Животные в группе высокой дозировки демонстрируют сначала пониженную расселенность в клетке и пониженную двигательную активность, как во всех других группах, но перед смертью, которая происходила приблизительно через 1 ч после обработки, они демонстрируют повышенную расселенность в клетке и двигательную активность. Спустя 30 мин после обработки происходят сильные изогнутые симметричные конвульсии. Дыхание сначала ослабляется, а перед смертью усиливается. Реакция ушей была запоздалой, и наблюдалась положительная реакция пальцев, что указывает на испуганность, также как наблюдалось у животных в группе малой дозы. После обработки температура тела упала до 30,7 С. Наблюдалась повышенная позиционная пассивность, а также пониженный тонус тела. Наблюдалось ненормальное вращение конечностей и уменьшение прочности захвата, отсутствовала болевая реакция и происходила потеря рефлекса выпрямления. 42 Обсуждение При сопоставлении с животными контрольной группы и обработанными ДМСО, животные, получившие малую дозу (50 мг/кг),продемонстрировали только уменьшение дыхания и увеличение степени закрывания век. Животные, получившие высокую дозу (300 мг/кг) испытываемого образца, реагировали весьма интенсивно, продемонстрировав конвульсии и смерть. Все другие наблюдения, проведенные с этими животными можно приписать животным,которые находятся в конвульсиях и умирают. Не были отмечены признаки, позволяющие предположить успокоительные или седативные эффекты, такие как заметное уменьшение расселения в клетках, пониженная двигательная активность и апатия в испытуемых группах,которые можно было бы приписать испытываемому образцу. Следовательно, можно сделать вывод, что испытываемый образец оказывает летальное действие на мышей при дозе 300 мг/кг и оказывает эффект подавления дыхания у мышей при дозе 50 мг/кг, введенной внутрибрюшинно с ДМСО в качестве растворителя.b) Испытание острой токсичности. Целью этого испытания является сбор информации о токсичности испытываемого образца. Методика эксперимента Растительный экстракт, полученный в соответствии с изобретением, как описано выше и обладающий активностью подавления аппетита,очищают и один испытываемый образец исследуют при введении возрастающих пероральных доз мышам. Используют двух животных в одной группе дозировки, за исключением группы наибольшей дозировки, в которой обрабатывали только одно животное. В день обработки животных обследуют на состояние здоровья и определяют массу тела. Дозы варьируются от 100 до 3028,5 мг/кг. Эти дозы рассчитывают и подмешивают в приготовленный картофельный крахмал таким образом, чтобы каждое животное получило общую дозу 0,2 мл. Животное 13 получило дозу 0,25 мл. Картофельный крахмал готовят, смешивая 20 г крахмала в небольшом объеме холодной воды, добавляют эту смесь в кипящую воду и доводят объем до 1 л суспензии дают остыть до комнатной температуры до ее дозировки. Животных первой и второй групп обрабатывают в тот же день. За ними наблюдают в течение 24 ч, и если не проявляются какие-либо признаки токсичности, обрабатывают следующую группу. Аналогичный подход применяют до тех пор, пока не обработают всех животных. Такой программы придерживаются, чтобы удостовериться, что животные не были обработаны без необходимости, когда доза острой токсичности была достигнута в предыдущей группе. 43 Животных обследуют на клинические признаки токсичности сразу же (через 1-2 ч) после обработки и ежедневно в последующем. Массу тела определяют 1 раз в неделю, причем замеряют общее потребление пищи и воды каждым животным. Выживших животных безболезненно умерщвляют посредством внутрибрюшинной инъекции пентобарбитона натрия (доступен в продаже под торговой маркой Euthanaze, CentaurR) на 14 день эксперимента. Обследование после смерти проводят на этих животных, а также на одном животном, которое умерло в ходе опыта. Собирают образцы на гистологию. Результаты Группа 1 (контрольная группа) В течение 14-суточного периода потребление пищи и воды было в нормальных пределах. Изменения массы тела также были в нормальных пределах. В образцах печени не замечены гистопатологические изменения. Группа 2 (100 мг/кг) В течение периода наблюдений не замечены клинические признаки токсичности. Потребление пищи и воды было в нормальных пределах и изменения массы тела также были в нормальных пределах. Макроскопическая патология не наблюдалась, и в образцах печени не замечены гистопатологические или морфологические изменения. Группа 3 (200 мг/кг) В течение эксперимента для животных в этой группе не замечены клинические признаки токсичности. Потребление пищи и воды было нормальным, также как и изменения массы тела. Не было обнаружено макроскопической патологии, но при обследовании печени обнаружены гистопатологические изменения. Набухание гепатоцитов было мягким (в виде замутнения) для животного 6, но умеренным для животного 5. В гепатоцитах животного 5 также происходит умеренное водянистое перерождение. Группа 4 (400 мг/кг) В течение периода наблюдений не замечены клинические признаки токсичности, а в ходе посмертного исследования не наблюдалась макроскопическая патология. При гистологии наблюдали умеренное набухание и мягкое водянистое перерождение гепатоцитов. Потребление пищи и воды и изменение массы тела у животного 7 было нормальным. Животное 8 потребляло в сумме почти вдвое больше пищи, чем животное 7 (144,6 г и 73,9 г соответственно), но увеличение массы тела составило только 0,81 г по сравнению с 2,7 г. Группа 5 (800 мг/кг) Одно животное ( 10) умерло через три дня после нагрузки, не обнаружив никак специфических признаков. Другое животное ( 9) выжило в течение всего периода наблюдений без каких-либо признаков токсичности. Потребление воды выжившим животным было нор 002885 44 мальным (42,42 мл), хотя потребление пищи было высоким (134,2 г). Масса тела увеличилась на 2,85 г, что является самым высоким приростом для всех животных в этом эксперименте. При посмертном исследовании животного 10, которое умерло вскоре после получения пероральной дозы, найдено, что легкие были переполнены кровью. Отсутствовала реакции на постороннее тело, что могло бы указать на ингаляцию испытываемого образца. Для животного 9 не наблюдалась макроскопическая патология. У животного 10 отмечено мягкое образование цитоплазматических вакуолей (водянистое перерождение), однако оно было умеренным у животного 9. У обоих животных железистый цитоплазматический внешний вид печени был классифицирован как умеренный. Группа 6 (1600 мг/кг) В течение эксперимента ни у одного из животных не замечены клинические признаки токсичности. При посмертном исследовании не наблюдалась макроскопическая патология, но при гистопатологическом исследовании наблюдались умеренное перерождение печени у животного 11. У животного 12 обнаружено умеренное мутное набухание и мягкое водянистое перерождение гепатоцитов. Потребление пищи и воды, как и увеличение массы тела было нормальным на протяжении эксперимента. Группа 7 (3028,5 мг/кг) Только одно животное обработали такой дозой. Для этого животного в течение периода наблюдений не замечены какие-либо признаки токсичности и не наблюдалась макроскопическая патология. При гистопатологическом исследовании наблюдали умеренное мутное набухание и водянистое перерождение гепатоцитов. У этого животного отмечена потеря массы тела за период наблюдений (-0,82 г), но потребление пищи и воды было нормальным. Обсуждение Так как в каждой группе доз было использовано очень малое число животных, сделать какие-либо выводы затруднительно. Тот факт,что только одно животное умерло при низком уровне дозы, без каких-либо наблюдаемых симптомов, может указывать на то, что смерть не была связана с испытываемым образцом, а вызвана стрессом в ходе обработки и/или после нее. В группах с повышенной дозировкой умершие животные отсутствовали и не замечены какие-либо признаки токсичности, что дополнительно подтверждает сделанное предположение. Наблюдаемое для животного 8 повышенное потребление пищи можно было бы приписать избыточному разбрасыванию пищи, что нашло отражение в небольшом приросте массы тела. Необходимо иметь в виду, что все животные в этом опыте были обработаны только однажды и что маловероятно, чтобы агент, подавляющий аппетит, оказывал заметное влияние на 45 потребление или пищи, или воды, или на массу тела в течение 14-суточного периода, как в случае этого эксперимента. При гистопатологическом исследовании образцов печени стало ясно, что патологические изменения связаны с величиной дозы: у животных, получивших повышенные дозы, наблюдались обширные изменения. Наблюдаемая патология по своему характеру не была метаболической, а возможно была вызвана испытываемым образцом. Эти изменения были только дегенеративными и поэтому обратимыми. Не наблюдались какие-либо необратимые изменения клеток печени. Поэтому можно сделать вывод, что умерло только одно животное, получившее пониженную дозу (800 мг/кг), однако эта смерть, повидимому, не была связана с испытываемым образцом. Ни у одного из других животных в любой из групп дозировок не наблюдались какие-либо признаки токсичности в течение 14 суточного периода наблюдений после обработки, и в результате обработки больше не умерло ни одного животного. Единственная пероральная доза испытываемого образца вызвала обратимые изменения клеток печени, связанные с дозой. с) Тест потери аппетита от пероральной дозы. Целью этого испытания было определение активности растительного экстракта, полученного в соответствии с изобретением, и минимальной эффективной дозы; и в то же время исследование любых возможных побочных действий, таких как подавление дыхания, как установлено в тесте Ирвина (см. выше). Методика эксперимента Животные были распределены на группы обработки, используя таблицу случайных чисел. Каждая группа обработки состояла из 3 животных, а в контрольной группе было 6 животных. Испытываемый образец дозировали молодым самкам крыс с массой тела 100-150 г при акклиматизации в течение трех последующих дней. Животных идентифицировали с помощью металлической ушной бирки, опознование облегчали отметинами марганцовки (KMnO4) на шкурке. Животных выдерживали индивидуально в стандартных поликарбонатных клетках для грызунов, причем вода и порошкообразные продажные таблетки для грызунов были доступны по желанию. Потребление воды и пищи измеряли и рассчитывали в течение каждого дня. Для определения минимальной эффективной дозы были испытаны пять доз. Обработку осуществляли посредством орального зонда,причем испытываемый образец суспендировали в картофельном крахмале. Испытываемым соединением было соединение (1) - белый гранулированный порошок,полученный из экстракта растительного материала в соответствии с изобретением; измерен 002885 46 ное количество испытываемого образца смешивали с препаратом картофельного крахмала и дозировали. Смешивание с картофельным крахмалом осуществляли непосредственно перед каждодневным дозированием. Эти суспензии тщательно вымешивали с использованием аппарата Vortex до извлечение дозируемого объема для каждого животного. Был испытан ряд из пяти доз, причем контрольная группа получала только вещество носителя. Дозы выбирали на основе эффектов,наблюдаемых в описанном выше тесте Ирвина,причем они составляли: Группа 1: 0,00 мг/кг (контрольная группа); Группа 2: 6,25 мг/кг; Группа 3: 12,50 мг/кг; Группа 4: 25,00 мг/кг; Группа 5: 37,50 мг/кг; Группа 6: 50,00 мг/кг; Результаты Обработка не влияет на здоровье животных в течение исследуемого периода. Во всех группах дозировки для животных, обработанных испытываемым образцом, наблюдается существенно пониженный прирост средней массы тела в течение исследуемого периода, а в трех из пяти групп обработки животные фактически теряли массу тела. Среднее потребление пищи было пониженным для всех групп обработки в течение исследуемого периода. У животных из группы повышенной дозировки наблюдается повышенное потребление воды. Во всех группах дозировки ни у одного из животных не наблюдается влияния на интенсивность дыхания. При посмертном исследовании животные во всех группах дозировки имели хрупкую печень, однако макроскопическая патология не наблюдалась. Обсуждение Данные, отобранные в течение периода акклиматизации, подтверждают, что все животные, вовлеченные в этот эксперимент, были здоровы, причем прирост массы тела у различных животных был сопоставимым. Уменьшение прироста массы тела, а у некоторых животных даже потеря массы, в сочетании с пониженным потреблением пищи, убедительно свидетельствует о подавлении центра аппетита. Уменьшение потребления пищи и уменьшение прироста массы тела наблюдали в эксперименте даже в группе с наименьшей дозировкой (6,25 мг/кг). Фактически потеря массы тела наблюдалась в эксперименте в группе с дозировкой 12,50 мг/кг. Важно отметить, что во всех группах обработки наблюдалось повышенное потребление воды при снижении потребления пищи (фиг. 2). Это может быть вызвано диуретическим эффек 47 том испытываемого образца или стимулированием центров жажды в мозге. Факт отсутствия подавления дыхания, который наблюдали при испытаниях острой токсичности, на которые ссылались выше при внутрибрюшинном введении дозы, рассматривается как положительный эффект. Это может быть вызвано пониженным поглощением из желудочно-кишечного тракта, с последующей пониженной биологической доступностью. Однако биологическая доступность испытанных оральных доз была достаточной для испытываемого образца, чтобы обеспечить его эффективность. Небольшое снижение дыхательной активности, спустя 1 ч после обработки, в большинстве групп может быть приписано заполнению желудка объемом дозы и последующей пассивностью животных. Наблюдаемая в группах обработки животных хрупкая печень может быть обусловлена изменением энергии обмена веществ, вторичным по отношению к пониженному потреблению пищи, вызывающим повышенный жировой обмен веществ и перегрузку печени. Если это действительно так, то эти изменения можно было бы рассматривать как переходные, которые могли бы восстановиться со временем, после достижения стационарного состояния или после выведения испытываемого образца. Возможное влияние на печень также необходимо дополнительно исследовать. Поскольку основной целью этого исследования было отборочное испытание, использовали небольшие группы испытуемых животных. Это затрудняет статистическую интерпретацию данных, особенно когда реакция отдельных животных является совершенно различной. Однако эти данные указывают на то, что испытываемый образец обладает активностью подавления аппетита, даже при наименьшей испытываемой дозе (6,25 мг/кг). При всех испытываемых дозах не обнаружены какие-либо клинические признаки подавления дыхания. Пример 43. Собранные растения из рода Hoodia, полученные либо из естественной среды обитания,либо по программе культивации, сначала хранят при 4 С, максимум в течение 48 ч. Растения промывают водопроводной водой и после этого нарезают на кусочки 1 см. Все нарезанные кусочки объединяют и затем выжимают на гидравлическом прессе при давлении 300 бар (30 МПа) минимум в течение 0,5 ч на каждую загрузку. Отдельно собирают сок, выделившийся при прессовании растений. Этот сок хранят при-18 С, до тех пор пока не потребуется его дальнейшая обработка. Этот сок сушат распылением в подходящих условиях, чтобы получить сыпучий порошок. Содержание влаги в этом порошке предпочтительно составляет меньше, чем 5% после сушки распылением, и в случае необходимости, 002885 48 его дополнительно сушат в вакуумном шкафу или используют сушку в псевдоожиженном слое. Как сок, так и материал, высушенный распылением, продемонстрировали эффективность в качестве агента, подавляющего аппетит, в биологических испытаниях на крысах. Экспериментальная часть Растения Hoodia gordonii (50 кг) промывают водопроводной водой и после этого нарезают ломтиками размером 1 см. Затем ломтики растений выжимают на гидравлическом прессе при давлении 300 бар (30 МПа) минимум в течение 0,5 ч на каждую загрузку. Собирают сок и определяют, что его масса составляет 10 кг, когда используют растения Hoodia gordonii, полученные из естественной среды обитания, и 20 кг, когда используют растения Hoodia gordonii,выращенные по программе культивации. Сок(500 г) сушат распылением, используя следующие условия: Скорость потока 2,85 мл/мин Температура на входе 110 С Температура на выходе 70 С Температура в камере 78 С Полученный при сушке распылением порошок представлял собой сыпучий порошок (22 г), с содержанием влаги 6,9%. Порошок, высушенный распылением, анализировали, используя метод жидкофазной хроматографии высокого разрешения (ЖХВР),чтобы определить концентрацию активного компонента. Найдено, что концентрация активного компонента составляет 13 г/кг порошка,высушенного распылением. Метод анализа ЖХВР Элюент Ацетонитрил: вода (7:3),изократный Колонка С обращенной фазой С-18 Поглощение УФ при 225 нм Скорость потока 1 мл/мин Объем вводимой пробы 10 мкл Порошок (10 мг), высушенный распылением, растворяют в 0,5 мл воды и 0,5 мл ацетонитрила. Вводят 10 мкл этого раствора в колонку ЖХВР и определяют концентрацию активного соединения (1), используя стандартную кривую,которая была построена по данным для чистого соединения (1). Пример 44. Ниже представлены результаты изучения,посвященного оценке возможного эффекта соединения (1) для подавления аппетита у крыс. В последующем тексте испытываемые образцы представляют собой чистый сок (образец 1), сок,высушенный распылением (образец 2), и активнаую часть (образец 3). Образцы 1 и 2 представляют собой сок и соответственно сок, высушенный распылением,как описано выше в примере 43. Образец 3 представлял собой экстрагированное растворителем соединение (1), имеющее чистоту 95%. Каждый из образцов 1-3 назначают самцам крыс Wistar в виде единственной пероральной дозы. Две дополнительные контрольные группы получали носитель (дистиллированная вода или ДМСО). В качестве относительного стандарта был включен фенфлурамин (7,5 мг/кг), назначаемый перорально. Образец 1 (чистый сок) при оральном введении дает снижение потребления пищи, зависящее от дозы, которое было статистически значимым при дозах 1600 мг/кг и выше при сопоставлении с контрольными животными, обработанными носителем. Также было отмечено сопутствующее уменьшение массы тела (или скорости роста). В день введения дозы было отмечено статистически значимое увеличение потребления воды через 3 ч после дозы (6400 и 10000 мг/кг) и спустя 6 ч после дозы (10000 мг/кг). Между 24 и 48 ч после нагрузки было отмечено статистически значимое уменьшение потребления воды при дозах 3200 мг/кг и выше. Образец 2 (сок, высушенный распылением) при оральном введении дозы 76 мг/кг также давал статистически значимое снижение потребления пищи и уменьшение массы тела при сопоставлении с животными, обработанными носителем. Не было отмечено какого-либо статистически значимого влияния на потребление воды. Образец 3 (активная часть) при оральном введении дозы 5,0 мг/кг давал статистически значимое снижение потребления пищи. Не было отмечено какого-либо статистически значимого влияния активной части на массу тела, хотя при изучении данных было выявлено небольшая задержка в росте при сопоставлении с контрольными животными, обработанными носителем. Не было отмечено какого-либо статистически значимого влияния на потребление воды. Относительный стандарт, фенфлурамин(7,5 мг/кг) дает статистически значимое снижение потребления пищи спустя 6 и 24 ч после дозы, при сопоставлении с соответствующими контрольными животными, обработанными носителем. Не было отмечено какого-либо статистически значимого влияния на потребление воды или массу тела. Не было отмечено какого-либо влияния на печень, связанного с обработкой. Идентичность Внешний вид Условия хранения Чистота Носитель Испытываемое вещество Образец 1 Образец 2 (сок, высу(чистый шенный распылением) сок) Коричне- Порошок вая жидкость-20 С в Комнатная температутемноте ра в темноте Чистый Чистый сок, высушенсок ный распылением Дистилли- Дистиллированная рованная вода вода 50 Методика эксперимента Для исследования использовали пятьдесят пять самцов крыс Wistar. Вес тела, потребление пищи (вес контейнера с едой) и потребление воды (вес бутылки) регистрировали ежедневно в одно и тоже время каждый день со дня поступления до окончания исследования. В первый день крысы получали одну пероральную (через зонд) дозу согласно следующей таблице: Группа 1 2 3 4 5 6 7 Группы 1-8 получали дозу постоянного объема 10 мл/кг и группы 9-12 обрабатывали с использованием дозы объемом 1 мл/кг. Потребление пищи и воды измеряли через 1, 3 и 6 ч в первый день после дозирования. После замеров на 8 день животных умерщвляли посредством асфиксии диоксидом углерода, их печень извлекали и помещали в 10% забуференный раствор формалина перед гистологией. Были взяты парафиновые срезы каждой печени толщиной 4-5 мкм и окрашены гематоксилином и эозином. Дополнительные срезы толщиной 12 мкм были сделаны на криостате и жировую ткань окрашивали красным 0 маслом(ORO). Анализ данных Замеры последозового потребления пищи и воды и массы тела для каждого значения времени для животных, обработанных Р 57, сравнивали с показателями для соответствующей, подобным образом обработанной носителем контрольной группы, используя анализ изменений с последующим анализом по Вильямсу для сравнения с контрольными животными. Показатели для животных, обработанных фенфлурамином, сравнивали с результатами для обработанной носителем группы с использованием критерия Стьюдента. Результаты Результаты суммированы в таблицах. Образец 1 (чистый сок), назначенный перорально, приводил к заметному, соответствующему дозе, снижению суточного потребления пищи. Длительность и величина этого уменьшения зависела от дозы. Через 24 ч после дозы образец 1 (чистый сок) приводил к статистически значимым уменьшениям потребления 51 пищи при дозах 1600 мг/кг и выше по сравнению с обработанными носителем контрольными животными. Самая высокая доза образца 1 (сок)(10000 мг/кг) вызывала статистически значимые снижения суточного потребления пищи в течение 5 дней после дозы. Образец 2 (высушенный распылением сок) и образец 3 (активная часть) приводили к заметным и статистически значимым уменьшениям потребления пищи при пероральных дозах 76 и 5,0 мг/кг соответственно. В обоих случаях действие сохранялось в течение 48 ч после нагрузки. Введение сравнительного эталона фенфлурамин (7,5 мг/кг, перорально) приводило к статистически значимым сокращениям потребления пищи животными через 6 и 24 ч после нагрузки по сравнению с соответствующей обработанной носителем контрольной группой(группа 12). Введение образца 2 (высушенный распылением сок) и образца 3 (активная часть) не вызывало никакого заметного, зависящего от дозы влияния на потребление воды. В день введения чистого сока наблюдали статистически значимое увеличению потребления воды через 3 ч после дозы (6400 и 10000 мг/кг) и 6 ч после дозы (10000 мг/кг). Однако через два дня после введения, статистически значимое уменьшение потребления воды было зарегистрировано у животных, получающих образец 1 (сок) в количестве 3200, 6400 и 10000 мг/кг. Однако эти изменения не зависели четко от дозы и имели место только между 1 и 2 днями после ввода дозы. Поэтому биологическое значение этих результатов остатся неясным. Введение образца 1 (чистый сок) приводил к связанным с дозой, статистически значимым эффектам на массу тела животных по сравнению с контрольной группой животных, обработанных носителем (группа 1). Пероральное назначение (в дозах 3200 мг/кг и выше) образца 1(чистый сок) приводило к статистически значимому уменьшению массы тела или пониженной скорости роста животных, по сравнению с животными, обработанными носителем. Эти эффекты были статистически значимыми, начиная с 48 ч после нагрузки и до конца изучения. Пероральное назначение образца 2 (высушенный распылением сок) в количестве 76 мг/кг, также приводило к статистически значимому подавлению роста животных, по сравнению с контрольной группой, обработанной носителем (группа 1). Эти результаты были статистически значимыми между днями 3 (48 ч после нагрузки) и 5 включительно. Несмотря на то, что образец 3 (активная часть), по-видимому, подавляет рост животных при самой высокой дозе (5,0 мг/кг), по сравнению с соответствующей контрольной группой,обработанной носителем (группа 12), этот результат не был статистически значимым. 52 Фенфлурамин (7,5 мг/кг) не вызывал заметного или статистически значимого действия на потребление воды или на массу тела животных по сравнению с контрольной группой, обработанной носителем (группа 12). Не были зарегистрированы никакие воздействия на печень, связанные с обработкой. Таблица 1a. Действие перорального назначения на потребление пищи крысами (суточные данные, предшествующие дозе)m - стандартные отклонения Таблица 1b. Действие перорального назначения на потребление пищи крысами (суточные данные после дозы) 53 Таблица 2 а Действие перорального назначения на потребление воды крысами (суточные данные, предшествующие дозе). 54 Таблица 3 а. Действие перорального назначения на массу тела крысы (суточные данные, предшествующие дозе)m - стандартные отклонения. Таблица 2b Действие перорального назначения на потребление воды крысами (суточные данные после дозы) Таблица 3b. Действие перорального назначения на массу тела крысы (суточные данные, предшествующие дозе) Гистопатологический отчет Гистологическое исследование ограничивали печенью. Никаких связанных с обработкой изменений не было отмечено для образца 1(жидкость), образца 2 (сок, высушенный распылением), образца 3 (активная часть), для фенфлураминовой или диметилсульфоксидной контрольной группы. Зарегистрированные данные по сфере действия были подобны в контрольной и обработанной группах. Таблица. Краткое изложение микроскопической патологии Группа 1 Группа 2 Группа 3 Группа 4 Группа 5 Группа 6 Пол: самцы 0 мг/кг 800 мг/кг 1600 мг/кг 3200 мг/кг 6400 мг/кг 10000 мг/кг Самцы на изучении 5 4 5 5 5 5 Животные законченные 5 4 5 5 5 5 Печень 5 4 5 5 5 5 Исследовано Аномалий не найдено 0 0 1 2 3 3 Паренхимные воспалительные очаги клеток 0 1 0 0 0 3ORO) Исследовано Аномалий не найдено 2 3 2 4 3 3 Жир гепатоцита центродольчатый (сум 3 1 2 1 2 2 марно) Минимально 3 1 2 1 2 2 Жир гепатоцитаперипортальный (сум 0 0 1 0 0 0 марно) Минимально 0 0 1 0 0 0 Таблица (продолжение) Группа 7 Группа 8 Группа 9 Группа 10 Группа 11 Группа 12 Пол: самцы 38 мг/кг 76 мг/кг 2,5 мг/кг 5 мг/кг 7,5 мг/кг 0 мг/кг Самцы на изучении 5 5 5 5 3 3 Животные законченные 5 5 5 5 3 3 Печень 5 5 5 5 3 3 Исследовано Аномалий не найдено 2 2 0 1 0 2 Паренхимные воспалительные очаги клеток 0 0 0 0 0 1ORO) Исследовано Аномалии не найдено Жир гепатоцитацентродольчатый (суммарно) Минимально Пример 45. Дальнейшие биологические испытания, в которых использовали те же опытные образцы, как описано в примере 44,приведены ниже. Животные в этом исследовании принимали ограниченную диету, т.е. животные только получали пищу только между 12:00 и 3:00 часами пополудни ежедневно. Это отличается от всех других биологических испытаний, проводимых таким образом, что пища была доступна крысам по их желанию. Животных акклиматизировали в течение семидневного периода (дни от -7 до -1), причем нагрузка имела место от дня 0 до дня 6 в 9:00 утра перорально. Восстановительный период продолжался от дня 7 до дня 13. Дозировка групп описана в таблице 1 ниже. Необходимо отметить, что действительная контрольная группа маркирована как группа 09. Группа 5 является контрольной группой, которая имела диету, эквивалентную диете группы 4. Задачей этой группы было оценить эффект, который оказывает на жизнь животных ограниченная диета. Результаты Результаты, полученные в ходе исследования, показали, что период акклиматизации был слишком коротким. Крысы питаются, главным образом, в течение ночи, и внезапный переход к ограниченному доступу к пище в течение трех часов дневного времени привл к низкому суточному потреблению. Суточное потребление пищи было ещ повышено в большинстве групп в конце акклиматизационного периода, когда началась нагрузка опытными образцами. В результате этого испытуемые материалы по существу не оказали действия на потребление пищи крысами в течение периода дозирования. Средние массы тела для различных групп от дня -7 до -1 и дней от 0 до 6 показаны в таблицах D1 и D2. Действие различных дозировок сока и сока, высушенного распылением, показано на прилагаемых графиках как процент изменения массы тела в течение от нулевого до седьмого дня (фиг. 5) и процент изменения массы тела в течение от -7 до 7 дня (фиг. 6). Потеря массы тела четко связана с дозой, особенно при более высоких дозировках. Гистопатологическая проверка печени не показала никакой существенной патологии в группах, получающих испытываемые образцы. Пища Потребление пищи измеряли ежедневно, в течение периода акклиматизации и в ходе исследования. Пища была доступна в течение 3 часового периода кормления ежедневно, начиная с 12:00 и заканчивая 15:00. В течение остального времени животные голодали. Животные в группе 5 получали измеренное количество пищи в день 1, эквивалентное среднему потреблению пищи группой 4 в день 0. Этой модели нормированной подачи питания для группы 5,определенной как среднее потребление пищи группой 4 в течение предыдущего дня, следовали в течение дней 1-7. Вода Воду подавали в стандартных контейнерах. Вода (Magalies Water Board Tap Water),пригодная для потребления человеком, была доступна по желанию (без ограничений). Расход воды измеряли один раз ежедневно, в одно и тоже время каждый день, после определения потребления пищи. Акклиматизация Животные были акклиматизированы в течение семи дней перед началом изучения, в течение этого времени потребление пищи и расход воды определяли, как описано выше. План исследования и методики Таблица 1. План исследования Груп Испы- Номера Доза Испытываемые попа тание зиции 01 001-006 100 мг/кг Замороженный сок 6 02 007-012 400 мг/кг Замороженный сок 6 03 013-018 1600 мг/кг Замороженный сок 6 04 019-024 3200 мг/кг Замороженный сок 6 05 025-030 Контрольная Elga Option 4, очи 6 щенная вода 06 031-036 2,2 мг/кг Сок, высушенный 6 распылением 07 037-042 8,8 мг/кг Сок, высушенный 6 распылением 08 043-048 35 мг/кг Сок, высушенный 6 распылением 09 049-054 Контрольная Elga Option 4, очи 6 щенная вода Способ назначения Испытываемые образцы вводили ежедневно в течение семи дней с помощью внутрижелудочной иглы. Животные голодали в течение 18 часов перед введением образца (начиная с 9:00). Длительность обработки Животных обрабатывали в течение семи последовательных дней (от дня 0 до дня 6). Троих животных из каждой группы умерщвляли через 24 ч после последней дозы (день 7). Оставшихся трех животных умерщвляли через 7 дней после последней обработки (день 13). Этой методики придерживались для всех групп, за исключением группы 5, в которой трое животных были умерщвлены через 24 ч после последнего контрольного кормления (день 8), а оставшиеся трое животных были умерщвлены через 7 дней после последней обработки (день 13). Масса тела Массу тела определяли ежедневно, приблизительно в то же самое время каждый день в течение исследования, включая период акклиматизации. Эвтаназия Трое животных каждой группы были умерщвлены через 24 часа после последнего дозирования (день 7). Оставшиеся трое животных были умерщвлены через 7 дней после последней обработки. 60 Этой методики придерживались для всех групп за исключением группы 5, в которой трое животных были умерщвлены через 24 ч после последнего нормированного кормления (день 8), а оставшиеся три животных были умерщвлены через 7 дней после последней обработки (день 13). Животные были подвергнуты эвтаназии в конце периода изучения с помощью газа СО. Офтальмоскопическое обследование Офтальмоскопическое обследование с использованием офтальмоскопа было выполнено до первого назначения испытуемого материала и при завершении, для всех животных во всех группах. Макроскопическая патология Полное патологоанатомическое исследование было выполнено на каждом животном,которое было подвергнуто эвтаназии в конце периода изучения. Гистопатология Гистопатологическую экспертизу проводили с печенью каждого животного. Таблица D1. Средняя масса тел (групповая) за неделю
МПК / Метки
МПК: A61K 35/78, C07J 17/00
Метки: растительного, средства, подавления, аппетита, происхождения
Код ссылки
<a href="https://eas.patents.su/30-2885-sredstva-rastitelnogo-proishozhdeniya-dlya-podavleniya-appetita.html" rel="bookmark" title="База патентов Евразийского Союза">Средства растительного происхождения для подавления аппетита</a>
Предыдущий патент: Адгезив на основе органических растворителей (варианты)
Следующий патент: Система пересылки файлов
Случайный патент: Способ извлечения металлов из отработанных катализаторов