Конъюгаты, которые можно использовать при лечении рака предстательной железы
Номер патента: 2745
Опубликовано: 29.08.2002
Авторы: Брэди Стефен Ф., Фенг Донг-Мей, Гарски Виктор М.
Формула / Реферат
1. Конъюгат формулы I
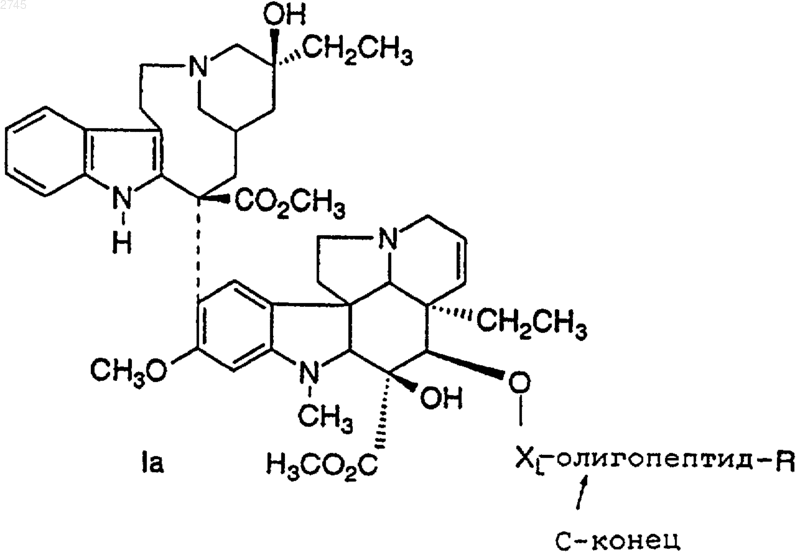
где олигопептид представляет собой олигопептид, который специфически распознается свободным специфическим агентом предстательной железы (PSA) и способен протеолитически расщепляться ферментативной активностью свободного специфического антигена предстательной железы,
XL выбран из связи;
R выбран из
a) водорода;
b) -(C=O)R1a;
c)

d)
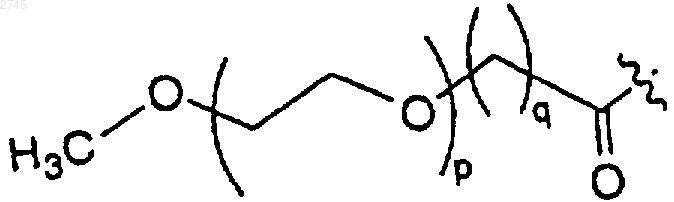
е)
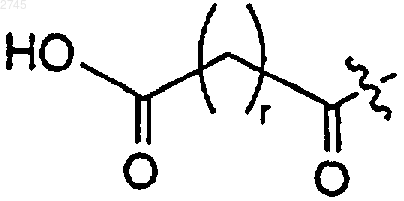
f) этоксискварата; и
g) котининила;
R1 и R2 независимо выбраны из водорода, ОН, C1-C6алкила, C1-C6алкокси, C1-C6аралкила и арила;
R1a представляет собой C1-C6алкил, гидроксилированный С3-С8циклоалкил, полигидроксилированный С3-С8циклоалкил, гидроксилированный арил, полигидроксилированный арил или арил;
R9 представляет собой водород, (C1-С3алкил)-СО или хлорзамещенный (C1-С3алкил)-СО;
n равно 1, 2, 3 или 4;
р равно нулю или целому числу от 1 до 100;
q равно 0 или 1 при условии, что если р равно нулю, то q равно 1;
r равно 1, 2 или 3;
t равно 3 или 4;
или его фармацевтически приемлемая соль, или оптический изомер.
2. Конъюгат по п.1, отличающийся тем, что олигопептид представляет собой олигомер, который включает аминокислотную последовательность, выбранную из
a) AsnLysIleSerTyrGln|Ser (SEQ.ID.NO. 1),
b) LysIleSerTyrGln|Ser (SEQ.ID.NO. 2),
c) AsnLysIleSerTyrTyr|Ser (SEQ.ID.NO. 3),
d) AsnLysAlaSerTyrGln|Ser (SEQ.ID.NO. 4),
e) SerTyrGln|SerSer (SEQ.ID.NO. 5),
f) LysTyrGln|SerSer (SEQ.ID.NO. 6),
g) hArgTyrGln|SerSer (SEQ.ID.NO. 7),
h) hArgChaGln|SerSer (SEQ.ID.NO. 8),
i) TyrGln|SerSer (SEQ.ID.NO. 9),
j) TyrGln|SerLeu (SEQ.ID.NO. 10),
k) TyrGln|SerNle (SEQ.ID.NO. 11),
l) ChgGln|SerLeu (SEQ.ID.NO. 12),
m) ChgGln|SerNle (SEQ.ID.NO. 13),
n) SerTyrGln|Ser (SEQ.ID.NO. 14),
о) SerChgGln|Ser (SEQ.ID.NO. 15),
p) SerTyrGln|SerVal (SEQ.ID.NO. 16),
q) SerChgGln|SerVal (SEQ.ID.NO. 17),
r) SerTyrGln|SerLeu (SEQ.ID.NO. 18),
s) SerChgGln|SerLeu (SEQ.ID.NO. 19),
t) HaaXaaSerTyrGln|Ser (SEQ.ID.NO. 20),
u) HaaXaaLysTyrGln|Ser (SEQ.ID.NO. 21),
v) HaaXaahArgTyrGln|Ser (SEQ.ID.NO. 22),
w) HaaXaahArgChaGln|Ser (SEQ.ID.NO. 23),
x) HaaTyrGln|Ser (SEQ.ID.NO. 24),
у) HaaXaaSerChgGln|Ser (SEQ.ID.NO. 25),
z) HaaChgGln|Ser (SEQ.ID.NO. 26),
где Наа представляет собой циклическую аминокислоту, замещенную гидрофильной частью, hArg представляет собой гомоаргинин, Хаа представляет собой любую аминокислоту, Cha представляет собой циклогексилаланин и Chg представляет собой циклогексилглицин;
или его оптический изомер.
3. Конъюгат по п.2, отличающийся тем, что Наа представляет собой транс-4-гидрокси-L-пролин или его оптический изомер.
4. Конъюгат по п.1, отличающийся тем, что олигопептид-R выбран из
Ac-4-транс-L-HypSerSerChgGlnSerSerPro; (SEQ.ID.NO. 84)
Ac-4-транс-L-HypSerSerChgGlnSerGly; (SEQ.ID.NO. 85)
Ac-4-транс-L-HypSerSerChgGlnSerSerSar; (SEQ.ID.NO. 86)
Ac-4-транс-L-Hyp-Ser-Ser-Chg-Gln-Ser-Ser-Pro; (SEQ.ID.NO. 87)
Ac-4-транс-L-Hyp-Ser-Ser-Chg-Gln-SerVal; (SEQ.ID.NO. 88)
Ac-4-транс-L-Hyp-Ser-Ser-Chg-Gln-Ser-Ser-4-транс-L-Hyp; (SEQ.ID.NO. 89)
Ac-Abu-Ser-Ser-Chg-Gln-Ser-Pro; (SEQ.ID.NO. 90)
гидроксиацетилАbu-Ser-Ser-Chg-Gln-Ser-Pro; (SEQ.ID.NO. 91)
ацетил 3-PALSer-Ser-Chg-Gln-Ser-Ser-Pro; (SEQ.ID.NO. 92)
Ac-4-транс-L-Hyp-Ser-Ser-Chg-Gln-Ser-Val; (SEQ.ID.NO. 93)
Ac-4-транс-L-Hyp-Ser-Ser-Chg-Gln-Ser-Leu; (SEQ.ID.NO. 94)
Ac-4-транс-L-HypSerSerChgGlnSerSer4-trans-L-Hyp; (SEQ.ID.NO. 95)
Ac-4-транс-L-HypSerSerChgGlnSerPro; (SEQ.ID.NO. 96)
Ac-SerSerChgGlnSerGly; (SEQ.ID.NO. 98)
Ac-SerSerChgGlnSerSer-4-транс-L-Hyp; (SEQ.ID.NO. 99)
Ac-SerSerChgGlnSerSerPro; (SEQ.ID.NO. 100)
Ac-4-транс-L-HypSerSerChgGlnSerAla; (SEQ.ID.NO. 103)
Ac-4-транс-L-HypSerSerChgGlnSerChg; (SEQ.ID.NO. 104)
Ac-4-транс-L-HypSerSerChgGlnSerSerSar; (SEQ.ID.NO. 105)
Ac-SerSerChgGlnSerSerHyp; (SEQ.ID.NO. 106)
Ac-4-транс-L-HypSerSerChgGlnSerSerPro; (SEQ.ID.NO. 107)
Ac-AbuSerSerChgGlnSer(dSer)Pro; (SEQ.ID.NO. 108)
Ac-AbuSerSerChgGlnSerSerPro; (SEQ.ID.NO. 109)
Ac-SerSerChgGlnSerSerPro; (SEQ.ID.NO. 111)
Ac-4-транс-L-HypSerSerChg(dGln)SerSerPro; (SEQ.ID.NO. 114)
Ac-4-транс-L-HypSerSerChg(dGln)(dSer)SerPro; (SEQ.ID.NO. 115)
Ac-SerChgGln-SerSerPro; (SEQ.ID.NO. 116)
Ac-SerChgGlnSerSer-4-транс-L-Hyp; (SEQ.ID.NO. 117)
Ac-SerChgGlnSerSerSar; (SEQ.ID.NO. 118)
Ac-SerChgGlnSerSerAibPro; (SEQ.ID.NO. 119)
Ac-SerChgGlnSerSerN-Me-Ala; (SEQ.ID.NO. 120)
Ac-4-транс-L-HypSerSerChgGlnSerSerPip; (SEQ.ID.NO. 124)
Ac-SerChgGlnSerSerN-Me-dA; (SEQ.ID.NO. 125)
где Abu представляет собой аминомасляную кислоту, 4-транс-L-4-Нур представляет собой 4-транс-L-4-гидроксипролин, Pip представляет собой пипеколиновую кислоту, 3,4-DiHyp представляет собой 3,4-дигидроксипролин, 3-PAL представляет собой 3-пиридилаланин, Sar представляет собой саркозин и Chg представляет собой циклогексилглицин.
5. Конъюгат по n.1, который выбран из
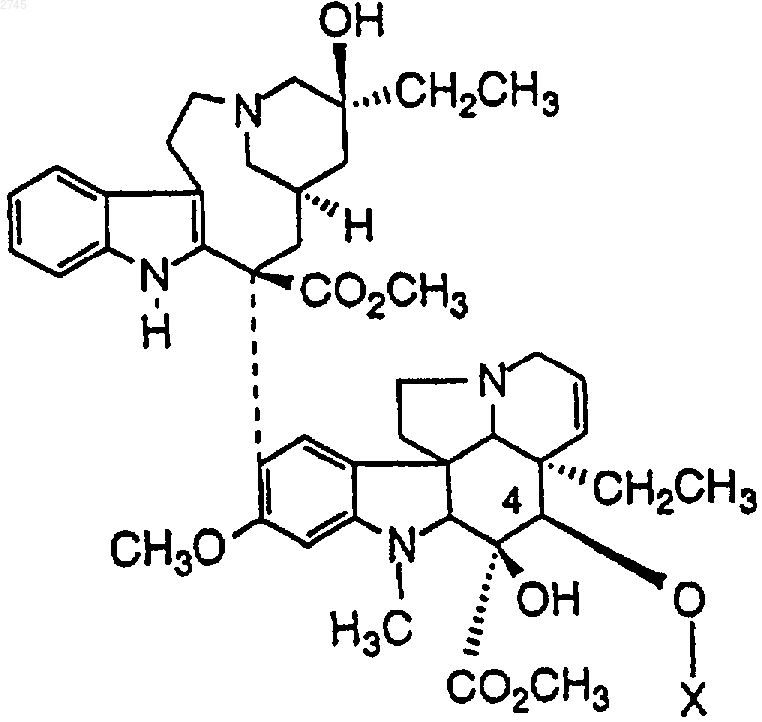
где Х представляет собой

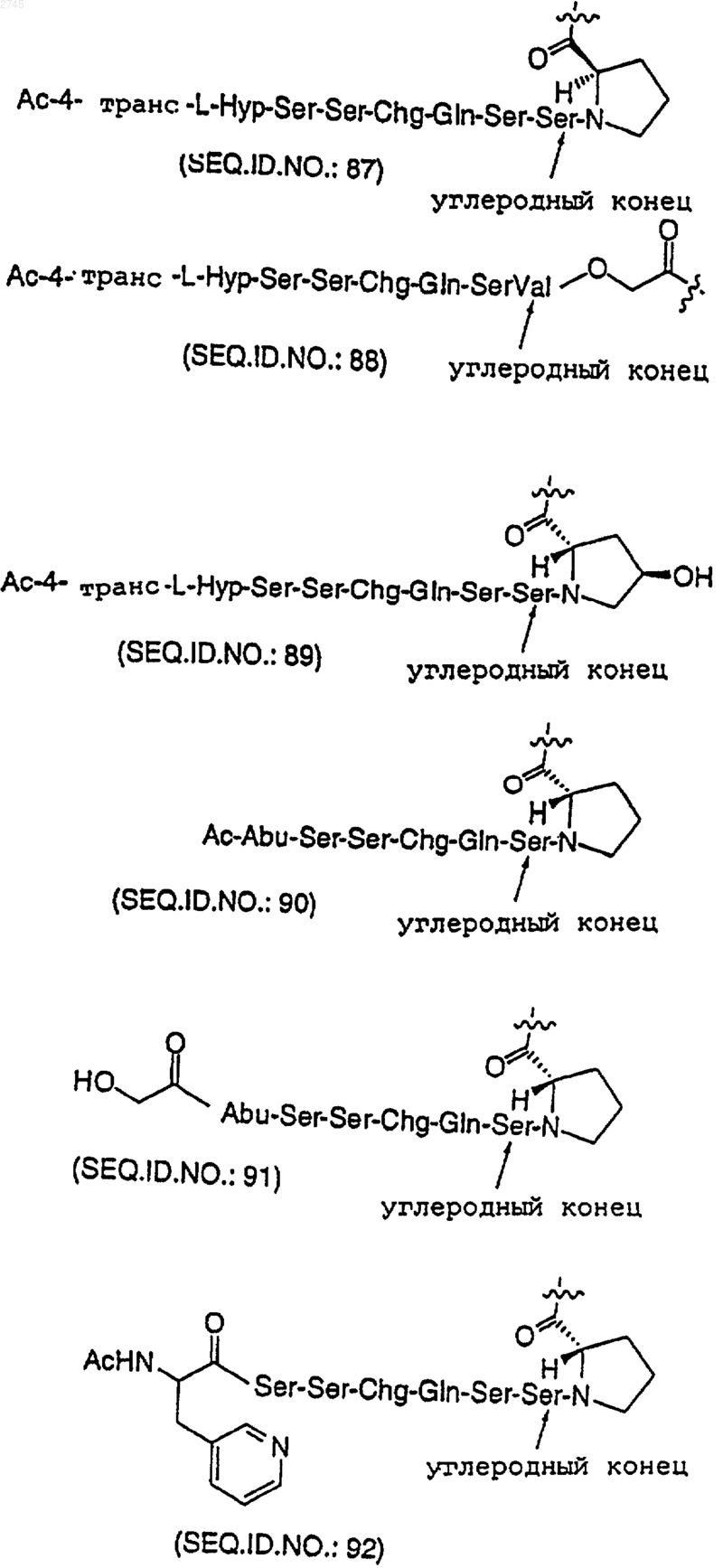
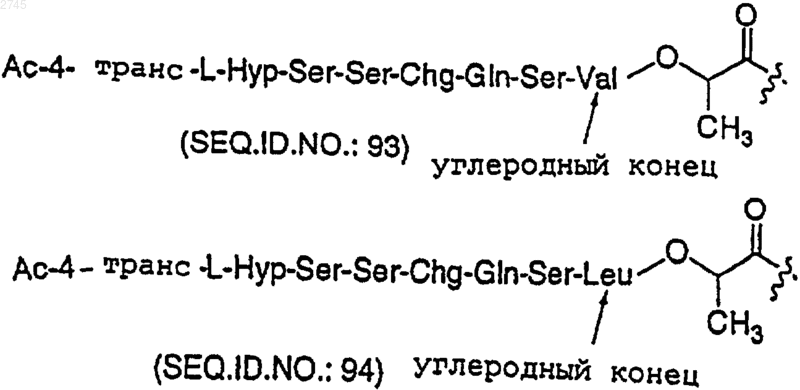
или его фармацевтически приемлемая соль, или оптический изомер.
6. Конъюгат по п.1, который представляет собой
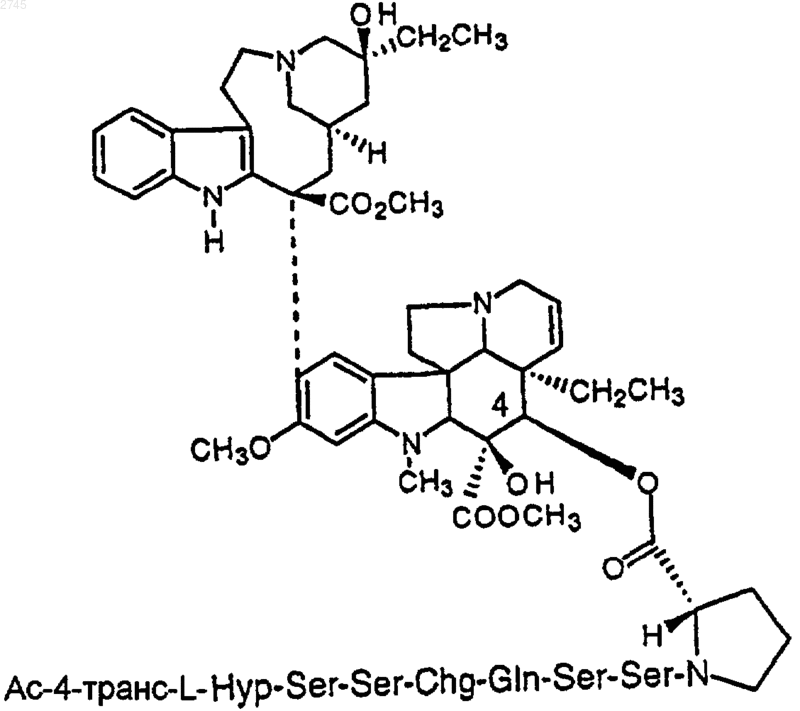
или его фармацевтически приемлемую соль, или оптический изомер.
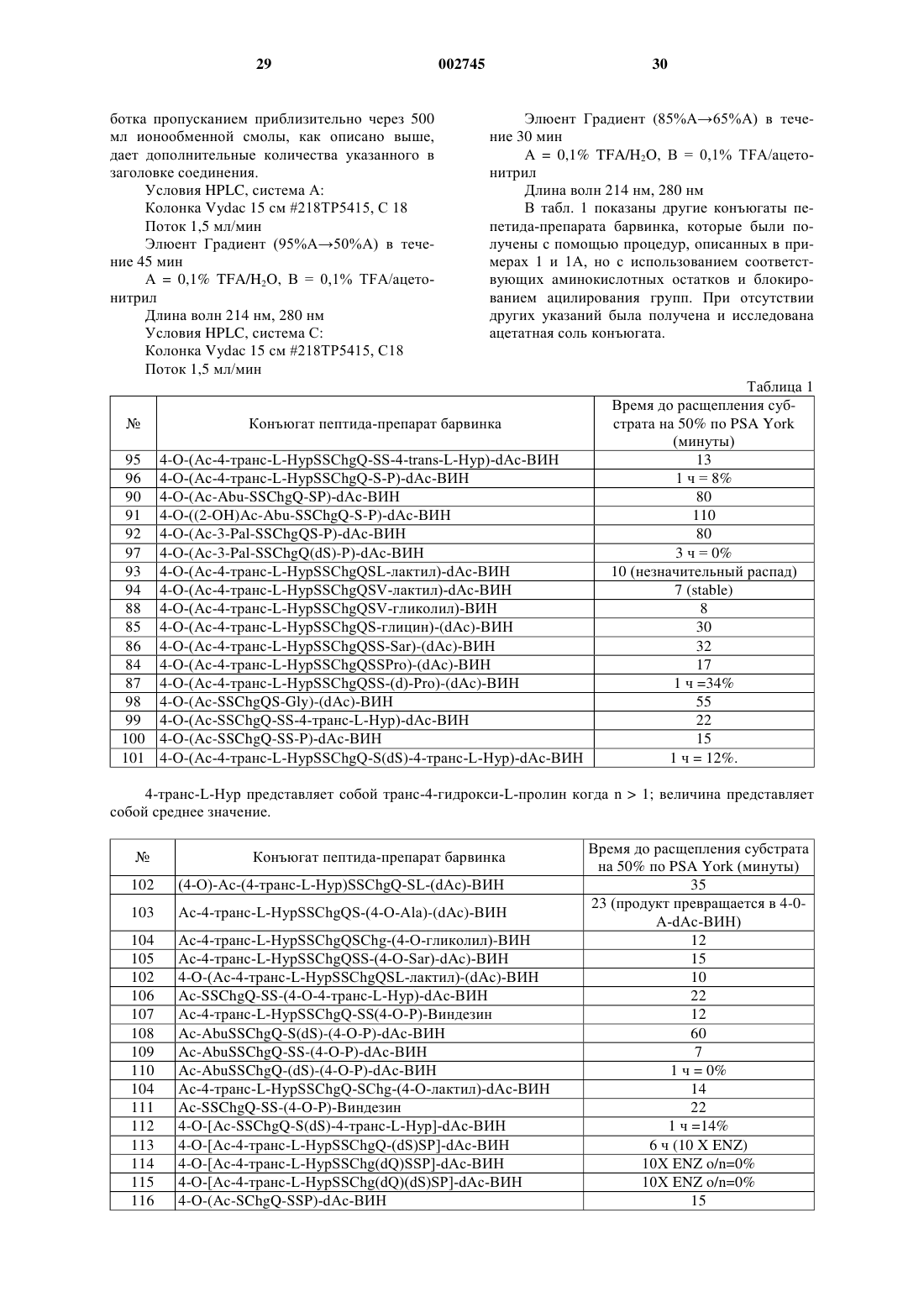
7. Фармацевтическая композиция, включающая фармацевтический носитель и диспергированное в нем терапевтически эффективное количество конъюгата по п.1.
8. Фармацевтическая композиция, включающая фармацевтический носитель и диспергированное в нем терапевтически эффективное количество конъюгата по п.5.
9. Способ лечения рака предстательной железы, который включает введение нуждающемуся в нем млекопитающему терапевтически эффективного количества композиции по п.7.
10. Способ лечения рака предстательной железы, который включает введение нуждающемуся в нем млекопитающему терапевтически эффективного количества композиции по п.8.
11. Способ лечения доброкачественной гиперплазии предстательной железы, который включает введение нуждающемуся в нем млекопитающему терапевтически эффективного количества композиции по п.8.
12. Фармацевтическая композиция, изготовленная с помощью комбинирования конъюгата по п.1 и фармацевтически приемлемого носителя.
Текст
1 Предшествующий уровень техники Ожидалось, что в 1996 г. в США диагноз рака предстательной железы будет поставлен у 317000 мужчин и 42000 американских мужчин умрут от этого заболевания [Garnick, M.B.(1994). The Dilemmas of Prostate Cancer. Scientific American, April: 72-81]. Таким образом, у мужчин в США рак предстательной железы представляет собой наиболее часто диагностируемое злокачественное заболевание (кроме рака кожи) и вторую по частоте причину случаев смерти от рака в группе (вслед за раком легких). Специфический антиген предстательной железы (PSA) представляет собой одиночноцепочечный гликопротеид с молекулярной массой 33 кДа, который почти исключительно вырабатывается эпителием предстательной железы человека и встречается в семенной жидкости человека на уровне от 0,5 до 2,0 мг/мл [Nadji,М., Taber, S.Z., Castro, A, et al. (1981) Cancer 48:1229; Papsidero, L., Kuriyama, M., Wang, M.,et al. (1981). JNCI 66:37; Qui, S.D, Young, C.Y.F,Bihartz, D.L, et al. (1990), J. Urol. 144:1550;(1979), Invest. Urol. 17:159]. У аспарагинового остатка номер 45 прикреплен одиночный углеводный элемент, который определяет от 2 до 3 кДа общей молекулярной массы. PSA представляет собой протеазу с подобной химотрипсину специфичностью [Christensson, A., Laurell, С.В.,Lilja, Н. (1990). Eur. J. Biochem. 194:755-763]. Было показано, что PSA главным образом ответствен за растворения гелевой структуры, образуемой при эйякуляции, с помощью протеолиза основных белков в сперме, захватывающих гель, семеногелина I и семеногелина II и фибронектина [Lilja, Н. (1985), J. Clin. Invest, 76:1899;PSA протеолиз образующих гель белков генерирует несколько растворимых фрагментов семеногелина I и семеногелина II и растворимых фрагментов фибронектина с разжижением эйякулята и высвобождением все более подвижных сперматозоидов [Lilja, H., Laurell, С,В, (1984).Scand. J, Clin. Lab, Invest. 44:447; McGee, R.S.,Herr, J.C, (1987)]. Кроме того, PSA может протеолитически расщеплять IGFBP-3 (инсулиноподобный фактор роста, связывающий белок 3),позволяя IGF (инсулиноподобному фактору) специфически стимулировать рост клеток, секретирующих PSA [Cohen et al., (1992) J.Clin.Endo.Meta. 75:1046-1053]. Комплекс PSA с альфа 1-антихимотрипсином представляет собой преобладающую молекулярную форму сывороточного PSA и может составлять до 95% выявленного сывороточногоal. (1991), Cancer Res, 51:222-226]. Считается,что ткань предстательной железы (нормальная,при доброкачественной гиперплазии или злокачественная ткань) преимущественно высвобождает зрелую, ферментативно активную формуPSA, поскольку эта форма требуется для образования комплекса с альфа 1-антихимотрипсином (Mast, А.Е., Enghild, J.J., Pizzo. S,V., etNatl. Acad, Sci. USA 87:3753-3757). Поэтому считается, что в микроокружении клеток предстательной железы, секретирующих PSA, PSA обрабатывается и секретируется в его зрелой,ферментативно активной форме, не образующей комплексы ни с какой ингибирирующей молекулой PSA также образует устойчивые комплексы с альфа-2-макроглобулином, но поскольку это приводит к инкапсулированию PSA и к полной потере эпитопов PSA, значение образования этого комплекса in vivo неясно. Свободная, не образовавшая комплексы форма PSA составляет небольшую фракцию сывороточного(1993). J. Urol. 150:100-105; Lilja, H., Christensson, A, Dahln, U. (1991). Clin. Chem. 37:16181625). Размер этой формы сывороточного PSA аналогичен размеру PSA в семенной жидкостиChem. 37:1618-1625), но еще не известно, может ли свободная форма сывороточного PSA быть зимогеном; внутренне расщепленной неактивной формой зрелого PSA или PSA, проявляющим ферментную активность. Однако представляется маловероятным, что свободная форма сывороточного PSA проявляет ферментную активность, поскольку в сравнении с выявленным сывороточным уровнем свободной формы PSA 33 кДа, в сыворотке имеется значительный (в 100-1000 раз) молярный избыток не вступавших в реакцию как альфа 1-антихимотрипсина, так и альфа 2-макроглобулина (Christensson, A., Bjrk,Т., Nilsson, О., et al. (1993). J. Urol. 150:100-105;Chem. 37:1618-1625). Измерения уровня сывороточного PSA могут использоваться для контроля лечения аденокарциномы предстательной железы (Duffy, M.S.Med. 113:541-548), хотя есть также данные об указанных выше нормальных сывороточных концентрациях PSA при доброкачественной гиперплазии предстательной железы и после хирургической травмы предстательной железыClin. Chem. 37:1618-1625). Известно также, что метастазы предстательной железы секретируют иммунологически реактивный PSA, поскольку у пациентов с клиническими проявлениями ши 3 роко распространенного метастатического рака предстательной железы после резекции предстательной железы выявляется высокий уровеньal. (1985). Brit. J. Urology 57:50-55). Поэтому цитотоксическое соединение, которое может активироваться протеолитической активностьюPSA, должно быть специфичным для клеток предстательной железы, а также специфичным для метастазов, секретирующих PSA. Задачей этого изобретения является предоставление новой противораковой композиции, которая может использоваться для лечения рака предстательной железы, и включающая олигопептиды, которые избирательно протеолитически расщепляются свободным специфическим антигеном предстательной железы (PSA),сопряженно связанные с цитотоксическим средством из алкалоида барвинка. Другой задачей этого изобретения является предоставление способа лечения рака предстательной железы, который включает введение новой противораковой композиции. Сущность изобретения Раскрыты химические конъюгаты, которые включают олигопептиды, имеющие аминокислотные последовательности, которые избирательно протеолитически расщепляются свободным специфическим антигеном предстательной железы (PSA), и цитотоксическое средство из алкалоида барвинка. Конъюгаты изобретения характеризуются прикреплением расщепляемого олигопептида к атому кислорода в четвертом положении на препарате барвинка, который был дезацетилирован. Такие конъюгаты могут использоваться в лечении рака предстательной железы и доброкачественной гиперплазии предстательной железы (ДТП). Подробное описание изобретения Настоящее изобретение относится к новым противораковым композициям, которые могут использоваться для лечения рака предстательной железы. Такие композиции включают олигопептид, ковалентно связанный, необязательно посредством химического связывающего вещества, с цитотоксическим средством из алкалоида барвинка. Точка прикрепления олигопептида к цитотоксическому средству из алкалоида барвинка находится у атома кислорода в четвертом положении цитотоксического средства из алкалоида барвинка. Понятно, что те цитотоксические средства из алкалоида барвинка, которые имеют ацетиловую часть на атоме кислорода в четвертом положении должны сначала перед образованием настоящих конъюгатов дезацетилироваться. Олигопептиды выбраны из олигомеров, которые избирательно распознаются свободным специфическим антигеном предстательной железы (PSA) и способны протеолитически расщепляться ферментной активностью свободного специфического антигена предстательной железы. Такая комбинация олигопепти 002745 4 да и цитотоксического средства может называться конъюгатом. В идеале цитотоксическая активность препарата барвинка значительно снижена или отсутствует, когда к препарату барвинка непосредственно или посредством химического связывающего вещества прикреплен олигопептид,содержащий участок протеолитического расщепления PSA и являющийся интактным. Также в идеале цитотоксическая активность препарата барвинка значительно увеличивается или возвращается к активности неизмененного препарата барвинка после протеолитического расщепления прикрепленного олигопептида у пептидной связи, где олигопептид расщепляется свободным PSA и любым последующим гидролизом эндогенными аминопептидазами. Более того, предпочтительно, чтобы олигопептид отбирался из олигопептидов, которые в сравнении с расщеплением олигопептидов в присутствии свободного ферментативно активного PSA перед расщеплением свободным PSA не расщепляются или расщепляются с гораздо меньшей частотой в присутствии протеолитических ферментов, отличных от PSA, таких как ферменты, являющиеся эндогенными для человеческой сыворотки. Было открыто, что аминокислота в точке прикрепления олигопептида к препарату барвинка или необязательное связывающее вещество предпочтительно представляет собой вторичную аминокислоту, отобранную из группы,включающей пролин,3 гидроксипролин, 3-фторпролин, пипеколиновую кислоту, 3-гидроксипипеколиновую кислоту, 2 азетидин, 3-гидрокси-2-азетидин, саркозин и им подобные. Более предпочтительно аминокислота в точке прикрепления олигопептида к препарату барвинка или необязательное связывающее вещество представляет собой циклическую аминокислоту, отобранную из группы, включающей пролин,3-гидроксипролин,3 фторпролин, пипеколиновую кислоту, 3 гидроксипипеколиновую кислоту, 2-азетидин, 3 гидрокси-2-азетидин, саркозин и им подобные. По указанной выше причине желательно,чтобы олигопептид включал короткую пептидную последовательность предпочтительно менее десяти аминокислот. Наиболее предпочтительно, чтобы олигопептид включал 7 или 6 аминокислот. Ввиду того, что конъюгат предпочтительно включает короткую аминокислотную последовательность, на растворимость конъюгата в большей степени может влиять в целом гидрофобный характер компонента цитотоксического средства. Поэтому в олигопептидную последовательность могут быть включены аминокислоты с гидрофильными заместителями или могут отбираться группы, блокирующие Nконец, для компенсации или уменьшения такого гидрофобного влияния цитотоксического средства. 5 Хотя в этом нет необходимости для осуществления этого аспекта изобретения, предпочтительный вариант реализации этого изобретения представляет собой конъюгат, в котором олигопептид и в случае присутствия необязательное химическое связывающее вещество,отщепляются от цитотоксического средства с помощью протеолитической активности свободного PSA и любых других нативных протеолитических ферментов, присутствующих в ближайшей ткани, представляя таким образом цитотоксическое средство, или цитотоксическое средство, которое удерживает часть элемента олигопептида/связывающего вещества, но остается цитотоксичным, в физиологическую среду на месте протеолитического расщепления. Включены также фармацевтически приемлемые соли конъюгатов. Понятно, что олигопептид, который конъюгирован с цитотоксическим средством, либо посредством прямой ковалентной связи или через связывающее вещество, не должен представлять собой олигопептид, который максимально распознается свободным PSA и максимально легко протеолитически расщепляется свободным PSA. Таким образом, олигопептид,который отобран для включения в такую противораковую композицию, будет выбран и за его избирательное протеолитическое расщепление свободным PSA, и за цитотоксическую активность конъюгата цитотоксического средства протеолитического остатка (или, что считается самой идеальной ситуацией, неизмененного цитотоксического средства), который получается в результате такого расщепления. Термин избирательное, используемый в связи с протеолитическим расщеплением PSA, обозначает более высокую частоту расщепления свободнымPSA олигопептидного компонента настоящего изобретения относительно расщепления олигопептида, который включает случайную последовательность аминокислот. Поэтому олигопептидный компонент настоящего изобретения представляет собой предпочтительный субстрат свободного PSA. Термин избирательное также указывает на то, что олигопептид протеолитически расщеплен свободным PSA между двумя специфическими аминокислотами в олигопептиде. Олигопептидные компоненты настоящего изобретения избирательно распознаются свободным специфическим антигеном предстательной железы (PSA) и способны протеолитически расщепляться ферментной активностью свободного специфического антигена предстательной железы. Такие олигопептиды включают олигомер, выбранный изz) HaaChgGlnSer (SEQ. ID.NO.: 26); в которых Наа представляет собой циклическую аминокислоту, замещенную гидрофильной частью, hArg представляет собой гомоаргинин, Хаа представляет собой любую аминокислоту, Cha представляет собой циклогексилаланин и Chg представляет собой циклогексилглицин. В варианте реализации настоящего изобретения олигопептид включает олигомер, который выбран изm) 4-HypAlaSerChgGlnSer (SEQ.ID.NO.: 38); в которых 4-Hyp представляет собой 4 гидроксипролин, Хаа представляет собой любую аминокислоту, Cha представляет собой циклогексилаланин и Chg представляет собой циклогексилглицин. В более предпочтительном варианте реализации настоящего изобретения олигопептид включает олигомер, который выбран из(SEQ.ID.NO.: 68); в которых Abu представляет собой аминомасляную кислоту, 4-Hyp представляет собой 4 гидроксипролин, Pip представляет собой пипеколиновую кислоту, 3,4-DiHyp представляет собой 3,4-дигидроксипролин, 3-Раl представляет собой 3-пиридилаланин, Sar представляет собой саркозин и Chg представляет собой циклогексилглицин. Использованная здесь выше и в других местах раздела Подробное описание изобретения фраза олигомеры, которые включают аминокислотную последовательность описывает олигомеры, состоящие из от приблизительно 3 до приблизительно 100 аминокислотных остатков, которые включают в их аминокислотной последовательности описанную специфическую аминокислотную последовательность и которые поэтому протеолитически расщепляются свободным PSA внутри описанной аминокислотной последовательности. Предпочтительно, олигомер представляет собой от 5 до 10 аминокислотных остатков. Таким образом, например, следующий олигомер:hArgSer4-HypChgGlnSerLeu (SEQ.ID.NO.: 70) включает аминокислотную последовательность 4-HypChgGlnSerLeu (SEQ.ID.NO.: 71) и поэтому вошла в пределы настоящего изобретения. Понятно, что такие олигомеры не включают семеногелин I и семеногелин II. Специалист среднего уровня в пептидной химии легко поймет, что определенные аминокислоты в биологически активном олигопеп 002745 8 тиде могут замещаться другими гомологичными, изостерическими и/или изоэлектронными аминокислотами, в которых в модифицированном олигопептиде была сохранена биологическая активность исходного олигопептида. Для замещения соответствующей естественной аминокислоты в олигопептиде настоящего изобретения могут также использоваться определенные не естественные и модифицированные естественные аминокислоты. Так, например, тирозин может замещаться 3-иодтирозином, 2 метилтирозином, 3-фтортирозином, 3-метилтирозином и им подобными. Далее, например,лизин может замещатьсяN'-(2-имидазолил)лизином и ему подобными. Следующий список замещений аминокислот предназначен для иллюстрации и не является ограничивающим: Исходная аминокислота Аlа Таким образом, с помощью методик, хорошо известных специалисту среднего уровня в этой области, могут быть синтезированы следующие олигопептиды, которые, как ожидается,будут протеолитически расщепляться свободным PSA:(SEQ.ID.NO.: 81) 3-гидроксипролин SerChgGlnSer (SEQ.ID.NO.: 82) 4-HypAlaSerChgGlnSerSer (SEQ.ID.NO.: 83). Включение символа "I" внутри аминокислотной последовательности указывает на точку внутри последовательности, в которой олигопептид протеолитически расщепляется свободным PSA. Соединения настоящего изобретения могут иметь асимметричные центры и встречаются в виде рацематов, рацемических смесей и в виде отдельных диастереомеров со всеми возможными изомерами, включая оптические изомеры,включенные в настоящее изобретение. Если нет других определений, то подразумевается, что аминокислоты имеют естественную "L" стереоконфигурацию. Как указано ниже, в настоящем изобретении раскрытые аминокислоты идентифицируются и с помощью обычных сокращений из 3 букв, и из одиночных букв: Аланин Аргинин Аспарагин Аспарагиновая кислота Аспарагин или Аспарагиновая кислота Цистеин Глутамин Глутаминовая кислота Глутамин или Глутаминовая кислота Глицин Гистидин Изолейцин Лейцин Лизин Метионин Фенилаланин Пролин Серин Треонин Триптофан Тирозин Валин Следующие сокращения используются в описании и чертежах для обозначения указанных аминокислот частей:Nva: Норвалин В данной области хорошо известно и понятно в настоящем изобретении, что пептидиловые терапевтические средства, такие как настоящие конъюгаты олигопептидацитотоксического средства предпочтительно имеют концевую аминосоставляющую любого олигопептидного заместителя, защищенную подходящей защитной группой, такой как аце 10 тил, бензоил, пивалоил и им подобные. Такая защита концевой аминогруппы уменьшает или устраняет ферментативный распад таких пептидиловых терапевтических средств под действием экзогенных аминопептидаз, которые присутствуют в плазме крови теплокровных животных. Такие защитные группы также включают гидрофильные блокирующие группы, которые выбраны на основании присутствия гидрофильной функциональности. Блокирующие группы, которые увеличивают гидрофильность конъюгатов и поэтому увеличивают растворимость конъюгатов в воде, включают гидроилированный алканоил, полигидроксилированный алканоил, полиэтиленгликоль, гликозилаты, сахара и кронэфиры, но не ограничиваются ими. Nконцевые неестественные аминосоставляющие могут также ослабить такое ферментное разложение под действием экзогенных аминопептидаз. Предпочтительно N-концевая защитная группа выбрана изa) водорода,b) незамещенного или замещенного арила,незамещенного или замещенного гетероцикла,С 3-С 10 циклоалкила,C2-C6 алкенила,С 2 С 6 алкинила, галогена, C1-C6 перфторалкила,R3O-, R3C(O)NR3-, (R3)2NC(O)-, R32N-C(NR3)-,R4S(O)2NH, CN, NO2, R3C(O)-, N3, -N(R3)2 илиR4OC(O)NR3-,c) незамещенного C1-С 6 алкила,d) замещенного C1-C6 алкила, в котором заместитель на замещенном C1-C6 алкиле выбран из незамещенного или замещенного арила, незамещенного или замещенного гетероциклического соединения, С 3-С 10 циклоалкила, С 2 С 6 алкенила, С 2-С 6 алкинила, R3O-, R4S(O)2NH,R3C(O)NR3-, (R3)2NС(O)-, R32N-C(NR3), CN,R3C(O)-, N3, N(R3)2, и R4OC(O)-NR3-, или-(CH2)s, в котором один из атомов углерода необязательно замещен группой, выбранной из О, S(O)m, -NC(O)-, NH и -N(COR4)-;n равно 1, 2, 3 или 4; р равно нулю или целому числу от 1 до 100; иs равно 3, 4 или 5. Определенные из олигопептидов настоящих конъюгатов включают циклическую аминокислоту, замещенную гидрофильной составляющей, ранее представленной термином Наа, которая также может быть представлена формулой представляет циклическую аминосоставляющую, имеющую 5 или 6 членов в кольце, такой как циклический амин, который может необязательно сливаться с фенилом или циклогексиловым кольцом. Примеры такой циклической аминосоставляющей включают следующие специфические структуры: но не ограничиваются ими. Конъюгаты настоящего изобретения могут иметь асимметричные центры и встречаются в виде рацематов, рацемических смесей и в качестве отдельных диастереомеров со всеми возможными изомерами, включая оптические изомеры, включенные в настоящее изобретение. Если в любом компоненте любая переменная часть (например, арил, гетероцикл, R3 и т.д.) встречается более одного раза, ее определение при каждом появлении независимо от каждого другого появления. Например, НО(CR1R2)2 представляет HOCH2CH2-, HOCH2CH(ОН)-,НОСН(СН 3)СН(ОН)- и т.д. Комбинации замес 002745 12 тителей и/или переменных частей также допустимы только если такие комбинации приводят к образованию устойчивых соединений. Используемые здесь термины алкил и алкильная часть аралкила и аналогичные термины предназначены включать разветвленные и прямоцепочечные насыщенные алифатические углеводородные группы, имеющие определенное количество атомов углерода; алкокси представляет алкиловую группу из указанного числа атомов углерода, прикрепленных через кислородный мостик. Используемый здесь термин циклоалкил предназначен для включения неароматических циклических углеводородных групп, имеющих определенное число атомов углерода. Примеры циклоалкиловых групп включают циклопропил,циклобутил, циклопентил, циклогексил и им подобные. Алкениловые группы включают группы,имеющие определенное число атомов углерода,и имеющие один или несколько двойных связей. Примеры алкениловых групп включают винил,аллил, изопропенил, пентенил, гексенил, гептенил, циклопропенил, циклобутенил, циклопентенил, циклогексенил, 1-пропенил, 2-бутенил, 2 метил-2-бутенил, изопренил, фарнесил, геранил,геранилгеранил и им подобные. Алкиниловые группы включают группы,имеющие определенное число атомов углерода и имеющие одну тройную связь. Примеры алкиниловых групп включают ацетилен, 2 бутинил, 2-пентинил, 3-пентинил и им подобные. Используемый здесь термин галоген или гало обозначает фторо, хлоро, бромо и иодо. Используемый здесь термин арил и арильная часть аралкила и ароила предназначен обозначать любое устойчивое моноциклическое или бициклическое углеродное кольцо до 7 членов в каждом кольце, в котором, по меньшей мере, одно кольцо является ароматическим. Примеры таких ариловых элементов включают фенил, нафтил, тетрагидронафтил, инданил,бифенил, фенантрил, антрил или аценафтил. Используемый здесь термин гетероцикл или гетероциклический представляет устойчивое 5-7-членное моноциклическое или устойчивое 8-11-членное бициклическое гетероциклическое кольцо, которое или насыщено, или не насыщено и которое состоит из атомов углерода и из 1-4 гетероатомов, выбранных из группы,состоящей из N, О и S и включающей любую бициклическую группу, в которой любое из определенных выше гетероциклических колец слито с бензольным кольцом. Гетероциклическое кольцо может быть прикреплено у любого гетероатома или атома углерода, что приводит к созданию устойчивой структуры. Примеры таких гетероциклических элементов включают азепинил, бензимидазолил, бензисоксазолил,бензофуразанил, бензопиранил, бензотиопира 13 нил, бензофурил, бензотиазолил, бензотиенил,бензоксазолил, хроманил, циннолинил, дигидробензофурил, дигидробензотиенил, дигидробензотиопиранил,дигидробензотиопиранилсульфон, фурил, имидазолидинил, имидазолинил, имидазолил, индолинил, индолил, изохроманил, изоиндолинил, изохинолинил, изотиазолидинил, изотиазолил, изотиазолидинил,морфолинил, нафтиридинил, оксадиазолил, 2 оксоазепинил, оксазолил, 2-оксопиперазинил, 2 оксопиперидинил, 2-оксопирролидинил, пиперидил, пиперазинил, пиридил, пиразинил, пиразолидинил, пиразолил, пиридазинил, пиримидинил, пирролидинил, пирролил, хиназолинил,хинолинил, хиноксалинил, тетрагидрофурил,тетрагидроизохинолинил,тетрагидрохинолинил, тиаморфолинил, тиаморфолинилсульфоксид, тиазолил, тиазолинил, тиенофурил, тиенотиенил и тиенил, но не ограничиваются ими. Используемые здесь термины замещенный C1-C8 алкил, замещенный арил и замещенный гетероцикл включают части, содержащие от 1 до 3 заместителей в дополнение к точке прикрепления к остальному соединению. Такие дополнительные заместители выбраны изF, Cl, Вr, СF3, NH2, N(C1-C6 алкил)2, NO2, CN,(C1-C6 алкил)O-, -ОН, (C1-C6 алкил)S(О)m-, (C1-C6 алкил)С(O)NH-, H2N-C(NH)-, (C1-C6 алкил)С(О)-,(C1-C6 алкил)ОС(О)-, N3, (C1-C6 алкил)ОС(O)NHи C1-С 20 алкил. Когда R1 и R2 комбинируется для образования -(CH2)s-, определенные так циклические группы и циклические группы, содержащие гетероатом, включают а термин PEG(6) представляет Используемый здесь термин (d) (2,3 дигидроксипропионил) представляет следующую структуру: Используемый здесь термин (2R,3S)2,3,4 тригидроксибутаноил представляет следующую структуру: Используемый здесь термин представляет следующую структуру: или ее диастереомер. Используемый здесь термин котининил представляет следующую структуру: или ее диастереомер. Используемый здесь термин представляет следующую структуру: Используемый здесь термин 4 этоксискварат представляет следующую структуру: но не ограничиваются ими. Используемый здесь термин гидроксилированный представляет замещение гидроксильной группой на замещаемом углероде описанной так кольцевой системы. Используемый здесь термин полигидроксилированный представляет замещение 2, 3 или 4 гидроксильной группой на двух или более замещаемых углеродах именуемой так кольцевой системы. Используемый здесь термин PEG представляет определенный полиэтиленгликоль,содержащий заместители, имеющие обозначенное число этиленокси субъединиц. Таким образом, термин PEG(2) представляет Цитотоксическое средство, которое используется в конъюгатах настоящего изобретения, может быть выбрано из цитотоксических средств алкалоида барвинка. В частности, члены этого класса, которые можно использовать,включают, например, алкалоид барвинка, выбранный из винбластина, винкристина, лейрозидина, виндезина, винорелбина, навелбина,лейрозина и им подобных или их оптических изомеров. Понятно, что конъюгаты настоящего изобретения имеют прикрепление олигопептида посредством атома кислорода, прикрепленного к С-4 алкалоиду барвинка. Поэтому определенные алкалоиды барвинка, имеющие ацетиловую 15 группу на этом кислороде, сначала перед соединением с олигопептидом (или необязательным соединительным элементом) должны быть дезацетилированы. Более того, специалист в этой области может произвести химические модификации в желаемом цитотоксическом средстве для того, чтобы сделать более удобными реакции этого соединения в целях получения конъюгатов изобретения. Предпочтительная группа цитотоксических средств из 4-дезацетилалкалоида барвинка по настоящему изобретению включает препараты следующих формул. Группа препаратов из алкалоида барвинка формулы I: в которой R7 представляет собой Н, СН 3 или СНО; когда R9 и R10 берутся по одиночке, R10 представляет собой Н, а один из R8 и R9 представляет собой этил, а другое представляет собой Н или ОН; когда R9 и R10 берутся вместе для образования двойной связи, R8 представляет собой этил;R12 представляет собой ОН, O-(С 1-С 3 алкил), или NH2. Конъюгат олигопептида-цитотоксического средства настоящего изобретения, в котором цитотоксическое средство представляет собой предпочтительное цитотоксическое средство 4O-дезацетилвинбластин, может быть описан представленной ниже общей формулой Iа в которой олигопептид представляет собой олигопептид, который специфично распознается свободным специфическим антигеном предстательной железы (PSA) и способен протеолитически расщепляться ферментативной активностью свободного специфического антигена предстательной железы,XL выбран из связи, -С(О)-(СН 2)u-W(CH2)u-O- и -С(О)-(СН 2)u-W-(CH2)u-NH-;R1 и R2 независимо выбраны из водорода,ОН, C1-C6 алкила, C1-C6 алкокси, C1-C6 аралкила и арила;R1a представляет собой C1-C6 алкил, гидроксилированный С 3-С 8 циклоалкил, полигидроксилированный С 3-С 8 циклоалкил, гидроксилированный арил, полигидроксилированный арил или арил,R9 представляет собой водород, (C1 С 3 алкил)-СО, или хлорзамещенный (C1-С 3 алкил)-СО;W выбран из разветвленного или прямоцепочечного C1-C6 алкила, циклопентила, циклогексила, циклогептила или бицикло[2.2.2]октанила;n равно 1, 2, 3 или 4; р равно нулю или целому числу от 1 до 100;u равно 0, 1, 2 или 3, или его фармацевтически приемлемая соль или оптический изомер. Предпочтительно ХL представляет собой связь. В варианте реализации настоящей заявки составляющая олигопептид - R выбрана из(SEQ.ID.NO.: 125) в которых Abu представляет собой аминомасляную кислоту, 4-транс-L-Hyp представляет собой 4-транс-L-гидроксипролин, Pip представляет собой пипеколиновую кислоту, 3,4-DiHyp представляет собой 3,4-дигидроксипролин, 3-PAL представляет собой 3-пиридилаланин, Sar представляет собой саркозин и Chg представляет собой циклогексилглицин. Следующие соединения представляют собой специфические примеры конъюгата олигопептида-дезацетилвинбластина настоящего изобретения или его фармацевтически приемлемую соль, или оптический изомер. 19 Олигопептиды, пептидные субъединицы и производные пептидов (также именуемые пептидами) настоящего изобретения могут синтезироваться из составляющих их аминокислот с помощью обычных методик синтеза пептидов,предпочтительно с помощью твердофазной технологии. Затем пептиды очищаются с помощью высоко эффективной жидкостной обращеннофазовой хроматографии (HPLC). Стандартные способы синтеза пептидов раскрыты, например, в следующих работах:Press, 1973; Barany et al., "The Peptides: Analysis,Synthesis, Biology" 2, Chapter 1, Academic Press,1980, и Stewart et al., "Solid Phase Peptide Synthesis", Second Edition, Pierce Chemical Company,1984. Положения этих работ включены сюда в качестве ссылки. Подходящим образом замещенная циклическая аминокислота, имеющая гидрофильный заместитель, которая может быть включена в конъюгаты настоящего изобретения с помощью стандартных методик синтеза пептидов, представляет собой или имеющееся в продаже соединение, или легко синтезируется с помощью хорошо известных в этой области или описанных здесь методик. Так, синтез подходящим образом замещенных пролинов описан в следующих статьях, приводимых здесь в качестве ссылки: J. Ezquerra et al., J. Org. Chem. 60: 29252930 (1995); P. Gill and W.D. Lubell, J. Org.al., J. Med. Chem., 34:457-461 (1991). Положения этих работ включены сюда в качестве ссылки. Фармацевтически приемлемые соли соединений этого изобретения включают обычные не токсичные соли соединений этого изобретения, образованные, например, из не токсичных неорганических или органических кислот. Например, такие обычные не токсичные соли включают соли, полученные из неорганических кислот, таких как хлористо-водородная, бромисто-водородная, серная, сульфамовая, фосфорная, азотная кислоты и им подобные; и соли,полученные из органических кислот, таких как уксусная, пропионовая, янтарная, гликолевая,стеариновая, молочная, оксиянтарная, винная,лимонная, аскорбиновая, памоевая, малеиновая,гидроксималеиновая, фенилуксусная, глутаминовая, бензойная, салициловая, сульфанильная 2-ацетоксибензойная, фумаровая, толуолсульфоновая, метансульфоновая, этандисульфоновая, щавелевая, изетионовая, трифторуксусная кислоты и им подобные. Конъюгаты настоящего изобретения, которые включают олигопептид, содержащий участок отщепления PSA, и цитотоксическое средство из алкалоида барвинка, могут быть синтезированы с помощью методик, хорошо извест 002745 20 ных в области фармации. Например, гидроксильная группа на препарате барвинка может быть ковалентно прикреплена к олигопептиду на карбоксильном конце так, что образуется эфирная связь. С этой целью может использоваться реактив, такой как комбинация HBTU и НОВТ, комбинация ВОР и имидазола, комбинация DCC и DMAP и им подобные. Карбоновая кислота может также активироваться с помощью образования нитрофенилового эфира или ему подобного и вступления в реакцию в присутствии DBU (1,8-диазобицикло[5,4,0]ундец-7 ена). Специалисту в этой области понятно, что при синтезе соединений изобретения может потребоваться защита различных реактивных функциональных групп на исходных и промежуточных соединениях, хотя желаемая реакция проводится на других частях молекулы. После завершения желаемых реакций или в любое желаемое время обычно такие защитные группы будут удалены, например, с помощью гидролитических или гидрогенолитических средств. Такие этапы защиты и снятия защиты являются обычными в органической химии. Специалисту в этой области в качестве ссылок предлагаются публикации Protective Groups in Organic Chemistry, McOmie, ed., Plenum Press, NY, NY (1973); и Protective Groups in Organic Synthesis, Greene,ed. John WileySons, NY, NY (1981), где представлены положения о защитных группах, которые могут использоваться при получении соединений настоящего изобретения. Только в качестве примера пригодные к использованию группы, защищающие аминогруппы, могут включать, например, C1-С 10 алканоильные группы, такие как формил, ацетил,дихлорацетил,пропионил,гексаноил,3,3 диэтилгексаноил, -хлорбутрил и им подобные;C1-С 10 алкоксикарбонильные и C5-C15 арилоксикарбонильные группы, такие как третбутоксикарбонил, бензилоксикарбонил, аллилоксикарбонил, 4-нитробензилоксикарбонил,фторенилметилоксикарбонил и циннамоилоксикарбонил; гало-(C1-С 10)-алкоксикарбонил, такой как 2,2,2-трихлорэтоксикарбонил; и C1-C15 арилалкильную и алкенильную группу, такую как бензил, фенетил, аллил, тритил и им подобные. Другие обычно используемые группы, защищающие аминогруппы, представляют собой группы в форме энаминов, полученных с кетоэфирами, такими как метил или этилацетоацетат. Пригодные к использованию группы, защищающие карбоксильные группы, могут включать, например, C1-С 10 алкильные группы,такие как метил, трет-бутил, децил; гало-C1-C10 алкил, такой как 2,2,2-трихлорэтил и 2-иодэтил; 21 как ацетоксиметил, пропионоксиметил и им подобные; и группы, такие как фенацил, 4 галофенацил, аллил, диметилаллил, три-(С 1-С 3 алкил)силил, такой как триметилсилил, -ртолуолсульфонилэтил, -р-нитрофенилтиоэтил,2,4,6-триметилбензил, -метилтиоэтил, фталимидометил, 2,4-динитрофенилсульфенил, 2 нитробензгидрил и родственные группы. Аналогичным образом, пригодные для использования группы, защищающие гидроксильные группы, могут включать, например, формильную группу, хлорацетильную группу, бензильную группу, бензгидрильную группу, тритильную группу, 4-нитробензильную группу,триметилсилильную группу,фенацильную группу, трет-бутильную группу, метоксиметильную группу, тетрагидропиранильную группу и им подобные. В отношении предпочтительного варианта реализации олигопептида, комбинированного с дезацетилвинбластином, следующие схемы реакции иллюстрируют синтез конъюгатов настоящего изобретения. Схема реакции I иллюстрирует получение конъюгатов олигопептидов настоящего изобретения и цитотоксического средства из алкалоида барвинка винбластина, в котором прикрепление кислорода 4-дезацетилвинбластина происходит на С-конце олигопептида. Хотя при образовании таких конъюгатов могут использоваться другие последовательности реакций, было обнаружено, что первоначальное прикрепление одиночной аминокислоты к 4-кислороду и последующее прикрепление остающейся последовательности олигопептида к этой аминокислоте представляет собой предпочтительный способ. Было также обнаружено, что на окончательном этапе соединения вместо HOAt может использоваться 3,4-дигидро-3-гидрокси-4-оксо-1,2,3 бензотриазин(ODHBT). Схема реакции II иллюстрирует получение конъюгатов олигопептидов настоящего изобретения, в котором в качестве связывающего соединения между препаратом барвинка и олигопептидом используется гидроксиалканолиловая кислота. Конъюгаты олигопептида-цитотоксического средства изобретения могут использоваться при лечении заболеваний, которые характеризуются патологическими клетками или патологической злокачественной или доброкачественной пролиферацией клеток, при которой эти клетки характеризуются своей секрецией ферментативно активного PSA. Такие заболевания включают рак предстательной железы, доброкачественную гиперплазию предстательной железы, метастатический рак предстательной железы, рак молочной железы и им подобные, но не ограничиваются ими. Конъюгаты олигопептида-цитотоксического средства изобретения вводятся пациенту в форме фармацевтической композиции, которая включает конъюгат настоящего изобретения и его фармацевтически приемлемый носитель,наполнитель или растворитель. Использованный здесь термин фармацевтически приемлемый относится к тем средствам, которые могут использоваться при лечении или диагностике у теплокровных животных, включая, например,человека, лошадей, свиней, коров, мышей, собак, кошек или других млекопитающих, а также птиц или других теплокровных животных. Предпочтительный способ введения представляет собой парентеральный, в частности, путем внутривенного, внутримышечного, подкожного,внутрибрюшинного или внутрилимфатического введения. Такие композиции могут быть получены с использованием носителей, растворителей или наполнителей, знакомых специалистам в этой области. В этом отношении см., например, Remingtons Pharmaceutical Sciences, 16thOsol et al. Такие композиции могут включать белки, такие как сывороточные белки, например сывороточный альбумин человека, буферы или буферные вещества, такие как фосфаты, другие соли или электролиты и им подобные. Подходящие растворители могут включать, например,стерильную воду, изотонический солевой раствор, разбавленный водный раствор декстрозы,многоатомный спирт или смесь таких спиртов,например глицерин, пропиленгликоль, полиэтиленгликоль и им подобные. Композиции могут содержать консерванты, такие как фенэтиловый спирт, метиловый и пропиловый эфиры парабензойной кислоты, тимеросал и им подобные. При желании композиция может включать от приблизительно 0,05 до приблизительно 0,20 мас.% антиоксиданта, такого как метабисульфит натрия или бисульфит натрия. Используемый здесь термин композиция предназначен для охвата продукта, включающего определенные ингредиенты в определенных количествах, а также любого продукта, который прямо или косвенно получается в результате комбинации определенных ингредиентов в определенных количествах. Фармацевтические композиции могут быть в форме стерильных водных растворов для инъекций. К приемлемым носителям и растворителям, которые могут применяться, относятся вода, раствор Рингера и изотонический раствор хлорида натрия. Стерильный препарат для инъекций может также представлять собой стерильную пригодную для инъекций микроэмульсию масла в воде,в которой активный ингредиент растворен в масляной фазе. Например, активный ингредиент может быть сначала растворен в смеси соевого масла и лецитина. Затем масляный раствор вносится в смесь воды и глицерина и обрабатывается для образования микроэмульсии. Пригодные для инъекций растворы или микроэмульсии могут вноситься в поток крови пациента с помощью местной болюсной инъекции. Альтернативно может иметь преимущество введение раствора или микроэмульсии таким образом, чтобы поддерживать постоянную концентрацию данного соединения в циркулирующей крови. Для поддержания такой постоянной концентрации может использоваться устройство для постоянной внутривенной доставки. Примером такого устройства является внутривенный насос Deltec CADD-PLUS модель 5400. Фармацевтические композиции могут быть в форме стерильной пригодной для инъекций водной или маслянистой суспензии для внутримышечного и подкожного введения. Композиция этой суспензии может составляться в соответствии с известным способом с использованием тех подходящих диспергирующих или смачивающих средств и суспендирующих средств,которые были упомянуты выше. Стерильный 25 пригодный для инъекций препарат может также представлять собой стерильный пригодный для инъекций раствор или суспензию в не токсичном приемлемом для парентерального введения разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Кроме того, в качестве растворителя или суспендирующей среды обычно используются стерильные нелетучие масла. Для этой цели может использоваться любое легкое нелетучее масло, включая синтетические моно- и диглицериды. Кроме того, при приготовлении препаратов для инъекций используются жирные кислоты, такие как олеиновая кислота. Композиция для внутривенного введения будет предпочтительно приготовлена так, чтобы количество, введенное пациенту, составляло от приблизительно 0,01 до приблизительно 1 г конъюгата. Предпочтительно введенное количество будет в диапазоне от приблизительно 0,2 до приблизительно 1 г конъюгата. Конъюгаты изобретения эффективны в широком диапазоне доз в зависимости от таких факторов как патологическое состояние, которое предстоит лечить, или биологический эффект, который предстоит модифицировать, способ, которым вводится конъюгат, возраст, вес и состояние пациента, а также другие факторы, которые должен определить лечащий врач. Таким образом, количество, вводимое любому данному пациенту,должно определяться на индивидуальной основе. Специалисту в данной области будет понятно, что хотя в следующих примерах очерчены определенные реагенты и условия реакции, в них могут вноситься изменения, которые, как подразумевается, охватываются сущностью и диапазоном притязаний изобретения. Поэтому следующие препараты и примеры предоставляются для дополнительной иллюстрации изобретения и не являются ограничивающими. Примеры Пример 1. Сложный эфир дезацетилвинбластин-4-O-(N-ацетил-4-транс-L-Hyp-Ser-SerChg-Gln-Ser-Ser-Pro). Этап А. Получение 4-дезацетилвинбластина. Образец из 2,40 г (2,63 ммоль) винбластина сульфата (Sigma V-1377) растворяют под N2 в 135 мл абсолютного метанола и обрабатывают 45 мл безводного гидразина и раствор перемешивают при 20-25 С в течение 18 ч. Реакционную смесь выпаривают до твердой пасты, которую распределяют между 300 мл CH2Cl2 и 150 мл насыщенного NаНСО 3. Водный слой промывают двумя порциями по 100 мл CH2Cl2 и каждый из 3 слоев CH2Cl2 в свою очередь промывают 100 мл Н 2 О (дважды) и насыщенным NaCl(однократно). Комбинированные органические слои сушат над безводным Na2SO4 и растворитель удаляют при пониженном давлении для получения указанного в заголовке соединения в 26 виде белого с оттенком твердого кристаллического вещества. Этот материал до использования хранят при -20 С. Этап В. Получение сложного эфира 4 дезацетилвинбластин 4-O-(пропила). Образец из 804 мт (1,047 ммоль) 4-дезацетилвинбластина, растворенного в 3 млCH2Cl2 и 18 мл безводного пиридина под азотом, обрабатывают 1,39 г хлорангидрида Fmocпролина (Fmoc-Pro-Cl, Advanced Chemtech) и смесь перемешивают в течение 20 ч при 25 С. Когда при анализе с помощью HPLC выявляют присутствие не вступившего в реакцию исходного дезацетилвинбластина, добавляют еще 0,50 г Fmoc-Pro-Cl с перемешиванием еще в течение 20 ч для завершения реакции. В реакционную смесь добавляют воду (приблизительно 3 мл) для вступления в реакцию с избыточным хлорангидридом и раствор затем выпаривают до сухости и распределяют между 300 мл EtOAc и 150 мл насыщенного NaHCO3 с последующим промыванием 2 раза насыщенным NaCl. После сушки (Na2SO4) растворитель удаляют под пониженным давлением для получения оранжевокоричневого остатка, к которому добавляют 30 мл DMF и 14 мл пиперидина и через 5 мин раствор выпаривают под пониженным давлением для получения оранжево-желтого полутвердого остатка. После сушки в вакууме в течение приблизительно 1 ч в этот материал добавляют приблизительно 200 мл Н 2 О и 100 мл эфира с последующим добавлением по каплям ледяного НОАс со встряхиванием и обработкой ультразвуком до того как не произойдет полное растворение и водный раствор не приобретет устойчивое рН 4,5-5,0 (смоченная бумага для определения рН в диапазоне от 4 до 6). Затем водный слой промывают одной 100-мл порцией эфира и каждый слой эфира промывают по очереди 50 мл Н 2 О. Комбинированные водные слои подвергают препаративной HPLC двумя порциями на колонке Waters C4 Delta-Pak 15 М 300 А (А = 0,1% TFA/H2O; В = 0,1% TFA/CH3CN), градиентное элюирование 9570% А/70 мин. После концентрации и лиофилизации объединенных фракций получают указанное в заголовке соединение. Этап С. N-Ацетил-4-транс-L-Нур-Sеr-SеrСhg-Сln-Sеr-Sеr-смола WANG. Начиная с 0,5 ммоль (0,61 г) Fmoc-Ser(tВu)-смолы WANG при нагрузке 0,82 ммоль/г синтезируют защищенный пептид на пептидном синтезаторе ABI модель 430 А, приспособленном для синтеза на основе Fmoc/трет-бутила. В протоколе используют двукратный избыток(1,0 ммоль) каждой из следующих защищенных аминокислот: Fmoc-Ser(t-Bu)-ОН, Fmoc-Gln-OH,Fmoc-Chg-OH, Fmoc-4-тpaнс-L-Нур-ОН; и уксусную кислоту (двойное соединение). Во время каждого цикла соединения защиту Fmoc удаляют с использованием 20% пиперидина в Nметил-2-пирролидиноне (NMP) с последующим 27 промыванием NPM. Соединение достигают с использованием активации DCC и HOBt в NMP. При завершении синтеза пептид-смолу сушат для получения указанного соединения. Этап D. N-Ацетил-4-транс-L-Нур-Sеr-SеrСhg-Gln-Sеr-Sеr-ОН. Одну фракцию 0,5 ммоль указанного выше пептида-смолы суспендируют в 25 мл TFA с последующим добавлением H2O и триизопропилсилана по 0,625 мл каждого, затем перемешиванием при 25 С в течение 2,0 ч. Полученную в результате расщепления смесь фильтруют, твердые вещества промывают TFA, растворители удаляют из фильтрата под пониженным давлением и остаток растирают в порошок с эфиром для получения бледно-желтого твердого вещества, которое выделяют с помощью фильтрации и сушки в вакууме для получения указанного в заголовке соединения. Условия HPLC, система А: Колонка Vydac 15 см 218 ТР 5415, С 18 Элюент градиент (95%А 50%А) в течение 45 мин А = 0,1% TFA/H2O, В = 0,1%TFA/ацетонитрил Поток 1,5 мл/мин Высокоразрешающая E3/FT-MS: 789,3 Этап Е. Сложный эфир дезацетилвинбластин-4-O-(N-ацетил-4-тpaнс-L-Hyp-Ser-Ser-ChgGln-Ser-Ser-Pro. Образцы 522 мг (0,66 ммоль) пептида из этапа D и 555 мг (приблизительно 0,6 ммоль) сложного эфира 4-дезацетилвинбластин 4-O(пропила) из этапа В, полученного как описано выше, растворяют в 17 мл DMF под N2. Затем добавляют 163 мг (1,13 ммоль) 1-гидрокси-7 азабензотриазола (HOAt) и рН доводят до 6,5-7(смоченная бумага для определения рН в диапазоне от 5 до 10) 2,4,6-коллидином с последующим охлаждением до 0 С и добавлением 155 мг(0,81 ммоль) 1-(3-диметиламинопропил)-3 этилкарбодиимида гидрохлорида (EDC). Перемешивание продолжают при 0-5 С до завершения соединения под контролем аналитическойTFA/CH3CN), поддерживая рН на уровне 6,5-7 с помощью периодического добавления 2,4,6 коллидина. Через 12 ч реакцию запускают с помощью добавления 4 мл H2O и после перемешивания в течение 1 ч концентрируют до маленького объема в вакууме, растворяют приблизительно в 150 мл 5% НОАс и проводят препаративную HPLC двумя порциями на колонкеTFA/H2O; В = 0,1% ТFА/СН 3 СN), градиентное элюирование 9565% А/70 мин). Однородные фракции, содержащие позже элюируемый продукт (оцениваемый с помощью HPLC, системы А, 9565% А/70 мин) из обоих хроматографических сеансов, объединяют и концентрируют до объема 50 мл и пропускают приблизительно через 40 мл ионообменной смолы AG4X4(ацетатный цикл) с последующей лиофилизацией для получения указанного в заголовке соединения в виде лиофилизированного порошка. Высокоразрешающая ES/FT-MS 1637,0. Пример 1 А. Сложный эфир ацетат дезацетилвинбластин-4-O-(N-ацетил-4-транс-L-HypSer-Ser-Chg-Gln-Ser-Ser-Pro). Образец 4,50 г (3,7 ммоль) соли 4-O(пропил) дезацетилбластина, полученной как описано на этапе В примера 1, растворяют в 300 мл DMF под N2 и раствор охлаждают до 0 С. Затем добавляют 1,72 г (10,5 ммоль) 3,4 дигидро-3-гидрокси-4-оксо-1,2,3-бензотриазина(ODHBT) и рН доводят до 7,0 (смоченная бумага для определения рН в диапазоне от 5 до 10)N-метилморфолином (NMM) с последующим добавлением порциями 4,95 г (5,23 ммоль) Nацетилгептапептида этапа D примера 1, давая возможность им полностью раствориться между каждым добавлением. Снова NMM доводят рН до 7,0 и добавляют 1,88 г (9,8 ммоль) 1-(3 диметиламинопропил)-3-этилкарбодиимид гидрохлорид (EDC) с последующим перемешиванием раствора при 0-5 до завершения соединения под контролем аналитической HPLC (система А), поддерживая рН на уровне 7 с помощью периодического добавления NMM. Анализ показывает главный компонент при времени удерживания 26,3 мин, которому предшествует второстепенный компонент (приблизительно 10%) при 26,1 мин, выявляемый в виде D-Ser изомера указанного в заголовке соединения. Через 20 ч реакцию запускают с помощью добавления 30 мл Н 2O и после перемешивания в течение 1 ч концентрируют до маленького объема в вакууме, растворяют приблизительно в 500 мл 20% НОАс и проводят препаративнуюHPLC 12 порциями на колонке Waters C18= 0,1% TFA/CH3CN), градиентное элюирование 8565% А/90 мин) при скорости потока 80 мл/мин. Однородные фракции (по оценке с помощью системы С HPLC), представляющие приблизительно одну четвертую часть всей перегонки, объединяют и концентрируют до объема 150 мл и пропускают через приблизительно 200 мл ионообменной смолы Bio-Rad AGX4(ацетатный цикл) с последующей лиофилизацией элюата, что дает ацетатную соль указанного в заголовке соединения в виде лиофилизированного порошка; время удерживания (система А) 26,7 мин, чистота 98,9%; высокоразрешающаяES/FT-MS m/e 1636,82; анализ аминокислотного состава 20 ч, 100 С, 6N НСl (теоретический/установленный), Ser4/3,91 (корректирован), Glu 1/0,92 (превращение Gln в Glu), Chg 1/1,11, Hyp 1/1,07, Pro 1/0,99, содержание пептида 0,516 ммоль/мг. Дальнейшая комбинация однородных фракций и очистка от побочных фракций, обра 29 ботка пропусканием приблизительно через 500 мл ионообменной смолы, как описано выше,дает дополнительные количества указанного в заголовке соединения. Условия HPLC, система А: Колонка Vydac 15 см 218 ТР 5415, С 18 Поток 1,5 мл/мин Элюент Градиент (95%А 50%А) в течение 45 мин А = 0,1% TFA/H2O, В = 0,1% TFA/ацетонитрил Длина волн 214 нм, 280 нм Условия HPLC, система С: Колонка Vydac 15 см 218 ТР 5415, С 18 Поток 1,5 мл/мин 30 Элюент Градиент (85%А 65%А) в течение 30 мин А = 0,1% TFA/H2O, В = 0,1% TFA/ацетонитрил Длина волн 214 нм, 280 нм В табл. 1 показаны другие конъюгаты пепетида-препарата барвинка, которые были получены с помощью процедур, описанных в примерах 1 и 1 А, но с использованием соответствующих аминокислотных остатков и блокированием ацилирования групп. При отсутствии других указаний была получена и исследована ацетатная соль конъюгата. Таблица 1 Время до расщепления субстрата на 50% по PSA York 4-транс-L-Hyp представляет собой транс-4-гидрокси-L-пролин когда n1; величина представляет собой среднее значение. Время до расщепления субстрата на 50% по PSA York (минуты) 35 23 (продукт превращается в 4-0A-dAc-ВИН) 12 15 10 22 12 60 7 1 ч = 0% 14 22 1 ч =14% 6 ч (10 X ENZ) 10 Х ENZ o/n=0% 10 Х ENZ o/n=0% 15 Пример 4. Оценка распознавания конъюгатов олигопептида-препарата барвинка с помощью свободного PSA. Конъюгаты, полученные как описано в примере 3, по отдельности растворяют в буфере дигерированияNaCl) и раствор добавляют в PSA в молярном соотношении 100 к 1. Альтернативно используемый расщепляющий буфер представляет собой 50 ммоль трис(гидроксиметил)аминометана рН 7,4, 140 ммоль НСl. Реакцию прекращают после различных периодов реакции с помощью добавления трифторуксусной кислоты (TFA) до конечной концентрации 1% (объем/объем). Альтернативно реакцию прекращают 10 ммольZnCl2. Смесь после прекращения реакции анализируют с помощью обращенно-фазовой HPLC на колонке С 18 с использованием градиента водной 0,1% TFA/ацетонитрила. Затем рассчитывают период времени (в мин), требуемый для расщепления на 50% указанных конъюгатов олигопептида-цитотоксического средства ферментативно активным свободным PSA. Результаты показаны в табл. 1. Пример 5. Анализ цитотоксичности пептидиловых производных препаратов барвинка invitro. С помощью анализа Alamar Blue оценивают цитотоксичность расщепляемых конъюгатов олигопептидов-препаратов барвинка, полученных как описано в примере 3, против линии клеток, которые, как известно, погибают под действием не модифицированного препарата барвинка. В частности, клеточные культуры клеток LNCaP опухоли предстательной железы,клеток Colo320DM (обозначенных С 320) или клеток T47D в 96-ячеечных планшетах разводят средой, содержащей различные концентрации данного конъюгата (конечный объем ячейки планшеты 200 мкл). Клетки Colo320DM, которые не экспрессируют свободный PSA, используются в качестве контрольной клеточной линии для определения токсичности, не основанной на механизме. Клетки в течение 3 дней инкубируют при 37 С в аналитическую ячейку добавляют 20 мкл Alamar Blue. Клетки продолжают инкубировать и результаты анализа считывают с аналитических планшет на считывающем устройстве EL-310 ELISA при двойной длине волн 570 и 600 нм через 4 и 7 ч после добавления Alamar Blue. Затем рассчитывают относительную жизнеспособность в процентах при различных исследованных концентрациях конъюгата в сравнении с контрольными культурами (без конъюгата) и определяют ЕС 50. Результаты показаны в табл. 2. Пока нет других указаний, исследуют ацетатную соль конъюгата. Таблица 2 ЕС 50(50 мкмоль), при которой Конъюгат пептида-препарата барвинка клетки LNCaP гибнут через 72 чPip представляет собой пипеколиновую кислоту; Sar представляет собой саркозин; Chg представляет собой циклогексилглицин; Abu представляет собой 2-аминомасляную кислоту;Aib представляет собой 2-аминоизомасляную кислоту. Пример 6. Эффективность конъюгатов пептидил-цитотоксического средства in vivo. Клетки LNCaP.FGC или DuPRO-1 трипсинизируют, ресуспендируют в ростовой среде и центрифугируют в течение 6 мин при 200 хg. Клетки ресуспендируют в бессывороточной среде -МЕМ и подсчитывают. Затем соответствующий объем этого раствора, содержащий желаемое количество клеток, переносят в коническую центрифужную пробирку, центрифуги 3.0 (Colo320DM = 12) n=3 4.1 (Colo320DM = 8.1) 9.3 (Colo320DM = 13.5) n= 2 16.3 (Colo320DM =16.3) 6.8 (Colo320DM = 8.1) n=2 4.5 (Colo320DM = 4.5) 3.8 (Colo320DM = 5.5) 3.9 (Colo320DM = 2.3) 40 (Colo320DM = 86.7) SF; 50 (97) 0.5% FBS 0.7 (Colo320DM = 4.1) n=2 3.8 (Colo320DM = 2.2) 0.6 (Colo320DM = 4.2) 12.5 (Colo320DM = 32.5) 1.3 (Colo320DM = 3.3) 4.1 (Colo320DM = 4.1) 2.0 (Colo320DM = 4.1) 12 (Colo320DM = 12) 1.1 (Colo320DM = 13.3) 1.3 (Colo320DM = 2.6) 0.7 (Colo320DM = 2.0) 4.1 (Colo320DM = 8.4) 8.1 (Colo320DM = 27.9) PS 6.8 (Colo320DM = 8.1) n = 2 12.5 (Colo320DM73) 12.8 (Colo320DM = 28.4) 0.3 (Colo320DM = 6.9) 32.5 (Colo320DM73) 0.1 (Colo320DM = 0.3) 2.0 (Colo320DM = 14.5) 12.2 (Colo320DM = 43.7) 16.3 (Colo320DM = 47.7) 15 (Colo320DM = 20) 0.7 (Colo320DM = 0.7) 5.6 (Colo320DM = 5.6) 2.9 (Colo320DM = 2.9) 0.8 (Colo = 3.0)25 (Colo320DM25) 2.3 (Colo320DM = 3.1) 80 (Colo320DM75) 7.5 (Colo320DM = 60) 1.0 (Colo320DM = 1.7) руют как указано выше, и ресуспендируют в соответствующем объеме холодной смеси 1:1 МЕМ-Matrigel. Суспензию держат на льду до введения животным. Самцов безволосых мышей Harlan SpragueDawley (в возрасте 10-12 нед.) удерживают без анестезии и им с помощью подкожной инъекции в левый бок с использованием иглы калибра 22G вводят 0,5 мл клеточной суспензии. Мышам вводят приблизительно или 5105 клетокDuPRO или 1,5107 клеток LNCaP.FGC. После введения опухолевых клеток мышей лечат по одному из двух протоколов. Протокол А. Через 1 день после введения клеток животным вводят исследуемый конъюгат, препа 35 рат барвинка или контрольный носитель (стерильную воду) в объеме 0,1-0,5 мл. Дозировки конъюгата и препарата барвинка первоначально представляют собой максимальное не смертельное количество, но в последующем могут подбираться более низкие дозы. Идентичные дозы вводят в течение 5 дней с интервалами 24 ч. Через 10 дней у мышей берут образцы крови и определяют уровень PSA в сыворотке. Аналогичные уровни PSA в сыворотке определяют с интервалами 5-10 дней. В конце периода 5,5 нед. мышей забивают и определяют вес любой имеющейся опухоли и снова определяют уровень PSA в сыворотке. Определяют вес животных в начале и в конце анализа. Протокол В. Через 10 дней после введения клеток у животных берут образцы крови и определяют уровень PSA в сыворотке. Затем животных делят на группы в соответствии с их уровнем PSA в сыворотке. Через 14-15 дней после введения клеток животным вводят исследуемый конъюгат,препарат барвинка или контрольный носитель(стерильную воду) в объеме 0,1-0,5 мл. Дозировки конъюгата и препарата барвинка первоначально представляют собой максимальное не смертельное количество, но в последующем могут подбираться более низкие дозы. Идентичные дозы вводят в течение 5 дней с интервалами 24 ч. Уровни PSA в сыворотке определяют с интервалами 5-10 дней. В конце периода 5,5 нед. мышей забивают и определяют вес любых имеющихся опухолей и снова определяют уровень PSA в сыворотке. Определяют вес животных в начале и в конце анализа. Пример 7. Определение протеолитического расщепления конъюгатов in vitro с помощью эндогенных протеаз, отличных от PSA. Этап А. Получение протеолитических тканевых экстрактов. Все процедуры проводят при 4 С. Соответствующих животных забивают и подлежащие исследованию ткани отделяют и хранят в жидком азоте. Замороженную ткань измельчают в порошок с использованием ступки и пестика и измельченную в порошок ткань переносят в гомогенизатор Potter-Elvejeh и добавляют 2 объема буфера А (50 ммоль Tris, содержащего 1,15% КСl при рН 7,5). Затем ткань разрывают 20 ударами, используя сначала неплотно прилегающий, а затем плотно прилегающий к ступке пестик. Гомогенат центрифугируют при 10000(НВ 4-5), гранулированный осадок удаляют и повторно полученную надосадочную жидкость центрифугируют при 10000g (Ti 70). Надосадочную жидкость (цитозоль) сохраняют. Гранулированный осадок повторно суспендируют в буфере В (10 ммоль EDTA, содержащей 1,15% КСl при рН 7,5) с использованием такого же объема, который использовался выше 36 с буфером А. Суспензию гомогенизируют в указанном выше гомогенизаторе и раствор центрифугируют при 10000g. Надосадочную жидкость удаляют, а гранулированный осадок повторно суспендируют в буфере С (10 ммоль буфера фосфата калия, содержащего 0,25 моль сахарозы при рН 7,4) с использованием 1/2 указанного выше объема и гомогенизируют указанным гомогенизатором. Определяют содержание белка в двух растворах (цитозоль и мембрана) с использованием анализа Bradford. Затем для анализа берут аликвотные пробы и замораживают в жидком N2. Аликвотные пробы хранят при -70 С. Этап В. Анализ протеолитического расщепления. Для каждой точки времени в раствор с конечным объемом 200 мкл в буфере (50 ммольTRIS, 140 ммоль NaCl, pH 7,2) помещают 20 мкг конъюгата пептида-препарата барвинка и 150 мкг тканевого белка, полученного как описано на этапе А и как определено Bradford в реакционном буфере. Реакции анализа проводят в течение 0, 30, 60, 120 и 180 мин и затем прекращают 9 мкл 0,1 М ZnCl2 и немедленно помещают в кипящую воду на 90 с. Продукты реакции анализируют с помощью HPLC с использованием колонки VY-DAC18 15 см в воде/ацетонитриле (5% к 50% ацетонитрила в течение 30 мин). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Конъюгат формулы I где олигопептид представляет собой олигопептид, который специфически распознается свободным специфическим агентом предстательной железы (PSA) и способен протеолитически расщепляться ферментативной активностью свободного специфического антигена предстательной железы,XL выбран из связи;R1 и R2 независимо выбраны из водорода,ОН, C1-C6 алкила, C1-C6 алкокси, C1-C6 аралкила и арила;R1a представляет собой C1-C6 алкил, гидроксилированный С 3-С 8 циклоалкил, полигидроксилированный С 3-С 8 циклоалкил, гидроксилированный арил, полигидроксилированный арил или арил;n равно 1, 2, 3 или 4; р равно нулю или целому числу от 1 до 100;t равно 3 или 4; или его фармацевтически приемлемая соль или оптический изомер. 2. Конъюгат по п.1, отличающийся тем,что олигопептид представляет собой олигомер,который включает аминокислотную последовательность, выбранную изz) HaaChgGlnSer (SEQ.ID.NO. 26),где Наа представляет собой циклическую аминокислоту, замещенную гидрофильной частью,hArg представляет собой гомоаргинин, Хаа представляет собой любую аминокислоту, Cha представляет собой циклогексилаланин и Chg представляет собой циклогексилглицин; или его оптический изомер. 3. Конъюгат по п.2, отличающийся тем,что Наа представляет собой транс-4-гидрокси-Lпролин или его оптический изомер. 4. Конъюгат по п.1, отличающийся тем,что олигопептид-R выбран изAc-SerChgGlnSerSerN-Me-dA; (SEQ.ID.NO. 125) где Abu представляет собой аминомасляную кислоту, 4-транс-L-4-Нур представляет собой 4 транс-L-4-гидроксипролин, Pip представляет собой пипеколиновую кислоту, 3,4-DiHyp представляет собой 3,4-дигидроксипролин, 3-PAL представляет собой 3-пиридилаланин, Sar представляет собой саркозин и Chg представляет собой циклогексилглицин. 5. Конъюгат по n.1, который выбран из или его фармацевтически приемлемая соль, или оптический изомер. 6. Конъюгат по п.1, который представляет собой или его фармацевтически приемлемую соль, или оптический изомер. 7. Фармацевтическая композиция, включающая фармацевтический носитель и диспергированное в нем терапевтически эффективное количество конъюгата по п.1. 8. Фармацевтическая композиция, включающая фармацевтический носитель и дисперСписок последовательностей 42 гированное в нем терапевтически эффективное количество конъюгата по п.5. 9. Способ лечения рака предстательной железы, который включает введение нуждающемуся в нем млекопитающему терапевтически эффективного количества композиции по п.7. 10. Способ лечения рака предстательной железы, который включает введение нуждающемуся в нем млекопитающему терапевтически эффективного количества композиции по п.8. 11. Способ лечения доброкачественной гиперплазии предстательной железы, который включает введение нуждающемуся в нем млекопитающему терапевтически эффективного количества композиции по п.8. 12. Фармацевтическая композиция, изготовленная с помощью комбинирования конъюгата по п.1 и фармацевтически приемлемого носителя.
МПК / Метки
МПК: A61P 35/00, C07K 14/47, A61K 38/08
Метки: рака, можно, железы, использовать, лечении, конъюгаты, предстательной, которые
Код ссылки
<a href="https://eas.patents.su/30-2745-konyugaty-kotorye-mozhno-ispolzovat-pri-lechenii-raka-predstatelnojj-zhelezy.html" rel="bookmark" title="База патентов Евразийского Союза">Конъюгаты, которые можно использовать при лечении рака предстательной железы</a>
Предыдущий патент: Корм для животных и птиц и способ его приготовления
Следующий патент: Стимуляторы секреции гормона роста
Случайный патент: {5-[4-(3,3-диметилазетидин-1-карбонил)фенил]-[1,2,4]триазол[1,5-a]пиридин-2-ил}амид циклопропанкарбоновой кислоты