Диаминиевые соли фенотиазина и их применение
Номер патента: 25033
Опубликовано: 30.11.2016
Авторы: Лох Инь Сзе, Клунас Скотт, Ишак Ахтшам, Стори Джон Мервин Дэвид, Баддели Томас Кравен, Ларч Кристофер Пол, Харрингтон Чарльз Роберт, Хорсли Дэвид, Рикард Дженет Элизабет, Синклер Джеймс Питер, Вуд Барри Алан, Уилльямсон Крейг, Симпсон Майкл, Вишик Клод Мишель, Кхан Каррар Ахмад, Маршалл Колин
Формула / Реферат
1. Соединение, соответствующее следующей формуле:
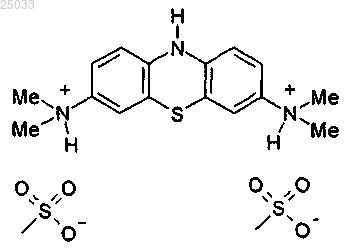
2. Соединение, соответствующее следующей формуле:
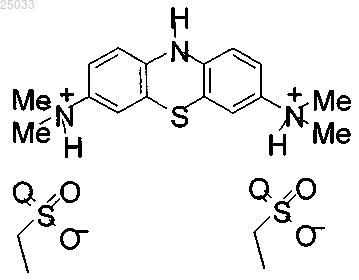
3. Соединение по п.1 в кристаллической форме, имеющее кристаллическую структуру, как показано на фиг. 11-16.
4. Соединение по п.2 в кристаллической форме, имеющее кристаллическую структуру, как показано на фиг. 17.
5. Фармацевтическая композиция, содержащая соединение по любому из пп.1-4 и фармацевтически приемлемый носитель или разбавитель.
6. Фармацевтическая композиция по п.5, которая представляет собой твердую лекарственную форму, содержащую соединение по любому из пп.1-4 и по меньшей мере один разбавитель, подходящий для сухого прессования, при этом необязательно твердую лекарственную форму получают прямым прессованием сухим гранулированием.
7. Композиция по п.6, где твердая лекарственная форма растворяется до степени по меньшей мере 80% в пределах 30 мин, как оценено стандартным способом фармакопеи, как определено фармакопеей США (USP), общая глава <711>.
8. Композиция по любому из пп.6, 7, где указанный по меньшей мере один разбавитель выбран из микрокристаллической целлюлозы, лактозы, маннитола и сахаров, таких как лактоза, сахароза, декстроза и мальтодекстрин, необязательно дополнительно содержащая по меньшей мере один разрыхлитель, выбранный из поперечно сшитого поливинилпирролидона (кросповидона), натрий-крахмалгликолята, поперечно сшитой натрий-карбоксиметилцеллюлозы (кроскармелоза натрия) или прежелатинизированного крахмала.
9. Композиция по любому из пп.6-8, где твердую лекарственную форму покрывают пленкой.
10. Композиция по любому из пп.6-9, дополнительно содержащая кислоту, имеющую pK1 больше чем 1,5, где кислота необязательно выбрана из малеиновой кислоты, фосфорной кислоты, аскорбиновой кислоты, сорбиновой кислоты, аспарагиновой кислоты и сиаловой кислоты.
11. Композиция по п.10, дополнительно содержащая носитель, выбранный из маннитола, целлюлозного материала, крахмала или их смесей.
12. Композиция по любому из пп.6-11, характеризующаяся тем, что указанная композиция содержит частицы, из которых более чем 10% имеют размер частиц больше чем 10 мкм.
13. Композиция по любому из пп.6-11, содержащая носитель, имеющий форму частиц, которая препятствует включению воды, такой как Elcema TM, этилцеллюлоза, маннитол или крахмал 1500 ТМ.
14. Способ получения фармацевтической композиции, включающий смешивание соединения по любому из пп.1-4 и фармацевтически приемлемого носителя или разбавителя.
15. Способ по п.14, где способ включает сухое прессование тонко перемешанной порошковой смеси, содержащей соединение по любому из пп.1-4, по меньшей мере с одним разбавителем, пригодным для сухого прессования, и необязательно одним или более другими вспомогательными веществами, где:
(i) данный способ включает способ сухого гранулирования, где указанное соединение, по меньшей мере один разбавитель и необязательные вспомогательные вещества получают в виде прессованной массы, измельчают и затем прессуют, применяя таблеточную машину; или
(ii) данный способ включает способ прямого прессования, где указанное соединение, по меньшей мере один разбавитель и необязательные вспомогательные вещества смешивают вместе в виде твердых частиц, получая указанную тонкоперемешанную смесь, и затем прессуют, применяя таблеточную машину, где указанный по меньшей мере один разбавитель необязательно выбран из микрокристаллической целлюлозы, лактозы, маннитола, кальциевых солей, таких как гидрофосфат дикальция, сульфат кальция, карбонат кальция, и сахаров, таких как лактоза, сахароза, декстроза и мальтодекстрин, и где указанный по меньшей мере один разбавитель необязательно представляет собой гранулированный продукт, полученный способом влажного гранулирования одного или более вспомогательных веществ, включающим стадию гранулирования влажной массы одного или более вспомогательных веществ с применением гранулирующей жидкости и сушку с получением указанного гранулированного продукта.
16. Способ по любому из пп.14 или 15, дополнительно включающий стадию нанесения пленочного покрытия на полученные в результате таблетки.
17. Применение соединения по любому из пп.1-4 в способе лечения или профилактики заболевания человека или млекопитающего, где заболевание представляет собой заболевание белковой агрегации.
18. Применение по п.17, где заболевание представляет собой TDP-43 протеинопатию.
19. Применение по п.17, где заболевание представляет собой таупатию.
20. Применение по п.19, где таупатия представляет собой болезнь Альцгеймера (AD), болезнь Пика, прогрессирующий надъядерный паралич (PSP), фронтотемпоральную деменцию (FTD), FTD с паркинсонизмом, связанным с хромосомой 17 (FTDP 17), синдром лобно-височной лобарной дегенерации (FTLD); комплекс расторможенность-деменция-паркинсонизм-амиотрофия (DDPAC), паллидо-понто-нигральную дегенерацию (PPND), гуам-ALS синдром, паллидо-нигро-льюисовую дегенерацию (PNLD), кортикобазальную дегенерацию (CBD), деменцию с аргирофильными волокнами (AgD), деменцию боксеров (DP) или хроническую травматическую энцефалопатию (СТЕ), синдром Дауна (DS), деменцию с тельцами Леви (DLB), подострый склерозирующий панэнцефалит (SSPE), мягкое когнитивное расстройство (MCI), болезнь Ниманна-Пика типа С (NPC), синдром Санфилиппо типа В (или мукополисахаридоз III В (MPS III В)), миотоническую дистрофию (DM), DM1 или DM2 или амиотрофический латеральный склероз (ALS).
21. Применение по п.20, где заболевание представляет собой болезнь Альцгеймера.
22. Применение по п.17, где заболевание представляет собой болезнь Паркинсона.
23. Применение по п.17, где заболевание представляет собой PSP, ALS или FTLD.
24. Применение по п.17, где заболевание представляет собой полиглутаминовое расстройство.
25. Применение по п.17, где заболевание представляет собой болезнь Хаттингтона, спинальную и бульбарную мышечную атрофию, дентато-рубро-паллидо-льюисову атрофию или спинально-церебеллярную атаксию.
26. Применение соединения по любому из пп.1-4 в способе лечения или профилактики заболевания человека или млекопитающего, где заболевание представляет собой рак кожи или меланому или вирусное, бактериальное или протозойное заболевание.
27. Применение по п.26, где вирусное, бактериальное или протозойное заболевание выбрано из гепатита С, ВИЧ, вируса Западного Нила (WNV) и малярии.
28. Применение по любому из пп.17-27 в виде фармацевтической композиции, включающей соединение и фармацевтически приемлемый носитель или разбавитель.
29. Применение соединения или композиции по любому из пп.1-4 для производства лекарственного средства для применения в лечении или профилактике заболевания человека или животного, где заболевание представляет собой заболевание белковой агрегации.
30. Применение по п.29, где заболевание представляет собой TDP-43 протеинопатию.
31. Применение по п.29, где заболевание представляет собой таупатию.
32. Применение по п.31, где таупатия представляет собой болезнь Альцгеймера (AD), болезнь Пика, прогрессирующий надъядерный паралич (PSP), фронтотемпоральную деменцию (FTD), FTD с паркинсонизмом, связанным с хромосомой 17 (FTDP 17), синдром лобно-височной лобарной дегенерации (FTLD); комплекс расторможенность-деменция-паркинсонизм-амиотрофия (DDPAC), паллидо-понто-нигральную дегенерацию (PPND), гуам-ALS синдром, паллидо-нигро-льюисовую дегенерацию (PNLD), кортикобазальную дегенерацию (CBD), деменцию с аргирофильными волокнами (AgD), деменцию боксеров (DP) или хроническую травматическую энцефалопатию (СТЕ), синдром Дауна (DS), деменцию с тельцами Леви (DLB), подострый склерозирующий панэнцефалит (SSPE), мягкое когнитивное нарушение (MCI), болезнь Ниманна-Пика типа С (NPC), синдром Санфилиппо типа В (или мукополисахаридоз III В (MPS III В)), или миотоническую дистрофию (DM), DM1 или DM2, или амиотрофический латеральный склероз (ALS).
33. Применение по п.32, где заболевание представляет собой болезнь Альцгеймера.
34. Применение по п.29, где заболевание представляет собой болезнь Паркинсона.
35. Применение по п.29, где заболевание представляет собой PSP, ALS или FTLD.
36. Применение по п.29, где заболевание представляет собой полиглутаминовое расстройство.
37. Применение по п.29, где заболевание представляет собой болезнь Хаттингтона, спинальную и бульбарную мышечную атрофию, дентато-рубро-паллидо-льюисову атрофию или спинально-церебеллярную атаксию.
38. Применение соединения по любому из пп.1-4 для получения лекарственного средства для применения в способе лечения или профилактики заболевания человека или млекопитающего, где заболевание представляет собой рак кожи или меланому или вирусное, бактериальное или протозойное заболевание.
39. Применение по п.38, где вирусное, бактериальное или протозойное заболевание выбрано из гепатита С, ВИЧ, вируса Западного Нила (WNV) и малярии.
40. Применение по любому из пп.29-39 в виде фармацевтической композиции, включающей соединение и фармацевтически приемлемый носитель или разбавитель.
41. Способ лечения или профилактики заболевания у субъекта, включающий введение субъекту профилактически или терапевтически эффективного количества соединения по любому из пп.1-13, где заболевание представляет собой заболевание белковой агрегации.
42. Способ по п.41, где заболевание представляет собой TDP-43 протеинопатию.
43. Способ по п.41, где заболевание представляет собой таупатию.
44. Способ по п.43, где заболевание представляет собой таупатию, необязательно выбранную из следующей группы: болезнь Альцгеймера (AD), болезнь Пика, прогрессирующий надъядерный паралич (PSP), фронтотемпоральная деменция (FTD), FTD с паркинсонизмом, связанным с хромосомой 17 (FTDP 17), синдром лобно-височной лобарной дегенерации (FTLD); комплекс расторможенность-деменция-паркинсонизм-амиотрофия (DDPAC), паллидо-понто-нигральная дегенерация (PPND), гуам-ALS синдром, паллидо-нигро-льюисовая дегенерация (PNLD), кортикобазальная дегенерация (CBD), деменция с аргирофильными волокнами (AgD), деменция боксеров (DP) или хроническая травматическая энцефалопатия (СТЕ), синдром Дауна (DS), деменция с тельцами Леви (DLB), подострый склерозирующий панэнцефалит (SSPE), мягкое когнитивное нарушение (MCI), болезнь Ниманна-Пика типа С (NPC), синдром Санфилиппо типа В (или мукополисахаридоз III В (MPS III В)), или миотоническая дистрофия (DM), DM1 или DM2, или амиотрофический латеральный склероз (ALS).
45. Способ по п.44, где заболевание представляет собой болезнь Альцгеймера.
46. Способ по п.41, где заболевание представляет собой болезнь Паркинсона.
47. Способ по п.41, где заболевание представляет собой PSP, ALS или FTLD.
48. Способ по п.41, где заболевание представляет собой полиглутаминовое расстройство.
49. Способ по п.41, где заболевание представляет собой болезнь Хаттингтона, спинальную и бульбарную мышечную атрофию, дентато-рубро-паллидо-льюисову атрофию или спинально-церебеллярную атаксию.
50. Способ лечения или профилактики заболевания у субъекта, включающий введение субъекту профилактически или терапевтически эффективного количества соединения по любому из пп.1-14, где заболевание представляет собой рак кожи или меланому или вирусное, бактериальное или протозойное заболевание.
51. Способ по п.50, где вирусное, бактериальное или протозойное заболевание выбрано из гепатита С, ВИЧ, вируса Западного Нила (WNV) и малярии.
52. Способ по любому из пп.41-51 в виде фармацевтической композиции, включающей соединение и фармацевтически приемлемый носитель или разбавитель.
53. Способ обращения и/или ингибирования агрегации белка, включающий контакт белка с эффективным количеством соединения или композиции по любому из пп.1-13, в котором агрегация необязательно связана с заболеванием, включающий стадию введения нуждающемуся в данном лечении млекопитающему профилактически или терапевтически эффективного количества указанного соединения или композиции.
54. Способ дезактивации патогена в образце, включающий стадии введения соединения по любому из пп.1-4 в образец и затем воздействия на образец светом.
55. Способ получения соединения по любому из пп.1-4 из N-защищенного 3,7-диамино-10Н-фенотиазина, включающий стадии деблокирования кольцевой аминогруппы (DP) и образования соли (SF).
56. Способ по п.55, где N-защищенный 3,7-диамино-10Н-фенотиазин представляет собой соединение формулы (II)
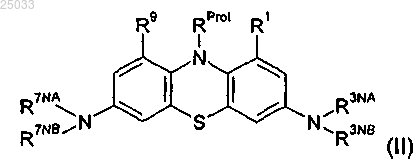
где RProt представляет собой защитную группу аминогруппы и каждый из R1 и R9 представляет собой -Н;
каждый из R3NA, R3NB, R7NA, R7NB представляет собой метил;
RProt представляет собой ацил.
57. Способ по любому из пп.55 или 56, где деблокирование кольцевой аминогруппы (DP) и образование соли (SF) проводят одновременно и деблокирование кольцевой аминогруппы (DP) и образование соли (SF) необязательно включают обработку N-защищенного 3,7-диамино-10Н-фенотиазина по меньшей мере одной сульфокислотой, такую как обработка метансульфокислотой и водой, в органическом растворителе с получением бис-(метансульфонатной) соли.
Текст
ДИАМИНИЕВЫЕ СОЛИ ФЕНОТИАЗИНА И ИХ ПРИМЕНЕНИЕ Изобретение относится к соединениям общей формулы (I)(GB), Лох Инь Сзе (SG), Кхан Каррар Ахмад, Ларч Кристофер Пол (GB) Медведев В.Н. (RU) где каждый из R1 и R9 независимо выбран из -Н, С 1-4 алкила, С 2-4 алкенила и галогенированного С 1-4 алкила; каждый из R3NA и R3NB независимо выбран из -Н, С 1-4 алкила, С 2-4 алкенила и галогенированного С 1-4 алкила; каждый из R7NA и R7NB независимо выбран из -Н, С 1-4 алкила,С 2-4 алкенила и галогенированного C1-4 алкила и где каждый из RA и RB независимо выбран из С 1-4 алкила, галогенированного С 1-4 алкила и С 6-10 арила или RA и RB соединены, образуя группу,выбранную из С 1-6 алкилена и С 6-10 арилена; и их фармацевтически приемлемым солям, которые являются пригодными в лечении, например, болезни Альцгеймера. В других аспектах изобретение также относится к новым составам 3,7-диамино-10 Н-фенотиазиниевых солей. Область техники, к которой относится изобретение Настоящее изобретение относится, в общем, к области фенотиазиновых соединений, в частности определенным диаминиевым солям фенотиазина, включая их применение и составы. В некоторых вариантах осуществления настоящее изобретение относится к бис-(сульфонатным) солям диаминофенотиазиновых соединений, таких как N,N,N',N'-тетраметил-10H-фенотиазин-3,7-диамин. Соединения настоящего изобретения являются пригодными, например, в лечении таупатий, таких как болезнь Альцгеймера(AD). Уровень техники настоящего изобретения Ряд патентов и публикаций приводятся в настоящем изобретении для того, чтобы более полно описать и раскрыть настоящее изобретение и современный уровень техники, к которому относится настоящее изобретение. Каждая из данных ссылок включена в настоящее изобретение полностью в той же степени, как если бы было указано, что каждая отдельная ссылка специально и отдельно включена с помощью ссылки. В настоящем изобретении, включая формулу изобретения, которая следует далее, если контекст не требует иначе, ясно, что слово "включает" и варианты, такие как "включающий" и "включая", подразумевает включение указанного целого или стадии или группы целых или стадий, но не исключает любое другое целое или стадию или группу целых или стадий. Следует отметить, что, как применяют в описании и прилагаемой формуле изобретения, единичные формы "a", "an" и "the" включают множественные ссылки, если контекст ясно не предписывает иначе. Таким образом, например, ссылка "фармацевтический носитель" включает смеси двух или более данных носителей и подобные. Диапазоны часто приводятся в настоящем изобретении как от приблизительно одной конкретной величины и/или до приблизительно другой конкретной величины. При выражении данного диапазона другой вариант осуществления включает от одной конкретной величины и/или до другой конкретной величины. Аналогично, когда величины приводят в виде приближенных величин применением предшествующего слова "приблизительно", ясно, что конкретная величина образует другой вариант осуществления. Любой подзаголовок в настоящем изобретении включен только для удобства и не следует истолковывать его как ограничивающий настоящее описание любым способом. Заболевания с синдромом деменции часто характеризуются нарастающим накоплением внутриклеточных и/или внеклеточных отложений белковоподобных структур, таких как -амилоидные бляшки и нейрофибриллярные клубки (NFT) в мозге страдающих от заболевания пациентов. Появление данных очагов повреждения в значительной степени коррелирует с патологической нейрофибриллярной дегенерацией и атрофией мозга, а также с когнитивным нарушением (см., например, Mukaetova-Ladinska, E.B.et al., 2000, Am. J. Pathol., Vol. 157, No. 2, p. 623-636). При болезни Альцгеймера и нейритические бляшки, и NFT содержат спаренные спиральные филаменты (PHF), из которых основным компонентом является связанный с микротрубочками тау-белок (см.,например, Wischik et al., 1988, PNAS USA, Vol. 85, p. 4506-4510). Бляшки также содержат внеклеточные-амилоидные фибриллы, полученные в результате нарушенной обработки белка-предшественника амилоида (АРР) (см., например, Kang et al., 1987, Nature, Vol. 325, p. 733). Статья Wischik et al. (в Neurobiology of Alzheimer's Disease, 2nd Edition, 2000, Eds. Dawbarn, D. and Allen, S.J., The Molecular and CellularNeurobiology Series, Bios Scientific Publishers, Oxford) подробно обсуждает предполагаемую роль таубелка в патогенезе нейродегенеративной деменции. Все из потери нормальной формы тау, накопления патологических PHF и потери синапсов в среднелобной доле коррелируют с ассоциированными когнитивными нарушениями. Более того, и потеря синапсов, и потеря пиримидальных клеток коррелируют с морфометрическими величинами реагирующей на тау нейрофибриллярной патологии, которая соответствует, на молекулярном уровне, практически полному перераспределению пула тау-белка из растворимой в полимеризуемую форму (т.е. PHF) при болезни Альцгеймера. Тау существует в альтернативно сплайсированных изоформах, которые содержат три или четыре копии повторяющейся последовательности, соответствующей домену, связывающему микротрубочки(см., например, Goedert, M., et al., 1989, EMBO J., Vol. 8, p. 393-399; Goedert, M., et al., 1989, Neuron, Vol. 3, p. 519-526). Тау в PHF подвергается протеолитической обработке до ключевого домена (см., например,Wischik, С.М., et al., 1988, PNAS USA, Vol. 85, p. 4884-4888; Wischik et al., 1988, PNAS USA, Vol. 85, p. 4506-4510; Novak, M., et al., 1993, EMBO J., Vol. 12, p. 365-370), который состоит из сдвинутого по фазе варианта повторяющегося домена; только три повтора включены в стабильное тау-тау взаимодействие(см., например, Jakes, R., et al., 1991, EMBO J., Vol. 10, p. 2725-2729). После образования PHF-подобные тау агрегаты действуют как затравка для дальнейшего захвата и дают матрицу для протеолитического процессинга полноразмерного тау-белка (см., например, Wischik et al., 1996, PNAS USA, Vol. 93, p. 11213-11218). Сдвиг по фазе, который наблюдается в повторяющемся домене тау, включенном в PHF, указывает на то, что повторяющийся домен подвергается индуцированным конформационным изменениям в про-1 025033 цессе включения в филамент. При возникновении AD, предполагается, что данное конформационное изменение может вызываться связыванием тау с патологическим субстратом, таким как поврежденные или мутированные мембранные белки (см., например, Wischik, С.М., et al., 1997, в "Microtubule-associatedproteins: modifications in disease", Eds. Avila, J., Brandt, R. and Kosik, K.S. (Harwood Academic Publishers,Amsterdam) p. 185-241). В процессе их образования и накопления PHF вначале объединяются, образуя аморфные агрегаты в цитоплазме, вероятно из ранних тау олигомеров, которые становятся урезанными перед или в процессеPHF сборки (см., например, Mena, R., et al., 1995, Acta Neuropathol., Vol. 89, p. 50-56; Mena, R., et al.,1996, Acta Neuropathol., Vol. 91, p. 633-641). Затем данные филаменты развиваются, образуя классические внутриклеточные NFT. В данном состоянии PHF состоят из ядра урезанного тау и рыхлого внешнего покрытия, содержащего полноразмерный тау (см., например, Wischik et al., 1996, PNAS USA, Vol. 93,p. 11213-11218). Процесс сборки является экспоненциальным, потребляющим клеточный пул нормального функционального тау и вызывающим синтез нового тау, восполняя его недостаток (см., например, Lai,R.Y.K., et al., 19 95, Neurobiology of Ageing, Vol. 16, No. 3, p. 433-445). В итоге, функциональное нарушение нейрона прогрессирует до момента гибели клетки, оставляя после себя внеклеточный NFT. Гибель клетки в высокой степени коррелирует с количеством внеклеточных NFT (см., например, Wischik et al., вCellular Neurobiology Series, Bios Scientific Publishers, Oxford). По мере того как клубки выталкиваются во внеклеточное пространство, имеется прогрессирующая потеря рыхлого наружного покрытия нейрона с соответствующей потерей N-концевой тау иммунореактивности, не сохранение тау иммунореактивности, связанной с PHF ядром (см., например, Bondareff, W. et al., 1994, J. Neuropath. Exper. Neurol., Vol. 53,No. 2, p. 158-164). Диаминофенотиазиновые соединения. Хлорид метилтиониния (МТС) (также известный как метиленовый синий (MB); хлорид метилтионина; хлорид тетраметилтионина; хлорид 3,7-бис-(диметиламино)фенотиазин-5-ия; C.I. Basic Blue 9; хлорид тетраметилтионина; хлорид 3,7-бис-(диметиламино)феназатиония; Swiss blue; C.I. 52015; C.I.Solvent Blue 8; анилиновый фиолетовый и Urolene Blue) является низкомолекулярным (319,86), растворимым в воде, трициклическим органическим соединением следующей формулы Хлорид метилтиониния (МТС) представляет собой хорошо известный фенотиазиновый краситель и окислительно-восстановительный индикатор, и его также применяют в качестве оптического зонда биофизических систем, в качестве интеркалятора в нанопористые материалы, в качестве окислительновосстановительного посредника и при фотоэлектрохромном получении изображения. Хлорид метилтиониния (МТС) и другие диаминофенотиазины описаны в качестве ингибиторов агрегации белков при заболеваниях, в которых белки агрегируют патологически. В частности, показано, что диаминофенотиазины, включая МТС, ингибируют агрегацию тау-белка и разрушают структуру PHF, и изменяют протеолитическую стабильность PHF ядра (см., например, WO 96/30766, Hofmann-La Roche). Данные соединения описаны для применения в лечении или профилактики различных заболеваний, включая болезнь Альцгеймера.WO 2007/110630 (WisTa Laboratories Ltd) также описывает определенные специфические диаминофенотиазиновые соединения, родственные МТС, включая ETC, DEMTC, DMETC, DEETC, MTZ, ETZ,MTI, MTILHI, ETI, ETLHI, MTN и ETN, которые являются пригодными в качестве лекарственных средств, например, при лечении болезни Альцгеймера. Кроме того, WO 2005/030676 (The University Court: of the University of Aberdeen) обсуждает радиомеченные фенотиазины и их применение в диагностике и терапии, например, таупатий. Хлорид метилтиониния (МТС) также описан для других медицинских применений. Например, в настоящее время его применяют при лечении метгемоглобинемии (состояние, которое наблюдается, когда кровь не может доставлять кислород туда, где это необходимо, в организме). МТС также применяют в качестве медицинского красителя (например, для окрашивания определенных частей тела перед или в процессе операции); диагностического средства (например, в качестве индикаторного красителя для обнаружения определенных соединений, присутствующих в моче); слабого антисептика мочевого пузыря; стимулятора слизистых поверхностей; терапевтического и превентативного средства от камней в почках; и при диагностике и лечении меланомы. МТС применяют для лечения малярии, или отдельно (см., например, Guttmann, P. and Ehrlich, P.,1891, "Uber die wirkung des methylenblau bei malaria", Berl. Klin. Woschenr., Vol. 28, p. 953-956), или в комбинации с хлороквином (см., например, Schirmer, H., et al., 2003, "Methylene blue as an antimalarialchlorocjuine and methylene blue combination against malaria", European Journal of Clinical Pharmacology,Vol. 60, p. 709-715). МТС (под названием Virostat от Bioenvision Inc., New York) также показал сильную вируцидную активность in vitro. В частности, Virostat является эффективным против вирусов, таких как ВИЧ и вирус Западного Нила в лабораторных испытаниях. Virostat также в настоящее время проходит клинические испытания для лечения хронического гепатита С, вирусной инфекции печени. Вирус, HCV, является основной причиной острого гепатита и хронического заболевания печени, включая цирроз и рак печени. МТС в комбинации со светом может также предотвращать репликацию нуклеиновых кислот (ДНК или РНК). Плазма, тромбоциты и красные кровяные клетки не содержат ядерных ДНК или РНК. Когда МТС вводят в кровяные компоненты, он проходит бактериальные клеточные стенки или вирусную мембрану, затем перемещается во внутреннюю часть структуры нуклеиновой кислоты. При активации светом, затем соединение связывается с нуклеиновой кислотой вирусного или бактериального патогена,препятствуя репликации ДНК или РНК. Поскольку МТС может дезактивировать патоген, он обладает потенциалом снижать риск передачи патогенов, которые могут оставаться недетектируемыми при анализе. Пероральные и парентеральные составы МТС имеются в продаже в Соединенных Штатах, обычно под названием Urolene Blue. Восстановленные ("лейко") формы МТС, фенотиазин-5-иевую соль, можно считать "окисленной формой" относительно соответствующего 10 Н-фенотиазинового соединения, N,N,N',N'-тетраметил-10 Нфенотиазин-3,7-диамина, который можно считать "восстановленной формой"May et al. (Am. J. Physiol. Cell Physiol., 2004, Vol. 286, p. C1390-C1398) показал, что человеческие эритроциты последовательно восстанавливают и поглощают МТС; что сам МТС не поглощается клетками; что именно восстановленная форма МТС проходит через клеточную мембрану; что скорость поглощения является зависимой от фермента и что и МТС и восстановленный МТС накапливаются в клетках(восстановленный МТС приходит в равновесие внутри клетки, образуя МТС). МТС и аналогичные лекарственные средства поглощаются в кишечнике и попадают в кровоток. Непоглощенное лекарственное средство проникает далее в пищеварительный тракт, в дистальную часть кишечника. Одним важным нежелательным побочным эффектом является эффект непоглощенного лекарственного средства в дистальной части кишечника, например аллергическая реакция в дистальной части кишечника и/или антимикробные эффекты непоглощенного лекарственного средства в дистальной части кишечника, оба из которых ведут к диарее. Следовательно, желательно снизить до минимума количество лекарственного средства, которое проникает в дистальную часть кишечника. Увеличивая поглощение лекарственного средства в кишечнике (т.е. увеличивая биодоступность лекарственного средства), можно снизить дозу и можно облегчить нежелательные побочные эффекты, такие как диарея. Поскольку именно восстановленная форма МТС поглощается клетками, может быть желательно вводить пациентам восстановленную форму. Это также может снизить определяющую роль ограничивающей скорость стадии ферментативного восстановления.WO 02/055720 (The University Court of the University of Aberdeen) описывает применение восстановленных форм определенных диаминофенотиазинов для лечения заболеваний, связанных с агрегацией белков, в первую очередь, таупатий.WO 2007/110627 (WisTa Laboratories Ltd) описывал определенные 3,7-диамино-10 Нфенотиазиниевые соли, эффективные в качестве лекарственных средств или пролекарств для лечения заболеваний, включая болезнь Альцгеймера. Данные соединения также находятся в "восстановленной" или "лейко" форме при рассмотрении относительно МТС. Они включают следующие соли: Хотя и обеспечивая некоторые преимущества по сравнению с применением МТС, синтез LMT.2HCl в определенных условиях может приводить в результате к тому, что CH3Cl будет захватываться в кристаллах. Затем его надо удалять, поскольку CH3Cl является токсичным, и его концентрации необходимо держать ниже максимальной безопасной концентрации. Более того, LMT.2HBr содержит ионы брома. Это в принципе является менее желательным, поскольку бромид является токсичным и при высокой концентрации или при постоянном дозирование и при низкой концентрации, и может вызывать побочные эффекты, такие как спутанность сознания, у пациентов. Следовательно, можно видеть, что обеспечение дополнительных солей метилтиониниевых соединений, обладающих одним или более желательными свойствами по сравнению с уже известными соединениями, будет усовершенствовать существующий уровень техники. Более того, обеспечение новых составов метилтиониниевых соединений, которые увеличивают стабильность, поглощение и/или иначе увеличивают их эффективность в качестве терапевтических средств,будет усовершенствовать существующий уровень техники. Сущность настоящего изобретения Авторы настоящего изобретения в настоящее время обнаружили новый класс стабильных фенотиазиндиаминиевых соединений, которые обладают улучшенными свойствами по сравнению с ранее описанными диаминофенотиазиновыми соединениями и солями. Свойства соединений описывают далее в настоящем изобретении, посредством чего можно видеть,что в предпочтительных вариантах осуществления настоящее изобретение может обеспечивать одно или более из улучшенных физических, фармакокинетических, биохимических или других полезных свойств. В других аспектах авторы настоящего изобретения также обеспечивают новые составы 3,7 диамино-10 Н-фенотиазиниевых солей. В одном аспекте настоящее изобретение обеспечивает определенные соединения, в частности определенные фенотиазиндиаминиевые соединения, как описано в настоящем изобретении. Одно из соединений по изобретению представляет соединение следующей формулы: Другой аспект настоящего изобретения относится к соединению формулы Другой аспект настоящего изобретения относится к способу получения соединений, описанных выше, из N-защищенного 3,7-диамино-10 Н-фенотиазина, включающий стадии деблокирования кольцевой аминогруппы (DP) и образования соли (SF). Другой аспект настоящего изобретения относится к фармацевтической композиции, содержащей соединение, описанное в настоящем изобретении, и фармацевтически приемлемый носитель или разбавитель. Другой аспект настоящего изобретения относится к способу получения фармацевтической композиции, содержащей смесь соединения, как описано в настоящем изобретении, и фармацевтически приемлемого носителя или разбавителя, включающий смешивание соединения по изобретению и фармацевтически приемлемого носителя или разбавителя. Другой аспект настоящего изобретения относился к фармацевтической композиции в твердой лекарственной форме, содержащей соединение, как описано в настоящем изобретении, и дополнительно содержащей по меньшей мере один разбавитель, пригодный для сухого прессования, при этом необязательно твердую лекарственную форму получают прямым прессованием сухим гранулированием. Другой аспект настоящего изобретения относится к способу получения фармацевтической композиции способом сухого прессования, причем указанный состав представляет собой твердую лекарственную форму, содержащую соединение, как описано в настоящем изобретении, по меньшей мере один разбавитель, пригодный для сухого прессования, и, необязательно, одно или более других вспомогательных веществ. Другой аспект настоящего изобретения относится к способу лечения или профилактики заболевания у субъекта, включающему введение указанному субъекту профилактически или терапевтически эффективного количества соединения, как описано в настоящем изобретении, предпочтительно в виде фармацевтической композиции, предпочтительно фармацевтической композиции в твердой лекарственной форме, как далее описано в настоящем изобретении. Другой аспект настоящего изобретения относится к соединению или композиции, как описано в настоящем изобретении, для применения в способе лечения или профилактики (например, заболевания) человека или животного. Другой аспект настоящего изобретения относится к применению соединения или композиции, как описано в настоящем изобретении, для получения лекарственного средства для применения в лечении или профилактики заболевания. В некоторых вариантах осуществления заболевание представляет собой заболевание агрегации белков. В некоторых вариантах осуществления заболевание представляет собой таупатию, например нейродегенеративную таупатию, например болезнь Альцгеймера или другое заболевание, описанное далее в настоящем изобретении. В некоторых вариантах осуществления заболевание представляет собой заболевание кожи, например меланому. В некоторых вариантах осуществления заболевание представляет собой вирусное, бактериальное или протозойное заболевание, например гепатит С, ВИЧ, вирус Западного Нила (WNV) или малярию. Другой аспект настоящего изобретения относится к способу дезактивации патогена в образце (например, образце крови или плазмы), включающему стадии введения соединения или композиции, как описано в настоящем изобретении, в образец, и затем воздействие на образец светом. Специалисту в данной области техники ясно, что отличительные признаки и предпочтительные варианты осуществления одного аспекта настоящего изобретения будет также относиться к другим аспектам настоящего изобретения. Краткое описание чертежей Фиг. 1 показывает 1H ЯМР спектр примерного соединения настоящего изобретения (LMT.2MsOH) в цейтерированном метаноле (CD3OD) при 600 МГц. Фиг. 2 показывает 13 С ЯМР спектр LMT.2MsOH в CD3OD при частоте 100,56 МГц. Фиг. 3 показывает DEPT-135 спектр LMT.2MsOH в CD3OD при частоте 100,56 МГц. Фиг. 4 показывает HSQC спектр LMT.2MsOH в CD3OD при частоте 100,56 МГц. Фиг. 5 показывает увеличенную часть HSQC спектра LMT.2MsOH в CD3OD при частоте 100,56 МГц. Фиг. 6 показывает ИК (FT-IR) спектр LMT.2MsOH (KBr). Фиг. 7 показывает масс-спектр LMT.2MsOH при электронном ударе (EI). Фиг. 8 показывает масс-спектр LMT.2MsOH при ионизации электроспреем (ESI). Фиг. 9 показывает УФ/ВО спектр LMT.2MsOH в деионизированной воде. Фиг. 10 показывает ВЭЖХ кривую LMT.2MsOH. Фиг. 11 показывает порошковую рентгеновскую дифрактограмму для LMT.2MsOH, измеренную при Cu K излучении. Фиг. 12 показывает FT-Рамановский спектр для кристаллической LMT.2MsOH. Сигналы с наибольшими интенсивностями обнаружены при 1615, 1588, 1258 и 1042 см-1. Фиг. 13 показывает термогравиметрический профиль для кристаллической LMT.2MsOH. Постоянный вес детектировали TG и TG-FTIR вплоть до начала разложения при 240-270 С. Фиг. 14 показывает анализ дифференциальной сканирующей калориметрией для кристаллическойLMT.2MSOH. За резкой температурой плавления при 271 С (Н=87 Дж/г) сразу же шло разложение. Фиг. 15 а и 15b показывают кривую динамической сорбции паров (ДСП) для кристаллическойLMT.2MsOH, измеренную при 25 С с 5%/ч скоростью сканирования. Горизонтальные пунктирные линии показывают стадии поглощения воды 1 экв. Стабильный вес образца (менее чем 0,5 мас.%. изменение) наблюдали в диапазоне относительной влажности (r.h.) 0-70%. Выше данной относительной влажности поглощение воды быстро увеличивалось, и образец, в конце концов, растворялся. После сушки содержание воды снижалось снова до приблизительно 4 экв. при 50% относительной влажности ДСП кривая кристаллической дигидрохлоридной соли (LMT.2HCl) показана для сравнения в виде пунктирной линии,ДСП кривая дигидробромидной соли (LMT.2HBr) в виде точечного пунктира. Фиг. 15 с показывает кривую динамической сорбции паров (ДСП) для кристаллическойLMT.2MsOH в виде функции времени. Относительная влажность также показана (правая ось). Горизонтальные пунктирные линии показывают стадии поглощения 1 экв. воды. Фиг. 16 показывает картину микроскопии в поляризованном свете LMT.2MsOH (левая) и перекристаллизованной LMT.2MsOH (правая). Кристаллы с размером вплоть до 100 пм получали перекристаллизацией из 2-PrOH/вода. Кристаллы имели нерегулярную форму. Фиг. 17 а-с показывают рентгеновские кристаллические структуры LMT.EsOH, LMT.EDSA иLMT.2MsOH. Фиг. 18 показывает сравнение концентрации в плазме свиньи МТ молекулы с течением времени после введения дозы LMT.2HBr, LMT.2HCl и LMT.2MsOH. Фиг. 19 представляет собой диаграмму устройства, применяемого в исследованиях на растворение(см. пример состава 12). Подробное описание настоящего изобретения Авторы настоящего изобретения обнаружили новый класс фенотиазиндиаминиевых соединений,которые обладают требуемыми физическими или другими свойствами и/или неожиданно увеличивают активность по сравнению с ранее описанными диаминофенотиазиновыми соединениями и солями. В других аспектах они дополнительно обеспечили новые составы фенотиазиндиаминиевых соединений, включая (но без ограничения) класс, приведенный выше. Соединения. В общих чертах, если контекст не требует иначе, соединения настоящего изобретения можно описать как бис-(сульфонатные) соли (или бис-(сульфо) соли) 3,7-диамино-10 Н-фенотиазиновых соединений. Другими словами, соединения представляют собой соли соответствующих 3,7-диамино-10Hфенотиазиновых соединений с органическими сульфокислотами. Более конкретно, соединение настоящего изобретения представляет собой бис-(сульфонатную) соль соединения формулы: Другими словами, соединения настоящего изобретения можно считать продуктами, полученными реакцией 3,7-диамино-10H-фенотиазинового соединения путем деблокирования кольцевой аминогруппы(DP) и образования соли (SF). Дополнительные определения и предпочтения. Группы R1 и R9. Каждый из R1 и R9 независимо представляет собой -Н. Группы R3NA и R3NB. Каждый из R3NA и R3NB представляет собой метил. Группы R7NA и R7NB. Каждый из R7NA и R7NB представляет собой метил. Группа RProt.RProt представляет собой ацил. Комбинации. Все совместимые комбинации вариантов осуществления, описанных выше, явно описаны в настоящем изобретении, как если бы каждая комбинация перечислялась специально и отдельно. В частности, в соединениях настоящего изобретения группы R3NA, R3NB, R7NA, R7NB, R1, R9, RA и RB(и R ) определяют как независимые переменные, и специалисту в данной области техники ясно, что любую совместимую комбинацию данных групп и заместителей можно применять в соединениях и способах настоящего изобретения. Следовательно, все совместимые комбинации данных и других определенных переменных специально включены в настоящее изобретение, и они описаны в настоящем изобретении, как если бы каждая комбинация перечислялась отдельно и явно. Некоторые предпочтительные варианты осуществления Одно конкретное соединение настоящего изобретения представляет собой соединение 1 бис-(метансульфонат) N,N,N',N'-тетраметил-10 Н-фенотиазин-3,7-диаминия. Данное соединение можно также называть бис-(гидрометансульфонатом) N,N,N',N'-тетраметил-10 Н-фенотиазин-3,7-диамина,лейко бис-(гидрометансульфонатом)метилтиониния,лейко бис-(мезилатом)метилтиониния,LMTM,LMT.2MsOH. Чистота. Соединения настоящего изобретения можно удобно описывать как являющиеся "стабилизированной восстановленной формой". Соединения окисляются (например, самоокисляются), давая соответствующие окисленные формы. Таким образом, вероятно, если не неизбежно, что композиции, содержащие соединения настоящего изобретения, будут содержать в качестве примеси, по меньшей мере, некоторую долю соответствующего окисленного соединения. Таким образом, другой аспект настоящего изобретения относится к соединениям, как описано в настоящем изобретении, по существу, в чистой форме и/или в форме, по существу, не содержащей примесей (например, соответствующего окисленного соединения, других примесей). В некоторых вариантах осуществления, по существу, чистая форма имеет по меньшей мере 50 мас.% чистоту, например по меньшей мере 60 мас.% чистоту, например по меньшей мере 70 мас.% чистоту, например по меньшей мере 80 мас.%, чистоту, например по меньшей мере 90 мас.% чистоту,например по меньшей мере 95 мас.%, чистоту, например по меньшей мере 97 мас.% чистоту, например по меньшей мере 98 мас.% чистоту, например по меньшей мере 99 мас.% чистоту. В некоторых вариантах осуществления примеси присутствуют в количестве не более чем 50 мас.%,например не более чем 40 мас.%, например не более чем 30 мас.%, например не более чем 20 мас.%, например не более чем 10 мас.%, например не более чем 5 мас.%, например не более чем 3 мас.%, например не более чем 2 мас.%, например не более чем 1 мас.%. Способ получения продукта. В некоторых вариантах осуществления соединение представляет собой соединение, которое получают или которое можно получить способом, как описано в настоящем изобретении. Химическое получение. Способы химического получения соединений настоящего изобретения описаны в настоящем изобретении. Данные и/или другие хорошо известные способы можно модифицировать и/или приспосабливать известными способами для того, чтобы облегчить получение дополнительных соединений, включенных в объем настоящего изобретения. можно получить из соединений формулы (II) где R1, R9, R3NA, R3NB, R7NA и R7NB такие, как определено ранее. Как описано в данном документе, подходящий фенотиазин можно превратить в соответствующий 3,7-динитрофенотиазин, например, применяя нитрит натрия с уксусной кислотой и хлороформом. Затем кольцевую аминогруппу можно защищать, например, в виде ацетата, например, применяя уксусный ангидрид и пиридин. Затем нитрогруппы можно восстанавливать до аминогрупп, например, применяя хлорид олова (II) с этанолом. Затем аминогруппы можно замещать, например замещать дважды, например дважды замещать метилом, например, применяя метилйодид, гидроксид натрия, ДМСО и бромид тетра-н-бутиламмония, получая N-ацетил защищенный 3,7-диалкиламино-10 Н-фенотиазин. Примеры данного способа показаны на схемах 1 а и 1b. Применение любого одного или более из реагентов, описанных в настоящем изобретении, в способе, конечно, включено в настоящее изобретение. Схема 1 а Затем аминогруппу данного N-ацетильного промежуточного соединения можно деблокировать, т.е.N-ацетильную группу можно удалить, например, применяя водный раствор кислоты. В одном варианте осуществления подходящий хлорид тиониния (например, хлорид метилтиониния,хлорид этилтиониния и т.д.) можно вначале восстановить и ацетилировать, получая соответствующий 1(3,7-бис-диметиламинофенотиазин-10-ил)этанон, например, реакцией с гидразином (NH2NH2), метилгидразином (MeNHNH2) или боргидридом натрия (NaBH4); и уксусным ангидридом Н 3 ССО)2O); например,в присутствии подходящего основания, например пиридина (C5H5N) или основания Хунига (диизопропилэтиламин, C8H19N), например, в подходящем растворителе, например этаноле или ацетонитриле. Затем восстановленное и ацетилированное соединение (формулы (III можно деблокировать (удалением ацетильной группы), например, реакцией с подходящей кислотой, получая соединение формулы (II), или можно применять непосредственно. Предпочтительно данная реакция может давать продукт с высокой степенью чистоты. Пример показан на следующей схеме. Схема 2 В другом варианте осуществления подходящую тиониниевую соль, например хлорид этилтиониния полуцинка, можно одновременно восстановить и кольцевую аминогруппу защищать, например, реакцией с восстанавливающим агентом, фенилгидразином, этанолом, уксусным ангидридом и пиридином. Пример показан на следующей схеме. Схема 3 В некоторых вариантах осуществления способ включает стадию образования соли (SF). В некоторых вариантах осуществления образование соли (SF) включает обработку соединения по изобретению подходящей сульфокислотой. В некоторых вариантах осуществления образование соли включает обработку раствора соединения по изобретению подходящей сульфокислотой в органическом растворителе. Большое разнообразие защитных групп аминогруппы широко применяют, и они являются хорошо известными в органическом синтезе; см., например, Protective Groups in Organic Synthesis (Т. Green and P.Wuts; 4th Edition; John Wiley and Sons, 2006). В некоторых вариантах осуществления защитная группа аминогруппы представляет собой ацильную группу, такую как ацетильная группа. В некоторых вариантах осуществления способ включает стадии деблокирования кольцевой аминогруппы (DP) и образования соли (SF). Деблокирование кольцевой аминогруппы (DP) включает удаление защитной группы, превращая Nзащитную группу кольцевого амина (-NRProt-) в свободную кольцевую аминогруппу (-NH-). Деблокирование соединения формулы (III) дает соответствующее соединение формулы (II). Способы удаления защитных групп аминогруппы являются хорошо известными в данной области техники; см., например, Protective Groups in Organic Synthesis (Т. Green and P. Wuts; 4th Edition; John В некоторых вариантах осуществления стадию деблокирования кольцевой аминогруппы (DP) и стадию образования соли (SF) проводят одновременно (т.е. в виде одной стадии). Например В некоторых вариантах осуществления одновременное деблокирование кольцевой аминогруппы(DP) и образование соли (SF) включает обработку соединения формулы (III) подходящей сульфокислотой, получая бис-(сульфонатную) соль соединения по изобретению. В некоторых вариантах осуществления одновременное деблокирование кольцевой аминогруппы и образование соли может включать обработку раствора соединения формулы (III) в органическом растворителе сульфокислотой и водой. В некоторых вариантах осуществления органический растворитель представляет собой толуол. В некоторых вариантах осуществления сульфокислота может представлять собой дисульфокислоту,т.е. соединение, содержащее два остатка сульфокислоты на молекулу. Данные остатки сульфокислоты могут быть соединены, например, алкиленовой или ариленовой группой. В некоторых вариантах осуществления сульфокислоту можно выбрать из метансульфокислоты(MsOH). В некоторых вариантах осуществления фенотиазиновое исходное соединение (т.е. соединение формулы (III) вначале нагревают в органическом растворителе до полного растворения, и полученный в результате раствор фильтруют перед добавлением реагентов (т.е. сульфокислоты и воды). В некоторых вариантах осуществления соединение нагревают в указанном органическом растворителе при температуре приблизительно 60-80 С, например при температуре приблизительно 70 С. В некоторых вариантах осуществления сульфокислоту добавляют в количестве по меньшей мере 2 мол.экв., например приблизительно 2,2 мол.экв., относительно фенотиазинового исходного соединения. Если применяют дисульфокислоту, ясно, что молярное количество кислоты будет составлять по меньшей мере 1 мол.экв., например приблизительно 1,1 мол.экв., так чтобы получить то же количество остатков сульфокислоты на молекулу фенотиазинового исходного соединения. Может быть желательно добавлять сульфокислоту медленно для предотвращения повышения температуры (экзотермическая реакция). Следовательно, в некоторых вариантах осуществления сульфокислоту добавляют постепенно. В некоторых вариантах осуществления сульфокислоту добавляют при температуре приблизительно 15-25 С. В некоторых вариантах осуществления после добавления сульфокислоты и воды реакцию нагревают до температуры приблизительно 80-90 С. В некоторых вариантах осуществления реакцию выдерживают при данной температуре до установления завершения, например, хроматографическим анализом. В некоторых вариантах осуществления после реакции раствор обрабатывают антирастворителем для осаждения продукта. В некоторых вариантах осуществления антирастворитель представляет собой спирт, например этанол. Может быть желательно вносить "затравку" в реакционную смесь в небольшом количестве, например приблизительно 1 мг на 1 г исходного соединения (соединения формулы (II), требуемого бис(сульфонатного) продукта. Не желая быть связанными теорией, считают, что добавление затравки делает возможным раннее и эффективное осаждение требуемого продукта, снижая возможность побочных реакций и образования побочного продукта. Также считают, что затравка является полезной для контролирования размера частиц выпавшего продукта. Следовательно, в некоторых вариантах осуществления после реакции в полученную в результате смесь вносят затравку в небольшом количестве требуемой бис-(сульфонатной) соли. В некоторых вариантах осуществления затравка содержит требуемую бис-(сульфонатную) соль, которая измельчена. В некоторых вариантах осуществления затравка содержит частицы требуемой бис-(сульфонатной) соли, которая измельчена до размера, меньшего, чем приблизительно 100 мкм. В некоторых вариантах осуществления выпавший продукт выделяют фильтрованием. В некоторых вариантах осуществления после фильтрования продукт промывают органическим растворителем, например этанолом или ацетонитрилом. Образование соли (SF) дает бис-(сульфонатную) соль формулы (I) из соединения формулы (II). Как объясняют выше, бис-(сульфонатную) соль можно также получить непосредственно из соответствующего аминозащиценного (например, N-ацетильного) соединения формулы (III). В данном случае образование соли можно осуществлять одновременно с деблокированием, например, применяя подходящую сульфокислоту, например метансульфокислота, на стадии деблокирования. Пример показан на следующей схеме. Схема 4 В следующем аспекте настоящее изобретение относится к способу получения соединения формулы где RA, RB, R1, R9, R3NA, R3NB, R7NA и R7NB такие, как определено ранее, причем способ включает получение соединения формулы (II) или (III), как определено в настоящем изобретении, с последующим образованием соли (SF) и/или деблокированием кольцевого амина (DP). Стадии образования соли (SF) и деблокирования кольцевого амина (DP) такие, как описано выше. В некоторых вариантах осуществления получение указанного соединения формулы (II) или (III) включает способ, как описано в WO 2007/110627. В некоторых вариантах осуществления получение указанного соединения формулы (II) или (III) включает способ, как описано в WO 2008/007074. В некоторых вариантах осуществления получение соединения формулы (II) включает деблокирование кольцевого амина (DP) соединения формулы (III), как указано выше. Стадии можно осуществлять в любом логическом порядке. В некоторых вариантах осуществления стадии осуществляют в приведенном порядке (т.е. любую стадию в списке проводят одновременно или последовательно с предшествующей стадией в списке). В некоторых вариантах осуществления защищенный 3,7-ди(дизамещенный амино)-10 Нфенотиазин, например N-ацетил 3,7-ди(дизамещенный амино)-10 Н-фенотиазин, подвергают стадии очистки. В некоторых вариантах осуществления очистка включает добавление органического растворителя,например толуола, и кислоты, например уксусной кислоты, растворяя соединение, с последующей стадией промывки. В некоторых вариантах осуществления промывка включает добавление воды и/или водного раствора уксусной кислоты к раствору соединения; встряхивание и/или нагревание; и отделение органического слоя. В некоторых вариантах осуществления промывку повторяют, например, вплоть до трех раз. В некоторых вариантах осуществления за промывкой следует выделение очищенного продукта. В некоторых вариантах осуществления выделение очищенного продукта включает охлаждение,осаждение и фильтрование продукта. Кристаллические формы. В некоторых вариантах осуществления кристаллическая форма имеет структуру, показанную на фиг. 17, и/или характеризуется кристаллическим данными, показанными в добавочной табл. 1, и/или атомными координатами, показанными в добавочной табл. 2, и/или длинами и углами связей, показан- 11025033 ными в добавочной табл. 3, и/или параметрами анизотропного замещения, показанными в добавочной табл. 4, и/или координатами атомов водорода и параметрами изотропного замещения, показанными в добавочной табл. 5. Обращение и/или ингибирование агрегации белка. Один аспект настоящего изобретения представляет собой применение соединения или композиции,как описано в настоящем изобретении, для регулирования (например, обращения и/или ингибирования) агрегации белка, например агрегации белка, связанной с нейродегенеративным заболеванием и/или клинической деменцией. Агрегация может быть in vitro или in vivo, и может быть связана с заболеванием,как обсуждается ниже. Таким образом, один аспект настоящего изобретения относится к способу регулирования (например, обращения и/или ингибирования) агрегации белка, например агрегации белка, связанной с нейродегенеративным заболеванием и/или клинической деменцией, включающему контакт белка с эффективным количеством соединения или композиции, как описано в настоящем изобретении. Способ можно осуществлять in vitro или in vivo. Аналогично, один аспект настоящего изобретения относится к способу регулирования (например,обращения и/или ингибирования) агрегации белка в мозге млекопитающего, где агрегация связана с заболеванием, как описано в настоящем изобретении, причем лечение включает стадию введения нуждающемуся в данном лечении млекопитающему профилактически или терапевтически эффективного количества соединения или композиции, как описано в настоящем изобретении, которое представляет собой ингибитор указанной агрегации. Способы лечения. Другой аспект настоящего изобретения относится к способу лечения, включающему введение нуждающемуся в данном лечении пациенту профилактически или терапевтически эффективного количества соединения, как описано в настоящем изобретении, предпочтительно в виде фармацевтической композиции. Применение в способах терапии. Другой аспект настоящего изобретения относится к соединению или композиции, как описано в настоящем изобретении, для применения в способе лечения (например, заболевания) человека или млекопитающего. Применение в получении лекарственных средств. Другой аспект настоящего изобретения относится к применению соединения или композиции, как описано в настоящем изобретении, для получения лекарственного средства для применения в лечении(например, заболевания). В некоторых вариантах осуществления лекарственное средство содержит соединение настоящего изобретения. В некоторых вариантах осуществления лекарственное средство представляет собой композицию,как описано в настоящем изобретении ниже. Вылечиваемые заболевания - заболевания белковой агрегации. Соединения и композиции настоящего изобретения являются пригодными в лечении или профилактике заболеваний белковой агрегации. Таким образом, в некоторых вариантах осуществления заболевание представляет собой заболевание белковой агрегации и, например, лечение осуществляют количеством соединения или композиции, как описано в настоящем изобретении, достаточным для ингибирования агрегации белка, связанной с указанным заболеванием. В общем, белковая агрегация представляет собой агрегацию, которая является результатом индуцированного конформационного полимеризационного взаимодействия, т.е. агрегацию, при которой конформационное изменение белка или его фрагмента приводит в результате к матричному связыванию и агрегации активированных (предшественники) белковых молекул самораспространяющимся способом. После образования активных центров может возникать агрегационный каскад, который включает индуцированную конформационную полимеризацию активированных белковых молекул, приводя в результате к образованию токсичных результирующих фрагментов продуктов в агрегатах, которые, по существу,являются устойчивыми к дальнейшему протеолизу. Считают, что таким образом образовавшиеся белковые агрегаты являются непосредственной причиной заболеваний, проявляющихся как нейродегенерация,клиническая деменция и другие патологические симптомы. В следующей таблице перечислены различные агрегирующие белки, связанные с заболеваниями, и соответствующие заболевания белковой агрегации. Применение соединений и композиций настоящего изобретения относительно данных белков или заболеваний включено в настоящее изобретение. Как описано в WO 02/055720, WO 2007/110630 и WO 2007/110627, диаминофенэтиазины применяют для ингибирования данных заболеваний, связанных с агрегацией белков. Таким образом, ясно, что за исключением случаев, когда контекст требует иначе, описание вариантов осуществления относительно тау-белка или тау-подобных белков (например, МАР 2; см. ниже) следует понимать как применяемое равно и к другим белкам, обсуждаемым в настоящем изобретении (например, -амилоиду, синуклеину, приону и т.д.) или другим белкам, которые могут вызывать или подвергаться аналогичной патологической агрегации посредством конформационного изменения в домене,важном для развития агрегации, или которые придают протеолитическую стабильность таким образом образовавшемуся агрегату (см., например, статью Wischik et al. в "Neurobiology of Alzheimer's Disease",2nd Edition, 2000, Eds. Dawbarn, D. and Allen, S.J., The Molecular and Cellular Neurobiology Series, BiosScientific Publishers, Oxford). Все данные белки можно называть в настоящем изобретении "агрегирующие белки, связанные с заболеваниями". Аналогично при упоминании в настоящем изобретении "тау-тау агрегации" или подобного это можно также применять относительно другой "агрегации агрегирующих белков", такой как-амилоидная агрегация, прионная агрегация, синуклеиновая агрегация и т.д. То же самое применяют для "тау протеолитической деградации" и т.д. Предпочтительные агрегирующие белки, связанные с заболеваниями Предпочтительные варианты осуществления настоящего изобретения основаны на тау-белке. Термин "тау-белок", как применяют в настоящем изобретении, относится в общем к любому белку семейства тау-белков. Тау-белки характеризуются как являющиеся единственными среди большого набора семейств, которые совместно очищают с микротрубочками в процессе повторяющихся циклов сборки и разборки (см., например, Shelanski et al.,1973, Proc. Natl. Acad. Sci. USA, Vol. 70, p. 765-768), и известны как белки, ассоциированные с микротрубочками (MAP). Члены тау-семейства обладают общими свойствами, заключающимися в наличии характеристичного N-концевого сегмента, последовательностей приблизительно из 50 аминокислот, встроенных в N-концевой сегмент, которые регулируются в мозге; в процессе развития, характеристичной области тандемных повторов, состоящей из 3 или 4 тандемных повторов из 31-32 аминокислот и Сконцевым хвостом. МАР 2 представляет собой преобладающий белок, связанный с микротрубочками, в соматодендритическом отделе (см., например, Matus, А. в "Microtubules" [Hyams and Lloyd, Eds.], p. 155-166, JohnWiley and Sons, New York, USA). MAP2 изоформы являются практически идентичными тау-белку в области тандемных повторов, но отличаются, по существу, и по последовательности, и по удлинениюN-концевого домена (см., например, Kindler and Garner, 1994, Mol. Brain Res., Vol. 26, p. 218-224). Тем не менее, агрегация в области тандемных повторов не является селективной для тау повторяющегося домена. Таким образом, ясно, что любое обсуждение в настоящем изобретении относительно тау-белка или тау-тау агрегации следует рассматривать как относящееся также к тау-МАР 2 агрегации, МАР 2-МАР 2 агрегации и так далее. В некоторых вариантах осуществления белок представляет собой тау-белок. В некоторых вариантах осуществления белок представляет собой синуклеин, например - или-синуклеин. В некоторых вариантах осуществления белок представляет собой TDP-43.TAR ДНК-связывающий белок 43 (TDP-43) представляет собой белок из 414 аминокислот, кодируемый TARDBP в хромосоме lp36.2. Белок является высококонсервативным, повсеместно экспрессируемым и преимущественно локализованным в ядре, но может перемещаться между ядром и цитоплазмой (Mackenzie et al., 2010). Он вовлечен в регуляцию транскрипции и сплайсинга и может играть определенную роль в других процессах, таких как микроРНК процессинг, апоптоз, деление клеток, стабилизация мРНК, регуляция нейрональной пластичности и поддержание дендритной целостности. Более того,с 2006 значительное количество фактов собрано в поддержку гипотезы TDP-43 токсичного усиления функционирования при амиотрофическом латеральном склерозе (ALS). TDP-43 представляет собой наследственный предрасположенный к агрегации белок, и агрегаты, образовавшиеся in vitro, являются ультраструктурно аналогичными TDP-43 отложениям, наблюдаемым при дегенерации нейронов у ALS пациентов (Johnson et al., 2009). Johnson et al. (2008) показали, что когда TDP-43 сверхэкспрессируется в модели дрожжей, только агрегированная форма является токсичной. Несколько in vitro исследований также показали, что С-концевые фрагменты TDP-43, а не полноразмерный TDP-43, более вероятно образуют нерастворимые цитоплазматические агрегаты, которые становятся убиквитиновыми и токсичными для клеток (Arai et al., 2010; Igaz et al., 2009; Nonaka et al., 2009; Zhang et al., 2009). Хотя Nonaka et al.(2009) сделали предположение, что данные цитоплазматические агрегаты связываются с эндогенным полноразмерным белком, уменьшая его содержание в ядре, Zhang et al. (2009) обнаружили задержку нормальной ядерной экспрессии, что предполагает чисто токсичный эффект данных агрегатов. Yang et al.(2010) описывают захват полноразмерного TDP-43 в агрегаты С- и N-концевых фрагментов TDP-43 вNSC34 моторных нейронах в культуре. Нейритный отросток, поврежденный в результате наличия данных укороченных фрагментов, можно сохранить сверхэкспрессией полноразмерного белка. Хотя роль нейритного отростка in vivo не установлена, данная модель служит поддержкой предположению, сделанному Nonaka и коллегами относительно роли TDP-43 агрегации в ALS патогенезе. Неоднократно сообщалось, что экспрессия мутантного TDP-43 в культурах клеток приводит в результате к усиленной генерации С-концевых фрагментов, с даже более сильной цитоплазматической агрегацией и токсическими эффектами, чем белок дикого типа (Kabashi et al., 2008; Sreedharan et al., 2008;Johnson et al., 2009; Nonaka et al., 2009; Arai et al., 2010; Barmarda et al., 2010; Kabashi et al., 2010). Когда белок представляет собой тау-белок, в некоторых вариантах осуществления настоящего изобретения обеспечивают способ ингибирования продуцирования белковых агрегатов (например, в виде спаренных спиральных филаментов (PHF), необязательно в нейрофибриллярных клубках (NFT) в мозге млекопитающего, причем лечение является, как описано выше. Предпочтительные показания - заболевания белковой агрегации. Примечательно, что не только при болезни Альцгеймера (AD) тау-белок (и его нарушенное функционирование или процессинг) может играть свою роль. Патогенез нейродегенеративных заболеваний,таких как болезнь Пика и прогрессирующий надъядерный паралич (PSP), по-видимому, коррелирует с накоплением патологических укороченных тау агрегатов в зубчатой извилине и звездообразных пиримидальных клетках неокортекса соответственно. Другие деменции включают фронто-темпоральную деменцию (FTD); FTD с паркинсонизмом, связанным с хромосомой 17 (FTDP-17); комплекс расторможенность-деменция-паркинсонизм-амиотрофия (DDPAC); паллидо-понто-нигральную дегенерацию (PPND); Гуам-ALS синдром; паллидо-нигро-льюисову дегенерацию (PNLD); кортикобазальную дегенерацию(CBD) и другие (см., например, статью Wischik et al. в "Neurobiology of Alzheimer's Disease", 2nd Edition,2000, Eds. Dawbarn, D. and Allen, S.J., The Molecular and Cellular Neurobiology Series, Bios Scientific Publishers, Oxford; особенно табл. 5.1). Все из данных заболеваний, которые характеризуются в первую очередь или частично нарушенной тау агрегацией, называют в настоящем изобретении "таупатиями". Таким образом, в некоторых вариантах осуществления заболевание представляет собой таупатию. В некоторых вариантах осуществления заболевание представляет собой нейродегенеративную таупатию. В некоторых вариантах осуществления заболевание выбрано из болезни Альцгеймера (AD), болезни Пика, прогрессирующего надъядерного паралича (PSP), фронто-темпоральной деменции (FTD), FTD с паркинсонизмом, связанным с хромосомой 17 (FTDP 17), синдромов лобно-височной лобарной дегенерации (FTLD); комплекса расторможенность-деменция-паркинсонизм-амиотрофия (DDPAC), паллидопонто-нигральной дегенерации (PPND), Гуам-ALS синдрома, паллидо-нигро-льюисовой дегенерации(PNLD), кортикобазальной дегенерации (CBD), деменции с аргирофильными волокнами (AgD), деменции боксеров (DP) или хронической травматической энцефалопатии (СТЕ), синдрома Дауна (DS), деменции с тельцами Леви (DLB), подострого склерозирующего панэнцефалита (SSPE), MCI, болезни Ниманна-Пика типа С (NPC), синдрома Санфилиппо типа В (мукополисахаридоз III В) или миотонической дистрофии (DM), DM1 или DM2, или хронической травматической энцефалопатии (СТЕ). В некоторых вариантах осуществления заболевание представляет собой лизосомальную болезнь накопления с тау патологией. NPC вызвано мутациями в гене NPC1, который влияет на метаболизм холестерина (Love et al., 1995), и синдром Санфилиппо типа В вызван мутацией в гене NAGLU, при котором имеется лизосомальное накопление гепаринсульфата (Ohmi et al. 2009). При данных лизосомальных болезнях накопления наблюдается тау патология, и ее лечение может замедлить развитие заболевания. Другие лизосомальные болезни накопления могут также характеризоваться накоплением тау. Применение диаминиевых солей фенотиазина в лечении болезни Паркинсона и MCI описано более подробно в PCT/GB2007/ЭС 1105 и PCT/GB2008/002066. В некоторых вариантах осуществления заболевание представляет собой болезнь Паркинсона, MCI или болезнь Альцгеймера. В некоторых вариантах осуществления заболевание представляет собой болезнь Хантингтона или другое полиглутаминовое заболевание, такое как спинобульбарная мышечная атрофия (или болезнь Кеннеди), и дентато-рубро-паллидо-льюисова атрофия и различные спинально-церебеллярные атаксии. В некоторых вариантах осуществления заболевание представляет собой FTLD синдром (который может представлять собой, например, таупатию или TDP-43 протеинопатию, см. ниже). В некоторых вариантах осуществления заболевание представляет собой PSP или ALS. В некоторых вариантах осуществления лечение (например, лечение нейродегенеративной таупатии,например, болезни Альцгеймера) может необязательно быть в комбинации с одним или более другими агентами, например одним или более ингибиторами холинэстеразы, такими как донепезил (также известный как Aricept), ривастигмин (также известный как Exelon), галантамин (также известный какRerainyl), NMDA рецепторные антагонисты (такие как мемантин (также известный как Ebixa, Namenda), агонисты мускариновых рецепторов и/или ингибиторы процессинга белка-предшественника амилоида, который ведет к усиленному генерированию бета-амилоида.TDP-43 протеинопатии включают амиотрофический латеральный склероз (ALS; ALS-TDP) и лобновисочную лобарную дегенерацию (FTLD-TDP). Роль TDP-43 в нейродегенерации при ALS и других нейродегенеративных заболеваниях рассмотрена в нескольких недавних публикациях (Chen-Plotkin et al., 2010; Gendron et al., 2010; Geser et al., 2010;ALS представляет собой нейродегенеративное заболевание, характеризующееся прогрессивным параличом и мышечной атрофией, вследствие дегенерации и верхних и нижних моторных нейронов в первичной двигательной коре, стволе головного мозга и спинного мозга. Его иногда называют болезнь двигательного нейрона (MND), но существуют заболевания, отличные от ALS, которые поражают и верхние или нижние моторные нейроны. Точный диагноз требует наличия признаков болезни и в нижних и в верхних моторных нейронах в бульбарной мускулатуре и мускулатуре рук и ног с явным доказательством клинического прогрессирования, которое не объясняется любым другим болезненным процессом(Wijesekera and Leigh, 2009). Хотя большинство случаев являются ALS-TDP, имеются другие случаи, когда патологический белок отличается от TDP-43. Неправильно свернутый SOD1 является патологическим белком в убиквитинположительных включениях при ALS с SOD1 мутациями (Seetharaman et al., 2009) и в очень небольшом поднаборе (приблизительно 3-4%) известных ALS, в результате мутаций в FUS (объединенные в саркомном белке), убиквитиновый патологический белок представляет собой FUS (Vance et al. 2009; Blair et al.,2010). FUS, подобно TDP-43, по-видимому, является важным при перемещении между ядром и цитоплазмой, хотя пути, по которым поврежденное ядро импортирует FUS, остаются неясными. Новая молекулярная классификация ALS, приспособленная Mackenzie et al. (2010), отражает различные лежащие в основе патологические механизмы для различных субтипов (см. таблицу ниже). Новая молекулярная классификация ALS (модифицированная Mackenzie et al., 2010). В большинстве случаев TDP-43 представляет собой патологический убиквитиновый белок, обнаруживаемый при Амиотрофический латеральный склероз общепризнан в качестве нозологической единицы в течение почти 150 лет и общепризнано, что ICD-10 классифицируют как: подтип MND в ICD 10 312.2). Надежная клиническая диагностика является доступной для ALS, которая не сильно отличается от первоначального описания Шарко, и также установлен невропатологический критерий, отражающий лежащую в основе молекулярную патологию. Тогда как ALS классифицируют патологически на три подгруппы, ALS-TDP, ALS-SOD1 и ALSFUS, оба последних заболевания являются редкими. Крупномасштабное исследование в настоящее время показало, что все спорадические ALS случаи имеют TDP-43 патологию (Mackenzie et al., 2007). Только приблизительно 5% ALS являются семейными (Byrne et al., 2010) и мутации в SOD1, наиболее частые мутации, обнаруживаемые при FALS, насчитывают 12-23% случаев (Andersen et al., 2006) SOD1 может также быть непосредственно связанным с 2-7% SALS. Мутации в FUS, по-видимому, гораздо менее часты, насчитывая только приблизительно 3-4% FALS (Blair et al., 2010). Таким образом, можно надежно предсказать, что клинический случай SALS будет иметь патологию на основе TDP-43. Аналогично, это можно легко предсказать при FALS в результате мутаций в TDP-43, которые насчитывают приблизительно 4% случаев (Mackenzie et al., 2010). ALS с мутациями в: также сообщалось, что VCP, насчитывав 1-2% FALS (Johnson et al., 2010), ANG (Seilhean et al., 2009) и CHMP2B (Cox et al., 2010), связаны с TDP43 положительной патологией. Хотя не обнаружено, что SOD1, FUS и ATXN2 мутации связаны с TDP-43 положительными агрегатами, однако сообщалось, что TDP-43 участвует в патологических процессах, как предполагается, возникающих в результате данных мутаций (Higashi et al., 2010; Ling et al., 2010; Elden etal., 2010). Следовательно, установлено, что TDP-43 является важным и играет потенциально центральную роль в патогенезе подавляющего большинства SALS случаев и может участвовать в патогенезе значительной доли FALS. В настоящее время ALS повсеместно считают TDP-43 протеинопатией (Neumann etal., 2009) и многочисленные in vitro и in vivo исследования подтверждают гипотезу, что токсическое усиление функционирования в результате TDP-43 агрегация является ответственной, по меньшей мере, за некоторую долю нейротоксичности при заболевании.FTLD синдромы сопровождаются началом заболевания, протекающим без явных симптомов, являются непрестанно развивающимися, нейродегенеративными заболеваниями с пиком возникновения в позднем среднем возрасте. Часто есть положительная история в семье аналогичных заболеваний у ближайших родственников. Поведенческий вариант FTD характеризуется ранним выделяющимся изменением в социальном и межличностном функционировании, часто сопровождающимся повторяющимся поведением и изменениями режима питания. При семантической деменции имеются выделяющиеся проблемы с нахождением подходящих слов, независимо от другой беглой речи, с ухудшенным знанием объектов и нарушенным пониманием отдельных слов при комплексном исследовании и анализе когнитивных способностей. Прогрессирующая небеглая афазия присутствует в комбинации с проблемами моторной речи и грамматическими нарушениями. Ключевые клинические диагностические признаки для данных трех FTLD синдромов показаны в таблице ниже, и полный критерий в Neary et al. (1998). Клинический профиль и ключевые диагностические признаки FTLD синдромов. За открытием того, что TDP-43-положительные включения характеризуют ALS и FTLD-TDP (Neumann et al., 2006), быстро последовало обнаружение бессмысленных мутаций в TARDBP гене и при семейных и спорадических случаях ALS (Gitcho et al., 2008, Sreedharan et al., 2008). На сегодняшний день сообщается о 38 различных TARDBP мутаций в 7 9 генеалогически неродственных семействах по всему миру (Mackenzie et al., 2010). TARDBP мутации насчитывают приблизительно 4% из всех семейных и приблизительно 1,5% спорадических ALS случаев. По данным на декабрь 2010 г. обнаружены мутации в тринадцати генах, которые связаны с семейным и спорадическим ALS. Связь ALS с пятью другими хромосомными локусами продемонстрирована,но до сих пор не идентифицированы конкретные мутации. Метилтиониний (МТ) при TDP-43 протеинопатиях. МТ имеет механизм действия, который нацелен и может ослаблять TDP-43 белковую агрегацию в клетках, которая представляет собой патологическую особенность подавляющего большинства и семейных и спорадических ALS и также является характеристикой FTLD-P. Кроме того, лабораторные данные показывают, что метилтиониний ингибирует образование TDP43 агрегатов в SH-SY5Y клетках. После обработки 0,05 мкМ МТ количество TDP-43 агрегатов снижается до 50%. Данные находки подтверждаются иммуноблотт-анализом (Yamashita et al., 2009). Следовательно, соединения и композиции настоящего изобретения могут быть пригодны для лечения амиотрофического латерального склероза (ALS) и лобно-височной лобарной дегенерации (FTLD). Метилтиониний (МТ) при болезни Хантингтона и полиглутаминовых заболеваниях. МТ может снижать агрегацию полиглутаминовых белков в клетках, которая представляет собой патологическую особенность болезни Хантингтона. Болезнь Хантингтона вызвана удлинением транслированного CAG повтора, расположенного на N-конце хантингтина. Хромосомы дикого типа содержат 6-34 повторов, тогда как при болезни Хантингтона, хромосомы содержат 36-121 повторов. Возраст возникновения заболевания обратно коррелирует с длинной CAG участков, которые кодируют полиглутаминовые повторы в белке. Лабораторные данные показывают, что метилтиониний ингибирует образование агрегатов хантингтинового производного, содержащего полиглутаминовое удлинение из 102 остатков в данио-рерио (vanBebber et al. 2010). МТ, при испытании при 0,10 и 10 0 мкМ, предотвращал образование данных агрегатов у данио-рерио зависящим от дозы способом. Следовательно, соединения и композиции настоящего изобретения могут быть пригодными для лечения болезни Хантингтона и других полиглутаминовых заболеваний, таких как спинобульбарная мышечная атрофия (или болезнь Кеннеди), и дентато-рубро-паллидо-льюисова атрофия и различные спинально-церебеллярные атаксии (OrrZoghbi, 2007). Митохондриальные заболевания и болезнь Лафора. Органом, который наиболее часто поражается при митохондриальных заболеваниях, в частности заболеваниях дыхательной цепи (RCD), в добавление к скелетным мышцам, является центральная нервная система (ЦНС). ЦНС проявления RCD включают инсульт-подобные эпизоды, эпилепсию, мигрень,атаксию, спастичность, двигательные расстройства, психические расстройства, когнитивные нарушения или даже деменцию (митохондриальную деменцию). До сих пор о митохондриальной деменции сообщалось при MELAS, MERRF, LHON, CPEO, KSS, MNGIE, NARP, синдроме Ли и болезни АльперсаХуттенлохера (Finsterer, 2009). Имеется четыре комплекса в митохондриальной дыхательной цепи,включая серию переносов электронов. Нарушенное функционирование любого из данных комплексов может приводить в результате к митохондриальным заболеваниям, вторичным относительно нарушения цепи переноса электронов, и последующему нарушению митохондриального дыхания. Комплекс III митохондриальной дыхательной цепи действует как переносчик электронов на цитохром С. Соединения и композиции настоящего изобретения можно также применять для лечения митохондриальных заболеваний, которые связаны с недостаточностью и/или нарушением функционирования комплекса III дыхательной цепи. Соединения обладают способностью действовать в качестве носителя и/или переносчика электронов, поскольку тиониниевая молекула имеет низкий окислительновосстановительный потенциал между окисленной и восстановленной формой. В случае нарушения и/или недостаточности функционирования комплекса III, приводящих к митохондриальным заболеваниям, соединения настоящего изобретения также способны осуществлять транспорт электронов и роль переносчика комплекса III из-за способности тиониниевой молекулы превращаться из окисленной в восстановленную форму и обратно, таким образом, действуя как носитель электронов вместо неоптимально функционирующего комплекса III, переносящего электроны на цитохром С. Соединения и композиции настоящего изобретения также обладают способностью генерировать активную тионичиевую молекулу, которая обладает способностью переводить неправильно свернутый белок/аминокислотные мономеры/олигомеры с Hsp70 ADP-связанного белкового накопления и/или путей рефолдинга, и вместо перенаправления данных неправильно свернутых белковых мономеров/олигомеров на путь, который приводит непосредственно к Hsp70 АТР-зависимой убиквитинпротеосомальной системе (UPS), направляет по пути, который удаляет данные неправильно свернутые белки/аминокислотные мономеры /олигомеры прямым путем (Jinwal et al. 2009). Болезнь Лафора (LD) представляет собой аутосомно-рецессивную возникающую в юношестве смертельную эпилепсию, связанную с постепенным накоплением недостаточно разветвленного и нерастворимого гликогена, называемого полиглюкозаном, во многих тканях. В мозге полиглюкозановые тельца или тельца Лафора образуются в нейронах. Ингибирование Hsp70 АТФазы МТ (Jinwal et al. 2009) может активировать удаление неправильно свернутых белков. Болезнь Лафора, в первую очередь, обуслов- 22025033 лена дефектом лизосомальной убиквитин-протеосомальной системы (UPS) из-за мутации или в гене Laforin или в гене Malin, оба из которых расположены в хромосоме 6, которые приводят в результате к включениям, которые ускоряют агрегацию неправильно свернутого тау-белка. Вторичное митохондриальное повреждение в результате нарушения UPS может далее приводить к подавленной митохондриальной активности и нарушению цепи переноса электронов, приводящему к дополнительному липофусцину и вызывающему судороги, которые являются характеристикой болезни Лафора. МТ молекула может разделять существующие тау агрегаты, ослаблять дополнительно тау накопление и увеличивать липосомальную эффективность ингибированием Hsp70 АТФазы. МТ может приводить в результате к уменьшению тау клубков усилением удаления убиквитиновой протеосомальной системой тау мономеров/олигомеров, посредством его ингибирующего действия на Hsp70 АТФазу. Таким образом, соединения и композиции настоящего изобретения могут быть пригодны для лечения болезни Лафора. Вылечиваемые заболевания - другие заболевания. В некоторых вариантах осуществления заболевание представляет собой рак кожи. В некоторых вариантах осуществления заболевание представляет собой меланому. В некоторых вариантах осуществления заболевание представляет собой вирусное, бактериальное или протозойное заболевание. В некоторых вариантах осуществления (протозойное) заболевание представляет собой малярию. Лечение можно осуществлять в комбинации с одним или более противомикробными агентами, например хлороквином и/или атоваквоном. В некоторых вариантах осуществления (вирусное) заболевание вызвано гепатитом С, ВИЧ или вирусом Западного Нила (WNV). Другие применения. Другой аспект настоящего изобретения относится к применению соединений, как описано в настоящем изобретении, в способе дезактивации патогена в образце (например, образце крови или плазмы),включающему стадии введения соединения в образец и воздействия на образец светом. Например, в некоторых вариантах осуществления способ включает стадии введения соединения в образец и затем воздействия на образец светом. Лечение. Термин "лечение", как применяют в настоящем изобретении в контексте лечения заболевания, в общем, относится к лечению и терапии человека или животного (например, при применении в ветеринарии), при котором достигают некоторого желательного терапевтического эффекта, например ингибирования развития заболевания, и включает замедление скорости развития, остановку развития, ослабление симптомов заболевания, облегчение заболевания и вылечивание заболевания. Лечение как профилактическая мера (т.е. профилактика, предотвращение) также включено в это понятие. Термин "терапевтически эффективное количество'", как применяют в настоящем изобретении, относится к такому количеству соединения настоящего изобретения или вещества, композиции или лекарственной формы, содержащей указанное соединение, которое является эффективным для оказания некоторого желательного терапевтического эффекта, с соразмерным соотношением риск/польза, при введении согласно требуемому режиму лечения. Аналогично термин "профилактически эффективное количество", как применяют в настоящем изобретении, относится к такому количеству соединения настоящего изобретения или вещества, композиции или лекарственной формы, содержащей указанное соединение, которое является эффективным для оказания некоторого желательного профилактического эффекта, с соразмерным соотношением риск/польза, при введении согласно требуемому режиму лечения."Профилактику" в контексте настоящего изобретения не следует понимать как достигающую полный успех, т.е. полной защиты или полного предотвращения. Скорее профилактика в контексте настоящего изобретения относится к мере, которую принимают до обнаружения симптоматического состояния с целью сохранить здоровье, помогая приостановить, ослабить или избежать данного конкретного заболевания. Термин "лечение" включает комбинированное лечение и терапию, в котором комбинируют два или более видов лечения или терапии, например, последовательно или одновременно. Примеры лечения и терапии включают, но без ограничения, химиотерапию (введение активных агентов, включая, например,лекарственные средства, антитела (например, как в иммунотерапии), пролекарства (например, как в фотодинамической терапии, GDEPT, ADEPT и т.д.); хирургическую операцию; радиотерапию и генную терапию. Например, может быть полезно комбинировать лечение соединением, как описано в настоящем изобретении, с одним ИЛИ более другими (например, 1, 2, 3, 4) агентами или терапиями. Конкретная комбинация будет определяться на усмотрение лечащего врача, который будет выбирать дозу, применяя общие данные о нем/ней и режимы дозирования, известные практикующему врачу. Агенты (т.е. соединение, как описано в настоящем изобретении, плюс один или более других агентов) можно вводить одновременно или последовательно и можно вводить по индивидуально изменяю- 23025033 щемуся графику дозирования и различными путями. Например, при введении последовательно агенты можно вводить через близко расположенные интервалы времени (например, в течение 5-10 мин) или через более длительные интервалы (например, 1, 2, 3, 4 или более часов между приемами, или даже более длительные периоды между приемами, при необходимости), причем точный режим дозирования соответствует свойствам терапевтического агента(ов). Агенты (т.е. соединение, как описано в настоящем изобретении, плюс один или более других агентов) можно формулировать вместе в виде единичной лекарственной формы, или, альтернативно, отдельные агенты можно формулировать отдельно и предоставлять вместе в виде набора, необязательно с инструкцией по их применению. Пути введения. Соединение настоящего изобретения или содержащую его фармацевтическую композицию можно вводить субъекту/пациенту любым общепринятым способом введения, системно/периферически или местно (т.е. в требуемом месте действия). Пути введения включают, но без ограничения, пероральный (например, при приеме внутрь); буккальный; сублингвальный; трансдермальный (включая, например, с помощью наклейки, пластыря и т.д.); трансмукозальный (включая, например, с помощью наклейки, пластыря и т.д.); интраназальный (например, в виде назального аэрозоля); глазной (например, глазными каплями); легочный (например, ингаляционной или инсуффляционной терапией, применяя, например, аэрозоль, например, через рот или нос); ректальный (например, суппозиторием или клизмой), вагинальный (например, пессарием); парентеральный, например инъекцией, включая подкожную, внутрикожную, внутримышечную, внутривенную,внутриартериальную, внутрисердечную, интратекальную, интраспинальную, внутрикапсульную, интракапсулярную, интраорбитальную, внутрибрюшинную, внутритрахеальную, подкожную, внутрисуставную, субарахноидальную и интрастернальную (включая, например, интракатетерную инъекцию в мозг),имплантатом депо или емкости, например, подкожно или внутримышечно. Предпочтительные композиции представляют собой пероральные композиции, сформулированные,как описано более подробно ниже в настоящем изобретении. Субъект/пациент. Субъект/пациент может представлять собой животное, млекопитающее, плацентарное млекопитающее, грызуна (например, морскую свинку, хомяка, крысу, мышь), мышиных (например, мышь), зайцеобразных (например, кролика), птиц (например, птиц), собак (например, собак), кошачьих (например,кошку), лошадь (например, лошадь), свинью (например, свинью), овцу (например, овцу), крупный рогатый скот (например, корову), примата, человекообразную обезьяну (например, обезьяну или человекообразную обезьяну), обезьяну (например, мартышку, бабуина), однопроходное яйцекладущее (например,утконоса), человекообразную обезьяну (например, гориллу, шимпанзе, орангутана, гиббона) или человека. Более того, субъект/пациент может представлять собой любую из их форм развития, например плод. В некоторых вариантах осуществления субъект/пациент представляет собой человека. Композиции/составы. Когда можно применять соединение настоящего изобретения отдельно (например, вводить), часто предпочтительно предоставлять его в виде композиции или состава. Следовательно, другой аспект настоящего изобретения относится к фармацевтической композиции(например, составу, препарату, лекарственному средству), содержащей соединение, как описано в настоящем изобретении, и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество. В некоторых вариантах осуществления композиция представляет собой фармацевтическую композицию, содержащую по меньшей мере одно соединение, как описано в настоящем изобретении, вместе с одним или более другими фармацевтически приемлемыми ингредиентами, хорошо известными специалисту в данной области техники, включая, но без ограничения, фармацевтически приемлемые носители,разбавители, вспомогательные вещества, адъюванты, наполнители, буферы, консерванты, антиоксиданты, смазывающие вещества, стабилизаторы, солюбилизаторы, поверхностно-активные вещества (например, смачивающие агенты), маскирующие агенты, красители, ароматизаторы и подсластители. Подходящие носители, разбавители, вспомогательные вещества и т.д. можно найти в стандартных фармацевтических текстах; см., например, Handbook of Pharmaceutical Additives, 2nd Edition (eds. M. Ash и I. Ash), 2001 (Synapse Information Resources, Inc., Endicott, New York, USA), Remington's PharmaceuticalSciences, 20th edition, pub. Lippincott, WilliamsWilkins, 2000 и Handbook of Pharmaceutical Excipients,2nd Edition, 1994. Термин "фармацевтически приемлемый", как применяют в настоящем изобретении, относится к соединениям, ингредиентам, материалам, композициям, лекарственным формам и т.д., которые являются,по результатам тщательной медицинской оценки, пригодными для применения в контакте с тканями указанного субъекта (например, человека) без избыточной токсичности, раздражения, аллергической реакции или другой проблемы или осложнения, с соизмеримым соотношением польза/риск. Каждый носи- 24025033 тель, разбавитель, вспомогательное вещество и т.д. должен быть также "приемлемым" в том смысле, что он должен быть совместимым с другими ингредиентами состава. Составы можно получить любыми способами, известными в области фармацевтики. Дачные способы включают стадию смешивания соединения с носителем, который составляет один или более вспомогательных ингредиентов. В общем, составы получают равномерным и тщательным смешиванием соединения с носителями (например, жидкими носителями, мелкодисперсными твердыми носителями и т.д.) и затем, при необходимости, формованием продукта. Состав можно получить для обеспечения быстрого или медленного высвобождения; немедленного,задержанного, регулируемого по времени или пролонгированного высвобождения; или их комбинации. Составы, пригодные для парентерального введения (например, инъекцией), включают водные или неводные, изотонические, апирогенные, стерильные жидкости (например, растворы, суспензии), в которых соединение растворяют, суспендируют или предоставляют иначе (например, в липосоме или другой микрочастице). Данные жидкости могут дополнительно содержать другие фармацевтически приемлемые ингредиенты, такие как антиоксиданты, буферы, консерванты, стабилизаторы, бактериостатические агенты, суспендирующие агенты, загустители и растворенные вещества, делающие состав изотоническим с кровью (или другой соответствующей биологической жидкостью) предполагаемого реципиента. Примеры вспомогательных веществ включают, например, воду, спирты, полиолы, глицерин, растительные масла и подобные. Примеры подходящих изотонических носителей для применения в данных составах включают хлорид натрия для инъекций, раствор Рингера или раствор Рингера с лактатом для инъекций. Обычно концентрация соединения в жидкости составляет от приблизительно 1 нг/мл до приблизительно 10 мкг/мл, например от приблизительно 10 нг/мл до приблизительно 1 мкг/мл. Составы могут быть представлены в виде герметичных емкостей с единичной или несколькими дозами, например, ампул и пробирок, и их можно хранить в лиофилизированном состоянии, требующем добавления только стерильного жидкого носителя, например воды для инъекций, непосредственно перед применением. Приготовленные; для немедленной инъекции растворы и суспензии можно получить из стерильных порошков, гранул и таблеток. Примеры некоторых предпочтительных составов. Один аспект настоящего изобретения относится к единице дозирования (например, фармацевтической таблетке или капсуле), содержащей 20-300 мг соединения, как описано в настоящем изобретении(например, полученного или которое можно получить способом, как описано в настоящем изобретении; имеющего чистоту, как описано в настоящем изобретении; и т.д.), и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество. В некоторых вариантах осуществления единица дозирования представляет собой таблетку. В некоторых вариантах осуществления единица дозирования представляет собой капсулу. В некоторых вариантах осуществления указанные капсулы представляют собой желатиновые капсулы. В некоторых вариантах осуществления указанные капсулы представляют собой НРМС (гидроксипропилметилцеллюлозные) капсулы. В некоторых вариантах осуществления количество составляет 30-200 мг. В некоторых вариантах осуществления количество составляет приблизительно 30 мг. В некоторых вариантах осуществления количество составляет приблизительно 60 мг. В некоторых вариантах осуществления количество составляет приблизительно 100 мг. В некоторых вариантах осуществления количество составляет приблизительно 150 мг. В некоторых вариантах осуществления количество составляет приблизительно 200 мг. Во всем настоящем изобретении дозируемые количества, например, как указано выше, могут относиться к количеству самого соединения или могут относиться к количеству эквивалента свободного основания (т.е. количеству LMT молекулы), содержащемуся в единице дозирования. Обе из данных альтернатив описаны в явной форме в настоящем изобретении. В некоторых вариантах осуществления фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество представляет собой или включает один или оба из глицерида (например, Gelucire 44/14; лауроил макроголь-32 глидериды PhEur, USP) и коллоидного диоксида кремния (например, 2% Aerosil 200; Colliodal Silicon Dioxide PhEur, USP). Новые составы - твердые лекарственные формы. Способы, обычно применяемые для формулирования таблеток и пленочных покрытий, часто требуют применение нагревания, сопровождающегося низкой влажностью при сушке.LMTM и другие лейко-метилтиониевые соли потенциально подвержены окислению до метилтиониниевой молекулы (МТ) и разлагаются, например, до L Azure В (LAB) (см. схему ниже). Для вещества, такого как, например, LMTM, который подвержен окислению (как объясняется выше), общепринятые способы формулирования могут, следовательно, приводить к разложению и, следовательно, потенциально, к нестабильности характеристик продукта. Принцип, лежащий в основе составов настоящего изобретения, следовательно, заключается в обеспечении способа получения прессованных фармацевтических составов и капсул, содержащих лейкометилтиониевые соли, например бис-(метансульфонат) (LMTM) в качестве активного вещества, прямым способом прессования таблеток или другими уникальными способами таблетирования, и инкапсулированием, в котором активное вещество существует, по существу, в стабильной форме. Самым часто применяемым способом для получения твердых лекарственных форм является влажное гранулирование (также называемое мокрым гранулированием). Оно включает добавление гранулирующей жидкости к порошку. Данная гранулирующая жидкость может представлять собой воду или другой растворитель, который является достаточно летучим, чтобы впоследствии его можно было удалить сушкой. Гранулирующая жидкость может также содержать связующее. После удаления растворителя полученную в результате массу измельчают. Влажное гранулирование является часто предпочтительным относительно прямого прессования,поскольку влажное гранулирование, более вероятно, преодолевает проблемы, связанные с физическими характеристиками различных ингредиентов в составе. Влажное гранулирование дает материал, который обладает требуемыми свойствами текучести и когезивными свойствами, требуемыми для получения подходящей твердой лекарственной формы. Однородность состава твердой лекарственной формы обычно улучшают влажным гранулированием, поскольку все из гранул обычно содержат одинаковое количество лекарственного средства. Также избегают отделения лекарственного средства от вспомогательного вещества. В прямом прессовании отдельные составляющие композиции, которые будут прессовать, смешивают без предварительного гранулирования и затем непосредственно прессуют. Хотя, по-видимому, он представляет собой элегантный и простой способ, может быть трудно получить им коммерчески пригодные таблетки, которые имеют достаточную дозу, которые, кроме того, также достаточно быстро распадаются после введения. Кроме того, многие активные вещества нельзя обрабатывать прямым прессованием, поскольку они не прессуются без стадии гранулирования. В настоящее время неожиданно обнаружили, что соединения настоящего изобретения являются стабильными в твердой лекарственной форме, полученной сухим прессованием, талой как таблетка, при получении и хранении, и что количество образующихся продуктов разложения, таких как L Azure В(LAB) и метилтиониний (МТ), можно контролировать в пределах установленных требований (например,LAB менее чем 2% и МТ менее чем 12%). Это противоположно поведению, например, LMTM при обработке общепринятым способом влажного гранулирования. Не желая быть связанными теорией, в общепринятом способе влажного гранулирования LMTM, например, может быть очень нестабильным, и может образовываться значительное количество LAB и МТ. Соответственно один аспект настоящего изобретения обеспечивает фармацевтическую композицию, содержащую соединение настоящего изобретения, в твердой лекарственной форме. Композиция предпочтительно дополнительно содержит по меньшей мере один разбавитель, подходящий для сухого прессования. Фармацевтическая композиция характеризуется тем, что соединение существует, по существу, в стабильной форме. Другой аспект настоящего изобретения обеспечивает сыпучий, структурообразующий порошок, содержащий соединение настоящего изобретения и по меньшей мере один разбавитель, пригодный для сухого прессования, и, необязательно, одно или более других вспомогательных веществ, причем указанный порошок можно прессовать до твердой лекарственной формы. Данные композиции и составы первоначально описывают в настоящем изобретении относительно бис-(сульфонатных) солей настоящего изобретения, в частности LMTM. Однако преимущества настоящих способов формулирования равно применимы к другим членам лейко-метилтиониевого семейства солей. Например, составы, описанные в настоящем изобретении, являются применимыми также к 3,7 диамино-10 Н-фенотиазиниевым солям, описанным в W0 2007/110627 (WisTa Laboratories Ltd), которые коротко обсуждаются выше. Они включают бис-(гидробромид) лейко-метилтиония (LMT.2HBr, LMTB) и бис-(гидрохлорид) лейко-метилтиония (LMT.2HCl, LMTC). Следовательно, в более широком аспекте настоящее изобретение обеспечивает фармацевтическую композицию, содержащую соединение следующей формулы: в твердой лекарственной форме, как описано в настоящем изобретении. Как применяют в настоящем изобретении далее, термин "активный ингредиент" относится к подходящей лейко(метилтиониниевой) соли. Другими словами, он относится к соединению формулы (I), такому как соединение настоящего изобретения, например LMTM. Другой аспект настоящего изобретения обеспечивает способ получения указанных фармацевтических композиций способом сухого прессования. Данный способ предпочтительно включает сухое прессование тонко перемешанной порошковой смеси активного соединения по меньшей мере с одним разбавителем, пригодным для сухого прессования, и, необязательно, одним или более другими вспомогательными веществами. В некоторых вариантах осуществления данный способ включает прямое прессование. В некоторых вариантах осуществления данный способ включает простое прямое прессование. В некоторых вариантах осуществления данный способ включает сухое гранулирование. Твердые лекарственные формы согласно настоящему изобретению предпочтительно обладают длительной химической и физической стабильностью активного ингредиента (соединения настоящего изобретения, например, LMTM). Фармацевтические композиции согласно настоящему изобретению также обладают быстрой скоростью растворения даже после длительного хранения."По существу, стабильная" форма активных ингредиентов обозначает, в настоящем контексте, форму, которая не реагирует, образуя примеси, такие как окисленные примеси или другие продукты разложения в любой значительной степени в процессе формулирования или при хранении сформулированного продукта. Следовательно, в настоящем контексте оно может относиться к веществу, которое содержит, например, менее чем 20, менее чем 15 или менее чем 10% мас./мас. окисленных примесей или других продуктов разложения. Другими словами, вещество содержит по меньшей мере 80, по меньшей мере 85 или по меньшей мере 90% мас./мас. чистого активного ингредиента в его первоначальной (непрореагировавшей) форме. В некоторых вариантах осуществления материал, содержащий активный ингредиент, может содержать, например, менее чем 20, менее чем 15, менее чем 12 или менее чем 10% мас./мас. МТ. В некоторых вариантах осуществления материал может содержать, например, менее чем 5, менее чем 3 или менее чем 2% мас./мас. LAB."Стабильная" таблетка в контексте настоящего изобретения представляет собой таблетку, которая сохраняется, по существу, стабильной после длительного хранения в контролируемых условиях температуры и влажности. Испытание на стабильность можно проводить с твердыми лекарственными формами,непосредственно подверженными выбранным условиям окружающей среды, или с твердыми лекарственными формами, содержащимися в упаковке. Содержание активного ингредиента. Количество активного ингредиента в композиции без покрытия обычно составляет более чем приблизительно 10% мас./мас., но может составлять более чем 20 или более чем 30% мас./мас. Количество активного ингредиента обычно составляет менее чем приблизительно 70% мас./мас. и обычно менее чем 60 или менее чем 50% мас./мас. в таблетке. Обычно, количество активного ингредиента в составе сердцевины таблетки без покрытия, таким образом, составляет от приблизительно 10% мас./мас. (или 20, или 30% мас./мас.) до приблизительно 70% мас./мас. (или 60, или 50% мас./мас.). При нанесении покрытия на композицию, как описано ниже, суммарный вес композиции увеличивается и, таким образом, процент активного ингредиента в суммарной композиции немного снижается. Разбавители. Активный ингредиент может по своей природе быть не способен к прессованию и, таким образом,может требовать добавления подходящих разбавителей для облегчения прессования. Следовательно, фармацевтические композиции настоящего изобретения обычно содержат по меньшей мере 15, более обычно по меньшей мере 20, по меньшей мере 30, по меньшей мере 40 или по меньшей мере 50% мас./мас. разбавителя(ей). Разбавители, которые можно применять, включают один или более из микрокристаллической целлюлозы, лактозы, маннита, солей кальция, таких как гидрофосфат дикальция, сульфат кальция и карбонат кальция, и Сахаров, таких как лактоза, сахароза, декстроза и мальтодекстрин. Предпочтительными разбавителями являются микрокристаллическая целлюлоза, лактоза и маннитол. Высушенные распылением формы лактозы и маннитолы являются особенно подходящими формами данных соединений для способа прямого прессования или сухого гранулирования. Неожиданно обнаружили, что когда активный ингредиент, как описано в настоящем изобретении,например соединение настоящего изобретения, такое как LMTM, смешивают с разбавителями для сухого прессования, такими как один или более из микрокристаллической целлюлозы, высушенной распылением лактозы, безводной лактозы и маннитола, полученные в результате твердые лекарственные формы являются пригодными в том смысле, что активный ингредиент остается химически стабильным, даже после продолжительного хранения. Таким образом, настоящее изобретение относится к способу получения таблеток с низкой, средней или высокой дозой, например таблеток с низкой, средней или высокой дозой LMTM, которые являются стабильными и имеют хорошие профили растворения, приемлемые степени твердости и устойчивости к раздроблению, а также короткое время распада. Растворение композиций настоящего изобретения. Авторы настоящего изобретения также неожиданно обнаружили, что индивидуальные твердые лекарственные формы, описанные в настоящем изобретении, имеют очень быструю скорость растворения. Как объясняют в настоящем изобретении далее и не желая быть связанными теорией, считают, что активная метилтиониниевая (МТ) молекула может предпочтительно поглощаться из желудка и/или верхней части желудочно-кишечного тракта. Быстро распадающийся и быстро растворяющийся состав лейко(метилтиониниевых) солей будет, следовательно, предпочтительным, поскольку он будет доставлять максимально возможное количество лекарственного средства в предполагаемое место поглощения. Быстрая скорость растворения твердых лекарственных форм, описанных в настоящем изобретении,обозначает то, что они являются способными быстро растворяться в желудке и/или верхней части желудочно-кишечного тракта и, следовательно, эффективно выделять активный ингредиент в данном месте для быстрого поглощения. В некоторых вариантах осуществления составы нестоящего изобретения при оценке, применяя стандартный способ фармакопеи, дают по меньшей мере 80% растворение в пределах 30 мин, предпочтительно по меньшей мере 80% растворение в пределах 15 мин, более предпочтительно по меньшей мере 80% растворение в пределах 10 мин. В некоторых вариантах осуществления составы настоящего изобретения при оценке, применяя стандартный способ фармакопеи, дают по меньшей мере 90% растворение в пределах 30 мин, предпочтительно по меньшей мере 90% растворение в пределах 15 мин, более предпочтительно по меньшей мере 90% растворение в пределах 10 мин. В некоторых вариантах осуществления составы настоящего изобретения при оценке, применяя стандартный способ фармакопеи, дают по меньшей мере 95% растворение в пределах 30 мин, предпочтительно по меньшей мере 95% растворение в пределах 15 мин, более предпочтительно по меньшей мере 95% растворение в пределах 10 мин. Скорости растворения можно измерить стандартными способами фармакопеи, как описано в фармакопее Соединенных Штатов Америки (USP) общая глава 711. Настоящая USP представляет собойUSP 34 (2011). Например, скорости растворения для составов настоящего изобретения можно измерить,применяя прибор согласно USP Dissolution Apparatus 2 (с лопастью). В некоторых вариантах осуществления приведенные выше скорости растворения оценивают в 0,1 М хлористо-водородной кислоте при рабочей концентрации 5 мкг/мл LMT, при перемешивании при скорости лопасти 50 об/мин. В некоторых вариантах осуществления скорости растворения оценивают спектрофотометрическим анализом. В некоторых вариантах осуществления анализ включает УФ/ВО спектрофотометрию (max LMT=255 нм). Как следствие их неожиданно высокой скорости растворения способы формулирования, описанные в настоящем изобретении, могут давать активное соединение с высокой степенью биодоступности. Быстрая скорость растворения сохраняется после длительного хранения, даже если хранение осуществляют в "стрессовых" условиях (т.е. повышенные температура и влажность). Быстрая скорость растворения и, следовательно, хорошая биодоступность, композиций, формулируемых согласно данным способам настоящего изобретения, является также малочувствительной к изменениям в самом составе. Другие ингредиенты. Фармацевтическая композиция будет обычно также содержать смазывающее вещество. Примеры смазывающих веществ включают стеарат магния, стеарат кальция, стеарилфумарат натрия, стеариновую кислоту, глицерилбигаптат, полиэтиленгликоль, этиленоксидные полимеры (например, те, которые доступны под зарегистрированным товарным знаком Carbowax от Union Carbide, Inc., Danbury, CT), лаурилсульфат натрия, лаурилстеарат магния, смеси стеарата магния с лаурилсульфатом натрия и гидрогенизированное растительное масло. Предпочтительные смазывающие вещества включают стеарат кальция,стеарат магния и стеарилфумарат натрия. Более предпочтительным в качестве смазывающего вещества является стеарат магния. Смазывающие вещества обычно содержатся в количестве от приблизительно 0,5 до приблизительно 5,0% суммарного веса (непокрытой) таблетки. Количество применяемого смазывающего вещества обычно составляет от приблизительно 1,0 до приблизительно 2,0, предпочтительно 0,5-2,0% мас./мас. В добавление к разбавителю(ям) и смазывающему(им) веществу(ам), другие общепринятые вспомогательные вещества могут также присутствовать в фармацевтических композициях настоящего изобретения. Данные дополнительные вспомогательные вещества включают разрыхлители, связующие, ароматизаторы, красители и регуляторы сыпучести. Некоторые вспомогательные вещества могут выполнять несколько функций, например, и как связующее, и как разрыхлитель для таблеток. Разрыхлитель для таблеток может присутствовать в количестве, необходимом для достижения быстрого растворения. Разрыхлители представляют собой вспомогательные вещества, которые противодействуют физическим силам соединения частиц в таблетке или капсуле, когда лекарственную форму помещают в водный раствор. Примеры разрыхлителей включают поперечно сшитый поливинилпирролидон (кросповидон), натрий-крахмалгликолят, поперечно сшитую натрий-карбоксиметилцеллюлозу (кроскармелоза натрия) и прежелатинизированный крахмал. Обычно количество разрыхлителя может составлять от 0 до приблизительно 25% мас./мас., более обычно от приблизительно 1 до приблизительно 5% мас./мас. и обычно менее чем 10 или менее чем 5% мас./мас. композиции. Связующие представляют собой вспомогательные вещества, которые способствуют слипанию частиц в твердом составе. Примеры связующих включают целлюлозные производные (карбоксиметилцеллюлозу, гидроксипропилметилцеллолозу, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу, этилцеллюлозу, микрокристаллическую целлюлозу) и сахара, такие как лактоза, сахароза, декстроза, глюкоза, мальтодекстрин и маннитол, ксилитол, полиметакрилаты, поливинилпирролидон, сорбитол, прежелатинизированный крахмал, альгиновые кислоты и их соли, такие как альгинат натрия, силикат магния алюминия, полиэтиленгликоль, каррагенан и подобные. Обычно, количество связующего будет изменяться в широком диапазоне, например от 0 до 95% мас./мас. композиции. Как отмечалось выше, вспомогательные вещества могут выполнять несколько функций. Например, разбавитель для таблетирования может служить как связующее. Регуляторы сыпучести представляют собой вещества, добавляемые к порошку для улучшения его текучести. Примеры регуляторов сыпучести включают стеарат магния, коллоидный диоксид кремния(такие как степени качества, продаваемые как Aerosil), крахмал и тальк. Регуляторы сыпучести могут присутствовать в фармацевтической композиции при концентрации от 0 до приблизительно 5% мас./мас. Снова, однако, следует отметить, что вспомогательные вещества могут выполнять несколько функций. Смазывающее вещество, например стеарат магния, может служить также в качестве регулятора сыпучести. Примеры красителей, которые можно вводить в фармацевтические композиции настоящего изобретения, включают диоксид титана и/или красители, пригодные в пищу, такие как красители, известные как FDC красители и природные окрашивающие агенты. Мало вероятно, что краситель будут применять в порошковой смеси, которую прессуют согласно аспектам настоящего изобретения, обсуждаемым выше, но он может образовывать часть покрытия, наносимого на композицию, как описано ниже, в данном случае краситель может присутствовать в пленочном покрытии в количестве вплоть до приблизительно 2,0% мас./мас. Таблетку желательно покрывать общепринятым пленочным покрытием, которое придает твердость,облегчает проглатывание и придает элегантный внешний вид конечному продукту. Многие полимерные материалы для пленочного покрытия являются хорошо известными в данной области техники. Предпочтительным материалом для пленочного покрытия является гидроксипропилметилцеллюлоза (НРМС) или частично гидролизованный поливиниловый спирт (PVA). НРМС и PVA можно получить из коммерческих источников, например у Colorcon, в виде составов для нанесения покрытия, содержащих вспомогательные вещества, которые служат в качестве веществ, облегчающих нанесения покрытия, под зарегистрированной товарной маркой Opadry. Opadry составы могут также содержать тальк, полидекстрозу, три- 29
МПК / Метки
МПК: A61K 31/5415, A61P 25/00, C07D 279/20
Метки: диаминиевые, фенотиазина, применение, соли
Код ссылки
<a href="https://eas.patents.su/30-25033-diaminievye-soli-fenotiazina-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Диаминиевые соли фенотиазина и их применение</a>












