Производные 6-циклоалкил-1,5-дигидропиразоло[3,4-d]пиримидин-4-она и их применение в качестве ингибиторов pde9a
Номер патента: 24984
Опубликовано: 30.11.2016
Авторы: Айкмайер Кристиан, Хайне Никлас, Джованнини Риккардо, Феррара Марко, Розенброк Хольгер, Шэнцле Герхард
Формула / Реферат
1. Соединение формулы (I)
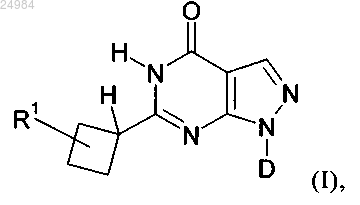
в которой
R1 обозначает 5- или 6-членную гетероарильную группу, в которой 1, 2, 3 или 4 из кольцевых атомов являются гетероатомами, которые независимо друг от друга выбраны из N, О или S,
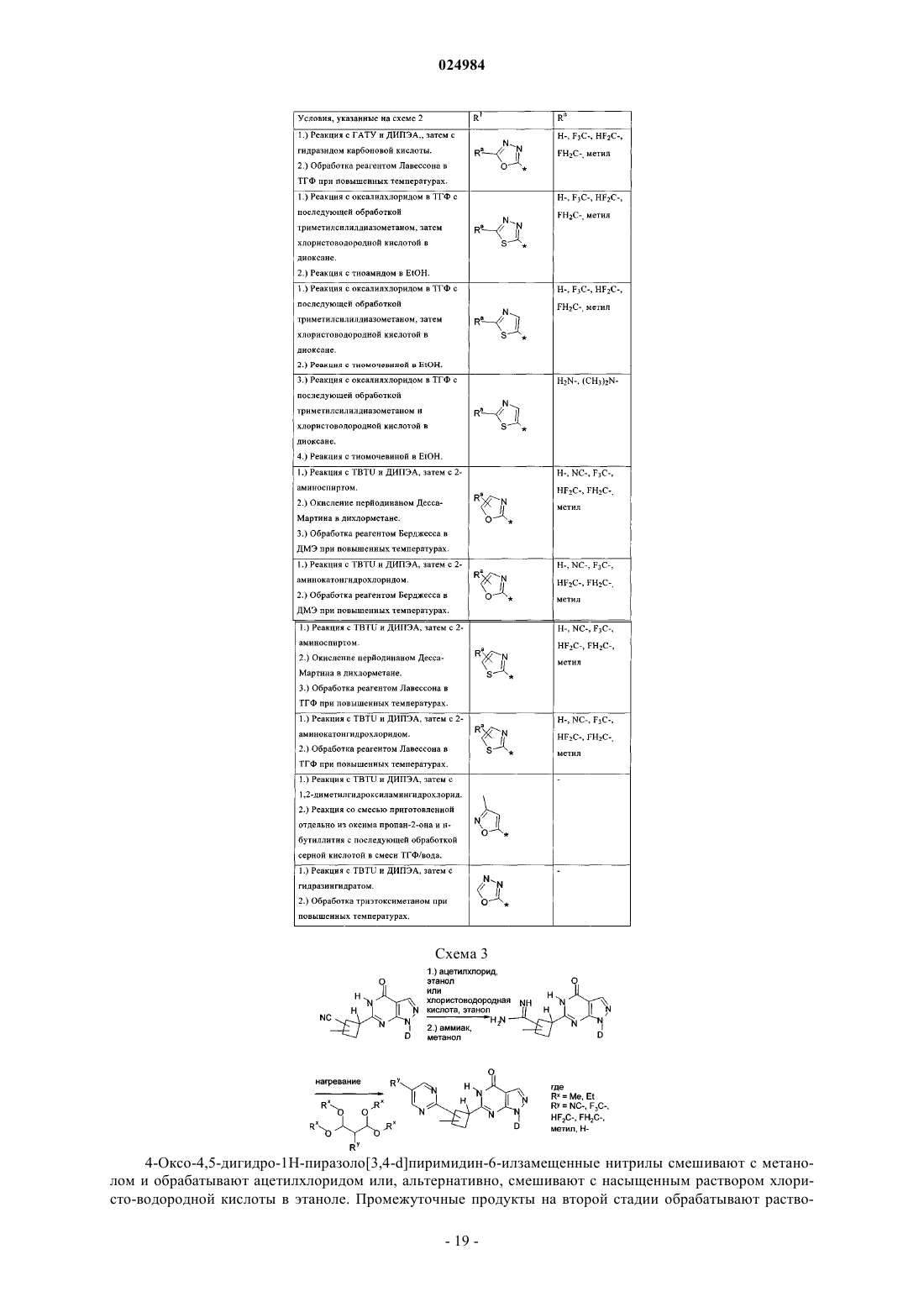
где указанная 5- или 6-членная ароматическая гетероарильная группа необязательно может содержать 1, 2, 3 или 4 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, НО-, NC-, F3C-, HF2C-, FH2C-, метил, H2N- и (CH3)2N-;
D выбран из группы, включающей циклогексил, тетрагидропиранил, 2-, 3- и 4-пиридил,
где циклогексил необязательно может содержать 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, NC-, F3C-, HF2C- и FH2C-;
где тетрагидропиранил необязательно может содержать 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, NC-, F3C-, HF2C- и FH2C-;
где пиридил необязательно может содержать 1 заместитель, где указанный заместитель может быть выбран из группы, включающей фтор, хлор, бром, NC-, F3C-, HF2C-, FH2C-, F3C-CH2-, C1-С6-алкил- и С3-С7-циклоалкил,
и его фармацевтически приемлемые соли;
при условии, что соединение не представляет собой
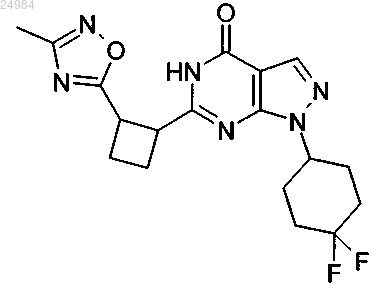
в форме любого возможного стереоизомера или смеси всех или некоторых из них.
2. Соединение по п.1, в котором
R1 обозначает 5- или 6-членную гетероарильную группу, в которой 1, 2, 3 или 4 из кольцевых атомов являются гетероатомами, которые независимо друг от друга выбраны из N, О или S,
где указанная 5- или 6-членная ароматическая гетероарильная группа необязательно может содержать 1, 2, 3 или 4 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, NC-, F3C-, HF2C-, FH2C-, метил, H2N- и (CH3)2N-;
D выбран из группы, включающей циклогексил, тетрагидропиранил 2-, 3- и 4-пиридил,
где циклогексил необязательно может содержать 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, F3C-, HF2C- и FH2C;
где тетрагидропиранил необязательно может содержать 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, F3C-, HF2C- и FH2C-;
где пиридил необязательно может содержать 1 заместитель, где указанный заместитель может быть выбран из группы, включающей фтор, хлор, бром, NC-, F3C-, HF2C-, FH2C-, F3C-CH2-, С1-С6-алкил- и С3-С7-циклоалкил;
и его фармацевтически приемлемые соли.
3. Соединение по п.2, в котором
R1 обозначает гетероарильную группу, выбранную из группы, включающей тиадиазолил, оксадиазолил, изоксазолил, тиазолил, оксазолил, пиридил и пиримидинил,
где указанная гетероарильная группа необязательно может содержать 1, 2, 3 или 4 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, NC-, F3C-, HF2C-, FH2C-, метил, H2N- и (CH3)2N-.
4. Соединение по п.1, в котором
R1 обозначает гетероарильную группу, выбранную из группы, включающей тиадиазолил, 1,2,3-оксадиазолил, 1,3,4-оксадиазолил, 1,2,5-оксадиазолил, изоксазолил, тиазолил, оксазолил, пиридил и пиримидинил,
где указанная гетероарильная группа необязательно может содержать 1, 2, 3 или 4 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, NC-, F3C-, HF2C-, FH2C-, метил, H2N- и (CH3)2N-;
D выбран из группы, включающей циклогексил, тетрагидропиранил, 2-, 3- и 4-пиридил,
где циклогексил необязательно может содержать 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, F3C-, HF2C- и FH2C-;
где тетрагидропиранил необязательно может содержать 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, F3C-, HF2C- и FH2C-;
где пиридил необязательно может содержать 1 заместитель, где указанный заместитель может быть выбран из группы, включающей фтор, хлор, бром, NC-, F3C-, HF2C-, FH2C-, F3C-CH2-, C1-С6-алкил- и С3-С7-циклоалкил;
и его фармацевтически приемлемые соли.
5. Соединение по любому из пп.1-4, в котором R1 не обозначает незамещенный или замещенный оксадиазолил.
6. Соединение по п.4, в котором
R1 обозначает гетероарильную группу, выбранную из группы, включающей [1,3,4]тиадиазол-2-ил, изоксазол-5-ил, тиазол-5-ил-, оксазол-2-ил, пиридин-2-ил и пиримидин-2-ил,
где указанная гетероарильная группа необязательно может содержать 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, CN-, метил и H2N-;
D выбран из группы, включающей циклогексил, тетрагидропиран-4-ил, 2-, 3- и 4-пиридил,
где циклогексил необязательно может содержать 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, F3C-, HF2C- и FH2C-;
где тетрагидропиранил необязательно может содержать 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, F3C-, HF2C- и FH2C-;
где пиридил необязательно может содержать 1 заместитель, где указанный заместитель может быть выбран из группы, включающей фтор, хлор, бром, NC-, F3C-, HF2C-, FH2C-, F3C-CH2- и метил;
и его фармацевтически приемлемые соли.
7. Соединение по п.1, отличающееся тем, что оно является соединением формулы (II)

в которой R1 является таким как определено в любом из пп.1-5 или 6;
D выбран из группы, включающей 4,4-дифторциклогексил, тетрагидропиран-4-ил и 4-метил-3-пиридил;
и его фармацевтически приемлемые соли.
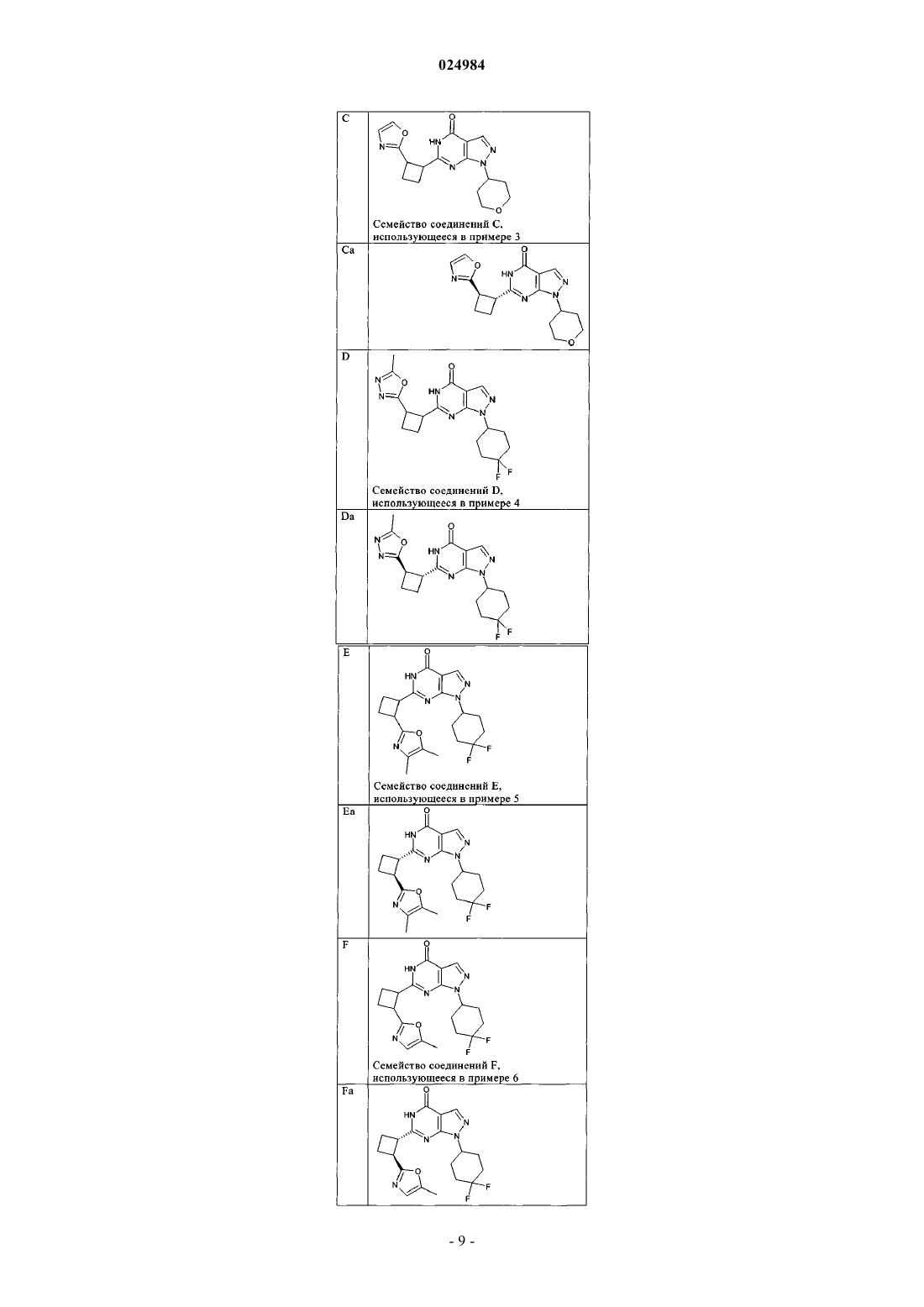
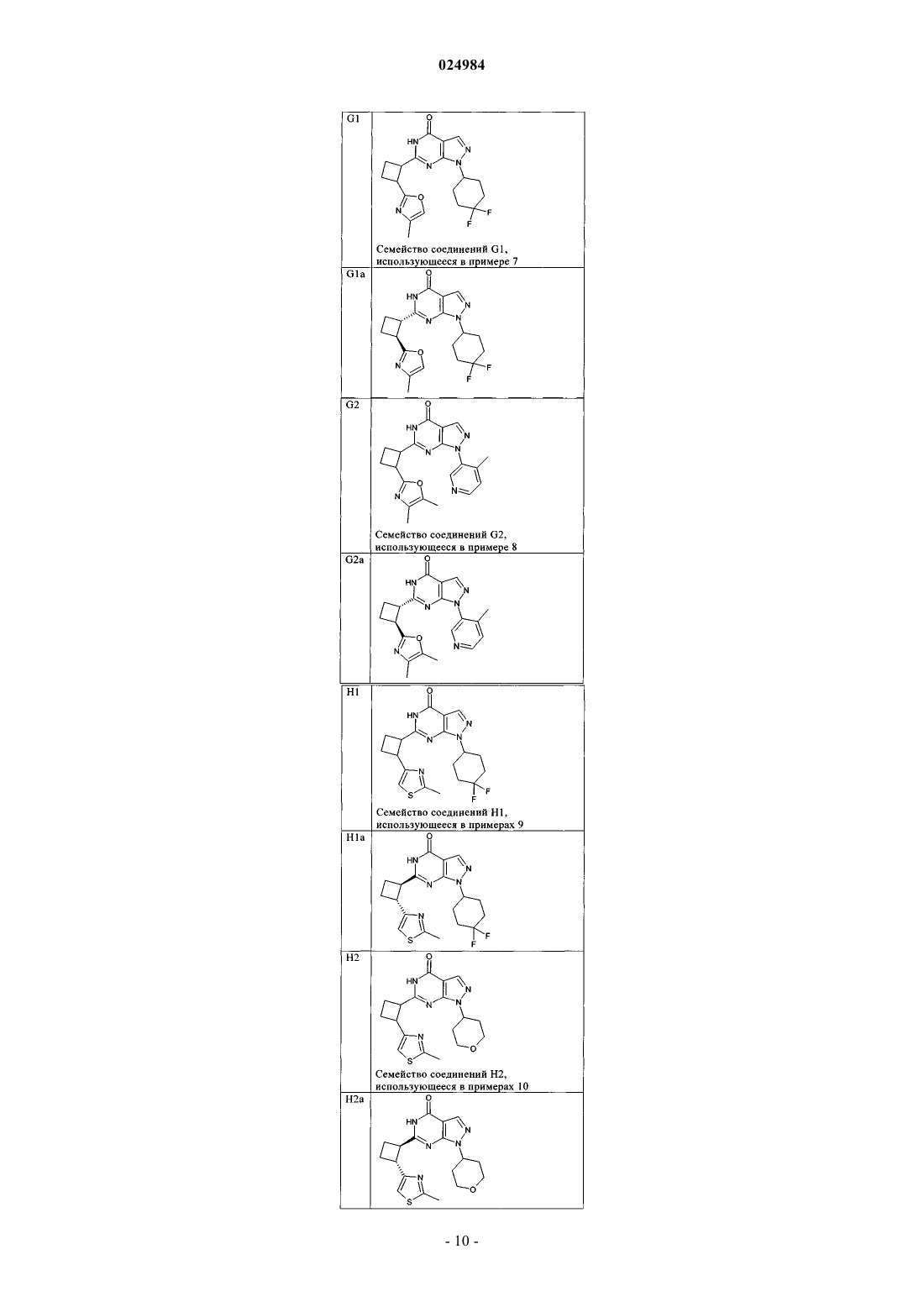
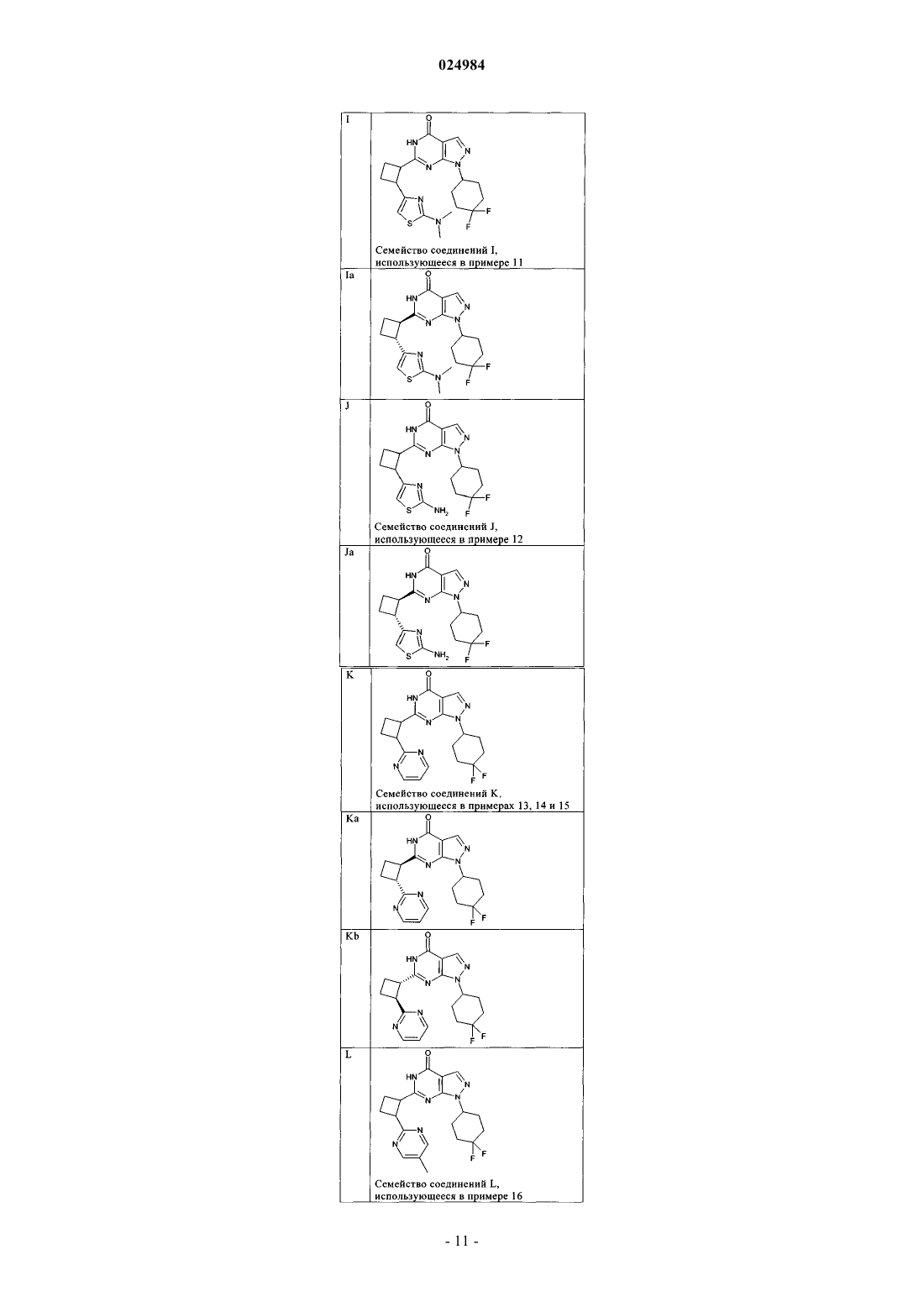
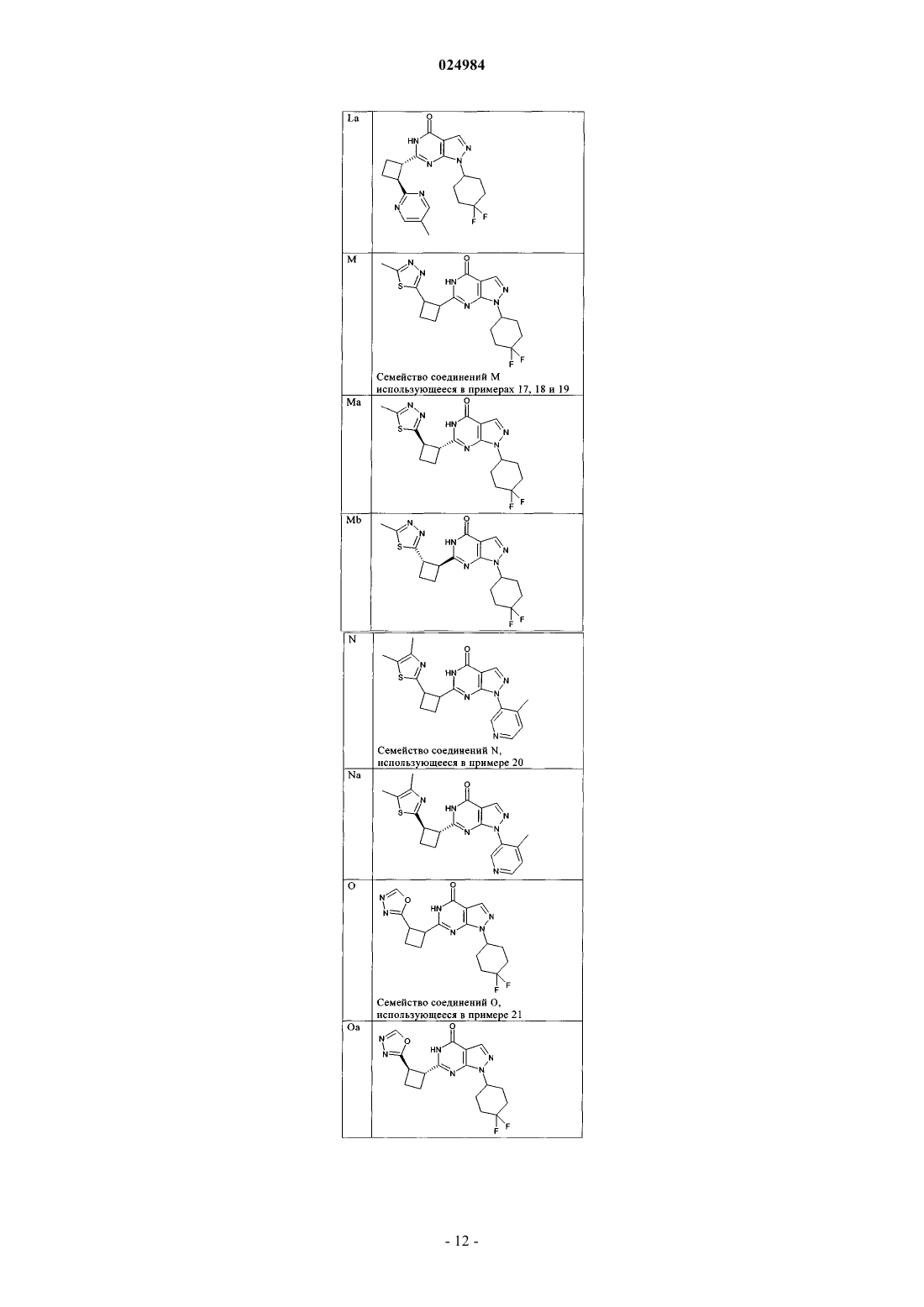
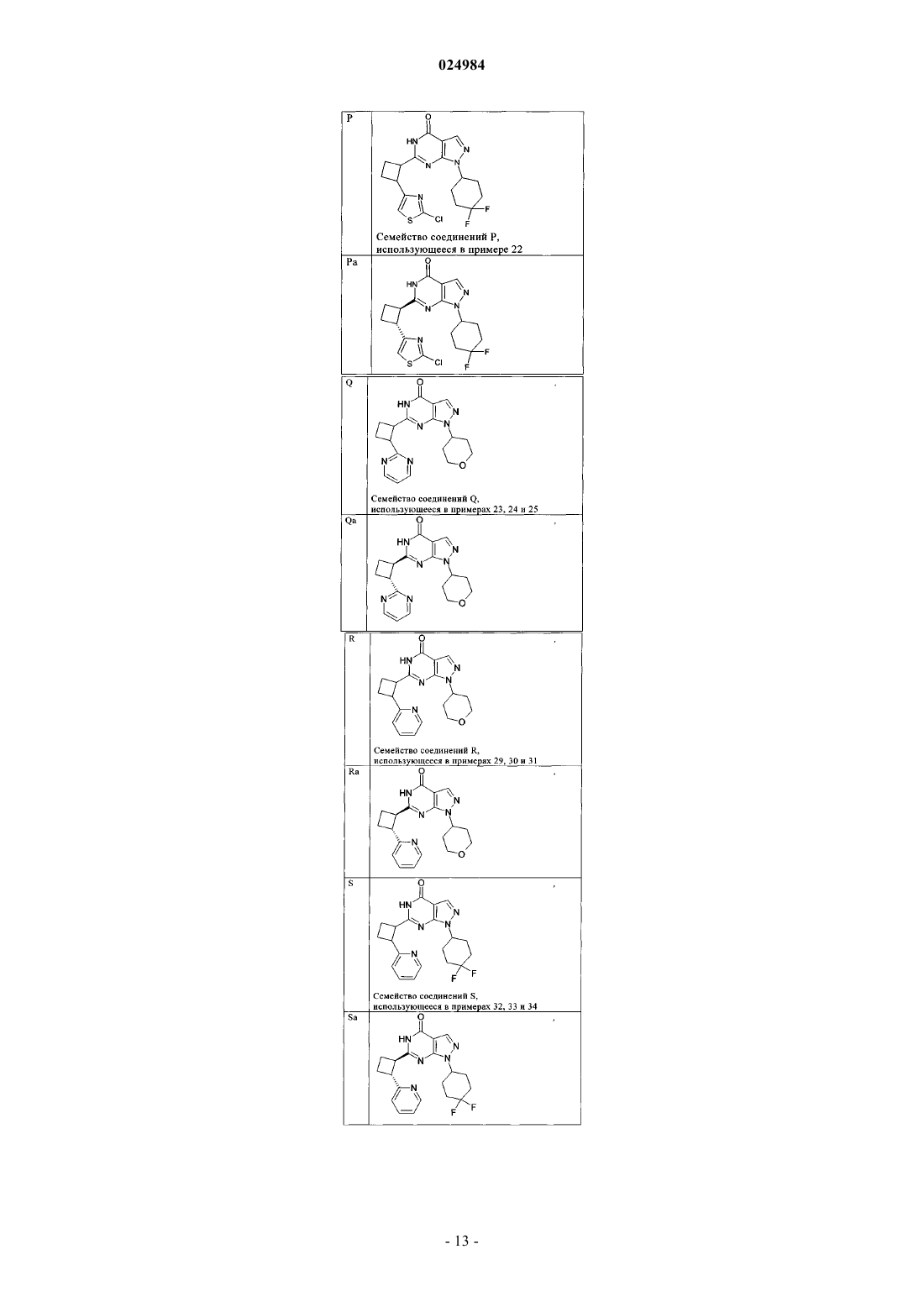
8. Соединение по п.7, которое выбрано из группы, включающей
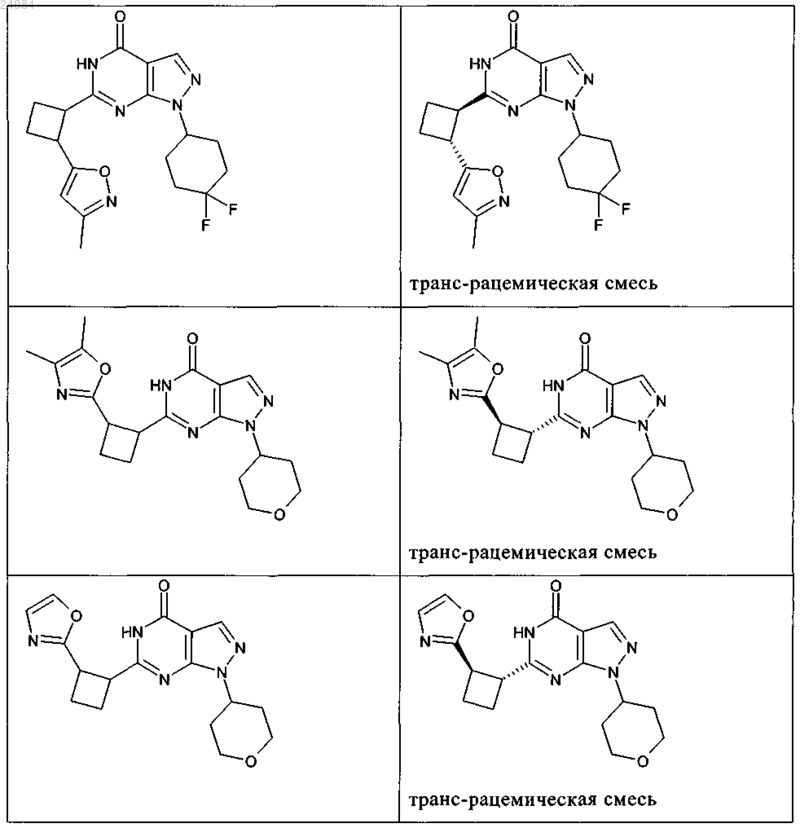
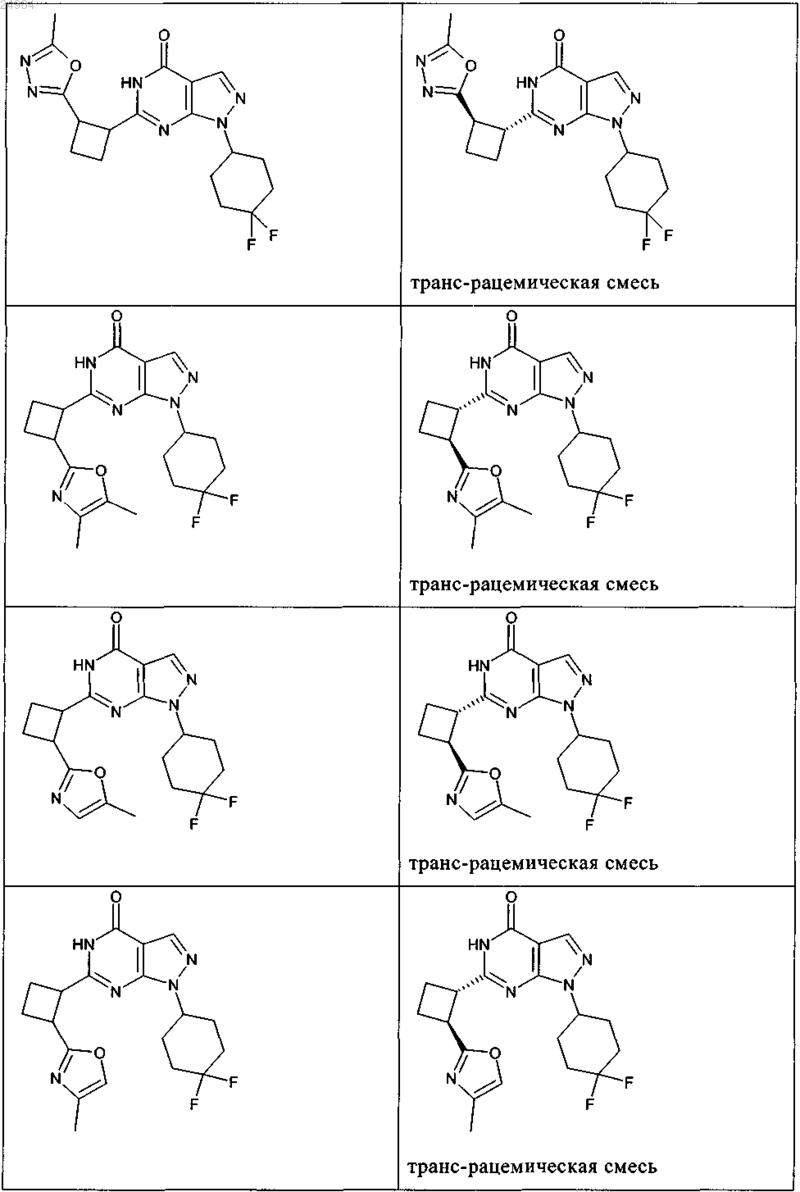
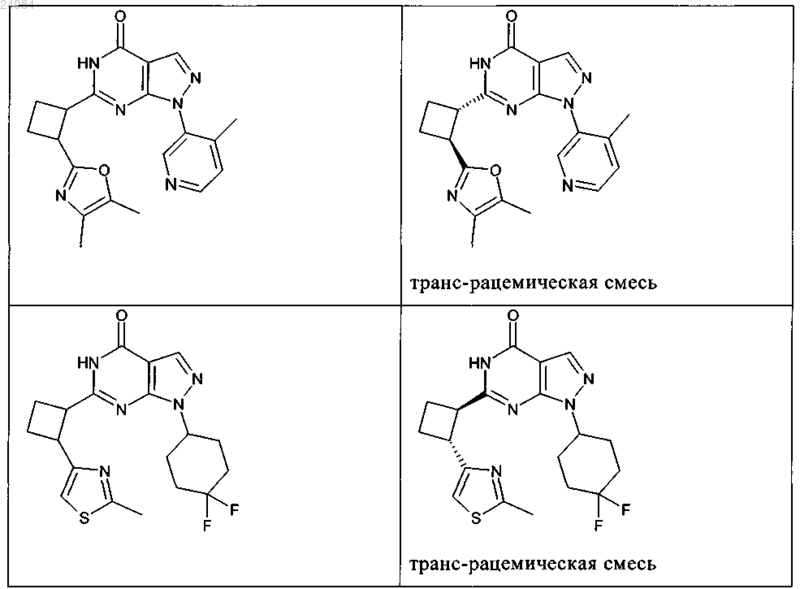
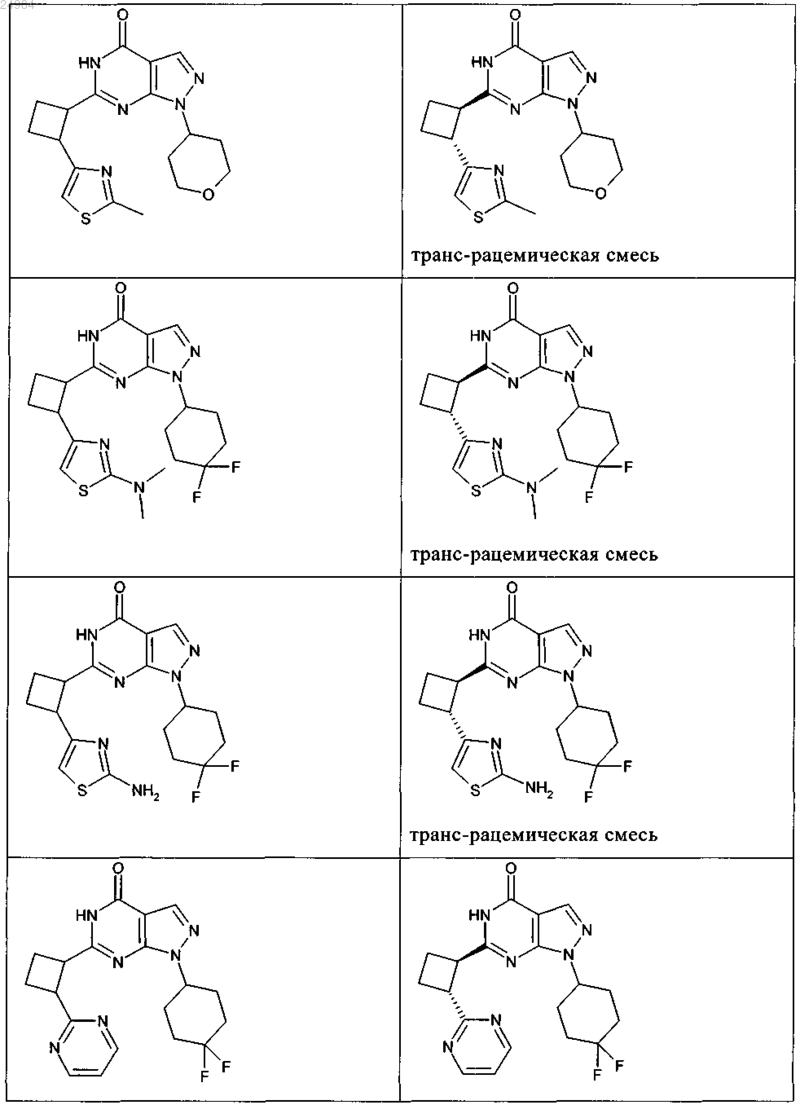
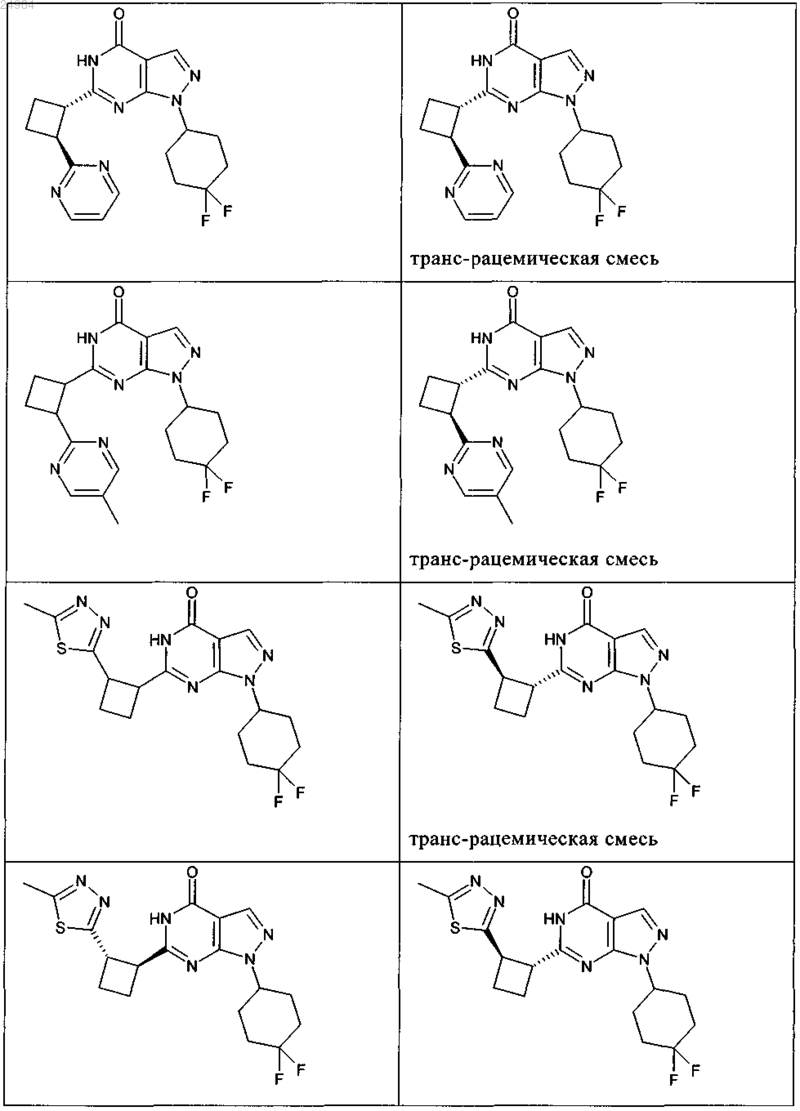
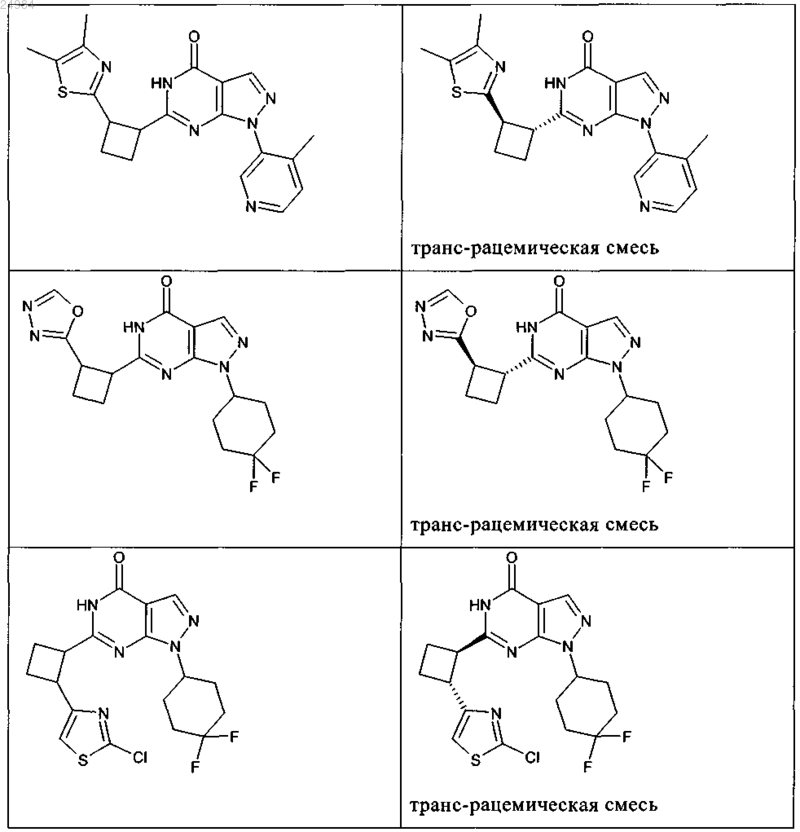
и его фармацевтически приемлемые соли.
9. Соединение по любому из пп.1 и 7, которое выбрано из группы, включающей соединение формулы (IIc) и формулы (IId)

в которых значения R1 и D являются такими, как определено в любом из пп.1-8,
и его фармацевтически приемлемые соли.
10. Применение соединения по любому из пп.1-9 в качестве лекарственного средства, ингибирующего PDE9, в терапевтическом способе.
11. Применение соединения по любому из пп.1-9 в качестве лекарственного средства, ингибирующего PDE9, в профилактическом способе.
12. Применение соединения по любому из пп.1-9 в терапевтическом способе
(a) для лечения заболевания ЦНС,
(b) для лечения заболевания, лечение которого возможно путем ингибирования PDE9,
(c) для лечения патологического состояния, выбранного из группы, включающей нарушение познавательной способности, связанное с заболеванием или патологическим состоянием, выбранным из группы, включающей восприятие, сосредоточенность, познавательную способность, способность к обучению или память, где лечение нарушения познавательной способности относится к возрастным нарушениям способности к обучению и памяти, возрастной амнезии, мультиинфарктному слабоумию, черепно-мозговой травме, удару, слабоумию, возникшему после ударов (постинсультное слабоумие), посттравматическому слабоумию, общим нарушениям сосредоточенности, нарушениям сосредоточенности у детей с проблемами обучения и памяти, слабоумию с тельцами Леви, слабоумию с дегенерацией лобных долей, включая синдром Пика, болезнь Паркинсона, прогрессирующий ядерный паралич, слабоумию с кортикобазальной дегенерацией, боковому амиотрофическому склерозу (ALS), болезни Гентингтона, рассеянному склерозу, дегенерации таламуса, слабоумию Крейтцфельда-Якоба, слабоумию, связанному с ВИЧ, эпилепсии, височной эпилепсии, шизофрении, шизофрении (со слабоумием), психозу Корсакова или нарушению познавательной способности, связанному с депрессией или биполярным нарушением,
(d) для лечения болезни Альцгеймера или нарушения познавательной способности, связанного с болезнью Альцгеймера,
(e) для лечения шизофрении или нарушения познавательной способности, связанного с шизофренией,
(f) для лечения эпилепсии или нарушения познавательной способности, связанного с эпилепсией,
(g) для лечения заболевания или патологического состояния, выбранного из группы, включающей нарушения сна, биполярное нарушение, метаболический синдром, ожирение, сахарный диабет, гипергликемию, дислипидемию, нарушенную переносимость глюкозы, заболевание яичек, головного мозга, тонкого кишечника, скелетных мышц, сердца, легких, вилочковой железы или селезенки.
13. Применение соединения по любому из пп.1-9 для лечения или профилактики нарушения познавательной способности.
14. Применение соединения по любому из пп.1-9 для лечения или профилактики нарушения познавательной способности, связанного с восприятием, сосредоточенностью, способностью к обучению или памятью.
15. Применение соединения по любому из пп.1-9 для лечения или профилактики нарушения познавательной способности в качестве симптомов основного заболевания.
16. Применение соединения по любому из пп.1-9 для лечения или профилактики нарушения познавательной способности, связанного с восприятием, сосредоточенностью, способностью к обучению или памятью в качестве симптомов основного заболевания.
17. Применение соединения по любому из пп.1-9 для улучшения навыков познавательной способности, связанных с восприятием, сосредоточенностью, способностью к обучению или памятью.
18. Фармацевтическая композиция, содержащая соединение, ингибирующее фосфодиэстеразу 9А, по любому из пп.1-9 и фармацевтически приемлемый носитель.
19. Применение соединения по любому из пп.1-9 для приготовления лекарственного средства, предназначенного для лечения заболевания или патологического состояния, определенного в любом из пп.13-15.
Текст
R1 обозначает 5- или 6-членную ароматическую гетероарильную группу, R2 обозначает необязательный заместитель, D обозначает необязательный замещенный циклопентил,циклогексил, тетрагидрофуранил, тетрагидропиранил или 2-, 3- или 4-пиридил, m=1 или 2 и n=0, 1 или 2. Эти новые соединения пригодны для применения в качестве активного компонента лекарственных средств или для приготовления лекарственных средств соответственно,в частности лекарственных средств, предназначенных для лечения патологических состояний,связанных с недостаточностью восприятия, сосредоточенности, способности к обучению или памяти. Такие патологические состояния могут быть связаны, например, с болезнью Альцгеймера,шизофренией и другими заболеваниями. Эти новые соединения также применимы, например, для приготовления лекарственных средств и/или для применения для лечения этих заболеваний, в частности нарушения познавательной способности, связанного с таким заболеванием. Соединения,предлагаемые в настоящем изобретении, являются ингибиторами PDE9(71)(73) Заявитель и патентовладелец: БРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНАЦИОНАЛЬ ГМБХ (DE) Настоящее изобретение относится к новым пиразолопиримидинонам формулы (I) в которой R1 обозначает 5- или 6-членную ароматическую гетероарильную группу, в которой 1,2,3 или 4 из кольцевых атомов являются гетероатомами, которые независимо друг от друга выбраны из N, О или S, D обозначает циклогексил, тетрагидропиранил или 2-, 3- или 4-пиридил. Эти новые соединения предназначены для применения в качестве лекарственных средств или для приготовления лекарственных средств, предпочтительно лекарственных средств, предназначенных для лечения патологических состояний, связанных с недостаточностью восприятия, сосредоточенности, способности к обучению или памяти. Такие патологические состояния могут быть связаны, например, с болезнью Альцгеймера, шизофренией и другими заболеваниями. Эти новые соединения также применимы,например, для приготовления лекарственных средств и/или для применения для лечения этих заболеваний, например нарушения познавательной способности, связанного с таким заболеванием. Соединения,предлагаемые в настоящем изобретении, являются ингибиторами PDE9. Уровень техники Ингибирование фосфодиэстеразы 9 А (PDE9A) является одним из современных подходов к поиску новых путей лечения нарушений познавательной способности, вызванных нарушениями ЦНС (центральная нервная система), такими как болезнь Альцгеймера, или вызванных любым другим нейродегенеративным процессом в головном мозге. В настоящем изобретении предложены новые соединения, которые соответствуют этому подходу. Фосфодиэстераза 9 А является одним представителем большого семейства фосфодиэстераз. Эти типы ферментов модулируют содержание циклических нуклеотидов - циклического 5'-3'аденозинмонофосфата (сАМР) и циклического 5'-3'-гуанозинмонофосфата (cGMP). Эти циклические нуклеотиды (сАМР и cGMP) являются важными вторыми мессенджерами и поэтому играют главную роль в каскадах передачи сигналов клеток. Каждый из них реактивирует, в частности, но не исключительно, протеинкиназы. Протеинкиназа, активированная с помощью сАМР, называется протеинкиназой А (PKA), и протеинкиназа, активированная с помощью cGMP, называется протеинкиназой G (PKG). В свою очередь, активированные PKA и PKG способны фосфорилировать целый ряд эффекторных клеточных белков (например, ионные каналы, связанные с белком G рецепторы, структурные белки, факторы транскрипции). Таким путем вторые мессенджеры сАМР и cGMP могут регулировать множество физиологических процессов во многих органах. Однако, циклические нуклеотиды также могут непосредственно воздействовать на эффекторные молекулы. Так, например, известно, что cGMP может непосредственно воздействовать на ионные каналы и тем самым может влиять на концентрацию иона в клетке (см. обзор: Wei et al., Prog. Neurobioh, 1998, 56, 37-64). Фосфодиэстеразы (PDE) являются средством регулирования активности сАМР и cGMP и таким образом регулируют соответствующие физиологические процессы. PDE гидролизуют циклические монофосфаты с образованием неактивных монофосфатов AMP иGMP. В настоящее время на основании гомологии последовательностей соответствующих генов идентифицированы 11 семейств PDE. Отдельные гены PDE в семействе обозначают буквами (например, PDE1A и PDE1B). Если в гене также возникают разные варианты сплайсинга, то их указывают дополнительными цифрами после букв (например, PDE1A1).PDE9A человека клонировали и секвенировали в 1998 г. Совпадение аминокислотных последовательностей с последовательностями в других PDE не превышает 34% (PDE8A) и никогда не меньше 28%(PDE5A). При константе Михаэлиса-Ментена (Km), равной 170 нМ, PDE9A обладает высоким сродством к cGMP. Кроме того, PDE9A селективна по отношению к cGMP (Km для сАМР=230 мкМ). PDE9A не содержит домен связывания с cGMP и это показывает, что cGMP не регулирует активность этого фермента. С помощью вестерн-блоттинга показано, что у людей PDE9A экспрессируется, в частности, в яичках, головном мозге, тонком кишечнике, скелетных мышцах, сердце, легких, вилочковой железе и селезенке. Наибольшее экспрессирование обнаружено в головном мозге, тонком кишечнике, почках, предстательной железе, толстой кишке и селезенке (Fisher et al., J. Biol. Chem., 1998, 273 (25), 15559-15564;Wang et ah, Gene, 2003, 314, 15-27). Ген PDE9A человека расположен в хромосоме 21q22.3 и содержит 21 экзон. Выявлены 4 альтернативных варианта сплайсинга PDE9A (Guipponi et al., Hum. Genet., 1998, 103,386-392). Классические ингибиторы PDE не ингибируют PDE9A человека. Так, IBMX, дипиридамол,SKF94120, ролипрам и винпоцетин не ингибируют изолированный фермент при концентрациях, равных до 100 мкМ. Значение IC50 для запринаста найдено равным 35 мкМ (Fisher et al., J. Biol. Chem., 1998, 273PDE9A мышей клонировали и секвенировали в 1998 г. Soderling et al. (J. Biol. Chem., 1998, 273 (19),15553-15558). Она, как и PDE9A человека, обладает высоким сродством к cGMP при Km, равной 70 нМ. Особенно высокое экспрессирование обнаружено в почках, головном мозге, легких и печени мышей. равна 29 мкМ (Soderling et al., J. Biol. Chem., 1998, 273 (19), 15553-15558). Установлено, что PDE9A сильно экспрессируется в некоторых областях головного мозга крыс. К ним относятся обонятельные луковицы, гиппокамп, кора, базальное ядро и базальные отделы переднего мозга (Andreeva et al., J.Neurosci., 2001, 21 (22), 9068-9076). В частности, гиппокамп, кора и базальные отделы переднего мозга играют важную роль в процессах обучения и запоминания. Как уже указано выше, PDE9A отличается особенно высоким сродством к cGMP. Поэтому PDE9A активна даже при низких физиологических концентрациях, в отличие от PDE2A (Km=10 мкМ); Martins et(Km=0,52 мкМ; Fawcett et al., Proc. Nat. Acad. Sci., 2000, 97 (7), 3702-3707). В отличие от PDE2A (Murashima et al., Biochemistry, 1990, 29, 5285-5292) каталитическая активность PDE9A не увеличивается под влиянием cGMP, поскольку она не содержит домена GAF (домен связывания с cGMP, с помощью которого аллостерически повышается активность PDE) (Beavo et al., Current Opinion in Cell Biology, 2000, 12,174-179). Поэтому ингибиторы PDE9A могут привести к повышению базовой концентрации cGMP. Из этого общего описания следует, что PDE9A участвует в специфических физиологических процессах характерным и особым образом, что четко отличает роль PDE9A от роли любых других представителей семейства PDE. В WO 2004/099210 раскрыты 6-арилметилзамещенные пиразолопиримидиноны, которые являются ингибиторами PDE9. В WO 2004/099211 раскрыты 6-циклилметил- и 6-алкизметилзамещенные пиразолопиримидины и их применение для улучшения познавательной способности, сосредоточенности и т. п. В DE 10238722 раскрыто применение ингибиторов PDE9A для улучшения познавательной способности, сосредоточенности.WO 2004/018474 раскрыты фенилзамещенные пиразолопиримидины и их применение для улучшения восприятия, сосредоточенности, способности к обучению и/или памяти. В WO 2004/026876 раскрыты алкилзамещенные пиразолопиримидины и их применение для улучшения восприятие, сосредоточенности, способности к обучению и/или работы памяти. В WO 2004/096811 раскрыты гетероциклические бициклические системы, как ингибиторы PDE9,предназначенные для лечения диабета, включая диабет типа 1 и типа 2, гипергликемии, дислипидемии,нарушенной переносимости глюкозы, метаболического синдрома и/или сердечно-сосудистого заболевания. В WO 2009/068617 раскрыты ингибирующие PDE9 соединения, полученные из пиразолопиримидинонов, с замещенной фенилметил- или пиридилметильной группой в положении 6. В WO 2010/112437 раскрыты ингибирующие PDE9 соединения, полученные из пиразолопиримидинонов, с фенил- или гетероарилзамещенной арилметил-или гетероарилметильной группой в положении 6. В WO 2009/121919 раскрыты ингибиторы PDE9, полученные из пиразолопиримидинонов, с неароматической гетероциклильной группой в положении 1, в число которых входит тетрагидропиранил. В WO 2010/026214 раскрыты ингибиторы PDE9, полученные из пиразолопиримидинонов, с циклоалкильной или циклоалкенильной группой в положении 1, в число которых входит 4,4 дифторциклогексил. Некоторые данные предшествующего уровня техники относятся к химически сходным производным нуклеозидов. В качестве примеров можно отметить WO 2002/057425, где раскрыты производные нуклеозидов, которые являются ингибиторами РНК-зависимой вирусной РНК полимеразы, или WO 2001/060315, где раскрыты производные нуклеозидов, предназначенные для лечения инфицирования гепатитом С, или ЕР 679657, где раскрыты соединения, которые служат аналогами рибонуклеозидов, илиUS 2002/058635, где раскрыты пуриновые L-нуклеозиды, в которых и пуриновые кольца, и углеводное кольцо (пентозное кольцо) модифицированы, снабжены функциональными группами или подвергнуты обеим операциям. Так, например, сахар должен содержать по меньшей мере одну образовавшую сложный эфир группу ОН. В WO 2005/051944 раскрыты содержащие оксетан нуклеозиды, предназначенные для лечения нарушений, связанных с аналогами нуклеозидов, таких как нарушения, включающие пролиферацию клеток и инфицирование. В WO 2006/084281 раскрыты ингибиторы активирующего фермента Е 1, которые содержат сульфонамидный фрагмент. В WO 1998/40384 раскрыты пиразолопиримидиноны, которые являются ингибиторами PDE1, 2 и 5,и могут использоваться для лечения сердечно-сосудистых и цереброваскулярных нарушений и нарушений мочеполовой системы. В СН 396924, СН 396925, СН 396926, СН 396927, DE 1147234, DE 1149013 описаны пиразолопиримидины, которые расширяют коронарные сосуды и которые можно использовать для лечения нарушений кровотока в миокарде. В US 3732225 описаны пиразолопиримидины, которые обладают противовоспалительной способ-2 024984 ностью и способностью снижать содержание глюкозы в крови. В DE 2408906 описаны стирилпиразолопиримидиноны, которые можно использовать в качестве противомикробных и противовоспалительных средств для лечения, например отека. Задачи изобретения Изменения схемы замещения пиразолопиримидинонов приводят к представляющим интерес изменениям биологической активности и соответственно к изменениям сродства к различным ферментаммишеням. Поэтому задачей настоящего изобретения является получение соединений, которые описаны здесь,особенно в формуле изобретения, которые эффективно модулируют PDE9A, с целью разработки лекарственного средства, в частности, в связи с заболеваниями, лечение которых возможно путем модулирования PDE9A. Другой задачей настоящего изобретения является получение соединений, которые применимы для приготовления лекарственного средства, предназначенного для лечения нарушений ЦНС. Еще одной задачей настоящего изобретения является получение соединений, которые обладают благоприятным профилем безопасности. Другой задачей настоящего изобретения является получение соединений, которые обладают благоприятным более селективным профилем ингибирования PDE9A по сравнению с профилем ингибирования других представителей семейства PDE и других фармакологических мишеней и вследствие этого могут обеспечить терапевтические преимущества. Еще одной задачей настоящего изобретения является получение такого лекарственного средства,которое применимо не только для лечения, но и для предупреждения или модификации соответствующего заболевания или патологического состояния. Настоящее изобретение также относится к фармацевтической композиции, включающей соединение, описанное в настоящем изобретении, особенно в формуле изобретения, и фармацевтически приемлемый носитель. Настоящее изобретение также относится к способу лечения любого из патологических состояний,описанных в настоящем изобретении, у млекопитающего, нуждающегося в таком лечении, предпочтительно у человека, включающему введение млекопитающему соединения, описанного в настоящем изобретении, особенно в формуле изобретения, в терапевтически эффективном количестве. Настоящее изобретение также относится к соединению, описанному в настоящем изобретении, особенно в формуле изобретения, предназначенному для применения в способе лечения организма человека или животного с помощью терапии. Подробное описание настоящего изобретения Соединения, предлагаемые в настоящем изобретении, характеризуются общей формулой (I)R1 обозначает 5- или 6-членную гетероарильную группу, в которой 1, 2, 3 или 4, предпочтительно 1,2 или 3 из кольцевых атомов являются гетероатомами, которые независимо друг от друга выбраны из N,О или S, где указанная 5- или 6-членная ароматическая гетероарильная группа необязательно может содержать 1, 2, 3 или 4, предпочтительно 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, НО-, NC-, F3C-, HF2C-, FH2C-,метил, H2N- и (CH3)2N-;D выбран из группы, включающей циклогексил, тетрагидропиранил, 2-, 3- и 4-пиридил,где циклогексил необязательно может содержать 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, NC-, F3C-, HF2C- и FH2C-; где тетрагидропиранил необязательно может содержать 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, NC-, F3C-, HF2C- иFH2C-; где пиридил необязательно может содержать 1, 2, 3 или 4 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, NC-, F3C-,HF2C-, FH2C- F3C-СН 2-, С 1-С 6-алкил- и С 3-С 7-циклоалкил; и их фармацевтически приемлемые соли; при условии, что соединение не является следующим производным оксадиазолила находится ли оно в форме любого возможного стереоизомера или смеси всех или некоторых из них,или его сольвата или сольвата его соли. Этот вариант осуществления является вариантом осуществления 1 настоящего изобретения. Применительно к определенному выше условию следует понимать, что хотя это описание является определением соединения, а именно "следующее производное оксадиазолила находится ли оно в форме любого возможного стереоизомера или смеси всех или некоторых из них,включает следующие стереоизомеры, кроме смесей этих соединений Вариант осуществления 2 настоящего изобретения: другой вариант осуществления настоящего изобретения относится к соединению общей формулы (I), в которойR1 обозначает 5- или 6-членную гетероарильную группу, в которой 1, 2, 3 или 4, предпочтительно 1,2 или 3 из кольцевых атомов являются гетероатомами, которые независимо друг от друга выбраны из N,О или S,где указанная 5- или 6-членная ароматическая гетероарильная группа необязательно может содержать 1, 2, 3 или 4, предпочтительно 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, NC-, F3C-, HF2C-, FH2C-, метил,H2N- и (CH3)2N-;D выбран из группы, включающей циклогексил, тетрагидропиранил, 2-, 3- и 4-пиридил,где циклогексил необязательно может содержать 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, F3C-, HF2C- и FH2C-; где тетрагидропиранил необязательно может содержать 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, F3C-, HF2C- и FH2C; где пиридил необязательно может содержать 1, 2, 3 или 4, предпочтительно 1, 2 или 3, более предпочтительно 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, NC-, F3C-, HF2C-, FH2C-, F3C-CH2-, C1-С 6-алкил-и С 3 С 7-циклоалкил; и его фармацевтически приемлемым солям; при условии, что соединение не является следующим производным оксадиазолила находится ли оно в форме любого возможного стереоизомера или смеси всех или некоторых из них,-4 024984 или его сольвата или сольвата его соли. Вариант осуществления 3 настоящего изобретения: другой вариант осуществления настоящего изобретения относится к соединению общей формулы (I), в которойR1 обозначает 5-членную гетероарильную группу, в которой 1, 2, 3 или 4, предпочтительно 1, 2 или 3, более предпочтительно 2 или 3 из кольцевых атомов являются гетероатомами, которые независимо друг от друга выбраны из N, О или S,где указанная 5-членная ароматическая гетероарильная группа необязательно может содержать 1, 2,3 или 4, предпочтительно 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, NC-, F3C-, HF2C-, FH2C-, метил, H2N- иD выбран из группы, включающей циклогексил, тетрагидропиранил, 2-, 3- и 4-пиридил,где циклогексил необязательно может содержать 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, F3C-, HF2C- и FH2C-; где тетрагидропиранил необязательно может содержать 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, F3C-, HF2C- и FH2C; где пиридил необязательно может содержать 1, 2, 3 или 4, предпочтительно 1, 2 или 3, более предпочтительно 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, NC-, F3C-, HF2C-, FH2C-, F3C-CH2-, C1-С 6-алкил-и С 3 С 7-циклоалкил; и его фармацевтически приемлемым солям; при условии, что соединение не является следующим производным оксадиазолила находится ли оно в форме любого возможного стереоизомера или смеси всех или некоторых из них,или его сольвата или сольвата его соли. Вариант осуществления 4 настоящего изобретения: другой вариант осуществления настоящего изобретения относится к соединению общей формулы (I), в которойR1 обозначает 6-членную гетероарильную группу, в которой 1, 2, 3 или 4, предпочтительно 1, 2 или 3, более предпочтительно 2 или 3 из кольцевых атомов являются гетероатомами, которые независимо друг от друга выбраны из N, О или S,где указанная 6-членная ароматическая гетероарильная группа необязательно может содержать 1, 2,3 или 4, предпочтительно 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, NC-, F3C-, HF2C-, FH2C-метил, H2N- иD выбран из группы, включающей циклогексил, тетрагидропиранил, 2-, 3- и 4-пиридил,где циклогексил необязательно может содержать 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, F3C-, HF2C- и FH2C-; где тетрагидропиранил необязательно может содержать 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, F3C-, HF2C- и FH2C; где пиридил необязательно может содержать 1, 2, 3 или 4, предпочтительно 1, 2 или 3, более предпочтительно 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, NC-, F3C-, HF2C-, FH2C-; F3C-CH2-, C1-С 6-алкил-и С 3 С 7-циклоалкил; и его фармацевтически приемлемым солям. Вариант осуществления 5 настоящего изобретения: другой вариант осуществления настоящего изобретения относится к соединению общей формулы (I), в которойR1 обозначает гетероарильную группу, выбранную из группы, включающей тиадиазолил, оксадиазолил, изоксазолил, тиазолил, оксазолил, пиридил и пиримидинил, предпочтительно если указанная гетероарильная группа выбрана из группы, включающей тиадиазолил, оксадиазолил, изоксазолил, тиазолил, оксазолил и пиримидинил,где указанная гетероарильная группа необязательно может содержать 1, 2, 3 или 4, предпочтительно 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, NC-, F3C-, HF2C-, FH2C-, метил, H2N- и (CH3)2N-;D выбран из группы, включающей циклогексил, тетрагидропиранил, 2-, 3- и 4-пиридил,где циклогексил необязательно может содержать 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, F3C-, HF2C- и FH2C-; где тетрагидропиранил необязательно может содержать 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, F3C-, HF2C- и FH2C; где пиридил необязательно может содержать 1, 2, 3 или 4, предпочтительно 1, 2 или 3, более предпочтительно 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, NC-, F3C-, HF2C-, FH2C-, F3C-CH2-, C1-С 6-алкил-и С 3 С 7-циклоалкил; и его фармацевтически приемлемым солям; при условии, что соединение не является следующим производным оксадиазолила находится ли оно в форме любого возможного стереоизомера или смеси всех или некоторых из них,или его сольвата или сольвата его соли. Вариант осуществления 6 настоящего изобретения: другой вариант осуществления настоящего изобретения относится к соединению общей формулы (I), в которойR1 обозначает гетероарильную группу, выбранную из группы, включающей тиадиазолил, 1,2,3 оксадиазолил, 1,3,4-оксадиазолил, 1,2,5-оксадиазолил, изоксазолил, тиазолил, оксазолил, пиридил и пиримидинил, предпочтительно если указанная гетероарильная группа выбрана из группы, включающей тиадиазолил, изоксазолил, тиазолил, оксазолил, пиридил и пиримидинил,где указанная гетероарильная группа необязательно может содержать 1, 2, 3 или 4, предпочтительно 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, NC-, F3C-, HF2C-, FH2C-, метил, H2N- и (CH3)2N-;D выбран из группы, включающей циклогексил, тетрагидропиранил, 2-, 3- и 4-пиридил,где циклогексил необязательно может содержать 1 или 2 заместителя, выбранных из группы, включающей фтор, F3C-, HF2C- и FH2C-; где тетрагидропиранил необязательно может содержать 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, F3C-, HF2C- и FH2C; где пиридил необязательно может содержать 1, 2, 3 или 4, предпочтительно 1, 2 или 3, более предпочтительно 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, NC-, F3C-, HF2C-, FH2C-, F3C-CH2-, C1-С 6-алкил-и С 3 С 7-циклоалкил; и его фармацевтически приемлемым солям. Вариант осуществления 7 настоящего изобретения относится к соединению, которое по всем параметрам соответствует варианту осуществления 6, с тем отличием, чтоR1 обозначает гетероарильную группу, выбранную из группы, включающей тиадиазолил, 1,2,3 оксадиазолил, 1,3,4-оксадиазолил, 1,2,5-оксадиазолил, изоксазолил, тиазолил, оксазолил и пиримидинил,предпочтительно если указанная гетероарильная группа выбрана из группы, включающей тиадиазолил,изоксазолил, тиазолил, оксазолил и пиримидинил,где указанная гетероарильная группа необязательно может содержать 1, 2, 3 или 4, предпочтительно 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, NC-, F3C-, HF2C-, FH2C-, метил, H2N- и (CH3)2N-. Вариант осуществления 8 настоящего изобретения: другой вариант осуществления настоящего изобретения относится к соединению общей формулы (I), в которойR1 обозначает гетероарильную группу, выбранную из группы, включающей [1,3,4]тиадиазол-2-ил,изоксазол-5-ил, тиазол-5-ил-, оксазол-2-ил, пиридин-2-ил и пиримидин-2-ил, предпочтительно если указанная гетероарильная группа выбрана из группы, включающей [1,3,4]тиадиазол-2-ил, изоксазол-5-ил,тиазол-5-ил-, оксазол-2-ил и пиримидин-2-ил,где указанная гетероарильная группа необязательно может содержать 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, хлор,бром, CN-, метил и H2N-;D выбран из группы, включающей циклогексил, тетрагидропиранил, 2-, 3- и 4-пиридил,где циклогексил необязательно может содержать 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, F3C-, HF2C- и FH2C-; предпочтительно фтор; где тетрагидропиранил необязательно может содержать 1 или 2 заместителя, где указанные замес-6 024984 тители могут быть независимо друг от друга выбраны из группы, включающей фтор, F3C-, HF2C- и FH2C; где пиридил необязательно может содержать 1, 2, 3 или 4, предпочтительно 1, 2 или 3, более предпочтительно 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, NC-, F3C-, HF2C-, FH2C-, F3C-CH2- и метил; где предпочтительно, если D выбран из группы, включающей 4,4-дифторциклогекс-1-ил, тетрагидропиранил, предпочтительно тетрагидропиран-4-ил и 4-метил-3-пиридил; и его фармацевтически приемлемым солям. Варианты осуществления 9-16 настоящего изобретения. В любом из приведенных выше вариантов осуществления 1-8 предпочтительные соединения описываются формулой (II)R1 является таким, как определено в любом из приведенных выше вариантов осуществления 1-8;D обозначает 4,4-дифторциклогексил или тетрагидропиран-4-ил или 4-метил-3-пиридил и ни одна из этих двух групп не содержит дополнительных заместителей; и их фармацевтически приемлемые соли; при условии, что соединение не является следующим производным оксадиазолила находится ли оно в форме любого возможного стереоизомера или смеси всех или некоторых из них,или его сольвата или сольвата его соли. Предпочтительные варианты осуществления 9-16 формулы (II) образованы из вариантов осуществления формулы (I), в которыхR1 в формуле (I) присоединен к указанному выше циклобутилу в положении 2, а положение 1 указанного циклобутила является положением присоединения к положению 6 D-замещенного пиразолопиримидинона. Соответствующие варианты осуществления обозначены, как варианты осуществления 9, 10, 11, 12,13, 14, 15 и 16 соответственно. Вариант осуществления 9 образован из варианта осуществления 1, вариант осуществления 10 - из варианта осуществления 2, вариант осуществления 11 - из варианта осуществления 3, вариант осуществления 12 - из варианта осуществления 4, вариант осуществления 13 - из варианта осуществления 6, вариант осуществления 14 - из варианта осуществления 6, вариант осуществления 15 - из варианта осуществления 7, вариант осуществления 16 - из варианта осуществления 7. Варианты осуществления 17-24 настоящего изобретения: В каждом из указанных выше вариантов осуществления 1-16 более предпочтительные соединения описываются формулой (II)R1 является таким, как определено в любом из приведенных выше вариантов осуществления 1-8;D обозначает 4,4-дифторциклогексил или тетрагидропиран-4-ил и ни одна из этих двух групп не содержит дополнительных заместителей; и их фармацевтически приемлемые соли,при условии, что соединение не является следующим производным оксадиазолила находится ли оно в форме любого возможного стереоизомера или смеси всех или некоторых из них,или его сольвата или сольвата его соли. Во всех вариантах осуществления 1-24 конфигурация циклоалкильной группы в положении 6 пиразолопиримидиноновой группы по отношению к указанной пиразолопиримидиноновой группе и заместителю R1 может быть цис или транс. Вариант осуществления 25 настоящего изобретения. В контексте настоящего изобретения являются предпочтительными одно или большее количество соединений, которые выбраны из группы специально определенных соединений, приведенных в представленной ниже таблице. В левом столбце указан буквенный код для идентификации семейства соединений, которым является группа соединений, которые обладают одной общей химической структурной формулой, если не рассматривать стереохимические характеристики. Представители этих семейств соединений приведены в качестве примера в разделе "Типичные варианты осуществления". Таблица соединений и их фармацевтически приемлемые соли. В последней группе соединения, которые обладают транс-конфигурацией по отношению к заместителю циклобутильной группы, могут быть предпочтительнее соединений с цис-конфигурацией. Из возможных соединений, обладающих транс-конфигурацией, одно из них может быть предпочтительнее по эффективности. Чем эффективнее соединение, тем более предпочтительным оно является. Другим критерием, по которому могут различаться предпочтительные соединения, предлагаемые в настоящем изобретении, является баланс эффективности и безопасности, например селективность по отношению к другим представителям семейства PDE, таким как PDE1C. Для одной пары соединений, обладающих транс-конфигурацией, проведенный в экспериментальной части рентгеноструктурный анализ монокристаллов показал, что абсолютной стереохимической конфигурацией соединения, которое обладает наименьшей эффективностью, является его энантиомерR,R. Поэтому абсолютной стереохимической конфигурацией соединения, которое обладает наибольшей эффективностью, является S,S. Для указанного соединения S,S-конфигурация описывается следующей структурой, соответствующей общей формуле (II) Аналогичным образом, можно предположить, что из соединений варианта осуществления 25, такие соединения, которые обладают такой же абсолютной стереохимической конфигурацией, могут быть более активными, чем другие представители этого семейства соединений. В контексте настоящего изобретения для одного семейства соединений более активные соединения предпочтительнее менее активных соединений. Семейство соединений представляет собой группу соединений, химические структуры которых различаются только по стереохимическим характеристикам. Разные стереоизомеры относятся к отдельным вариантам осуществления настоящего изобретения: вариант осуществления 28 настоящего изобретения относится к соединению любого из вариантов осуществления 1-25, где соединение обладает следующими стереохимическими характеристиками: вариант осуществления 29 настоящего изобретения относится к соединению любого из вариантов осуществления 1-25, где соединение обладает следующими стереохимическими характеристиками: вариант осуществления 30 настоящего изобретения. Другой набор предпочтительных вариантов осуществления настоящего изобретения образован из каждого из указанных выше вариантов осуществления, включающих соединения формулы (I) или (II),- 14024984R1 обозначает пиримидинил или пиридил, предпочтительно пиримидин-2-ил или пиридин-2-ил, иD выбран из группы, включающей циклогексил, тетрагидропиранил, 2-, 3- и 4-пиридил,где циклогексил необязательно может содержать 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, F3C-, HF2C- и FH2C-; предпочтительно фтор; где тетрагидропиранил необязательно может содержать 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, F3C-, HF2C- и FH2C; где пиридил необязательно может содержать 1, 2, 3 или 4, предпочтительно 1, 2 или 3, более предпочтительно 1 или 2 заместителя, где указанные заместители могут быть независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, NC-, F3C-, HF2C-, FH2C-, F3C-CH2- и метил; где предпочтительно, если D выбран из группы, включающей 4,4-дифторциклогекс-1-ил, тетрагидропиранил и 4-метил-3-пиридил,и их фармацевтически приемлемые соли. В каждом из вариантов осуществления 1-30, в которых D может обозначать тетрагидропиранил, он предпочтительно обозначает тетрагидропиран-3-ил или тетрагидропиран-4-ил, более предпочтительно тетрагидропиран-4-ил. В каждом из вариантов осуществления 1-30 гетероарильная группа R1 предпочтительно связана через свой кольцевой атом углерода с циклоалкильной группой, которая присоединена к положению 6 пиразолопиримидинонового ядра. В соответствии с общей формулой (I) указанной циклоалкильной группой может быть циклобутильная или циклопентильная группа, в соответствии с общей формулой (II) указанной циклоалкильной группой является циклобутильная группа. Термины и определения Терминам, специально не определенным в настоящем изобретении, следует придавать такие значения, которые им придал бы специалист в данной области техники с учетом описания и контекста. Примеры включают конкретные заместители или атомы, обозначенные своими 1- или 2-буквенными обозначениями, такими как Н для водорода, N для азота, С для углерода, О для кислорода, S для серы и т. п. После буквы необязательно следует черточка для обозначения связи. При использовании в настоящем описании, если не указано иное, приведенные ниже термины обладают указанными значениями и используются указанные ниже обозначения. В определенных ниже группах, радикалах или фрагментах перед группой часто указано количество атомов углерода, например (С 1-С 6)алкил означает алкильную группу или алкильный радикал, содержащий от 1 до 6 атомов углерода. Обычно в группах, состоящих из двух или большего количества подгрупп, последняя названная группа является положением присоединения радикала, например "(СН 3)2N-" означает одновалентный радикал формулы (СН 3)2N-, который присоединен через атом азота (т.е. диметиламиногруппа). Если обозначение заместителя начинается или заканчивается знаком "минус" или дефисом, т. е. -, то этот символ указывает положение присоединения, такое как в приведенном выше примере (СН 3)2N-, где N связан с группой, для которой диметиламиногруппа является заместителем. Если ниже не указано иное, то во всех формулах и группах используются обычные определения терминов и обычные валентности атомов, соответствующие стабильным состояниям. В общем случае, если термины специально определены в определенном контексте, такие конкретные определения будут превалировать над более общими определениями, приведенными в этом разделе. Обычно в объем настоящего изобретения входят все "таутомерные формы и изомерные формы и смеси", а именно отдельные геометрические изомеры или оптические изомеры, или рацемические и нерацемические смеси изомеров химической структуры или соединения, если в названии или структуре соединения не указанная конкретная стереохимическая конфигураций или изомерная форма. Конкретные определения являются превалирующими."Замещение": термин "замещенный" при явном или неявном использовании в настоящем изобретении означает, что у указанного атома любой один или большее количество атомов водорода замещены элементом из указанной группы заместителей при условии, что не превышена нормальная валентность указанного атома. В случае заместителя, присоединенного посредством двойной связи, например оксогруппы, такой заместитель заменяет два атома водорода у указанного атома. Замещение должно приводить к стабильному соединению. В этом контексте "стабильное" предпочтительно означает соединение,которое с фармацевтической точки зрения является достаточно химически и физически стабильным для использования в качестве активного фармацевтического ингредиента фармацевтической композиции. Если заместитель не определен, им должен быть водород. Термин "необязательно замещенный" означает, что соответствующая группа замещена или не замещена. Указание на то, что заместители одной и той же группы могут быть "выбраны независимо друг от друга" означает, что соответствующие заместители могут быть одинаковыми или могут быть разными. Выражение "фармацевтически приемлемое" используется в настоящем изобретении для указания таких соединений, материалов, композиций и/или дозированных форм, которые в соответствии с основ- 15024984 ными положениями медицины являются подходящими для использования при соприкосновении с тканями людей или, как в случае животных, без проявления чрезмерной токсичности, раздражающего воздействия, аллергической реакции или других затруднений или осложнений при разумном соотношении польза/риск."Фармацевтически приемлемая соль (соли)" соединений, предлагаемых в настоящем изобретении,также являются объектом настоящего изобретения. Термин "фармацевтически приемлемая соль (соли)" означает производные раскрытых соединений, в которых исходное соединение изменено путем образования его солей с кислотой или основанием, предпочтительно солей присоединения. Примеры фармацевтически приемлемых солей включают, но не ограничиваются только ими, соли неорганических или органических кислот с основными остатками/фрагментами соединений, предлагаемых в настоящем изобретении, такими как аминогруппы; кислые остатки/фрагменты соединений, предлагаемых в настоящем изобретении, могут образовывать соли со щелочами или органическими основаниями. Фармацевтически приемлемые соли включают обычные нетоксичные соли или четвертичные аммониевые соли исходного соединения, образованные, например, из нетоксичных неорганических или органических кислот. Например, такие обычные нетоксичные соли включают соли, образованные из неорганических кислот, таких как хлористо-водородная кислота, бромисто-водородная кислота, серная кислота, сульфаминовая кислота, фосфорная кислота, азотная кислота и т. п.; и соли, полученные из органических кислот, таких как уксусная кислота, пропионовая кислота, янтарная кислота, гликолевая кислота, стеариновая кислота,молочная кислота, яблочная кислота, винная кислота, лимонная кислота, аскорбиновая кислота, памоевая кислота, малеиновая кислота, гидроксималеиновая кислота, фенилуксусная кислота, глутаминовая кислота, бензойная кислота, салициловая кислота, сульфаниловая кислота, 2-ацетоксибензойная кислота,фумаровая кислота, толуолсульфоновая кислота, метансульфоновая кислота, этандисульфоновая кислота, щавелевая кислота, изэтионовая кислота и т. п. Физиологически приемлемые соли с основаниями также могут включать соли с обычными основаниями, такие как, например и предпочтительно, соли щелочных металлов (например, соли натрия и калия), соли щелочно-земельных металлов (например, соли кальция и магния) и аммония, соли с органическими аминами, содержащими от 1 до 16 атомов С, такие как, например и предпочтительно, этиламин,диэтиламин, триэтиламин, этилдиизопропиламин, моноэтаноламин, диэтаноламин. триэтаноламин, дихлоргексиламин, диметиламиноэтанол, прокаин, дибензиламин, N-метилморфолин, дегидроабиетиламин,аргинин, лизин, этилендиамин и метилпиперидин и т. п. Фармацевтически приемлемые соли, предлагаемые в настоящем изобретении, можно синтезировать из исходного соединения, которое обладает свойствами основания или кислоты, по обычным химическим методикам. Обычно такие соли можно получить по реакции этих соединений в форме свободной кислоты или основания со стехиометрическим количеством соответствующего основания или кислоты в воде или в органическом растворителе или в их смеси; обычно являются предпочтительными неводные среды, такие как эфир, этилацетат, этанол, изопропанол или ацетонитрил."Пролекарством" считают соединение, которое предназначено для высвобождения in vivo биологически активного соединения, предлагаемого в настоящем изобретении, когда такое пролекарство вводят млекопитающему. Пролекарства соединений, предлагаемых в настоящем изобретении, получают путем модификации функциональных групп, содержащихся в соединении, предлагаемом в настоящем изобретении, так что при физиологических условиях эти модифицированные группы превращаются в исходные функциональные группы. Следует понимать, что пролекарства соединений, предлагаемых в настоящем изобретении, также являются объектом настоящего изобретения."Метаболитами" считают производными соединений, предлагаемых в настоящем изобретении, которые образуются in vivo. Активными метаболитами являются такие метаболиты, которые оказывают фармацевтическое воздействие. Следует понимать, что метаболиты, в частности активные метаболиты соединений, предлагаемых в настоящем изобретении, также являются объектом настоящего изобретения. Некоторые из соединений могут образовывать "сольваты". Для задач настоящего изобретения термин "сольваты" означает такие формы соединений, которые в твердом или жидком состоянии образуют комплекс путем координации с молекулами растворителя. Гидраты являются особой формой сольватов,в которых координация происходит с водой. В контексте настоящего изобретения этот термин предпочтительно используется для твердых сольватов, таких как аморфные или более предпочтительно кристаллические сольваты."Ядро" соединений, предлагаемых в настоящем изобретении, описывается приведенной ниже основной структурой. Нумерация положений кольцевых атомов выполнена жирным шрифтом Для специалиста в данной области техники должно быть очевидно, что это ядро можно описать его таутомерной "енольной" формой В контексте настоящего изобретения оба представления структуры ядра следует считать объектом настоящего изобретения даже если приведено только одно из двух представлений. Без наложения какихлибо ограничений предполагается, что для большинства соединений при нормальных условиях окружающей среды и при условиях, которые соответствуют условиям в фармацевтической композиции, содержащей указанные соединения, равновесие таутомерных форм смещено в сторону пиразолопиримидин-4-онового представления. Поэтому все варианты осуществления представлены в виде производных пиразолопиримидин-4-она или точнее в виде производных пиразоло[3,4-d]пиримидин-4-она."Связи": если в химической формуле кольцевой системы или определенной группы заместитель непосредственно связан с атомом или группой, такой как заместитель "RyR" в приведенной ниже формуле,это означает, что этот заместитель присоединен только к соответствующему атому. Однако, если связь от другого заместителя, такого как "RxR" направлена не к определенному атому кольцевой системы, а направлена к центру кольца или группы, это означает, что такой заместитель "RxR" может быть связан с любым доступным атомом кольцевой системы/группы, если не указано иное Символ связи "-" (- знак "минус") или символ "-" (- знак "минус", затем знак звездочки) обозначает связь, с помощью которой заместитель связывается с соответствующей остальной частью молекулы/ядром. В случае, когда знак "минус" представляется недостаточно понятным, к символу связи "-" добавляют звездочку, чтобы указать положение соединения указанной связи с соответствующей главной частью молекулы/ядром. Термин C1-С 6-алкил означает насыщенную, разветвленную или неразветвленную углеводородную группу, содержащую от 1 до 6 атомов С. Примеры таких групп включают метил, этил, н-пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, трет-пентил, н-гексил,изогексил. Это определение относится к использованию термина "алкил" в настоящем описании в любом приемлемом контексте, если отсутствует дополнительное определение. Термин "С 3-С 7-циклоалкил" означает насыщенную моноциклическую группу, содержащую от 3 до 7 кольцевых атомов С. Не содержится кольцевых атомов, отличающихся от атомов углерода. Примеры таких групп включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил. Это определение относится к "циклоалкилу" в любом приемлемом контексте в настоящем описании, если отсутствует дополнительное определение. Термин "гетероарил" при использовании в настоящей заявке означает гетероциклическую моноили бициклическую ароматическую кольцевую систему, которая в самой кольцевой системе в дополнение по меньшей мере к одному атому С содержит один или большее количество гетероатомов, независимо выбранных из N, О и/или S. Предпочтительными являются гетероарилы, содержащие от 1 до 3 гетероатомов, от 1 до 2 гетероатомов или 1 гетероатом. Предпочтительным гетероатомом является N. Термин "пиридил" означает пиридиновый заместитель, иногда он также называется пиридинилом. Выражения "предупреждение", "профилактика", "профилактическое лечение" или "предупредительное лечение" при использовании в настоящем изобретении следует понимать, как синонимы и в том смысле, что риск развития патологического состояния, указанного выше в настоящем изобретении, снижается особенно у пациента, для которого существует повышенная опасность возникновения указанных патологических состояний или соответствующий анамнез. Таким образом, выражение "предупреждение заболевания" при использовании в настоящем изобретении означает лечение и уход за пациентом, для которого существует опасность развития заболевания, до появления клинических симптомов заболевания. Целью предупреждения является борьба с развитием заболевания, патологического состояния или нарушения, и оно включает введение активных соединений для предупреждения или задержки появления симптомов или осложнений или для предупреждения или задержки развития родственных заболеваний, патологических состояний или нарушений. Успех указанного предупредительного лечения отражен статистически в уменьшении частоты возникновения указанного патологического состояния в группе пациентов, для которых существует опасность возникновения этого патологического состояния, по сравнению с аналогичной группой пациентов, не подвергающихся предупредительному лечению. Выражение "лечение" или "терапия" предпочтительно означает лекарственное лечение (например,человека) пациентов, у которых уже развилось одно или большее количество указанных патологических состояний в явной, острой или хронической форме, включая симптоматическое лечение, предназначенное для облегчения симптомов при конкретном показании, или этиотропное лечение, предназначенное для обращения или частичного обращения патологического состояния или для остановки или замедления прогрессирования заболевания настолько, насколько это возможно в зависимости от патологического состояния и его тяжести. Таким образом, выражение "лечение заболевания" при использовании в настоящем изобретении означает лечение и уход за пациентом, у которого развилось заболевание, патологическое состояние или нарушение. Целью лечения является борьба с заболеванием, патологическим состоянием или нарушением или с их симптомами. Лечение включает введение активных соединений для устранения заболевания, патологического состояния или нарушения или борьбы с ними, а также облегчение симптомов или осложнений, связанных с заболеванием, патологическим состоянием или нарушением. Приведенные ниже схемы в качестве примера в общем иллюстрируют способ получения соединений, предлагаемых в настоящем изобретении. Обозначенные аббревиатурами заместители могут быть такими, как определено для вариантов осуществления формулы (I), если в описаниях схем не приведено других определений Схема 1 На первой стадии 2-этоксиметиленмалононитрил конденсируют с монозамещенными гидразинами путем нагревания в подходящем растворителе, таком как этанол, в присутствии основания (например,триэтиламина) и получают соответствующие 5-амино-1H-пиразол-4-карбонитрилы. На второй стадии эти соединения превращают в соответствующие амиды, например, путем обработки этанольного раствора аммиаком (25% в воде) и пероксидом водорода (35% в воде). На третьей стадии нагревание с диэфирами карбоновых кислот в щелочной среде (например, гидрид натрия в этаноле) с последующим добавлением водного раствора гидроксид натрия дает 4-оксо-4,5-дигидро-1H-пиразоло[3,4-d]пиримидин-6 илзамещенные карбоновые кислоты (путь 1). Функциональная группа карбоновой кислоты превращается в гетероарильную группу, как это показано на схеме 2, и получают пиразоло[3,4-d]пиримидин-4-оны в качестве конечных продуктов. Альтернативно, 4-оксо-4,5-дигидро-1H-пиразоло[3,4-d]пиримидин-6 илзамещенные нитрилы можно синтезировать из динитрилов путем нагревания в щелочной среде (например, гидрид натрия в этаноле) на третьей стадии (путь 2). Затем функциональная группа нитрила превращается в гетероарильный заместитель, как это показано на схеме 3, и получают пиразоло[3,4d]пиримидин-4-оны в качестве конечных продуктов [см., например, A. Miyashita et al., Heterocycles 1990,31, 1309ff]. Схема 2 4-Оксо-4,5-дигидро-1 Н-пиразоло[3,4-d]пиримидин-6-илзамещенные карбоновые кислоты обрабатывают при условиях, указанных в приведенной ниже таблице, и получают гетероарилзамещенные пиразоло[3,4-d]пиримидин-4-оны в качестве конечных продуктов. Ra является заместителем для R1. 4-Оксо-4,5-дигидро-1 Н-пиразоло[3,4-d]пиримидин-6-илзамещенные нитрилы смешивают с метанолом и обрабатывают ацетилхлоридом или, альтернативно, смешивают с насыщенным раствором хлористо-водородной кислоты в этаноле. Промежуточные продукты на второй стадии обрабатывают раство- 19024984 ром аммиака в метаноле и получают соответствующие амидины. Реакция с 1,1,3,3 тетраалкоксипропаном дает пиримидин-2-илзамещенные пиразоло[3,4-d]пиримидин-4-оны в качестве конечных продуктов. Другие альтернативные способы получения пиразоло[3,4-d]пиримидин-4-онов известны в данной области техники и также могут быть использованы для синтеза соединений, предлагаемых в настоящем изобретении (см., например: Р. Schmidt et al., Helvetica Chimica Acta 1962, 189, 1620ff.). Схема 4 Монозамещенные производные гидразина, которые использованы на стадии 1 схемы 1, можно получить восстановительным аминированием кетона трет-бутиловым эфиром гидразинкарбоновой кислоты с последующей стадией удаления защитной группы, как это показано на схеме 4 для D, обозначающего циклопентил или циклогексил, как это определено для общей формулы (I) [см., например, J.W. Timberlake et al., "Chemistry of Hydrazo-, Azo- and Azoxy Groups"; Patai, S., Ed.; 1975, Chapter 4; S.C. Hung et al.,Journal of Organic Chemistry 7957, 46, 5413-5414]. Схема 5 Как показано на схеме 1, на первой стадии 2-этоксиметилен-малононитрил конденсируют с монозамещенными гидразинами путем нагревания в подходящем растворителе, таком как этанол, в присутствии основания (например, триэтиламина) с образованием соответствующих 5-амино-1 Н-пиразол-4 карбонитрилов. Это соединения на второй стадии превращают в соответствующие амиды, например,путем обработки этанольного раствора аммиаком (25% в воде) и пероксидом водорода (35% в воде). На третьей стадии нагревание с R1-замещенным эфиром циклобутил- или циклопентилкарбоновой кислоты в щелочной среде (например, гидрид натрия в этаноле) дает конечные пиразоло[3,4-d]пиримидин-4-оны в качестве конечных продуктов [см., например, A. Miyashita et al., Heterocycles 1990, 31, 1309ff]. Эта процедура для случая, когда R1 обозначает пиридинил, подробнее описана в экспериментальном разделе(примеры 29-32). Дополнительная информация также приведена в WO 2004/099210 (в особенности описание от последнего абзаца на с. 9 до строки 8 с. 14, которое включено в настоящее изобретение в качестве ссылки),по общей методике получения соединений, в которых D означает тетрагидропиранил, дополнительная информация приведена в WO 2009/121919, в особенности с. 120-125, и в экспериментальной части этой заявки (включены в настоящее изобретение в качестве ссылки), для случая, когда D означает 4,4 дифторциклогексил, дополнительная информация приведена в WO 2010/026214, в особенности с. 59-63,и в экспериментальной части этой заявки (включены в настоящее изобретение в качестве ссылки), и в экспериментальной части (типичные варианты осуществления) настоящего описания. В частности, в ней описано получение следующих двух структурных блоков: Способ лечения. Настоящее изобретение относится к соединениям, которые считаются эффективными для лечения заболеваний. Соединения, предлагаемые в настоящем изобретении, являются эффективными и селективными ингибиторами фосфодиэстеразы 9 А и могут использоваться для разработки лекарственных средств. Такие лекарственные средства предпочтительно следует использовать для лечения заболеваний,при которых ингибирование PDE9A может привести к терапевтическому, профилактическому или модифицирующему заболевание эффекту. Лекарственные средства предпочтительно следует использовать для улучшения восприятия, сосредоточенности, познавательной способности, способности к обучению или памяти, таких как происходящих, в частности, при ситуациях/заболеваниях/синдромах, таких как слабое нарушение познавательной способности, возрастные нарушения способности к обучению и памяти, возрастная амнезия, мультиинфарктное слабоумие, черепно-мозговая травма, удар, слабоумие,возникшее после ударов (постинсультное слабоумие), посттравматическое слабоумие, общие нарушения сосредоточенности, нарушения сосредоточенности у детей с проблемами обучения и памяти, болезнь Альцгеймера, слабоумие с тельцами Леви,слабоумие с дегенерацией лобных долей, включая синдром Пика, болезнь Паркинсона, прогрессирующий ядерный паралич, слабоумие с кортикобазальной дегенерацией, боковой амиотрофический склероз (ALS), болезнь Гентингтона, рассеянный склероз, дегенерация таламуса, слабоумие Крейтцфельда-Якоба, слабоумие, связанное с ВИЧ (вирус иммунодефицита человека), эпилепсия, височная эпилепсия, шизофрения, шизофрения (со слабоумием), психоз Корсакова или нарушение познавательной способности, связанное с депрессией или биполярным нарушением. Другим объектом настоящего изобретения является лечение заболевания, которое возможно путем модулирования PDE9A, в частности нарушений сна, таких как инсомния или нарколепсия, биполярного нарушения, метаболического синдрома, ожирения, сахарного диабета, включая диабет типа 1 или типа 2,гипергликемии, дислипидемии, нарушенной переносимости глюкозы или заболеваний яичек, головного мозга, тонкого кишечника, скелетных мышц, сердца, легких, вилочковой железы или селезенки. Таким образом, медицинский объект настоящего изобретения можно кратко описать так, что соединение формулы (I) или (II), определенное в настоящем изобретении, предпочтительно специально определенное соединение применяется в качестве лекарственного средства. Такое лекарственное средство предпочтительно предназначено для лечения заболевания ЦНС. В альтернативном применении лекарственное средство предназначено для применения в терапевтическом или профилактическом способе, предпочтительно в терапевтическом способе, для лечения заболевания ЦНС, лечение которого возможно путем ингибирования PDE9. В альтернативном применении лекарственное средство предназначено для применения в терапевтическом или профилактическом способе, предпочтительно в терапевтическом способе для лечения заболевания, лечение которого возможно путем ингибирования PDE9, предпочтительно PDE9A. В наиболее предпочтительном альтернативном применении лекарственное средство предназначено для лечения, улучшения протекания и/или предупреждения нарушения познавательной способности,связанного с восприятием, сосредоточенностью, познавательной способностью, способностью к обучению или памятью, предпочтительно, если такое нарушение познавательной способности связано с заболеванием или патологическим состоянием, описанным в этом разделе. В альтернативном применении лекарственное средство предназначено для применения в терапевтическом или профилактическомспособе, предпочтительно в терапевтическом способе для лечения или улучшения протекания или предупреждения нарушения познавательной способности, связанного с возрастными нарушениями способности к обучению и памяти, возрастной амнезии, мультиинфарктного слабоумия, черепно-мозговой травмы, удара, слабоумия, возникшего после ударов (постинсультное слабоумие), посттравматического слабоумия, общих нарушений сосредоточенности, нарушений сосредоточенности у детей с проблемами обучения и памяти, болезни Альцгеймера, слабоумия с тельцами Леви,слабоумия с дегенерацией лобных долей, включая синдром Пика, болезни Паркинсона, прогрессирующего ядерного паралича, слабоумия с кортикобазальной дегенерацией, бокового амиотрофического склероза (ALS), болезни Гентингтона, рассеянного склероза, дегенерации таламуса, слабоумия Крейтцфельда-Якоба, слабоумия, связанного с ВИЧ, эпилепсии, височной эпилепсии, шизофрении, шизофрении(со слабоумием), психоза Корсакова или нарушения познавательной способности, связанного с депрессией или биполярным нарушением. В альтернативном применении лекарственное средство предназначено для применения в терапевтическом или профилактическом способе, предпочтительно в терапевтическом способе для лечения болезни Альцгеймера, шизофрении или нарушения познавательной способности, связанного с болезнью Альцгеймера или связанного с шизофренией. В альтернативном применении лекарственное средство предназначено для применения в терапевтическом или профилактическом способе, предпочтительно в терапевтическом способе для лечения нарушений сна, биполярного нарушения, метаболического синдрома, ожирения, сахарного диабета, гипергликемии, дислипидемии, нарушенной переносимости глюкозы или заболеваний яичек, головного мозга, тонкого кишечника, скелетных мышц, сердца, легких, вилочковой железы или селезенки. В другом объекте настоящего изобретения настоящее изобретение относится к способу лечения или предупреждения патологического состояния или заболевания, выбранного из приведенных выше групп патологических состояний и заболеваний, который включает введение нуждающемуся в этом человеку соединения, предлагаемого в настоящем изобретении, в терапевтически эффективном количестве. Другим объектом настоящего изобретения являются соединения, предлагаемые в настоящем изобретении, предназначенные для применения в качестве лекарственного средства в терапевтическом или профилактическом способе, предпочтительно в терапевтическом способе. Если это показано, то терапевтический способ или лекарственное средство предпочтительно предназначено для лечения патологического состояния или заболевания, выбранного из приведенных группы патологических состояний или заболеваний, который включает введение нуждающемуся в нем человеку соединения, указанного выше в этом разделе, называющемся "способ лечения". Фармацевтические композиции. Лекарственные средства для введения, которые также являются объектом настоящего изобретения,содержат соединение, предлагаемое в настоящем изобретении, или фармацевтически активный ингредиент в терапевтически эффективном количестве и фармацевтический носитель."Терапевтически эффективное количество" означает, что при введении лекарственного средства в соответствующем режиме, приспособленном к состоянию пациента, количество указанного соединения формулы (I) будет достаточно для эффективного лечения, предупреждения или замедления прогрессирования соответствующего заболевания или иного улучшения состояния пациента, страдающего от такого заболевания. Может оказаться, что "терапевтически эффективное количество", использующееся при монотерапии, отличается от "терапевтически эффективного количества", использующегося в комбинированной терапии вместе с другим лекарственным средством. Диапазон доз соединений общей формулы (I), вводимых в сутки, может составлять от 0,1 до 5000 мг, предпочтительно от 0,1 до 1000 мг, предпочтительно от 2 до 500 мг, более предпочтительно от 5 до 250 мг, наиболее предпочтительно от 10 до 100 мг. Дозированная форма (например, таблетка) предпочтительно может содержать от 2 до 250 мг, особенно предпочтительно от 10 до 100 мг соединений, предлагаемых в настоящем изобретении. Реальное фармацевтически эффективное количество или терапевтическая доза будет зависеть от факторов, известных специалистам в данной области техники, таких как возраст, масса тела, пол или другие характеристики пациента, путь введения, тяжесть заболевания и т. п. Соединения, предлагаемые в настоящем изобретении, можно вводить пероральным, парентеральным (внутривенным, внутримышечным и т. п.), назальным, сублингвальным, ингаляционным, внутриоболочечным, местным или ректальным путем. Подходящие препараты для введения соединений, предлагаемых в настоящем изобретении, включают, например, пластыри, таблетки, капсулы, пилюли, пеллеты, драже, порошки, лепешки, суппозитории, жидкие препараты, такие как растворы, суспензии, эмульсии, капли, сиропы, эликсиры или газообразные препараты, такие как аэрозоли, спреи и т. п. Содержание фармацевтически активного соединения (соединений) должно находиться в диапазоне от 0,05 до 90 мас.%, предпочтительно от 0,1 до 50 мас.% в пересчете на массу композиции в целом. Подходящие таблетки можно изготовить, например, путем смешивания активного вещества (веществ) с известными инертными наполнителями, например инертными разбавителями, такими как карбонат кальция, фосфат кальция или лактоза, разрыхлителями, такими как кукурузный крахмал или альгиновая кислота, связующими, такими как крахмал или желатин, смазывающими веществами, такими как стеарат магния или тальк, и/или агентами для замедления высвобождения, такими как карбоксиметилцеллюлоза, ацетатфталат целлюлозы или поливинилацетат. Таблетки также могут содержать несколько слоев. Таблетки с покрытием можно изготовить путем нанесения на ядра, полученные аналогично таблеткам, покрытия из вещества, обычно использующегося для нанесения на таблетки, например коллидона или шеллака, гуммиарабика, талька, диоксида титана или сахара. Для обеспечения замедленного высвобождения и предупреждения несовместимости ядро также может состоять из нескольких слоев. Аналогичным образом, покрытие таблетки может состоять из ряда слоев, обеспечивающих замедленное высвобождение, возможно, с включением инертных наполнителей, указанных выше для таблеток. Сиропы и эликсиры, содержащие активные вещества или их комбинации, предлагаемые в настоящем изобретении, могут дополнительно содержать подсластитель, такой как сахарин, цикламат, глицерин или сахар, и усилитель вкуса, например ароматизатор, такой как ванилин или апельсиновый экстракт. Они также могут содержать суспендирующие вспомогательные вещества или загустители, такие как натриевая соль карбоксиметилцеллюлозы, смачивающие агенты, такие как, например, продукты конденсации жирных спиртов с этиленоксидом, или консерванты, такие как п-гидроксибензоаты. Растворы готовят обычным образом, например, путем добавления изотонических агентов, консервантов, таких как п-гидроксибензоаты, или стабилизаторов, таких как соли щелочных металлов этилендиаминтетрауксусной кислоты, необязательно с использованием эмульгаторов и/или диспергирующих агентов, хотя, если в качестве разбавителя используют воду, то в качестве солюбилизаторов или растворяющих средств необязательно можно использовать органические растворители, и растворы можно помещать во флаконы или ампулы для инъекции или бутыли для вливания. Капсулы, содержащие одно или большее количество активных веществ или комбинации активных веществ, например, можно изготовить путем смешивания активных веществ с инертными носителями,- 22024984 такими как лактоза или сорбит, и их помещения в капсулы из желатина. Подходящие суппозитории, например, можно изготовить путем смешивания с носителями, предназначенным для этой цели, такими как нейтральные жиры, или полиэтиленгликоль, или его производные. Инертные наполнители, которые можно использовать, включают, например, воду, фармацевтически приемлемые органические растворители, такие как парафины (например, фракции нефти), растительные масла (например, арахисовое или кунжутное масло), одно- или многоатомные спирты (например, этанол или глицерин), носители, такие как, например, порошкообразные природные минералы (например, каолины, глины, тальк, мел), порошкообразные синтетические минералы (например, высокодисперсная кремниевая кислота и силикаты), сахара (например, тростниковый сахар, лактоза и глюкоза), эмульгаторы (например, лигнин, отработанные сульфитные щелоки, метилцеллюлоза, крахмал и поливинилпирролидон) и смазывающие вещества (например, стеарат магния, тальк, стеариновая кислота и лаурилсульфат натрия). Таблетки для перорального введения в дополнение к указанным носителям могут содержать добавки, такие как цитрат натрия, карбонат кальция и дикальцийфосфат, вместе с различными дополнительными веществами, такими как крахмал, предпочтительно картофельный крахмал, желатин и т. п. Для приготовления таблеток также можно использовать смазывающие вещества, такие как стеарат магния,лаурилсульфат натрия и тальк. В случае водных суспензий в дополнение к указанным выше инертным наполнителям активные вещества можно объединить с различными средствами, усиливающими вкус,или красителями. Доза соединений, предлагаемых в настоящем изобретении, разумеется, сильно зависит от методики введения и подвергающегося лечению заболевания. Комбинации с другими активными веществами. Другим объектом настоящего изобретения является комбинированная терапия, в которой соединение, предлагаемое в настоящем изобретении, вводят совместно с другим активным соединением. В соответствии с этим настоящее изобретения также относится к фармацевтическим препаратам, которые представляют собой такую комбинацию активных ингредиентов, в которой одним из этих соединений является соединение, предлагаемое в настоящем изобретении. Такие комбинации могут представлять собой фиксированные комбинации доз (фармацевтически активные ингредиенты, которые необходимо объединить, находятся в одном и том же фармацевтическом препарате) или нефиксированные комбинации доз(фармацевтически активные ингредиенты находятся в разных фармацевтических препаратах). Поэтому другим объектом настоящего изобретения является комбинация каждого из соединений,предлагаемых в настоящем изобретении, предпочтительно по меньшей мере одного соединения, предлагаемого в настоящем изобретении, с другим соединением, выбранным из группы, включающей, например, ингибиторы бета-секретазы; ингибиторы гамма-секретазы; модуляторы гамма-секретазы; ингибиторы агрегации амилоидов, такие как, например, альцгемед; нейропротективные вещества прямого или непрямого действия и/или модифицирующие заболевание вещества; антиоксиданты, такие как, например, витамин Е, гинкго билоба или гинколид; противовоспалительные вещества, такие как, например,ингибиторы Сох, нестероидные противовоспалительные средства (NSAIDs), дополнительно или исключительно способные снижать содержание А (А-бета); ингибиторы HMG-СоА редуктазы, такие как статины; ингибиторы ацетилхолинэстеразы, такие как донепезил, ривастигмин, такрин, галантамин; антагонисты рецептора NMDA, такие как, например, мемантин; агонисты рецептора АМРА; позитивные модуляторы рецептора АМРА, АМРкины, ингибиторы переносчика 1 глицина; ингибиторы рецептора повторного захвата моноаминов; вещества, влияющие на концентрацию или высвобождение нейротрансмиттеров; вещества, вызывающие секрецию гормона роста, такие как ибутаморенмезилат и капроморелин; антагонисты или обратные агонисты рецептора СВ-1; антибиотики, такие как миноциклин или рифампицин; ингибиторы PDE1, PDE2, PDE4, PDE5 и/или PDE10, обратные агонисты рецептора GABAA; антагонисты рецептора GABAA; агонисты или частичные агонисты, или позитивные модуляторы никотинового рецептора; агонисты или частичные агонисты, или позитивные модуляторы никотинового рецептора альфа-4-бета-2; агонисты или частичные агонисты никотинового рецептора альфа-7; антагонисты гистаминового рецептора Н 3; агонисты или частичные агонисты рецептора 5-НТ 4; антагонисты рецептора 5-НТ 6; антагонисты альфа-2-адренорецептора, антагонисты кальция; агонисты или частичные агонисты, или позитивные модуляторы мускаринового рецептора M1; антагонисты мускаринового рецептора М 2; антагонисты мускаринового рецептора М 4; позитивные аллостерические модуляторы метаботропного глутаматного рецептора 5; антагонисты метаботропного глутаматного рецептора 2, агонисты метаботропного глутаматного рецептора 2/3, позитивные аллостерические модуляторы метаботропного глутаматного рецептора 2 и другие вещества, которые модулируют рецепторы или ферменты таким образом, что повышается эффективность и/или безопасность соединений, предлагаемых в настоящем изобретении, или уменьшаются нежелательные побочные эффекты. Настоящее изобретение также относится к фармацевтическим композициям, содержащим одно или большее количество, предпочтительно одно активное вещество. По меньшей мере одно активное вещество выбрано из числа соединений, предлагаемых в настоящем изобретении, и/или соответствующих солей. Композиция предпочтительно содержит только одно такое активное вещество. В случае, если со- 23024984 держится более одного активного вещества, другое вещество может быть выбрано из указанной выше группы компонентов комбинации, включающей альцгемед, витамин Е, гинколид, донепезил, ривастигмин, такрин, галантамин, мемантин, ибутаморенмезилат, капроморелин, миноциклин и/или рифампицин. Композиция необязательно дополнительно содержит такие ингредиенты, как инертные носители и/или разбавители. Соединения, предлагаемые в настоящем изобретении, также можно использовать в комбинации с методиками иммунотерапии, такими как, например, активная иммунизация с помощью Abeta (амилоидные бета-пептиды) или ее части или пассивная иммунизация гуманизированными антителами к Abeta или фрагментами антител, для лечения указанных выше заболеваний и патологических состояний. Соединения, предлагаемые в настоящем изобретении, также можно объединять с димебоном. Соединения, предлагаемые в настоящем изобретении, также можно объединять с антидепрессантами, такими как амитриптилин, имипрамингидрохлорид (тофранил), имипраминмалеат (сурмонтил), лофепрамид, дезипрамин (норпрамин), доксепин (синекван, зоналон), тримипрамин (сурмонтил). Или соединения, предлагаемые в настоящем изобретении, также можно объединять с ингибиторами повторного всасывания серотонина (5-НТ), такими как алапроклат, циталопрам (целекса, ципрамил) эсциталопрам (лексапро, ципралекс), кломипрамин (анафранил), дулоксетин (цимбалта), феноксетин (малексил), фенфлурамин (пондимин), норфенфлурамин, флуоксетин (прозак), флувоксамин (лувокс), индальпин, милнаципрам (иксел), пароксетин (паксил, сероксат), сертралин (золофт, люстрал), тразодон(пристик), бразофензин и тезофензин. Компоненты комбинаций, предлагаемых в настоящем изобретении, могут находиться одновременно в одной дозированной форме, т. е. в виде комбинированного препарата, например два компонента могут быть включены в одну таблетку, например, в разные слои указанной таблетки. Компоненты комбинаций также могут быть использоваться по отдельности в виде свободной комбинации, т.е. соединения, предлагаемые в настоящем изобретении, находятся в одной дозированной форме и один или большее количество указанных выше компонентов комбинации находятся в другой дозированной форме. Эти две дозированные формы могут представлять собой равноценные дозированные формы, например при совместном введении двух таблеток, одна из которых содержит соединение, предлагаемое в настоящем изобретении, в терапевтически эффективном количестве, а вторая содержит указанный выше компонент комбинации в терапевтически эффективном количестве. При необходимости также можно комбинировать разные вводимые формы. Можно приготовить подходящие вводимые формы любого типа. Соединение, предлагаемое в настоящем изобретении, или его физиологически приемлемую соль в комбинации с другим активным веществом можно использовать одновременно или поочередно, но предпочтительно быстро одно за другим. При одновременном введении эти два активных вещества вводят пациенту совместно: при поочередном введении эти два активных вещества вводят пациенту последовательно с промежутком, меньшим или равным 12, предпочтительно меньшим или равным 6 ч. На дозированные или вводимые формы не налагаются ограничения, в контексте настоящего изобретения можно использовать любую подходящую дозированную форму. Типичные дозированные формы можно выбрать из числа твердых препаратов, таких как пластыри, таблетки, капсулы, пилюли, пеллеты, драже, порошки, лепешки, суппозитории, жидких препаратов, таких как растворы, суспензии, эмульсии, капли, сиропы, эликсиры, или газообразных препаратов, таких как аэрозоли, спреи и т. п. Дозированные формы с успехом готовят в виде дозированных единиц, каждая дозированная единица обеспечивает введение одной дозы каждого содержащегося активного компонента. Ингредиенты выбирают в соответствии с путем введения и дозированной формой. Дозировка компонентов указанной выше комбинаций предпочтительно составляет от 1/5 от обычно рекомендуемой минимальной дозы до 1/1 от обычно рекомендуемой дозы. Дозированные формы вводят пациенту, например 1, 2, 3 или 4 раза в сутки в зависимости от типа препарата. В случае препаратов замедленного или пролонгированного высвобождения или других фармацевтических препаратов введение можно проводить по-другому (например, один раз в неделю или в месяц и т .п.). Соединения, предлагаемые в настоящем изобретении, предпочтительно вводить три раза в сутки или реже, более предпочтительно один или два раза в сутки. Примеры Фармацевтические композиции. Примеры могут иллюстрировать возможные фармацевтические препараты, которые не являются ограничивающими. Термин "активное вещество" означает одно или большее количество соединений, предлагаемых в настоящем изобретении, включая их соли. В случае, если одна из указанных выше комбинаций содержит одно или большее количество активных веществ, термин "активное вещество" также может включать дополнительные активные вещества. Пример А. Таблетки, содержащие 100 мг активного вещества. Препарат: таблетка. Пример С. Капсулы из твердого желатина, содержащие 150 мг активного вещества. Приготовление любого из указанных выше препаратов можно провести по стандартным методикам. Биологическое исследование. Воздействие in vitro соединений, предлагаемых в настоящем изобретении, можно продемонстрировать с помощью приведенных ниже биологических исследований. Протокол исследования PDE9A2. Исследование ферментативной активности PDE9A2 проводили с помощью сцинтилляционнопроксимального анализа (СПА) в целом в соответствии с протоколом изготовителя (GE Healthcare, ранее- Amersham Biosciences, product number: TRKQ 7100). В качестве источника фермента использовали лизат (забуференный фосфатом физиологический раствор (ЗФФ) с добавлением 1% Triton Х-100 и ингибиторов протеазы, продукт распада клеток удаляли центрифугированием при 13000 об/мин в течение 30 мин) клеток SF 9, экспрессирующих PDE9A2 человека. Полное количество белка, использованного при анализе, менялось в зависимости от степени заражения и эффективности продуцирования клетками SF9 и находилось в диапазоне 0,1-100 нг. Обычно условия проведения анализа были следующими: полный объем при анализе 40 мкл,количество белка 0,1-50 нг,концентрация субстрата (cGMP) 20 нМ; 1 мкКи/л,длительность инкубации 60 мин при комнатной температуре,конечная концентрация ДМСО 0,2-1%. Анализы проводили в 384-луночных планшетах. Исследуемые реагенты, а также фермент и субстрат разводили в буфере для анализа. Буфер для анализа содержал 50 мМ Tris 0,1% БСА (бычий сывороточный альбумин), 0,05% Tween 20; значение рН буфера для анализа устанавливали равным 7,5. Реакцию останавливали путем введения избытка специфического ингибитора PDE9(например, соединения, указанного в WO 04099210 или WO 04099211, такого как один из энантиомеров,приведенных в примере 37, например, 1-(2-хлорфенил)-6-[(2R)-3,3,3-трифтор-2-метилпропил]-1,5 дигидро-4 Н-пиразоло[3,4-d]пиримидин-4-она). Литература.inhibitor BAY 73-6691 improves learning и memory in rodents. Neuropharmacology. 2008 Oct;55(5):908-18. Протокол исследования PDE1C. Анализ проводили аналогично анализу PDE9A2 с внесением следующих изменений: вместоPDE9A2 использовали PDE1C, и буфер для анализа дополнительно содержал 50 нМ кальмодулина, 3 мМCaCl2. Реакцию можно остановить путем введения такого же ингибитора, как указанный выше (1-(2 хлорфенил)-6-[(2R)-3,3,3-трифтор-2-метилпропил]-l,5-дигидро-4 Н-пиразоло[3,4-d]пиримидин-4-он. Определение IC50.IC50 можно рассчитать с помощью GraphPadPrism или другого подходящего программного обеспечения с заданием значения, равного 100 для положительного контроля и равного 0 для отрицательного контроля. Для расчета значений IC50 разведения исследуемых соединений (субстратов) следует выбирать и исследовать по указанному выше протоколу. Данные. Приведенные ниже значения IC50 для ингибирования PDE9A2 [наномолей (нМ)] показывают, что соединения, предлагаемые в настоящем изобретении, ингибируют PDE9, в частности PDE9A2. Это свидетельствует о том, что соединения обладают полезными фармакологическими характеристиками. Примеры не являются ограничивающими. В таблице также приведены значения селективности (селективность), которые указывают на преимущество соединений при ингибировании PDE9A по сравнению с ингибированием PD1C. Селективность представляет собой отношение (IC50 для ингибирования PDE1 С [наномолей (HM)])/(IC50 ДЛЯ ингибирования PDE9A2 [наномолей (нМ)]). Номера примеров относятся к заключительным примерам, описанным в разделе "Типичные варианты осуществления", и определены для приведенной выше таблицы семейства соединений (вариант осуществления 25). Все значения получены по методике, описанной в настоящем изобретении. Определение "энантиомер 1 или энантиомер 2" относится к порядку элюирования энантиомеров в хиральной СЖХ и хиральной ВЭЖХ. Воздействия in vivo. Предполагается, что данные по благоприятной эффективности in vitro соединений, предлагаемых в настоящем изобретении, соответствуют благоприятной эффективности in vivo. Воздействие in vivo соединений, предлагаемых в настоящем изобретении, можно исследовать с помощью нового теста распознавания объектов по методике, описанной в публикации Prickaerts et al. (Neuroscience, 2002, 113, 351-361), с помощью теста социального распознавания или с помощью исследования самопроизвольных нарушений в Т-образном лабиринте по методикам, описанным в публикации van derStaay et al. (Neuropharmacology 2008, 55, 908-918). Дополнительная информация о биологическом исследовании также приведена в этих двух публикациях. Кроме способности ингибировать мишень PDE9, соединения, предлагаемые в настоящем изобретении, могут обладать другими полезными фармакокинетическими характеристиками. Например, соединения, предлагаемые в настоящем изобретении, могут обладать одной или большим количеством благоприятных характеристик, таких как сбалансированный метаболизм, незначительная опасность лекарственных взаимодействий и/или сбалансированный клиренс. Соединения также могут обладать одной или большим количеством дополнительных или альтернативных благоприятных характеристик, таких как биологическая доступность, значительная степень всасывания, способность проходить через гематоэнцефалический барьер, подходящее (например, большое среднее) время удерживания, благоприятное воздействие на подвергающийся лечению участок и т. п. Получение соединений. Аббревиатуры: реагент Берджесса (метоксикарбонилсульфамоил)триэтиламмоний-N-бетаин,реагент Лавессона 2,4-бис-(4-метоксифенил)-[1,3,2,4]дитиадифосфетан 2,4-дисульфид Методики ЖХ-МС. Методика 1. Тип прибора для МС: Waters Micromass ZQ. Тип прибора для ВЭЖХ: Waters Alliance 2695, Waters 2996 детектор с диодной матрицей; колонка: Varian Microsorb 100 C18, 304,6 мм, 3,0 мкм; элюент А: вода+0,13% ТФК, элюент В: АЦН; градиентный режим: 0,0 мин 5% В 0,18 мин 5% В 2,0 мин 98% В 2,2 мин 98% В 2,3 мин 5% В 2,5 мин 5% В; скорость потока: 3,5 мл/мин; УФ-детектирование: 210380 нм. Методика 2. Тип прибора для МС: Waters Micromass ZQ. Тип прибора для ВЭЖХ: Waters Alliance 2695, Waters 2996 детектор с диодной матрицей; колонка: Varian Microsorb 100 С 18, 304,6 мм, 3,0 мкм; элюент А: вода+0,13% ТФК, элюент В: МеОН; градиентный режим: 0,0 мин 5% В 0,35 мин 5% В 3,95 мин 100% В 4,45 мин 100% В 4,55 мин 5% В 4,9 мин 5% В; скорость потока: 2,4 мл/мин; УФ-детектирование: 210-380 нм. Методика 3. Тип прибора для МС: Waters Micromass ZQ. Тип прибора для ВЭЖХ: Waters Alliance 2695, Waters 2996 детектор с диодной матрицей; колонка: Varian Microsorb С 18, 204,6 мм, 5,0 мкм; элюент А: вода+0,15% ТФК, элюент В: МеОН; градиентный режим: 0,0 мин 5% В 0,25 мин 5% В 1,90 мин 100%(100) за 10 мин в течение 1,5 мин; скорость потока: 1,2 мл/мин; УФ-детектирование: 254 нм; источник ионов: ХИАД. Методики хиральной СЖХ. Методика 4. Тип прибора для СЖХ: Berger "Analytix"; колонка: Daicel IC, 2504,6 мм, 5,0 мкм; элюент: СО 2/25% МеОН/0.2% ДЭА (в изократическом режиме); скорость потока: 4,0 мл/мин, 10 мин; температура: 40 С; УФ-детектирование: 210/220/254 нм. Методика 5. Тип прибора для СЖХ: Berger "Analytix"; колонка: Daicel ADH, 2504,6 мм, 5,0 мкм; элюент: СО 2/25% МеОН/0,2% ДЭА (в изократическом режиме); скорость потока: 4,0 мл/мин, 10 мин; температура: 40 С; УФ-детектирование: 210/220/254 нм. Методики хиральной ВЭЖХ. Методика 6. Тип прибора для ВЭЖХ: Agilent 1100; колонка: Daicel chiralcel OJ-H, 2504,6 мм, 5,0 мкм; элюент: гексан/EtOH80:20; скорость потока: 1 мл/мин, температура: 25 С; УФ-детектирование: при переменной длине волны (200-500 нм). Методика 6.1. Тип прибора для ВЭЖХ: Agilent 1100; колонка: Daicel chiralcel OJ-H, 250 4,6 мм, 5,0 мкм; элюент: гексан/EtOH 85:15; скорость потока: 1 мл/мин, температура: 25 С; УФ-детектирование: при переменной длине волны (200-500 нм). Методика 7. Тип прибора для ВЭЖХ: Agilent 1100; колонка: Chiralpak AD-H, 2504,6 мм, 5,0 мкм; элюент: гексан/изопропанол 80:20; скорость потока: 1 мл/мин, температура: 25 С; УФ-детектирование: при переменной длине волны (200-500 нм). Тип прибора для ВЭЖХ: Agilent 1100; колонка: Chiralpak AD-H, 250 4,6 мм, 5,0 мкм; элюент: гексан/изопропанол 80:20; скорость потока: 1 мл/мин, температура: 25 С; УФ-детектирование: при переменной длине волны (200-500 нм). Нагревание микроволновым излучением. Приборы Discover СЕМ, снабженные сосудами емкостью 10 и 35 мл;Biotage Initiator Sixty. Общие замечания о представлении структур. Соединения, содержащие стереогенный центр (центры): Структуры, представленные ниже в экспериментальном разделе, отображают только одну, а необязательно все стереохимические варианты соединений. Однако в таких случаях после структуры приведено, например, выражение "транс-рацемическая смесь" или "цис-рацемическая смесь", чтобы отметить другие возможные стереохимические конфигурации. Пример приведен ниже. Представленная структурная формула имеет вид Добавленное выражение "цис-рацемическая смесь" указывает на вторую возможную стереохимическую конфигурацию Таким образом, полученное соединение представляет собой смесь Такой подход используется и для других изображенных структур. Исходные соединения. Пример 1A (транс-рацемическая смесь) 2,00 г (13,9 ммоля) транс-циклобутан-1,2-дикарбоновой кислоты смешивали с 16 мл EtOH при 0 С и 2,21 мл (30,5 ммоля) тионилхлорид медленно добавляли. Смеси давали нагреваться до комнатной температуры и перемешивали в течение 1 ч. Растворитель удаляли при пониженном давлении и продукт фильтровали через слой активированного основного оксида алюминия. Получали 2,71 г (98%) продукта. ВЭЖХ-МС (методика 1): Rt=1,34 мин. МС (ИЭР, положительная ионизация): m/z=201 (М+Н)+. Соединение указанного ниже примера синтезировали аналогично получению соединения примера 1 А с использованием соответствующей дикислоты в качестве исходного вещества. 8,00 г (89,7 ммоля) 2-аминопропионовой кислоты смешивали с 88,0 мл (0,93 моля) уксусного ангидрида и 88,0 мл пиридина. Реакционную смесь перемешивали при 100 С в течение 135 мин. Растворитель удаляли при пониженном давлении. К остатку добавляли толуол, и растворитель удаляли при пониженном давлении, затем 204 мл (816 ммоля) HCl (4 М водный раствор) добавляли и смесь кипятили с обратным холодильником в течение 3 ч. Растворитель удаляли при пониженном давлении. 1-Бутанол (20 мл) к остатку добавляли и растворитель удаляли при пониженном давлении. Получали 11,6 г искомого соединения в виде гидрохлорида. МС (ИЭР, положительная ионизация): m/z=88 (М+Н)+. Пример 3 А (транс-рацемическая смесь)(см. заявку на патент РСТ WO 2010/026214, пример 8 А) смешивали с 15 мл безводного EtOH, добавляли 2,46 г (12,3 ммоля) соединения примера 1 А и 0,66 г (16,4 ммоля) гидрида натрия (60% суспензия в минеральном масле). Реакционную смесь нагревали при 140 С в течение 30 мин в микроволновой печи. Смесь охлаждали до комнатной температуры и добавляли раствор гидроксида натрия (4 М водный раствор). Растворитель удаляли при пониженном давлении. Остаток очищали с помощью препаративной ВЭЖХ(элюент А:вода+0,13% ТФК, элюент В: МеОН). 0,70 г (49%) продукта получали. ВЭЖХ-МС (методика 1): Rt=1,24 мин. МС (ИЭР, положительная ионизация): m/z=353 (М+Н)+. Соединения указанных ниже примеров синтезировали аналогично получению соединения примера 3 А с использованием соответствующего амида и сложного эфира в качестве исходных веществ (исходные вещества описаны в публикации патентов РСТ WO 2010/026214, WO 2009/121919 и WO 2004/09921).
МПК / Метки
МПК: C07D 487/04, A61P 25/28, A61K 31/519
Метки: качестве, производные, 6-циклоалкил-1,5-дигидропиразоло[3,4-d]пиримидин-4-она, применение, pde9a, ингибиторов
Код ссылки
<a href="https://eas.patents.su/30-24984-proizvodnye-6-cikloalkil-15-digidropirazolo34-dpirimidin-4-ona-i-ih-primenenie-v-kachestve-ingibitorov-pde9a.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 6-циклоалкил-1,5-дигидропиразоло[3,4-d]пиримидин-4-она и их применение в качестве ингибиторов pde9a</a>
Предыдущий патент: Сменный защитный элемент для землеройного оборудования и монтажный узел для такого оборудования, содержащий указанный защитный элемент
Следующий патент: Повышение урожайности культурных растений через отбор эпигенетически модифицированных популяций
Случайный патент: Способ, устройство и машиночитаемый носитель для анализа состояния машины, имеющей вращающуюся часть