Дейтерированные 1-пиперазино-3-фенилинданы, применяемые для лечения шизофрении
Номер патента: 24651
Опубликовано: 31.10.2016
Авторы: Андерсен Петер Хонгор, Йергенсен Мортен, Венегор Метте Граулун, Бадоло Лассина, Якобсен Миккель Фог, Енсен Клаус Гьервиг
Формула / Реферат
1. Соединение формулы Y
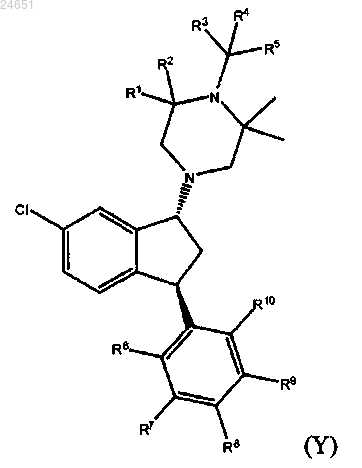
в которой R1-R10 независимо представляют собой водород или дейтерий и в которой по меньшей мере один из R1-R10 содержит по меньшей мере 50% дейтерия,
или его фармацевтически приемлемая кислотно-аддитивная соль.
2. Соединение по п.1, у которого каждый из R6-R10 представляет собой дейтерий.
3. Соединение по п.2, у которого каждый из R3-R5 представляет собой водород.
4. Соединение по п.2, у которого каждый из R3-R5 представляет собой дейтерий.
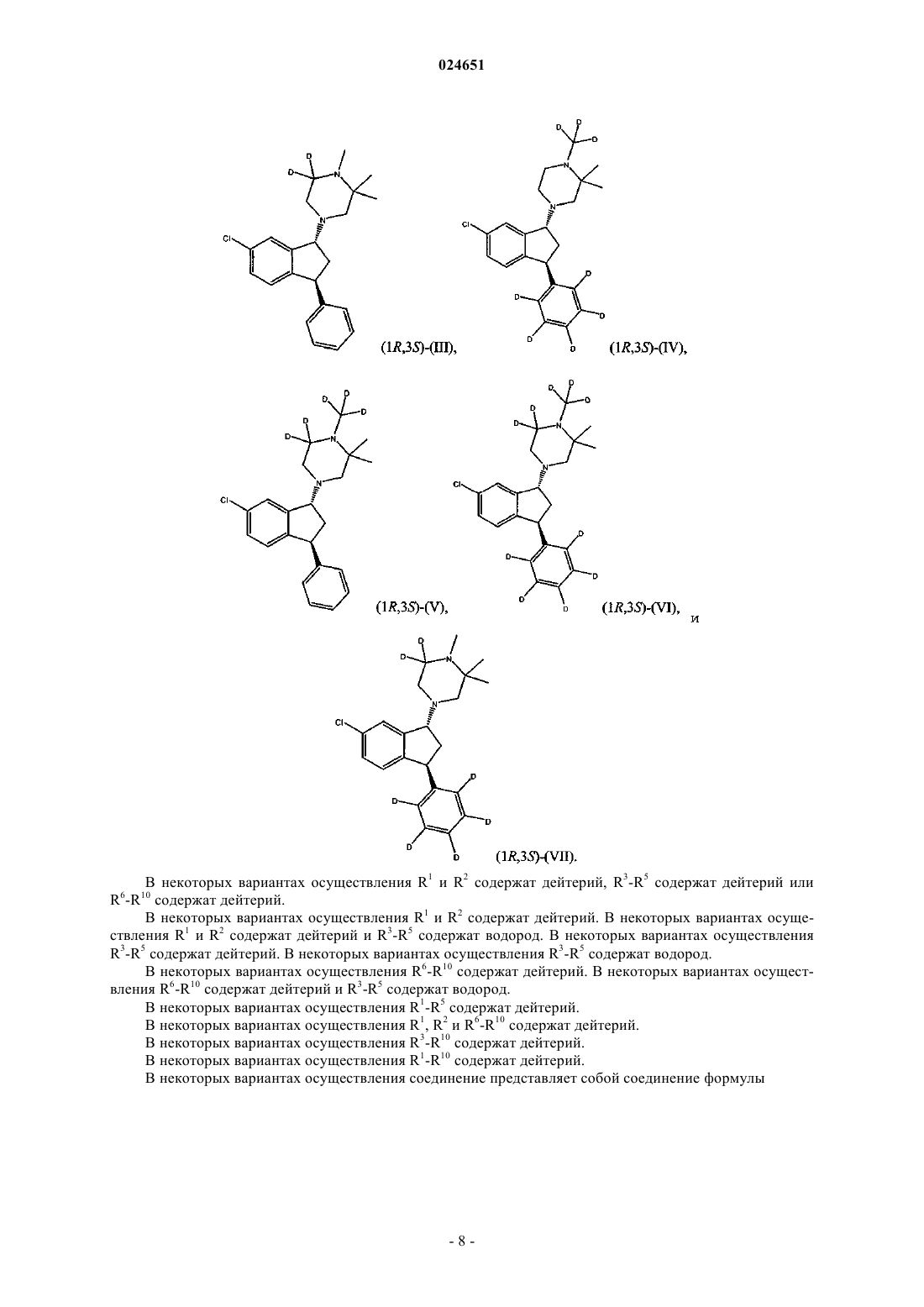
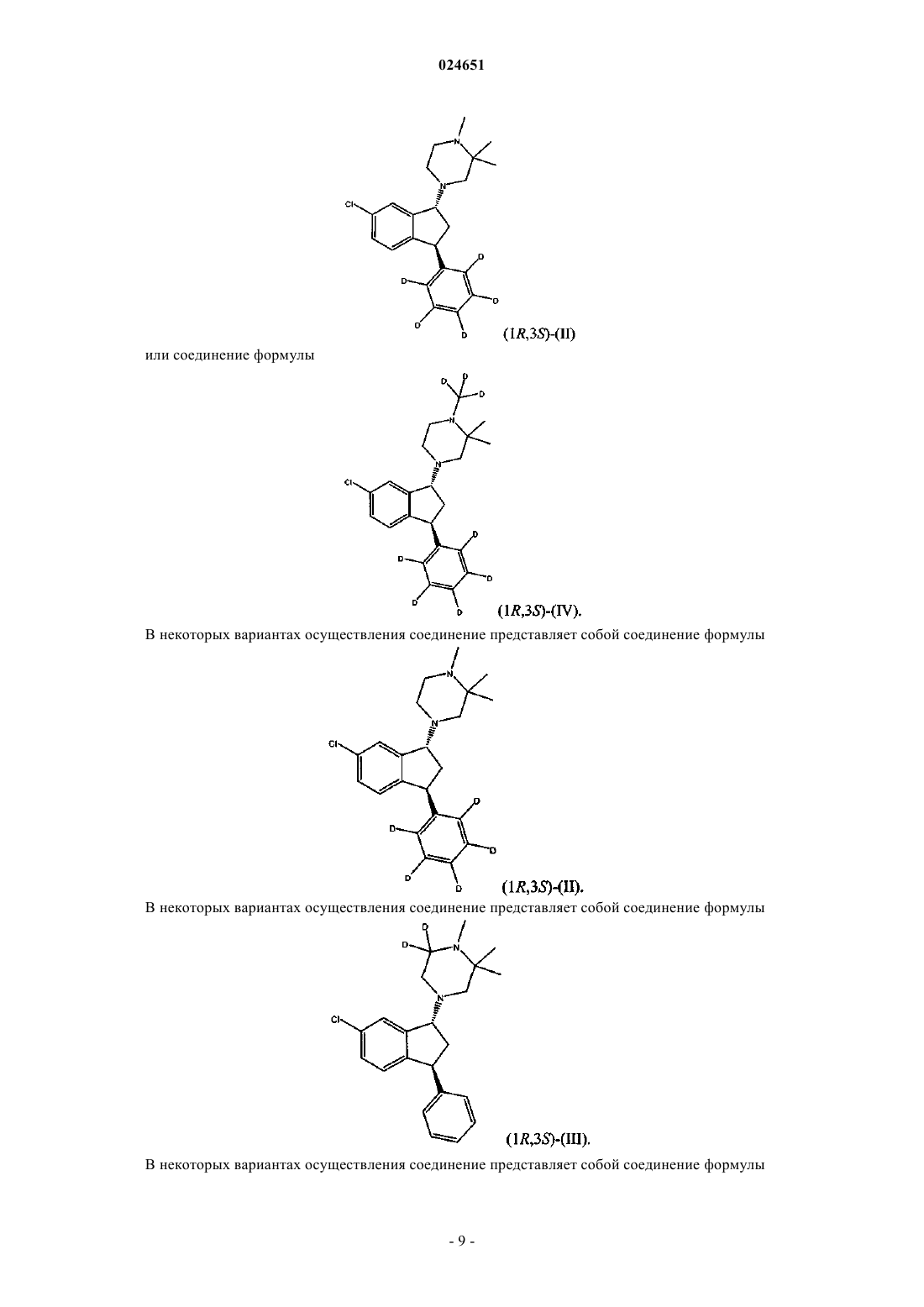
5. Соединение по п.3, где соединение является соединением (1R,3S)-(II)
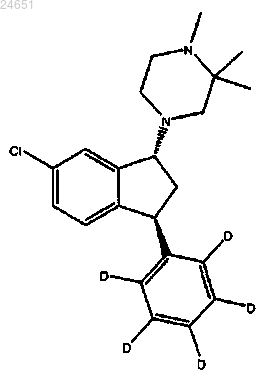
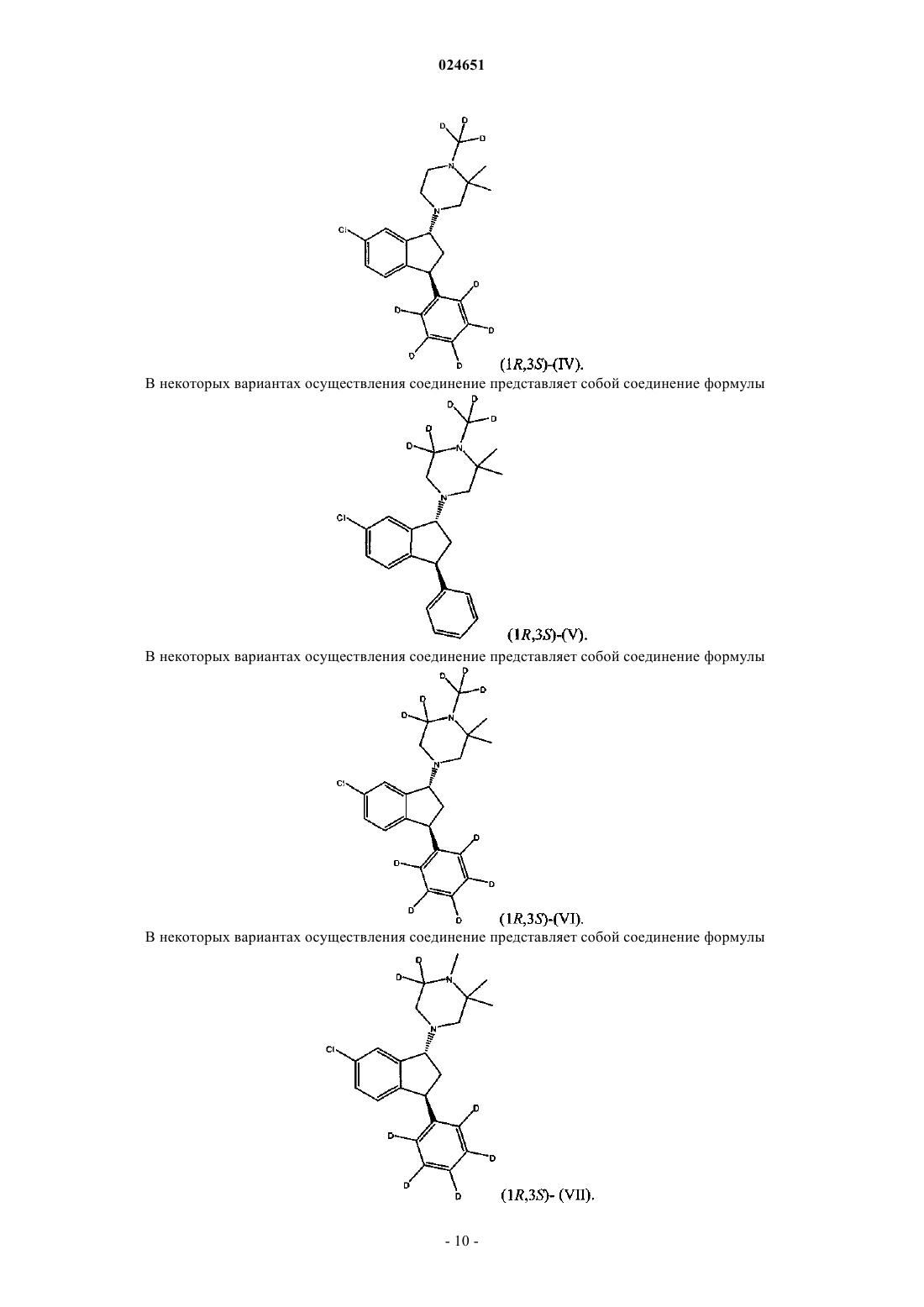
6. Соединение по п.3, где соединение является соединением (1R,3S)-(VII)
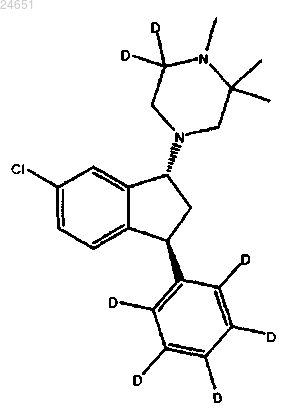
7. Соединение по п.4, где соединение является соединением (1R,3S)-(IV)
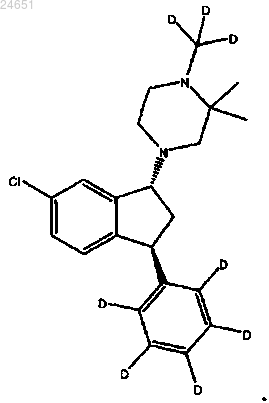
8. Соединение по п.4, где соединение является соединением (1R,3S)-(VI)
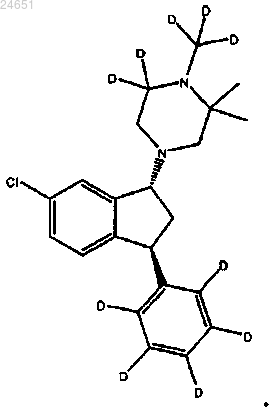
9. Соединение по п.1, у которого каждый из R1 и R2 представляет собой дейтерий.
10. Соединение по п.9, у которого каждый из R3-R5 представляет собой дейтерий.
11. Соединение по п.9, у которого каждый из R3-R5 представляет собой водород.
12. Соединение по п.10, где соединение является соединением (1R,3S)-(V)
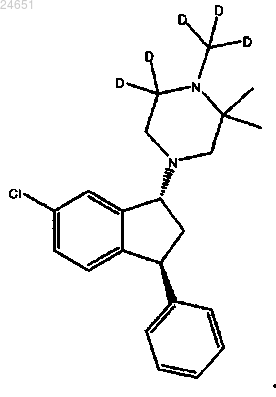
13. Соединение по п.11, где соединение является соединением (1R,3S)-(III)

14. Соединение по любому из пп.1-13, у которого по меньшей мере 85% соединения имеет атом дейтерия в каждом положении, указанном как дейтерий, и любой атом, не указанный как дейтерий, присутствует приблизительно при его природной изотопной распространенности.
15. Соединение по любому из пп.1-14, у которого по меньшей мере 90% соединения имеет атом дейтерия в каждом положении, указанном как дейтерий, и любой атом, не указанный как дейтерий, присутствует приблизительно при его природной изотопной распространенности.
16. Соединение по п.1, где соединение является гидротартратной солью соединения (1R,3S)-(IV)
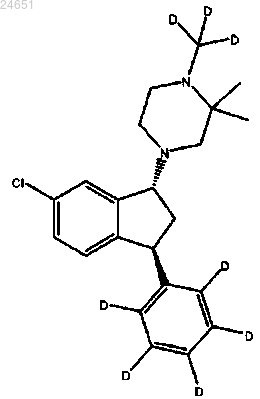
17. Соединение по п.16, где соединение существует в полиморфной форме А и имеет такую дифракционную картину XRPD, как показано на фиг. 18.
18. Соединение по п.16, где по меньшей мере 85% соединения имеет атом дейтерия в каждом положении, указанном как дейтерий, и любой атом, не указанный как дейтерий, присутствует приблизительно при его природной изотопной распространенности.
19. Фармацевтическая композиция, содержащая соединение по любому из пп.1-18 и один или несколько фармацевтически приемлемых носителей, разбавителей или эксципиентов.
20. Фармацевтическая композиция по п.19, у которой соединение является гидротартратной солью соединения формулы (1R,3S)-(IV)
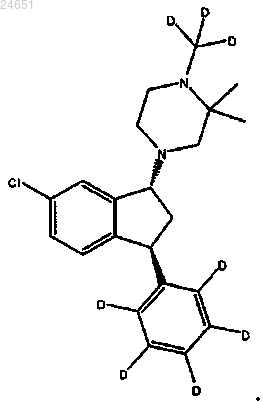
21. Композиция по п.19 или 20, в которой носитель содержит гидроксипропил-β-циклодекстрин в воде и в которой по меньшей мере 85% соединения имеет атом дейтерия в каждом положении, указанном как дейтерий, и любой атом, не указанный как дейтерий, присутствует приблизительно при его природной изотопной распространенности.
22. Применение соединения по любому из пп.1-18 при лечении психоза, других заболеваний, включающих в себя психотические симптомы, психотических нарушений или заболеваний, которые присутствуют с психотическими симптомами.
23. Применение соединения по любому из пп.1-18 для изготовления лекарственного средства для лечения психоза, других заболеваний, включающих в себя психотические симптомы, психотических нарушений или заболеваний, которые присутствуют с психотическими симптомами.
24. Применение композиции по любому из пп.19-21 при лечении психоза, других заболеваний, включающих в себя психотические симптомы, психотических нарушений или заболеваний, которые присутствуют с психотическими симптомами.
25. Применение композиции по любому из пп.19-21 для изготовления лекарственного средства для лечения психоза, других заболеваний, включающих в себя психотические симптомы, психотических нарушений или заболеваний, которые присутствуют с психотическими симптомами.
26. Применение по любому из пп.22-25, в котором психозом или заболеванием, включающим в себя психотические симптомы, является шизофрения, шизофрениформное нарушение, шизоаффективное нарушение, бредовое расстройство, кратковременное психотическое расстройство, разделяемое психотическое расстройство, биполярное расстройство или мания при биполярном расстройстве.
27. Применение по любому из пп.22-26, дополнительно содержащее соединение, выбранное из группы, состоящей из сертиндола, оланзапина, респеридона, кветиапина, арипипразола, галогенперидола, клозапина, зипразидона и озанетанта.
28. Применение по любому из пп.22-26, где психозом или заболеванием, включающим в себя психотические симптомы, является шизофрения.
29. Применение по любому из пп.24-28, где психозом или заболеванием, включающим в себя психотические симптомы, является шизофрения, где фармацевтическая композиция содержит эффективное количество гидротартратной соли соединения формулы (1R,3S)-(IV)
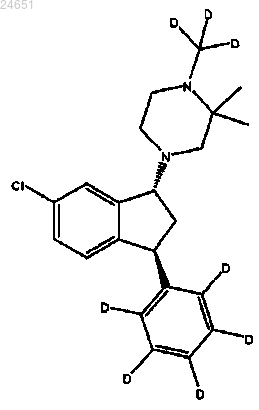
и гидроксипропил-β-циклодекстрин в воде и где по меньшей мере 85% соединения (IV) имеет атом дейтерия в каждом положении, указанном как дейтерий, и любой атом, не указанный как дейтерий, присутствует приблизительно при его природной изотопной распространенности.
30. Способ лечения психоза, других заболеваний, включающих в себя психотические симптомы, психотических нарушений или заболеваний, которые присутствуют с психотическими симптомами, включающий введение эффективного количества соединения по пп.1-18 или композиции по любому из пп.19, 20 нуждающемуся в этом субъекту.
31. Способ по п.30, в котором психозом или заболеванием, включающим в себя психотические симптомы, является шизофрения.
32. Способ по п.30 или 31, дополнительно включающий введение одного или нескольких нейролептических агентов.
33. Способ по п.32, в котором нейролептический агент выбран из сертиндола, оланзапина, респеридона, кветиапина, арипипразола, галогенперидола, клозапина, зипразидона и озанетанта.
34. Способ по любому из пп.30-33, в котором соединение или композиция содержит гидротартратную соль соединения формулы (1R,3S)-(IV)
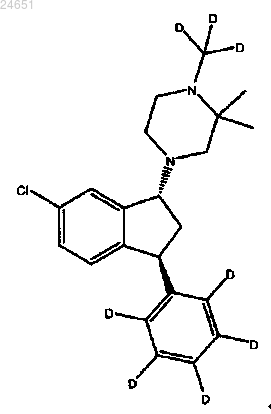
35. Способ по любому из пп.30-34, в котором по меньшей мере 85% соединения имеет атом дейтерия в каждом положении, указанном как дейтерий, и любой атом, не указанный как дейтерий, присутствует приблизительно при его природной изотопной распространенности.
36. Способ по любому из пп.30-35, в котором композиция содержит гидроксипропил-β-циклодекстрин в воде.
37. Способ лечения шизофрении у субъекта, нуждающегося в этом, включает введение фармацевтической композиции, содержащей эффективное количество гидротартратной соли соединения формулы (1R,3S)-(IV)
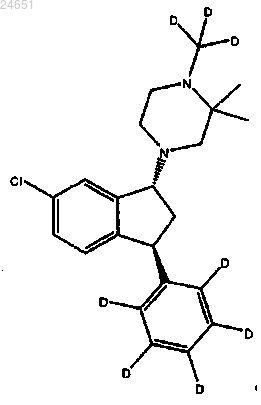
и гидроксипропил-β-циклодекстрин в воде, где по меньшей мере приблизительно 85% соединения (IV) имеет атом дейтерия в каждом положении, указанном как дейтерий, и любой атом, не указанный как дейтерий, присутствует приблизительно при его природной изотопной распространенности.
38. Соединение формулы (S)-(XV)
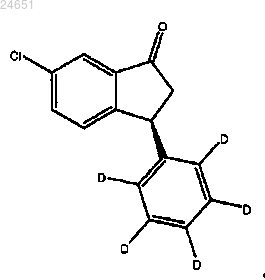
39. Способ получения соединения формулы (S)-(XV)
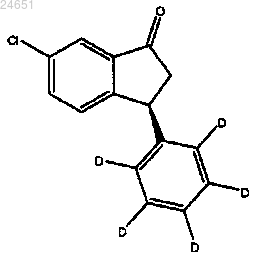
включающий обработку соединения (XIV)
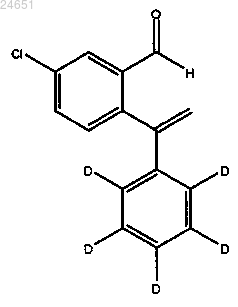
соединением [(S)-BINAP]Rh(I)BF4.
40. Способ по п.39, в котором [(S)-BINAP]Rh(I)BF4 применяют в каталитическом количестве.
41. Способ получения соединения (XIV)
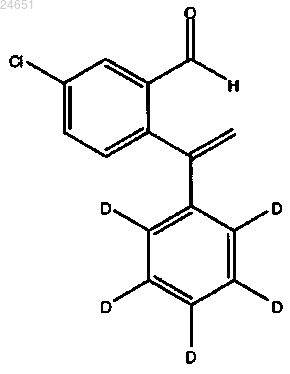
включающий а) обработку соединения формулы (XII)

бис-(пинаколато)дибороном и b) обработку 2-бром-5-хлорбензальдегидом.
42. Способ по п.41, в котором обработка соединения формулы (XII)
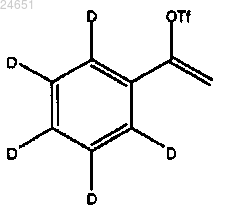
бис-(пинаколато)дибороном дополнительно включает добавление Pd(II).
43. Способ по п.42, в котором обработка 2-бром-5-хлорбензальдегидом дополнительно включает добавление Pd(0).
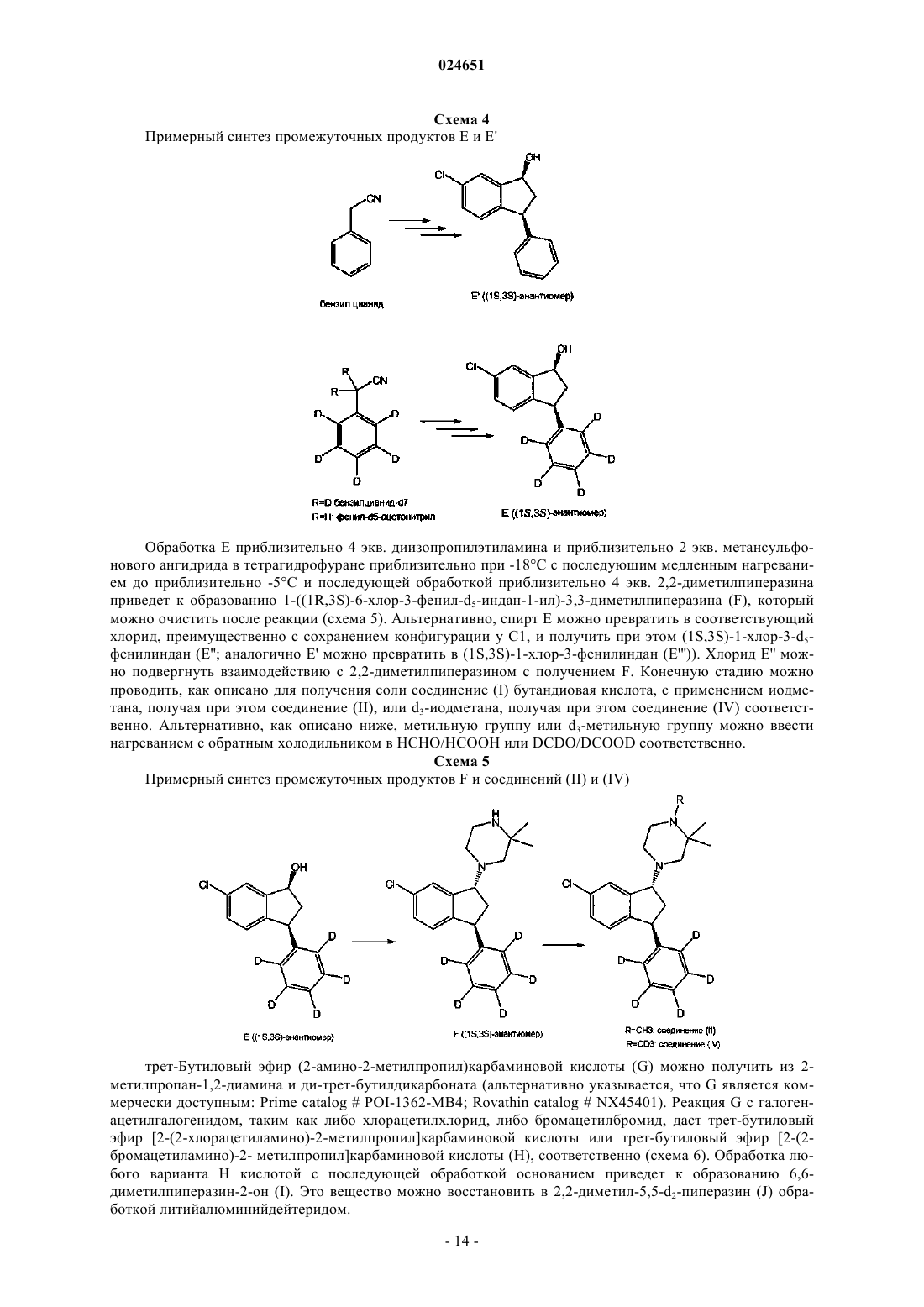
44. Способ получения тартрата соединения (1R,3S)-(IV), включающий обработку рацемического транс-1-(6-хлор-3-фенил(d5)индан-1-ил)-1(d3),2,2-триметилпиперазина L-(+)-винной кислотой.
45. Способ по п.42, в котором транс-1-(6-хлор-3-фенил(d5)индан-1-ил)-1(d3),2,2-триметилпиперазин получают из соответствующей его сукцинатной соли.
Текст
ДЕЙТЕРИРОВАННЫЕ 1-ПИПЕРАЗИНО-3-ФЕНИЛИНДАНЫ, ПРИМЕНЯЕМЫЕ ДЛЯ ЛЕЧЕНИЯ ШИЗОФРЕНИИ Изобретение относится к дейтерированным 1-пиперазино-3-фенилинданам и их солям с активностью по отношению к D1- и D2-рецепторам допамина, а также 5 НТ 2-рецепторам в центральной нервной системе, к лекарственным средствам, содержащим такие соединения в качестве активных ингредиентов, к применению таких композиций при лечении заболеваний центральной нервной системы и к способам лечения, содержащим введение таких соединений. Заявка на данный патент испрашивает приоритет предварительной заявки на патент США 61/498651, поданной 20 июня 2011 г., и 61/537103, поданной 21 сентября 2011 г., полное содержание каждой из которых включено в контекст в качестве ссылки. Все патенты, заявки на патенты и публикации, цитированные в контексте, таким образом включены в качестве ссылки во всей их полноте. Описания этих публикаций во всей их полноте таким образом включены в качестве ссылки в данное изобретение, чтобы более полно описать состояние данной области техники, известной специалисту в данной области на дату описанного и заявленного изобретения. Область техники, к которой относится изобретение Настоящее изобретение относится к дейтерированным 1-пиперазино-3-фенилинданам и их солям с активностью в отношении D1- и D2-рецепторов допамина, а также 5-НТ 2-рецепторов серотонина в центральной нервной системе, к лекарственным средствам, содержащим такие соединения в качестве активных ингредиентов, и к применению таких соединений при лечении заболеваний центральной нервной системы. Уровень техники На всем протяжении данного изобретения различные публикации указываются полностью. Описания этих публикаций таким образом включены в качестве ссылки в данное изобретение для описания более полного состояния области техники, к которой относится данное изобретение. 4-1R,3S)-6-Хлор-3-фенилиндан-1-ил)-1,2,2-триметилпиперазин и его соли, фармацевтические композиции, содержащие эти соли, и лекарственное применение их, включающее в себя лечение шизофрении или других заболеваний, включающих в себя психотические симптомы, описаны вWO 2005/016900. 4-1R,3S)-6-Хлор-3-фенилиндан-1-ил)-1,2,2-триметилпиперазин имеет общую формулу (X), в дальнейшем его называют соединением (X) В ЕР 638073 описывается группа транс-изомеров 3-арил-1-(1-пиперазинил)инданов, замещенных в 2- и/или 3-положении кольца пиперазина. Соединения описываются как имеющие высокую аффинность в отношении D1- и D2-рецепторов допамина и 5-НТ 2-рецепторов, и предполагается, что они являются применимыми для лечения некоторых заболеваний центральной нервной системы, в том числе шизофрении. Энантиомер указанной выше формулы (X) был описан Bogeso et al. in J. Med. Chem., 1995, 38, page 4380-4392 в форме фумаратной соли, см. табл. 5, соединение (-)-38. В данной публикации сделан вывод,что (-)-энантиомер соединения 38 является сильнодействующим D1/D2-антагонистом, проявляющим некоторую D1-селективность in vitro. Соединение описано также как сильнодействующий антагонист 5 НТ 2. Указывается также, что данное соединение не индуцирует каталепсию у крыс. Этиология шизофрении является неизвестной, но допаминовая гипотеза шизофрении (Carlsson, Am.J. Psychiatry 1978, 135, 164-173), сформулированная в начале 1960-х, обеспечила теоретическую основу для понимания биологических механизмов, лежащих в основе этого нарушения. В своей самой простейшей форме допаминовая гипотеза утверждает, что шизофрения связана с гипердопаминергическим состоянием, точка зрения, которая подтверждается тем фактом, что все антипсихотические лекарственные средства на рынке сегодня оказывают некоторый антагонизм D2-рецептору допамина (Seeman Scienceand Medicine, 1995, 2, 28-37). Тем не менее, в то же время общепринято, чтоантагонизм D2-рецепторов допамина в допаминалимбических областях мозга играет ключевую роль при лечении позитивных симптомов шизофрении, блокада D2-рецепторов в стриарных областях головного мозга вызывает экстрапирамидные симптомы (EPS). Как описано в ЕР 638073, профиль смешанного ингибирования D1/D2 рецепторов допамина наблюдали при применении некоторых так называемых "атипичных" антипсихотических соединений,в частности клозапина(8-хлор-11-(4-метилпиперазин-1-ил)-5 Ндибензо[b,е][1,4]диазепина), применяемого при лечении пациентов с шизофренией. Кроме того, селективные антагонисты D1 были связаны с лечением нарушений сна и злоупотребления алкоголем (D.N. Eder, Current Opinion in Investigational Drugs, 2002, 3(2):284-288). Допамин может также играть важную роль в этиологии аффективных нарушений (P. Willner, Brain.Res. Rev. 1983, 6, 211-224, 225-236 and 237-246; Bogeso et al., J. Med. Chem., 1985, 28, 1817-1828). В ЕР 638073 описано, как соединения, обладающие аффинностью в отношении 5-НТ 2-рецепторов, в частности антагонисты 5-НТ 2 А-рецепторов, были предложены для лечения различных заболеваний, таких как шизофрения, включая негативные симптомы у пациентов с шизофренией, депрессию, тревогу, нару-1 024651 шения сна, приступы мигрени и вызванный нейролептиками паркинсонизм. Было также предположено,что антагонизм 5-НТ 2 А-рецепторов уменьшает частоту появления экстрапирамидных побочных эффектов, вызванных классическими нейролептиками (Balsara et al. Psychopharmacology 1979, 62, 67-69). Изотопное замещение одного или нескольких атомов водорода (Н) атомами дейтерия (D) в соединении может вызывать кинетический изотопный эффект, который может влиять на скорость реакции,например, метаболизм соединения. Особенно это проявляется в случае, когда изотопная замена имеется в химической связи, которая разрывается или образуется в ограничивающей скорость стадии. В таком случае замену называют первичным изотопным эффектом. Когда изотопное замещение(я) не имеет место в одной или нескольких связях, которые разрываются, можно наблюдать меньшее изменение скорости,называемое вторичным изотопным эффектом. Сущность изобретения Настоящее изобретение относится к соединениям, у которых один или несколько атомов водорода(Н) в одном или нескольких метаболических участках M1, M2 и М 3 соединения (X) заменены атомами дейтерия (D). В одном аспекте изобретение относится к соединению формулы Y: в которой R1-R10 независимо представляют собой водород или дейтерий и в которой по меньшей мере один из R1-R10 содержит по меньшей мере приблизительно 50% дейтерия, или его фармацевтически приемлемой кислотно-аддитивной соли. В другом аспекте данное изобретение относится к фармацевтическим композициям, содержащим соединение формулы (Y) и один или несколько фармацевтически приемлемых носителей, разбавителей или эксципиентов. В другом аспекте изобретение относится к применению соединения формулы (Y) или фармацевтической композиции, содержащей соединение формулы (Y), при лечении психоза, других заболеваний,включающих в себя психотические симптомы, психотические нарушения или заболевания, которые сопровождаются психотическими симптомами. В еще одном аспекте изобретение относится к изготовлению лекарственного средства, содержащего соединение формулы (Y), для лечения психоза, других заболеваний, включающих в себя психотические симптомы, психотические нарушения или заболевания, которые сопровождаются психотическими симптомами. В еще одном аспекте изобретение относится к способам лечения психоза, других заболеваний,включающих в себя психотические симптомы, психотические нарушения или заболевания, которые сопровождаются психотическими симптомами, содержащим введение эффективного количества соединения формулы (Y) или фармацевтической композиции, содержащей соединение формулы (Y), субъекту,нуждающемуся в таком лечении. В еще одном аспекте настоящее изобретение относится к соединению формулы (S)-(XV) В еще одном аспекте изобретение относится к способу получения соединения формулы (S)-(XV),содержащему обработку соединения (XIV) соединением [(S)-BINAP]Rh(I)BF4. В еще одном аспекте изобретение относится к способу получения соединения, тартрата (1R,3S)(IV), содержащему обработку рацемического транс-1-(6-хлор-3-фенил(d5)индан-1-ил)-1(d3),2,2 триметилпиперазина L-(+)-винной кислотой. Кроме того, другие задачи и преимущества изобретения станут очевидными специалистам в данной области изпредложенного в контексте описания, которое является просто иллюстративным и не ограничивающим изобретение. Таким образом, специалистами в данной области техники будут осознаны другие варианты осуществления, не выходящие за пределы сущности и объема изобретения. Краткое описание чертежей На фиг. 1 показаны основные метаболические участки соединения (X). На фиг. 2 показаны соединение (I) и соединение (XI), каждое в виде (1R,3S)-энантиомера. На фиг. 3 показаны ЯМР-спектры соединения (II) и соединения (V). Показаны отдельные области 13 С ЯМР спектров с протонной развязкой и развязкой протона и дейтерия соединения (II) [фиг. 3 А] и соединения (V) [фиг. 3 В]. На фиг. 4 показан масс-спектр соединения (IV). На фиг. 5 показано образование метаболитного соединения (XI) в результате метаболизма соединения (X) и соединения (I) (0,1 мкМ) в криоконсервированных гепатоцитах собак (n=2, вертикальные линии (черточки) представляют собой максимальные и минимальные результаты). На фиг. 6 показано образование метаболитного соединения (XI) метаболизмом соединения (X) и соединения (I) (1 мкМ) в криоконсервированных гепатоцитах собак (n=2, вертикальные линии представляют собой максимальные и минимальные результаты). На фиг. 7 показано образование десметилметаболита метаболизмом соединений (II), (IV) и (X)(1 мкМ) в микросомах печени человека (n=3, вертикальные линии представляют собой стандартное отклонение. На фиг. 8 показано образование десметилметаболита метаболизмом соединений (II), (IV) и (X)(10 мкМ) в микросомах печени человека (n=3, вертикальные линии представляют собой стандартное отклонение). На фиг. 9 показано образование десметилметаболита метаболизмом соединения (III) (10 мкМ) в микросомах печени человека (n=3, вертикальные линии представляют собой стандартное отклонение). На фиг. 10 показано образование десметилметаболита метаболизмом соединения (V) (10 мкМ) в микросомах печени человека (n=3, вертикальные линии представляют собой стандартное отклонение). На фиг. 11 показано образование десметилметаболита метаболизмом соединения (VI) (10 мкМ) в микросомах печени человека (n=3, вертикальные линии представляют собой стандартное отклонение). На фиг. 12 показано образование десметилметаболита метаболизмом соединения (VII) (10 мкМ) в микросомах печени человека (n=3, вертикальные линии представляют собой стандартное отклонение). На фиг. 13 показана химическая структура соединений (I)-(VII), (Х)-(XI) и (XIX)-(XXI). На фиг. 14 показано образование десметилметаболита метаболизмом соединений (II) и (X) (10 мкМ) посредством рекомбинантного CYP2C19 печени человека (n=3, стандартное отклонение). На фиг. 15 показано образование десметилметаболита метаболизмом соединения (IV) и соединения(X) (1 мкМ) посредством рекомбинантного CYP2C19 печени человека (n=3, вертикальные линии представляют собой стандартное отклонение). На фиг. 16 показана РСР-индуцированная гиперактивность у мышей для соединения (IV). На фиг. 17 показана каталептическая реакция у крыс для соединения (IV). На фиг. 18 показаны дифрактограммы рентгеновских лучей двух порций гидротартратной соли соединения (IV). Подробное описание изобретения Атипичные антипсихотики были предметом многочисленных исследований в фармацевтической промышленности, они показали перспективу их при лечении психических расстройств, таких как шизофрения, биполярное расстройство, деменция, тревожное расстройство и обсессивно-компульсивное расстройство (OCD). Механизм действия этих агентов остается неизвестным; однако все антипсихотические средства действуют до некоторой степени на систему дофамина. Большинство атипичных антипсихотиков проявляет активность в отношении рецепторов дофамина подтипов 1 и 2 (D1 и D2 соответственно) и в отношении рецепторов серотонина подтипа 2 (5-НТ 2). В некоторых случаях определение "атипичный" было предназначено для антипсихотиков, которые не вызывают экстрапирамидные побочные действия; однако, было показано, что некоторые атипичные антипсихотики все же вызывают экстрапирамидные побочные действия, хотя и в меньшей степени, чем такие действия, наблюдаемые с типичными антипсихотиками (публикация Weiden, P.J., "EPS profiles: the atypical antipsychotics are not all thesame", J. Psychiatr. Pract. 2007, 13(1): 13-24; включенная в контекст в качестве ссылки во всей ее полноте). Одобренные атипичные нейролептики включают в себя, например, амисульприд (Solian), арипипразол(Abilify), азенапин (Saphris), блонансерин (Lonasen), клотиапин (Entumine), клозапин (Clozaril), илоперидон (Fanapt), луразидон (Latuda), мозапрамин (Cremin), оланзапин (Zyprexa), палиперидон (Invega), пероспирон (Lullan), кветиапин (Seroquel), ремоксиприд (Roxiam), рисперидон (Risperdal), сертиндол (Serdolect), суплирид (Sulpirid, Eglonyl), зипразидон (Geodon, Zeldox) и зотепин (Nipolept). Несколько других таких нейролептиков находятся в настоящее время в стадии разработки. Поскольку механизм действия атипичных нейролептиков хорошо не известен, побочные действия, связанные с этими лекарственными средствами, было трудно планировать. Таким образом, существует потребность в дополнительных антипсихотических терапиях с потенциалом ослабленного побочного действия и/или улучшенным терапевтическим профилем относительно существующих терапий. В одном аспекте данное изобретение относится к соединениям, у которых один или несколько атомов водорода (Н) в одном или нескольких метаболических участках M1, M2 и М 3 соединения (X) были замещены атомами дейтерия (D). Соединение (X) и его варианты описаны, например, в патентах США 5807855; 7648991; 7767683; 7772240; 8076342; публикациях патентов США 2008/0269248; 2010/0069676; 2011/0178094; 2011/0207744; WO 2005/016900; ЕР 0638073 и J. Med. Chem. 1995, 38, 43804392; причем каждый из них включен в контекст в качестве ссылки во всей его полноте. Кинетическое действие изотопа может потенциально влиять на скорость метаболизма в одном или нескольких метаболических участках из M1, M2 и М 3, показанных на фиг. 1. Авторы настоящего изобретения определили три основных метаболических участка 4-1R,3S)-6-хлор-3-фенилиндан-1-ил)-1,2,2 триметилпиперазина (соединения (X, обозначенных как M1, M2 и М 3 и показанных на фиг. 1. Дейтерирование соединения на участке, подвергаемом окислительному метаболизму, может в некоторых случаях уменьшить скорость метаболизма соединения вследствие первичного изотопного эффекта. Если стадия расщепления связи С-Н является стадией, ограничивающей скорость, можно наблюдать значительное изотопное влияние. Однако если другие стадии влияют на скорость метаболизма соединения, стадия расщепления связи С-Н не является стадией, ограничивающей скорость, и изотопное действие может иметь небольшое значение. Кроме того, негативное изотопное действие можно наблюдать,когда скорость реакции увеличивается при замещении дейтерием. Таким образом, включение дейтерия на участке, подвергаемом окислительному ферментативному метаболизму, является непредсказуемым и не влияет на фармакокинетики (см., например, патент США 7678914; Drug Metab. Dispos. 1986, 14,509; Arch Toxicol 1990, 64, 109; Int. Arch. Occup. Environ. Health 1993, 65 (Suppl. 1): S139, причем каждая публикация включена в контекст в качестве ссылки во всей ее полноте). Влияние включения дейтерия не действует непредсказуемо для многих лекарственных средств или классов лекарственных средств. Пониженный метаболический клиренс наблюдали у некоторых дейтерированных соединений относительно недейтерированных производных, тогда как на метаболизм других соединений это не влияло. Примеры исследований, указывающих на отсутствие предсказуемости в отношении включения дейтерия, включают в себя патент США 6221335; J. Pharm. Sci. 1975, 64, 367-391; Adv. Drug. Res. 1985, 14, 1-40; J. Med.Rep. Med. Chem. 2011, 46, 404-418; причем каждая публикация включена в контекст в качестве ссылки во всей ее полноте. Даже включение дейтерия в известные участки метаболизма имеет непредсказуемое влияние на метаболический профиль. Метаболическое переключение может иметь результат, при котором метаболический профиль конкретного лекарственного средства изменяется вследствие включения дейтерия, таким образом приводя к различным пропорциям метаболитов (или разным метаболитам), в отличие от наблюдаемого профиля у недейтерированного аналога того же лекарственного средства. Новый метаболический профиль может привести к определенному токсикологическому профилю дейтерированного аналога. Дополнением к потенциальным усложнениям включения дейтерия является возможность обмена дейтерий/водород в физиологической среде (Adv. Drug. Res. 1985, 14, 1-40; причем публикация включена в контекст в качестве ссылки во всей ее полноте). В некоторых вариантах осуществления изотопное замещение одного или нескольких атомов водорода в соединении (X) атомами дейтерия создавало кинетический изотопный эффект, который влияет на скорость метаболизма. Изотопное замещение атомов водорода в соединении (X) атомами дейтерия приводит к меньшему метаболизму дейтерированного соединения, которое, как показано, происходит в гепатоцитах собак, в которых, например, было отмечено приблизительно 50%-ное снижение образования десметилметаболита(соединения (XI из соединения (I) (фиг. 2) по сравнению с образованием соединения (XI) вследствие метаболизма соединения (X). Дейтерирование свободного фенил, необязательно в сочетании с дейтерированием 1-метильной группы (соединения (II) и (IV, неожиданно уменьшило количество десметилметаболита, продуцированного в микросомах печени человека, по сравнению с недейтерированным соединением (соединением(X. Также неожиданно дейтерирование 1-метильной группы повлияло на метаболизм в гепатоцитах собак, но не гепатоцитах человека, что таким образом свидетельствует о непредсказуемости влияния дейтерирования на фармакологические свойства. Влиянием уменьшенного метаболизма является более высокая биологическая доступность дейтерированного исходного соединения и меньшее образование метаболита. Без связи с какой-либо теорией, на основании результатов, описанных в экспериментальной части данной заявки, предполагается увидеть такое же действие после нескольких введений доз людям, что позволяет вводить людям более низкие дозы, т.е. меньшую нагрузку давать всему организму, например, печени, и реже проводить дозирование. Известно, что десметилметаболит (соединение (XI обладает сродством к hERG и таким образом,потенциально способствует пролонгации QTc. Как указано выше, дейтерирование свободного фенила,необязательно в сочетании с дейтерированием 1-метильной группы (соединения (II) и (IV, неожиданно уменьшает количество десметилметаболита, продуцированного в микросомах печени человека, по сравнению с недейтерированным соединением (соединение (X. Соответственно, и без ограничения теорией,предполагается, что будет меньше взаимодействия с каналом hERG и, как следствие, более низкая нагрузка на сердце при дозировании дейтерированных вариантов соединения (X) [например, соединений формулы (Y)], по сравнению с дозированием соединения (X). Настоящее изобретение далее подробно описывается в примерных вариантах осуществления, представленных в контексте. Определения. Термин "соединение(я) изобретения", применяемый в контексте, означает соединения (Y), (I), (II),(III), (IV), (V), (VI) и/или (VII) и может включать в себя их соли, гидраты и/или сольваты. Соединения настоящего изобретения получают в различных формах, таких как соли, гидраты и/или сольваты, и изобретение включает в себя композиции и способы, охватывающие все вариантные формы соединений. Термин "композиция(и) изобретения", применяемый в контексте, означает композиции, содержащие соединения (Y), (I), (II), (III), (IV), (V), (VI) и/или (VII) или их соли, гидраты и сольваты. Композиции изобретения могут дополнительно содержать один или несколько химических компонентов, таких как, например, эксципиенты, разбавители, наполнители или носители. Термин "способ(ы) изобретения", применяемый в контексте, означает способы, содержащие лечение соединениями и/или композициями изобретения. Применяемый в контексте термин "приблизительно" используют в контексте для обозначения термина аппроксимативно, примерно, приближенно, около или в диапазоне. Когда термин "приблизительно" применяют в сочетании с численным диапазоном, он изменяет этот диапазон расширением выше и ниже границ указанных численных величин. В общем, термин "приблизительно" применяют в контексте для изменения численной величины выше и ниже указанной величины на 20% выше или ниже (до более высокой или более низкой величины на 20%). Термин "эффективное количество", "достаточное количество" или "терапевтически эффективное количество", применяемый в контексте, означает количество соединения, которое является достаточным для достижения полезных или желаемых результатов, в том числе клинических результатов. Как таковое,эффективное количество может быть достаточным, например, для снижения или смягчения тяжести и/или уменьшения продолжительности поражения или заболевания или одного или нескольких его симптомов, предотвращения прогрессирования состояний, связанных с поражением или заболеванием, предотвращения рецидива, развития или возникновения одного или нескольких симптомов, ассоциированных с поражением или заболеванием, или усиления или же улучшения профилактического или терапевтического действия(ий) другой терапии. Эффективное количество включает в себя также количество соединения, которое предотвращает или существенно ослабляет нежелательные побочные действия. Применяемый в данном контексте, а также хорошо известный в данной области техники термин"лечение" является подходом для получения полезных или желаемых результатов, в том числе клинических результатов. Полезные или желаемые клинические результаты могут включать в себя, но не ограничиваются ими, ослабление или уменьшение интенсивности одного или нескольких симптомов или заболеваний, снижение степени заболевания, стабилизацию (т.е. без ухудшения) состояния заболевания,предотвращение распространения заболевания, задержку или замедление прогрессирования заболевания,-5 024651 улучшение или временное облегчение патологического состояния и ремиссию (или частичную или полную), или поддающуюся или не поддающуюся обнаружению. "Лечение" может также означать продлевание выживаемости по сравнению с ожидаемой выживаемостью без получения лечения. Термин "нуждающийся в этом" относится к необходимости симптоматического или бессимптомного облегчения заболевания, такого как, например, психоз или психотическое нарушение. Субъект, нуждающийся в этом, может или не может быть подвергнут лечению от заболеваний, связанных, например, с психозом или психотическим нарушением. Термин "носитель" относится к разбавителю, адъюванту, эксципиенту или наполнителю, с которым вводят соединение. Неограничивающие примеры таких фармацевтических носителей включают в себя жидкости, такие как вода и масла, включая масла нефтяного, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобное. Фармацевтическими носителями могут быть также физиологический раствор, аравийская камедь, желатин, крахмальная паста, тальк, кератин, коллоидный диоксид кремния, мочевина и тому подобное. Кроме того, можно применять вспомогательные, стабилизирующие, загущающие, смазывающие и красящие агенты. Другие примеры подходящих фармацевтических носителей описаны в публикацииRemington: The Science and Practice of Pharmacy, 21st Edition (University of the Sciences in Philadelphia, ed.,Lippincott WilliamsWilkins 2005), тем самым публикация включена в контекст в качестве ссылки во всей ее полноте). Термины "животное", "субъект" и "пациент", применяемые в контексте, включают в себя всех членов царства животных, включающего в себя, но не ограничивающегося указанным, млекопитающих,животных (например, кошек, собак, лошадей, свиней и т.д.) и людей. Термин "изотопный вариант", применяемый в контексте, означает соединение, полученное заменой одного или нескольких атомов водорода в исходном соединении, не содержащем атомы дейтерия, на атомы дейтерия. Известно, что в большинстве синтетических соединений элементы имеют природное изотопное содержание, что приводит к присущему природному включению дейтерия. Однако, природное изотопное содержание изотопов водорода, такого как дейтерий, является несущественным (приблизительно 0,015%) относительно степени стабильного изотопного замещения соединений, указанных в контексте. Таким образом, применяемое в контексте обозначение атома как дейтерия в положении указывает, что содержание дейтерия значительно больше, чем природное содержание дейтерия. Предполагается, что любой атом, не указанный в качестве конкретного изотопа, представляет собой любой стабильный изотоп этого атома, как будет очевидно специалисту в данной области. Соединения (Y) являются изотопными вариантами соединения (X). В некоторых вариантах осуществления соединения (I), (II), (III), (IV), (V), (VI) и (VII) являются изотопными вариантами соединения (X).M1 является участком соединения (X), восприимчивым к метаболизму; M1 состоит из -СН 2- в 6 положении пиперазина соединения (X). М 2 является участком соединения (X), восприимчивым к метаболизму; М 2 состоит из метила, Nсвязанного с пиперазином соединения (X). М 3 является участком соединения (X), восприимчивым к метаболизму; М 3 состоит из фенильной группы соединения (X). Исходное соединение представляет собой химическое соединение, которое является основой для его производных, получаемых либо замещением, либо разложением, например, метаболическим разложением. В контексте настоящего изобретения исходное соединение является активным фармацевтическим ингредиентом (API). В некоторых вариантах осуществления любой атом водорода, не обозначенный как дейтерий, имеет свое природное изотопное содержание. В некоторых вариантах осуществления любой атом водорода, не обозначенный как дейтерий, имеет изотопное содержание изотопа дейтерия менее 1%. В одном аспекте изобретение относится к соединению формулы (Y) в которой R1-R10 независимо представляют собой водород или дейтерий, причем по меньшей мере один из R1-R10 содержит по меньшей мере приблизительно 50% дейтерия,или его фармацевтически приемлемой кислотно-аддитивной соли. В другом аспекте изобретение относится к фармацевтической композиции, содержащей соединение формулы (Y) и один или несколько фармацевтически приемлемых носителей, разбавителей или эксципиентов. В другом аспекте изобретение относится к применениям соединения формулы (Y) или фармацевтической композиции, содержащей соединение формулы (Y), при лечении психоза, других заболеваний,включающих в себя психотические симптомы, психотические нарушения или заболевания, которые имеют психотические симптомы. В еще одном аспекте изобретение относится к изготовлению лекарственного средства, содержащего соединение формулы (Y), и предназначено для лечения психозов, других заболеваний, включающих в себя психотические симптомы, психотические нарушения или заболевания, которые имеют психотические симптомы. В еще одном аспекте изобретение относится к способам лечения психоза, других заболеваний,включающих в себя психотические симптомы, психотических нарушений или заболеваний, которые имеют психотические симптомы, содержащим введение эффективного количества соединения формулы(Y) или фармацевтической композиции, содержащей соединение формулы (Y). В некоторых вариантах осуществления соединение является рацемическим. В некоторых вариантах осуществления соединение является энантиомерно обогащенным. В некоторых вариантах осуществления соединение выбирают из группы, состоящей из В некоторых вариантах осуществления R1 и R2 содержат дейтерий, R3-R5 содержат дейтерий илиR -R содержат дейтерий. В некоторых вариантах осуществления R1 и R2 содержат дейтерий. В некоторых вариантах осуществления R1 и R2 содержат дейтерий и R3-R5 содержат водород. В некоторых вариантах осуществленияR3-R5 содержат дейтерий. В некоторых вариантах осуществления R3-R5 содержат водород. В некоторых вариантах осуществления R6-R10 содержат дейтерий. В некоторых вариантах осуществления R6-R10 содержат дейтерий и R3-R5 содержат водород. В некоторых вариантах осуществления R1-R5 содержат дейтерий. В некоторых вариантах осуществления R1, R2 и R6-R10 содержат дейтерий. В некоторых вариантах осуществления R3-R10 содержат дейтерий. В некоторых вариантах осуществления R1-R10 содержат дейтерий. В некоторых вариантах осуществления соединение представляет собой соединение формулы 6 В некоторых вариантах осуществления соединение представляет собой соединение формулы В некоторых вариантах осуществления соединение представляет собой соединение формулы В некоторых вариантах осуществления соединение представляет собой соединение формулы В некоторых вариантах осуществления соединение представляет собой соединение формулы В некоторых вариантах осуществления соединение представляет собой соединение формулы В некоторых вариантах осуществления соединение представляет собой соединение формулы В некоторых вариантах осуществления по меньшей мере приблизительно 75% соединения имеет атом дейтерия в каждом положении, обозначенном как дейтерий, и любой атом, не обозначенный как дейтерий, имеет приблизительно свое природное изотопное содержание. В некоторых вариантах осуществления по меньшей мере приблизительно 85% соединения имеет атом дейтерия в каждом положении, обозначенном как дейтерий, и любой атом, не обозначенный как дейтерий, имеет приблизительно свое природное изотопное содержание. В некоторых вариантах осуществления по меньшей мере приблизительно 90% соединения имеет атом дейтерия в каждом положении, обозначенном как дейтерий, и любой атом, не обозначенный как дейтерий, имеет приблизительно свое природное изотопное содержание. В некоторых вариантах осуществления соединение представляет собой соль, выбранную из группы,состоящей из фумарата, малеата, сукцината и тартрата. В некоторых вариантах осуществления соединение представляет собой фумаратную соль. В некоторых вариантах осуществления соединение представляет собой гидрофумаратную соль. В некоторых вариантах осуществления соединение представляет собой малеатную соль. В некоторых вариантах осуществления соединение представляет собой гидромалеатную соль. В некоторых вариантах осуществления соединение представляет собой сукцинатную соль. В некоторых вариантах осуществления соединение представляет собой гидросукцинатную соль. В некоторых вариантах осуществления соединение представляет собой тартратную соль. В некоторых вариантах осуществления соединение представляет собой гидротартратную соль. В некоторых вариантах осуществления соединение представляет собой гидротартратную соль соединения (1R,3S)-(IV). В некоторых вариантах осуществления психозом или заболеванием, включающим в себя психотические симптомы, является шизофрения, шизофрениформное нарушение, шизоаффективное нарушение,бредовое расстройство, кратковременное психотическое расстройство, разделяемое психотическое расстройство, биполярное расстройство или мания при биполярном расстройстве. В некоторых вариантах осуществления психозом или заболеванием, включающим в себя психотические симптомы, является шизофрения. В некоторых вариантах осуществления способы дополнительно содержат введение одного или нескольких нейролептических агентов. В некоторых вариантах осуществления применения дополнительно содержат применение одного или нескольких нейролептических агентов. В некоторых вариантах осуществления нейролептический агент выбран из группы, состоящей из сертиндола, оланзапина, рисперидона, кветиапина, арипипразола, галогенперидола, клозапина, зипразидона и озанетанта. В некоторых вариантах осуществления введение является пероральным, сублингвальным или трансбуккальным. В некоторых вариантах осуществления введение является пероральным. В некоторых вариантах осуществления субъектом является млекопитающее. В некоторых вариантах осуществления субъект является грызуном, кошкой, собакой, обезьяной, лошадью, свиньей, коровой или человеком. В некоторых вариантах осуществления субъект является грызуном, кошкой, собакой,обезьяной, быком или человеком. В некоторых вариантах осуществления субъектом является мышь,крыса, кошка, собака, обезьяна или человек. В некоторых вариантах осуществления субъектом является мышь, крыса, собака, обезьяна или человек. В некоторых вариантах осуществления субъектом является мышь, крыса, собака или человек. В некоторых вариантах осуществления субъектом является мышь,крыса или человек. В некоторых вариантах осуществления субъектом является собака или человек. В некоторых вариантах осуществления субъектом является человек. В некоторых вариантах осуществления обозначение положения как "D" в соединении означает минимальное включение дейтерия приблизительно более 40% в это положение. В некоторых вариантах осуществления обозначение положения как "D" в соединении означает минимальное включение дейтерия приблизительно более 50% в это положение. В некоторых вариантах осуществления обозначение положения как "D" в соединении означает минимальное включение дейтерия приблизительно более 60% в это положение. В некоторых вариантах осуществления обозначение положения как "D" в соединении означает минимальное включение дейтерия приблизительно более 65% в это положение. В некоторых вариантах осуществления обозначение положения как "D" в соединении означает минимальное включение дейтерия приблизительно более 70% в это положение. В некоторых вариантах осуществления обозначение положения как "D" в соединении означает минимальное включение дейтерия приблизительно более 75% в это положение. В некоторых вариантах осуществления обозначение положения как "D" в соединении означает минимальное включение дейтерия приблизительно более 80% в это положение. В некоторых вариантах осуществления обозначение положения как "D" в соединении означает минимальное включение дейтерия приблизительно более 85% в это положение. В некоторых вариантах осуществления обозначение положения как "D" в соединении означает минимальное включение дейтерия приблизительно более 90% в это положение. В некоторых вариантах осуществления обозначение положения как"D" в соединении означает минимальное включение дейтерия приблизительно более 95% в это положение. В некоторых вариантах осуществления обозначение положения как "D" в соединении означает ми- 11024651 нимальное включение дейтерия приблизительно более 97% в это положение. В некоторых вариантах осуществления обозначение положения как "D" в соединении означает минимальное включение дейтерия приблизительно более 99% в это положение. Фармацевтически приемлемые соли. Настоящее изобретение включает в себя также соли соединений, обычно фармацевтически приемлемые соли. Такие соли включают в себя фармацевтически приемлемые кислотно-аддитивные соли. Кислотно-аддитивные соли включают в себя соли неорганических кислот, а также органических кислот. Репрезентативные примеры подходящих неорганических кислот включают в себя хлористоводородную, бромисто-водородную, иодисто-водородную, фосфорную, серную, сульфаминовую, азотную кислоты и тому подобное. Репрезентативные примеры подходящих органических кислот включают в себя муравьиную, уксусную, трихлоруксусную, трифторуксусную, пропионовую, бензойную, коричную,лимонную, фумаровую, гликолевую, итаконовую, молочную, метансульфоновую, малеиновую, яблочную, малоновую, миндальную, щавелевую, пикриновую, пировиноградную, салициловую, янтарную,метансульфоновую, этансульфоновую, винную, аскорбиновую, памовую, бисметиленсалициловую, этандисульфоновую, глюконовую, цитраконовую, аспарагиновую, стеариновую, пальмитиновую, ЭДТА,гликолевую, п-аминобензойную, глутаминовую, бензолсульфоновую, п-толуолсульфоновую кислоты,теофиллинуксусные кислоты, а также 8-галогентеофиллины, например, 8-бромтеофиллин и тому подобное. Дополнительные примеры фармацевтически приемлемых неорганических или органических кислотно-аддитивных солей включают в себя фармацевтически приемлемые соли, перечисленные в публикациях Berge, S.M. et al., J Pharm. Sci. 1977, 66, 2, и Gould, P.L., Int. J. Pharmaceutics 1986, 33, 201-217; содержание каждой из которых таким образом включено в качестве ссылки. Кроме того, соединения данного изобретению могут существовать в несольватированных, а также в сольватированных формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и тому подобное. В общем, сольватированные формы считаются сравнимыми с несольватированными формами для целей данного изобретения. Заголовки и подзаголовки применяют в контексте только для удобства и не должны быть истолкованы как ограничивающие изобретение в любом случае. Применение любого из "в том числе", "например", "как таковой" в данном описании предназначено только для лучшего освещения изобретения и не накладывает ограничений на объем изобретения, если не указано иначе. Применение форм в единственном числе в контексте описания изобретения следует истолковывать так, что они охватывают как единственные, так и множественные числа, если в контексте не указано иное или это явно отрицается контекстом. Если не указано иное, все точные величины, представленные в контексте, являются представителями соответствующих аппроксимативных величин (например, можно считать, что все точные примерные величины, предоставленные по отношению к конкретному фактору или измерению, предусматривают также соответствующую приблизительную величину, модифицированную словом "приблизительно", где это уместно). Предполагается, что описание в контексте любого аспекта или аспекта изобретения с использованием таких терминов, как "заключающий в себя", "имеющий", "включающий" или "содержащий" со ссылкой на элемент или элементы, обеспечивает поддержку для подобного аспекта или аспектов настоящего изобретения, которые "состоят из", "состоят по существу из" или "по существу содержат" этот конкретный элемент или элементы, если не указано иное или это явно противоречит контексту. Иллюстративные синтезы соединений изобретения можно легко достичь способами, описанными,например, в патентах США 5807855; 7648991; 7767683; 7772240; 8076342; публикациях патентов США 2008/0269248; 2010/0069676; 2011/0178094; 2011/0207744; WO 2005/016900; ЕР 0638073 и J.Med. Chem. 1995, 38, 4380-4392; каждый из источников включен в контекст в качестве ссылки во всей его полноте. Такие способы и аналогичные способы можно проводить с применением дейтерированных реагентов и/или промежуточных продуктов и/или введением атомов дейтерия в химическую структуру согласно протоколам, известным в данной области техники. Следующие иллюстративные способы синтеза включают в себя превращение инданона А в промежуточный продукт С посредством обработки 3-бром-6-хлориндан-1-она (А; для ссылок по этому веществу см. публикации Bogeso ЕР 35363 А 1 19810909 и Kehler, Juhl, Puschl, WO 200802536; причем каждая из таких публикаций включена в контекст в качестве ссылки во всей ее полноте) основанием, таким как триэтиламин, в растворителе, таком как тетрагидрофуран, при температуре окружающей среды (схема 1). Удаление осажденной гидробромидной соли амина фильтрованием, и концентрирование фильтрата даст 6-хлоринден-1-он (В). Это вещество можно подвергнуть взаимодействию с фенил-d5-бороновой кислотой в присутствии приблизительно 1 экв. основания, такого как триэтиламин, и каталитического количества смеси 1:1 [Rh(ndb)2]BF4 (бис-(норборнадиен)родий(I)тетрафторбората) и рацемического BINAP(2,2'-бис-(дифенилфосфино)-1,1'-бинафтила) в подходящем растворителе (например, смеси приблизительно 10:1 растворителей 1,4-диоксана и воды) в атмосфере аргона при повышенной температуре (например, приблизительно 100 С). Обработка позволит получить рацемический 6-хлор-3-фенил-d5-индан- 12024651 1-он (С). Схема 1 Примерный синтез промежуточного продукта С Обработка 6-хлор-3-фенил-d5-индан-1-она (С) основанием-восстановителем, таким как борогидрид натрия (2 экв.) в смеси растворителей 10:1 тетрагидрофурана и воды при низкой температуре (приблизительно -15 С) приведет к восстановлению карбонильной группы в соответствующий спирт (схема 2). Обработка даст рацемический цис-6-хлор-3-фенилиндан-1-ол (D). Обработка этого вещества винилбутиратом (приблизительно 5 экв.) и Novozym 435 в растворителе, таком как диизопропиловый эфир, при температуре окружающей среды даст (1S,3S)-6-хлор-3-фенилиндан-1-ол (Е) после обработки. Схема 2 Примерный синтез промежуточного продукта Е Альтернативно, проведение последовательности реакций от А до Е с применением фенилбороновой кислоты или 4,4,5,5-тетраметил-2-фенил[1,3,2]диоксаборолана вместо 4,4,5,5-тетраметил-2-d5 фенил[1,3,2]диоксаборолана приведет к получению (1S,3S)-6-хлор-3-фенилиндан-1-ола (Е') (схема 3). Схема 3 Примерный синтеза промежуточного продукта Е' Следующие альтернативные способы синтеза для получения Е' описаны в патентной литературе(Dahl, Wohlk Nielsen, Suteu, Robin, Brosen WO 2006/086984 A1; Bang-Andersen, Bogeso, Jensen, Svane,Dahl, Howells, Lyngso, Mow WO 2005/016901 A1; каждая из которых включена в контекст в качестве ссылки во всей ее полноте). В этих процедурах бензилцианид применяют в качестве одного из субстратов. Применение бензилцианида-d7 (является коммерчески доступным от Aldrich, catalog495840) или фенил-d5-ацетонитрила (является коммерчески доступным от Aldrich, catalog495859, или от CDN, catalogD-5340, или от Kanto, catalog49132-27) и такой же процедуры может привести к получению Е(схема 4). В качестве альтернатив коммерческим источникам, бензилцианиду-d7 и фенил-d5 ацетонитрилу, можно применять полученный цианид натрия и бензил-d7-хлорид (коммерчески доступный от Aldrich, catalog217336) и бензил-2,3,4,5,6-d5-хлорид (коммерчески доступный от Aldrich, catalog485764) соответственно. Схема 4 Примерный синтез промежуточных продуктов Е и Е' Обработка Е приблизительно 4 экв. диизопропилэтиламина и приблизительно 2 экв. метансульфонового ангидрида в тетрагидрофуране приблизительно при -18 С с последующим медленным нагреванием до приблизительно -5 С и последующей обработкой приблизительно 4 экв. 2,2-диметилпиперазина приведет к образованию 1-1R,3S)-6-хлор-3-фенил-d5-индан-1-ил)-3,3-диметилпиперазина (F), который можно очистить после реакции (схема 5). Альтернативно, спирт Е можно превратить в соответствующий хлорид, преимущественно с сохранением конфигурации у С 1, и получить при этом (1S,3S)-1-хлор-3-d5 фенилиндан (Е; аналогично Е' можно превратить в (1S,3S)-1-хлор-3-фенилиндан (Е. Хлорид Е можно подвергнуть взаимодействию с 2,2-диметилпиперазином с получением F. Конечную стадию можно проводить, как описано для получения соли соединение (I) бутандиовая кислота, с применением иодметана, получая при этом соединение (II), или d3-иодметана, получая при этом соединение (IV) соответственно. Альтернативно, как описано ниже, метильную группу или d3-метильную группу можно ввести нагреванием с обратным холодильником в НСНО/НСООН или DCDO/DCOOD соответственно. Схема 5 Примерный синтез промежуточных продуктов F и соединений (II) и (IV) трет-Бутиловый эфир (2-амино-2-метилпропил)карбаминовой кислоты (G) можно получить из 2 метилпропан-1,2-диамина и ди-трет-бутилдикарбоната (альтернативно указывается, что G является коммерчески доступным: Prime catalogPOI-1362-MB4; Rovathin catalogNX45401). Реакция G с галогенацетилгалогенидом, таким как либо хлорацетилхлорид, либо бромацетилбромид, даст трет-бутиловый эфир [2-(2-хлорацетиламино)-2-метилпропил]карбаминовой кислоты или трет-бутиловый эфир [2-(2 бромацетиламино)-2- метилпропил]карбаминовой кислоты (Н), соответственно (схема 6). Обработка любого варианта Н кислотой с последующей обработкой основанием приведет к образованию 6,6 диметилпиперазин-2-он (I). Это вещество можно восстановить в 2,2-диметил-5,5-d2-пиперазин (J) обработкой литийалюминийдейтеридом. Схема 6 Примерный синтез промежуточного продукта J В качестве альтернативы, J можно получить из 2-амино-2-метилпропионовой кислоты. Реакция 2 амино-2-метилпропионовой кислоты и ди-трет-бутилдикарбоната даст 2-трет-бутоксикарбониламино-2 метилпропионовую кислоту (K) (схема 7). Функциональную кислотную группу можно превратить в соответствующий амид Вайнреба реакцией с O,N-диметилгидроксиламином в присутствии подходящего реагента сочетания,такого как 2-(1 Н-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилуронийгексафторфосфатметанаминий (HATU) или 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC), получая при этом трет-бутиловый эфир [1-(метоксиметилкарбамоил)-1-метилэтил]карбаминовой кислоты (L). Селективным восстановлением амида Вайнреба получают трет-бутиловый эфир (1,1-диметил-2 оксоэтил)карбаминовой кислоты (М). Восстановительное аминирование с применением альдегида М и метилового эфира аминоуксусной кислоты можно применять для получения метилового эфира (2-третбутоксикарбониламино-2-метилпропиламино)уксусной кислоты (N). Обработка карбаматного эфира N подходящей кислотой, такой как трифторуксусная кислота, приведет к образованию пиперазинона I, который при обработке литийалюминийдейтеридом дает пиперазин J. Схема 7 Альтернативный примерный синтез промежуточного продукта J Применение J вместо 2,2-диметилпиперазина, как описано для превращения Е в соединения (II) и(V). В другом аспекте настоящее изобретение относится к способу получения соединения формулы содержащему обработку соединения (XIV) соединением [(S)-BINAP]Rh(I)BF4. В другом аспекте изобретение относится к способу получения тартрата соединения (1R,3S)-(IV),содержащему обработку рацемического транс-1-(6-хлор-3-фенил(d5)индан-1-ил)-1(d3),2,2 триметилпиперазина L-(+)-винной кислотой. В некоторых вариантах осуществления рацемический транс-1-(6-хлор-3-фенил(d5)индан-1-ил)1(d3),2,2-триметилпиперазин получают из соответствующей его сукцинатной соли. В некоторых вариантах осуществления сукцинат рацемического транс-1-(6-хлор-3-фенил(d5)индан 1-ил)-1(d3),2,2-триметилпиперазина получают из малеатной соли рацемического транс-1-(6-хлор-3 фенил(d5)индан-1-ил)-3,3-диметилпиперазина. В некоторых вариантах осуществления ацетофенон-d5 превращают в простой эфир енола. В некоторых вариантах осуществления простым эфиром енола является силиловый эфиренола. В некоторых вариантах осуществления еноловый эфир ацетофенона-d5 превращают в соответствующий винилборонат. В некоторых вариантах осуществления еноловый эфир ацетофенона-d5 обрабатывают бис(пинаколато)дибороном. В некоторых вариантах осуществления винилборонат обрабатывают 2-галоген 5-хлорбензальдегидом. В некоторых вариантах осуществления соединения существуют как рацематы. В некоторых вариантах осуществления соединения существуют с содержанием приблизительно более 70% энантиомерного избытка. В некоторых вариантах осуществления соединения существуют с содержанием приблизительно более 75% энантиомерного избытка. В некоторых вариантах осуществления соединения существуют с содержанием приблизительно более 80% энантиомерного избытка. В некоторых вариантах осуществления соединения существуют с содержанием приблизительно более 85% энантиомерного избытка. В некоторых вариантах осуществления соединения существуют с содержанием приблизительно более примерно 90% энантиомерного избытка. В некоторых вариантах осуществления соединения существуют с содержанием приблизительно более 92% энантиомерного избытка. В некоторых вариантах осуществления соединения существуют с содержанием приблизительно более 95% энантиомерного избытка. В некоторых вариантах осуществления соединения существуют с содержанием приблизительно более 97% энантиомерного избытка. В некоторых вариантах осуществления соединения существуют с содержанием приблизительно более 99% энантиомерного избытка. Фармацевтические композиции. Настоящее изобретение далее относится к фармацевтическим композициям, содержащим терапевтически эффективное количество соединений настоящего изобретения и фармацевтически приемлемый носитель или разбавитель. Соединения изобретения можно вводить отдельно или в комбинации с фармацевтически приемлемыми носителями, разбавителями или эксципиентами, либо в виде одной, либо в виде нескольких доз. Фармацевтические композиции согласно изобретению можно изготовить с фармацевтически приемлемыми носителями или разбавителями, а также любыми другими известными адъювантами и эксципиентами согласно общепринятым методикам, таким как методики, которые описаны в Remington: The Science and Practice of Pharmacy, 21st Edition (University of the Sciences in Philadelphia, ed., Lippincott WilliamsWilkins 2005). Дальнейшие примерные композиции соединений изобретения описаны, например, в патентах США 5807855; 7648991; 7767683; 7772240; 8076342; публикациях патентов США 2008/0269248; 2010/0069676; 2011/0178094; 2011/0207744, WO 2005/016900, ЕР 0638073 и J. Med.Chem. 1995, 38, 4380-4392; причем каждое описание включено в контекст в качестве ссылки во всей его полноте. Фармацевтические композиции можно специально изготовить для введения любым подходящим путем, таким как пероральный, назальный, местный (в том числе трансбуккальный и подъязычный) и парентеральный (включая подкожный, внутримышечный, внутриоболочечный, внутривенный и внутрикожный) пути. Следует иметь в виду, что путь введения будет зависеть от общего состояния и возраста субъекта, подвергаемого лечению, природы подвергаемого лечению заболевания и активного ингредиента. Суточная доза соединений изобретения в расчете на свободное основание является подходящей от приблизительно 1,0 до приблизительно 160 мг/день, более подходящей от приблизительно 1 до приблизительно 100 мг, например, предпочтительно от приблизительно 2 до приблизительно 55, такая как от приблизительно 2 до приблизительно 15 мг, например от приблизительно 3 до приблизительно 10 мг. В некоторых вариантах осуществления суточная доза составляет от приблизительно 0,1 до приблизительно 500 мг. В некоторых вариантах осуществления суточная доза составляет от приблизительно 1 до приблизительно 500 мг. В некоторых вариантах осуществления суточная доза составляет от приблизительно 1 до приблизительно 400 мг. В некоторых вариантах осуществления суточная доза составляет от приблизительно 1 до около 300 мг. В некоторых вариантах осуществления суточная доза составляет от приблизительно 1 до приблизительно 200 мг. В некоторых вариантах осуществления суточная доза составляет от приблизительно 1 до приблизительно 160 мг. В некоторых вариантах осуществления суточная доза составляет от приблизительно 1 до приблизительно 100 мг. В некоторых вариантах осуществления суточная доза составляет от приблизительно 1 до приблизительно 60 мг. В некоторых вариантах осуществления суточная доза составляет от приблизительно 2 до приблизительно 30 мг. В некоторых вариантах осуществления суточная доза составляет от приблизительно 2 до приблизительно 15 мг. В некоторых вариантах осуществления суточная доза составляет от приблизительно 3 до приблизительно 10 мг. В некоторых вариантах осуществления суточная доза составляет приблизительно 60 мг. В некоторых вариантах осуществления суточная доза составляет приблизительно 50 мг. В некоторых вариантах осуществления суточная доза составляет приблизительно 40 мг. В некоторых вариантах осуществления суточная доза составляет приблизительно 30 мг. В некоторых вариантах осуществления суточная доза составляет приблизительно 20 мг. В некоторых вариантах осуществления суточная доза составляет приблизительно 10 мг. В некоторых вариантах осуществления суточная доза составляет приблизительно 5 мг. В некоторых вариантах осуществления суточная доза составляет приблизительно 3 мг. В некоторых вариантах осуществления суточная доза составляет приблизительно 2 мг. В некоторых вариантах осуществления суточная доза составляет приблизительно 1 мг. Для парентеральных путей введения, таких как внутривенное, внутриоболочечное, внутримышечное и аналогичное введение, типичными дозами являются дозы порядка половины дозы, применяемой для перорального введения. Соединения настоящего изобретения обычно применяют в виде свободного вещества или в виде фармацевтически приемлемой соли. Примеры подходящих органических и неорганических кислот описаны в контексте. В некоторых вариантах осуществления композиция содержит циклодекстрин. В некоторых вариантах осуществления композиция содержит циклодекстрин в воде. В некоторых вариантах осуществления циклодекстрин представляет собой гидроксипропилциклодекстрин. В некоторых вариантах осуществления композиция содержит гидроксипропилциклодекстрин в воде. Лечение нарушений. Настоящее изобретение относится также к лекарственному применению соединений настоящего изобретения, например, для лечения заболеваний центральной нервной системы, включая психоз, в частности шизофрении или других заболеваний, включающих в себя психотические симптомы, таких как,например, шизофрения, шизофрениформное нарушение, шизоаффективное нарушение, бредовое расстройство, кратковременное психотическое расстройство, разделяемое параноидальное расстройство, а также другие психотические расстройства или заболевания с психотическими симптомами, например,биполярное расстройство, такое как мания при биполярном расстройстве. Соединения и/или композиции изобретения можно дополнительно применять при лечении нарушений, таких как нарушения, описанные, например, в патентах США 5807855; 7648991; 7767683; 7772240; 8076342; публикациях патентов США 2008/0269248; 2010/0069676; 2011/0178094; 2011/0207744; WO 2005/016900, ЕР 0638073 и J.Med. Chem. 1995, 38, 4380-4392; каждое описание включено в контекст в качестве ссылки во всей его полноте. Изобретение также относится к медицинскому применению соединений настоящего изобретения в качестве комбинированной терапии в сочетании с другими терапевтическими агентами, такими как агенты, которые описаны, например, в патентах США 5807855; 7648991; 7767683; 7772240; 8076342; публикациях патентов США 2008/0269248; 2010/0069676; 2011/0178094; 2011/0207744; WO 2005/016900, ЕР 0638073 и J. Med. Chem. 1995, 38, 4380-4392; каждое описание включено в контекст в качестве ссылки во всей его полноте. Должно быть понятно, что один или несколько отличительных признаков любого из описанных в контексте вариантов осуществления можно объединить и/или переставить в объеме настоящего изобретения для получения дополнительных вариантов осуществления, которые также входят в объем настоящего изобретения. Специалистам в данной области техники будет понятно или они будут способны установить с применением не более чем обычного экспериментирования многие эквиваленты описанных в контексте конкретных вариантов осуществления изобретения. Предполагается, что такие эквиваленты находятся в пределах объема настоящего изобретения. Настоящее изобретение далее описывается следующими не ограничивающими примерами. Примеры Ниже приводятся примеры для облегчения более полного понимания настоящего изобретения. Нижеследующие примеры иллюстрируют примерные способы получения и применения на практике изобретения. Однако объем настоящего изобретения не ограничивается конкретными вариантами осуществления, описанными в этих примерах, которые предназначены только для целей иллюстрации, так как для получения аналогичных результатов можно применять альтернативные способы. Очистка соединений хроматографией относится к применению хроматографии на силикагеле с применением либо ручной флэш-хроматографии или автоматизированной флэш-хроматографии, обычно выполняемой с применением градиентов элюирования от гептанов до этилацетата или смеси этилацетата, триэтиламина и метанола. Описание способов ЖХ-МС. Соединения (I), (II), (III), (IV), (V), (VI) и (VII) характеризовали посредством ЖХ-МС с применением следующих способов (табл. 1). Таблица 1 Способы анализа ЖХ-МС Описание способов хиральной ВЭЖХ. Чистоту энантиомеров анализировали на системе Hewlett Packard серии 1100, снабженной диодным матричным детектором, и с применением ChemStation для LC Rev. A.08.03 [847]. Параметры способа ВЭЖХ описаны в приведенной ниже таблице (табл. 2). Соединение (X) имеет время удерживания приблизительно 13,6-13,7 мин, тогда как его энантиомер, 4-1S,3R)-6-хлор-3-фенилиндан-1-ил)-1,2,2 триметилпиперазин, элюируется за время 8,5-8,6 мин. Таблица 2 Способы анализа хиральной ВЭЖХA1; причем каждое описание включено в контекст в качестве ссылки во всей его полноте). Добавляли 12,0 М раствор гидроксида калия в воде (5,38 мл), бромид тетра-N-бутиламмония (1,42 г) и d3-иодметан(каталог Aldrich176036; 2,4 мл) и смесь перемешивали при комнатной температуре в течение 18 ч(схема 8). Смесь фильтровали через стеклянный фильтр в делительную воронку. Твердое вещество на фильтре промывали толуолом (50 мл) в делительную воронку. Водный слой экстрагировали толуолом(100 мл) и объединенные органические слои промывали концентрированным водным аммиаком (100 мл) и затем водой (100 мл) и после этого сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, получая при этом бледно-желтое масло. Масло охлаждали до -78 С в вакууме, в результате чего масло затвердевало. После нагревания до комнатной температуры масло становилось полутвердым. Это вещество растворяли в ацетоне (30 мл). В отдельной колбе бутандиовую кислоту (3,46 г) суспендировали в ацетоне (30 мл) и нагревали для кипячения с обратным холодильником (не все количество двухосновной кислоты переходило в раствор). К раствору сырого продукта добавляли суспензию кислоту и дополнительный ацетон (50 мл) добавляли к остатку бутандиовой кислоты и затем выливали в раствор. Смесь перемешивали в течение ночи. На протяжении ночи происходило частичное осаждение, и смесь концентрировали в вакууме. Остаток повторно растворяли в ацетоне (70 мл) и нагревали для кипячения с обратным холодильником и оставляли для охлаждения до комнатной температуры и перемеши- 20024651 вали в течение 2 ч. Смесь фильтровали, получая при этом соль 4-1R,3S)-6-хлор-3-фенилиндан-1-ил)-1-метил-d3-2,2 диметилпиперазинбутандиовой кислоты (соль соединение (I)бутандиовая кислота; 7,61 г). ЖХ-МС(способ 131): ИТ(УФ) 1,57 мин; чистота по УФ/ELS была 100%/100%; наблюдаемая масса составляла 358,0. Включение трех атомов дейтерия соответствовало 99%. 13 С ЯМР-спектр с развязкой протонов показал гептет приблизительно у 36,4 м.д., соответствующий дейтерированному метаболическому участку М 2; этот сигнал превращался в синглет в 13 С ЯМР-спектре с развязкой протонов и дейтерия. Все другие сигналы были синглетами в обоих спектрах. Оптическая чистота изомера ее была 95%. Пример 2. Альтернативный способ получения соли 4-1R,3S)-6-хлор-3-фенилиндан-1-ил)-1-метилd3-2,2-диметилпиперазинбутандиовой кислоты (соль соединение (I)бутандиовая кислота). Свободное основание 1-1R,3S)-6-хлор-3-фенилиндан-1-ил)-3,3-диметилпиперазина получали из соответствующей гидрохлоридной соли распределением 23,4 г соли между смесью воды (100 мл), концентрированного водного раствора гидроксида калия (40 мл) и толуола (250 мл). Органический слой промывали смесью воды (50 мл) и концентрированного водного раствора гидроксида калия (10 мл). Объединенные водные слои экстрагировали толуолом (75 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, получая при этом свободное основание 11R,3S)-6-хлор-3-фенилиндан-1-ил)-3,3-диметилпиперазина (21,0 г) в виде бесцветного масла. Это вещество растворяли в смеси толуола (150 мл) и воды (150 мл) перед добавлением 12,0 М водного раствора гидроксида калия (11,3 мл), бромида тетра-н-бутиламмония (2,98 г) и d3-йодметана (4,9 мл) и смесь перемешивали при комнатной температуре в течение 18 ч. Обработку и очистку проводили, как описано выше, и получали соль 4-1R,3S)-6-хлор-3 фенилиндан-1-ил)-1-метил-d3-2,2-диметилпиперазинбутандиовой кислоты(IV. К раствору соединения А (57 г) в тетрагидрофуране (600 мл) добавляли по каплям триэтиламин (30 мл) на протяжении 30 мин. Реакционную смесь выдерживали при комнатной температуре в течение 3 ч. Осажденное твердое вещество отделяли фильтрованием и фильтрат концентрировали в вакууме. Остаток снова осаждали из диэтилового эфира, получая при этом соединение В (31 г) в виде желтого твердого вещества. К раствору соединения фенил-d5-бороновая кислота (25 г) в смеси 1,4-диоксан/вода (900 мл/90 мл) добавляли [Rh(ndb)2]BF4 (1,3 г), рацемический BINAP (2,1 г) и триэтиламин (14 мл), затем реакционную смесь выдерживали при комнатной температуре в течение 2 ч в атмосфере N2. Затем добавляли соединение инденон (19 г) и полученную смесь нагревали до 100 С в течение 3 ч. Осажденное твердое вещество отфильтровывали. Фильтрат концентрировали в вакууме. Остаток очищали хроматографией, получая при этом инданон С (10 г). Схема 9 Синтез соединения С 13,4 кг 3-бром-6-хлориндан-2-она (А; ссылку на это вещество см.: Bogeso ЕР 35363 А 1 19810909 иKehler, Juhl, Puschl, WO 2008025361; причем каждая указанная в контексте публикация включена в качестве ссылки во всей полноте) растворяли в тетрагидрофуране (170,8 л) и раствор охлаждали до 0-5 С(схема 9). На протяжении 0,5 ч добавляли триэтиламин (9,1 л). Смесь перемешивали при 0-5 С в течение 5 ч перед добавлением дополнительной порции триэтиламина (2,48 л) в течение 0,5 ч и перемешивание продолжали в течение 2 ч. Смесь фильтровали и фильтрат концентрировали до 30 л перед добавлением н-гептана (102 л). Объем уменьшали до 60 л. Добавляли еще н-гептан (203 л) и смесь перемешивали в течение 1 ч. Добавляли силикагель (17,2 кг). Смесь фильтровали и остаточное твердое вещество промы- 21024651 вали н-гептаном (100 л). Объединенные фильтраты концентрировали до 30 л и перемешивали при 0-5 С в течение 1 ч. Смесь центрифугировали и остаточное твердое вещество сушили, получая при этом 6 хлоринден-1-он (соединение В; 2,42 кг), достаточно чистый для следующей стадии. В реактор добавляли 2-метилтетрагидрофуран (85 л) и N,N-диметилацетамид (12,4 л) с последующим добавлением ацетата калия (10,9 кг) и бис-(пинаколато)диборона (14,8 кг). Полученную смесь перемешивают в течение 0,5 ч. Добавляли Pd(dppf)Cl2-DCM (0,91 кг) с последующим добавлением бромбензола-d5 (9,0 кг) и 2-метилтетрагидрофурана (12,2 л). Смесь нагревали до 80-85 С в течение 3 ч, после чего температуру снижали до температуры окружающей среды. Неочищенную смесь фильтровали через кизельгур и силикагель. Осадок на фильтре промывали 2-метилтетрагидрофураном (31 л). Объединенные фильтраты концентрировали приблизительно до 25 л при поддержании температуры ниже 35 С. Добавляли н-гептан (52 л) и 7% водный раствор NaHCO3 (31 л) и полученную смесь перемешивали в течение 0,5 ч. Органический слой перемешивали с 7%-ным водным NaHCO3 (31 л) в течение 0,5 ч. Объединенные водные слои экстрагировали н-гептаном (22 л) в течение 0,5 ч. Объединенные органические экстракты промывали 25%-ным водным раствором NaCl (50 л) в течение 0,5 ч. Органический слой концентрировали при поддержании температуры ниже 35 С, получая при этом 4,4,5,5-тетраметил-2-d5 фенил[1,3,2]диоксаборолан (соединение В'; 10,5 кг), достаточно чистый для следующей стадии. В реактор добавляли последовательно 1,4-диоксан (85 л), 6-хлоринден-1-он (соединение В; 9,09 кг,полученный способом, аналогичным способу, описанному выше), 1,5-циклооктадиен (0,2 л), бис(норборнадиен)родий(I)тетрафторборат (0,52 кг), триэтиламин (5,5 л), 4,4,5,5-тетраметил-2-d5 фенил[1,3,2]диоксаборолан (соединение В'; 6,5 кг) и 1,4-диоксан (26 л). Смесь нагревали до 48-53 С и перемешивали при этой температуре в течение 5 ч. Реакцию гасили добавлением 2 М водным HCl (13 кг). Затем добавляли н-гептан (110 л), метил-трет-бутиловый эфир (32 л) и воду (90 л) и полученную смесь перемешивали в течение 0,3 ч. Органический слой промывали водой (90 л) в течение 0,3 ч. Объединенные водные слои экстрагировали смесью метил-трет-бутилового эфира (30 л) и н-гептана (57 л) в течение 0,3 ч. Объединенные органические слои фильтровали через силикагель (13 кг). Осадок на фильтре промывали смесью 2:1 н-гептана и метил-трет-бутилового эфира (19,5 кг). Фильтрат концентрировали приблизительно до 25 л. Добавляли н-гептан (45 л) и объем смеси уменьшали приблизительно до 25 л. Добавляли н-гептан (45 л) и объем смеси уменьшали приблизительно до 35 л. Смесь перемешивали при 0-5 С в течение 3 ч. Смесь центрифугировали и оставшееся твердое вещество сушили, получая при этом рацемический 6-хлор-3-d5-фенилиндан-1-он (соединение С; 8,4 кг), достаточно чистый для следующей стадии. В реактор добавляли тетрагидрофуран (90 л) с последующим добавлением воды (10 л) и 6-хлор-3d5-фенилиндан-1-она (соединение С; 7,73 кг) (схема 10). Смесь охлаждали до температуры от -35 до-30 С. Порциями добавляли борогидрид натрия (1,5 кг) при поддержании температуры от -35 до -30 С. Полученную смесь перемешивали при температуре от -35 до 30 С в течение 5 ч, после чего давали ей возможность нагреться до температуры окружающей среды. Избыточный борогидрид натрия гасили добавлением 2 М водного HCl (7,6 кг) при поддержании температуры ниже 45 С. Добавляли воду (17 л) и метил-трет-бутиловый эфир (67 л) и смесь перемешивали в течение 0,3 ч. Водный слой экстрагировали метил-трет-бутиловым эфиром (39 л) в течение 0,3 ч. Объединенные органические слои промывали солевым раствором (36 кг) в течение 0,3 ч. Органический слой фильтровали через силикагель (6,4 кг). Осадок на фильтре промывали метил-трет-бутиловым эфиром (20 л). Объединенные фильтраты концентрировали приблизительно до 30 л при поддержании температуры ниже 45 С. Добавляли н-гептан (55 л) и полученную смесь концентрировали приблизительно до 30 л при поддержании температуры ниже 45 С. Полученную смесь перемешивали при 0-5 С в течение 2 ч. Смесь центрифугировали и осадок на фильтре промывали н-гептаном (12 л), прежде чем ее снова центрифугировали. Оставшееся твердое вещество сушили, получая при этом неочищенное вещество D. 4,87 кг этого вещества растворяли в метил-третбутиловом эфире (20 л) и сушили над Na2SO4 (2 кг) в течение 0,25 ч. Смесь фильтровали и осадок на фильтре промывали метил-трет-бутиловым эфиром (4,4 л). Объединенный фильтрат концентрировали приблизительно до 20 л при поддержании температуры ниже 45 С. Добавляли н-гептан (32 л) и смесь концентрировали приблизительно до 25 л при поддержании температуры ниже 45 С. Добавляли н-гептан(16 л) и смесь концентрировали приблизительно до 20 л при поддержании температуры ниже 45 С. Твердое вещество отфильтровывали и сушили, получая при этом рацемический цис-6-хлор-3-d5 фенилиндан-1-ол (соединение D; 4,99 кг), достаточно чистый для следующей стадии. К раствору рацемического цис-6-хлор-3-d5-фенилиндан-1-ола (соединение D, 50 г) в 2 изопропоксипропане (200 мл) добавляли винилбутират (120 мл) и новозим-435 (15 г). Смесь выдерживали при температуре окружающей среды в течение 2 дней. Твердое вещество отфильтровывали. Фильтрат выпаривали и очищали хроматографией на силикагеле, получая при этом (1S,3S)-6-хлор-3-d5 фенилиндан-1-ол (соединение Е; 13 г), достаточно чистый для следующей стадии. Раствор (1S,3S)-6-хлор-3-d5-фенилиндан-1-ола (соединение Е; 7 г) в ТГФ (100 мл) обрабатывалиSOCl2 (6,6 г) при температуре окружающей среды на протяжении ночи. Смесь выливали в охлажденную льдом воду и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором. Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме, получая при этом промежуточный хлорид (7,5 г). 3,5 г этого вещества растворяли в 2-бутаноне (50 мл) и подвергали взаимодействию с 2,2-диметилпиперазином (1,7 г) в присутствии K2CO3 (2,7 г) при кипячении с обратным холодильником в течение ночи. Твердое вещество отфильтровывали. Фильтрат концентрировали в вакууме и остаток очищали препаративной ВЭЖХ на приборе Shimadzu FRC-10A, снабженном колонкой С 18 Synergi (250 мм 50 мм, 10 мкм) с применением воды и ацетонитрила (содержащего 0,1% TFA,об./об.) в качестве элюента, получая при этом 1-1R,3S)-6-хлор-d5-фенилиндан-1-ил)-3,3 диметилпиперазин (соединение F; 2,6 г), достаточно чистый для следующей стадии. К раствору 1-1R,3S)-6-хлор-3-d5-фенилиндан-1-ил)-3,3-диметилпиперазина (соединение F; 2,2 г) в НСНО/НСООН (3 мл/3 мл) кипятили с обратным холодильником в течение ночи. Летучие вещества удаляли в вакууме. Остаток распределяли между этилацетатом и 10% водным NaOH. Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле, получая при этом 4-1R,3S)-6-хлор-3-d5-фенилиндан-1-ил)-1,2, 2-триметилпиперазин (соединение (II); 1,89 г). ЖХ-МС (метод WXV-AB05): RT(УФ) 2,43 мин; чистота по УФ/ELS 95,1%/99,6%; наблюдаемая масса 360,2. Включение пяти атомов дейтерия составляет 95%. 13 С ЯМР-спектр с развязкой протонов показал три триплета приблизительно у 126,1, 127,2 и 128,2 м.д., соответствующие дейтерированным метаболическим участкам М 3; эти сигналы превращался в три синглета в 13 С ЯМР-спектре с развязкой протонов и дейтерия. Все другие сигналы были синглетами в обоих спектрах. Оптическая чистота изомера ее 95%. Раствор 1-1R,3S)-6-хлор-3-d5-фенилиндан-1-ил)-3,3-диметилпиперазина (соединение F; 3,0 г) вDCDO/DCOOD (4 мл/4 мл) кипятили с обратным холодильником в течение ночи. Летучие вещества удаляли в вакууме. Остаток распределяли между этилацетатом и 10% водным NaOH. Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле, получая при этом 4-1R,3S)-6-хлор-3-d5-фенилиндан-1-ил)-d3-метил-2,2-диметилпиперазин(соединение (IV); 2,14 г). ЖХ-МС (метод WXV-AB10): RT(УФ) 2,06 мин; чистота по УФ/ELS 98%/100%; наблюдаемая масса 363,3. Включение восьми атомов дейтерия составляет 94%. 13 С ЯМР-спектр с развязкой протонов показал гептет приблизительно у 36,4 м.д., соответствующий дейтерированному метаболическому участку М 2; этот сигнал превращается в синглет в 13 С ЯМР-спектре с развязкой протонов и дейтерия. 13 С ЯМР-спектр с развязкой протонов показал также три триплета приблизительно у 126,1,127,2 и 128,2 м.д., соответствующие дейтерированным метаболическим участкам М 3; эти сигналы превращаются в три синглета в 13 С ЯМР-спектре с развязкой протонов и дейтерия. Все другие сигналы были синглетами в обоих спектрах. Оптическая чистота изомера ее была 95%. Пример 4. Получение 4-1R,3S)-6-хлор-3-фенилиндан-1-ил)-1,2,2-триметилпиперазина-6,6-d2 (соединения (III, 4-1R,3S)-6-хлор-3-фенилиндан-1-ил)-1-метил-d5-2,2-диметилпиперазина-6,6-d2 (соединения (V, 4-1R,3S)-6-хлор-3-фенил-d5-индан-1-ил)-1-метил-d3-2,2-диметилпиперазина-6,6-d2 (соединения (VI и 4-1R,3S)-6-хлор-3-фенил-d5-индан-l-ил)-1,2,2-триметилпиперазина-6,6-d2 (соединения(9:1, 1,2 л) (схема 11). Добавляли 1 М водный раствор NaOH (450 мл) при перемешивании до тех пор,пока все твердое вещество не растворялось. Добавляли ди-трет-бутилдикарбонат (Вос 2 О; 214,0 г) и смесь перемешивали при температуре окружающей среды в течение ночи. Органические летучие вещества удаляли в вакууме. Добавляли EtOAc (500 мл). Органический слой промывали насыщенным раствором соли и сушили над Na2SO4, фильтровали, затем концентрировали, получая при этом 2-третбутоксикарбониламино-2-метилпропионовую кислоту (соединение K; 90 г) в виде белого твердого вещества, которое применяли непосредственно в следующей стадии. Схема 11 Синтез промежуточного продукта J Смесь полученной 2-трет-бутоксикарбониламино-2-метилпропионовой кислоты (соединения K; 60,0 г) и гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида (EDCHCl; 86,4 г) в дихлорметане (900 мл) перемешивали при температуре окружающей среды, затем добавляли гидрохлорид N,Одиметилгидроксиламина (35,3 г) и триэтиламин (150 мл). Полученную смесь перемешивали при температуре окружающей среды в течение 3 дней. Добавляли воду и большую часть летучих веществ удаляли в вакууме. Остаток распределяли между DCM и водным раствором NaHCO3. Органический слой промывали 3 М водным HCl, затем насыщенным раствором соли, после чего сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле, получая при этом третбутиловый эфир [1-(метоксиметилкарбамоил)-1-метилэтил]карбаминовой кислоты (соединение L; 28,2 г) в виде белого твердого вещества, достаточно чистого для следующей стадии. Литийалюминийгидрид (7,8 г) добавляли к перемешиваемому раствору трет-бутилового эфира [1(метоксиметилкарбамоил)-1-метилэтил]карбаминовой кислоты (соединение L; 42,0 г) в сухом диэтиловом эфире (1,5 л) при -40 С. Затем смесь перемешивали при такой же температуре в течение приблизительно 5 мин. Избыток LiAlH4 гасили раствором гидросульфата калия в воде. Полученную смесь распределяли между EtOAc и 3 М водным HCl. Органический слой промывали насыщ. водным растворомNaHCO3, сушили над Na2SO4, фильтровали и концентрировали в вакууме, получая при этом третбутиловый эфир (1,1-диметил-2-оксоэтил)карбаминовой кислоты (соединение М; 29 г), достаточно чистый для следующей стадии. Гидрохлорид метилового эфира аминоуксусной кислоты (80,6 г) и Et3N (160 мл) растворяли в DCM (1000 мл) и перемешивали в течение 15 мин, чтобы выделить амин из соли. Затем добавляли раствор трет-бутилового эфира 1,1-диметил-2-оксоэтил)карбаминовой кислоты (соединение М; 29,0 г) в DCM (600 мл). Полученную смесь перемешивали в течение 0,5 ч при температуре окружающей среды, затем добавляли NaBH(Oac)3 (102 г) и смесь перемешивают при температуре окружающей среды в течение ночи. Добавляли насыщ. водный раствор NaHCO3. Водный слой экстрагировали DCM. Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле, получая при этом метиловый эфир (2-третбутоксикарбониламино-2-метилпропиламино)уксусной кислоты (соединение N; 26,5 г) в виде белого твердого вещества, которое непосредственно применяли на следующей стадии. Раствор метилового эфира (2-трет-бутоксикарбониламино-2-метилпропиламино)уксусной кислоты(соединение N; 26,5 г) в DCM (800 мл) перемешивали при температуре окружающей среды, добавляли по каплям TFA (180 мл). Смесь перемешивали при 30-40 С в течение 5 ч, после чего концентрировали в вакууме. Остаток распределяли между растворенным толуолом и водой. Органический слой сушили надNa2SO4, фильтровали и концентрировали в вакууме. Оставшееся твердое вещество растворяли в смеси этанола (400 мл) и метанола (90 мл). Добавляли K2CO3 (207 г) и смесь кипятили с обратным холодильником в течение ночи. Смесь охлаждали до комнатной температуры. Добавляли DCM (2500 мл) и смесь перемешивали в течение 1 ч при температуре окружающей среды. Твердое вещество отфильтровывали и фильтрат концентрировали в вакууме, получая при этом 6,6-диметилпиперазин-2-он (соединение I; 5,85 г) в виде белого твердого вещества, достаточно чистого для следующей стадии. Раствор 6,6-диметилпиперазин-2-она (соединение I; 3,6 г) в ТГФ (20 мл) перемешивают при 0 С. Добавляли литийалюминийдейтерид (LiAlD4; 3,6 г), затем смесь кипятили с обратным холодильником в течение ночи. Смесь охлаждали до температуры окружающей среды и добавляли Na2SO4. Смесь перемешивали в течение 0,5 ч перед удалением большей части летучих веществ в вакууме. Остаток суспендировали в насыщенном растворе HCl в EtOAc при комнатной температуре в течение 0,5 ч. Твердое вещество отфильтровывали и сушили, получая при этом 2,2-d2-6,6-диметилпиперазин в виде бисгидрохлоридной соли (соединение J2HCl; 5,3 г), достаточно чистой для следующей стадии. К раствору соединения Е' (5 г) в ТГФ (50 мл) добавляли SOCl2 (4,7 г) и полученную смесь перемешивали в течение ночи при температуре окружающей среды (схема 12). Смесь выливали в воду со льдом и экстрагировали EtOAc. Органический слой промывали насыщенным раствором соли, сушили надNa2SO4, фильтровали и концентрировали в вакууме, получая при этом соответствующий хлорид (5,3 г),который применяли непосредственно в следующей стадии. 3,3 г этого вещества растворяли в 2-бутаноне(50 мл) и подвергали взаимодействию с 2,2-d5-6,6-диметилпиперазином (соединением J; 3 г) в присутствии K2CO3 (8,28 г) при кипячении с обратным холодильником в течение ночи. Твердое вещество отфильтровывали. Фильтрат концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ на приборе Shimadzu FRC-10A, снабженном колонкой Synergy C18 (250 мм 50 мм, 10 мкм) с применением воды и ацетонитрила (содержащего 0,1% TFA, об./об.) в качестве элюентов, получая при этом 1-1R,3S)-6 хлор-3-фенилиндан-1-ил)-3,3-d2-5,5-диметилпиперазин (соединение О; 1,7 г). Схема 12 Синтез соединения (III) и соединения (V) Раствор 1-1R,3S)-6-хлор-3-фенилиндан-1-ил)-3,3-d2-5,5-диметилпиперазина (соединения О; 0,5 г) в НСНО/НСООН (1 мл/1 мл) кипятили с обратным холодильником в течение ночи. Летучие вещества удаляли в вакууме. Остаток распределяли между EtOAc и 10% водным NaOH. Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле, получая при этом 4-1R,3S)-6-хлор-3-фенилиндан-1-ил)-1,2,2-триметилпиперазин-6,6-d2 (соединение (III); 0,33 г). ЖХ-МС (метод WXV-AB30): RT(УФ) 1,42 мин; чистота по УФ/ELS 100%/100%; наблюдаемая масса 357,2. Включение двух атомов дейтерия составляло 97%. 13 С ЯМР-спектр с развязкой протонов показал квинтет приблизительно у 49,5 м.д., соответствующий дейтерированному метаболическому участку M1; этот сигнал превращался в синглет в 13 С ЯМР-спектре с развязкой протонов и дейтерия. 13 С ЯМР-спектр с развязкой протонов дополнительно показал три триплета приблизительно при 126,1,127,2 и 128,2 м.д., соответствующие дейтерированным метаболическим участкам М 3; эти сигналы превращались в три синглета в 13 С ЯМР-спектре с развязкой протонов и дейтерия. Все другие сигналы были синглетами в обоих спектрах. Оптическая чистота изомера ее была 95%. Раствор 1-1R,3S)-6-хлор-3-фенилиндан-1-ил)-3,3-d2-5,5-диметилпиперазина (соединения О; 0,7 г) в DCDO/DCOOD (1 мл/1 мл) кипятили с обратным холодильником в течение ночи. Летучие вещества удаляли в вакууме. Остаток распределяли между EtOAc и 10% водным NaOH. Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле, получая при этом 4-1R,3S)-6-хлор-3-фенилиндан-1-ил)-1-метил-d3-2,2-диметилпиперазин-6,6-d2(соединение (V); 0,49 г). ЖХ-МС (метод WXVAB25): RT(УФ) 2,13 мин; чистота по УФ/ELS 100%/100%; наблюдаемая масса 360,2. Включение пяти атомов дейтерия составляло 95%. 13 С ЯМР-спектр с развязкой протонов показал гептет приблизительно у 36,4 м.д., соответствующий дейтерированному метаболическому участку М 2; этот сигнал превращается в синглет в 13 С ЯМР-спектре с развязкой протонов и дейтерия. 13 С ЯМР-спектр с развязкой протонов дополнительно показал квинтет приблизительно у 49,5 м.д.,соответствующий дейтерированному метаболическому участку M1; этот сигнал превращался в синглет в 13 С ЯМР-спектре с развязкой протонов и дейтерия. Все другие сигналы были синглетами в обоих спектрах. Оптическая чистота изомера ее была 95%. Раствор (1S,3S)-6-хлор-3-d5-фенилиндан-1-ола (соединения Е; 7 г) в ТГФ (100 мл) обрабатывалиSOCl2 (6,6 г) при комнатной температуре на протяжении ночи (схема 13). Смесь выливали в воду со льдом и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли. Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме, получая при этом промежуточный хлорид (7,5 г). Схема 13 Синтез соединения (VI) и соединения (VII) 1,8 г данного вещества растворяли в 2-бутаноне (30 мл) и подвергали взаимодействию с 2,2-d2-6,6 диметилпиперазином (соединение J; 1,4 г) в присутствии K2CO3 (5,5 г) при кипячении с обратным холодильником в течение ночи. Твердое вещество отфильтровывали. Фильтрат концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ на приборе Shimadzu FRC-10A, снабженном колонкой SynergyC18 (250 мм 50 мм, 10 мкм) с применением воды и ацетонитрила (содержащего 0,1% TFA, об./об.) в качестве элюента, получая при этом 1-1R,3S)-6-хлор-3-d5-фенилиндан-1-ил)-3,3-d2-5,5-диметилпиперазин(соединение Р; 1,7 г). Раствор 1-1R,3S)-6-хлор-3-d5-фенилиндан-1-ил)-3,3-d2-5,5-диметилпиперазина (соединение Р; 1 г) в DCDO/DCOOD (1,5 мл/1,5 мл) кипятили с обратным холодильником в течение ночи. Летучие вещества удаляли в вакууме. Остаток распределяли между EtOAc и 10% водным NaOH. Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле, получая при этом 4-1R,3S)-6-хлор-3-d5-фенилиндан-1-ил)-1-d3-метил-2,2-диметилпиперазин-6,6-d2(соединение (VI); 0,55 г). ЖХ-МС (метод WuXiAB25): RT(УФ) 2,13 мин; чистота по УФ/ELS 98,2%/100%; наблюдаемая масса 365,2. Включение десяти атомов дейтерия составляет 91%. 13 С ЯМРспектр с развязкой протонов показал гептет приблизительно у 36,4 м.д., соответствующий дейтерированному метаболическому участку М 2; этот сигнал превращается в синглет в 13 С ЯМР-спектре с развязкой протонов и дейтерия. 13 С ЯМР-спектр с развязкой протонов дополнительно показал квинтет приблизительно у 49,5 м.д., соответствующий дейтерированному метаболическому участку M1; этот сигнал превращался в синглет в 13 С ЯМР-спектре с развязкой протонов и дейтерия. 13 С ЯМР-спектр с развязкой протонов дополнительно показал три триплета приблизительно у 126,1, 127,2 и 128,2 м.д., соответствующие дейтерированным метаболическим участкам М 3; эти сигналы превращались в три синглета в 13 С ЯМР-спектре с развязкой протонов и дейтерия. Все другие сигналы были синглетами в обоих спектрах. Оптическая чистота изомера ее была 95%. Раствор 1-1R,3S)-6-хлор-3-d5-фенилиндан-1-ил)-3,3-d2-5,5-диметилпиперазина (соединения Р; 0,7 г) в HCDO/HCOOH (1 мл/1 мл) кипятили с обратным холодильником в течение ночи. Летучие вещества удаляли в вакууме. Остаток распределяли между EtOAc и 10% водным NaOH. Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле, получая при этом 4-1R,3S)-6-хлор-3-d5-фенилиндан-1-ил)-1-метил-2,2-диметилпиперазин-6,6-d2(соединение (VII); 0,47 г). ЖХ-МС (метод WXV-AB30): RT(УФ) 1,33 мин; чистота по УФ/ELS 97,4%/100%; наблюдаемая масса 362,3. Включение семи атомов дейтерия составляло 93%. 13 С ЯМРспектр с развязкой протонов показал квинтет приблизительно у 49,5 м.д., соответствующий дейтерированному метаболическому участку M1; этот сигнал превращался в синглет в 13 С ЯМР-спектре с развязкой протонов и дейтерия. 13 С ЯМР-спектр с развязкой протонов дополнительно показал три триплета приблизительно у 126,1, 127,2 и 128,2 м.д., соответствующие дейтерированным метаболическим участкам М 3; эти сигналы превращались в три синглета в 13 С ЯМР-спектре с развязкой протонов и дейтерия. Все другие сигналы были синглетами в обоих спектрах. Оптическая чистота изомера ее была 95%. Пример 5. Описание определения способом ЯМР положения(й), содержащего дейтерий вместо водорода. Спектры ЯМР регистрировали на спектрометре Bruker 600-Avance-III, снабженном 5-мм криозондом TCI, действующим при 150,91 МГц для 13 С. Растворитель CDCl3 применяли в качестве внутреннего стандарта для экспериментов с развязкой протонов, в то время как спектры с развязкой протонов и инверсно регулируемого дейтерия регистрировали с применением управляемого запирания. Разница(ы) между двумя спектрами для соединений изобретения определяет положение(я) атомов дейтерия. При объединении этой информации, суммированной в приведенной табл. 3, с данными масс-спектрометрии с электрораспылением, которые определяли степень дейтерирования, можно однозначно устанавливать структуры соединений изобретения. Таблица 3 Данные 13 С ЯМР для соединений В таблицу включены только сигналы ЯМР, которые "изменяются" как следствие присутствия D, а не Н, в соединениях изобретения. Соответствующие области 13 С ЯМР-спектров с развязкой протонов (нижний спектр) и развязкой дейтерия (верхний спектр) соединения (II) и соединения (V) приведены на фиг. 3 в качестве репрезентативных примеров. Выбранные области 13 С ЯМР-спектров с развязкой протонов и развязкой дейтерия соединения (II) [фиг. 3 А] и соединения (V) [фиг. 3 В]. Пример 6. Описание масс-спектрометрии с электрораспылением для определения степени дейтерирования. Инструменты. Масс-спектры кислотных, водных растворов соединений получали на квадрупольном масс-спектрометре Hewlett Packard модели 1100 LC-MSD. Жидкостную хроматографию проводили на хроматографе ВЭЖХ системы Agilent 1100, соединенном с масс-спектрометром. Эксперимент. Растворы образцов получали растворением приблизительно 2 мг вещества в смеси 2 мл метанола + 18 мл 10 мМ раствора формиата аммония, рН 3,0. Затем растворы разбавляли в 100 раз перед анализом. Для того чтобы получить "чистый" пик, образцы хроматографировали с применением колонки Waters X-bridge C18, 3,5 мкм (1502,1 мм) и смеси 0,1% трифторуксусная кислота/ацетонитрил,50/50, в качестве подвижной фазы. Эта процедура дает один пик представляющего интерес соединения,которое элюируется приблизительно через 3,6 мин и содержит как дейтерированные соединения изобретения, так и небольшие количества соединений с дефицитом дейтерия. Масс-спектры, полученные для этих пиков, применяли для оценки вида целевых молекул. Результаты определяли в процентах от общего количества вещества, принятого за 100%. Фактическую эффективность соединений не анализировали,определяли только относительное содержание соединений с дефицитом дейтерия. В качестве репрезентативного примера масс-спектр соединения (IV) показан на фиг. 4. Изотопная картина протонированного соединения (V) [М+Н]+ имела массу 363,1 (362,1+1,0) и изотопные ионы 363,1, 364,1, 365,1 и 366,1 были в соотношении 100:25,3:34,9:7,9; расчет для C20H22N2ClD8 дает отношение 100:25,2:34,9:8,3. Кроме того, D7-аналоги и D3-аналоги наблюдали у масс 362,1 и 358,1 соответственно. Сигналы у 364, 365 и 366 обусловлены главным образом протонированными молекулами, содержащими изотопы 13 С и/или 37Cl вместо 12 С и 35 С (вследствие природного распределения). Эти данные пока- 27024651 зывают, что включение восьми атомов дейтерия составляет больше 94%. Пример 7. Анализы экспериментального связывания. Описание анализа связывания D2 человека. Анализ проводили как конкурентное связывание на основе комплекса SPA в буфере для анализа 50 мМ Трис, рН 7,4, содержащем 120 мМ NaCl, 5 мМ KCl, 4 мМ MgCl2, 1,5 мМ CaCl2, 1 мМ ЭДТА. 1,5 нМ 3 Н-раклоприда (Perkin Elmer, NET 975) смешивали с испытуемым соединением перед добавлением 20 мкг гомогенизированного мембранного препарата D2-рецепторов человека и 0,25 мг гранул комплекса SPA (WGA RPNQ 0001, Amersham) в общем объеме 90 мкл. Аналитические планшеты инкубировали при перемешивании в течение 60 мин при комнатной температуре, а затем проводили подсчеты в сцинтилляционном счетчике (TriLux, Wallac). Общее связывание, которое составило приблизительно 15% добавленного радиолиганда, определяли с помощью аналитического буфера, тогда как неспецифическое связывание определяли в присутствии 10 мкМ галогенперидола. Неспецифическое связывание составляло приблизительно 10% от общего связывания. Данные, выраженные в процентах от специфического связывания 3 Н-раклоприда, и величины IC50(концентрация, вызывающая 50%-ное ингибирование специфического связывания 3 Н-раклоприда) определяли с помощью нелинейного регрессионного анализа с использованием подгонки сигмоидальной кривой с переменным наклоном. Константу диссоциации (Ki) рассчитывали по уравнению Cheng Prusoff(Ki=IC50/(1+(L/KD, где концентрацию свободного радиолиганда L аппроксимируют к концентрации добавленного в анализе 3 Н-раклоприда. KD 3H-раклоприда определяли до 1,5 нМ из двух независимых анализов насыщения, каждый из которых выполняли в трех повторностях. Описание анализа связывания D1 человека. Анализ проводили, как основанное на комплексе SPA конкурентное связывание в буфере для анализа 50 мМ Трис, рН 7,4, содержащем 120 мМ NaCl, 5 мМ KCl, 4 мм MgCl2, 1,5 мм CaCl2, 1 мМ EDTA. Приблизительно 1 нМ 3H-SCH23390 (Perkin Elmer, NET 930) смешивали с испытуемым соединением перед добавлением 2,5 мкг гомогенизированного мембранного препарата D1-рецептора человека и 0,25 мг гранул SPA (WGA RPNQ 0001, Amersham) в общем объеме 60 мкл. Аналитические планшеты инкубировали при перемешивании в течение 60 мин при комнатной температуре, после чего планшеты центрифугировали, а затем проводили подсчет в сцинтилляционном счетчике (TriLux, Wallac). Общее связывание, которое составило приблизительно 15% добавленного радиолиганда, определяли с помощью буфера для анализа, тогда как неспецифическое связывание определяли в присутствии 10 мкМ галогенперидола. Данные выражали в процентах от специфического связывания и величины IC50 (концентрация, вызывающая 50% ингибирования специфического связывания) определяли нелинейным регрессионным анализом с использованием подгонки сигмоидальной кривой с вариабельным наклоном. Константу диссоциации (Ki) вычисляли по уравнению Cheng Prusoff (Ki=IC50/(1+(L/KD, где концентрацию свободного радиолиганда L аппроксимируют к концентрации добавленного в анализе радиолиганда. Описание связывания 5-НТ 2 А человека. Эксперимент проводили в Cerep Contact Laboratories (Cat. Ref.471). Соединение (I) испытывали также in vivo на приборе, демонстрирующем основные действия соединения. Посредством связывания in vivo оценивали in vivo аффинность соединений в отношении к D2 рецепторам и наблюдали связывание 60% мишени. Связывание D2-рецепторов тесно связано с антипсихотическими действиями на животных моделях и у пациентов. Описание связывания in vivo D2-рецепторов в головном мозге крыс. Связывание in vivo проводили согласно публикации Andersen et al. (Eur J. Pharmacol. (1987), 144:16; описание которой включено в контекст во всей ее полноте) с некоторыми изменениями (публикацияKapur S. et al., J. Pharm Exp Ther, 2003, 305, 625-631; описание которой включено в контекст во всей ее полноте). Вкратце, 6 крыс (самцы линии Вистар, 180-200 г) обрабатывали подкожным введением 20 мг/кг испытуемого соединения за 30 мин до внутривенного введения 9, 4 микроКи [3 Н]-раклоприда через хвостовую вену. Спустя 15 мин после инъекции радиолиганда животных убивали шейным смещением, головной мозг быстро удаляли и полосатое тело и мозжечок вырезали и гомогенизировали в 5 мл (мозжечок в 20 мл) охлажденного льдом буфера (50 мМ K3PO4, рН 7,4). 1,0 мл гомогената фильтровали через пропитанные 0,1% PEI фильтры Whatman GF/C. Эта процедура была завершена в течение 60 с после декапитации. Фильтры промывали два раза 5 мл охлажденного льдом буфера и проводили подсчет в сцинтилляционном счетчике. Группу обработанных носителем животных применяли для определения общего связывания [3 Н]-раклоприда в полосатом теле и неспецифического связывания в мозжечке. Содержание белка в гомогенате измеряли анализом определения белка ВСА (публикация Smith P.K. et al. (1985), Anal Biochem, 150: 6-85; описание которой включено в контекст во всей ее полноте). Пример 8. Исследование метаболизма 4-1R,3S)-6-хлор-3-фенилиндан-1-ил)-1,2,2 триметилпиперазина (соединения (X и 4-1R,3S)-6-хлор-3-фенилиндан-1-ил)-1-метил-d3-2,2 диметилпиперазина (соединения (I. Криоконсервированные гепатоциты собак (самцы собак бигль) (1 миллион клеток/мл в суспензии,- 28024651 50 мкл/лунку) предварительно инкубировали в течение 15 мин в 96-луночных планшетах при 37 С на водяной бане в среде DMEM с высокой концентрацией глюкозы, забуференной 1 М HEPES. В суспензию клеток добавляли 50 мкл испытуемых соединений (конечная концентрация 0,1 или 1 мк М 4-1R,3S)-6 хлор-3-фенилиндан-1-ил)-1,2,2-триметилпиперазина (соединение (X или 4-1R,3S)-6-хлор-3 фенилиндан-1-ил)-1-метил-d3-2,2-диметилпиперазина (соединение (I и дополнительно инкубировали в течение 0, 15, 45, 75 и 120 мин. Реакцию останавливали добавлением 100 мкл ацетонитрила к клеточной суспензии, и образцы затем удаляли для анализа посредством ЖХ-МС десметилметаболита (соединения(XI. Данные выражали в виде области MS по сравнению с внутренним стандартом. Результаты (фиг. 5 и 6) показывают, что количество десметилметаболита (соединение (XI, продуцированного в криоконсервированных гепатоцитах собак ниже у дейтерированной формы (соединения(I, чем у исходного соединения (соединение (X, оба применяли при концентрации 0,1 мкМ (фиг. 5) и при концентрации 1 мкМ (фиг. 6). Пример 9. Фармакологическое испытание соединений. 4-1R,3S)-6-Хлор-3-фенилиндан-1-ил)-1-d3-метил-2,2-диметилпиперазин (соединение (I. 4-1R,3S)-6-Хлор-3-фенилиндан-1-ил)-1-d5-метил-2,2-диметилпиперазин (соединение (I испытывали в трех анализах in vitro для определения аффинности в отношении допамина D1, допамина D2 и серотонина 5-НТ 2 А. Эксперименты проводили, как в разделе анализы связывания. Экспериментальные результаты показали следующие аффинности для 4-1R,3S)-6-хлор-3-фенилиндан-1-ил)-1-метил-d3-2,2 диметилпиперазина:D2: среднее значение log Ki=34 нМ (pKi 1,54+/-0,11); 5-НТ 2 А: IC50=1,14 нМ. Эти аффинности связывания указывают на то, что соединение (I) обладает биологической активностью, подходящей для оказания антипсихотического действия. Фармакологическое испытание соединения (II) и соединения (IV). Эксперименты проводили, как описано в разделе "Анализы связывания". Экспериментальные результаты для двух соединений приведены ниже. Соединение (II) и соединение (IV) испытывали в двух анализах in vitro на аффинность в отношении допамина D1 и допамина D2. Соединение (IV):D2: среднее значение log Ki=26,5 нМ (pKi 1,42+/-0,03). Эти аффинности связывания показывают, что соединения (II) и (IV) обладают биологической активностью, подходящей для оказания антипсихотического действия. Соединения (II) и (IV) испытывали также in vitro на приборе, демонстрирующем основные действия соединений. Посредством связывания in vivo анализировали in vivo аффинность соединений в отношении D2-рецепторов и наблюдали связывание 70% мишени (соединение IV) и 75% мишени (соединение(II мишени. Связывание D2-рецепторов тесно связано с антипсихотическими действиями на животных моделях и у пациентов. Соединения (I)-(VII) и (X) анализировали последовательным анализом в Cerep Contact Laboratories(Cat. Rep44, 46 и 471). Результаты связывания рецептора представлены в табл. 4.
МПК / Метки
МПК: C07B 59/00, C07D 241/04, A61P 25/00, A61K 31/495
Метки: 1-пиперазино-3-фенилинданы, шизофрении, лечения, применяемые, дейтерированные
Код ссылки
<a href="https://eas.patents.su/30-24651-dejjterirovannye-1-piperazino-3-fenilindany-primenyaemye-dlya-lecheniya-shizofrenii.html" rel="bookmark" title="База патентов Евразийского Союза">Дейтерированные 1-пиперазино-3-фенилинданы, применяемые для лечения шизофрении</a>
Предыдущий патент: Способ получения кристаллической формы i агомелатина
Следующий патент: Биоцидная система и способы ее применения
Случайный патент: Трубное резьбовое соединение