Аминоспирт-замещенные производные 2,3-дигидроимидазо[1,2-c]хиназолина, пригодные для лечения гиперпролиферативных нарушений и заболеваний, связанных с ангиогенезом
Номер патента: 24406
Опубликовано: 30.09.2016
Авторы: Бёмер Ульф, Скотт Уилльям Джонстон, Мённинг Урзула, Мёвес Манфред, Лю Ниншу, Хегебарт Андреа
Формула / Реферат
1. Соединение общей формулы (I)
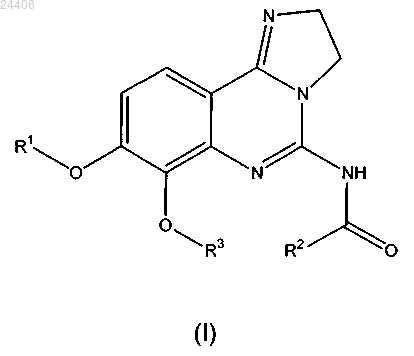
в которой R1 означает -(CH2)n-(CHR4)-(CH2)m-N(R5)(R5');
R2 означает гетероарил структуры
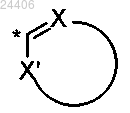
необязательно замещенный 1, 2 или 3 R6 группами,
в которой * означает точку присоединения указанного гетероарила к остатку соединения общей формулы (I),
X означает N или C-R6,
X' означает О, S, NH, N-R6, N или C-R6,
при условии, что когда X и X' оба означают C-R6, то один C-R6 означает С-Н;
R3 означает метил;
R4 означает гидрокси;
R5 и R5' являются одинаковыми или разными и означают, независимо друг от друга, атом водорода или C1-С6-алкил, или
R5 и R5', взятые вместе с атомом азота, к которому они присоединены, означают 3-7-членное азотсодержащее гетероциклическое кольцо, которое необязательно содержит по меньшей мере один дополнительный гетероатом, выбранный из кислорода, азота или серы, и которое необязательно может быть замещено 1 или несколькими группами R6';
в каждом случае R6 может быть одинаковым или разным и независимо означает атом водорода, С1-С6-алкил или -N(R7)(R7');
в каждом случае R6' означает C1-С6-алкил;
в каждом случае R7 и R7' означают атом водорода;
n означает целое число 1 и m означает целое число 1;
при условии, что когда
указанные R5 и R5', взятые вместе с атомом азота, к которому они присоединены, означают
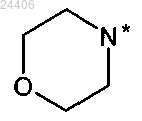
в которой * означает точку присоединения к остатку структуры общей формулы (I),
тогда
указанный R2 гетероарил структуры
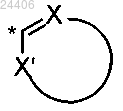
не означает
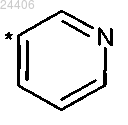
в которой * означает точку присоединения к остатку структуры общей формулы (I),
или его стереоизомер, таутомер, N-оксид, гидрат, сольват или соль, или смесь таковых.
2. Соединение по п.1, где соль представляет собой физиологически приемлемую соль.
3. Соединение по любому из пп.1 или 2, где
R1 означает -(CH2)n-(CHR4)-(CH2)m-N(R5)(R5');
R2 означает гетероарил структуры
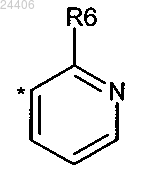
в которой * означает точку присоединения указанного гетероарила к остатку структуры общей формулы (I);
R3 означает метил;
R4 означает гидрокси;
R5 и R5' являются одинаковыми или разными и означают, независимо друг от друга, атом водорода или C1-С6-алкил, или
R5 и R5', взятые вместе с атомом азота, к которому они присоединены, означают 3-7-членное азотсодержащее гетероциклическое кольцо, которое необязательно содержит по меньшей мере один дополнительный гетероатом, выбранный из кислорода, азота или серы, и которое необязательно может быть замещено 1 или несколькими группами R6';
в каждом случае R6 может быть одинаковым или разным и независимо означает атом водорода, С1-С6-алкил или -N(R7)(R7');
в каждом случае R6' означает С1-С6-алкил;
в каждом случае R7 и R7' означают атом водорода;
n означает целое число 1 и m означает целое число 1;
при условии, что когда
указанные R5 и R5', взятые вместе с атомом азота, к которому они присоединены, означают
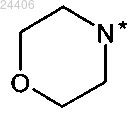
в которой * означает точку присоединения к остатку структуры общей формулы (I),
тогда
указанный R2 гетероарил структуры
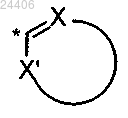
не означает
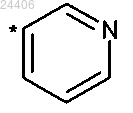
в которой * означает точку присоединения к остатку структуры общей формулы (I),
или его стереоизомер, таутомер, N-оксид, гидрат, сольват или соль, в частности физиологически приемлемая соль, или смесь таковых.
4. Соединение по любому из пп.1-3, которое выбирают из группы, состоящей из
N-(8-{[(2R)-2-гидрокси-3-(морфолин-4-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиридин-3-карбоксамида;
N-(8-{[(2S)-2-гидрокси-3-(морфолин-4-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиридин-3-карбоксамида;
N-[8-({(2R)-3-[(2R,6S)-2,6-диметилморфолин-4-ил]-2-гидроксипропил}окси)-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]пиридин-3-карбоксамида;
N-(8-{[(2R)-2-гидрокси-3-(8-окса-3-азабицикло[3.2.1]окт-3-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиридин-3-карбоксамида;
N-{8-[2-гидрокси-3-(тиоморфолин-4-ил)пропокси]-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил}пиридин-3-карбоксамида;
N-(8-{[(2R)-3-(азетидин-1-ил)-2-гидроксипропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиридин-3-карбоксамида;
N-(8-{[(2R)-2-гидрокси-3-(пирролидин-1-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиридин-3-карбоксамида;
N-(8-{[(2R)-2-гидрокси-3-(пиперидин-1-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиридин-3-карбоксамида;
N-{8-[3-(диметиламино)-2-гидроксипропокси]-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил}пиридин-3-карбоксамида;
N-(8-{[(2R)-3-(диметиламино)-2-гидроксипропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиридин-3-карбоксамида;
N-(8-{[(2R)-3-(дипропан-2-иламино)-2-гидроксипропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиридин-3-карбоксамида;
N-(8-{[(2R)-2-гидрокси-3-(морфолин-4-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)-2-метилпиридин-3-карбоксамида;
N-(8-{[(2R)-3-(азетидин-1-ил)-2-гидроксипропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)-2-метилпиридин-3-карбоксамида;
N-[8-({(2R)-3-[(2R,6S)-2,6-диметилморфолин-4-ил]-2-гидроксипропил}окси)-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-2-метилпиридин-3-карбоксамида;
N-(8-{[(2R)-2-гидрокси-3-(пирролидин-1-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)-2-метилпиридин-3-карбоксамида;
N-(8-{[(2R)-2-гидрокси-3-(пиперидин-1-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)-2-метилпиридин-3-карбоксамида;
N-(8-{[(2R)-3-(дипропан-2-иламино)-2-гидроксипропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)-2-метилпиридин-3-карбоксамида;
6-амино-N-{8-[2-гидрокси-3-(морфолин-4-ил)пропокси]-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил}пиридин-3-карбоксамида;
6-амино-N-(8-{[(2R)-2-гидрокси-3-(морфолин-4-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)-2-метилпиридин-3-карбоксамида;
N-(8-{[(2R)-2-гидрокси-3-(пирролидин-1-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиримидин-5-карбоксамида;
2-амино-N-{8-[2-гидрокси-3-(морфолин-4-ил)пропокси]-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил}пиримидин-5-карбоксамида;
2-амино-N-[8-({(2R)-3-[(2R,6S)-2,6-диметилморфолин-4-ил]-2-гидроксипропил}окси)-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]пиримидин-5-карбоксамида;
дигидрохлорида 2-амино-N-(8-{[(2R)-2-гидрокси-3-(8-окса-3-азабицикло[3.2.1]окт-3-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиримидин-5-карбоксамида;
2-амино-N-(8-{[(2R)-3-(диметиламино)-2-гидроксипропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиримидин-5-карбоксамида;
N-(8-{[(2R)-2-гидрокси-3-(морфолин-4-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)-3Н-имидазо[4,5-b]пиридин-6-карбоксамида;
N-(8-{[(2R)-2-гидрокси-3-(морфолин-4-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)-1,3-тиазол-5-карбоксамида;
N-[8-({(2R)-3-[(2R,6S)-2,6-диметилморфолин-4-ил]-2-гидроксипропил}окси)-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-1,3-тиазол-5-карбоксамида;
N-(8-{[(2R)-3-(азетидин-1-ил)-2-гидроксипропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)-1,3-тиазол-5-карбоксамида;
N-(8-{[(2R)-2-гидрокси-3-(пирролидин-1-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)-1,3-тиазол-5-карбоксамида;
N-(8-{[(2R)-2-гидрокси-3-(пиперидин-1-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)-1,3-тиазол-5-карбоксамида;
N-(8-{[(2R)-2-гидрокси-3-(пирролидин-1-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)-4-метил-1,3-тиазол-5-карбоксамида;
2-амино-N-(8-{[(2R)-2-гидрокси-3-(морфолин-4-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)-4-метил-1,3-тиазол-5-карбоксамида;
N-(8-{[(2R)-2-гидрокси-3-(пирролидин-1-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)-1,3-оксазол-5-карбоксамида;
N-(8-{[(2R)-3-(дипропан-2-иламино)-2-гидроксипропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)-1,3-тиазол-5-карбоксамида,
или его стереоизомер, таутомер, N-оксид, гидрат, сольват или соль, в частности физиологически приемлемая соль, или смесь таковых.
5. Соединение по любому из пп.1-4, которое выбирают из группы, состоящей из
N-(8-{[(2R)-2-гидрокси-3-(морфолин-4-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиридин-3-карбоксамида;
N-[8-({(2R)-3-[(2R,6S)-2,6-диметилморфолин-4-ил]-2-гидроксипропил}окси)-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]пиридин-3-карбоксамида;
N-(8-{[(2R)-2-гидрокси-3-(8-окса-3-азабицикло[3,2,1]окт-3-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиридин-3-карбоксамида;
N-(8-{[(2R)-3-(азетидин-1-ил)-2-гидроксипропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиридин-3-карбоксамида;
N-(8-{[(2R)-2-гидрокси-3-(пирролидин-1-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиридин-3-карбоксамида;
N-(8-{[(2R)-2-гидрокси-3-(пиперидин-1-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиридин-3-карбоксамида;
N-(8-{[(2R)-3-(диметиламино)-2-гидроксипропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиридин-3-карбоксамида;
N-(8-{[(2R)-3-(дипропан-2-иламино)-2-гидроксипропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиридин-3-карбоксамида;
N-(8-{[(2R)-2-гидрокси-3-(морфолин-4-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)-2-метилпиридин-3-карбоксамида;
N-(8-{[(2R)-3-(азетидин-1-ил)-2-гидроксипропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)-2-метилпиридин-3-карбоксамида;
N-(8-{[(2R)-2-гидрокси-3-(пирролидин-1-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)-2-метилпиридин-3-карбоксамида;
N-(8-{[(2R)-2-гидрокси-3-(пиперидин-1-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)-2-метилпиридин-3-карбоксамида;
N-(8-{[(2R)-3-(дипропан-2-иламино)-2-гидроксипропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)-2-метилпиридин-3-карбоксамида;
N-(8-{[(2R)-2-гидрокси-3-(пирролидин-1-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиримидин-5-карбоксамида;
дигидрохлорида 2-амино-N-(8-{[(2R)-2-гидрокси-3-(8-окса-3-азабицикло[3,2,1]окт-3-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиримидин-5-карбоксамида;
N-(8-{[(2R)-2-гидрокси-3-(пирролидин-1-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)-1,3-тиазол-5-карбоксамида;
N-(8-{[(2R)-2-гидрокси-3-(пиперидин-1-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)-1,3-тиазол-5-карбоксамида;
N-(8-{[(2R)-2-гидрокси-3-(пирролидин-1-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)-1,3-оксазол-5-карбоксамида,
или его стереоизомер, таутомер, N-оксид, гидрат, сольват или соль, в частности физиологически приемлемая соль, или смесь таковых.
6. Соединение по п.1, где
R1 означает -(CH2)n-(CHR4)-(CH2)m-N(R5)(R5');
R2 означает гетероарил структуры
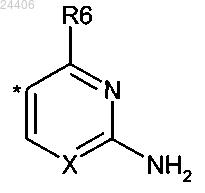
в которой * означает точку присоединения указанного гетероарила к остатку структуры общей формулы (I), и
X означает N или C-R6;
R3 означает метил;
R4 означает гидрокси;
R5 и R5' являются одинаковыми или разными и означают, независимо друг от друга, атом водорода или C1-С6-алкил, или
R5 и R5', взятые вместе с атомом азота, к которому они присоединены, означают 3-7-членное азотсодержащее гетероциклическое кольцо, которое необязательно содержит по меньшей мере один дополнительный гетероатом, выбранный из кислорода, азота или серы, и которое необязательно может быть замещено 1 или несколькими группами R6';
в каждом случае R6 может быть одинаковым или разным и независимо означает атом водорода, C1-С6-алкил или -N(R7)(R7');
в каждом случае R6' означает С1-С6-алкил;
в каждом случае R7 и R7' означают атом водорода;
n означает целое число 1 и m означает целое число 1;
или его стереоизомер, таутомер, N-оксид, гидрат, сольват или соль, в частности физиологически приемлемая соль, или смесь таковых.
7. Соединение по любому из пп.1 или 6, которое выбирают из группы, состоящей из
6-амино-N-{8-[2-гидрокси-3-(морфолин-4-ил)пропокси]-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил}пиридин-3-карбоксамида;
6-амино-N-(8-{[(2S)-2-гидрокси-3-(морфолин-4-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиридин-3-карбоксамида;
6-амино-N-(8-{[(2R)-2-гидрокси-3-(морфолин-4-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)-2-метилпиридин-3-карбоксамида;
2-амино-N-{8-[2-гидрокси-3-(морфолин-4-ил)пропокси]-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил}пиримидин-5-карбоксамида;
2-амино-N-(8-{[(2S)-2-гидрокси-3-(морфолин-4-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиримидин-5-карбоксамида;
2-амино-N-[8-({(2R)-3-[(2R,6S)-2,6-диметилморфолин-4-ил]-2-гидроксипропил}окси)-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]пиримидин-5-карбоксамида;
дигидрохлорида 2-амино-N-(8-{[(2R)-2-гидрокси-3-(8-окса-3-азабицикло[3,2,1]окт-3-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиримидин-5-карбоксамида;
2-амино-N-(8-{[(2R)-3-(диметиламино)-2-гидроксипропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиримидин-5-карбоксамида,
или его стереоизомер, таутомер, N-оксид, гидрат, сольват или соль, в частности физиологически приемлемая соль, или смесь таковых.
8. Соединение по любому из пп.1, 6 или 7, которое представляет собой дигидрохлорид 2-амино-N-(8-{[(2R)-2-гидрокси-3-(8-окса-3-азабицикло[3,2,1]окт-3-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиримидин-5-карбоксамида или его стереоизомер, таутомер, N-оксид, гидрат, сольват или соль, в частности физиологически приемлемая соль, или смесь таковых.
9. Соединение N-(8-{[(2R)-2-гидрокси-3-(морфолин-4-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)-2-метилпиридин-3-карбоксамид или его стереоизомер, таутомер, N-оксид, гидрат, сольват или соль, в частности физиологически приемлемая соль, или смесь таковых.
10. Соединение N-(8-{[(2R)-2-гидрокси-3-(морфолин-4-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)-2-метилпиридин-3-карбоксамид или его физиологически приемлемая соль, или смесь таковых.
11. Соединение N-(8-{[(2R)-2-гидрокси-3-(морфолин-4-ил)пропил]окси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)-2-метилпиридин-3-карбоксамид.
12. Соединение по любому из пп.1-3, где
R5 и R5' являются одинаковыми или разными и означают, независимо друг от друга, атом водорода или C1-С6-алкил, или
R5 и R5', взятые вместе с атомом азота, к которому они присоединены, означают 3-7-членное азотсодержащее гетероциклическое кольцо, которое необязательно содержит по меньшей мере один дополнительный гетероатом, выбранный из кислорода или азота, и которое необязательно может быть замещено 1 или несколькими группами R6'.
13. Соединение по любому из пп.1-3, где
R5 и R5', взятые вместе с атомом азота, к которому они присоединены, означают морфолинил.
14. Соединение по любому из пп.1-3, где
в каждом случае R6 может быть одинаковым или разным и независимо означает атом водорода или C1-С6-алкил.
15. Соединение по любому из пп.1-3, где
в каждом случае R6 может быть одинаковым или разным и означает С1-С6-алкил.
16. Соединение по любому из пп.1-3, где
в каждом случае R6 может быть одинаковым или разным и означает С1-С4-алкил.
17. Соединение по пп.1-16, где асимметричные углеродные атомы присутствуют в (R)-конфигурации.
18. Способ получения соединения общей формулы (I) по любому из пп.1-17, который включает стадию обеспечения реакции промежуточного соединения общей формулы (XI)

в которой R1 и R3 принимают значения, определенные для общей формулы (I) в любом из пп.1-17,
с соединением общей формулы (XIa)
R2COOH (XIa),
в которой R2 принимает значение, определенное для общей формулы (I) в любом из пп.1-6, таким образом с получением соединения общей формулы (I)
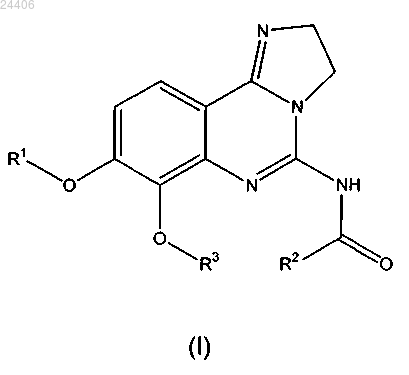
в которой R1, R2 и R3 принимают значения, определенные для общей формулы (I) в любом из пп.1-17.
19. Фармацевтическая композиция, содержащая соединение общей формулы (I) или его стереоизомер, таутомер, N-оксид, гидрат, сольват или соль, смесь таковых по любому из пп.1-17, и фармацевтически приемлемый разбавитель или носитель.
20. Фармацевтическая композиция по п.19, где соль представляет собой фармацевтически приемлемую соль.
21. Фармацевтическая комбинация, содержащая
одно или несколько соединений общей формулы (I) или их стереоизомеров, таутомеров, N-оксидов, гидратов, сольватов или солей, или смесь таковых по любому из пп.1-17; и
одно или несколько средств, выбранных из таксана, такого как доцетаксел, паклитаксел или таксол; эпотилона, такого как иксабепилон, патупилон или сагопилон; митоксантрона; прединизолона; дексаметазона; эстрамустина; винбластина; винкристина; доксорубицина; адриамицина; идарубицина; даунорубицина; блеомицина; этопозида; циклофосфамида; ифосфамида; прокарбазина; мелфалана; 5-фторурацила; капецитабина; флударабина; цитарабина; Ara-С; 2-хлор-2'-дезоксиаденозина; тиогуанина; антиандрогена, такого как флутамид, ципротерон ацетат или бикалутамид; бортезомиба; производного платины, такого как цисплатин или карбоплатин; хлорамбуцила; метотрексата и ритуксимаба.
22. Фармацевтическая комбинация по п.21, где соль представляет собой фармацевтически приемлемую соль.
23. Применение соединения общей формулы (I) или его стереоизомера, таутомера, N-оксида, гидрата, сольвата или соли, или смеси таковых по любому из пп.1-17 для профилактики или лечения заболевания, неконтролируемого роста клеток, пролиферации и/или жизнеспособности, неподходящих клеточных иммунных ответов или неподходящих клеточных воспалительных ответов.
24. Применение соединения общей формулы (I) или его стереоизомера, таутомера, N-оксида, гидрата, сольвата или соли, или смеси таковых по любому из пп.1-17 для получения лекарственного средства для профилактики или лечения заболевания, неконтролируемого роста клеток, пролиферации и/или жизнеспособности, неподходящих клеточных иммунных ответов или неподходящих клеточных воспалительных ответов.
25. Применение по п.23 или 24, где соль представляет собой фармацевтически приемлемую соль.
26. Применение по п.23 или 24, где вышеуказанное заболевание представляет собой заболевание неконтролируемого(ой) роста клеток, пролиферации и/или жизнеспособности, неподходящего клеточного иммунного ответа или неподходящего клеточного воспалительного ответа, в частности, когда неконтролируемый(ая) рост клеток, пролиферация и/или жизнеспособность, неподходящий клеточный иммунный ответ или неподходящий клеточный воспалительный ответ опосредуются фосфотидилинозитол-3-киназным (PI3K) путем, более предпочтительно, когда заболевание неконтролируемого(ой) роста клеток, пролиферации и/или жизнеспособности, неподходящего клеточного иммунного ответа или неподходящего клеточного воспалительного ответа представляет собой гематологическую опухоль, солидную опухоль и/или их метастазы, например лейкемии и миелодиспластический синдром, злокачественные лимфомы, опухоли головы и шеи, включая опухоли головного мозга и метастазы в головной мозг, опухоли грудной клетки, включая немелкоклеточные и мелкоклеточные опухоли легкого, гастроинтестинальные опухоли, эндокринные опухоли, опухоли молочной железы и гинекологические опухоли, урологические опухоли, включая опухоли почек, мочевого пузыря и предстательной железы, опухоли кожи, и саркомы и/или их метастазы.
27. Соединение общей формулы (XI)
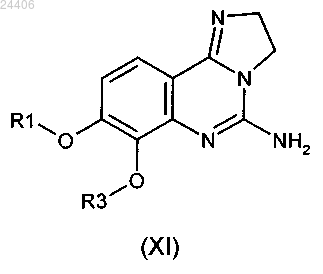
в которой R1 и R3 принимают значения, определенные для общей формулы (I) в любом из пп.1-17.
28. Применение соединений общей формулы (XI) по п.27 для получения соединения общей формулы (I) по любому из пп.1-17.
Текст
АМИНОСПИРТ-ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ 2,3-ДИГИДРОИМИДАЗО[1,2 с]ХИНАЗОЛИНА, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ ГИПЕРПРОЛИФЕРАТИВНЫХ НАРУШЕНИЙ И ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С АНГИОГЕНЕЗОМ Настоящее изобретение относится к новым соединениям 2,3-дигидроимидазо[1,2-с]хиназолина,фармацевтическим композициям, содержащим такие соединения, и применению таких соединений или композиций для ингибирования фосфотидилинозитол-3-киназы (PI3K) и лечения заболеваний, связанных с активностью фосфотидилинозитол-3-киназы (PI3K), в частности лечения гиперпролиферативных нарушений и/или нарушений ангиогенеза, в виде отдельного средства или в комбинации с другими активными компонентами. Скотт Уилльям Джонстон (US), Лю Ниншу, Мвес Манфред, Мннинг Урзула, Хегебарт Андреа, Бмер Ульф(71)(73) Заявитель и патентовладелец: БАЙЕР ИНТЕЛЛЕКТЧУАЛ ПРОПЕРТИ ГМБХ (DE) Область техники, к которой относится изобретение Настоящее изобретение относится к ариламиноспирт-замещенным 2,3-дигидроимидазо[1,2-с]хинолинам (далее именуемым как "соединения общей формулы (I)"), как описано и определено в данной заявке, к способам получения вышеуказанных соединений, к промежуточным соединениям для получения вышеуказанных соединений, к фармацевтическим композициям и комбинациям, содержащим вышеуказанные соединения, и к применению вышеуказанных соединений для изготовления фармацевтической композиции для лечения или профилактики заболевания, в частности гиперпролиферативного нарушения и/или нарушения ангиогенеза, в виде отдельного средства или в комбинации с другими активными компонентами. Предпосылки создания изобретения В последнее десятилетие концепция разработки противораковых лекарственных средств, мишенями которых являются патологически активные протеинкиназы, привела к ряду успехов. В дополнение к действиям протеинкиназ липидкиназы также играют важную роль в генерации критических регулирующих вторичных мессенджеров. Семейство PI3K липидкиназ производит 3'-фосфоинозитиды, которые связываются с множеством клеточных мишеней и активируют их, начиная широкий диапазон каскадов передачи сигналов (Vanhaesebroeck и др., 2001; Toker, 2002; Pendaries и др., 2003; Downes и др., 2005). Эти каскады в конечном счете вызывают изменения во многих клеточных процессах, включая пролиферацию клеток, жизнеспособность клеток, дифференцирование, транспорт в везикулах, миграцию и хемотаксис.PI3K могут быть разделены на три различных класса на основании различий и в структуре, и в предпочтении к субстрату. В то время как члены семейства Класса II PI3K были вовлечены в регулирование роста опухоли (BrownShepherd, 2001; Traer и др., 2006), большая часть исследования сосредоточилась на ферментах Класса I и их роли при раке (Stauffer и др., 2005; Stephens и др., 2005; VivancoPI3K Класса I были традиционно разделены на два различных подкласса на основании различий в составе белковой субъединицы. PI3K Класса IA состоят из р 110 каталитической субъединицы (р 110,или ), гетеродимеризированной с членом семейства р 85 регулирующих субъединиц. Напротив, каталитическая субъединица PI3K Класса IB (р 110) гетеродимеризируется с другой р 101 регулирующей субъединицей (рассмотрено VanhaesebroeckWaterfield, 1999; Funaki и др., 2000; Katso и др., 2001). Стерминальный участок этих белков содержит каталитический домен, который обладает отдаленной гомологией к протеинкиназам. Структура PI3K подобна р 110 Класса IA, но не содержит N-терминального р 85 связывающего участка (DominWaterfield, 1997). Хотя они подобны по общей структуры, гомология между каталитическими р 110 субъединицами является низкой или средней. Самая высокая гомология между PI3K изоформами находится в кармане киназы киназного домена.PI3K изоформы Класса IA связываются с активированными рецепторными тирозинкиназами (RTK)(включая PDGFR, EGFR, VEGFR, IGF1-R, c-KIT, CSF-R и Met), или с тирозин-фосфорилированными адаптерными белками (такими как Grb2, CbI, IRS-1 или Gab1), через их р 85 регулирующие субъединицы,что приводит к стимуляции липидкиназной активности. Активация липидкиназной активности р 110 и р 110 изоформ, как показано, происходит в ответ на связывание с активированными формами ras онкогена (Kodaki и др., 1994). Фактически, онкогенная активность этих изоформ может потребовать связывания с ras (Kang и др., 2006). Напротив, р 110 и р 110 изоформы показывают онкогенную активность независимо от связывания ras, через конститутивную активацию Akt.PIP3 с помощью PI3K затрагивает множественные сигнальные процессы, которые регулируют и координируют биологические конечные точки клеточной пролиферации, клеточной жизнеспособности, дифференцирования и клеточной миграции. PIP3 связывается содержащими домен Pleckstrin-гомологии (РН) белками, включая фосфоинозитид-зависимую киназу, PDK1 и Akt прото-онкогенный продукт, локализируя эти белки в участках активной передачи сигналов и также непосредственно способствуя их активации (Klippel и др., 1997; Fleming и др., 2000; ItohTakenawa, 2002; Lemmon, 2003). Эта совместная локализация PDK1 с Akt облегчает фосфорилирование и активацию Akt. Карбокситерминальное фосфорилирование Akt на Ser473 способствует фосфорилированию Thr308 в петле активации Akt (ChanTsichlis,2001; Hodgkinson и др., 2002; Scheid и др., 2002; Hresko и др., 2003). При активации Akt фосфорилирует и регулирует множество регулирующих киназы путей, которые непосредственно влияют на прогрессию клеточного цикла и клеточную жизнеспособность. Многие из эффектов активации Akt опосредуются через ее отрицательное регулирование путей, которые воздействуют на жизнеспособность клетки и которые обычно дисрегулированы при раке. Akt способствует жизнеспособности опухолевых клеток путем регулирования компонентов апоптозных механизмов и механизмов клеточного цикла. Akt - одна из нескольких киназ, которая фосфорилирует и инактивирует про-апоптические белки BAD (del Peso и др., 1997; Pastorino и др., 1999). Akt может также способствовать клеточной жизнеспособности через блокирование цитохром С-зависимой каспазной активации путем фосфорилирования Каспазы 9 на Ser196 (Cardone и др., 1998).Akt воздействует на генную транскрипцию на нескольких уровнях. Akt-опосредованное фосфори-1 024406 лирование MDM2 Е 3 убиквитинлигазы на Ser166 и Ser186 облегчает ядерный импорт MDM2 и формирование и активацию комплекса убиквитинлигазы. Ядерный MDM2 нацеливается на р 53 опухолевый супрессор для деградации, процесса, который может быть заблокирован LY294002 (Yap и др., 2000; Ogawara и др., 2002). Нисходящее регулирование р 53 с помощью MDM2 отрицательно воздействует на транскрипцию р 53-регулируемых про-апоптических генов (например, Вах, Fas, PUMA и DR5), ингибитор клеточного цикла, p21Cip1 и PTEN опухолевый супрессор (Momand и др., 2000; Hupp и др., 2000; Мауо и др.,2002; Su и др., 2003). Подобным образом, Akt-опосредованное фосфорилирование факторов транскрипции Forkhead FKHR, FKHRL и AFX (Kops и др., 1999; Tang и др., 1999) облегчает их связывание с белками 14-3-3 и экспорт из клеточного ядра в цитозоль (Brunet и др., 1999). Эта функциональная инактивация активности Forkhead также воздействует на транскрипцию про-апоптических и про-ангиогенных генов, включая транскрипцию лиганда Fas (Ciechomska и др., 2003) Bim, члена про-апоптического Bcl-2 семейства (Dijkers и др., 2000), и антагониста Ангиопоэтина-1 (Ang-1), Ang-2 (Daly и др., 2004). Факторы транскрипции Forkhead регулируют экспрессию ингибитора циклин-зависимой киназы (Cdk) p27Kip1. Действительно, ингибиторы PI3K, как было продемонстрировано, индуцируют экспрессию p27Kip1, что приводит к ингибированию Cdk1, остановке клеточного цикла и апоптозу (Dijkers и др., 2000). Также сообщают, что Akt фосфорилирует p21Cip1 на Thr145 и р 27Kip1 на Thr157, облегчая их ассоциацию с белками 14-3-3, что приводит к ядерному экспорту и удерживанию в цитоплазме, предотвращая их ингибирование Cdk ядра (Zhou и др., 2001; Motti и др., 2004; Sekimoto и др., 2004). В дополнение к этим эффектам,Akt фосфорилирует IKK (RomashkovaMakarov, 1999), что приводит к фосфорилированию и деградации IkB и последующей ядерной транслокации NFkB, что приводит к экспрессии генов жизнеспособности, таких как IAP и Bcl-XL. Путь PI3K/Akt также связан с супрессией апоптоза через JNK и р 38MAPK MAP киназы, которые связаны с индукцией апоптоза. Akt, как постулируется, подавляет сигнальный путь JNK и р 38MAPK через фосфорилирование и ингибирование двух JNK/p38 регулирующих киназ, регулирующей сигнал апоптоза киназы 1 (ASK1) (Kim и др., 2001; LiaoHung, 2003; Yuan и др., 2003), и киназы смешанного происхождения 3 (MLK3) (Lopez-llasaca и др., 1997; Barthwal и др., 2003; Figueroa и др., 2003). Индукция р 38MAPK активности наблюдается в опухолях, леченных с помощью цитотоксических средств, и требуется для этих средств для индукции смерти клетки (рассмотрено Olson и Hallahan, 2004). Таким образом, ингибиторы пути PI3K могут способствовать активностям совместно вводимых цитотоксических лекарственных средств. Дополнительная роль для передачи сигналов PI3K/Akt вовлекает регулирование прогрессии клеточного цикла через модуляцию активности гликоген синтаз киназы 3 (GSK3). Активность GSK3 повышена в неподвижных клетках, где она фосфорилирует циклин D1 на Ser286, нацеливая белок для убиквитинации и деградации (Diehl и др., 1998) и блокируя вход в S-фазу. Akt ингибирует активность GSK3 через фосфорилирование на Ser9 (Cross и др., 1995). Это приводит к повышению уровней циклина D1, что способствует прогрессии клеточного цикла. Ингибирование активности GSK3 также воздействует на пролиферацию клеток через активацию wnt/бета-катенинового сигнального пути (AbboshNephew,2005; Naito и др., 2005; Wilker и др., 2005; Segrelles и др., 2006). Akt-опосредованное фосфорилированиеGSK3 приводит к стабилизации и ядерной локализации бета-катенинового белка, что, в свою очередь,приводит к увеличению экспрессии с-myc и циклина D1, мишеней бета-катенинового/Tcf пути. Хотя передача сигналов PI3K используется многими сетями передачи сигналов, связанными с онкогенами и опухолевыми супрессорами, PI3K и ее активность были непосредственно связаны с раком. Сверхэкспрессия обеих изоформ р 110 и р 110 наблюдалась в опухолях мочевого пузыря и толстой кишки и в клеточных линиях, и сверхэкспрессия вообще коррелирует с увеличенной активностью PI3K(Bnistant и др., 2000). Также сообщалось об сверхэкспрессии р 110 в опухолях яичника и шейки матки и опухолевых клеточных линиях, так же как в чешуйчатоклеточных карциномах легкого. Сверхэкспрессия р 110 в линиях опухоли шейки матки и яичника связана с увеличением активности PI3K (Shayesteh и др., 1999; Ма и др., 2000). Повышенная активность PI3K наблюдалась при колоректальных карциномах(Phillips и др., 1998) и увеличенная экспрессия наблюдалась при карциномах молочной железы (Gershteinu др., 1999). За прошлые несколько лет соматические мутации в гене, кодирующем р 110 (PIK3CA), были идентифицированы во многих типах рака. Данные, собранные до настоящего времени, свидетельствуют, чтоPIK3CA мутирована приблизительно в 32% случаев колоректального рака (Samuels и др., 2004; Ikenoue и др., 2005), 18-40% рака молочной железы (Bachman и др., 2004; Campbell и др., 2004; Levine и др., 2005;(Samuels и др., 2004; WhyteHolbeck, 2006) и до 40% рака эндометрия (Oda и др., 2005). Сообщалось о мутациях PIK3CA при олигодендроме, астроцитоме, медуллобластоме, а также опухолях щитовидной железы (Broderick и др., 2004; Garcia-Rostan и др., 2005). На основании наблюдаемой высокой частоте мутации PIK3CA - один из двух наиболее часто мутируемых генов, связанных с раком, другим являетсяK-ras. Больше чем 80 % группы мутаций PIK3CA расположено в пределах двух участков белка, спирального (Е 545K) и каталитического доменов (H1047R). Биохимический анализ и исследования экспрессии белка продемонстрировали, что обе мутации приводят к увеличению конститутивной р 110 каталитической активности и фактически являются онкогенными (Bader и др., 2006; Kang и др., 2005; Samuels и др.,2005; SamuelsEricson, 2006). Недавно сообщалось, что фибробласты эмбриона PIK3CA нокаутной мыши не имели нисходящей передачи сигналов от различных рецепторов фактора роста (IGF-1, инсулин,PDGF, EGF), и являются резистентными к преобразованию множеством онкогенных RTK (IGFR, EGFR дикого типа и соматическими активирующими мутантами EGFR, Her2/Neu) (Zhao и др., 2006). Функциональные исследования PI3K in vivo продемонстрировали, что siPHK-опосредованная нисходящая регуляция р 110 ингибирует и фосфорилирование Akt и рост опухоли клеток HeLa у голых мышей (Czauderna и др., 2003). В подобных экспериментах siPHK-опосредованная нисходящая регуляция р 110, как также показано, ингибировала рост клеток злокачественной глиомы in vitro и in vivo (Pu и др., 2006). Ингибирование функции PI3K доминант-отрицательными р 85 регулирующими субъединицами может блокировать митогенез и клеточную трансформацию (Huang и др., 1996; Rahimi и др., 1996). Несколько соматических мутаций в генах, кодирующих р 85 и р 85 регулирующие субъединицы PI3K,которые приводят к повышенной липидкиназной активности, были также идентифицированы во многих раковых клетках (Janssen и др., 1998; Jimenez и др., 1998; Philp и др., 2001; Jucker и др., 2002; Shekar и др., 2005). Нейтрализация антител PI3K также блокирует митогенез и может вызвать апоптоз in vitro(Roche и др., 1994; Roche и др., 1998; Bnistant и др., 2000). Контрольно-проверочные in vivo исследования с использованием ингибиторов PI3K LY294002 и вортманнина демонстрируют, что ингибирование передачи сигналов PI3K замедляет рост опухоли in vivo (Powis и др., 1994; Schultz и др., 1995; Semba и др., 2002; Ihle и др., 2004). Сверхэкспрессия активности PI3K Класса I или стимуляция их липидкиназных активностей связана с резистентностью как к нацеленным (таким как иматиниб и тратсузумаб), так и цитотоксическим химиотерапевтическим подходам, а также лучевой терапии (West и др., 2002; Gupta и др., 2003; Osaki и др.,2004; Nagata и др., 2004; Gottschalk и др., 2005; Kim и др., 2005). Активация PI3K, как также было показано, приводит к экспрессии белка-1 с множественной медикаментозной резистентностью (MRP-1) в клетках рака предстательной железы и последующей индукции резистентности к химиотерапии (Lee и др., 2004). Важность передачи сигналов PI3K при канцерогенезе дополнительно подчеркнута результатами о том, что опухолевый супрессор PTEN, PI(3)P фосфатаза принадлежит к обычно инактивированным генам при человеческих типах рака (Li и др., 1997; Steck и др., 1997; Ali и др., 1999; Ishii и др., 1999). PTEN дефосфорилирует PI(3,4,5)P3 до PI(4,5)P2, таким образом антагонизируя PI3K-зависимую передачу сигналов. Клетки, содержащие функционально неактивный PTEN, имеют повышенные уровни PIP3, высокие уровни активности передачи сигналов PI3K (Haas-Kogan и др., 1998; Myers и др., 1998; Taylor и др.,2000), увеличенный пролиферативный потенциал и уменьшенную чувствительность к про-апоптическим стимулам (Stambolic и др., 1998). Восстановление функционального PTEN подавляет передачу сигналовPI3K (Taylor и др., 2000), ингибирует клеточный рост и повторно сенсибилизирует клетки к проапоптическим стимулам (Myers и др., 1998; Zhao и др., 2004). Подобным образом, восстановление функции PTEN в опухолях, не имеющих функционального PTEN, ингибирует рост опухоли in vivo (Stahl и др., 2003; Su и др., 2003; TanakaGrossman, 2003) и сенсибилизирует клетки к цитотоксическим средствам (TanakaGrossman, 2003). Сигнальные входы к классу I PI3K являются разными и могут быть выведены через генетические анализы. Таким образом, активация АКТ была нарушена в р 110-дефицитных фибробластах эмбриона мыши (MEF) при стимуляции классическими лигандами рецепторной тирозинкиназы (RTK) (такими как,например, EGF, инсулин, IGF-1 и PDGF) (Zhao и др., 2006). Тем не менее, MEF, в которых р 110 подвергались абляции или замене на киназа-недействующий аллель р 110, обычно реагируют на стимуляцию факторов роста через RTK (Jia и др., 2008). В противоположность этому, р 110 каталитическая активность необходима для активации АКТ в ответ на GPCR лиганды (такие как LPA). Как таковая, р 110 повидимому несет большинство сигналов PI3K в классическом RTK пути передачи сигналов и отвечает за рост опухолевых клеток, пролиферацию, жизнеспособность, ангиогенез и метаболизм, тогда как р 110 опосредует GPCR путь передачи сигналов от митогенов и хемокинов и, следовательно, может регулировать пролиферацию опухолевых клеток, метаболизм, воспаление и инвазию (Vogt и др., 2009; Jia и др.,2009). Мутация гена, кодирующего р 110 редко встречается в опухолях, но амплификация PI3K была обнаружена во многих опухолях (Bnistant и др., 2000; Brugge и др., 2007). Важно отметить, что на мышиной модели опухоли предстательной железы, обусловленной дефицитом PTEN, было показано, что абляция р 110 не оказывает действия на онкогенез (Jia и др., 2008). Кроме того, р 110 PTENдефицитных линий человеческих раковых клеток (например, РС-3, U87MG, и ВТ 549), но не р 110, ингибирует лежащую ниже в цепи передачи сигналов активацию AKT, клеточное превращение и ростPTEN-дефицитных клеток и ксенотрансплантатных опухолей (Wee и др., 2008). Генетические исследова-3 024406 ния позволили предположить, что активность киназы р 110 имеет важное значение в клеточном превращении, вызванном потерей PTEN. Например, обратное добавление киназа-недействующей р 110, но не ее аналога дикого типа, нарушало формирование очагов в PTEN-дефицитных РС 3 клетках, обедненных эндогенной р 110 (Wee и др., 2008). Эти исследования показывают, что PTEN-дефицитные опухолевые клетки зависят от р 110 и ее каталитической активности относительно передачи сигналов и роста. Генетическая альтерация гена-супрессора опухолевого роста PTEN часто встречается во многих видах рака (Liu и др., 2009), таких как рак эндометрия (43%), CRPC (рак предстательной железы, резистентный к кастрации) (35-79%), глиома (19%) и меланома (18%). В случае рака эндометрия, была подтверждена сосуществующая генетическая альтерация PIK3CA и PTEN (YuanCantley, 2008). В дополнение к мутации, была обнаружена амплификация PIK3CA и потеря функции PTEN посредством различных молекулярных механизмов. Например, амплификация PIK3CA и потеря функции PTEN была найдена в 30-50% и 35-60% больных раком желудка, соответственно, хотя уровень PIK3CA и PTEN мутаций, как сообщалось, составляет менее 7% для каждого (Byun и др., 2003; Oki и др., 2006; Li и др.,2005; Sanger Database). В то время как подмножество типов опухолей исключительно зависят от передачи сигналов посредством PI3K, другие опухоли зависят от передачи сигналов посредством PI3K или от комбинации обеих путей - передачи сигналов посредством PI3K и PI3K. Следовательно, остается потребность в сбалансированных PI3K / ингибиторах, способных ингибировать обе, PI3K альфа и бета, цели.WO 2008/070150 (Bayer Schering Pharma Aktiengesellschaft) относится к соединениям 2,3-дигидроимидазо[1,2-с]хиназолина, к фармацевтическим композициям, содержащим такие соединения, и применению таких соединений или композиций для ингибирования фосфотидилинозитол-3-киназы (PI3K), и лечения заболеваний, связанных с активностью PI3K, в частности лечения гиперпролиферативных нарушений и/или нарушений ангиогенеза, в виде отдельного средства или в комбинации с другими активными компонентами. Вышеуказанные соединения показывают более высокую активность (более низкийIC50) по отношению к PI3K альфа, чем по отношению к PI3k бета. Тем не менее, состояние уровня техники, раскрытое выше, не описывает соединения общей формулы (I) настоящего изобретения, их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты, или соли,или смесь таковых, которые описаны и определены в формуле изобретения данной заявки, и которые далее именуются как "соединения настоящего изобретения". Состояние уровня техники, описанное выше, также не показывает фармакологическую активность, которую демонстрируют соединения общей формулы (I) настоящего изобретения. В настоящее время было обнаружено, и это составляет основу настоящего изобретения, что вышеуказанные соединения настоящего изобретения, которые описаны и определены здесь, и которые далее именуются как "соединения настоящего изобретения", обладают неожиданными и полезными свойствами: соединения настоящего изобретения демонстрируют удивительно сбалансированную активность ингибирования фосфатидилинозитол-3-киназы альфа- и бета-изоформ, как показано в биологическом разделе этого документа, которая представляется как отношение PI3K бета IC50/PI3K альфа IC50. Соединения настоящего изобретения, включая соли, метаболиты, сольваты, сольваты солей, гидраты, и их стереоизомерные формы, демонстрируют антипролиферативную активность и, таким образом,являются пригодными для предотвращения или лечения нарушений, связанных с гиперпролиферацией: в частности, поэтому вышеуказанные соединения общей формулы (I) настоящего изобретения можно применять для лечения или профилактики заболеваний неконтролируемого(-ой) роста клеток, пролиферации и/или жизнеспособности, неподходящих клеточных иммунных ответов, или неподходящих клеточных воспалительных ответов, или заболеваний, которые сопровождаются неконтролируемым(-ой) ростом клеток, пролиферацией и/или жизнеспособностью, неподходящими клеточными иммунными ответами,или неподходящими клеточными воспалительными ответами, в частности, когда неконтролируемый(-ая) рост клеток, пролиферация и/или жизнеспособность, неподходящие клеточные иммунные ответы, или неподходящие клеточные воспалительные ответы опосредуется PI3K путем, таких как, например, гематологические опухоли, солидные опухоли, и/или их метастазы, например лейкемии и миелодиспластический синдром, злокачественные лимфомы, опухоли головы и шеи, включая опухоли головного мозга и метастазы в головной мозг, опухоли грудной клетки, включая немелкоклеточные и мелкоклеточные опухоли легкого, гастроинтестинальные опухоли, эндокринные опухоли, опухоли молочной железы и другие гинекологические опухоли, урологические опухоли, включая опухоли почек, мочевого пузыря и предстательной железы, опухоли кожи, и саркомы, и/или их метастазы. Описание изобретения Один вариант осуществления изобретения охватывает соединение, имеющее общую формулу (I) необязательно замещенный 1, 2 или 3 R6 группами,в которойозначает точку присоединения указанного гетероарила к остатку соединения общей формулы (I),X означает N или C-R6,X' означает О, S, NH, N-R6, N или C-R6,при условии, что когда X и X' оба означают C-R6, то один C-R6 означает С-Н;R5 и R5' являются одинаковыми или разными и означают, независимо друг от друга, атом водорода,или C1-С 6-алкил, С 3-С 6-циклоалкил-С 1-С 6-алкил или C1-С 6-алкокси-С 1-С 6-алкил, илиR5 и R5', взятые вместе с атомом азота, к которому они присоединены, означают 3-7-членное азотсодержащее гетероциклическое кольцо, которое необязательно содержит по меньшей мере один дополнительный гетероатом, выбранный из кислорода, азота или серы, и которое необязательно может быть замещено 1 или несколькими группами R6; в каждом случае R6 может быть одинаковым или разным и независимо означает атом водорода,атом галогена, C1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 6-циклоалкил, С 3-С 6-циклоалкил-С 1-С 6 алкил, арил, арил-С 1-С 6-алкил, гетероарил, гетероарил-С 1-С 6-алкил, 3-8-членное гетероциклическое кольцо, 3-8-членный гетероциклил-С 1-С 6-алкил, -C1-C6-алкил-OR7, -С 1-С 6-алкил-SR7, -С 1-C6-алкилN(R7)(R7'), -C1-C6-алкил-C(=O)R7, -CN, -C(=O)OR7, -C(=O)N(R7)(R7'), -OR7, -SR7, -N(R7)(R7'), или-NR7C(=O)R7, каждый из которых необязательно может быть замещен 1 или несколькими группами R8; в каждом случае R6 может быть одинаковым или разным и независимо означает С 1-С 6-алкил, С 3-С 6 циклоалкил-С 1-С 6-алкил или С 1-С 6-алкил-OR7; в каждом случае R7 и R7' могут быть одинаковыми или разными и независимо означают атом водорода или С 1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 6-циклоалкил, С 3-С 6-циклоалкил-С 1-С 6-алкил,С 3-С 6-циклоалкенил, арил, арил-С 1-С 6-алкил, гетероарил, 3-8-членное гетероциклическое кольцо, 3-8 членный гетероциклил-С 1-С 6-алкил или гетероарил-С 1-С 6-алкил; в каждом случае R8 независимо означает атом галогена или нитро, гидрокси, циано, формил, ацетил, амино, C1-С 6-алкил, C1-С 6-алкокси, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 6-циклоалкил, С 3-С 6 циклоалкил-С 1-С 6-алкил, С 1-С 6-циклоалкенил, арил, арил-С 1-С 6-алкил, гетероарил, 3-8-членное гетероциклическое кольцо, гетероциклил-С 1-С 6-алкил или гетероарил-С 1-С 6-алкил;n означает целое число 1 и m означает целое число 1; при условии, что когда указанные R5 и R5', взятые вместе с атомом азота, к которому они присоединены, означают в которойозначает точку присоединения к остатку структуры общей формулы (I),тогда указанный R2 гетероарил структуры-5 024406 в которойозначает точку присоединения к остатку структуры общей формулы (I). или его стереоизомер, таутомер, N-оксид, гидрат, сольват или соль, в частности физиологически приемлемую соль, или смесь таковых. Определения Термины, как указано в настоящем тексте, предпочтительно имеют следующие значения. Термин "атом галогена" или "галоген" следует понимать как означающий атом фтора, хлора, брома или йода. Термин "C1-С 6-алкил" следует понимать как предпочтительно означающий линейную или разветвленную, насыщенную, моновалентную углеводородную группу, содержащую 1, 2, 3, 4, 5 или 6 атомов углерода, например, метильную, этильную, пропильную, бутильную, пентильную, гексильную, изопропильную, изо-бутильную, втор-бутильную, трет-бутильную, изо-пентильную, 2-метилбутильную, 1 метилбутильную, 1-этилпропильную, 1,2-диметилпропильную, нео-пентильную, 1,1-диметилпропильную, 4-метилпентильную, 3-метилпентильную, 2-метилпентильную, 1-метилпентильную, 2-этилбутильную, 1-этилбутильную, 3,3-диметилбутильную, 2,2-диметилбутильную, 1,1-диметилбутильную, 2,3 диметилбутильную, 1,3-диметилбутильную, или 1,2-диметилбутильную группу, или ее изомер. В частности, вышеуказанная группа содержит 1, 2 или 3 атома углерода ("С 1-С 3-алкил"), означая метил, этил, нпропил- или изо-пропил. Термин "C1-С 6-алкокси" следует понимать как предпочтительно означающий линейную или разветвленную, насыщенную, моновалентную, углеводородную группу формулы -О-алкил, в которой термин "алкил" определен выше, например метокси, этокси, н-пропокси, изо-пропокси, н-бутокси, изобутокси, трет-бутокси, втор-бутокси, пентокси, изо-пентокси или н-гексоксигруппу, или ее изомер. Термин "С 1-С 6-алкокси-С 1-С 6-алкил" следует понимать как предпочтительно означающий линейную или разветвленную, насыщенную, моновалентную алкильную группу, как определено выше, в которой один или несколько атомов водорода заменены, одинаково или по-разному, С 1-С 6-алкоксигруппой,как определено выше, например метоксиалкильную, этоксиалкильную, пропилоксиалкильную, изопропоксиалкильную, бутоксиалкильную, изо-бутоксиалкильную, трет-бутоксиалкильную, втор-бутоксиалкильную, пентилоксиалкильную, изо-пентилоксиалкильную, гексилоксиалкильную группу, в которой термин "C1-С 6-алкил" определен выше, или ее изомер. Термин "С 2-С 6-алкенил" следует понимать как предпочтительно означающий линейную или разветвленную, моновалентную углеводородную группу, которая содержит одну или несколько двойных связей и которая содержит 2, 3, 4, 5 или 6 атомов углерода, в частности 2 или 3 атома углерода ("С 2-С 3 алкенил"), при этом следует понимать, что в случае, при котором вышеуказанная алкенильная группа содержит более чем одну двойную связь, указанные двойные связи могут располагаться отдельно друг от друга или быть сопряженными друг с другом. Вышеуказанная алкенильная группа означает, например,винильную, аллильную, (Е)-2-метилвинильную, (Z)-2-метилвинильную, гомоаллильную, (Е)-бут-2 енильную, (Z)-бут-2-енильную, (Е)-бут-1-енильную, (Z)-бут-1-енильную, пент-4-енильную, (Е)-пент-3 енильную, (Z)-пент-3-енильную, (Е)-пент-2-енильную, (Z)-пент-2-енильную, (Е)-пент-1-енильную, (Z)пент-1-енильную, гекс-5-енильную, (Е)-гекс-4-енильную, (Z)-гекс-4-енильную, (Е)-гекс-3-енильную, (Z)гекс-3-енильную, (Е)-гекс-2-енильную, (Z)-гекс-2-енильную, (Е)-гекс-1-енильную, (Z)-гекс-1-енильную,изопропенильную, 2-метилпроп-2-енильную, 1-метилпроп-2-енильную, 2-метилпроп-1-енильную, (Е)-1 метилпроп-1-енильную, (Z)-1-метилпроп-1-енильную, 3-метилбут-3-енильную, 2-метилбут-3-енильную,1-метилбут-3-енильную, 3-метилбут-2-енильную, (Е)-2-метилбут-2-енильную, (Z)-2-метилбут-2-енильную, (Е)-1-метилбут-2-енильную, (Z)-1-метилбут-2-енильную, (Е)-3-метилбут-1-енильную, (Z)-3-метилбут-1-енильную, (Е)-2-метилбут-1-енильную, (Z)-2-метилбут-1-енильную, (Е)-1-метилбут-1-енильную,(Z)-1-метилбут-1-енильную, 1,1-диметилпроп-2-енильную, 1-этилпроп-1-енильную, 1-пропилвинильную,1-изопропилвинильную, 4-метилпент-4-енильную, 3-метилпент-4-енильную, 2-метилпент-4-енильную, 1 метилпент-4-енильную, 4-метилпент-3-енильную, (Е)-3-метилпент-3-енильную, (Z)-3-метилпент-3 енильную, (Е)-2-метилпент-3-енильную, (Z)-2-метилпент-3-енильную, (Е)-1-метилпент-3-енильную, (Z)1-метилпент-3-енильную, (Е)-4-метилпент-2-енильную, (Z)-4-метилпент-2-енильную, (Е)-3-метилпент-2 енильную, (Z)-3-метилпент-2-енильную, (Е)-2-метилпент-2-енильную, (Z)-2-метилпент-2-енильную, (Е)1-метилпент-2-енильную, (Z)-1-метил пент-2-енильную, (Е)-4-метилпент-1-енильную, (Z)-4-метилпент-1 енильную, (Е)-3-метилпент-1-енильную, (Z)-3-метил пент-1-енильную, (Е)-2-метилпент-1-енильную, (Z)2-метилпент-1-енильную, (Е)-1-метилпент-1-енильную, (Z)-1-метилпент-1-енильную, 3-этилбут-3 енильную, 2-этилбут-3-енильную, 1-этилбут-3-енильную, (Е)-3-этилбут-2-енильную, (Z)-3-этилбут-2 енильную, (Е)-2-этилбут-2-енильную, (Z)-2-этилбут-2-енильную, (Е)-1-этилбут-2-енильную, (Z)-1 этилбут-2-енильную, (Е)-3-этилбут-1-енильную, (Z)-3-этилбут-1-енильную, 2-этилбут-1-енильную, (Е)-1 этилбут-1-енильную, (Z)-1-этилбут-1-енильную, 2-пропилпроп-2-енильную, 1 -пропилпроп-2-енильную,2-изопропилпроп-2-енильную, 1-изопропилпроп-2-енильную, (Е)-2-пропилпроп-1-енильную, (Z)-2 пропилпроп-1-енильную, (Е)-1-пропил проп-1-енильную, (Z)-1-пропил проп-1-енильную, (Е)-2 изопропилпроп-1-енильную, (Z)-2-изопропилпроп-1-енильную, (Е)-1-изопропил проп-1-енильную, (Z)-1 изопропил проп-1-енил ьную, (Е)-3,3-диметил проп-1-енильную, (Z)-3,3-диметилпроп-1-енильную, 1(1,1-диметилэтил)этенильную, бута-1,3-диенильную, пента-1,4-диенильную, гекса-1,5-диенильную или-6 024406 метилгексадиенильную группу. В частности, вышеуказанная группа представляет собой винил или аллил. Термин "С 2-С 6-алкинил" следует понимать как предпочтительно означающий линейную или разветвленную, моновалентную углеводородную группу, которая содержит один или несколько тройных связей и которая содержит 2, 3, 4, 5 или 6 атомов углерода, в частности 2 или 3 атома углерода ("С 2-С 3 алкинил"). Вышеуказанная С 2-С 6-алкинильная группа означает, например, этинильную, проп-1 инильную, проп-2-инильную, бут-1-инильную, бут-2-инильную, бут-3-инильную, пент-1-инильную,пент-2-инильную, пент-3-инильную, пент-4-инильную, гекс-1-инильную, гекс-2-инильную, гекс-3 инильную, гекс-4-инильную, гекс-5-инильную, 1-метилпроп-2-инильную, 2-метилбут-3-инильную, 1 метилбут-3-инильную, 1-метилбут-2-инильную, 3-метилбут-1-инильную, 1-этилпроп-2-инильную, 3 метилпент-4-инильную, 2-метилпент-4-инильную, 1-метилпент-4-инильную, 2-метилпент-3-инильную,1-метилпент-3-инильную, 4-метилпент-2-инильную, 1-метилпент-2-инильную, 4-метилпент-1-инильную,3-метилпент-1-инильную, 2-этилбут-3-инильную, 1-этилбут-3-инильную, 1-этилбут-2-инильную, 1 пропил проп-2-инильную, 1-изопропил проп-2-инильную, 2,2-диметилбут-3-инильную, 1,1-диметилбут 3-инильную, 1,1-диметилбут-2-инильную, или 3,3-диметилбут-1-инильную группу. В частности, вышеуказанная алкинильная группа представляет собой этинил, проп-1-инил или проп-2-инил. Термин "С 3-С 6-циклоалкил" следует понимать как предпочтительно означающий насыщенное, моновалентное, моно- или бициклическое углеводородное кольцо, которое содержит 3, 4, 5 или 6 атомов углерода. Вышеуказанная С 3-С 6-циклоалкильная группа означает, например, моноциклическое углеводородное кольцо, например циклопропильную, циклобутильную, циклопентильную, или циклогексильную группу, или бициклическое углеводородное кольцо, например пергидропентаениленовое или декалиновое кольцо. Вышеуказанное циклоалкильное кольцо необязательно может содержать одну или несколько двойных связей, например означать циклоалкенил, такой как циклопропенильная, циклобутенильная,циклопентенильная или циклогексенильная группа, причем связь между указанным кольцом и остатком молекулы может осуществляться через любой атом углерода указанного кольца, будь оно насыщенным или ненасыщенным. Термин "алкилен" понимают как предпочтительно означающий необязательно замещенную углеводородную цепь (или "линкер"), содержащую 1, 2, 3, 4, 5 или 6 атомов углерода, то есть необязательно замещенную -СН 2- ("метилен" или "одночленный линкер" или, например -С(Ме)2-), -СН 2-СН 2- ("этилен","диметилен" или "двучленный линкер"), -СН 2-СН 2-СН 2- ("пропилен", "триметилен" или "тричленный линкер"), -СН 2-СН 2-СН 2-СН 2- ("бутилен", "тетраметилен" или "четырехчленный линкер"), -СН 2-СН 2 СН 2-СН 2-СН 2- ("пентилен", "пентаметилен" или "пятичленный линкер") или -СН 2-СН 2-СН 2-СН 2-СН 2 СН 2- ("гексилен", "гексаметилен" или шестичленный линкер") группу. В частности, вышеуказанный алкиленовый линкер содержит 1, 2, 3, 4 или 5 атомов углерода, более предпочтительно 1 или 2 атома углерода. Термин "3-8-членный гетероциклоалкил", следует понимать как означающий насыщенное, моновалентное, моно- или бициклическое углеводородное кольцо, которое содержит 2, 3, 4, 5, 6 или 7 атомов углерода, и одну или несколько содержащих гетероатом групп, выбранных из С(=О), О, S, S(=O), S(=O)2,NRa, в которой Ra означает атом водорода, или С 1-С 6-алкильную или галоген-С 1-С 6-алкильную группу; причем возможно, чтобы вышеуказанная гетероциклоалкильная группа была присоединена к остатку молекулы через любой один из атомов углерода или, если присутствует, атом азота. В частности, вышеуказанный 3-8-членный гетероциклоалкил может содержать 2, 3, 4, 5, 6 или 7 атомов углерода, и одну или несколько вышеупомянутых содержащих гетероатом групп ("3-8-членный гетероциклоалкил"), более предпочтительно вышеуказанный гетероциклоалкил может содержать 4 или 5 атомов углерода, и одну или несколько вышеупомянутых содержащих гетероатом групп ("5-7-членный гетероциклоалкил"). В частности, не ограничиваясь указанным, вышеуказанный гетероциклоалкил может, например,быть 4-членным кольцом, таким как азетидинил, оксетанил, или 5-членным кольцом, таким как тетрагидрофуранил, диоксолинил, пирролидинил, имидазолидинил, пиразолидинил, пирролинил, или 6 членным кольцом, таким как тетрагидропиранил, пиперидинил, морфолинил, дитианил, тиоморфолинил,пиперазинил, или тритианил, или 7-членным кольцом, таким как диазепанильное кольцо. Необязательно,вышеуказанный гетероциклоалкил может быть бензоконденсированным. Вышеуказанный гетероциклил может, например, быть бициклическим,таким как, не ограничиваясь указанным, 5,5-членное кольцо, например гексагидроциклопента[с]пиррол-2(1 Н)-ильное кольцо, или 5,6 членное бициклическое кольцо, например гексагидропирроло[1,2-а]пиразин-2(1 Н)-ильное кольцо, или 8 окса-3-азабицикло[3.2.1]окт-3-ильное кольцо. Как упоминалось выше, вышеуказанное содержащее атом азота кольцо может, например, быть частично ненасыщенным, то есть оно может содержать одну или несколько двойных связей, таким как, не ограничиваясь указанным, 2,5-дигидро-1 Н-пирролильное, 4 Н-[1,3,4]тиадиазинильное, 4,5-дигидрооксазолильное, или 4 Н-[1,4]тиазинильное кольцо, или оно может, например, быть бензоконденсированным,таким как, не ограничиваясь указанным, дигидроизохинолинильное кольцо. Термин "арил" следует понимать как предпочтительно означающий моновалентное, ароматическое-7 024406 или частично ароматическое, моно-, или би-, или трициклическое углеводородное кольцо, содержащее 6,7, 8, 9, 10, 11, 12, 13 или 14 атомов углерода ("С 6-С 14-арильную" группу), в частности кольцо, содержащее 6 атомов углерода ("С 6-арильную" группу), например, фенильную группу; или бифенильную группу,или кольцо, содержащее 9 атомов углерода ("С 9-арильную" группу), например, инданильную или инденильную группу, или кольцо, содержащее 10 атомов углерода ("С 10-арильную" группу), например, тетралинильную, дигидронафтильную или нафтильную группу, или кольцо, содержащее 13 атомов углерода,("С 13-арильную" группу), например, флуоренильную группу, или кольцо, содержащее 14 атомов углерода, ("С 14-арильную" группу), например, антранильную группу. Отдельным примером арильной группы является одна из следующих возможных структур: в которых z означает О, S, NH или N(С 1-С 6-алкил) иуказывает точку присоединения вышеуказанный арильной группы к остатку молекулы. Термин "гетероарил" понимают как предпочтительно означающий моновалентную, моноциклическую-, бициклическую- или трициклическую ароматическую кольцевую систему, которая содержит 5, 6,7, 8, 9, 10, 11, 12, 13 или 14 кольцевых атомов ("5-14-членную гетероарильную" группу), в частности 5,или 6, или 9, или 10 атомов, и которая содержит по меньшей мере один гетероатом, причем, в случае,если содержится несколько гетероатомов, они могут быть одинаковыми или разными, и причем вышеуказанный гетероатом является таким как кислород, азот или сера, и, кроме того, гетероарил в каждом случае может быть бензоконденсированным. В частности, вышеуказанный гетероарил имеет структуру необязательно замещенную 1, 2 или 3 R6 группами,в которойозначает точку присоединения указанного гетероарила к остатку соединения общей формулы (I),как определено выше,X означает N или C-R6,X' означает О, S, NH, N-R6, N или C-R6,в каждом случае R6 может быть одинаковым или разным и независимо означает атом водорода,атом галогена, С 1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 6-циклоалкил, С 3-С 6-циклоалкил-С 1-С 6 алкил, арил, арил-С 1-С 6-алкил, гетероарил, гетероарил-С 1-С 6-алкил, 3-8-членное гетероциклическое кольцо, 3-8-членный гетероциклил-С 1-С 6-алкил, -C1-С 6-алкил-OR7, -C1-C6-алкил-SR7, -C1-C6-алкилN(R7)(R7'), -C1-С 6-алкил-C(=O)R7, -CN, -C(=O)OR7, -C(=O)N(R7)(R7'), -OR7, -SR7, -N(R7)(R7') или-NR7C(=O)R7, каждый из которых необязательно может быть замещен 1 или несколькими группами R8; в каждом случае R7 и R7' могут быть одинаковыми или разными и независимо означают атом водорода, или С 1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 6-циклоалкил, С 3-С 6-циклоалкил-С 1-С 6-алкил,С 3-С 6-циклоалкенил, арил, арил-С 1-С 6-алкил, гетероарил, 3-8-членное гетероциклическое кольцо, 3-8 членный гетероциклил-С 1-С 6-алкил, или гетероарил-С 1-С 6-алкил; в каждом случае R8 независимо означает атом галогена или нитро, гидрокси, циано, формил, ацетил, амино, С 1-С 6-алкил, C1-С 6-алкокси, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 6-циклоалкил, С 3-С 6 циклоалкил-C1-С 6-алкил, C1-С 6-циклоалкенил, арил, арил-С 1-С 6-алкил, гетероарил, 3-8-членное гетероциклическое кольцо, гетероциклил-С 1-С 6-алкил или гетероарил-С 1-С 6-алкил. Более предпочтительно, вышеуказанный гетероарил выбирают из тиенила, фуранила, пирролила,оксазолила, тиазолила, имидазолила, пиразолила, изоксазолила, изотиазолила, оксадиазолила, триазолила, тиадиазолила, тиа-4 Н-пиразолила и т.д., и их бензопроизводных, таких как, например, бензофуранил,бензотиенил, бензоксазолил, бензизоксазолил, бензимидазолил, бензотриазолил, индазолил, индолил,изоиндолил, и т.д.; или пиридила, пиридазинила, пиримидинила, пиразинила, триазинила, и т.д., и их бензо-производных, таких как, например, хинолинил, хиназолинил, изохинолинил, и т.д.; или азоцинила,индолизинила, пуринила, и т.д., и их бензопроизводных; или циннолинила, фталазинила, хиназолинила,хиноксалинила, нафтпиридинила, птеридинила, карбазолила, акридинила, феназинила, фенотиазинила,феноксазинила, ксантенила или оксепинила и т.д. В общем, и если не оговорено противное, гетероарильные или гетероариленовые радикалы включают все их возможные изомерные формы, например их позиционные изомеры. Таким образом, к качестве некоторых иллюстративных неограничивающих примеров термин пиридинил или пиридинилен включает пиридин-2-ил, пиридин-2-илен, пиридин-3-ил, пиридин-3-илен, пиридин-4-ил и пиридин-4 илен; или термин тиенил или тиенилен включает тиен-2-ил, тиен-2-илен, тиен-3-ил и тиен-3-илен. Термин "C1-C6", используемый по всему данному тексту, например в контексте определения "С 1-С 6 алкила" или "C1-С 6-алкокси", следует понимать как означающий алкильную группу, содержащую огра-8 024406 ниченное число атомов углерода - от 1 до 6, то есть 1, 2, 3, 4, 5 или 6 атомов углерода. Более того, следует понимать, что вышеуказанный термин "C1-С 6" следует интерпретировать как любой поддиапазон, содержащийся в нем, например C1-С 6, С 2-С 5, С 3-С 4, С 1-С 2, С 1-С 3, C1-C4, С 1-С 5, С 1-С 6; в частности С 1-С 2, С 1 С 3, C1-C4, С 1-С 5, C1-C6; более предпочтительно С 1-С 4; в случае "C1-С 6-галогеналкил" или "C1-С 6 галогеналкокси" еще более предпочтительно С 1-С 2. Подобным образом, как используется здесь, термин "С 2-С 6", используемый по всему данному тексту, например в контексте определений "С 2-С 6-алкенил" и "С 2-С 6-алкинил", следует понимать как означающий алкенильную группу или алкинильную группу, содержащую ограниченное число атомов углерода - от 2 до 6, то есть 2, 3, 4, 5 или 6 атомов углерода. Более того, следует понимать, что вышеуказанный термин "С 2-С 6" следует интерпретировать как любой поддиапазон, содержащийся в нем, например С 2-С 6, С 3-С 5, С 3-С 4, С 2-С 3, С 2-С 4, С 2-С 5; в частности С 2-С 3. Кроме того, как используется здесь, термин "С 3-С 6", используемый по всему данному тексту, например в контексте определения "С 3-С 6-циклоалкил", следует понимать как означающий циклоалкильную группу, содержащую ограниченное число атомов углерода - от 3 до 6, то есть 3, 4, 5 или 6 атомов углерода. Более того, следует понимать, что вышеуказанный термин "С 3-С 6" следует интерпретировать как любой поддиапазон, содержащийся в нем, например С 3-С 6, С 4-С 5, С 3-С 5, С 3-С 4, С 4-С 6, С 5-С 6; в частности С 3-С 6. Термин "замещенный" означает, что один или несколько атомов водорода на обозначенном атоме заменено на вариант, выбранный из указанной группы, при условии что нормальная валентность обозначенного атома в существующих условиях не превышена, и что замещение приводит к образованию стабильного соединения. Комбинации заместителей и/или переменных допустимы, только если такие комбинации приводят к образованию стабильных соединений. Термин "необязательно замещенный" означает необязательное замещение указанными группами,радикалами или фрагментами. Заместитель кольцевой системы означает заместитель, присоединенный к ароматической или неароматической кольцевой системы, который, например, замещает подходящий атом водорода в кольцевой системе. Используемый здесь термин "один или несколько раз", например в определении заместителей соединений общих формул настоящего изобретения, понимают как означающий "один, два, три, четыре или пять раз, в частности один, два, три или четыре раза, более предпочтительно один, два или три раза,еще более предпочтительно один или два раза". При использовании в данной заявке множественной формы слов, например, терминов соединения,соли, полиморфы, гидраты, сольваты и т.п., также подразумевается и отдельное соединение, соль, полиморф, изомер, гидрат, сольват или т.п. Под "стабильным соединением" или "стабильной структурой" подразумевают соединение, которое является в достаточной мере устойчивым, чтобы выдержать выделение с нужной степенью чистоты из реакционной смеси, и превращение в эффективное терапевтическое средство. Термин "карбонил" относится к атому кислорода, присоединенному к атому углерода молекулы двойной связью. Соединения настоящего изобретения могут содержать один или несколько асимметричных центров,в зависимости от положения и природы различных желательных заместителей. Асимметричные углеродные атомы могут присутствовать в (R)- или (S)-конфигурации, что приводит к образованию рацемических смесей в случае единственного асимметричного центра и диастереомерных смесей в случае множественных асимметричных центров. В определенных случаях асимметрия может также присутствовать изза ограниченного вращения вокруг данной связи, например, центральной связи, примыкающей к двум замещенным ароматическим кольцам указанных соединений. Заместители на кольце могут также присутствовать или в цис- или в транс-форме. Считается, что все такие конфигурации (включая энантиомеры и диастереомеры), включены в рамки настоящего изобретения. Предпочтительными соединениями являются те, которые демонстрируют более желательную биологическую активность. Отделенные, чистые или частично очищенные изомеры и стереоизомеры или рацемические или диастереомерные смеси соединений настоящего изобретения также включены в рамки настоящего изобретения. Очистка и разделение таких веществ могут быть достигнуты стандартными методами, известными в уровне техники. Таутомеры, иногда именуемые как протон-сдвиговые таутомеры, представляют собой два или несколько соединения(-й), которые связаны миграцией атома водорода, сопровождаемой переносом одной или нескольких простых связей и одной или нескольких расположенных рядом двойных связей. Соединения настоящего изобретения могут существовать в одной или нескольких таутомерных формах. Например, соединение формулы I может существовать в таутомерной форме Ia, таутомерной форме Ib или таутомерной форме Ic, или может существовать в виде смеси любых этих форм. Предполагается, что все такие таутомерные формы включатся в объем настоящего изобретения. Настоящее изобретение также касается пригодных форм соединений, раскрытых авторами, таких как фармацевтически приемлемые соли, ко-преципитаты, метаболиты, гидраты, сольваты и пролекарства всех соединений из примеров. Термин "фармацевтически приемлемая соль" касается относительно нетоксичной аддитивной соли неорганической или органической кислоты и соединения настоящего изобретения(см., например, S.M. Berge и др. "Pharmaceutical Salts," J. Pharm. Sci. 1977, 66, 1-19). Фармацевтически приемлемые соли включают полученные путем реакции главного соединения, функционирующего как основание, с неорганической или органической кислотой для образования соли, например, соли соляной кислоты, серной кислоты, фосфорной кислоты, метансульфоновой кислоты, камфорсульфоновой кислоты, щавелевой кислоты, малеиновой кислоты, янтарной кислоты и лимонной кислоты. Фармацевтически приемлемые соли также включают те, в которых главное соединение функционирует как кислота и реагирует с соответствующим основанием для образования, например, соли натрия, калия, кальция, магния, аммония и хлорина. Квалифицированные специалисты в данной области далее признают,что кислотно-аддитивные соли указанных в формуле соединений могут быть получены путем реакции соединений с соответствующей неорганической или органической кислотой с помощью любого из многих известных методов. Альтернативно, соли щелочных и щлочно-земельных металлов кислотных соединений изобретения получают путем реакции соединений изобретения с соответствующим основанием с помощью многих известных методов. Характерные соли соединений этого изобретения включают обычные нетоксичные соли и соли четвертичного аммония, которые образованы, например, из неорганических или органических кислот или оснований способами, известными в данной области. Например, такие кислотно-аддитивные соли включают ацетат, адипат, альгинат, аскорбат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, цитрат,камфорат, камфорсульфонат, циннамат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, фумарат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, хлорид, бромид,йодид, 2-гидроксиэтансульфонат, итаконат, лактат, малеат, манделат, метансульфонат, 2-нафталенсульфонат, никотинат, нитрат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат,пропионат, сукцинат, сульфонат, сульфат, тартрат, тиоцианат, тозилат и ундеканоат. Основные соли включают соли щелочных металлов, такие как соли калия и натрия, соли щлочноземельных металлов, такие как соли кальция и магния, и соли аммония и органических оснований, таких как дициклогексиламин и N-метил-D-глюкамин. Кроме того, основные азот-содержащие группы могут быть превращены в четвертичные с помощью таких средств, как низшие алкилгалогениды, такие как метил-, этил-, пропил- или бутилхлориды, бромиды и йодиды; диалкилсульфаты, такие как диметил-,диэтил-, дибутилсульфат или диамилсульфаты, длинноцепочечные галогениды, такие как децил-, лаурил-, миристил- и стеарилхлориды, бромиды и йодиды, аралкилгалогениды, такие как бензил- и фенэтилбромиды и другие. Сольват с целью этого изобретения представляет собой комплекс растворителя и соединения изобретения в твердом состоянии. Характерные сольваты включали бы, без ограничения перечисленным,комплексы соединения изобретения с этанолом или метанолом. Гидраты представляют собой определенную форму сольвата, в котором растворитель - вода. В предпочтительном варианте изобретение охватывает соединение формулы (I), где в которойозначает точку присоединения указанного гетероарила к остатку структуры общей формулы (I);R5 и R5' являются одинаковыми или разными и означают, независимо друг от друга, атом водорода,или С 1-С 6-алкил, С 3-С 6-циклоалкил-С 1-С 6-алкил или С 1-С 6-алкокси-С 1-С 6-алкил, илиR5 и R5', взятые вместе с атомом азота, к которому они присоединены, означают 3-7-членное азотсодержащее гетероциклическое кольцо, которое необязательно содержит по меньшей мере один дополнительный гетероатом, выбранный из кислорода, азота или серы, и которое необязательно может быть замещено 1 или несколькими группами R6';- 10024406 в каждом случае R6 может быть одинаковым или разным и независимо означает атом водорода,атом галогена, С 1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 6-циклоалкил, С 3-С 6-циклоалкил-С 1-С 6 алкил, арил, арил-С 1-С 6-алкил, гетероарил, гетероарил-С 1-С 6-алкил, 3-8-членное гетероциклическое кольцо, 3-8-членный гетероциклил-С 1-С 6-алкил, -С 1-С 6-алкил-OR7, -С 1-С 6-алкил-SR7, -C1-C6-алкилN(R7)(R7'), -С 1-С 6-алкил-С(=О)R7, -CN, -C(=O)OR7, -C(=O)N(R7)(R7'), -OR7, -SR7, -N(R7)(R7'), или-NR7C(=O)R7, каждый из которых необязательно может быть замещен 1 или несколькими группами R8; в каждом случае R6' может быть одинаковым или разным и независимо означает C1-С 6-алкил, С 3-С 6 циклоалкил-С 1-С 6-алкил или С 1-С 6-алкил-OR7; в каждом случае R7 и R7' могут быть одинаковыми или разными и независимо означают атом водорода, или С 1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 6-циклоалкил, С 3-С 6-циклоалкил-С 1-С 6-алкил,С 3-С 6-циклоалкенил, арил, арил-С 1-С 6-алкил, гетероарил, 3-8-членное гетероциклическое кольцо, 3-8 членный гетероциклил-С 1-С 6-алкил или гетероарил-С 1-С 6-алкил; в каждом случае R8 независимо означает атом галогена, или нитро, гидрокси, циано, формил, ацетил, амино, С 1-С 6-алкил, C1-С 6-алкокси, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 6-циклоалкил, С 3-С 6 циклоалкил-С 1-С 6-алкил, C1-C6-циклоалкенил, арил, арил-С 1-С 6-алкил, гетероарил, 3-8-членное гетероциклическое кольцо, гетероциклил-С 1-С 6-алкил или гетероарил-С 1-С 6-алкил;n означает целое число 1 и m означает целое число 1; при условии, что когда указанные R5 и R5', взятые вместе с атомом азота, к которому они присоединены, означают в которойозначает точку присоединения к остатку структуры общей формулы (I),тогда указанный R2 гетероарил структуры в которойозначает точку присоединения к остатку структуры общей формулы (I); или его стереоизомер, таутомер, N-оксид, гидрат, сольват или соль, в частности физиологически приемлемую соль, или смесь таковых. В другом предпочтительном варианте изобретение охватывает соединение формулы (I), где в которойозначает точку присоединения указанного гетероарила к остатку структуры общей формулы (I);R5 и R5 являются одинаковыми или разными и означают, независимо друг от друга, атом водорода,или C1-С 6-алкил, С 3-С 6-циклоалкил-С 1-С 6-алкил или С 1-С 6-алкокси-C1-С 6-алкил,илиR5 и R5', взятые вместе с атомом азота, к которому они присоединены, означают 3-7-членное азотсодержащее гетероциклическое кольцо, которое необязательно содержит по меньшей мере один дополнительный гетероатом, выбранный из кислорода, азота или серы, и которое необязательно может быть замещено 1 или несколькими группами R6'; в каждом случае R6 может быть одинаковым или разным и независимо означает атом водорода,атом галогена, С 1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 6-циклоалкил, С 3-С 6-циклоалкил-С 1-С 6 алкил, арил, арил-С 1-С 6-алкил, гетероарил, гетероарил-С 1-С 6-алкил, 3-8-членное гетероциклическое кольцо, 3-8-членный гетероциклил-С 1-С 6-алкил, -С 1-С 6-алкил-OR7, -С 1-С 6-алкил-SR7, -C1-C6-алкилN(R7)(R7'), -C1-C6-алкил-C(=O)R7, -CN, -C(=O)OR7, -C(=O)N(R7)(R7'), -OR7, -SR7, -N(R7)(R7) или-NR7C(=O)R7, каждый из которых необязательно может быть замещен 1 или несколькими группами R8;- 11024406 в каждом случае R6' может быть одинаковым или разным и независимо означает С 1-С 6-алкил, С 3-С 6 циклоалкил-С 1-С 6-алкил или С 1-С 6-алкил-OR7; в каждом случае R7 и R7' могут быть одинаковыми или разными и независимо означают атом водорода или C1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 6-циклоалкил, С 3-С 6-циклоалкил-С 1-С 6-алкил,С 3-С 6-циклоалкенил, арил, арил-C1-С 6-алкил, гетероарил, 3-8-членное гетероциклическое кольцо, 3-8 членный гетероциклил-С 1-С 6-алкил или гетероарил-С 1-С 6-алкил; в каждом случае R8 независимо означает атом галогена, или нитро, гидрокси, циано, формил, ацетил, амино, C1-С 6-алкил, C1-С 6-алкокси, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 6-циклоалкил, С 3-С 6 циклоалкил-С 1-С 6-алкил, С 1-С 6-циклоалкенил, арил, арил-С 1-С 6-алкил, гетероарил, 3-8-членное гетероциклическое кольцо, гетероциклил-С 1-С 6-алкил, или гетероарил-С 1-С 6-алкил;n означает целое число 1 и m означает целое число 1; при условии, что когда указанные R5 и R5', взятые вместе с атомом азота, к которому они присоединены, означают в которойозначает точку присоединения к остатку структуры общей формулы (I), тогда указанный R2 гетероарил структуры в которойозначает точку присоединения к остатку структуры общей формулы (I); или его стереоизомер, таутомер, N-оксид, гидрат, сольват или соль, в частности физиологически приемлемую соль, или смесь таковых. В еще одном предпочтительном варианте изобретение охватывает соединение формулы (I), где в которой:означает точку присоединения указанного гетероарила к остатку структуры общей формулы (I), иR5 и R5' являются одинаковыми или разными и означают, независимо друг от друга, атом водорода,или C1-С 6-алкил, С 3-С 6-циклоалкил-С 1-С 6-алкил или C1-С 6-алкокси-С 1-С 6-алкил, илиR5 и R5', взятые вместе с атомом азота, к которому они присоединены, означают 3-7-членное азотсодержащее гетероциклическое кольцо, которое необязательно содержит по меньшей мере один дополнительный гетероатом, выбранный из кислорода, азота или серы, и которое необязательно может быть замещено 1 или несколькими группами R6'; в каждом случае R6 может быть одинаковым или разным и независимо означает атом водорода,атом галогена, C1-C8-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 6-циклоалкил, С 3-С 6-циклоалкил-С 1-С 6 алкил, арил, арил-С 1-С 6-алкил, гетероарил, гетероарил-С 1-С 6-алкил, 3-8-членное гетероциклическое кольцо, 3-8-членный гетероциклил-С 1-С 6-алкил, -С 1-С 6-алкил-OR7, -С 1-С 6-алкил-SR7, -C1-C6-алкилN(R7)(R7'), -C1-C6-алкил-C(=O)R7, -CN, -C(=O)OR7, -C(=O)N(R7)(R7'), -OR7, -SR7, -N(R7)(R7') или-NR7C(=O)R7, каждый из которых необязательно может быть замещен 1 или несколькими группами R8; в каждом случае R6' может быть одинаковым или разным и независимо означает С 1-С 6-алкил, С 3-С 6 циклоалкил-С 1-С 6-алкил или С 1-С 6-алкил-OR7; в каждом случае R7 и R7' могут быть одинаковыми или разными и независимо означают атом водорода или C1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 6-циклоалкил, С 3-С 6-циклоалкил-С 1-С 6-алкил,С 3-С 6-циклоалкенил, арил, арил-C1-С 6-алкил, гетероарил, 3-8-членное гетероциклическое кольцо, 3-8 членный гетероциклил-С 1-С 6-алкил или гетероарил-С 1-С 6-алкил; в каждом случае R8 независимо означает атом галогена или нитро, гидрокси, циано, формил, аце- 12024406 тил, амино, C1-С 6-алкил, С 1-С 6-алкокси, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 6-циклоалкил, С 3-С 6 циклоалкил-С 1-С 6-алкил, С 1-С 6-циклоалкенил, арил, арил-С 1-С 6-алкил, гетероарил, 3-8-членное гетероциклическое кольцо, гетероциклил-С 1-С 6-алкил или гетероарил-С 1-С 6-алкил;n означает целое число 1 и m означает целое число 1; или его стереоизомер, таутомер, N-оксид, гидрат, сольват или соль, в частности физиологически приемлемую соль, или смесь таковых. В еще одном предпочтительном варианте изобретение охватывает соединение формулы (I), где в которойозначает точку присоединения указанного гетероарила к остатку структуры общей формулы (I), иR5 и R5' являются одинаковыми или разными и означают, независимо друг от друга, атом водорода,или C1-С 6-алкил, С 3-С 6-циклоалкил-С 1-С 6-алкил или C1-С 6-алкокси-С 1-С 6-алкил,илиR5 и R5', взятые вместе с атомом азота, к которому они присоединены, означают 3-7-членное азотсодержащее гетероциклическое кольцо, которое необязательно содержит по меньшей мере один дополнительный гетероатом, выбранный из кислорода, азота или серы, и которое необязательно может быть замещено 1 или несколькими группами R6'; в каждом случае R6 может быть одинаковым или разным и независимо означает атом водорода,атом галогена, С 1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 6-циклоалкил, С 3-С 6-циклоалкил-С 1-С 6 алкил, арил, арил-С 1-С 6-алкил, гетероарил, гетероарил-С 1-С 6-алкил, 3-8-членное гетероциклическое кольцо, 3-8-членный гетероциклил-С 1-С 6-алкил, -С 1-С 6-алкил-OR7, -C1-C6-алкил-SR7, -C1-C6-алкилN(R7)(R7'), -С 1-С 6-алкил-С(=О)R7, -CN, -C(=O)OR7, -C(=O)N(R7)(R7'), -OR7, -SR7, -N(R7)(R7') или-NR7C(=O)R7, каждый из которых необязательно может быть замещен 1 или несколькими группами R8; в каждом случае R6' может быть одинаковым или разным и независимо означает С 1-С 6-алкил, С 3-С 6 циклоалкил-С 1-С 6-алкил или С 1-С 6-алкил-OR7; в каждом случае R7 и R7' могут быть одинаковыми или разными и независимо означают атом водорода, или C1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 6-циклоалкил, С 3-С 6-циклоалкил-С 1-С 6-алкил,С 3-С 6-циклоалкенил, арил, арил-C1-С 6-алкил, гетероарил, 3-8-членное гетероциклическое кольцо, 3-8 членный гетероциклил-С 1-С 6-алкил или гетероарил-С 1-С 6-алкил; в каждом случае R8 независимо означает атом галогена, или нитро, гидрокси, циано, формил, ацетил, амино, С 1-С 6-алкил, C1-С 6-алкокси, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 6-циклоалкил, С 3-С 6 циклоалкил-С 1-С 6-алкил, С 1-С 6-циклоалкенил, арил, арил-С 1-С 6-алкил, гетероарил, 3-8-членное гетероциклическое кольцо, гетероциклил-С 1-С 6-алкил или гетероарил-С 1-С 6-алкил;n означает целое число 1 и m означает целое число 1; или его стереоизомер, таутомер, N-оксид, гидрат, сольват или соль, в частности физиологически приемлемую соль, или смесь таковых. В дополнительном варианте вышеупомянутых аспектов изобретение относится к соединениям формулы (I), гдеR1 означает -(CH2)n-(CHR4)-(CH2)m-N(R5)(R5'). В дополнительном варианте вышеупомянутых аспектов изобретение относится к соединениям формулы (I), где необязательно замещенный 1, 2 или 3 R6 группами,в которойозначает точку присоединения указанного гетероарила к остатку соединения общей формулы (I),X означает N или C-R6,X' означает О, S, NH, N-R6, N или C-R6,при условии, что когда X и X' оба означают C-R6, то один C-R6 означает С-Н. В дополнительном варианте вышеупомянутых аспектов изобретение относится к соединениям- 13024406 формулы (I), где R3 означает метил. В дополнительном варианте вышеупомянутых аспектов изобретение относится к соединениям формулы (I), где R4 означает гидрокси. В дополнительном варианте вышеупомянутых аспектов изобретение относится к соединениям формулы (I), гдеR5 и R5' являются одинаковыми или разными и означают, независимо друг от друга, атом водорода,или C1-С 6-алкил, С 3-С 6-циклоалкил-С 1-С 6-алкил или C1-С 6-алкокси-C1-С 6-алкил,илиR5 и R5', взятые вместе с атомом азота, к которому они присоединены, означают 3-8-членное азотсодержащее гетероциклическое кольцо, которое необязательно содержит по меньшей мере один дополнительный гетероатом, выбранный из кислорода, азота или серы, и которое необязательно может быть замещено 1 или несколькими группами R6. В дополнительном варианте вышеупомянутых аспектов изобретение относится к соединениям формулы (I), где в каждом случае R6 может быть одинаковым или разным и независимо означает атом водорода,атом галогена, C1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 6-циклоалкил, С 3-С 6-циклоалкил-С 1-С 6 алкил, арил, арил-С 1-С 6-алкил, гетероарил, гетероарил-С 1-С 6-алкил, 3-8-членное гетероциклическое кольцо, 3-8-членный гетероциклил-С 1-С 6-алкил, -С 1-С 6-алкил-OR7, -С 1-С 6-алкил-SR7, -С 1-C6-алкилN(R7)(R7'), -С 1-С 6-алкил-С(=О)R7,-CN, -C(=O)OR7, -C(=O)N(R7)(R7'), -OR7, -SR7, -N(R7)(R7') или-NR7C(=O)R7, каждый из которых необязательно может быть замещен 1 или несколькими группами R8. В дополнительном варианте вышеупомянутых аспектов изобретение относится к соединениям формулы (I), где в каждом случае R6' может быть одинаковым или разным и независимо означает C1-С 6-алкил, С 3-С 6 циклоалкил-С 1-С 6-алкил или С 1-С 6-алкил-OR7. В дополнительном варианте вышеупомянутых аспектов, изобретение относится к соединениям формулы (I), где в каждом случае R7 и R7' могут быть одинаковыми или разными и независимо означают атом водорода или С 1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 6-циклоалкил, С 3-С 6-циклоалкил-С 1-С 6-алкил,С 3-С 6-циклоалкенил, арил, арил-C1-С 6-алкил, гетероарил, 3-8-членное гетероциклическое кольцо, 3-8 членный гетероциклил-С 1-С 6-алкил или гетероарил-С 1-С 6-алкил. В дополнительном варианте вышеупомянутых аспектов изобретение относится к соединениям формулы (I), где в каждом случае R8 независимо означает атом галогена или нитро, гидрокси, циано, формил, ацетил, амино, C1-С 6-алкил, С 1-С 6-алкокси, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 6-циклоалкил, С 3-С 6 циклоалкил-С 1-С 6-алкил, С 1-С 6-циклоалкенил, арил, арил-С 1-С 6-алкил, гетероарил, 3-8-членное гетероциклическое кольцо, гетероциклил-С 1-С 6-алкил, или гетероарил-С 1-С 6-алкил. В дополнительном варианте вышеупомянутых аспектов изобретение относится к соединениям формулы (I), гдеn означает целое число 1 и m означает целое число 1; при условии, что когда указанные R5 и R5', взятые вместе с атомом азота, к которому они присоединены, означают в которойозначает точку присоединения к остатку структуры общей формулы (I),тогда указанный R2 гетероарил структуры в которойозначает точку присоединения к остатку структуры общей формулы (I).- 14024406 в которойозначает точку присоединения указанного гетероарила к остатку структуры общей формулы (I). В дополнительном варианте вышеупомянутых аспектов изобретение относится к соединениям формулы (I), где в которойозначает точку присоединения указанного гетероарила к остатку структуры общей формулы (I), иZ означает N или C-R6. В одном из вариантов вышеупомянутых аспектов изобретение относится к соединениям формулы(I), в соответствии с любым из вышеупомянутых вариантов осуществления, в форме их стереоизомеров,таутомеров, N-оксидов, гидратов, сольватов или солей, или смесей таковых. Следует понимать, что настоящее изобретение относится к любой подкомбинации в рамках любого варианта настоящего изобретения соединений общей формулы (I), приведенного выше. Еще более предпочтительно настоящее изобретение охватывает соединения общей формулы (I), которые раскрыты в разделе "примеры" этого текста, приведенного ниже. В соответствии с другим аспектом настоящее изобретение охватывает способ получения соединений настоящего изобретения, содержащий стадии, описанные здесь. В соответствии с еще одним аспектом настоящее изобретение охватывает промежуточные соединения, которые пригодны для получения соединений настоящего изобретения общей формулы (I), в частности, способом, описанным в данной заявке. В частности, настоящее изобретение охватывает соединения общей формулы (XI) в которой R1 и R3 принимают значения, определенные выше для общей формулы (I). В соответствии с еще одним аспектом настоящее изобретение охватывает применение промежуточных соединений общей формулы (XI), приведенной выше, для получения соединений настоящего изобретения общей формулы (I), приведенной выше. В случае если существует несоответствие между химическим названием и изображенной химической структурой, изображенная химическая структура имеет приоритет перед данным химическим названием. Экспериментальный раздел Общие методы получения Конкретный способ для использования для получения соединений, применяемых в рассматриваемом варианте осуществления изобретения, зависит от конкретно требуемого соединения. Такие факторы,как выбор конкретных заместителей, играют некоторую роль в пути, которым необходимо следовать при получении конкретных соединений настоящего изобретения. Эти факторы могут быть легко установлены средним специалистом в данной области техники. Соединения изобретения можно получить путем использования известных химических реакций и методик. Тем не менее, для помощи читателю в синтезе соединений настоящего изобретения представлены следующие общие методы получения с более подробным описанием отдельных примеров, представленных ниже в экспериментальном разделе, описывающем рабочие примеры. Соединения изобретения можно получить в соответствии с обычными химическими методами,и/или как раскрыто ниже, из исходных веществ, которые являются либо коммерчески доступными, либо получаемыми в соответствии со стандартными, обычными химическими методами. Общие методы получения соединений приведены ниже, а получение характерных соединений конкретно проиллюстрировано в примерах. Синтетические превращения, которые можно использовать в синтезе соединений настоящего изобретение и в синтезе промежуточных соединений, вовлеченных в синтез соединений настоящего изобретения, известны или доступны среднему специалисту в данной области техники. Множество синтетических превращений можно найти в сборниках, таких какPress: Оксфорд, Соединенное Королевство (1996); С. Hansch; P.G. Sammes; J.B. Taylor, ред. Comprehensive Medicinal Chemistry: Pergamon Press: Оксфорд, Соединенное Королевство (1990). Кроме того, периодические обзоры синтетической методологии и связанных вопросов включаютPress: Сан-Диего Калифорния; и Methoden der Organischen Chemie (Houben-Weyl); Thieme: Штутгарт,Германия. Кроме того, базы данных синтетических преобразований включают Chemical Abstracts, которую можно найти, используя либо CAS OnLine, либо SciFinder, Handbuch der Organischen Chemie (Beilstein), которую можно найти, используя SpotFire и REACCS. Ниже, "PG" относится к пригодной защитной группе, широко известной специалисту в данной области техники, например из T.W. Greene; P.G.M. Wuts. Protective Groups in Organic Synthesis, 3-е изд.;- 16024406 На схеме реакции 1 ацетат ванилина может быть превращен в промежуточное соединение (III) в условиях нитрирования, таких как неразбавленная дымящая азотная кислота или азотная кислота в присутствии другой сильной кислоты, такой как серная кислота. Гидролиз ацетата в промежуточное соединение(III) возможен в присутствии основания, такого как гидроксид натрия, гидроксид лития, или гидроксид калия в протонном растворителе, таком как метанол. Защиту промежуточного соединения (IV) с образованием соединений формулы (V) (PG = защитная группа, широко известная специалисту в данной области техники) можно выполнить стандартными методами (Greene T.W.; Wuts P.G.M.; Protective Groups inOrganic Synthesis; WileySons: Нью-Йорк, 1999). Превращение соединений формулы (V) в соединения формулы (VI) может быть выполнено с использованием аммиака в присутствии йода в апротонном растворителе, таком как ТГФ или диоксан. Восстановление нитрогруппы в формуле (VI) можно выполнить с использованием железа в уксусной кислоте или газообразного водорода в присутствии пригодного палладиевого, платинового или никелевого катализатора. Превращения соединений формулы (VII) в имидазолин формулы (VIII) лучше всего достигают с использованием этилендиамина в присутствии катализатора, такого как элементарная сера при нагревании. Циклизацию соединений формулы (VIII) в соединения формулы (IX) выполняют с использованием бромциана в присутствии аминного основания, такого как триэтиламин, диизопропилэтиламин, или пиридин в галогенированном растворителе, таком как ДХМ или дихлорэтан. Удаление защитной группы в формуле (IX) будет зависеть от выбранной группы и может быть выполнено стандартными методами (Greene T.W.; Wuts P.G.M.; Protective Groups in OrganicSynthesis; WileySons: Нью-Йорк, 1999). Алкилирование фенола в формуле (X) может быть достигнуто с использованием основания, такого как карбонат цезия, гидрид натрия, или т-бутилат калия в полярном апротонном растворителе, таком как ДМФА или ДМСО, с введением боковой цепи, несущей подходящую уходящую группу, такую как галогенидная или сульфонатная группа, с обеспечением соединений формулы (XI). В заключение, амиды формулы (I) могут быть образованы с использованием активированных сложных эфиров, таких как хлорангидриды и ангидриды кислот или, альтернативно, могут быть образованы с использованием карбоновых кислот и подходящих агентов сочетания, таких как PYBOP,DCC или EDCI в полярных апротонных растворителях. Схема реакции 2 На схеме реакции 2 соединение формулы (IV), полученное, как описано выше, может быть превращено в структуру формулы (XII) с использованием аммиака в присутствии йода в апротонном растворителе, таком как ТГФ или диоксан. Алкилирование фенола в формуле (XII) может быть достигнуто с использованием основания, такого как карбонат цезия, гидрид натрия, или т-бутилат калия в полярном апротонном растворителе, таком как ДМФА или ДМСО с введением боковой цепи, несущей подходящую уходящую группу, такую как галогенидная или сульфонатная группа. Восстановление нитрогруппы в формуле (XIII) можно выполнить с использованием железа в уксусной кислоте или газообразного водорода в присутствии пригодного палладиевого, платинового или никелевого катализатора. Превращения соединений формулы (XIV) в имидазолин формулы (XV) лучше всего достигают с использованием этилендиамина в присутствии катализатора, такого как элементарная сера при нагревании. Циклизацию соединений формулы (XV) в соединение формулы (XVI) выполняют с использованием бромциана в присутствии аминного основания, такого как триэтиламин, диизопропилэтиламин или пиридин в галогенированном растворителе, таком как ДХМ или дихлорэтан. В заключение, амиды формулы (I) могут быть образованы с использованием активированных сложных эфиров, таких как хлорангидриды и ангидриды кислот или альтернативно могут быть образованы с использованием карбоновых кислот и подходящих агентов сочетания, таких как PYBOP, DCC или EDCI в полярных апротонных растворителях. На схеме реакции 3 соединение формулы (X), полученное, как описано выше, может быть превращено в амид (XVI) с использованием активированных сложных эфиров, таких как хлорангидриды и ангидриды кислот, или альтернативно может быть превращено с использованием карбоновых кислот и подходящих агентов сочетания, таких как PYBOP, DCC или EDCI в полярных апротонных растворителях. Эти соединения затем превращают в соединения формулы (I) с использованием основания, такого как карбонат цезия, гидрид натрия или т-бутилат калия в полярном апротонном растворителе, таком как ДМФА или ДМСО с введением боковой цепи, несущей подходящую уходящую группу, такую как галогенидная или сульфонатная группа. Схема реакции 4 На схеме реакции 4 соединение формулы (IX), полученное, как описано выше, может быть превращено в амид (XVII) с использованием активированных сложных эфиров, таких как хлорангидриды и ангидриды кислот, или альтернативно может быть превращено с использованием карбоновых кислот и подходящих агентов сочетания, таких как PYBOP, DCC или EDCI в полярных апротонных растворителях. Удаление защитной группы в формуле (XVII) будет зависеть от выбранной группы и может быть выполнено стандартными методами (Greene T.W.; Wuts P.G.M.; Protective Groups in Organic Synthesis;WileySons: Нью-Йорк, 1999). Алкилирование фенола в формуле (XVI) может быть достигнуто с использованием основания, такого как карбонат цезия, гидрид натрия, или т-бутилат калия в полярном апротонном растворителе, таком как ДМФА или ДМСО с введением боковой цепи, несущей подходящую уходящую группу, такую как галогенидная или сульфонатная группа. Схема реакции 5 На схеме реакции 5 соединение формулы XVIII может быть превращено в бисхлоридное соедине- 18024406 ние формулы XIX с использованием хлорирующих агентов, таких как POCl3 или COCl2 в апротонных растворителях. Хлорид, полученный таким образом, может быть превращен в имидазолины формулыXXI посредством реакции с подходящими количествами этаноламина или подходяще защищенного заместителя, с последующей активацией пригодным активирующим агентом, например сульфонилхлоридом, PPh3, или галогенирующим агентом, таким как SOCl2. Хлорид XXI может быть превращен в аминXXII с помощью применения любого источника нуклеофильного амина, такого как аммиак, фталимид,или защищенные амины, такие как бензиламин, в полярном растворителе, таком как ДМФА или ДМСО. Образование фенола, изображенного формулой X, может быть выполнено путем снятия защиты расщепления метилового эфира с использованием любого из условий, очерченных в литературе (GreeneT.W.; Wuts P.G.M.; Protective Groups in Organic Synthesis; WileySons: Нью-Йорк, 1999). Для лучшего понимания этого изобретения, приведены следующие примеры. Эти примеры служат только для иллюстративных целей, и не должны быть истолкованы как ограничение объема изобретения каким-либо образом. Все публикации, упомянутые здесь, включены путем ссылки в их полном объеме. Сокращения и акронимы Полный список сокращений, используемых химиками-органиками, являющимися средними специалистами в данной области техники, находится в ACS Style Guide (третье издание) или в Guidelines forAuthors Journal of Organic Chemistry. Сокращения, содержащиеся в указанных списках, и все сокращения,используемые химиками-органиками, являющимися средними специалистами в данной области техники,включены путем ссылки. Для целей этого изобретения химические элементы идентифицированы в соответствии с Периодической таблицей элементов версии CAS, Handbook of Chemistry and Physics, 67-ое изд., 1986-87. Более определенно, при использовании следующих сокращений в течение этого раскрытия, они имеют следующие значения: асас ацетилацетонат Ас 2 О уксусный ангидрид АсО (или ОАс) ацетат безв. безв. водн. водныйCelite фильтрующее средство из диатомовой земли,Celite Corp ХИ-МС химическая ионизационная масс-спектроскопия 13 С ЯМР углерод-13 ядерный магнитный резонанс м-СРВА метахлорпероксибензойная кислотаELSD испарительный детектор светорассеяния экв. эквивалент ЭР-МС электрораспылительная масс-спектроскопияFmoc 9-фторенилметоксикарбонил ГХ газовая хроматография ГХ-МС газовая хроматография - масс-спектроскопия ч. час, часы гекс. гексаны или гексан 1 Н ЯМР протонный ядерный магнитный резонанс НМРА гексаметилфосфорамид НМРТ гексаметилфосфорный триамид НОВТ гидроксибензотриазол ВЭЖХ высокоэффективная жидкостная хроматография нераст. нерастворимыйIPA изопропиламин изо PrOH изопропиловый спирт ИК инфракрасныйLAH алюмогидрид лития ЖХ жидкостная хроматография ЖХ-МС жидкостная хроматография - масс-спектрометрияMeCN ацетонитрил МеОН метанол МГц мегагерц мин. минута, минуты мкл микролитр мл миллилитр мкМ микромолярный моль моль Тпл температура плавления МС масс-спектр, масс-спектрометрияNMM 4-метилморфолин ЯМР ядерный магнитный резонанс о орто наблюд. наблюдаемый п пара с. страницаPG защитная группа, хорошо известная специалисту в данной области техники рН отрицательный логарифм концентрации ионов водородаpK отрицательный логарифм константы равновесияpKa отрицательный логарифм константы равновесия для ассоциации РРА поли(фосфорная кислота)PS-DIEA полистирол-связанный диизопропилэтиламин РуВОР гексафторфосфат бензотриазол-1-ил-окси-трис-пирролидино-фосфонияrel относится к соединению, в котором один хиральный центр не определен, причем вышеуказанный хиральный центр существует в присутствии одного или нескольких других хиральных центров, которые определеныZ zusammen (конфигурация) Специальные экспериментальные описания Условия аналитической ВЭЖХ-МС ВЭЖХ-МС данные, приведенные в последующих специальных экспериментальных описаниях, относятся к следующим условиям: Метод 1: 99% 0.1% водная муравьиная кислота: 1% CH3CN - 1% 0.1% водная муравьиная кислота: 99% CH3CN в течение 1.6 мин; 1% 0.1% водная муравьиная кислота: 99% CH3CN в течение 1.6 мин, в течение 0.4 мин. Метод 2: 99% 0.2% водный аммиак: 1% CH3CN - 1% 0.1% водный аммиак: 99% CH3CN в течение 1.6 мин; 1% 0.1% водный аммиак: 99% CH3CN в течение 1.6 мин, в течение 0.4 мин. Если не указано иное, для аналитической ВЭЖХ использовали метод 2. Условия препаративной ВЭЖХ Если не указано иное, "очистка препаративной ВЭЖХ" в последующих специальных эксперимен- 21024406 тальных описаниях относится к следующим условиям: Аналитика Условия хиральной ВЭЖХ Данные хиральной ВЭЖХ, приведенные в последующих специальных экспериментальных описаниях, относятся к следующим условиям: Аналитика Препаративная ЖХСД Препаративную жидкостную хроматографию среднего давления (ЖХСД) проводили с помощью стандартных методик "флэш-хроматографии" на силикагеле (например, Still и др., 1978), или путем использования картриджей с силикагелем и устройств, таких как системы Flashmaster или Biotage Flash. Если не указано иное, каждую очистку с помощью ЖХСД проводили с использованием хроматографаFlash Master II, оборудованного колонкой Isolute Flash NH2 с обращенной фазой, элюируя градиентом смешанного растворителя (100% CH2Cl2 в течение 3 мин, градиент до 90% CH2Cl2: 10% МеОН в течение 12 мин; градиент до 80% CH2Cl2: 20% МеОН в течение 20 мин; градиент до 70% CH2Cl2: 30% МеОН в течение 10 мин; и градиент до 50% CH2Cl2: 50% МеОН в течение 15 мин) при скорости потока, рекомендованном для данного размера колонки (то есть 5 г колонка, 10 мл/мин; 50 г колонка, 30 мл/мин). Элюат контролировали с помощью УФ-детектора при длине волны 254 нм. Определение условий оптического вращения Оптические вращения измеряли в ДМСО, при длине волны 589 нм, 20 С, концентрации 1.0000 г/100 мл, времени интеграции 10 с, толщине слоя 100.00 мм. Структуры соединений этого изобретения были подтверждены с использованием одной или нескольких следующих методик. ЯМР Спектры ЯМР были получены для каждого соединения и были согласованы с показанными структурами.- 22024406 Обычную одномерную ЯМР спектроскопию выполняли либо на 300, либо на 400 МГц спектрометрах Varian Mercury-plus. Образцы растворяли в дейтерированных растворителях. Химические сдвиги были зарегистрированы на шкале м.д. и были отнесены к соответствующим сигналам растворителей,таким как 2.49 м.д. для ДМСО-d6, 1.93 м.д. для CD3CN, 3.30 м.д. для CD3OD, 5.32 м.д. для CD2Cl2 и 7.26 м.д. для CDCl3 для 1 Н спектров. Процентные выходы, сообщенные в следующих примерах, основаны на исходном компоненте, который использовали в самом низком молярном количестве. Чувствительные к воздуху и влажности жидкости и растворы переносились через шприц или канюлю, и вводились в реакционные сосуды через резиновые прокладки. Реагенты и растворители коммерческого класса использовали без дополнительной очистки. Термин "концентрировали при пониженном давлении" относится к использованию роторного испарителя Бюхи при давлении приблизительно 15 мм Hg. Все температуры сообщаются без учета поправок в градусах Цельсия (С). Тонкослойную хроматографию (ТСХ) выполняли на стеклянных пластинах, предварительно покрытых силикагелем 60 A F-254 250 мкм. Реакции, для которых требовалось микроволновое излучение, проводили с использованием микроволновой печи Biotage Initator, необязательно оснащенной роботизированным блоком. Сообщенное время реакций в случае использования нагревания микроволновым излучением, следует понимать как фиксированное время реакций после достижения указанной температуры реакции. Процентные выходы, сообщенные в следующих примерах, основаны на исходном компоненте, который использовали в самом низком молярном количестве. Чувствительные к воздуху и влажности жидкости и растворы переносились через шприц или канюлю и вводились в реакционные сосуды через резиновые прокладки. Реагенты и растворители коммерческого класса использовали без дополнительной очистки. Термин "концентрировали в вакууме" относится к использованию роторного испарителя Бюхи при минимальном давлении приблизительно 15 мм Hg. Все температуры сообщаются без учета поправок в градусах Цельсия (С). Названия соединений были генерированы с использованием программы ACD/Name Batch версии 12.01. В некоторых случаях были использованы общепринятые названия коммерчески доступных реагентов. Синтез промежуточных соединений Промежуточное соединение А Получение 2-аминопиримидин-5-карбоновой кислоты(1Z)-2-(Диметоксиметил)-3-метокси-3-оксопроп-1-ен-1-олят натрия получали, как описано исследователем Жичкиным (Zhichkin и др., 2002).(1Z)-2-(Диметоксиметил)-3-метокси-3-оксопроп-1-ен-1-олят натрия (1.37 г, 7.8 ммоль) разбавляли в ДМФА (12 мл) и добавляли гидрохлорид гуанидина (640 мг, 6.7 ммоль). Смесь перемешивали при 100 С в течение 1 ч, затем охлаждали до к.т. и разбавили водой. Метил 2-аминопиримидин-5-карбоксилат осаждался виде светло-желтого твердого вещества, которое выделяли с помощью вакуумного фильтрования(510 мг, 50%): 1 Н ЯМР (ДМСО-d6) : 8.67 (s, 2 Н), 7.56 (br s, 2H), 3.79 (s, 3 Н). Метил 2-аминопиримидин-5-карбоксилат (300 мг, 2.0 ммоль) разбавляли в метаноле (5 мл), содержащем несколько капель воды. Добавляли гидроксид лития (122 мг, 5.1 ммоль), и реакционную смесь перемешивали при 60 С в течение ночи. Смесь концентрировали при пониженном давлении, затем разбавляли водой и значение рН устанавливали на 4 с помощью 1 М HCl. 2-Аминопиримидин-5-карбоновая кислота осаждалась виде белого твердого вещества, которое выделяли с помощью вакуумного фильтрования (244 мг, 90%): 1 Н ЯМР (ДМСО-d6) : 12.73 (1 Н, br s), 8.63 (2 Н, s), 7.44 (2 Н, br s). Промежуточное соединение В Получение гидрохлорида 4-(3-хлорпропил)морфолина К раствору 1-бром-3-хлорпропана (45 г, 0.29 моль) в толуоле (100 мл) добавляли морфолин (38 г,0.44 моль). Раствор перемешивали при 84 С в течение 3 ч, в течение которых образовался осадок. После охлаждения до к.т., осадок выделяли с помощью вакуумного фильтрования, промывали эфиром, и твердое вещество отбрасывали. Маточный раствор подкисляли с помощью HCl (4 M в диоксане, 72 мл, 0.29 моль), что вызывало осаждение целевого продукта в виде HCl соли. Растворитель удаляли при пониженном давлении, и получающееся в результате твердое вещество сушили с получением указанного в заголовке соединения (53 г, 90%): 1 Н ЯМР (ДМСО-d6) : 11.45 (1 Н, br s), 3.94-3.77 (4 Н, m), 3.74 (2 Н, t), 3.39 Суспензию 6-амино-2-метилникотинонитрила (1.0 г, 7.5 ммоль) в водном растворе KOH (20%, 12 мл) нагревали при температуре дефлегмации в течение 3 дней. По истечении этого времени ее охлаждали до комнатной температуры, нейтрализовали концентрированной HCl, фильтровали и сушили с получением целевого продукта, который использовали без дополнительной очистки (1.1 г, 96%). Промежуточное соединение С Получение гидрохлорида 4-[(2-оксидо-1,3,2-диоксатиолан-4-ил)метил]морфолина 3-Морфолин-4-илпропан-1,2-диол (2.1 г, 9.07 ммоль) растворяли в ДХМ (15 мл) и охлаждали до 0 С. Охлажденный раствор обрабатывали тионилхлоридом (1.81 мл, 24.8 ммоль) и затем нагревали при температуре дефлегмации в течение 1 ч. Реакционную смесь затем концентрировали при пониженном давлении с получением твердого вещества (2.5 г, 97%): 1 Н ЯМР (ДМСО-d6) : 11.4 (1 Н, br s), 5.64-5.55 Дымящую азотную кислоту (2200 мл) под азотом охлаждали до 0 С после чего порциями добавляли ацетат ванилина (528 г, 2.7 моль), поддерживая внутреннюю температуру ниже 10 С. Через 2 ч полученную смесь выливали при перемешивании на лед. Взвесь фильтровали и получающиеся твердые вещества промывали водой (3100 мл) и высушивали на воздухе. Через 2 дня твердые вещества нагревали в ДХМ(3000 мл) до полного растворения. Раствору давали охладиться до комнатной температуры, в то время как по каплям добавляли гексаны (3000 мл). Твердые вещества отфильтровывали, промывали гексанами(500 мл) и сушили на воздухе с получением 4-формил-2-метокси-3-нитрофенилацетата (269 г, 41%): 1 Н ЯМР (ДМСО-d6) : 9.90 (s, 1H), 7.94 (d, 1H), 7.75 (d, 1H), 3.87 (s, 3 Н), 2.40 (s, 3 Н). Стадия 2. Получение 4-гидрокси-3-метокси-2-нитробензальдегида Смесь 4-формил-2-метокси-3-нитрофенилацетата (438 г, 1.8 моль) и карбоната калия (506 г, 3.7 моль) в МеОН (4000 мл) перемешивали при комнатной температуре течение 16 ч. Реакционную смесь концентрировали при пониженном давлении с получением вязкого масла. Масло растворяли в воде, подкисляли с использованием раствора HCl (2 н.) и экстрагировали с помощью EtOAc. Органический слой промывали насыщенным раствором хлорида натрия, сушили (сульфат магния) и фильтровали. Растворитель концентрировали при пониженном давлении до 1/3 объема и получающиеся твердые вещества отфильтровывали и высушивали на воздухе с получением 4-гидрокси-3-метокси-2-нитробензальдегида 4-Гидрокси-3-метокси-2-нитробензальдегид (155 г, 786 ммоль) растворяли в ДМФА (1500 мл) и перемешиваемый раствор обрабатывали карбонатом калия (217 г, 1.57 моль) и далее бензилбромидом (161 г, 0.94 моль). После перемешивания в течение 16 ч реакционную смесь концентрировали при пониженном давлении и разделяли между водой (2 л) и EtOAc (2 л). Органический слой промывали насыщенным- 24024406 раствором хлорида натрия (32 л), сушили (безв. сульфатом натрия) и концентрировали при пониженном давлении. Получающиеся твердые вещества растирали с Et2O (1 л) с получением 4-(бензилокси)-3 метокси-2-нитробензальдегида (220 г, 97%): 1 Н ЯМР (ДМСО-d6) : 9.77 (1 Н, s), 7.87 (1 Н, d), 7.58 (1 Н, d),7.51 (1 Н, m), 7.49 (1 Н, m), 7.39 (3 Н, m), 5.36 (2 Н, s), 3.05 (3 Н, s). Стадия 4. Получение 4-(бензилокси)-3-метокси-2-нитробензонитрила Йод (272 г, 1.1 ммоль) добавляли к смеси 4-(бензилокси)-3-метокси-2-нитробензальдегида (220 г,766 ммоль) и гидроксида аммония (28% раствор, 3 л), растворенной в ТГФ (5 л). Через 16 ч реакционную смесь обрабатывали сульфитом натрия (49 г, 383 ммоль) и концентрировали при пониженном давлении с получением густой взвеси. Взвесь фильтровали, промывали водой (250 мл) и сушили с получением 4(бензилокси)-3-метокси-2-нитробензонитрила в виде твердого вещества (206 г, 95%): 1 Н ЯМР (ДМСО-d6) Дегазированный раствор 4-(бензилокси)-3-метокси-2-нитробензонитрила (185 г, 651 ммоль) в ледяной уксусной кислоте (3500 мл) и воде (10 мл) охлаждали до 5 С и обрабатывали железным порошком(182 г, 3.25 моль). Через 3 дня реакционную смесь фильтровали через Celite, и фильтрат концентрировали при пониженном давлении. Полученное таким образом масло обрабатывали насыщенным раствором хлорида натрия, нейтрализовали раствором бикарбоната натрия и экстрагировали в CH2Cl2. Получающуюся эмульсию фильтровали через Celite, после чего органический слой отделяли, промывали насыщенным раствором хлорида натрия, сушили (безв. сульфатом натрия) и концентрировали при пониженном давлении с получением 2-амино-4-(бензилокси)-3-метоксибензонитрила в виде твердого вещества Смесь 2-амино-4-(бензилокси)-3-метоксибензонитрила (144 г, 566 ммоль) и серы (55 г, 1.7 моль) в этилендиамине (800 мл) дегазировали в течение 30 мин, затем нагревали до температуры 100 С. Через 16 ч реакционную смесь охлаждали до комнатной температуры и затем фильтровали. Фильтрат концентрировали при пониженном давлении, разбавляли насыщенным раствором бикарбоната натрия и экстрагировали с помощью EtOAc. Органический слой промывали соляным раствором, сушили (сульфатом натрия), фильтровали и концентрировали при пониженном давлении. Получающиеся твердые вещества перекристаллизовывали из EtOAc и гексанов с получением 3-(бензилокси)-6-(4,5-дигидро-1 Н-имидазол 2-ил)-2-метоксианилина (145 г, 86%): 1 Н ЯМР (ДМСО-d6) : 7.27-7.48 (5 Н, m), 7.14 (1 Н, d), 6.92 (2 Н, m),6.64 (1 Н, m), 6.32 (1 Н, d), 5.11 (2 Н, s), 3.67 (3 Н, s), 3.33 (2 Н, s). Стадия 7. Получение 8-(бензилокси)-7-метокси-2.3-дигидроимидазо[1,2-с]хиназолин-5-амина Смесь 3-(бензилокси)-6-(4,5-дигидро-1 Н-имидазол-2-ил)-2-метоксианилина (100 г, 336 ммоль) и триэтиламина (188 мл) в ДХМ (3 л) охлаждали до 0 С и обрабатывали бромцианом (78.4 г, 740 ммоль). Реакционную смесь перемешивали и давали постепенно нагреться до комнатной температуры. Через 16 ч реакционную смесь разбавляли насыщенным раствором бикарбоната натрия и экстрагировали с помощью CH2Cl2. Органический слой промывали 3 раза насыщенным раствором бикарбоната и далее многократно промывали соляным раствором. Органический слой сушили (сульфат натрия) и концентрировали при пониженном давлении с получением полутвердого вещества (130 г, с примесью соли триэтиламина): 1 Н ЯМР (ДМСО-d6) : 7.30-7.48 (7 Н, m), 5.31 (2 Н, s), 4.32 (2 Н, m), 4.13 (2 Н, m), 3.81 (3 Н, s). 3-(Бензилокси)-6-(4,5-дигидро-1 Н-имидазол-2-ил)-2-метоксианилин (30 г, 93 ммоль) порциями добавляли в течение 1 ч в круглодонную колбу, содержащую ТФУ (400 мл), предварительно охлажденную на ледяной бане. Реакционную смесь нагревали до температуры 60 С и оставляли перемешиваться при этой температуре в течение 17 ч, после чего ее охлаждали до к.т., и затем реакционную смесь концентрировали при пониженном давлении. Полученный остаток вносили в ДХМ и гексаны и концентрировали при пониженном давлении. Вещество, полученное таким образом, растворяли в растворе МеОН/CH2Cl2(250 мл, 1:1) и концентрировали при пониженном давлении. Получающееся твердое вещество сушили в течение ночи в вакууме при низкой температуре с получением бис-(трифторацетата) 5-амино-7-метокси 2,3-дигидроимидазо[1,2-с]хиназолин-8-ола (44.7 г, 100%): 1 Н ЯМР (ДМСО-d6) : 7.61 (1 Н, m), 6.87 (1 Н,m), 4.15 (2 Н, br t), 4.00 (2 Н, m), 3.64 (3 Н, s). Промежуточное соединение F Получение 7-метокси-8-[(2R)-оксиран-2-илметокси]-2,3-дигидроимидазо[1,2-с]хиназолин-5-амина Раствор (S)-(-)-глицидола (8.6 мл, 130 ммоль) и триэтиламина (36.2 мл, 260 ммоль, 2.0 экв.) в ДМФА (250 мл) охлаждали на ледяной бане и по каплям добавляли метансульфонилхлорид (10.1 мл, 130 ммоль, 1.0 экв.). Смесь перемешивали в течение 1.5 ч при комнатной температуре, обеспечивая 0.47 М раствор (R)-глицидилметансульфоната в ДМФА, который использовали без дополнительной очистки. Стадия 2. Получение 7-метокси-8-[(2R)-оксиран-2-илметокси]-2,3-дигидроимидазо[1,2-с]хиназолин-5-амина К раствору бис-(трифторацетата) 5-амино-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-8-ола(промежуточное соединение Е, 0.30 г, 0.65 ммоль) в ДМФА (8 мл) добавляли карбонат цезия до образования белой суспензии. Суспензию перемешивали при комнатной температуре в течение 1.5 ч, затем добавляли (R)-глицидилметансульфонат (промежуточное соединение F, стадия 1, 3.9 мл 0.34 М раствор в ДМФА, 1.30 ммоль, 2.0 экв.), и получающийся раствор перемешивали при 60 С в течение 20 ч. Получающуюся суспензию концентрировали при пониженном давлении и остаток разделяли между насыщенным раствором бикарбоната натрия (30 мл) и раствором 4:1 CH2Cl2/изопропанол (30 мл). Водную фазу экстрагировали раствором 4:1 CH2Cl2/изопропанол (30 мл). Объединенные органические фазы сушили (безв. сульфатом натрия) и концентрировали при пониженном давлении. Остаток очищали с использованием ЖХСД (колонка Isolute Flash NH2 с обращенной фазой; 100% CH2Cl2 течение 5 мин,градиент до 95% CH2Cl2: 5% МеОН в течение 15 мин; градиент до 90% CH2Cl2: 10% МеОН в течение 15 мин; градиент до 80% CH2Cl2: 20% МеОН в течение 15 мин; и градиент до 75% CH2Cl2: 25% МеОН в течение 15 мин) с получением 7-метокси-8-[(2R)-оксиран-2-илметокси]-2,3-дигидроимидазо[1,2 с]хиназолин-5-амина (0.080 г, 43%): 1 Н ЯМР (ДМСО-d6 + 1 капля ТФУ-d)2.71 (dd, J=2.5, 4.8 Гц, 1 Н),2.85, (t, J=4.6 Гц, 1 Н), 3.34-3.40 (br m, 1 Н), 3.75 (s, 3 Н), 3.82 (s, 3 Н), 4.30 (dd, J=6.6, 11.4 Гц, 1 Н), 4.10 (br t,J=9.7 Гц, 2 Н), 4.31 (br t, J=9.7 Гц, 2 Н), 4.54 (dd, J=2.3, 11.6 Гц, 1 Н), 7.26 (d, J=9.4 Гц, 1 Н), 7.84 (d, J=9.1 Гц,1 Н). Промежуточное соединение G Получение 7-метокси-8-(оксиран-2-илметокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-амина Рацемический глицидолметансульфонат синтезировали способом, аналогичным способу получения промежуточного соединения F, стадия 1, заменяя рацемический глицидол (S)-(-)-глицидолом. Раствор- 26024406 рацемического глицидилметансульфоната в ДМФА использовали в дальнейших превращениях без дополнительной очистки. Стадия 2. Получение 7-метокси-8-(оксиран-2-илметокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5 амина Промежуточное соединение G синтезировали способом, аналогичным способу получения промежуточного соединения F, стадия 2, заменяя рацемический глицидилметансульфонат (R)-глицидилметансульфонатом (0.30 г, 24%): ВЭЖХ, время удержания 0.62 мин; 1 Н ЯМР (ДМСО-d6 + 1 капля ТФУ-d)2.71 (dd, J=2.5, 4.8 Гц, 1 Н), 2.85, (t, J=4.6 Гц, 1 Н), 3.34-3.40 (br m, 1H), 4.30 (dd, J=6.6, 11.4 Гц, 1 Н), 4.10(S)-Глицидилметансульфонат синтезировали способом, аналогичным способу получения промежуточного соединения F, стадия 1, заменяя (R)-(+)-глицидол (S)-(-)-глицидолом. Продукт использовали в дальнейших превращениях в виде раствора (S)-глицидилметансульфоната в ДМФА, без дополнительной очистки. Стадия 2. Получение 7-метокси-8-[(2S)-оксиран-2-илметокси]-2,3-дигидроимидазо[1,2-с]хиназолин 5-амина Промежуточное соединение G синтезировали способом, аналогичным способу получения промежуточного соединения F, стадия 2, заменяя (S)-глицидилметансульфонат (R)-глицидилметансульфонатом(33.7 г, 260.4 ммоль) и далее PYBOP (51 г, 97.7 ммоль). Полученную смесь перемешивали с помощью верхнеприводной мешалки в течение 3 дней при температуре окружающей среды. Получающийся в результате осадок выделяли с помощью вакуумного фильтрования, многократно промывали с помощьюEtOAc и сушили в вакууме при слабом нагревании с получением N-[8-(бензилокси)-7-метокси-2,3 дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамида (27.3 г, 98%): 1 Н ЯМР (ДМСО-d6 + 2 капли ТФУ-d)N-[8-(Бензилокси)-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид (20 г, 45.1 ммоль) порциями добавляли в течение 1 ч в круглодонную колбу, содержащую ТФУ (400 мл), предварительно охлажденную на ледяной бане. Реакционную смесь нагревали до температуры 60 С и оставляли перемешиваться при этой температуре в течение 17 ч, после чего ее охлаждали до комнатной температуры. Реакционную смесь затем концентрировали при пониженном давлении. Полученный остаток растворяли в CH2Cl2 и гексане и концентрировали при пониженном давлении. Полученное таким образом вещество растворяли в МеОН и CH2Cl2 (250 мл, 1:1) и концентрировали при пониженном давлении. Получающиеся твердые вещества сушили в течение ночи в вакууме при низкой температуре с получением N(8-гидрокси-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)никотинамида (17.3 г, 66%): 1 Н ЯМР(1 Н, d), 7.59 (1 Н, m), 7.17 (1 Н, d), 4.54 (2 Н, m), 4.21 (2 Н, m), 3.98 (3 Н, s); масс-спектр m/z 481 М+1)+). Стадия 3. Получение N-[7-метокси-8-(оксиран-2-илметокси)-2,3-дигидроимидазо[1,2-с]хиназолин 5-ил]никотинамида Смесь N-8-гидрокси-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-илпиридин-3-карбоксамида (0.85 г, 1.50 ммоль) и карбоната цезия (2.93 г, 8.99 ммоль, 6.0 экв.) в ДМФА (12.5 мл) перемешивали при комнатной температуре в течение 1 ч, затем обрабатывали рацемическим эпихлоргидрином (0.29 мл,3.75 ммоль, 2.5 экв.), и полученную смесь перемешивали при комнатной температуре течение 16 ч. Полученную смесь использовали в дальнейших превращениях в виде 0.120 М раствора N-[7-метокси-8(оксиран-2-илметокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамида в ДМФА. Промежуточное соединение J Получение Смесь N-8-гидрокси-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-илпиридин-3-карбоксамида (промежуточное соединение I, стадия 2 (используемое в виде бис-ТФУ соли), 1.50 г, 2.65 ммоль) и карбоната цезия (4.32 г, 13.3 ммоль, 5.0 экв.) в ДМФА (37 мл) перемешивали при комнатной температуре в течение 1 ч, затем обрабатывали (R)-глицидилметансульфонатом (промежуточное соединение F, стадия 1, 21.2 мл, 0.25 М в ДМФА, 5.31 ммоль, 2.0 экв.). Полученную смесь перемешивали при комнатной температуре в течение 16 ч при 60 С, затем охлаждали до комнатной температуры и концентрировали при пониженном давлении. Полученный остаток разделяли между водой (50 мл) и раствором 4:1CH2Cl2/изопропанол (50 мл). Органическую фазу промывали концентрированным раствором бикарбоната натрия, сушили (безв. сульфатом натрия), и концентрировали при пониженном давлении. Полученное вещество растирали с EtOH и сушили при пониженном давлении с получением N-7-метокси-8-[(2R)оксиран-2-илметокси]-2,3-дигидроимидазо[1,2-с]хиназолин-5-илникотинамида (0.72 г, 69%): ВЭЖХ,время удержания 0.94 мин; 1 Н ЯМР (ДМСО-d6 + 1 капля ТФУ-d)2.75 (dd, J=2.5, 5.1 Гц, 1 Н), 2.88(прибл. t, J=4.7, 1 Н), 3-42-3.47 (m, 1H), 4.01 (s, 3 Н), 4.14 (dd, J=6.6, 11.6 Гц, 1 Н), 4.20-4.29 (m, 3 Н), 4.524.59 (m, 2 Н), 4.68 (dd, J=2.3, 11.6 Гц, 1 Н), 7.47 (d, J=9.4 Гц, 1 Н), 7.92 (dd, J=5.6, 7.8 Гц, 1 Н), 8.03 (d, J=9.1 Гц, 1 Н), 8.90 (br d, J=7.8 Гц, 1 Н), 8.97(dd, J=1.5, 5.6 Гц, 1 Н), 9.49 (d, J=1.5 Гц, 1 Н); масс-спектр m/z 394 М+1)+, 11%). Примеры Сравнительный пример 1 (из WO 2008/070150) Получение N-8-[2-гидрокси-3-(морфолин-4-ил)пропокси]-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиридин-3-карбоксамида Карбонат цезия (3 г, 9.37 ммоль) добавляли к суспензии бис-трифторацетата N-(8-гидрокси-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)никотинамида (1.0 г, 1.88 ммоль) в ДМФА (40 мл) и перемешивали в течение 1.5 ч перед добавлением гидрохлорида 4-[(2-оксидо-1,3,2-диоксатиолан-4 ил)метил]морфолина (промежуточное соединение С, 0.39 г, 1.88 ммоль). Через 3 ч, реакционную смесь обрабатывали другим эквивалентом гидрохлорида 4-[(2-оксидо-1,3,2-диоксатиолан-4-ил)метил]морфолина (промежуточное соединение С, стадия 2) и перемешивали при 60 С в течение ночи. Реакционную смесь концентрировали при пониженном давлении и продукт экстрагировали раствором 20% изопропанол/ 80% хлороформ и промывали насыщенным раствором гидрокарбоната натрия. Органическую фазу сушили (сульфат магния) и концентрировали при пониженном давлении, и полученный остаток растирали с EtOAc и отфильтровывали. Твердое вещество затем очищали с помощью ВЭЖХ (Gilson, 5% Ме- 28024406 ОН/95% Н 2 О до 50% МеОН/50% Н 2 О градиент, 0.1% NH4OH) с получением N-8-[2-гидрокси-3(морфолин-4-ил)пропокси]-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-илпиридин-3-карбоксамида (160 мг, 18%): ВЭЖХ МС RT = 0.19 мин; 1 Н ЯМР (ДМСО-d6 + 1 капля ТФУ-d)13.40-13.38 (1 Н,brs), 9.45 (1 Н, d), 8.90 (1 Н, dd), 8.72 (1 Н, d), 8.06 (1 Н, d), 7.77 (1 Н, dd), 7.51 (1 Н, d) 4.59 (2 Н, t), 4.49-4.41(1 Н, br s), 4.33-4.22 (4 Н, m), 4.06 (3 Н, s) 4.05-3.92 (2 Н, m), 3.86-3.67 (2 Н, m), 3.51 (2 Н, d), 3.43-3.13 (4 Н,m); масс-спектр m/z 495 M+1)+). Следующие примеры получали способом, аналогичным сравнительному примеру 1 Пример 21. 6-Амино-N-(8-[2-гидрокси-3-(морфолин-4-ил)пропокси]-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-илпиридин-3-карбоксамид Получен с использованием 6-амино-3-пиридинкарбоновой кислоты вместо никотиновой кислоты,используемой при получении промежуточного соединения I, стадия 2 (94.0 мг, 31%): ТСХ (9:1 Раствор (S)-глицидола (1.00 мл, 15.0 ммоль) и морфолина (1.96 мл, 22.5 ммоль, 2.5 экв.) в абс. этаноле нагревали в микроволновой печи в течение 4 мин при 140 С, охлаждали до комнатной температуры и концентрировали при 70 С в вакууме 12 мбар с получением (2R)-3-(4-морфолинил)-1,2 пропандиола (2.47 г, 102%): 1 Н ЯМР (CDCl3)2.37 (dd J=4.0, 12.4 Гц, 1 Н), 2.40-2.48 (m, 2H), 2.57 (dd,J=9.6, 12.4 Гц, 1 Н), 2.62-2.71 (m, 2H), 3.50 (dd, J=4.2, 11.4 Гц, 1 Н), 3.65-3.79 (m, 5 Н), 3.79-3.88 (m, 1H). Стадия 2. Получение гидрохлорида 4-[(4R)-(2-оксидо-1,3,2-диоксатиолан-4-ил)метил]морфолина Раствор (2R)-3-(4-морфолинил)-1,2-пропандиола (0.447 г, 2.77 ммоль) в CH2Cl2 (7.5 мл) охлаждали до 0 С и по каплям добавляли тионилхлорид (0.41 мл, 5.55 ммоль, 2.0 экв.). Получающийся раствор нагревали при температуре дефлегмации в течение 1 ч, охлаждали до комнатной температуры и концентрировали при пониженном давлении с получением гидрохлорида 4-[(4R)-(2-оксидо-1,3,2-диоксатиолан 4-ил)метил]морфолина (0.70 г, 104%). Это вещество использовали на следующей стадии без дополнительной очистки. Стадия 3. Получение N-(8-[(2R)-2-гидрокси-3-(морфолин-4-ил)пропил]окси-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиридин-3-карбоксамида К раствору бис-ТФУ соли N-(8-гидрокси-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)никотинамида (промежуточное соединение I, стадия 2, 0.750 г, 1.3 ммоль) в ДМФА (50 мл) добавляли карбонат цезия (1.30 г, 3.9 ммоль, 3.0 экв.) и получающуюся взвесь перемешивали при комнатной температуре в течение 1.5 ч с последующим добавлением циклического сульфитного сложного эфира (0.275 г,1.3 ммоль, 1.0 экв.). Эту смесь перемешивали при 60 С в течение 12 ч, охлаждали до комнатной температуры, обрабатывали дополнительным карбонатом цезия (0.86 г, 2.6 ммоль, 2.0 экв.) и циклическим сульфитным сложным эфиром (0.275 г, 1.3 ммоль, 1.0 экв.) и перемешивали при 60 С в течение дополнительных 12 ч. Полученную смесь концентрировали при пониженном давлении. Остаток растворяли в растворе 4:1 CH2Cl2/изопропанол (100 мл), затем промывали насыщенным раствором бикарбоната натрия(50 мл) и насыщенным раствором хлорида натрия (50 мл), сушили (безв. сульфатом натрия), и концентрировали при пониженном давлении. Остаток (1.77 г) очищали препаративной ВЭЖХ с получением N(8-[(2R)-2-гидрокси-3-(морфолин-4-ил)пропил]окси-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5 ил)пиридин-3-карбоксамида (0.52 г, 82%): ТСХ (9:1 CH2Cl2/MeOH + 1% NH4OH в МеОН) Rf 0.35. Препаративная ВЭЖХ (условия А) время удержания 3.70 мин; 1 Н ЯМР (ДМСО-d6+ 1 капля ТФУ-d)3.10-3.40
МПК / Метки
МПК: C07D 487/04
Метки: лечения, гиперпролиферативных, 2,3-дигидроимидазо[1,2-c]хиназолина, заболеваний, связанных, ангиогенезом, производные, нарушений, пригодные, аминоспирт-замещенные
Код ссылки
<a href="https://eas.patents.su/30-24406-aminospirt-zameshhennye-proizvodnye-23-digidroimidazo12-chinazolina-prigodnye-dlya-lecheniya-giperproliferativnyh-narushenijj-i-zabolevanijj-svyazannyh-s-angiogenezom.html" rel="bookmark" title="База патентов Евразийского Союза">Аминоспирт-замещенные производные 2,3-дигидроимидазо[1,2-c]хиназолина, пригодные для лечения гиперпролиферативных нарушений и заболеваний, связанных с ангиогенезом</a>
Предыдущий патент: Устройство и способ для генерации пучка акустической энергии из буровой скважины и их применения
Следующий патент: Узел фильтрации изделия трубопроводной арматуры
Случайный патент: Стимуляция срт -1 как средство уменьшения веса












