Соединения, ингибирующие металлоферменты
Номер патента: 24385
Опубликовано: 30.09.2016
Авторы: Салленбергер Майкл, Йейтс Кристофер М., Шотцингер Роберт Дж., Хекстра Уиллиам Дж., Лосо Майкл, Рэфферти Стивен У.
Формула / Реферат
1. Соединение формулы I или его соль:
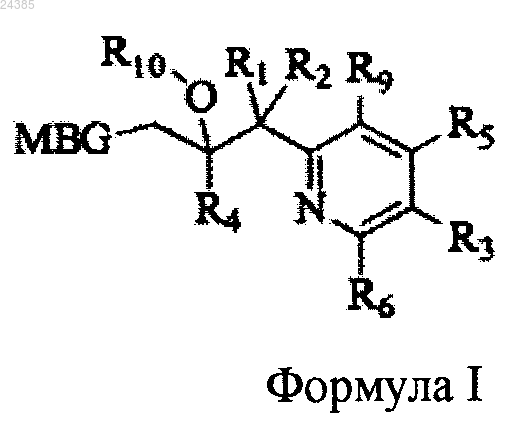
где MBG представляет собой тетразолил, оксазолил, пиримидинил, тиазолил или пиразолил;
R1 представляет собой гало;
R2 представляет собой гало;
R3 независимо представляет собой атом водорода (Н), C1-C6-алкил, C2-C6-алкенил, циклопропил, 5-6-членный гетероарил, содержащий 1, 2 или 3 независимых атома S, N или О, C1-C6-гидроксиалкил, циано, C1-C6-галоалкил, гало, -C(O)фенил, -CH(OH)(фенил), -CH2(фенил), -CH2(пиридил), -CF2(фенил), -CF2(пиридил),-CH2О(фенил), -CH2О(пиридил), -CH2S(O)x(фенил),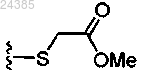 и 6-членный циклический амино, необязательно содержащий О, где каждый может быть необязательно замещен 1, 2 или 3 независимыми заместителями R7;
и 6-членный циклический амино, необязательно содержащий О, где каждый может быть необязательно замещен 1, 2 или 3 независимыми заместителями R7;R4 представляет собой фенил, необязательно замещенный 1, 2 или 3 независимыми заместителями R8;
R5 независимо представляет собой атом водорода (Н) или гало;
R6 независимо представляет собой атом водорода (Н) или гало;
каждый R7 независимо представляет собой циано, циклопропил, C1-C6-галоалкил, гидрокси, C1-C6-алкокси, гало, C1-C6-галоалкокси, -C(O)-C1-C6-алкил, -C(O)OH, -C(O)О-C1-C6-алкил и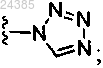
каждый R8 независимо представляет собой гало;
R9 представляет собой атом водорода (Н);
R10 представляет собой атом водорода (Н);
х независимо равно 0.
2. Соединение по п.1, где R1 представляет собой фтор.
3. Соединение по п.1, где R2 представляет собой фтор.
4. Соединение по п.1, где R1 и R2 представляют собой фтор.
5. Соединение по п.1, где R4 представляет собой фенил, необязательно замещенный 1, 2 или 3 атомами фтора.
6. Соединение по п.1, где R4 представляет собой 2,4-дифторфенил.
7. Соединение по п.1, где R5 представляет собой гало.
8. Соединение по п.1, где R3 представляет собой 5-6-членный гетероарил, содержащий 1, 2 или 3 независимых атома S, N или О, необязательно замещенный 1, 2 или 3 независимыми заместителями R7.
9. Соединение по п.1, где
R1 представляет собой фтор;
R2 представляет собой фтор;
R3 представляет собой C1-C6-алкил, замещенный 1, 2 или 3 независимыми заместителями R7;
R4 представляет собой 2,4-дифторфенил.
10. Соединение по п.1, где
R1 представляет собой фтор;
R2 представляет собой фтор;
R3 представляет собой C2-C6-алкенил, замещенный 1, 2 или 3 независимыми заместителями R7;
R4 представляет собой 2,4-дифторфенил.
11. Соединение по п.1, где R3 представляет собой гало.
12. Соединение по п.1, которое является одним из следующих:
1-(5-бромпиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (1);
2-(2,4-дифторфенил)-1,1-дифтор-1-(пиридин-2-ил)-3-(1H-тетразол-1-ил)пропан-2-ол (2);
(Е)-3-(6-(2-(2,4-дифторфенил)-1,1-дифтор-2-гидрокси-3-(1H-тетразол-1-ил)пропил)пиридин-3-ил)акрилонитрил (3);
(E)-этил-3-(6-(2-(2,4-дифторфенил)-1,1-дифтор-2-гидрокси-3-(1H-тетразол-1-ил)пропил)пиридин-3-ил)акрилат (4);
этил-3-(6-(2-(2,4-дифторфенил)-1,1-дифтор-2-гидрокси-3-(1H-тетразол-1-ил)пропил)пиридин-3-ил)пропаноат (5);
(E)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)-1-(5-(3-(2,2,2-трифторэтокси)проп-1-енил)пиридин-2-ил)пропан-2-ол (6);
(E)-4-(6-(2-(2,4-дифторфенил)-1,1-дифтор-2-гидрокси-3-(1H-тетразол-1-ил)пропил)пиридин-3-ил)бут-3-ен-2-он (7);
4-(6-(2-(2,4-дифторфенил)-1,1-дифтор-2-гидрокси-3-(1H-тетразол-1-ил)пропил)пиридин-3-ил)бутан-2-он (8);
1-(5-(2H-1,2,3-триазол-2-ил)пиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (9);
2-(2,4-дифторфенил)-1,1-дифтор-1-(5-фторпиридин-2-ил)-3-(1H-тетразол-1-ил)пропан-2-ол (10);
2-(4-хлор-2-фторфенил)-1,1-дифтор-1-(пиридин-2-ил)-3-(1H-тетразол-1-ил)пропан-2-ол (11);
1-(5-хлорпиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (12);
2-(2,4-дифторфенил)-1,1-дифтор-1-(4-фторпиридин-2-ил)-3-(1H-тетразол-1-ил)пропан-2-ол (13);
1-(4-хлорпиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (14);
2-(2,4-дифторфенил)-1,1-дифтор-1-(5-(5-фторпиримидин-4-ил)пиридин-2-ил)-3-(1H-тетразол-1-ил)пропан-2-ол (15);
2-(2,5-дифторфенил)-1,1-дифтор-1-(4-фторпиридин-2-ил)-3-(1H-тетразол-1-ил)пропан-2-ол (16);
2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)-1-(5-(2,2,2-трифторэтил)пиридин-2-ил)пропан-2-ол (17);
1-(5-циклопропилпиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (18);
2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)-1-(5-(трифторметил)пиридин-2-ил)пропан-2-ол (19);
1-(6-бромпиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (20);
1-(5-бромпиридин-2-ил)-2-(2,5-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (21);
1-(5-бромпиридин-2-ил)-2-(4-хлор-2-фторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (22);
1-(5-бромпиридин-2-ил)-1,1-дифтор-2-(2-фтор-4-(трифторметил)фенил)-3-(1H-тетразол-1-ил)пропан-2-ол (23);
1-(4-бромпиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (24);
2-(2,4-дифторфенил)-1,1-дифтор-1-(5-метилпиридин-2-ил)-3-(1H-тетразол-1-ил)пропан-2-ол (25);
2-(4-хлор-2-фторфенил)-1-(5-хлорпиридин-2-ил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (26);
2-(4-хлор-2-фторфенил)-1,1-дифтор-1-(5-фторпиридин-2-ил)-3-(1H-тетразол-1-ил)пропан-2-ол (27);
1-(5-(2H-1,2,3-триазол-2-ил)пиридин-2-ил)-2-(4-хлор-2-фторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (28);
1-(6'-хлор-[3,3'-бипиридин]-6-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (30);
2-(2,4-дифторфенил)-1,1-дифтор-1-(6'-фтор-[3,3'-бипиридин]-6-ил)-3-(1H-тетразол-1-ил)пропан-2-ол (31);
2-(2,4-дифторфенил)-1,1-дифтор-1-(5-(5-метокситиофен-2-ил)пиридин-2-ил)-3-(1Н-тетразол-1-ил)пропан-2-ол (32);
1-(5-(5-(дифторметил)тиофен-2-ил)пиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (33);
2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)-1-(5-(5-(трифторметил)тиофен-2-ил)пиридин-2-ил)пропан-2-ол (34);
2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)-1-(6'-(трифторметил)-[3,3'-бипиридин]-6-ил)пропан-2-ол (35);
1-(5-(5-бромтиазол-2-ил)пиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1Н-тетразол-1-ил)пропан-2-ол (36);
2-(2,4-дифторфенил)-1,1-дифтор-1-(5-(2-метоксипиримидин-5-ил)пиридин-2-ил)-3-(1H-тетразол-1-ил)пропан-2-ол (37);
2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)-1-(5-(тиазол-2-ил)пиридин-2-ил)пропан-2-ол (38);
2-(4-хлор-2-фторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)-1-(5-(2,2,2-трифторэтил)пиридин-2-ил)пропан-2-ол (39);
2-(4-хлор-2-фторфенил)-1-(5-циклопропилпиридин-2-ил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (40);
метил-2-((6-(2-(2,4-дифторфенил)-1,1-дифтор-2-гидрокси-3-(1H-тетразол-1-ил)пропил)пиридин-3-ил)тио)ацетат (41);
(Е)-1-(5-(3-(1H-тетразол-1-ил)проп-1-ен-1-ил)пиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (42);
(Е)-3-(6-(2-(2,4-дифторфенил)-1,1-дифтор-2-гидрокси-3-(1H-тетразол-1-ил)пропил)пиридин-3-ил)проп-2-ен-1-ол (43);
3-(6-(2-(2,4-дифторфенил)-1,1-дифтор-2-гидрокси-3-(1H-тетразол-1-ил)пропил)пиридин-3-ил)пропан-1-ол (44);
2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)-1-(5-(3-(2,2,2-трифторэтокси)пропил)пиридин-2-ил)пропан-2-ол (45);
(Е)-4-(6-(2-(2,4-дифторфенил)-1,1-дифтор-2-гидрокси-3-(1H-тетразол-1-ил)пропил)пиридин-3-ил)бут-3-ен-2-ол (46);
4-(6-(2-(2,4-дифторфенил)-1,1-дифтор-2-гидрокси-3-(1H-тетразол-1-ил)пропил)пиридин-3-ил)бутан-2-ол (47);
(E)-2-(2,4-дифторфенил)-1,1-дифтор-1-(5-(3-метоксипроп-1-ен-1-ил)пиридин-2-ил)-3-(1H-тетразол-1-ил)пропан-2-ол (48);
(Z)-2-(2,4-дифторфенил)-1,1-дифтор-1-(5-(3-метоксипроп-1-ен-1-ил)пиридин-2-ил)-3-(1H-тетразол-1-ил)пропан-2-ол (49);
2-(2,4-дифторфенил)-1,1-дифтор-1-(5-(3-метоксипропил)пиридин-2-ил)-3-(1H-тетразол-1-ил)пропан-2-ол (50);
(E)-2-(2,4-дифторфенил)-1-(5-(3-этоксипроп-1-ен-1-ил)пиридин-2-ил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (51);
(Z)-2-(2,4-дифторфенил)-1-(5-(3-этоксипроп-1-ен-1-ил)пиридин-2-ил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (52);
2-(2,4-дифторфенил)-1-(5-(3-этоксипропил)пиридин-2-ил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (53);
(E)-2-(2,4-дифторфенил)-1,1-дифтор-1-(5-(3-изопропоксипроп-1-ен-1-ил)пиридин-2-ил)-3-(1H-тетразол-1-ил)пропан-2-ол (54);
2-(2,4-дифторфенил)-1,1-дифтор-1-(5-(3-изопропоксипропил)пиридин-2-ил)-3-(1H-тетразол-1-ил)пропан-2-ол (55);
1-(5-(2-хлорпиримидин-5-ил)пиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (56);
2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)-1-(5-(2,2,2-трифтор-1-гидроксиэтил)пиридин-2-ил)пропан-2-ол (57);
2-(5-бромпиридин-2-ил)-1-(2,4-дифторфенил)-2,2-дифтор-1-(пиримидин-5-ил)этанол (58);
1-(5-(циклопропилметил)пиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (59);
2-(4-хлор-2-фторфенил)-1-(5-(циклопропилметил)пиридин-2-ил)-1,1-дифтор-3-(1Н-тетразол-1-ил)пропан-2-ол (60);
1-(5-аллилпиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (61);
1-(5-бромпиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-пиразол-3-ил)пропан-2-ол (62);
1-(5-(2Н-1,2,3-триазол-2-ил)пиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-пиразол-3-ил)пропан-2-ол (63);
1-(5-(1H-1,2,3-триазол-1-ил)пиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-пиразол-3-ил)пропан-2-ол (64);
2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-пиразол-4-ил)-1-(пиридин-2-ил)пропан-2-ол (65);
(6-(2-(2,4-дифторфенил)-1,1-дифтор-2-гидрокси-3-(1H-тетразол-1-ил)пропил)пиридин-3-ил)(4-(трифторметил)фенил)метанон (66);
(4-хлорфенил)(6-(2-(2,4-дифторфенил)-1,1-дифтор-2-гидрокси-3-(1H-тетразол-1-ил)пропил)пиридин-3-ил)метанон (67);
(6-(2-(2,4-дифторфенил)-1,1-дифтор-2-гидрокси-3-(1H-тетразол-1-ил)пропил)пиридин-3-ил)(4-(2,2,2-трифторэтокси)фенил)метанон (68);
(6-(2-(2,4-дифторфенил)-1,1-дифтор-2-гидрокси-3-(1H-тетразол-1-ил)пропил)пиридин-3-ил)(4-фторфенил)метанон (69);
(3,4-дифторфенил)(6-(2-(2,4-дифторфенил)-1,1-дифтор-2-гидрокси-3-(1H-тетразол-1-ил)пропил)пиридин-3-ил)метанон (70);
(4-хлор-3-фторфенил)(6-(2-(2,4-дифторфенил)-1,1-дифтор-2-гидрокси-3-(1H-тетразол-1-ил)пропил)пиридин-3-ил)метанон (71);
2-(2,4-дифторфенил)-1,1-дифтор-1-(5-(гидрокси(4-(трифторметил)фенил)метил)пиридин-2-ил)-3-(1H-тетразол-1-ил)пропан-2-ол (72);
2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)-1-(5-(4-(трифторметил)бензил)пиридин-2-ил)пропан-2-ол (73);
1-(5-((4-хлорфенил)дифторметил)пиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (74);
1-(5-бензилпиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (75);
2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)-1-(5-(4-(трифторметокси)бензил)пиридин-2-ил)пропан-2-ол (76);
1-(5-(4-хлорбензил)пиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (77);
1-(5-(5-бромтиофен-2-ил)пиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (78);
4-((6-(2-(2,4-дифторфенил)-1,1-дифтор-2-гидрокси-3-(1H-тетразол-1-ил)пропил)пиридин-3-ил)метокси)бензонитрил (79);
4-((6-(2-(2,4-дифторфенил)-1,1-дифтор-2-гидрокси-3-(2H-тетразол-2-ил)пропил)пиридин-3-ил)метокси)бензонитрил (80);
2-(2,4-дифторфенил)-1,1-дифтор-1-(5-морфолинопиридин-2-ил)-3-(1H-тетразол-1-ил)пропан-2-ол (81);
2-(2,4-дифторфенил)-1,1-дифтор-1-(5-(пиперидин-1-ил)пиридин-2-ил)-3-(1H-тетразол-1-ил)пропан-2-ол (82);
1-(5-бромпиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(оксазол-5-ил)пропан-2-ол (83);
2-(2,4-дифторфенил)-1,1-дифтор-1-(пиридин-2-ил)-3-(тиазол-5-ил)пропан-2-ол (86);
1-(5-(5-хлортиофен-2-ил)пиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (87);
4-((6-(2-(2,4-дифторфенил)-1,1-дифтор-2-гидрокси-3-(1Н-тетразол-1-ил)пропил)пиридин-3-ил)метокси)-3-фторбензонитрил (88);
3-((6-(2-(2,4-дифторфенил)-1,1-дифтор-2-гидрокси-3-(1Н-тетразол-1-ил)пропил)пиридин-3-ил)метокси)-2-фторбензонитрил (89);
4-(((6-(2-(2,4-дифторфенил)-1,1-дифтор-2-гидрокси-3-(1Н-тетразол-1-ил)пропил)пиридин-3-ил)метил)тио)-3-фторбензонитрил (90);
2-(2,4-дифторфенил)-1,1-дифтор-1-(5-(изопропоксиметил)пиридин-2-ил)-3-(1H-тетразол-1-ил)пропан-2-ол (91);
1-(5-((дифторметокси)метил)пиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1Н-тетразол-1-ил)пропан-2-ол (92);
1-(5-хлор-[2,3'-бипиридин]-6'-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1Н-тетразол-1-ил)пропан-2-ол (93);
2-(2,4-дифторфенил)-1,1-дифтор-3-(1Н-тетразол-1-ил)-1-(5-(трифторметил)-[2,3'-бипиридин]-6'-ил)пропан-2-ол (94);
6'-(2-(2,4-дифторфенил)-1,1-дифтор-2-гидрокси-3-(1H-тетразол-1-ил)пропил)-[2,3'-бипиридин]-5-карбонитрил (95);
1-([3,4'-бипиридин]-6-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1Н-тетразол-1-ил)пропан-2-ол (96);
1-(5-((6-хлорпиридин-3-ил)метил)пиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1Н-тетразол-1-ил)пропан-2-ол (97);
6-((6-(2-(2,4-дифторфенил)-1,1-дифтор-2-гидрокси-3-(1Н-тетразол-1-ил)пропил)пиридин-3-ил)метокси)никотинонитрил (98);
2-(2,4-дифторфенил)-1,1-дифтор-3-(1Н-тетразол-1-ил)-1-(5-(((5-(трифторметил)пиридин-2-ил)окси)метил)пиридин-2-ил)пропан-2-ол (99);
1-(5-(((3-хлор-5-(трифторметил)пиридин-2-ил)окси)метил)пиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1Н-тетразол-1-ил)пропан-2-ол (100);
1-(5-(дифтор(4-фторфенил)метил)пиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1Н-тетразол-1-ил)пропан-2-ол (101);
1-(5-(дифтор(4-(трифторметил)фенил)метил)пиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1Н-тетразол-1-ил)пропан-2-ол (102) или
4-((6-(2-(2,4-дифторфенил)-1,1-дифтор-2-гидрокси-3-(1Н-тетразол-1-ил)пропил)пиридин-3-ил)дифторметил)бензонитрил (103).
13. Способ лечения субъекта, страдающего от металлофермент-опосредованного заболевания или нарушения или подверженного ему, где субъект был идентифицирован как нуждающийся в лечении металлофермент-опосредованного заболевания или нарушения, содержащий введение указанному субъекту, нуждающемуся в этом, эффективного количества соединения по п.1.
14. Способ по п.13, где заболевание или нарушение вызвано ланостерол деметилазой (CYP51).
15. Способ по п.13, где заболеванием или нарушением является рак, сердечно-сосудистое заболевание, эндокринологическое заболевание, воспалительное заболевание, инфекционное заболевание, гинекологическое заболевание, нарушение обмена веществ, офтальмологическое заболевание, заболевание центральной нервной системы, урологическое заболевание или желудочно-кишечное заболевание.
16. Способ по п.13, где заболеванием или нарушением является системная грибковая инфекция или оникомикоз.
17. Композиция для лечения или профилактики металлофермент-опосредованного заболевания или нарушения у субъекта, содержащая соединение по п.1 и фармацевтически приемлемый носитель.
18. Композиция по п.17, дополнительно содержащая дополнительное терапевтическое средство, выбранное из одного или более из группы, включающей противораковое средство, противогрибковое средство, сердечно-сосудистое средство, противовоспалительное средство, химиотерапевтическое средство, антиангиогенное средство, цитотоксическое средство, антипролиферативное средство, средство для лечения нарушения обмена веществ, средство для лечения офтальмологических заболеваний, средство для лечения заболеваний центральной нервной системы, средство для лечения урологических заболеваний или средство для лечения желудочно-кишечных заболеваний.
19. Применение соединения формулы I или его соли для лечения или профилактики металлофермент-опосредованного заболевания или нарушения у субъекта.
Текст
Изобретение относится к соединениям, обладающим модулирующей активностью в отношении металлоферментов, и способам лечения заболеваний, нарушений или их симптомов,опосредованных такими металлоферментами. Уровень техники Живые организмы имеют развитые глубоко регулируемые процессы, которые специфически импортируют металлы, переносят их во внутриклеточные сайты хранения и в результате переносят их в сайты применения. Одной из наиболее важных функций металлов, таких как цинк и железо, в биологических системах является способность активировать металлоферменты. Металлоферментами являются ферменты, которые включают металлические ионы в активном сайте фермента и используют металл как часть каталитического процесса. Более трети всех охарактеризованных ферментов составляют металлоферменты. Функция металлоферментов сильно зависит от присутствия иона металла в активном сайте фермента. Хорошо известно, что агенты, которые связываются с металлическим ионом активного сайта и инактивируют его, критическим образом понижают активность фермента. В природе действует та же самая стратегия понижения активности определенных металлоферментов в ходе периодов, когда ферментативная активность нежелательна. Например, белок TIMP (тканевый ингибитор металлопротеаз) связывается с ионом цинка в активном сайте различных матриксных ферментов металлопротеаз и, таким образом,затормаживает ферментативную активность. В фармацевтической промышленности применялась та же самая стратегия при создании терапевтических агентов. Например, азольные противогрибковые агенты флуконазол и вориконазол содержат 1-(1,2,4-триазольную) группу, которая связывается с гем-железом,присутствующим в активном сайте целевого фермента ланостерол деметилазы и, таким образом, инактивирует фермент. Другим примером является связывающая цинк группа гидроксаминовой кислоты, которая была включена в наиболее известные ингибиторы матриксных металлопротеиназ и гистондеацетилаз. Другим примером является связывающая цинк группа карбоновой кислоты, которая была включена в наиболее известные ингибиторы ангиотензин-превращающих ферментов. При создании клинически безопасных и эффективных ингибиторов металлоферментов критическое значение имеет применение металл-связывающей группы, наиболее подходящей для конкретной цели и клинической индикации. Если применяется слабо связывающая металл-связывающая группа, эффективность может быть субоптимальной. С другой стороны, если применяется очень сильно связывающая металл-связывающая группа, селективность для целевого фермента по отношению к родственным металлоферментам может быть субоптимальной. Отсутствие оптимальной селективности может быть причиной клинической токсичности из-за непреднамеренного ингибирования этих нецелевых металлоферментов. Одним примером такой клинической токсичности является непреднамеренное ингибирование ферментов человека, метабилизирующих лекарственные средства, таких как Р 450 2 С 9 (CYP2C9), CYP2C19 иCYP3A4, доступными в настоящее время азольными противогрибковыми средствами, такими как флуконазол и вориконазол. Предполагают, что такое нецелевое ингибирование вызвано, прежде всего, неселективным связыванием применяемого в настоящее время 1-(1,2,4-триазола) с железом в активном сайтеCYP2C9, CYP2C19 и CYP3A4. Другим примером этого является суставная боль, которая наблюдалась при многих клинических испытаниях ингибиторов матриксных металлопротеиназ. Эта токсичность рассматривается как связанная с ингибированием нецелевых металлоферментов из-за неселективного связывания группы гидроксаминовой кислоты с цинком в нецелевых активных сайтах. Поэтому поиск металл-связывающих групп, которые могут достигнуть более хорошего баланса между эффективностью и селективностью, остается важной целью и был бы существенным для создания терапевтических средств и способов, для того чтобы удовлетворить неудовлетворенные в настоящее время потребности в лечении и профилактики заболеваний, нарушений и их симптомов. Фунгицидами являются соединения, природного или синтетического происхождения, которые действуют для защиты и лечения растения от повреждения, вызванного сельскохозяйственно важными грибками. В общем, никакой конкретный фунгицид не может быть полезен во всех ситуациях. Следовательно, поиск продолжается в настоящее время для получения фунгицидов, которые могут обладать более хорошей эффективностью, являются более легкими для применения, и обладают меньшей стоимостью. Настоящее изобретение относится к соединениям формулы I, показанным ниже, их производным и их применению в качестве фунгицидов. Соединения согласно настоящему изобретению могут обеспечивать защиту от аскомицетов, базидиомицетов, дейтеромицетов и оомицетов. Сущность изобретения Настоящее изобретение направлено на соединения (например, любое из приведенных в настоящем описании), способы модуляции активности металлоферментов и способы лечения заболеваний, нарушений или их симптомов. Способы могут основываться на соединениях, приведенных в описании настоящего изобретения. Одним объектом настоящего изобретения является соединение формулы I или его соль, сольват, Формула I где MBG представляет собой тетразолил, оксазолил, пиримидинил, тиазолил или пиразолил;R3 независимо представляет собой атом водорода (Н), C1-C6-алкил, C2-C6-алкенил, циклопропил,5-6-членный гетероарил, содержащий 1, 2 или 3 независимых атома S, N или О, C1-C6-гидроксиалкил,иано, C1-C6-галоалкил, гало, -O)фенил, -CH(OH)(фенил), -CH2(фенил), -CH2(пиридил), -CF2(фенил),-CF2(пиридил), -CH2O(фенил), -CH2O(пиридил), -CH2S(O)x(фенил),и 6-членный циклический амино, необязательно содержащий О, где каждый может быть необязательно замещен 1, 2 или 3 независимыми заместителями R7;R5 независимо представляет собой атом водорода (Н) или гало;R6 независимо представляет собой атом водорода (Н) или гало; каждый R7 независимо представляет собой циано, циклопропил, C1-C6-галоалкил, гидрокси,C1-C6-алкокси, гало, C1-C6-галоалкокси, -C(O)-C1-С 6-алкил, -C(O)OH, -C(O)О-C1-C6-алкил и каждый R8 независимо представляет собой гало;R9 представляет собой атом водорода (Н);R10 представляет собой атом водорода (Н); х независимо равен 0. Другими объектами настоящего изобретения являются соединения любой из приведенных в настоящем изобретении формул, гдеR3 представляет собой пиридил, пиримидинил, тиенил или триазолил, причем каждый независимо замещен 1, 2 или 3 независимыми R7;R3 представляет собой 3-пиридил, 4-пиримидинил, 2-тиенил или 2 Н-1,2,3-триазолил, причем каждый независимо замещен 1, 2 или 3 независимыми R7;R3 представляет собой пиридил, пиримидинил, тиенил или триазолил, причем каждый независимо замещен 1, 2 или 3 независимыми R7; где R1 представляет собой фтор;R3 представляет собой гало. Соединения согласно настоящему изобретению включают те, которые идентифицируется как достигающее аффинности, по меньшей мере частично, с металлоферментом путем образования одной или более из следующих типов химических взаимодействий или связей с металлом: сигма-связи, ковалентные связи, ковалентно-координационные связи, ионные связи, пи-связи, дельта-связи или взаимодействия обратного связывания. Соединения могут также достигать аффинности посредством более слабого взаимодействия с металлом, как, например, Ван-дер-Ваальсовы взаимодействия, пи-катионные взаимодействия, пи-анионные взаимодействия, диполь-дипольные взаимодействия, ион-дипольные взаимодействия. В одном варианте выполнения настоящего изобретения соединение идентифицируется как способное к взаимодействию связыванием с металлом через тетразолильную составляющую, триазолильную составляющую или пиразолильную составляющую соответственно. В одном варианте выполнения настоящего изобретения соединение идентифицируется как способное к взаимодействию связыванием с металлом через 1-тетразолильную составляющую; в другом варианте выполнения настоящего изобретения соединение идентифицируется как способное к взаимодействию связыванием с металлом через N2 атом 1-тетразолильной составляющей; в другом варианте выполнения настоящего изобретения соединение идентифицируется как способное к взаимодействию связыванием с металлом через N3 атом 1-тетразолильной составляющей; в другом варианте выполнения настоящего изобретения соединение идентифицируется как способное к взаимодействию связыванием с металлом через N4 атом 1-тетразолильной составляющей. Способы содействия металл-лиганд связывающим взаимодействиям известны в данной области техники, как приведено в ссылках, включающих, например, "Principles of Bioinorganic Chemistry" byGray, Ed Stiefel, Joan Valentine, University Science Books (2007); Xue et al. "Nature Chemical Biology",vol. 4, no. 2, 107-109 (2008). В конкретных вариантах выполнения настоящего изобретения соединения согласно настоящему изобретению выбираются из следующих соединений формулы (I) (и их фармацевтически приемлемых солей, сольватов или гидратов): 1-(5-бромпиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (1); 2-(2,4-дифторфенил)-1,1-дифтор-1-(пиридин-2-ил)-3-(1H-тетразол-1-ил)пропан-2-ол (2);(93); 2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)-1-(5-(трифторметил)-[2,3'-бипиридин]-6'ил)пропан-2-ол (94); 6'-(2-(2,4-дифторфенил)-1,1-дифтор-2-гидрокси-3-(1 Н-тетразол-1-ил)пропил)-[2,3'-бипиридин]-5 карбонитрил (95); 1-([3,4'-бипиридин]-6-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1 Н-тетразол-1-ил)пропан-2-ол (96); 1-(5-6-хлорпиридин-3-ил)метил)пиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1 Н-тетразол-1 ил)пропан-2-ол (97); 6-6-(2-(2,4-дифторфенил)-1,1-дифтор-2-гидрокси-3-(1 Н-тетразол-1-ил)пропил)пиридин-3 ил)метокси)никотинонитрил (98); 2-(2,4-дифторфенил)-1,1-дифтор-3-(1 Н-тетразол-1-ил)-1-(5-5-(трифторметил)пиридин-2 ил)окси)метил)пиридин-2-ил)пропан-2-ол (99); 1-(5-3-хлор-5-(трифторметил)пиридин-2-ил)окси)метил)пиридин-2-ил)-2-(2,4-дифторфенил)-1,1 дифтор-3-(1 Н-тетразол-1-ил)пропан-2-ол (100); 1-(5-(дифтор(4-фторфенил)метил)пиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1 ил)пропан-2-ол (101); 1-(5-(дифтор(4-(трифторметил)фенил)метил)пиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1 Нтетразол-1-ил)пропан-2-ол (102); 4-6-(2-(2,4-дифторфенил)-1,1-дифтор-2-гидрокси-3-(1 Н-тетразол-1-ил)пропил)пиридин-3 ил)дифторметил)бензонитрил (103). Другим объектом настоящего изобретения является соединение любой из приведенных в настоящем изобретении формул (например, формулы I), где соединение ингибирует (или идентифицируется как ингибирующее) ланостерол деметилазу (CYP51). Другим объектом настоящего изобретения является соединение любой приведенной в описании настоящего изобретения формулы, где соединение идентифицируется как имеющее диапазон активности против целевого организма (например, минимальная подавляющая концентрация (MIC) для С.albicans 0.25 мкг/мл; минимальная подавляющая концентрация (MIC) для S.tritici 0.5 мкг/мл; например, минимальная подавляющая концентрация (MIC) для P.triticina 0.5 мкг/мл). Другим объектом настоящего изобретения является фармацевтическая композиция, содержащая соединение любой из приведенных в настоящем изобретении формул (например, формулы I) и фармацевтически приемлемый носитель. Другим объектом настоящего изобретения является способ модуляции активности металлофермента у субъекта, содержащий контакт субъекта с соединением любой из приведенных в настоящем изобретении формул (например, формулы I), в количестве и при условиях, достаточных для модуляции активности металлофермента. Другим объектом настоящего изобретения является способ лечения субъекта, страдающего от связанного с металлоферментом заболевания или нарушения, или подверженного ему, содержащий введение субъекту эффективного количества соединения любой из приведенных в настоящем изобретении формул (например, формулы I) или его фармацевтической композиции. Другим объектом настоящего изобретения является способ лечения субъекта, страдающего от связанного с металлоферментом заболевания или нарушения, или подверженного ему, где субъект был идентифицирован как нуждающийся в лечении связанного с металлоферментом нарушения или заболевания, содержащий введение указанному субъекту, нуждающемуся в этом, эффективного количества соединения любой из приведенных в настоящем изобретении формул (например, формулы I) или его фармацевтической композиции, так что субъект лечится от указанного заболевания. Другим объектом настоящего изобретения является лечения субъекта, страдающего от связанного с металлоферментом заболевания или нарушения, или подверженного ему, где субъект был идентифицирован как нуждающийся в лечении связанного с металлоферментом нарушения или заболевания, содержащий введение указанному субъекту, нуждающемуся в этом, эффективного количества соединения любой из приведенных в настоящем изобретении формул (например, формулы I) или его фармацевтической композиции, так что модулируется активность металлофермента у указанного субъекта (например, понижается, ингибируется). Способы согласно настоящему изобретению включают те, в которых заболевание или нарушение опосредовано любым ферментом из 4-гидроксифенилпируватдиоксигеназы, 5-липоксигеназы, аденозиндеаминазы, спиртовой дегидрогеназы, аминопептидазы n, ангиотензин-превращающего фермента, ароматазы (CYP19), кальциневрина, карбамоилфосфат-синтазы, семейства углеродной ангидразы, катехоло-метилтрансферазы, семейства циклооксигеназы, дигидропиримидиндегидрогеназы-1, ДНК полимеразы, фарнезилдифосфат синтазы, фарнезилтрансферазы, фумаратредуктазы, GABA аминотрансферазы,HIF-пролилгидроксилазы, семейства гистондеацетилазы, ВИЧ интегразы, ВИЧ-1 обратной транскриптазы, изолейцин-тРНК-лигазы, ланостерол деметилазы (CYP51), семейства матриксной металлопротеазы,метионинаминопептидазы, природной эндопептидазы, семейства синтазы оксида азота, фосфодиэстеразы Ш, фосфодиэстеразы IV, фосфодиэстеразы V, пируват ферредоксин оксидоредуктазы, почечной пептидазы, рибонуклеозид-дифосфат-редуктазы, тромбоксансинтазы (CYP5a), тироидпероксидазы, тирозиназы, уреазы или ксантиноксидазы. Способы согласно настоящему изобретению включают те, в которых заболевание или нарушение опосредовано любым ферментом из 1-дезокси-d-ксилулоза-5-фосфат редуктоизомеразы (DXR),17-альфа гидроксилазы/17,20-лиазы (CYP17), альдостерон синтазы (CYP11B2), аминопептидазы р, летального фактора антракса, аргиназы, бета-лактамазы, цитохрома Р 450 2 А 6, d-ala d-ala лигазы, допаминбета-гидроксилазы, эндотелии превращающего фермента-1, глютамат карбоксипептидазы II, глутаминил циклазы, глиоксалазы, гем-оксигеназы, HPV/HSV E1 геликазы, индоламина 2,3-диоксигеназы, лейкотриен А 4 гидролазы, метионинаминопептидазы 2, пептиддеформилазы, фосфодиэстеразы VII, релаксазы,гидроксилазы ретиноевой кислоты (CYP26), TNF-альфа превращающего фермента (ТАСЕ),UDP-(3-O-(R-3-гидроксимиристоил-N-ацетилглюкозамин деацетилазы (LpxC), белка-1 сосудистой адгезии (VAP-1) или витамин D гидроксилазы (CYP24). Способы согласно настоящему изобретению включают те, в которых заболеванием или нарушением является рак, сердечно-сосудистое заболевание, воспалительное заболевание, инфекционное заболевание, нарушение обмена веществ, офтальмологическое заболевание, заболевание центральной нервной системы (ЦНС), урологическое заболевание или желудочно-кишечное заболевание. Способы согласно настоящему изобретению включают те, в которых заболеванием или нарушением является рак предстательной железы, рак молочной железы, воспалительная болезнь кишечника, псориаз, системный микоз, микоз кожной структуры, микоз слизистой оболочки или онихомикоз. Способы, описанные в настоящем изобретении, включают те, в которых субъект идентифицируется как нуждающийся в конкретно установленном лечении. Идентификация субъекта как нуждающегося в таком лечении может являться оценкой субъекта или профессионального работника в области здравоохранения и может быть субъективной (например, мнение) или объективной (например, определение с помощь способа тестирования или диагностики). Подробное описание изобретения Определения. Для того чтобы можно было более легко понять настоящее изобретение, прежде всего для удобства приводятся определения некоторых терминов. Как применяется в описании настоящего изобретения термин "лечение" заболевания охватывает профилактику, улучшение, смягчение и/или координацию нарушения и/или состояний, которые могут вызывать нарушение. Термины "лечение" и "терапия" относятся к способу облегчения или ослабления заболевания и/или сопровождающих его симптомов. В соответствии с настоящим изобретением термин"лечение" включает профилактику, блокирование, ингибирование, ослабление, защиту, модуляцию, реверсирование эффектов, вызванных нарушением, и уменьшение наличия, например, вредных эффектов,вызванных нарушением. Как применяется в описании настоящего изобретения, термин "ингибирование" охватывает предупреждение, уменьшение и остановку развития. Необходимо отметить, что термин "ингибирование фермента" (например, ингибирование металлофермента) уточняется и описывается ниже. Как применяется в описании настоящего изобретения, термин "модулировать" относится к повышению или уменьшению активности фермента в ответ на воздействие соединения по изобретению. Термины "выделенный", "очищенный" или "биологически чистый" относятся к материалу, который является по существу или существенно свободным от компонентов, которые, как правило, сопутствуют ему в его природном состоянии. Чистота и гомогенность, как правило, определяются с применением аналитических химических методик, таких как электрофорез на полиакриламидном геле и высокоэффективная жидкостная хроматография. В частности, в вариантах выполнения настоящего изобретения соедине-7 024385 ние имеет чистоту по меньшей мере 85%, более предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95% и наиболее предпочтительно по меньшей мере 99%. Термин "ввод" или "введение" включает маршруты введения соединения(ий) субъекту для осуществления предназначенной им функции. Примеры маршрутов введения, которые могут применяться,включают инъекцию (подкожную, внутривенное, парентеральное, интраперитонеальное, интратекальное введение), местное введение, пероральное введение, ингаляцию, ректальное введение и трансдермальное введение. Термин "эффективное количество" включает количество, эффективное при дозах и в течение необходимых периодов времени, для достижения желательного результата. Эффективное количество соединения может варьироваться в соответствии с факторами, такими как болезненное состояние, возраст и масса субъекта, и способность соединения вызывать желательный ответ у субъекта. Режимы введения доз могут регулироваться для обеспечения оптимального терапевтического эффекта. Эффективным количеством также является количество, при котором терапевтические благоприятные эффекты соединения-ингибитора преобладают над токсическими или вредными эффектами (например, побочные эффекты) этого соединения. Фразы "системное введение", "введенный системно", "периферийное введение" и "введенный периферийно", как применяется в описании настоящего изобретения, означают введение соединения(ий),лекарственного средства или другого материала таким образом, что оно включается в систему пациента и, таким образом, подвергается метаболизму и другим подобным процессам. Термин "терапевтически эффективное количество" относится к количеству соединения, подлежащего введению, достаточному для предупреждения развития или улучшению до некоторой степени одного или более симптомов состояния или нарушения, подлежащих лечению. Терапевтически эффективное количество соединения (т.е. эффективная доза) может находиться в интервале от около 0.005 до около 200 мг/кг, предпочтительно от около 0.01 до около 200 мг/кг, более предпочтительно от около 0.015 до около 30 мг/кг массы тела. В других вариантах выполнения настоящего изобретения терапевтически эффективное количество может находиться в интервале от около 1.0 пМ до около 10 мкМ, от около 1.0 пМ до около 50 мкМ и от около 1.0 пМ до около 100 мкМ. Специалисту в данной области техники будет очевидно, что определенные факторы могут влиять на дозу, необходимую для эффективного лечения субъекта, включая, но без ограничения к этому, серьезность заболевания или нарушения, предшествующее лечение, общее состояние здоровья и/или возраст субъекта и другие имеющиеся заболевания. Более того, лечение субъекта с применением терапевтически эффективного количества соединения может включать однократное лечение или предпочтительно может включать серию лечений. В одном примере субъекта лечат с применением соединения в количестве от около 0.005 мкг/кг до около 200 мг/кг массы тела, один раз в день в течение периода времени от 1 до 10 недель,предпочтительно от 2 до 8 недель, более предпочтительно от около 3 до 7 недель и даже более предпочтительно в течение около 4, 5 или 6 недель. В другом примере субъект может подвергаться лечению ежедневно в течение нескольких лет в случае хронического состояния или заболевания. Должно быть оценено по достоинству, что эффективная доза соединения, применяемого для лечения, может повышаться или понижаться в ходе конкретного лечения. Термин "хиральная" относится к молекулам, которые обладаю свойством несовпадения при наложении с партнером зеркального отражения, тогда как термин "ахиральная" относится к молекулам, которые обладаю свойством совпадения с их зеркальным отражением. Термин "диастереомеры" относится к стереоизомерам с двумя или более центрами асимметрии, молекулы которых не являются зеркальным отражением друг друга. Термин "энантиомера" относится к двум стереоизомерам соединения, которые не являются зеркальным отражением друг друга. Эквимолярная смесь двух энантиомеров называется "рацемической смесью" или "рацематом". Термин "изомеры" или "стереоизомеры" относится к соединениям, которые имеют идентичный химический состав, но различаются с точки зрения расположения атомов или групп в пространстве. Термин "пролекарство" включает соединения с составляющими, которые могут подвергаться метаболизму in vivo. В общем, пролекарства метаболизируются in vivo эстеразами или посредством других механизмов до активных лекарственных средств. Примеры пролекарств и их применения хорошо известны в данной области техники (см., например, Berge et al. (1977), "Pharmaceutical Salts", J. Pharm. Sci. 66:1-19). Пролекарства могут быть получены in situ в ходе конечного выделения и очищения соединений или путем отдельной реакции очищенного соединения в его свободной кислотной форме или в форме гидроксила с подходящим эстерифицирующим агентом. Гидроксильные группы могут быть превращены в сложные эфиры путем обработки карбоновой кислотой. Примеры пролекарственных составляющих включают составляющие на основе сложных эфиров замещенных и незамещенных разветвленных или неразветвленных низших алкилов (например, сложные эфиры пропионовой кислоты), низший алкенилсложные эфиры, ди-низший алкиламино-низший алкил-сложные эфиры (например, диметиламиноэтиловый сложный эфир), ациламино-низший алкил-сложные эфиры (например, ацетилоксиметиловый сложный эфир), ацилокси-низший алкил-сложные эфиры (например, пивалоилоксиметиловый сложный эфир), ариловые сложные эфиры (фениловый сложный эфир), арил-низший алкил-сложные эфиры (например, бензиловый сложный эфир), замещенный (например, метил, галоген или метокси заместителями) арил и арил-низший алкил-сложные эфиры, амиды, низший алкил-амиды, ди-низший алкиламиды и гидроксиамиды. Предпочтительными пролекарственными составляющими являются сложные эфиры пропионовой кислоты и ациловые сложные эфиры. Пролекарства, которые превращаются в активные формы через другие механизмы in vivo, также включены в настоящее изобретение. В вариантах выполнения настоящего изобретения соединения по настоящему изобретению представляют собой пролекарства любой из формул, приведенных в настоящем документе. Термин "субъект" относится к животным, таким как млекопитающие, включая, но без ограничения к этому, приматов (например, людей), коров, овец, козлов, лошадей, собак, кошек, кроликов, крыс, мышей и т.п. В определенных вариантах выполнения настоящего изобретения субъектом является человек. Ветеринарные использования или применения относятся к применению, в котором субъектом является млекопитающее, отличное от человека. Формы единственного числа относятся к "одному или более", при применении в описании настоящего изобретения, включая формулу изобретения. Таким образом, например, ссылка на "образец" включает множество образцов, если из контекста ясным образом не следует иное (например, множество образцов), и так далее. В описании изобретения и в формуле изобретения слова "содержат", "содержит" и "содержание" применяются в смысле, обозначающем отсутствие исключения, если из контекста не следует иное. Как применяется в описании настоящего изобретения, термин "около", применяемый в отношении значения, означает и охватывает его вариации, в некоторых вариантах выполнения изобретения 20%, в некоторых вариантах выполнения изобретения 10%, в некоторых вариантах выполнения изобретения 5%, в некоторых вариантах выполнения изобретения 1%, в некоторых вариантах выполнения изобретения 0.5% и в некоторых вариантах выполнения изобретения 0.1% от конкретного количества, так как такие вариации подходят для осуществления заявленных способов или применения заявленных композиций. Термин "ингибитор" в описании настоящего изобретения означает молекулу, которая проявляет ингибирующую активность в отношении металлофермента. Термин "ингибировать" при применении в описании настоящего изобретения означает понижение активности металлофермента по сравнению с активностью металлофермента в отсутствие ингибитора. В некоторых вариантах выполнения настоящего изобретения термин "ингибирование" означает понижение активности металлофермента по меньшей мере примерно на 5%, по меньшей мере около 10%, по меньшей мере около 20%, по меньшей мере около 25%,по меньшей мере около 50%, по меньшей мере около 60%, по меньшей мере около 70%, по меньшей мере около 80%, по меньшей мере около 90% или по меньшей мере около 95%. В других вариантах выполнения настоящего изобретения ингибирование означает понижение активности металлофермента на примерно от 5 до около 25%, от около 25 до около 50%, от около 50 до около 75% или от около 75 до 100%. В некоторых вариантах выполнения настоящего изобретения ингибирование означает понижение активности металлофермента примерно на 95-100%, например, понижение активности фермента на 95,96, 97, 98, 99 или 100%. Такие понижения могут быть измерены с применением множества методик, которые известны специалистам в данной области техники. Конкретный анализ измерения индивидуальной активности описывается ниже. Кроме того, соединения по настоящему изобретению включают олефины, имеющие одну из двух геометрий: "Z" относится к геометрии, которая обозначается как "цис" (та же сторона) конфигурация,тогда как "Е" относится к геометрии, которая обозначается как "транс" (противоположная сторона) конфигурация. В отношении номенклатуры хирального центра применяются термины "d" и "l" конфигурация, как определено согласно рекомендациям ИЮПАК. Термины "диастереомер", "рацемат", "эпимер" и"энантиомер" применяются в описании настоящего изобретения в их обычном контексте для описания стереохимии препаратов. Как применяется в описании настоящего изобретения, термин "R" относится к группе, содержащейC1-8 алкил, С 3-8 алкенил или С 3-8 алкинил, если иного не указано. Как применяется в описании настоящего изобретения, термин "алкил" относится к неразветвленной или разветвленной углеводородной группе, содержащей от 1 до 12 атомов углерода. Термин "низший алкил" относится к C1-C6-алкильной цепи. Примеры алкильных групп включают метил, этил, н-пропил,изопропил, трет-бутил и н-пентил. Алкильные группы могут быть при необходимости замещены одним или более заместителями. Термин "алкенил" относится к ненасыщенной углеводородной цепи, которая может быть неразветвленной цепью или разветвленной цепью, содержащей от 2 до 12 атомов углерода и по меньшей мере одну углерод-углеродную двойную связь. Алкенильные группы могут быть необязательно замещены одним или более заместителями. Термин "алкинил" относится к ненасыщенной углеводородной цепи, которая может быть неразветвленной цепью или разветвленной цепью, содержащей от 2 до 12 атомов углерода и по меньшей мере одну углерод-углеродную тройную связь. Алкинильные группы могут быть необязательно замещены одним или более заместителями.sp2 или sp углероды алкенильной группы и алкинильной группы соответственно могут при необходимости быть точкой присоединения алкенильной или алкинильной групп. Термин "галоалкил" относится к алкильному радикалу, который замещен одним или более гало заместителями. Примеры галоалкильных групп включают фторметилдифторметил, трифторметил, бромметил, хлорметил и 2,2,2-трифторэтил. Термин "алкокси" относится к -OR замещенному радикалу. Как применяется в описании настоящего изобретения, термин "галоген", "гал" или "гало" означает-F,-С 1, -Br или -I. Термин "галоалкокси" относится к -OR заместителю, где R полностью или частично замещен Cl, F,I или Br или любой их комбинацией. Примеры галоалкокси групп включают трифторметокси и 2,2,2-трифторэтокси. Термин "циклоалкил" относится к углеводородной 3-8-членной моноциклической или 7-14-членной бициклической кольцевой системе, содержащей по меньшей мере одно насыщенное кольцо или содержащей по меньшей мере одно неароматическое кольцо, где неароматическое кольцо может иметь некоторую степень ненасыщенности. Циклоалкильные группы могут быть необязательно замещенными одним или более заместителями. В одном варианте выполнения настоящего изобретения 0, 1, 2, 3 или 4 атома каждого кольца циклоалкильной группы могут быть замещены заместителем. Характерные примеры циклоалкильной группы включают циклопропил, циклопентил, циклогексил, циклобутил, циклогептил, циклопентенил, циклопентадиенил, циклогексенил, циклогексадиенил и т.п. Термин "арил" относится к углеводородной моноциклической, бициклической или трициклической ароматической кольцевой системе. Арильные группы могут быть необязательно замещены одним или более заместителями. В одном варианте выполнения настоящего изобретения 0, 1, 2, 3, 4, 5 или 6 атомов каждого кольца арильной группы могут быть замещены заместителем. Примеры арильных групп включают фенил, нафтил, антраценил, фторенил, инденил, азуленил и т.п. Термин "гетероарил" относится к ароматической 5-8-членной моноциклической, 8-12-членной бициклической или 11-14-членной трициклической кольцевой системе, имеющей 1-4 кольцевых гетероатомов в случае моноциклической, 1-6 гетероатомов в случае бициклической или 1-9 гетероатомов в случае трициклической, причем указанные гетероатомы выбираются из О, N или S, а оставшимися кольцевыми атомами являются атомы углерода (с соответствующим количеством атомов водорода, если иное не указано). Гетероарильные группы могут быть необязательно замещены одним или более заместителями. В одном варианте выполнения настоящего изобретения 0, 1, 2, 3 или 4 атома каждого кольца гетероарильной группы могут быть замещены заместителем. Примеры гетероарильных групп включают пиридил,фуранил, тиенил, пирролил, оксазолил, оксадиазолил, имидазолил, тиазолил, изоксазолил, хинолинил,пиразолил, изотиазолил, пиридазинил, пиримидинил, пиразинил, триазинил, изохинолинил, индазолил и т.п. Термин "азотсодержащий гетероарил" относится к гетероарильной группе, имеющей 1-4 кольцевых гетероатома азота в случае моноцикла, 1-6 кольцевых гетероатомов азота в случае бицикла или 1-9 кольцевых гетероатомов азота в случае трицикла. Термин "гетероциклоалкил" относится к неароматической 3-8-членной моноциклической,7-12-членной бициклической или 10-14-членной трициклической кольцевой системе, содержащей 1-3 гетероатома в случае моноцикла, 1-6 гетероатомов в случае бицикла или 1-9 гетероатомов в случае трицикла, причем указанные гетероатомы выбираются из О, N, S, В, Р или Si, где неароматическая кольцевая система является полностью насыщенной. Гетероциклоалкильные группы могут быть необязательно замещены одним или более заместителями. В одном варианте выполнения настоящего изобретения 0, 1,2, 3 или 4 атома каждого кольца гетероциклоалкильной группы могут быть замещены заместителем. Примеры гетероциклоалкильных групп включают пиперидинил, пиперазинил, тетрагидропиранил, морфолинил, тиоморфолинил, 1,3-диоксолан, тетрагидрофуранил, тетрагидротиенил, тииренил и т.п. Термин "алкиламино" относится к аминозаместителю, который далее замещается одним или двумя алкильными группами. Термин "аминоалкил" относится к алкильному заместителю, который далее замещается одной или более аминогруппами. Термин "гидроксиалкил" или "гидроксилалкил" относится к алкильному заместителю, который далее замещается одной или более гидроксильными группами. Алкильная или арильная часть алкиламино, аминоалкила, меркаптоалкила, гидроксиалкила, меркаптоалкокси, сульфонилалкила, сульфониларила, алкилкарбонила и алкилкарбонилалкила может быть необязательно замещена одним или более заместителями. Кислоты и основания, полезные в способах согласно настоящему изобретению, известны в данной области техники. Кислотными катализаторами являются любые известные кислотные соединения, которые могут быть неорганическими (например, соляная, серная, азотная кислоты, трихлорид алюминия) или органическими (например, камфорсульфоновая кислота, п-толуолсульфоновая кислота, уксусная кислота, трифлат иттербия) по своей природе. Кислоты полезны либо в каталитическом, либо в стехиометрическом количествах для содействия химическим реакциям. Основаниями являются любые основ- 10024385 ные химические соединения, которые могут быть неорганическими (например, бикарбонат натрия, гидроксид калия) или органическими (например, триэтиламин, пиридин) по своей природе. Основания полезны либо в каталитическом, либо в стехиометрическом количествах для содействия химическим реакциям. Алкилирующие агенты представляют собой любой реагент, который способен эффективно алкилировать рассматриваемую функциональную группу (например, атом кислорода спирта, атом азота аминогруппы). Алкилирующие агенты известны в данной области техники, включая приведенные ссылочные источники, и включают алкилгалогениды (например, метил иодид, бензилбромид или хлорид), алкилсульфаты (например, метилсульфат) или другие комбинации алкильная группа-уходящая группа, известные в данной области техники. Уходящими группами являются любые стабильные группы, которые могут быть отделены от молекулы в ходе реакции (например, реакция элиминирования, реакция замещения) и известны в данной области техники, включая приведенные в описании настоящего изобретения ссылочные источники, и включают галогениды (например,I-, Cl-, Br-, F-), гидрокси, алкокси (например,-OMe, -O-t-Bu), ацилокси анионы (например, -OAc, -OC(O)CF3), сульфонаты (например, мезил, тозил),ацетамиды (например, -NHC(O)Me), карбаматы (например, -N(Me)C(O)Ot-Bu), фосфонаты (например,-OP(O)(OEt)2), воду или спирты (протонсодержащие условия) и т.п. В определенных вариантах выполнения настоящего изобретения заместители при любой группе(как, например, алкил, алкенил, алкинил, арил, аралкил, гетероарил, гетероаралкил, циклоалкил, гетероциклоалкил) могут находиться при любом атоме этой группы, где любая группа, которая может быть замещена (как, например, алкил, алкенил, алкинил, арил, аралкил, гетероарил, гетероаралкил, циклоалкил, гетероциклоалкил) может быть необязательно замещена одним или более заместителями (которые могут быть одинаковыми или различными), причем каждый замещает атом водорода. Примеры подходящих заместителей включают, но без ограничения к этому, алкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, аралкил, гетероаралкил, арил, гетероарил, галоген, галоалкил, циано, нитро, алкокси, арилокси, гидроксил, гидроксилалкил, оксо (т.е. карбонил), карбоксил, формил, алкилкарбонил, алкилкарбонилалкил, алкоксикарбонил, алкилкарбонилокси, арилоксикарбонил, гетероарилокси, гетероарилоксикарбонил, тио, меркапто, меркаптоалкил, арилсульфонил, амино, аминоалкил, диалкиламино, алкилкарбониламино, алкиламинокарбонил, алкоксикарбониламино, алкиламино, ариламино, диариламино, алкилкарбонил или ариламинозамещенный арил; арилалкиламино, аралкиламинокарбонил, амидо,алкиламиносульфонил, ариламиносульфонил, диалкиламиносульфонил, алкилсульфониламино, арилсульфониламино, имино, карбамидо, карбамил, тиоуреидо, тиоцианато, сульфоамидо, сульфонилалкил,сульфониларил, меркаптоалкокси, N-гидроксиамидил или N'-арил, N-гидроксиамидинил. Соединения согласно настоящему изобретению могут быть получены способами органического синтеза, известными в данной области техники. Способы оптимизации условий реакции, если необходимо уменьшить конкурирующие побочные продуты, известны в данной области техники. При оптимизации реакции и масштабировании могут предпочтительно применяться оборудование для высокоскоростного параллельного синтеза и микрореакторы, контролируемые компьютером (например, Design иOptimization in Organic Synthesis, 2nd Edition, Carlson R., Ed, 2005; Elsevier Science Ltd.; Jahnisch, K. et al.,Angew. Chem. Int. Ed. Engl. 2004, 43:406 и ссылки приведенные там). Дополнительные реакционные схемы и протоколы могут быть определены специалистами в данной области техники путем применения коммерчески доступного программного обеспечения для поиска структуры по базам данных, напримерSciFinder (CAS division of the American Chemical Society) и CrossFire Beilstein (Elsevier MDL), или путем соответствующего поиска по ключевому слову с применением средства для поиска в интернете,такого как Google, или баз данных, допускающих поиск по ключевому слову, как, например, база данных текстов патентного ведомства США. Соединения согласно настоящему изобретению могут также содержать связи (например, углеродуглеродные связи), где вращение связи ограничено около этой конкретной связи, например ограничение в результате присутствия кольца или двойной связи. Соответственно, все цис/транс и E/Z изомеры определенным образом включены в объем настоящего изобретения. Соединения согласно настоящему изобретению могут также быть представлены во множественных таутомерных формах, в таком случае настоящее изобретение определенным образом охватывает все таутомерные формы соединений, описанных в настоящем изобретении, даже если только одна таутомерная форма может быть представлена. Все такие изомерные формы таких соединений согласно настоящему изобретению определенным образом включены в объем настоящего изобретения. Все кристаллические формы и полиморфы соединений, описанных в описании настоящего изобретения, определенным образом включены в объем настоящего изобретения. Также вариантами выполнения настоящего изобретения являются экстракты и фракции, содержащие соединения по настоящему изобретению. Термин "изомеры", как подразумевается, включает диастереоизомеры, энантиомеры, региоизомеры, структурные изомеры, ротационные изомеры, таутомеры и т.п. Для соединений, которые содержат один или более стереогенных центров, например хиральных соединений, способы согласно настоящему изобретению могут выполняться с энантиомерно обогащенным соединением, рацематом или смесью диастереомеров. Предпочтительные энанатиомерно обогащенные соединения имеют энантиомерный избыток 50% или более, более предпочтительно соединение имеет энантиомерный избыток 60, 70, 80, 90, 95, 98 или 99% или более. В предпочтительных вариантах выполнения настоящего изобретения только один энантиомер или диастереомер хирального соединения согласно настоящему изобретению вводится в клетки или субъекту. Другим объектом настоящего изобретения является способ синтеза соединения формулы I (или любой из приведенных в описании настоящего изобретения формул), как описано в описании настоящего изобретения. Другим объектом настоящего изобретения является способ создания соединения любой из приведенных в описании настоящего изобретения формул, применяя любую одну из или комбинацию,реакций, описанных в описании настоящего изобретения. Способ может включать применение одного или более промежуточных соединений или химических реагентов, описанных в настоящем изобретении. Способы лечения. Одним объектом настоящего изобретения является способ модуляции металлоферментной активности клетки субъекта, содержащий контакт субъекта с соединением формулы I, в количестве и при условиях, достаточных для модуляции активности металлофермента. В одном варианте выполнения настоящего изобретения модуляцией является ингибирование. Другим объектом настоящего изобретения является способ лечения субъекта, страдающего от нарушения или заболевания, или подверженного ему, содержащий введение субъекту эффективного количества соединения формулы I или его фармацевтической композиции. Другим объектом настоящего изобретения является способ лечения субъекта, страдающего от металлофермент-опосредованного заболевания или нарушения, или подверженного ему, где субъект идентифицирован как нуждающийся в лечении металлофермент-опосредованного нарушения или заболевания, содержащий введение указанному субъекту, нуждающемуся в этом, эффективного количества соединения формулы I или его фармацевтической композиции, так что указанный субъект лечится от указанного нарушения. В определенных вариантах выполнения настоящего изобретения настоящее изобретение обеспечивает способы лечения заболевания, нарушения или их симптомов, где нарушением является рак, сердечно-сосудистое заболевание, воспалительное заболевание или инфекционное заболевание. В других вариантах выполнения настоящего изобретения заболеванием, нарушением или их симптомами является нарушение обмена веществ, офтальмологическое заболевание, заболевание центральной нервной системы(ЦНС), урологическое заболевание или желудочно-кишечное заболевание. В определенных вариантах выполнения настоящего изобретения заболеванием является рак предстательной железы, рак молочной железы, воспалительная болезнь кишечника, псориаз, системный микоз, микоз кожной структуры, микоз слизистой оболочки или онихомикоз. В определенных вариантах выполнения настоящего изобретения субъектом является млекопитающее, предпочтительно примат или человек. В другом варианте выполнения настоящего изобретения настоящее изобретение обеспечивает способ, как описано выше, в котором эффективное количество соединения формулы I представляет собой эффективное количество как описано выше. В другом варианте выполнения настоящего изобретения настоящее изобретение обеспечивает способ, как описано выше, в котором соединение формулы I вводится внутривенно, внутримышечно, подкожно, интрацеребровентрикулярно, перорально или местно. В других вариантах выполнения настоящего изобретения настоящее изобретение обеспечивает способ, как описано выше, в котором соединение формулы I вводится само по себе или в комбинации с одним или более другими терапевтическими средствами. В другом варианте выполнения настоящего изобретения дополнительным терапевтическим средством является противораковое средство, противогрибковое средство, сердечно-сосудистое средство, противовоспалительное средство, химиотерапевтическое средство, антиангиогенное средство, цитотоксическое средство, антипролиферативное средство, средство для лечения нарушения обмена веществ, средство для лечения офтальмологических заболеваний, средство для лечения заболеваний центральной нервной системы (ЦНС), средство для лечения урологических заболеваний или средство для лечения желудочно-кишечных заболеваний. Другим объектом настоящего изобретения является применение соединения, как описано в настоящем изобретении (например, соединения любой из формул, приведенных в настоящем описании), для получения лекарственного средства для применения при лечении металлофермент-опосредованного заболевания или нарушения. Другим объектом настоящего изобретения является применение соединения,как описано в настоящем изобретении (например, соединения любой из формул, приведенных в настоящем описании), при лечении металлофермент-опосредованного заболевания или нарушения. Другим объектом настоящего изобретения является применение соединения, как описано в настоящем изобретении (например, соединения любой из формул, приведенных в настоящем описании), для получения противогрибковой композиции для применения при лечении или профилактике металлоферментопосредованного заболевания или нарушения в области сельского хозяйства или аграрного хозяйства. Фармацевтические композиции. В одном варианте выполнения настоящего изобретения настоящее изобретение обеспечивает фармацевтическую композицию, содержащую соединение формулы I и фармацевтически приемлемый носитель. В другом варианте выполнения настоящего изобретения настоящее изобретение обеспечивает фармацевтическую композицию, дополнительно содержащую дополнительное терапевтическое средство. В другом варианте выполнения настоящего изобретения дополнительным терапевтическим средством является противораковое средство, противогрибковое средство, сердечно-сосудистое средство, противовоспалительное средство, химиотерапевтическое средство, антиангиогенное средство, цитотоксическое средство, антипролиферативное средство, средство для лечения нарушения обмена веществ, средство для лечения офтальмологических заболеваний, средство для лечения заболеваний центральной нервной системы (ЦНС), средство для лечения урологических заболеваний или средство для лечения желудочнокишечных заболеваний. Одним объектом настоящего изобретения является набор, содержащий эффективное количество соединения формулы I, в стандартной лекарственной форме, вместе с инструкциями по введению соединения субъекту, страдающему от металлофермент-опосредованного заболевания или нарушения, или подверженного ему, включая рак, солидную опухоль, сердечно-сосудистое заболевание, воспалительное заболевание, инфекционное заболевание. В других вариантах выполнения настоящего изобретения заболеванием, нарушением или их симптомами является нарушение обмена веществ, офтальмологическое заболевание, заболевание центральной нервной системы (ЦНС), урологическое заболевание или желудочно-кишечное заболевание. Термин "фармацевтически приемлемые соли" или "фармацевтически приемлемый носитель" согласно его значению включает соли активных соединений, которые получают с относительно нетоксичными кислотами или основаниями, в зависимости от конкретных заместителей, обнаруживаемых в соединениях, описанных в описании настоящего изобретения. Если соединения согласно настоящему изобретению содержат относительно кислотные функциональные группы, основно-аддитивные соли могут быть получены путем контакте нейтральной формы таких соединений с достаточным количеством желательного основания, либо в чистом виде, либо в подходящем инертном растворителе. Примеры фармацевтически приемлемых солей основного добавления включают соль натрия, калия, кальция, аммония,органическую аминосоль, или соль магния, или подобную соль. Если соединения согласно настоящему изобретению содержат относительно основные функциональные группы, кислотно-аддитивные соли могут быть получены путем контакта нейтральной формы таких соединений с достаточным количеством желательной кислоты, либо в чистом виде, либо в подходящем инертном растворителе. Примеры фармацевтически приемлемых солей кислотного добавления включают соли, полученные из неорганических кислот, таких как соляная кислота, бромисто-водородная кислота, азотная кислота, угольная кислота,моногидрокарбоновая кислота, фосфорная кислота, моногидрофосфорная кислота, дигидрофосфорная кислота, серная кислота, моногидросерная кислота, йодисто-водородная кислота или фосфорная кислота,и т.п., а также соли, полученные из относительно нетоксичных органических кислот, как, например, уксусная кислота, пропионовая кислота, изомасляная кислота, малеиновая кислота, малоновая кислота,бензойная кислота, янтарная кислота, пробковая кислота, фумаровая кислота, молочная кислота, миндальная кислота, фталевая кислота, бензолсульфоновая кислота, п-толилсульфоновая кислота, лимонная кислота, винная кислота, метансульфоновая кислота и т.п. Сюда также включены соли аминокислот, такие как аргинат и т.п., и соли органических кислот, как, например, глюкуроновой или галактуроновой кислот, и тому подобное (см., например, Berge et al., J. Pharm. Sci. 1997, 66, 1-19). Определенные специфические соединения согласно настоящему изобретению содержат как основную, так и кислотную функциональные группы, что позволяет соединениям превращаться либо в соли основного добавления,либо в соли кислотного добавления. Другие фармацевтически приемлемые носители, известные специалистам в данной области техники, подходят согласно настоящему изобретению. Нейтральные формы соединений могут регенерироваться контактированием соли с основанием или кислотой и выделением исходного соединения удобным образом. Исходная форма соединения отличается от различных солевых форм определенными физическими свойствами, такими как растворимость в полярных растворителях, но что касается целей настоящего изобретения, то в остальном соли эквивалентны исходной форме соединений согласно настоящему изобретению. Некоторые соединения согласно настоящему изобретению могут существовать как в несольватированных формах, так и в сольватированных формах, включая гидратные формы. Как правило, сольватированные формы эквиваленты несольватированным формам, и подразумевается, что они включены в объем настоящего изобретения. Некоторые соединения согласно настоящему изобретению могут существовать во множестве кристаллических или аморфных форм. Обычно все физические формы эквивалентны для областей применения, предусмотренных настоящим изобретением, и подразумевается, что они включены в объем настоящего изобретения. Настоящее изобретение также обеспечивает фармацевтическую композицию, содержащую эффективное количество соединения согласно настоящему изобретению и фармацевтически приемлемый но- 13024385 ситель. В варианте выполнения настоящего изобретения соединение вводится субъекту с применением фармацевтически приемлемого состава, например, фармацевтически приемлемого состава, который обеспечивает пролонгированную доставку соединения субъекту в течение по меньшей мере 12, 24, 36,48 ч, одной недели, двух недель, трех недель или четырех недель после введения субъекту фармацевтически приемлемого состава. Точные уровни доз и временной порядок введения активных ингредиентов в фармацевтических композициях согласно настоящему изобретению может варьироваться таким образом, чтобы получить количество активного ингредиента, которое эффективно для достижения желательного терапевтического ответа для конкретного пациента, композиции и способа введения, без возникновения токсичных эффектов (или неприемлемых токсичных эффектов) в организме пациента. При применении по меньшей мере одно соединение согласно настоящему изобретению вводится в фармацевтически эффективном количестве субъекту, нуждающемуся в этом, в фармацевтическом носителе, путем внутривенной, внутримышечной, подкожной или интрацеребровентрикулярной инъекции,или путем перорального введения, или путем местного введения. В соответствии с настоящим изобретением соединение согласно настоящему изобретению может вводиться само по себе или в комбинации со вторым отличным терапевтическим средством. Выражение "в комбинации с" означает совместное введение, по существу одновременное введение или последовательное введение. В одном варианте выполнения настоящего изобретения соединение согласно настоящему изобретению вводится пронзительно. Соединение согласно настоящему изобретению может, таким образом, вводиться в течение короткого курса лечения, такого как от около 1 дня до около 1 недели. В другом варианте выполнения настоящего изобретения соединение согласно настоящему изобретению может вводиться в течение более длительного периода лечения для улучшения хронических нарушений, такого как, например, в течение от около одной недели до нескольких месяцев, в зависимости от состояния, которое подлежит лечению. Термин "фармацевтически эффективное количество", как применяется в описании настоящего изобретения, означает количество соединения согласно изобретению, достаточно высокого для существенной положительной модификации состояния, которое подлежит лечению, но достаточно низкого, чтобы избежать серьезных побочных эффектов (при целесообразном соотношении благоприятный эффект/риск), по результатам тщательной медицинской клинической оценки. Фармацевтически эффективное количество соединения согласно настоящему изобретению будет варьироваться в зависимости от конкретной цели, которая должна быть достигнута, возраста и физического состояния пациента, подлежащего лечению, серьезности излечиваемого заболевания, продолжительности лечения, природы сопутствующей терапии и конкретного применяемого соединения. Например, терапевтически эффективное количество, вводимое ребенку или новорожденному, будет пропорционально уменьшено в соответствии с тщательной медицинской клинической оценки. Эффективным количеством соединения согласно настоящему изобретению будет, таким образом, минимальное количество, которое будет обеспечивать желательный эффект. Несомненным преимуществом настоящего изобретения при практическом осуществлении является то, что соединение может вводиться обычным образом, например с помощью таких путей введения, как внутривенный, внутримышечный, подкожный, пероральный или интрацеребровентрикулярная инъекция,или путем местного введения, например в виде кремов или гелей. В зависимости от маршрута пути, активные ингредиенты, которые содержат соединение согласно настоящему изобретению, могут требовать покрытия материалом, для защиты соединения от действия ферментов, кислот и других естественных условий, которые могут инактивировать соединение. Для того чтобы ввести соединение согласно изобретению путем введения, отличного от парентерального, соединение может быть покрыто материалом для предотвращения инактивации или вводиться вместе с ним. Соединение может вводиться парентерально или интраперитонеально. Дисперсии могут также быть получены, например, в глицерине, жидких полиэтиленгликолях и их смесях, или в маслах. Некоторыми примерами веществ, которые могут служить в качестве фармацевтических носителей,являются сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлоза и е производные, такие как натрий-карбоксиметилцеллюлоза, этилцеллюлоза и ацетаты целлюлозы; порошкообразная трагакантовая камедь; солод; желатин; тальк; стеариновые кислоты; стеарат магния; сульфат кальция; растительные масла, такие как арахисовое масло, хлопковое масло, кунжутное масло, оливковое масло, кукурузное масло и какао-масло; полиолы, такие как пропиленгликоль, глицерин, сорбит, маннит и полиэтиленгликоль; агар; альгиновые кислоты; апирогенная вода; изотонический солевой раствор и раствор фосфатного буфера; порошок из сухого молока; а также другие нетоксичные совместимые вещества, применяемые в фармацевтических композициях, такие как витамин С, эстроген и эхинацея, например. Также могут присутствовать смачивающие средства и смазывающие средства, такие как лаурилсульфат натрия, а также окрашивающие агенты, ароматизирующие вещества, лубриканты, эксципиенты, таблетирующие агенты, стабилизаторы, антиоксиданты и консерванты. Солюбилизирующие агенты, включая, например, кремофор и бета-циклодекстрины, также могут применяться в фармацевтических композициях согласно настоящему изобретению. Фармацевтические композиции, содержащие активные соединения согласно раскрываемому объекту изобретения (или их пролекарства), могут быть получены посредством обычных процессов смешивания, растворения, грануляции, растирания в порошок с получением драже, эмульгирования, инкапсуляции, включения или лиофилизации. Композиции могут быть получены обычным образом с применением одного или более фармацевтически приемлемых носителей, разбавителей, эксципиентов или вспомогательных веществ, которые способствуют превращению активных соединений в препараты, которые могут применяться фармацевтическим путем. Фармацевтические композиции согласно раскрываемому объекту изобретения могут иметь форму,подходящую практически для любого пути введения, включая, например, местное введение, окулярное введение, пероральное введение, буккальное введение, системное введение, назальное введение, инъекцию, трансдермальное введение, ректальное введение, вагинальное введение и т.п., или форму, подходящую для введения путем ингаляции или вдувания. Для местного введения активное соединение (активные соединения) могут быть получены в виде растворов, гелей, мазей, кремов, суспензий и т.п. Системные составы включают составы, разработанные для введения путем инъекции, например подкожной, внутривенной, внутримышечной, интратекальной или интраперитонеальной инъекции, а также составы, разработанные для трансдермального, трансмукозального, перорального или пульмонального введения. Применяемые инъецируемые препараты включают стерильные суспензии, растворы или эмульсии активного соединения (активных соединений) в водной или масляной среде Композиции могут также содержать вспомогательные агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Составы для инъекции могут быть представлены в стандартной лекарственной форме (например, в ампулах или в контейнерах, содержащих множество доз) и могут содержать добавленные консерванты. Альтернативным образом, инъецируемый состав может быть получен в форме порошка для восстановления подходящей средой, включая, но без ограничения к этому, стерильную апирогенную воду, буфер, раствор декстрозы и т.п., перед применением. С этой целью активное соединение (активные соединения) может быть высушено (могут быть высушены) любым известным в данной области техники методом, таким как лиофилизация, и восстановлено перед применением. Для трансмукозального введения в составе применяются пенетранты, подходящие для барьера, через который необходимо проникнуть. Такие пенетранты известны в данной области техники. Для перорального введения фармацевтические композиции могут иметь форму, например, лепешек,таблеток или капсул, полученных обычными средствами с фармацевтически приемлемыми эксципиентами, такими как связывающие агенты (например, предварительно желатинизированный крахмал маиса,поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или гидрофосфат кальция); смазывающие вещества (например, стеарат магния, тальк или диоксид кремния); дезинтегрирующие средства (например, картофельный крахмал или натрия крахмал гликолят); или смачивающие агенты (например, натрия лаурилсульфат). Таблетки могут быть покрыты способами, известными в данной области техники, например сахарами или enteric энтеросолюбильными покрытиями. Жидкие препараты для перорального введения могут иметь форму, например, эликсиров, растворов, сиропов или суспензий, или они могут присутствовать в виде сухого продукта для разведения водой или другим подходящим носителем перед применением. Такие жидкие препараты могут быть получены с помощью обычных средств с фармацевтически приемлемыми добавками, такими как суспендирующие агенты (например, сироп сорбита, производные целлюлозы или гидрогенизированные пищевые жиры); эмульгирующие агенты (например, лецитин или акация); неводными средами (например, миндальное масло, масляные сложные эфиры, этиловый спирт или фракционированные растительные масла) и консерванты (например, метил или пропил п-гидроксибензоаты или сорбиновая кислота). Препараты также могут содержать буферные соли, консерванты, ароматизирующие вещества, окрашивающие и подслащивающие агенты, при необходимости. Препараты для перорального введения могут быть подходящим образом получены с обеспечением контролируемого высвобождения активного соединения или пролекарства, как хорошо известно. Для буккального введения композиции могут иметь форму таблеток или лепешек, полученных обычным образом. Для ректального и вагинального путей введения активное соединение(ия) могут быть приготовлены в виде растворов (для удерживающих клизм), суппозиториев или мазей, содержащих традиционные основы суппозитория, такие как какао-масло или другие глицериды. Для назального введения или введения путем ингаляции или вдувания активное соединение (активные соединения) могут, как правило, доставляться в форме аэрозольного спрея из контейнера, находящегося под давлением, или распылителя с применением подходящего газа-вытеснителя, как, например, дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, фторуглероды, диоксид углерода или другого подходящего газа. В случае сжатого аэрозоля единица дозы может быть определена с помощью обеспечения клапана для доставки отмеренного количества. Капсулы и картриджи для применения в ингаляторах или вдувателях (например, капсулы и картриджи, состоящие из желатина) могут быть получены с содержанием порошкообразной смеси соединения и подходящей порошкообразной основы, такой как лактоза или крахмал. Конкретный пример состава в виде водной суспензии, подходящего для назального введения с применением доступных для приобретения коммерческим путем устройств для распыления в нос, включает следующие ингредиенты: активное соединение (0.5-20 мг/мл); бензалкония хлорид (0.1-0.2 мг/мл); полисорбат 80 (TWEEN 80; 0.5-5 мг/мл); натрий-карбоксиметилцеллюлоза или микрокристаллическая целлюлоза (1-15 мг/мл); фенилэтанол (1-4 мг/мл) и декстроза (20-50 мг/мл). Значение рН конечной суспензии может быть доведено до около 5-7, причем рН около 5.5 является типичным. Для окулярного введения активное(ые) соединение(ия) получают в виде раствора, эмульсии, суспензии или т.п., подходящих для введения в глаза. В данной области техники известно многообразие сред, подходящих для введения соединений в глаза. Конкретные неограничивающие примеры приводятся в патентах США 6261547; 6197934; 6056950; 5800807; 5776445; 5698219; 5521222; 5403841; 5077033; 4882150 и 4738851, каждый из которых включен в настоящий документ в полном объеме путем ссылки. Для пролонгированной доставки активное(ые) соединение(ия) могут быть получены в виде препарата-депо для введения путем имплантации или внутримышечной инъекции. Активный ингредиент может входить в состав вместе с подходящими полимерными или гидрофобными материалами (например,как эмульсия в приемлемом масле) или ион-обменными смолами, или в виде труднорастворимых производных, например, в виде труднорастворимой соли. Альтернативным образом, могут применяться трансдермальные системы доставки в виде трансдермального диска или пластыря, который медленно высвобождает активное(ые) соединение(ия) для подкожной абсорбции. С этой целью могут применяться усилители проникновения для облегчения трансдермального проникновения активного(ых) соединения(ий). Подходящие трансдермальные пластыри описываются, например, в патентах США 5407713; 5352456; 5332213; 5336168; 5290561; 5254346; 5164189; 5163899; 5088977; 5087240; 5008110 и 4921475, каждый из которых включен в настоящий документ в полном объеме путем ссылки. Альтернативным образом, для доставки активного(ых) соединения(ий) или пролекарства (пролекарств) могут применяться другие фармацевтические системы доставки. Липосомы и эмульсии являются хорошо известными примерами носителей для доставки, которые могут применяться для доставки активного(ых) соединения(ий) или пролекарства (пролекарств). Также могут применяться определенные органические растворители, такие как диметилсульфоксид (DMSO). Если желательно, фармацевтические композиции могут присутствовать в виде набора или раздаточного устройства, которые могут содержать одну или более стандартных лекарственных форм, содержащих активное соединение (активные соединения). Набор может, например, содержать металлическую или пластиковую фольгу, как, например, блистерная упаковка. Набор или блистерная упаковка могут сопровождаться инструкциями по применению. Активное соединение (активные соединения) согласно раскрываемому объекту изобретения или их композиции, как правило, будут применяться в количестве, эффективном для достижения желательного результата, например, в количестве, эффективном для лечения или профилактики конкретного заболевания, подлежащего лечению. Соединение(ия) может (могут) вводиться терапевтически для достижения терапевтической пользы или профилактически для достижения профилактической пользы. Под терапевтической пользой понимается ликвидация или уменьшение рассматриваемого нарушения, подлежащего лечению, и/или ликвидация или уменьшение одного или более симптомов, связанных с рассматриваемым нарушением, так что улучшается самочувствие или состояние пациента, несмотря на то, что пациент может все еще страдать от рассматриваемого нарушения. Например, введение соединения пациенту,страдающему от аллергии, обеспечивает терапевтическую пользу, но только если рассматриваемая аллергическая реакция исключается или уменьшается, а также если у пациента наблюдается уменьшение серьезности или продолжительности симптомов, связанных с аллергией, после воздействия аллергена. Другой пример, терапевтическая польза в контексте астмы включает улучшение дыхания после начала приступа астмы, или уменьшение частоты или серьезности астматических приступов. Терапевтическая польза также включает прекращение или замедление развития заболевания, независимо от того происходит ли улучшение. В отношении профилактического введения необходимо отметить, что соединение может вводиться пациент в случае риска развития одного из ранее описанных заболеваний. Пациент в случае риска развития заболевания может быть пациентом, обладающим характеристиками, приводящими к помещению пациента в обозначенную группу риска, как определено соответствующим профессионалом в области медицины или группой. Пациентом с риском также может быть пациент, которые обычно или регулярно находится в среде, где происходит развитие рассматриваемого заболевания, которое можно лечить путем введения ингибитора металлоферментов согласно настоящему изобретению. Другими словами, пациентом с риском является пациент, который обычно или регулярно подвергается воздействию условий, вызывающий болезнь или расстройство, или может быть подвержен в высокой степени в течение ограни- 16024385 ченного периода времени. Альтернативным образом, профилактическое введение может применяться,чтобы избежать возникновения у пациентов симптомов, позволяющих диагностировать рассматриваемое заболевание. Количество вводимого соединения будет завесить от множества факторов, включая, например, конкретное показание, подлежащее лечению, путь введения желательно ли достичь профилактики либо лечения, серьезность показания, подлежащего лечению, и возраст и вес пациента, биодоступность конкретного активного соединения и т.п. Определение эффективной дозы находится в компетенции специалиста в данной области техники. Эффективные дозы могут быть оценены первоначально на основе анализов in vitro. Например, начальная доза для применения на животных может быть получена для достижения концентрации активного соединения в циркулирующей крови или сыворотке, которая равна или больше IC50 конкретного соединения, как измерено в анализе in vitro, как, например, in vitro грибковая MIC или MFC и других invitro анализах, описанных в разделе "Примеры". Расчет доз для достижения таких концентраций в циркулирующей крови или сыворотке учитывает биодоступность конкретного соединения, что входит в компетенцию специалиста в данной области техники. Для руководства смотрите FinglWoodbury,"General Principles", In: Goodman и Gilman's The Pharmaceutical Basis of Therapeutics, Chapter 1, p. 1-46,12th edition, McGraw-Hill Professional, и ссылки, приведенные там, которые включены в настоящий документ посредством ссылки. Первоначальные дозы также могут быть оценены на основании in vivo данных, как, например, животные модели. Животные модели, полезные для тестирования эффективности соединений для лечения или профилактики различных заболеваний, описанных выше, хорошо известны в данной области техники. Количества доз будут, как правило, находиться в интервале от около 0.0001, или 0.001, или 0.01 до около 100 мг/кг/день, но могут быть выше или ниже, в зависимости от, среди других факторов,активности соединения, его биодоступности, пути введения и различных факторов, обсуждаемых выше. Количество доз и интервал введения могут регулироваться индивидуально для обеспечения уровней в плазме соединения(ий), которые достаточны для поддержания терапевтического или профилактического эффекта. В случаях локального введения или селективного поглощения, как, например, локальное местное введение, эффективная локальная концентрация активного соединения (активных соединений) не может быть связана с концентрацией в плазме. Специалисты в данной области техники смогут оптимизировать эффективные локальные дозы без дополнительных экспериментов. Соединение(ия) может (могут) вводиться один раз в день, немного или несколько раз в день или даже множество раз в день в зависимости от, среди прочего, показания, подлежащего лечению, и предписания лечащего врача. Предпочтительно соединение(ия) будет (будут) обеспечивать терапевтическую или профилактическую пользу, не вызывая существенной токсичности. Токсичность соединения(ий) может быть определена с применением стандартных фармацевтических методик. Отношение доз между токсическим и терапевтическим (или профилактическим) эффектами представляет собой терапевтический индекс. Предпочтительным (предпочтительными) является (являются) соединение (соединения), которое (которые) проявляет (проявляют) высокий терапевтический индекс. Перечисление списка химических групп в любом определении переменной в описании настоящего изобретения включает определения этой переменной как любой одиночной группы или комбинации перечисленных групп. Приведение варианта выполнения изобретения для переменной, указанной в настоящем изобретении, включает этот вариант в виде любого одиночного варианта выполнения или в комбинации с любыми другими вариантами выполнения или их частями. Приведение варианта выполнения изобретения в настоящем описании включает этот вариант в виде любого одиночного варианта выполнения или в комбинации с любыми другими вариантами выполнения или их частями. Любой интервал или желательное значение, приведенное в описании настоящего изобретения, может быть расширен или изменен, без потери эффективности, как очевидно специалисту в данной области техники для понимания изложенного в описании настоящего изобретения. Примеры Настоящее изобретение далее иллюстрируется посредством конкретных примеров, которые не являются ограничивающими. Общие экспериментальные методики Определения переменных в структурах в схемах, приведенных в описании настоящего изобретения,соответствуют переменным в соответствующих положениях в формулах, приведенных в описании настоящего изобретения. Синтез азольных целевых соединений Синтез азольных целевых соединений (соединения формулы I) может осуществляться посредством применения примера синтеза, который показан ниже (схема 1). Пример 2-пиридин, приведенный ниже(формула 1 на схеме 2), может быть получен исходя из функционализированных галоароматических исходных соединений. В целях этого в примере R4 галогенируется бензольной составляющей. Бромпромежуточные соединения (С) могут обрабатываться олефинами или нуклеофилами с получением R3 составляющей (М = металл или противоион; схемы 1 и 2). Для связывания Хека R3-М представляет собой комбинацию палладиевого (Pd) катализатора с олефином. Как правило, М представляет собой калий,литий или магний. Кроме того, бром-промежуточные соединения (С) могут быть превращены в соответствующие бороновые кислоты (применяя н-бутиллитий (n-BuLi) и триметилборат (В(ОCH3)3) и затем связаны, применяя метод поперечного сшивания Сузуки с бром-ароматическими реагентами (R3-Br). Функционализированное соединение (D) может затем обрабатываться азолами с получением соединения формулы 1. Схема 1 Пример синтеза начинается с конденсации 2,5-дибромпиридина с медь-активированным этил-2 бром-2,2-дифторацетатом с последующей конденсацией возникшего этилсложноэфирного продукта с литиированным 1-бром-2,4-дифторбензолом до получения кетона Е (схема 2). Кетон эпоксидизируется диазометаном с получением F. 1-Тетразольный продукт 1 получают путем открытия эпоксида F с помощью тетразола в присутствии карбоната калия. Схема 2 Синтез 2-(5-бромпиридин-2-ил)-1-(2,4-дифторфенил)-2,2-дифторэтанона (Е). К суспензии порошка меди (2.68 г, 42.2 ммоль) в диэтилсульфоксиде (DMSO; 35 мл) добавили этил-2-бром-2,2-дифторацетат (2.70 мл, 21.10 ммоль) и смесь перемешивали в течение 1 ч при комнатной температуре (RT). 2,5-Дибромпиридин (2.50 г, 10.55 ммоль) затем добавили и перемешивание продолжали в течение 15 ч при комнатной температуре. Реакцию погасили водным (aq) хлоридом аммония(NH4Cl) и смесь экстрагировали дихлорметаном (CH2Cl2; 325 мл). Объединенные органические слои промыли водой, промыли соляным раствором, высушили над безводным сульфатом натрия (Na2SO4) и концентрировали при пониженном давлении с получением продукта в виде неочищенной смеси. Очищение с помощью колоночной хроматографии (элюирование EtOAc-гексаном) позволило получить промежуточное соединение в виде сложного этилового эфира (2.40 г, 8.57 ммоль, 81%) в виде масла бледножелтого цвета. 1 Н ЯМР (500 МГц, CDCl3):8.71 (с, 1H), 8.00 (д, J=9.0 Гц, 1H), 7.64 (д, J=9.0 Гц, 1H), 4.42-4.35 (м,2 Н), 1.39-1.31 (м, 3 Н). К перемешиваемому раствору 1-бром-2,4-дифторбензола (1.65 г, 8.57 ммоль) в диэтиловом простом эфире (Et2O; 10 мл) добавили n-BuLi (2.3 М в гексане; 3.70 мл, 8.57 ммоль) при -70C, а затем вышеуказанный сложный эфир (2.40 г, 8.57 ммоль) в Et2O (5 мл) через 15 мин. Реакционную смесь перемешивали в течение 1 ч при -70C, затем нагрели до комнатной температуры и перемешивали еще 2 ч. Реакционную смесь погасили с помощью водного раствора NH4Cl и экстрагировали с помощью этилацетат(EtOAc; 320 мл). Объединенные органические слои промыли водой, промыли соляным раствором, высушили над безводным Na2SO4 и концентрировали при пониженном давлении. Неочищенное соединение очистили с помощью колоночной хроматографии (элюирование EtOAc/гексан) с получением кетона Е(1.30 г, 3.73 ммоль, 43%) в виде жидкости желтого цвета. 1 Н ЯМР (500 МГц, CDCl3):8.62 (с, 1H), 8.08-8.04 (м, 2 Н), 7.74-7.70 (м, 1H), 7.05-6.95 (м, 1H), 6.886.78 (м, 1H).MS (ESI): m/z 347, 349 [(M1)+2]. Синтез 5-бром-2-2-(2,4-дифторфенил)оксиран-2-ил)дифторметил)пиридина (F). К перемешиваемому раствору кетона Е (1.30 г, 3.73 ммоль) в Et2O (300 мл) добавили свежеприготовленный диазометан при 0C. Реакционную смесь нагрели до комнатной температуры и перемешивали в течение 2 ч. Летучие вещества удалили при пониженном давлении с получением неочищенной смеси продукта. Колоночная хроматография (элюирование EtOAc/гексан) позволила получить оксиран F(800 мг, 2.20 ммоль, 59%) в виде твердого вещества светло-желтого цвета. 1 Н ЯМР (500 МГц, CDCl3):8.72 (с, 1 Н), 7.89 (д, J=9.0 Гц, 1H), 7.39-7.35 (м, 2 Н), 6.86-6.83 (м, 1 Н),6.77-6.74 (м, 1H), 3.44 (с, 1H), 2.98 (с, 1H). 1-(5-Бромпиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (1). К перемешиваемому раствору тетразола (248 мг, 3.54 ммоль) в N,N-диметилформамиде (DMF; 10 мл) добавили карбонат калия (K2CO3) (244 мг, 3.54 ммоль), а затем эпоксид F (1.28 г, 3.54 ммоль). Реакционную смесь перемешивали в течение 3 ч при 60C. Летучие вещества удалили при пониженном давлении. Остаток растворили в EtOAc и промыли соляным раствором, промыли водой и высушили над безводным Na2SO4. Очищение с помощью колоночной хроматографии (элюирование EtOAc/гексан) обеспечило соединение 1 (350 мг, 0.81 ммоль, 23%) в виде порошка бледно-желтого цвета. 1 Н ЯМР (500 МГц, CDCl3):8.74 (s, 1H), 8.62 (с, 1 Н), 7.94 (д, J=7.50 Гц, 1H), 7.46 (д, J=9.0 Гц, 1 Н),7.31-7.26 (м, 1H), 6.88 (с, 1H), 6.78-6.74 (м, 1H), 6.70-6.67 (м, 1H), 5.60 (д, J=14.50 Гц, 1H), 5.11 (д,J=14.50 Гц, 1H).MS (ESI): m/z 432, 434 [М 2]. ВЭЖХ: 95.65%. Соединения 19-27, приведенные в табл. 1, были получены при тех же самых условиях, что и соединение 1 (см. табл. 1 для исходных веществ). Пример 2. 2-(2,4-Дифторфенил)-1,1-дифтор-1-(пиридин-2-ил)-3-(1H-тетразол-1-ил)пропан-2-ол (2). К перемешиваемому раствору тетразола (49 мг, 0.7 ммоль) в DMF (5 мл) добавили K2CO3 (49 мг,0.35 моль), а затем аналогичный эпоксид (полученный на основе 2-бромпиридина, применяя синтез, показанный на схеме 2; 200 мг, 0.7 ммоль). Реакционную смесь перемешивали в течение 4 ч при 65C. Летучие вещества удалили при пониженном давлении и экстрагировали с помощью EtOAc (220 мл). Органический слой промыли водой, промыли соляным раствором и высушили над безводным Na2SO4. Неочищенное соединение очистили с помощью колоночной хроматографии (элюирование EtOAc/гексан) с получением соединения 2 (30 мг, 0.09 ммоль, 12%) в виде твердого вещества белого цвета. 1 Н ЯМР (500 МГц, CDCl3):8.75 (с, 1 Н), 8.55 (д, J=4.0 Гц, 1 Н), 7.84-7.82 (м, 1H), 7.75 (с, 1H), 7.59 Разделение с помощью хиральной препаративной высокоэффективной жидкостной хроматографииCHIRALPAK AD-H (25020 мм, 5 мкм; подвижная фаза (А) 0.1% трифторуксусная кислота (TFA) в н-гексане - (В) изопропиловый спирт (IPA) (А:В = 93:7) и расход 15 мл/мин) с получением 2-(-) с получением твердого вещества грязновато-белого цвета. Аналитические данные. Хиральная ВЭЖХ: 99.69% ее, Rt = 36.90 мин (CHIRALPAK AD-H, 2504.6 мм, 5 мкм; подвижная фаза (А) 0.1% TFA в н-гексане - (В) IPA (А:В = 93:7); расход 1.00 мл/мин), угол поворота плоскости поляризации света []D25: -13.68 (с = 0.1% в метиловом спирте (CH3OH. 1 Н ЯМР (500 МГц, CDCl3):8.76 (с, 1 Н), 8.54 (с, 1H), 7.83 (т, J=7.0 Гц, 1 Н), 7.64 (с, 1H), 7.59 (д,J=8.0 Гц, 1 Н), 7.46-7.43 (м, 1H), 7.35-7.30 (м, 1H), 6.78-6.74 (м, 1 Н), 6.66-6.63 (м, 1H), 5.59 (д, J=14.5 Гц,1H), 5.12 (д, J=14.5 Гц, 1 Н).(E)-3-(6-(2-(2,4-Дифторфенил)-1,1-дифтор-2-гидрокси-3-(1H-тетразол-1-ил)пропил)пиридин-3 ил)акрилонитрил (3). К перемешиваемому раствору F (1.0 г, 2.76 ммоль) в DMF (10 мл) добавили акрилонитрил (0.52 г,9.9 ммоль), каталитическое количество тетрабутиламмония бромида (ТВАВ) и бикарбонат натрия(NaHCO3; 0.27 г, 3.32 ммоль) при комнатной температуре в атмосфере азота (N2). После того как смесь продули аргоном в течение 30 мин, палладия(II) ацетат (Pd(OAc)2, 0.18 г, 0.82 ммоль) добавили. Температуру повысили до 110C и перемешивание продолжали в течение 4 ч. После того как исходные вещества были израсходованы, реакционную смесь охладили, летучие вещества выпарили при пониженном давлении и полученный остаток растворили в EtOAc (250 мл). Органический слой промыли водой(250 мл), соляным раствором (50 мл) и высушили над безводным Na2SO4. После отфильтровывания твердого вещества растворитель выпарили при пониженном давлении с получением неочищенного соединения. Неочищенное вещество очистили с помощью колоночной хроматографии (элюированиеH ЯМР (200 МГц, CDCl3):8.72 (с, 1H), 7.84 (д, J=8.0 Гц, 1 Н), 7.56-7.32 (м, 3 Н), 6.88-6.69 (м, 2 Н),6.05 (д, J=16.8 Гц, 1H), 3.46 (д, J=5.2 Гц, 1H), 3.00 (д, J=5.2 Гц, 1 Н). К перемешиваемому раствору G (170 мг, 0.5 ммоль) в DMF (10 мл) добавили 1 Н-тетразол (124 мг,1.77 ммоль) и K2CO3 (35 мг, 0.25 ммоль) при комнатной температуре в атмосфере азота. Реакционную смесь перемешивали в течение 22 ч при 65C. Летучие вещества выпарили при пониженном давлении и полученный остаток растворили в EtOAc (150 мл). Органический слой промыли водой (275 мл) и соляным раствором (50 мл), высушили над безводным Na2SO4 и выпарили при пониженном давлении. Неочищенное вещество очистили с помощью колоночной хроматографии (элюирование EtOAc/гексан) с получением соединения 3 (30 мг, 0.074 ммоль, 14%) в виде твердого вещества. 1 Н ЯМР (500 МГц, CDCl3):8.73 (с, 1 Н), 8.58 (с, 1H), 7.88 (д, J=6.5 Гц, 1H), 7.64 (д, J=7.5 Гц, 1H),7.39 (д, J=16.5 Гц, 1H), 7 35-7.30 (м, 1 Н), 6.95 (уш.с, 1H), 6.79-6.73 (м, 1H), 6.68 (т, J=8.5 Гц, 1H), 6.04 (д,J=16.5 Гц, 1 Н), 5.53 (д, J=14.0 Гц, 1 Н), 5.18 (д, J=14.0 Гц, 1H).(0.49 г, 4.8 ммоль) при комнатной температуре в атмосфере азота. После продувания азотом в течение 30 мин Pd(OAc)2 (68 мг, 0.30 ммоль) добавили к реакционной смеси. Затем постепенно температуру повысили до 90C и перемешивание продолжали в течение 16-18 ч. После того как исходные вещества были израсходованы (определили посредством тонкослойной хроматографии (TLC, реакционную смесь охладили до комнатной температуры и разбавили водой (50 мл). Водный слой экстрагировали с помощью Et2O (350 мл); объединенную органическую фазу промыли водой (225 мл) и соляным раствором(25 мл) и высушили над безводным Na2SO4. После фильтрования и выпаривания неочищенное вещество очистили с помощью колоночной хроматографии (элюирование EtOAc/гексан) с получением связанного продукта Н (0.14 г, 0.070 ммоль, 26.9%) в виде полутвердого вещества желтого цвета. 1 Н ЯМР (200 МГц, CDCl3):8.77 (с, 1 Н), 7.87 (д, J=8.0 Гц, 1H), 7.70 (д, J=16.0 Гц, 1H), 7.50 (д,J=8.0 Гц, 1H), 7.45-7.30 (м, 1H), 6.90-6.55 (м, 2 Н), 6.55 (д, J=16.0 Гц, 1 Н), 4.30 (кв, J=7.2 Гц, 2 Н), 3.46 (д,J=5.0 Гц, 1H), 2.97-2.98 (м, 1H), 1.35 (т, J=1.4 Гц, 3 Н).MS (ESI): m/z 382 [M1]. К перемешиваемому раствору Н (1.25 г, 3.2 ммоль) в DMF (5 мл) добавили 1 Н-тетразол (0.34 г,4.8 ммоль) и K2CO3 (0.9 г, 6.5 ммоль) при комнатной температуре в атмосфере азота. Реакционную смесь медленно нагрели до 65C и перемешивание продолжали в течение 10 ч. Реакционную смесь охладили до комнатной температуры, разбавили водой (40 мл) и водный слой экстрагировали с помощью Et2O(2100 мл). Объединенную органическую фазу промыли водой (225 мл) и соляным раствором (25 мл),высушили над безводным Na2SO4 и концентрировали при пониженном давлении. Неочищенное вещество очистили с помощью колоночной хроматографии (элюирование EtOAc/гексан) с получением соединения 4 (0.2 г, 0.044 ммоль, 13.6%) в виде твердого вещества грязно-белого цвета. 1 Н ЯМР (200 МГц, CDCl3):8.76 (с, 1H), 8.64 (с, 1 Н), 7.94 (дд, J=8.2, 2.2 Гц, 1H), 7.68-7.59 (м, 2 Н),7.40-7.28 (м, 2 Н), 6.81-6.61 (м, 2 Н), 6.55 (д, J=16.2 Гц, 1H), 5.60 (д, J=14.5 Гц, 1H), 5.15 (д, J=14.5 Гц, 1H),4.30 (кв, J=7.2 Гц, 2 Н), 1.35 (т, J=7.4 Гц, 3 Н). Этил 3-(6-(2-(2,4-дифторфенил)-1,1-дифтор-2-гидрокси-3-(1H-тетразол-1-ил)пропил)пиридин-3 ил)пропаноат (5). К раствору соединения 4 (20 мг, 0.04 ммоль) в этиловом спирте (EtOH; 5 мл) добавили 10% палладий на углероде (Pd/C; 2 мг) в атмосфере азота и реакционную смесь перемешивали в атмосфере водорода (давление баллонах) при комнатной температуре в течение 3 ч. Реакционную смесь отфильтровали через слой Celite, слой Celite тщательно промыли с помощью EtOH (25 мл) и полученный фильтрат концентрировали в вакууме. Неочищенное вещество очистили с помощью колоночной хроматографии(элюирование EtOAc/гексан) с получением соединения 5 (10 мг, 0.02 ммоль, 50%) в виде твердого вещества грязно-белого цвета. 1(E)-2-(2,4-Дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)-1-(5-(3-(2,2,2-трифторэтокси)проп-1 енил)пиридин-2-ил)пропан-2-ол (6). К перемешиваемому раствору F (1.0 г, 2.76 ммоль) в DMF (10 мл) добавили аллил-2,2,2-трифторэтиловый простой эфир (1.4 г, 9.9 ммоль), каталитическое количество ТВАВ и NaHCO3 (0.3 г,3.58 ммоль) при комнатной температуре в атмосфере азота. После продувания азотом в течение 30 минPd(OAc)2 (0.18 г, 0.83 ммоль) добавили к реакционной смеси. Затем постепенно температуру повысили до 100C и перемешивание продолжали в течение 3 ч. Реакционную смесь охладили до комнатной температуры, разбавили с помощью EtOAc (150 мл) и отфильтровали через слой Celite. Фильтрат промыли водой (250 мл) и соляным раствором (50 мл) и высушили над безводным Na2SO4. После отфильтровывания твердого вещества растворитель выпарили при пониженном давлении с получением соединения I(0.48 г, crude) в виде густого сиропа. Неочищенное соединение применяли на следующей стадии без дальнейшей очистки. К перемешиваемому раствору K (0.39 г, crude) в DMF (10 мл) добавили 1H-тетразол (0.22 г,3.2 ммоль) и K2CO3 (0.23 г, 1.66 ммоль) при комнатной температуре в атмосфере азота. Реакционную смесь перемешивали в течение 16 ч при 65C. Реакционную смесь охладили до комнатной температуры и разбавили EtOAc (150 мл). Органический слой промыли водой (275 мл) и соляным раствором (50 мл),высушили над безводным Na2SO4, отфильтровали и выпарили при пониженном давлении. Неочищенное вещество очистили с помощью колоночной хроматографии (элюирование EtOAc/гексан) с получением соединения 6 (0.26 г, 0.52 ммоль, 57%) в виде твердого вещества. 1(Z)-4-(6-(2-(2,4-Дифторфенил)-1,1-дифтор-2-гидрокси-3-(1H-тетразол-1-ил)пропил)пиридин-3 ил)бут-3-ен-2-он (7). К перемешиваемому раствору F (1.0 г, 2.76 ммоль) в CH3CN (10 мл) добавили Et3N (1.0 мл,7.4 ммоль) и три-о-толилфосфин (0.26 г, 0.88 ммоль), а затем метилэтиловый кетон (0.8 мл, 8.2 ммоль) при комнатной температуре в атмосфере азота. После продувания азотом в течение 30 мин Pd(OAc)2(136 мг, 0.67 ммоль) добавили к реакционной смеси. Затем постепенно температуру повышали до 90C и перемешивание продолжали в течение 16-18 ч. После того как исходное вещество было израсходовано(определили с помощью TLC), реакционную смесь охладили до комнатной температуры и отфильтровали через слой Celite. Фильтрат концентрировали; остаток разбавили водой (50 мл). Водный слой экстрагировали с помощью Et2O (350 мл); объединенную органическую фазу промыли водой (225 мл) и соляным раствором (25 мл) и высушили над безводным Na2SO4. После фильтрации и выпаривания неочищенное вещество очистили с помощью колоночной хроматографии (элюирование EtOAc/гексан) с получением неочищенного продукта (0.4 г, 1.1 ммоль, 41%) в виде полутвердого вещества, окрашенного в желтый цвет. 1 Н ЯМР (500 МГц, CDCl3):8.78 (с, 1 Н), 7.90 (д, J=8.0 Гц, 1H), 7.52-7.48 (м, 2 Н), 7.40-7.36 (м, 1H),6.85-6.79 (м, 2 Н), 6.76-6.71 (м, 1 Н), 3.46 (д, J=5.5 Гц, 1H), 2.98 (д, J=4.5 Гц, 1H), 2.41 (с, 3 Н). К перемешиваемому раствору связанного продукта (0.42 г, 1.16 ммоль) в DMF (5 мл) добавили 1H-тетразол (81 мг, 1.16 ммоль) и K2CO3 (80 мг, 0.58 ммоль) при комнатной температуре в атмосфере азота. Реакционную смесь медленно нагрели до температуры флегмы и перемешивание продолжали в течение 3-4 ч. Прогресс реакции контролировали с помощью TLC. Летучие вещества выпарили при пониженном давлении; полученный остаток разбавили водой (25 мл). Водный слой экстрагировали с помощью EtOAc (320 мл); объединенную органическую фазу промыли водой (25 мл) и соляным раствором (25 мл) и высушили над безводным Na2SO4. После фильтрации и выпаривания неочищенное вещество очистили с помощью колоночной хроматографии (элюирование EtOAc/гексан) с получением соединения 7 (14.6 мг, 0.034 ммоль, 3%) в виде полутвердого вещества. 1 Н ЯМР (500 МГц, CDCl3):8.74 (с, 1 Н), 8.64 (с, 1H), 7.95 (д, J=6.5 Гц, 1H), 7.61 (д, J=8.5 Гц, 1H),7.45 (дд, J=16.5, 4.5 Гц, 1H), 7.35-7.30 (м, 2 Н), 6.82-6.74 (м, 2 Н), 6.68-6.65 (м, 1H), 5.55 (д, J=15.0 Гц, 1H),5.16 (д, J=15.0 Гц, 1H), 2.40 (с, 3 Н). 4-(6-(2-(2,4-Дифторфенил)-1,1-дифтор-2-гидрокси-3-(1H-тетразол-1-ил)пропил)пиридин-3 ил)бутан-2-он (8). К раствору 7 (30 мг, 0.071 ммоль) в CH3OH (10 мл) добавили 10% Pd/C (10 мг) в атмосфере азота и реакционную смесь перемешивали в атмосфере водорода при комнатной температуре в течение 30 мин. Реакционную смесь отфильтровали через слой Celite, слой Celite тщательно промыли с помощьюEtOAc (310 мл) и затем фильтрат концентрировали в вакууме. Неочищенное вещество очистили с помощью колоночной хроматографии (элюирование EtOAc/гексан) с получением соединения 8 (16 мг,0.037 ммоль, 53%) в виде бесцветного полутвердого вещества. 1 Н ЯМР (500 МГц, DMSO-d6):9.11 (с, 1H), 8.45 (с, 1H), 7.74 (д, J=8.0 Гц, 1H), 7.34 (д, J=8.0 Гц,1H), 7.24-7.21 (м, 2 Н), 7.17-7.12 (м, 1H), 6.89-6.85 (м, 1H), 5.61 (д, J=14.5 Гц, 1H), 5.06 (д, J=14.5 Гц, 1H),2.81 (уш.с, 4 Н), 2.08 (с, 3 Н). 1-(5-(2 Н-1,2,3-Триазол-2-ил)пиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1 ил)пропан-2-ол (9). К перемешиваемому раствору 1H-1,2,3-триазола (410 мг, 5.93 ммоль) добавили порошок меди (Cu)(93 мг, 1.45 ммоль), K2CO3 (160 мг, 1.15 ммоль) и соединение 1 (300 мг, 0.694 ммоль) в атмосфере азота. Реакционную смесь равномерно нагрели до 140C и перемешивали в течение 4 ч. Реакционную смесь охладили до 100C, погасили раствором натриевой соли этилендиаминтетрауксусной кислотой (EDTA) и сделали основным с помощью раствора карбоната натрия (Na2CO3). Водный слой экстрагировали с помощью CH2Cl2 (350 мл); объединенную органическую фазу промыли соляным раствором, высушили над безводным Na2SO4 и выпарили при пониженном давлении. Неочищенное вещество очистили с помощью колоночной хроматографии на силикагеле (элюирование 45% EtOAc/гексан) с получением соединения 9 (0.12 г, 0.297 ммоль, 42%) в виде твердого вещества. 1 Н ЯМР (500 МГц, CDCl3):9.33 (с, 1H), 8.77 (с, 1H), 8.47 (дд, J=8.5, 2.0 Гц, 1H), 7.90 (с, 2 Н), 7.70MS (ESI): m/z 420.9 [М 1]. ВЭЖХ: 99.9%. Соединение 28 в табл. 1 было получено при таких же условиях, что соединение 9 (см. табл. 1 для исходного вещества). 2-(2,4-Дифторфенил)-1,1-дифтор-1-(5-фторпиридин-2-ил)-3-(1H-тетразол-1-ил)пропан-2-ол (10). Соединение 10 было получено подобным образом, что и соединение 1. К перемешиваемому раствору этил-2-бром-2,2-дифторацетата (2.18 мл, 17.0 ммоль) в DMSO (18 мл) добавили порошок меди (2.16 г,34.0 ммоль) при комнатной температуре в атмосфере азота. После перемешивания в течение 2 ч при комнатной температуре 2-бром-5-фторпиридин (1.50 г, 8.52 ммоль) затем добавили и перемешивание продолжали в течение 3 ч при комнатной температуре. Прогресс реакции контролировали с помощьюTLC. Реакцию погасили водным NH4Cl и экстрагировали с помощью CH2Cl2 (350 мл). Объединенные органические слои промыли водой и соляным раствором, высушили над безводным Na2SO4 и концентрировали при пониженном давлении с получением продукта в виде неочищенной смеси. Очищение с помощью колоночной хроматографии (элюирование EtOAc/гексан) позволило получить сложный эфирn-BuLi (2.5 М в гексане; 2.7 мл, 6.8 ммоль) при -70C в атмосфере азота. После перемешивания в течение 15 мин при такой же температуре сложный эфир (1.50 г, 6.84 ммоль) в Et2O (5 мл) добавили к реакционной смеси при -70C. Реакционную смесь перемешивали в течение 1 ч при -70C, нагрели до комнатной температуры и перемешивали еще 2 ч. Прогресс реакции контролировали с помощью TLC. Реакцию погасили водным раствором NH4Cl и экстрагировали с помощью EtOAc (350 мл). Объединенные органические слои промыли водой и соляным раствором, высушили над безводным Na2SO4 и концентрировали при пониженном давлении. Неочищенное соединение очистили с помощью колоночной хроматографииMS (ESI): m/z 288 [М 1]. К перемешиваемому раствору кетона (0.69 г, 2.4 ммоль) в Et2O (50 мл) добавили свежеприготовленный диазометан [нитрозилметилмочевина (NMU; 1.8 г) в 10% гидроксиде калия (KOH; 300 мл)] при 0C и затем смесь нагрели до комнатной температуры. После перемешивания при комнатной температуре в течение 2 ч растворитель выпарили при пониженном давлении с получением неочищенного продукта. Неочищенный продукт очистили с помощью колоночной хроматографии (элюирование градиент 5-7% EtOAc/гексан) с получением эпоксида (0.49 г, 1.62 ммоль, 67.7%) в виде бесцветного полутвердого вещества. 1 Н ЯМР (200 МГц, CDCl3):8.51 (с, 1H), 7.56-7.30 (м, 3 Н), 6.89-6.67 (м, 2 Н), 3.44 (д, J=5.2 Гц, 1 Н),3.00-2.96 (м, 1 Н).MS (ESI): m/z 302[M1]. К перемешиваемому раствору эпоксида (0.49 г, 1.62 ммоль) в DMF (10 мл) добавили 1H-тетразол(0.11 г, 1.62 ммоль), а затем K2CO3 (0.11 г, 0.81 ммоль) при комнатной температуре в инертной атмосфере. Реакционную смесь перемешивали в течение 4 ч при 75C. Летучие вещества удалили при пониженном давлении и полученный остаток разбавили EtOAc (50 мл). Органический слой промыли водой, соляным раствором и высушили над безводным Na2SO4. После отфильтровывания твердого вещества растворитель выпарили при пониженном давлении с получением неочищенного соединения. Неочищенное соединение очистили с помощью колоночной хроматографии (элюирование EtOAc/гексан) с получением соединения 10 (0.18 г, 0.48 ммоль, 29.8%) в виде твердого вещества белого цвета. 1 Н ЯМР (500 МГц, CDCl3):8.73 (с, 1 Н), 8.41 (с, 1H), 7.63-7.58 (м, 1H), 7.54-7.50 (м, 1H), 7.32-7.27MS (ESI): m/z 372 [М 1]. ВЭЖХ: 98.6%. Разделение с помощью хиральной препаративной ВЭЖХ энантиомеров 10.(+) и (-) энантиомеры 10 разделили с помощью хиральной препаративной ВЭЖХ, применяя(A:B = 80:20) и расход 1.00 мл/мин). Разбавителем был EtOH/гексан (20:80). Угол поворота плоскости поляризации света: 2-(4-Хлор-2-фторфенил)-1,1-дифтор-1-(пиридин-2-ил)-3-(1H-тетразол-1-ил)пропан-2-ол (11). Соединение 11 синтезировали с применением таких же условий, что и для соединения 1, применяя 2-бромпиридин и 1-бром-4-хлор-2-фторбензол. Промежуточное соединение 1-(4-хлор-2-фторфенил)-2,2-дифтор-2-(пиридин-2-ил)этанон. Выход: 49%. 1 Н ЯМР (200 МГц, CDCl3):8.58 (д, J=4.4 Гц, 1H), 8.01-7.80 (м, 3 Н), 7.43 (т, J=5.6 Гц, 1 Н), 7.28-7.07 1-(5-Хлорпиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (12). Соединение 12 было синтезировано с применением таких же условий, что и соединение 1. Промежуточное соединение этил-2-(5-хлорпиридин-2-ил)-2,2-дифторацетат. Выход: 32.7%. 1 Н ЯМР (200 МГц, CDCl3):8.61 (с, 1H), 7.85 (дд, J=8.4, 2.6 Гц, 1H), 7.70 (д, J=8.4 Гц, 1 Н), 4.37 (кв,J=7.0 Гц, 2 Н), 1.33 (т, J=7.0 Гц, 3 Н). Промежуточное соединение 2-(5-хлорпиридин-2-ил)-1-(2,4-дифторфенил)-2,2-дифторэтанон. Выход: 51.8%. 1 Н ЯМР (200 МГц, CDCl3):8.51 (с, 1H), 8.10-8.00 (м, 1 Н), 7.91-7.75 (м, 2 Н), 7.03-6.95 (м, 1H), 6.906.70 (м, 1H). Промежуточное соединение 5-хлор-2-2-(2,4-дифторфенил)оксиран-2-ил)дифторметил)пиридин. Неохарактеризованный неочищенный продукт ввели на следующую стадию без дальнейшей очистки. 1-(5-Хлорпиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (12). Выход: 41% (0.021 г). 1 Н ЯМР (500 МГц, CDCl3):8.79 (с, 1 Н), 8.54 (с, 1 Н), 7.83-7.74 (м, 1H), 7 54 (д, J=5.5 Гц, 1 Н), 7.397.22 (м, 1H), 6.91 (с, 1H), 6.81-6.62 (м, 2 Н), 5.62 (д, J=15.0 Гц, 1H), 5.15 (д, J=15.0 Гц, 1H).MS (ESI): m/z 388 [M1]. ВЭЖХ: 99.1%. Соединение 29 в табл. 1 было получено при таких же условиях, что соединение 12 (см. табл. 1 для исходного вещества). Пример 13. 2-(2,4-Дифторфенил)-1,1-дифтор-1-(4-фторпиридин-2-ил)-3-(1H-тетразол-1-ил)пропан-2-ол (13). К суспензии порошка меди (0.72 г, 11.4 ммоль) в DMSO (10 мл) добавили этил-2-бром-2,2 дифторацетат (0.73 мл, 5.7 ммоль) и смесь перемешивали в течение 1 ч при комнатной температуре. 2-Бром-4-фторпиридин (0.5 г, 2.85 ммоль) затем добавили и перемешивание продолжали в течение 15 ч при комнатной температуре. Прогресс реакции контролировали с помощью TLC. Реакцию погасили водным NH4Cl (15 мл) и экстрагировали с помощью CH2Cl2 (315 мл). Объединенные органические слои промыли водой и соляным раствором, высушили над безводным Na2SO4 и концентрировали при пониженном давлении с получением неочищенного продукта. Колоночная хроматография (элюированиеEtOAc/гексан) обеспечила сложный эфир (0.37 г, 1.68 ммоль, 59%) в виде жидкости светло-желтого цвета. 1 Н ЯМР (500 МГц, CDCl3):8.50 (с, 1 Н), 7.78 (дд, J=9.0, 4.5 Гц, 1 Н), 7.58-7.54 (м, 1 Н), 4.41-4.34 (м,2 Н), 1.39-1.31 (м, 3 Н).MS (ESI): m/z 220 [M1]. К перемешиваемому раствору 1-бром-2,4-дифторбензола (0.19 мл, 1.68 ммоль) в Et2O (10 мл) добавили n-BuLi (2.5 М в гексане; 0.67 мл, 1.68 ммоль) при -70C и смесь перемешивали в течение 20 мин. Раствор сложного эфира (0.37 г, 1.68 ммоль) в Et2O (10 мл) добавили по каплям и смесь перемешивали в течение 1 ч при -70C. Температуру равномерно повышали до температуры окружающей среды и смесь перемешивали в течение еще 3 ч. Реакционную смесь погасили с помощью водного NH4Cl и экстрагировали с помощью EtOAc (320 мл). Объединенные органические слои промыли водой и соляным раствором, высушили над безводным Na2SO4 и концентрировали при пониженном давлении. Очищение с помощью колоночной хроматографии (элюирование EtOAc/гексан) позволило получить кетон (0.2 г,0.69 ммоль, 41%) в виде жидкости желтого цвета. 1 Н ЯМР (500 МГц, CDCl3):8.41 (с, 1 Н), 8.05 (арр кв, 1 Н), 7.85 (дд, J=9.0, 4.5 Гц, 1 Н), 7.62-7.58 (м,1 Н), 7.01-6.97 (м, 1 Н), 6.84-6.79 (м, 1H).MS (ESI): m/z 288 [M1]. Диазометан получили следующим образом. К холодному раствору 10% водного KOH (50 мл) и простого эфира (30 мл) добавили нитрозометилмочевину (2 г) по частям и смесь перемешивали в течение 1 ч. Простой эфирный слой отделили. К перемешиваемому раствору кетона (0.2 г, 0.69 ммоль) в Et2O(25 мл) добавили свежеприготовленный диазометан при 0C и смесь нагрели до комнатной температуры. После перемешивания в течение 3 ч при комнатной температуре растворитель выпарили при пониженном давлении с получением неочищенного продукта. Неочищенный продукт очистили с помощью колоночной хроматографии (элюирование EtOAc/гексан) с получением эпоксида (0.12 г, 0.41 ммоль, 59%) в виде жидкости. 1 Н ЯМР (500 МГц, CDCl3):8.51 (с, 1H), 7.52-7.43 (м, 2 Н), 7.39-7.35 (м, 1 Н), 6.86-6.81 (м, 1H), 6.766.71 (м, 1H), 3.43 (д, J=5.0 Гц, 1H), 2.97 (арр с, 1H). К перемешиваемому раствору вышеуказанного эпоксида (0.12 г, 0.41 ммоль) в DMF (5 мл) добавили K2CO3 (29 мг, 0.20 ммоль), а затем 1H-тетразол (29 мг, 0.41 ммоль) при комнатной температуре в инертной атмосфере. Реакционную смесь перемешивали в течение 5 ч при 80C. Летучие вещества удалили при пониженном давлении, и полученный остаток растворили в EtOAc (30 мл). Органический слой промыли водой и соляным раствором, высушили над безводным Na2SO4 и концентрировали при пониженном давлении. Очищение с помощью колоночной хроматографии (элюирование EtOAc/гексан) позволило получить соединение 13 (50 мг, 0.13 ммоль, 32%) в виде полутвердого вещества. 1 Н ЯМР (500 МГц, CDCl3):8.73 (с, 1 Н), 8.41 (с, 1H), 7.61 (дд, J=9.0, 4.5 Гц, 1H), 7.54-7.50 (м, 1H),7.50-7.27 (м, 1H), 6.90 (с, 1H), 6.78-6.73 (м, 1 Н), 6.69-6.65 (м, 1H), 5.58 (д, J=14.5 Гц, 1H), 5.13 (д,J=14.5 Гц, 1 Н).MS (ESI): m/z 372 [М 1]. ВЭЖХ: 97.1%. Разделение с помощью хиральной препаративной ВЭЖХ энантиомеров 13. Энантиомеры 13 (180 мг, 0.48 ммоль) разделили с помощью хиральной препаративной ВЭЖХ,применяя CHIRALPAK AD-H колонку (25020 мм, 5 мкм); подвижную фазу (А) 0.1% TFA в н-гексане - (В) EtOH (A:B = 90:10) и расход 15 мл/мин) с получением 13-(-) (60.0 мг, 0.16 ммоль, 33%) в виде твердого вещества грязно-белого цвета. Аналитические данные. Хиральная ВЭЖХ: 97.4% ее Rt = 9.429 мин (CHIRALPAK AD-H, 2504.6 мм, 5 мкм; подвижная фаза (А) н-гексан (В) EtOH (A:B = 80:20); расход 1.00 мл/мин). Угол поворота плоскости поляризации света []D24: -20.36 (с = 0.1% в CH3OH). 1 Н ЯМР (500 МГц, CDCl3):8.73 (с, 1H), 8.41 (д, J=2.5 Гц, 1H), 7.62-7.59 (м, 1H), 7.54-7.50 (м, 1H),7.32-7.27 (м, 1 Н), 6.90 (с, 1 Н), 6.78-6.73 (м, 1 Н), 6.69-6.65 (м, 1H), 5.58 (д, J=14.5 Гц, 1H), 5.13 (д,J=14.5 Гц, 1H). 1-(4-Хлорпиридин-2-ил)-2-(2,4-дифторфенил)-1,1-дифтор-3-(1H-тетразол-1-ил)пропан-2-ол (14). Соединение 14 было синтезировано при таких же условиях, что и соединение 13. Промежуточное соединение этил-2-(4-хлорпиридин-2-ил)-2,2-дифторацетат. Выход: 33%. 1 2-(2,4-Дифторфенил)-1,1-дифтор-1-(5-(5-фторпиримидин-4-ил)пиридин-2-ил)-3-(1H-тетразол-1 ил)пропан-2-ол (15). К перемешиваемому раствору F (2 г, 5.52 ммоль) в безводном Et2O (100 мл) добавили n-BuLi (1.6 М в гексане; 7 мл, 11.04 ммоль) при -78C в инертной атмосфере. После перемешивания в течение 45 мин при -78C, триметилборат (1.25 мл, 11.04 ммоль) добавили к реакционной смеси и перемешивание продолжали в течение еще 10 мин при -78C и за тем в течение 1 ч при комнатной температуре. Прогресс реакции контролировали с помощью TLC. Реакционную смесь погасили с помощью раствора уксусной кислоты (АсOH) в воде при 0C и затем перемешивали в течение еще 30 мин. Реакционную смесь сделали основной с помощью 2 нормального (N) гидроксида натрия (NaOH; рН 12) и промыли с помощьюEt2O (250 мл). Водный слой подкислили с помощью 2 н. НCl (рН 6) и экстрагировали с помощьюCH2Cl2 (350 мл). Объединенные органические слои промыли водой и соляным раствором, высушили над безводным Na2SO4 и концентрировали при пониженном давлении с получением соответствующей 5-пиридил-бороновой кислоты (1.6 г, 4.89 ммоль, 88%) в виде твердого вещества. 1 Н ЯМР (200 МГц, CDCl3):8.21 (с, 1 Н), 7.42-7.38 (м, 2 Н), 7.25-7.18 (м, 1H), 6.88-6.64 (м, 2 Н), 3.42(д, J=5.2 Гц, 1 Н), 2.98 (уш.с, 1H). К перемешиваемому раствору этой бороновой кислоты (0.2 г, 0.61 ммоль) и 4-бром-5-фторпиримидина (0.054 г, 0.30 ммоль) в 1,4-диоксане (10 мл) добавили K2CO3 (0.084 г,0.61 ммоль) и тетракис-(трифенилфосфин)палладий(0) (Pd(PPh3)4; 0.035 г, 0.03 ммоль) при комнатной температуре в инертной атмосфере. Полученную смесь перемешивали при 100C в течение 5 ч. Прогресс реакции контролировали с помощью TLC. Реакционной смеси дали охладиться до комнатной температуры, разбавили водой и экстрагировали с помощью EtOAc (350 мл). Объединенную органическую фазу промыли водой и соляным раствором, высушили над безводным Na2SO4 и концентрировали in vacuo. Неочищенное вещество очистили с помощью колоночной хроматографии на силикагеле (элюированиеEtOAc/гексан) с получением связанного продукта (0.14 г, 0.36 ммоль, 60%). 1 Н ЯМР (500 МГц, CDCl3):9.42 (с, 1 Н), 9.15 (с, 1H), 8.74 (д, J=3.0 Гц, 1H), 8.53 (дд, J=8.0, 2.0 Гц,1 Н), 7.66-7.63 (м, 1H), 7.43-7.39 (м, 1 Н), 6.86-6.83 (м, 1H), 6.77-6.73 (м, 1 Н), 3.51-3.48 (м, 1 Н), 3.01 (уш.с,1 Н).MS (ESI): m/z 380 [M1]. К перемешиваемому раствору связанного продукта (0.14 г, 0.36 ммоль) в DMF (3 мл) добавили 1H-тетразол (0.031 г, 0.44 ммоль), а затем K2CO3 (0.025 г, 0.18 ммоль) при комнатной температуре в инертной атмосфере. Реакционную смесь перемешивали при 70C в течение 16 ч. Реакционную смесь охладили до комнатной температуры, разбавили водой (5 мл) и экстрагировали с помощью EtOAc(220 мл). Органический слой промыли водой и соляным раствором и высушили над безводным Na2SO4. После отфильтровывания твердого вещества, растворитель выпарили при пониженном давлении с получением неочищенного соединения. Колоночная хроматография на силикагеле (элюированиеMS (ESI): m/z 450 [М 1]. ВЭЖХ: 94.47%. Соединения 30-38 и 93-96 в табл. 1 были получены с применением таких же условий, что и соединение 15 (cм. табл. 1 для исходных веществ). Разделение с помощью хиральной препаративной ВЭЖХ энантиомеров 30. Энантиомеры 30 (300 мг, 0.64 ммоль) разделили с помощью хиральной препаративной ВЭЖХ,применяя CHIRALPAK IA колонку (25020 мм, 5 мукм) подвижную фазу (А) н-гексан - (В) ГРА (А:В = 80:20) и расход 15 мл/мин с получением 30-(+) (60 мг, 0.13 ммоль) в виде твердого вещества грязнобелого цвета. Аналитические данные. Хиральная ВЭЖХ: 99.42% ее, Rt = 13.98 мин (CHIRALPAK IB колонка, 2504.6 мм, 5 мкм; подвижная фаза (А) н-гексан - (В) EtOH (A:B = 75:25); расход: 1.00 мл/мин). Угол поворота плоскости поляризации света []D24: +18.56 (с = 0.1% в CH3OH). 1 Н ЯМР (500 МГц, CDCl3):8.75 (с, 1H), 8.70 (с, 1 Н), 8.60 (д, J=2.0 Гц, 1 Н), 7.99 (д, J=8.0 Гц, 1H),7.84 (дд, J=8.0, 2.0 Гц, 1H), 7.72 (д, J=8.0 Гц, 1 Н), 7.49 (д, J=8.0 Гц, 1 Н), 7.47-7.38 (м, 1 Н), 7.33 (с, 1H),6.81-6.76 (м, 1H), 6.72-6.69 (м, 1H), 5.55 (д, J=14.5 Гц, 1H), 5.19 (д, J=14.5 Гц, 1 Н).MS (ESI): m/z 465 [M+H]+. ВЭЖХ: 99.1%. Разделение с помощью хиральной препаративной ВЭЖХ энантиомеров 31. Энантиомеры 31 (315 мг, 0.70 ммоль) разделили с помощью хиральной препаративной ВЭЖХ,применяя CHIRALPAK IC колонку (25020 мм, 5 мкм) подвижную фазу (А) н-гексан - (В) EtOH (А:В = 80:20) и расход 15 мл/мин с получением 31-(+) (90 мг, 0.20 ммоль) в виде твердого вещества грязнобелого цвета. Аналитические данные. Хиральная ВЭЖХ: 100% ее, Rt = 15.22 мин (CHIRALPAK IC колонка, 2504.6 мм, 5 мкм; подвижная фаза (А) н-гексан - (В) EtOH (A:B = 80:20); расход: 1.00 мл/мин). Угол поворота плоскости поляризации света []D25: +13.96 (с = 0.1% в CH3OH). 1 Н ЯМР (500 МГц, CDCl3):8.76 (с, 1H), 8.70 (с, 1H), 8.44 (д, J=2.0 Гц, 1 Н), 7.99-7.97 (м, 2 Н), 7.72 2-(2,5-Дифторфенил)-1,1-дифтор-1-(4-фторпиридин-2-ил)-3-(1H-тетразол-1-ил)пропан-2-ол (16). Соединение 16 получили с применением 2,5-дифтор-бромбензола и условий, применяемых при получении соединения 13: 0.021 г, в виде стекла. 1 Н ЯМР (500 МГц, CDCl3):8.74 (с, 1 Н), 8.41 (с, 1H), 7.64-7.62 (м, 1H), 7.55-7.51 (м, 1H), 7.07-7.03(400 мл) добавили n-BuLi (1.6 М раствор в гексане; 62.98 мл, 100.77 ммоль) медленно при -78C. После перемешивания в течение 45 мин DMF (12.28 г, 168.2 ммоль) добавили к реакционной смеси при -78C и перемешивание продолжали в течение еще 2 ч. После того как исходное вещество было израсходовано(определили с помощью TLC), реакционную смесь погасили с помощью насыщенного (satd) раствораNH4Cl и экстрагировали с помощью EtOAc (4500 мл). Объединенные органические экстракты высушили над безводным Na2SO4 и концентрировали при пониженном давлении с получением неочищенного вещества. Очищение посредством колоночной хроматографии на силикагеле (элюирование 15%EtOAc/гексан) позволило получить альдегид J (7.0 г, 37.8 ммоль, 45%) в виде твердого вещества желтого цвета. 1 Н ЯМР (500 МГц, CDCl3):10.09 (с, 1H), 8.83 (д, J=2.0 Гц, 1H), 8.02 (дд, J=8.0, 2.0 Гц, 1 Н), 7.68 (д,J=8.0 Гц, 1 Н).MS (ESI): m/z 186 [М+]. К перемешиваемому раствору альдегида J (1.0 г, 5.40 ммоль) в 1,2-диметоксиэтане (DME; 10 мл) добавили триметил(трифторметил)силан (TMSCF3; 1.3 мл, 8.10 ммоль), а затем фторид цезия (CsF; 821 мг, 5.40 ммоль) медленно при 0C в инертной атмосфере. Полученный раствор перемешивали в течение 12 ч при комнатной температуре. Прогресс реакции контролировали с помощью TLC. После того как исходное вещество было израсходовано, реакцию погасили с помощью 1 н. соляной кислоты (НCl; 5.0 мл), перемешивали в течение 30 мин и затем экстрагировали с помощью EtOAc (2150 мл). Объединенные органические экстракты промыли водой и насыщенным раствором NaHCO3, высушили над безводным Na2SO4 и концентрировали при пониженном давлении с получением неочищенного вещества. Очищение посредством колоночной хроматографии на силикагеле (элюирование 20% EtOAc/гексан) позволило получить соединение K (0.6 г, 2.34 ммоль, 43%) в виде твердого вещества желтого цвета. 1 Н ЯМР (500 МГц, CDCl3):8.44 (д, J=2.0 Гц, 1H), 7.73 (дд, J=8.5, 2.0 Гц, 1H), 7.56 (д, J=8.5 Гц, 1 Н),5.09-5.06 (м, 1 Н), 3.27 (уш.с, 1H).MS (ESI): m/z 258 [М 2]. ВЭЖХ: 97.05%. К перемешиваемому раствору соединения K (5.0 г, 19.53 ммоль) в сухом THF (60 мл) добавили гидрид натрия (NaH; 935 мг, 39.06 ммоль) по частям при 0C в инертной атмосфере. После перемешивания в течение 1 ч дисульфид углерода (CS2; 2.35 мл, 39.06 ммоль) добавили к реакционной смеси по каплям и смесь перемешивали в течение 1 ч при 0C. К полученной реакционной смеси йодметан (CH3I; 2.43 мл,39.06 ммоль) добавили при 0C и затем смесь перемешивали в течение 2 ч при комнатной температуре. После того как исходное вещество было израсходовано (определили с помощью TLC), реакцию погасили с помощью ледяной воды и экстрагировали с помощью CH2Cl2 (2100 мл). Объединенные органические экстракты высушили над безводным Na2SO4 и концентрировали при пониженном давлении с получением
МПК / Метки
МПК: A61K 31/4439, A61P 35/00, C07D 417/14, A61P 29/00, C07D 401/14, C07D 401/06
Метки: ингибирующие, металлоферменты, соединения
Код ссылки
<a href="https://eas.patents.su/30-24385-soedineniya-ingibiruyushhie-metallofermenty.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения, ингибирующие металлоферменты</a>
Предыдущий патент: Применение комплексной соли 2-морфолилметил-5-метилфенола в качестве пестицида против оидиума в плодах и листьях винограда
Следующий патент: Аппарат и способ для маркировки объекта
Случайный патент: Скважинные системы генерации света и способы применения












