Соединения, ингибирующие металлоферменты
Номер патента: 24197
Опубликовано: 31.08.2016
Авторы: Рафферти Стефен Уильям, Шотзингер Роберт Дж., Хоэкстра Уильям Дж.
Формула / Реферат
1. Соединение, имеющее структуру формулы (III)
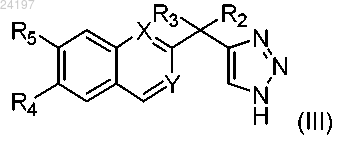
в котором X представляет собой СН или N, Y представляет собой СН или N,
R2 представляет собой изопропил,
R3 представляет собой гидроксил, и
R4 и R5 независимо представляют собой Н, галоген, метокси, циклопропилокси, C1-C6-фторалкоксигруппу, содержащую 1-5 атомов фтора, трифторметил, метилтио или оксазолил,
или его соль.
2. Соединение по п.1, в котором X = СН и Y = СН.
3. Соединение по п.1, в котором X = СН и Y = N.
4. Соединение по п.1, в котором X = N и Y = СН.
5. Соединение по п.1, которое представляет собой:
1-(6,7-диметоксинафтален-2-ил)-2-метил-1-(1H-1,2,3-триазол-4-ил)пропан-1-ол (1);
1-(6,7-диметоксиизохинолин-3-ил)-2-метил-1-(1H-1,2,3-триазол-4-ил)пропан-1-ол (2);
1-(6,7-бис-(дифторметокси)нафтален-2-ил)-2-метил-1-(1H-1,2,3-триазол-4-ил)пропан-1-ол (3);
2-метил-1-(6-(оксазол-5-ил)нафтален-2-ил)-1-(1Н-1,2,3-триазол-4-ил)пропан-1-ол (4);
1-(6,7-дихлорхинолин-2-ил)-2-метил-1-(1H-1,2,3-триазол-4-ил)пропан-1-ол (5);
2-метил-1-(6-(метилтио)хинолин-2-ил)-1-(1Н-1,2,3-триазол-4-ил)пропан-1-ол (7);
1-(6-циклопропоксихинолин-2-ил)-2-метил-1-(1H-1,2,3-триазол-4-ил)пропан-1-ол (8);
1-(7-хлор-6-(трифторметил)хинолин-2-ил)-2-метил-1-(1H-1,2,3-триазол-4-ил)пропан-1-ол (9);
2-метил-1-(1H-1,2,3-триазол-4-ил)-1-(6-(2,2,2-трифторэтокси)нафтален-2-ил)пропан-1-ол (12);
1-(6-(дифторметокси)нафтален-2-ил)-2-метил-1-(1Н-1,2,3-триазол-4-ил)пропан-1-ол (13);
1-(6-метоксихинолин-2-ил)-2-метил-1-(1Н-1,2,3-триазол-4-ил)пропан-1-ол (14);
2-метил-1-(1Н-1,2,3-триазол-4-ил)-1-(6-(2,2,2-трифторэтокси)хинолин-2-ил)пропан-1-ол (15);
1-(6,7-дифторхинолин-2-ил)-2-метил-1-(1Н-1,2,3-триазол-4-ил)пропан-1-ол (16);
2-метил-1-(1Н-1,2,3-триазол-4-ил)-1-(6-(трифторметокси)хинолин-2-ил)пропан-1-ол (17);
1-(6,7-бис-(дифторметокси)хинолин-2-ил)-2-метил-1-(1Н-1,2,3-триазол-4-ил)пропан-1-ол (20);
или их соль.
6. Способ лечения субъекта, страдающего от или подверженного нарушению или заболеванию, связанным с металлоферментами, который включает введение субъекту эффективного количества соединения, определенного в п.1, где нарушение или заболевание, связанное с металлоферментами, опосредовано 17-альфа гидроксилазой (CYP17) и где заболевание или нарушение представляет собой рак простаты, рак груди, андроген-зависимый рак, эстроген-зависимый рак, гиперплазию надпочечников, гипертрофию простаты, вирилизм, гирсутизм, облысение по мужскому типу, истинное преждевременное половое созревание, эндометриоз, миому матки, рак матки, мастопатию, синдром поликистозных яичников, бесплодие, акне, функциональный яичниковый гиперандрогенизм, гиперандрогенизм с хронической ановуляцией, гиперандрогенемию, преждевременное половое созревание, избыток гормонов надпочечников или андрогенов или маточные фиброиды.
7. Фармацевтическая композиция для лечения рака простаты, рака груди, андроген-зависимого рака, эстроген-зависимого рака, гиперплазии надпочечников, гипертрофии простаты, вирилизма, гирсутизма, облысения по мужскому типу, истинного преждевременного полового созревания, эндометриоза, миомы матки, рака матки, мастопатии, синдрома поликистозных яичников, бесплодия, акне, функционального яичникового гиперандрогенизма, гиперандрогенизма с хронической ановуляцией, гиперандрогенемии, преждевременного полового созревания, избытка гормонов надпочечников или андрогенов или маточных фиброидов, содержащая соединение по п.1 или его соль и фармацевтически приемлемый носитель.
8. Соединение, которое выбирается из группы, состоящей из:
1-(6-хлор-5-(трифторметил)хинолин-2-ил)-2-метил-1-(1H-1,2,3-триазол-4-ил)пропан-1-ол (6);
1-(6-(дифторметокси)-5-(тиофен-2-ил)хинолин-2-ил)-2-метил-1-(1H-1,2,3-триазол-4-ил)пропан-1-ол (10);
2-метил-1-(5-(тиофен-2-ил)-6-(2,2,2-трифторэтокси)хинолин-2-ил)-1-(1Н-1,2,3-триазол-5-ил)пропан-1-ол (11);
1-(5,6-дихлорхинолин-2-ил)-2-метил-1-(1Н-1,2,3-триазол-4-ил)пропан-1-ол (18);
1-(5-хлор-6-(дифторметокси)хинолин-2-ил)-2-метил-1-(1Н-1,2,3-триазол-4-ил)пропан-1-ол (19);
1-(5-хлор-6-(трифторметокси)хинолин-2-ил)-2-метил-1-(1H-1,2,3-триазол-4-ил)пропан-1-ол (21);
1-(6-(4-фторфенил)-5-(трифторметил)хинолин-2-ил)-2-метил-1-(1Н-1,2,3-триазол-4-ил)пропан-1-ол (22);
2-(1-гидрокси-2-метил-1-(1Н-1,2,3-триазол-4-ил)пропил)-5-(трифторметил)хинолин-6-карбонитрил (23),
или его соль.
Текст
Настоящее изобретение относится к соединениям формулы (III) имеющим модулирующую активность по отношению к металлоферментам, а также относится к способам лечения заболеваний, нарушений или их симптомов, опосредованных такими металлоферментами. Перекрестная ссылка на родственные заявки Настоящая заявка испрашивает приоритет американской патентной заявки US 61/413395, поданной в 13 ноября 2010 г., содержание которой включено сюда путем ссылки во всей полноте. Уровень техники Живые организмы развили строго отрегулированные процессы, которые особым образом импортируют металлы, транспортируют их к внутриклеточным местам хранения и, в конечном счете, транспортируют их к местам использования. Одной из наиболее важных функций металлов, таких как цинк и железо, в биологических системах является обеспечение активности металлоферментов. Металлоферменты представляют собой ферменты, которые вводят ионы металлов в активный центр фермента и используют металл как часть каталитического процесса. Более одной трети всех охарактеризованных ферментов являются металлоферментами. Работа металлоферментов сильно зависит от присутствия иона металла в активном центре фермента. Хорошо известно, что агенты, которые связываются и инактивируют ион металла в активном центре,резко снижают активность фермента. Природа использует ту же самую стратегию для снижения активности определенных металлоферментов в промежутки времени, когда ферментативная активность является нежелательной. Например, белок TIMP (тканевый ингибитор металлопротеиназ) связывается с ионом цинка в активном центре различных матриксных металлопротеиназ и тем самым приостанавливает ферментативную активность. Фармацевтическая промышленность использует такой же подход для дизайна лекарственных средств. Например, противоопухолевый агент кетоконазол против рака простаты содержит 1-имидазольную группу, которая связывается с гемовым железом, присутствующим в активном центре фермента-мишени CYP17 (17 гидроксилаза, 17,20-лиаза), и тем самым инактивирует фермент. Другой пример включает группу цинк-связывающей гидроксамовой кислоты, которая включена в наиболее известные ингибиторы матриксных металлопротеиназ и деацетилазы гистонов. Другим примером является группа цинк-связывающей карбоновой кислоты, которая включена в наиболее известные ингибиторы ангиотензин-конвертирующих ферментов. При разработке клинически безопасных и эффективных ингибиторов металлоферментов ключевым является применение наиболее подходящей металлсвязывающей группы для конкретной мишени и показания для лечения. Если используется слабо связывающая металлсвязывающая группа, активность может быть недостаточно оптимальной. С другой стороны, если используется очень сильно связывающая металлсвязывающая группа, селективность по отношению к ферменту-мишени по сравнению с родственными металлоферментами может быть недостаточно оптимальной. Отсутствие оптимальной селективности может послужить причиной клинической токсичности из-за непреднамеренного ингибирования этих нецелевых металлоферментов. Одним примером такой клинической токсичности является непреднамеренное ингибирование человеческих ферментов, участвующих в метаболизме лекарств, таких какCYP2C9, CYP2C19 и CYP3A4, противоопухолевым агентом кетоконазол против рака простаты, который имеется в продаже в настоящее время. Полагают, что это нецелевое ингибирование вызвано, главным образом, неизбирательным связыванием используемого в настоящее время 1-имидазола с железом в активном центре CYP2C9, CYP2C19 и CYP3A4. Другим примером является боль в суставах, которая наблюдалась во многих клинических исследованиях ингибиторов матриксных металлопротеиназ. Предполагается, что эта токсичность связана с ингибированием нецелевых металлоферментов из-за неизбирательного связывания группы гидроксамовой кислоты с цинком в нецелевых активных центрах. Следовательно, поиск металлсвязывающих групп, которые могут обеспечить более хороший баланс активности и селективности, остается главной задачей и был бы важным в осуществлении лекарственных средств и способов, чтобы восполнить неудовлетворенные в настоящее время потребности в лечении и предотвращении заболеваний, нарушений и их симптомов. Сущность изобретения Изобретение направлено на соединения (например, любые из изображенных ниже), способы регулирования активности металлоферментов и способы лечения заболеваний, нарушений и их симптомов. Способы могут содержать описываемые здесь соединения. Одним объектом настоящего изобретения являются соединения формулы (III) где X представляет собой СН или N; Y представляет собой СН или N; R2 представляет собой изопропил, R3 представляет собой гидроксил, и R4 и R5 независимо друг от друга представляют собой Н,галоген, метокси, циклопропилокси, C1-С 6-фторалкоксигруппу, содержащую 1-5 атомов фтора, трифторметил, метилтио или оксазолил, или их соли. В одном аспекте соединение формулы (III) является таким, в котором X представляет собой СН илиN; Y представляет собой СН или N; и R4 и R5 независимо представляют собой Н, галоген, метокси, С 1-С 6 фторалкоксигруппу, содержащую 1-5 атомов фтора, трифторметил, метилтио или оксазолил. В одном аспекте соединение формулы (III) является таким, в котором X = СН. В одном аспекте соединение формулы (III) является таким, в котором X = N. В одном аспекте соединение формулы (III) является таким, в котором Y = СН. В одном аспекте соединение формулы (III) является таким, в котором Y = N. В одном аспекте соединение формулы (III) является таким, в котором X = СН и Y=N. В одном аспекте соединение формулы (III) является таким, в котором X = N и Y=CH. В одном аспекте соединение формулы (III) является таким, в котором X = Y = СН. В одном аспекте соединение формулы (III) является таким, в котором X = Y = N. В одном аспекте соединение формулы III является таким, что соединение приобретает сродство к металлоферменту путем формирования одного или более из следующих типов химических взаимодействий или связей с металлом: сигма-связи, ковалентные связи, координационные-ковалентные связи, ионные связи, пи-связи, дельта-связи или дативные взаимодействия. В одном аспекте соединение формулы III является таким, что соединение связывается с металлом. В одном аспекте соединение формулы III является таким, что соединение связывается с железом,цинком, гемовым железом, марганцем, магнием, кластером сульфида железа, никелем, молибденом или медью. В одном аспекте соединение формулы III является таким, что соединение ингибирует класс ферментов, выбранный из семейства цитохрома Р 450, деацетилаз гистонов, матриксных металлопротеиназ,фосфодиэстераз, циклооксигеназ, карбоангидраз и синтаз оксида азота. В одном аспекте соединение формулы III является таким, что соединение ингибирует фермент, выбранный из 4-гидроксифенилпируват диоксигеназы, 5-липоксигеназы, аденозин дезаминазы, алкогольдегидрогеназы, аминопептидазы n, ангиотензин-конвертирующего фермента, ароматазы (CYP19), кальциневрина, карбамоилфосфат синтетазы, семейства карбоангидраз, катехол-О-метил трансферазы, семейства циклооксигеназ, дигидропиримидин дегидрогеназы-1, ДНК полимеразы, фарнезил-дифосфатсинтазы,фарнезил-трансферазы, фумарат редуктазы, ГАМК-аминотрансферазы, ГИФ-пролил гидроксилазы, семейства деацетилаз гистонов, интегразы ВИЧ, обратной транскриптазы ВИЧ-1, изолейцин тРНК лигазы,ланостерол деметилазы (CYP51), семейства матриксных металлопротеиназ, метионин аминопептидазы,нейтральной эндопептидазы, семейства синтаз оксида азота, фосфодиэстеразы III, фосфодиэстеразы IV,фосфодиэстеразы V, пируват: ферредоксин-оксидоредуктазы, почечной пептидазы, рибонуклеозиддифосфат-редуктазы, тромбоксан синтазы (CYP5a), тиреоидной пероксидазы, тирозиназы, уреазы и ксантиноксидазы. В одном аспекте соединение формулы III является таким, что соединение ингибирует фермент, выбранный из 1-дезокси-D-ксилулозо-5-фосфата редуктоизомеразы (DXR), 17-альфа гидроксилазы(CYP17), альдостерон синтазы (CYP11B2), аминопептидазы р, летального фактора сибирской язвы, аргиназы, бета-лактамазы, цитохрома Р 450 2 А 6, D-Ala-D-Ala-лигазы, дофамин-бета-гидроксилазы, эндотелин-конвертирующего фермента-1, глутамат карбоксипептидазы II, глутаминил циклазы, глиоксалазы,гем-оксигеназы, HPV/HSV E1 хеликазы, индоламин 2,3-диоксигеназы, лейкотриен-А 4-гидролазы, метионин аминопептидазы-2, пептид-деформилазы, фосфодиэстеразы VII, релаксазы, гидроксилазы ретиноевой кислоты (CYP26), ФНО-альфа конвертирующего фермента (ТАСЕ), УДФ-(3-O-(R-3-гидроксимиристоил-N-ацетилглюкозамин деацетилазы (LpxC), сосудистого адгезивного белка-1 (VAP-1) и гидроксилазы витамина D (CYP24). В одном аспекте соединение формулы III является таким, что соединение, как установлено, связывается с металлом. В одном аспекте соединение формулы III является таким, что соединение, как установлено, связывается с железом, цинком, гемовым железом, марганцем, магнием, кластером сульфида железа, никелем,молибденом или медью. В одном аспекте соединение формулы III является таким, что соединение, как установлено, ингибирует класс ферментов, выбранный из семейства цитохрома Р 450, деацетилаз гистонов, матриксных металлопротеиназ, фосфодиэстераз, циклооксигеназ, карбоангидраз и синтаз оксида азота. В одном аспекте соединение формулы III является таким, что соединение, как установлено, ингибирует фермент, выбранный из 4-гидроксифенилпируват диоксигеназы, 5-липоксигеназы, аденозин дезаминазы, алкогольдегидрогеназы, аминопептидазы n, ангиотензин-конвертирующего фермента, ароматазы (CYP19), кальциневрина, карбамоилфосфат синтетазы, семейства карбоангидраз, катехол-О-метил трансферазы, семейства циклооксигеназ, дигидропиримидин дегидрогеназы-1, ДНК полимеразы, фарнезил-дифосфат синтазы, фарнезил-трансферазы, фумарат редуктазы, ГАМК-аминотрансферазы, ГИФпролил гидроксилазы, семейства деацетилаз гистонов, интегразы ВИЧ, обратной транскриптазы ВИЧ-1,изолейцин тРНК лигазы, ланостерол деметилазы (CYP51), семейства матриксных металлопротеиназ, метионин аминопептидазы, нейтральной эндопептидазы, семейства синтаз оксида азота, фосфодиэстеразыIII, фосфодиэстеразы IV, фосфодиэстеразы V, пируват: ферредоксин-оксидоредуктазы, почечной пептидазы, рибонуклеозид-дифосфат-редуктазы, тромбоксан синтазы (CYP5a), тиреоидной пероксидазы, тирозиназы, уреазы и ксантиноксидазы. В одном аспекте описываемые здесь соединения являются такими, что соединение, как установле-2 024197 но, является ингибитором CYP17. В одном аспекте описываемые здесь соединения являются такими, что соединение, как установлено, имеет диапазон активности по отношению к ферменту-мишени и диапазон активности по отношению к нецелевому ферменту (например, CYP17 IC500,5 мкМ и IC506,0 мкМ для CYP2C9, CYP2C19 иIC500,96 мкМ и IC505,5 мкМ для CYP2C9, CYP2C19 и CYP3A4; CYP17 IC50XX мкМ и IC50YY мкМ ДЛЯ CYP2C9, CYP2C19 и CYP3A4, где XX представляет собой число меньше чем YY). В некоторых аспектах, например, XX в 2 раза, 5 раз, 10 раз, 50 раз, 100 или 1000 раз меньше чем YY). Другим объектом является способ ингибирования активности металлофермента, включающий контактирование соединения формулы III с металлоферментом. В одном аспекте контактирование происходит in vivo. В другом аспекте контактирование происходит in vitro. Способ также может быть таким, в котором металлофермент содержит атом металла, который представляет собой железо, цинк, гемовое железо, марганец, магний, кластер сульфида железа, никель,молибден или медь; в котором металлофермент является представителем класса ферментов, выбранного из семейства цитохрома Р 450, деацетилаз гистонов, матриксных металлопротеиназ, фосфодиэстераз, циклооксигеназ,карбоангидраз и синтаз оксида азота; металлофермент представляет собой ароматазу (CYP19), циклооксигеназу, ланостерол деметилазу (CYP51), синтазу оксида азота, тромбоксан-синтазу (CYP5a), тиреоидную пероксидазу, 17-альфа гидроксилазу/17,20-лиазу (CYP17), альдостерон синтазу (CYP11B2), цитохром Р 450 2 А 6, гемоксигеназу, индоламин 2,3-диоксигеназу, гидроксилазу ретиноевой кислоты (CYP26) или гидроксилазу витамина D (CYP24); в котором металлофермент представляет собой 17-альфа гидроксилазу/17,20-лиазу (CYP17); в котором металлофермент представляет собой 4-гидроксифенилпируват диоксигеназу, 5 липоксигеназу, аденозин дезаминазу, алкогольдегидрогеназу, аминопептидазу n, ангиотензинконвертирующий фермент, ароматазу (CYP19), кальциневрин, карбамоилфосфат синтетазу, семейство карбоангидраз, катехол-О-метил трансферазу, семейство циклооксигеназ, дигидропиримидин дегидрогеназу-1, ДНК полимеразу, фарнезил-дифосфат синтазу, фарнезил-трансферазу, фумарат редуктазу,ГАМК-аминотрансферазу, ГИФ-пролил гидроксилазу, семейство деацетилаз гистонов, интегразу ВИЧ,обратную транскриптазу ВИЧ-1, изолейцин тРНК лигазу, ланостерол деметилазу (CYP51), семейство матриксных металлопротеиназ, метионин аминопептидазу, нейтральную эндопептидазу, семейство синтаз оксида азота, фосфодиэстеразу III, фосфодиэстеразу IV, фосфодиэстеразу V, пируват: ферредоксиноксидоредуктазу, почечную пептидазу, рибонуклеозид-дифосфат-редуктазу, тромбоксан синтазу(CYP5a), тиреоидную пероксидазу, тирозиназу, уреазу и ксантиноксидазу; или в котором металлофермент представляет собой 1-дезокси-D-ксилулозо-5-фосфата редуктоизомеразу(DXR), 17-альфа гидроксилазу (CYP17), альдостерон синтазу (CYP11B2), аминопептидазу р, летальный фактор сибирской язвы, аргиназу, бета-лактамазу, цитохром Р 450 2 А 6, D-Ala-D-Ala-лигазу, дофаминбета-гидроксилазу, эндотелин-конвертирующий фермент-1, глутамат карбоксипептидазу II, глутаминил циклазу, глиоксалазу, гемоксигеназу, HPV/HSV E1 хеликазу, индоламин 2,3-диоксигеназу, лейкотриенА 4-гидролазу, метионин аминопептидазу-2, пептид-деформилазу, фосфодиэстеразу VII, релаксазу, гидроксилазу ретиноевой кислоты (CYP26), ФНО-альфа конвертирующий фермент (ТАСЕ), УДФ-(3-O-(R-3 гидроксимиристоил-N-ацетилглюкозамин деацетилазу (LpxC), сосудистый адгезивный белок-1 (VAP-1) или гидроксилазу витамина D (CYP24). Способы, соответствующие настоящему изобретению, могут также включать введение соединения субъекту. Заявляемые здесь способы включают такие способы, в которых указанное соединение приведенной здесь формулы (III), как установлено, имеет диапазон активности по отношению к CYP17 IC500,5 мкМ и IC506,0 мкМ для CYP2C9, CYP2C19 и CYP3A4; CYP17 IC501,0 мкМ и IC506,0 мкМ для CYP2C9,CYP2C19 и CYP3A4; CYP17 IC501,0 мкМ и IC5010,0 мкМ для CYP2C9, CYP2C19 и CYP3A4; CYP17CYP3A4; CYP17 IC50XX мкМ и IC50YY мкМ ДЛЯ CYP2C9, CYP2C19 и CYP3A4, где XX представляет собой число меньше чем YY. В некоторых вариантах осуществления, например, XX является в 2 раза, 5 раз, 10 раз, 50 раз, 100 или 1000 раз меньше чем YY. Заявляемые соединения включают такие, когда соединение, как установлено, приобретает сродство,по меньшей мере частично, к металлоферменту путем формирования одного или более из следующих типов химических взаимодействий или связей с металлом: сигма-связи, ковалентные связи, координационные-ковалентные связи, ионные связи, пи-связи, дельта-связи или дативные взаимодействия. Соединения также могут приобретать сродство через более слабые взаимодействия с металлом, такие как вандер-ваальсовые взаимодействия, катион-pi взаимодействия, анион-pi взаимодействия, диполь-дипольные взаимодействия, ион-дипольные взаимодействия. В одном варианте осуществления соединение, как ус-3 024197 тановлено, имеет связывающее взаимодействие с металлом через 4-(1,2,3-триазольный) фрагмент; в другом варианте осуществления соединение, как установлено, имеет связывающее взаимодействие с металлом через N атом 4-(1,2,3-триазольного) фрагмента. Способы определения металл-лиганд связывающих взаимодействий известны в уровне техники, что подтверждается ссылками, которые включают, например, "Principles of Bioinorganic Chemistry" by Lippard and Berg, University Science Books, (1994); "Mechanisms of Inorganic Reactions" by Basolo and PearsonJohn WileySons Inc.; 2nd edition (September 1967); "Biological Inorganic Chemistry" by Ivano Bertini, Harry Gray, Ed Stiefel, Joan Valentine, University Science Books (2007); Xue et al. "Nature Chemical Biology",vol. 4, no. 2, 107-109 (2008). В некоторых случаях соединения изобретения выбраны из соединений формулы (III) (а также их фармацевтически приемлемые соли): 1-(6,7-диметоксинафтален-2-ил)-2-метил-1-(1H-1,2,3-триазол-4-ил)пропан-1-ол (1); 1-(6,7-диметоксиизохинолин-3-ил)-2-метил-1-(1H-1,2,3-триазол-4-ил)пропан-1-ол (2); 1-(6,7-бис-(дифторметокси)нафтален-2-ил)-2-метил-1-(1H-1,2,3-триазол-4-ил)пропан-1-ол (3); 2-метил-1-(6-(оксазол-5-ил)нафтален-2-ил)-1-(1H-1,2,3-триазол-4-ил)пропан-1-ол (4); 1-(6,7-дихлорхинолин-2-ил)-2-метил-1-(1H-1,2,3-триазол-4-ил)пропан-1-ол (5); 2-метил-1-(6-(метилтио)хинолин-2-ил)-1-(1 Н-1,2,3-триазол-4-ил)пропан-1-ол (7); 1-(6-циклопропоксихинолин-2-ил)-2-метил-1-(1H-1,2,3-триазол-4-ил)пропан-1-ол (8); 1-(7-хлор-6-(трифторметил)хинолин-2-ил)-2-метил-1-(1H-1,2,3-триазол-4-ил)пропан-1-ол (9); 2-метил-1-(1 Н-1,2,3-триазол-4-ил)-1-(6-(2,2,2-трифторэтокси)нафтален-2-ил)пропан-1-ол (12); 1-(6-(дифторметокси)нафтален-2-ил)-2-метил-1-(1 Н-1,2,3-триазол-4-ил)пропан-1-ол (13); 1-(6-метоксихинолин-2-ил)-2-метил-1-(1 Н-1,2,3-триазол-4-ил)пропан-1-ол (14); 2-метил-1-(1 Н-1,2,3-триазол-4-ил)-1-(6-(2,2,2-трифторэтокси)хинолин-2-ил)пропан-1-ол (15); 1-(6,7-дифторхинолин-2-ил)-2-метил-1-(1 Н-1,2,3-триазол-4-ил)пропан-1-ол (16); 2-метил-1-(1 Н-1,2,3-триазол-4-ил)-1-(6-(трифторметокси)хинолин-2-ил)пропан-1-ол (17); 1-(6,7-бис-(дифторметокси)хинолин-2-ил)-2-метил-1-(1H-1,2,3-триазол-4-ил)пропан-1-ол (20). В некоторых случаях соединения согласно изобретению формулы (III) (включая описанные выше соединения и их фармацевтически приемлемые соли) представляют собой (+) энантиомер, (-) энантиомер, (R)-энантиомер или (S)-энантиомер. В других вариантах осуществления изобретения соединение представляет собой преимущественно (например, 90%, 95%, 98%, N%, где N представляет собой число больше чем 50) (+) энантиомер, (-) энантиомер, (R)-энантиомер или (S)-энантиомер. В другом аспекте изобретение обеспечивает фармацевтическую композицию, содержащую соединение формулы III и фармацевтически приемлемый носитель. В других аспектах изобретение обеспечивает способ модуляции активности металлоферментов в субъекте, включающий контактирование субъекта с соединением формулы III, в таком количестве и в таких условиях, которые являются достаточными, чтобы модулировать активность металлоферментов. В одном аспекте изобретение обеспечивает способ лечения субъекта, страдающего от или подверженного нарушению или заболеванию, которые указаны здесь, включающий введение субъекту эффективного количества соединения или фармацевтической композиции соединения формулы III. В одном аспекте изобретение обеспечивает способ лечения субъекта, страдающего от или подверженного нарушению или заболеванию, которые ассоциированы с металлоферментами, включающий введение субъекту эффективного количества соединения или фармацевтической композиции соединения формулы III. В другом аспекте изобретение обеспечивает способ лечения субъекта, страдающего от или подверженного нарушению или заболеванию, которые ассоциированы с металлоферментами, где субъект был признан нуждающимся в лечении нарушения или заболевания, ассоциированных с металлоферментами,включающий введение указанному субъекту, нуждающемуся в этом, эффективного количества соединения или фармацевтической композиции соединения формулы III, так что указанный субъект лечится от указанного нарушения. В другом аспекте изобретение обеспечивает способ лечения субъекта, страдающего от или подверженного нарушению или заболеванию, которые опосредованы металлоферментами, где субъект был признан нуждающимся в лечении нарушения или заболевания, опосредованных металлоферментами,включающий введение указанному субъекту, нуждающемуся в этом, эффективного количества соединения или фармацевтической композиции соединения формулы III, так что активность металлоферментов в указанном субъекте модулируется (например, снижается, ингибируется). В другом аспекте описанные здесь соединения предпочтительно нацелены на раковые клетки по сравнению с нетрансформированными клетками. Способы, соответствующие настоящему изобретению, включают такие способы, в которых заболевание или нарушение опосредовано любой из 4-гидроксифенилпируват диоксигеназы, 5-липоксигеназы,аденозин дезаминазы, алкогольдегидрогеназы, аминопептидазы n, ангиотензин-конвертирующего фермента, ароматазы (CYP19), кальциневрина, карбамоилфосфат синтетазы, семейства карбоангидраз, катехол-О-метил трансферазы, семейства циклооксигеназ, дигидропиримидин дегидрогеназы-1, ДНК поли-4 024197 меразы, фарнезил-дифосфат синтазы, фарнезил-трансферазы, фумарат редуктазы, ГАМКаминотрансферазы, ГИФ-пролил гидроксилазы, семейства деацетилаз гистонов, интегразы ВИЧ, обратной транскриптазы ВИЧ-1, изолейцин тРНК лигазы, ланостерол деметилазы (CYP51), семейства матриксных металлопротеиназ, метионин аминопептидазы, нейтральной эндопептидазы, семейства синтаз оксида азота, фосфодиэстеразы III, фосфодиэстеразы IV, фосфодиэстеразы V, пируват: ферредоксиноксидоредуктазы, почечной пептидазы, рибонуклеозид-дифосфат-редуктазы, тромбоксан синтазы(CYP5a), тиреоидной пероксидазы, тирозиназы, уреазы или ксантиноксидазы. Способы, соответствующие настоящему изобретению, включают способы, в которых заболевание или нарушение опосредовано любой из 1-дезокси-D-ксилулозо-5-фосфата редуктоизомеразы (DXR), 17 альфа гидроксилазы (CYP17), альдостерон синтазы (CYP11B2), аминопептидазы р, летального фактора сибирской язвы, аргиназы, бета-лактамазы, цитохрома Р 450 2 А 6, D-Ala-D-Ala-лигазы, дофамин-бетагидроксилазы, эндотелин-конвертирующего фермента-1, глутамат карбоксипептидазы II, глутаминил циклазы, глиоксалазы, гем-оксигеназы, HPV/HSV E1 хеликазы, индоламин 2,3-диоксигеназы, лейкотриен-А 4-гидролазы, метионин аминопептидазы-2, пептид-деформилазы, фосфодиэстеразы VII, релаксазы,гидроксилазы ретиноевой кислоты (CYP26), ФНО-альфа конвертирующего фермента (ТАСЕ), УДФ-(3 О-(R-3-гидроксимиристоил-N-ацетилглюкозамин деацетилазы (LpxC), сосудистого адгезивного белка-1(VAP-1) или гидроксилазы витамина D (CYP24). Способы, соответствующие настоящему изобретению, включают способы, в которых заболевание или нарушение представляет собой рак, сердечно-сосудистое заболевание, воспалительное заболевание,инфекционное заболевание, нарушение обмена веществ, офтальмологическое заболевание, заболевание центральной нервной системы (ЦНС), урологическое заболевание или заболевание желудочнокишечного тракта. Способы, соответствующие настоящему изобретению, включают способы, в которых заболевание или нарушение представляет собой рак простаты, рак груди, эндометриоз, маточные фиброиды, воспалительная болезнь кишечника, псориаз, системную грибковую инфекцию, онихомикоз или сердечнососудистое заболевание. Способы, соответствующие настоящему изобретению, включают способы, в которых субъект признан нуждающимся в особо назначенном лечении. Признание субъекта в необходимости такого лечении может быть суждением субъекта или специалиста в области медицины и может быть субъективным (например, мнение) или объективным (например, оценка путем теста или диагностики). Другим объектом настоящего изобретения являются соединения: 1-(6-хлор-5-(трифторметил)хинолин-2-ил)-2-метил-1-(1H-1,2,3-триазол-4-ил)пропан-1-ол (6); 1-(6-(дифторметокси)-5-(тиофен-2-ил)хинолин-2-ил)-2-метил-1-(1 Н-1,2,3-триазол-4-ил)пропан-1-ол(23). Подробное описание Определения Для того чтобы изобретение можно было легче понять, некоторым терминам для удобства сначала даются определения. Используемый здесь термин "лечение" заболевания охватывает предотвращение, улучшение, облегчение и/или вылечивание нарушения и/или условий, которые могут вызвать нарушение. Термины"лечащий" и "лечение" относятся к способу облегчения или ослабления болезни и/или ее сопутствующих симптомов. В соответствии с настоящим изобретением, термин "лечение" включает предотвращение,блокирование, ингибирование, смягчение, защиту от, модуляцию, реверсирование эффектов и снижение частоты возникновения, например, пагубных эффектов нарушения. Используемый здесь термин "ингибирование" охватывает предотвращение, снижение и остановку прогрессирования. Следует учесть, что термину "ингибирование фермента" (например, ингибирование металлофермента) дается определение и описание ниже. Термин "модулировать" относится к повышениям или снижениям активности фермента в ответ на воздействие соединением по изобретению. Термины "изолированный", "очищенный" или "биологически чистый" относятся к материалу, который по существу или преимущественным образом не содержит компоненты, который обычно сопровождают его в его нативном (как он найден в природе) состоянии. Чистота и гомогенность обычно определяется с использованием методик аналитической химии, таких как гель-электрофорез в полиакриламидном геле или высокоэффективная жидкостная хроматография. В частности, в вариантах осуществления соединение является чистым по меньшем мере на 85%, более предпочтительно по меньшей мере на 90%,более предпочтительно по меньшей мере на 95%, и наиболее предпочтительно по меньшей мере на 99%. Термин "введение" или "вводящий" включает пути введения соединения(й) субъекту с целью выполнения предназначенной им задачи. Примеры путей введения, которые могут быть использованы,включают инъекцию (подкожную, внутривенную, парентерально, внутрибрюшинно, интратекально),наружное, пероральное, ингаляция, ректальное и трансдермальное. Термин "эффективное количество" включает количество, эффективное (при необходимых дозировках и в течение необходимых периодов времени) для достижения требуемого результата. Эффективное количество соединения может варьироваться в зависимости от факторов, таких как состояние болезни,возраст и вес субъекта, и способности соединения вызвать требуемый эффект в субъекте. Режимы дозирования могут быть отрегулированы для обеспечения оптимального терапевтического эффекта. Эффективное количество также представляет собой количество, в котором любые токсические или вредные эффекты (например, побочные эффекты) ингибирующего соединения перевешиваются благоприятными терапевтическими эффектами. Используемые здесь фразы "системное введение", "введенный системно", "периферическое введение" и "введенный периферически" означают такое введение соединения(й), лекарственного средства или другого вещества, что оно поступает в систему пациента и, таким образом, подлежит метаболизму и другим подобным процессам. Термин "терапевтически эффективное количество" относится к такому количеству вводимого соединения, которое является достаточным для предотвращения развития или облегчения в определенной степени одного или более из симптомов лечимого состояния или нарушения. Терапевтически эффективное количество соединения (т.е. эффективная доза) может варьироваться от около 0,005 мкг/кг до около 200 мг/кг, предпочтительно от около 0,01 до около 200 мг/кг, более предпочтительно от около 0,015 до около 30 мг/кг массы тела. В других вариантах осуществления изобретения терапевтически эффективное количество может варьироваться от около 1,0 пМ до около 10 М. Специалист в данной области техники понимает, что определенные факторы могут влиять на дозировку,требуемую для эффективного лечения субъекта, включая, но не ограничиваясь, тяжесть заболевания или расстройства, предыдущие случаи лечения, общее состояние здоровья и/или возраст субъекта и наличие других заболеваний. Более того, лечение субъекта терапевтически эффективным количеством соединения может включать однократное введение или, предпочтительно, может включать серию введений. В одном примере лечение субъекта проводится соединением в диапазоне между около 0,005 мкг/кг до около 200 мг/кг массы тела, один раз в день, в течение между около 1-10 недель, предпочтительно между 2-8 неделями, более предпочтительно между около 3-7 недель и еще более предпочтительно в течение около 4, 5 и 6 недель. В другом примере, лечение субъекта может проводиться ежедневно в течение нескольких лет на фоне хронического состояния или нарушения. Следует понимать, что эффективная доза соединения, используемая для лечения, может повышаться или понижаться в течение курса конкретного лечения. Термин "хиральный" относится к молекулам, у которых есть свойство не совмещаться в пространстве со своим зеркальным отражением, в то время как термин "ахиральный" относится к молекулам, которые совмещаются в пространстве с их зеркальным отражением. Термин "диастереоизомеры" относится к стереоизомерам с двумя или более центрами асимметрии,чьи молекулы не являются зеркальными отражениями друг друга. Термин "энантиомеры" относится к двум стереоизомерам соединения, которые не являются совмещаемыми в пространстве зеркальными отражениями друг друга. Эквимолярная смесь двух энантиомеров называется "рацемической смесью" или "рацематом". Термин "изомеры" или "стереоизомеры" относится к соединениям, которые имеют идентичный химические состав, но отличаются расположением атомов или групп в пространстве. Термин "пролекарство" включает соединения с фрагментами, которые могут метаболизироваться invivo. В целом, пролекарство метаболизируется in vivo эстеразами или через другие механизмы до активных лекарств. Примеры пролекарств и их применений хорошо известны в уровне техники (см., например, Berge et al. (1977) "Pharmaceutical Salts", J. Pharm. Sci. 66:1-19). Пролекарства могут быть полученыin situ во время финального выделения и очистки соединений, или путем отдельной реакции очищенного соединения в форме свободной кислоты или гидроксильной форме с подходящим эстерифицирующим агентом. Гидроксильные группы могут превращаться в сложные эфиры за счет обработки карбоновой кислотой. Примеры пролекарственных фрагментов включают замещенные и незамещенные, разветвленные или неразветвленные фрагменты, являющиеся низшими алкиловыми сложными эфирами (например,сложные эфиры пропионовой кислоты), низшие алкениловые сложные эфиры, ди-(низший алкил)-амино низшие алкиловые сложные эфиры (например, диметиламиноэтиловый сложный эфир), ациламино низшие алкиловые сложные эфиры (например, ацетилоксиметиловый сложный эфир), ацилокси низшие алкиловые сложные эфиры (например, пивалоилоксиметиловый сложный эфир), ариловые сложные эфиры эфир), замещенные (например, метильными, галогеновыми, или метоксизаместителями) ариловые и ариловые-(низшие алкиловые) сложные эфиры, амиды, низшие алкиловые амиды, ди-(низшие алкиловые) амиды и гидроксиамиды. Предпочтительными пролекарственными фрагментами являются сложные эфиры пропионовой кислоты и сложные ацилэфиры. Пролекарства, которые превращаются в активные формы через другие механизмы in vivo, также включены. В некоторых аспектах соединения по изобретению представляют собой пролекарства любой из приведенных здесь формул. Термин "субъект" относится к животным, таким как млекопитающие, включая, но не ограничиваясь только ими, приматов (например, людей), коров, овец, коз, лошадей, собак, кошек, кроликов, крыс, мышей и т.п. В некоторых вариантах осуществления изобретения, субъектом является человек. Термины "a," "an" и "the" относятся к "одному или более" при использовании в настоящей заявке,включая формулу изобретения. Таким образом, например, указание "образец" включает множество образцов, если только контекст явно не указывает обратное (например, множество образцов), и так далее. Во всем описании и формуле изобретения слова "содержат", "содержит" и "содержащий" используются в неограничивающем смысле, за исключением случаев, когда контекст свидетельствует о другом. Под используемым здесь термином "около", когда он относится к значению, подразумевается, что он охватывает варьирование в некоторых вариантах осуществления 20%, в некоторых вариантах осуществления 10%, в некоторых вариантах осуществления 5%, в некоторых вариантах осуществления 1%, в некоторых вариантах осуществления 0,5%, и в некоторых вариантах осуществления 0,1% от указанного значения, пока такое варьирование подходит для осуществления раскрытых способов или исполнения раскрытых композиций. Применение слова "ингибитор" здесь означает молекулу, которая проявляет активность ингибирования металлофермента. Под термином "ингибировать" здесь подразумевается снижение активности металлофермента по сравнению с активностью металлофермента в отсутствие ингибитора. В некоторых вариантах осуществления изобретения термин "ингибировать" означает снижение активности металлофермента по меньшей мере на около 5%, по меньшей мере на около 10%, по меньшей мере на около 20%,по меньшей мере на около 25%, по меньшей мере на около 50%, по меньшей мере на около 60%, по меньшей мере на около 70%, по меньшей мере на около 80%, по меньшей мере на около 90%, или по меньшей мере на около 95%. В других вариантах осуществления изобретения "ингибировать" означает снижение активности металлофермента от около 5 до около 25%, от около 25 до около 50%, от около 50 до около 75%, или от около 75 до 100%. В некоторых вариантах осуществления изобретения, "ингибировать" означает снижение активности металлофермента на около 95-100%, например снижение активности на 95, 96, 97, 98, 99 или 100%. Такие снижения можно измерить, используя разнообразные методики,которые известны специалисту в данной области техники. Конкретные методы анализов для измерения индивидуальной активности описаны ниже. Далее, соединения по изобретению включают олефины, имеющие любую геометрию: "Z" относится к конфигурации, которая называется "cis" (та же сторона) конфигурация, в то время как "Е" относится к конфигурации "транс" (противоположная сторона) конфигурация. Что касается классификации хиральных центров, терминам "D" и "L" (или плюс и минус) конфигурация даны определения в Рекомендациях ИЮПАК. Что же касается применения терминов диастереомер, рацемат, эпимер и энантиомер, они будут использоваться в их обычном контексте для описания стереохимии препаратов. Используемый здесь термин "алкил" относится к прямоцепочечнойили разветвленной углеводородной группе, содержащей 1-12 атомов углерода. Термин "низший алкил" относится к С 1-С 6-алкильной цепи. Примеры алкильных групп включают метил, этил, н-пропил, изопропил, трет-бутил и н-пентил. Алкильные группы могут быть необязательно замещенными одним или более заместителями. Термин "алкенил" относится к ненасыщенной углеводородной цепи, которая может быть неразветвленной или разветвленной цепью, содержащей 2-12 атомов углерода и по меньшей мере одну двойную связь углерод-углерод. Алкенильные группы могут быть необязательно замещенными одним или более заместителями. Термин "алкинил" относится к ненасыщенной углеводородной цепи, которая может быть неразветвленной или разветвленной цепью, содержащей 2-12 атомов углерода и по меньшей мере одну тройную связь углерод-углерод. Алкинильные группы могут быть необязательно замещенными одним или более заместителями. Углероды sp2 или sp алкенильной группы и алкинильной группы, соответственно, могут быть необязательно местом присоединения алкенильных или алкинильных групп. Термин "алкокси" относится к -О-алкильному радикалу. Термин "галоалкокси" относится к -О-алкильному радикалу, замещенному одним или более галогеновыми заместителями. Примеры галоалкоксигрупп включают трифторметокси и 2,2,2-трифторэтокси. Используемый здесь термин "галоген", "гал" или "гало" означает -F, -Cl, -Br или -I. Термин "циклоалкил" относится к углеводородной 3-8 членной моноциклической или 7-14 членной бициклической кольцевой системе, имеющей по меньше мере одно насыщенное кольцо или имеющей по меньшей мере одно неароматическое кольцо, где неароматическое кольцо может иметь некоторую сте-7 024197 пень ненасыщения. Циклоалкильные группы могут быть необязательно замещенными одним или более заместителями. В одном варианте осуществления изобретения 0, 1, 2, 3 или 4 атома каждого кольца циклоалкильной группы могут быть замещенными заместителем. Представительные примеры циклоалкильной группы включают циклопропил, циклопентил, циклогексил, циклобутил, циклогептил, циклопентенил, циклопентадиенил, циклогексенил, циклогексадиенил и т.п. Термин "арил" относится к углеводородной моноциклической, бициклической или трициклической ароматической кольцевой системе. Арильные группы могут быть необязательно замещенными одним или более заместителями. В одном варианте осуществления изобретения 0, 1,2, 3, 4, 5 или 6 атомов каждого кольца арильной группы могут быть замещенными заместителем. Примеры арильных групп включают фенил, нафтил, антраценил, флуоренил, инденил, азуленил и т.п. Термин "гетероарил" относится к ароматической 5-8-членной моноциклической, 8-12-членной бициклической или 11-14-членной трициклической кольцевой системе, имеющей 1-4 кольцевых гетероатома в случае моноциклической системы, 1-6 гетероатомов - в случае бициклической системы, или 1-9 гетероатомов - в случае трициклической системы, где указанные гетероатомы выбраны из О, N, или S, а остальные атомы в кольцах являются углеродами (с соответствующим количеством атомов водорода,если не указано иначе). Гетероарильные группы могут быть необязательно замещенными одним или более заместителями. В одном варианте осуществления изобретения 0, 1, 2, 3 или 4 атома каждого кольца гетероарильной группы могут быть замещенными заместителем. Примеры гетероарильных групп включают пиридил, фуранил, тиенил, пирролил, оксазолил, оксадиазолил, имидазолил, тиазолил, изоксазолил,хинолинил, пиразолил, изотиазолил, пиридазинил, пиримидинил, пиразинил, триазинил, изохинолинил,индазолил и т.п. Термин "азот-содержащий гетероарил" относится к гетероарильной группе, имеющей 1-4 кольцевых гетероатома азота в случае моноциклической группы, 1-6 кольцевых гетероатома азота - в случае бициклической группы, или 1-9 кольцевых гетероатома азота - в случае трициклической группы. Термин "гетероциклоалкил" относится к неароматической 3-8-членной моноциклической, 7-12 членной бициклической или 10-14-членной трициклической кольцевой системе, содержащей 1-3 гетероатома в случае моноциклической системы, 1-6 гетероатомов - в случае бициклической системы, или 19 гетероатомов - в случае трициклической системы, где указанные гетероатомы выбраны из О, N, S, В, Р или Si, и где неароматическая кольцевая система является полностью насыщенной. Гетероциклоалкильные группы могут быть необязательно замещенными одним или более заместителями. В одном варианте осуществления изобретения, 0, 1, 2, 3 или 4 атома каждого кольца гетероциклоалкильной группы могут быть замещенными заместителем. Представительные гетероциклоалкильные группы включают пиперидинил, пиперазинил, тетрагидропиранил, морфолинил, тиоморфолинил, 1,3-диоксоланил, тетрагидрофуранил, тетрагидротиенил, тиенил и т.п. Термин "алкиламино" относится к аминозаместителю, который дополнительно замещен одной или двумя алкильными группами. Термин "аминоалкил" относится к алкильному заместителю, который дополнительно замещен одной или более аминогруппами. Термин "гидроксиалкил" или "гидроксилалкил" относится к алкильному заместителю, который дополнительно замещен одной или более гидроксильными группами. Алкильная или арильная часть групп алкиламино, аминоалкил, меркаптоалкил, гидроксиалкил, меркаптоалкокси, сульфонилалкил, сульфониларил, алкилкарбонил и алкилкарбонилалкил может быть необязательно замещенной одним или более заместителями. Кислоты и основания, полезные в способах, соответствующих настоящему изобретению, известны в уровне техники. Кислотные катализаторы являются любыми кислотными химическими веществами,которые могут быть неорганическими (например, соляная, серная, азотная кислоты, трихлорид алюминия) или органическими (например, камфорсульфокислота, п-толуолсульфоновая кислота, уксусная кислота, трифлат иттербия) по своей природе. Кислоты используются либо в каталитических, либо в стехиометрических количествах для ускорения химических реакций. Основания представляют собой любое основное химическое вещество, которое может быть неорганическим (например, бикарбонат натрия,гидроксид калия) или органическим (например, триэтиламин, пиридин) по природе. Основания используются либо в каталитических, либо в стехиометрических количествах для ускорения химических реакций. Алкилирующие агенты представляют собой любой реактив, который способен влиять на алкилирование рассматриваемой функциональной группы (например, атом кислорода спирта, атом азота аминогруппы). Алкилирующие агенты известны из уровня техники, включая приводимые здесь ссылки, и включают алкилгалогениды (например, метилиодид, бензилбромид или хлорид), алкилсульфаты (например, метилсульфат), или другие комбинации алкильная группа-замещаемая группа, известные из уровня техники. Замещаемые группы представляют собой любые стабильные группы, которые могут отсоединиться от молекулы в ходе реакции (например, в ходе реакции отщепления, реакции замещения) и известны из уровня техники, в том числе из приводимых здесь ссылок, и включают галогениды (например,I-, Cl-, Br-, F-), гидрокси, алкокси (например, -OMe, -O-t-Bu), ацилокси анионы (например, -OAc,-OC(O)CF3), сульфонаты (например, мезил, тозил), ацетамиды (например, -NHC(O)Me), карбаматы (например, N(Me)C(O)Ot-Bu), фосфонаты (например, -OP(O)(OEt)2), воду или спирты (протонная среда), и т.п. В некоторых вариантах осуществления изобретения заместители на любой группе (как, например,алкил, алкенил, алкинил, арил, аралкил, гетероарил, гетероаралкил, циклоалкил, гетероциклоалкил) могут быть на любом атоме этой группы, где любая группа, которая может быть замещенной (как, например, алкил, алкенил, алкинил, арил, аралкил, гетероарил, гетероаралкил, циклоалкил, гетероциклоалкил),может быть необязательно замещенной одним или более заместителями (которые могут быть одними и теми же или разными), при этом каждый замещает атом водорода. Примеры подходящих заместителей включают, но не ограничиваются только ими, алкил, алкенил, алкинил, циклоалкил, гетероциклоалкил,аралкил, гетероаралкил, арил, гетероарил, галоген, галоалкил, циано, нитро, алкокси, галоалкокси, арилокси, гидроксил, гидроксилалкил, оксо (т.е. карбонил), карбоксил, формил, алкилкарбонил, алкилкарбонилалкил, алкоксикарбонил, алкилкарбонилокси, арилоксикарбонил, гетероарилокси, гетероарилоксикарбонил, тио, меркапто, меркаптоалкил, арилсульфонил, амино, аминоалкил, диалкиламино, алкилкарбониламино, алкиламинокарбонил, алкоксикарбониламино, алкиламино, ариламино, диариламино, алкилкарбонил, или ариламино-замещенный арил; арилалкиламино, аралкиламинокарбонил, амидо, алкиламиносульфонил, ариламиносульфонил, диалкиламиносульфонил, алкилсульфониламино, арилсульфониламино, имино, карбамидо, карбамил, тиоуреидо, тиоцианато, сульфоамидо, сульфонилалкил, сульфониларил, меркаптоалкокси, N-гидроксиамидинил, или N'-арил, N-гидроксиамидинил, тиоалкокси, циклоалкокси, фторалкокси, содержащий 1-5 атомов фтора, карбоксамидо, необязательно замещенный арил или необязательно замещенный гетероарил. Соединения по изобретению могут быть получены путем известного из уровня техники органического синтеза. Способы оптимизации условий реакций, при необходимости минимизация конкурирующих побочных продуктов, известны в уровне техники. Для оптимизации реакции и увеличения масштаба предпочтительно могут использоваться оборудование для высокоскоростного параллельного синтеза и управляемые компьютером микрореакторы (например, Design and Optimization in Organic Synthesis, 2ndEdition, Carlson R., Ed, 2005; Elsevier Science Ltd.; Jhnisch, K. et al., Angew. Chem. Int. Ed. Engl. 2004, 43: 406; и ссылки в этой публикации). Дополнительные схемы реакций и условия могут быть определены специалистом в данной области техники с помощью коммерчески доступного программного обеспечения базы данных, ищущей по структуре, например SciFinder (подразделение CAS Американского химического общества) и CrossFire Beilstein (Elsevier MDL), или через поиск по ключевому слову, используя поисковую службу Интернет, такую как Google, или базы данных с ключевым словами, такую как US Patent and Trademark Office text database. Специалист поймет, что способы синтеза соединений приведенных здесь формул будут понятны специалистам в данной области техники, включая те, которые иллюстрируются здесь на схемах и в примерах. Кроме того, различные стадии синтеза могут осуществляться в другой последовательности, чтобы получить необходимые соединения. Кроме того, растворители, температуры, длительности реакций и т.п., описанные здесь, приведены только в иллюстративных целях, и специалист в данной области техники поймет, что варьирование условиями реакций может привести к получению желаемых соединений согласно настоящему изобретению. Описываемые здесь соединения также могут содержать связи (например, углерод-углеродные связи), где вращение вокруг связи ограничено вокруг этой конкретной связи, например ограничение, вызванное присутствием кольца или двойной связи. Соответственно, все цис/транс и E/Z изомеры явным образом включены в настоящее изобретение. Описываемые здесь соединения также могут быть представлены в множественных таутомерных формах, в таких случаях изобретение явным образом включает все таутомерные формы описанных здесь соединений, даже если только единственная таутомерная форма может быть представлена. Все такие изомерные формы таких описываемых здесь соединений явным образом включены в настоящее изобретение. Все кристаллические формы и полиморфы описываемых здесь соединений явным образом включены в настоящее изобретение. Также включены экстракты и фракции, содержащие соединения по изобретению. Термин "изомеры" предназначен включать диастереоизомеры, энантиомеры, региоизомеры, структурные изомеры, вращательные изомеры, таутомеры и т.п. Для соединений, которые содержат один или более стереогенный центр, например для хиральных соединений, способы по изобретению могут осуществляться с энантиомерно обогащенным соединением,рацематом или смесью диастереомеров. Предпочтительные энантиомерно обогащенные соединения имеют энантиомерный избыток, равный 50% или более, более предпочтительно соединение имеет энантиомерный избыток, равный 60, 70,80, 90, 95, 98 или 99% или больше. В предпочтительных вариантах осуществления изобретения только один энантиомер или диастереомер хирального соединения по изобретению вводится в клетки или субъекту. Способы лечения В одном аспекте изобретение обеспечивает способ модуляции активности металлоферментов клетки в субъекте, включающий контактирование субъекта с соединением формулы III, в таком количестве и в таких условиях, которые являются достаточными, чтобы модулировать активность металлоферментов. В одном варианте осуществления изобретения модуляция представляет собой ингибирование. В другом аспекте изобретение обеспечивает способ лечения субъекта, страдающего от или подверженного нарушению или заболеванию, которые опосредованы металлоферментами, включающий введение субъекту эффективного количества соединения или фармацевтической композиции соединения формулы III. В других аспектах изобретение обеспечивает способ лечения субъекта, страдающего от или подверженного нарушению или заболеванию, которые опосредованы металлоферментами, где субъект был признан нуждающимся в лечении от нарушения или заболевания, опосредованных металлоферментами,включающий введение указанному субъекту, нуждающемуся в этом, эффективного количества соединения или фармацевтической композиции соединения формулы III, так что указанный субъект лечится от указанного нарушения. В некоторых вариантах осуществления изобретение обеспечивает способ лечения заболевания, нарушения или их симптома, где нарушение представляет собой рак, сердечно-сосудистое заболевание,воспалительное заболевание или инфекционное заболевание. В других вариантах осуществления изобретения заболевание, нарушение или их симптом представляет собой нарушение обмена веществ, офтальмологическое заболевание, заболевание центральной нервной системы (ЦНС), урологическое заболевание илизаболевание желудочно-кишечного тракта. В некоторых вариантах осуществления изобретения,болезнь представляет собой рак простаты, рак груди, андроген-зависимые раки, эстроген-зависимые раки, воспалительное кишечное заболевание, псориаз, системную грибковую инфекцию, онихомикоз, гиперплазию надпочечников, гипертрофию простаты, вирилизм, гирсутизм, облысение по мужскому типу,истинное преждевременное половое созревание, эндометриоз, миому матки, рак матки, фиброиды матки,мастопатию, синдром поликистозных яичников, бесплодие, акне, функциональный яичниковый гиперандрогенизм, гиперандрогенизм с хронической ановуляцией, гиперандрогенемия, преждевременное половое созревание, избыток гормонов надпочечников или андрогенов. В некоторых вариантах осуществления изобретения субъектом является млекопитающее, предпочтительно примат или человек. В другом варианте осуществления изобретение обеспечивает описанный выше способ, в котором эффективное количество соединения формулы III является таким, как описано выше. В другом варианте осуществления изобретение обеспечивает описанный выше способ, в котором соединение формулы III вводится внутривенно, внутримышечно, подкожно, интрацеребровентрикулярно, перорально или наружно. В другом варианте осуществления изобретение обеспечивает описанный выше способ, в котором соединение формулы III проявляет селективность в отношении диапазона активности по отношению к ферменту-мишени и диапазона активности по отношению к нецелевому ферменту (например, CYP17CYP3A4; CYP17 IC501,0 мкМ и IC505,0 мкМ для CYP2C9, CYP2C19 и CYP3A4; CYP17 IC500,5 мкМ и IC501,0 мкМ для CYP2C9, CYP2C19 и CYP3A4; CYP17 IC500,96 мкМ и IC505,5 мкМ для CYP2C9,CYP2C19 и CYP3A4; CYP17 IC50XX мкМ и IC50YY мкМ для CYP2C9, CYP2C19 и CYP3A4, где XX представляет собой число меньше чем YY). В некоторых аспектах, например, XX является в 2 раза, 5 раз,10 раз, 50 раз, 100 раз или 1000 раз меньше чем YY. Используемый здесь термин "CYP17-ассоциированное заболевание" означает физиологическое или патологическое состояние, которое зависит от активности CYP17. Неограничивающие примеры CYP17 ассоциированных заболеваний включают рак простаты, рак груди, гиперплазию надпочечников, гипертрофию простаты, вирилизм, гирсутизм, облысение по мужскому типу, истинное преждевременное половое созревание, эндометриоз, миому матки, рак матки, мастопатию, синдром поликистозных яичников,бесплодие, акне, функциональный яичниковый гиперандрогенизм, гиперандрогенизм с хронической ановуляцией, гиперандрогенемию, преждевременное половое созревание, избыток гормонов надпочечников или андрогенов. Другим объектом настоящего изобретения является применение описанного здесь соединения в производстве лекарственного средства для применения в лечении нарушения или заболевания, опосредованных металлоферментами. Другим объектом настоящего изобретения является применение описанного здесь соединения для применения в лечении нарушения или заболевания, опосредованных металлоферментами. Фармацевтические композиции В одном аспекте изобретение обеспечивает фармацевтическую композицию, содержащую соединение формулы III и фармацевтически приемлемый носитель. В одном аспекте изобретение обеспечивает набор, содержащий эффективное количество соединения формулы III, в единичной лекарственной форме, совместно с инструкциями по введению соединения субъекту, страдающему от или подверженному заболеванию или нарушению, которые опосредованы металлоферментами, включая рак, солидную опухоль, заболевание сердечно-сосудистой системы, воспалительное заболевание, инфекционное заболевание. В других вариантах осуществления изобретения за- 10024197 болевание, нарушение или их симптом представляет собой нарушение обмена вещества, офтальмологическое заболевание, заболевание центральной нервной системы (ЦНС), урологическое заболевание или заболевание желудочно-кишечного тракта. Под термином "фармацевтически приемлемые соли" или "фармацевтически приемлемый носитель" подразумевается, что он включает соли активных соединений, которые получены с относительно нетоксичными кислотами или основаниями, в зависимости от конкретных заместителей, находящихся на описанных здесь соединениях. Когда соединения, соответствующие настоящему изобретению, содержат относительные кислотные функциональные группы, соли присоединения основания могут быть получены путем контактирования нейтральной формы таких соединений с достаточным количеством необходимого основания, либо в чистом виде, либо в подходящем инертном растворителе. Примеры фармацевтически приемлемых солей присоединения основания включают натриевую, калиевую, кальциевую, аммониевую, органическую аминную или магниевую соль, или подобную соль. Когда соединения, соответствующие настоящему изобретению, содержат относительно основные функциональные группы, соли присоединения кислоты могут быть получены путем контактирования нейтральной формы таких соединений с достаточным количеством необходимой кислоты, либо в чистом виде, либо в подходящем инертном растворителе. Примеры фармацевтически приемлемых солей присоединения кислоты включают соли, образованные из неорганических кислот, подобно соляной, бромисто-водородной, азотной,угольной, ортофосфорной, серной, йодисто-водородной или фосфористой кислот, а также гидрокарбонаты, гидрофосфаты, дигидрофосфаты или гидросульфаты и т.п., а также соли, образованные из относительно нетоксичных органических кислот, подобно уксусной, пропионовой, изомасляной, малеиновой,малоновой, бензойной, янтарной, пробковой, фумаровой, молочной, миндальной, фталевой, бензолсульфоновой, п-толилсульфоновой, лимонной, винной, метансульфоновой и т.п. Также включены соли аминокислот, такие как аргинат и т.п., и соли органических кислот, подобно глюкуроновой или галактуроновой кислот и т.п. (см., например, Berge et al., Journal of Pharmaceutical Science 66:1-19 (1977. Некоторые конкретные соединения по настоящему изобретению содержат как основные, так и кислотные функциональные группы, которые позволяют соединениям превращаться либо в соли присоединения основания,либо в соли присоединения кислоты. Для настоящего изобретения подходят другие фармацевтически приемлемые носители, известные специалистам в данной области техники. Нейтральные формы соединений могут быть восстановлены путем контактирования соли с основанием или кислотой и выделения исходной формы соединения общеизвестным образом. Исходная форма соединения отличается от различных солевых форм определенными физическими свойствами, такими как растворимость в полярных растворителях, а в остальном соли эквивалентны исходной форме соединения при применении в целях настоящего изобретения. Некоторые соединения, соответствующие настоящему изобретению, могут обеспечиваться в пролекарственной форме. Пролекарства соединений, описанных выше, представляют собой такие соединения,которые легко подвергаются химическим изменениям в физиологических условиях с получением соединений, соответствующих настоящему изобретению. Кроме того, пролекарства могут превращаться в соединения, соответствующие настоящему изобретению, с помощью химических или биохимических способов в среде ex vivo. Например, пролекарства могут медленно превращаться в соединения, соответствующие настоящему изобретению, при помещении в резервуар трансдермальной терапевтической системы с подходящим ферментом или химическим реагентом. Некоторые соединения, соответствующие настоящему изобретению, могут существовать в несольватированных формах, также как в сольватированных формах, включая гидратированные формы. В основном, сольватированные формы эквивалентны несольватированным формам, и подразумевается, что они входят в объем настоящего изобретения. Некоторые соединения, соответствующие настоящему изобретению, могут существовать в многообразных кристаллических или аморфных формах. В основном,все физические формы являются эквивалентными для применений, предусмотренных настоящим изобретением, и подразумевается, что они входят в объем настоящего изобретения. Изобретение также обеспечивает фармацевтическую композицию, содержащую эффективное количество соединения, описываемого в настоящем изобретении, и фармацевтически приемлемый носитель. В одном варианте осуществления изобретения, соединение вводится субъекту, используя фармацевтически приемлемый состав, например фармацевтически приемлемый состав, который обеспечивает замедленную доставку соединения субъекту в течение по меньшей мере 12, 24, 36, 48 ч, одной недели, двух недель, трех недель или четырех недель после введения фармацевтически приемлемого состава субъекту. Фактические дозы и режим введения активных компонентов фармацевтических композиций, соответствующих настоящему изобретению, могут варьироваться, с тем чтобы получить количество активного компонента, которое эффективно для достижения требуемого терапевтического ответа для конкретного пациента, композиции и режима введения, и при этом не является токсичным (или неприемлемо токсичным) для пациента. При применении по меньшей мере одно соединение, соответствующее настоящему изобретению,вводится в фармацевтически эффективном количестве субъекту, нуждающемуся в этом, в фармацевтическом носителе путем внутривенной, внутримышечной, подкожной или интрацеребровентрикулярной инъекции, либо путем перорального введения или наружного применения. В соответствии с настоящим изобретением, соединение, соответствующее изобретению, может вводиться одно или в сочетании со вторым, другим терапевтическим агентом. Под выражением "в сочетании с" подразумевается вместе, по существу, одновременно или последовательно. В одном варианте осуществления изобретения, соединение, соответствующее настоящему изобретению, вводится кратковременно. Соединение, соответствующее настоящему изобретению, может поэтому вводиться в течение короткого курса лечения, такого как от около 1 дня до около 1 недели. В другом варианте осуществления изобретения, соединение, соответствующее настоящему изобретению, может вводиться в течение более длительного периода времени,чтобы улучшить состояние хронических болезней, такого как, например, от около одной недели до нескольких месяцев, в зависимости от состояния, подвергаемого лечению. Под используемым здесь термином "фармацевтически эффективное количество" подразумевается количество соединения, соответствующего настоящему изобретению, которое является достаточно большим, чтобы значительно модифицировать в положительную сторону состояние, подвергаемое лечению, но при этом достаточное маленьким, чтобы избежать серьезных побочных эффектов (при разумном соотношении полезный эффект/риск), по результатам тщательной медицинской оценки. Фармацевтически эффективное количество соединения, соответствующего настоящему изобретению, будет варьироваться в зависимости от конкретной поставленной задачи, возраста и физического состояния пациента,подвергаемого лечению, тяжести первопричинного заболевания, длительности лечения, природы конкурентной терапии и конкретного используемого соединения. Например, терапевтически эффективное количество соединения, соответствующего настоящему изобретению, введенного ребенку или новорожденному, будет снижено пропорционально в соответствии с тщательной медицинской оценкой. Эффективное количество соединения по изобретению будет, таким образом, представлять собой минимальное количество, которое обеспечивает требуемый эффект. Несомненное практическое преимущество настоящего изобретения заключается в том, что соединение может вводиться любым удобным образом, таким как внутривенный, внутримышечный, подкожный, пероральный или интрацеребровентрикулярный пути введения или наружное применение, такое как в форме кремов или гелей. В зависимости от пути введения, может понадобиться, чтобы активные компоненты, которые содержат соединение по изобретению, были покрыты веществом, чтобы защитить соединение от действия ферментов, кислот и других природных условий, которые могут инактивировать соединение. Для того чтобы ввести соединение по изобретению путем введения отличным от парентерального, соединение может быть покрыто или введено с веществом для предотвращения инактивации. Соединение может быть введено парентерально или интраперитонеально. Дисперсии также могут быть приготовлены, например, в глицерине, жидких полиэтиленгликолях и их смесях, а также в маслах. Некоторые примеры веществ, которые могут служить в качестве фармацевтических носителей,представляют собой сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как натрий-карбоксиметилцеллюлоза, этилцеллюлоза и ацетаты целлюлозы; порошкообразный трагакант; солод; желатин; тальк; стеариновые кислоты; стеарат магния; сульфат кальция; растительные масла, такие как арахисовые масла, хлопчатниковое масло, кунжутное масло, оливковое масло, кукурузное масло и какао-масло; полиолы, такие как пропиленгликоль, глицерин, сорбитол, маннитол и полиэтиленгликоль; агар; альгиновые кислоты; апирогенную воду; изотонический раствор; и фосфатно-солевой буфер; сухое обезжиренное молоко; также как другие нетоксичные совместимые вещества, используемые в фармацевтических составах, такие как, например, Витамин С, эстроген и эхинацея. Также могут присутствовать смачивающие вещества и смазывающие вещества, такие как лаурилсульфат натрия, а также красители, ароматизаторы,наполнители, средства для таблетирования, стабилизаторы, антиоксиданты и консерванты. Солюбилизаторы, включая, например, кремофор и бета-циклодекстрины, также могут использоваться в описываемых здесь фармацевтических композициях. Фармацевтические композиции, содержащие активные соединения, соответствующие настоящему изобретению, могут быть изготовлены посредством процессов обычного смешивания, растворения, гранулирования, изготовления драже, отмучивания, эмульгирования, инкапсулирования, включения или лиофилизации. Композиции могут быть составлены обычным образом, используя один или более физиологически приемлемых носителей, разбавителей, наполнителей или вспомогательных средств, которые облегчают обработку активных соединений в препараты, которые могут применяться фармацевтически. Фармацевтические композиции, соответствующие настоящему изобретению, могут принимать форму, подходящую для практически любого режима введения, включая, например, наружный, окулярный, пероральный, буккальный, системный, назальный, инъекционный, трансдермальный, ректальный,вагинальный и т.п., или форму, подходящую для введения путем ингаляции или инсуффляции. Для наружного применения активное(ые) соединение(я) могут быть введены в растворы, гели, мази,кремы, суспензии и т.п. Составы для системного введения включают составы, разработанные для введения путем инъекции,например подкожной, внутривенной, внутримышечной, интратекальной или внутрибрюшинной инъекции, а также составы, разработанные для трансдермального, трансмукозального, перорального или ле- 12024197 гочного введения. Пригодные инъецируемые препараты включают стерильные суспензии, растворы или эмульсии активного соединения(й) в водных или масляных средах. Композиции также могут содержать рецептурные добавки, такие как суспендирующий, стабилизирующий и/или диспергирующий агент. Составы для инъекции могут быть представлены в единичной лекарственной форме (например, в ампулах или в многодозовых контейнерах) и могут содержать включенные консерванты. В альтернативном случае, инъецируемый состав может быть представлен в порошкообразной форме для разведения до применения подходящей средой, включая, но не ограничиваясь только ими, стерильную апирогенную воду, буфер, раствор декстрозы и т.п. С этой целью активное(ые) соединение(я) может быть высушено с помощью любой известной в уровне техники методики, такой как лиофилизация, и восстановлен до применения. Для трансмукозального введения, в составе используются пенетранты, соответствующие барьеру,который необходимо преодолеть. Такие пенетранты известны в уровне техники. Для перорального введения, фармацевтические композиции могут принимать форму, например, пастилок для рассасывания, таблеток или капсул, получаемых традиционным образом с фармацевтически приемлемыми вспомогательными веществами, такими как связывающие вещества (например, прежелатинизированный маисовый крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или гидроортофосфат кальция); смазывающие вещества (например, стеарат магния, тальк или диоксид кремния); разрыхлители (например,картофельный крахмал или крахмалгликолят натрия); или смачивающие вещества (например, лаурилсульфат натрия). Таблетки могут быть покрыты с помощью хорошо известных в уровне техники методов, например, сахарными или кишечнорастворимыми покрытиями. Жидкие препараты для перорального введения могут принимать форму, например, эликсиров, растворов, сиропов или суспензий, либо они могут быть представлены в форме сухого продукта для разведения водой или другой подходящей средой до применения. Такие жидкие препараты могут быть получены традиционным образом с фармацевтически приемлемыми добавками, такими как суспендирующие агенты (например, сорбитовый сироп, производные целлюлозы или гидрированные пищевые жиры); эмульгирующие агенты (например, лецитин или аравийская камедь); неводные среды (например, миндальное масло, сложноэфирные масла, этиловый спирт или фракционированные растительные масла); и консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). Препараты также могут содержать буферные соли, консерванты, ароматизаторы, красители и подсластители в случае необходимости. Препараты для перорального введения могут быть составлены подходящим образом, чтобы обеспечить контролируемое высвобождение активного соединения или пролекарства, как хорошо известно. Для буккального введения композиции могут принимать форму таблеток или пастилок для рассасывания, составленных традиционным образом. Для ректального и вагинального пути введения активное(ые) соединение(я) может быть введено в форму растворов (для удерживающих клизм), суппозиториев или мазей, содержащих традиционные основы для суппозиториев, такие как какао-масло или другие глицериды. Для назального введения или введения путем ингаляции или инсуффляции, активное(ые) соединение(я) может быть удачно доставлено в форме спрея-аэрозоля из находящихся под давлением упаковок или небулайзера с применением подходящего пропеллента, например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, фторуглеродов, диоксида углерода или другого подходящего газа. В случае аэрозоля под давлением, единицу дозирования можно задать путем установки клапана для доставки дозируемого количества. Капсулы и картриджи для применения в ингаляторе или инсуффляторе(например, капсулы и картриджи, состоящие из желатина) могут быть приготовлены с содержанием порошкообразной смеси соединения и подходящей порошкообразной основы, такой как лактоза или крахмал. Конкретный пример состава в форме водной суспензии, который подходит для назального введения с использованием коммерчески доступных устройств назальных спреев, включает следующие ингредиенты: активное соединение или пролекарство (0,5-20 мг/мл); бензалкония хлорид (0,1-0,2 мг/мл); полисорбат 80 (TWEEN 80; 0,5-5 мг/мл); карбоксиметилцеллюлозу натрия или микрокристаллическую целлюлозу (1-15 мг/мл); фенилэтанол (1-4 мг/мл); и декстрозу (20-50 мг/мл). Показатель рН готовой суспензии можно довести до диапазона от около рН 5 до рН 7, при этом типичным является показатель рН около рН 5,5. Для окулярного введения активное(ые) соединение(я) может быть введено в форму раствора,эмульсии, суспензии и т.п., пригодных для введения в глаз. В уровне техники известны разнообразные среды, подходящие для введения соединений в глаз. Конкретные неограничивающие примеры описаны в американских патентах US 6261547; US 6197934; US 6056950; US 5800807; US 5776445; US 5698219; US 5521222; US 5403841; US 5077033; US 4882150 и US 4738851, каждый из которых включен сюда путем ссылки во всей полноте. Для пролонгированной доставки активное(ые) соединение(я) может быть введено в форму депо- 13024197 препарата для введения путем имплантации или внутримышечной инъекции. Активный компонент может быть объединен с подходящим полимерными или гидрофобными веществами (например, в виде эмульсии в приемлемом масле) или ионообменными смолами, или может быть представлен в форме труднорастворимых производных, например в форме труднорастворимой соли. В альтернативном случае могут использоваться трансдермальные системы доставки, изготовленные в виде лейкопластыря или пластырной повязки, которая медленно высвобождает активное(ые) соединение(я) для впитывания через кожу. С этой целью могут применяться усилители проникновения для облегчения трансдермального проникновения активного(ых) соединения(й). Подходящие трансдермальные повязки описаны, например, в американских патентах US 5407713; US 5352456; US 5332213; US 5336168; US 5290561; US 5254346; US 5164189; US 5163899; US 5088977; US 5087240; US 5008110 и US 4921475, каждый из которых включен сюда путем ссылки во всей полноте. В альтернативном случае, другие фармацевтические системы доставки могут использоваться. Липосомы и эмульсии являются хорошо известными примерами носителей, которые могут использоваться для доставки активного(ых) соединения(й) или пролекарства (пролекарств). Некоторые органические растворители, такие как диметилсульфоксид (ДМСО), также могут применяться. Фармацевтические композиции, при желании, могут быть представлены в упаковке или устройстве с дозатором, которые могут содержать одну или более лекарственных форм с однократной дозировкой,содержащих активное(ые) соединение(я). Упаковка может, например, содержать металлическую или пластиковую фольгу, как, например, блистерная упаковка. Упаковка или устройство с дозатором могут сопровождаться инструкциями для введения. Активное(ые) соединение(я), соответствующие настоящему изобретению, или их композиции, в основном, будут применяться в количестве, эффективно для достижения намеченного результата, например в количестве, эффективном для лечения или предотвращения конкретной болезни, которая подвергается лечению. Соединение(я) может вводиться терапевтически для достижения терапевтической пользы или профилактически для достижения профилактической пользы. Под терапевтической пользой подразумевается уничтожение или улучшение первопричинного заболевания, подвергаемого лечению, и/или уничтожение или улучшение одного или более симптомов, ассоциированных с первопричинным заболеванием, так что пациент свидетельствует об улучшении самочувствия или состояния, несмотря на то, что пациент все еще может быть болен обсуждаемым заболеванием. Например, введение соединения пациенту, страдающему от аллергии, обеспечивает терапевтическую пользу не только когда первопричинный аллергический ответ уничтожен или улучшен, но также когда пациент свидетельствует о снижении тяжести или длительности симптомов, ассоциированных с аллергией в результате воздействия аллергена. В качестве другого примера, терапевтическая польза в контексте астмы включает улучшение дыхания после возникновения астматического приступа, или снижение частоты или тяжести астматических приступов. Терапевтическая польза также включает остановку или замедления прогрессирования заболевания, вне зависимости от того, наступило ли улучшение. Для профилактического введения соединение может вводиться пациенту при риске развития одной из ранее описанных болезней. Пациентом, у которого есть риск развития болезни, может быть пациент,имеющий показатели, относящие пациента в специальную выделенную группу риска, что определяется соответствующим медицинским работником или группой работников. Пациентом, у которого есть риск развития болезни, также может быть пациент, который обычно или повседневно находится в условиях, в которых может произойти развитие первопричинного заболевания, которое может лечиться путем введения ингибитора металлоферментов в соответствии с настоящим изобретением. Другими словами, пациент с риском развития заболевания - это пациент, который обычно или повседневно подвергается условиям, вызывающим заболевание или нарушение, или может быть однократно подвержен в течение ограниченного периода времени. В альтернативном случае, можно осуществить профилактическое введение,чтобы избежать возникновения симптомов у пациента с установленным диагнозом наличия первопричинного заболевания. Количество введенного соединения будет зависеть от множества факторов, включая, например,конкретное показание для лечения, режим введения, независимо от того является ли желаемая польза профилактической или терапевтической, тяжесть показания для лечения, а также возраст и вес пациента,биодоступность конкретного активного соединения и т.п. Определение эффективной дозы находится в компетенции специалиста в данной области техники. Эффективные дозы можно первично оценить из анализов in vitro. Например, начальная доза для применения на животных может быть установлена такой, чтобы достигнуть концентрации активного соединения в циркулирующей крови или сыворотке, которая равна или выше IC50 конкретного соединения, что измеряется в анализе in vitro, таком как анализ in vitro на культивируемых человеческих мезангиальных клетках (CHMC) или мышиных тучных клетках костного мозга (ВММС) и других анализах invitro, описанных в разделе Примеры. Вычисление доз для достижения таких концентраций в циркулирующей крови или сыворотке, учитывая биодоступность конкретного соединения, находится в компетенции специалистов в области техники. Для получения обзорной информации смотри публикацию авторов FinglWoodbury, "General Principles," в Goodman and Gilman's The Pharmaceutical Basis ofChapter 1, pp. 1-46, latest edition, Pagamonon Press, и приведенные в ней ссылки, которые включены сюда путем ссылки. Начальные дозы можно оценить из данных, полученных in vivo, как, например, на животных моделях. Животные модели, пригодные для исследования эффективности соединений для лечения или предотвращения различных заболеваний, хорошо известны в уровне техники. Размеры дозы обычно будут в диапазоне от около 0,0001 или 0,001 или 0,01 мг/кг/день до около 100 мг/кг/день, но могут быть выше или ниже, в зависимости от, среди прочих факторов, активности соединения, его биодоступности, режима введения и различных факторов, которые обсуждались выше. Размер дозы и интервал введения могут быть подобраны индивидуально для создания уровней содержания соединения(й) в плазме, которые являются достаточными для поддержания терапевтического или профилактического эффекта. В случаях местного введения или селективного поглощения, как, например, местное наружное применение, эффективная местная концентрация активного(ых) соединения(й) может не быть связана с концентрацией в плазме. Специалисты в области техники смогут оптимизировать эффективные дозы для местного введения без необходимости проведения неоправданного экспериментирования. Соединение(я) может вводиться один раз в сути, немного или несколько раз в день, или даже много раз в день, в зависимости от, среди прочих факторов, показания для лечения и мнения лечащего врача. Предпочтительно соединение(я) будет обеспечивать терапевтическую или профилактическую пользу, не вызывая значительного токсического воздействия. Токсичность соединения(й) может быть определена, используя стандартные фармацевтические приемы. Соотношение доз, обеспечивающих токсический и терапевтический (или профилактический) эффект, представляет собой терапевтический индекс. Соединение(я), которые имеют высокие терапевтические индексы, являются предпочтительными. Описание перечня химических групп, когда дается любое определение переменной в настоящей заявке, включает значения этой переменной, представляющие собой любую одну группу или комбинацию перечисленных групп. Описание варианта выполнения переменной, даваемое в настоящей заявке, включает этот вариант выполнения как любой один вариант выполнения или в комбинации с любыми другими вариантами выполнения или их фрагментами. Описание варианта осуществления, даваемое в настоящей заявке, включает этот вариант осуществления как любой один вариант осуществления или в комбинации с любыми другими вариантами осуществления или их фрагментами. Примеры Настоящее изобретение далее будет продемонстрировано на конкретных примерах, которые не должны рассматриваться как ограничивающие. Основные экспериментальные методики Значения переменных в структурах на приведенных здесь схемах соответствуют переменным в соответствующих положениях формул, которые описаны в настоящем изобретении. Синтез 4-(1,2,3-триазолов) Синтез 4-замещенных 1,2,3-триазольных мишеней (III) можно осуществить, используя представленный для примера синтез, который описывается ниже (например, схема А, схема 1). Широкий ряд R4 иR5-замещенных нафталенов может быть получен, начиная с функционализированных гало- и алкоксинафталеновых исходных веществ (например, вещество А). Вещество А можно получить путем ацилирования по Фриделю-Крафтсу 2,3-диметоксинафталена с изобутирил хлоридом/алюминий трихлоридом. Добавление литированного 1-N-(2-(триметилсилилэтоксиметил-1,2,3,-триазола к кетону А дает промежуточное соединение в виде третичного спирта, с которого можно снять защитную группу с помощью источника фторид-ионов (например, фторид цезия) с получением 1. Для получения соединений III, в которых R4 или R5 представляют собой арил или гетероарил, эти группы могут быть добавлены к промежуточным соединениям в виде Br-нафталенов (R4 или R5 = Br) по методике кросс-сочетания Сузуки [арилВ(ОН)2 или гетероарил-В(ОН)2, катализатор: ацетат палладия (II)]. В некоторых вариантах осуществления изобретение обеспечивает промежуточные соединения формул, приведенных в настоящей заявке, и способы превращения таких соединений в соединения формул, приведенных в настоящей заявке (например, в схеме А, А 1-А 2; А 2-А 3; А 1-А 3), которые включают вступление в реакцию соединения, соответствующего настоящему изобретению, с одним или более реагентами в одной или более реакциях химического преобразования (включая те, которые описываются здесь), обеспечивая тем самым соединения любой из приведенных здесь формул или их промежуточное соединение. Методы синтеза, описанные здесь, также могут дополнительно включать стадии, либо до, либо после любой из стадий, описанной на любой схеме, для добавления или удаления подходящих защитных групп, чтобы позволить синтезу соединения формул, приведенных в настоящей заявке, пройти окончательно. Способы, описываемые здесь, предполагают превращение соединений одной формулы в соединения другой формулы (например, в схеме А, А 1-А 2; А 2-А 3; А 1-А 3). Процесс превращения относится к одному или более химическим преобразованиям, которые могут осуществляться in situ, или с выделением промежуточных соединений. Преобразования могут включать реагирование исходных соединений или промежуточных соединений с дополнительными реагентами, используя методики и условия, известные в уровне техники, которые включают те, которые описываются в приведенных здесь ссылках. Промежуточные соединения могут использоваться с или без очистки (например, путем фильтрации, дистилляции, сублимации, кристаллизации, измельчения, твердофазной экстракции и хроматографии). Схема А(7 мл) добавили при -78 С, и давали реакционной смеси согреться до комнатной температуры и перемешивали в течение 16 ч. Реакцию в реакционной смеси останавливали добавлением раствора NH4Cl и смесь подвергали экстракции этилацетатом (225 мл). Объединенные органические фазы промывали рассолом, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, получая В (0,25 г) в виде сиропа. Сырой продукт был взят на следующую стадию без дополнительной очистки. Получение N-2-(триметилсилил)этоксиметил-1,2,3-триазола К перемешанному раствору 1,2,3-триазола (2,0 г, 28,9 ммоль) в THF (10 мл) добавили порциямиNaH (1,065 г, 43,1 ммоль) при 0 С в инертной атмосфере. После перемешивания в течение 45 мин при 0 С 2-(триметилсилил)этоксиметил-Cl (SEM-CI; 7,6 мл, 43,1 ммоль) добавили в реакционную смесь. После окончания добавления, реакционной смеси давали согреться до комнатной температуры и перемешивали в течение 12 ч. Реакцию в реакционной смеси останавливали добавлением воды и смесь подвергали экстракции этилацетатом (2100 мл). Объединенные органические экстракты промывали рассолом, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, получая неочищенное соединение. Сырой продукт очищали посредством колоночной хроматографии с элюированием 10%-й смесью EtOAc/гексан, получая N-2-(триметилсилил)этоксиметил-1,2,3-триазол (3,5 г, 17,5 ммоль, 61%) в виде жидкости. Масс-спектр: m/z 200 [М 1]. К перемешанному раствору соединения В (0,15 г, 0,32 ммоль) в THF (30 мл) добавили тетра-нбутиламмония фторид (TBAF) (1,5 мл, 1 М в THF) и реакционную смесь нагревали с обратным холодильником в течение 3 ч. Реакционную смесь концентрировали in vacuo; полученный осадок подвергали распределительной экстракции в системе вода-дихлорметан. Органическая фаза была отделена и водный слой был подвергнут экстракции дихлорметаном (225 мл); объединенные органические фазы промывали рассолом, сушили на безводным Na2SO4 и концентрировали при пониженном давлении, получая сырой продукт. Сырой продукт очищали с помощью колоночной хроматографии (SiO2, 100-200 меш), получая соединение 1 (25 мг, 0,07 ммоль, 25%) в виде белого твердого вещества. 1 Н ЯМР (500 МГц,CDCl3):11,4 (шс, 1 Н), 7,88 (с, 1 Н), 7,72 (с, 1 Н), 7,65 (д, J= 8,5 Гц, 1 Н), 7,49 (д, J= 8,0 Гц, 1 Н), 7,12 (с,1 Н), 7,09 (с, 1 Н), 3,98 (с, 6 Н), 2,81 (м, 1 Н), 0,96 (д, J = 6,5 Гц, 3 Н), 0,83 (д, J = 6,5 Гц, 3 Н). ВЭЖХ: 98,6%. Масс-спектр (ИЭР): m/z 326, 398 [М+Н]+. Пример 2 1-(6,7-Диметоксиизохинолин-3-ил)-2-метил-1-(1H-1,2,3-триазол-4-ил)пропан-1-ол (2) Раствор соединения С (1,0 г, 4,2 ммоль в насыщенном метанольном растворе хлороводорода (120 мл) перемешивали с обратным холодильником в течение 50 ч. После расходования исходного вещества(отслеживали путем ТСХ) летучие вещества выпаривали при пониженном давлении. Полученный осадок растворили в ледяной воде и создавали основную среду с рН 10, используя насыщенный водный раствор K2CO3, и затем подвергали экстракции хлороформом CHCl3 (650 мл). Объединенные органические слои промывали рассолом, сушили на безводным Na2SO4, и концентрировали при пониженном давлении,получая сложный эфир D (0,85 г, 3,38 ммоль, 85%) в виде белого твердого вещества. 1 Н ЯМР (500 МГц,CDCl3):6,59 (с, 1 Н), 6,52 (с, 1 Н), 4,06-3,98 (м, 2 Н), 3,83 (с, 6 Н), 3,78 (с, 3 Н), 3,73-3,71 (м, 1 Н), 2,99 (дд,J= 4,5, 16 Гц, 1 Н), 2,89 (дд, J = 8,5, 16 Гц, 1 Н). Масс-спектр: m/z 252 [М 1]. К перемешанному раствору сложного эфира D (0,65 г, 2,58 ммоль) в нитробензоле (30 мл) добавилиS8 (0,20 г, 6,47 ммоль) при комнатной температуре в инертной атмосфере. Реакционную смесь перемешивали при 140 С в течение 14 ч. После расходования исходного вещества, нитробензол выпаривали при пониженном давлении. Полученный осадок растворили в холодном 1N растворе HCl и промывали дважды толуолом. В водном слое создавали основную среду с рН 10, используя насыщенный растворK2CO3, и подвергали экстракции этилацетатом (350 мл). Объединенные органические слои промывали рассолом, сушили над безводным Na2SO4, и концентрировали при пониженном давлении, получая соединение Е (0,43 г, 1,74 ммоль, 67,2%) в виде твердого вещества грязновато-белого цвета. 1 Н ЯМР (500 МГц, CDCl3):9,12 (с, 1 Н), 8,47 (с, 1 Н), 7,29 (с, 1 Н), 7,20 (с, 1 Н), 4,07-4,03 (м, 9 Н). Масс-спектр: m/z 248[М 1]. К перемешанному раствору соединения Е (0,20 г, 0,809 ммоль) в МеОН (5 мл) добавили растворNaOH (0,097 г, 2,42 ммоль) в Н 2 О (1 мл) при 0 С. Реакционной смеси давали согреться до комнатной температуры и перемешивали в течение 12 ч. Летучие вещества удаляли при пониженном давлении. Полученный осадок растворяли в воде, подкисляли 1N раствором HCl и перемешивали в течение 15 мин при 0 С. Осадок отфильтровывали и сушили в вакууме, получая кислоту F (0,13 г, 0,55 ммоль, 69%) в виде белого твердого вещества. 1 Н ЯМР (500 МГц, DMSO-d6):9,10 (с, 1 Н), 8,41 (с, 1 Н), 7,59 (с, 1 Н),7,55 (с, 1 Н), 3,94 (с, 6 Н). К перемешанному раствору кислоты F (2,0 г, 8,58 ммоль) в ДМФА (10 мл) добавили 1-этил-3-(3 диметиламинопропил)карбодиимид (EDCl) (2,46 г, 12,8 ммоль), 1-гидроксибензотриазол (НОВТ) (1,15 г,8,58 ммоль), N-метилморфолин (NMM) (3,7 мл, 34,3 ммоль) и N,О-диметилгидроксиламин гидрохлорид(1,25 г, 12,8 ммоль) при 0 С в инертной атмосфере. После окончания добавления, реакционной смеси давали согреться до комнатной температуры и перемешивали в течение 5 ч. Реакцию в реакционной смеси останавливали добавлением ледяной воды и подвергали реакционную смесь экстракции этилацетатом(2100 мл). Объединенные органические экстракты промывали рассолом, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, получая сырой продукт. Сырой продукт очищали посредством колоночной хроматографии, элюируя смесью EtOAc/гексан, с получением амида Вайнреба G (1,6 г, 5,79 ммоль, 70%) в виде сиропа. 1H ЯМР (500 МГц, CDCl3):9,02 (с, 1 Н), 8,02 (с, 1 Н), 7,24 (с, 1 Н), 7,14(с, 1 Н), 4,05 (с, 6 Н), 3,81 (с, 3 Н), 3,47 (с, 3 Н). Масс-спектр: m/z 277 [М 1]. К перемешанному раствору соединения Н (0,43 г, 2,17 ммоль) в эфире (10 мл) добавили третбутиллитий (t-BuLi) (2,13 мл, 3,6 ммоль) по каплям при -70 С в инертной атмосфере. После перемешивания в течение 1 ч при -70 С амид Вайнреба G (0,20 г, 0,72 ммоль) в THF (5 мл) был добавлен в реакционную смесь. После перемешивания в течение дополнительных 30 мин при -70 С реакцию в реакционной смеси останавливали водой и подвергали экстракции этилацетатом (350 мл). Объединенные органические фазы промывали рассолом, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, получая сырой продукт. Сырой продукт очищали посредством колоночной хроматографии,получая кетон I (0,11 г, 0,27 ммоль, 38,3%) в виде сиропа. 1 Н ЯМР (500 МГц, CDCl3):9,18 (с, 1 Н), 9,12(с, 1 Н), 8,57 (с, 1 Н), 7,83-7,78 (м, 1 Н), 7,37 (с, 1 Н), 5,77 (с, 2 Н), 4,15 (с, 3 Н), 4,14 (с, 3 Н), 3,74-3,66 (м, 2 Н),1,00-0,94 (м, 2 Н), 0,0-0,00 (м, 9 Н). Масс-спектр: m/z 415 [М 1]. К перемешанному раствору кетона I (0,12 г, 0,28 ммоль) в THF (3 мл) добавили изопропилмагний хлорид (0,72 мл, 1,44 ммоль) по каплям при 0 С в инертной атмосфере. После перемешивания в течение 1 ч при комнатной температуре, реакцию в реакционной смеси останавливали добавлением воды и подвергали экстракции этилацетатом (350 мл). Объединенные органические экстракты промывали рассолом, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, получая спирт J (55 мг, 0,12 ммоль, 74%) в виде сиропа. 1H ЯМР анализ сырого продукта показал все требуемые пики наряду с некоторыми примесями. Сырой продукт был взят напрямую на следующую стадию без дополнительной очистки. Масс-спектр: m/z 459 [M1]. К перемешанному раствору спирта J (0,24 г, 0,52 ммоль) в THF (5 мл) добавили тетра-н-бутиламмония фторид (TBAF) (0,05 мл, 0,052 ммоль, 1 М в THF) и CsF (0,15 г, 1,04 ммоль) при комнатной температуре в инертной атмосфере. Реакционную смесь перемешивали при температуре флегмы в течение 12 ч. Летучие вещества выпаривали при пониженном давлении с получением сырого соединения. Сырой продукт очищали посредством колоночной хроматография с элюированием 30%-й смесью EtOAc/гексан,получая соединение 2 (90 мг, 0,27 ммоль, 52%) в виде белого твердого вещества. 1 Н ЯМР (500 МГц,CDCl3):8,87 (с, 1 Н), 7,88-7,81 (м, 2 Н), 7,18 (с, 1 Н), 7,09 (с, 1 Н), 4,01 (с, 6 Н), 2,74-2,66 (м, 1 Н), 0,97 (д, J = 6,6 Гц, 3 Н), 0,71 (д, J = 6,6 Гц, 3 Н). ВЭЖХ: 93,55%. Масс-спектр: m/z 329 [М 1].(+)-Энантиомер соединения (2) Показатели ВЭЖХ для получения хирального соединения: Колонка: Chiralpak IC, 2504,6 мМ, 5-micron Подвижная фаза: А) н-Гексан, В) Изопропанол Изократическое элюирование: А:В (95:5) Скорость потока 1,00 мл/мин ВЭЖХ: 99,2% (11 мг, выделенные в виде белого порошка). Оптическое вращение []D: + 7,6 (с = 0,5 % в МеОН).(-)-Энантиомер соединения (2) Показатели ВЭЖХ для получения хирального соединения: Колонка: Chiralpak IC, 2504,6 мМ, 5-micron Подвижная фаза: А) н-Гексан, В) Изопропанол Изократическое элюирование: А:В (95:5) Скорость потока 1,00 мл/мин ВЭЖХ: 99,8% (12 мг, выделенные в виде белого порошка). Оптическое вращение []D: - 5,8 (с = 0,5 % в МеОН). Схема 3 Пример 3 1-(6,7-бис-(Дифторметокси)нафтален-2-ил)-2-метил-1-(1H-1,2,3-триазол-4-ил)пропан-1-ол (3) К перемешанному раствору соединения А (18 г, 69 ммоль) в дихлорметане (180 мл) добавили BBr3(87,2 г, 348 ммоль) по каплям при -40 С. После окончания добавления продолжали перемешивание в течение 1 ч при -40 С и 1 ч при комнатной температуре. Реакционную смесь выливали в холодную воду и водный слой затем подвергали экстракции дихлорметаном (2 200 мл). Объединенные органические экстракты промывали водой (100 мл), рассолом (100 мл) и сушили над безводным Na2SO4. После фильтрования и выпаривания растворителя при пониженном давлении сырой продукт очищали посредством колоночной хроматографии (SiO2, 100-200 меш), получая соединение K (9,0 г, 39 ммоль, 56%) в виде бурого твердого вещества. 1 Н ЯМР (200 МГц, CDCl3):8,29 (с, 1 Н), 7,88 (дд, J = 8,8, 1,6 Гц, 1 Н), 7,68 (д, J = 8,6 Гц, 1 Н), 7,36 (с, 1 Н), 7,26 (с, 1 Н), 5,88 (шс, 2 Н), 3,79-3,63 (м, 1 Н), 1,27 (д, J=6,8 Гц, 6 Н). К перемешанному раствору соединения K (5,0 г, 21,7 ммоль) в диметилформамиде (50 мл) добавили этилбромдифторацетат (17,6 г, 86,6 ммоль) и K2CO3 (18 г, 130 ммоль) и смесь перемешивали при 110 С в течение 48 ч. Реакционную смесь выливали в холодную воду и водный слой затем подвергали экстракции дихлорметаном (2100 мл). Объединенные органические экстракты промывали водой (50 мл), рассолом (50 мл) и сушили над безводным Na2SO4. После фильтрования и выпаривания растворителя при пониженном давлении сырой продукт очищали посредством колоночной хроматографии (SiO2, 100-200 меш), получая соединение L (2,3 г, 4,3 ммоль, 32%) в виде твердого вещества. 1 Н ЯМР (500 МГц, CDCl3):8,40 (с, 1 Н), 8,05 (дд, J = 8,5, 1,5 Гц, 1 Н), 7,86 (д, J = 9,0 Гц, 1 Н), 7,79 (с, 1 Н), 7,68 (с, 1 Н), 6,67 (t, JF,H = 73 Гц, 1 Н), 6,65 (t, JF,H = 73 Гц, 1 Н), 3,72-3,65 (м, 1 Н), 1,27 (д, J= 7,0 Гц, 6 Н). К перемешанному раствору N-SEM-1,2,3-триазола (2,25 г, 11,8 ммоль) в сухом эфире (25 мл) добавили t-BuLi (0,69 г, 10,7 ммоль) по каплям при -78 С в инертной атмосфере. После перемешивания в течение 1 ч при -78 С соединение L (1,5 г, 2,83 ммоль) в сухом эфире (25 мл) добавили в реакционную смесь и перемешивание продолжали в течение одного дополнительного часа при -78 С. Реакцию в реакционной смеси останавливали добавлением насыщенного раствора NH4Cl и подвергали реакционную смесь экстракции этилацетатом (250 мл). Объединенные органические фазы промывали рассолом, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, получая соединение М (2,0 г) в виде густого сиропа. Сырой продукт брали на следующую стадию без дополнительной очистки. К перемешанному раствору соединения М (3,0 г, 5,6 ммоль) в THF (30 мл) добавили TBAF (1,48 г,5,67 ммоль, 1 М в THF) и CsF (2,58 г, 16,8 ммоль) при комнатной температуре в инертной атмосфере. Реакционную смесь перемешивали при 80 С в течение 4 ч. Смесь концентрировали in vacuo; полученный осадок подвергали распределительной экстракции в системе вода-дихлорметан. Органическую фазу отделяли и водный слой подвергали экстракции дихлорметаном (225 мл); объединенные органические фазы промывали рассолом, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, получая сырой продукт. Сырой продукт очищали посредством колоночной хроматографии (SiO2,100-200 меш), получая соединение 3 (2,2 г, 5,5 ммоль, 61%) в виде белого твердого вещества. 1 Н ЯМР(+)-Энантиомер соединения (3) Показатели ВЭЖХ для получения хирального соединения: Колонка: Chiralpak IC, 2504,6 мМ, 5-micron Подвижная фаза: А) н-Гексан, В) Изопропанол Изократическое элюирование: А:В (95:5) Скорость потока 1,00 мл/мин ВЭЖХ: 98,1% (15 мг, выделенные в виде белого порошка). Оптическое вращение []D: + 41,5 (с = 0,5 % в МеОН).(-)-Энантиомер соединения (3) Показатели ВЭЖХ для получения хирального соединения: Колонка: Chiralpak IC, 2504,6 мМ, 5-micron Подвижная фаза: А) н-Гексан, В) Изопропанол Изократическое элюирование: А:В (95:5) Скорость потока 1,00 мл/мин ВЭЖХ: 99,5% (13 мг, выделенные в виде белого порошка). Оптическое вращение []D: - 54 (с = 0,5% в МеОН). Схема 4 Пример 4 2-Метил-1-(6-(оксазол-5-ил)нафтален-2-ил)-1-(1H-1,2,3-триазол-4-ил)пропан-1-ол (4) К перемешанному раствору 6-гидрокси-2-нафтонитрила N (3,0 г, 17,7 ммоль) в ДХМ (90 мл) добавили триэтиламин (2,68 г, 26,5 ммоль) и трифторметансульфоновый ангидрид (7,5 г, 26,5 ммоль) при 0 С и перемешивание продолжалось в течение одного дополнительного часа при 0 С. Реакционную смесь подвергали распределительной экстракции в системе вода-дихлорметан; органическую фазу отделяли,сушили над безводным Na2SO4 и концентрировали при пониженном давлении, получая сырой продукт. Сырой продукт очищали посредством колоночной хроматографии (SiO2, 100-200 меш) с элюированием 3%-й смесью EtOAc/гексан, получая спирт О (4,2 г, 13,9 ммоль, 78%) в виде твердого вещества. 1 Н ЯМР(200 МГц, CDCl3):8,30 (с, 1 Н), 8,00 (видимый т, 2 Н), 7,83 (д, J = 2,6 Гц, 1 Н), 7,74 (дд, J = 8,8, 1,8 Гц,1 Н), 7,51 (дд, J = 8,8, 2,2 Гц, 1 Н). Получение 5-(трибутилстаннил)-2-(триизопропилсилил)оксазола (Р) К перемешанному раствору оксазола (3,0 г, 43,4 ммоль) в диэтиловом эфире (90 мл) добавили nBuLi (28 мл, 47,8 ммоль, 1,6 М в гексане) по каплям при -78 С в инертной атмосфере. После перемешивания в течение дополнительных 45 мин при - 78 С триизопропил трифторметан сульфонат (11,1 мл, 43,4 ммоль) добавили медленно в реакционную смесь при - 78 С. После окончания добавления, реакционной смеси давали медленно согреться до комнатной температуры и перемешивали в течение 12 ч. Реакцию в реакционной смеси останавливали добавлением н-гексана и выпаривали при пониженном давлении летучие вещества. Полученный сырой продукт очищали посредством колоночной хроматографии, получая 2-триизопропилсилил-оксазол (8,0 г, 35,5 ммоль, 81%) в виде сиропа. 1 Н ЯМР (500 МГц, CDCl3):7,81(50 мл) добавили tert-BuLi (10,4 мл, 17,0 ммоль, 1,6 М в гексане) по каплям при -78 С в инертной атмосфере. После перемешивания в течение одного дополнительного часа при -78 С, три-н-бутилстаннил хлорид (5,7 г, 17,0 ммоль) медленно добавили в реакционную смесь при -78 С. После окончания добавления реакционной смеси давали медленно согреться до комнатной температуры и перемешивали в течение 1 ч. Реакцию в реакционной смеси останавливали добавлением воды и подвергали экстракции посредством EtOAc. Органическую фазу промывали рассолом, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, получая соединение Р (5,0 г, 9,7 ммоль, 87%) в виде сиропа. Массспектр (ИЭР): m/z 516 [M+H]+. Соединение О (2,5 г, 8,27 ммоль) растворяли в 1,4-диоксане (100 мл) и смесь продували аргоном в течение 20 мин. Pd(PPh3)4 (0,152 г, 0,20 ммоль) добавили и следом соединение Р (6,3 г, 12,4 ммоль) в 1,4 диоксане (20 мл) в инертной атмосфере. Реакционную смесь перемешивали в течение 2 ч при 120 С. Реакционную смесь подвергали выпариванию in vacuo и полученный сырой продукт очищали посредством колоночной хроматографии (SiO2, 100-200 меш), получая соединение Q (1,5 г, 3,9 ммоль, 48%) в виде твердого вещества. 1 Н ЯМР (200 МГц, CDCl3):8,22 (с, 1 Н), 8,14 (с, 1 Н), 7,99-7,87 (м, 3 Н), 7,67-7,61 (м,2 Н), 1,58-1,42 (м, 3 Н), 1,25-1,19 (м, 18 Н). Масс-спектр (ИЭР): m/z 377 [М+Н]+. К перемешанному раствору соединения Q (1,5 г, 3,98 ммоль) в безводном диэтиловом эфире (60 мл) добавили изо-пропиллитий (i-PrLi) (14,1 мл, 9,9 ммоль, 0,7 М в диэтиловом эфире) по каплям при -78 С в инертной атмосфере и смесь перемешивали в течение одного дополнительного часа при -78 С. Реакцию в реакционной смеси останавливали добавлением насыщенного раствора NH4Cl и перемешивали в течение 1 ч. Органическую фазу отделяли и водную фазу подвергали экстракции диэтиловым эфиром. Объединенные органические фазы промывали рассолом, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, получая неочищенное соединение. Сырой продукт очищали посредством колоночной хроматографии с получением соединения R (1,1 г, 2,6 ммоль, 65%) в виде твердого вещества. 1 Н ЯМР (200 МГц, CDCl3):8,45 (с, 1 Н), 8,14 (с, 1 Н), 8,09-7,93 (м, 3 Н), 7,80 (дд, J= 8,4, 1,6 Гц, 1 Н),7,59 (с, 1 Н), 3,80-3,69 (м, 1 Н), 1,54-1,39 (м, 3 Н), 1,31-1,20 (м, 24 Н). Масс-спектр (ИЭР): m/z 421,9 [М+Н]+. К перемешанному раствору соединения R (1,1 г, 2,61 ммоль) в THF (21 мл) добавили 2 N HCl (11 мл) при 0 С и реакционную смесь перемешивали в течении 30 мин при комнатной температуре. Основность реакционной смеси повышали насыщенным раствором NaHCO3 и подвергали реакционную смесь экстракции посредством EtOAc (250 мл). Объединенные органические слои промывали водой и рассолом, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, получая неочищенное соединение. Сырой продукт очищали посредством колоночной хроматографии (SiO2, 100-200 меш) с элюированием 20%-й смесью EtOAc/гексан, получая соединение S (0,6 г, 2,26 ммоль, 87%) в виде белого твердого вещества. 1 Н ЯМР (200 МГц, CDCl3):8,46 (с, 1 Н), 8,17 (с, 1 Н), 8,10-7,92 (м, 4 Н), 7,80 (дд, J= 8,6, 1,8 Гц, 1 Н), 7,54 (с, 1 Н), 3,79-3,66 (м, 1 Н), 1,30 (д, J = 6,8 Гц, 6 Н). Масс-спектр (ИЭР): m/z 266[М+Н]+. К перемешанному раствору N-1-SEM-1,2,3-триазола (Н, 0,45 г, 2,26 ммоль) в сухом эфире (6 мл) добавили t-BuLi (1,3 мл, 2,26 ммоль) по каплям при -78 С в инертной атмосфере. После перемешивания в течение 1 ч при -78 С, соединение S (0,17 г, 0,63 ммоль) в THF (5 мл) добавили в реакционную смесь и перемешивание продолжалось в течение дополнительных 2 ч при комнатной температуре. Реакцию в реакционной смеси останавливали добавлением насыщенного раствора NH4Cl и подвергали экстракции этилацетатом (250 мл). Объединенные органические фазы промывали рассолом, сушили над безводнымNa2SO4 и концентрировали при пониженном давлении, получая соединение Т (0,26 г) в виде сиропа. Сырой продукт брали на следующую стадию без дополнительной очистки. К перемешанному раствору соединения Т (0,2 г, 0,43 ммоль) в THF (4 мл) добавили TBAF (0,21 мл,1 М в THF) и CsF (0,09 г, 1,29 ммоль) при комнатной температуре в инертной атмосфере. Реакционную смесь перемешивали при 80 С в течение 4 ч. Реакционную смесь концентрировали in vacuo; полученный осадок растворили в воде. Водный слой подвергали экстракции посредством EtOAc (250 мл); объединенные органические фазы промывали рассолом, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, получая сырой продукт. Сырой продукт очищали посредством колоночной хроматографии (SiO2, 100-200 меш) с элюированием 15%-й смесью EtOAc/гексан, получая соединение 4 (35 мг, 0,10 ммоль, 24%) в виде твердого вещества. 1 Н ЯМР (500 МГц, CDCl3):8,47 (с, 1 Н), 8,17 (с, 1 Н),8,06 (с, 1 Н), 7,96 (д, J= 8,5 Гц, 1 Н), 7,88 (д, J= 8,5 Гц, 1 Н), 7,81 (д, J = 8,5 Гц, 1 Н), 7,78 (с, 1 Н), 7,75-7,67H2O (30 мл) добавили глицерин (18,7 г, 203,2 ммоль) и смесь перемешивали в течение 10 мин при 150 С. 3,4-Дихлор-анилин U (10,0 г, 61,7 ммоль) был добавлен в реакционную смесь и перемешивание продолжалось в течение 12 ч при 150 С. Уровень рН реакционной смеси доводили до 9 посредством 50%-го водного раствора NaOH при 0 С и подвергали экстракции посредством EtOAc (2250 мл). Объединенные органические фазы промывали водой (100 мл) и рассолом (100 мл), сушили над безводным Na2SO4,фильтровали и концентрировали in vacuo. Сырой продукт очищали путем перекристаллизации с использованием этанола, получая соединение V (смесь 5,6- и 6,7-региоизомеров) (8 г, 40 ммоль, 65%) в виде твердого вещества. К перемешанному раствору соединения V (смесь 5,6- и 6,7-региоизомеров) (10,0 г, 50,5 ммоль) вEtOAc (200 мл) добавили метахлорпероксибензойную кислоту (m-СРВА) (17,4 г, 101 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 6 ч. Осажденное твердое вещество отфильтровывали и сушили in vacuo, получая соединение W (смесь 5,6- и 6,7-региоизомеров) (2,3 г, 10,7 ммоль, 21%) в виде твердого вещества. К перемешанному раствору соединения W (смесь 5,6- и 6,7-региоизомеров) (2,3 г, 10,7 ммоль) в(TMSCN) (5,7 мл, 37,6 ммоль), при комнатной температуре в инертной атмосфере. Реакционную смесь перемешали при комнатной температуре в течение 12 ч. Летучие вещества выпаривали при пониженном давлении и сырой продукт очищали посредством колоночной хроматографии (SiO2, 60-120 меш), получая соединение X в виде смеси 5,6- и 6,7-региоизомеров (2,0 г, 9,0 ммоль, 80%). После перекристаллизация твердого вещества из горячего MeCN, 5,6-региоизомер осаждали и собирали посредством фильтрования. Фильтрат концентрировали in vacuo, получая чистое соединение X (6,7-региоизомер) (1 г, 4,5 ммоль, 40%) в виде твердого вещества. 1 Н ЯМР (200 МГц, CDCl3):8,31 (с, 1 Н), 8,24 (д, J = 8,6 Гц, 1 Н),8,03 (с, 1 Н), 7,71 (д, J = 8,4 Гц, 1 Н). К перемешанному раствору соединения X (1,0 г, 4,5 ммоль) в толуоле (60 мл) добавили каталитическое количество CuBr (0,06 г, 0,45 ммоль) при комнатной температуре в атмосфере N2. Реакционную смесь охладили до 0 С; изопропилмагний бромид (11,2 мл, 11,2 ммоль, 1M в диэтиловом эфире) затем добавили по каплям в реакционную смесь и перемешивание продолжалось в течение дополнительных 20 мин при 0 С. Реакцию в реакционной смеси останавливали добавлением холодной воды и фильтровали через целит. Фильтрат подвергали экстракции этилацетатом (2 50 мл); объединенные органические экстракты промывали рассолом, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, получая соединение Y (0,6 г, 2,24 ммоль, 50%) в виде твердого вещества. 1 Н ЯМР (500 МГц, CDCl3):8,33 (с, 1 Н), 8,18 (д, J = 9,0 Гц, 1 Н), 8,13 (д, J= 8,0 Гц, 1 Н), 7,99 (с, 1 Н), 4,32-4,26 (м, 1 Н), 1,26 (д, J= 7,0 Гц, 6 Н). К перемешанному раствору N-1-SEM-1,2,3-триазола (Н, 0,76 г, 3,82 ммоль) в сухом диэтиловом эфире (6 мл) добавили t-BuLi (1,7 М в пентане, 2,2 мл, 3,82 ммоль) по каплям при -70 С в инертной атмосфере. После перемешивания в течение 1 ч при -70 С, раствор соединения Y (0,17 г, 0,63 ммоль) в диэтиловом эфире (5 мл) добавили в реакционную смесь и перемешивание продолжалось в течение одного дополнительного часа при -70 С. Реакцию в реакционной смеси останавливали добавлением насыщенного раствора NH4Cl и подвергали экстракции этилацетатом (2 50 мл). Объединенные органические фазы промывали рассолом, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, получая соединение Z (0,18 г) в виде твердого вещества. Сырой продукт брали на следующую стадию без дополнительной очистки. Масс-спектр (ИЭР): m/z 466 [М+Н]+. К перемешанному раствору соединения Z (0,4 г, 0,85 ммоль) в THF (10 мл) добавили TBAF (0,4 мл,1 М в THF) и CsF (0,38 г, 2,57 ммоль) при комнатной температуре в инертной атмосфере. Реакционную смесь перемешивали при 70 С в течение 12 ч. Реакцию в реакционной смеси останавливали добавлением воды и подвергали экстракции посредством EtOAc (250 мл). Объединенные органические фазы промывали рассолом, сушили над безводным Na2SO4, и концентрировали при пониженном давлении, получая сырой продукт. Сырой продукт очищали посредством колоночной хроматографии (SiO2, 100-200 меш) с элюированием 15%-й смесью EtOAc/гексан, получая соединение 5 (50 мг, 0,14 ммоль, 38%) в виде твердого вещества. 1 Н ЯМР (500 МГц, CDCl3):8,23 (с, 1 Н), 8,07 (д, J = 8,5 Гц, 1 Н), 7,93-7,91 (м, 2 Н), 7,82 (с,- 21024197 Пример 6 1-(6-Хлор-5-(трифторметил)хинолин-2-ил)-2-метил-1-(1H-1,2,3-триазол-4-ил) пропан-1-ол (6) К перемешанному раствору 4-хлор-3-(трифторметил)анилина (АА) (10,0 г, 51,28 ммоль) в глицерине (120 мл) добавили sulfamix (173 г, 768 ммоль), FeSO47H2O (2,9 г, 10,43 ммоль) и борную кислоту (5 г,80,9 ммоль) при комнатной температуре. Реакционную смесь затем охлаждали до 0 С и медленно добавили по порциям концентрированную H2SO4 (35 мл) в инертной атмосфере. Реакционную смесь нагревали до 140-145 С и перемешивали в течение 3 ч. После расходования исходного вещества (отслеживали путем ТСХ), реакционную смесь охлаждали до комнатной температуры, реакцию останавливали добавлением водного NaHCO3 и подвергали экстракции CH2Cl2 (3300 мл). Объединенные органические экстракты промывали водой (300 мл), рассолом (200 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Полученный сырой продукт очищали посредством колоночной хроматографии на силикагеле, используя 30%-ю смесь EtOAc/гексан в качестве элюента, с получением хинолина АВ (смесь 5,6- и 6,7-региоизомеры) (65 г, 280,6 ммоль, 55%) в виде окрашенной в желтый цвет жидкости. Образование продукта подтверждали посредством грубого анализа 1 Н-ЯМР и брали далее на следующую стадию. К перемешанному раствору хинолина АВ (13 г, 56,27 ммоль) в EtOAc (100 мл) при 0 С добавилиmCPBA (24,2 г, 140,28 ммоль) (60%-я дисперсия в воде) и перемешивали при комнатной температуре в течение 12 ч. После расходования исходного вещества (отслеживали путем ТСХ), осажденное твердое вещество отфильтровывали, промывали раствором EtOAc и сушили при пониженном давлении, получаяN-оксид АС (10 г) в виде неочищенного желтоватого твердого вещества. Этот продукт напрямую брали в следующую реакцию без дополнительного исследования. К перемешанному раствору N-оксида АС (10 г, 40,48 ммоль) в ACN (100 мл) добавили Et3N (19 мл,141,7 ммоль) и затем триметилсилил цианид (TMSCN) (19,4 мл, 141,7 ммоль) при 0 С в инертной атмосфере. Полученную реакционную смесь перемешивали при комнатной температуре в течение 16 ч. После расходования исходного вещества (отслеживали путем ТСХ), удаляли летучие вещества при пониженном давлении и сырой продукт очищали посредством колоночной хроматографии на силикагеле, используя 5% EtOAc/гексан в качестве элюента, с получением требуемого соединения AD (5,6-изомер) (1,8 г,7,01 ммоль, 17,3%) в виде желтоватого твердого вещества. 1 Н ЯМР (500 МГц, CDCl3):8,75 (д, J = 8,5 Гц, 1 Н), 8,25 (д, J = 9,5 Гц, 1 Н), 7,87 (д, J = 9,0 Гц, 1 Н), 7,83 (д, J = 9,0 Гц, 1 Н). К перемешанному раствору соединения AD (1,0 г, 3,9 ммоль) в толуоле (15 мл) добавили каталитическое количество CuBr при комнатной температуре в атмосфере N2. Реакционную смесь охлаждали до 78 С; изопропилмагний бромид (9,5 мл, 9,7 ммоль) затем добавили по каплям в реакционную смесь и перемешивание продолжалось в течение дополнительных 30 мин при -78 С. После расходования исходного вещества (отслеживали путем ТСХ), реакцию в реакционной смеси останавливали добавлением насыщенного раствора NH4Cl и подвергали экстракции посредством EtOAc (2100 мл). Объединенные органические экстракты сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Сырой продукт очищали посредством колоночной хроматографии на силикагеле, используя 10%-ю смесь EtOAc/гексан в качестве элюента, с получением кетона АЕ (0,6 г, 1,98 ммоль, 54,5%) в виде желтоватого твердого вещества. Этот продукт напрямую брали в следующую реакцию без дополнительного исследования. К перемешанному раствору SEM-триазола (0,79 г, 3,96 ммоль) в сухом эфире (10 мл) добавили по каплям tert-BuLi (1,9 мл, 37,48 ммоль) при -78 С и перемешивали в течение 1 ч. Раствор кетона АЕ (0,3 г,9,96 ммоль) в эфире (10 мл) добавили в реакционную смесь при 0 С и перемешивание продолжалось в течение дополнительных 20 мин. После расходования исходного вещества (отслеживали путем ТСХ),реакцию в реакционной смеси останавливали добавлением насыщенного раствора NH4Cl и подвергали реакционную смесь экстракции посредством EtOAc (250 мл). Объединенные органические экстракты промывали водой (30 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении,получая соединение AF (0,5 г) в виде неочищенной желтоватой сиропообразной массы. Этот продукт напрямую брали в следующую реакцию без дополнительной очистки и исследования. К перемешанному раствору соединения AF (0,5 г, 1,0 ммоль) в THF (10 мл) добавили CsF (0,462 г,- 22024197 3,0 ммоль) и затем 1 М раствор TBAF (0,26 г, 1,00 ммоль) в THF при комнатной температуре. Реакционную смесь нагревали с обратным холодильником и перемешивали в течение 18 ч. После расходования исходного вещества (отслеживали путем ТСХ), реакцию в реакционной смеси останавливали добавлением воды (50 мл) и подвергали экстракции посредством EtOAc (250 мл). Объединенные органические экстракты промывали водой (250 мл), раствором рассола (50 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Сырой продукт очищали посредством колоночной хроматографии на силикагеле, используя 30%-ю смесь EtOAc/гексан в качестве элюента, с получением соединения 6 (52 мг, 0,14 ммоль, 14%) в виде грязновато-белого твердого вещества. 1 Н ЯМР (500 МГц, CDCl3):11,60-11,58 (шс, 1H), 8,61 (д, J = 9,0 Гц, 1 Н), 8,17 (д, J= 9,5 Гц, 1 Н), 8,05-8,03 (м, 1 Н), 7,82 (с, 1 Н), 7,76 (д,J = 9,0 Гц, 1 Н), 6,17 (с, 1 Н), 2,83-2,82 (м, 1 Н), 0,97 (д, J = 6,5 Гц, 3 Н), 0,65 (д, J = 7,0 Гц, 3 Н). ВЭЖХ: 96,22%. Масс-спектр (ИЭР): m/z 370 [М+]. Схема 7 Пример 7 2-Метил-1-(6-(метилтио) хинолин-2-ил)-1-(1 Н-1,2,3-триазол-4-ил) пропан-1-ол(7) К перемешанному раствору 6-бромхинолина (AG) (15 г, 72,11 ммоль) в EtOAc (200 мл) при 0 С добавили mCPBA (24,8 г, 143,7 ммоль) (60%-ю дисперсию в воде) и перемешивали при комнатной температуре в течение 8 ч. После расходования исходного вещества (отслеживали путем ТСХ), осажденное твердое вещество отфильтровывали, промывали раствором EtOAc и высушивали при пониженном давлении, получая N-оксид АН (14 г) в виде сырого продукта. Этот продукт напрямую брали в следующую реакцию без дополнительного исследования. Масс-спектр (ИЭР): m/z 226 [М 2]. К перемешанному раствору N-оксида АН (14 г, неочищенный) в ACN (100 мл) добавили Et3N (30,9 мл, 218,7 ммоль) и затем TMSCN (27 мл, 218,7 ммоль) при 0 С в инертной атмосфере. Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. После расходования исходного вещества (отслеживали путем ТСХ), летучие вещества удаляли при пониженном давлении и очищали посредством колоночной хроматографии, используя 20%-ю смесь EtOAc/гексан в качестве элюента, с получением соединения AI (8 г, 34,3 ммоль, 54,7%) в виде буроватого твердого вещества. 1 Н ЯМР (500 МГц, CDCl3):8,23 (д, J = 8,5 Гц, 1 Н), 8,07 (д, J= 2 Гц, 1H), 8,04 (д, J = 9,5 Гц, 1 Н), 7,91 (дд, J = 2,0, 9,0 Гц, 1 Н), 7,72 (д,J = 8,5 Гц, 1 Н). К перемешанному раствору соединения AI (6 г, 25,64 ммоль) в толуоле (100 мл) добавили каталитическое количество CuBr при комнатной температуре в атмосфере N2. Реакционную смесь охлаждали до 0 С; затем в реакционную смесь добавили по каплям изопропилмагний бромид (64 мл, 64,10 ммоль) и перемешивание продолжалось в течение одного дополнительного часа. После расходования исходного вещества (отслеживали путем ТСХ), реакцию в реакционной смеси останавливали добавлением насыщенного раствора NH4Cl и подвергали экстракции посредством EtOAc (2100 мл). Объединенные органические экстракты сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Сырой продукт очищали посредством колоночной хроматографии, используя 10%-ю смесь EtOAc/гексан в качестве элюента, с получением кетона AJ (3 г, 10,78 ммоль, 41,89%) в виде грязновато-белого твердого вещества. 1 Н ЯМР (500 МГц, CDCl3):8,18-8,12 (м, 2 Н), 8,06-8,03 (м, 2 Н), 7,84 (дд, J = 2,0, 9,0 Гц, 1H),4,36-4,31 (м, 1 Н), 1,26 (д, J=7 Гц, 6 Н). ЖХ/МС: m/z 280,0 [М 2] при 13,44 RT (чистота 83,06%). К перемешанному раствору 1-(6-бромхинолин-2-ил)-2-метилпропан-1-она (AJ) (2 г, 7,19 ммоль) в ДМФА (20 мл) добавили NaSCH3 (0,75 мг, 10,79 ммоль) при комнатной температуре в инертной атмосфере. Полученную реакционную смесь перемешивали в течение 16 ч при 80 С. После расходования исходного вещества (отслеживали путем ТСХ), реакционную смесь разбавляли водой и подвергали экстракции посредством EtOAc (230 мл). Объединенные органические фазы сушили над безводнымNa2SO4, фильтровали и концентрировали in vacuo. Полученный сырой продукт очищали посредством колоночной хроматографии на силикагеле с элюированием 5%-й смесью EtOAc/гексан, получая соединение AK (0,7 г, 2,85 ммоль, 39,77%) в виде твердого вещества. 1 Н ЯМР (500 МГц, CDCl3):8,13-8,08 (м,2 Н), 8,05 (д, J= 9,0 Гц, 1 Н), 7,63 (дд, J = 2,5, 9,0 Гц, 1 Н), 7,52 (д, J = 2,0 Гц, 1 Н), 4,38-4,33 (м, 1 Н), 2,61 (с,3 Н), 1,26 (д, J = 7,5 Гц, 6 Н). К перемешанному раствору SEM-триазола (1,5 г, 7,34 ммоль) в сухом эфире (20 мл) добавили по каплям n-BuLi (4,3 мл, 7,34 ммоль) (1,6 М раствор в гексане) и давали перемешаться при -78 С в течение 1 ч в инертной атмосфере. Раствор 2-метил-1-(6-(метилтио)хинолин-2-ил)пропан-1-она (AK) (0,3 г, 1,22 ммоль) в эфире (10 мл) добавили в реакционную смесь при -78 С и перемешивание продолжалось в те- 23024197 чение дополнительных 2 ч при 0 С. После расходования исходного вещества (отслеживали путем ТСХ),реакцию в реакционной смеси останавливали добавлением насыщенного раствора NH4Cl и подвергали экстракции посредством EtOAc (250 мл). Объединенные органические экстракты промывали водой,сушили над безводным Na2SO4 и концентрировали при пониженном давлении, получая соединение AL (1 г) в виде неочищенной сиропообразной массы, окрашенной в желтый цвет. Этот продукт напрямую брали в следующую реакцию без дополнительного исследования. К перемешанному раствору 2-метил-1-(6-(метилтио)хинолин-2-ил)-1-(1-2-(триметилсилил)этокси)метил)-1H-1,2,3-триазол-5-ил)пропан-1-ола (AL) (1 г, 2,25 ммоль) в THF (20 мл) добавили CsF (1,02 г,6,75 ммоль) и затем TBAF (2,24 мл, 2,25 ммоль) (1 М раствор в THF) при комнатной температуре в инертной атмосфере. Реакционную смесь нагревали до 80 С и перемешивали в течение 16 ч. После расходования исходного вещества (отслеживали путем ТСХ), реакционную смесь разбавляли водой (30 мл) и подвергали экстракции посредством EtOAc (330 мл). Объединенный органический слой промывали водой, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Полученный сырой продукт очищали посредством колоночной хроматографии на силикагеле, используя 30%-ю смесь Пример 8 1-(6-Циклопропоксихинолин-2-ил)-2-метил-1-(1H-1,2,3-триазол-4-ил)пропан-1-ол (8) К перемешанному раствору 6-гидроксихинолина (AM) (0,5 г, 3,44 ммоль) в ДМФА (10 мл) добавили KOtBu (1,15 г, 10,32 ммоль) при комнатной температуре. После перемешивания в течение 4 ч при комнатной температуре, циклопропилбромид (1,24 г, 10,32 ммоль) добавили в реакционную смесь и нагревали при 80 С в течение 24 ч. После расходования исходного вещества (отслеживали путем ТСХ),реакционную смесь разбавляли водой (100 мл) и подвергали экстракции посредством EtOAc (350 мл). Объединенные органические экстракты промывали рассолом, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Сырой продукт очищали посредством колоночной хроматографии на силикагеле, получая соединение AN (0,1 г, 0,54 ммоль, 15,7%) в виде слегка желтого твердого вещества. 1 Н ЯМР (200 МГц, CDCl3):8,78-8,76 (м, 1 Н), 8,10-7,98 (м, 2 Н), 7,43-7,33 (м, 3 Н), 3,91-3,82 (м, 1 Н),0,94-0,85 (м, 4 Н). К перемешанному раствору соединения AN (0,1 г, 0,54 ммоль) в EtOAc (5 мл) добавили m-СРВА(0,18 г, 1,08 ммоль) при 0 С и перемешивали при комнатной температуре в течение 14 ч. После расходования исходного вещества (отслеживали путем ТСХ), реакционную смесь концентрировали при пониженном давлении. Сырой продукт очищали посредством колоночной хроматографии на силикагеле, получая N-оксид АО (0,1 г, 0,49 ммоль, 92,1%) в виде слегка красноватого твердого вещества. Это соединение напрямую использовали в следующей реакции. К перемешанному раствору N-оксида АО (0,1 г, 0,49 ммоль) в ACN (5 мл) добавили Et3N (2,6 мл,1,71 ммоль) и затем TMSCN (0,25 мл, 1,71 ммоль) при 0 С в инертной атмосфере. Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Летучие вещества выпаривали при пониженном давлении и сырой продукт очищали посредством колоночной хроматографии на силикагеле, получая соединение АР (80 мг, 0,36 ммоль, 73%) в виде грязновато-белого твердого вещества. 1 Н ЯМР (500 МГц,CDCl3):8,18 (д, J= 8,5 Гц, 1 Н), 8,05 (д, J = 9,0 Гц, 1 Н), 7,65 (д, J = 8,0 Гц, 1 Н), 7,47 (дд, J = 8,5, 2,5 Гц 1H), 7,42 (с, 1 Н), 3,91-3,88 (м, 1H), 0,93-0,85 (м, 4 Н). К перемешанному раствору соединения АР (0,2 г, 0,95 ммоль) в толуоле (5 мл) добавили каталитическое количество CuBr при комнатной температуре в атмосфере N2. Реакционную смесь охлаждали до 78 С; изопропилмагний бромид (2,4 мл, 2,37 ммоль) затем добавили по каплям в реакционную смесь и перемешивание продолжалось в течение одного дополнительного часа при 0 С. После расходования исходного вещества (отслеживали путем ТСХ), реакцию в реакционной смеси останавливали добавлением насыщенного раствора NH4Cl и подвергали экстракции EtOAc (2100 мл). Объединенные органические экстракты промывали водой, рассолом, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Полученный сырой продукт очищали посредством колоночной хроматографии на силикагеле с элюированием 20%-й смесью EtOAc/гексан, получая кетон AQ (0,1 г, 0,39 ммоль, 41,66%) в виде- 24024197 низкоплавкого желтого твердого вещества. 1 Н ЯМР (500 МГц, CDCl3):8,15 (д, J= 8,5 Гц, 1 Н), 8,10-8,06(м, 2 Н), 7,42-7,40 (м, 2 Н), 4,38-4,34 (м, 1 Н), 3,90-3,88 (м, 1 Н), 1,26 (д, J= 7,0 Гц, 6 Н), 0,90-0,85 (м, 4 Н). К перемешанному раствору SEM-триазола (0,62 г, 3,13 ммоль) в сухом эфире (6 мл) добавили по каплям tert-BuLi (2,9 мл, 11,89 ммоль, 1,6 М раствор в гексане) и дали перемешаться при -78 С в течение 1 ч в инертной атмосфере. Раствор 1-(6-циклопропоксихинолин-2-ил)-2-метилпропан-1-она (AQ) (0,2 г,0,78 ммоль) в эфире (6 мл) добавили в реакционную смесь при -78 С и перемешивание продолжалось в течение дополнительных 30 мин. После расходования исходного вещества (отслеживали путем ТСХ),реакцию в реакционной смеси останавливали добавлением насыщенного раствора NH4Cl и подвергали экстракции посредством EtOAc (315 мл). Объединенные органические экстракты промывали рассолом,сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Полученный сырой продукт очищали посредством колоночной хроматографии на силикагеле с элюированием 30%-й смесьюEtOAc/гексан, получая соединение AR (0,35 г) в виде неочищенной желтоватой густой сиропообразной массы. Этот продукт использовали в стадии снятия защиты без дополнительного исследования. К перемешанному раствору 1-(6-циклопропоксихинолин-2-ил)-2-метил-1-(1-2-(триметилсилил)этокси)метил)-1H-1,2,3-триазол-5-ил)пропан-1-ола (AR) (0,35 г, 0,77 ммоль) в THF (5 мл) добавилиCsF (0,42 г, 3,08 ммоль) и затем TBAF (1 мл, 0,77 ммоль, 1 М раствор в THF) при комнатной температуре и перемешивали с обратным холодильником в течение 12 ч в инертной атмосфере. После расходования исходного вещества (отслеживали путем ТСХ), реакцию в реакционной смеси останавливали добавлением воды (20 мл) и подвергали экстракции посредством EtOAc (330 мл). Объединенный органический слой промывали водой, рассолом и сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Полученный сырой продукт очищали посредством колоночной хроматографии на силикагеле,используя 30%-ю смесь EtOAc/гексан в качестве элюента, с получением соединения 8 (85 мг, 0,26 ммоль,33%) в виде грязновато-белого твердого вещества. 1 Н ЯМР (500 МГц, CDCl3):11,82-11,60 (шс, 1H), 8,08(5,06 г, 81,9 ммоль) при комнатной температуре. Реакционную смесь охлаждали до 0 С; концентрированную кислоту H2SO4 (35 мл) добавили в реакционную смесь и нагревали при 145 С в течение 3 ч. После расходования исходного вещества (отслеживали путем ТСХ), реакцию в реакционной смеси останавливали добавлением холодной воды и нейтрализовали добавлением NaHCO3. Водный слой подвергали экстракции CH2Cl2 (3500 мл). Объединенные органические фазы промывали водой (100 мл), рассолом(100 мл), сушили над безводным Na2SO4, фильтровали и концентрировали in vacuo. Полученный сырой продукт очищали посредством колоночной хроматографии на силикагеле с элюированием 30%-й смесьюEtOAc/гексан, получая соединение AT (смесь 5,6- и 6,7-региоизомеров) (4 г, 17,2 ммоль, 34%) в виде сиропа. К перемешанному раствору соединения AT (смесь 5,6- и 6,7-региоизомеров) (4 г, 17,2 ммоль) вEtOAc (20 мл) добавили m-СРВА (7,4 г, 43 ммоль) при 0 С и реакционную смесь перемешивали при комнатной температуре в течение 12 ч. После расходования исходного вещества (отслеживали путем ТСХ), реакционную смесь концентрировали при пониженном давлении. Сырой продукт очищали посредством колоночной хроматографии на силикагеле с элюированием 10%-й смесью MeOH/CH2Cl2, получая соединение AU (смесь 5,6- и 6,7-региоизомеров) (2 г, 8,06 ммоль, 47,6%) в виде желтого твердого вещества. К перемешанному раствору соединения AU (смесь 5,6- и 6,7-региоизомеров) (5,0 г, 20,1 ммоль) вACN (50 мл) добавили Et3N (7,1 г, 70,3 ммоль) и затем TMSCN (6,9 г, 70,3 ммоль) при 0 С в инертной атмосфере. Реакционную смесь перемешивали при комнатной температуре в течение 14 ч. Выпаривали летучие вещества при пониженном давлении и сырой продукт очищали посредством колоночной хроматографии на силикагеле с элюированием 8%-й смесью EtOAc/гексан, получая соединение AV (6,7 изомер) (2,0 г, 7,75 ммоль, 38,4%) в виде бурого твердого вещества. К перемешанному раствору соединения AV (0,3 г, 1,16 ммоль) в толуоле (10 мл) добавили каталитическое количество CuBr (30 мг) при комнатной температуре в атмосфере N2. Реакционную смесь охлаждали до -40 С; затем в реакционную смесь добавили по каплям изопропилмагний бромид (0,5 г, 3,48 ммоль) и перемешивание продолжалось в течение одного дополнительного часа. Реакцию в реакционной смеси останавливали добавлением насыщенного раствора NH4Cl и фильтровали реакционную смесь через целитовую подушку. Фильтрат подвергали экстракции этилацетатом (225 мл); объединенные органические экстракты промывали рассолом, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Сырой продукт очищали посредством колоночной хроматографии на силикагеле с элюированием 3%-й смесью EtOAc/гексан, получая кетон AW (0,11 г, 0,36 ммоль, 31%) в виде желтого твердого вещества. 1 Н ЯМР (500 МГц, CDCl3):8,36 (с, 1 Н), 8,35 (д, J = 9 Гц, 1H), 8,26 (с, 1 Н), 8,20 (д, J= 8,5 Гц, 1 Н), 4,31-4,28 (м, 1 Н), 1,29-1,26 (м, 6 Н). К перемешанному раствору SEM-триазола (1,0 г, 5,32 ммоль) в сухом эфире (20 мл) добавили по каплям tert-BuLi (3,12 мл, 5,32 ммоль) при -78 С и перемешивали в течение 4 ч. Раствор 1-(7-хлор-6(трифторметил)хинолин-2-ил)-2-метилпропан-1-она (AW) (0,4 г, 1,32 ммоль) в эфире (10 мл) добавили в реакционную смесь при -78 С и перемешивание продолжалось в течение дополнительных 30 мин. После расходования исходного вещества (отслеживали путем ТСХ), реакцию в реакционной смеси останавливали добавлением насыщенного раствора NH4Cl и водный слой подвергали экстракции CH2Cl2 (250 мл). Объединенные органические экстракты сушили над безводным Na2SO4 и концентрировали при пониженном давлении, получая соединение АХ (1,3 г) в виде неочищенной бледно-желтой жидкости. Это вещество использовали в следующей стадии без дополнительного исследования. К перемешанному раствору соединения АХ (1,3 г, 2,6 ммоль) в THF (26 мл) при комнатной температуре добавили CsF (1,1 г, 7,8 ммоль) и затем TBAF (2,5 мл, 2,6 ммоль, 1M в THF) и перемешивали с обратным холодильником в течение 16 ч. После расходования исходного вещества (отслеживали путем ТСХ), реакцию в реакционной смеси останавливали добавлением воды (100 мл) и подвергали экстракции посредством EtOAc (230 мл). Объединенные органические экстракты сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Сырой продукт очищали посредством колоночной хроматографии на силикагеле с элюированием 10%-й смесью EtOAc/гексан и очищали посредством препаративной ТСХ, получая соединение 9 (65 мг, 0,17 ммоль, 6,7%) в виде желтоватой густой сиропообразной массы. 1 Н ЯМР (500 МГц, CDCl3):8,26-8,20 (м, 3 Н), 8,03 (д, J= 8,5 Гц, 1 Н), 7,83 (с, 1 Н), 6,20 (с, 1 Н),2,86-2,84 (м, 1H), 0,97 (д, J= 6,5 Гц, 3 Н), 0,63 (д, J = 6,5 Гц, 3 Н). ВЭЖХ: 93,67%. Масс-спектр (ИЭР): m/z 369 [М+-1]. Схема 10(10) К перемешанному раствору хинолин-6-ола (AM) (2,0 г, 13,77 ммоль) в АсОН (20 мл) добавили по каплям Br2 (0,194 мл, 13,77 ммоль) при комнатной температуре и перемешивание продолжалось в течение одного дополнительного часа. За течением реакции следили с помощью ТСХ. Реакционную смесь выливали в ледяную воду, реакцию останавливали добавлением насыщенного раствора NaHSO3 и подвергали экстракции посредством EtOAc (250 мл). Объединенный органический слой сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Сырой продукт очищали посредством колоночной хроматографии на силикагеле, используя 30%-ю смесь EtOAc/гексан в качестве элюента, с получением соединения AY (1,3 г, 5,80 ммоль, 43%) в виде грязновато-белого твердого вещества. 1 Н ЯМР (500 МГц, CDCl3):8,80 (д, J = 4,0 Гц, 1 Н), 8,37 (д, J = 8,0 Гц 1 Н), 8,03 (д, J= 9,0 Гц, 1 Н), 7,52-7,47(м, 2 Н), 6,19-6,17 (шс, 1 Н). ЖХ/МС: m/z 225,9 [М 1] при 5,12 RT (чистота 92,56%). К перемешанному раствору соединения AY (1,1 г, 4,91 ммоль) в EtOAc (30 мл) при 0 С добавили мета-хлорбензойную кислоту (mCPBA) (2,1 г, 12,27 ммоль) (60%-я дисперсия в воде) и перемешивали при комнатной температуре в течение 16 ч. После расходования исходного вещества (отслеживали путем ТСХ), осажденное твердое вещество отфильтровывали, промывали EtOAc и сушили при пониженном давлении, получая N-оксид AZ (1 г, 4,16 ммоль, 84%) в виде чистого грязновато-белого твердого вещества. 1 Н ЯМР (500 МГц, DMSO-d6):11,24 (с, 1 Н), 8,46-8,44 (м, 2 Н), 7,90 (д, J= 8,5 Гц, 1 Н), 7,52-7,49 (м, 2 Н). Масс-спектр (ИЭР): m/z 240 [М+], 242 [М 2]. К перемешанному раствору N-оксида AZ (0,9 г, 3,72 ммоль) в ACN (30 мл) добавили Et3N (1,87 мл,12,98 ммоль) и затем TMSCN (1,87 мл, 12,98 ммоль) при 0 С в инертной атмосфере. Полученную реак- 26024197 ционную смесь перемешивали при комнатной температуре в течение 16 ч. После расходования исходного вещества (отслеживали путем ТСХ), летучие вещества удаляли при пониженном давлении и очищали посредством колоночной хроматографии, используя 30%-ю смесь EtOAc/гексан в качестве элюента, с получением соединения ВА (0,9 г, 3,61 ммоль, 97%) в виде грязновато-белого твердого вещества. 1 Н ЯМР (500 МГц, CDCl3):8,47 (д, J = 8,5 Гц, 1 Н), 8,09 (д, J= 9,5 Гц, 1H), 7,77 (д, J = 9,0 Гц, 1H), 7,62 (д, J= 9,5 Гц, 1 Н), 6,21-6,20 (шс, 1 Н). К перемешанному раствору соединения ВА (9 г, 36 ммоль) в ДМФА (90 мл) добавили BrCF2CO2Na(28,3 г, 144 ммоль) и K2CO3 (29,8 г, 216 ммоль) при комнатной температуре и перемешивали при 80 С в течение 4 ч. После расходования исходного вещества (отслеживали путем ТСХ), реакционную смесь выливали в ледяную воду и экстрагировали посредством EtOAc (3 300 мл). Объединенные органические экстракты сушили над безводным Na2SO4 и концентрировали при пониженном давлении, получая сырой продукт. Сырой продукт очищали посредством колоночной хроматографии на силикагеле, используя 8%-ю смесь EtOAc/гексан в качестве элюента, с получением соединения ВВ (7 г, 23,41 ммоль, 65,4%) в виде бледно-желтого твердого вещества. 1 Н ЯМР (500 МГц, CDCl3):8,76 (д, J= 8,0 Гц, 1 Н), 8,20 (д, J= 9,0 Гц, 1H), 7,83 (д, J = 9,0 Гц, 1H), 7,78 (д, J = 9,0 Гц, 1 Н), 6,72 (t, J = 72,5 Гц, 1 Н). К перемешанному раствору соединения ВВ (4,8 г, 16,05 ммоль) в толуоле (50 мл) добавили каталитическое количество CuBr при комнатной температуре в атмосфере N2. Реакционную смесь охлаждали до -78 С; затем в реакционную смесь добавили по каплям изопропилмагний бромид (40,1 мл, 40,13 ммоль) и перемешивание продолжалось в течение дополнительных 30 мин при -78 С. После расходования исходного вещества (отслеживали путем ТСХ), реакцию в реакционной смеси останавливали добавлением насыщенного раствора NH4Cl и подвергали экстракции EtOAc (2100 мл). Объединенные органические экстракты сушили над безводным Na2SO4 и концентрировали при пониженном давлении, получая сырой продукт. Сырой продукт очищали посредством колоночной хроматографии на силикагеле,используя 2%-ю смесь EtOAc/гексан в качестве элюента, с получением кетона ВС (2 г, 5,81 ммоль, 36%) в виде бледно-желтого твердого вещества. 1 Н ЯМР (500 МГц, CDCl3):8,69 (д, J = 9,0 Гц, 1 Н), 8,23 (д, J= 9,0 Гц, 1 Н), 8,20 (д, J = 9,0 Гц, 1 Н), 7,70 (д, J= 9,5 Гц, 1 Н), 6,69 (t, J = 73,0 Гц, 1 Н), 4,35-4,30 (м, 1 Н), 1,27(д, J=7 Гц, 6 Н). ЖХ/МС: m/z 344,1 [М 1] 5,18 RT (чистота 88,39%). Раствор соединения ВС (1,0 г, 2,90 ммоль) в 1,4-диоксане (20 мл) продували аргоном в течение 30 мин. Затем Pd(PPh3)4 (0,335 г, 0,29 ммоль) и трибутил(тиофен-2-ил)станнан (1,38 мл, 4,06 ммоль) добавили в реакционную смесь и продували аргоном в течение дополнительных 10 мин. Полученную реакционную смесь перемешивали при 90 С в течение 24 ч. После расходования исходного вещества (отслеживали путем ТСХ), летучие вещества выпаривали при пониженном давлении. Сырой продукт очищали посредством колоночной хроматографии на силикагеле и затем путем препаративной ВЭЖХ, получая соединение BD (0,9 г, 2,59 ммоль, 90%) в виде бледно-желтого твердого вещества. 1 Н ЯМР (500 МГц,CDCl3):8,26 (д, J = 9,0 Гц, 2 Н), 8,08 (д, J = 8,5 Гц, 1 Н), 7,73 (д, J = 9,5 Гц, 1 Н), 7,57 (д, J = 5,5 Гц, 1 Н),7,26-7,23 (м, 1 Н), 7,13 (д, J= 2,5 Гц, 1 Н), 6,47 (t, J= 73,5 Гц, 1 Н), 4,39-4,33 (м, 1 Н), 1,27 (д, J= 7,5 Гц, 6 Н). Масс-спектр (ИЭР): m/z 348,3 [М 1]. К перемешанному раствору SEM-триазола (0,68 мл, 3,45 ммоль) в сухом эфире (10 мл) добавили по каплям t-BuLi (2 мл, 3,45 ммоль) при -78 С и перемешивали в течение 1 ч. Раствор 1-(6-(дифторметокси)5-(тиофен-2-ил)хинолин-2-ил)-2-метилпропан-1-она (BD) (0,3 г, 0,86 ммоль) в эфире (10 мл) добавили в вышеуказанную реакционную смесь и перемешивание продолжалось в течение дополнительных 30 мин при -78 С. Реакцию в реакционной смеси останавливали добавлением насыщенного раствора NH4Cl и подвергали экстракции EtOAc (250 мл). Объединенные органические экстракты промывали водой, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Сырой продукт очищали посредством колоночной хроматографии на силикагеле, используя 5%-ю смесь EtOAc/гексан в качестве элюента, получая соединение BE (0,4 г, 0,73 ммоль, 84%) в виде твердого вещества. Это вещество использовали в следующей стадии без дополнительного исследования. К перемешанному раствору соединения BE (0,409 г, 0,747 ммоль) в сухом THF (20 мл) добавилиCsF (0,331 г, 2,19 ммоль) и затем TBAF (0,732 мл, 0,732 ммоль) (1M раствор в THF) при комнатной температуре. Реакционную смесь перемешивали в течение 16 ч при 70 С. После расходования исходного вещества (отслеживали путем ТСХ), реакцию в реакционной смеси останавливали добавлением воды (40 мл) и подвергали экстракции EtOAc (2 50 мл). Объединенные органические экстракты сушили над безводным Na2SO4 и концентрировали при пониженном давлении, получая сырой продукт. Сырой продукт очищали посредством колоночной хроматографии на силикагеле, используя 20%-ю смесь EtOAc/гексан в качестве элюента, с получением соединения 10 (90 мг, 0,216 ммоль, 30%) в виде белого твердого вещества. 1 Н ЯМР (500 МГц, CDCl3):8,18-8,14 (м, 2 Н), 7,81 (с, 1 Н), 7,68 (д, J = 9,0 Гц, 1 Н), 7,54 (д, J=5,5 Гц,1 Н), 7,22-7,20 (м, 1 Н), 7,10 (д, J = 3,0 Гц, 1 Н), 6,42 (t, J= 74,0 Гц, 1 Н), 6,44 (с, 1 Н), 2,88-2,78 (м, 1 Н), 0,97 Пример 11 2-Метил-1-(5-(тиофен-2-ил)-6-(2,2,2-трифторэтокси)хинолин-2-ил)-1-(1H-1,2,3-триазол-5-ил)пропан-1-ол (11) К перемешанному раствору соединения ВА (6 г, 24,09 ммоль) в ДМФА (90 мл) добавили 2,2,2 трифторэтил 4-метилбензолсульфонат (9,1 г, 35,83 ммоль) и K2CO3 (6,6 г, 47,82 ммоль) при комнатной температуре и перемешивали при 90 С в течение 24 ч. За течением реакции следили с помощью ТСХ; реакционную смесь выливали в ледяную воду и экстрагировали посредством EtOAc (3300 мл). Объединенные органические экстракты промывали водой, рассолом, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Сырой продукт очищали посредством колоночной хроматографии на силикагеле, используя 30%-ю смесь EtOAc/гексан в качестве элюента, с получением требуемого 5,6 изомера соединения BF (2,5 г, 7,55 ммоль, 32%) в виде низкоплавкого желтоватого твердого вещества. 1 Н ЯМР (500 МГц, CDCl3):8,71 (д, J = 8,5 Гц, 1 Н), 8,20 (д, J = 9,5 Гц, 1 Н), 7,79 (д, J = 9,0 Гц, 1 Н), 7,58 (д,J= 9,5 Гц, 1 Н), 4,66-4,59 (м, 2 Н). К перемешанному раствору соединения BF (2,5 г, 7,55 ммоль) в толуоле (60 мл) добавили каталитическое количество CuBr при комнатной температуре в атмосфере N2. Реакционную смесь охлаждали до 78 С; изопропилмагний бромид (22 мл, 22,65 ммоль) затем добавили по каплям в реакционную смесь и перемешивание продолжалось в течение дополнительных 30 мин при -5 С. После расходования исходного вещества (отслеживали путем ТСХ), реакцию в реакционной смеси останавливали добавлением насыщенного раствора NH4Cl и подвергали экстракции EtOAc (2 100 мл). Объединенные органические экстракты промывали раствором рассола (100 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Сырой продукт очищали посредством колоночной хроматографии на силикагеле, используя 30%-ю смесь EtOAc/гексан в качестве элюента, с получением кетона BG (1,5 г, 3,98 ммоль, 53%) в виде густой красноватой сиропообразной массы. 1 Н ЯМР (500 МГц, CDCl3):8,65 (д, J= 9,0 Гц, 1 Н), 8,21-8,19 (м, 2 Н), 7,52 (д, J= 9,5 Гц, 1 Н), 4,62-4,57 (м, 2 Н), 4,35-4,29 (м, 1 Н), 1,27 (д, J = 7,0 Гц, 6 Н). Раствор соединения BG (2 г, 5,31 ммоль) в 1,4-диоксане (40 мл) продували аргоном в течение 10 мин. Затем Pd(PPh3)4 (0,61 г, 0,53 ммоль) и Bu3Sn-тиофен (2,9 мл, 7,96 ммоль) добавили в реакционную смесь и продували аргоном в течение дополнительных 20 мин. Полученную реакционную смесь перемешивали в течение 18 ч при 80 С. После расходования исходного вещества (отслеживали путем ТСХ),выпаривали летучие вещества при пониженном давлении. Сырой продукт очищали посредством колоночной хроматографии на силикагеле, используя 15%-ю смесь EtOAc/гексан в качестве элюента, с получением соединения ВН (1,0 г, 2,63 ммоль, 67%) в виде грязновато-белого твердого вещества. 1 Н ЯМР(500 МГц, CDCl3):8,26-8,22 (м, 2 Н), 8,04 (д, J= 9,0 Гц, 1 Н), 7,55 (д, J = 9,0 Гц, 2 Н), 7,22-7,21 (м, 1 Н),7,12-711 (м, 1 Н), 4,39-4,34 (м, 3 Н), 1,26 (д, J= 7,0 Гц, 6 Н). К перемешанному раствору SEM-триазола (0,55 г, 2,6 ммоль) в сухом эфире (15 мл) добавили по каплям tert-BuLi (1,5 мл, 2,5 ммоль) при -78 С и перемешивали в течение 1 ч. Раствор соединения ВН(0,3 г, 0,65 ммоль) в эфире (10 мл) добавили в реакционную смесь при -78 С и перемешивание продолжалось в течение дополнительных 30 мин при -78 С. Реакцию в реакционной смеси останавливали добавлением насыщенного раствора NH4Cl (50 мл) и подвергали экстракции EtOAc (250 мл). Объединенные органические экстракты промывали рассолом (50 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Сырой продукт очищали посредством колоночной хроматографии на силикагеле, используя 15%-ю смесь EtOAc/гексан в качестве элюента, с получением соединения BI (0,35 г) в виде неочищенного грязновато-белого твердого вещества. Это вещество использовали в следующей стадии без дополнительного исследования. К перемешанному раствору соединения BI (0,35 г, 0,60 ммоль) в THF (10 мл) добавили CsF (0,28 г,1,8 ммоль) и затем 1 М раствор TBAF (0,6 мл, 0,60 ммоль) при комнатной температуре. Реакционную смесь нагревали с обратным холодильником и перемешивали в течение 12 ч. После расходования исходного вещества (отслеживали путем ТСХ), реакцию в реакционной смеси останавливали добавлением воды (100 мл) и подвергали экстракции EtOAc (250 мл). Объединенные органические экстракты промывали рассолом (100 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Сырой продукт очищали посредством колоночной хроматографии на силикагеле, используя 20%-ю смесь EtOAc/гексан в качестве элюента, с получением соединения 11 (85 мг, 0,18 ммоль, 31%) в виде- 28024197 грязновато-белого твердого вещества. 1 Н ЯМР (500 МГц, CDCl3):12,10-11,30 (шс, 1 Н), 8,19 (д, J = 9,5 Гц, 1 Н), 8,13 (д, J = 9,5 Гц, 1 Н), 7,80 (д, J = 5,0 Гц, 2 Н), 7,54-7,50 (м, 2 Н), 7,21-7,19 (м, 1 Н), 7,10-7,09 (м,1 Н), 6,49 (с, 1 Н), 4,34-4,29 (м, 2 Н), 2,82-2,79 (м, 1 Н), 0,97 (д, J = 6,5 Гц, 3 Н), 0,65 (д, J = 7,0 Гц, 3 Н). Массспектр (ИЭР): m/z 449 [М 1]. ВЭЖХ: 94,03%. Следующие соединения в примерах были синтезированы, используя методики, аналогичные описанным выше, с использованием модифицированных соответствующим образом реагентов и/или исходных веществ. Пример 12 2-Метил-1-(1H-1,2,3-триазол-4-ил)-1-(6-(2,2,2-трифторэтокси)нафтален-2-ил)пропан-1-ол (12)
МПК / Метки
МПК: C07D 413/10, A61P 35/00, A61K 31/4725, A61P 9/00, A61K 31/4192, C07D 401/06, C07D 249/04
Метки: соединения, металлоферменты, ингибирующие
Код ссылки
<a href="https://eas.patents.su/30-24197-soedineniya-ingibiruyushhie-metallofermenty.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения, ингибирующие металлоферменты</a>












