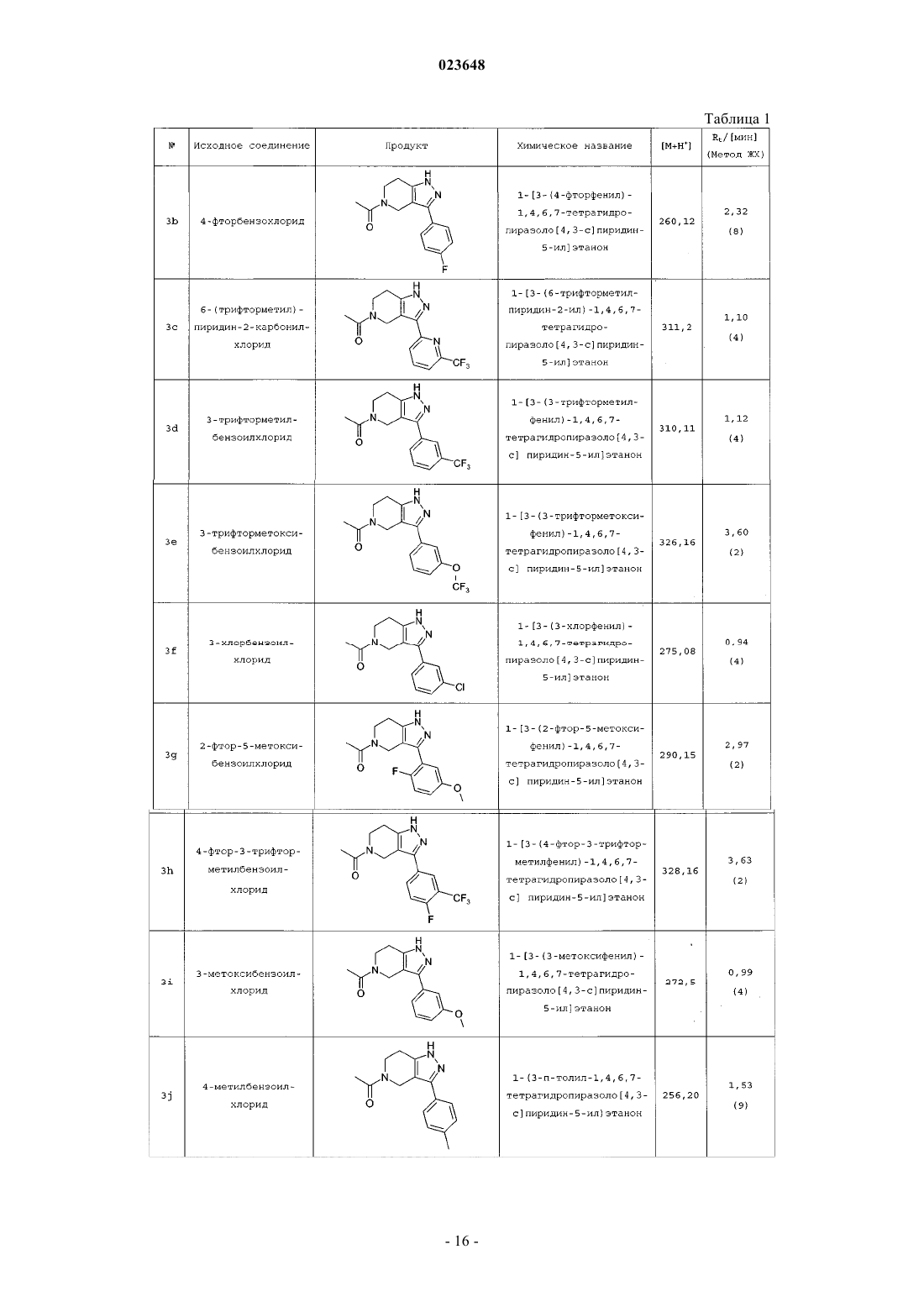
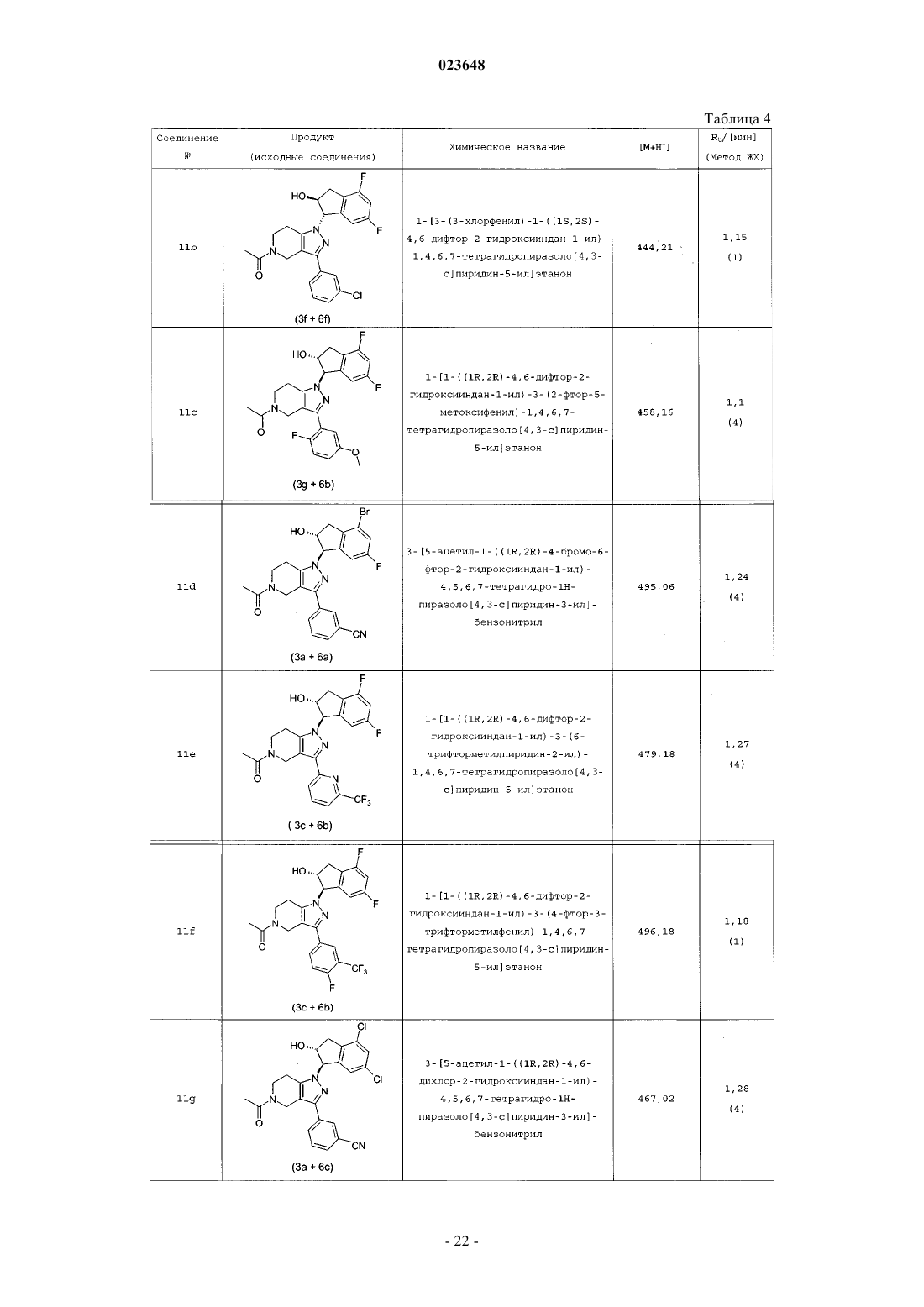
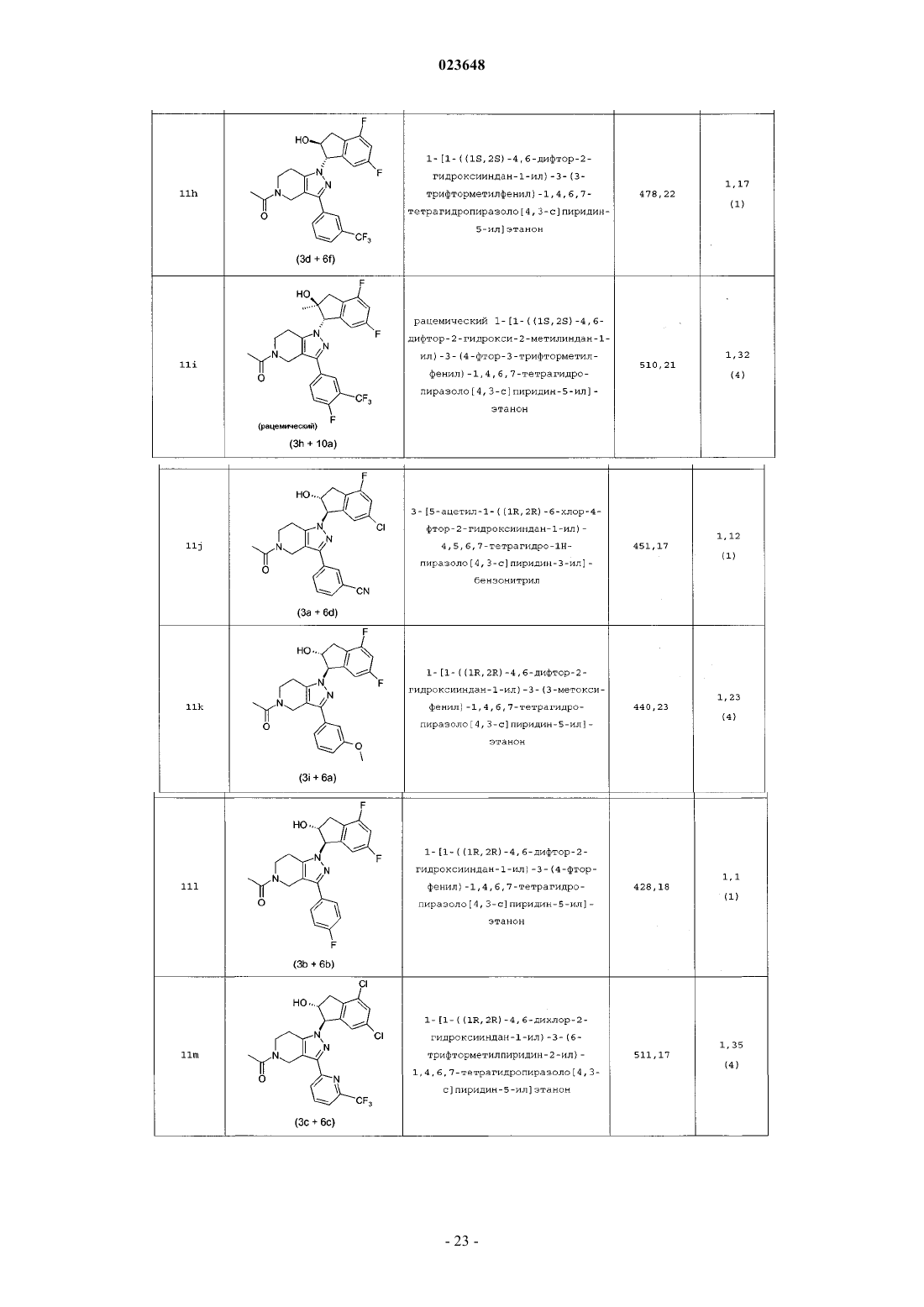
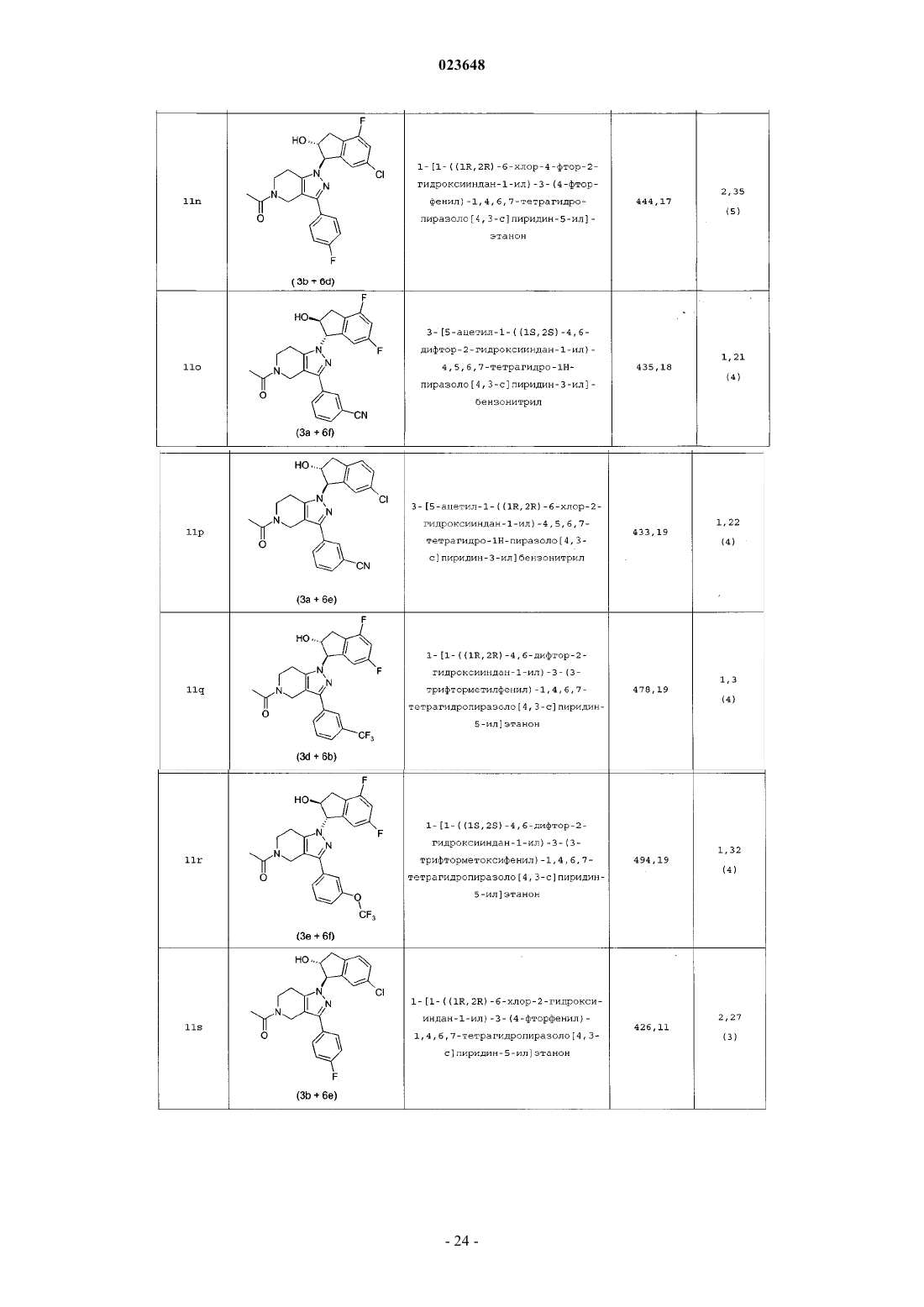
Инданилзамещенные 4,5,6,7-тетрагидро-1h-пиразоло[4,3-с]пиридины, их применение в качестве лекарственного средства и содержащие их фармацевтические препараты
Номер патента: 23648
Опубликовано: 30.06.2016
Авторы: Пернершторфер Йозеф, Хесслер Герхард, Стайнмайер Клаус, Вирт Клаус, Биали Лоран
Формула / Реферат
1. Соединение формулы I
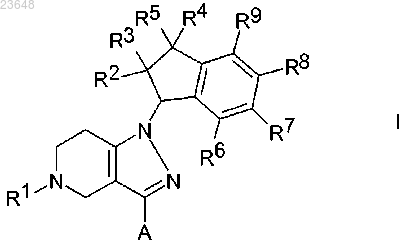
где А представляет собой фенил или пиридил, необязательно замещенные 1 или 2 заместителями, независимо выбранными из F, Cl, Br, (C1-C6)алкила, (C1-C6)алкилокси-, NC- или R12R13N-C (О)-, где один или более атомов водорода алкильного радикала могут быть замещены атомами фтора;
R1 представляет собой R10-C(O)-, R11-(C1-C6)алкил-, (С3-С6)циклоалкил или (C1-C6)алкил-SO2-, где один или более атомов водорода алкильного радикала могут быть замещены атомами фтора;
R2 представляет собой Н, ОН, (C1-C6)алкилокси- или (C1-С6)алкил-С(O)O-;
R3 представляет собой Н или (С1-С6)алкил;
R4 представляет собой Н;
R5 представляет собой Н;
каждый из R6-R9 независимо выбран из Н, F, Cl, Br, NC-, (С1-С6)алкила, (С3-С6)циклоалкила, (C1-C6)алкилокси- и (С1-С6)алкил-S- при условии, что две группы из R6-R9 представляют собой Н, где один или более атомов водорода алкильного радикала могут быть замещены атомами фтора;
R10 представляет собой (C1-C6)алкил, (С3-С6)циклоалкил, (C1-C6)алкилокси-, (C1-C6)алкил-О-(C1-C6)алкил- или R12R13N-, где один или более атомов водорода алкильного радикала могут быть замещены атомами фтора;
R11 представляет собой Н, (С3-С6)циклоалкил или (C1-C6)алкилокси-, где один или более атомов водорода алкильного радикала могут быть замещены атомами фтора;
каждый из R12 и R13 независимо представляет собой Н или (C1-C6)алкил,
и/или его стереоизомерные формы и/или смеси этих форм и/или физиологически переносимые соли соединений формулы I.
2. Соединение по п.1, где
А представляет собой фенил или пиридил, необязательно замещенные 1 или 2 заместителями, независимо выбранными из F, Cl, (C1-C4)алкилокси-, (C1-C4)алкила и NC-, где один или более атомов водорода алкильного радикала могут быть замещены атомами фтора;
R1 представляет собой R10-C(O)-, R11-(C1-C4)алкил- или (C1-С2)алкил -SO2-;
R2 представляет собой Н, ОН, (C1-C4)алкилокси- или (С1-С4)алкил-С(О)О-;
R3 представляет собой Н или (C1-C6)алкил;
R4 представляет собой Н;
R5 представляет собой Н;
каждый из R6-R9 независимо выбран из Н, F, Cl, Br, NC-, (C1-C4)алкила, циклопропила, (C1-C4)алкилокси- и (C1-C4)алкил-S- при условии, что две группы из R6-R9 представляют собой Н, где один или более атомов водорода алкильного радикала могут быть замещены атомами фтора;
R10 представляет собой (C1-C4)алкил, циклопропил, (C1-C4)алкилокси, (C1-C4)алкил-О-(С1-С4)алкил- или R12R13N-;
R11 представляет собой Н, циклопропил или (С1-С4)алкилокси-, где один или более атомов водорода алкильного радикала могут быть замещены атомами фтора;
каждый из R12 и R13 независимо представляет собой Н или (C1-C4)алкил,
и/или его стереоизомерные формы и/или смеси этих форм и/или физиологически переносимые соли соединений формулы I.
3. Соединение по п.1 или 2, где
А представляет собой фенил или пиридил, необязательно замещенные 1 или 2 заместителями, независимо выбранными из F, Cl, метокси, этокси, метила, этила, NC-, CF3O- или CF3;
R1 представляет собой R10-C(O)-, R11-(C1-C4)алкил- или СН3-SO2-;
R2 представляет собой ОН, метокси, этокси или метил-С(O)O- или этил-С(О)О-;
R3 представляет собой Н или метил;
каждый из R4 и R5 представляет собой Н;
каждый из R6-R9 независимо выбран из Н, F, Cl, Br, NC-, метила, этила, циклопропила, метокси, этокси, метил-S-, этил-S- и CF3 при условии, что две группы из R6-R9 представляют собой Н;
R10 представляет собой метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, циклопропил, метокси, этокси, (C1-C2)алкил-О-(C1-C2)алкил- или R12R13N-;
R11 представляет собой Н, циклопропил, метокси, этокси или CF3,
каждый из R12 и R13 независимо представляет собой Н, метил или этил;
и/или его стереоизомерные формы и/или смеси этих форм и/или физиологически переносимые соли соединений формулы I.
4. Соединение согласно любому из пп.1-3, где
А представляет собой фенил или пиридил, необязательно замещенные 1 или 2 заместителями, независимо выбранными из F, C1, метокси, метила, NC-, CF3O-, CF3;
R1 представляет собой R10-C(O)-, R11-(CnH2n)-, изопропил, трет-бутил или CH3-SO2-, где n равно 1, 2 или 3;
R2 представляет собой ОН или метокси;
R3 представляет собой Н или метил;
каждый из R4 и R5 представляет собой Н;
R6 представляет собой Н;
R7 и R8 независимо выбраны из Н, F, Cl, Br;
R9 представляет собой Н, F, Cl, Br, NC-, метил, этил, циклопропил, метокси, этокси, метил-S-, этил-S- или CF3;
R10 представляет собой метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, циклопропил, метокси или метоксиметил-;
R11 представляет собой Н, циклопропил, метокси или CF3,
и/или его стереоизомерные формы и/или смеси этих форм и/или физиологически переносимые соли соединений формулы I.
5. Соединение по любому из пп.1-4, выбранное из группы, состоящей из
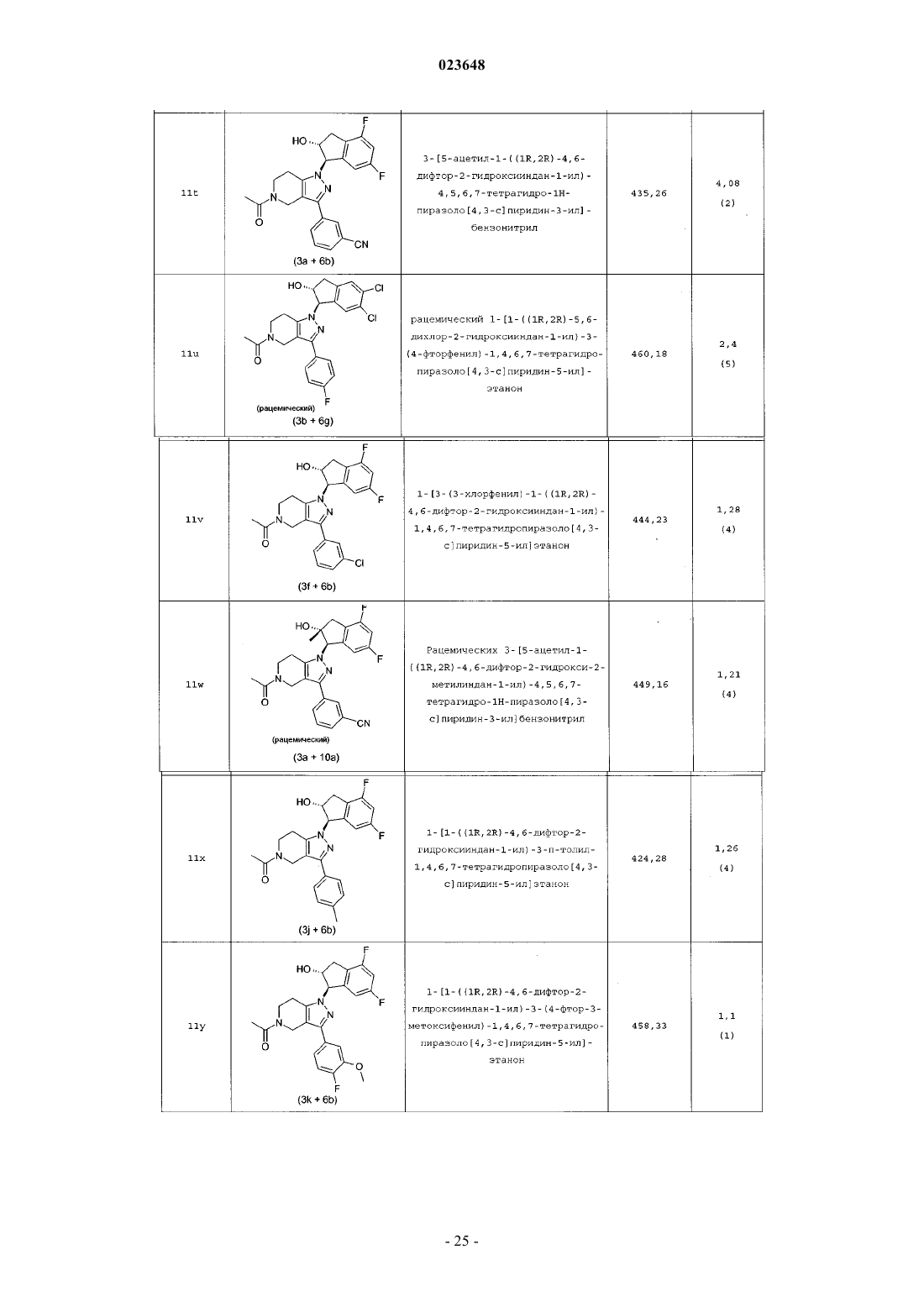
3-[1-((1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-5-пропионил-4,5,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридин-3-ил]бензонитрила;
3-[5-циклопропанкарбонил-1-((1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-4,5,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридин-3-ил]бензонитрила;
1-[1-((1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-3-(3-трифторметоксифенил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанона;
1-[3-(3-хлорфенил)-1-((1S,2S)-4,6-дифтор-2-гидроксииндан-1-ил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанона;
1-[1-((1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-3-(2-фтор-5-метоксифенил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанона;
3-[5-ацетил-1-((1R,2R)-4-бром-6-фтор-2-гидроксииндан-1-ил)-4,5,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридин-3-ил]бензонитрила;
3-[5-ацетил-1-((1R,2R)-6-фтор-2-гидрокси-4-метилиндан-1-ил)-4,5,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридин-3-ил]бензонитрила;
1-[1-((1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-3-(6-трифторметилпиридин-2-ил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанона;
3-[5-циклопропанкарбонил-1-((1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-4,5,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридин-3-ил]бензамида;
3-[1-((1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-5-изобутирил-4,5,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридин-3-ил]бензонитрила;
метилового эфира 3-(3-цианофенил)-1-((1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-карбоновой кислоты;
1-[1-((1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-3-(4-фтор-3-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанона;
3-[5-ацетил-1-((1R,2R)-4,6-дихлор-2-гидроксииндан-1-ил)-4,5,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридин-3-ил]бензонитрила;
1-[1-((1S,2S)-4,6-дифтор-2-гидроксииндан-1-ил)-3-(3-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанона;
рацемического 1-[1-((1S,2S)-4,6-дифтор-2-гидрокси-2-метилиндан-1-ил)-3-(4-фтор-3-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанона;
3-[1-((1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-5-(3,3,3-трифторпропил)-4,5,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридин-3-ил]бензамида;
3-[5-ацетил-1-((1R,2R)-4-хлор-6-фтор-2-гидроксииндан-1-ил)-4,5,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридин-3-ил]бензонитрила;
3-[5-ацетил-1-((1R,2R)-6-хлор-4-фтор-2-гидроксииндан-1-ил)-4,5,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридин-3-ил]бензонитрила;
1-[1-((1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-3-(3-метоксифенил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанона;
3-[5-ацетил-1-((1R,2R)-4,6-дифтор-2-метоксииндан-1-ил)-4,5,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридин-3-ил]бензонитрила;
1-[(S)-3-(4-фторфенил)-1-индан-1-ил-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанона;
1-[1-((1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-3-(4-фторфенил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанона;
3-[5-ацетил-1-((1R,2R)-4-циклопропил-6-фтор-2-гидроксииндан-1-ил)-4,5,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридин-3-ил]бензонитрила;
(1R,2R)-1-[5-циклопропилметил-3-(4-фторфенил)-4,5,6,7-тетрагидропиразоло[4,3-с]пиридин-1-ил]-4,6-дифториндан-2-ола;
эфира (1R,2R)-1-[3-(3-цианофенил)-5-пропионил-4,5,6,7-тетрагидропиразоло[4,3-с]пиридин-1-ил]-4,6-дифториндан-2-илпропионовой кислоты;
1-[1-((1R,2R)-4,6-дихлор-2-гидроксииндан-1-ил)-3-(6-трифторметилпиридин-2-ил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанона;
(1R,2R)-4,6-дифтор-1-[3-(4-фторфенил)-5-(2-метоксиэтил)-4,5,6,7-тетрагидропиразоло[4,3-с]пиридин-1-ил]индан-2-ола;
1-[1-((1R,2R)-6-хлор-4-фтор-2-гидроксииндан-1-ил)-3-(4-фторфенил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанона;
1-[1-((1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-3-(4-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанона;
(1R,2R)-4,6-дифтор-1-[3-(4-фторфенил)-5-пропил-4,5,6,7-тетрагидропиразоло[4,3-с]пиридин-1-ил]индан-2-ола;
3-[5-ацетил-1-((1S,2S)-4,6-дифтор-2-гидроксииндан-1-ил)-4,5,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридин-3-ил]бензонитрила;
3-[5-ацетил-1-((1R,2R)-6-хлор-2-гидроксииндан-1-ил)-4,5,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридин-3-ил]бензонитрила;
1-[(R)-3-(4-фторфенил)-1-индан-1-ил-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанона;
3-[1-((1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-5-(2-метоксиацетил)-4,5,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридин-3-ил]бензонитрила;
1-[1-((1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-3-(3-трифторметилфенил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанона;
1-[1-((1S,2S)-4,6-дифтор-2-гидроксииндан-1-ил)-3-(3-трифторметоксифенил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанона;
1-[1-((1R,2R)-6-хлор-2-гидроксииндан-1-ил)-3-(4-фторфенил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанона;
3-[5-циклопропилметил-1-((1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-4,5,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридин-3-ил]бензонитрила;
3-[5-ацетил-1-((1R,2R)-4-этил-6-фтор-2-гидроксииндан-1-ил)-4,5,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридин-3-ил]бензонитрила;
3-[1-((1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-5-(2-метоксиэтил)-4,5,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридин-3-ил]бензонитрила;
3-[5-ацетил-1-((1R,2R)-6-фтор-2-гидрокси-4-метилсульфанилиндан-1-ил)-4,5,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридин-3-ил]бензонитрила;
3-[5-ацетил-1-((1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-4,5,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридин-3-ил]бензонитрила;
3-[1-((1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-5-(3,3,3-трифторпропил)-4,5,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридин-3-ил]бензамида;
3-[1-((1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-5-(2,2-диметилпропионил)-4,5,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридин-3-ил]бензонитрила;
рацемического 1-[1-((1R,2R)-5,6-дихлор-2-гидроксииндан-1-ил)-3-(4-фторфенил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанона;
1-[1-((1R,2R)-4,6-дифтор-2-метоксииндан-1-ил)-3-(4-фторфенил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанона;
1-[3-(3-хлорфенил)-1-((1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанона;
рацемического 3-[5-ацетил-1-((1R,2R)-4,6-дифтор-2-гидрокси-2-метилиндан-1-ил)-4,5,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридин-3-ил]бензонитрила;
1-[1-((1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-3-п-толил-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанона;
1-[1-((1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-3-(4-фтор-3-метоксифенил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанона;
5-[5-ацетил-1-((1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-4,5,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридин-3-ил]-2-фторбензонитрила;
1-[1-((1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-3-(3-фторфенил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанона;
1-[3-(4-хлорфенил)-1-((1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанона;
рацемического 1-[1-((1R,2R)-5,7-дихлор-2-гидроксииндан-1-ил)-3-(4-фторфенил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанона;
1-[1-((1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-3-(4-метоксифенил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанона;
(1R,2R)-4,6-дифтор-1-[3-(4-фторфенил)-5-изопропил-4,5,6,7-тетрагидропиразоло[4,3-с]пиридин-1-ил]индан-2-ола;
(1R,2R)-1-[5-ацетил-3-(3-цианофенил)-4,5,6,7-тетрагидропиразоло[4,3-с]пиридин-1-ил]-6-фтор-2-гидроксииндан-4-карбонитрила;
3-[1-((1R,2R)-4,6-дихлор-2-гидроксииндан-1-ил)-5-метансульфонил-4,5,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридин-3-ил]бензонитрила,
их стереоизомерных форм и/или их физиологически переносимых солей.
6. Лекарственное средство для лечения или профилактики TASK-1 канал-опосредованных заболеваний, содержащее соединение формулы I и/или его фармацевтически приемлемую соль по любому из пп.1-5.
7. Применение соединения формулы I и/или его фармацевтически приемлемой соли по любому из пп.1-5 для лечения или профилактики TASK-1 канал-опосредованных заболеваний.
8. Применение соединения формулы I и/или его фармацевтически приемлемой соли по любому из пп.1-5 для лечения или профилактики аритмии, предсердной тахиаритмии, фибрилляции предсердий и трепетания предсердий.
9. Применение соединения формулы I и/или его фармацевтически приемлемой соли по любому из пп.1-5 для лечения или профилактики дыхательных расстройств во время сна, приступов центрального и обструктивного апноэ во сне, синдрома повышенной резистентности верхних дыхательных путей, дыхания Чейна-Стокса, храпения, нарушений центральной регуляции дыхания, синдрома внезапной детской смерти, послеоперационной гипоксии и апноэ, респираторных мышечных расстройств, дыхательных расстройств после длительной механической вентиляции легких (отлучение), дыхательных расстройств во время адаптации в высоких горах, острых дыхательных расстройств, хронических легочных расстройств с гипоксией и гиперкапнией, хронического обструктивного заболевания легких и синдрома гиповентиляции вследствие ожирения.
10. Применение соединения формулы I и/или его фармацевтически приемлемой соли по любому из пп.1-5 в качестве стимулятора дыхания для лечения или профилактики респираторной депрессии, связанной с анестезией или процедурной седации для малых вмешательств или в диагностических целях.
11. Применение соединения формулы I и/или его фармацевтически приемлемой соли по любому из пп.1-5 в качестве стимулятора дыхания для лечения или профилактики респираторной депрессии опиоидами в лечении хронической боли, например, при злокачественной опухоли или паллиативной терапии или процедурной седации и/или отлучении от длительной механической вентиляции.
12. Применение соединения формулы I и/или его фармацевтически приемлемой соли по любому из пп.1-5 для лечения или профилактики рассеянного склероза и воспалительных или дегенеративных расстройств центральной нервной системы.
13. Применение соединения формулы I и/или его фармацевтически приемлемой соли по любому из пп.1-5 для внутривенного введения, перорального введения, назального введения, внутримышечного введения, подкожного введения, ингаляционного введения, местного применения или фарингеального введения.
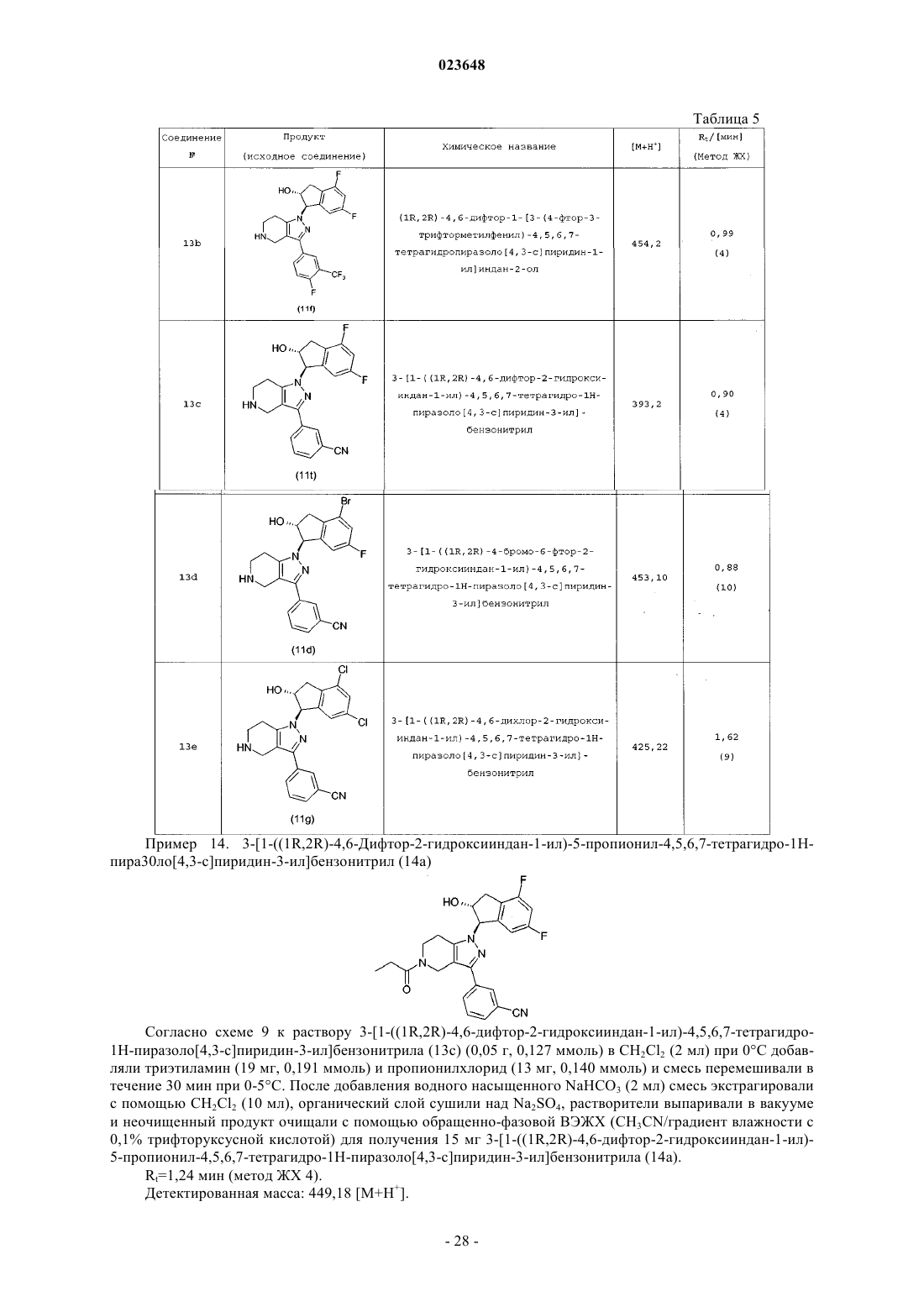
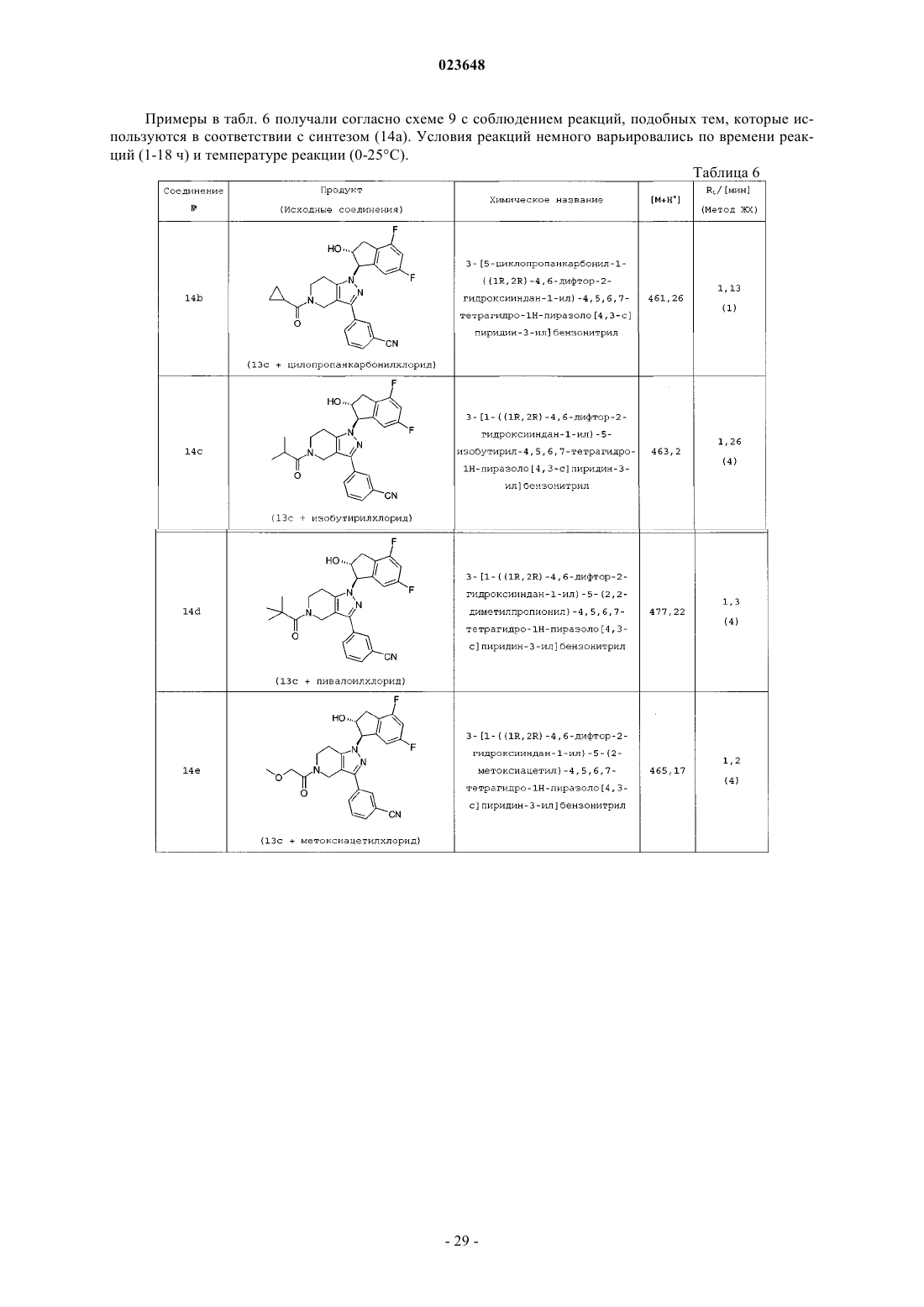
14. Способ получения соединения формулы I по любому из пп.1-5, включающий взаимодействие 4,5,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридинов 3 с эпоксидами 6 или 10 для получения 2-гидроксииндан-1-илзамещенных 4,5,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридинов 11 посредством нагревания смеси соединения 3 и эпоксида 6 в присутствии избытка основания в инертном растворителе или посредством депротонирования соединения 3 с основанием и его алкилирования с эпоксидом 6
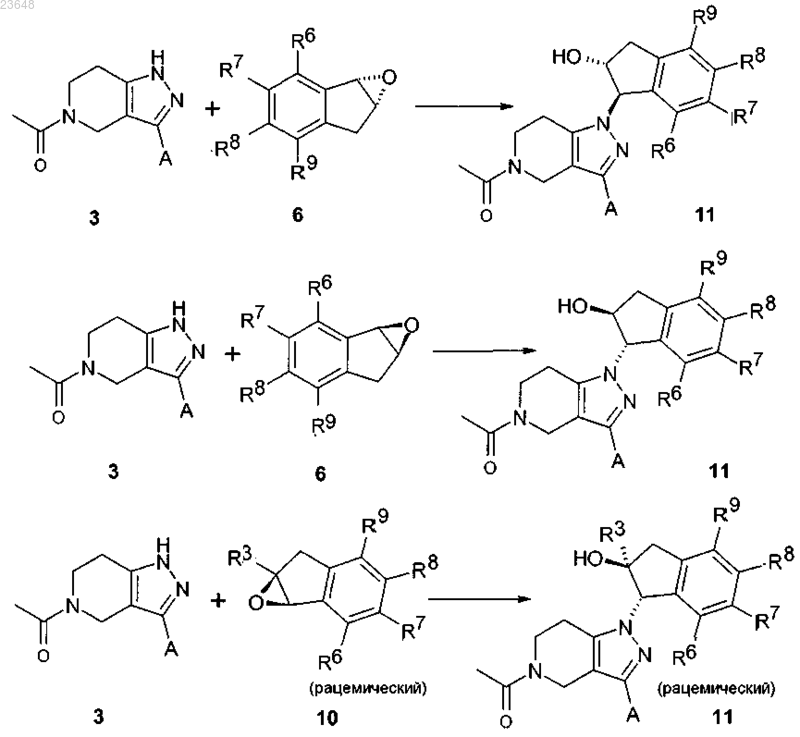
где остатки A, R3, R6, R7, R8, R9 имеют такие же значения, которые указаны в пп.1-5.
15. Способ получения соединения формулы I по любому из пп.1-5, включающий взаимодействие 4,5,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридина 3 с аминоиндан-1-олами 4' или 8', посредством нагревания смеси соединения 3 и аминоиндан-1-ола 4' или 8' в присутствии фосфина и соединения 1,1'-(азодикарбонила) для получения соединения 12

где остатки A, R3, R6, R7, R8, R9 имеют такие же значения, которые указаны в пп.1-5, и где R2 представляет собой Н или группу (C1-C6)алкила, (C1-C6)алкилокси-, (C1-C6)алкил-С(О)О-.
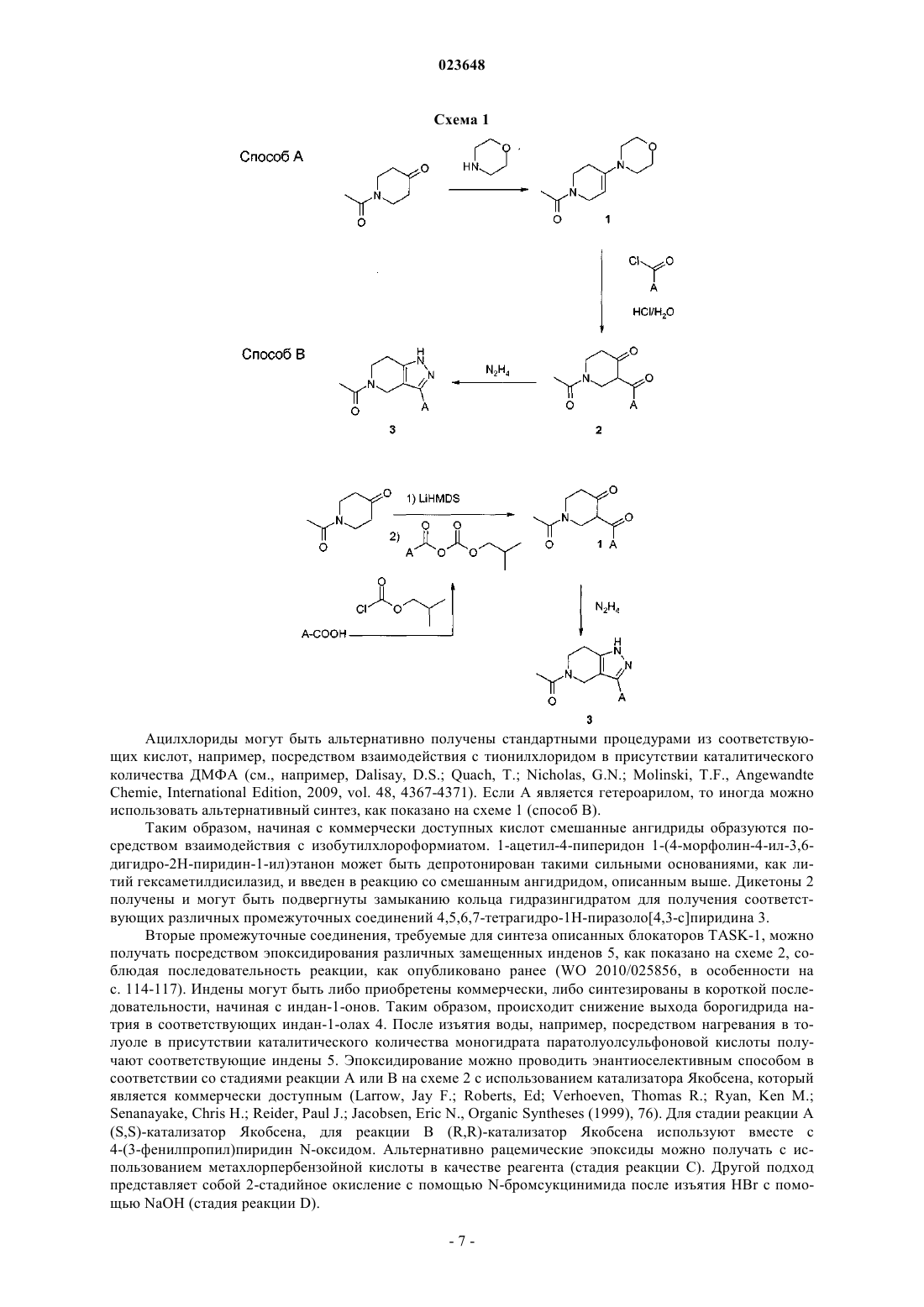
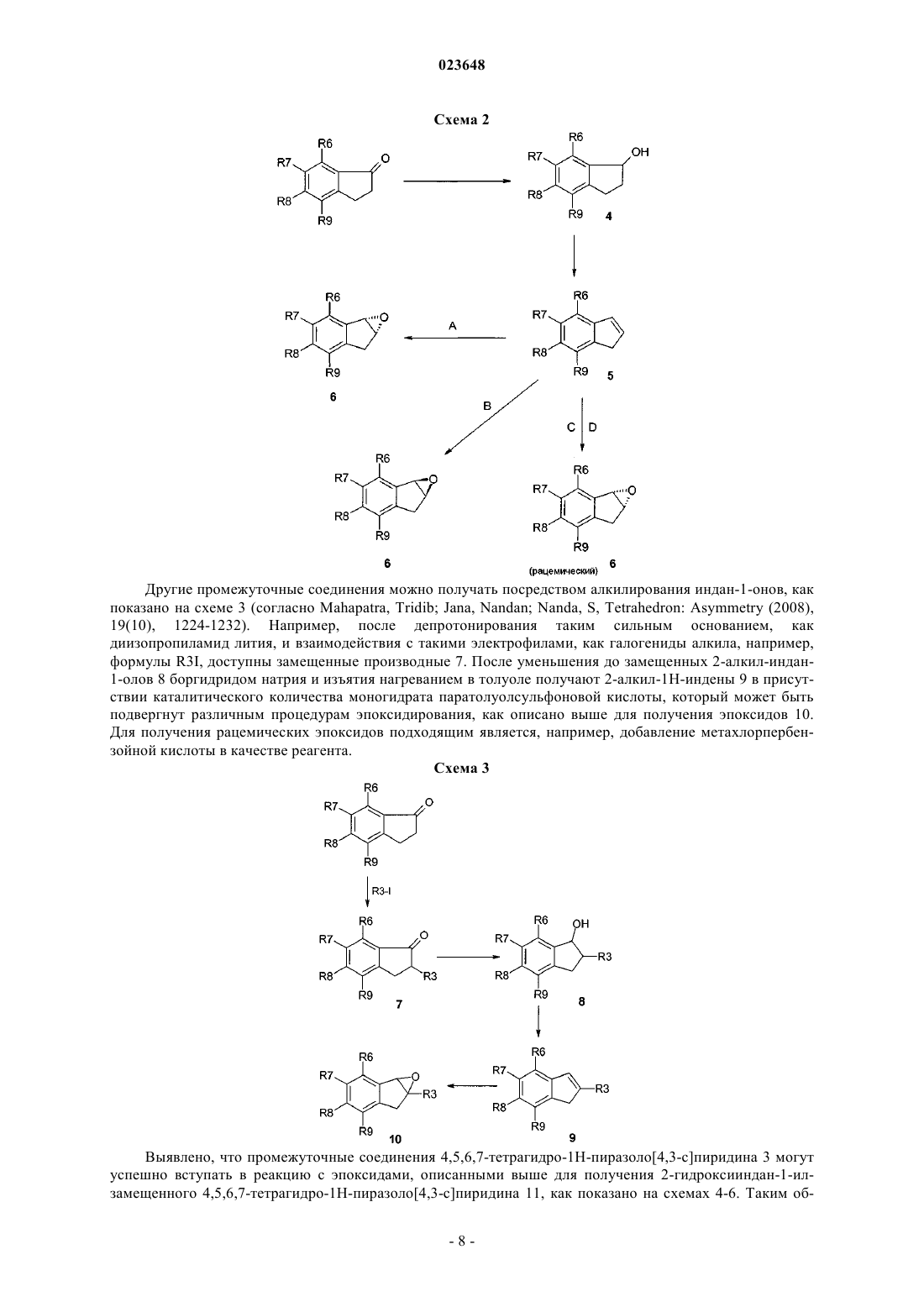
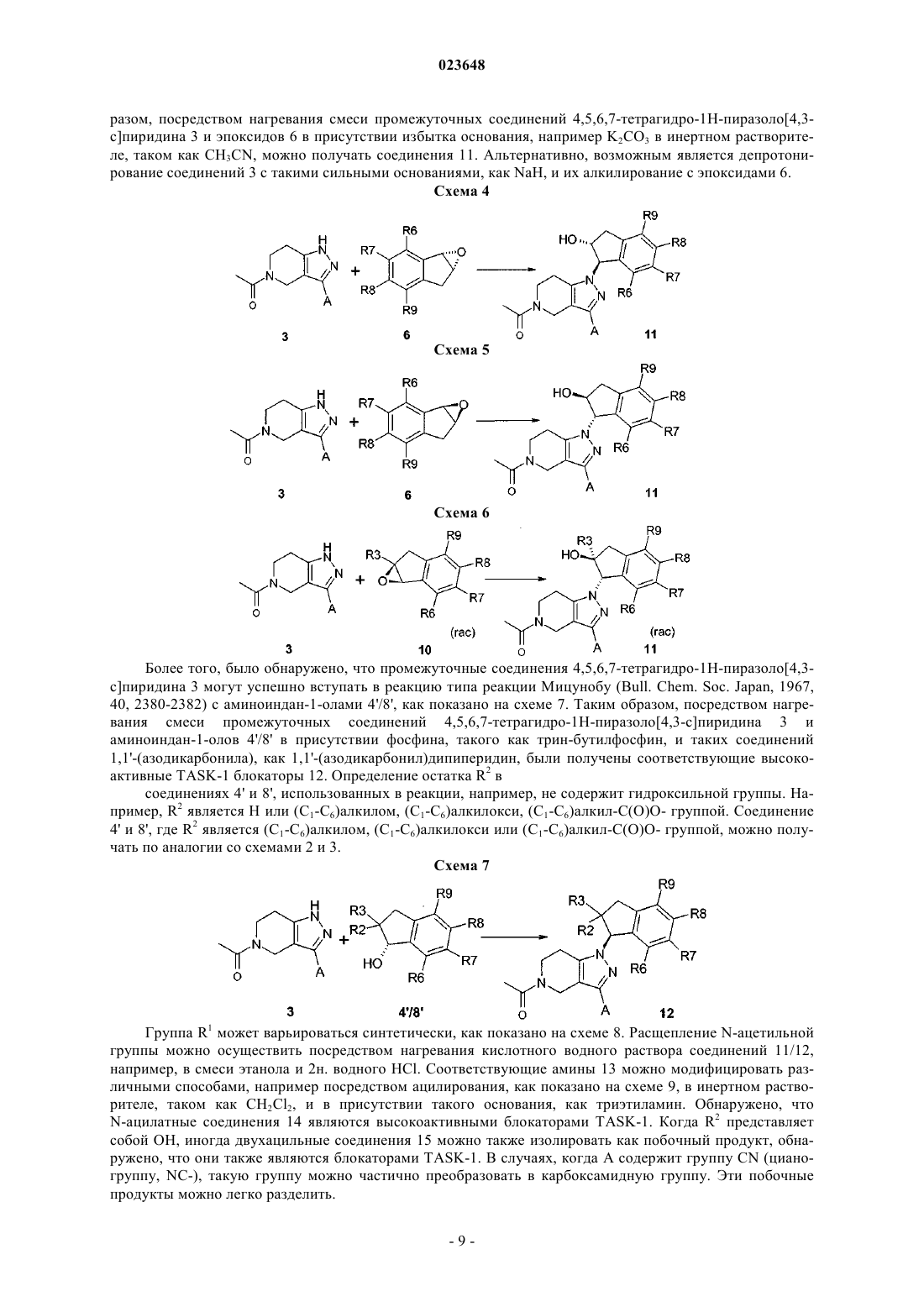
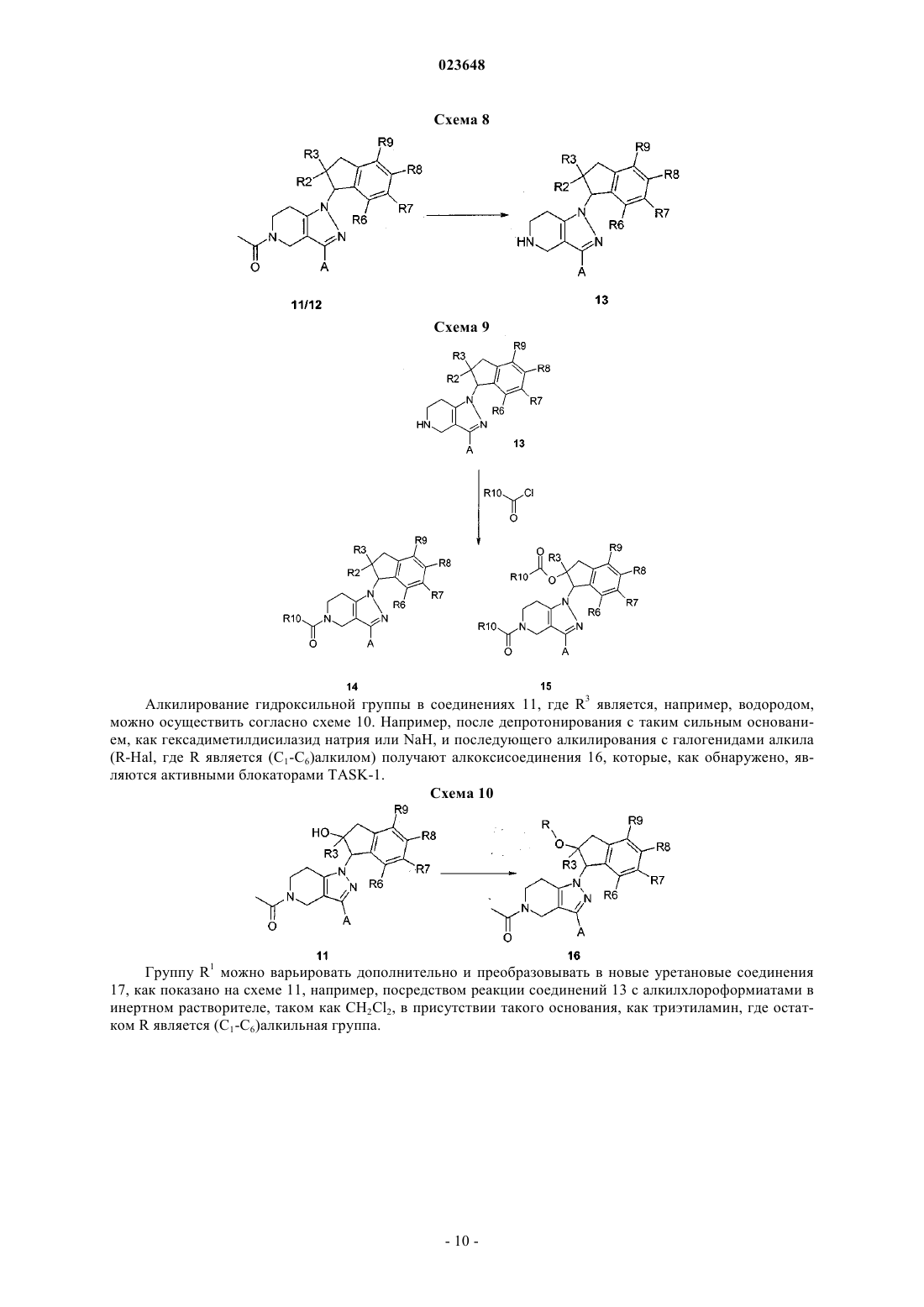
Текст
ИНДАНИЛЗАМЕЩЕННЫЕ 4,5,6,7-ТЕТРАГИДРО-1H-ПИРАЗОЛО[4,3-с]ПИРИДИНЫ,ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННОГО СРЕДСТВА И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ ПРЕПАРАТЫI, их применению в качестве лекарственного средства и содержащим их фармацевтическим препаратам. Соединения формулы I оказывают воздействие на калиевый канал TASK-1. Соединения пригодны для лечения или профилактики предсердной аритмии, например фибрилляции предсердий или трепетания предсердий. к их получению и их применению в качестве лекарственных препаратов для лечения или профилактикиTASK-1 канал-опосредованных заболеваний. Соединения формулы I оказывают воздействие на калиевый канал TASK-1 (KCNK3). Соединения подходят для лечения различных патологий и применимы в качестве антиаритмических активных ингредиентов, для лечения и профилактики предсердной аритмии, например фибрилляции предсердий (ФП) или трепетания предсердий. Калиевые каналы представляют собой широко распространенные мембранные белки, которые вследствие своего влияния на мембранный потенциал клетки играют важную роль во многих физиологических процессах. В рамках ряда классов калиевых каналов различие проводится на основе их молекулярной структуры между тремя большими группами, которые характеризуются числом трансмембранных доменов (2, 4 или 6). Группа калиевых каналов с четырьмя трансмембранными сегментами отличается от двух других тем, что каждый их представитель имеет двухпоровые домены, вследствие чего эти каналы обозначают также как каналы K2P (Coetzee W.J. et al.; Molecular diversity of K+ channels; Ann. NewYork Acad. Sci. 1999 (868), 233-285). В функциональной терминологии каналы K2P характеризуются проходящими через них токами утечки или "фоновыми" токами, которые имеют большое значение для мембранного потенциала покоя и, следовательно, возбудимости нервных или мышечных клеток. Среди каналов K2P особый интерес представляет семейство TASK каналов (тандем Р доменов в слабом канале K+ внутреннего выпрямления, связанных с [TWIK] кислоточувствительных каналов K+),которые включают подтип TASK-1, TASK-3 и TASK-5 (D.A. Bayliss, P. Barrett, Trends in PharmacologicalSciences, 2008, 29(11), 566-575). Другими терминами, используемыми в литературе для генов предрасположенности, являются KCNK3 или K2P3,1 (TASK-1), KCNK9 или K2P9,1 (TASK-3) и KCNK15 илиK2P15,1 (TASK-5). Самую высокую гомологию в рамках данного семейства отмечают для каналовTASK-1 и TASK-3, у которых идентичность аминокислот составляет более 50%. Димеризация каналовK2P приводит к образованию функциональных калиевых каналов, состоящих из четырех субъединиц поры. Потоки, проходящие через эти каналы, именуются в литературе как поток IKso. В дополнение к гомодимеризации, например, двух TASK-1 или двух TASK-3 белков в данном контексте также возможна гетеродимеризация TASK-1 и TASK-3 (Berg A.P., Talley E.M., Manger J.P., Bayliss D.A.; MotoneuronsTASK-3 (KCNK9) subunits; J. Neuroscience 2004 (24), 6693-6702). Каналы TASK примечательны, в частности, своей очень сильной зависимостью от внеклеточного рН в физиологическом диапазоне (pK приблизительно 6,5-7,5). Каналы ингибируются при кислотном показателе рН и активируются при щелочном показателе рН. Вследствие такой рН-зависимости, каналамTASK присваивают физиологическую функцию сенсора, который транслирует малые изменения внеклеточного рН в соответствующие клеточные сигналы EMBO J. 1997 (16), 5464-5471; Patel A.J., Honore E.;TASK-1 мыши с нокаутом показывают слабовыраженный фенотип, представленный в описании в целом здоровым и демонстрирует нормальное поведение при размножении (Journal of NeuroscienceTASK-1 экспрессируется в головном мозге и также в спинальных ганглиях и некоторых периферических тканях, например поджелудочной железе, плаценте, матке, легком, сердце, почке, тонком кишечнике и желудке. Кроме того, TASK-1 был обнаружен в хемочувствительных клетках стволовой части головного мозга и сонном гломусе, а также мотонейронах подъязычного нерва Mol. Brain Res. 2001 (86),101-114). Электрические токи, индуцированные калиевыми каналами TASK-1, были обнаружены в мотонейронах подъязычного нерва, двигательного черепно-мозгового нерва, обладающего наиважнейшей функцией поддержания верхних дыхательных путей и голубого пятна. Выявлено, что каналы TASK-1 участвуют в регуляции дыхания в респираторных нейронах стволовой части мозга, каротидных тельцах и мотонейронах подъязычного нерва, а также в нейроэпителиальных клетках легкого. В случае недостаточного дыхания (гипоксии, пространственно-затрудненном дыхании) и в случае физического стресса либо вследствие повышения концентрации CO2, либо возникающего ацидоза, либо вследствие кислотных метаболитов происходит понижение рН и, таким образом, блокировка рН-зависимых каналовTASK-1. Это приводит к деполяризации клеток, вследствие этого происходит активация нейронов, участвующих в регуляции дыхания. J. Physiol. 2000 (525), 135-142; Bayliss D.A., Talley E.M., Sirois J.E., Leineurons; Respiration Physiology 2001 (129), 159-174). Повышение активности хемочувствительных нейронов в сочетании с активацией мотонейронов подъязычного нерва посредством блокировки канала TASK-1 может стимулировать дыхание и одномоментно стабилизировать верхние дыхательные пути для их защиты от коллапса и непроходимости. Кроме того, храп можно ингибировать посредством стабилизации верхних дыхательных путей посредством повышения активности фарингеальных мышц. Блокировка ионных каналов TASK-1 находит, таким образом, применение в лечении дыхательных расстройств, например приступов апноэ во сне (Brendel, J.;Goegelein, H.; Wirth, K.; Kamm, W., WO 2007/124849). На культивированных зернистых клетках мозжечка было показано, что генетическая инактивация каналов TASK приводит к нейропротективному действию (Lauritzen I., Zanzouri M., Honore Е., Duprat F.,Ehrengruber M.U., Lazdunski M., Patel A.J.; K+-dependent cerebellar granule neuron apoptosis - Role of Taskleak K+ channels; J. Biol. Chem. 2003 (278), 32068-32076). Также показано, что каналы TASK-1 ответственны за программируемую гибель клеток (апоптоз) в зернистых клетках и что гибель клеток можно предотвратить блокированием TASK-3. Таким образом, разработка особых ингибиторов каналовTASK-1/3 может быть применима для лечения нейродегенеративных нарушений (Patel A.J.,Lazdunski M., The 2P-domain K+ channels: role in apoptosis and tumorigenesis, Pflugers Arch. 2004 (448),261-273). Отмечено, что TASK-1 имеет отношение к установлению мембранного потенциала покоя и сохранению равновесия возбудимости нейрона, которая экспрессируется на Т-клетках и нейронах и является ключевым модулятором иммунитета и нейродегенерации Т-клетки в воспалении аутоиммунной центральной нервной системы. После индуцирования экспериментального аутоиммунного энцефаломиелита, экспериментальной модели, имитирующей рассеянный склероз, TASK-1(-/-) мыши показали существенное снижение тяжести клинического течения и заметное снижение аксональной дегенерации по сравнению с контрольными группами дикого типа. Т-клетки TASK-1(-/-) мышей продемонстрировали замедленную Т-клеточную пролиферацию и получение цикотина, в то время как иммунный репертуар является нормальным. В дополнение к этим эффектам на системные ответы Т-клетки, TASK-1 проявляет независимый нейропротективный эффект, который был демонстрирован с использованием четко приготовленных срезов головного мозга, сокультивированных с активированными Т-клетками, а также экспериментов in vitro культивирования с изолированными зрительными нервами. Превентивная блокировка TASK-1 значительно улучшила экспериментальный аутоиммунный энцефаломиелит после иммунизации и значительно снизила тяжесть течения заболевания и оказалась способна снизить прогрессирующую потерю объема паренхимы мозга согласно оценке магнитнорезонансной томографии. Таким образом, блокаторы TASK-1 являются потенциальными соединениями,применимыми для терапии воспалительных и дегенеративных расстройств центральной нервной системы (Bittner Stefan; Meuth Sven G.; Gobel Kerstin; Melzer Nico; Herrmann Alexander M.; Simon Ole J.;TASK-1, член семейства калиевого канала с двухпоровым доменом (K2P), в недавнем времени возник в качестве цели для фармакологического лечения фибрилляции предсердий. (K2P) калиевые каналы с двухпоровым доменом выступают в качестве связующего звена между фоновыми калиевыми токами,стабилизируя мембранный потенциал покоя и ускоряя потенциал действия реполяризации. В сердце каналы TASK-1 показали свою роль в сердечной реполяризации (Basic Res Cardiol. 2011 Jan; 106(1):75-87,Putzke С., Wemhoner K., Sachse F.B., Rinne S., Schlichthorl G., Li X.T., Jae L., Eckhardt I., Wischmeyer E.,Wulf H., Preisig-Muller R., Daut J., Decher N. (2007), Cardiovascular Research, 75: 59-68). Фибрилляция предсердий (ФП) и трепетание предсердий являются чрезвычайно распространенным нарушением сердечного ритма, вызывающим существенное повышение частоты заболеваемости и повышение процента смертности (Journal of Clinical Invest. 2011; 121(8): 2955-2968). Доступные в настоящее время терапевтические подходы имеют значительные ограничения, включая ограниченную эффективность и потенциально серьезные побочные эффекты, такие как индуцирование злокачественной желудочковой аритмии или отрицательные инотропные эффекты. Вероятность возникновения ФП увеличивается с возрастом и часто приводит к летальным последствиям, таким как инсульт. Антиаритмические препараты класса I и III, используемые в настоящее время, снижают периодичность возникновения ФП,но их используют лишь в определенных пределах ввиду их потенциальных проаритмогенных побочных эффектов и ограниченной эффективности. Прогрессирующее возрастание возникновения ФП подчеркивает важность определения подходящего лечения, в особенности лекарственных средств, являющихся безопасными, эффективными и связанными с усовершенствованными клиническими исходами. Показано, что в фибрилляции и трепетании предсердий механизм повторного входа возбуждения играет важную роль в индуцировании и сохранении аритмии. Такое круговое движение импульса или волн возбуждения возникает тогда, когда сердечная ткань имеет низкую скорость проведения импульса и одновременно короткие рефрактерные периоды. Увеличение миокардиального рефрактерного периода посредством продления потенциала действия является признанным механизмом для остановки аритмии и профилактики ее развития (Т.J. Colatsky et al., Drug Dev. Res. 19, 1990, 129-140; "Potassium channels astargets for antiarrhythmic drug action"). Длительность потенциала действия главным образом определяется степенью реполяризации токов K+, вытекающих из клеток через различные каналы K+. TASK-1 представляет собой один из таких реполяризующих калиевых токов. Его ингибирование продлевает потенциал действия и, вследствие этого, рефрактерность. Большинство известных антиаритмических препаратов класса III (например, дофетилид, Е 4031 и д-соталол) блокируют преимущественно или исключительно быстро активирующий калиевый канал IKr,который может быть обнаружен как в клетках желудочка человека, так и предсердии. Выяснилось, что эти соединения несут в себе повышенный проаритмогенный риск при частоте сердечных сокращений,являющийся низкой или нормальной, и в частности были обнаружены случаи аритмии, обозначаемые как "torsades de pointes" (D.M. Roden, Am. J. Cardiol. 72, 1993, 44B-49B; "Current status of class IIIantiarrhythmic drug therapy"). Кроме данного проаритмогенного риска, было обнаружено снижение терапевтической эффективности блокаторов IKr в условиях тахикардии (электрического ремоделирования при предсердной тахикардии). Было показано, что экспрессия TASK-1 в сердце человека ограничена предсердием с отсутствием или очень слабой степенью экспрессии в желудочке. Еще одним преимуществом является то, что экспрессия TASK-1 не снижается, но даже немного повышается у пациентов с фибрилляцией предсердий по сравнению с пациентами с синусовым ритмом, в отличие от этого у пациентов с фибрилляцией предсердий отмечено снижение экспрессии других предсердных каналов K+ по сравнению с пациентами с синусовым ритмом: см. например, Basic. Res. Cardiol. 2003, 98, 137-148; Brundel B.J.J.M. et al., JACC 2001, 37,926-932). Таким образом, TASK-1, тем не менее, находит выражение в целевом контингенте больных(Journal of Molecular Medicine 2004, 308-316; European Journal of Physiology 2005, 450, 201-208,WO 2005/016965; Ellinghaus P. et al., J. Thoracic Cardiovascular Surgery, 2005, 129, 1383-1390). Несмотря на огромное физиологическое значение каналов TASK, на данный момент в литературе известно очень мало фармакологических модуляторов этих каналов. Отмечалось, что активация канала TASK-1 может быть достигнута посредством терапевтической концентрации ингаляционных анестетиков-галотана и изофлурана (Patel A.J., Honore E., Lesage F.,Fink M., Romey G., Lazdunski M.; Inhalational anesthetics activate two-pore-domain background K+ channels;Nature Neurosci. 1999 (2), 422-426). Кроме того, некоторые блокаторы Kv1,5, которые также ингибируют канал TASK-1, описаны в существующем уровне техники (Brendel, J.; Goegelein, H.; Wirth, K.; Karam, W.,WO 2007/124849, Brendel, J.; Englert, H.C.; Wirth, K.; Wagner, M.; Ruxer, J.-M.; Pilorge, F.,WO 2006/136304). Указывалось, что 1899, ранее описанный блокатор Kv1,5 (Peukert, S., Brendel, J.,Pirard, В., Brueggemann, A., Below, P., Kleemann, H.-W., Hemmerle, H., Schmidt, W.; Identification,Synthesis, and Activity of Novel Blockers of the Voltage-Gated Potassium Channel Kvl.5; Journal of Medicinalthe Structure of the TASK-1 Open Pore; Journal of Biological Chemistry (2011), 286(16), 13977-13984). Также арахидонамид анандамид (эндогенный лиганд каннабиноидного рецептора) и его метанандамидный гомолог описаны в качестве блокаторов TASK-1 (Maingret F., Patel A.J., Lazdunski M., Honore E.; Theendocannabinoid anandamide is a direct and selective blocker of the background K+ channel TASK-1; EMBO J. 2001 (20), 47-54). Отмечается, что доксапрам, используемый для лечения дыхательных расстройств, является блокатором (Cotten J.F., Keshavaprasad В., Laster M.J., Eger E.I., Yost C.S.; The Ventilatory StimulantAlveolar Anesthetic Concentration; Anesth. Analg. 2006 (102) 779-785). Таким образом, задачей настоящего изобретения является обеспечение эффективных ингибиторовTASK-1, пригодных для лечения и профилактики состояний, связанных с TASK-1. Настоящее изобретение относится к блокаторам TASK-1 формулы I где А представляет собой фенил или пиридил, необязательно замещенные 1 или 2 заместителями,независимо выбранными из F, Cl, Br, (С 1-С 6)алкила, (C1-C6)алкилокси-, NC- или R12R13N-C(О)-, где один или несколько атомов водорода алкильного радикала могут быть замещены атомами фтора;R1 представляет собой R10-C(O)-, R11-(C1-C6)алкил-, (С 3-С 6)циклоалкил или (C1-C6)алкил-SO2-, где один или несколько атомов водорода алкильного радикала могут быть замещены атомами фтора;R5 представляет собой Н; каждый из R6-R9 независимо выбран из Н, F, Cl, Br, NC-, (C1-C6)алкила, (С 3-С 6)циклоалкила,(C1-C6)алкилокси- и (C1-C6)алкил-S- при условии, что две группы из R6-R9 представляют собой Н, где один или несколько атомов водорода алкильного радикала могут быть замещены атомами фтора;(C1-C6)алкил,(С 3-С 6)циклоалкил,(С 1-С 6)алкилокси-,(C1-C6)алкил-О-(C1-C6)алкил- или R12R13N-, где один или несколько атомов водорода алкильного радикала могут быть замещены атомами фтора,R11 представляет собой Н, (С 3-С 6)циклоалкил или (C1-C6)алкилокси-, где один или несколько атомов водорода алкильного радикала могут быть замещены атомами фтора; каждый из R12 и R13 независимо представляет собой Н или (C1-C6)алкил; и/или из стереоизомерной формы соединения формулы I и/или смесей этих форм и/или физиологически переносимой соли соединений формулы I. Среди упомянутых соединений формулы I, являющихся объектом настоящего изобретения, могут быть соединения, полученные из соединений формулы I, где А представляет собой фенил или пиридил, необязательно замещенные 1 или 2 заместителями, независимо выбранными из F, Cl, (C1-C4)алкилокси-, (С 1-С 4)алкила и NC-,где один или несколько атомов водорода алкильного радикала могут быть замещены атомами фтора;R5 представляет собой Н; каждый из R6-R9 независимо выбран из Н, F, Cl, Br, NC-, (C1-C4)алкила, циклопропила,(C1-C4)алкилокси- и (С 1-С 4)алкил-S- при условии, что две группы из R6-R9 представляют собой Н, где один или несколько атомов водорода алкильного радикала могут быть замещены атомами фтора;R11 представляет собой Н, циклопропил или (C1-C4)алкилокси-, где один или несколько атомов водорода алкильного радикала могут быть замещены атомами фтора,каждый из R12 и R13 независимо представляет собой Н или (C1-C4)алкил; и/или их стереоизомерные формы и/или смеси этих форм и/или физиологически переносимые соли соединений формулы I. Среди упомянутых соединений формулы I, являющихся объектом настоящего изобретения, могут быть соединения, полученные из соединений формулы I, где А представляет собой фенил или пиридил, необязательно замещенные 1 или 2 заместителями, независимо выбранными из F, C1, метокси, этокси, метила, этила, NC-, CF3O- или CF3;R3 представляет собой Н или метил; каждый из R4 и R5 представляет собой Н; каждый из R6-R9 независимо выбран из Н, F, Cl, Br, NC-, метила, этила, циклопропила, метокси,этокси, метил-S-, этил-S-и CF3 при условии, что две группы из R6-R9 представляют собой Н;R11 представляет собой Н, циклопропил, метокси, этокси или CF3; каждый из R12 и R13 независимо представляет собой Н, метил или этил; и/или их стереоизомерные формы и/или смеси этих форм и/или физиологически переносимые соли соединений формулы I. Среди упомянутых соединений формулы I, являющихся объектом настоящего изобретения, могут быть соединения, полученные из соединений формулы I, где А представляет собой фенил или пиридил, необязательно замещенные 1 или 2 заместителями, независимо выбранными из F, Cl, метокси, метила, NC-, CF3O-, CF3;R2 представляет собой ОН или метокси;R7 и R8 независимо выбраны из H, F, Cl, Br;R11 представляет собой Н, циклопропил, метокси или CF3; и/или их стереоизомерные формы и/или смеси этих форм и/или физиологически переносимые соли соединений формулы I. Алкильные радикалы имеют от 1 до 6, например от 1 до 4, атомов углерода и могут быть неразветвленной или разветвленной цепью. Алкильные радикалы могут также иметь от 1 до 4 атомов углерода и могут быть, если они замещены или присутствуют в других радикалах, например в радикале алкилокси(радикале алкокси) или во фторированном алкильном радикале. Примерами алкильных радикалов являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил. Один или несколько, например 1, 2, 3, 4, 5, 6, 7, 8 или 9, атомов водорода алкильных радикалов могут быть заменены атомами фтора. Примерами фторированных алкильных радикалов являются CF3, CF2H и CFH2. Замещенные алкильные радикалы могут быть замещены в любых позициях. Примерами радикалов алкилокси являются метокси и этокси. Эти объяснения в отношении алкильных радикалов соответственно применимы к алкильным радикалам, которые при определении группы в соединениях формулы I соединены с двумя соседними группами или связаны с двумя группами и могут считаться двухвалентными алкильными радикалами (радикалами алкандиола, радикалами алкилена), как в случае алкильной части замещенной алкильной группы, например группы (C1-C6)алкилокси-(C1-C6)алкил- или группы R11-(C1-C6)алкил-, в которых группы, и аналогично в других группах, концевое тире означает свободную связь, посредством которой соединена группа, и, таким образом, указывает, посредством какой подгруппы соединена группа, образованная из подгрупп. Таким образом, такие радикалы могут быть также с неразветвленной или разветвленной цепью, связи с соседними группами могут находиться в любых позициях и могут начинаться с одного и того же атома углерода или с разных атомов углерода, и они могут быть незамещенными или замещены заместителями фтора, независимо от любых других заместителей. Примерами таких двухвалентных алкильных радикалов являются метилен, 1,1-этилен, 1,2-этилен, 1,1-пропилен,1,2-пропилен, 2,2-пропилен, 1,3-пропилен, 1,1-бутилен, 1,4-бутилен и т.д. Примерами циклоалкильных радикалов, имеющих от 3 до 6 атомов С, являются циклопропил, циклобутил,1-метилциклопропил-,2-метилциклопропил-,циклобутил,2-метилциклобутил-,3-метилциклобутил-, циклопентил, 2-метилциклопентил-, 3-метилциклопентил-, циклогексил и т.д. Если радикал является двузамещенным или трехзамещенным, заместители могут быть одинаковыми или различными. Если соединения формулы I содержат одну или несколько основных групп или один или несколько основных гетероциклов, изобретение также включает соответствующие физиологически приемлемые соли, включая трифторацетаты, в особенности фармацевтически приемлемые соли. Таким образом, соединения формулы I, имеющие одну или несколько основных, т.е. способных к протонированию, групп или содержат одно или несколько основных гетероциклических колец, также можно использовать в форме их физиологически переносимых кислотно-аддитивных солей с неорганическими или органическими кислотами, например, как гидрохлориды, фосфаты, сульфаты, метансульфонаты, ацетаты, лактаты, малеаты, фумараты, малеаты, глюконаты и т.д. Соли можно получать из соединений формулы I по общепринятым процедурам, например, посредством соединения с кислотой в растворителе или дисперсанте или также посредством анионного обмена из других солей. Соединения формулы I могут также быть депротонированы на кислотной группе и быть использованы, например, в качестве солей щелочных металлов, в одном из вариантов осуществления в качестве солей натрия или калия или в качестве аммонийных солей, например в качестве солей с аммиаком или органическими аминами или аминокислотами. В дополнительном варианте осуществления настоящего изобретения соединения общей формулы I,как описано выше, включены в настоящий документ при условии, что 1-[1-1R,2R)-4,6-дифтор-2 гидроксииндан-1-ил)-3-(2-фтор-5-метоксифенил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанон,1-[1-1S,2S)-4,6-дифтор-2-гидроксииндан-1-ил)-3-(3-трифторметоксифенил)-1,4,6,7 тетрагидропиразоло[4,3-с]пиридин-5-ил]этанон,3-[5-ацетил-1-1R,2R)-4,6-дифтор-2-метоксииндан-1 ил)-4,5,6,7-тетрагидро-1 Н-пиразоло[4,3-с]пиридин-3-ил]бензонитрил и 1-[1-1R,2R)-4,6-дифтор-2 метоксииндан-1-ил)-3-(4-фторфенил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанон не включены. В дополнительном варианте осуществления настоящего изобретения соединения общей формулы I,как описано выше, включены в настоящее описание при условии, что 1-[1-1R,2R)-4,6-дифтор-2 гидроксииндан-1-ил)-3-(2-фтор-5-метоксифенил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанон,1-[1-1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-3-(3-трифторметоксифенил)-1,4,6,7 тетрагидропиразоло[4,3-с]пиридин-5-ил]этанон,3-[5-ацетил-1-1R,2R)-4,6-дифтор-2-метоксииндан-1 ил)-4,5,6,7-тетрагидро-1 Н-пиразоло[4,3-с]пиридин-3-ил]бензонитрил и 1-[1-1R,2R)-4,6-дифтор-2 метоксииндан-1-ил)-3-(4-фторфенил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанон не включены. Среди упомянутых соединений формулы I, являющихся объектом настоящего изобретения, могут быть соединения, полученные из соединений формулы I, где А представляет собой фенил, заместивший остаток, выбранный из Cl, NC- или CF3, например, в мета-позиции;R7, R9 являются независимо выбранными из F и Cl;R10 представляет собой метил, этил, изопропил, циклопропил; и/или их стереоизомерные формы и/или смеси этих форм и/или физиологически переносимые соли соединений формулы I. Соединения формулы I могут существовать в стероизомерных формах. Присутствующими центрами асимметрии могут независимо друг от друга иметь конфигурацию S или конфигурацию R. Изобретение включает все возможные стереоизомеры, например энантиомеры или диастереомеры, и смеси двух или более стереоизомерных форм, например энантиомеров и/или диастереомеров, в любых соотношениях. Изобретение, таким образом, включает, например, энантиомеры в энантиомерочистой форме как в качестве левовращающих, так и в качестве правовращающих антиподов и в форме смесей двух энантиомеров в различных соотношениях или в форме рацематов. Отдельные стереоизомеры можно, по желанию, получать посредством фракционирования смеси общепринятыми способами или, например, посредством стереоселективного синтеза. В дополнительном варианте осуществления молекула 1,4,6,7-тетрагидропиразоло[4,3-с]пиридина в соединениях формулы I и остаток R2 имеют трансконфигурацию в соединениях формулы I. Для получения соединений формулы I можно использовать следующие способы. В различных описанных химических процессах остатки R1, R2, R3, R6, R7, R8, R9 и А имеют такое же значение, которое определено в соединениях формулы I, при условии, что не упоминается конкретное определение соответствующего остатка. В следующих схемах реакции остатки R4 и R5 являются атомами водорода. Однако эти реакции можно аналогичным образом проводить с соединениями, где R4 и R5 имеют указанное выше значение, за исключением водорода. Получение различных промежуточных соединений 4,5,6,7-тетрагидро-1 Н-пиразоло[4,3-с]пиридина можно осуществить в соответствии со схемой 1 (способ А) после ранее описанного синтеза(ЕР 0086422 А 2). Синтез применим к большому разнообразию различных групп А. Таким образом, начиная с коммерчески доступного 1-ацетил-4-пиперидона получают 1-(4-морфолин-4-ил-3,6-дигидро-2 Нпиридин-1-ил)этанон (енамин 1). Таким образом, морфолин добавляют к раствору 1-ацетил-4 пиперидона в присутствии моногидрата паратолуолсульфоновой кислоты (каталитическая PTSA). После ацилирования с коммерчески доступными ацилхлоридами, за которым следует кислотно-водный гидролиз, получают дикетоны 2, и они могут быть подвергнуты замыканию кольца с гидразингидратом для получения соответствующих различных промежуточных соединений 4,5,6,7-тетрагидро-1 Нпиразоло[4,3-с]пиридина 3. Ацилхлориды могут быть альтернативно получены стандартными процедурами из соответствующих кислот, например, посредством взаимодействия с тионилхлоридом в присутствии каталитического количества ДМФА (см., например, Dalisay, D.S.; Quach, Т.; Nicholas, G.N.; Molinski, T.F., AngewandteChemie, International Edition, 2009, vol. 48, 4367-4371). Если А является гетероарилом, то иногда можно использовать альтернативный синтез, как показано на схеме 1 (способ В). Таким образом, начиная с коммерчески доступных кислот смешанные ангидриды образуются посредством взаимодействия с изобутилхлороформиатом. 1-ацетил-4-пиперидон 1-(4-морфолин-4-ил-3,6 дигидро-2 Н-пиридин-1-ил)этанон может быть депротонирован такими сильными основаниями, как литий гексаметилдисилазид, и введен в реакцию со смешанным ангидридом, описанным выше. Дикетоны 2 получены и могут быть подвергнуты замыканию кольца гидразингидратом для получения соответствующих различных промежуточных соединений 4,5,6,7-тетрагидро-1 Н-пиразоло[4,3-с]пиридина 3. Вторые промежуточные соединения, требуемые для синтеза описанных блокаторов TASK-1, можно получать посредством эпоксидирования различных замещенных инденов 5, как показано на схеме 2, соблюдая последовательность реакции, как опубликовано ранее (WO 2010/025856, в особенности на с. 114-117). Индены могут быть либо приобретены коммерчески, либо синтезированы в короткой последовательности, начиная с индан-1-онов. Таким образом, происходит снижение выхода борогидрида натрия в соответствующих индан-1-олах 4. После изъятия воды, например, посредством нагревания в толуоле в присутствии каталитического количества моногидрата паратолуолсульфоновой кислоты получают соответствующие индены 5. Эпоксидирование можно проводить энантиоселективным способом в соответствии со стадиями реакции А или В на схеме 2 с использованием катализатора Якобсена, который является коммерчески доступным (Larrow, Jay F.; Roberts, Ed; Verhoeven, Thomas R.; Ryan, Ken M.;Senanayake, Chris H.; Reider, Paul J.; Jacobsen, Eric N., Organic Syntheses (1999), 76). Для стадии реакции A(S,S)-катализатор Якобсена, для реакции В (R,R)-катализатор Якобсена используют вместе с 4-(3-фенилпропил)пиридин N-оксидом. Альтернативно рацемические эпоксиды можно получать с использованием метахлорпербензойной кислоты в качестве реагента (стадия реакции С). Другой подход представляет собой 2-стадийное окисление с помощью N-бромсукцинимида после изъятия HBr с помощью NaOH (стадия реакции D). Другие промежуточные соединения можно получать посредством алкилирования индан-1-онов, как показано на схеме 3 (согласно Mahapatra, Tridib; Jana, Nandan; Nanda, S, Tetrahedron: Asymmetry (2008),19(10), 1224-1232). Например, после депротонирования таким сильным основанием, как диизопропиламид лития, и взаимодействия с такими электрофилами, как галогениды алкила, например,формулы R3I, доступны замещенные производные 7. После уменьшения до замещенных 2-алкил-индан 1-олов 8 боргидридом натрия и изъятия нагреванием в толуоле получают 2-алкил-1 Н-индены 9 в присутствии каталитического количества моногидрата паратолуолсульфоновой кислоты, который может быть подвергнут различным процедурам эпоксидирования, как описано выше для получения эпоксидов 10. Для получения рацемических эпоксидов подходящим является, например, добавление метахлорпербензойной кислоты в качестве реагента. Схема 3 Выявлено, что промежуточные соединения 4,5,6,7-тетрагидро-1 Н-пиразоло[4,3-с]пиридина 3 могут успешно вступать в реакцию с эпоксидами, описанными выше для получения 2-гидроксииндан-1-илзамещенного 4,5,6,7-тетрагидро-1 Н-пиразоло[4,3-с]пиридина 11, как показано на схемах 4-6. Таким об-8 023648 разом, посредством нагревания смеси промежуточных соединений 4,5,6,7-тетрагидро-1 Н-пиразоло[4,3 с]пиридина 3 и эпоксидов 6 в присутствии избытка основания, например K2CO3 в инертном растворителе, таком как CH3CN, можно получать соединения 11. Альтернативно, возможным является депротонирование соединений 3 с такими сильными основаниями, как NaH, и их алкилирование с эпоксидами 6. Схема 4 Более того, было обнаружено, что промежуточные соединения 4,5,6,7-тетрагидро-1 Н-пиразоло[4,3 с]пиридина 3 могут успешно вступать в реакцию типа реакции Мицунобу (Bull. Chem. Soc. Japan, 1967,40, 2380-2382) с аминоиндан-1-олами 4'/8', как показано на схеме 7. Таким образом, посредством нагревания смеси промежуточных соединений 4,5,6,7-тетрагидро-1 Н-пиразоло[4,3-с]пиридина 3 и аминоиндан-1-олов 4'/8' в присутствии фосфина, такого как трин-бутилфосфин, и таких соединений 1,1'-(азодикарбонила), как 1,1'-(азодикарбонил)дипиперидин, были получены соответствующие высокоактивные TASK-1 блокаторы 12. Определение остатка R2 в соединениях 4' и 8', использованных в реакции, например, не содержит гидроксильной группы. Например, R2 является Н или (C1-С 6)алкилом, (C1-C6)алкилокси, (C1-C6)алкил-С(О)O- группой. Соединение 4' и 8', где R2 является (C1-C6)алкилом, (C1-C6)алкилокси или (C1-C6)алкил-С(О)О- группой, можно получать по аналогии со схемами 2 и 3. Схема 7 Группа R1 может варьироваться синтетически, как показано на схеме 8. Расщепление N-ацетильной группы можно осуществить посредством нагревания кислотного водного раствора соединений 11/12,например, в смеси этанола и 2 н. водного HCl. Соответствующие амины 13 можно модифицировать различными способами, например посредством ацилирования, как показано на схеме 9, в инертном растворителе, таком как CH2Cl2, и в присутствии такого основания, как триэтиламин. Обнаружено, чтоN-ацилатные соединения 14 являются высокоактивными блокаторами TASK-1. Когда R2 представляет собой ОН, иногда двухацильные соединения 15 можно также изолировать как побочный продукт, обнаружено, что они также являются блокаторами TASK-1. В случаях, когда А содержит группу CN (цианогруппу, NC-), такую группу можно частично преобразовать в карбоксамидную группу. Эти побочные продукты можно легко разделить. Алкилирование гидроксильной группы в соединениях 11, где R3 является, например, водородом,можно осуществить согласно схеме 10. Например, после депротонирования с таким сильным основанием, как гексадиметилдисилазид натрия или NaH, и последующего алкилирования с галогенидами алкила(R-Hal, где R является (C1-C6)алкилом) получают алкоксисоединения 16, которые, как обнаружено, являются активными блокаторами TASK-1. Схема 10 Группу R1 можно варьировать дополнительно и преобразовывать в новые уретановые соединения 17, как показано на схеме 11, например, посредством реакции соединений 13 с алкилхлороформиатами в инертном растворителе, таком как CH2Cl2, в присутствии такого основания, как триэтиламин, где остатком R является (С 1-С 6)алкильная группа. Группу R1 можно варьировать в новые амины 18, как показано на схеме 12, например, посредством взаимодействия соединений 13 с незамещенными или замещенными галогенидами алкила в инертном растворителе, таком как CH3CN или ДМФА, в присутствии такого основания, как триэтиламин. Подходящими галогенидами алкила являются соединения формулы R1-Hal, где R1 выбран из остатковR11-(C1-С 6)алкил-. Другие способы можно использовать в качестве восстановительного аминирования с альдегидами (для обзора см. Е.W. Baxter and А. В.Reitz, Organic Reactions, 1, 59, 2002). Схема 12 Алкильные группы R можно вводить в соединения, начиная с соединений 11'/12', в которых одна из групп R5, R6, R7, R8 является галогеном, например бромом, согласно схеме 13. Остатком R1 соединений 11' и 12' является, например, R10-C(O)-, в особенности СН 3-С(O)-. Например, после обработки тетралкилоловом (SnR4, где R4 представляет собой (C1-C6)алкильную группу) в инертных растворителях при высокой температуре в присутствии катализатора, например тетракис-(трифенилфосфин)палладия(0)Communications (1987), (20), 1528-30), можно получать новые алкилзамещенные соединения 19, которые являются активными блокаторами TASK-1. Схема 13 Циклопропильные или арильные группы можно вводить с проведением реакции Сузуки(N. Miyaura, A. Suzuki: J. Chem. Soc., Chem. Commun. 1979, S. 866-867) в соединениях, начиная с соединений 11'/12', в которых одна из групп R5, R6, R7, R8 является галогеном, например бромом, согласно схеме 14. Остатком R1 соединений 11' и 12' является, например, R10-C(O)-, в особенности СН 3-С(O)-. Например, после обработки циклопропилбороновой кислотой в инертных растворителях при высокой температуре в присутствии катализатора, например тетракис-(трифенилфосфин)палладия(0) в водномCH3CN с таким основанием, как K2CO3, можно получать новые циклопропилзамещенные соединения 20,которые являются активными блокаторами TASK-1. Галогены или нитрильные группы X можно вводить в соединения, начиная с соединений 11'/12', в которых одна из групп R5, R6, R7, R8 является галогеном, например бромом или йодом, согласно схеме 15. Остатком R1 соединений 11' и 12' является, например, R10-C(O)-, в особенности СН 3-С(O)-. Например,после нагревания CuX в инертном растворителе, например диметилсульфоксиде, при высокой температуре под воздействием микроволн можно получать новые Х-замещенные соединения 21, которые являются активными блокаторами TASK-1. Простые тиоловые эфиры 21' можно иногда изолировать дополнительно как побочные продукты, которые возникают в результате частичного распада растворителя диметилсульфоксида. Эти соединения могут быть блокаторами TASK-1. Схема 15 Группу R1 можно варьировать для получения новых сульфонамидов 23, как показано на схеме 16,например, посредством реакции соединений 13 с алкилсульфонилхлоридом (R-SO2Cl, где R представляет собой (С 1-С 6)алкильную группу) в инертном растворителе, таком как CH2Cl2, в присутствии основания,например триэтиламина. Схема 16(C1-C6)алкильную группу, как показано на схемах 17-18, например, посредством реакции соединений 13 с изоцианатами или поэтапной реакции с фосфогеном и последующим амином (см., например, Journal of Подготовка и, при необходимости, очистка продуктов и/или промежуточных соединений осуществляются общепринятыми способами, такими как экстрагирование, хроматография или кристаллизация и общепринятая сушка. Для получения соединений формулы I реакции, показанные на схемах 8-18, можно проводить в различном порядке. Например, соединения 11/12 получают способом согласно схемам 4-6 или 7. Затем в соединения 11/12 можно ввести определенный остаток с R6 по R9 согласно схемам 13, 14 или 15, при желании можно провести модификацию остатка R2 согласно схеме 10, и необязательно вводится остаток R1 согласно схемам 8, 9, 11, 12, 16, 17 или 18. Там, где в дополнительном варианте осуществления остаток сR6 по R9 вводят до модификации остатка R2. В конкретном варианте осуществления остаток R1 вводят в последнюю очередь. Вследствие ингибирующих свойств TASK-1 соединения формулы I и/или их фармацевтически совместимые соли применимы для предотвращения и лечения расстройств, вызванных активацией или активированным TASK-1, и также расстройств, в которых нарушения, связанные с TASK-1, являются вторичной причиной. Соединения формулы I и/или их физиологически совместимые соли также можно использовать для лечения и профилактики нарушений, в которых TASK-1 требует только частичного ингибирования, например, с использованием уменьшенной дозировки. Соединения формулы I и/или их фармацевтически приемлемые соли можно использовать для получения лекарственных средств с эффектом блокировки канала TASK-1 для терапии и профилактикиTASK-1 канал-опосредованных заболеваний. Соединения формулы I и/или их фармацевтически приемлемые соли можно также использовать для терапии или профилактики аритмии сердца, например случаев аритмии, которые реагируют на изменения формы потенциала действия, в основном продление потенциала действия, индуцированного блокировкой TASK-1. Соединения формулы I и/или их фармацевтически приемлемые соли можно использовать для остановки существующей фибрилляция или трепетания предсердий для восстановления синусового ритма(кардиоверсия). Кроме того, соединения снижают предрасположенность к новому развитию случаев возникновения фибрилляция предсердий, таким образом, соединения пригодны для профилактического лечения посредством поддержания синусового ритма (контроль ритма). Вещества не несут риска вентрикулярного проаритмогенного эффекта (пролонгация QT-интервала и аритмия Torsades de pointe). Соединения формулы I и/или их фармацевтически приемлемые соли можно использовать для получения лекарственного средства для лечения и/или предотвращения аритмии, например, предсердной тахиаритмии, фибрилляции предсердий и трепетания предсердий. Соединения формулы I и/или их фармацевтически приемлемые соли также применимы для получения лекарственного средства для терапии или профилактики дыхательных расстройств во время сна,приступов центрального и обструктивного апноэ во сне, синдрома повышенной резистентности верхних"дыхательных путей, дыхания Чейна-Стокса, храпения, нарушений центральной регуляции дыхания,синдрома внезапной детской смерти, послеоперационной гипоксии и апноэ, респираторных мышечных расстройств, дыхательных расстройств после длительной механической вентиляции легких (отлучение),дыхательных расстройств во время адаптации в высоких горах, острых дыхательных расстройств, хронических легочных расстройств с гипоксией и гиперкапнией, хронического обструктивного заболевания легких (ХОЗЛ) и синдрома гиповентиляции вследствие ожирения. Соединения формулы I и/или их фармацевтически приемлемые соли также применимы в качестве стимулятора дыхания для профилактики и лечения респираторной депрессии, связанной с анестезией или процедурной седации для малых вмешательств или в диагностических целях, для лечения и профилактики респираторной депрессии опиоидами в лечении хронической боли, например при злокачественной опухоли или паллиативной терапии или процедурной седации и/или отлучении от длительной механической вентиляции. Соединения формулы I и/или их фармацевтически приемлемые соли также пригодны для лечения и/или профилактики рассеянного склероза и воспалительных или дегенеративных расстройств центральной нервной системы. Соединения по изобретению формулы I и их фармацевтически приемлемые соли могут, таким образом, быть использованы на животных, например на млекопитающих, в частности на людях, в качестве лекарственных препаратов, применяемых самостоятельно, в смесях друг с другом или в форме фармацевтических препаратов. Таким образом, дополнительным вариантом осуществления настоящего изобретения является фармацевтический препарат или фармацевтическая композиция для предотвращения и лечения расстройств,вызванных активацией или активированным TASK-1, содержащая эффективное количество соединения формулы I и/или его фармацевтически приемлемые соли, вместе с фармацевтически приемлемыми носителями и добавками, отдельно или в комбинации с другими фармакологически активными ингредиентами или лекарственными препаратами. Фармацевтические препараты, как правило, содержат от 0,1 до 90 мас.% соединений формулы I и/или их фармацевтически приемлемых солей. Фармацевтические препараты можно получать способом, известным per se. Для этой цели соединения формулы I и/или их фармацевтически приемлемые соли преобразуют вместе с одним или несколькими твердыми или жидкими фармацевтическими носителями и/или эксципиентами и, при желании, в комбинации с другими фармацевтически активными ингредиентами в подходящую лекарственную форму, которая затем может быть использована в качестве лекарственного препарата в медицине человека или ветеринарии. Лекарственные препараты, содержащие соединение формулы I и/или их фармацевтически приемлемые соли, можно, кроме того, вводить, например, перорально, внутривенно, внутримышечно, подкожно, назально, местно, фаренгиально или ингаляционно, и предпочтительное введение зависит от индивидуального случая, например от конкретного проявления расстройства. Соединения формулы I можно также использовать отдельно или вместе с фармацевтическими эксципиентами, в частности, как в ветеринарии, так и в медицине человека. Лекарственные препараты содержат активные ингредиенты формулы I и/или их фармацевтически приемлемые соли в обычном количестве от 0,01 мг до 1 г на единицу дозы. Эксципиенты, которые являются подходящими для требуемого фармацевтического состава, хорошо известны квалифицированному специалисту в данной области техники. Помимо растворителей, гелеобразователей, основ суппозиториев, эксципиентов таблеток и других носителей активных веществ возможно использовать, например, антиоксиданты, дисперсанты, эмульгаторы, противовспениватели, маскирующие вкусоароматические добавки, консерванты, солюбизаторы, агенты для достижения депоэффекта, буферные вещества или красители. Для форм перорального применения активные соединения смешивают с добавками, подходящими для этой цели, такими как носители, стабилизаторы или инертные разбавители, и с помощью общепринятых способов преобразуют их в пригодные лекарственные формы, такие как таблетки, таблетки в оболочке, двойные желатиновые капсулы, водные, спиртовые или масляные растворы. Примерами инертных носителей, которые можно использовать, являются гуммиарабик, магнезия, карбонат магния, фосфат калия, лактоза, глюкоза или крахмал, в особенности кукурузный крахмал. Препарат может быть как в виде сухих, так и влажных гранул. В качестве масляных носителей или в качестве растворителей подходящими являются, например, растительные или животные жиры, такие как подсолнечное масло или жир печени рыбы. Подходящими растворителями для водных или спиртовых растворов являются, например,вода, этанол или сахарные растворы или их смеси. Примерами других эксципиентов также для других форм введения являются полиэтиленгликоли и полипропиленгликоли. Для подкожного, внутримышечного или внутривенного введения активные соединения, используемые при необходимости вместе с обычными для такой цели веществами, такими как солюбилизаторы,эмульгаторы или другие эксципиенты, преобразуют в раствор, суспензию или эмульсию. Соединения формулы I и/или их фармацевтически приемлемые соли могут также быть лиофилизированы, и полученные в результате лиофилизаты могут быть использованы, например, для получения продуктов для инъекций или инфузии. Примерами подходящих растворителей являются вода, физиологический раствор или спирты, например этанол, пропанол, глицерин, а также сахарные растворы, такие как глюкоза или растворы маннита или же смеси различных упомянутых растворителей. Подходящими в качестве фармацевтического состава для введения в форме аэрозолей или спреев являются, например, растворы, суспензии или эмульсии активного ингредиента формулы I или их фармацевтически приемлемые соли в фармацевтически приемлемом растворителе, таком как этанол или вода или смесь таких растворителей. Состав может по требованию содержать также другие фармацевтические эксципиенты, такие как поверхностно-активные вещества, эмульгаторы и стабилизаторы, и газвытеснитель. Такой препарат содержит активный ингредиент обычно в концентрации приблизительно от 0,1 до 10, в частности приблизительно от 0,3 до 3 мас.%. Дозировка для введения активного ингредиента или их фармацевтически приемлемых солей зависит от конкретного случая и обычно для оптимального воздействия должна быть адаптирована в соответствии с обстоятельствами конкретного случая заболевания. Таким образом, она зависит от частоты введения и от силы и продолжительности действия соединений, используемых в каждом случае для терапии или профилактики, но также от типа и тяжести заболевания, подвергаемого лечению, и от пола,возраста, массы тела и индивидуальной восприимчивости человека или животного, подвергаемого лечению, и от того, проводят ли лечение случая острого заболевания или профилактику. Суточная дозировка соединения формулы I и/или его фармацевтически приемлемых солей для пациента с массой тела приблизительно 75 кг составляет обычно по меньшей мере от 0,001 до 100 мг/кг массы тела, например от 0,01 до 20 мг/кг. Еще более высокие дозы могут также потребоваться для острых периодов заболевания, например, в отделении интенсивной терапии. Может потребоваться до 800 мг в сутки. Однократная доза может быть введена сразу полностью или она может быть разделена на многократные приемы, например два, три или четыре однократные дозы. Парентеральное введение путем инъекции или инфузии, например продолжительной внутривенной инфузии, может быть более эффективным, особенно при лечении острых случаев аритмии сердца, например, в отделении интенсивной терапии. Примеры Следующие примеры демонстрируют различные варианты осуществления настоящего изобретения. Пример 1. 1-(4-Морфолин-4-ил-3,6-дигидро-2 Н-пиридин-1-ил)этанон (1). Согласно схеме 1, стадия 1 смесь морфолина (67,85 г, 0,779 моль), 1-ацетил-4-пиперидона (99,95 г,0,708 моль) и моногидрат паратолуолсульфоновой кислоты (0,366 г, 2,1 ммоль) в толуоле (300 мл) нагревали на приборе с насадкой Дина-Старка в течение 16 ч при кипячении с обратным холодильником. Растворители выпаривали в вакууме для получения 149 г 1-(4-морфолин-4-ил-3,6-дигидро-2 Н-пиридин-1 ил)этанона (1), который использовали на следующей стадии без какой-либо дальнейшей очистки. Примеры 2 и 3. 3-(5-Ацетил-4,5,6,7-тетрагидро-1 Н-пиразоло[4,3-с]пиридин-3-ил)бензонитрил (3 а).(1) (6,35 г, 30,2 ммоль) в сухом дихлорметане (30 мл) при 0 С добавляли триэтиламин (3,056 г,30,2 ммоль) и после перемешивания раствора при 0 С в течение 10 мин добавляли 3-цианобензохлорид(5 г, 30,2 ммоль). Смесь перемешивали в течение 45 мин при 0 С, затем смесь оставляли нагреваться до комнатной температуры и перемешивали в течение ночи. Добавляли 5% водный HCl и смесь перемешивали в течение 2 ч. Смесь экстрагировали дихлорметаном и органический слой отмывали водой, фильтровали через небольшой слой силикагеля и испаряли досуха, получая в результате 8 г 3-(1-ацетил-4 оксопиперидин-3-карбонил)бензонитрила (2 а), который незамедлительно использовали на следующей стадии без очистки. К смеси 3-(1-ацетил-4-оксопиперидин-3-карбонил)бензонитрила (2 а) (8 г, 29,6 ммоль) в этаноле(26 мл) при 10 С медленно добавляли гидразингидрат (4,44 г, 88,8 ммоль) в течение 5 мин. Смесь перемешивали 3 ч и оставляли нагреваться до комнатной температуры в течение ночи. Смесь концентрировали до 1/4 ее объема до образования осадка. Суспензию перемешивали в течение 2 ч, охлаждали и фильтровали. Твердое вещество отмывали с помощью небольшого количества этанола. А вторую порцию продукта оставляли для выпадения осадка из фильтрата в течение ночи и объединяли с первой порцией твердого вещества для получения 4,02 г 3-(5-ацетил-4,5,6,7-тетрагидро-1 Н-пиразоло[4,3-с]пиридин-3 ил)бензонитрила (3 а) в виде твердого вещества.Rt=1,20 мин (метод ЖХ 7). Детектированная масса: 267,15 [М+Н+]. Промежуточные соединения в табл. 1 получали согласно схеме 1, соблюдая последовательность реакций в соответствии с синтезом (3 а).(183 мл) при 0 С порционно добавляли NaBH4 (3,67 г, 97,0 ммоль), а затем смесь перемешивали при комнатной температуре в течение 18 ч. После испарения растворителей в вакууме к остатку добавляли воду, раствор экстрагировали 3 раза этилацетатом, затем добавляли 2 н. водный HCl и объединенные органические слои отмывали насыщенным водным NaHCO3 и водой. После сушки над Na2SO4 и фильтрации растворители выпаривали в вакууме для получения 10,0 г 4-бром-6-фториндан-1-ола (4 а), который незамедлительно использовали на следующей стадии без очистки. Согласно схеме 2 стадия 2 смесь 4-бромо-6-фториндан-1-ола (4 а) (10,0 г, 43,3 ммоль) и моногидрата паратолуолсульфоновой кислоты (372 мг, 2,16 ммоль) в толуоле нагревали при кипячении с обратным холодильником в течение 2,5 ч. Раствор отмывали водным насыщенным NaHCO3 и насыщенным солевым раствором, сушили над MgSO4 и испаряли растворители для получения 9,0 г 7-бром-5-фтор-1 Ниндена (5 а), который незамедлительно использовали на следующей стадии без очистки. Согласно схеме 2, стадия I/II получение буферного раствора гипохлорита натрия осуществляли следующим образом. К 383 мл воды добавляли 67,5 мл коммерческого раствора NaOCl (10-13% свободного хлора) и рН корректировали до 11,3 путем добавления небольшого количества NaH2PO4. Раствор хранили при 4 С в течение 24 ч. К раствору 9 г (42,3 ммоль) 7-бром-5-фтор-1 Н-индена (5 а) в CH2Cl2 при 0 С добавляли хлорид(S,S)-(+)-N,N'-бис-(3,5-ди-трет-бутилсалицилиден)-1,2-циклогександиаминомарганца(III) (катализатор Якобсена; 1,2 г, 1,7 ммоль) и 4-(3-фенилпропил)пиридин N-оксид (1,8 г,8,5 ммоль). После перемешивания в течение 15 мин при 0 С добавляли холодный буферный раствор гипохлорита натрия и смесь перемешивали при 0 С в течение 3 ч. Полученные в результате слои жидкости разделяли и водный слой экстрагировали 3 раза с помощью CH2Cl2. Объединенные органические слои отмывали насыщенным солевым раствором и сушили над MgSO4. Растворители выпаривали и неочищенный продукт очищали с помощью силикагелевой хроматографии (с извлечением от 5 до 50% этилацетата в гептане). Продукт повторно кристаллизовали из гептана для получения 3,2 г (1aS,6aR)-5-бром 3-фтор-6,6 а-дигидро-1 аН-1-оксациклопропа[а]индена (6 а) в виде белых игольчатых кристаллов.H-ЯМР (d6-ДМСО):(м.д.) 2,9 (м, 1 Н); 3,0 (м, 1 Н); 4,26 (т, 1 Н); 4,47 (дд, 1 Н); 7,4 (дд, 1 Н); 7,5 (дд,1 Н). Промежуточные соединения в табл. 2 получали согласно схеме 2, соблюдая последовательность реакций в соответствии с синтезом (6 а). Таблица 2 Промежуточное соединение в табл. 3 получали согласно схеме 2, соблюдая последовательность реакций в соответствии с синтезом (6 а), но используя хлорид (R,R-(+)-N,N'-бис-(3,5-ди-третбутилсалицилиден)-1,2-циклогександиаминомарганца(III) (катализатор Якобсена) на последней стадии. Таблица 3 Согласно схеме 2, стадия IV к раствору 5,6-дихлор-1 Н-индена (5f) (1,28 г, 6,92 ммоль), который получали согласно схеме 2 с соблюдением последовательности реакций, согласно синтезу (5 а), в диметилсульфоксиде (6,5 мл) и воде (0,16 мл) добавляли N-бромсукцинимид (2,44 г, 13,7 ммоль) при 10 С и смесь перемешивали при 25 С в течение 1 ч. Смесь добавляли в воду, перемешивали в течение 30 мин, и твердое вещество отфильтровывали. Неочищенный продукт очищали посредством силикагелевой хроматографии (с извлечением от 0 до 50% этилацетата в гептане) для получения 1,46 г 2-бром-5,6-дихлориндан-1-ола, который незамедлительно растворяли в тетрагидрофуране (35 мл). ТонкоизмельченныйNaOH (1,37 г, 34,2 ммоль) добавляли и смесь перемешивали при 25 С в течение 2 ч. Смесь фильтровали через небольшой слой целита и промывали небольшим количеством этилацетата. Фильтрат выпаривали досуха для получения 1 г рацемического(1aS,6aR)-3,4-дихлор-6,6 а-дигидро-1 аН-1 оксациклопропа[а]индена (6f), который использовали на следующей стадии без очистки. получали согласно схеме 2 с соблюдением последовательности реакции согласно синтезу (5 а), в CH2Cl2(80 мл) добавляли метахлорпербензойную кислоту (6,28 г, 25,5 ммоль) и смесь перемешивали при 25 С в течение 16 ч. Смесь разбавляли с помощью CH2Cl2, твердое вещество отфильтровывали. Раствор отмывали водным насыщенным раствором Na2S2O3, водным насыщенным NaHCO3 и водой, сушили надNa2SO4, фильтровали и раствор выпаривали досуха. Неочищенный продукт очищали с помощью силикагелевой хроматографии (с извлечением от 15 до 100% этилацетата в гептане для получения 2,84 г рацемического (1aS,6aR)-2,4-дихлор-6,6 а-дигидро-1 аН-1-оксациклопропа[а]индена (6 г). Согласно схеме 3, стадия 1 к раствору 4,6-дифториндан-1-одина (5,0 г, 2 9,8 ммоль) в сухом тетрагидрофуране (100 мл) при -78 С капельно добавляли 2 М раствор литийдиизопропиламида (16,4 мл,32,7 ммоль) в тетрагидрофуране и смесь перемешивали в течение 1 ч при -78 С. Затем йодметан (4,64 г,32,7 ммоль) добавляли и смесь медленно нагревали до 25 С. После добавления водного насыщенногоNaHCO3 смесь экстрагировали 3 раза этилацетатом. Объединенные органические слои сушили надNa2SO4 и фильтровали, растворители выпаривали в вакууме. Неочищенный продукт очищали с помощью силикагелевой хроматографии (с извлечением от 0 до 100% этилацетата в гептане для получения 1,15 г 4,6-дифтор-2-метилиндан-1-одина (7 а). Согласно схеме 3, стадия 2 к раствору 4,6-дифтор-2-метилиндан-1-одина (7 а) (1,27 г, 6,97 ммоль) в этаноле (30 мл) порционно добавляли NaBH4 (0,26 г, 6,97 ммоль) при 0 С, а затем смесь перемешивали при комнатной температуре в течение 18 ч. После выпаривания растворителей в вакууме воду добавляли к остатку, раствор экстрагировали 3 раза этилацетатом, затем добавляли 2 н. водный HCl и объединенные органические слои отмывали насыщенным водным NaHCO3 и водой. После высушивания над Na2SO4 и фильтрации растворители выпаривали в вакууме для получения 650 мг 4,6-дифтор-2-метилиндан-1-ола(8 а), который незамедлительно использовали на следующей стадии без очистки. Согласно схеме 3, стадия 3 смесь 4,6-дифтор-2-метилиндан-1-ола (8 а) (0,65 г, 3,53 ммоль) и моногидрата паратолуолсульфоновой кислоты (30 мг, 0,18 ммоль) в толуоле нагревали при кипячении с обратным холодильником в течение 1 ч. Раствор отмывали водным насыщенным NaHCO3 и насыщенным солевым раствором, сушили над MgSO4 и выпаривали растворители. Неочищенный продукт очищали с помощью силикагелевой хроматографии (с извлечением от 0 до. 100% этилацетата в гептане) для получения 0,50 г 5,7-дифтор-2-метил-1 Н-индена (9 а), который незамедлительно использовали на следующей стадии.CH2Cl2 (3 мл) добавляли метахлорпербензойную кислоту (707 мг, 2,87 ммоль) и смесь перемешивали при 25 С в течение 16 ч. Смесь разбавляли с помощью CH2Cl2 и твердое вещество отфильтровывали. Раствор отмывали водным насыщенным раствором Na2S2O3, водным насыщенным NaHCO3 и водой, сушили надNa2SO4, фильтровали и раствор выпаривали досуха для получения 242 мг рацемического Согласно схеме 4 смесь 1-[3-(3-трифторметоксифенил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин 5-ил]этанона (3 е) (0,461 ммоль), 0,44 г, 2,65 ммоль), (1aS,6aR)-3,5-дифтор-6,6 а-дигидро-1 аН-1 оксациклопропа[а]индена (6b) (0,077 г, 0,461 ммоль) и K2CO3 (127 мг, 0,922 ммоль) в 5 мл CH3CN перемешивали при 50 С в течение 24 ч. Воду добавляли, смесь экстрагировали 3 раза с помощью CH2Cl2,объединенные органические слои сушили над MgSO4, фильтровали и раствор выпаривали досуха. Неочищенный продукт очищали обращенно-фазовой ВЭЖХ (CH3CN/градиент влажности в присутствии 0,1% трифторуксусной кислоты) для получения 53 мг 1-[1-1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-3(3-трифторметоксифенил)-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанона (11 а).Rt=1,2 мин (метод ЖХ 4). Детектированная масса: 494,14 [М+Н+]. Примеры соединений в табл. 4 получали согласно схемам 4-6 с соблюдением реакции в соответствии с синтезом (11 а). Условия реакции немного варьировались по времени реакции (1-3 суток), температуре (50-80 С) и 1-3 экв. эпоксида.(0,389 г, 1,54 ммоль) и (S)-1-инданола в сухом толуоле (2,5 мл) перемешивали при 80 С в течение 2 ч. Растворители выпаривали в вакууме. Неочищенный продукт очищали с помощью обращенно-фазовой ВЭЖХ (CH3CN/градиент влажности в присутствии 0,1% трифторуксусной кислоты) для получения 81 мг 1-[(R)-3-(4-фторфенил)-1-индан-1-ил-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанона (12 а). Согласно схеме 7 по аналогии с синтезом (12 а), но взамен используя (R)-1-инданол, получали 1-[(S)-3-(4-фторфенил)-1-индан-1-ил-1,4,6,7-тетрагидропиразоло[4,3-с]пиридин-5-ил]этанон (12b). Согласно схеме 8 смесь (1-[1-1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-3-(4-фторфенил)-1,4,6,7 тетрагидропиразоло [4,3-c] пиридин-5-ил]этанона (111) (0,2 г, 0,468 ммоль), этанола (14 мл) и 2 н. водного HCl (14 мл) перемешивали при 80 С в течение 6 ч. Смесь концентрировали в вакууме. После добавления водного насыщенного NaHCO3 смесь экстрагировали 3 раза этилацетатом, растворители выпаривали в вакууме и остаток высушивали сублимацией из водного CH3CN для получения 0,170 г (1R,2R)-4,6 дифтор-1-[3-(4-фторфенил)-4,5,6,7-тетрагидропиразоло[4,3-с]пиридин-1-ил]индан-2-ола (13 а).Rt=1,04 мин (метод ЖХ 4). Детектированная масса: 386,3 [М+Н+]. Соединения в табл. 5 получали согласно схеме 8 с соблюдением реакций, подобных тем, которые используются для синтеза (13 а). Условия реакций немного варьировались по времени реакций (6 ч-3 суток), и в некоторых случаях продукт очищали с помощью обращенно-фазовой ВЭЖХ (CH3CN/градиент влажности в присутствии 0,1% трифторуксусной кислоты). Согласно схеме 9 к раствору 3-[1-1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)-4,5,6,7-тетрагидро 1 Н-пиразоло[4,3-с]пиридин-3-ил]бензонитрила (13 с) (0,05 г, 0,127 ммоль) в CH2Cl2 (2 мл) при 0 С добавляли триэтиламин (19 мг, 0,191 ммоль) и пропионилхлорид (13 мг, 0,140 ммоль) и смесь перемешивали в течение 30 мин при 0-5 С. После добавления водного насыщенного NaHCO3 (2 мл) смесь экстрагировали с помощью CH2Cl2 (10 мл), органический слой сушили над Na2SO4, растворители выпаривали в вакууме и неочищенный продукт очищали с помощью обращенно-фазовой ВЭЖХ (CH3CN/градиент влажности с 0,1% трифторуксусной кислотой) для получения 15 мг 3-[1-1R,2R)-4,6-дифтор-2-гидроксииндан-1-ил)5-пропионил-4,5,6,7-тетрагидро-1 Н-пиразоло[4,3-с]пиридин-3-ил]бензонитрила (14 а). Примеры в табл. 6 получали согласно схеме 9 с соблюдением реакций, подобных тем, которые используются в соответствии с синтезом (14 а). Условия реакций немного варьировались по времени реакций (1-18 ч) и температуре реакции (0-25 С). Таблица 6
МПК / Метки
МПК: A61K 31/4353, A61P 25/28, C07D 471/04, A61P 9/06
Метки: 4,5,6,7-тетрагидро-1h-пиразоло[4,3-с]пиридины, препараты, качестве, инданилзамещенные, лекарственного, содержащие, средства, фармацевтические, применение
Код ссылки
<a href="https://eas.patents.su/30-23648-indanilzameshhennye-4567-tetragidro-1h-pirazolo43-spiridiny-ih-primenenie-v-kachestve-lekarstvennogo-sredstva-i-soderzhashhie-ih-farmacevticheskie-preparaty.html" rel="bookmark" title="База патентов Евразийского Союза">Инданилзамещенные 4,5,6,7-тетрагидро-1h-пиразоло[4,3-с]пиридины, их применение в качестве лекарственного средства и содержащие их фармацевтические препараты</a>