Противовирусные соединения
Номер патента: 23644
Опубликовано: 30.06.2016
Авторы: Като Дэррил, Трехо Мартин Тереса Алехандра, Трен Чинх Вьет, Крыговский Эван С., Коттелл Джероми Дж., Зипфель Шейла, Ян Чжэн-Юй, Катана Эшли Энн, Бейкон Элизабет М., Линк Джон О., Тейлор Джеймс
Формула / Реферат
1. Соединение формулы:

или его фармацевтически приемлемая соль.
2. Фармацевтическая композиция для лечения гепатита С, содержащая соединение по п.1 и фармацевтически приемлемый носитель.
3. Фармацевтическая композиция по п.2, дополнительно содержащая ингибитор полимеразы NS5B.
4. Способ лечения гепатита С у пациента, представляющего собой человека, включающий введение пациенту-человеку, который в этом нуждается, соединения по п.1.
5. Способ лечения гепатита С у пациента, представляющего собой человека, включающий введение пациенту-человеку, который в этом нуждается, композиции по п.2 или 3.
6. Соединение формулы
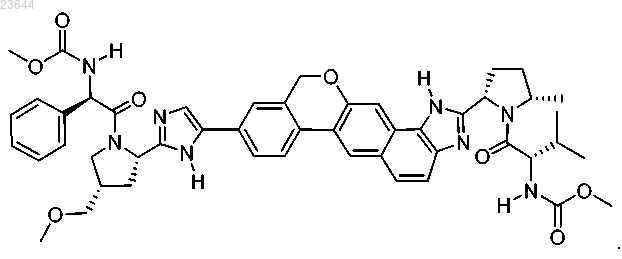
7. Фармацевтическая композиция для лечения гепатита С, содержащая соединение по п.6 и фармацевтически приемлемый носитель.
8. Фармацевтическая композиция по п.7, дополнительно содержащая ингибитор полимеразы NS5B.
9. Способ лечения гепатита С у пациента, представляющего собой человека, включающий введение пациенту-человеку, который в этом нуждается, соединения по п.6.
10. Способ лечения гепатита С у пациента, представляющего собой человека, включающий введение пациенту-человеку, который в этом нуждается, композиции по п.7 или 8.
Текст
Настоящее изобретение относится к противовирусному соединению формулы: Бэйкон Элизабет М., Коттелл Джероми Дж., Катана Эшли Энн,Като Дэррил, Крыговский Эван С.,Линк Джон О., Тэйлор Джеймс, Трен Чинх Вьет, Трехо Мартин Тереса Алехандра, Ян Чжэн-Юй, Зипфел Шейла (US) композициям, содержащим указанное соединение, и терапевтическим способам, которые включают введение указанного соединения, а также к способам и промежуточным соединениям,подходящим для получения указанного соединения.(71)(73) Заявитель и патентовладелец: ДЖИЛИД ФАРМАССЕТ ЛЛС (US) Перекрестная ссылка на родственные заявки Настоящая заявка испрашивает приоритет в соответствии с 119(е) раздела 35 свода законов США на основании предварительной заявки на патент США 61/560654, поданной 16 ноября 2011 г., содержание которой включено в настоящую заявку во всей полноте посредством ссылки. Уровень техники Гепатит С определяют как хроническое вирусное заболевание печени, которое характеризуется заболеванием печени. Хотя лекарственные средства, направленно воздействующие на печень, широко применимы и эффективны, их применение ограничено токсичностью и другими побочными эффектами. Ингибиторы вируса гепатита С (ВГС) являются подходящими для применения при ограничении образования и развития инфекции ВГС, а также в диагностических исследованиях на ВГС. Существует потребность в новых терапевтических агентах против ВГС. В частности, существует потребность в терапевтических агентах против ВГС, обладающих широким спектром активности против генотипов ВГС (например, генотипов 1a, 1b, 2 а, 3 а, 4 а). Также существует особая потребность в агентах,менее подверженных вирусной резистентности. Мутации резистентности к ингибиторам описаны дляNS5A ВГС для генотипов 1 а и 1b в Antimicrobial Agents and Chemotherapy, September 2010, Volume 54, p. 3641-3650. Краткое описание изобретения В одном из вариантов реализации настоящего изобретения предложено соединение согласно настоящему описанию, которое представляет собой соединение формулы или фармацевтически приемлемую соль указанного соединения. В изобретении также предложены изотопно-обогащенные соединения, которые представляют собой соединения согласно настоящему описанию, которые содержат обогащенные изотоп в одном или более положениях в соединении. В настоящем изобретении также предложена фармацевтическая композиция, содержащая соединение согласно настоящему описанию или фармацевтически приемлемую соль указанного соединения и по меньшей мере один фармацевтически приемлемый носитель. В настоящем изобретении также предложена фармацевтическая композиция для применения для лечения гепатита С (ВГС). В одном из вариантов реализации композиция содержит по меньшей мере один дополнительный терапевтический агент для лечения ВГС. В одном из вариантов реализации терапевтический агент представляет собой ингибитор NS5B полимеразы ВГС. В одном из вариантов реализации нуклеозидный или нуклеотидный ингибитор NS5B полимеразы ВГС выбран из рибавирина, вирамидина, левовирина, L-нуклеозида или изаторибина. В одном из вариантов реализации предложена фармацевтическая композиция, содержащая соединение согласно настоящему описанию и по меньшей мере один ингибитор NS5B полимеразы ВГС и по меньшей мере один фармацевтически приемлемый носитель. Соединение согласно настоящему изобретению представляет собой соединение, приведенное в примере PY. В одном из вариантов реализации ингибитор NS5B полимеразы ВГС представляет собой софосбувир. В настоящем изобретении также предложен способ лечения гепатита С, где указанный способ включает введение пациенту-человеку фармацевтической композиции, которая содержит терапевтически эффективное количество соединения согласно настоящему описанию. В настоящем изобретении также предложен способ ингибирования ВГС, включающий введение млекопитающему, пораженному состоянием, связанным с активностью ВГС, количества соединения согласно настоящему описанию, эффективного для ингибирования ВГС. В настоящем изобретении также предложено соединение согласно настоящему описанию для применения в медицинской терапии (например, для применения для ингибирования активности ВГС или для лечения состояния, связанного с активностью ВГС), а также применение соединения согласно настоящему описанию для получения лекарственного средства, подходящего для ингибирования ВГС или для лечения состояния, связанного с активностью ВГС, у млекопитающих. В настоящем изобретении также предложены способы синтеза и новые промежуточные соединения согласно настоящему описанию, подходящие для получения соединений согласно настоящему описанию. Некоторые из соединений согласно настоящему описанию являются подходящими для получения других соединений согласно настоящему описанию. В другом аспекте настоящего изобретения предложено соединение согласно настоящему описанию или фармацевтически приемлемая соль или пролекарство указанного соединения для применения в про-1 023644 филактическом или терапевтическом лечении гепатита С или расстройства, связанного с гепатитом С. В другом аспекте настоящего изобретения предложен способ ингибирования активности ВГС в образце, включающий обработку образца соединением согласно настоящему описанию. Было установлено, что соединения формулы (I) обладают подходящей для применения активностью в отношении генотипов 1 ВГС. Кроме того, некоторые соединения формулы (I) обладают значительной активностью в отношении резистентных вариантов GT1. Соответственно, некоторые соединения формулы (I) обладают полезными фармакологическими свойствами, которые делают указанные соединения хорошо подходящими для удовлетворения текущей потребности в агентах ВГС с такими полезными свойствами. В одном из вариантов реализации изобретения предложено соединение, обладающее улучшенными ингибирующими или фармакокинетическими свойствами, в том числе повышенной активностью в отношении развития вирусной резистентности, улучшенной биодоступностью для перорального введения,более высокой эффективностью (например, при ингибировании активности ВГС) или увеличенным эффективным периодом полураспада in vivo. Некоторые соединения согласно настоящему описанию могут иметь меньшее количество побочных эффектов, менее сложный режим дозирования или могут являться перорально активными. Подробное описание изобретения Ниже приведено подробное описание некоторых вариантов реализации согласно настоящему описанию, примеры которых проиллюстрированы прилагаемыми структурами и формулами. Хотя изобретение описано в отношении приведенных вариантов реализации, следует понимать, что они не ограничивают изобретение указанными вариантами реализации. Напротив, изобретение охватывает все альтернативы, модификации и эквиваленты, которые можно включить в объем настоящего изобретения, как определено в вариантах реализации. Соединения Соединения согласно настоящему описанию не включают соединения, известные на данный момент. Тем не менее, согласно настоящему изобретению применяют соединения, для которых ранее не было установлено наличие противовирусных свойств, для противовирусных целей (например, для получения противовирусного эффекта у животных). Применительно к Соединенным Штатам, соединения или композиции в настоящем описании не включают соединения, которые предполагаются согласно 102 раздела 35 свода законов США или которые являются очевидными согласно 103 раздела 35 свода законов США. Всякий раз, когда соединение согласно настоящему описанию является замещенным более чем одним заместителем из одной и той же группы, например, "R1" или "А 3", следует понимать, что группы могут являться одинаковыми или различными, т.е. каждая группа выбрана независимо."Отсутствует"-некоторые группы, определенные таким образом, могут отсутствовать. Если группа отсутствует, то она представляет собой связь. Две группы, которые могли бы быть присоединены к указанной отсутствующей группе, соединены друг с другом связью. Термин "алкил" обозначает C1-C18 углеводород, содержащий первичные, вторичные, третичные или циклические атомы углерода. Примерами являются метил (Me,-СН 3), этил (Et,-СН 2 СН 3), 1-пропил (n-Pr,n-пропил,-СН 2 СН 2 СН 3),2-пропил(-СН(СН 3)С(СН 3)3 и циклопропилметил Термин "алкенил" обозначает С 2-С 18 углеводород, содержащий первичные, вторичные, третичные или циклические атомы углерода по меньшей мере с одной степенью ненасыщенности, т.е. углеродуглерод, sp2 двойной связью. Примеры включают, но не ограничиваются ими, этилен или винил(-СН=СН 2), аллил (-СН 2 СН=СН 2), циклопентенил (-С 5 Н 7) и 5-гексенил (-CH2CH2CH2CH2CH=CH2). Термин "алкинил" обозначает С 2-С 18 углеводород, содержащий первичные, вторичные, третичные или циклические атомы углерода по меньшей мере с одной степенью ненасыщенности, т.е. углеродуглерод, s2 тройной связью. Примеры включают, но не ограничиваются ими, ацетиленовую группу(-С=СН) и пропаргил (-CH2CСН). Термин "алкилен" относится к насыщенным, разветвленным или линейным или циклическим угле-2 023644 водородным радикалам, содержащим 1-18 атомов углерода и имеющим два одновалентных радикальных центра, полученных удалением двух атомов водорода от одного и того же или двух различных атомов углерода исходного алкана. Типичные алкиленовые радикалы включают, но не ограничиваются ими,метилен (-СН 2-) 1,2-этил (-СН 2 СН 2-), 1,3-пропил (-СН 2 СН 2 СН 2-), 1,4-бутил (-СН 2 СН 2 СН 2 СН 2-) и т.п. Термин "алкенилен" относится к ненасыщенным, разветвленным или линейным или циклическим углеводородным радикалам, содержащим 2-18 атомов углерода и имеющим два одновалентных радикальных центра, полученных удалением двух атомов водорода от одного и того же или двух различных атомов углерода исходного алкена. Типичные алкениленовые радикалы включают, но не ограничиваются ими, 1,2-этилен (-СН=СН-). Термин "алкинилен" относится к ненасыщенным, разветвленным или линейным или циклическим углеводородным радикалам, содержащим 2-18 атомов углерода и имеющим два одновалентных радикальных центра, полученных удалением двух атомов водорода от одного и того же или двух различных атомов углерода исходного алкина. Типичные алкиниленовые радикалы включают, но не ограничиваются ими, ацетилен (-СС-), пропаргил (-CH2CC-) и 4-пентинил (-СН 2 СН 2 СН 2 ССН). В настоящем описании термины "алкокси" или "алкилокси" относятся к алкильной группе, присоединенной к фрагменту исходной молекулы через атом кислорода. В настоящем описании термин "алкоксикарбонил" относится к алкоксигруппе, присоединенной к фрагменту исходной молекулы через карбонильную группу. В настоящем описании термин "циклоалкил" относится к насыщенной моноциклической углеводородной системе колец, содержащей от трех до семи атомов углерода и не содержащей гетероатомов. Характерные примеры циклоалкильных групп включают, но не ограничиваются ими, циклопропил, циклопентил и циклогексил. Циклоалкильные группы согласно настоящему описанию могут быть замещены одним, двумя, тремя, четырьмя или пятью заместителями, независимо выбранными из алкокси, алкила,арила, циано, галогена, галогеналкокси, галогеналкила, гетероциклила, гидрокси, гидроксиалкила, нитро и-NRxRy, где арил и гетероциклил возможно дополнительно замещены одним, двумя или тремя заместителями, независимо выбранными из алкокси, алкила, циано, галогена, галогеналкокси, галогеналкила,гидрокси и нитро. В настоящем описании термин "циклоалкилкарбонил" относится к циклоалкильной группе, присоединенной к фрагменту исходной молекулы через карбонильную группу. В настоящем описании термин "циклоалкилокси" относится к циклоалкильной группе, присоединенной к фрагменту исходной молекулы через атом кислорода. В настоящем описании термин "циклоалкилоксикарбонил" относится к группе циклоалкилокси,присоединенной к фрагменту исходной молекулы через карбонильную группу. Термин "арил" обозначает одновалентный ароматический углеводородный радикал, содержащий 620 атомов углерода, полученный путем удаления одного атома водорода от одного атома углерода исходной ароматической системы колец. Типичные арильные группы включают, но не ограничиваются ими, радикалы, полученные из бензола, замещенного бензола, нафталена, антрацена, бифенила и т.п. Термин "арилалкил" относится к ациклическому алкильному радикалу, в котором один из атомов водорода, связанный с атомом углерода, обычно с концевым или sp3 атомом углерода, заменен на арильный радикал. Типичные арилалкильные группы включают, но не ограничиваются ими, бензил, 2 фенилэтан-1-ил, нафтилметил, 2-нафтилэтан-1-ил, нафтобензил, 2-нафтофенилэтан-1-ил и т.п. Арилалкильная группа содержит от 6 до 20 атомов углерода, например, алкильный фрагмент, включая алканильные, алкенильные или алкинильные группы, арилалкильной группы содержит от 1 до 6 атомов углерода, а арильный фрагмент содержит от 5 до 14 атомов углерода. Термины "замещенный алкил", "замещенный арил" и "замещенный арилалкил" обозначают алкил,арил и арилалкил соответственно, в которых каждый из одного или более атомов водорода независимо заменены на заместитель, отличный от водорода. Типичные заместители включают, но не ограничиваются ими: галоген (например, F, Cl, Br, I), -R, -OR, -SR, -NR2, -CF3, -CCl3, -OCF3, -CN, -NO2, -N(R)C(=O)R,-C(=O)R, -OC(=O)R, -C(O)OR, -C(=O)NRR, -S(=O)R, -S(=O)2OR, -S(=O)2R, -OS(=O)2OR, -S(=O)2NRR, и каждый R независимо представляет собой-Н, алкил, арил, арилалкил или гетероцикл. Алкиленовые, алкениленовые и алкиниленовые группы также могут быть замещены аналогичным образом. Термин "возможно замещенный" в отношении конкретного фрагмента соединения формулы (I) (например, возможно замещенная арильная группа) относится к фрагменту, содержащему 0, 1, 2 или более заместителей. Символ "" в структуре кольца обозначает, что связь является одинарной или двойной. В каче стве неограничивающего примера или В настоящем описании термин "галогеналкил" включает алкильную группу, замещенную одним или более галогенами (например, F, Cl, Br или I). Характерные примеры галогеналкилов включают трифторметил, 2,2,2-трифторэтил, 2,2,2-трифтор-1-(трифторметил)этил. В настоящем описании термины "гетероцикл" или "гетероциклил" включают, в качестве примера,но не ограничения, гетероциклы, описанные в Paquette, Leo A.; Principles of Modern Heterocyclic Chemistry (W.A. Benjamin, New York, 1968), в частности, в главах 1, 3, 4, 6, 7 и 9; The Chemistry of HeterocyclicCompounds, A Series of Monographs" (John WileySons, New York, 1950 to present), в частности, в выпусках 13, 14, 16, 19 и 28; и J. Am. Chem. Soc. (1960) 82:5566. В одном конкретном варианте реализации термин "гетероцикл" включает "карбоцикл" согласно настоящему описанию, где один или более (например, 1, 2, 3 или 4) атомов углерода заменены на гетероатом (например, О, N или S). Термин "гетероцикл" также включает "гетероарил", который представляет собой гетероцикл, где по меньшей мере одно гетероциклическое кольцо является ароматическим. Примеры гетероциклов включают, в качестве примера, но не ограничения, пиридил, дигидропиридил, тетрагидропиридил (пиперидил), тиазолил, тетрагидротиофенил, тетрагидротиофенил с окисленным атомом серы, пиримидинил, фуранил, тиенил, пирролил, пиразолил, имидазолил, тетразолил, бензофуранил, тианафталенил, индолил, индоленил, хинолинил, изохинолинил, бензимидазолил, пиперидинил, 4 пиперидонил, пирролидинил, 2-пирролидонил, пирролинил, тетрагидрофуранил, тетрагидрохинолинил,тетрагидроизохинолинил, декагидрохинолинил, октагидроизохинолинил, азоцинил, триазинил, 6 Н-1,2,5 тиадиазинил, 2 Н,6 Н-1,5,2-дитиазинил, тиенил, тиантренил, пиранил, изобензофуранил, хроменил, ксантенил, феноксантинил, 2 Н-пирролил, изотиазолил, изоксазолил, пиразинил, пиридазинил, индолизинил,изоиндолил, 3 Н-индолил, 1H-индазолил, пуринил, 4 Н-хинолизинил, фталазинил, нафтиридинил, хиноксалинил, хиназолинил, циннолинил, птеридинил, 4 Н-карбазолил, карбазолил, -карболинил, фенантридинил, акридинил, пиримидинил, фенантролинил, феназинил, фенотиазинил, фуразанил, феноксазинил,изохроманил, хроманил, имидазолидинил, имидазолинил, пиразолидинил, пиразолинил, пиперазинил,индолинил, изоиндолинил, хинуклидинил, морфолинил, оксазолидинил, бензотриазолил, бензизоксазолил, оксиндолил, бензоксазолинил, изатиноил и бис-тетрагидрофуранил В качестве примера, но не ограничения, гетероциклы, связанные через атом углерода, связаны в 2,3, 4, 5 или 6 положениях пиридина, 3, 4, 5 или 6 положениях пиридазина, 2, 4, 5 или 6 положениях пиримидина, 2, 3, 5 или 6 положениях пиразина, 2, 3, 4 или 5 положениях фурана, тетрагидрофурана, тиофурана, тиофена, пиррола или тетрагидропиррола, 2, 4 или 5 положениях оксазола, имидазола или тиазола,3, 4 или 5 положениях изоксазола, пиразола или изотиазола, 2 или 3 положениях азиридина, 2, 3 или 4 положениях азетидина, 2, 3, 4, 5, 6, 7 или 8 положениях хинолина или 1, 3, 4, 5, 6, 7 или 8 положениях изохинолина. Еще более типично, гетероциклы, связанные через атом углерода, включают 2-пиридил, 3 пиридил, 4-пиридил, 5-пиридил, 6-пиридил, 3-пиридазинил, 4-пиридазинил, 5-пиридазинил, 6-пиридазинил, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил, 6-пиримидинил, 2-пиразинил, 3-пиразинил, 5 пиразинил, 6-пиразинил, 2-тиазолил, 4-тиазолил или 5-тиазолил. В качестве примера, но не ограничения, гетероциклы, связанные через атом азота, связаны в 1 положении азиридина, азетидина, пиррола, пирролидина, 2-пирролина, 3-пирролина, имидазола, имидазолидина, 2-имидазолина, 3-имидазолина, пиразола, пиразолина, 2-пиразолина, 3-пиразолина, пиперидина,пиперазина, индола, индолина, 1H-индазола, 2 положении изоиндола или изоиндолина, 4 положении морфолина и 9 положении карбазола или -карболина. Еще более типично, гетероциклы, связанные через атом азота, включают 1-азиридил, 1-азетедил, 1-пирролил, 1-имидазолил, 1-пиразолил и 1 пиперидинил. Термин "карбоцикл" относится к насыщенным, ненасыщенным или ароматическим кольцам, содержащим до 25 атомов углерода. Как правило, карбоцикл содержит от 3 до 7 атомов углерода в виде моноцикла, от 7 до 12 атомов углерода в виде бицикла и до 25 атомов углерода в виде полицикла. Моноциклические карбоциклы, как правило, содержат от 3 до 6 кольцевых атомов, более типично, 5 или 6 кольцевых атомов. Бициклические карбоциклы, как правило, содержат от 7 до 12 кольцевых атомов, например, расположенных в виде бицикло [4,5], [5,5], [5,6] или [6,6] системы, или 9 или 10 кольцевых атомов, расположенных в виде бицикло [5,6] или [6,6] системы. Термин "карбоцикл" включает "циклоалкил", который представляет собой насыщенный или ненасыщенный карбоцикл. Примеры моноциклических карбоциклов включают циклопропил, циклобутил, циклопентил, 1-циклопент-1-енил, 1-циклопент 2-енил, 1-циклопент-3-енил, циклогексил, 1-циклогекс-1-енил, 1-циклогекс-2-енил, 1-циклогекс-3-енил,фенил, спирил и нафтил. В настоящем описании термин "амино" относится к-NH2. Термин "хиральный" относится к молекулам, обладающим структурой, которая не совпадает с их зеркальным отражением, тогда как термин "ахиральный" относится к молекулам, которые совпадают с их зеркальным отражением. Термин "стереоизомеры" относится к соединениям, которые имеют одинаковый химический состав,но отличаются расположением атомов или групп в пространстве. Термин "диастереомер" относится к стереоизомеру с двумя или более центрами хиральности, молекулы которого не являются зеркальным отражением друг друга. Диастереомеры обладают различными физическими свойствами, например, температурами плавления, температурами кипения, спектральными характеристиками и реакционными способностями. Смеси диастереомеров можно разделять при помощи высокоэффективных аналитических способов, таких как электрофорез и хроматография. Термин "энантиомеры" относится к двум стереоизомерам соединения, которые являются несовместимыми зеркальными отражениями друг друга. Термины "лечение" или "излечение" в тех случаях, когда они относятся к заболеванию или состоянию, включают предотвращение возникновения заболевания или состояния, ингибирование заболевания или состояния, устранение заболевания или состояния и/или облегчение одного или более симптомов заболевания или состояния. В настоящем описании для стереохимических определений и обозначений, как правило, руководствовались S.P. Parker, Ed., McGraw-Hill Dictionary of Chemical Terms (1984) McGraw-Hill Book Company, New York; и Eliel, E. and Wilen, S., Stereochemistry of Organic Compounds (1994) John WileySons,Inc., New York. Многие органические соединения существуют в оптически активной форме, т.е. они обладают способностью вращать плоскость плоскополяризованного света. При описании оптически активного соединения префиксы (D и L) или (R и S) применяют для обозначения абсолютной конфигурации молекулы в хиральном(ых) центре(ах). Префиксы d и l или (+) и (-) применяют для обозначения знака вращения плоскости плоскополяризованного света соединением, причем (-) или l означают, что соединение является левовращающим. Соединение с префиксом (+) или d является правовращающим. Для данной химической структуры указанные стереоизомеры являются идентичными, за исключением того, что они являются зеркальными отражениями друг друга. Конкретный стереоизомер также может являться энантиомером, а смесь таких изомеров обычно называют энантиомерной смесью. 50:50 смесь энантиомеров называют рацемической смесью или рацематом, который может быть получен в случае отсутствия стереоселективности или стереоспецифичности в химической реакции или процессе. Термины "рацемическая смесь" и "рацемат" относятся к эквимолярной смеси двух энантиомеров, не проявляющей оптической активности. Описание включает все стереоизомеры соединений согласно настоящему описанию. Пролекарства В настоящем описании термин "пролекарство" относится к любому соединению, которое при введении в биологическую систему образует соединение согласно настоящему описанию, которое ингибирует активность ВГС ("активное ингибирующее соединение"). Соединение может образовываться из пролекарства в результате: (i) спонтанной(ых) химической(их) реакции(й), (ii) катализируемой(ых) ферментами химической(их) реакции(й), (iii) фотолиза и/или (iv) метаболической(их) химической(их) реакции(й). Термин "фрагмент пролекарства" относится к лабильной функциональной группе, которая отделяется от активного ингибирующего соединения в процессе метаболизма, в организме, внутри клетки, в результате гидролиза, ферментного расщепления или в ходе другого процесса (Bundgaard, Hans, "DesignH. Bundgaard, Eds. Harwood Academic Publishers, pp. 113-191). Ферменты, способные осуществлять ферментную активацию пролекарств соединений согласно настоящему описанию, включают, но не ограничиваются ими, амидазы, эстеразы, микробные ферменты, фосфолипазы, холинэстеразы и фосфазы. Фрагменты пролекарства способны увеличивать растворимость, абсорбцию и липофильность для оптимизации доставки лекарственного средства, его биодоступности и эффективности. Фрагмент пролекарства может содержать активный метаболит или указанное лекарственное средство само по себе. Типичные фрагменты пролекарств включают чувствительные или лабильные к гидролизу ацилоксиметиловые сложные эфиры-CH2OC(=O)R99 и ацилоксиметилкарбонаты-CH2OC(=O)OR99, где R99 представляет собой C1-С 6 алкил, C1-С 6 замещенный алкил, С 6-С 20 арил или С 6-С 20 замещенный арил. Ацилоксиалкиловый сложный эфир сначала применяли в качестве пролекарства карбоновых кислот, а затем применяли к фосфатам и фосфонатам согласно Farquhar et al. (1983) J. Pharm. Sci. 72:324; а также патентам США 4816570, 4968788, 5663159 и 5792756. В дальнейшем ацилоксиалкиловый сложный эфир применяли для доставки фосфоновых кислот через клеточные мембраны и для повышения пероральной биодоступности. Близкий вариант ацилоксиалкилового сложного эфира, алкоксикарбонилоксиалкиловый сложный эфир (карбонат), также способен повышать пероральную биодоступность в качестве фрагмента пролекарства в соединениях в комбинациях согласно настоящему описанию. Типичным ацилоксиметиловым сложным эфиром является пивалоилоксиметокси (РОМ)-СН 2 ОС(=О)С(СН 3)3. Типичным ацилоксиметилкарбонатным фрагментом пролекарства является пивалоилоксиметилкарбонат (РОС)-CH2OC(=O)OC(CH3)3. Описаны ариловые сложные эфиры фосфорных групп, особенно фениловые сложные эфиры, которые повышают пероральную биодоступность (De Lombaert et al. (1994) J. Med. Chem. 37:498). Также описаны фениловые сложные эфиры, содержащие сложные эфиры карбоновых кислот в орто-положении по отношению к фосфатной группе (Khamnei and Torrence, (1996) J. Med. Chem. 39:4109-4115). Описаны бензиловые сложные эфиры, образующие исходные фосфоновые кислоты. В некоторых случаях заместители в орто- или пара-положении способны ускорять гидролиз. Бензиловые аналоги с ацилированным фенолом или алкилированным фенолом под действием ферментов, например, эстераз, оксидаз и т.п.,способны образовывать фенольное соединение, которое, в свою очередь, расщепляется по бензильной связи С-O с образованием фосфорной кислоты и промежуточного соединения хинонметида. Примеры указанного класса пролекарств описаны в Mitchell et al. (1992) J. Chem. Soc. Perkin Trans. II 2345; GlazierWO 91/19721. Также описаны другие бензильные пролекарства, содержащие группы, содержащие остатки сложных эфиров карбоновых кислот, присоединенные к метилену бензильной группы (Glazier WO 91/19721). Описаны тиосодержащие пролекарства, подходящие для внутриклеточной доставки фосфонатных лекарственных средств. Такие сложные проэфиры содержат этилтиогруппу, в которой тиольная группа либо этерифицирована ацильной группой, либо объединена с другой тиольной группой с образованием дисульфида. Деэтерификация или восстановление дисульфидов приводит к образованию промежуточного соединения со свободной тиогруппой, которая впоследствии отщепляется с образованием фосфорной кислоты и эписульфида (Puech et al. (1993) Antiviral Res., 22:155-174; Benzaria et al. (1996) J.Med. Chem. 39:4958). Защитные группы В контексте настоящего описания защитные группы включают фрагменты пролекарств и химические защитные группы. Термин "защитная группа" относится к фрагменту соединения, который блокирует или изменяет свойства функциональной группы или свойства соединения в целом. Химические защитные группы и способы их применения для введения/снятия защиты хорошо известны специалистам в данной области техники (см., например, Protective Groups in Organic Chemistry, Theodora W. Greene, John WileySons,Inc., New York, 1991). Защитные группы часто применяют для блокирования реакционной способности определенных функциональных групп, для содействия эффективности целевых химических реакций,например, образования и разрыва химических связей по предназначенному и запланированному способу. Защита функциональных групп соединения помимо реакционной способности защищенной функциональной группы изменяет другие физические свойства, такие как полярность, липофильность (гидрофобность) и другие свойства, которые можно измерить при помощи обычных способов анализа. Сами по себе химически защищенные промежуточные соединения могут являться биологически активными или неактивными. Защищенные соединения также способны проявлять измененные, а в некоторых случаях оптимизированные, свойства in vitro и in vivo, такие как проходимость через клеточные мембраны и резистентность к ферментному расщеплению или секвестрации. В этом смысле защищенные соединения с предназначенным терапевтическим действием можно относить к пролекарствам. Другой функцией защитной группы является превращение исходного лекарственного средства в пролекарство, при условии, что исходное лекарственное средство высвобождается в результате превращения пролекарства in vivo. Поскольку активные пролекарства способны поглощаться более эффективно, чем исходное лекарственное средство, пролекарства могут обладать более высокой активностью in vivo по сравнению с исходным лекарственным средством. Защитные группы удаляют либо in vitro, в случае химических промежуточных веществ, либо in vivo, в случае пролекарств. В случае химических промежуточных веществ не имеет существенного значения, являются ли получаемые после снятия защиты продукты, например, спирты, физиологически приемлемыми, хотя, в целом, желательно, чтобы продукты являлись фармакологически безопасными. Защитные группы доступны, широко известны и применяемы, и возможно применяются для предотвращения побочных реакций с защищенной группой в процессе синтеза, т.е., путей и способов получения соединений согласно настоящему описанию. По большей части, решение о том, какие группы применять для защиты и когда, а также о природе химической защитной группы "ЗГ", зависит от химизма реакции, требующей защиты (например, кислотные, основные, окислительные, восстановительные или другие условия) и предполагаемого направления синтеза. ЗГ не должны и, в целом, не являются одинаковыми, если соединение замещено несколькими ЗГ. В целом, ЗГ применяют для защиты функциональных групп, таких как карбоксил, гидроксил, тио или аминогруппы, и, тем самым, для предотвращения побочных реакций или, с другой стороны, облегчения эффективности синтеза. Порядок снятия защиты с получением свободных незащищенных групп зависит от предполагаемого направления синтеза и условий реакции, которые могут возникнуть, и может осуществляться в любом порядке, определенном специалистом. Можно защищать различные функциональные группы соединений согласно настоящему описанию. Например, защитные группы для-ОН групп (будь то гидроксил, карбоновая кислота, фосфоновая кислота или другие функциональные группы) включают "группы, образующие простые и сложные эфиры". Группы, образующие простые и сложные эфиры, способны функционировать в качестве химических защитных групп в схемах синтеза, приведенных в настоящем описании. Однако, как понятно специалистам в данной области техники, некоторые гидроксильные и тиозащитные группы являются группами, не образующими ни простые, ни сложные эфиры, и включены в амиды, обсуждаемые ниже. Очень большое количество гидроксильных защитных групп и групп, образующих амиды, и соответствующих реакций химического расщепления описано в Protective Groups in Organic Synthesis, Theodora W. Greene (John WileySons, Inc., New York, 1991, ISBN 0-471-62301-6) ("Greene"). См. также Kocienski, Philip J.; Protecting Groups (Georg Thieme Verlag Stuttgart, New York, 1994), содержание которой включено в настоящую заявку во всей полноте посредством ссылки. В частности, глава 1, ProtectingGroups, стр. 95-117, глава 4, Carboxyl Protecting Groups, стр. 118-154, глава 5, Carbonyl Protecting Groups,стр. 155-184. Защитные группы для карбоновой кислоты, фосфоновой кислоты, фосфоната, сульфокислоты и другие защитные группы для кислоты см. в Greene, как приведено ниже. В качестве примера, но не ограничения, переменные, приведенные в настоящем описании, могут представлять собой рекурсивные заместители в некоторых вариантах реализации. Как правило, каждый из них может независимо встречаться 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1 или 0 раз в данном варианте реализации. Более типично, каждый из них может независимо встречаться 12 или меньше раз в данном варианте реализации. Всякий раз, когда соединение, приведенное в настоящем описании, является замещенным более чем одной одинаково обозначенными группами, например, "R1" или"R3", следует понимать, что группы могут являться одинаковыми или различными, т.е., каждая группа выбрана независимо. Волнистые линии указывают на место присоединения к соседним группам, фрагментам или атомам посредством ковалентной связи. В одном из вариантов реализации настоящего изобретения соединение находится в выделенной и очищенной форме. Как правило, термин "выделенный и очищенный" означает, что соединение по существу очищено от биологических материалов (например, крови, ткани, клеток и т.п.). В одном конкретном варианте реализации настоящего изобретения термин означает, что по меньшей мере около 50 мас.% соединения или конъюгата согласно настоящему изобретению очищены от биологических материалов; в другом конкретном варианте реализации настоящего изобретения термин означает, что по меньшей мере около 75 мас.% соединения или конъюгата согласно настоящему изобретению очищены от биологических материалов; в другом конкретном варианте реализации настоящего изобретения термин означает,что по меньшей мере около 90 мас.% соединения или конъюгата согласно настоящему изобретению очищены от биологических материалов; в другом конкретном варианте реализации настоящего изобретения термин означает, что по меньшей мере около 98 мас.% соединения или конъюгата согласно настоящему изобретению очищены от биологических материалов; и в другом конкретном варианте реализации настоящего изобретения термин означает, что по меньшей мере около 99 мас.% соединения или конъюгата согласно настоящему изобретению очищены от биологических материалов. В другом конкретном варианте реализации настоящего изобретения предложено соединение или конъюгат согласно настоящему изобретению, который получали синтетическим путем (например, ex vivo). Стереоизомеры Соединения согласно настоящему изобретению могут иметь хиральные центры, например хиральные атомы углерода или фосфора. Таким образом, соединения согласно настоящему изобретению включают рацемические смеси всех стереоизомеров, в том числе энантиомеров, диастереомеров и атропизомеров. Кроме того, соединения согласно настоящему изобретению включают смеси с преимущественным содержанием одного оптического изомера или разделенные оптические изомеры при любых или всех асимметричных, хиральных атомах. Другими словами, соединения, содержащие очевидные из приведенных изображений хиральные центры, представлены в качестве хиральных изомеров или рацемических смесей. И рацемические, и диастереомерные смеси, а также отдельные оптические изомеры, выделенные или синтезированные так, что они являются по существу очищенными от своих энантиомеров или диастереомеров, включены в объем настоящего изобретения. Рацемические смеси разделяют на индивидуальные, по существу оптически чистые изомеры при помощи хорошо известных способов, таких как, например, разделение диастереомерных солей, образованных оптически активными добавками, например, кислотами или основаниями с последующим превращением обратно в оптически активные вещества. В большинстве случаев целевой оптический изомер синтезируют при помощи стереоспецифических реакций, применяя в качестве исходного подходящий стереоизомер целевого соединения. Соединения согласно настоящему изобретению в некоторых случаях также могут существовать в виде таутомерных изомеров. Хотя может быть изображен только один таутомер, все такие формы включены в объем настоящего изобретения. Например, ен-амин таутомеры могут существовать для систем пурина, пиримидина, имидазола, гуанидина, амидина и тетразола, и все их возможные таутомерные формы включены в объем настоящего изобретения. Соли и гидраты Примеры физиологически или фармацевтически приемлемых солей соединений согласно настоящему изобретению включают соли, полученные из соответствующих оснований, таких как соли щелочных металлов (например, натрия), щелочно-земельных металлов (например, магния), аммония и NX4+(где X представляет собой С 1-С 4 алкил). Физиологически приемлемые соли замещения атома водорода или аминогруппы включают соли органических карбоновых кислот, таких как уксусная, бензойная, мо-7 023644 лочная, фумаровая, винная, малеиновая, малоновая, яблочная, изетионовая, лактобионовая и янтарная кислоты; органических сульфокислоты, таких как метансульфоновая, этансульфоновая, бензолсульфоновая и n-толуолсульфоновая кислоты; и неорганических кислот, таких как соляная, серная, фосфорная и сульфаминовая кислоты. Физиологически приемлемые соли соединения с гидроксигруппой включают анион указанного соединения в сочетании с подходящим катионом, таким как Na+ и NX4+ (где X независимо выбран из Н или С 1-С 4 алкильной группы). Для терапевтического применения соли активных ингредиентов соединений согласно настоящему изобретению обычно должны являться физиологически приемлемыми, т.е., солями, полученными из физиологически приемлемой соли или основания. Однако, соли кислот или оснований, которые не являются физиологически приемлемыми, также можно применять, например, для получения или очистки физиологически приемлемого соединения. Все соли, как полученные из физиологически приемлемой кислоты или основания, так и нет, включены в объем настоящего изобретения. Соли металлов обычно получают путем взаимодействия гидроксида металла с соединением согласно настоящему изобретению. Примеры солей металлов, которые получены таким образом, представляют собой соли, содержащие Li+, Na+ и K+. Менее растворимую соль металла можно осадить из раствора более растворимой соли путем добавления подходящего соединения металла. Кроме того, соли можно получать путем присоединения некоторых неорганических кислот, например, HCl, HBr, H2SO4, H3PO4 или органических сульфокислот, к основным центрам, как правило, аминам,или к кислотным группам. Наконец, следует понимать, что композиции, приведенные в настоящем описании, содержат соединения согласно настоящему изобретению в их неионизированной форме, а также в цвиттерионной форме и в комбинации со стехиометрическими количествами воды в виде гидратов. Также в объем настоящего изобретения включены соли исходных соединений с одной или более аминокислотами. Любые природные или искусственные аминокислоты являются пригодными, в особенности встречающиеся в природе аминокислоты, которые являются компонентами белков, хотя аминокислота обычно представляет собой соединение, в боковой цепи которого содержится основная или кислотная группа, например, лизин, аргинин или глутаминовая кислота, или нейтральная группа, такая как глицин, серии, треонин, аланин, изолейцин или лейцин. Способы ингибирования ВГС Другой аспект настоящего изобретения относится к способам ингибирования активности ВГС,включающим стадию обработки образца, предположительно содержащего ВГС, соединением или композицией согласно настоящему описанию. Соединения согласно настоящему описанию способны выступать в качестве ингибиторов ВГС, в качестве промежуточных соединений для таких ингибиторов или иметь другие применения, как описано ниже. Ингибиторы, как правило, связываются с местами на поверхности или в полостях печени. Соединения, связывающиеся в печени, способны связываться с различной степенью обратимости. Указанные соединения, связывающиеся по существу необратимо, являются идеальными кандидатами для применения в данном способе согласно настоящему описанию. Однажды помеченные, по существу необратимо связывающиеся соединения являются подходящими для применения в качестве зондов для детектирования ВГС. Соответственно, изобретение относится к способам детектирования NS3 в образце, предположительно содержащем ВГС, включающим стадии обработки образца, предположительно содержащего ВГС, композицией, содержащей соединение согласно настоящему описанию, связанное с меткой; и наблюдение влияния образца на активность метки. Подходящие метки хорошо известны в области диагностики и включают стабильные свободные радикалы, фторофоры, радиоизотопы, ферменты, хемилюминесцентные группы и хромогены. Соединения, приведенные в настоящем описании, метят обычным способом с применением функциональных групп, таких как гидроксильные или аминогруппы. В одном из вариантов реализации настоящего изобретения предложено соединение любой из формул (I) и (А 1)-(А 4),которое содержит или которое связано или присоединено к одной или более детектируемым меткам. В контексте настоящего описания образцы, предположительно содержащие ВГС, содержатприродные или искусственные материалы, такие как живые организмы; тканевые или клеточные культуры; биологические образцы, такие как образцы биологических веществ (кровь, сыворотка, моча, спинномозговая жидкость, слезы, мокрота, слюна, образцы тканей и т.п.); лабораторные образцы; образцы еды, воды или воздуха; образцы биопродуктов, такие как клеточные экстракты, в частности, рекомбинантные клетки, участвующие в синтезе целевого гликопротеина; и т.п. Как правило, в образце предполагают содержание ВГС. Образцы можно содержать в любой среде, включая воду и смеси органический растворитель/вода. Образцы включают живые организмы, такие как люди, и искусственные материалы, такие как клеточные культуры. Стадии обработки согласно настоящему описанию включают добавление соединения согласно настоящему описанию к образцу или добавление предшественника композиции к образцу. Стадия добавления включает любой способ введения, описанный выше. Возможно активность ВГС после применения соединения можно наблюдать при помощи любого способа, в том числе прямых или косвенных способов детектирования активности ВГС. Предполагаются для применения количественные, качественные и полуколичественные способы детектирования актив-8 023644 ности ВГС. Обычно применяют один из способов скрининга, описанных выше, однако, любой другой способ, например, наблюдение за физиологическими свойствами живого организма, также является применимым. Многие организмы содержат ВГС. Соединения согласно настоящему описанию являются подходящими для применения для лечения или профилактики состояний, связанных с активацией ВГС у животных или человека. Однако следует иметь в виду, что в скрининг соединениях, способных ингибировать активность ВГС, результаты ферментных анализов не всегда коррелируют с исследованиями клеточных культур. Таким образом, исследование на основе клеток обычно является главным способом скрининга. Фармацевтические составы Соединения согласно настоящему описанию входят в состав с традиционными носителями и вспомогательными веществами, которые выбирают в соответствии с традиционной практикой. Таблетки содержат вспомогательные вещества, глиданты, наполнители, связующие вещества и т.п. Водные составы получают в стерильной форме, а в случае, если предназначены для доставки при помощи способа, отличного от перорального введения, они обычно являются изотоническими. Все составы возможно могут содержать вспомогательные вещества, такие как приведенные в Handbook of Pharmaceutical Excipients(1986). Вспомогательные вещества включают аскорбиновую кислоту и другие антиоксиданты, хелатирующие агенты, такие как ЭДТА, углеводы, такие как декстрин, гидроксиалкилцеллюлоза, гидрокиалкилметилцеллюлоза, стеариновая кислота и т.п. рН составов находится в диапазоне от примерно 3 до примерно 11, но обычно примерно от 7 до 10. Как правило, соединение вводят в дозе от 0,01 мг до 2 г. В одном из вариантов реализации доза составляет от примерно 10 до 450 мг. В другом варианте реализации доза составляет от примерно 25 до примерно 250 мг. В другом варианте реализации доза составляет примерно 50 или 100 мг. В одном из вариантов реализации доза составляет примерно 100 мг. Предполагается, что соединение можно вводить один, два или три раза в день. Хотя для активных ингредиентов возможно индивидуальное введение, предпочтительным является их представление в виде фармацевтических составов. Составы согласно настоящему описанию, как для ветеринарии, так и для применения человеком, содержат по меньшей мере один активный ингредиент,определенный выше, совместно с одним или более приемлемыми носителями для указанного ингредиента и, возможно с другими терапевтическими ингредиентами. Носитель(и) должен являться "приемлемым" с точки зрения совместимости с другими ингредиентами состава и физиологической безопасности для реципиента указанного состава. Составы включают составы, подходящие для вышеуказанных способов введения. В целях удобства составы можно получать в виде стандартной дозированной формы и можно получать при помощи любых способов, хорошо известных в области фармацевтики. Способы и составы, как правило, можно найти вRemington's Pharmaceutical Sciences (Mack Publishing Co., Easton, PA). Указанные способы включают стадию смешения активного ингредиента и носителя, который содержит один или более вспомогательные ингредиенты. В целом, составы получают путем равномерного и тщательного смешения активного ингредиента и жидких носителей или тонко измельченных твердых носителей или обоих указанных носителей, а затем, при необходимости, формования продукта. Составы согласно настоящему описанию, подходящие для перорального введения, могут быть представлены в виде раздельных единиц, таких как капсулы, крахмальные капсулы или таблетки, каждая из которых содержит определенное количество активного ингредиента; в виде порошка или гранул; в виде раствора или суспензии в водной или неводной жидкости; или в виде жидкой эмульсии типа маслов-воде или жидкой эмульсии типа вода-в-масле. Активный ингредиент также можно вводить в виде болюса, электуария или пасты. Таблетку можно получать прессованием или формованием, возможно с одним или более вспомогательными ингредиентами. Прессованные таблетки можно получать в подходящем устройстве прессованием активного ингредиента в свободно-текучей форме, такой как порошок или гранулы, возможно смешанного со связующим веществом, смазывающим веществом, инертным наполнителем, консервантом, поверхностно-активным или диспергирующим агентом. Формованные таблетки можно получать в подходящем устройстве формованием смеси порошкообразного активного ингредиента, увлажненного инертным жидким разбавителем. Таблетки могут содержать оболочку или являться делимыми и возможно их можно получать таким образом, чтобы обеспечить медленное или контролируемое высвобождение активного ингредиента из указанных таблеток. Для введения в глаза или на другие наружные ткани, например рта или кожи, составы предпочтительно применяют в виде топической мази или крема, содержащего активный(е) ингредиент(ы) в количестве, например, от 0,075 до 20% мас./мас. (в том числе, активный(е) ингредиент(ы) в диапазоне между 0,1 и 20% с шагом в 0,1% мас./мас., например, 0,6, 0,7% мас./мас. и т.д.), предпочтительно от 0,2 до 15% мас./мас. и более предпочтительно от 0,5 до 10% мас./мас. При получении в виде мази активные ингредиенты можно применять с парафиновой или водорастворимой мазевой основой. Альтернативно, активные ингредиенты можно получать в виде крема с кремовой основой масло-в-воде. Водная фаза крема может содержать, например, по меньшей мере 30% мас./мас. полиспирта, т.е. спирта, содержащего две или более гидроксильные группы, например, пропиленгликоль, бутан-1,3-диол,маннит, сорбит, глицерин и полиэтиленгликоль (включая ПЭГ 400) и смеси указанных соединений. Топические составы могут предпочтительно включать соединение, которое улучшает абсорбцию или проникновение активного ингредиента внутрь через кожу или другие участки, подвергающиеся воздействию. Примеры указанных веществ, способствующих проникновению через кожу включают диметилсульфоксид и его аналоги. Масляная фаза эмульсий согласно настоящему изобретению может быть составлена из известных ингредиентов известным образом. Хотя фаза может содержать исключительно только эмульгатор (также известный как эмульгент), данная фаза предпочтительно содержит смесь по меньшей мере одного эмульгатора и жира или масла, или и жира, и масла. Предпочтительно гидрофильный эмульгатор содержится вместе с липофильным эмульгатором, выступающим в качестве стабилизатора. Также предпочтительно содержание как масла, так и жира. Эмульгатор(ы) вместе со стабилизатором(ами) или без него образуют так называемый эмульгирующий воск, а воск вместе с маслом и жиром образуют так называемую эмульгирующую мазевую основу, которая образуют масляную диспергированную фазу кремовых составов. Эмульгенты и стабилизаторы эмульсий, подходящие для применения в составах согласно настоящему изобретению, включают Tween 60, Span 80, цетостеариловый спирт, бензиловый спирт, миристиловый спирт, глицерин моностеарат и лаурилсульфат натрия. Выбор подходящих масел или жиров для состава основан на достижении требуемых косметических свойств. Крем предпочтительно должен быть нежирным, не оставляющим пятен и смываемым продуктом с подходящей консистенцией для предотвращения вытекания из туб или других контейнеров. Можно применять моно-или двухосновные алкильные сложные эфиры с линейной или разветвленной цепью,такие как диизоадипат, изоцетилстеарат, пропиленгликолевый сложный диэфир жирных кокосовых кислот, изопропилмиристат, децилолеат, изопропилпальмитат, бутилстеарат, 2-этилгексилпальмитат или смесь сложных эфиров с разветвленной цепью, известную как Crodamol CAP, причем три последних являются предпочтительными сложными эфирами. Указанные соединения можно применять индивидуально или в комбинации в зависимости от требуемых свойств. Альтернативно, применяют липиды с высокой температурой плавления, такие как белый мягкий парафин и/или жидкий парафин или другие минеральные масла. Фармацевтические составы согласно настоящему изобретению содержат одно или более соединения согласно настоящему изобретению вместе с одним или более фармацевтически приемлемыми носителями или вспомогательными веществами и возможно другими терапевтическими агентами. Фармацевтические составы, содержащие активный ингредиент, могут находиться в любой форме, подходящей для назначенного способа введения. Например, для перорального введения можно получать таблетки, формованные пастилки, пастилки, водные или масляные суспензии, диспергируемые порошки или гранулы,эмульсии, твердые или мягкие капсулы, сиропы или эликсиры. Композиции, предназначенные для перорального применения можно получать в соответствии с любым способом, известным в данной области техники для производства фармацевтических композиций, и указанные композиции могут содержать один или более агенты, включая подсластители, вкусоароматические добавки, красители и консерванты,для получения привлекательного препарата. Таблетки, содержащие активный ингредиент в смеси с нетоксичным фармацевтически приемлемым вспомогательным веществом, которое подходит для производства таблеток, являются приемлемыми. Указанные вспомогательные вещества могут представлять собой, например, инертные разбавители, такие как карбонаты натрия или кальция, лактоза, моногидрат лактозы, кроскармеллоза натрия, повидон, фосфаты натрия или кальция; гранулирующие или улучшающие распадаемость агенты, такие как кукурузный крахмал или альгиновая кислота; связывающие агенты,такие как целлюлоза, микрокристаллическая целлюлоза, крахмал, желатин или камедь; и смазывающие агенты, такие как стеарат магния, стеариновая кислота или тальк. Таблетки могут являться безоболочечными или могут быть покрыты оболочкой при помощи известных способов, включая микроинкапсулирование, для задержки разложения и поглощения в желудочно-кишечном тракте и, таким образом, обеспечения замедленного действия в течение длительного периода. Например, можно применять вещество с замедленным высвобождением, такое как глицерилмоностеарат или глицерилдистеарат, индивидуально или с воском. Составы для перорального применения также могут быть представлены в виде твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем, например фосфатом кальция или каолином, или мягких желатиновых капсул, в которых активный ингредиент смешан с водной или масляной средой, такой как арахисовое масло, жидкий парафин или оливковое масло. Водные суспензии согласно настоящему изобретению содержат активные вещества в смеси с вспомогательными веществами, подходящими для производства водных суспензий. Указанные вспомогательные вещества включают суспендирующий агент, такой как карбоксиметилцеллюлоза натрия, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакантовая камедь и аравийская камедь, и диспергирующий или увлажняющий агент, такой как природный фосфатид (например, лецитин), продукт конденсации алкиленоксида и жирной кислоты (например, полиоксиэтиленстеарат), продукт конденсации этиленоксида и длинноцепочечного алифатического спирта (на- 10023644 пример, гептадекаэтиленоксицетанол), продукт конденсации этиленоксида и неполного сложного эфира,полученного из жирной кислоты и ангидрида гексита (например, полиоксиэтиленсорбитана моноолеат). Водная суспензия также может содержать один или более консервант, такой как этил или н-пропил-nгидроксибензоат, один или более краситель, одну или более вкусоароматическую добавку и один или более подсластитель, такие как сахароза или сахарин. Масляные суспензии можно получать путем суспендирования активного ингредиента в растительном масле, таком как арахисовое масло, оливковое масло, кунжутное масло или кокосовое масло, или в минеральном масле, таком как жидкий парафин. Пероральные суспензии могут содержать загуститель,такой как пчелиный воск, твердый парафин или цетиловый спирт. Для получения привлекательных пероральных препаратов можно добавлять подсластители, например, представленные выше, и вкусоароматические добавки. Указанные композиции можно консервировать при помощи добавления антиоксиданта, такого как аскорбиновая кислота. Диспергируемые порошки и гранулы согласно настоящему изобретению, подходящие для получения водной суспензии путем добавления воды, содержат активный ингредиент в смеси с диспергирующим или увлажняющим агентом, суспендирующим агентом и одним или более консервантами. Подходящие диспергирующие или увлажняющие агенты и суспендирующие агенты представлены агентами,описанными выше. Также могут содержаться дополнительные вспомогательные вещества, например,подсластители, вкусоароматические добавки и красители. Фармацевтические композиции согласно настоящему изобретению также могут находиться в виде эмульсий типа масло-в-воде. Масляная фаза может представлять собой растительное масло, такое как оливковое масло или арахисовое масло, минеральное масло, такое как жидкий парафин, или их смесь. Подходящие эмульгаторы включают природную камедь, такую как аравийская камедь и трагакантовая камедь, природные фосфатиды, такие как соевый лецитин, сложные эфиры или неполные сложные эфиры, полученные из жирных кислот и ангидридов гексита, такие как сорбитана моноолеат, и продукты конденсации указанных неполных эфиров и этиленоксида, такие как полиоксиэтиленсорбитана моноолеат. Эмульсия также может содержать подсластители и вкусоароматические добавки. Сиропы и эликсиры можно получать с подсластителями, такими как глицерин, сорбит или сахароза. Указанные составы также могут содержать средство, уменьшающее раздражение, консервант, вкусоароматическую добавку или краситель. Фармацевтические композиции согласно настоящему изобретению могут находиться в виде стерильного инъецируемого препарата, такого как стерильная инъецируемая водная или масляная суспензия. Указанную суспензию можно получать согласно уровню техники с применением диспергирующих или увлажняющих агентов и суспендирующих агентов, указанных выше. Стерильный инъецируемый препарат также может представлять собой стерильный инъецируемый раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе, такой, как раствор в 1,3-бутандиоле или полученный в виде лиофилизированного порошка. В число приемлемых носителей и растворителей,которые можно применять, входят вода, раствор Рингера и изотонический раствор хлорида натрия. В дополнение, в качестве растворителя или суспендирующей среды можно применять стерильные нелетучие масла. С указанной целью также можно применять любые не раздражающие нелетучие масла, включая синтетические моно-или диглицериды. Дополнительно для получения инъецируемых препаратов также можно применять жирные кислоты, такие как олеиновая кислота. Количество активного ингредиента, которое можно смешивать с носителем с получением стандартной лекарственной формы, варьируется в зависимости от субъекта лечения и конкретного способа введения. Например, состав с длительным высвобождением, предназначенный для перорального введения людям, может содержать примерно от 1 до 1000 мг активного вещества, смешанного с подходящим и соответствующим количеством носителя, которое может изменяться примерно от 5 до 95% композиции мас./мас. Фармацевтическую композицию можно получать для обеспечения легко измеряемых количеств для введения. Например, водный раствор, предназначенный для внутривенной инфузии, может содержать примерно от 3 до 500 мкг активного ингредиента на миллилитр раствора так, чтобы обеспечить прохождение инфузии подходящего объема со скоростью, равной примерно 30 мл/ч. Составы, подходящие для введения в глаза включают глазные капли, в которых активный ингредиент растворен или суспендирован в подходящем носителе, особенно в водном растворителе активного ингредиента. Активный ингредиент предпочтительно содержится в указанных составах в концентрации от 0,5 до 20%, преимущественно от 0,5 до 10%, в частности примерно 1,5% мас./мас. Составы, подходящие для топического введения в рот, включают пастилки, содержащие активный ингредиент в основе со вкусоароматической добавкой, обычно сахарозе и аравийской камеди или трагакантовой камеди; пастилы, содержащие активный ингредиент в инертной основе, такой как желатин и глицерин, или сахароза и аравийская камедь; и растворы для полоскания рта, содержащие активный ингредиент в подходящем жидком носителе. Составы для ректального введения могут существовать в виде суппозиториев с подходящей основой, содержащих, например, масло какао или салицилат. Составы, подходящие для внутрилегочного или назального введения, имеют размер частиц, напри- 11023644 мер, в диапазоне от 0,1 до 500 микрон (включая размеры частиц в диапазоне между 0,1 и 500 микрон с шагами в микронах, таких как 0,5, 1, 30, 35 микрон и т.д.), которые вводят при помощи быстрой ингаляции через носовой канал или при помощи ингаляции через рот для обеспечения доставки в альвеолярные мешочки. Подходящие составы включают водные или масляные растворы активного ингредиента. Составы, подходящие для введения в виде аэрозоля или сухого порошка, можно получать в соответствии с традиционными способами и доставлять с другими терапевтическими агентами, такими как соединения,которые до настоящего времени применяют для лечения или профилактики состояний, связанных с активностью ВГС. Составы, подходящие для вагинального введения, могут существовать в виде пессариев, тампонов,кремов, гелей, паст, пен или спреев, содержащих, в дополнение к активному ингредиенту, подходящие носители, известные в данной области техники. Составы, подходящие для парентерального введения, включают водный или неводные стерильные инъецируемые растворы, которые могут содержать антиоксиданты, буферы, бактериостаты и растворенные вещества, которые превращают раствор в изотонический с кровью предполагаемого реципиента; и водные и неводные стерильные суспензии, которые могут содержать суспендирующие агенты и загустители. Составы находятся в одноразовых контейнерах или контейнерах, содержащих несколько доз, например, в запаянных ампулах и пробирках, и могут храниться в полученном в результате сублимационной сушки (лиофилизированном) состоянии, которое требует только добавления стерильного жидкого носителя, например, воды для инъекций, непосредственно перед применением. Приготовленные для немедленного применения инъецируемые растворы и суспензии получают из стерильных порошков, гранул и таблеток, описанных ранее. Предпочтительные стандартные дозированные составы представляют собой составы, содержащие дневную дозу или единичную дневную поддозу активного ингредиента, как представлено выше в настоящем описании, или подходящую часть указанной дозы. Следует понимать, что в дополнение к ингредиентам, конкретно представленным выше, составы согласно настоящему изобретению могут содержать другие агенты, общепринятые в данной области техники, имеющие отношение к данному типу состава, например, составы, подходящие для перорального введения могут содержать вкусоароматические добавки. В изобретении дополнительно предложены ветеринарные композиции, содержащие по меньшей мере один активный ингредиент, определенный выше, вместе с ветеринарным носителем для указанного ингредиента. Ветеринарные носители представляют собой вещества, подходящие для применения для введения композиции, и могут представлять собой твердые, жидкие или газообразные вещества, которые являются инертными или приемлемыми в области ветеринарии и являются совместимыми с активным ингредиентом. Указанные ветеринарные композиции можно вводить перорально, парентерально или при помощи любого другого требуемого способа. Соединения согласно настоящему изобретению также применяют для обеспечения контролируемого высвобождения активного ингредиента для достижения меньшей частоты дозирования или для улучшения фармакокинетических или токсичных свойств активного ингредиента. Соответственно, в настоящем изобретении также предложены композиции, содержащие одно или более соединения согласно настоящему изобретению, полученные для обеспечения замедленного или контролируемого высвобождения. Эффективная доза активного ингредиента зависит по меньшей мере от природы состояния, требующего лечения, токсичности, профилактического применения соединения (меньшие дозы), способа доставки и фармацевтического состава, и определяется лечащим врачом с применением традиционных исследований с увеличением дозы. Способы введения Одно или более соединения согласно настоящему изобретению (называемые в настоящем описании активными ингредиентами) вводят любыми способами, подходящими для состояния, требующего лечения. Подходящие способы включают пероральный, ректальный, назальный, топический (включая буккальный и подъязычный), вагинальный и парентеральный (включая подкожный, внутримышечный,внутривенный, внутрикожный, интратекальный и эпидуральный) и т.п. Следует иметь в виду, что предпочтительный способ может изменяться в зависимости, например, от состояния реципиента. Преимуществом соединений согласно настоящему изобретению является то, что указанные соединения являются перорально биодоступными и могут быть дозированы перорально. Комбинированная терапия ВГС В другом варианте реализации не ограничивающие примеры подходящих комбинаций включают комбинации соединения согласно настоящему описанию с одним или более интерферонами, рибавирином или аналогами указанных соединений, ингибиторами NS3 протеазы ВГС, ингибиторами альфаглюкозидазы 1, гепатопротекторами, нуклеозидными или нуклеотидными ингибиторами NS5B полимеразы ВГС, ненуклеозидными ингибиторами NS5B полимеразы ВГС, ингибиторами NS5A ВГС, агонистами TLR-7, ингибиторами циклофилина, ингибиторами IRES ВГС, фармакокинетическими усилителя- 12023644 ми и другими лекарственными средствами или терапевтическими агентами для лечения ВГС. Более конкретно, одно или более соединения, представленные в настоящем описании, можно объединять с одним или более соединениями, выбранными из группы, состоящей из 1) интерферонов, например, пегилированного рИФН-альфа 2b (ПЕГ-Интрон), пегилированного рИФНальфа 2 а (Пегасис), рИФН-альфа 2b (Интрон А), рИФН-альфа 2 а (Роферон-А), интерферона альфа (MOR-22,ОРС-18, Альфаферон, Alfanative, Мультиферон, субалин), интерферона альфакон-1 (Инферген), интерферона альфа-n1 (Вэллферон), интерферона альфа-n3 (Альферон), интерферона-бета (Авонекс, DL-8234), интерферона-омега (омега DUROS, Biomed 510), альбинтерферона альфа-2b (Альбуферон), ИФН альфа-2b XL, BLX-883SM-360320; 10) ингибиторов циклофилина, например, DEBIO-025, SCY-635 NIM811; 11) ингибиторов IRES ВГС, например, MCI-067; 12) фармакокинетических усилителей, например, BAS-100, SPI-452, PF-4194477, ТМС-41629, GS-9350,GS-9585 и рокситромицина; и 13) других лекарственных средств для лечения ВГС, например, тимозина альфа-1 (Задаксин), нитазоксанида (Alinea, NTZ), BIVN-401 (виростат), PYN-17 (altirex), KPE02003002, актилона (CPG-10101), GS-9525,KRN-7000, цивацира, GI-5005, XTL-6865, BIT225, РТХ-111, ITX2865, TT-033i, ANA 971, NOV-205, тарвацина, ЕНС-18, VGX-410C, EMZ-702, AVI 4065, BMS-650032, BMS-791325, Бавитуксимаба, MDX-1106 (ONO4538), Оглуфанида и VX-497 (меримеподиб). Более конкретно, одно или более соединения, представленные в настоящем описании, можно объединять с одним или более соединениями, выбранными из группы, состоящей из ненуклеозидных ингибиторовNS5B полимеразы ВГС (АВТ-072 и АВТ-333), ингибиторов NS5A ВГС (АСН-3102 и АСН-2928) и ингибиторов NS3 протеазы ВГС (АВТ-450 и АСН-1625). В другом варианте реализации настоящей заявки описаны фармацевтические композиции, содержащие соединение согласно настоящему изобретению, или фармацевтически приемлемую соль, сольват и/или сложный эфир указанного соединения, в комбинации с по меньшей мере одним дополнительным терапевтическим агентом, и фармацевтически приемлемым носителем или вспомогательным веществом. Согласно настоящему изобретению терапевтический агент, применяемый в комбинации с соединением согласно настоящему изобретению, ингибиторы NS5b полимеразы и другие лекарственные средства для лечения ВГС. В другом варианте реализации предложена фармацевтическая композиция, содержащая соединение,представленное в настоящем описании, и нуклеозидные или нуклеотидные ингибиторы NS5B полимеразы ВГС и возможно интерферон или рибавирин. В одном из вариантов реализации соединение представляет собой метил-(2S)-1-[(2S,5S)-2-(9-2-[(2S,4S)-1-(2R)-2-[(метоксикарбонил)амино]-2-фенилацетил-4-(метоксиметил)пирролидин-2-ил]-1H-имидазол-5-ил-1,11-дигидроизохромено[4',3':6,7]нафто[1,2-d]имидазол-2-ил)-5 метилпирролидин-1-ил]-3-метил-1-оксобутан-2-илкарбамат, имеющий формулу а ингибитор представляет собой софосбувир. Комбинации соединений согласно настоящему изобретению и дополнительных активных терапевтических агентов можно выбирать для лечения пациентов, инфицированных ВГС, и других состояний,таких как инфекции ВИЧ. Соответственно, соединения согласно настоящему изобретению можно объединять с одним или более соединениями, подходящими для применения для лечения ВИЧ, например, с соединениями, ингибирующими протеазу ВИЧ, ненуклеозидными ингибиторами обратной транскриптазы ВИЧ, нуклеозидными ингибиторами обратной транскриптазы ВИЧ, нуклеотидными ингибиторами обратной транскриптазы ВИЧ, ингибиторами интегразы ВИЧ, ингибиторами gp41, ингибиторамиCXCR4, ингибиторами gp120, ингибиторами CCR5, интерферонами, аналогами рибавирина, ингибиторами NS3 протеазы, ингибиторами NS5b полимеразы, ингибиторами альфа-глюкозидазы 1, гепатопротекторами, ненуклеозидными ингибиторами ВГС и другими лекарственными средствами для лечения ВГС. Более конкретно, одно или более соединения согласно настоящему изобретению можно объединять с одним или более соединениями, выбранными из группы, состоящей из 1) ингибиторов протеазы ВИЧ,например, ампренавира, атазанавира, фосампренавира, индинавира, лопинавира, ритонавира, лопинавира+ритонавира, нелфавира, сахинавира, типранавира, бреканавина, дарунавира, ТМС-126, ТМС-114, мозенавира (DMP-450), JE-2147 (AG1776), AG1859, DG35, L-756423, RO0334649, KNI-272, DPC-681, DPC684 и GW640385X, DG17, PPL-100, 2) ненуклеозидных ингибиторов обратной транскриптазы ВИЧ, например, каправирина, эмивирина, делавиридина, эфавиренца, невирапина, (+) каланолида А, этравирина,GW5634, DPC-083, DPC-961, DPC-963, MIV-150 и ТМС-120, ТМС-278 (рилпивирина), эфавиренца, BILR 355 BS, VRX 840773, UK-453,061, RDEA806, 3) нуклеозидных ингибиторов обратной транскриптазы ВИЧ, например, зидовудина, эмтрицитабина, диданозина, ставудина, залцитабина, ламивудина, абакавира, амдоксовира, элвуцитабина, аловудина, MIV-210, рацивира (+-FTC), D-d4FC, эмтрицитабина, фосфазида, фозивудина тидоксила, фосалвудина тидоксила, априцитибина (AVX754), амдоксовира, KP-1461,абакавира + ламивудина, абакавира + ламивудина + зидовудина, зидовудина + ламивудина, 4) нуклеотидных ингибиторов обратной транскриптазы ВИЧ, например, тенофовира, тенофовира дизопроксилфумарата + эмтрицитабина, тенофовира дизопроксил фумарата + эмтрицитабина + эфавиренца и адефовира, 5) ингибиторов интегразы ВИЧ, например, куркумина, производных куркумина, цикориевой кислоты,производных цикориевой кислоты, 3,5-дикофеилхиновой кислоты, производных 3,5-дикофеилхиновой кислоты, ауринтрикарбоновой кислоты, ауринтрикарбоновой кислоты, производных ауринтрикарбоновой кислоты, сложного фенэтилового эфира кофейной кислоты, производных сложного фенэтилового эфира кофейной кислоты, тирфостина, производных тирфостина, кверцетина, производных кверцетина,S-1360, зинтевира (AR-177), L-870812 и L-870810, MK-0518 (ралтегравир), BMS-707035, МК-2048, ВА 011, BMS-538158, GSK364735C, 6) ингибиторов gp41, например, энфувиртида, сифувиртида, FB006M,TRI-1144, SPC3, DES6, Locus gp41, CovX и REP 9, 7) ингибиторов CXCR4, например, AMD-070, 8) ингибиторов входа, например, SP01A, TNX-355, 9) ингибиторов gp120, например, BMS-488043 и(тарибавирин), 14) ингибиторов NS5a, например, А-831, А-689 и BMS-790052, 15) ингибиторов NS5b полимеразы, например, NM-283, валопицитабина, R1626, PSI-6130 (R1656), PSI-7851, PSI-7977, HCV796, BILB 1941, MK-0608, NM-107, R7128, VCH-759, PF-868554, GSK625433 и XTL-2125, 16) ингибиторов NS3 протеазы, например, SCH-503034 (SCH-7), VX-950 (Телапревира), ITMN-191 и BILN-2065, 17) ингибиторов альфа-глюкозидазы 1, например, МХ-3253 (целгосивир) и UT-231B, 18) гепатопротекторов,например, IDN-6556, ME 3738, MitoQ и LB-84451, 19) ненуклеозидных ингибиторов ВГС, например,производных бензимидазола, производных бензо-1,2,4-тиадиазина и производных фенилаланина, 20) других лекарственных средств для лечения гепатита С, например, задаксина, нитазоксанида (alinea),BIVN-401 (виростат), DEBIO-025, VGX-410C, EMZ-702, AVI 4065, бавитуксимаба, оглуфанида, PYN-17,KPE02003002, актилона (CPG-10101), KRN-7000, цивацира, GI-5005, ANA-975 (изаторибин), XTL-6865,ANA 971, NOV-205, тарвацина, ЕНС-18 и NIM811, 21) фармакокинетических усилителей, например,BAS-100 и SPI452, 22) ингибиторов РНКазы Н, например, ODN-93 и ODN-112, 23) других анти-ВИЧ агентов, например, VGV-1, РА-457 (бевиримат), амплигена, HRG214, цитолина, полимуна, VGX-410,KD247, AMZ 0026, CYT 99007, А-221 HIV, BAY 50-4798, MDX010 (иплимумаб), PBS119, ALG889 и РА 1050040. Предполагается, что второй терапевтический агент вводят способом, известным в данной области техники, и дозу определяет специалист в данной области техники. Например, второй агент можно вводить в дозе от примерно 0,01 мг до примерно 2 г в день. Метаболиты соединений Также в рамки настоящего изобретения включены продукты метаболизма in vivo соединений, представленных в настоящем описании. Указанные продукты можно получать, например, в результате окисления, восстановления, гидролиза, амидирования, этерификации и т.п. введенного соединения, главным образом вследствие ферментных процессов. Соответственно, изобретение включает соединения, полученные в результате процесса, включающего приведение в контакт соединения согласно настоящему изобретению и млекопитающего в течение периода времени, достаточного для получения метаболического продукта указанного соединения. Указанные продукты, как правило, определяют путем получения радиомеченого (например, С 14 или Н 3) соединения согласно настоящему изобретению, введения указанного соединения парентерально в детектируемой дозе (например, больше чем примерно 0,5 мг/кг) животному, такому как крыса, мышь, морская свинка, обезьяна или человек, выдерживания в течение времени, достаточного для прохождения метаболизма (как правило, примерно от 30 с до 30 ч) и выделения продуктов конверсии указанных соединений из мочи, крови или других биологических образцов. Указанные продукты легко выделять, так как они являются мечеными (другие выделяют путем применения антител, способных связывать эпитопы, сохраняющиеся в метаболите). Структуры метаболита определяют традиционным способом, например, при помощи анализа МС или ЯМР. В целом, анализ метаболитов проводят аналогично традиционным исследованиям метаболизма лекарственных средств, хорошо известным специалистам в данной области техники. Продукты конверсии, если они не присутствуют invivo в другом виде, являются подходящими для применения для диагностических исследований терапевтического дозирования соединений согласно настоящему описанию, даже если они не обладают активностью, ингибирующей полимеразу ВГС, сами по себе. Известны способы определения стабильности соединений в суррогатных желудочно-кишечных секрециях. Примеры способов получения соединений Настоящее изобретение также относится к способам получения композиций согласно настоящему описанию. Композиции получают при помощи любых подходящих способов органического синтеза. Многие такие способы хорошо известны в данной области техники. Однако многие из известных способов проработаны в Compendium of Organic Synthetic Methods (John WileySons, New York), Vol. 1, IanYork, 1985), Comprehensive Organic Synthesis. Selectivity, StrategyEfficiency in Modern Organic Chemistry. В 9 Volumes, Barry M. Trost, Editor-in-Chief (Pergamon Press, New York, 1993 тираж). Другие способы,подходящие для получения соединений согласно настоящему описанию, приведены в международной патентной заявке WO 2006/020276. Ряд примеров способов получения композиций согласно настоящему описанию приведен в схемах и примерах ниже. Указанные способы приведены для иллюстрации природы подобных способов получения и не ограничивают объем применяемых способов. В целом, условия реакции, такие как температура, время реакции, растворители, процедуры обработки и т.п., являются условиями, традиционно применяемыми в данной области техники для проведения конкретной реакции. Приведенные справочные материалы совместно с перечисленными материалами содержат подробные описания указанных условий. Обычно температура находится в диапазоне от-100 до 200 С, растворители являются апротонными или протонными, а время реакции составляет от 10 с до 10 дней. Обработка обычно состоит из гашения непрореагировавших реагентов с последующим разделением между водным/органическим слоями (экстракция) и отделением слоя, содержащего продукт. Реакции окисления и восстановления обычно проводят при температурах, близких к комнатной температуре (около 20 С), хотя для реакций восстановления гидридов металлов температуру часто понижают до значений от 0 до -100 С, для реакций восстановления растворители обычно являются апротонными, а для реакций окисления могут являться как протонными, так и апротонными. Время реакции регулируют для достижения целевых значений конверсии. Реакции конденсации обычно проводят при температурах, близких к комнатной температуре, хотя для неравновесных, кинетически контролируемых реакций конденсации также распространены пониженные температуры (от 0 до -100 С). Растворители могут являться протонными (обычно для равновесных реакций) или апротонными (обычно для кинетически контролируемых реакций). Стандартные способы синтеза, такие как азеотропное удаление побочных продуктов реакции и применение безводных условий реакции (например, среды, состоящие из инертного газа), широко распространены в данной области техники и применяются, если являются приемлемыми. Термины "обработанный", "обработка", "обрабатывать" и т.п., в контексте химических способов синтеза, обозначают контактирование, смешение, реагирование, введение в реакцию, приведение в контакт и другие термины, широко распространенные в данной области техники, указывающие на то, что одно или более химические соединения обрабатывали указанным способом для превращение в одно или более другие химические соединения. Это означает, что "обработка соединения один соединением два" является синонимом выражениям "приведение соединения один в реакцию с соединением два", "привести соединение один в контакт с соединением два", "реагирование соединения один с соединением два" и другим выражениям, широко распространенным в области органического синтеза, для уместного обозначения того, что соединение один "было обработано", "прореагировало", "было введено в реакцию" и т.п. с соединением два. Например, обработка означает уместный и обычный способ, в котором органические химические вещества вводят в реакцию. Если не указано иное, подразумевают нормальные концентрации (от 0,01 до 10 М, обычно от 0,1 до 1 М), температуры (от -100 до 250 С, обычно от -78 до 150 С,более типично от -78 до 100 С, еще более типично от 0 до 100 С), реакционные сосуды (обычно стеклянные, пластиковые, металлические), растворители, давления и атмосферы (обычно воздушная для реакций, не чувствительных к кислороду и воде, и азотная или аргонная, для реакций, чувствительных к кислороду и воде) и т.д. Сведения о схожих реакциях, известных в области органического синтеза, применяют при выборе условий и устройств для "обработки" в данном способе. В частности, специалист в области органического синтеза выбирает условия и устройства, предполагая успешное проведение химических реакций, описанных способов на основе сведений в данной области техники. Изменения в каждой из типовых схем и в примерах (далее, "типовые схемы") приводят к получению различных аналогов конкретных типовых соединений. Вышеприведенные цитаты описания подходящих способов органического синтеза подходят для проведения указанных изменений. В каждой из типовых схем может являться предпочтительным отделение продуктов реакции друг от друга и/или от исходных материалов. Целевые продукты каждой стадии или ряда стадий разделяют и/или очищают (далее, выделяют) до требуемой степени гомогенности при помощи способов, широко распространенных в данной области техники. Обычно указанное разделение включает многофазную экстракцию, кристаллизацию из растворителя или смеси растворителей, дистилляцию, сублимацию или хроматографию. Хроматография может включать любое количество способов, включая, например, обращено-фазовую и нормально-фазовую; эксклюзионную; ионообменную; жидкостную хроматографию высокого, среднего и низкого давления; мелкомасштабную аналитическую; хроматографию с псевдодвижущимся слоем (ПДС) и препаративную тонко- и толстослойную хроматографию, а также мелкомасштабную тонкослойную и флэш-хроматографию. Другой класс способов разделения включает обработку смеси реагентом, выбранным для связывания или другого способа разделения целевого продукта, непрореагировавшего исходного вещества, побочного продукта реакции и т.п. Указанные реагенты включают адсорбенты или абсорбенты, такие как активированный уголь, молекулярные сита, ионообменные среды и т.п. Альтернативно, реагенты могут являться кислотами в случае основного материала или основаниями в случае кислотного материала, связывающими реагентами, такими как антитела, связывающие белки, селективными хелатирующими агентами, такими как краун-эфиры, реагенты для жидкостной/жидкостной ионной экстракции (LIX) и т.п. Выбор соответствующих способов разделения зависит от природы применяемых соединений. Например, температуры кипения и молекулярного веса в дистилляции и сублимации, наличия или отсутствия полярных функциональных групп в хроматографии, стабильности соединений в кислотной и щелочной среде в многофазной экстракции и т.п. Специалист в данной области техники применяет способы,наиболее подходящие для проведения требуемого разделения. Индивидуальный стереоизомер, например, энантиомер, по существу, не содержащий своего стереоизомера, можно получать путем разделения рацемической смеси с использованием способа, такого как образование диастереомеров при помощи оптически активного разделяющего агента (Stereochemistry ofCarbon Compounds, (1962) by E. L. Eliel, McGraw Hill; Lochmuller, С. Н., (1975) J. Chromatogr., 113, 3) 283302). Рацемические смеси хиральных соединений согласно настоящему описанию можно разделять и выделять при помощи любого подходящего способа, в том числе:(1) образование ионных диастереомерных солей с хиральными соединениями и разделение при помощи фракционной кристаллизации или других способов, (2) образование дистереомерных соединений с хиральными дериватизирующими агентами, разделение диастереомеров и превращение в чистые стереоизомеры, и (3) разделение, по существу,чистых стереоизомеров или стереоизомеров с преимущественным содержанием одного оптического изомера непосредственно в хиральных условиях. Согласно способу (1) диастереомерные соли можно получать при помощи взаимодействия энантиомерно чистых хиральных оснований, таких как бруцин, хинин, эфедрин, стрихнин, -метилфенилэтиламин (амфетамин) и т.п., с асимметричными соединениями, содержащими кислотные функциональные группы, такими как карбоновые кислоты и сульфоновые кислоты. Диастереомерные соли можно разделять при помощи фракционной кристаллизации или ионной хроматографии. При разделении оптических изомеров аминосоединений добавление хиральных карбоксильных или сульфоновых кислот, таких как камфорсульфоновая кислота, винная кислота, миндальная кислота или молочная кислота, может приводить к образованию диастереомерных солей. Альтернативно, согласно способу (2) субстрат, который требуется разделить, взаимодействует с одним энантиомером хирального соединения с образованием диастереомерной пары (Eliel, E. and Wilen, S.(1994) Stereochemistry of Organic Compounds, John WileySons, Inc., p. 322). Диастереомерные соединения можно получать при помощи взаимодействия асимметричных соединений с энантиомерно чистыми хиральными дериватизирующими реагентами, такими как производные ментола, с последующим разделением диастереомеров и гидролизом с получением чистых субстратов с преимущественным содержанием одного оптического изомера. Способ определения оптической чистоты включает получение хиральных сложных эфиров, таких как сложный ментоловый эфир, например, (-) сложный ментоловый эфир хлормуравьиной кислоты, в присутствии основания, или рацемической смеси эфира Мошера, -метокси-(трифторметил)фенилацетата (Jacob III. (1982) J. Org. Chem. 47:4165), и анализ спектра ЯМР на наличие двух атропизомерных диастереомеров. Стабильные диастереомеры атропизомерных соединений можно разделять и выделять при помощи нормально- и обращенно-фазовой хроматографии в соответствии со способами разделения атропизомерных нафтилизохинолинов (Ноуе, Т., WO 96/15111). Согласно способу (3), рацемическую смесь двух энантиомеров можно разделять при помощи хроматографии с применением хиральной неподвижной фазы (Chiral Liquid Chromatography (1989) W. J. Lough, Ed. Chapman and Hall, New York; Okamoto, (1990) J. of Chromatogr. 513:375-378). Энантиомеры с преимущественным содержанием одного оптического изомера или очищенные энантиомеры можно различать при помощи способов, применяемых для других хиральных молекул с асимметричными атомами углерода, таких как оптическое вращение и круговой дихроизм. Схемы и примеры Общие аспекты указанных типовых способов описаны ниже и в Примерах. Каждый из продуктов,полученных при помощи нижеприведенных способов, возможно разделяли, выделяли и/или очищали перед дальнейшим применением. В нижеприведенных примерах представлен ряд типовых способов получения соединений согласно настоящему описанию. Указанные способы приведены для иллюстрации природы подобных способов получения и не ограничивают объем применяемых способов. Некоторые соединения согласно настоящему описанию можно применять в качестве промежуточных соединений для получения других соединений согласно настоящему описанию. В типовых способах, приведенных в настоящем описании, фрагмент E-V-также можно быть записан, как R9-. ЗГ представляет собой защитную группу, широко применяемую для данной функциональной группы, к которой она присоединена. Введение и удаление защитной группы можно осуществлять с применением стандартных способов, таких как способы, приведенные в Wuts, P. G. М., Greene, Т. Protective Groups in Organic Synthesis, 4th ed.; John WileySons, Inc.: Hoboken, New Jersey, 2007. Схема 1. Типовой синтез E-V-C(=O)-P-W-P-C(=O)-V-E На схеме 1 приведен общий синтез молекулы E-V-C(=O)-P-W-P-C(=O)-V-E согласно настоящему описанию, где, в иллюстративных целях, Е представляет собой метоксикарбониламино. Обработка 1 а или 1 с одним или двумя эквивалентами метилового эфира хлормуравьиной кислоты, соответственно, в щелочных условиях (например, гидроксид натрия) приводит к образованию молекулы 1b или 1d. Схема 2. Типовой синтез E-V-C(=O)-P-W-P-C(=O)-V-E На схеме 2 приведен общий синтез молекулы E-V-C(=O)-P-W-P-C(=O)-V-E согласно настоящему описанию, где, в иллюстративных целях, Р представляет собой пирролидин. Связывание амина 2 а с кислотой 2b с применением пептидного связующего реагента (например, HATU) приводит к образованию 2 с. Альтернативно, связывание амина 2d с двумя эквивалентами 2b проводят в условиях, подобных условиям для получения 2 е. На схеме 6 приведен общий синтез промежуточного соединения R1-V-C(=O)-P-R2, где, в иллюстративных целях, Р представляет собой пирролидин, R1 представляет собой родственную группу, которая обозначена, как-Е или аминозащитная группа, a R2 представляет собой родственную группу, которая обозначена как-W-P-C(=O)-V-E,-W-P-C(=O)-V-NH-PG,-W-P-NH-PG или-W-NH-PG. Связывание амина 6 а(или 6d, 6h, 6k) с кислотой 6b или 6 е с применением пептидного связующего реагента (например, HATU) приводит к получению 6 с (или 6f, 6g, 6i, 6j, 6l, 6m) соответственно. Схема 7. Типовой синтез E-V-C(=O)-R1 На схеме 7 приведен общий синтез промежуточного соединения E-V-C(=O)-R1, где, в иллюстратив- 18023644 ных целях, Е представляет собой метоксикарбониламино и R1 представляет собой родственную группу,которая обозначена как-P-W-P-C(=O)-V-NH-PG,-P-W-P-PG,-P-W-PG,-P-PG или-O-PG. Обработка 7 а (или 7 с, 7 е, 7g, 7i) метиловым эфиром хлормуравьиной кислоты в щелочных условиях (например, гидроксид натрия) приводит к образованию молекулы 7b (или 7d, 7f, 7h, 7j). Схема 9. Типовой синтез R1-P-R2 На схеме 9 приведен общий синтез промежуточного соединения R1-P-R2, где, в иллюстративных целях, R1 представляет собой-C(=O)-V-E или защитную группу, a R2 представляет собой замещенный бензимидазол. Получение бензимидазола путем связывания кислоты 9b или 9 е с ариламином 9 а с применением пептидного связующего реагента, такого как HATU, приводит к получению 9 с или 9d. Циклизация амида в присутствии кислоты (такой как уксусная кислота) приводит к получению молекул, содержащих бензимидазол, 9d или 9g. Получение множества бензимидазолов осуществляют аналогичным способом, начиная с бисдиамина с получением соответствующего бис-бензимидазола. Схема 20. Типовой синтез R1-P-W-P-R2 На схеме 20 приведен общий синтез промежуточного соединения согласно настоящему описаниюR1-P-W-P-R2, где, в иллюстративных целях, R1 и R2 независимо представляют собой защитные группы, aW представляет собой фрагмент из двух ароматических колец, образованный путем циклизации, опосре- 19023644 дованной переходным металлом. Алкилирование фенола 20b алкилбромидом, таким как 20 а, приводит к образованию эфира 20 с. Циклизация ароматических колец в присутствии палладиевого катализатора приводит к образованию соединения 20d. Обработка 20d при помощи CuBr2 приводит к образованию агалогенкетона 20 е, из которого в результате добавления кислоты в щелочных условиях (например, Et3N) образуется 20f. Взаимодействие 20f с амином или солью амина (например, ацетатом аммония) приводит к образованию молекулы, содержащей имидазол, 20g. Окисление 20g, 20i или 20l можно осуществлять путем нагревания в присутствии MnO2 с образованием 20h, 20j или 20m соответственно. Превращение 20g или 20h в присутствии палладиевого катализатора, такого как Pd2dba3 и X-Phos, и источника бора,такого как бис-(пинаколато)диборон, приводит к получению боронового сложного эфира 20i или 20j. Бороновый сложный эфир связывается с соответствующим связывающим партнером (например, 20k) в присутствии палладиевого катализатора, такого как Pd(PPh3)4 или PdCl2(dppf), с образованием 20l или 20m. Для каждой реакции кросс-сочетания, опосредованной переходным металлом, роли нуклеофила и электрофила можно менять местами с получением аналогичного продукта связывания. Другие реакции кросс-сочетания, опосредованные переходным металлом, приводящие к образованию W, но с применением альтернативных связывающих партнеров и реагентов, включают, но не ограничиваются ими, сочетания Негиши, Кумада, Стилле и Ульмана. Для получения альтернативных групп, состоящих из двух ароматических колец и содержащих W, можно применять данную типовую схему путем соответствующего подбора исходных реагентов. Схема 21. Типовой синтез R1-P-W-P-R2 На схеме 21 приведен общий синтез промежуточного соединения согласно настоящему описаниюR1-P-W-P-R2, где, в иллюстративных целях, R1 и R2 независимо представляют собой защитные группы, aW представляет собой фрагмент из двух ароматических колец, образованный путем циклизации, опосредованной переходным металлом. Обработка 20d активированным винильным реагентом (например, винилтрифторборат калия) в присутствии палладиевого катализатора (например, ацетата палладия и SPhos) приводит к получению винильного соединения 21 а. Превращение в соответствующий -галогенкетон можно осуществлять путем бромирования N-бромсукцинимидом с последующим окислениемMnO2. Замещение -галогенкетона осуществляют путем добавления кислоты в щелочных условиях (например, Et3N). Бромирование 21d осуществляют путем обработки трибромидом пиридиния с последующим добавлением второй кислоты в щелочных условиях с получением сложного диэфира 21 е. Взаимодействие 21 е с амином или солью амина (например, ацетатом аммония) приводит к образованию молекулы, содержащей имидазол, 21f. Окисление 21f можно осуществлять в присутствии MnO2 с образованием 21g. На схеме 22 приведен общий синтез промежуточного соединения согласно настоящему описаниюE-V-C(=O)-P-W-P-R, где, в иллюстративных целях, R представляет собой защитную группу, a W представляет собой фрагмент из двух ароматических колец. Замещение -галогенкетона 21b осуществляют путем добавления кислоты в щелочных условиях (например, Et3N). Бромирование 22b осуществляют путем обработки трибромидом пиридиния с последующим добавлением второй кислоты в щелочных условиях с получением сложного диэфира 22 с. Взаимодействие 22 с с амином или солью амина (например, ацетатом аммония) приводит к образованию молекулы, содержащей имидазол, 22d. Окисление 22d можно осуществлять в присутствии MnO2 с образованием 22 е. Схема 23. Типовой синтез R-P-W-P-C(=O)-V-E На схеме 23 приведен общий синтез промежуточного соединения согласно настоящему описаниюE-V-C(=O)-P-W-P-R, где, в иллюстративных целях, R представляет собой защитную группу, a W представляет собой фрагмент из двух ароматических колец. Замещение -галогенкетона 21d осуществляют путем добавления кислоты в щелочных условиях (например, Et3N). Взаимодействие 23 а с амином или солью амина (например, ацетатом аммония) приводит к образованию молекулы, содержащей имидазол,23b. Окисление 23b можно осуществлять в присутствии MnO2 с образованием 23 с. Схема 25. Типовой синтез E-V-C(=O)-P-W-P-C(=O)-V-E На схеме 25 приведен общий синтез молекулы согласно настоящему описанию Е-V-C(=O)-P-W-PC(=O)-V-E, где, в иллюстративных целях, Е представляет собой этилкарбониламино. Обработка 25 а или 25 с одним или двумя эквивалентами пропионилхлорида, соответственно, в щелочных условиях (например, гидроксид натрия) приводит к образованию молекул 25b или 25d. Схема 26. Типовые синтезы E-V-C(=O)-P-R и R1-P-R На схеме 26 приведен общий синтез молекул согласно настоящему описанию E-V-C(=O)-P-R и R1P-R, где, в иллюстративных целях, R представляет собой галогенимидазол. Обработка альдегида 26 а глиоксалью в присутствии гидроксида аммония приводит к получению имидазола 26b. Обработка Nбромсукцинамидом или иодом приводит к получению соответствующего галогенимидазола 26 с и 26d,соответственно. Отделение от соответствующего бис-галогенированного соединения можно осуществлять при помощи препаративной ВЭЖХ. Превращение бис-галогенимидазола в моногалогенимидазол также можно осуществлять путем нагревания в присутствии сульфита натрия. Дальнейшую функционализацию группы Р можно осуществлять путем удаления защитной группы и связывания с соответствующей кислотой (E-V-C(=O)-OH). Схема 27. Типовой синтез R1-P-W-P-R2 На схеме 27 приведен альтернативный общий синтез промежуточного соединения согласно настоящему изобретению R1-P-W-P-R2, где, в иллюстративных целях, R1 и R2 независимо представляют собой защитные группы, a W представляет собой фрагмент из двух ароматических колец, образованный путем циклизации, опосредованной переходным металлом. Бромирование 21b осуществляют путем обработки бромирующим агентом (т.е. трибромидом пиридиния) с получением дибромида 27 а. Затем осуществляют замещение первичного бромида путем добавления кислоты в щелочных условиях (например,K2CO3) с получением 21d. Превращение в 21f или 21g можно осуществлять способами, представленными на схеме 21. На схеме 28 приведен альтернативный общий синтез промежуточного соединения согласно настоящему изобретению E-V-C(=O)-P-W-P-R, где, в иллюстративных целях, R представляет собой защитную группу, a W представляет собой фрагмент из двух ароматических колец. Бромирование 21b осуществляют путем обработки бромирующим агентом (т.е. трибромидом пиридиния) с получением дибромида 27 а. Затем осуществляют замещение первичного бромида путем добавления кислоты в щелочных условиях (например, K2CO3) с получением 22d. Превращение в 22d или 22 е можно осуществлять способами, представленными на схеме 22. Конкретные варианты реализации В одном из вариантов реализации настоящего изобретения предложено соединение формулы или фармацевтически приемлемая соль указанного соединения. Описание проиллюстрировано нижеприведенными неограничивающими примерами. В настоящем описании, в том числе в примерах, применяют следующие аббревиатуры. Примеры Сравнительный пример LQ 7-(2-Бром-5-хлорбензилокси)-3,4-дигидронафталин-1(2H)-он К раствору 7-гидрокси-1-тетралона (13,9 г, 85,7 ммоль) и 1-бром-2-(бромметил)-4-хлорбензола (25,6 г, 90,0 ммоль) в диметилформамиде (850 мл) при перемешивании добавляли карбонат калия (24 г, 172 ммоль). Реакционную смесь перемешивали в атмосфере аргона в течение 18 ч, а затем разбавляли этилацетатом (1 л). Органический слой три раза промывали водой и один раз солевым раствором. Затем органический слой сушили над сульфатом магния, фильтровали и концентрировали. К полученному маслу добавляли метанол (500 мл) и суспензию перемешивали в течение 30 мин. 7-(2-бром-5-хлорбензилокси)3,4-дигидронафталин-1(2H)-он (27,8 г, 89% выход) выделяли путем фильтрования. 3-Хлор-10,11-дигидро-5H-дибензо[c,g]хромен-8(9H)-он В 1-л колбу, содержащую пивалат палладия(II) (1,18 г, 3,8 ммоль), три(4-фторфенил)фосфин (1,20 г,3,8 ммоль), пивалевую кислоту (2,33 г, 22,8 ммоль) и карбонат калия (31,8 г, 228 ммоль) добавляли раствор 7-(2-бром-5-хлорбензилокси)-3,4-дигидронафтали-1(2H)-она (27,8 г, 76,2 ммоль) в диметилацетамиде (380 мл). Колбу вакуумировали и заполняли аргоном 5 раз, а затем перемешивали в атмосфере аргона при 60 С в течение 24 ч. Реакционную смесь охлаждали до комнатной температуры и разбавляли МТБЭ и водой. Полученную двухфазную смесь перемешивали в течение 3 ч и фильтровали через целит, промывая МТБЭ. Органический слой фильтрата отделяли, а затем дважды промывали водой и один раз солевым раствором. Затем органическую фазу сушили над сульфатом магния, фильтровали, концентрировали и очищали при помощи колоночной флэш-хроматографии (гексан/ДХМ) с получением 3-хлор 10,11-дигидро-5H-дибензо[с,g]хромен-8(9H)-она (14,4 г, 67% выход) в виде беловатого твердого вещества. 9-Бром-3-хлор-10,11-дигидро-5H-дибензо[c,g]хромен-8(9H)-он К смеси 3-хлор-10,11-дигидро-5H-дибензо[с,g]хромен-8(9H)-она (14,8 г, 52 ммоль) в хлороформе(50 мл) и этилацетата (50 мл) добавляли бромид меди(II) (24,3 г, 104 ммоль). Реакционную смесь нагревали до 80 С в течение 2 ч, а затем охлаждали до комнатной температуры. Смесь разбавляли дихлорметаном, дважды промывали 5:1 раствором насыщенного водного хлорида аммония и водного гидроксида аммония ( 38%) и один раз промывали водой. Органическую фазу сушили над сульфатом магния, филь- 25023644 тровали и концентрировали с получением 9-бром-3-хлор-10,11-дигидро-5H-дибензо[с,g]хромен-8(9H)она (18,5 г,95% выход) с чистотой 95%. Примечание: Реакция не всегда проходит с образованием настолько чистого продукта. Иногда происходит избыточное бромирование или сохраняется значительное количество исходного вещества. Указанные примеси можно удалить при помощи колоночной флэш-хроматографии. трет-Бутил-2-(9-хлор-1,4,5,11-тетрагидроизохромено[4',3':6,7]нафто[1,2-d]имидазол-2-ил)пирролидин-1-карбоксилат К раствору (1R)-2-(трет-бутоксикарбонил)циклопентанкарбоновой кислоты (10,17 г, 47,25 ммоль) и 9-бром-3-хлор-10,11-дигидро-6H-нафто[2,3-с]хромен-8(9H)-она (5,7 мг, 15,7 ммоль) в ацетонитриле (50 мл) добавляли диизопропилэтиламин (11,11 мл, 64 ммоль). Реакционную смесь перемешивали при 50 С в течение 4 ч, а затем разбавляли этилацетатом. Органический слой промывали водой и солевым раствором, сушили (MgSO4) и концентрировали. Полученный неочищенный остаток очищали при помощи флэш-хроматографии с получением (2S)-1-трет-бутил-2-(3-хлор-8-оксо-8,9,10,11-тетрагидро-5H-нафто[c,g]хромен-9-ил)пирролидин-1,2-дикарбоксилата (4,52 г, 58%). К раствору (2S)-1-трет-бутил-2-(3 хлор-8-оксо-8,9,10,11-тетрагидро-6H-нафто[2,3-с]хромен-9-ил)пирролидин-1,2-дикарбоксилата (3,27 мг,6,56 ммоль) в смеси толуола (11 мл) и 2-метоксиэтанола (0,7 мл) добавляли ацетат аммония (5,06 г, 65,6 ммоль). Реакционную смесь нагревали до 110 С в течение 3 ч, охлаждали до комнатной температуры и разбавляли этилацетатом. Органический слой промывали водой и солевым раствором, сушили (Na2SO4) и концентрировали. Неочищенный остаток очищали при помощи флэш-хроматографии с получением трет-бутил-2-(9-хлор-1,4,5,11-тетрагидроизохромено[4',3':6,7]нафто[1,2-d]имидазол-2-ил)пирролидин-1 карбоксилата (1,95 г, 61%). ЖХМС-ЭСИ+:вычислено для C27H28ClN3O34 2: 477,98; наблюдали [М+1]+: 478,47. трет-Бутил-2-(9-хлор-1,11-дигидроизохромено[4',3':6,7]нафто[1,2-d]имидазол-2-ил)пирролидин-1 карбоксилат К раствору трет-бутил-2-(9-хлор-1,4,5,11-тетрагидроизохромено[4',3':6,7]нафто[1,2-d]имидазол-2 ил)пирролидин-1-карбоксилата (1,9 г, 3,96 ммоль) в дихлорметане (35 мл) добавляли оксид марганца(IV)(17 г, 198 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, разбавляли этилацетатом. Органический слой промывали водой и солевым раствором, сушили (Na2SO4) и концентрировали. Неочищенный остаток очищали при помощи флэш-хроматографии с получением третбутил-2-(9-хлор-1,11-дигидроизохромено[4',3':6,7]нафто[1,2-d]имидазол-2-ил)пирролидин-1-карбоксилата (1,52 г, 81%). ЖХМС-ЭСИ+:вычислено для C27H26ClN3O3 42:475,9; наблюдали [М+1]+:476,45. трет-Бутил-2-[9-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,11-дигидроизохромено[4',3':6,7]нафто[1,2-d]имидазол-2-ил]пирролидин-1-карбоксилат Дегазированную смесь трет-бутил-2-(9-хлор-1,11-дигидроизохромено[4',3':6,7]нафто[1,2-d]имидазол-2-ил)пирролидин-1-карбоксилата (1,52 г, 3,17 ммоль), бис-(пинаколато)диборона (1,21 г, 4,75 ммоль),ацетата калия (934 мг, 9,52 ммоль), трис-(дибензилиденацетон)палладия (116 мг, 0,13 ммоль) и 2 дициклогексилфосфино-2',4',6'-триизопропил-1,1'-бифенила (121 мг, 0,08 ммоль) в 1,4-диоксане (16 мл) нагревали до 90 С в течение 1,5 ч, охлаждали до комнатной температуры и разбавляли этилацетатом. Органический слой промывали водой и солевым раствором, сушили (Na2SO4) и концентрировали. Неочищенный остаток очищали при помощи флэш-хроматографии с получением трет-бутил-2-[9-(4,4,5,5 тетраметил-1,3,2-диоксаборолан-2-ил)-1,11-дигидроизохромено[4',3':6,7]нафто[1,2-d]имидазол-2-ил]пирролидин-1-карбоксилата (1,7 г, 94%). трет-Бутил-2-[9-(2-1-[N-(метоксикарбонил)валил]пирролидин-2-ил-1H-имидазол-5-ил)-1,11-дигидроизохромено[4',3':6,7]нафто[1,2-d]имидазол-2-ил]пирролидин-1-карбоксилат К раствору метил-(S)-1-S)-2-(5-бром-1H-имидазол-2-ил)пирролидин-1-ил)-3-метил-1-оксобутан-2 илкарбамата (1,48 г, 3,97 ммоль), трет-бутил-2-[9-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,11 дигидроизохромено[4',3':6,7]нафто[1,2-d]имидазол-2-ил]пирролидин-1-карбоксилата (1,88 г, 1,48 ммоль),тетракис(трифенилфосфин)палладия(0) (191 мг, 0,16 ммоль) и дихлор[1,1'-бис-(дифенилфосфино)ферроцен]палладия(II) (242 мг, 0,33 ммоль) в смеси 1,2-диметоксиэтана (37,0 мл) и диметилформамида (6 мл) добавляли раствор карбоната калия (2 M в воде, 5 мл, 9,93 ммоль). Полученную смесь дегазировали,а затем нагревали до 85 С в атмосфере аргона в течение 18 ч. После охлаждения до комнатной температуры реакционную смесь разбавляли этилацетатом. Органический слой промывали водой и солевым раствором, сушили (Na2SO4) и концентрировали. Неочищенный остаток очищали при помощи флэшхроматографии с получением трет-бутил-2-[9-(2-1-[N-(метоксикарбонил)валил]пирролидин-2-ил-1Hимидазол-5-ил)-1,11-дигидроизохромено[4',3':6,7]нафто[1,2-d]имидазол-2-ил]пирролидин-1-карбоксилата смесь концентрировали и неочищенный продукт растворяли в ДХМ (6 мл). Раствор концентрировали и к продукту добавляли раствор (R)-2-(метоксикарбониламино)-2-фенилуксусной кислоты (172 мг, 0,82 ммоль) и COMU (311 мг, 0,73 ммоль) в ДМФ (6 мл). К полученному раствору добавляли диизопропилэтиламин (330 мкл, 1,89 ммоль). После перемешивания в течение 18 ч при комнатной температуре реакционную смесь разбавляли этилацетатом, промывали водой и солевым раствором, сушили (Na2SO4),концентрировали и очищали при помощи препаративной обращено-фазовой ВЭЖХ (Gemini, градиент 15%, 45% ACN/H2O + 0,1% ТФК). Фракции, содержащие продукт, лиофилизировали с получением [1-(25-[2-(1-[(метоксикарбонил)амино](фенил)ацетилпирролидин-2-ил)-1,11-дигидроизохромено[4',3':6,7]нафто[1,2-d]имидазол-9-ил]-1H-имидазол-2-илпирролидин-1-ил)-3-метил-1-оксобутан-2 ил]карбаминовой кислоты (231 мг, 45%). ЖХМС-ЭСИ+:вычислено для C46H48N8O7 8:824,92; наблюдали(2S,4S)-1-трет-Бутил-2,4-диметилпирролидин-1,2,4-трикарбоксилат К раствору (2S,4S)-1-трет-бутил-2-метил-4-цианопирролидин-1,2-дикарбоксилата (9,0 г, 35,4 ммоль) в МеОН (196 мл) добавляли HCl (4 M в 1,4-диоксане, 100 мл, 403 ммоль). Раствор перемешивали при комнатной температуре в течение 16 ч и концентрировали в вакууме. Неочищенное промежуточное соединение растворяли в EtOAc (180 мл) и подщелачивали водным раствором бикарбоната (нас.). Добавляли ди-трет-бутилдикарбонат (8,5 г, 38,9 ммоль) и двухфазный раствор перемешивали при комнатной температуре в течение 12 ч. Затем слои разделяли и водный слой повторно экстрагировали EtOAc. Объединенные органические слои промывали водой и солевым раствором, сушили над Na2SO4 и концентрировали. Неочищенное масло очищали при помощи хроматографии на силикагеле (градиент 15, 40, 100%(3S,5S)-1-(трет-Бутоксикарбонил)-5-(метоксикарбонил)пирролидин-3-карбоновая кислота К раствору (2S,4S)-1-трет-бутил-2,4-диметилпирролидин-1,2,4-трикарбоксилата (9,56 г, 33,3 ммоль) в ТГФ (70 мл) при 0 С (внешняя температура, ледяная баня) добавляли NaOH (1N водный, 33 мл, 33,3 ммоль) по каплям в течение 15 мин. Раствор перемешивали при 0 С в течение 5 ч перед подкислениемHCl (1N). Раствор экстрагировали EtOAc (3). Объединенные органические слои сушили над Na2SO4 и концентрировали. Неочищенное масло очищали при помощи хроматографии на силикагеле (градиент 2,5, 10% MeOH/CH2Cl2) с получением (3S,5S)-1-(трет-бутоксикарбонил)-5-(метоксикарбонил)пирролидин 3-карбоновой кислоты (6,38 г, 70%).(4,9 мл, 35,0 ммоль) и этилхлорформиат (2,7 мл, 28,0 ммоль). Полученный раствор перемешивали при 0 С в течение 45 мин, за это время образовывался белый осадок. Реакционную смесь фильтровали через целит и концентрировали. Неочищенное промежуточное соединение растворяли в ТГФ (59 мл) и охлаждали до 0 С (внешняя температура, ледяная баня). Медленно добавляли NaBH4 (4,41 г, 116,7 ммоль) в H2O (59 мл) и полученный раствор перемешивали при 0 С в течение 2 ч. Полученную смесь разбавляли EtOAc и промывалиH2O. Водный слой повторно экстрагировали EtOAc. Объединенные органические слои сушили надNa2SO4 и концентрировали. Неочищенное масло очищали при помощи хроматографии на силикагеле(2S,4S)-1-трет-Бутил-2-метил-4-(метоксиметил)пирролидин-1,2-дикарбоксилат К раствору (2S,4S)-1-трет-бутил-2-метил-4-(гидроксиметил)пирролидин-1,2-дикарбоксилата (2,57 г,9,9 ммоль) в CH2Cl2 (50 мл) добавляли AgOTf (4,07 г, 15,8 ммоль) и 2,6-ди-трет-бутилпиридин (4,4 мл,19,8 ммоль). Реакционную смесь охлаждали до 0 С (внешняя температура, ледяная баня) и медленно добавляли MeI (0,98 мл, 15,8 ммоль). Полученную суспензию перемешивали при 0 С в течение 1,5 ч и при комнатной температуре в течение 1,5 ч. Суспензию разбавляли CH2Cl2 и фильтровали через целит. Фильтрат концентрировали досуха, растворяли в Et2O и промывали HCl (1N) и солевым раствором. Водные слои повторно экстрагировали Et2O и объединенные органические слои сушили над Na2SO4 и концентрировали. Неочищенное масло очищали при помощи хроматографии на силикагеле (градиент 10%,75%, 100% EtOAc/гексан) с получением (2S,4S)-1-трет-бутил-2-метил-4-(метоксиметил)пирролидин-1,2 дикарбоксилата (2,11 г, 78%). 1H-ЯМР: 400 МГц, (CDCl3) : (смесь ротамеров, данные основного ротамера) 4,20 (t, 1H), 3,71 (s, 3 Н), 3,67 (m, 1H), 3,34 (m, 2H), 3,30 (s, 3 Н), 3,16 (t, 1H), 2,43 (m, 2H), 1,74 (m, 1H),1,38 (s, 9H).(2S,4S)-1-(трет-Бутоксикарбонил)-4-(метоксиметил)пирролидин-2-карбоновая кислота К раствору (2S,4S)-1-трет-бутил-2-метил-4-(метоксиметил)пирролидин-1,2-дикарбоксилата (2,11 г,7,7 ммоль) в смеси ТГФ (38 мл) и МеОН (15 мл) добавляли LiOH (2,5 М водный, 15 мл, 38,6 ммоль). Полученный раствор перемешивали при комнатной температуре в течение 2 ч и подкисляли водным HCl (1N). Желаемый продукт экстрагировали CH2Cl2 (4). Объединенные органические слои сушили над(2S,4S)-трет-Бутил-2-(9-хлор-4,5-дигидро-5H-нафто[2,3-с]хромено[8,9-d]имидазол-2-ил)-4-(метоксиметил)пирролидин-1-карбоксилат К раствору S)-1-(трет-бутоксикарбонил)-4-(метоксиметил)пирролидин-2-карбоновой кислоты (5,9 г, 23,1 ммоль) и 9-бром-3-хлор-10,11-дигидро-5H-нафто[c,g]хромен-8(9H)-она (5,6 мг, 15,4 ммоль) в ацетонитриле (60 мл) добавляли диизопропилэтиламин (5,35 мл, 30,8 ммоль). Реакционную смесь перемешивали при 50 С в течение 18 ч, а затем разбавляли этилацетатом. Органический слой промывали водой и солевым раствором, сушили (MgSO4) и концентрировали. Полученный неочищенный остаток очищали при помощи флэш-хроматографии с получением (2S)-1-трет-бутил-2-(3-хлор-8-оксо-8,9,10,11-тетрагидро-6H-нафто[2,3-с]хромен-9-ил)-4-(метоксиметил)пирролидин-1,2-дикарбоксилата (5,12 г, 61%). К раствору (2S)-1-трет-бутил-2-(3-хлор-8-оксо-8,9,10,11-тетрагидро-6H-нафто[2,3-с]хромен-9-ил)-4-(метоксиметил)пирролидин-1,2-дикарбоксилата (5,11 мг, 9,42 ммоль) в смеси толуола (94 мл) и 2-метоксиэтанола (0,1 мл) добавляли ацетат аммония (23,5 г, 304 ммоль). Реакционную смесь нагревали до 110 С в течение 18 ч, охлаждали до комнатной температуры и разбавляли этилацетатом. Органический слой промывали водой и солевым раствором, сушили (Na2SO4) и концентрировали. Неочищенный остаток очищали при помощи флэш-хроматографии с получением (2S,4R)-трет-бутил-2-(9-хлор-4,5-дигидро-5Hнафто[с,g]хромено[8,9-d]имидазол-2-ил)-4-(метоксиметил)пирролидин-1-карбоксилата (1,05 г, 21%) и(2S,4S)-трет-Бутил-2-(9-хлор-5H-нафто[c,g]хромено[8,9-d]имидазол-2-ил)-4-(метоксиметил)пирролидин-1-карбоксилат К раствору (2S,4S)-трет-бутил-2-(9-хлор-4,5-дигидро-5H-нафто[с,g-]хромено[8,9-d]имидазол-2-ил)4-(метоксиметил)пирролидин-1-карбоксилата (1,99 г, 3,82 ммоль) в дихлорметане (30 мл) добавляли оксид марганца(IV) (10 г, 115 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, разбавляли этилацетатом. Органический слой промывали водой и солевым раствором, сушили (Na2SO4) и концентрировали. Неочищенный остаток очищали при помощи флэш-хроматографии с получением (2S,4S)-трет-бутил-2-(9-хлор-6H-нафто[2,3-с]хромено[8,9-d]имидазол-2-ил)-4-(метоксиметил)пирролидин-1-карбоксилата (1,05 г, 21%) и (2S,4S)-трет-бутил-2-(9-хлор-4,5-дигидро-6H-нафто[2,3 с]хромено[8,9-d]имидазол-2-ил)-4-(метоксиметил)пирролидин-1-карбоксилата (1,64 г, 82%). ЖХМСЭСИ+: вычислено для C29H30ClN3O4 2: 520,02; наблюдали [М+1]+: 520,97.(2S,4S)-трет-Бутил-4-(метоксиметил)-2-(9-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5H-нафто[c,g]хромено[8,9-d]имидазол-2-ил)пирролидин-1-карбоксилат Дегазированную смесь (2S,4S)-трет-бутил-2-(9-хлор-5H-нафто[c,g]хромено[8,9-d]имидазол-2-ил)-4(метоксиметил)пирролидин-1-карбоксилата (649 мг, 1,25 ммоль), бис-(пинаколато)диборона (635 мг, 2,5 ммоль), ацетата калия (368 мг, 3,7 ммоль), трис-(дибензилиденацетон)палладия (46 мг, 0,05 ммоль) и 2 дициклогексилфосфино-2',4',6'-триизопропил-1,1'-бифенила (60 мг, 0,12 ммоль) в 1,4-диоксане (7 мл) нагревали до 90 С в течение 3 ч, охлаждали до комнатной температуры и разбавляли этилацетатом. Органический слой промывали водой и солевым раствором, сушили (Na2SO4) и концентрировали. Неочищенный остаток очищали при помощи флэш-хроматографии с получением (2S,4S)-трет-бутил-4(метоксиметил)-2-(9-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5H-нафто[с,g]хромено[8,9-d]имидазол-2-ил)пирролидин-1-карбоксилата (467 мг, 61%) ЖХМС-ЭСИ+:вычислено для C35H42BN3O6: 611,54; наблюдали [М+1]+: 612,96.
МПК / Метки
МПК: C07D 491/052, A61K 31/4188
Метки: соединения, противовирусные
Код ссылки
<a href="https://eas.patents.su/30-23644-protivovirusnye-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Противовирусные соединения</a>
Предыдущий патент: Автомобильное оконное стекло с антенной
Следующий патент: Анод для электролитического выделения хлора
Случайный патент: Способ и устройство для получения цемента