3,5-диамино-6-хлор-n-(n-(4-(4-(2-(гексил(2,3,4,5,6-пентагидроксигексил)амино)этокси)фенил)бутил)карбамимидоил)пиразин-2-карбоксамид
Формула / Реферат
1. Соединение формулы (I)
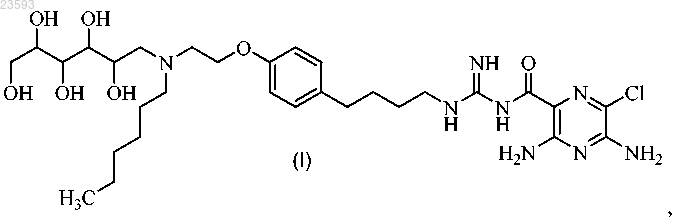
или его фармацевтически приемлемая соль.
2. Соединение по п.1, представляющее собой 3,5-диамино-6-хлор-N-(N-(4-(4-(2-(гексил((2S,3R,4R,5R)-2,3,4,5,6-пентагидроксигексил)амино)этокси)фенил)бутил)карбамимидоил)пиразин-2-карбоксамид формулы
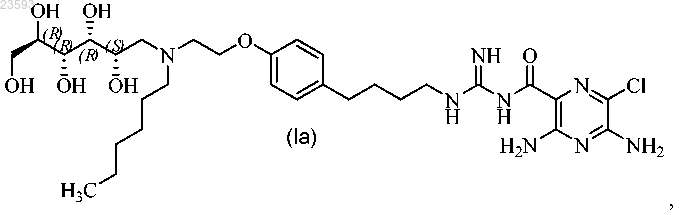
или его фармацевтически приемлемая соль.
3. Фармацевтическая композиция для блокирования натриевых (Na) каналов, содержащая фармацевтически эффективное количество соединения по п.1 или 2 или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель или наполнитель.
4. Фармацевтическая композиция по п.3, отличающаяся тем, что указанное соединение представляет собой 3,5-диамино-6-хлор-N-(N-(4-(4-(2-(гексил((2S,3R,4R,5R)-2,3,4,5,6-пентагидроксигексил)амино)этокси)фенил)бутил)карбамимидоил)пиразин-2-карбоксамид или его фармацевтически приемлемую соль.
5. Композиция по любому из пп.3 или 4, отличающаяся тем, что указанная композиция предназначена для ингаляции.
6. Композиция по любому из пп.3 или 4, отличающаяся тем, что указанная композиция представляет собой раствор для распыления в виде аэрозоля и введения с помощью небулайзера.
7. Композиция по любому из пп.3 или 4, отличающаяся тем, что указанная композиция предназначена для введения с помощью дозирующего ингалятора.
8. Композиция по любому из пп.3 или 4, отличающаяся тем, что указанная композиция представляет собой сухой порошок для введения с помощью ингалятора сухого порошка.
9. Способ блокирования натриевых каналов у человека, включающий введение указанному человеку эффективного количества соединения по п.1 или 2 или его фармацевтически приемлемой соли.
10. Способ стимулирования гидратации поверхностей слизистой оболочки или восстановления защитного барьера слизистой оболочки у человека, включающий введение указанному человеку эффективного количества соединения по п.1 или 2 или его фармацевтически приемлемой соли.
11. Способ лечения заболевания, выбранного из обратимой или необратимой обструкции дыхательных путей, хронической обструктивной болезни легких (ХОБЛ), астмы, бронхоэктаза, острого бронхита, хронического бронхита, поствирусного кашля, кистозного фиброза, эмфиземы, пневмонии, панбронхиолита, бронхиолита, связанного с трансплантатом, и трахеобронхита, связанного с аппаратом искусственной вентиляции легких (ИВЛ-связанного трахеобронхита), или предотвращения пневмонии, связанной с аппаратом искусственной вентиляции легких (ИВЛ-связанной пневмонии), у человека, включающий введение указанному человеку эффективного количества соединения по п.1 или 2 или его фармацевтически приемлемой соли.
12. Способ лечения заболевания по п.11, отличающийся тем, что бронхоэктаз обусловлен состояниями, отличными от кистозного фиброза.
13. Способ лечения хронической обструктивной болезни легких (ХОБЛ) у человека, включающий введение указанному человеку эффективного количества соединения по п.1 или 2 или его фармацевтически приемлемой соли.
14. Способ лечения кистозного фиброза у человека, включающий введение указанному человеку эффективного количества соединения по п.1 или 2 или его фармацевтически приемлемой соли.
15. Способ лечения сухости во рту (ксеростомии), сухости кожи, вагинальной сухости, синусита, риносинусита или обезвоживания носовой полости, сухости глаз или болезни Шегрена, стимулирования гидратации глаза или роговицы, лечения синдрома дистальной интестинальной обструкции, лечения среднего отита, первичной цилиарной дискинезии, эзофагита, запора или хронического дивертикулита у человека, включающий введение указанному человеку эффективного количества соединения по п.1 или 2 или его фармацевтически приемлемой соли.
16. Способ по п.15, отличающийся тем, что указанное обезвоживание носовой полости вызвано введением сухого кислорода.
17. Применение соединения по п.1 или 2 или его фармацевтически приемлемой соли для получения лекарственного средства для лечения заболевания, связанного с обратимой или необратимой обструкцией дыхательных путей, хронической обструктивной болезни легких (ХОБЛ), астмы, бронхоэктаза, острого бронхита, хронического бронхита, поствирусного кашля, кистозного фиброза, эмфиземы, пневмонии, панбронхиолита, бронхиолита, связанного с трансплантатом, и ИВЛ-связанного трахеобронхита или предотвращения ИВЛ-связанной пневмонии.
18. Применение соединения по п.17, отличающееся тем, что бронхоэктаз обусловлен состояниями, отличными от кистозного фиброза.
19. Применение соединения по п.1 или 2 или его фармацевтически приемлемой соли для получения лекарственного средства для лечения сухости во рту (ксеростомии), сухости кожи, вагинальной сухости, синусита, риносинусита или обезвоживания носовой полости, сухости глаз или болезни Шегрена, стимулирования гидратации глаза или роговицы, лечения синдрома дистальной интестинальной обструкции, лечения среднего отита, первичной цилиарной дискинезии, эзофагита, запора или хронического дивертикулита.
20. Применение соединения по п.19, отличающееся тем, что указанное обезвоживание носовой полости вызвано введением сухого кислорода.
21. Применение композиции, содержащей соединение по п.1 или 2 или его фармацевтически приемлемую соль, для получения лекарственного средства для лечения заболевания, связанного с обратимой или необратимой обструкцией дыхательных путей, хронической обструктивной болезни легких (ХОБЛ), астмы, бронхоэктаза, острого бронхита, хронического бронхита, поствирусного кашля, кистозного фиброза, эмфиземы, пневмонии, панбронхиолита, бронхиолита, связанного с трансплантатом, и ИВЛ-связанного трахеобронхита, или предотвращения ИВЛ-связанной пневмонии.
22. Применение соединения по п.21, отличающееся тем, что бронхоэктаз обусловлен состояниями, отличными от кистозного фиброза.
23. Применение композиции, содержащей соединение по п.1 или 2 или его фармацевтически приемлемую соль, для получения лекарственного средства для лечения сухости во рту (ксеростомии), сухости кожи, вагинальной сухости, синусита, риносинусита или обезвоживания носовой полости, сухости глаз или болезни Шегрена, стимулирования гидратации глаза или роговицы, лечения синдрома дистальной интестинальной обструкции, лечения среднего отита, первичной цилиарной дискинезии, эзофагита, запора или хронического дивертикулита.
24. Применение по п.23, отличающееся тем, что указанное обезвоживание носовой полости вызвано введением сухого кислорода.
25. Способ предотвращения, ослабления и/или лечения детерминированных воздействий на дыхательные пути и/или другие органы тела, вызванных вдыхаемыми аэрозолями, содержащими радионуклиды, у человека, включающий введение указанному человеку эффективного количества соединения по п.1 или 2 или его фармацевтически приемлемой соли.
Текст
или его фармацевтически приемлемым солям, а также композициям, содержащим указанное соединение, способам получения указанного соединения и терапевтическим способам его применения для стимулирования гидратации поверхностей слизистой оболочки и лечения заболеваний, включая хроническую обструктивную болезнь легких (ХОБЛ), астму, бронхоэктаз,острый бронхит и хронический бронхит, кистозный фиброз, эмфизему и пневмонию. Область техники Изобретение относится к новым соединениям, в частности включая 3,5-диамино-6-хлор-N-(N-(4-(4(2-(гексил(2,3,4,5,6-пентагидроксигексил)амино)этокси)фенил)бутил)карбамимидоил)пиразин-2-карбоксамид и его фармацевтически приемлемые солевые формы, подходящие для применения в качестве блокаторов натриевых каналов, композициям, содержащим указанное соединение, терапевтическим способам и применениям указанного соединения и способам получения указанного соединения. Уровень техники Поверхности слизистых оболочек на границе между окружающей средой и телом в результате эволюции выработали ряд видов "врожденной защиты", т.е. защитных механизмов. Основной формой такой врожденной защиты является очистка указанных поверхностей жидкостью. Обычно количество слоя жидкости на поверхности слизистых оболочек отражает баланс между эпителиальной секрецией жидкости, часто отражающей анионную (Cl- и/или HCO3-) секрецию, в сочетании с водой (и катионным противоионом), и эпителиальным поглощением жидкости, часто отражающим поглощение Na+ в сочетании с водой и анионным противоионом (Cl- и/или HCO3-). Многие заболевания поверхностей слизистой оболочки вызваны слишком малым количеством защитной жидкости на указанных поверхностях слизистых оболочек, вызванным дисбалансом между секрецией (слишком низкая) и поглощением (относительно слишком большое). Нарушение процессов переноса солей, характеризующее указанные дисфункции слизистой оболочки, происходит в эпителиальном слое поверхности слизистых оболочек. Одним из подходов к восстановлению защитного слоя жидкости на поверхности слизистых оболочек является "перебалансировка" системы путем блокирования Na+ канала и поглощения жидкости. Эпителиальный белок, опосредующий лимитирующую скорость стадию поглощения Na+ и жидкости, представляет собой эпителиальный Na+ канал ("ENaC"). ENaC расположен на апикальной поверхности эпителия, т.е. на границе между поверхностью слизистой оболочки и окружающей средой. В идеале, для ингибирования поглощения Na+, опосредованного ENaC, и жидкости, блокатор ENaC амилоидного класса должен быть доставлен к поверхности слизистой оболочки и пребывать в указанной области для достижения максимального терапевтического эффекта. Сообщалось об использовании блокаторов ENaC при различных заболеваниях, которые поддаются облегчению за счет повышенной гидратации слизистой оболочки. В частности, сообщалось о применении блокаторов ENaC для лечения респираторных заболеваний, таких как хронический бронхит (англ.chronic bronchitis, CB), кистозный фиброз (англ. cystic fibrosis, CF) и ХОБЛ, которые отражают неспособность организма в нормальном режиме выводить слизь из легких и в конечном итоге приводят к хронической инфекции дыхательных путей. См. Evidence for airway surface dehydration as the initiating event inMedicine, Vol. 13, Issue 6, June 2007, pages 231-240. Данные показывают, что инициирующей проблемой как при хроническом бронхите, так и при кистозном фиброзе является неспособность очистки поверхности дыхательных путей от слизи. Неспособность очистки слизи отражает дисбаланс количества слизи, являющейся жидкостью поверхности дыхательных путей (англ. airway surface liquid, ASL) на поверхностях дыхательных путей. Указанный дисбаланс приводит к относительному снижению ASL, что приводит к концентрированию слизи, уменьшению смазочной активности околоресничной жидкости (англ. periciliary liquid, PCL), прилипанию слизи к поверхности дыхательных путей и неспособности очистки слизи посредством активности ресничного эпителия во рту. Снижение очистки слизи приводит к хронической бактериальной колонизации слизи, прилипающей к поверхности дыхательных путей. Хронический удержание бактерий, неспособность местных антибактериальных веществ на постоянной основе уничтожать бактерии, удерживаемые в слизи, и,как следствие, хронический воспалительный ответ на этот тип поверхностной инфекции приводят к хроническому бронхиту и кистозному фиброзу. В настоящее время существует значительная неудовлетворенная медицинская потребность в продуктах, которые как раз и будут лечить различные заболевания, которые ослабляются при повышенной гидратации слизистой оболочки, в том числе, среди прочего, хронический бронхит, ХОБЛ и кистозный фиброз. Современные способы лечения хронического бронхита, ХОБЛ и кистозного фиброза направлены на лечение симптомов и/или отдаленных последствий указанных заболеваний. Однако ни одна из указанных терапий не устраняет эффективно фундаментальную проблему неспособности очистки легких от слизи.R.C. Boucher в патенте США 6264975 описывает применение пиразиноилгуанидиновых блокаторов натриевых каналов для гидратации поверхности слизистых оболочек, типичными примерами которых служат хорошо известные диуретики амилорид, бензамил и фенамил. Тем не менее, указанные соединения являются относительно слабыми, учитывая ограниченную массу лекарственного средства, которое можно вдохнуть в легкие; (2) быстро всасываются и, таким образом, имеют нежелательно короткий период полувыведения на поверхности слизистых оболочек; и (3) свободно диссоциируют из ENaC. Необходимы более активные лекарственные средства с более длинными периодами полувыведения на поверхности слизистых оболочек. Слишком малое количество защитной поверхностной жидкости на других поверхностях слизистых оболочек является общей патофизиологией для ряда заболеваний. Например, при ксеростомии (сухости во рту) полость рта теряет жидкость из-за неспособности околоушной подъязычной и подчелюстной желез секретировать жидкость, несмотря на продолжающееся поглощение жидкости, опосредованное транспортом Na+ (ENaC), из ротовой полости. Сухой кератоконъюнктивит (синдром сухого глаза) возникает при неспособности слезных желез секретировать жидкость, несмотря на продолжающееся Na+ зависимое поглощение жидкости на смежных поверхностях. При риносинусите существует дисбаланс между секрецией муцина и относительным истощением ASL. Неспособность секретирования CI- (и жидкости) в среднем отделе тонкой кишки в сочетании с повышенным поглощением Na+ (и жидкости) в терминальном отделе подвздошной кишки приводит к синдрому дистальной интестинальной обструкции(DIOS). У пожилых пациентов чрезмерное поглощение Na+ (и объемная абсорбция) в нисходящей ободочной кишке приводит к запору и дивертикулиту. Опубликованная литература включает ряд патентных заявок и выданных патентов на имя ParionSciences Inc, описывающих аналоги пиразиноилгуанидина в качестве блокаторов натриевых каналов. Примеры таких публикаций включают международные публикацииWO 2003/070182, WO 2003/070184, WO 2004/073629, WO 2005/025496, WO 2005/016879, WO 2005/018644, WO 2006/022935,WO 2006/023573, WO 2006/023617, WO 2007/018640, WO 2007/146869, WO 2008/031028, WO 2008/031048 и патенты США 6858614, 6858615, 6903105, 7064129, 7186833, 7189719, 7192958,7192959, 7192960, 7241766, 7247636, 7247637, 7317013, 7332496, 7368447, 7368450, 7368451, 7375102,7388013, 7399766, 7410968, 7807834, 7842697 и 7868010. Сохраняется потребность в новых соединениях, блокирующих натриевые каналы, с повышенной активностью и эффективностью воздействия на ткани слизистой оболочки. Также сохраняется потребность в новых соединениях, блокирующих натриевые каналы, обеспечивающих терапевтический эффект,но минимизирующих или предотвращающих возникновение или прогрессирование гиперкалиемии у реципиентов. Краткое описание изобретения В изобретении предложено соединение 3,5-диамино-6-хлор-N-(N-(4-(4-(2-(гексил(2,3,4,5,6-пентагидроксигексил)амино)этокси)фенил)бутил)карбамимидоил)пиразин-2-карбоксамид формулы или его фармацевтически приемлемая соль. В настоящем изобретении предложены сольваты и гидраты, индивидуальные стереоизомеры, в том числе оптические изомеры (энантиомеры и диастереоизомеры) и геометрические изомеры (цис-/транс-изомеризм), смеси стереоизомеров, таутомеров 3,5 диамино-6-хлор-N-(N-(4-(4-(2-(гексил(2,3,4,5,6-пентагидроксигексил)амино)этокси)фенил)бутил)карбамимидоил)пиразин-2-карбоксамида, или его фармацевтически приемлемая соль, а также фармацевтические композиции, содержащие указанное соединение или его фармацевтически приемлемую соль, его применение в способах лечения и способы его получения. Краткое описание графических материалов Более полная оценка настоящего изобретения и многих из его преимуществ может быть легко получена при обращении к информации, приведенной в данном документе, совместно со следующими фигурами: фиг. 1 представляет собой репрезентативный график зависимости концентрационного эффекта соединения (Ia) от тока короткого замыкания с помощью бронхиальных эпителиальных клеток собаки(англ. canine bronchial epithelial, CBE); фиг. 2 представляет собой график эффекта дозы соединения (Ia) на мукоцилиарный клиренс (англsheep mucociliary clearance, MCC) у овцы через 4 ч после дозирования; фиг. 3 представляет собой график эффекта соединения (Ia) и гипертонического солевого раствора(англ. hypertonic saline, HS) на MCC у овцы через 4 ч после дозирования; фиг. 4 представляет собой график эффекта соединения (Ia) и HS на MCC у овцы через 8 ч после дозирования; фиг. 5 представляет собой график эффекта блокирования натриевого канала соединением (Ia) на удержание поверхностной жидкости в течение 0-8 ч на in vitro CBE клеточной модели; фиг. 6 представляет собой гистограмму эффекта соединения (Ia) на удержание поверхностной жидкости через 24 ч на in vitro CBE модели; фиг. 7 представляет собой график эффекта блокаторов ENaC соединения 1 а и примера сравнения I на MCC овцы через 8 ч; фиг. 8 представляет собой график эффекта блокаторов ENaC соединения 1 а и сравнительного при-2 023593 мера 1 на содержания калия в плазме овцы; фиг. 9 представляет собой график сравнения активности сравнительного примера 4 и соединения 1 а на MCC у овцы через 4 ч после дозирования; фиг. 10 представляет собой график сравнения эффекта на содержание K+ в плазме овцы сравнительного примера 4 и соединения 1 а. Подробное описание изобретения В описании следующие термины определены следующим образом."Соединение согласно изобретению" означает соединение формулы I или соль, в частности его фармацевтически приемлемую соль."Соединение формулы I" означает соединение, имеющее структурную формулу, обозначенную в настоящем документе как формула I. Соединения формулы I включают сольваты и гидраты (т.е. аддукты соединения формулы I с растворителем). В тех вариантах реализации, когда соединение формулы I содержит один или более хиральных центров, указанное выражение охватывает каждый индивидуальный стереоизомер, включая оптические изомеры (энантиомеры и диастереомеры) и геометрические изомеры(цис-/транс-изомеризм) и смеси стереоизомеров. Кроме того, соединения формулы I также включают таутомеры изображенной формулы (формул). В описании и примерах соединения названы с использованием стандартных принципов наименования ИЮПАК, где это возможно, включая использование программного обеспечения ChemDraw Ultra 11,0 для наименования соединений, продаваемого CambridgeSoft Corp./PerkinElmer. На некоторых изображениях химических структур, когда атомы углерода не имеют достаточного количества присоединенных переменных, показанных для достижения валентности четыре, оставшимися заместителями атома углерода, необходимыми для обеспечения валентности четыре, следует считать водород. Аналогично, в некоторых химических структурах, когда связь нарисована без указания концевой группы, такая связь указывает на метильную (Me, -CH3) группу, что является традиционным в данной области техники. Согласно одному из предпочтительных вариантов реализации указанное соединение формулы (I) представляет собой 3,5-диамино-6-хлор-N-(N-(4-(4-(2-(гексил 2S,3R,4R,5R)-2,3,4,5,6-пентагидроксигексил)амино)этокси)фенил)бутил)карбамимидоил)пиразин-2-карбоксамид, имеющее формулу или его фармацевтически приемлемую соль. Указанные соединения формулы I могут быть в форме свободного основания или соли, в частности фармацевтически приемлемой соли. Для обзора фармацевтически приемлемых солей см. Berge с соавт., JPharma Sci. (1977) 66 1-19. Фармацевтически приемлемые соли, образованные из неорганических или органических кислот,включают, например, гидрохлорид, гидробромид, гидройодид, сульфат, бисульфат, нитрат, сульфамат,фосфат, кислый фосфат, ацетат, трифторацетат, малеат, малат, фумарат, лактат, тартрат, цитрат, формиат, глюконат, сукцинат, пируват, таннат, аскорбат, пальмитат, салицилат, стеарат, фталат, альгинат, полиглутамат, оксалат, оксалоацетат, сахарат, бензоат, алкил или арилсульфонаты (например, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат или нафталинсульфонат) и изотионат, комплексы, образованные с аминокислотами, такими как лизин, аргинин, глутаминовая кислота, глицин,серин, треонин, аланин, изолейцин, лейцин и тому подобное соединения согласно изобретению могут также быть в форме соли, образованной из элементарных анионов, таких как хлор, бром или йод. Для терапевтического применения соли активных ингредиентов соединений формулы I будут фармацевтически приемлемыми, т.е. они будут представлять собой соли, полученные из фармацевтически приемлемой кислоты Однако могут также найти применение соли кислот, которые не являются фармацевтически приемлемыми, например, при получении или очистке фармацевтически приемлемого соединения Например, могут использоваться трифторацетатные соли Все соли, независимо от того получены ли они из фармацевтически приемлемой кислоты или нет, подпадают под объем настоящего изобретения. Термин "хиральный" относится к молекулам, которые обладают свойством неналожимости на зеркального партнера, тогда как термин "ахиральный" относится к молекулам, которые совмещаются с их зеркальным партнером. Термин "стереоизомеры" относится к соединениям, которые имеют одинаковые химический состав,но отличаются в отношении расположения атомов или групп в пространстве. "Диастереомер" относится к стереоизомеру с двумя или более центрами хиральности, и чьи молекулы не являются зеркальными отражениями друг друга. Диастереомеры обладают различными физическими свойствами, например температурами плавления, кипения, спектральными свойствами и реакционноспособностью. Смеси диастереомеров можно разделить с помощью аналитических процедур с высокой чувствительностью, таких как электрофорез и хроматография. "Энантиомеры" относятся к двум стереоизомерам соединения, которые не являются зеркальными отражениями друг друга. Стереохимические определения и условные обозначения, используемые в данном документе, в целом, следуют S. P. Parker, Ed., McGraw-Hill Dictionary of Chemical Terms (1984) McGraw-Hill Book Company, New York; и Eliel, E. и Wilen, S., Stereochemistry of Organic Compounds (1994) John WileySons,Inc., New York. Многие органические соединения существуют в оптически активных формах, т.е. они обладают способностью вращать плоскость плоскополяризованного света. При описании оптически активного соединения префиксы D и L или R и S используются для обозначения абсолютной конфигурации молекулы относительно ее хирального центра(ов). Конкретный стереоизомер может также упоминаться как энантиомер, и смесь таких изомеров часто называют энантиомерной смесью. Смесь энантиомеров 50:50 называют рацемической смесью или рацематом, которое может получиться, когда не было никакой стереоселекции или стереоспецифичности в химической реакции или процессе. Термины "рацемическая смесь" и "рацемат" относятся к эквимолярной смеси двух энантиомерных видов. Термин "таутомеры" относится к типу стереоизомера, в котором миграция атома водорода приводит к получению двух или более структур. Соединения формулы I могут существовать в различных таутомерных формах. Специалисту в данной области техники будет понятно, что амидины, амиды, гуанидины, мочевины, тиомочевины, гетероциклы и т.п. могут существовать в таутомерных формах. В качестве примера, но не ограничения, соединения формулы I могут существовать в различных таутомерных формах, как показано ниже Все возможные таутомерные формы амидинов, амидов, гуанидинов, мочевин, тиомочевин, гетероциклов и т.п. во всех вариантах реализации формулы I находятся в пределах объема настоящего изобретения. Таутомеры существуют в равновесии и, таким образом, специалистам в данной области техники будет понятно, что изображение одного таутомера в предложенных формулах также относиться ко всем возможным таутомерам. Следует отметить, что все энантиомеры, диастереомеры и рацемические смеси, таутомеры, полиморфы, псевдополиморфы соединений в пределах объема формулы I и их фармацевтически приемлемые соли входят в объем настоящего изобретения. Все смеси таких энантиомеров и диастереомеров, в том числе энантиомерно обогащенные смеси и диастереомерно обогащенные смесей находятся в пределах объема настоящего изобретения. Энантиомерно обогащенной смесью являются смеси энантиомеров, в которых отношение указанного энантиомера с альтернативным энантиомером составляет более 50:50. В частности, энантиомерно обогащенная смесь содержит по меньшей мере примерно 75% указанного энантиомера, предпочтительно по меньшей мере примерно 85% указанного энантиомера. Согласно одному из вариантов реализации энантиомерно обогащенная смесь, по существу, не содержит другой энантиомер. Аналогично, диастереомерно обогащенные смеси представляют собой смеси диастереомеров, в которых количество указанного диастереомера больше, чем количество каждого альтернативного диастереомера. В частности, диастереомерно обогащенная смесь содержит по меньшей мере примерно 75% указанного диастереомера, и предпочтительно по меньшей мере примерно 85% указанного диастереомера. Согласно одному из вариантов реализации диастереомерно обогащенная смесь, по существу, не содержит любые другие диастереомеры. Термин "по существу, не содержит" будет понятен специалистам в данной области, как указывающий на менее 5% присутствие других диастереомеров, предпочтительно менее 1%, более предпочтительно менее 0,1%. Согласно другим вариантам реализации никакие другие диастереомеры не будут присутствовать или количество любых других присутствующих диастереомеров будет ниже уровня обнаружения. Стереоизомеры могут быть разделены методами, известными в данной области, в том числе с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) и кристаллизации хиральных солей. Отдельный стереоизомер, например энантиомер, по существу, не содержащий его стереоизомер,может быть получен разделением рацемической смеси с использованием такого способа, как получение диастереомеров с использованием оптически активных разделяющих агентов ("Stereochemistry of CarbonCompounds," (1962) by E.L. Eliel, McGraw Hill; Lochmuller C.H., (1975) J. Chromatogr., 113:(3) 283-302). Рацемические смеси хиральных соединений согласно изобретению можно разделять и выделять с помощью любого подходящего способа, включая: (1) получение ионных, диастереомерных солей с хиральными соединениями и разделение путем фракционной кристаллизации или других способов, (2) получение диастереомерных соединений с хиральными дериватизирующими реагентами, разделение диастереомеров и превращение в чистые стереоизомеры, и (3) разделение, по существу, чистых или обогащенных стереоизомеров непосредственно в хиральных условиях. Для целей иллюстрации конкретные примеры энантиомеров соединения формулы (I), в пределах объема настоящего изобретения, включают, но не ограничиваются ими: 3,5-диамино-6-хлор-N-(N-(4-(4(2-(гексил 2S,3R,4R,5R)-2,3,4,5,6-пентагидроксигексил)амино)этокси)фенил)бутил)карбамимидоил)пиразин-2-карбоксамид Согласно одному из вариантов реализации в настоящем изобретении предложена энантиомерно обогащенная смесь или композиция, содержащая 5-диамино-6-хлор-N-(N-(4-(4-(2-(гексил 2S,3R,4R,5R)2,3,4,5,6-пентагидроксигексил)амино)этокси)фенил)бутил)карбамимидоил)пиразин-2-карбоксамид или его фармацевтически приемлемую соль в качестве основного изомера. Другие варианты реализации включают энантиомерно обогащенные смеси или композиции, содержащие, соответственно, соединения формул (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih), (Ii), (Ij), (Ik) и (Il) или их фармацевтически приемлемые соли в качестве основного изомера в каждой из их соответствующих смесей. Согласно другому варианту реализации в настоящем изобретении предложена энантиомерно обогащенная смесь или композиция, содержащая 5-диамино-6-хлор-N-(N-(4-(4-(2-(гексил 2S,3R,4R,5R)2,3,4,5,6-пентагидроксигексил)амино)этокси)фенил)бутил)карбамимидоил)пиразин-2-карбоксамид или его фармацевтически приемлемую соль, по существу, не содержащую других изомеров. Четыре других варианта реализации включают энантиомерно обогащенные смеси или композиции,содержащие, соответственно, соединения формул (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih), (Ii), (Ij), (Ik) и (Il) или его фармацевтически приемлемые соли, по существу, не содержащие других изомеров в каждой из их соответствующих смесей. Соединение формулы I и его фармацевтически приемлемые соли могут существовать в виде различных полиморфов или псевдополиморфов. В настоящем документе кристаллический полиморфизм означает способность кристаллического соединения существовать в различных кристаллических структурах. Кристаллический полиморфизм может быть результатом различий в кристаллической упаковке(упаковочный полиморфизм) или различия в упаковке между различными конформерами той же молекулы (конформационный полиморфизм). В настоящем документе кристаллический псевдополиморфизм также включает способность гидрата или сольвата соединения существовать в различных кристаллических структурах. Псевдополиморфы согласно настоящему изобретению могут существовать вследствие различий в кристаллической упаковке (упаковочный псевдополиморфизм) или вследствие различий в упаковке между различными конформерами той же молекулы (конформационные псевдополиморфизм). Настоящее изобретение включает все полиморфы и псевдополиморфы соединений формулы I и их фармацевтически приемлемых солей. Соединение формулы I и его фармацевтически приемлемые соли могут также существовать в виде аморфного твердого вещества. В настоящем документе аморфное твердое вещество представляет собой твердое вещество, в котором нет дальнего порядка положений атомов в указанном твердом веществе. Это определение применимо также, когда размер кристалла составляет два нанометра или менее. Добавки, включая растворители, можно использовать для создания аморфных форм согласно настоящему изобретению. Настоящее изобретение, включая все фармацевтические композиции, способы лечения, комбинированные продукты и их применения, описанные в настоящем документе, включает все аморфные формы соединений формулы I и их фармацевтически приемлемые соли. Применения Соединения согласно изобретению проявляют активность в качестве блокаторов натриевых каналов. Не будучи связанными какой-либо конкретной теорией, полагают, что соединения согласно изобретению могут действовать in vivo, блокируя эпителиальные натриевые каналы, присутствующие на поверхности слизистых оболочек, и тем самым снижают поглощение воды поверхностью слизистой оболочки. Этот эффект увеличивает объем защитных жидкостей на поверхности слизистых оболочек и перебалансирует систему. Как следствие, соединения согласно изобретению подходят для применения в качестве лекарственных средств, особенно для лечения клинических состояний, для которых может быть показан блокатор натриевых каналов. Такие условия включают легочные состояния, такие как заболевания, связанные с обратимой или необратимой обструкцией дыхательных путей, хроническую обструктивную болезнь легких (ХОБЛ), в том числе острые приступы ХОБЛ, астму, бронхоэктаз (включая бронхоэктаз, вызванный состояниями, отличными от кистозного фиброза), острый бронхит, хронический бронхит, пост-вирусный кашель, кистозный фиброз, эмфизему, пневмонию, панбронхиолит и транстплантат-связанный бронхиолит, в том числе бронхиолит, связанный с транстплантатом легкого и костного мозга, у человека, нуждающегося в этом. Соединения согласно изобретению также могут подходить для лечения трахеобронхита, связанного с аппаратом искусственной вентиляции легких (ИВЛ-связанного трахеобронхита) и/или предотвращения пневмонии, связанной с аппаратом искусственной вентиляции легких (ИВЛ-связанной пневмонии) у вентилируемых пациентов. Настоящее изобретение включает способы лечения каждого из указанных состояний у млекопитающего, нуждающегося в этом, предпочтительно у человека, нуждающегося в этом, каждый способ включает введение указанному млекопитающему фармацевтически эффективного количества соединения согласно настоящему изобретению или его фармацевтически приемлемой соли. Также предложены (a) способ уменьшения острых приступов ХОБЛ у млекопитающего, нуждающегося в этом, (b) способ снижения острых приступов CF у млекопитающего, нуждающегося в этом; (c) способ улучшения функции легких (FEV1) у млекопитающего, нуждающегося в, этом, (d) способ улучшения функции легких (FEV1) у млекопитающих с ХОБЛ, (е) способ улучшения функции легких (FEV1) у млекопитающих с CF, (f) способ уменьшения инфекций дыхательных путей у млекопитающего, нуждающегося в этом. Также предложен способ стимуляции, усиления или улучшения мукоцилиарного клиренса у млекопитающего, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Следует понимать, что мукоцилиарный клиренс включает естественные мукоцилиарные действия, связанные с переносом или клиренсом слизи в дыхательных путях, в том числе само-очищающих механизмов бронхов. Таким образом, также предложен способ улучшения клиренса слизи в дыхательных путях млекопитающих, которые в этом нуждаются. Кроме того, блокаторы натриевых каналов могут быть показаны для лечения состояний, которые облегчаются путем повышенной гидратации поверхностей слизистых оболочек, отличных от легочных поверхностей слизистых оболочек. Примеры таких состояний включают сухость во рту (ксеростомию),сухость кожи, вагинальную сухость, синусит, риносинусит, носовое обезвоживание, в том числе носовое обезвоживание, вызванное введением сухого кислорода, сухость глаз, болезнь Шегрена, средний отит,первичную цилиарную дискинезию, синдром дистальной интестинальной обструкции, эзофагит, запор или хронический дивертикулит. Соединения согласно изобретению также можно использовать для стимулирования гидратации глаз или роговицы. Соединения согласно настоящему изобретению также могут подходить для способов получения образца мокроты у человека. Способ может быть осуществлен путем введения соединения согласно настоящему изобретению в по меньшей мере одно легкое пациента, а затем индицирования и сбора образцов мокроты указанного человека. Соответственно, в одном аспекте в настоящем изобретении предложен способ лечения состояния у млекопитающего, такого как человек, для которого показан блокатор натриевых каналов. Согласно другим вариантам реализации в настоящем изобретении предложен каждый из описанных в настоящем документе способов с дополнительным преимуществом минимизации или исключения гиперкалиемии у реципиента способа. Также предложены варианты реализации, включающие каждый из описанных в настоящем документе способов, в которых достигается улучшенный терапевтический индекс. В настоящем описании термины "лечить", "лечащий" и "лечение" относятся к обращению, облегчению, ингибированию развития или предотвращению нарушения или состояния, или один или более симптомов такого нарушения или состояния. Все терапевтические способы, описанные в настоящем документе, осуществляют путем введения эффективного количества соединения согласно изобретению, соединения формулы I или его фармацевтически приемлемой соли пациенту (обычно млекопитающему и предпочтительно человеку), нуждающемуся в лечении. Согласно одному из вариантов реализации в изобретении предложен способ лечения состояния, облегчаемого путем повышенной гидратации слизистой у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации в изобретении предложен способ лечения заболевания, связанного с обратимой или необратимой обструкцией дыхательных путей, у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из конкретных вариантов реализации в настоящем изобретении предложен способ лечения хронической обструктивной болезни легких(ХОБЛ) у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из конкретных вариантов реализации в настоящем изобретении предложен способ снижения частоты, тяжести или длительности острого приступа ХОБЛ или лечения одного или более симптомов острого приступа ХОБЛ у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации в изобретении предложен способ лечения астмы у млекопитающего, в частности человека, нуждаю-8 023593 щегося в этом. Согласно одному из вариантов реализации в изобретении предложен способ лечения бронхоэктаза (включая бронхоэктазы, вызванные состояниями, отличными от кистозного фиброза) у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации в изобретении предложен способ лечения бронхита, включая острый и хронический бронхит, у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации в изобретении предложен способ лечения пост-вирусного кашля у млекопитающего, в частности человека,нуждающегося в этом. Согласно одному из вариантов реализации в изобретении предложен способ лечения кистозного фиброза у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации в изобретении предложен способ лечения эмфиземы у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации в изобретении предложен способ лечения пневмонии у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации в изобретении предложен способ лечения панбронхиолита у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации в изобретении предложен способ лечения бронхиолита, связанного с трансплантатом, включая бронхиолит, связанный с трансплантатом легкого и костного мозга, у млекопитающего, в частности человека,нуждающегося в этом. Согласно одному из вариантов реализации в изобретении предложен способ лечения ИВЛ-связанного трахеобронхита и/или предотвращения ИВЛ-связанной пневмонии у вентилируемого у человека, нуждающегося в этом. В изобретении предложены конкретные способы лечения заболевания, выбранного из группы обратимой или необратимой обструкции дыхательных путей, хронической обструктивной болезни легких(ХОБЛ), астмы, бронхоэктаза (в том числе бронхоэктаза, вызванного состояниями, отличными от кистозного фиброза), острого бронхита, хронического бронхита, пост-вирусного кашля, кистозного фиброза,эмфиземы, пневмонии, панбронхиолита, трансплантат-связанного бронхиолита и ИВЛ-связанного трахеобронхита, или предотвращения ИВЛ-связанной пневмонии у человека, нуждающегося в этом, включающие введение указанному человеку эффективного количества соединения формулы 1(а) или его фармацевтически приемлемой соли. Согласно другим вариантам реализации каждого способа лечения, форма фармацевтически приемлемой соли представляет собой гидрохлоридную соль или гидроксинафтоатную соль соединения формулы (Ia). Согласно другим вариантам реализации каждого способа лечения используют свободное основание соединения формулы (Ia). Согласно одному из вариантов реализации в изобретении предложен способ лечения сухости во рту(ксеростомии) у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации в изобретении предложен способ лечения сухости кожи у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации в изобретении предложен способ лечения вагинальной сухости у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации в изобретении предложен способ лечения синусита, риносинусита или носового обезвоживания, в том числе носового обезвоживания, вызванного введением сухого кислорода, у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации в изобретении предложен способ лечения сухости глаз или болезни Шегрена, или стимулирования гидратации глаз или роговицы у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации в изобретении предложен способ лечения среднего отита у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации в изобретении предложен способ лечения первичной цилиарной дискинезии у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации в изобретении предложен способ лечения синдрома дистальной интестинальной обструкции, эзофагита, запора или хронического дивертикулита у млекопитающего, в частности человека, нуждающегося в этом. Также предложено соединение согласно изобретению для применения в лекарственной терапии, в частности для применения для лечения состояния у млекопитающего, такого как человек, для которого показан блокатор натриевых каналов. Все терапевтические применения, описанные в настоящем документе, осуществляют путем введения эффективного количества соединения согласно изобретению субъекту, нуждающемуся в этом. Согласно одному из вариантов реализации предложено соединение согласно изобретению для применения для лечения легочного состояния, такого как заболевание, связанное с обратимой или необратимой обструкцией дыхательных путей, у млекопитающего, в частности человека,нуждающегося в этом. Согласно одному из конкретных вариантов реализации предложено соединение согласно изобретению для применения для лечения хронической обструктивной болезни легких (ХОБЛ) у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации предложено соединение согласно изобретению для применения для снижения частоты, тяжести или продолжительности острого приступа ХОБЛ или для лечения одного или более симптомов острого приступа ХОБЛ у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации предложено соединение согласно изобретению для применения для лечения астмы у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации предложено соединение для применения для лечения бронхоэктаза, включая бронхоэктазы, вызванные состояниями, отличнымиот кистозного фиброза, или бронхита, включая острый бронхит и хрониче-9 023593 ский бронхит, у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации предложено соединение для применения для лечения поствирусного кашля, у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации предложено соединение для применения для лечения кистозного фиброза у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации предложено соединение согласно изобретению для применения для лечения эмфиземы у млекопитающего, в частности человека,нуждающегося в этом. Согласно одному из вариантов реализации предложено соединение согласно изобретению для применения для лечения пневмонии у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации предложено соединение согласно изобретению для применения для лечения панбронхиолита или транстплантат-связанного бронхиолита, включая бронхиолит, связанный с транстплантатом легкого и костного мозга у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации предложено соединение согласно изобретению для применения для лечения ИВЛ-связанного трахеобронхита или предотвращения ИВЛ-связанной пневмонии у вентилируемого человека, нуждающегося в этом. Согласно одному из вариантов реализации предложено соединение согласно изобретению для применения для лечения состояния, облегчаемого путем повышенной гидратации слизистой оболочки на поверхностях слизистых оболочек у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации предложено соединение для применения для лечения сухости во рту (ксеростомии) у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации предложено соединение для применения для лечения сухости кожи у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации предложено соединение для применения для лечения вагинальной сухости у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации предложено соединение согласно изобретению для применения для лечения синусита, риносинусита или носового обезвоживания,в том числе носового обезвоживания, вызванного введением сухого кислорода, у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации предложено соединение согласно изобретению для применения для лечения сухости глаз или болезни Шегрена или стимулирования гидратации глаз или роговицы у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации предложено соединение согласно изобретению для применения для лечения среднего отита у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации предложено соединение согласно изобретению для применения для лечения первичной цилиарной дискинезии у млекопитающего, в частности человека, нуждающегося в этом. Согласно одному из вариантов реализации предложено соединение согласно изобретению для применения для лечения синдрома дистальной интестинальной обструкции, эзофагита, запора или хронического дивертикулита у млекопитающего, в частности человека, нуждающегося в этом. В настоящем изобретении также предложено применение соединения согласно изобретению для получения лекарственного средства для лечения состояния у млекопитающего, такого как человек, для которого показан блокатор натриевых каналов. Согласно одному из вариантов реализации предложено применение соединения согласно изобретению для получения лекарственного средства для лечения заболеваний, связанных с обратимой или необратимой обструкцией дыхательных путей, хронической обструктивной болезни легких (ХОБЛ), острых приступов ХОБЛ, астмы, бронхоэктаза (включая бронхоэктаз, вызванный состояниями, отличными от кистозного фиброза), бронхита (включая острый бронхит и хронический бронхит), поствирусный кашля, кистозного фиброза, эмфиземы, пневмонии, панбронхиолита, бронхиолита, связанного с трансплантатом, и ИВЛ-связанного трахеобронхита, или предотвращения ИВЛ-связанной пневмонии. Согласно одному из конкретных вариантов реализации применение соединения согласно изобретению для получения лекарственного средства для лечения состояния, облегчаемого путем повышенной гидратации слизистой оболочки на поверхностях слизистой, лечения сухости во рту (ксеростомии), сухости кожи, вагинальной сухости, синусита, риносинусита или носового обезвоживания, в том числе носового обезвоживания, вызванного введением сухого кислорода, лечения сухости глаз, болезни Шегрена, стимулирования гидратации глаз или роговицы, лечения среднего отита, первичной цилиарной дискинезии, синдрома дистальной интестинальной обструкции, эзофагита, запора или хронического дивертикулита. В настоящем описании термины "эффективное количество", "фармацевтически эффективное количество", "эффективная доза" и "фармацевтически эффективная доза" относятся к количеству соединения согласно изобретению, достаточному, чтобы вызывать биологический или клинический ответ для культур клеток, тканей, системы или млекопитающего (включая человека), у субъекта, которому ее вводят,которые определяются, например исследователем или практикующим врачом. Указанный термин также включает в объем количества, эффективные для повышения нормальной физиологической функции. Согласно одному из вариантов реализации эффективное количество представляет собой количество, необходимое для обеспечения требуемого уровня лекарственного средства в секретах и тканях дыхательных путей и легких, или альтернативно, в кровотоке субъекта, подлежащего лечению, с получением ожидаемого физиологического ответаили требуемого биологического эффекта, когда такую композицию вводят путем ингаляции. Например, эффективное количество соединения согласно изобретению для лечения состояния, для которого показан блокатор натриевых каналов, достаточно лечения конкретного состояния у субъекта, которому ее вводят. Согласно одному из вариантов реализации эффективное количество представляет собой количество соединения согласно изобретению, достаточное для лечения ХОБЛ или кистозного фиброза у человека. Точное эффективное количество соединений согласно изобретению будет зависеть от ряда факторов, включая, но не ограничиваясь ими, вида, возраста и веса субъекта, подлежащего лечению, точного состояния, требующего лечения, и его тяжести, биодоступности, эффективности и других свойств конкретного вводимого соединения, природы состава, способа введения и устройства для доставки, и в конечном итоге будет определяться по усмотрению лечащего врача или ветеринара. Дополнительное руководство по отношению к подходящей дозе может быть найдено при рассмотрении традиционной дозировки других блокаторов натриевых каналов, таких как амилорид, с учетом также любых различий в активности между амилоридом и соединением согласно настоящему изобретению. Фармацевтически эффективная доза, вводимая местно на поверхности дыхательных путей субъекта(например, путем ингаляции), соединения согласно изобретению для лечения человека весом 70 кг может составлять от примерно 10 нг до примерно 10 мг. Согласно другому варианту реализации фармацевтически эффективная доза может составлять от примерно 0,1 до примерно 1000 мкг. Как правило, суточная доза, вводимая местно на поверхности дыхательных путей, будет представлять собой количество,достаточное для достижения растворенной концентрации активного агента на поверхностях дыхательных путей, составляющей от примерно 10-9, 10-8, или 10-7 до примерно 10-4, 10-3, 10-2 или 10-1 моль/л, более предпочтительно от примерно 10-9 до примерно 10-4 моль/л. Выбор конкретной дозы для пациента будет осуществляться лечащим врачом, врачом или ветеринаром средней квалификации в данной области техники на основании ряда факторов, в том числе отмеченных выше. Согласно одному из конкретных вариантов реализации доза соединения согласно изобретению для лечения человека весом 70 кг будет составлять от примерно 10 нанограмм (нг) до примерно 10 мг. Согласно другому варианту реализации эффективная доза будет составлять от примерно 0,1 до примерно 1000 мкг. Согласно одному из вариантов реализации доза соединения согласно изобретению для лечения человека весом 70 кг будет составлять от примерно 0,5 мкг до примерно 0,5 мг. Согласно дополнительному варианту реализации доза будет составлять от примерно 0,5 до примерно 60 мкг. Согласно другому варианту реализации фармацевтически эффективная доза будет составлять от примерно 1 до примерно 10 мкг. Согласно другому варианту реализации фармацевтически эффективная доза будет составлять от примерно 5 до примерно 50 мкг. Согласно другому варианту реализации эффективная доза будет составлять от примерно 10 до примерно 40 мкг. Согласно двум дополнительным вариантам реализации фармацевтически эффективная доза будет составлять от примерно 15 до примерно 50 мкг, от примерно 15 до примерно 30 мкг соответственно. Следует понимать, что в каждом из указанных диапазонов доз, все возрастающие дозы включены в диапазон. Например, диапазон 0,5-50 мкг включает отдельные дозы: 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,1,1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3,0, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7,3,8, 3,9, 4,0, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9, 5,0, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6,0, 6,1, 6,2, 6,3,6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7,0, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9, 8,0, 8,1, 8,2, 8,3, 8,4, 8,5, 8,6, 8,7, 8,8, 8,9,9,0, 9,1, 9,2, 9,3, 9,4, 9,5, 9,6, 9,7, 9,8, 9,9, 10,0, 10,1, 10,2, 10,3, 10,4, 10,5, 10,6, 10,7, 10,8, 10,9, 11,0, 11,1,11,2, 11,3, 11,4, 11,5, 11,6, 11,7, 11,8, 11,9, 12,0, 12,1, 12,2, 12,3, 12,4, 12,5, 12,6, 12,7, 12,8, 12,9, 13,0, 13,1,13,2, 13,3, 13,4, 13,5, 13,6, 13,7, 13,8, 13,9, 14,0, 14,1, 14,2, 14,3, 14,4, 14,5, 14,6, 14,7, 14,8, 14,9, 15,0, 15,1,15,2, 15,3, 15,4, 15,5, 15,6, 15,7, 15,8, 15,9, 16,0, 16,1, 16,2, 16,3, 16,4, 16,5, 16,6, 16,7, 16,8, 16,9, 17,0, 17,1,17,2, 17,3, 17,4, 17,5, 17,6, 17,7, 17,8, 17,9, 18,0, 18,1, 18,2, 18,3, 18,4, 18,5, 18,6, 18,7, 18,8, 18,9, 19,0, 19,1,19,2, 19,3, 19,4, 19,5, 19,6, 19,7, 19,8, 19,9, 20,0, 20,1, 20,2, 20,3, 20,4, 20,5, 20,6, 20,7, 20,8, 20,9, 21,0, 21,1,21,2, 21,3, 21,4, 21,5, 21,6, 21,7, 21,8, 21,9, 22,0, 22,1, 22,2, 22,3, 22,4, 22,5, 22,6, 22,7, 22,8, 22,9, 23,0, 23,1,23,2, 23,3, 23,4, 23,5, 23,6, 23,7, 23,8, 23,9, 24,0, 24,1, 24,2, 24,3, 24,4, 24,5, 24,6, 24,7, 24,8, 24,9, 25,0, 25,1,25,2, 25,3, 25,4, 25,5, 25,6, 25,7, 25,8, 25,9, 26,0, 26,1, 26,2, 26,3, 26,4, 26,5, 26,6, 26,7, 26,8, 26,9, 27,0, 27,1,27,2, 27,3, 27,4, 27,5, 27,6, 27,7, 27,8, 27,9, 28,0, 28,1, 28,2, 28,3, 28,4, 28,5, 28,6, 28,7, 28,8, 28,9, 29,0, 29,1,29,2, 29,3, 29,4, 29,5, 29,6, 29,7, 29,8, 29,9, 30,0, 30,1, 30,2, 30,3, 30,4, 30,5, 30,6, 30,7, 30,8, 30,9, 31,0, 31,1,31,2, 31,3, 31,4, 31,5, 31,6, 31,7, 31,8, 31,9, 32,0, 32,1, 32,2, 32,3, 32,4, 32,5, 32,6, 32,7, 32,8, 32,9, 33,0, 33,1,33,2, 33,3, 33,4, 33,5, 33,6, 33,7, 33,8, 33,9, 34,0, 34,1, 34,2, 34,3, 34,4, 34,5, 34,6, 34,7, 34,8, 34,9, 35,0, 35,1,35,2, 35,3, 35,4, 35,5, 35,6, 35,7, 35,8, 35,9, 36,0, 36,1, 36,2, 36,3, 36,4, 36,5, 36,6, 36,7, 36,8, 36,9, 37,0, 37,1,37,2, 37,3, 37,4, 37,5, 37,6, 37,7, 37,8, 37,9, 38,0, 38,1, 38,2, 38,3, 38,4, 38,5, 38,6, 38,7, 38,8, 38,9, 39,0, 39,1,39,2, 39,3, 39,4, 39,5, 39,6, 39,7, 39,8, 39,9, 40,0, 40,1, 40,2, 40,3, 40,4, 40,5, 40,6, 40,7, 40,8, 40,9, 41,0, 41,1,41,2, 41,3, 41,4, 41,5, 41,6, 41,7, 41,8, 41,9, 42,0, 42,1, 42,2, 42,3, 42,4, 42,5, 42,6, 42,7, 42,8, 42,9, 43,0, 43,1,43,2, 43,3, 43,4, 43,5, 43,6, 43,7, 43,8, 43,9, 44,0, 44,1, 44,2, 44,3, 44,4, 44,5, 44,6, 44,7, 44,8, 44,9, 45,0, 45,1,45,2, 45,3, 45,4, 45,5, 45,6, 45,7, 45,8, 45,9, 46,0, 46,1, 46,2, 46,3, 46,4, 46,5, 46,6, 46,7, 46,8, 46,9, 47,0, 47,1,47,2, 47,3, 47,4, 47,5, 47,6, 47,7, 47,8, 47,9, 48,0, 48,1, 48,2, 48,3, 48,4, 48,5, 48,6, 48,7, 48,8, 38,9, 49,0, 49,1,49,2, 49,3, 49,4, 49,5, 49,6, 49,7, 49,8, 39,9 и 50 мкг. Указанные выше предложенные дозы могут быть скорректированы с использованием традиционных методик расчетов дозы, если соединение вводят другим способом. Определение соответствующей дозы для введения другими способами находится в пределах компетенции специалистов в данной области в свете приведенного выше описания и общих знаний в данной области техники. Доставка эффективного количества соединения согласно изобретению могут включать доставку единичной лекарственной формы или множественных единичных доз, которые могут быть доставлены одновременно или раздельно по времени в течение заданного периода времени, например 24 ч. Дозу соединения согласно настоящему изобретению (отдельно или в форме композиции, содержащей указанное соединение) можно вводить от одного до десяти раз в день. Как правило, соединение согласно настоящему изобретению (отдельно или в форме композиции, содержащей указанное соединение) можно вводить четыре, три, два или один раз в сутки (24 ч). Соединения формулы (I) согласно настоящему изобретению также подходят для лечения воздушнокапельных инфекций. Примеры воздушно-капельных инфекций включают, например, респираторный синцитиальный вирус (англ. Human respiratory syncytial virus, RSV). Соединения формулы (I) согласно настоящему изобретению также подходят для лечения инфекции сибирской язвы. Настоящее изобретение относится к применению соединений формулы (I) согласно настоящему изобретению для профилактики, постэкспозиционной профилактики, профилактического или терапевтического лечения заболеваний или состояний, вызванных патогенными микроорганизмами. В предпочтительном варианте реализации настоящее изобретение относится к применению соединений формулы (I) для профилактики, постэкспозиционной профилактики, профилактического или терапевтического лечения заболеваний или состояний, вызванных патогенами, которые могут быть использованы в целях биотерроризма. В последние годы было начато множество научно-исследовательских программ и принято множество мер биозащиты в отношении использования биологических агентов в террористических актах. Указанные меры предназначены для решения проблем, касающихся терроризма или использования микроорганизмов или биологических токсинов для убийства людей, распространения страха и подрыва общественного строя. Например, Национальный институт аллергии и инфекционных заболеваний (англ. National Institute of Allergy and Infectious Diseases, NIAID) разработал стратегический план исследований биозащиты, в котором излагаются планы для решения научно-исследовательских потребностей в широком спектре биотерроризма и новых и повторно возникающих инфекционных заболеваний. В соответствии с планом преднамеренное воздействие на гражданское население соединенных Штатов спорами Bacillus anthracis выявило пробелы в общей готовности страны к защите от биотерроризма. Кроме того, в докладе подробно описано, что указанные атаки позволили выявить неудовлетворенную потребность в тестах для быстрой диагностики, вакцинах и иммунотерапиях для предотвращения и лекарственных средствах и биопрепаратах для лечения заболевания, вызванного агентами биотерроризма. Большая часть различных исследовательских программ была направлена на изучение биологии возбудителей, идентифицированных как потенциально опасные в качестве агентов биотерроризма, изучение реакции хозяина в отношении таких агентов, разработку вакцин против инфекционных заболеваний,оценку терапии, как доступной в настоящее время, так и исследуемой, в отношении таких агентов, а также разработку диагностики для выявления признаков и симптомов от потенциально опасных агентов. Такие программы заслуживают одобрения, но, учитывая большое количество патогенов, идентифицированных как потенциально доступные для биотерроризма, указанные программы пока не в состоянии обеспечить удовлетворительные ответы на все возможные угрозы биотерроризма. Кроме того, многие из патогенов, идентифицированных как потенциально опасные в качестве агентов биотерроризма, не обеспечивают надлежащих экономических стимулов для развития в промышленности терапевтических или профилактических мер. Более того, даже если бы профилактические меры, такие как вакцины, были доступны для каждого патогена, который может использоваться в целях биотерроризма, стоимость введения всех таких вакцин общей численности населения в целом является чрезмерной. До того как будут доступны удобные и эффективные способы лечения в отношении каждой угрозы биотерроризма, будет существовать острая необходимость в предотвращающих, профилактических или терапевтических процедурах, позволяющих предотвратить или снизить риск заражения от патогенных агентов. В настоящем изобретении предложены такие способы профилактического лечения. В одном аспекте предложен способ профилактического лечения, включающий введение профилактически эффективного количества соединений формулы (I) индивидууму, нуждающемуся в профилактическом лечении против инфекции от одного или более воздушно-капельных патогенов. Конкретным примером воздушнокапельного патогена является сибирская язва. В другом аспекте предложен способ профилактического лечения для снижения риска инфекции от воздушно-капельного патогена, который может вызвать заболевание у человека, где указанный способ включает введение эффективного количества соединений формулы (I) в легкие человека, который может подвергаться риску заражения от воздушно-капельного патогена, вызывающего бессимптомное заболевание, причем указанное эффективное количество блокатора натриевых каналов и осмолита достаточно,чтобы снизить риск инфекции в организме человека. Конкретным примером воздушно-капельного патогена является сибирская язва. В другом аспекте предложен способ пост-контактного профилактического или терапевтического лечения для лечения инфекции воздушно-капельного патогена, включающий введение эффективного количества соединений формулы (I), в легкие индивидууму, нуждающемуся в таком лечении в отношении инфекции воздушно-капельного патогена. Патогены, от которых может быть обеспечена защита с помощью профилактического пост-контактного, экстренного и терапевтического способов лечения согласно изобретению включают любые патогены, которые могут попасть в организм через рот, нос или назальные дыхательные пути, таким образом переходя в легкие. Как правило, патогены будут представлять собой воздушно-капельные патогены, как находящиеся в природе, так и после распыления. Патогены могут быть природного происхождения или могут быть введены в окружающую среду в результате намеренного распыления или посредством другого способа введения патогенов в окружающую среду. Множество патогенов, которые не переносятся в воздухе естественным образом, были или могут быть распылены для использования в целях биотерроризма. Патогены, для которых может подходить лечение согласно изобретению, включают, но не ограничиваются ими, приоритетные патогены категорий A, B иC, приведенные NIAID. Указанные категории в целом соответствуют спискам, составленным по данным Центров по контролю и профилактике заболеваний (CDC). Как указано CDC, агенты категории А представляют собой агенты, которые могут быть легко распространены или перенесены от человека к человеку, вызывают высокую смертность, обладают потенциалом в отношении серьезных последствий для общественного здравоохранения. Следующие по приоритету агенты категории В включают агенты, которые умеренно легко распространяются и вызывают умеренную заболеваемость и низкую смертность. Категория С состоит из новых патогенов, которые могут быть разработаны для массового распространения в будущем вследствие их доступности, простоты производства и распространения и потенциала в отношении высокой заболеваемости и смертности. Конкретными примерами указанных патогенов являются сибирская язва и чума. Дополнительные патогены, от которых может быть обеспечена защита или риск инфекции которых может быть снижен, включают вирусы гриппа, риновирусы, аденовирусы и респираторно-синцитиальные вирусы и тому подобное. Дополнительных патоген, от которого может быть обеспечена защита, представляет собой коронавирус, который, как полагают, является причиной тяжелого острого респираторного синдрома (англ. severe acute respiratory syndrome, SARS). Изобретение также относится к применению блокаторов натриевых каналов формулы I или их фармацевтически приемлемой соли для предотвращения, облегчения и/или лечения детерминированных воздействий на дыхательные пути, вызванных воздействием радиоактивных материалов, в частности вдыхаемых аэрозолей, содержащих радионуклиды в результате ядерных атак, таких как детонация радиологического рассеивающего устройства (RDD), или несчастных случаев, таких как авария на АЭС. Таким образом, в настоящем изобретении предложен способ предотвращения, облегчения и/или лечения детерминированных воздействий на дыхательные пути и/или другие органы тела, вызванных вдыхаемыми аэрозолями, содержащими радионуклиды, у реципиента, нуждающегося в этом, в том числе у человека, нуждающегося в этом, причем указанный способ включает введение указанному человеку эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Одной из основных проблем, связанных с управлением последствий при воздействии на представителей общественности вдыхаемых аэрозолей, содержащих радионуклиды в результате ядерных атак, таких как детонация радиологического рассеивающего устройства (RDD), или несчастных случаев, таких как авария АЭС, является предотвращение, облегчение или лечение потенциальных детерминированных воздействий на дыхательные пути, в первую очередь на легкие. Необходимо иметь лекарственные средства, методики и процедуры, и обученный персонал, подготовленный для управления и лечения таких высокопораженных лиц. Было проведено исследование с целью определения способов предотвращения, облегчения или лечения потенциального повреждения дыхательных путей и различных органов в организме, вызванного внутренними осажденными радионуклидами. На сегодняшний день большая часть исследований была сосредоточена на стратегиях, направленных на облегчение медицинских последствий от внутренних осажденных радионуклидов за счет ускорения их выведения или удаления. Указанные стратегии были направлены на растворимые химические формы, способные поступать в кровоток, и которые осаждаются на удаленных системных сайтах, специфичных по отношению к заданному радиоэлементу. Такие подходы не будут работать в тех случаях, когда осажденные радионуклиды находятся в относительно нерастворимой форме. Исследования показали, что множество, если не большинство физико-химических форм радионуклидов, распыляемых из радиологических распыляющих устройств (англ. Radiological Dispersion Device, RDD), будет в относительно нерастворимой форме. Единственным известным способом, эффективно уменьшающим дозу облучения легких от вдыхаемых нерастворимых радиоактивных аэрозолей, является бронхоальвеолярный лаваж или БАЛ. Было показано, что указанный способ, который был доработан из уже использующегося способа для лечения пациентов с альвеолярным протеинозом, является безопасной, воспроизводимой процедурой, даже когда выполняется в течение длительного периода времени. Хотя существуют различия в процедуре, основный метод БАЛ включает введение обезболивающего субъекту, затем медленное введение изотонического солевого раствора в одну долю легкого, пока не будет достигнута функциональная остаточная мкость. Затем добавляют дополнительные объемы и выводят самотеком. Результаты исследований с использованием БАЛ на животных показывают, что примерно 40% глубокого содержимого в легких может быть удалено посредством разумной последовательности БАЛ. В некоторых исследованиях встречались значительные различия в количестве извлеченных радионуклидов среди животных. Причины изменчивости в настоящее время не известны. Кроме того, на основании исследования животных, полагают, что значительное снижение дозы в результате терапии БАЛ приводит к облегчению медицинских последствий при вдыхании нерастворимых радионуклидов. В указанном исследовании, взрослые собаки вдыхали нерастворимые частицы 144Ce-FAP. Две группы собак получали содержание 144Ce в легких, вызывающее радиационный пневмонит и фиброз легких (примерно 2 МБк/кг массы тела), одна группа проходила 10 односторонних лаважей между 2 и 56 сутками после воздействия, другая оставалась без лечения. Третья группа подвергалась воздействию на уровне 144Ce, сравнимого с воздействием в группе, обработанной БАЛ, после лечения(примерно 1 МБк/кг), но указанные животные не подвергались лечению. Всем животным позволяли прожить в течение своей продолжительности жизни, которая составляла 16 лет. Поскольку существовали различия в исходном содержании 144Ce в легких у собак в каждой группе, уровни дозы и суммарные дозы для каждой группы перекрывались. Тем не менее, эффект БАЛ в снижении риска пневмонита/фиброза был очевиден из кривых выживаемости. У необработанных собак содержание в легких составляло 1,5-2,5 МБк/кг, среднее время выживания составило 37065 суток. Для обработанных собак среднее время выживания составило 1270240 суток, причем оно было статистически значительно различно. Третья группа, которая получила содержание 144 Се в легких в количестве 0,6-1,4 МБк, имела среднее время выживания 1800230, которое статистически не отличалось от обработанной группы. Не менее важно, что с увеличением выживаемости собаки необработанной группы с высокой дозой умерли от детерминированных эффектов в легких (пневмония/фиброз), в то время как обработанные собаки не умерли. Вместо этого, обработанные собаки, такие как собаки необработанной группы с низкими дозами, в основном имели опухоли легких (гемангиосаркома или карцинома). Таким образом, по видимому, снижение дозы в результате лечения БАЛ приводило к биологическим эффектам в легких, которые были предсказуемы на основании доз облучения, получаемых легкими. На основании этих результатов полагают, что дополнительное уменьшение остаточной радиологической дозы с помощью любого способа или комбинации способов повышения клиренса частиц из легких приведет к большему снижению вероятности возникновения воздействия на легкие. Тем не менее,БАЛ это процедура, имеющая множество недостатков. БАЛ является высокоинвазивной процедурой,которая должна быть выполнена в специализированных медицинских центрах обученными пульмонологами. Таким образом, BAL является дорогой процедурой. Учитывая недостатки БАЛ, он не подходит в качестве варианта лечения, который будет легко и немедленно доступен лицам, нуждающимся в ускоренном удалении радиоактивных частиц, например в случае ядерной атаки. В случае ядерной атаки или ядерной аварии необходимо немедленное и относительно легко вводимое лечение для лиц, подвергнутых или имеющих риск подвергнуться воздействию. Было показано, что блокаторы натриевых каналов, вводимые в виде аэрозолей для ингаляции, восстанавливают гидратацию поверхностей дыхательных путей. Такая гидратация поверхностей дыхательных путей помогает в очистке накопившихся выделений слизи и связанных твердых частиц из легких. Таким образом, не будучи связанными какой-либо конкретной теорией, полагают, что блокаторы натриевых каналов можно использовать для ускорения удаления радиоактивных частиц из проходов дыхательных путей. Как обсуждалось выше, наибольший риск для легких вследствие радиологической атаки, например грязной бомбы, вытекает из ингаляции и удержания нерастворимых радиоактивных частиц. В результате удержания радиоактивных частиц, кумулятивное воздействие на легкие значительно увеличивается, что,в конечном счете, приводит к фиброзу легких/пневмониту и, потенциально, к смерти. Нерастворимые частицы не могут системно очищаться хелатирующими агентами, так как указанные частицы не находятся в растворе. На сегодняшний день физическое удаление твердых частиц через БАЛ является единственным терапевтическим режимом, демонстрирующим эффективность облегчения радиационноиндуцированных заболеваний легких. Как обсуждалось выше, БАЛ не является реалистичным лечебным решением для снижения действия радиоактивных частиц, которые были ингаляционно введены в организм. Таким образом, необходимо обеспечить терапевтический режим, эффективно способствующий выведению радиоактивных частиц из проходов дыхательных путей, и который, в отличие от БАЛ, является относительно простым в применении и масштабируемым при крупномасштабном сценарии радиационного воздействия. Кроме того, также необходимо, чтобы указанный терапевтический режим был легкодоступен для множества людей в течение относительно короткого периода времени. В одном аспекте настоящего изобретения предложен способ предотвращения, облегчения и/или лечения детерминированных воздействий на дыхательные пути и/или другие органы тела, вызванных вдыхаемыми аэрозолями, содержащими радионуклиды, включающий введение эффективного количества блокатора натриевых каналов формулы I или его фармацевтически приемлемой соли индивидууму, нуждающемуся в этом. Согласно одному из признаков указанного аспекта, блокатор натриевых каналов вводят в сочетании с осмолитом. Согласно дополнительному признаку осмолит представляет собой гипер- 14023593 тонический солевой раствор (HS). Согласно еще одному признаку блокатор натриевых каналов и осмолит вводят в сочетании с модулятором ионного переноса. Согласно дополнительному из признаку указанный модулятор ионного переноса может быть выбран из группы, состоящей из -агонистов, CFTR потенцирующех средств, агонистов пуринергического рецептора, лубипростонов и ингибиторов протеазы. Согласно другому признаку указанного аспекта радионуклиды выбраны из группы, состоящей из кобальт-60, цезий-137, иридий-192, радий-226, фосфор-32, стронций-89 и 90, йод-125, таллий-201, свинец-210, торий-234, уран-238, плутоний, кобальт-58, хром-51, америций и кюрий. Согласно дополнительному признаку радионуклиды представляют собой радионуклиды из радиоактивного распыляющего устройства. Согласно еще одному признаку, блокатор натриевых каналов или его фармацевтически приемлемую соль вводят в аэрозольной суспензии вдыхаемых частиц, которые вдыхает индивидуум. Согласно дополнительному признаку, блокатор натриевых каналов или его фармацевтически приемлемую соль вводят после воздействия радионуклидами. Композиции Хотя введение соединения согласно изобретению возможно в отдельности, согласно некоторым вариантам реализации предпочтительно его присутствие в форме композиции, в частности фармацевтической композиции (составе). Таким образом, в другом аспекте, в изобретении предложены композиции, в частности фармацевтические композиции (такие как ингалируемые фармацевтические композиции), содержащие фармацевтически эффективное количество соединения согласно изобретению в качестве активного ингредиента, и фармацевтически приемлемый наполнитель, разбавитель или носитель. В настоящем описании термин "активный ингредиент" относится к любому соединению согласно изобретению или комбинации двух или более соединений согласно изобретению в фармацевтической композиции. Также предложены конкретные варианты реализации, согласно которым фармацевтическая композиция содержит фармацевтически эффективное количество соединения формул (I), (Ia), (Ib), (Ic), (Id),(Ie), (If), (Ig), (Ih), (Ii), (Ij), (Ik) и (Il) или его фармацевтически приемлемую соль, независимо или в комбинации, и фармацевтически приемлемый наполнитель, разбавитель или носитель. Согласно некоторым вариантам реализации указанная фармацевтическая композиция содержит фармацевтически эффективное количество соединения формул (I), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih),(Ii), (Ij), (Ik) и (Il) или его фармацевтически приемлемую соль, независимо или в комбинации, в разбавителе. Согласно отдельным вариантам реализации указанная фармацевтическая композиция содержит фармацевтически эффективное количество соединения формул (I), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih),(Ii), (Ij), (Ik) и (Il) или его фармацевтически приемлемую соль, в гипертоническом солевом растворе, стерильной воде и гипертоническом солевом растворе, соответственно, причем концентрация указанного солевого раствора может быть такой, как описано в настоящем документе. Согласно одному из вариантов реализации концентрация указанного солевого раствора составляет 0,17% мас./об. и согласно другому 2,8% мас./об. Также предложен набор, содержащий i) фармацевтически эффективное количество соединения формулы (I), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih), (Ii), (Ij), (Ik) и (Il) или его фармацевтически приемлемой соли; ii) один или более фармацевтически приемлемых наполнителей, носителей или разбавителей;iii) инструкции по введению соединения группы i) и наполнителей, носителей, или разбавителей группыii) субъекту, нуждающемуся в этом; и iv) контейнер. Субъект, нуждающийся в этом, включает любой субъект, нуждающийся в способах лечения, описанных в настоящем документе, в частности, включая человека, нуждающегося в этом. Дополнительные варианты реализации также включают устройство для распыления аэрозоля, выбранное из группы небулайзера, включая вибрирующие ячеистые небулайзеры(vibrating mesh nebulizers) и струйные небулайзеры, ингалятора сухого порошка, включая активные и пассивные ингаляторы сухого порошка, и дозирующего ингалятора, включая дозирующие ингаляторы под давлением, дозирующие ингаляторы сухого порошка, а также жидкостные (soft mist) дозирующие ингаляторы. Согласно одному из вариантов реализации набор содержит i) от примерно 10 нг до примерно 10 мг соединения формулы (I), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih), (Ii), (Ij), (Ik) и (Il) или его фармацевтически приемлемой соли, на дозу; ii) от примерно 1 до примерно 5 мл разбавителя на дозу; iii) инструкции по введению соединения группы i) и разбавителя группы ii) субъекту, нуждающемуся в этом; и; iv) контейнер. Согласно дополнительному варианту реализации указанный разбавитель представляет собой от примерно 1 до примерно 5 мл солевого раствора, описанного в настоящем документе, на дозу. Согласно дополнительному варианту реализации указанный разбавитель представляет собой от примерно 1 до примерно 5 мл гипотонического солевого раствора на дозу. Согласно другому варианту реализации указанный разбавитель представляет собой от примерно 1 до примерно 5 мл гипертонического солевого раствор на дозу. Согласно дополнительному варианту реализации указанный разбавитель представляет собой от примерно 1 до примерно 5 мл стерильной воды на дозу. Также предложен набор, содержащий i) раствор, содержащий фармацевтически эффективное количество соединения формулы (I), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih), (Ii), (Ij), (Ik) и (Il) или его фармацевтически приемлемой соли; растворенного в фармацевтически приемлемом разбавителе; iii) инструкции по введению указанного раствора группы i) субъекту, нуждающемуся в этом; и iii) контейнер. Также предложен набор, содержащий i) раствор, содержащий от примерно 10 нг до примерно 10 мг соединения формулы (I), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih), (Ii), (Ij), (Ik) и (Il) или его фармацевтически приемлемой соли; растворенного в фармацевтически приемлемом разбавителе; iii) инструкции по введению указанного раствора группы i) субъекту, нуждающемуся в этом; и iii) контейнер. Согласно дополнительному варианту реализации указанный разбавитель представляет собой от примерно 1 до примерно 5 мл солевого раствора, описанного в настоящем документе, на дозу. Другой вариант реализации включает набор, содержащий i) фармацевтически эффективное количество соединения формулы (I), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih), (Ii), (Ij), (Ik) и (Il) или его фармацевтически приемлемой соли; в составе сухого порошка, подходящем для ингаляции ii) один или более фармацевтически приемлемых наполнителей или носителей, подходящих для ингаляции; iii) инструкции по введению указанного соединения группы i) и указанных наполнителей или носителей группы ii) субъекту, нуждающемуся в этом; и; iv) контейнер. Согласно дополнительному варианту реализации указанный набор также содержит ингалятор сухого порошка, подходящий для доставки состава сухого порошка реципиенту. Указанный ингалятор сухого порошка может представлять собой, согласно дополнительным вариантам реализации, однодозовый ингалятор или многодозовый ингалятор. Дополнительные варианты реализации каждого из наборов, описанных в настоящем документе,включают наборы, в которых концентрация соединения формулы (I), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih),(Ii), (Ij), (Ik) и (Il) или его фармацевтически приемлемой соли на дозу представляет собой одну из эффективных диапазонов доз, описанных в настоящем документе, включая а) от примерно 0,1 мкг до примерно 1000 мкг; b) от примерно 0,5 мкг до примерно 0,5 мг; и с) от примерно 0,5 до примерно 50 мкг. Для каждого из наборов, описанных выше, существует дополнительный вариант реализации, в котором разбавитель представляет собой гипертонический солевой раствор с концентраций, описанной в настоящем документе. Согласно другому варианту реализации для каждого набора разбавитель представляет собой гипотонический солевой раствор с концентраций, описанной в настоящем документе. Согласно дополнительному варианту реализации для каждого набора, разбавитель представляет собой стерильную воду, подходящую для ингаляции. Фармацевтически приемлемые наполнитель(и), разбавитель(и) или носитель(и) должны быть приемлемыми в смысле совместимости с другими ингредиентами состава и не вредным для реципиента. Как правило, фармацевтически приемлемые наполнитель(и), растворитель (и) или носитель (и), используемые в фармацевтическом составе, являются "нетоксичными", что означает, что он/они считаются безопасными для употребления в количестве, доставляемом в составе, и "инертными", что означает, что он/они не вступают в реакцию или приводят к нежелательному эффекту в отношении терапевтической активности активного ингредиента(ов). Фармацевтически приемлемые наполнители, разбавители и носители являются традиционными в данной области техники и могут быть выбраны с использованием обычных методов, основанных на желаемом способе введения. См. Remington's, Pharmaceutical Sciences,Lippincott WilliamsWilkins; 21st Ed (May 1, 2005). Предпочтительно, фармацевтически приемлемые наполнитель(и), разбавитель(и) или носитель(и) в целом признаны безопасными (англ. Generally Regarded As Safe, GRAS) согласно правилам Управления по контролю качества пищевых продуктов и лекарственных средств США (англ. Food and Drug Administration, FDA). Фармацевтические композиции согласно изобретению включают составы, подходящие для перорального введения; парентерального введения, в том числе подкожного, внутрикожного, внутримышечного, внутривенного и внутрисуставного введения; местного применения, в том числе местного нанесения на кожу, глаза, уши и т.д.; вагинального или ректального введения и введения в дыхательные пути, в том числе носовые полости и пазухи, полости рта и экстраторакальные дыхательные пути, и легкие, в том числе с использованием аэрозолей, которые могут быть доставлены с помощью различных видов ингаляторов сухого порошка, дозирующих ингаляторов под давлением, жидкостных (softmist) ингаляторов, небулайзеров или инсуффляторов. Наиболее подходящий путь введения может зависеть от нескольких факторов, включая пациента и состояния или нарушения, подлежащего лечению. Составы могут быть представлены в единичной дозированной форме или в объемной форме, например, в случае составов, которые будут дозированы с помощью ингалятора, и могут быть получены любым из способов, хорошо известных в области фармации. Как правило, указанные способы включают стадию приведения активного ингредиента в ассоциацию с носителем, разбавителем или наполнителем и, возможно, одним или более вспомогательным ингредиентом. В целом, составы получают путем равномерного и тщательного смешивания активного ингредиента с одним или более жидким носителем,разбавителем или наполнителем или тонко измельченными твердыми носителями, разбавителями или наполнителями, или и тем и другим, и затем, если необходимо, формованием продукта в желательный состав. Согласно одному из предпочтительных вариантов реализации указанная композиция представляет собой ингалируемую фармацевтическую композицию, подходящую для ингаляции и доставки в эндобронхиальное пространство. Как правило, такая композиция присутствует в форме аэрозоля, содержащего частицы для доставки с использованием небулайзера, дозирующего ингалятора под давлением (англ.Metered dose inhaler, MDI), жидкостного (softmist) ингалятора или ингалятора сухого порошка (англ. drypowder inhaler, DPI). Аэрозольный состав, используемый в способах согласно настоящему изобретению,может представлять собой жидкость (например, раствор), подходящую для введения с помощью небулайзера, жидкостного (softmist) ингалятора или MDI, или сухого порошка, подходящего для введения с помощью MDI или DPI. Аэрозоли, используемые для введения лекарственных средств в дыхательные пути, как правило,полидисперсны, т.е. они состоят из частиц различных размеров. Распределение частиц по размерам, как правило, описывается масс-медианным аэродинамическим диаметром (англ. Mass Median AerodynamicDiameter, MMAD) и геометрическим стандартным отклонением (англ. Geometric Standard Deviation,GSD). Для оптимальной доставки лекарственного средства в эндобронхиальное пространство MMAD составляет от примерно 1 до примерно 10 мкм и предпочтительно от примерно 1 до примерно 5 мкм, иGSD составляет менее 3, предпочтительно менее примерно 2. Аэрозоли, имеющие MMAD выше 10 мкм,как правило, слишком большие, чтобы достичь легких при ингаляции. Аэрозоли с GSD более примерно 3 не являются предпочтительными для доставки в легкие, поскольку они обеспечивают высокое содержание лекарственного средства в ротовой полости. Для достижения этих размеров частиц в составе в виде порошка, размер частиц активного ингредиента может быть уменьшен с использованием традиционных способов, таких как микронизация или сушка распылением. Неограничивающие примеры других процессов или методов, которые могут быть использованы для получения вдыхаемых частиц, включают сушку распылением, осаждение, сверхкритическую жидкость и лиофилизацию. Целевую фракцию можно отделить посредством воздушной сортировки или просеивания. В одном из вариантов реализации частицы являются кристаллическими. Для жидких составов, размер частиц определяется выбором конкретной модели небулайзера, жидкостного (softmist) ингалятора или MDI. Распределение частиц аэрозоля по размерам определяют с использованием устройств, хорошо известных в данной области техники. Например, многоступенчатый каскадный импактор Андерсона или другой подходящий способ, такой как способы, приведенные в Фармакопее США Глава 601 в качестве характеризующих устройств для аэрозолей, высвобождаемых из дозирующих ингаляторов и ингаляторов сухого порошка. Сухие порошковые композиции для местной доставки в легкие путем ингаляции могут быть получены без наполнителя или носителя, и вместо этого включают только активные ингредиенты в форме сухого порошка, имеющего подходящий размер частиц для ингаляции. Сухие порошковые композиции могут также содержать смесь активного ингредиента и подходящей порошковой основы (вещества носителя/разбавителя/наполнителя), такие как моно-, ди- или полисахаридов (например, лактоза или крахмал). Лактоза, как правило, является предпочтительным наполнителем для сухих порошковых составов. Когда используют твердый наполнитель, такой как лактоза, в целом, размер частиц наполнителя будет гораздо больше, чем активного ингредиента, для облегчения дисперсии состава в ингаляторе. Неограничивающие примеры ингаляторов сухого порошка включают резервуарные многодозовые ингаляторы, многодозовые ингаляторы с предварительно отмеренной дозой, капсульные ингаляторы и однодозовые одноразовые ингаляторы. Резервуарный ингалятор содержит большое количество доз (например, 60) в одном контейнере. До ингаляции пациент приводит в действие ингалятор, что вызывает дозирование одной дозы лекарственного средства ингалятором из резервуара и подготовку ее для ингаляции. Примеры резервуарных DPI включают, но не ограничиваются ими Turbohaler от AstraZeneca иClickHaler от Vectura. В случае многодозового ингалятора с предварительно отмеренной дозой каждая индивидуальная доза была получена в отдельном контейнере, и приведение в действие ингалятора до ингаляции вызывает высвобождение новой дозы лекарственного средства из ее контейнера и подготовку ее для ингаляции. Примеры многодозовых ингаляторов DPI включают, но не ограничиваются ими, Diskus от GSK, Gyrohaler от Vectura и Prohaler от Valois. Во время ингаляции поток при вдохе пациента ускоряет выход порошка из устройства в полость рта. Для капсульного ингалятора состав находится в капсуле и хранится вне ингалятора. Пациент помещает капсулу в ингалятор, приводит в действие ингалятор (прокалывает капсулу), а затем вдыхает. Примеры включают Rotohaler (GlaxoSmithKline), Spinhaler (Novartis),HandiHaler (IB), TurboSpin (PHT). В случае однодозового одноразового ингалятора пациент приводит в действие ингалятор, чтобы подготовить его для ингаляции, вдыхает, затем выбрасывает ингалятор и упаковку. Примеры включают Twincer (U Groningen), OneDose (GFE) и Manta Inhaler (MantaDevices). Как правило, ингаляторы сухого порошка используют характеристики турбулентного потока пути порошка для диспергирования агрегатов наполнитель-лекарственное средство, и частицы активного ингредиента осаждаются в легких. Однако некоторые ингаляторы сухого порошка используют циклонную дисперсионную камеру для получения частиц требуемого дыхательного размера. В циклонной дисперсионной камере, лекарственное средство поступает дисперсионную камеру в форме монеты по касательной, так что воздушный поток и лекарственное средство двигаются вдоль наружной круговой стенки. Когда лекарственное средство движется вдоль наружной круговой стенки, оно отскакивает и агломераты распадаются вследствие воздействия ударных сил. Поток воздуха движется спирали по направлению к центру камеры,- 17023593 выходя по вертикали. Частицы, которые имеют достаточно небольшие аэродинамические размеры, могут следовать по потоку воздуха и покинуть камеру. В сущности, дисперсионная камера работает как небольшая струйная мельница. В зависимости от специфики состава, крупные частицы лактозы могут быть добавлены к составу для облегчения дисперсии посредством столкновения с частицами API. Однодозовый одноразовый ингалятор Twincer использует для работы циклонную дисперсионную камеру в форме монеты, называемую "воздушным классификатором". См. публикацию заявки на патент США 2006/0237010 на имя Rijksuniversiteit Groningen. В статьях, опубликованных в Университете Гронингена, сообщалось, что 60 мг доза чистого микронизированного сульфометата колистина может быть эффективно доставлена в качестве ингаляционного сухого порошка с использованием указанной технологии. В предпочтительных вариантах реализации аэрозольный состав доставляют в виде сухого порошка с использованием ингалятора сухого порошка, где частицы, испускаемые из ингалятора имеют MMAD в диапазоне от примерно 1 до приблизительно 5 мкм и GSD менее примерно 2. Примеры подходящих ингаляторов сухих порошков и порошковых дисперсионных устройств для использования для доставки соединений и композиций в соответствии с настоящим изобретением включают, но не ограничиваются ими, те, которые описаны в US 7520278; US 7322354; US 7246617; US 7231920; US 7219665; US 7207330; US 6880555; US 5522385; US 6845772; US 6637431; US 6329034; US 5458135; US 4805811; и публикацию заявки на патент США 2006/0237010. Согласно одному из вариантов реализации фармацевтический состав согласно изобретению представляет собой сухой порошок для ингаляции, полученный для доставки с помощью устройства типаDiskus. Устройство Diskus включает удлиненную полосу, образованную из подложки, имеющей множество выемок, расположенных вдоль ее длины, и покрывающий лист, присоединенный герметично,но с возможностью снятия, для разделения множества контейнеров, каждый контейнер содержит внутри ингаляционный состав, содержащий заданное количество активного ингредиента отдельно или в смеси с одним или более носителями или наполнителями (например, лактозой) и/или другими терапевтически активными агентами. Предпочтительно, полоска является достаточно гибкой, чтобы быть смотанной в рулон. Покрывающий лист и подложка предпочтительно имеют ведущие концевые части, которые не присоединены друг к другу, и по меньшей мере одна из ведущих концевых частей выполнена присоединенной к наматывающему средству. Кроме того, герметичное уплотнение между листом подложки и покрывающим листом предпочтительно проходит по всей их ширине. Для получения дозы для ингаляции покрывающий лист предпочтительно может быть очищен от подложки в продольном направлении от первого конца подложки. Согласно одному из вариантов реализации фармацевтический состав согласно изобретению представляет собой сухой порошок для ингаляции, полученный для доставки с использованием однодозового одноразового ингалятора и, в частности, ингалятора Twincer. Ингалятор Twincer содержит блистер из ламината фольги с одной или более выемками и покрывающий лист, присоединенный герметично, но с возможностью снятия, для разделения множество контейнеров. Каждый контейнер содержит ингаляционный состав, содержащий заданное количество активного ингредиента(ов) по отдельности или в смеси с одним или более носителями или наполнителями (например, лактозой). Покрывающий лист предпочтительно имеет ведущую концевую часть, выполненную выступающей из корпуса ингалятора. Пациент будет управлять устройством и тем самым вводить аэрозольный состав 1) удалив наружную упаковочную пленку, 2) потянув за вкладку фольги, чтобы раскрыть лекарственное средство в блистере и 3) вдохнув лекарственное средство из блистера. Согласно одному из вариантов реализации фармацевтический состав согласно изобретению представляет собой сухой порошок для ингаляции, в котором сухой порошок получен в виде микрочастиц,как описано в публикациях РСТ WO 2009/015286 или WO 2007/114881, обе на имя NexBio. Такие микрочастицы, как правило, получают путем добавления противоиона к раствору, содержащему соединение согласно изобретению в растворителе, добавления антирастворителя к указанному раствору, и постепенно охлаждения раствора до температуры ниже примерно 25C с образованием композиции, содержащей микрочастицы, содержащие соединение. Микрочастицы, содержащие соединение, затем можно отделить от раствора с помощью любых подходящих средств, таких как осаждение, фильтрование или лиофилизация. Подходящие противоионы, растворители и антирастворители для получения микрочастиц соединений согласно изобретению описаны в WO 2009/015286. Согласно другому варианту реализации фармацевтическую композицию согласно изобретению доставляют в виде сухого порошка с использованием дозирующего ингалятора. Неограничивающие примеры дозирующих ингаляторов и устройств включают устройства, описанные в патентах США US 5261538; US 5544647; US 5622163; US 4955371; US 3565070; US 3361306 и US 6116234 и US 7108159. В предпочтительном варианте реализации соединение согласно настоящему изобретению доставляют в виде сухого порошка с использованием дозирующего ингалятора, в котором высвобождаемые частицы имеют MMAD, которое находится в диапазоне приблизительно от 1 до примерно 5 мкм и GSD, составляющее меньше примерно 2. Жидкие аэрозольные композиции для доставки в эндобронхиальное пространство или легкое посредством ингаляции можно, например, получить в виде водных растворов или суспензий или в виде аэрозолей, извлекаемых из упаковок под давлением, таких как дозирующие ингаляторы, с использованием подходящих сжиженных пропеллентов, жидкостных (softmist) ингаляторов или небулайзеров. Такие аэрозольные композиции, подходящие для ингаляции, могут представлять собой или суспензию, или раствор и, как правило, содержат активный ингредиент(ы) вместе с фармацевтически приемлемым носителем или разбавителем (например, водой (стерильной или дистиллированной), физиологическим раствором, гипертоническоим солевым раствором или этанолом) и необязательно один или более других терапевтически активных агентов. Аэрозольные композиции для доставки с помощью дозирующих ингаляторов под давлением обычно дополнительно содержат фармацевтически приемлемый пропеллент. Примеры таких пропеллентов включают фторуглерод или водородсодержащий хлорфторуглерод или их смеси, в частности гидрофторалканы, например, дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, особенно 1,1,1,2 тетрафторэтан, 1,1,1,2,3,3,3-гептафтор-н-пропан или их смеси. В аэрозольные композиции могут не содержать наполнитель или могут необязательно содержать дополнительные наполнители, хорошо известные в данной области техники, такие как поверхностно-активные вещества, например олеиновую кислоту или лецитин, и сорастворители, например этанол. Составы под давлением обычно будут храниться в баллоне (например, в алюминиевом баллоне), закрытом клапаном (например, дозирующим клапаном) и встроенном в механизм, снабженным мундштуком. Согласно другому варианту реализации фармацевтическую композицию согласно изобретению доставляют в виде жидкости с помощью дозирующего ингалятора. Неограничивающие примеры дозирующих ингаляторов и устройств включают устройства, описанные в патентах США 6253762, 6413497,7601336, 7481995, 6743413, и 7105152. В предпочтительном варианте реализации соединение согласно настоящему изобретению доставляют в виде сухого порошка с использованием дозирующего ингалятора, в котором высвобождаемые частицы имеют MMAD, которое находится в диапазоне примерно от 1 до примерно 5 мкм и GSD, составляющее меньше примерно 2. Согласно одному из вариантов реализации аэрозольный состав подходит для распыления с помощью струйного небулайзера или ультразвукового небулайзера, включая статические и вибрационные небулайзеры с пористыми пластинами. Жидкие аэрозольные составы для распыления могут быть получены путем солюбилизации или восстановления состава твердых частиц или могут быть получены с водным носителем с добавлением агентов, таких как кислота или щелочь, буферные соли и агенты, регулирующие изотоничность. Они могут быть стерилизованы в процессе производства методами, такими как фильтрование или термическими способами, такими как нагревание в автоклаве или гамма-облучение. Они также могут быть представлены в нестерильной форме. Пациенты могут быть чувствительны к pH, осмоляльности и содержанию ионов распыленного раствора. Поэтому указанные параметры должны быть скорректированы в отношении совместимости с активным ингредиентом и переносимости пациентами. Наиболее предпочтительный раствор или суспензия активного ингредиента будет содержать концентрацию хлорида 30 мМ при pH 4,5-7,4, предпочтительно 5,0-5,5, и осмоляльность от примерно 800-1600 мОсм/кг. pH раствора можно контролировать либо титрованием с обычными кислотами (например, соляной кислотой или серной кислотой) или основаниями (например, гидроксидом натрия) или с использованием буферов. Обычно используемые буферы включают цитратные буферы, такие как буфер лимонная кислота/цитрат натрия, ацетатные буферы, такие как буфер уксусная кислота/ацетат натрия и фосфатные буферы. Буферная сила может варьироваться от 2 до 50 мМ. Подходящие ацетатные, фосфатные, цитратные буферы включают ацетат натрия, тригидрат ацетата натрия, ацетат аммония, ацетат калия, фосфат натрия, двухосновный фосфат натрия, дигидрофосфат натрия, дигидрофосфат калия, гидрофосфат калия, фосфат калия, цитрат натрия и цитрат калия. Другие буферы, которые могут быть использованы, включают гидроксид натрия, гидроксид калия, гидроксид аммония, аминометилпропанол, трометамин, тетрагидроксипропилэтилендиамин, лимонную кислоту,уксусную кислоту, гидрокситрикарбоновую кислоту или ее соль, например, цитрат или соль цитрат натрия, молочную кислоту и соли молочной кислоты, включая лактат натрия, лактат калия, лактат лития,лактат кальция, лактат магния, бария, лактат алюминия, лактат цинка, лактат серебра, лактат меди, лактат железа, лактат марганца, лактат аммония, моноэтаноламин, диэтаноламин, триэтаноламин, диизопропаноламин, а также их комбинации, и тому подобное. Такие составы можно вводить с использованием коммерчески доступных небулайзеров или других распылителей, которые могут разбить состав на частицы или капли, подходящие для осаждения в дыхательных путях. Неограничивающие примеры небулайзеров, которые могут быть использованы для аэрозольной доставки композиции согласно изобретению, включают пневматические струйные небулайзеры,вентилируемые или усиленные дыханием струйные небулайзеры, или ультразвуковые небулайзеры,включая статические или вибрирующие небулайзеры с пористыми пластинами. Коммерчески доступные небулайзеры включают небулайзер Aeroneb Go (Aerogen) и небулайзер eFlow (Pari Pharma). Струйный небулайзер использует высокоскоростной потока воздуха, высвобождающийся вверх че- 19023593 рез колонку с водой с получением капель. Частицы, неподходящие для ингаляции, оседают на стенках или аэродинамических перегородках. Вентилируемый или усиленный дыханием небулайзер работает по существу таким же образом, как струйный небулайзер, за исключением того, что вдыхаемый воздух проходит через область генерации основной капли для увеличения скорости выходного потока небулайзера во время вдоха пациента. В ультразвуковом небулайзере вибрация пьезоэлектрического кристалла создает поверхностные возмущения в резервуаре лекарственного средства, которые вызывают образование каплей. В небулайзерах с пористой пластиной поля давления, генерируемые звуковой энергией проталкивает жидкость через сетку пор, где она распадается на капли по распаду Рэлея. Звуковая энергия может обеспечиваться вибрирующим горном или пластиной, приводимой в действие пьезоэлектрическим кристаллом, или за счет вибрации самой сетки. Неограничивающие примеры распылителей включают любой единичный или двойной распылитель жидкости или сопло, которое производит капельки соответствующего размера. Единичный распылитель жидкости работает за счет проталкивания жидкости через одно или более отверстий, где струя жидкости распадается на капли. Двойной распылитель жидкости работает либо за счет проталкивания газа и жидкости через одно или более отверстий, либо столкновения струи жидкости и другой струи как жидкости, так и газа. Выбор небулайзера, распыляющего аэрозольный состав, имеет большое значение для введения активного ингредиента(ов). Различные небулайзеры имеют различную эффективность в зависимости от конструкции и принципа действия и чувствительны к физическим и химическим свойствам состава. Например, два состава с различными поверхностными напряжениями могут иметь различные распределения частиц по размерам. Кроме того, свойства состава, такие как pH, осмоляльность и количество проникающих ионов может повлиять на переносимость лекарственного средства, так что предпочтительные варианты реализации соответствуют определенным значениям указанных свойств. В предпочтительном варианте реализации состав для распыления доставляют в эндобронхиальное пространство в виде аэрозоля, имеющего MMAD от примерно 1 до примерно 5 мкм и GSD менее 2 с использованием соответствующего небулайзера. Чтобы обеспечить оптимальную эффективность и избежать побочных эффектов в верхних дыхательных путях и системных побочных эффектов, аэрозоль не должен иметь MMAD более примерно 5 мкм и не должен иметь GSD больше примерно 2. Если аэрозоль имеет MMAD более примерно 5 мкм или GSD более примерно 2, большая часть дозы может осадиться в верхних дыхательных путях, уменьшая количество лекарственного средства, поступившего в требуемое место в нижних дыхательных путях. Если MMAD аэрозоля меньше, чем примерно 1 мкм, то большое количество частиц может остаться в суспендированном состоянии во вдыхаемом воздухе и затем может быть выдохнуто при выдохе. Соединения по изобретению также можно вводить путем трансбронхоскопического лаважа. Составы, подходящие для перорального введения, могут быть в виде дискретных единиц, таких как капсулы, саше или таблетки, каждая из которых содержит заданное количество активного ингредиента; в виде порошка или гранул; в виде раствора или суспензии в водной жидкости или неводной жидкости; или в виде жидкой эмульсии масло-в-воде или жидкой эмульсии вода-в-масле. Активный ингредиент может также быть в виде саше, болюса, лекарственной кашки или пасты. Таблетка может быть изготовлена прессованием или формованием, необязательно с одним или более вспомогательными ингредиентами. Прессованные таблетки могут быть получены прессованием в соответствующей машине активного ингредиента в свободно-текучей форме, такой как порошок или гранулы, необязательно смешанного со связующими, смазывающим веществом, инертным разбавителем,поверхностно-активным или диспергирующим агентом. Формованные таблетки могут быть изготовлены формованием в соответствующей машине смеси порошкообразного соединения, увлажненного инертным жидким разбавителем. Таблетки могут быть покрыты или на них могут быть нанесены бороздки, и могут быть получены с обеспечением замедленного или контролируемого высвобождения активного ингредиента. Составы для местного применения на полости рта, например для трансбуккального или подъязычного введения, включают таблетки для рассасывания, содержащие активный ингредиент в ароматизированной основе, такой как сахароза и гуммиарабик или трагакант, и пастилки, содержащие активный ингредиент в основе, такой как желатин и глицерин или сахароза и акация. Составы для парентерального введения включают водные и неводные стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостатические вещества и растворенные вещества, которые делают этот состав изотоническим с кровью предполагаемого реципиента, и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты и загустители. Составы могут быть в однодозовом или в многодозовых контейнерах, например в герметичных ампулах и виалах, и могут храниться в высушенном замораживанием (лиофилизированном) состоянии,требующем только добавления стерильного жидкого носителя, например физиологического раствора или воды для инъекций непосредственно перед использованием. Инъекционные растворы и суспензии, приготовленные для немедленного прима, могут быть получены из стерильных порошков, гранул и таблеток описанного ранее вида. Пероральные жидкости, такие как растворы, сиропы и эликсиры могут быть получены в форме единичной дозы, так чтобы заданное количество содержало заданное количество активного ингредиента. Сиропы могут быть получены растворением активного ингредиента в ароматизированном соответствующем водном растворе, тогда как эликсиры получают с использованием фармацевтически приемлемого спиртового носителя. Суспензии могут быть получены путем диспергирования активного ингредиента в фармацевтически приемлемом носителе. Солюбилизаторы и эмульгаторы, такие как этоксилированные изостеариловые спирты и эфиры полиоксиэтиленсорбита, консерванты, вкусовые добавки, такие как масло мяты перечной или натуральные подсластители или сахарин, или другие искусственные подсластители и т.п. также могут быть включены в пероральные жидкие композиции. Системы доставки липосом, такие как небольшие однослойные везикулы, большие однослойные везикулы и многослойные везикулы могут быть также использованы в качестве средства доставки для соединений согласно изобретению. Липосомы могут быть образованы из различных фосфолипидов, таких как холестерин, стеариламин и фосфатидилхолины. Фармацевтические композиции для местного применения могут быть получены в виде мазей, кремов,суспензий, лосьонов, порошков, растворов, паст, гелей, спреев, аэрозолей или масел. Композиции, предназначенные для лечения глаз или других внешних тканей, например рта и кожи, могут быть нанесены в виде местной мази или крема. При получении в виде мази, активный ингредиент может быть использован с парафиновой или смешивающейся с водой мазевой основой. Альтернативно, активный ингредиент может быть получен в виде крема с кремовой основой масло-в-воде или основой типа вода-в-масле. Другие композиции, предназначенные для местного введения в глаза или уши, включают глазные капли и ушные капли, в которых активный ингредиент растворен или суспендирован в подходящем носителе, таком как, например, водный растворитель, в том числе физиологический раствор. Композиции, предназначенные для назального введения, включают аэрозоли, растворы, суспензии,спреи, аэрозоли и капли. Аэрозольные составы для назального введения могут быть получены во многом таким же образом, как и аэрозольные составы для ингаляции с условием, что частицы невдыхаемого размера будут предпочтительным в составах для назального введения. Как правило, можно использовать частицы размером от примерно 5 мкм вплоть до размера видимых капель. Таким образом, для назального введения можно использовать размер частиц в диапазоне 10-500 мкм с обеспечением удержания в носовой полости. Также можно использовать трансдермальные пластыри, которые выполнены с возможностью поддержания в контакте с эпидермисом пациента в течение длительного периода времени и стимулирования через него поглощения активного ингредиента. Композиции для вагинального или ректального введения включают мази, кремы, суппозитории и клизмы, все из которых могут быть получены с использованием традиционных методов. В другом аспекте в изобретении предложен способ стимулирования гидратации поверхностей слизистых оболочек или восстановления защитного барьера слизистой оболочки у человека, нуждающегося в этом, включающий введение указанному человеку фармацевтической композиции, содержащий соединение согласно изобретению, где указанное соединение вводят в эффективном количестве. Согласно одному из предпочтительных вариантов реализации указанный способ включает введение фармацевтической композиции в виде ингалируемой композиции, содержащей количество соединения согласно изобретению, достаточное для достижения растворенной концентрации соединения на поверхностях дыхательных путей от примерно 10-9, 10-8 или 10-7 до примерно 10-4,10-3, 10-2 или 10-1 моль/л, более предпочтительно от примерно 10-9 до примерно 10-4 моль/л. В другом аспекте в изобретении предложен способ лечения любого заболевания, связанного с обратимой или необратимой обструкцией дыхательных путей, хронической обструктивной болезни легких(ХОБЛ), астмы, бронхоэктаза (включая бронхоэктазы, вызванные состояниями, отличными от кистозного фиброза), острого бронхита, хронического бронхита, поствирусного кашля, кистозного фиброза, эмфиземы, пневмонии, панбронхиолита, бронхиолита, связанного с трансплантатом, и ИВЛ-связанного трахеобронхита, или предотвращения ИВЛ-связанной пневмонии у человека, нуждающегося в этом,включающий введение указанному человеку фармацевтической композиции, содержащий соединение согласно изобретению, где указанное соединение вводят в эффективном количестве. Согласно одному из предпочтительных вариантов реализации указанный способ включает введение фармацевтической композиции в виде ингалируемой композиции, содержащей количество соединения согласно изобретению,достаточное для достижения растворенной концентрации соединения на поверхностях дыхательных путей от примерно 10-9, 10-8 или 10-7 до примерно 10-4, 10-3, 10-2 или 10-1 моль/л, более предпочтительно от примерно 10-9 до примерно 10-4 моль/л. В другом аспекте в изобретении предложен способ лечения любого из сухости во рту (ксеростомии), сухости кожи, вагинальной сухости, синусита, риносинусита или носового обезвоживания, в том числе носового обезвоживания, вызванного введением сухого кислорода, сухости глаз или болезни Шегрена, стимулирования гидратации глаз или роговицы, лечения синдрома дистальной интестинальной обструкции, лечения среднего отита, первичной цилиарной дискинезии, синдрома дистальной интестинальной обструкции, эзофагита, запора или хронического дивертикулита у человека, нуждающегося в этом, включающий введение указанному человеку фармацевтической композиции, содержащий соединение согласно изобретению, где указанное соединение вводят в эффективном количестве. Предпочтительные единичные лекарственные формы для соединений согласно изобретению представляют собой формы, содержащие эффективное количество активного ингредиента или его соответствующую фракцию. Следует понимать, что в дополнение к ингредиентам, в частности, упомянутым выше, композиции согласно настоящему изобретению могут включать другие агенты, традиционные в данной области техники, имеющие отношение к типу рассматриваемой композиции, например, композиции подходящие для перорального введения могут включать вкусовые агенты. Композиции согласно настоящему изобретению могут быть получены для немедленного, контролируемого или замедленного высвобождения, как необходимо для конкретного состояния, подлежащего лечению, и требуемого способа введения. Например, состав с контролируемым высвобождением для перорального введения может быть желательным для лечения запора, чтобы максимизировать доставку активного агента к толстой кишке. Такие препараты и подходящие наполнители хорошо известны в области фармации. Поскольку свободное основание соединения, в целом, менее растворимо в водных растворах, чем соль, можно использовать композиции, содержащие свободное основание соединения формулы I, для обеспечения более длительного высвобождения активного агента путем ингаляции в легкие. Активный агент, присутствующий в легких в виде частиц, не растворяющихся в растворе, не доступен для обеспечения физиологического ответа, но служит в качестве депо для биодоступного лекарственного средства, которое постепенно растворяется в растворе. В качестве другого примера, в составе можно использовать как свободное основание, так и солевую форму соединения согласно изобретению для обеспечения как немедленного высвобождения, так и замедленного высвобождения активного ингредиента для растворения в слизистых выделениях, например в носу. Комбинации Соединения согласно изобретению могут быть объединены в процессе получения лекарственной формы и/или использоваться в комбинации с другими терапевтически активными агентами. Примеры других терапевтически активных агентов, которые могут быть объединены в процессе получения лекарственной формы или использованы в комбинации с соединениями настоящего изобретения, включают,но не ограничиваются ими, осмолиты, противовоспалительные агенты, антихолинергические агенты, агонисты (в том числе селективные 2-агонисты), агонисты рецепторов P2Y2, дельта агонисты рецепторов, активируемых пролифератором пероксисом (PPAR), другие эпителиальные блокаторы натриевых каналов (блокаторы рецепторов ENaC), модуляторы муковисцидозного трансмембранного регулятора проводимости (CFTR), ингибиторы киназы, противоинфекционные агенты, антигистаминные средства,неантибиотические противовоспалительные макролиды, эластазы и ингибиторы протеазы, и слизь или муцин модифицирующие агенты, такие как поверхностно-активные вещества. Кроме того, для сердечнососудистых показаний, соединения согласно изобретению могут быть использованы в комбинации с бета-блокаторами, ингибиторами АСЕ, ингибиторами HMGCoA-редуктазы, блокаторами кальциевых каналов и других сердечно-сосудистых агентов. Таким образом, в другом аспекте в настоящем изобретении предложены композиции, содержащие эффективное количество соединения согласно изобретению и один или более других терапевтически активных агентов, выбранных из осмолитов, противовоспалительных агентов, антихолинергических агентов, -агонистов (в том числе селективных 2-агонисты), агонистов рецепторов P2Y2, дельта агонистов PPAR, блокаторов рецепторов ENaC, модуляторов муковисцидозного трансмембранного регулятора проводимости (CFTR), ингибиторов киназы, противоинфекционных агентов, антигистаминных средств,неантибиотических противовоспалительных макролидов, эластаз и ингибиторов протеазы, и слизь или муцин модифицирующих агентов, такие как поверхностно-активные вещества. Таким образом, в другом аспекте в настоящем изобретении предложены композиции, содержащие эффективное количество соединения согласно изобретению и один или более других терапевтически активных агентов, выбранных из бета-блокаторов, ингибиторов АСЕ, ингибиторов HMGCoA-редуктазы и блокаторов кальциевых каналов Применение соединений согласно изобретению в комбинации с одним или более другими терапевтически активными агентами (в частности, осмолитами) может снизить дозу соединения согласно изобретению, необходимого для достаточной гидратации поверхности слизистых оболочек, тем самым уменьшая возможность появления нежелательных побочных эффектов, связанных с системным блокированием натриевых каналов, таких как, например, в почках."Осмолиты" в соответствии с настоящим изобретением представляют собой молекулы или соединения, которые являются осмотически активными. "Осмотически активные" молекулы и соединения являются мембрано непроницаемыми (т.е., по существу, не абсорбирумыми) на дыхательных путях или поверхности эпителия легкого. В настоящем описании термины "поверхность дыхательных путей" и"поверхность легкого" включают легочные поверхности дыхательных путей, таких как бронхи и бронхиолы, альвеолярные поверхности и назальные поверхности и поверхностей пазухи. Подходящие осмолиты включают ионные осмолиты (т.е. соли), и неионные осмолиты (т.е. сахара, сахарные спирты и ор- 22023593 ганические осмолиты). В целом, осмолиты (как ионные и неионные), используемые в комбинации с соединениями согласно изобретению представляют собой предпочтительно осмолиты, которые не способствуют, или, по существу, сдерживают или замедляют рост бактерий. Осмолиты, подходящие для использования в настоящем изобретении, могут быть в рацемической форме или в форме энантиомера,диастереомера, таутомера, полиморфа или псевдополиморфа. Примеры ионных осмолитов, подходящих для настоящего изобретения, включают любую соль фармацевтически приемлемого аниона и фармацевтически приемлемого катиона. Предпочтительно, либо(или оба) анион и катион являются осмотически активными и не подвержены быстрому активному транспорту, по отношению к поверхности дыхательных путей, на которые их вводят. Такие соединения включают, но не ограничиваются ими, анионы и катионы, которые содержатся в утвержденных FDA коммерчески продаваемых солях; см., например, Remington: The Science и Practice of Pharmacy, Vol. II,pg. 1457 (19th Ed. 1995), и могут быть использованы в любой комбинации, как известно в данной области техники. Конкретные примеры фармацевтически приемлемых осмотически активных анионов включают, но не ограничиваются ими, ацетат, бензолсульфонат, бензоат, бикарбонат, битартрат, бромид, кальций эдетат, камсилат (камфорсульфонат), карбонат, хлорид, цитрат, дигидрохлорид, эдетат, эдизилат (1,2 этандисульфонат), эстолат (лаурилсульфат), эзилат (1,2-этандисульфонат), фумарат, глюцептат, глюконат, глутамат, гликоллиларсанилат (п-гликолламидофениларсонат), гексилрезорцинат, гидрабамин (N,N'ди(дегидроабиетил)этилендиамин), гидробромид, гидрохлорид, гидроксинафтоат, йодид, изетионат, лактат, лактобионат, малат, малеат, манделат, мезилат, метилбромид, метилнитрат, метилсульфат, мукат,напсилат, нитрат, нитрит, памоат (эмбонат), пантотенат, фосфат или дифосфат, полигалактуронат, салицилат, стеарат, субацетат, сукцинат, сульфат, таннат, тартрат, теоклат (8-хлортеофиллинат), триэтиодид,бикарбонат и т.д. Предпочтительные анионы включают хлорид, сульфат, нитрат, глюконат, йодид, бромид, бикарбонат и фосфат. Конкретные примеры фармацевтически приемлемых осмотически активных катионов включают, но не ограничиваются ими, органические катионы, такие как бензатин (N,N'-дибензилэтилендиамин), хлорпрокаин, холин, диэтаноламин, этилендиамин, меглумин (N-метил-D-глюкамин), прокаин, D-лизин, Lлизин, D-аргинин, L-аргинин, триэтиламмоний, N-метил-D глицерин и тому подобное, и катионы металлов, таких как алюминий, кальций, литий, магний, калий, натрий, цинк, железо, аммония и тому подобное. Предпочтительные органические катионы включают 3-углеродные, 4-углеродные, 5-углеродные и 6 углеродные органические катионы. Предпочтительные катионы включают натрий, калий, литий, холин,меглумин, D-лизин, аммоний, магний и кальций. Конкретные примеры ионных осмолитов, которые могут быть использованы в комбинации с соединением согласно изобретению, включают, но не ограничиваются ими, хлорид натрия (в частности, гипертонический раствор), хлорид калия, хлорид холина, холин йодида, хлорид лития, хлорид меглумина,хлорид L-лизина, хлорид D-лизина, хлорид аммония, сульфат калия, нитрат калия, глюконат калия, йодид калия, хлорид железа (II), хлорид железа (III), бромид калия и комбинации любых двух или более из указанных выше. В одном варианте реализации настоящее изобретение относится к комбинации соединения согласно изобретению и двух различных осмотически активных солей. Когда используются различные соли, один из аниона или катиона могут быть одинаковыми среди различных солей. Гипертонический солевой раствора является предпочтительным ионным осмолитом для использования в комбинации с соединениями согласно настоящему изобретению. Неионные осмолиты включают сахара, сахарные спирты и органические осмолиты. Сахара и сахарные спирты, подходящие в качестве осмолитов для настоящего изобретения, включают, но не ограничиваются ими, 3-углеродные сахара (например, глицерин, дигидроксиацетон); 4-углеродные сахара (например, D и L и формы эритрозы, треозы, эритрулозы); 5-углеродные сахара (например, D и L формы рибозы, арабинозы, ксилозы, ликсозы, псикозы, фруктозы, сорбозы и тагатозы), а также 6-углеродные сахара (например, D и L формы альтозы, аллозы, глюкозы, маннозы, гулозы, идозы, галактозы и талозы иD и L формы аллогептулозы, аллогепулозы, глюкогептулозы, манногептулозы, гулогептулозы, идогептулозы, галактогептулозы, талогептулозы). Дополнительные сахара, используемые для осуществления настоящего изобретения, включают раффинозу, олигосахариды раффинозы и стахиозы. Обе D и L формы восстановленной формы каждого сахара/сахарного спирта, также подходят для осуществления настоящего изобретения. Например, глюкоза при восстановлении становится сорбитом; осмолитом в рамках настоящего изобретения. Соответственно, сорбит и другие восстановленные формы сахара/сахарных спиртов (например, маннит, дульцит, арабит) являются подходящими осмолитами для использования в настоящем изобретении. Маннит является предпочтительным неионным осмолитом для использования в комбинации с соединениями согласно настоящему изобретению. Термин "органические осмолиты", как правило, используется для обозначения молекул, которые контролируют внутриклеточное осмотическое давление в почках. См., например, J.S. Handler et al.,Comp. Biochem. Physiol, 117, 301-306 (1997); M. Burg, Am. J. Physiol., 268, F983-F996 (1995). Органические осмолиты включают, но не ограничиваются ими, три основных класса соединений: полиолы (многоатомные спирты), метиламины и аминокислоты. Подходящие органические полиольные осмолиты включают, но не ограничиваются ими, инозит, мио-инозит и сорбит. Подходящие органические метиламинные осмолиты включают, но не ограничиваются ими, холин, бетаин, карнитин (L-, D- и DL формы),фосфорилхолин, лизо-фосфорилхолин, глицерофосфорилхолин, креатин и фосфат креатина. Подходящие аминокислотные органические осмолиты включают, но не ограничиваются ими, D- и L-формы глицина,аланина, глутамина, глутамата, аспартата, пролина и таурина. Дополнительные органические осмолиты,подходящие для использования в настоящем изобретении, включают тигулозу (tihulose) и саркозин. Предпочтительны органические осмолиты для млекопитающих, наиболее предпочтительны органическими осмолиты человека. Тем не менее, некоторые органические осмолиты бактериального, дрожжевого и морского животного происхождения, и указанные соединения также могут быть использованы в настоящем изобретении. Предшественники осмолитов могут быть использованы в комбинации с соединениями согласно изобретению. В настоящем описании "предшественник осмолита" относится к соединению, которое преобразуется в осмолит на стадии метаболизма, либо катаболизма или анаболизма. Примеры предшественников осмолитов включают, но не ограничиваются ими, глюкозу, полимеры глюкозы, глицерин, холин,фосфатидилхолин, лизофосфатидилхолин и неорганические фосфаты, которые включают предшественники полиолов и метиламинов. Предшественники аминокислотных осмолитов включают белки, пептиды и полиаминокислоты, которые гидролизуются с получением осмолита аминокислоты, и метаболические предшественники, которые могут быть преобразованы в осмолитические аминокислоты на стадии метаболизма, таких как трансаминирование. Например, предшественник аминокислоты глутамина представляет собой поли-L-глутамин, и предшественником глутамата является поли-L-глутаминовая кислота. Также могут быть использованы химически модифицированные осмолиты или предшественники осмолитов. Такие химические модификации включают соединение осмолита (или предшественника) с дополнительной химической группой, которая изменяет или усиливает эффект осмолита или предшественника осмолитов (например, ингибирует деградацию молекулы осмолита). Такие химические модификации были использованы с лекарственными средствами или пролекарствами, и известны в данной области техники. (См. например, патент США 4479932 и 4540564; Shek E. et al., J. Med. Chem. 19:113117 (1976); Bodor N. et al., J. Pharm. Sci. 67:1045-1050 (1978); Bodor N. et al., J. Med. Chem. 26:313-318(1983); Bodor N. et al., J. Pharm. Sci. 75:29-35 (1986). Предпочтительные осмолиты для применения в комбинации с соединениями согласно изобретению включают хлорид натрия, особенно гипертонический солевой раствор и маннит. Для получения 7% и 7% гипертонического раствора, могут особенно подходить составы, содержащие анионы бикарбоната, особенно для дыхательных нарушений с дисфункцией муковисцидозного трансмембранного регулятора проводимости (CFTR), таких как CF или ХОБЛ. Последние данные показывают, что, хотя относительное соотношение проводимости HCO3-/проводимости Cl- составляет от 0,1 до 0,2 для одиночных каналов CFTR, активированных цАМФ и АТФ, соотношение в потовом ходе может варьироваться от 0 до практически почти 1,0, в зависимости от условий стимуляции. Т.е. комбинирование цАМФ + цГМФ + -кетоглютарата может привести к HCO3- проводимости CFTR, почти равнойCl- проводимости (Quiton et al. Physiology, Vol. 22, No. 3, 212-225, June 2007). Кроме того, составы 7% и 7% гипертонического раствора солевого раствора, содержащего бикарбонатные анионы, могут особенно подходить вследствие лучшего контроля pH в поверхностной жидкости дыхательных путей. Вопервых, было показано, что подкисление дыхательных путей происходит при CF (Tate и соавт. 2002) и что отсутствующая CFTR-зависимая секреция бикарбонатов может привести к нарушению способности реагировать на состояния дыхательных путей, связанные с подкислением жидкого слоя поверхности дыхательных путей (Coakley et al. 2003). Во-вторых, добавление HS раствора без бикарбоната на поверхности легких может дополнительно разбавить концентрацию бикарбоната и потенциально уменьшить pH или способность реагировать на подкисление дыхательных путей в жидком слое поверхности дыхательных путей. Поэтому добавление бикарбонатных анионов в HS может способствовать сохранению или улучшению pH жидкого слоя поверхности дыхательных путей у пациентов с CF. В связи с указанными данными включение бикарбонатного аниона в состав 7% или 7% гипертонического солевого раствора, вводимого с помощью способа согласно данному изобретению, будет особенно полезным. Составы, содержащие 30-200 мМ концентрации бикарбонатных анионов представляют особый интерес для 7% или 7% HS растворов. Полагают, что гипертонический солевой раствор содержит соль концентрации большей, чем у нормального физиологического раствора (NS), т.е. больше чем 9 г/л или 0,9% мас./об., и гипотонический солевой раствор содержит соль концентрации меньшей, что нормального физиологического раствора,например, от примерно 1 г или л/0,1% мас./об. до примерно 8 г/л или 0,8% мас./об. Гипертонические солевые растворы, подходящие для составов и способов лечения, предложенных в настоящем изобретении,могут иметь концентрацию соли от примерно 1 до примерно 23,4% (мас./об.). Согласно одному из вариантов реализации указанный гипертонический солевой раствор имеет концентрацию соли от примерно 60 г/л (6% мас./об.) до примерно 100 г/л (10% мас./об.). Согласно другому варианту реализации указанный солевой раствор имеет концентрацию соли от примерно 70 г/л (7% мас./об.) до примерно 100 г/л(10% мас./об.). Согласно дополнительным вариантам реализации указанный солевой раствор имеет кон- 24023593 центрации соли а) от примерно 0,5 г/л (0,05% мас./об.) до примерно 70 г/л (7% мас./об.); b) от примерно 1 г/л (0,1% мас./об.) до примерно 60 г/л (6% мас./об.); с) от примерно 1 г/л (0,1% мас./об.) до примерно 50 г/л (5% мас./об.); d) от примерно 1 г/л (0,1% мас./об.) до примерно 40 г/л (4% мас./об.); е) от примерно 1 г/л (0,1% мас./об.) до примерно 30 г/л (3% мас./об.); и f) от примерно 1 г/л (0,1% мас./об.) до примерно 20 г/л (2% мас./об.). Конкретные концентрации солевых растворов, подходящих для составов и способов лечения, предложенных в настоящем изобретении, включают, независимо, растворов концентрациями солей 1 г/л(7% мас./об.), 80 г/л (8% мас./об.), 90 г/л (9% мас./об.), 100 г/л (10% мас./об.), 110 г/л (11% мас./об.), 120 г/л (12% мас./об.), 130 г/л (13% мас./об.), 140 г/л (14% мас./об.), 150 г/л (15% мас./об.), 160 г/л (16% мас./об.), 170 г/л (17% мас./об.), 180 г/л (18% мас./об.), 190 г/л (19% мас./об.), 200 г/л (20% мас./об.), 210 г/л (21% мас./об.), 220 г/л (22% мас./об.), и 230 г/л (23% мас./об.). Также можно использовать концентрации солевых растворов между каждой из указанных перечисленных концентраций/процентов, например,солевой раствор 1,7 г/л (0,17% мас./об.), 1,25 г/л (1,25% мас./об.), 1,5 г/л (1,5% мас./об.), 25 г/л (2,5% мас./об.), 28 г/л (2,8% мас./об.), 35 г/л (3,5% мас./об.), 45 г/л (4,5% мас./об.), и 75 г/л (7,5% мас./об.). Конкретные подходящие концентрации гипотонических солевых растворов включают растворы от примерно 0,12 г/л (0,012% мас./об.) до примерно 8,5 г/л (0,85% мас./об.). Могут быть использованы любые концентрации в пределах указанного диапазона, например, основе мас./об., 0,05, 0,1, 0,15, 0,2, 0,225 (1/4NS), 0,25, 0,3 (1/3 NS), 0,35, 0,4, 0,45 (1/2 NS), 0,5, 0,55, 0,6 (2/3 NS), 0,65, 0,675 (3/4 NS), 0,7, 0,75 и 0,8%. Каждый из диапазонов и конкретных концентраций солевых растворов, описанных в настоящем документе, можно использовать в составах, способах лечения, режимах и наборах, описанных в настоящем документе. Также включены в объем настоящего изобретения химически модифицированные осмолиты или предшественники осмолитов. Такие химические модификации включают связывание осмолита (или предшественника) с дополнительной химической группой, которая изменяет или усиливает действие осмолита или предшественника осмолита (например, ингибирует деградацию молекулы осмолита). Такие химические модификации были использованы с лекарственными средствами или пролекарствами и известны в данной области техники. (См., например, патенты США.4479932 и 4540564; Shek E. etMed. Chem. 26:313-318 (1983); Bodor N. et al., J. Pharm. Sci. 75:29-35 (1986), каждый из которых включен в настоящее описание посредством ссылки. Подходящие противовоспалительные агенты для использования в комбинации с соединениями согласно изобретению включают кортикостероиды и нестероидные противовоспалительные препараты(НПВП), в частности ингибиторы фосфодиэстеразы (PDE). Примеры кортикостероидов для использования в настоящем изобретении включают пероральные или ингаляционные кортикостероиды или пролекарства. Конкретные примеры включают, но не ограничиваются ими, циклезонид, десизобутирилциклесонид, будезонид, флунизолид, мометазон и сложные эфиры (например, фуроат мометазона), пропионат флутиказона, фуроат флутиказона, беклометазон, метилпреднизолон, преднизолон, дексаметазон,S-фторметиловый эфир 6,9-дифтор-17-[(2-фуранилкарбонил)окси]-11-гидрокси-16-метил-3-оксоандроста-1,4-диен-17-карботиокислоты, S-(2-оксотетрагидрофуран-3S-ил) эфир 6,9-дифтор-11 гидрокси-16-метил-3-оксо-17-пропионилоксиандроста-1,4-диен-17-карботиокислоты, сложные эфиры беклометазона (например, 17-пропионатные эфиров или 17,21-дипропионатные эфиры, фторметильные сложные эфиры, ацетонид триамцинолона, рофлепонид или любую комбинацию или подгруппу указанных веществ. Предпочтительные кортикостероиды для композиции или применения в комбинации с соединениями согласно изобретению выбраны из циклесонида, десизобутирилциклесонида, будесонида,мометазона, пропионата флутиказона, фуроата флутиказона или любой их комбинации или подгруппы. НПВП для использования в настоящем изобретении включают, но не ограничиваются ими, кромогликат натрия, недокромил натрия, ингибиторы фосфодиэстеразы (PDE) (например, теофиллин, аминофиллин, ингибиторы PDE4, смешанные ингибиторы PDE3/PDE4 или смешанные ингибиторыPDE4/PDE7), антагонисты лейкотриенов, ингибиторы синтеза лейкотриена (например, 5 LO и ингибиторы FLAP), ингибиторы индуцибельной NO-синтетазы (INOS), ингибиторы протеаз (например, ингибиторы триптазы, ингибиторы эластазы нейтрофилов и ингибиторы металлопротеаз) антагонисты 2 интегрина и агонисты антагонисты рецептора аденозина (например, агонисты аденозина 2 а), антагонисты цитокинов (например, антагонисты хемокинов) или ингибиторы синтеза цитокинов (например, простагландин антагонисты рецепторов D2 (CRTH2. Примеры антагонистов лейкотриенов, подходящих для введения с помощью способа согласно изобретению, включают монтелукаст, зилеутон и зафирлукаст. Ингибитор PDE4, смешанный ингибитор PDE3/PDE4 или смешанный ингибитор PDE4/PDE7 может представлять собой любое соединение, ингибирующее фермент PDE4 или у которого обнаружено действие в качестве ингибитора PDE4, и которые являются селективным ингибитором PDE4 (например, со- 25023593 единения, которые существенно не ингибируют других представителей семейства PDE). Примеры конкретных ингибиторов PDE4 для составов и для применения в комбинации с соединениями согласно настоящему изобретению включают, но не ограничиваются ими, рофлумиласт, пумафентрин, арофиллин,циломиласт, тофимиласт, оглемиласт, толафентрин, пикламиласт, ибудиласт, апремиласт, 2-[4-[6,7 диэтокси-2,3-бис(гидроксиметил)-1-нафталенил]-2-пиридинил]-4-(3-пиридинил)-1(2 Н)-фталазинон(NCS-613),N-(2,5-дихлор-3 пиридинил)-8-метокси-5-хинолинкарбоксамид (D-4418), N-[(3R)-9-амино-3,4,6,7-тетрагидро-4-оксо-1 фенилпирроло[3,2,1-][1,4]бензодиазепин-3-ил]-3H-пурин-6-амин (PD-168787), 3-3-(циклопентилокси)4-метоксифенил]метил]-N-этил-8-(1-метилэтил)-3H-пурин-6-амин гидрохлорид (V-11294A), N-(3,5 дихлор-1-оксидо-4-пиридинил)-8-метокси-2-(трифторметил)-5-хинолинкарбоксамид (Sch351591), 5-[3(циклопентилокси)-4-метоксифенил]-3-[(3-метилфенил)метил]-(3S,5S)-2-пиперидинон (НТ-0712), 5-(21R,4R)-4-амино-1-(3-(циклопентилокси)-4-метоксифенил)циклогексил)этинил)-пиримидин-2-амин,цис-[4-циано-4-(3-циклопропилметокси-4-дифторметоксифенил)циклогексан-1-ол], и 4-[6,7-диэтокси 2,3-бис(гидроксиметил)-1-нафталенил]-1-(2-метоксиэтил)-2(1H)-пиридинон (Т-440), и любую их комбинацию или подгруппу. Антагонисты лейкотриенов и ингибиторы синтеза лейкотриенов включают зафирлукаст, монтелукаст натрия, зилеутон и пранлукаст. Антихолинергические агенты для состава или применения в комбинации с соединениями согласно изобретению включают, но не ограничиваются ими, антагонисты мускариновых рецепторов, в частности панантагонисты и антагонисты рецепторов М 3. Примеры соединений включают алкалоиды растений белладонны, такие как атропин, скополамин, гоматропин, гиосциамин, а также их различные формы,включая соли (например, безводный атропин, сульфат атропина, оксид атропина или HCl атропина, нитрат метилатропина, гидробромид гоматропина, бромистый метил гоматропина, гидробромид гиосциамина, сульфат гиосциамина, гидробромид скополамина, бромистый метил скополамина), или любую их комбинацию или подгруппу. Дополнительные антихолинергические средства для состава и применения в комбинации с соединениями согласно изобретению включают метантелин, бромид пропантелина, анизотропинметилбромид или Valpin 50, аклидиниум бромид, гликопирролат (Robinul), изопропамид йодид, мепензолата бромид,хлорид тридигексетила, метилсульфат гексоциклиума, HCl циклопентолата, тропикамид, CCl тригексифенидила, пирензепин, телензепин и метоктрамин или любую их комбинацию или подгруппу. Предпочтительные антихолинергические средства для состава и применения в комбинации с соединениями согласно изобретению включают ипратропий (бромид), окситропиум (бромид) и тиотропий(бромид) или любую их комбинацию или подгруппу. Примеры -агонистов для объединения в процессе получения лекарственной формы и применения в комбинации с соединениями согласно изобретению включают, но не ограничиваются ими, сальметерол, R-сальметерол и его ксинафоатные соли, альбутерол или R-альбутерол (свободное основание или сульфат), левосальбутамол, сальбутамол, формотерол (фумарат), фенотерол, прокатерол, пирбутерол,метапротеренол, тербуталин и их соли, а также любую их комбинацию или подгруппу. Агонисты рецепторов P2Y2 для объединения в процессе получения лекарственной формы и применения в комбинации с соединениями согласно изобретению могут быть использованы в количестве, эффективном для стимулирования секреции хлоридов и воды на поверхности дыхательных путей, в частности назальных поверхностях дыхательных путей. Подходящие агонисты рецепторов P2Y2 известны в данной области техники и описаны, например, в колонках 9-10 патента США 6264975, а также в патентах США 5656256 и 5292498. Агонисты P2Y2, которые могут быть введены с помощью способов согласно изобретению, включают агонисты рецепторов P2Y2, такие как ATP, UTP, UTP-.гамма.-S и динуклеотидные агонисты рецепторов P2Y2 (например, денуфосол или диквафосол) или его фармацевтически приемлемую соль. Агонист рецептора P2Y2, как правило, содержится в количестве, эффективном для стимулирования секрецию хлоридов и воды на поверхности дыхательных путей, особенно назальных поверхностей дыхательных путей. Подходящие агонисты рецепторов P2Y2 описаны, но не ограничиваются ими, в патенте США.6264975, патенте США 5656256, патенте США 5292498, патенте США 6348589, патенте США 6818629, патенте США 6977246, патенте США 7223744, патенте США 7531525 и патенте США 2009/0306009, каждый из которых включен в настоящее описание в качестве ссылки. Комбинированные терапии и составы по настоящему изобретению могут включать агонисты аденозина 2b (А 2b), также включая BAY 60-6583, NECA (N-этилкарбоксиамидоаденозин), (S)-PHPNECA,LUF-5835 и LUF-5845. Агонисты А 2b, которые могут быть использованы, описаны в Volpini et al., Jour- 26023593Medicinal Chemistry Letters 16 (2): 302-6 (Jan. 2006); Carotti et al., Journal of Medicinal Chemistry 49 (1): 282-99 (Jan. 2006); Tabrizi et al., BioorganicMedicinal Chemistry 16 (5): 2419-30 (March 2008); и Stefanachi et al., BioorganicMedicinal Chemistry 16 (6): 2852-69 (March 2008). Примеры других блокаторов рецепторов ENaC для состава и применения в комбинации с соединениями согласно изобретению, включают, но не ограничиваются ими, амилорид и его производные, такие как соединения, описанные в патенте США 6858615, и публикации РСТWO 2003/070182, WO 2004/073629, WO 2005/018644, WO 2006/022935, WO 2007/018640 и WO 2007/146869, все на имя ParionSciences, Inc. Малые молекулы блокаторов ENaC способны непосредственно предотвращать транспорт натрия через поры канала ENaC. Блокатор ENaC, который может быть введен в комбинации согласно изобретению, включает, но не ограничиваются ими, амилорид, бензамил, фенамил и аналоги амилоридов, приведенные в примерах в патенте США 6858614, патенте США 6858615, патенте США 6903105, патенте США 6995160, патенте США 7026325, патенте США 7030117, патенте США 7064129,патенте США 7186833, патенте США 7189719, патенте США 7192958, патенте США 7192959,патенте США 7241766, патенте США 7247636, патенте США 7247637, патенте США 7317013,патенте США 7332496, патенте США 7345044, патенте США 7368447, патенте США 7368450,патенте США 7368451, патенте США 7375107, патенте США 7399766, патенте США 7410968,патенте США 7820678, патенте США 7842697, патенте США 7868010, патенте США 7875619. Хорошо описано, что протеолиз ENaC увеличивает транспорт натрия через ENaC. Ингибитор протеазы блокирует активность эндогенных протеаз дыхательных путей, тем самым предотвращая расщепление и активацию ENaC. Протеазы, расщепляющие ENaC, включают фурин, меприн, матриптазу, трипсин, протеазы, связанные каналом (САР) и нейтрофилэластазу. Ингибиторы протеазы, которые могут ингибировать протеолитическую активность указанных протеаз, которые могут быть введены в комбинации согласно изобретению, включают, но не ограничиваются ими, ингибиторы камостата, простазина,фурина, апротинина, лейпептина и трипсина. Комбинации согласно изобретению могут включать одну или более подходящую нуклеиновую кислоту (или полинуклеиновую кислоту), в том числе, но не ограничиваясь ими, антисмысловой олигонуклеотид, миРНК, микроРНК, мимик микроРНК, антагомир, рибозим, аптамер и олигонуклеотидные нуклеиновые кислоты "ловушки". См., например, заявку на патент США 20100316628. В целом, такие нуклеиновые кислоты могут быть от 17 или 19 нуклеотидов в длину, до 23, 25 или 27 нуклеотидов в длину или более. Примеры включают, но не ограничиваются ими, те, которые описаны в патенте США 7517865 и заявках на патент США 20100215588; 20100316628; 20110008366; и 20110104255. В целом, миРНК содержат от 17 или 19 нуклеотидов в длину, до 23, 25 или 27 нуклеотидов в длину или более. Соединения, модулирующие активность CFTR, которые можно вводить в комбинации согласно настоящему изобретению, включают, но не ограничиваются ими, соединения, описанные в US 2009/0246137 A1, US 2009/0253736 A1, US 2010/0227888 A1, патенте US7645789, US 2009/0246820A1, US 2009/0221597 A1, US 2010/0184739 A1, US 2010/0130547 A1, US 2010/0168094 A1 и выданном патенте 7553855; US 7772259 B2, US 7405233 B2, US 2009/0203752, US 7499570. Агенты, модифицирующие слизь или муцин, подходящие для комбинаций и способов согласно изобретению, включают восстановители, поверхностно-активные вещества и детергенты, отхаркивающие агенты и дезоксирибонуклеазные агенты. Мукопротеины организованы в высокомолекулярные полимеры через образование ковалентной(дисульфидной) и нековалентной связей. Разрыв ковалентных связей восстанавливающими агентами является хорошо известным способом снижения вязкоупругих свойств слизи in vitro и, предположительно позволяет минимизировать адгезивность слизи и улучшить клиренс in vivo. Хорошо известно, что восстанавливающие агенты уменьшают вязкость слизи in vitro и обычно используется в качестве средств,облегчающих обработку образцов мокроты. Примеры восстанавливающих агентов включают сульфидсодержащий молекулы или фосфины, способные восстанавливать дисульфидные связи белка, включая,но не ограничиваясь ими, N-ацетил цистеин, N-ацистелин (acystelyn), карбоцистеин, глутатион, дитиотреитол, тиоредоксин содержащие белки и трис(2-карбоксиэтил)фосфин.N-ацетил цистеин (NAC) одобрен для использования в сочетании с физиотерапией грудной клетки для ослабления вязкой или густой слизи в дыхательных путях 12. Клинические исследования по оценке влияния перорального или ингаляционного NAC на CF и ХОБЛ показали улучшения в реологических свойств слизи и тенденции к улучшению функции легких и снижению легочных обострений 9. Тем не менее, подавляющее большинство клинических данных позволяет предположить, что NAC является в лучшем случае незначительно эффективным терапевтическим агентом для лечения обструкции слизистой дыхательных путей при пероральном введении или при ингаляции. В недавнем обзоре существующей клинической литературы по использованию NAC Cochrane не обнаружил никаких доказательств в- 27023593 поддержку эффективности NAC для CF10. Незначительная клиническая эффективность NAC отражает.NAC является относительным неэффективным восстанавливающим агентом, который лишь частично активен на поверхности дыхательных путей. Очень высокие концентрации NAC (200 мм или 3,26%) требуются для полного восстановления Muc5B, важного гелеобразующего муцина дыхательных путей, in vitro. Кроме того, в среде pH на поверхность дыхательных путей (измеряется в диапазоне pH от 6,0 до 7,2 при CF и ХОБЛ дыхательных путей)11, NAC существует только частично в активном состоянии, как отрицательно заряженный тиолят. Таким образом, в клинике, NAC вводят в очень высоких концентрациях. Тем не менее, предполагалось, что в настоящее время аэрозольные устройства не смогут доставить терапевтические концентраций даже 20%-ного раствора Mucomyst на дистальные поверхности дыхательных путей в пределах относительно коротких временных интервалов (7,5-15 мин), используемых традиционно. В неклинических исследованиях 14 С-меченный NAC, вводимый путем ингаляции, быстро удаляется из легких с периодом полувыведения от 6 до 36 мин 12.NAC вводится в виде высококонцентрированного, гипертонического раствора для ингаляции (20% или 1,22 молярный) и, как сообщается, вызывает бронхоспазм и кашель. Во многих случаях рекомендуется, чтобы NAC вводился с бронхолитическоим средством, чтобы улучшить переносимость указанного агента. Таким образом, восстанавливающие агенты, такие как NAC, не очень хорошо подходят для аэрозольного введения болюса. Тем не менее, полагают, что доставка восстанавливающих агентов путем легочной аэрозольной инфузии может повысить эффективность, позволяя при этом уменьшить концентрацию восстанавливающего агента в ингаляционном растворе (ожидается увеличенная переносимость). Было показано, что поверхностно-активные вещества и детергенты уменьшают вязкоупругость слизи, улучшая клиренс слизи. Примеры поверхностно-активных веществ включают дипальмитоилфосфатидилхолин (ДПФХ), PF, пальмитиновую кислоту, пальмитоилолеоилфосфатидилглицерин, белки, связанные с ПАВ (например, SP-A, В, или С) или могут быть животного происхождения (например, после промывание легких коровы или теленка или извлечения из фарша свиных легких) или их комбинации. См., например, патент США 7897577; 5876970; 5614216; 5100806 и 4312860. Примеры поверхностно-активных продуктов включают Exosurf Neonatal (колфосцерил пальмитат), Pumactant (DPPC и яичный фосфатидилглицерин), KL-4 ПАВ, Venticute (lusulptide, RSP-C ПАВ), Alveofact (бовактант),Curosurf (порактант альфа), Infasurf (calfactant), Newfacten (модифицированные бычье ПАВ), Surface, Natsurf (неионное спиртоэтоксилатное ПАВ) и Survanta (берактант). Примеры детергентов включают, но не ограничиваются ими, Tween-80 и тритон Х-100. Любое подходящее отхаркивающее средство может быть использовано, в том числе, но не ограничиваясь им, гвайфенезин (см., например, патент США 7345051). Может быть использована любая подходящая дезоксирибонуклеаза, в том числе, но не ограничиваясь ею, Dornase Alpha, (см., например,патент США 7482024). Примеры ингибиторов киназы включают ингибиторы NFkB, PI3K (фосфатидилинозитол 3-киназы), р 38-МАР-киназы и Rho-киназы. Противоинфекционные агенты для объединения в процессе получения лекарственной формы и применения в комбинации с соединениями согласно изобретению включают противовирусные препараты и антибиотики. Примеры подходящих противовирусных препаратов включают Тамифлю (осельтамивир) и Relenza (занамивир). Примеры подходящих антибиотиков включают, но не ограничиваются ими, азтреонам (аргинин или лизин), фосфомицин и аминогликозиды, такие как тобрамицин, или любую их комбинацию или подгруппу. Дополнительные противоинфекционные агенты, которые можно использовать в изобретении, включают аминогликозиды, даптомицин, фторхинолоны, кетолиды, карбапенемы,цефалоспорины, эритромицин, линезолид, пенициллины, азитромицин, клиндамицин, оксазолидиноны,тетрациклины и ванкомицин. Примеры подходящих антибиотиков карбапенемов представляют собой импенам (impenam), панипенам (panipenam), меропенам (meropenam), биапенам (biapenam), MK-826 (L-749,345), DA-1131, ER35786, ленапенам (lenapenam), S-4661, CS-834 (пролекарство R-95867), KR-21056 (пролекарство KR21012), L-084 (пролекарство LJC 11036) и цефтолозан (Ceftolozane) (CXA-101). Антигистамины (например, антагонисты H1-рецепторов) для состава и применения в комбинации с соединениями согласно изобретению включают, но не ограничиваются ими, этаноламины, такие как дифенгидрамин HCl, малеат карбиноксамина, доксиламин, фумарат клемастина, дифенилгидрамина HCl и дименгидринат; этилендиамины, такие как малеат пириламина (metpyramine), трипеленнамин HCl, цитрат трипеленнамина, и антазолин; алкиламины, такие как фенирамин, хлорофенирамин, бромфенирамин,дихлорбромфенирамин, трипролидин и акривастин; пиридины, такие как метапирилен, пиперазины, такие как гидроксизина HCl, гидроксизина памоат, циклизина HCl, лактат циклизина, меклизина HCl и цетиризина HCl; пиперидины, такие как астемизол, левокабастин HCl, лоратадин, дескарбоэтоксилоратадин, терфенадин, фексофенадин HCl и; три-и тетрациклины, такие как прометазин, хлорпрометазин тримепразин и азатадин, и азеластин HCl, или любую их комбинацию или их подгруппу. Примеры других классов терапевтических агентов, подходящих для использования в комбинациях и способах согласно изобретению, включают противовирусные препараты, такие как рибавирин, противогрибковые агенты, такие как амфотерицин, итраконазол и вориконазол, агенты против отторжения,такие как циклоспорин, такролимус и сиролимус, бронхолитические агенты, включая, но не ограничиваясь ими, антихолинергические агенты, такие как атровент, миРНК, векторы для генной терапии, аптамеры, антагонисты рецепторов эндотелина, альфа-1-антитрипсина и простациклины. В описанных выше способах лечения и применениях соединение согласно изобретению можно использовать отдельно или в комбинации с одним или более другими терапевтически активными агентами. Как правило, любой терапевтически активный агент, который обладает терапевтическим действием в отношении заболевания или состояния, подлежащего лечению с помощью соединения согласно изобретению, может быть использован в комбинации с соединениями согласно изобретению, при условии, что конкретный терапевтически активный агент совместим с терапией с использованием соединения согласно изобретению. Типичные терапевтически активные агенты, подходящие для использования в комбинации с соединениями согласно изобретению, включают агенты, описанные выше. Согласно одному из предпочтительных вариантов реализации соединения согласно изобретению используют в комбинации с одним или более осмолитом, в частности гипертоническим раствором или маннитом. В другом аспекте в изобретении предложены способы лечения и применения, описанные выше,включающие введение эффективного количества соединения согласно изобретению и, по меньшей мере,другого одного терапевтически активного агента. Соединения согласно изобретению и по меньшей мере один дополнительный терапевтически активный агент может быть использован в комбинации одновременно или последовательно в любой терапевтически подходящей комбинации. Введение соединения согласно изобретению с одним или более другими терапевтически активными агентами может представлять собой введение одновременно в 1) единичной фармацевтической композиции, такой как композиции, описанные выше, или 2) раздельных фармацевтических композициях, каждая из которых содержит один или более из компонентов активных ингредиентов. Компоненты комбинации можно вводить по отдельности в последовательно, причем соединение согласно изобретению вводят первым, а другой терапевтически активный агент вводят вторым или наоборот. В вариантах реализации, в которых соединение согласно изобретению вводят в комбинации с одним или более осмолитом, введение каждого компонента осуществляют предпочтительно одновременно в единичной композиции или в отдельных композициях. Согласно одному их вариантов реализации соединение согласно изобретению и один или более осмолитов осуществляют параллельно с трансбиоскопическим лаважем. Согласно другому варианту реализации соединение согласно изобретению и один или более осмолитов вводят одновременно путем ингаляции. Когда соединение согласно настоящему изобретению используют в комбинации с другим терапевтически активным агентом, доза каждого соединения может отличаться от используемой в том случае,когда соединение по настоящему изобретению используют отдельно. Соответствующие дозы могут быть легко определены специалистом с обычной квалификацией в данной области техники. Соответствующую дозу соединения согласно изобретению, другой терапевтически активный агент(ы) и относительное время введения будут выбраны для достижения требуемого комбинированного терапевтического эффекта, и находятся в пределах знаний и компетенции лечащего врача, клинициста или ветеринара. Экспериментальные процедуры Изобретение также относится к способам получения соединений согласно изобретению и к синтетическим промежуточным соединениям, используемым в таких способах, как подробно описано ниже. Некоторые сокращения и аббревиатуры используются для описания процессов синтеза и экспериментальных подробностей. Хотя большинство из них будет понятно специалисту в данной области, в следующей таблице приведен список многих из указанных аббревиатур и сокращений.
МПК / Метки
МПК: C07D 239/48, A61P 11/00, A61K 31/4965
Код ссылки
<a href="https://eas.patents.su/30-23593-35-diamino-6-hlor-n-n-4-4-2-geksil23456-pentagidroksigeksilaminoetoksifenilbutilkarbamimidoilpirazin-2-karboksamid.html" rel="bookmark" title="База патентов Евразийского Союза">3,5-диамино-6-хлор-n-(n-(4-(4-(2-(гексил(2,3,4,5,6-пентагидроксигексил)амино)этокси)фенил)бутил)карбамимидоил)пиразин-2-карбоксамид</a>
Предыдущий патент: Уплотняющий элемент для шиберной задвижки
Следующий патент: Способ коррекции вальгусной деформации 1-й плюсневой кости
Случайный патент: Производные пиразолопиридина и их применение в качестве фармацевтического препарата












